Сидеробластные анемии – гетерогенная группа заболеваний, общим признаком которых является гипохромная микроцитарная анемия с отложением депозитов железа в митохондриях эритроидных предшественников. Данная патология относится к числу редких болезней. В основе ее лежит нарушение синтеза гема и митохондриальная дисфункция. Для нее характерны: неэффективный эритропоэз, высокое содержание железа в крови и гемосидероз внутренних органов. В костном мозге образуются эритроциты малого размера, в которых снижено содержание гемоглобина, а железо откладывается внутри клеток, затем выходит в кровь и оседает в тканях внутренних органов.
У здорового человека в эритрокариоцитах костного мозга находится 3 железосодержащие гранулы. Эти клетки и называют сидеробластами. При анемии такого типа гранулы, содержащие железо, имеют большие размеры и обнаруживаются более чем у 15 % клеток предшественников. Некоторые из них имеют не 3, а 5 гранул, расположенных вокруг ядра. Это кольцевидные сидеробласты, их наличие – типичный признак данной патологии.
В клинической практике сидеробластные анемии разделяют на две большие группы:
Наследственный вариант болезни обусловлен генетическими изменениями. Как правило, он выявляется в детском или подростковом возрасте, чаще у мальчиков. Среди наследственных сидеробластных анемий выделяют:
- сцепленную с Х-хромосомой;
- эритропоэтическую порфирию;
- синдром Пирсона;
- митохондриальную миопатию с синдромом анемии.
Причину приобретенных сидеробластных анемий удается выяснить не всегда. Они чаще встречаются у лиц пожилого возраста с одинаковой частотой у мужчин и женщин. Если анемия у больного имеется, а происхождение ее остается неясным, говорят об идиопатической форме болезни. Существуют также симптоматические приобретенные сидеробластные анемии, которые связаны с:
- воздействием на организм некоторых лекарств (Изониазида, Рифампицина, Хлорамфеникола) и токсических веществ (цинка, свинца);
- алкогольной интоксикацией;
- дефицитом меди;
- злокачественными или хроническими воспалительными заболеваниями (лейкозами, множественной миеломой, миелопролиферативными заболеваниями, ревматоидным артритом).
Одним из основных проявлений болезни является анемический синдром. Такие пациенты жалуются на:
- слабость;
- утомляемость;
- головную боль;
- ломкость ногтей и выпадение волос;
- одышку при физической нагрузке;
- сжимающие боли в области сердца.
Выраженность анемии может варьировать от легкой степени с минимальными клиническими проявлениями до тяжелой, требующей регулярных гемотрансфузий (переливаний крови или эритроцитов).
В ряде случаев при сидеробластной анемии выявляется желтушность кожи, увеличение печени и селезенки.
При врожденных формах болезни ее течение может осложняться накоплением железа в тканях и развитием гемосидероза, который проявляется:
- «бронзовой» пигментацией кожи;
- симптомами диабета;
- сердечными аномалиями;
- нарушением функции печени.
Приобретенная идиопатическая форма в 7-20 % случаев может трансформироваться в острый лейкоз, рефрактерный к обычным схемам полихимиотерапии.
Диагноз «сидеробластная анемия» устанавливается на основании клинических и лабораторных данных. Последние имеют особое значение. Таким больным проводится:
Характерными лабораторными признаками данной патологии являются:
- гипохромная (цветовой показатель ниже 0,8) микроцитарная анемия;
- базофильная зернистость эритроцитов;
- снижение уровня ретикулоцитов;
- повышение концентрации сывороточного железа и насыщенных трансферринов;
- гиперплазия эритроидного ростка в костном мозге, наличие кольцевидных сидеробластов.
Лейкоцитарная формула и уровень тромбоцитов могут длительное время оставаться нормальными и изменяются при тяжелых поражениях печени.
Лечение пациентов, страдающих сидеробластной анемией, направлено на уменьшение патологических симптомов и нормализацию состава крови. Оно включает:
- устранение провоцирующих факторов при приобретенной форме болезни;
- курс инъекций витамина В₆ (не менее 2 месяцев);
- трансфузии эритроцитарной массы при тяжелой анемии;
- назначение хелаторов железа – дефероксамин (профилактика гемосидероза).
Показанием для госпитализации в гематологический стационар является тяжелая степень анемии или выраженная сопутствующая патология.
Лечением сидеробластных анемий занимается гематолог. Для выяснения причин заболевания понадобится консультация генетика, ревматолога, нарколога. При развитии гемосидероза к лечению подключаются профильные специалисты: эндокринолог, гепатолог, дерматолог, кардиолог.
Прогноз при врожденной сидеробластной анемии благоприятный при своевременно начатом лечении. Он значительно ухудшается при поздней диагностике и длительном отсутствии лечения, когда в органах и тканях развились необратимые изменения, связанные с гемосидерозом. Приобретенные сидеробластные анемии могут проходить даже без лечения после устранения их причины. Тяжелое течение нередко имеет идиопатическая форма болезни при ее трансформации в острый лейкоз.
источник
Одной из разновидностей гематологических заболеваний является сидеробластная анемия, возникающая на фоне нарушенной переработки внутриклеточного железа, необходимого для синтеза гемоглобина. Как правило, заболевание имеет несколько механизмов развития, и может носить генетический или приобретенный характер. Клиническая картина характеризуется различной степенью тяжести, поэтому чтобы не допустить серьезных осложнений, необходимо провести все терапевтические мероприятия на начальных этапах патологии.
Сидеробластная анемия – это патологическое состояние, также известное, как сидероахрестическая анемия. Оно проявляется дефицитом железа в эритроцитах, вследствие нарушения синтеза микроэлемента костным мозгом.
Для заболевания характерно преобладание микроцитов в периферической крови, а также значительное снижение цветного показателя, что является ее отличительной чертой от железодефицитной анемии. При сидеробластной анемии, железо присутствует в необходимой концентрации, но происходит нарушение механизма попадания микроэлемента в гемоглобин. В дальнейшем вместо железа в клетках, накапливаются сидеробласты, образуя соединения в виде колец.
Главной причиной состояния является дефицит протопорфина, который является важным элементом в процессе синтеза гемоглобина.
Наследственная форма возникает вследствие генетических аномалий, когда происходят патологические изменения в гене или хромосоме, ответственных за развитие заболевания. Также пусковым механизмом в развитии состояния может быть врожденный дефект транспортировки меди, которая необходима для полноценного усвоения железа клетками. В данной ситуации, патология будет носить вторичный характер, поскольку ее сопровождает нарушение обменных процессов в организме.
Как правило, причинной приобретенной формы являются:
- прием медикаментов;
- избыточное употребление спиртосодержащих напитков;
- действие химических веществ;
- отравление тяжелыми металлами;
- гематологические заболевания;
- воспалительные процессы;
- онкологические болезни.
Медикаментозная или токсическая сидеробластная анемия развивается на фоне негативного действия активного компонента лекарства или токсического соединения. Так, при отравлении свинцом заболевание развивается молниеносно, поскольку пары тяжелого металла быстро проникают в ткани организма. При условии незначительного железодефицитного состояния, клиническая картина заболевания протекает в ускоренном темпе.
Способствующие факторы, провоцирующие развитие патологии:
- алкогольная интоксикация;
- злоупотребление лекарственными препаратами;
- аутоиммунные заболевания;
- процесс формирования новообразований;
- аллергия на туберкулостатические лекарства;
- пожилой возраст.
У лиц, страдающих хроническим алкоголизмом, сидеробластная анемия наблюдается в несколько раз чаще, поскольку этанол способствует снижению концентрации фосфатов витамина В6.
Сидеробластическую анемию классифицируют в зависимости от причины возникновении, механизма развития и степени выраженности клинических симптомов.
Различают следующие виды патологического состояния:
- Наследственная . Заболевание передается по женской хромосоме, в результате аномальных изменений в гене. Вследствие дефекта происходит замедление синтеза органических соединений, как гем, приводящего к низкой продукции гемоглобина.
- Врожденная . Аномальные клетки передаются от матери к ребенку. Поэтому женщина с умеренными симптомами заболевания может родить одного здорового ребенка и одного с тяжелыми проявлениями патологии.
- Приобретенная . Развивается на фоне интоксикации лекарственными препаратами и алкоголем. Как правило, после ликвидации раздражителя такая форма анемии устраняется без помощи медикаментов.
Симптоматика заболевания характерна для всех видов и форм анемий:
- Анемический синдром (бледность кожных покровов, сухость слизистых, ломкость ногтевых пластин, головокружение, снижение памяти).
- Нарушения в работе сердца и сосудов (гипотензия, тахикардия, появление систолического шума над верхушкой сердца).
- Расстройство пищеварения (снижение аппетита, искажения вкусовых свойств, нарушения глотания, частые запоры и диарея).
При врачебном осмотре отмечается увеличение печени и селезенки, что обуславливается отложением избыточного количества железа (гемосидероз). Постепенное скопление микроэлемента в печени приводит к развитию цирроза, поэтому на последней стадии заболевания орган уменьшается в размерах, а при ультразвуковой диагностике выявляется уплотнение тканей.
В большинстве случаев, гемосидероз поражает другие системы организма. Так, при накоплении железа в половых органах у мужчин, происходит снижение количества вырабатываемого тестостерона, что приводит к развитию евнухоидизма. При поражении поджелудочной железы развивается сахарный диабет, который может осложниться диабетической комой.
Сидеробластические анемии, вызванные интоксикацией тяжелыми металлами, в клинической картине проявляются острыми болями в брюшной полости, и поражением периферической нервной системы. Очень часто данных пациентов направляют в хирургические отделения с подозрением на острый воспалительный процесс органов брюшной полости.
Диагностика данного вида анемии затруднительна, поскольку протекает без характерных клинических симптомов. Для подтверждения диагноза собирают анамнез жизни пациента, его жалобы, проводят оценку общего состояния, а также назначают прохождение лабораторных и инструментальных методов исследований.
Для диагностики интоксикации свинцом проводиться определение концентрации свинца в венозной крови. В случае хронического отравления тяжелым металлом, проводят рентгенологическое исследование коленных суставов, где обнаруживается в дистальном отделе бедренной кости уплотненные и расширенные участки кальцификации, а в проксимальных отделах выявляют свинцовую линию.
Алгоритм исследование пациента:
- Общий клинический анализ крови (определение количества ретикулоцитов, и характеристикой строения эритроцитов).
- Миелограмма (выявление колец сидеробластов методом окрашивания мазков).
- Биохимический анализ (определение ферментов, почечные и печёночные пробы, глюкоза, сывороточное железо).
- Общий анализ мочи.
- Копрограмма.
- Электрокардиограмма.
- УЗИ органов брюшной полости, сердца, почек
- Рентген коленных суставов.
Для определения формы патологии проводят следующие исследования:
- Дисфераловая проба.
- Концентрация в цельной крови протопорфина эритроцитов.
- Концентрация в цельной крови свинца.
- Проба с ЭДТА.
- Биопсия косного мозга.
Наследственная форма заболевания может иметь различную степень тяжести. С возрастом патология усиливается, приобретая гипохромный характер, когда цветовой показатель снижается до 0,5. В мазке выявляют гипохромные эритроциты, определяется анизоцитоз, пойкилоцитоз.
Наследственная форма недуга не поддается лечению, ее корректируют при помощи симптоматической терапии, направленной на подавление аномального гена. В лечении заболевания противопоказан прием препаратов железа и гемотрансфузии, так как они способны вызвать усугубление гемосидероза внутренних органов.
В качестве основной терапии применяют лекарственное средство пиридоксин, при условии отсутствия резистентности к нему. Дозировка препарата зависит от способа введения, так при внутримышечных инъекциях – 100 мг, внутрь – от 50 до 200 мг два раза в сутки. Терапевтический курс составляет 2 месяца.
Пациентам назначают применять коферменты витамина В6 в высоких дозах, с целью коррекции нарушенной трансформации пиридоксина в пиридоксальфосфат.
При анемии вследствие интоксикации свинцом используют препараты натриевой соли, которые помогают ускорить процесс выведения металла с организма.
В тяжелых случаях, когда отсутствует положительная динамика на медикаментозную терапию, показана заместительная гемотрансфузия красных кровяных тел. Она позволяет добиться временного восстановления баланса гемоглобина и снизить риск развития осложнений. Для предотвращения отложения гемосидерина во внутренних органах, у пациентов, находящихся на гемотрансфузионной терапии, показано использование медикамента Десферала. Его вводят внутривенно в дозе 500–1000 мг, регулярно контролируя уровень железа. Лечение медикаментом рекомендовано проводить небольшими курсами, чтобы не допустить резкого снижения уровня микроэлемента в крови.
Сидеробластические анемии довольно редкая патология. Клиническая картина не имеет отличительных симптомов от других гематологических заболеваний, поэтому необходимо проводить тщательное исследование пациентов. Самым эффективным диагностическим методом в выявлении данного типа анемии является анализ крови, который указывает на развитие патологического процесса в организме. При своевременном лечении можно добиться быстрой стабилизации состояния, однако при врожденной форме прогноз остается неблагоприятным.
источник
Сидеробластические анемии составляют особую группу заболеваний весьма разнообразной этиологии, которых, однако, объединяет общий знаменатель — наличие кольчатых сидеробластов в костном мозге (Bjorkman, Bowman). Последние рассматриваются патологическими и отличаются от нормальных — зерна феритина которых распространены по всей цитоплазме — тем, что железо располагается в гребешках митохондриев в виде железистых мицелиев (пластинок или пыли).
К другим общим характеристикам этих анемий можно отнести неэффективность эритропоэза, рост показателя железа в плазме и тканях и развитие гемохроматоза (Farid, Мунтяну и Попеску).
В медицинской литературе уже давно говорилось об этой болезни, включенной в крупную группу так называемых устойчивых анемий, поскольку они не поддавались никакому терапевтическому методу. Но постепенно, по мере освоения новых клинических и разведочно-лабораторных достижений, определилось, что некоторые из этих заболеваний отличаются четкой этиологией (отравление свинцом, длительное лечение изониазидом, ревматоидный артрит и пр.).
Другие — благоприятно реагируют на пиридоксинотерапию крупными дозами (сохраняя вместе е тем нормальный уровень пиридоксина в крови), в связи с чем получили название «анемий, реагирующих на пиридоксин». И наконец, наблюдение отдельных семейных случаев (Gooley, Bundles и Falls) сделало возможным отождествление наследственных форм болезни.
Однако имеется большая группа подобных заболеваний, с хорошо установленными клиническими и морфологическими характеристиками, получившая название первичной генуинной сидеробластической анемии, в отношение которой этиология еще не определена. Современная классификация этой болезни приведена ниже. Связанное с морфологическим пороком наличия кольчатых сидеробластов, это название было присвоено недавно (Bjorkman). Гейльмайер, основательно и многосторонне исследовавший эту болезнь, назвал ее сидероаккрестической анемией (вызываемой неиспользованием железа).
A. Первичные формы сидеробластических анемий:
I. Первичная приобретенная генуииная сидеробластическая анемия
II. Наследственная сидеробластическая анемия:
а) вид, связанный с полом, развивающийся за счет недостатка аминолевулин-синтстазы и копропорфириногеноксидазы (I тип по Гейльмейеру);
б) аутосомальный вид (поражающий лиц обоего пола) (II тип по Гейльмейеру),
Б. Анемия, поддающаяся пиридоксинотерапии
B. Вторичные формы сидеробластических анемий
I. Вызываемые токсическими веществами или медикаментами, в том числе, свинцом, гидразидом изоникотиновой кислоты, циклосерином, спиртом и пр.
II. Сопутствующие иным заболеваниям, в том числе, воспалительным (ревматизм, коллагеноз, заражение почек), крови (миелофиброз, истинная полицитемия, лейкемия, гемолитическая анемия, злокачественная анемия и пр.), прочим болезням (поздняя порфирия кожи, резецированный желудок, миксэдема и др.).
Общая гематологическая характеристика сидеробластических анемий:
1) Гипохромия или/и эритроцитный диморфизм.
2) Ретикулоцитопения.
3) Эритробластоз — костномозговой мегалобластоз.
4) Кольцевые сидеробласты.
5) Неполноценное кроветворение: внутрикостномозговое расплавление крови при высоких показателях косвенной гипербилирубинемии и уробилиногена в фекалиях, гиперсидеремия, клиренс и интенсивность и скорость метаболизма, высокий показатель Fe59, слабое-включение Fe59 в эритроциты, депонирование железа в запасах.
6) Нормальная продолжительность жизни эритроцитов.
7) Отсутствуют аномальные гемоглобины.
источник
Сидеробластная Анемия – это вид анемии, характеризующийся сниженным содержанием железа в эритроцитах из-за того, что костный мозг не использует его для синтеза гемоглобина. Вот что это такое и чем проявляется недуг, мы расскажем ниже.
Главными причинами возникновения болезни являются:
- наследственные факторы. Отмечается генетическая предрасположенность в 50% случаев. Болезнь сцеплена с Х-хромосомой или наследуется по аутосомно-доминантному типу;
- отравление свинцом, алкоголем, левомицетином;
- аутоиммунные заболевания;
- опухолевые процессы;
- лечение туберкулостатическими препаратами;
- пожилой возраст. У людей этой возрастной категории часто возникает идиопатическая приобретенная форма сидеробластной Анемии, причины которой до конца не установлены.
В основе патологического процесса, возникающего в организме из-за сидеробластной или сидероахристичекой Анемии, наблюдается нарушение процессов утилизации железа при нормальном его содержании в сыворотке крови. Это приводит к нарушению синтеза протопорфорина – вещества, которое соединяется с ионом железа и превращается в гем, входящий в состав гемоглобина.
В совокупности эти факторы приводят к образованию в костном мозге сидеробластов – клеток-предшественниц эритроцитов с вкраплениями гранул железа в виде кольца. В то же время происходит откладывание железа (гемосидероз) в таких органах, как печень, легкие, поджелудочная железа и сердце, что ведет к нарушению их функций.
Первые признаки наследственных форм появляются в детском возрасте и сопровождаются жалобами на слабость, головную боль, ухудшение памяти, повышенную утомляемость, невнимательность, ухудшение успеваемости в школе. При осмотре обнаруживают бледность кожных покровов, а также увеличение печени и селезенки.
Взрослые пациенты могут жаловаться на слабость, быструю утомляемость во время физических нагрузок. Обращает на себя внимание бледность кожи, которая может иметь землисто-серый оттенок, у трети больных возможен гепатолиенальный синдром. В анамнезе имеются факты контакта со свинцом, длительный прием лекарственных средств, сопутствующие болезни.
У всех категорий пациентов, по мере развития сидеробластной анемии, со временем наблюдаются признаки гемосидероза, который приводит к возникновению аритмии, сахарного диабета, легочной недостаточности.
Если вы заметили у себя симптомы болезни, следует срочно обратиться к врачу.
Для уточнения диагноза необходимо провести ряд анализов:
- общий анализ крови – покажет сниженный гемоглобин и цветной показатель, уменьшение количества ретикулоцитов;
- биохимический анализ крови укажет на нормальный или повышенный уровень сывороточного железа, высокие цифры ферритина;
- пункция костного мозга, в которой будут определяться сидеробласты;
- биопсия печени, в результате которой обнаружится накопление железа в клетках.
При возможности необходимо исключить факторы, способствующие хронической интоксикации (свинец, алкоголь).
В план лечения включают введение витамина В6 (пиридоксина) в течение двух месяцев. При устойчивой к пиридоксину форме назначают анаболические препараты, десферал для выведения излишков железа. Переливание крови используют крайне редко и в тяжелых случаях.
источник
Сидеробластная анемия (врожденная или приобретенная) — это анемия, когда в крови наблюдается избыток железа. Причины включают злоупотребление алкоголем, хронический миелоидный лейкоз или миелодиспластический синдром. Симптомы сидеробластической анемии включают, например, бледную кожу, головные боли и головокружение, быстрое сердцебиение. Лечение в этом случае зависит от типа анемии.
При железодефицитной анемии появляется нехватка железа в организме. Парадоксально, но иногда этот элемент бывает в изобилии, но не может быть использован для синтеза гема.
В этой ситуации развивается сидеропенический синдром, симптомы которого часто напоминают симптомы железодефицитной анемии.
Сидеробластическая анемия является редким заболеванием. Существует врожденная и приобретенная форма.
Сидеропеническая анемия связана с образованием сидеробластов или эритробластов с железным кольцом вокруг ядра. Эритробласты являются предшественниками эритроцитов, которые обычно используют железо для синтеза гема.
Однако если этот процесс нарушен, железо, накопленное в эритробластах, не используется и осаждается в избытке в печени и селезенке. Аномальные непигментированные эритроциты (которые не содержат достаточного количества гемоглобина) циркулируют в кровотоке без достаточного переноса кислорода.
Причинами сидеробластической анемии могут быть генетические дефекты. Такая наследственная анемия выявляется вскоре после рождения, хотя есть случаи, диагностированные только у взрослых.
Приобретенная сидеробластическая анемия может иметь много причин, наиболее распространенными из которых являются:
- лекарства: Хлорамфеникол, Изониазид, Циклосерин;
- отравление свинцом или цинком;
- миелодиспластический синдром;
- злоупотребление алкоголем;
- хронический миелоидный лейкоз.
Симптомы возникают из-за двух основных нарушений: первое — появление небольших непигментированных эритроцитов в крови, которые не переносят достаточное количество кислорода. Второе — накопление железа в органах и мягких тканях, то есть вторичный гемохроматоз.
Симптомы, связанные с тканевой гипоксией, включают головокружение и головные боли, слабость, проблемы с концентрацией. Отмечается бледность кожи и слизистых оболочек, ощущение постоянного холода, ускоренного сердечного ритма и более быстрого дыхания. Накопление железа в печени, селезенке и других органах приводит к диабету, аритмии и неврологическим расстройствам.
Наиболее важную роль играют морфология с мазком, биопсия костного мозга, определение уровня железа в сыворотке, концентрация ферритина и насыщение трансферрина.
Ниже приведены изменения в результатах лабораторных исследований, характерных для сидеробластической анемии:
- в морфологии обнаружено уменьшение количества эритроцитов, уменьшение размера MCV эритроцитов и сниженный гемоглобин в крови;
- в мазке крови присутствуют сидероциты, то есть эритроциты с экстрагемоглобиновыми железными зернами;
- повышенное железо в крови, увеличение ферритина и увеличение насыщения трансферрина.
Результаты анализов крови также указывают на присутствие сидеробластов в костном мозге.
Лечение сидеробластной анемии зависит от ее формы. При врожденной форме используется добавка витамина B6, то же самое относится к сосуществующему недостатку фолиевой кислоты.
Наследственная форма хорошо реагирует на такую терапию — ответ на лечение обычно происходит через несколько недель.
Приобретенная анемия лечится соединениями, которые хелатируют избыток железа в крови (например, дефероксамин).
При лечении очень важно вести правильный образ жизни.
Диета должна исключать продукты, содержащие цинк, что усиливает симптомы заболевания. Поэтому следует избегать чрезмерного потребления печени, ракообразных, орехов, твердых сыров.
Важно избегать употребления алкоголя. Невозможно вылечить врожденную сидеробластную анемию, но при правильном лечении и диете можно жить с ней, не испытывая назойливых симптомов. Однако приобретенные формы сидеробластической анемии полностью излечимы.
источник
Это нарушение гемопоэза встречается существенно реже, чем другие формы малокровия. Однако сидеробластная анемия чревата тяжелыми осложнениями, включая разрушение внутренних органов и нервной системы вплоть до развития олигофрении. Предотвратить такие опасные последствия позволяют своевременное выявление и лечение патологии.
Главная особенность данной формы анемии — дефицит железа в составе эритроцитов при его избыточном количестве в организме. Такое нарушение возникает вследствие того, что клетки костного мозга утрачивают способность полностью использовать этот микроэлемент в синтезе гемоглобина. Неиспользованное железо постепенно накапливается в печени и селезенке. Обедненные гемоглобином эритроциты не в состоянии обеспечивать клетки кислородом.
При диагностике необходимо выяснить причины, характер развития и степень тяжести патологии. От этого зависит ее вид. Сидеробластная (сидеробластическая, сидероахрестическая) анемия может быть:
Приобретенная патология — чаще всего результат воздействия на организм токсичных веществ, длительного пребывания в условиях холода. После устранения химического или температурного раздражителя в большинстве клинических случаев содержание железа в плазме крови нормализуется самостоятельно. Сложнее, если нарушение его выработки вызвано аутоиммунными или онкологическими заболеваниями. У каждого десятого пациента развивается лейкоз.
Наследственная сидеробластная анемия передается плоду через дефектную материнскую хромосому. Вследствие генной мутации синтез гемоглобина замедляется. При неосложненном течении болезни у матерей могут рождаться и здоровые дети, и дети с тяжелой патологией. Заболевание проявляется чаще всего в младенческом возрасте, но иногда гораздо позже. Классификацией выделяются врожденные аномалии, которые реагируют на Пиридоксин. Обособленную группу составляют наследственные патологии, не поддающиеся коррекции витамином В6.
Для выработки гемоглобина необходима следующая биохимическая триада:
Сидеробластная форма заболевания развивается вследствие дефицита протопорфирина. Этот пигмент является предшественником гема — соединения порфирина с железом, которое в дальнейшем преобразуется в гемоглобин.
Основные причины приобретенной и наследственной сидероахрестической анемии:
- длительное употребление алкоголя;
- интоксикация соединениями цинка или свинца;
- дефицит меди в организме;
- продолжительное лечение некоторыми гормональными лекарственными средствами, антибиотиками, противотуберкулезными препаратами (например, Левомицетином, Циклоспорином, Изониазидом);
- аутоиммунные заболевания (ревматоидный артрит, сахарный диабет I типа, рассеянный склероз, тиреоидит Хашимото, целиакия и др.);
- злокачественные опухоли;
- пожилой возраст (старше 50-55 лет);
- наследственная предрасположенность.
Для заболевания характерно наличие анемического синдрома. Его наиболее частыми проявлениями являются:
- головокружение;
- одышка даже при небольших физических нагрузках;
- быстрая утомляемость;
- упадок сил;
- головные боли;
- усиленное выпадение волос, ломкость ногтей;
- боли в области сердца.
Наследственная сидеробластическая анемия в большинстве клинических случаев проявляется в раннем детском возрасте. У ребенка наблюдаются следующие симптомы:
- рассеянность, плохая память;
- частые головные боли;
- бледность кожных покровов;
- мышечная слабость;
- быстрая утомляемость;
- увеличение печени, селезенки.
У взрослых эта форма патологии может проявляться такими симптомами:
- серовато-землистый или желтоватый оттенок кожи;
- быстрая усталость при повышенных физических нагрузках;
- увеличение печени, селезенки;
- повышение концентрации глюкозы в крови;
- тахикардия, сердечные боли;
- легочная недостаточность;
- ожирение, ослабление потенции, повышение тембра голоса.
Интенсивность симптомов сидеробластной анемии зависит от ее формы и возраста пациента. Проявления патологии могут быть минимальными, легкими, особенно на ранних стадиях развития заболевания. Выраженный, тяжелый синдром наблюдается у пожилых людей при гемосидерозе — отложении соединений железа в клетках тканей.
Анализ крови позволяет выявить форму и стадию развития этого заболевания, для которого типичны следующие показатели лабораторных исследований:
- повышенная концентрация сывороточного железа;
- уменьшение количества ретикулоцитов (протоэритроцитов);
- наличие патологических эритроцитов (базофильных гранулоцитов);
- падение уровня тромбоцитов, изменение лейкоцитарной формулы (при тяжелых поражениях печени);
- пониженный цветовой показатель (ниже 0,8) и др.
Если в эритроцитах снижено содержание протопорфирина, такой признак может свидетельствовать о наследственной патологии. Обнаружение в крови соединений свинца доказывает наличие приобретенной сидероахрестической анемии. Для уточнения диагноза назначается рентгенография. Если на снимке коленных суставов четко просматриваются участки кальцифицированных костей и линия отложения свинца, это указывает на хронический характер интоксикации.
Дополнительные методы исследования:
- общий анализ мочи, десфераловый тест (определение наличия железа в урине);
- копрограмма;
- УЗИ почек, сердца, органов брюшной полости;
- ЭКГ;
- биопсия и миелограмма костного мозга (при необходимости).
Профильным специалистом, который занимается терапией сидеробластной анемии, является гематолог. Однако для уточнения тактики лечения нередко требуются консультации эндокринолога, кардиолога, ревматолога или дерматолога.
При выявлении приобретенной формы патологии необходимо купировать симптомы болезни и восстановить формулу крови. Этому способствуют:
- устранение токсичного фактора-провокатора;
- инъекции Пиридоксина;
- внутримышечное или подкожное введение Десферала для предотвращения гемосидероза;
- внутривенные инъекции Пентацина (при свинцовой интоксикации);
- гемотрансфузии эритроцитов (при анемии тяжелой степени).
Вылечить наследственную форму заболевания нельзя. Ее можно только корректировать симптоматическими средствами, способными подавлять проявления дефектного гена. Улучшить состояние пациента помогают инъекции Пиридоксина. Синтез гемоглобина чаще всего активизируется в течение 2-3 месяцев при условии, что у пациента отсутствует резистентность к витамину В6.
Иногда заболевание сопровождается мегалобластическим кровотечением. В этом случае назначается терапия витамином В9 (фолиевой кислотой). Во избежание развития гемосидероза внутренних органов категорически запрещается применение препаратов железа.
Чтобы избежать риска развития анемии, необходимо:
- следить за полноценностью питания, употребляя говядину, печень, бобовые, куриные яйца, орехи, сухофрукты, богатые железом, витаминами В6, В9, B12;
- принимать в зимний период профилактические минерально-витаминные комплексы;
- не злоупотреблять спиртными напитками;
- чаще дышать свежим воздухом.
Врачи настоятельно рекомендуют ежегодно проверять состояние своего здоровья, чтобы как можно раньше диагностировать патологические процессы, скрыто протекающие в организме. Особенно важно своевременно лечить выявленные воспалительные заболевания желудка и кишечника.
источник
Многие люди знают, что анемия является довольно опасным заболеванием. Существует множество разновидностей этого недуга, и каждый из них приносит вред здоровью человека. Сидеробластная анемия представляет собой опасную патологию, связанную с нарушением синтеза микроэлементов. При данном заболевании костный мозг использует железо для объединения гемоглобина, поэтому оно откладывается во внутренних органах. Главное – не допустить осложнений, а для этого необходимо своевременно обратиться за помощью к специалисту.
Сидеробластная анемия отличается от других видов заболевания сниженной концентрацией железа в эритроцитах. Дело в том, что костный мозг не задействует этот элемент в синтезе гемоглобина. Чаще всего недуг развивается как врождённый или приобретённый. На генетическом уровне анемия встречается в основном у мальчиков.
Заболевание может передаваться также аутосомно-доминантным путём. Эту анемию называют синдромом Пирсона. Когда в организме плохо усваивается железо, оно откладывается во внутренних органах, что приводит к сидеробластной анемии. Если железа становится слишком много, нарушается работа печени, почек и сердечной мышцы.
Анемия этого типа подразделяется по степени тяжести, а также по причине появления и клинической картине. Выделяют несколько видов сидеробластной анемии:
- Наследственная. Недуг переходит по наследству в результате мутации гена. Эту патологию вызывает аномалия процесса обмена веществ при участии витамина В6 и аминолевулиновой кислоты. Заболевание даёт о себе знать после рождения или в подростковом возрасте.
- Врождённая. Эту форму выделяют отдельно, хотя в какой-то степени она относится к наследственному виду. Здесь характерно высокое содержание эритроцитарного копропорфирина.
- Приобретённая. Появляется в результате неблагоприятного воздействия химических веществ. Среди них выделяют этанол, свинец, циклосирин.
Проблемы с синтезом железа возникают также по причине опухолевых процессов в организме. Примерно 1/10 часть больных сидеробластной анемией страдает острым лейкозом.
Основной причиной развития этого заболевания является нехватка протопорфиирина, который является одним из компонентов синтеза наиболее важного элемента гемоглобина. Кроме этого вещества, в создании участвует ещё белок и железо.
Приобретённая форма сидеробластной анемии возникает из-за того, что в организм не поступают необходимые вещества в достаточном количестве. Бывают ситуации, когда нужные соединения подавляются медикаментами, которые принимает человек.
Организм истощается в результате воздействия алкоголя. Анемия может появиться из-за свинцового отравления или приёма сильных антибиотиков. Наследственная форма передаётся через женскую хромосому с повреждённым геном. Также причиной возникновения заболевания может служить расстройство иммунной системы и развитие опухолевых процессов.
Процесс выявления этого заболевания довольно сложный, так как оно протекает практически бессимптомно. Более того, нет ярко выраженной клинической картины, на которую можно опираться. Если смотреть только на внешние признаки, то диагностировать эту болезнь нереально. Однако есть один способ обнаружения сидеробластной анемии – анализ крови.
Также практикуют обследование внутренних органов пациента, чтобы найти отложения железа. Но к этому времени элемент и так вызывает гематологические симптомы. Чтобы не ошибиться, необходимо подтвердить диагноз. Это делается с помощью макроскопического исследования костного мозга.
Для того чтобы риск сводился к минимуму, необходимо провести биопсию. Именно эта процедура является самым эффективным способом определения сидеробластной анемии. Она осуществляется следующим образом: биоптат предварительно окрашивают специальным веществом, и, если обнаруживается несинтезированное железо, становятся видны характерные соединения.
Как уже было отмечено, симптомы сидеробластной анемии практически не определяются. Клиническая картина также отсутствует, и из-за этого возникают определённые трудности. Если человек чувствует быструю утомляемость, слабость в организме, то он, как правило, обращается к терапевту. Это врач при подозрении на анемию перенаправляет пациента к гематологу, который проводит обследование.
Сначала специалист выясняет общее состояние пациента, интересуется образом жизни, наличием вредных привычек, списком перенесённых заболеваний и т. д. Если врач посчитает нужным, он проведёт несколько исследований. К ним относятся:
- анализ крови (общий и биохимический);
- биопсия печени;
- анализ клеточного состава костного мозга.
Гематолог при необходимости может направить пациента к другим специалистам для более полного обследования. Например, чтобы выяснить форму анемии, нужно обратиться к генетику. Данный врач определит, имеет ли место быть наследственный вид сидеробластной анемии. Также может понадобиться консультация гинеколога, уролога или проктолога.
Прежде чем приступить к терапии, необходимо определить, действительно ли происходит отложение железа. Для этого используют десфераловую пробу. Её вводят внутримышечно, и в результате с мочой должно выделяться около 0,5-1,1 мг железа, а при гипохромной, гиперсидеремической, сидероахрестической, сидеробластной анемии – 5-10 мг.
Стоит отметить, что наследственную форму заболевания вылечить невозможно. Чтобы подавить ген, который начал мутировать, часто используют лечение высокими дозами витамина В6. Его вводят в количестве 100 мг в день. Однако реакция организма здесь практически непредсказуема. В процессе лечения сидеробластной анемии уровень гемоглобина должен повыситься до нормальных показателей за три месяца. Если в этот период времени улучшений не произошло, дальнейшая терапия бессмысленна.
Довольно часто заболевание возникает в результате отравления свинцом. Чтобы это предотвратить, необходимо осторожно обращаться с этим веществом. При реконструкции старых домов нужно соблюдать меры предосторожности, по возможности переселяя временно детей. Запрещается сжигать или закапывать краски, содержащие свинец. Лучше всего соскоблить или удалить их химическим путем. Кроме того, нужно регулярно следить за чистотой жилых помещений, соблюдать строительные и санитарные нормы.
Вылечить наследственную форму заболевания невозможно. Для обеспечения благоприятных последствий необходимо постоянно следить за показателями крови, особенно уровнем гемоглобина. Это достигается путём регулярного прохождения курса терапии, который не позволяет болезни развиваться и поддерживает нормальное состояние человека.
источник
Сайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна!
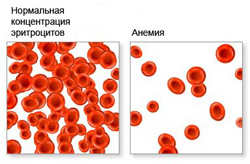
Эритроциты формируются в красном костном мозге из белковых фракций и небелковых компонентов под воздействием эритропоэтина (синтезируется почками). Эритроциты в течение трех дней обеспечивают транспорт, главным образом, кислорода и углекислого газа, а также питательных веществ и продуктов метаболизма от клеток и тканей. Срок жизни эритроцита сто двадцать дней, после чего он разрушается. Старые эритроциты накапливаются в селезенке, где утилизируются небелковые фракции, а белковые поступают в красный костный мозг, участвуя в синтезе новых эритроцитов.
Вся полость эритроцита наполнена белком, гемоглобином, в состав которого входит железо. Гемоглобин придает эритроциту красную окраску, а также помогает ему переносить кислород и углекислый газ. Его работа начинается в легких, куда эритроциты поступают с током крови. Молекулы гемоглобина захватывают кислород, после чего обогащенные кислородом эритроциты направляются сначала по крупным сосудам, а затем и по мелким капиллярам к каждому органу, отдавая клеткам и тканям необходимый для жизни и нормальной деятельности кислород.
Анемия ослабляет способность организма к газовому обмену, за счет сокращения числа эритроцитов нарушается транспортировка кислорода и углекислого газа. Вследствие этого у человека могут наблюдаться такие признаки анемии как чувство постоянной усталости, упадок сил, сонливость, а также повышенная раздражительность.
Анемия является проявлением основного заболевания и не является самостоятельным диагнозом. Многие болезни, включая инфекционные заболевания, доброкачественные или злокачественные опухоли могут быть связаны с анемией. Именно поэтому анемия является важным признаком, который требует проведения необходимых исследований для выявления основной причины, которая привела к ее развитию.
Тяжелые формы анемии вследствие тканевой гипоксии могут привести к серьезным осложнениям, таким как шоковые состояния (например, геморрагический шок), гипотония, коронарная или легочная недостаточность.
- по механизму развития;
- по степени тяжести;
- по цветному показателю;
- по морфологическому признаку;
- по способности костного мозга к регенерации.
| По патогенезу анемия может развиться вследствие кровопотери, нарушения образования эритроцитов или из-за их выраженного разрушения. По механизму развития выделяют:
|
- потеря крови (острые или хронические кровотечения);
- повышенное разрушение эритроцитов (гемолиз);
- уменьшенное производство эритроцитов.
Также следует заметить, что в зависимости от вида анемии причины ее возникновения могут отличаться.
Факторы, влияющие на развитие анемии
- гемоглобинопатии (изменение строения гемоглобина наблюдается при талассемии, серповидноклеточной анемии);
- анемия Фанкони (развивается вследствие имеющегося дефекта в кластере белков, которые отвечают за восстановление ДНК);
- ферментативные дефекты в эритроцитах;
- дефекты цитоскелета (клеточный каркас, располагающийся в цитоплазме клетки) эритроцита;
- врожденная дизэритропоэтическая анемия (характеризуется нарушением образования эритроцитов);
- абеталипопротеинемия или синдром Бассена-Корнцвейга (характеризуется нехваткой бета-липопротеина в клетках кишечника, что ведет к нарушению всасываемости питательных веществ);
- наследственный сфероцитоз или болезнь Минковского-Шоффара (вследствие нарушения клеточной мембраны эритроциты принимают шарообразную форму).
- дефицит железа;
- дефицит витамина B12;
- дефицит фолиевой кислоты;
- дефицит аскорбиновой кислоты (витамин С);
- голодание и недоедание.
Хронические заболевания и новообразования
- почечные заболевания (например, туберкулез печени, гломерулонефрит);
- заболевания печени (например, гепатит, цирроз);
- заболевания желудочно-кишечного тракта (например, язва желудка и двенадцатиперстной кишки, атрофический гастрит, неспецифический язвенный колит, болезнь Крона);
- коллагеновые сосудистые болезни (например, системная красная волчанка, ревматоидный артрит);
- доброкачественные и злокачественные опухоли (например, миома матки, полипы в кишечнике, рак почек, легких, кишечника).
- вирусные заболевания (гепатит, инфекционный мононуклеоз, цитомегаловирус);
- бактериальные заболевания (туберкулез легких или почек, лептоспироз, обструктивный бронхит);
- протозойные заболевания (малярия, лейшманиоз, токсоплазмоз).
Ядохимикаты и медикаментозные средства
- неорганический мышьяк, бензол;
- радиация;
- цитостатики (химиотерапевтические препараты, используемые для лечения опухолевых заболеваний);
- антибиотики;
- нестероидные противовоспалительные средства;
- антитиреоидные препараты (снижают синтез гормонов щитовидной железы);
- противоэпилептические препараты.
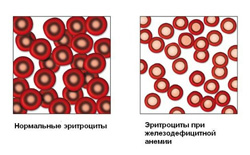
Для железодефицитной анемии характерно снижение эритроцитов, гемоглобина и цветового показателя.
Железо — это жизненно важный элемент, участвующий во многих метаболических процессах организма. У человека с весом семьдесят килограмм запас железа в организме составляет примерно четыре грамма. Данное количество поддерживается благодаря сохранению баланса между регулярными потерями железа из организма и его поступлением. Для поддержания равновесия суточная потребность железа составляет 20 – 25 мг. Большая часть поступающего железа в организм затрачивается на его нужды, остальное депонируется в виде ферритина или гемосидерина и при необходимости расходуется.
Нарушение поступления железа в организм
- вегетарианство вследствие неупотребления белков животного происхождения (мясо, рыба, яйца, молочные продукты);
- социально-экономическая составляющая (например, недостаточно денег для полноценного питания).
Нарушение усвоения железа
Всасывание железа происходит на уровне слизистых желудка, поэтому такие заболевания желудка как гастриты, язвенная болезнь или резекция желудка приводят к нарушению всасывания железа.
Повышенная потребность организма в железе
- беременность, в том числе многоплодная беременность;
- период лактации;
- подростковый возраст (за счет быстрого роста);
- хронические заболевания, сопровождающиеся гипоксией (например, хронический бронхит, пороки сердца);
- хронические нагноительные заболевания (например, хронические абсцессы, бронхоэктатическая болезнь, сепсис).
Потери железа из организма
- легочные кровотечения (например, при раке легких, туберкулезе);
- желудочно-кишечные кровотечения (например, язва желудка и двенадцатиперстной кишки, рак желудка, рак кишечника, варикозное расширение вен пищевода и прямой кишки, неспецифический язвенный колит, глистные инвазии);
- маточные кровотечения (например, преждевременная отслойка плаценты, разрыв матки, рак матки или шейки матки, прервавшаяся внематочная беременность, миома матки);
- почечные кровотечения (например, рак почек, туберкулез почек).
Питание при анемии
В питании железо делится на:
- гемовое, которое поступает в организм с продуктами животного происхождения;
- негемовое, которое поступает в организм с продуктами растительного происхождения.
Следует заметить, что гемовое железо усваивается в организме значительно лучше, нежели негемовое.
Количество железа на сто миллиграмм
Продукты питания
животного
происхождения
- печень;
- язык говяжий;
- мясо кролика;
- индюшатина;
- гусиное мясо;
- говядина;
- рыба.
- 9 мг;
- 5 мг;
- 4,4 мг;
- 4 мг;
- 3 мг;
- 2,8 мг;
- 2,3 мг.
Продукты питания растительного происхождения
- сушеные грибы;
- свежий горох;
- гречка;
- геркулес;
- свежие грибы;
- абрикосы;
- груша;
- яблоки;
- сливы;
- черешня;
- свекла.
- 35 мг;
- 11,5 мг;
- 7,8 мг;
- 7,8 мг;
- 5,2 мг;
- 4,1 мг;
- 2,3 мг;
- 2,2 мг;
- 2,1 мг;
- 1,8 мг;
- 1,4 мг.
При соблюдении диеты также следует увеличить потребление продуктов, содержащих витамин C, а также белок мяса (они повышают усвояемость железа в организме) и снизить потребление яиц, соли, кофеина и кальция (они уменьшают всасываемость железа).
Медикаментозное лечение
При лечении железодефицитной анемии больному параллельно с диетой назначается прием препаратов железа. Данные лекарственные средства предназначены для восполнения дефицита железа в организме. Они выпускаются в виде капсул, драже, инъекций, сиропов и таблеток.
Доза и длительность лечения подбирается индивидуально в зависимости от следующих показателей:
- возраста пациента;
- степени тяжести заболевания;
- причины, вызвавшей железодефицитную анемию;
- на основе результатов анализов.
Препараты железа принимаются за один час до еды или через два часа после приема пищи. Данные лекарственные средства нельзя запивать чаем или кофе, так как снижается всасываемость железа, поэтому их рекомендуется запивать водой или соком.
Принимать внутрь по одному грамму три – четыре раза в сутки.
Принимать по одной таблетке в день, с утра за тридцать минут до приема пищи.
Принимать по одной таблетке один – два раза в день.
Данные препараты рекомендуется назначать совместно с витамином C (по одной таблетке один раз в день), так как последний увеличивает всасываемость железа.
Препараты железа в виде инъекций (внутримышечных или внутривенных) применяются в следующих случаях:
- при тяжелой степени анемии;
- если анемия прогрессирует, несмотря на принимаемые дозы железа в виде таблеток, капсул или сиропа;
- если у больного имеются заболевания желудочно-кишечного тракта (например, язва желудка и двенадцатиперстной кишки, неспецифический язвенный колит, болезнь Крона), так как принимаемый препарат железа может усугубить имеющееся заболевание;
- перед оперативными вмешательствами с целью ускоренного насыщения организма железом;
- если у пациента имеется непереносимость препаратов железа при их приеме внутрь.
Хирургическое лечение
Хирургическое вмешательство производится при наличии у больного острого или хронического кровотечения. Так, например, при желудочно-кишечном кровотечении может применяться фиброгастродуоденоскопия или колоноскопия с выявлением области кровотечения и последующей его остановкой (например, удаляется кровоточащий полип, коагулируется язва желудка и двенадцатиперстной кишки). При маточных кровотечениях, а также при кровотечениях в органах, находящихся в брюшной полости, может применяться лапароскопия.
При необходимости больному может быть назначено переливание эритроцитарной массы для восполнения объема циркулирующей крови.

В норме витамин В12 поступает в организм с пищевыми продуктами. На уровне желудка В12 связывается с продуцируемым в нем белком, гастромукопротеидом (внутренний фактор Касла). Данный белок защищает поступивший в организм витамин от негативного воздействия микрофлоры кишечника, а также способствует его усвоению.
Комплекс гастромукопротеид и витамин В12 доходит до дистального отдела (нижний отдел) тонкого кишечника, где происходит распад этого комплекса, всасывание витамина В12 в слизистый слой кишечника и дальнейшее поступление его в кровь.
Из кровяного русла данный витамин поступает:
- в красный костный мозг для участия в синтезе эритроцитов;
- в печень, где происходит его депонирование;
- в центральную нервную систему для синтеза миелиновой оболочки (покрывает аксоны нейронов).
Клиническая картина В12 и фолиево-дефицитной анемии основывается на развитии у больного следующих синдромов:
- анемический синдром;
- желудочно-кишечный синдром;
- невралгический синдром.
| |
Данные симптомы развиваются вследствие атрофических изменений слизистого слоя ротовой полости, желудка и кишечника. |
|
- снижение уровня эритроцитов и гемоглобина;
- гиперхромия (выраженная окраска эритроцитов);
- макроцитоз (увеличенный размер эритроцитов);
- пойкилоцитоз (различная форма эритроцитов);
- при микроскопии эритроцитов выявляются кольца Кебота и тельца Жолли;
- ретикулоциты снижены или в норме;
- снижение уровня лейкоцитов (лейкопения);
- повышение уровня лимфоцитов (лимфоцитоз);
- снижение уровня тромбоцитов (тромбоцитопения).
В биохимическом анализе крови наблюдается гипербилирубинемия, а также снижение уровня витамина В12.
При пункции красного костного мозга выявляется повышение мегалобластов.
Больному могут быть назначены следующие инструментальные исследования:
- исследование желудка (фиброгастродуоденоскопия, биопсия);
- исследование кишечника (колоноскопия, ирригоскопия);
- ультразвуковое исследование печени.
Данные исследования помогают выявить атрофические изменения слизистой оболочки желудка и кишечника, а также обнаружить заболевания, которые привели к развитию В12-дефицитной анемии (например, злокачественные образования, цирроз печени).
Все больные госпитализируются в отделение гематологии, где проходят соответствующее лечение.
Питание при В12-дефицитной анемии
Назначается диетотерапия, при которой увеличивается потребление продуктов, богатых витамином В12.
Суточная норма витамина В12 составляет три микрограмма.
Количество витамина В12 на сто миллиграмм
Медикаментозное лечение
Медикаментозное лечение назначается больному по следующей схеме:
- В течение двух недель больной ежедневно получает по 1000 мкг Цианокобаламина внутримышечно. За две недели у пациента исчезает неврологическая симптоматика.
- В течение последующих четырех – восьми недель больной получает по 500 мкг ежедневно внутримышечно для насыщения депо витамина В12 в организме.
- Впоследствии больной пожизненно получает внутримышечные инъекции один раз в неделю по 500 мкг.
Во время лечения одновременно с Цианокобаламином больному могут назначить прием фолиевой кислоты.
Больной В12-дефицитной анемией должен пожизненно наблюдаться у гематолога, гастролога и семейного врача.
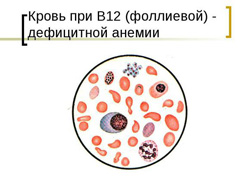
Фолиевая кислота (витамин B9) является водорастворимым витамином, который отчасти продуцируется клетками кишечника, но в основном должен поступать извне для восполнения необходимой для организма нормы. Суточная норма фолиевой кислоты составляет прием 200 – 400 мкг.
В пищевых продуктах, а также в клетках организма фолиевая кислота находится в форме фолатов (полиглутаматы).
Фолиевая кислота играет большую роль в организме человека:
- участвует в развитии организма во внутриутробном периоде (способствует формированию нервной проводимости тканей, кровеносной системы плода, предупреждает развитие некоторых пороков развития);
- участвует в росте ребенка (например, в первый год жизни, в период полового созревания);
- влияет на процессы кроветворения;
- совместно с витамином В12 участвует в синтезе ДНК;
- препятствует образованию тромбов в организме;
- улучшает процессы регенерации органов и тканей;
- участвует в обновлении тканей (например, кожи).
Абсорбция (всасывание) фолатов в организме осуществляется в двенадцатиперстной кишке и в верхнем отделе тонкого кишечника.
При фолиеводефицитной анемии у больного наблюдается анемический синдром (такие симптомы как повышенная утомляемость, сердцебиение, бледность кожных покровов, снижение работоспособности). Неврологический синдром, а также атрофические изменения слизистой оболочки ротовой полости, желудка и кишечника при данном виде анемии отсутствуют.
Также у больного может наблюдаться увеличение размеров селезенки.
При общем анализе крови наблюдаются следующие изменения:
- гиперхромия;
- снижение уровня эритроцитов и гемоглобина;
- макроцитоз;
- лейкопения;
- тромбоцитопения.
В результатах биохимического анализа крови наблюдается снижение уровня фолиевой кислоты (менее 3 мг/мл), а также повышение непрямого билирубина.
При проведении миелограммы выявляется повышенное содержание мегалобластов и гиперсегментированных нейтрофилов.
Питание при фолиеводефицитной анемии играет большую роль, больному необходимо ежедневно потреблять продукты, богатые фолиевой кислотой.
Следует заметить, что при любой кулинарной обработке продуктов фолаты разрушаются приблизительно на пятьдесят процентов и более. Поэтому для обеспечения организма необходимой суточной нормой продукты рекомендуется употреблять в свежем виде (овощи и фрукты).
| Продукты питания | Наименование продуктов | Количество железа на сто миллиграмм |
| Продукты питания животного происхождения |
|
|
| Продукты питания растительного происхождения |
|
|
Медикаментозное лечение фолиеводефицитной анемии включает прием фолиевой кислоты в количестве от пяти до пятнадцати миллиграмм в сутки. Необходимую дозировку устанавливает лечащий врач в зависимости от возраста пациента, тяжести течения анемии и результатов исследований.
Профилактическая доза включает прием одного – пяти миллиграмм витамина в сутки.
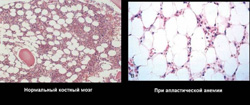
Апластическая анемия может быть врожденной или приобретенной.
Клинические проявления апластической анемии зависят от степени выраженности панцитопении.
При апластической анемии у больного наблюдаются следующие симптомы:
- бледность кожных покровов и слизистых;
- головная боль;
- учащенное сердцебиение;
- одышка;
- повышенная усталость;
- отеки на ногах;
- десневые кровотечения (вследствие снижения уровня тромбоцитов в крови);
- петехиальная сыпь (красные пятна на коже маленьких размеров), синяки на коже;
- острые или хронические инфекции (вследствие снижения уровня лейкоцитов в крови);
- изъязвления орофарингеальной зоны (поражается слизистая полости рта, язык, щеки, десна и глотка);
- желтушность кожных покровов (симптом поражения печени).
При биохимическом анализе крови наблюдается:
- повышение сывороточного железа;
- насыщение трансферрина (белок, переносящий железо) железом на 100%;
- повышение билирубина;
- повышение лактатдегидрогеназы.
При пункции красного мозга и последующем гистологическом исследовании выявляются:
- недоразвитие всех ростков (эритроцитарный, гранулоцитарный, лимфоцитарный, моноцитарный и макрофагальный);
- замещение костного мозга жировым (желтый костный мозг).
Среди инструментальных методов исследований больному может быть назначено:
- ультразвуковое исследование паренхиматозных органов;
- электрокардиография (ЭКГ) и эхокардиография;
- фиброгастродуоденоскопия;
- колоноскопия;
- компьютерная томография.
При правильно подобранном поддерживающем лечении состояние пациентов с апластической анемией существенно улучшается.
При лечении апластической анемии больному назначаются:
- иммунодепрессивные препараты (например, Циклоспорин, Метотрексат);
- глюкокортикостероиды (например, Метилпреднизолон);
- антилимфоцитарный и антитромбоцитарный иммуноглобулины;
- антиметаболиты (например, Флударабин);
- эритропоэтин (стимулирует образование эритроцитов и стволовых клеток).
Немедикаментозное лечение включает:
- трансплантацию костного мозга (от совместимого донора);
- переливание компонентов крови (эритроциты, тромбоциты);
- плазмаферез (механическое очищение крови);
- соблюдение правил асептики и антисептики с целью предотвращения развития инфекции.
Также при тяжелом течении апластической анемии больному может понадобиться хирургическое лечение, при котором производится удаление селезенки (спленэктомия).
В зависимости от эффективности проводимого лечения у больного при апластической анемии может наблюдаться:
- полная ремиссия (затухание или полное исчезновение симптомов);
- частичная ремиссия;
- клиническое улучшение;
- отсутствие эффекта от лечения.
|
|
|
|

Гемолитическая анемия может развиться вследствие наследственных или приобретенных заболеваний.
По локализации гемолиз может быть:
- внутриклеточным (например, аутоиммунная гемолитическая анемия);
- внутрисосудистым (например, переливание несовместимой крови, диссеминированное внутрисосудистое свертывание).
У пациентов с легкой степенью гемолиза уровень гемоглобина может быть нормальным, если производство эритроцитов соответствует темпу их разрушения.
Преждевременное разрушение эритроцита может быть связано со следующими причинами:
- внутренними мембранными дефектами эритроцитов;
- дефектами структуры и синтеза белка гемоглобина;
- ферментативными дефектами в эритроците;
- гиперспленомегалией (увеличение размеров печени и селезенки).
Наследственные заболевания могут вызвать гемолиз в результате отклонений мембраны эритроцита, ферментативных дефектов и отклонений гемоглобина.
Существуют следующие наследственные гемолитические анемии:
- энзимопатии (анемии, при которых наблюдается недостаток фермента, дефицит глюкозо-6-фосфатдегидрогеназы);
- наследственный сфероцитоз или болезнь Минковского-Шоффара (эритроциты неправильной шарообразной формы);
- талассемия (нарушение синтеза полипептидных цепей, входящих в строение нормального гемоглобина);
- серповидно-клеточная анемия (изменение строения гемоглобина приводит к тому, что эритроциты принимают серпообразную форму).
Приобретенные причины гемолитической анемии включают иммунные и не иммунные нарушения.
Иммунные нарушения характеризуются аутоиммунной гемолитической анемией.
Не иммунные нарушения могут быть вызваны:
- ядохимикатами (например, пестициды, бензол);
- лекарственными средствами (например, противовирусные препараты, антибиотики);
- физическим повреждением;
- инфекциями (например, малярия).
Гемолитическая микроангиопатическая анемия приводит к производству фрагментированных эритроцитов и может быть вызвана:
- дефектным искусственным сердечным клапаном;
- диссеминированным внутрисосудистым свертыванием;
- гемолитическим уремическим синдромом;
- тромбоцитопенической пурпурой.
Симптомы и проявления гемолитической анемии разнообразны и зависят от вида анемии, степени компенсации, а также от того, какое лечение получал больной.
Следует заметить, что гемолитическая анемия может протекать бессимптомно, а гемолиз выявляться случайно во время обычного лабораторного тестирования.
При гемолитической анемии могут наблюдаться следующие симптомы:
- бледность кожи и слизистых;
- ломкость ногтей;
- тахикардия;
- учащение дыхательных движений;
- снижение артериального давления;
- желтушность кожных покровов (из-за увеличения уровня билирубина);
- на ногах могут наблюдаться язвы;
- гиперпигментация кожи;
- желудочно-кишечные проявления (например, боль в животе, нарушение стула, тошнота).
Следует заметить, что при внутрисосудистом гемолизе у больного наблюдается дефицит железа из-за хронической гемоглобинурии (наличие гемоглобина в моче). Вследствие кислородного голодания нарушается сердечная функция, что приводит к развитию у пациента таких симптомов как слабость, тахикардия, одышка и стенокардия (при тяжелой форме анемии). Из-за гемоглобинурии у больного также наблюдается потемнение мочи.
Длительный гемолиз может привести к развитию желчных камней вследствие нарушения обмена билирубина. При этом пациенты могут жаловаться на боль в животе и бронзовый цвет кожи.
В общем анализе крови наблюдается:
- снижение уровня гемоглобина;
- снижение уровня эритроцитов;
- увеличение ретикулоцитов.
При микроскопии эритроцитов выявляется их серпообразная форма, а также кольца Кебота и тельца Жолли.
В биохимическом анализе крови наблюдается повышение уровня билирубина, а также гемоглобинемия (увеличение свободного гемоглобина в плазме крови).
Также необходимо сдать анализ мочи на выявление наличия гемоглобинурии.
При пункции костного мозга наблюдается выраженная гиперплазия эритроцитарного ростка.
Существует много видов гемолитической анемии, поэтому лечение может отличаться в зависимости от причины, вызвавшей анемию, а также от типа гемолиза.
При лечении гемолитической анемии больному могут назначаться следующие препараты:
- Фолиевая кислота. Профилактическая доза фолиевой кислоты назначается, потому что активный гемолиз может потреблять фолат и впоследствии привести к развитию мегалобластоза.
- Глюкокортикостероиды (например, Преднизолон) и иммунодепрессанты (например, Циклофосфан). Данные группы препаратов назначаются при аутоиммунной гемолитической анемии.
- Переливание эритроцитарной массы. Больному индивидуально подбираются отмытые эритроциты, так как существует высокий риск разрушения перелитой крови.
Спленэктомия
Спленэктомия может быть первоначальным вариантом в лечении некоторых типов гемолитической анемии, таких как, например, наследственный сфероцитоз. В других случаях, например, при аутоиммунной гемолитической анемии, спленэктомия рекомендуется тогда, когда другие методы лечения потерпели неудачу.
Терапия препаратами железа
При гемолитической анемии применение препаратов железа в большинстве случаев противопоказано. Это связано с тем, что уровень железа при данной анемии не снижается. Однако если у больного наблюдается постоянная гемоглобинурия, то происходит существенная потеря железа из организма. Поэтому при выявлении дефицита железа пациенту может быть назначено соответствующее лечение.
Проявления анемии будут зависеть от следующих факторов:
- какое количество крови было потеряно;
- с какой скоростью происходит кровопотеря.
Симптомами постгеморрагической анемии являются:
- слабость;
- головокружение;
- бледность кожных покровов;
- сердцебиение;
- одышка;
- тошнота, рвота;
- сечение волос и ломкость ногтей;
- шум в ушах;
- мелькание мушек перед глазами;
- жажда.
При острой кровопотере у больного может развиться геморрагический шок.
Выделяют четыре степени геморрагического шока.
источник



