Термином «анемия» обозначают патологические состояния, характеризующиеся уменьшением содержания гемоглобина (Гб) и/или количества эритроцитов (Эр) в единице объема крови.
Анемический синдром выявляется в любом возрасте и является одной из самых распространенных патологий. Если учитывать все анемии не только как нозологические формы, но и анемический синдром при различных заболеваниях, то масштабы проблемы столь широки, что ее иногда характеризуют, как «скрытую эпидемию» («Анемия — скрытая эпидемия», 2004). Анемия выявляется у 15-20% беременных, а по некоторым данным — у 40% будущих матерей.
В зависимости от уровня гемоглобина выделяют анемию тяжелой (уровень гемоглобина 75 г/л и ниже), умеренной или средней (гемоглобин 80-100 г/л) и легкой (100-110 г/л) степени тяжести.
- Этиологически они подразделяются на анемии, обусловленные внутри-эритроцитарными факторами — обычно врожденными (аномалии мембраны, ферментопатии, гемоглобинопатии), и анемии, обусловленные внеэри-троцитарными факторами — обычно приобретенными.
- В зависимости от размеров эритроцитов — микроцитарные анемии (средний объем эритроцитов МСУ 3 ), нормоцитарные (СДЭ = 7-8 мкм;МСУ = 80-100 мкм 3 ) и макроцитарные (МСУ более 95-100 мкмЗ) МСУ анемии.
- В зависимости от степени насыщения гемоглобином — гипохромные (с цветовым показателем — ЦП — менее 0,85 и средней концентрацией гемоглобина в эритроцитах — МСНС — ниже 30 г/дл), нормохромные (ЦП = 0,9-1,1; МСНС = 30-38 г/дл) и гиперхромные (ЦП выше 1,1; МСНС более 38 г/дл) анемии.
- В зависимости от сохранности и адекватности реакции костного мозга на снижение уровня гемоглобина и эритроцитов, определяемого по числу ретикулоцитов, анемии могут быть разделены на гипорегенераторные (при уровне ретикулоцитов менее 1-1,2% при наличии анемии), связанные с нарушением продукции эритроцитов в костном мозге, а также нормо-или гиперрегенераторные (уровень ретикулоцитов повышен умеренно или значительно — до 20-30% и более. Повышение числа ретикулоцитов указывает на то, что малокровие, скорее всего, обусловлено гемолизом (т. е. повышенным разрушением эритроцитов) или кровотечением.
С учетом ведущего механизма развития строятся патогенетические классификации, примером которых может быть следующий вариант группировки анемий по патогенетическому механизму (Воробьев П. А., 2001):
- Железодефицитные анемии.
- Анемии, связанные с нарушением синтеза тема: сидероахрестические, дефицит гемсинтетазы.
- Анемии, связанные с нарушением синтеза ДНК — мегалобластные анемии.
- Анемии, обусловленные нарушением транспорта железа — атрансферри-немия.
- Гемолитические анемии.
- Анемии, связанные с костномозговой недостаточностью.
- Анемии, связанные с нарушением регуляции эритропоэза (повышение уровня ингибиторов эритропоэза).
зависят от степени снижения кислород-насыщающей способности крови, степени изменения общего объема крови, проявлений основного заболевания, которое приводит к развитию анемии и способности сердечно-сосудистой и дыхательной систем компенсировать анемию.
Многообразные клинико-гематологические проявления анемий можно разделить на две основные группы: симптомы, возникновение которых связано с гипоксией (так называемые неспецифические симптомы) и симптомы, характерные только для определенной анемии.
К общеанемическим симптомам, составляющим общеанемический синдром, относят слабость, бледность кожи и слизистых, одышку, тахикардию, головокружение, головную боль, снижение умственной концентрации, сонливость. Практически для всех видов анемий характерны симптомы со стороны сердечно-сосудистой системы, которые проявляются наличием шума в сердце, обычно систолического характера, который выслушивается в области легочной артерии. При тяжелой анемии шумы могут определяться в области митрального и трехстворчато го клапанов. Эти шумы легко дифференцируются от шумов, возникающих при органических поражениях сердца. При анемиях часто наблюдается ритм галопа пресистолического и протодиастолического типов. Изменения ЭКГ проявляются в депрессии интервала 8Т с 17-образной деформацией 8Т сегмента, изменении продолжительности электрической систолы (интервал С>Т), нарушении предсердно-желудочковой проводимости. При тяжелых анемиях (уровень НЬ ниже 60 -70 г/л) может наблюдаться фибрилляция предсердий.
При диагностике анемий важно выяснить особенности начала заболевания. Так постепенное начало чаще связано с нарушением продукции эритроцитов, острое — чаще наблюдается при повышенном разрушении красных кровяных клеток. Следует отметить имевшиеся провоцирующие факторы (вирусные инфекции, химические и физические факторы и др.), что может свидетельствовать в пользу определенного вида анемий (аутоиммунных, фер-ментопатий и т. д.).
Для установления патогенеза анемии при оценке показателей «красной крови» обращают внимание на так называемые, эритроцитарные параметры (индексы), отражающие размеры эритроцитов и степень их насыщения гемоглобином, количество ретикулоцитов и морфологические характеристики эритроидных клеток, которые отмечает врач-лаборант при просмотре мазка крови.
Снижение МСУ характерно для микроцитарных — железодефицитной анемии (ЖДА), талассемии. Причиной макроцитарной анемии, характеризующейся повышением показателя МСУ, могут быть мегалобластные анемии или нарушения, не связанные с нарушенным синтезом ДНК. Так причиной макроцитоза могут стать хронические заболевания печени, хронические заболевания почек, курение, гипо- и гипертиреоидизм.
Гипохромия эритроцитов выявляется в случаях, когда снижение Гб выражено сильнее, чем уменьшение числа Эр. Чаще всего это происходит при нарушениях процессов синтеза гемоглобина (при железодефицитной анемии, талассемии, свинцовом отравлении) и сидеробластной анемии (нарушение утилизации запасов железа). Как нормохромные, обычно характеризуются гемолитические анемии и анемии, связанные с гипопластическим состоянием костного мозга в частности. Гиперхромия — повышенная насыщенность гемоглобином цитоплазмы клеток характерна для макро- и мегалоцитов.
Гипорегенераторные анемии со сниженным или нормальным уровнем ретикулоцитов наблюдаются при дефиците железа, анемии при хронических заболеваниях или миелодисплазии. Значительное повышение числа ретикулоцитов указывает на то, что малокровие, вероятее всего, обусловлено гемолизом или кровотечением.
Важную информацию можно получить при оценке морфологических особенностей эритроцитов. Наличие макро- и особенно мегалоцитоза эритроцитов типично для Вр и фолиево-дефицитной анемии. Сфероциты встречаются при аутоиммунном гемолизе или наследственном сфероцитозе, шизоциты — фраг-ментированные эритроциты, расщепленные фибриновыми нитями — при микроангиопатиях (тромботической тромбоцитопенической пурпуре или диссемини-рованном внутрисосудистом свертывании — ДВС). Мишеневидные («таргетные») клетки в небольшом количестве появляются в крови при ряде гемоглобинопатии, при патологии печени, но наиболее характерны для талассемии, при которой их процентное содержание может быть значительным. Появление базофиль-ной пунктации эритроцитов характерно для свинцовых отравлений, талассемии и других дизэритропоэтических анемиях.
Ядерные формы эритроцитов (нормобласты или эритрокариоциты) наблюдаются при эритробластической анемии, инфильтрации костного мозга, гемолизе, гипоксии.
Дальнейшие исследования проводятся для уточнения предполагаемого варианта анемии и включают в себя биохимические, иммунологические и другие виды анализов.
Существуют определенные группы больных, относящихся к группам риска по развитию того или иного вида малокровия, которых желательно обследовать регулярно в порядке скрининга с целью выявления предрасположенности к анемии или ранних стадий анемии и проведения соответствующих профилактических и лечебных мероприятий.
Железодефщитная анемия (ЖДА) — наиболее распространенная форма анемий. Социальная значимость данной патологии определяется частой встречаемостью ЖДС среди женщин детородного возраста и детей, неблагоприятным влиянием железодефщита нарост и развитие детей и подростков, снижением работоспособности и ухудшением качества жизни взрослых, зависимостью частоты заболеваемости от ряда социальных факторов (уровня жизни, образования, здравоохранения).
Основные причины развития дисбаланса обмена железа в организме, ведущего к железодефицитным состояниям:
- Потери крови, особенно меноррагии или кровотечения из желудочно-кишечного тракта (ЖКТ) при эзофагите, пептической язве, карциноме, колите, дивертикулите, геморрое.
- Неадекватное питание, приводящее к развитию ЖДА у детей и подростков, реже у взрослых.
- Глистные инвазии и связанные с ними ЖК-кровопотери.
- Мальабсорбция (например, при кишечных заболеваниях).
К группам повышенного риска развития железодефицита относятся:
- Дети: потребности в железе при быстром росте часто превышают его поступление.
- Девочки в подростковом возрасте.
- Женщины: некомпенсированные потери железа во время менструаций, беременности, родов, гиперполименоррее.
- Доноры без компенсации потерь железа.
- Пожилые люди вследствие хронических гастроинтестинальных заболеваний и питания, содержащего мало мясных продуктов. Определенную роль в развитии заболевания играет геликобактерная инфекция.
Клиническая картина заболевания складывается из неспецифических проявлений общеанемического синдрома и проявлений тканевого дефицита железа — так называемого сидеропенического синдрома. Как правило, отмечается сухость кожи, характерный алебастровый или зеленоватый оттенок кожных покровов, а также голубоватый оттенок склер («симптом голубых склер»), как отражение дистрофических изменений роговицы в условиях дефицита железа, повышенная ломкость ногтей и волос. Возможно появление поперечной ис-черченности ногтевой пластинки и специфические «ложкообразные» их изменения — койлонихии. У больных имеется выраженная общая слабость, которая может не соответствовать степени анемии, и мышечная слабость, обусловленная нарушением синтеза миоглобина. Может выявляться дисфагия, извращение вкуса и обоняния с пристрастием к необычным запахам, «заеды» в углах рта (ангулярный стоматит), сглаженность сосочков языка, дизурические явления, недержание мочи при смехе, кашле.
Железодефицитная анемия сопровождается многочисленными осложнениями в течение беременности и родов как у матери, так и у плода, включая невынашивание беременности, кровотечение в родах.
Поскольку заболевание развивается медленно (месяцы и даже годы), клинические проявления обычно сглажены и больные адаптированы ко многим проявлениям.
Для анализов крови при ЖДА характерно наличие гипохромной микро-цитарной анемии, отмечается анизоцитоз эритроцитов. При оценке мазка крови обращает на себя внимание бледность эритроцитов, встречаются эритроциты в виде колец с широким просветлением в центре (анулоциты). При глубокой анемии отмечается выраженный анизоцитоз и пойкилоцитоз эритроцитов, могут появляться единичные мишеневидные клетки. Количество ретикулоцитов обычно в норме, т.к. регенераторная способность эритроидного ростка костного мозга сохранена. Транзиторный ретикулоцитоз может наблюдаться при выраженной кровопотере или при приеме препаратов железа незадолго до проведения анализов. У отдельных больных возможна умеренная лейкопения и может отмечаться тромбоцитопения (чаще у детей) или тромбоцитоз.
ЖДА диагностируется при сниженном уровне сывороточного железа ( 69 мкмоль/л (ОЖСС). Процент насыщения трансферрина железом (Кнас) 100 фл).
Заболевание обусловлено малъабсорбцией В/2 в результате атрофического гастрита и отсутствия секреции внутреннего желудочного фактора (перни-циозная анемия, болезнь Аддисона-Бирмера), гастрэктомия; алиментарный дефицит (в частности, у вегетарианцев); иногда болезни терминального отдела подвздошной кишки (болезнь Крона) или ее резекция; слепая петля; дивертикул; глистные инвазии (ВурМНоЪо1гшгп).
В12 содержится в печени и всех животных продуктах. Имеются запасы витамина в организме.
Нередко В12-ДА ассоциирована с заболеваниями щитовидной железы (до 25%), витилиго, болезнью Аддисона, карциномой желудка.
В клинической картине заболевания наряду с общеанемическими симптомами могут присутствовать признаки поражения центральной и периферической нервной системы, ЖКТ, что проявляется такими нарушениями, как: парестезии; периферическая нейропатия, нарушение позиционной и вибрационной чувствительности; нейропсихиатрические отклонения; глоссит — болезненный красный язык; диаррея.
Важно отметить, что неврологическая симптоматика (симптоматика так называемого «фуникулярного миелоза») может опережать развитие анемии.
Возможна умеренная желтушиость (лимонный оттенок кожи), умеренная спленомегалия и билирубинемия за счет непрямой фракции в связи с гемолизом (преимущественно внутрикостномозговым), нередко сопровождающим В12-ДА. Диагностика. Основное значение в диагностике ВП-ДА принадлежит морфологическим исследованиям крови и костного мозга. Анемия носит характер макроцитарной нормо- или гиперхромной, гипорегенераторной анемии. Отмечается анизо-, пойкилоцитоз, базофильная зернистость эритроцитов за счет наличия элементов РНК. В эритроцитах обнаруживаются остатки ядра в виде телец Жолли, колец Кебота. В клиническом анализе крови могут быть лейко-и тромбоцитопения, обычно умеренные, а также морфологические изменения гранулоцитов и тромбоцитов (формы больших размеров, гиперсегментация ядер нейтрофилов). Для уточнения диагноза показаны дополнительные исследования, включая исследование костного мозга для подтверждения мегалобластоид-ного типа кроветворения.
Имеются методы определения концентрации В]2 в сыворотке крови, что служит отражением запасов кобаламина в организме. Указанием на клинически значимый дефицит витамина Вр является его существенно сниженный сывороточный уровень.
У части больных могут обнаруживаться антитела к париетальным клеткам желудка или антитела к внутреннему фактору (специфические для пернициоз-ной анемии). В таких случаях иногда информативен тест Шиллинга, который назначается для определения, является ли дефицит В12 следствием мальабсорбции или отсутствия внутреннего фактора путем сравнения пропорции содержания в оральной дозе (1 мкг) радиоактивного В|2 с экскретируемым с мочой — при и без дополнительного назначения внутреннего фактора. Концентрация гомоци-стеина у больных с дефицитом В12 и дефицитом фолатов повышена.
Дифференциальная диагностика проводится с другими видами анемий, в первую очередь — макроцитарных, а также с фолиеводефицитной анемией. Понятие макроцитарной анемии отражает увеличенный размер эритроцитов, причиной которого могут быть нарушения, не связанные с синтезом ДНК. Дефицит витамина В12 следует отличать от таких заболеваний, как апластическая анемия, рефрактерная анемия или миелодиспластический синдром (МДС). Макроцитар-ную анемию с панцитопенией могут вызывать как гипо- так и гипертиреоидизм, а также алкоголизм, хронические заболевания печени. Причиной макроцитоза могут стать хронические заболевания почек и курение. Большое число ретику-лоцитов может повышать показатель МСУ, поскольку ретикулоциты являются крупными клетками. Вследствие этого гемолитическая анемия иногда ошибочно принимается за мегалобластную. В сложных случаях основным методом исследования является исследование костного мозга.
В лечении Вр-ДА важным моментом является устранение причины дефицита. Проводится заместительная терапия цианкобаламином до нормализации гематологических показателей или при ЦНС симптомах — пока не завершится восстановление. Большинству больных требуется поддерживающая терапия умеренными дозами В[2 на протяжении длительного времени (до полугода), а при неустранимости причины дефицита — в течение жизни. Предвестником начала улучшения является значительный ретикулоцитоз (как правило, после 4-5 дней) — ретикулоцитарный криз. Поскольку гемопоэз активизируется в ходе лечения, может быть необходимо дополнительное назначение препаратов железа. В трансфузиях эритроцитарной массы обычно необходимости нет.
Возможно полное гематологическое и неврологическое восстановление.
Причины низких фолатов — бедная диета (например, у алкоголиков), повышение потребности в фолатах (беременность, гемолиз, дизеритропоэз, опухоли, длительный гемодиализ), мальабсорбция, особенно при заболеваниях кишечника, тропическая спру, медикаменты (ряд противосудорожных препаратов, антагонист фолатов — метатрексат и др).
Фолаты содержатся в зеленых овощах, фруктах, печени и синтезируется кишечными бактериями. Запасы в организме истощаются относительно быстро при недостаточном поступлении.
Клиническая картина аналогична В]2-ДА, за исключением неврологических нарушений. Дефицит фолатов у матери также связан с дефектами нервной трубки у плода.
Диагностика. Картина крови и костного мозга не отличается от таковой при В12-ДА.
Для диагностики и дифференциальной диагностики используется определение уровня фолатов и В12 в сыворотке, а также фолатов эритроцитов.
При смешанных В]2-фолиеводефицитных формах анемии или неверной диагностике ФДА назначение одних фолатов может способствовать проявлению или ухудшению течения подострой комбинированной дегенерации спинного мозга.
Лечение. При ФДА проводится заместительная терапия фолиевой кислотой в виде перорального препарата. Терапия проводится под контролем показателей гемограммы (уровень гемоглобина и эритроцитов, эритроцитарные параметры, появление ретикулоцитарного криза) до нормализации показателей красной крови. При невозможности полного устранения факторов, способствующих развитию дефицита фолатов, в дальнейшем проводятся профилактические курсы терапии.
Прогноз благоприятный при адекватном лечении анемии и устранении причины заболевания.
Профилактика фолиеводефицитной анемии
Первичные профилактические мероприятия включают в себя наблюдение за лицами из групп риска, коррекцию диеты и назначение профилактических доз фолиевой кислоты при заболеваниях и состояниях, способствующих развитию ФДА. В частности, группу риска составляют больные эпилепсией, поскольку противосудорожные препараты являются потенциальными индукторами печеночных ферментов, а увеличение их активности приводит к ускоренному распаду фолатов и возникновению фолиеводефицитной мегалобластной анемии. Поэтому больных эпилепсией и пациентов, принимающих препараты из группы антиметаболитов, таких как метатрексат, необходимо регулярно обследовать для своевременного обнаружения анемии и проведения соответствующих мероприятий.
Гемолизом называют преждевременное разрушение эритроцитов. Он может происходить непосредственно в циркуляции (внутрисосудистый гемолиз) или в ретикулоэндотелиалъной системе (внесосудистый).
Причины гемолиза могут быть как генетически обусловленными, так и приобретенными. Генетические:
- Патология мембраны: врожденный сфероцитоз, эллиптоцитоз.
- Патология гемоглобина: серповидноклеточная болезнь — серповиднокле-точная анемия (СКВ = СКА), талассемия.
- Энзимные дефекты: дефицит глюкозо-фосфат дегидрогеназы (Г6 ФД), дефицит пируваткиназы и др.
- Иммунные: либо изоиммунные (гемолитическая болезнь новорожденных, посттрансфузионные реакции реакции гемолитического типа), аутоиммунные (обусловленные тепловыми или Холодовыми антителами), лекарственно-индуцированные.
- Неиммунные: травматические (кардиальный гемолиз, микроангиопатиче-ская анемия), инфекционные (малярия, септицемия), патология мембраны (па-роксизмальная ночная гемоглобинурия), заболевания печени.
Признаки гемолиза:
- Клинические: желтушность кожи, потемнение мочи, гепатоспленомегалия и др.
- Лабораторные:
— Связанные с повышенным разрушением эритроцитов:
— Повышение уровня билирубина (неконъюгированного);
— Увеличение содержания уробилина в моче;
— Снижение уровня гаптоглобина в сыворотке (связывает свободный гемоглобин).
— Связанные с повышенной продукцией эритроцитов:
— Гиперплазия костного мозга с расширением эритроидного ростка.
При установлении диагноза и проведении дифференциальной диагностики у больных гемолитическими анемиями необходимо обратить внимание на данные анамнеза (семейная история, национальная принадлежность, желтухи, гематурия, прием препаратов, ранее выявлявшейся анемии), на желтушность, гепатоспленомегалию, костные деформации (стигмы при наследственной патологии, особенности черепа при талассемии и др.), язвы на ногах (наблюдаются при СКВ, иногда при сфероцитозе).
Из лабораторных исследований показательными являются общий анализ крови с ретикулоцитами, уровень билирубина и фракционный его состав, ЛДГ, гаптоглобин (снижение уровня — показатель внутрисосудистого гемолиза), уро-билиноген мочи. Мазки крови могут показать полихромазию, макроцитоз, сфероцитоз, эллиптоцитоз, фрагментированные или серповидные клетки, мишене-видные клетки (характерны для талассемии). На следующем этапе проводятся специальные исследования, такие как тест Кумбса, определение гемосидерина мочи (индикатор хронического внутрисосудистого гемолиза). Аномалии мембраны могут быть подтверждены тестами на осмотическую стойкость. Электрофорез гемоглобина определяет варианты гемоглобина. Когда другие причины исключены, проводятся исследования ферментов.
Аутоиммунная гемолитическая анемия (АИГА) — анемия, при которой укорочение длительности жизни эритроцитов является результатом воздействия аутоантител против антигенов (мембранных белков) эритроцитов.
Частота встречаемости — около 1:100 000 населения.
Гемолиз может быть обусловлен тепловыми или Холодовыми антителами.
АИГА может быть самостоятельным заболеванием или выявляться при системных заболеваниях соединительной ткани, патологии щитовидной железы, синдроме Фишера—Эванса (нарушение иммунной регуляции с иммунной тромбоцито-лейкопенией, анемией в сочетании с рядом других нарушений). Известна ВИЧ-ассоциированная АИГА, вторичные АИГА вследствие микоплазменных, пневмококковых инфекций. Возможно появление аутоантител в результате повторных гемотрансфузий, беременностей. Холодовые агглютинины могут продуцироваться микоплазмой и ЭБВ.
Выделяют острую и хроническую формы. Для большинства случаев характерно острое начало с возможным переходом в хроническую форму. В зависимости от серологического варианта различают АИГА с полными и неполными антителами, с тепловыми и Холодовыми антителами, гемолизиновые формы.
Пароксизмальная холодовая гемоглобинурия (синдром Доната-Ландштей-нера), как правило, наблюдается после перенесенных вирусных инфекций и в поздних стадиях сифилиса.
В клинической картине
сочетаются симптомы анемии и гемолиза: потемнение мочи, иктеричность кожи и склер, лихорадка, боли в животе, умеренная гаштоспленомегалия. Особенностью холодовой АИГА является обострение хронической анемии на холоде, частое сочетание с синдромом Рейно или акро-цианозом. Гемолизиновые формы нередко сопровождаются гемоглобинурией и другими признаками острого внутрисосудистого гемолиза.
Диагностика.
Анемия, как правило, нормохромная нормоцитарная, характерен ретикулоцитоз, часто выраженный. Могут встречаться сфероциты в небольшом количестве. Возможен лейкоцитоз со сдвигом лейкоцитарной формулы плево, умеренный тромбоцитоз. Характерно повышение непрямого билирубина, эритроидная гиперплазия костного мозга. Увеличивается уровень лактатдеги-дрогеначы (ЛДГ) сыворотки. Уровень сывороточного железа в норме или повышен, гаптоглобина — в норме или снижен.
Дифференциальная диагностика
проводится с другими видами анемий, в первую очередь — гемолитическими, вторичными анемиями, болезнью Жиль-бера. Задача врачей общей практики — заподозрить данный вид анемии и провести первичную диагностику. Уточнение варианта и лечение обычно проводится в специализированных учреждениях.
Основным диагностическими тестом является положительный прямой анти-глобулиновый тест (проба Кумбса), определяющий антитела или комплемент на поверхности эритроцитов. Дополнительно проводится непрямой тест Кумбса, определяющий антитела в сыворотке.
В лечении аутоиммунных форм гемолитической анемии основное место принадлежит глюкокортикостероидам (ГК). У пациентов с острым гемолизом может использоваться внутривенный иммуноглобулин, обычно в сочетании с ГК.
При отсутствии эффекта от консервативной терапии возможно проведение спленэктомии, эффективность которой при данной патологии составляет около 70%. Из иммуносупрессивных препаратов при неэффективности обычной терапии в лечении АИГА используется азатиаприн, цитостатики (винкаалкалоиды, циклофосфамид), циклоспорин А.
Основой лечения симптоматических анемий является лечение базового заболевания.
Профилактика аутоиммунной гемолитической анемии
Первичные профилактические мероприятия заключаются в лечении основных заболеваний, при которых может возникнуть АИГА.
Вторичная прфилактика. Пациентам, страдающим АИГА для предотвращения усиления гемолиза и развития гемолитических кризов рекомендуется избегать провоцирующих факторов: переохлаждения при Холодовых формах, вирусных инфекций — при всех вариантах заболевания и др. Пациентам, которым произведена спленэктомия, учитывая развитие иммунодефицита, показано введение пневмококковой вакцины. Эта рекомендация в первую очередь относится к детям и лицам, имеющим дополнительные показания к вакцинации (по эпидемиологической обстановке и др.).
Наследственный сфероцитоз (НС) — цитоскелетная аномалия, обусловленная нарушением структуры спектрина. Результатом таких аномалий является потеря способности эритроцитов к деформации, нарушается работа Ш+/К+ — насоса мембраны, происходит преждевременная (не по мере старения) сферуляция эритроцитов, укорочение продолжительности жизни красных кровяных клеток и разрушение их клетками селезенки. Длительность жизни эритроцитов укорачивается до 12-14 дней.
Обусловлено мутациями в генах, кодирующих мембранные белки цитоске-лета эритроцитов. Наследование аутосомно-доминантное (проявляется анемией легкой и средней степени тяжести) или рецессивное (клинически проявляется в тяжелой форме).
Характеризуется гемолитической анемией, спленомегалией и наличием эритроцитов сферической формы в периферической крови. Болезнь может протекать скрыто.
НС основывается на наличии у пациента характерных морфологических изменений эритроцитов и признаков гемолиза. Показатели насыщения эритроцитов гемоглобином и уровень сывороточного железа обычно в норме, за исключением тех случаев, когда на фоне длительно существующего гемолиза в организме развивается железодефицитное состояние.
В костном мозге отмечается компенсаторное усиление эритропоэза.
Дифференциальный диагноз
проводится с желтухами другой этиологии (инфекционным гепатитом, обструктивной желтухой, синдромом Жильбера и др.), иммунной гемолитической анемией, микроангиопатической гемолитической анемией, спленомегалиями другой этиологии. При дифференциальной диагностике наряду с выявлением морфологически измененных эритроцитов, отрицательной пробой Кумбса и другими лабораторными данными, немаловажное значение может иметь тщательно собранный семейный анамнез и обследование родственников больного для выявления у них признаков НС.
При клинически компенсированном состоянии больного, отсутствии значимого гемолиза и анемии терапия обычно ограничивается симптоматическими средствами, в том числе направленными на профилактику развития желчекаменной болезни (желчегонные, фитотерапия, рациональная диета). При тяжелом гемолизе с выраженной анемией и при апластических кризах с низким уровнем гемоглобина производятся трансфузии эритроцитарной массы.
Одним методом терапии у больных сфероцитарной анемией является спле-нэктомия. Оперативное лечение показано больным с наличием гемолитической анемии средней и тяжелой степени или ее осложнений, в том числе при наличии желчнокаменной болезни, особенно у лиц молодого возраста. В результате удаления селезенки прекращается или значительно уменьшается гемолиз эритроцитов, увеличивается продолжительность их жизни.
Первичная профилактика
при НС, как и при других наследственных заболеваниях, заключается в генетическом консультировании и планировании семьи.
Вторичная профилактика.
Поскольку у значительной части пациентов заболевание протекает в скрытой или клинически компенсированной форме, то основные мероприятия по вторичной профилактике направлены на устранение проявлений хронической интоксикации, компенсацию повышенного расхода необходимых для кроветворения веществ и предупреждение таких осложнений, как раннее развитие желчнокаменной болезни. В связи с этим показано полноценное питание, прием поливитаминов с микроэлементами, желчегонных средств, ежегодный УЗИ-контроль состояния желчевыводящих путей.
Как и при других формах хронических гемолитических анемий у больных НС нередко развивается дефицит фолатов, в связи с чем этой категории больных профилактически назначается фолиевая кислота.
Анемии могут быть обусловлены подавленным (гипотастическим) состоянием кроветворения за счет токсических и радиационных воздействий, развития реактивного фиброза в костном мозге при ряде заболеваний или в результате самостоятельных заболеваний — гипопластической (апластической) анемии, парциальной красноклеточной аплазии.
Апластическая анемия — тяжелое заболевание кроветворной системы, которое характеризуется панцитопенией в периферической крови и гипоклеточ-ным костным мозгом.
Заболевание редкое: от 2-3 до 10-20 случаев на млн населения в год. Наблюдается во всех возрастных группах. Большая частота встречаемости заболевания отмечается на Дальнем Востоке, в Японии, Таиланде.
Причинами развития заболевания могут быть цитотоксические препараты, радиация, лекарственные препараты (золото, хлорамфеникол), промышленные токсины, вирусы (гепатит). Этиологический фактор в половине случаев не выявляется — идиопатические формы. Выделяют врожденную форму — анемию Фанкони — генетически обусловленное заболевание с гиперчувствительностью к ДНК-повреждающим воздействиям и повышенной склонностью к развитию опухолевых заболеваний.
Современная концепция патогенеза АА предполагает связь между развитием аплазии кроветворения и дефектом стволовых клеток с нарушением их проли-феративной активности с участием иммуноопосредованных механизмов, нарушением регуляции гемопоэза иммунокомпетентными лимфоидными клетками.
Выделяют острую и хроническую формы заболевания, а также тяжелую апластическую анемию (тАА) и АА умеренной степени тяжести (нетяжелая апластическая анемия — нАА). ТАА определяется при наличии 2 любых из перечисленных критериев по данным периферической крови:
- Гранулоцитов менее 0,5 х 109/л
- Тромбоцитов менее 20 х 109/л
- Ретикулоцитов менее 1% (с коррекцией по гематокриту) в сочетании с аплазией костного мозга по данным трепанобиоптатов (клеточность костного мозга не более 30% от нормы).
Клинические проявления
заболевания обусловлены анемическим и геморрагическим синдромом.
Диагноз ставится на основании выявления характерных изменений в анализах крови и костном мозге с отсутствием признаков клонального гемопоэза. Осноиой диагностики является гистологическое исследование костного мозга.
Анемия нормохромного характера, количество ретикулоцитов снижено, как проянлспие I шюрегенераторного характера анемии.
И мпелограмме снижено количество ядросодержащих элементов, снижено суммарное процентное содержание клеточных элементов гранулопоэза и эритропоэза, нередко отмечается высокое относительное число лимфоцитов, значительно уменьшено содержание мегакариоцитов. В гистологических препаратах трепанопрепаратов подвздошной кости выявляется аплазия костного мозга с замещением кроветворной ткани жировой.
Содержание железа в сыворотке крови нормально или повышено.
Дифференциальный диагноз
проводится с гипопластическими вариантами гемобластозов (миелодиспластический синдром — МДС, острый лейкоз, су-блейкемический миелоз), вторичными — симптоматическими аплазиями, наблюдающимися при заболеваниях печени, ряде опухолевых заболеваний.
Пациентам с АА проводится иммуносупрессивная терапия, включающая глюкокортикоидные гормоны (ГК), антилимфоцитарный (АЛГ) или антитимоцитарный (АТГ) иммуноглобулин, циклоспорин-А (цА). Методом выбора в терапии тАА у пациентов до 40 лет является трансплантация костного мозга (ТКМ). Такая терапия позволяет получить ремиссии у 70 -80%. Проводится также симптоматическая терапия, направленная на коррекцию анемического и геморрагического синдромов, профилактику и лечение возможных инфекционных и иных осложнений.
Прогноз заболевания в первую очередь зависит от глубины аплазии и тяжести заболевания, а также своевременности и активности проводимой терапии.
Основные причины смерти больных — геморрагические и инфекционные осложнения, прогрессирование аплазии при безуспешной терапии.
Первичные профилактические мероприятия предусматривают прекращение контакта с факторами, обладающими гемодепрессивными свойствами, ограничение использования лекарственных препаратов с миелосупрессивными свойствами. Так, в ряде стран прекращено применение препарата левомецитин (хлорамфеникол), поскольку была показана связь приема данного лекарственного средства с повышением частоты развития аплазии кроветворения. При развитии АА на фоне беременности целесообразно ее прерывание.
Вторичная профилактика.
Пациенты с ремиссией заболевания должны оставаться под наблюдением с регулярным контролем показателей гемограммы, поскольку возможны рецидивы заболевания, как под воздействием неблагоприятных факторов, так и спонтанные.
источник
В.Ю. Сельчук, С.С. Чистяков, Б.О. Толокнов, Л.В. Манзюк, мгмсу М.П. Никулин, Т.В. Юрьева, П.В. Кононец, Г.В. Титова
МГМСУ
Реферат: обсуждаются вопросы современного лечения железодефицитных анемий, включая препарат для внутривенного введения — карбоксимальтозат железа, который быстро восстанавливает дефицит железа, не вызывает реакции гиперчувствительности, характерные для препаратов, содержащих декстран, и обеспечивает медленное высвобождение железа, что снижает риск токсических эффектов.
Ключевые слова: железодефицитная анемия, лечение, карбоксимальтозат железа
Анемия — это клинико-гематологический синдром, характеризующийся уменьшением количества эритроцитов и гемоглобина в крови. Снижение содержания гемоглобина до уровня менее 120 г/л рассматривается как анемия [Aapro, 2008]. Самые разнообразные физиологические и патологические процессы могут служить основой развития анемических состояний, в связи с чем анемии в большинстве случаев рассматриваются как симптом, а не основное заболевание. Анемии наблюдаются при многих терапевтических, хирургических, онкологических и других заболеваниях. Различают железодефицитные, сидероахрестические (с избытком железа), В12— и фолиеводефицитные, гемолитические, анемии при костномозговой недостаточности, постгеморрагические, анемии, связанные с перераспределением железа, комбинированные анемии. Однако 80% всех анемий связано с дефицитом железа. Железо в организме человека участвует в регуляции обмена веществ, в процессах переноса кислорода, в тканевом дыхании и оказывает огромное влияние на состояние иммунологической резистентности.
Почти все железо в организме человека входит в состав различных белков и ферментов. Можно выделить две его основные формы: гемовое (входящее в состав гема — составной части гемоглобина и миоглобина) и негемовое. Железо гема мясных продуктов всасывается без участия соляной кислоты. Однако ахилия может в определенной мере способствовать развитию железодефицитной анемии (ЖДА) при наличии значительных потерь железа и высокой потребности в нем.
Всасывание железа осуществляется преимущественно в двенадцатиперстной кишке и верхних отделах тощей кишки. Степень всасывания железа зависит от потребности организма в нем. При выраженном дефиците железа всасывание его может происходить и в остальных отделах тонкого кишечника. При уменьшении потребности организма в железе происходит снижение скорости поступления его в плазму крови и увеличивается отложение в энтероцитах в виде ферритина, который элиминируется при физиологическом слущивании эпителиальных клеток кишечника. В крови железо циркулирует в комплексе с плазменным трансферрином. Этот белок синтезируется преимущественно в печени. Трансферрин захватывает железо из энтероцитов, а также из депо в печени и селезенке и переносит его к рецепторам на эритрокариоцитах костного мозга. В норме трансферрин насыщен железом приблизительно на 30%. Комплекс трансферрин-железо взаимодействует со специфическими рецепторами на мембране эритрокариоцитов и ретикулоцитов костного мозга, после чего путем эндоцитоза проникает в клетки, и железо переносится в их митохондрии, где включается в протопорфирин и таким образом участвует в образовании гема. Освободившийся от железа трансферрин неоднократно участвует в переносе железа. Количество железа, которое расходуется на эритропоэз, составляет 25 мг/сут., что значительно превышает возможности всасывания железа в кишечнике. В связи с этим для гемопоэза постоянно используется железо, освобождающееся при распаде эритроцитов в селезенке. Хранение (депонирование) железа осуществляется в депо в составе белков ферритина и гемосидерина.
Наиболее распространенная форма депонирования железа в организме — ферритин. Ферритин представляет собой водорастворимый гликопротеиновый комплекс, в центре которого расположено железо, покрытое белковой оболочкой из апоферритина. Каждая молекула ферритина содержит от 1000 до 3000 атомов железа. Ферритин определяется почти во всех органах и тканях, но наибольшее его количество обнаруживается в макрофагах печени, селезенки, костного мозга, эритроцитах, сыворотке крови, слизистой оболочке тонкой кишки. При нормальном балансе железа в организме устанавливается своеобразное равновесие между содержанием ферритина в плазме и депо (прежде всего в печени и селезенке). Уровень ферритина в крови отражает количество депонированного железа. Ферритин создает запасы железа в организме, которые могут быстро мобилизоваться при повышении потребности тканей в железе.
Другая форма депонирования железа — гемосидерин. Это малорастворимое производное ферритина с более высокой концентрацией железа, состоящее из агрегатов кристаллов железа, не имеющих апоферритиновой оболочки. Гемосидерин накапливается в макрофагах костного мозга, селезенки, купферовских клетках печени.
Общепринято выделять две формы железодефицитных состояний: латентный дефицит железа и ЖДА. Латентный дефицит железа характеризуется уменьшением количества железа в его депо и снижением уровня транспортного железа крови при нормальных показателях гемоглобина и эритроцитов. ЖДА — гипохромная микроцитарная анемия, развивающаяся вследствие дефицита железа в сыворотке крови, костном мозге и депо — печени и селезенке. ЖДА возникает как правило, при хронической потере крови и (или) недостаточном поступлении железа в организм.
По данным Всемирной организации здравоохранения (ВОЗ), дефицит железа в организме человека является одним из наиболее распространенных дефицитов питательных веществ в организме человека во всем мире [Benoist B. et al., 2008; WHO, 2001]. Анемия относится к числу глобальных проблем современного здравоохранения. В мире анемией страдают около 1,6 млрд человек, или 24,8% от общего населения. Частота встречаемости анемии оказалась высокой во всех группах и составила 25,4-47,4% у детей дошкольного и школьного возраста, 41,8% — у беременных женщин, 30,2% — у небеременных женщин репродуктивного возраста, 23,9% — у пожилых людей и 12,7% — у мужчин.
Хотя среди взрослого населения анемия чаще всего развивалась у женщин во время беременности, тем не менее в популяции основную долю пациентов с анемией составляли небеременные женщины репродуктивного возраста (468 млн человек). По крайней мере в половине случаев причиной анемии служит дефицит железа [WHO, 2001], который может быть следствием хронической кровопотери (менструации, оккультные кровотечения при опухолях желудочно-кишечного тракта (ЖКТ), неспецифические и специфические воспалительные заболевания тонкой и толстой кишки, другие причины), недостаточного поступления железа с пищей или нарушения его усвояемости (например, при хроническом алкоголизме), повышенной потребности (детский и подростковый возраст, беременность, послеродовый период), нарушения всасывания.
Дефицит железа бывает не только абсолютным, но и функциональным. Последний возникает, когда адекватное или даже повышенное общее содержание железа в организме оказывается недостаточным у больных при увеличении потребности в железе костного мозга на фоне стимуляции эритропоэза. Важную роль в регуляции обмена железа играет гепсидин — гормон, который образуется в печени, взаимодействует с ферропортином (белком, осуществляющим транспорт железа) и подавляет всасывание железа в кишечнике, а также его высвобождение из депо и макрофагов. Повышение уровня гепсидина, отмечающееся при воспалении, считают основной причиной анемии при хронических заболеваниях. Кроме того, уровень гепсидина повышается при хронической болезни почек, что способствует развитию нефрогенной анемии и резистентности к стимуляторам эритропоэза. При усилении эритропоэза под действием эритропоэтина скорость мобилизации железа из депо становится недостаточной для обеспечения возросших потребностей костного мозга. Пролиферирующим эритробластам необходимо все большее количество железа, что приводит к истощению лабильного пула железа и снижению сывороточного уровня ферритина. Для мобилизации и растворения железа из гемосидерина требуется определенное время. В результате количество поступающего в костный мозг железа уменьшается, что вызывает развитие его функционального и абсолютного дефицита.
В соответствии с Международной классификацией болезней 10-го пересмотра (МКБ-10) учитывают следующие формы анемий, связанных с абсолютным и относительным дефицитом железа:
Классификация, клиника и диагностика ЖДА
Общепризнанной классификации ЖДА не существует. Имеются клиническая классификация ЖДА и классификация по стадиям и тяжести протекания анемии.
Клиническая классификация ЖДА:
1. ЖДА постгеморрагические. Эту группу составляют анемии, развивающиеся на почве повторных небольших кровопотерь, — метроррагии, эпистаксис, гематурия и т.д.
2. ЖДА беременных. Причины возникновения анемий данной группы различны: дисбаланс питания беременных и связанное с этим ухудшение утилизации железа, передача организмом матери значительного его количества развивающемуся плоду, потери железа в период лактации и др.
3. ЖДА, связанные с патологией ЖКТ. К ним относятся анемии, возникающие после гастрэктомии, обширных резекций тонкой кишки, при различных энтеропатиях. По своей сути это ЖДА, обусловленные грубым, тяжелым нарушением функции всасывания железа -проксимальном отделе двенадцатиперстной кишки.
4. ЖДА вторичные, возникающие при инфекционных, воспалительных или опухолевых болезнях. Анемии в этих случаях развиваются вследствие больших потерь железа при гибели клеток опухолей, распаде тканей, микро- и даже макрогеморрагиях, повышении потребности в железе в очагах воспаления.
5. Эссенциальная (идиопатическая) ЖДА, при которой самый тщательный анамнестический и лабораторный поиск не выявляет общеизвестные причины возникновения дефицита железа. У большинства больных имеет место особая форма нарушения всасывания железа.
6. Ювенильная ЖДА — анемия, развивающаяся у молодых девушек (и чрезвычайно редко — у юношей). Данная форма железодефицитного малокровия связана с генетическими или фенотипическими дисгормональными явлениями.
7. ЖДА сложного генеза. В эту группу входят анемии алиментарные.
ЖДА также классифицируют по стадиям и тяжести протекания.
I стадия — потеря железа превышает его поступление, постепенное истощение запасов, всасывание в кишечнике компенсаторно увеличивается;
II стадия — истощение запасов железа (уровень сывороточного железа — ниже 50 мкг/л, насыщение трансферрина — ниже 16%) препятствует нормальному эритропоэзу, эритропоэз начинает падать;
III стадия — развитие анемии легкой степени (100-120 г/л гемоглобина, компенсированной), с незначительным снижением цветового показателя и других индексов насыщения эритроцитов гемоглобином;
IVстадия — выраженная (менее 100 г/л гемоглобина, субкомпенсированная) анемия с явным снижением насыщения эритроцитов гемоглобином;
Vстадия — тяжелая анемия (60-80 г/л гемоглобина) с циркуляторными нарушениями и тканевой гипоксией.
Клиническая картина ЖДА
Клиническими проявлениями ЖДА являются два важнейших синдрома — анемический и сидеропенический.
Анемический синдром обусловлен снижением содержания гемоглобина и уменьшением количества эритроцитов, недостаточным обеспечением тканей кислородом и представлен неспецифическими симптомами. Больные жалуются на общую слабость, повышенную утомляемость, снижение работоспособности, головокружение, шум в ушах, мелькание мушек перед глазами, сердцебиения, одышку при физической нагрузке, появление обморочных состояний. Может появляться снижение умственной работоспособности, ухудшение памяти, сонливость. Субъективные проявления анемического синдрома вначале беспокоят больных при физической нагрузке, а затем и в покое (по мере развития анемии).
При объективном исследовании обнаруживается бледность кожи и видимых слизистых оболочек, нередко — некоторая пастозность в области голеней, стоп, лица. Характерны утренние отеки — «мешки» вокруг глаз. Анемия обусловливает развитие синдрома миокардиодистрофии, который проявляется одышкой, тахикардией, часто аритмией, умеренным расширением границ сердца влево, глухостью тонов сердца, негромким систолическим шумом во всех аускультативных точках. При тяжелой и длительной анемии миокардиодистрофия может привести к выраженной недостаточности кровообращения. ЖДА развивается постепенно, поэтому организм больного адаптируется к низкому уровню гемоглобина, и субъективные проявления анемического синдрома не всегда бывают ярко выражены.
Сидеропенический синдром (синдром гипосидероза) обусловлен тканевым дефицитом железа, что приводит к снижению активности многих ферментов (цитохромоксидаза, пероксидаза, сукцинат-дегидрогеназа и др.). Сидеропенический синдром проявляется многочисленными симптомами, такими как:
Лабораторные данные
Диагностика латентного дефицита железа
Латентный дефицит железа диагностируется на основании следующих признаков:
Диагностика ЖДА
При снижении содержания гемоглобинового железа появляются характерные для ЖДА изменения общего анализа крови:
Наиболее часто используемыми в практике критериями ЖДА являются:
— низкий цветовой показатель;
— гипохромия эритроцитов, микроцитоз;
— снижение уровня сывороточного железа;
— повышение ОЖСС;
— снижение содержания ферритина в сыворотке.
При биохимическом исследовании крови, кроме снижения уровня сывороточного железа и ферритина, выявляются также изменения, обусловленные основным онкологическим или другим заболеванием.
Лечение
В настоящее время существует следующие этапы лечения ЖДА:
Не так давно гемотрансфузия являлась одним из самых распространенных способов коррекции анемии даже легкой степени у больных после операционной кровопотери и кровопотери при других клинических ситуациях (роды, маточные кровотечения, геморрой, опухоли ЖКТ и др.). Считалось, что надо остановить кровотечение и перелить донорскую кровь или эритроцитную массу. Необходимое для переливания количество эритроцитов определяли исходя из объема кровопотери и уровня гемоглобина. Однако ориентация на достижение нормального уровня гемоглобина иногда приводила к переливанию значительных количеств (до 5-6 л) донорской крови, что сопровождалось развитием синдрома массивной трансфузии, рецидивом кровотечения, появлением признаков полиорганной недостаточности с высокой смертностью.
В последнее время получила распространение новая трансфузионная тактика — компонентная гемотерапия, в связи с чем переливание эритроцитной массы заняло доминирующее место в лечении не только хронической, но и острой кровопотери. Однако отсутствие детально разработанных и сформулированных показаний к гемотерапии с учетом индивидуальных особенностей пациентов нередко приводит к необоснованным, неоправданным трансфузиям, которых, к сожалению, еще много. В современных условиях оправдана тенденция к ограничению переливания препаратов крови в связи с ростом числа таких осложнений, как перенос инфекций, формирование ложных групповых антител, подавление эндогенного эритропоэза.
Лечебная программа при ЖДА включает:
При выявлении причины развития ЖДА основное лечение должно быть направлено на ее устранение (оперативное лечение опухоли желудка, кишечника, лечение энтерита, коррекция алиментарной недостаточности и др.). В целом ряде случаев радикальное устранение причины ЖДА не представляется возможным, например, при продолжающихся меноррагиях, наследственных геморрагических диатезах, проявляющихся носовыми кровотечениями, у беременных и в некоторых других ситуациях. В таких случаях основное значение приобретает патогенетическая терапия железосодержащими лекарственными препаратами.
Путь введения препарата больному ЖДА определяется конкретной клинической ситуацией. При проведении купирующей терапии применяются пероральное и парентеральное введение препаратов железа (ПЖ) больному.
Первый путь — пероральный — является наиболее распространенным, хотя и дающим более отсроченные результаты.
Основными принципами лечения ПЖ для приема внутрь являются следующие:
— назначение ПЖ с достаточным содержанием трехвалентного железа;
— нецелесообразность одновременного назначения витаминов группы В (в том числе В12), фолиевой кислоты без специальных показаний;
— избегание назначения ПЖ внутрь при наличии признаков нарушения всасывания в кишечнике;
— достаточная продолжительность насыщающего курса терапии (не менее 3-5 мес.);
— необходимость проведения поддерживающей терапии ПЖ после нормализации показателей гемоглобина в соответствующих ситуациях.
Для адекватного прироста показателей гемоглобина у больных необходимо назначать от 100 до 300 мг трехвалентного железа в сутки. Применение более высоких доз не имеет смысла, поскольку всасывание железа при этом не увеличивается. Индивидуальные колебания в количестве необходимого железа обусловлены степенью его дефицита в организме, истощения запасов, скоростью эритропоэза, всасываемостью, переносимостью и некоторыми другими факторами. С учетом этого при выборе лекарственного ПЖ следует ориентироваться не только на содержание в нем общего количества, но и, главным образом, на количество трехвалентного железа, которое только и всасывается в кишечнике.
Причины неэффективности терапии ПЖ для приема внутрь:
— отсутствие дефицита железа (неправильная трактовка природы гипохромной анемии и ошибочное назначение ПЖ);
— недостаточная дозировка ПЖ (недоучет количества трехвалентного железа в препарате);
— недостаточная длительность лечения ПЖ;
— нарушение всасывания ПЖ, назначаемых внутрь больным с соответствующей патологией;
— одновременный прием препаратов, нарушающих всасывание железа;
— наличие хронических (оккультных) кровопотерь, чаще всего из органов ЖКТ;
— сочетание ЖДА с другими анемическими синдромами (В12-дефицитной, фолиеводефицитной).
Второй путь введения ПЖ — парентеральное введение, которое может быть внутримышечным и внутривенным. Показаниями для применения ПЖ парентерально могут быть следующие клинические ситуации:
— нарушение всасывания при патологии кишечника (энтериты, синдром недостаточности всасывания, резекция тонкого кишечника, резекция желудка по методу Бильрот II с выключением двенадцатиперстной кишки);
— обострение язвенной болезни желудка или двенадцатиперстной кишки;
— непереносимость ПЖ для приема внутрь, не позволяющая дальнейшее продолжение лечения;
— необходимость более быстрого насыщения организма железом, например, у больных ЖДА, которым предстоят оперативные вмешательства (миома матки, геморрой и др.).
В отличие от ПЖ для приема внутрь в инъекционных препаратах железо всегда находится в трехвалентной форме. Лечение больных с ЖДА имеет свои особенности в зависимости от конкретной клинической ситуации с учетом многих факторов, в том числе характера основного заболевания и сопутствующей патологии, возраста больных (дети, пожилые люди), выраженности анемического синдрома, дефицита железа, переносимости ПЖ и др. Общая ориентировочная доза ПЖ для внутримышечного введения, необходимая для коррекции дефицита железа и анемии, может быть рассчитана по формуле:
А = KxF (100 — 6 Х Hb) F = 0,0066,
где А — число ампул, К — масса больного в кг, НЬ — содержание гемоглобина в г %.
При парентеральном введении ПЖ возможны развитие флебитов, инфильтратов, потемнение кожи в местах инъекций, аллергических реакций, в том числе тяжелых (анафилактический шок). Внутримышечные инъекции болезненны, в некоторых случаях они ассоциировались с развитием саркомы ягодичной мышцы [Grasso P, 1973; Greenberg G., 1976]. По мнению некоторых авторов [Auerbach M. et al., 2007], от внутримышечного введения ПЖ следует отказаться.
В последнее время особенно большой интерес вызывают ПЖ для внутривенного введения с целью терапии постгеморрагических анемий. В нескольких работах показано, что внутривенное введение ПЖ более эффективно при сравнении с приемом железа внутрь при тех же показаниях. Помимо этого, внутривенная терапия позволяет избежать возникновения как побочных эффектов со стороны ЖКТ, наблюдающихся при приеме ПЖ внутрь, так и некоторых осложнений, вызываемых при внутримышечном введении ПЖ, однако требует определенного уровня реанимационной службы учреждения, в котором вводятся препараты.
ПЖ для внутривенного введения
Для внутривенного введения в России применяют карбоксимальтозат железа (Феринжект®), сахарат железа (Венофер), глюконат железа и декстран железа, которые представляют собой сферические железоуглеводные коллоиды. Углеводная оболочка придает комплексу стабильность, замедляет высвобождение железа и поддерживает образующиеся формы в коллоидной суспензии.
Внутривенное введение декстрана железа вызывает большое число анафилактических реакций, сопровождающихся летальностью в 13,5% случаев [Faich G. еt Strobos J., 1999], и в настоящее время применяется ограниченно. Применение натриевого комплекса глюконата железа в сукрозе вызывает значительно меньше осложнений и, как правило, не сопровождается смертельными исходами. Однако токсические эффекты, связанные с поступлением свободного железа в организм, существенно ограничивают применение препарата в ежедневной практике терапии ЖДА.
Сахарат железа (III) (Венофер®) является популярным препаратом для лечения синдрома ЖДА. Это связано с безопасностью и высокой переносимостью комплекса трехвалентного железа с сахаратом в отличие от декстрана железа и глюконата железа. Данный препарат одобрен для применения, в том числе и в период беременности. Венофер следует вводить только в учреждениях, располагающих оборудованием для сердечно-легочной реанимации, так как часто могут отмечаться сердечно-сосудистые осложнения в виде гипотонии. Максимальная разовая парентеральная доза сахарата железа (III) составляет 500 мг, предпочтительно развести препарат в 100 мл 0,9% раствора NaCl для введения в форме инфузии. Продолжительность инфузии составляет приблизительно 4,5 ч с использованием внутривенного доступа (следует помнить, что высокая скорость инфузии связана с риском развития гипотензивной реакции). В зависимости от исходных значений уровня гемоглобина внутривенное введение повторяют 1-3 раза/нед. до повышения уровня гемоглобина >105 г/л. Затем пациента можно перевести на прием пероральных ПЖ для поддерживающей терапии. Оснований ожидать возможной передозировки железом не имеется.
Комплекс железа с карбоксимальтозой (Феринжект®) — новый недекстрановый комплекс железа, преимуществом которого является возможность введения высоких доз (до 1000 мг за 1 введение) в короткий промежуток времени (на 1 инфузию требуется 15 мин.). Благодаря этому отсутствует необходимость в дорогостоящих повторных инфузиях небольших доз железа, при этом Феринжект® характеризуется хорошей переносимостью. Феринжект® также одобрен для применения, в том числе и в период беременности. На сегодняшний день (как и в случае сахарата железа) не проводилось масштабных рандомизированных исследований для оценки безопасности применения данного препарата для плода. По этой причине перед назначением любых ПЖ внутривенно необходимо тщательно оценить соотношение пользы и рисков.
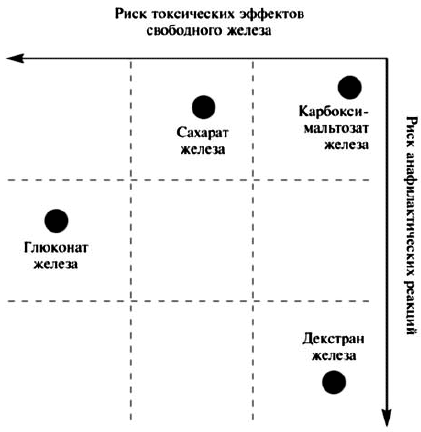
Эффективность и безопасность внутривенного введения ПЖ зависят от их молекулярной массы, стабильности и состава. Комплексы с низкой молекулярной массой, такие как глюконат железа, менее стабильны и быстрее высвобождают в плазму железо, которое в свободном виде может катализировать образование реактивных форм кислорода, вызывающих перекисное окисление липидов и повреждение тканей. Значительная часть дозы подобных препаратов выводится через почки в первые 4 ч после приема и не используется для эритропоэза. Хотя декстран железа обладает высокими молекулярной массой и стабильностью, его недостатком является повышенный риск развития аллергических реакций. Карбоксимальтозат железа сочетает в себе положительные свойства высокомолекулярных комплексов железа, но не вызывает реакции гиперчувствительности, наблюдающиеся при применении препаратов, содержащих декстран, и, в отличие от сахарата и глюконата железа, может вводиться в более высокой дозе [Geisser P., 2009]. Схема оценки риска токсических эффектов и анафилактических реакций препаратов свободного железа для внутривенного введения представлена на рисунке 1 [С.В. Моисеев, 2012].
Рис. 1. Риск токсических эффектов и анафилактических реакций при применении внутривенных препаратов железа
Из рисунка 1 видно, что глюконат железа может вызывать анафилактические реакции и одновременно обладает выраженным токсическим эффектом. Декстран железа, не являясь препаратом с выраженными токсическими эффектами, способен вызывать анафилаксию. Сахарат железа не приводит к развитию анафилактических реакций у больных с ЖДА, но обладает токсическими свойствами. Карбоксимальтозат железа — Феринжект® характеризуется сниженным риском возникновения как токсических эффектов свободного железа, так и анафилактических реакций.
Применение карбоксимальтозата железа позволяет вводить за 1 инфузию до 1000 мг железа (внутривенно капельно в течение 15 мин.), в то время как максимальная доза железа в виде сахарата составляет 500 мг и вводится в течение 4,5 ч, а длительность инфузии декстрана железа достигает 6 ч. Причем в двух последних случаях перед началом инфузии необходимо ввести тестовую дозу препарата. Введение большой дозы железа позволяет сократить необходимое число инфузий и затраты на лечение. Карбоксимальтозат железа отличается не только удобством применения, но и низкой токсичностью, а также отсутствием оксидативного стресса, которые определяются медленным и физиологичным высвобождением железа из стабильного комплекса с углеводом, по структуре сходного с ферритином.
Также, Феринжект® вводят внутривенно в виде болюса (максимальная доза — 4 мл, или 200 мг железа, не более 3 раз/нед.) или капельно (максимальная доза -20 мл, или 1000 мг железа, не чаще 1 раза/нед.). Перед началом лечения необходимо рассчитать оптимальную кумулятивную дозу препарата, которую не следует превышать. Кумулятивную дозу, необходимую для восстановления уровня гемоглобина в крови и восполнения запасов железа в организме, вычисляют по формуле Ганзони:
Кумулятивный дефицит железа (мг) = масса тела (кг) х (целевой НЬ — фактический НЬ) (г/дл) х 2,4 + содержание депонированного железа (мг), где целевой уровень гемоглобина (НЬ) у человека с массой тела или = 35 кг 15 г/дл (9,3 ммоль/л), соответственно, депо железа у человека с массой тела >35 кг и = 35 кг = 500 мг и ЛИТЕРАТУРА
1. Worldwide prevalence of anaemia 1993-2005. WHO global database of anaemia. Edited by de Benoist В. et al. World Health Organisation. 2008.
2. Iron deficiency anaemia: assessment, prevention, and control. A guide for programme managers. Geneva, WHO, 2001 (WH0/NHD/01.3).
3. Grasso P. Sarcoma after intramuscular iron injection // Br. Med. J. 1973. Vol. 2. Р. 667.
4. Greenberg G. Sarcoma after intramuscular iron injection // Br. Med. J. 1976. Vol. 1. Р. 1550-1550.
5. Auerbach M, Ballard H., Glaspy J. et al. Clinical update: intravenous iron for anaemia // Lancet. 2007. Vol. 369. Р. 1502-1504.
6. Geisser P. The pharmacology and safety profile of ferric carboxymaltose (Ferinjecf): structure/reactivity relationships of iron preparations // Port.. J. Nephrol. Hypert. 2009. Vol. 23 (1). Р. 11-16.
7. Моисеев С.В. Железа карбоксимальтозат (Феринжект) — новый внутривенный препарат для лечения железодефицитной анемии // Клиническая фармакология и терапия. 2012. № 21 (2). С. 2-7.
8. Faich G., Strobos J. //Am. J. Kidney Dis. 1999. Vol. 33. No. 3. P. 464-470.
9. Beshara S., Sorensen J., Lubberink M. et al. Pharmacokinetics and red cell utilization of 52Fe/59Fe-labelled iron polymaltose in anaemic patients using positron emission tomography// Br. J. Haematol. 2003. Vol. 120. Р. 853-859.
источник