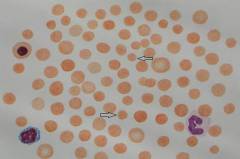
При вливании крови, несовместимой по группе или резус-фактору, клинические проявления развиваются либо сразу после введения небольших количеств несовместимой крови, либо в ближайшее время после окончания процедуры. В клинической картине можно выделить 4 периода:
период олиго- или анурии, т. е. острая почечная недостаточность (ОПН);
период восстановления диуреза;
Гемотрансфузионный шок характеризуется появлением болей в пояснице, падением артериального давления, тахикардией, нарушением дыхания. При отсутствии адекватного лечения заканчивается гибелью пострадавшего. При аутопсии выявляется скопление гемолизирован-ных эритроцитов и свободного гемоглобина в просветах сосудов печени, легких, сердца и почечных канальцах в виде аморфных и зернистых масс.
Второй период проявляется резким уменьшением или полным отсутствием выделяемой мочи, нарастанием азотемии, резким ухудшением общего состояния.
Неотложные мероприятия и последующее лечение должны начинаться как можно раньше. На первых этапах это массивное заменное переливание одногрупповой совместимой крови и противошоковые мероприятия с присоединением в дальнейшем гемодиализа.
К гемолитическим ядам относятся мышьяковистый водород, сапонины, свинец, фенилгидразин, змеиный и пчелиный яды, амилнитрит и т. д. Механизмы гемолиза различны. При отравлении финилгидразином, мышьяковистым водородом, змеиным ядом происходит в основном внутрисосудистый гемолиз, в то время как при отравлении солями свинца — преимущественно внутриклеточный гемолиз. Клиническая картина отравления обусловлена характером гемолитического яда. Общим для всех отравлений данного вида является поражение почек: развитие олигурии, анурии, азотемии, т.е. картины острой почечной недостаточности. Степень ее тяжести определяется количеством принятого яда.
Первая помощь при отравлении гемолитическими ядами зависит от характера отравления. При укусе змеи — это введение специфических противозмеиных сывороток, при отравлении гидразинами — введение пиридоксина, при отравлении мышьяком — специфического антидота.
Мероприятия по облегчению ОПН аналогичны тем, что перечислены при вливании крови, несовместимой по группе или резус-фактору.
Определение гемолитических и апластической анемий.
Этиология и патогенез гемолитических и апластической анемий.
Понятие о внутрисосудистом и внесосудистом гемолизе. Причины, основные механизмы их формирования.
Классификация гемолитических и апластической анемий.
Диагностические критерии (анамнестические, клинические, лабораторные) врожденных и приобретенных гемолитических и апластической анемий.
Диагностические критерии наследственного микросфероцитоза, аутоиммунных гемолитических анемий, пароксизмальной ночной гемоглобуинурии.
Дифференциальная диагностика гемолитических анемий с железодефицитной, В12-
дефицитной, апластической анемиями по клиническим и лабораторно-инструментальным критериям. Принципы дифференциального диагноза по ведущему синдрому (анемии с учетом цветового показателя, желтухи).
Принципы лечения гемолитических и апластической анемий. Показания для спленэктомии.
Уметь выделить гемолитический, геморрагический, общеанемический, инфекционно – септических осложнений синдром, диагностические критерии гемолитических и апластической анемий.
Уметь провести дифференциальный диагноз с другими видами анемий.
Уметь составить план обследования пациента с подозрением на гемолитические и апластическую анемию.
Уметь оценить результаты лабораторных (общий анализ крови, мазок крови, анализ мочи на уробилин и билирубин, биохимические показатели крови), миелограммы, трепанобиопсии и инструментальных методов исследования (УЗИ брюшной полости).
Составить план лечения при гемолитических и апластической анемий. Уметь выписать рецепты: преднизолон, гепарин, варфарин, сорбифер-дурулес, феррум-лек.
Обучение проводится на базе терапевтических отделений ГКБ №8. Главными методами обучения являются самостоятельная работа студента у постели больного под руководством преподавателя, детальный клинический разбор больных с последующей оценкой результатов параклинических методов исследований: лабораторно-биохимического, рентгенологического, ультразвукового, эндоскопического, морфологического, радиоизотопного и иммунологического (защита истории болезни проводится каждым обучающимся студентом). Студенты активно участвуют в проводимых в клинике клинических и патологоанатомических конференциях, консилиумах, курируют больных в составе «врачебных бригад» и оформляют академическую историю болезни (общепринятая схема истории болезни прилагается).
Вопросы по теме для самостоятельного изучения студентами
ВОПРОСЫ ПО ТЕМЕ, ВЫНОСИМЫЕ НА ЭКЗАМЕНЫ
ПРАКТИЧЕСКИЕ НАВЫКИ, КОТОРЫМИ ДОЛЖЕН ОВЛАДЕТЬ СТУДЕНТ ПО ТЕМЕ ЗАНЯТИЯ
источник
Поскольку аутоиммунная гемолитическая анемия делится на генуинную и вторичную формы по возможности лечение должно учитывать соответствующие особенности, и тем самым взаимодействовать с механизмами образования антител.
При вторичных формах за счет лимфопролиферации следует лечить последнюю в целях пресечения и дальнейшего угнетения разрастания массы злокачественных клеток, сецернирующих аутоантитела. Правильно проводимая терапия ХЛЛ, ЛС, PC защищает больного от тяжелых приступов расплавления крови, естественно поскольку имеются длительные межпрнступные периоды.
При аутоиммунной гемолитической анемии, за счет иммунного дефицита или гиперреактивного состояния с дисгаммаглобулинемией, лечить эти явления для устранения условий аутоиммунного гемолиза или даже его предупреждения. Хирургическое вмешательство, облучение или даже лечение цитостатическими средствами — когда это возможно при отдельных видах рака — устраняют причину развития аутоиммунной гемолитической анемии.
Однако наиболее часто периоды расплавления крови при вторичных формах заболевания — за исключением заболеваний за счет отсутствия антител — требуют лечение патогенетического характера в целях приостановления процесса.
При генуинной аутоиммунной гемолитической анемии с холодовыми или тепловыми антителами, когда не выявляется определенная этиологическая причина, в основном на острых периодах или формах хронического течения методы патогенетической терапии представляются единственно возможными. В подобных случаях заболевания удовлетворительные результаты дает кортизонотерапия, при этом среднесуточная доза преднизона равняется 40—50 мг.
При весьма тяжелых формах со сверхострым расплавлением крови, понижением показателя гемоглобина до 3—4 г, продолжительности жизни гематий от 5 до 10 дней назначать большую дозу от 80 до 100 мг в сутки, из расчета примерно 1—1,5 мг на кг веса тела. В большинстве наблюдаемых нами случаях (Берчану и сотр.) при генуинных формах гемолитический процесс был приостановлен на 2—4 неделях лечения.
Течение вторичной формы аутоиммунной гемолитической анемии (ДКВ или лимфопролиферация) зависит от реакции первичного заболевания на проводимую терапию. Даже если назначение кортикоидов обусловливает обратное течение гемолитического процесса, в случае неподдающейся лечению злокачественной лимфопролиферации или сложности ее терапии — например в устарелых формах РКВ — расплавление крови возобновляется непосредственно после уменьшения дозы кортизона.
По Leddy кортизонотерапия дает положительный результат примерно в 2/3 случаев с первичными заболеваниями, а в 1/3 — лишь относительный результат, причем из них 5—10% составляют безответные случаи. В группе случаев, не реагирующих на лечение или дающих посредственный результат с повторными рецидивами после непрерывной 5—6-месячной кортикотерапии, показана спленэктомия. Этот хирургический метод лечения дает хорошие результаты у больных, у которых наблюдается преимущественно селезеночная секвестрация.
Тем не менее удаление селезенки следует применять и больным с преимущественно печеночной секвестрацией, поскольку этим приемом устраняются важная иммунологическая система выделения аутоантител и значительная масса макрофаговой ткани гемолитичской активности. Спленэктомия также показана при тяжелом гемолитическом заболевании за счет гиперспленизма в результате злокачественной лимфомы и даже при РКВ или хроническом агрессивном гепатите, конечно когда это допускает общее состояние больного. Во всех отмеченных случаях силен-эктомия рассматривается как биологический иммуносупрессорный метод, устраняющий значительную массу лимфоретикулярных клеток с иммуной патологической реакцией.
Известно, что, в отдельных случаях, наличие антител отмечается и после удаления селезенки, даже если процесс расплавления крови не возобновляется.
Итак, положительный результат объясняется, в основном, устранением пожирающей эритроциты макрофаговой ткани. В нашем опыте, охватившем 100 случаев спленэктомии у страдающих гемолитической анемией (Теодореску и Берчану) в 25% случаев гемоцитопений по различным причинам наблюдались положительные результаты.
При гемолитической анемии с холодовыми антителами, развивающейся после вирусной инфекции, нередко специфическая терапия оказывается лишней, поскольку гемолитический эпизод исчезает по истечении периода выздоровления, когда сокращается число аутоантител. При генуинных или первичных, равно как и вторичных послевирусных формах, которые самоподдерживаются, также в заболеваниях за счет злокачественной лимфомы показана кортикотерапия крупными дозами, в связи с тем, что в этих случаях реакция слабее, чем при формах болезни с холодовыми антителами.
По истечении 5—6-месячного периода лечения испробовать спленэктомию, хотя положительный результат редкое явление. После непродолжительного улучшения гемолитической анемии процесс расплавления крови возобновляется, болезнь продолжает свое течение и антитела остаются неизменными.
В большинстве случаев гемолитической анемии с холодовыми антителами, не поддающейся кортикотерапии и спленэктомии назначать, в принципе, краткосрочную умеренную иммуносупрессорную терапию. Так, иммуран 100 мг в сутки, эндоксан 50—100 мг и лейкеран 4—6 мг за 1—3 месяца сокращают коэффициент антител и интенсивность расплавления крови, вообще устраняя острые приступы. Болезнь приобретает хроническое течение, чередуются периоды хорошого состояния и умеренного гемолиза, что напоминает хроническую гемолитическую желтуху с компенсированной или умеренной анемией.
Иные виды терапии симптоматического или патогенетического характера в аутоиммунной гемолитической болезни не оправдываются положительными результатами. В хронических, устойчивых к лечению формах, которые в основном развиваются за счет холодовых антител, следует избегать способствующие усугублению гемолиза условия, в том числе, инфекции, большую физическую нагрузку и стресс от волнения. В частности избегать воздействие холода, холодные ваны и даже контакт с определенными холодными предметами.
При аутоиммунной гемолитической анемии с богатым эритробластами регенеративным костным мозгом переливание крови в принципе не представляется необходимым. Когда в костном мозге, особенно на остром периоде, отмечаются заниженный ретикулоцитоз и мегалобластические отклонения назначать фолиевую кислоту и витамин В12, способствующих восстановлению процесса регенерации костного мозга.
В очень тяжелых случаях, с острым гемолизом, падением гемоглобина до 3—4 г., когда тканевая аноксия ставит под угрозу жизнь больного помимо кортизонотерапии крупными дозами, включительно внутривенным введением гемисукцината гидрокортизона, также назначать переливание массы промытых гематий, которые, вообще, хорошо переносимы. В периоды приступов эритробластопении проводить повторные переливания промытыми эритроцитами, одновременно с кортикотерапией до восстановления нормального кроветворения, роста показателей гемоглобина, гематокрита и ретикулоцитов.
Противопоказано переливание цельной крови, поскольку подвоз ею комплемента и собственно жидкая плазматическобелковая среда усугубляют явления агглютинации и внутрисосудистого расплавления крови.
Более сложные условия лечения при аутоиммунных антителах с характеристикой паиагглютинина и пангемолизина, отмечены нами, в основном, при острой анемии лекарственных средств, острой недифференцированной лейкемии и волчанке.
На остром периоде болезни больной не переносит ни одной из групп красных кровяных телец, в связи с чем, в первую очередь, помимо кортикоретапии крупными дозами, проводить характерную для злокачественного разрастания цитостатическую терапию — особенно непродолжительными комбинациями синхронизирующего эффекта, в целях быстрого сокращения массы злокачественных клеток. В принципе это обусловливает ослабление процесса аутогемолиза, сокращение коэффициента паиагглютинина и делает возможным переливание промытыми гематиями после их тщательного отбора от доноров, посредством прямого испытания.
Впрочем, проведение любого переливания страдающим острым аутоиммуным расплавлением крови требует особой осторожности и наблюдения непосредственного результата гемолиза, наступающего с началом переливания.
Значительная концентрация гемолитических антител у больного может обусловить развитие резкого расплавления переливаемых гематий в условиях оптимального испытания в пробирке. Появление клинических признаков даже незначительного гемолиза требует немедленной проверки выделяемого в кровообращение гемоглобина и прекращения переливания при любом незначительном росте.
источник
Гемолитические анемии включены в одну группу по единственному общему для всех представителей признаку – укорочение жизни красных клеток крови – эритроцитов. Эритроциты, разрушаясь преждевременно, теряют гемоглобин, который тоже распадается, что приводит к гемолизу («лаковая» кровь) – главному патологическому процессу, лежащему в основе развития гемолитических анемий. В остальном многие заболевания данной группы друг на друга не очень-то и похожи, они имеют разное происхождение, для каждой из них характерны свои особенности развития, течения, клинических проявлений.
При гемолитической анемии эритроциты живут 30 – 50 дней, а в некоторых, особо тяжелых случаях, успевают прожить вообще не больше двух недель, в то время как нормальная продолжительность жизни красных кровяных телец должна составлять 80 – 120 дней.
Очевидно, что досрочная массовая гибель клеток – процесс патологический, который называется гемолизом и осуществляется:
- Внутриклеточно (внесосудистый, экстраваскулярный гемолиз) – в селезенке, печени, красном костном мозге (подобно физиологическому);
- На месте преждевременной смерти (внеклеточно) – в кровеносных сосудах (интраваскулярный гемолиз).
Такое укороченное пребывание в кровеносном русле, обусловленное массовой досрочной гибелью эритроцитов, не может протекать бессимтомно и для организма безболезненно, однако внутриклеточный гемолиз и внеклеточный вариант имеют свои характерные симптомы, которые можно заметить и визуально, и определить с помощью лабораторных тестов.
Незапланированный организмом гемолиз, осуществляемый под воздействием мононуклеарных фагоцитов (макрофагов) внутриклеточно, происходит преимущественно в селезенке – симптомы его может заметить сам больной, разглядывая цвет кожи, мочи и кала, и подтвердят анализы клинической лабораторной диагностики:
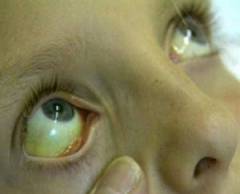
- Кожа и слизистые приобретают желтоватую или желтую (разная степень выраженности) окраску, в анализе крови – повышение билирубина за счет свободной его фракции;
- Перевод излишнего свободного билирубина в прямой требует активного участия гепатоцитов (клеток печени), которые стараются обезвредить токсический билирубин. Это приводит к интенсивному окрашиванию желчи за счет увеличения в ней концентрации желчных пигментов, что способствует образованию камней в пузыре и протоках;
- Насыщенная желчными пигментами желчь, поступая в кишечник, вызывает повышение количества стеркобилина и уробилиногена, чем объясняется интенсивное окрашивание кала;
- Экстраваскулярный гемолиз заметен и в моче, в которой повышается уробилин, придающий ей темный цвет;
- В ОАК (общий анализ крови) обнаруживается уменьшение содержания красных кровяных телец, но, поскольку костный мозг старается компенсировать потери, увеличивается количество молодых форм – ретикулоцитов.
Несанкционированный происходящий в кровеносных сосудах гемолиз тоже имеет свои симптомы и лабораторные признаки разрушения эритроцитов:
- Уровень свободно циркулирующего в крови гемоглобина повышается (оболочки клеток разрушились, Hb освободился и ушел «лакировать» кровь);
- Свободный гемоглобин (в неизменном виде или превращаясь в гемосидерин), покидая кровеносное русло и выходя из организма с мочой, попутно окрашивает ее в различные цвета: красный, бурый, черный;
- Некоторое количество железосодержащего пигмента, образованного при распаде гемоглобина, все же остается в организме, откладываясь в паренхиматозных органах и костном мозге (гемосидероз).
До недавнего времени гемолитическую анемию так и классифицировали, исходя из принципа внутрисосудистого или тканевого разрушения красных клеток крови. Сейчас существует несколько иной подход, где заболевание разделяется на 2 группы.
Современная наука не предусматривает деление гемолитической анемии в зависимости от места разрушения эритроцитов. В большей степени уделяя внимание этиологии и патогенезу заболевания и, исходя из этих принципов, болезнь делят на 2 основных класса:
многообразие гемолитических и анемических состояний
- Наследственные гемолитические анемии – классифицируются по принципу локализации генетического дефекта красных кровяных телец, из-за которого эритроциты становятся неполноценными, функционально неустойчивыми и не способными жить положенное для них время. В числе наследственных ГА значатся: мембранопатии (микросфероцитоз, овалоцитоз) дефекты ферментов (дефицит Г-6-ФДС), гемоглобинопатии (серповидно-клеточная анемия, талассемия);
- Приобретенные формы ГА, которые классифицируют по фактору, разрушающему эритроциты и вызывающему эту анемию (антитела, гемолитические яды, механическое повреждение).
Самой распространенной формой среди приобретенных ГА является аутоиммунная гемолитическая анемия (АИГА). Она будет рассмотрена более подробно далее, после наследственных анемий.
Следует отметить, что львиная доля в числе всех ГА попадает на приобретенные формы, но и среди них существует ряд вариантов, которые, в свою очередь, тоже имеют разновидности, обусловленные отдельными причинами возникновения:
- Развитие болезни обусловлено влиянием антиэритроцитарных антител, выработанных на собственные антигенные структуры эритроцитов (аутоиммунные – аутоиммунная гемолитическая анемия) или изоантител, попавших в кровь извне (изоиммунная – гемолитическая болезнь новорожденных);
- ГА развивается по причине соматических мутаций, изменяющих мембранную структуру красных кровяных телец (пароксизмальная холодовая ночная гемоглобинурия);
- К повреждению мембраны красных клеток крови может привести механическое воздействие искусственных сердечных клапанов или травмирование эритроцитов в капиллярных сосудах стоп при ходьбе и беге (маршевая гемоглобинурия);
- Негативное влияние на мембранные структуры нередко оказывают различные химические вещества, чужеродные для человеческого организма (органические кислоты, гемолитические яды, соли тяжелых металлов и др.);
- Развитие гемолитической анемии может запустить дефицит витамина Е;
- Такой паразит, как малярийный плазмодий, проникающий в кровь человека при укусе комара (самки) рода Anopheles (малярийный комар), опасен в плане возникновения гемолитической анемии, как симптома «болотной лихорадки».
Обусловленное наличием врожденного дефекта транспортной РНК или гена-регулятора, изменение скорости продукции одного из видов (α, β, γ) цепей глобина, определяет развитие гемоглобинопатии, называемой талассемией. Наиболее часто встречается нарушение синтеза β-цепей, что и объясняет более широкое распространение такой формы талассемии, как β-талассемия, которая проявляется снижением уровня нормального гемоглобина (HbA) и увеличением значений аномального варианта (HbF и HbA2).
Красные клетки крови, несущие в себе неправильный гемоглобин, очень «нежные», неустойчивые, склонные к разрушению и распаду с гемолизом из-за повышенной проницаемости оболочки. Попытка пройти через узкий просвет капиллярных сосудов для них нередко заканчивается неудачей, а в результате – появление симптомов талассемии, течение которой может идти по одному из двух вариантов:
- Гомозиготная форма, известная как болезнь Кули или большая талассемия, встречающаяся у детей;
- Гетерозиготная форма или малая талассемия – этот вариант чаще наблюдается у людей, вышедших из детского возраста, да и то, если случайно обнаружится при исследовании крови.
Ввиду того, что талассемия представляет собой генетически обусловленное состояние, для которого характерно нарушение синтеза нормального взрослого гемоглобина, не стоит особо останавливаться на малой талассемии. За счет своей гетерозиготности, а талассемия наследуется по рецессивному типу, она может вообще не проявляться или случайно обнаружиться уже у взрослого человека при исследовании ретикулоцитов и осмотической стойкости эритроцитов (что не входит в обязательные показатели ОАК). А вот гомозиготная форма протекает тяжело, обнаруживается у детей первого года жизни, прогнозом не обнадеживает, зато богата осложнениями.
- Бледность кожных покровов, желтушность, которая может менять интенсивность;
- Общая слабость, вялость, быстрая утомляемость;
- Спленомегалия (увеличение селезенки), за счет чего живот ребенка может достигать значительных размеров, возможно, увеличение печени;
- В ОАК низкий уровень гемоглобина при нормальном содержании эритроцитов (гипохромный тип анемии);
- Задержка психического и физического развития не относится к обязательным признакам болезни Кули, но все же эти дети позже начинают держать головку, ползать, ходить, плохо едят.
Нередко при подобных симптомах врачи начинают предполагать гепатит неясной этиологии, не забывая, однако, о гемолитической анемии данного типа. Развеять сомнения в отношении ГА помогает тщательно собранный анамнез (наличие подобных симптомов в семье) и лабораторные анализы (в крови – увеличение свободного билирубина, малых фракция HbF и HbA2, ретикулоцитоз, в ОАМ – уробилин).
Лечение гемолитической анемии, обусловленной гемоглобиновой аномалией:
- Гемотрансфузии (эритроцитарная масса) в случае резкого падения Hb;
- Курсы десфералотерапии (с целью предупреждения гемосидероза);
- Фолиевая кислота;
- Удаление селезенки при значительном ее увеличении;
- Пересадка костного мозга.
Внимание! Ферротерапия при талассемии противопоказана!
Микросфероцитарная мембранопатия (наследственный микросфероцитоз или болезнь Минковского –Шоффара) – аутосомно-доминантная патология (хотя встречаются и спонтанные мутации), для которой характерна врожденная аномалия оболочек и сферическая форма красных кровяных телец. Эритроциты в норме представляют собой двояковогнутые диски, что позволяет им свободно проходить самые узкие участки кровеносного русла. Сфероциты такой возможности не имеют, но при этом, как и положено эритроцитам, они пытаются «протиснуться» в узкую щель, отчего лишаются части мембраны (целостность нарушается – происходит гемолиз). Кроме этого, оболочка пропускает внутрь клетки ионы натрия в большем, чем нужно количестве, что приводит к дополнительным энергозатратам, которые тоже сокращают жизнь клеток.
Заболевания может проявить себя в любом возрасте, однако тяжелее протекают у новорожденных и менее выражено у детей старшего возраста (чем раньше обнаруживается, тем тяжелее течение).
Гемолитический синдром относят к главным симптомам болезни, который возникает на пустом месте или провоцируется неблагоприятными факторами (нагрузки, травмы, влияние холода). Заболевание имеет волнообразное течение, где отмечается постоянное чередование гемолитического криза с временным затишьем. Нередко болезнь сопровождают другие врожденные аномалии («заячья губа», сердечные пороки, башенный череп, патология внутренних органов).
Кроме этого, у врожденной микросфероцитарной мембранопатии есть и другие симптомы:
- Желтуха, интенсивность которой зависит от течения болезни состояния пациента в тот или иной период (при гемолитическом кризе выраженность желтухи очень отчетлива);
- Слабость (преходящая или постоянная);
- Лихорадка (во время обострения);
- Мышечные боли и болевые ощущения в правом подреберье (печень) и в месте расположения селезенки;
- Учащенное сердцебиение, снижение артериальное давления, у части больных шумы в сердце;
- Увеличение селезенки (с течением времени);
- Моча имеет цвет темного пива, кал тоже темнеет.
Нередко болезнь начинает проявлять себя желтухой, отчего пациенты с подозрением на гепатит попадают в инфекционное отделение, где уже с первых шагов поиска (лабораторные исследования) первоначальный диагноз будет отметен.
В ОАК – падение содержания гемоглобина и количества эритроцитов, которые преимущественно представлены маленькими клетками сферической формы.
Обращают на себя внимание такие показатели, как:
- Аутогемолиз (значительно повышен);
- Ретикулоциты (повышены);
- Осмотическая резистентность эритроцитов (заметно снижена);
- Биохимический анализ крови – гипербилирубинемия за счет несвязанной фракции;
- Стеркобилин (капрограмма) и уробилин (ОАМ) тоже превышают нормальные значения.
Лечение гемолитической анемии данной формы не отличается разнообразием терапевтических мероприятий. В случаях ярко выраженной анемии допустимо проведение гемотрансфузий, причем, только эритроцитарной массы. Препараты железа, витамины группы В, гормоны при болезни Минковского-Шоффара не применяются хотя бы из-за их полной неэффективности и бесполезности. Единственный способ борьбы с врожденной болезнью – удаление «кладбища» эритроцитов (селезенки). Спленэктомия заметно улучшает состояние пациента, хотя маленькие неполноценные эритроциты по-прежнему продолжают циркулировать в кровеносном русле.
Наследственные ГА не ограничиваются только вышеприведенными примерами, однако, учитывая невысокую распространенность, но схожесть симптоматики, лечения и идентичность диагностических критериев для всех форм, дифференциальную диагностику оставим для специалистов. Себе позволим лишь несколько слов в заключение о наследственных ГА.
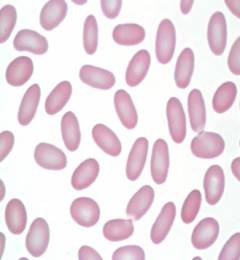
пример обилия эритроцитов неправильной формы при серповидноклеточной анемии, подвергающихся дальнейшему гемолизу
Серповидноклеточная анемия практически во всем повторяет талассемию, отличаясь массивной гибелью эритроцитов при кризе и, соответственно, таким же гемолизом. Серповидноклеточная болезнь у детей провоцируется инфекциями и может давать довольно тяжелые осложнения (параличи, инфаркт легкого, кардиомегалия, цирроз печени). У взрослых заболевание несколько «успокаивается», однако вероятность осложнений все равно остается.
Наследственный овалоцитоз (эллиптотоз) имеет сходную с микросфероцитозом симптоматику, но отличается от него строением красной клетки крови.
Наследственный дефект эритроцитов – дефицит активности Г-6-ФДГ (глюкозо-6-фосфатдегидрогеназа) обусловлен нарушением продукции энергии.
Болезнь не выбирает возраст, поэтому не исключается у новорожденных. ГБН с ядерной желтухой, которая развивается на фоне недостатка Г-6-ФДС, отличается особо тяжелым течением с выраженной неврологической симптоматикой. Диагностические критерии не отличаются от таковых при микросфероцитозе.
Заболевание имеет различные варианты течения: от бессимптомного до тяжелых гемолитических кризов, обычно спровоцированных приемом некоторых лекарственных средств, беременностью, инфекцией, аллергенами. Нераспознанный в свое время гемолитический криз со значительным снижением Hb грозит весьма тяжелыми осложнениями (ДВС-синдром, острая почечная недостаточность) и имеет довольно серьезный прогноз.
Аутоиммунная гемолитическая анемия (АИГА) рассматривается как патологический процесс, в основе которого лежит выработка антител на антигенную структуру собственных красных клеток крови. Иммунная система по какой-то причине принимает свой антиген за чужой и начинает с ним борьбу.
иммунная атака антител на эритроциты при АИГА
- Симптоматическую аутоиммунную гемолитическую анемию, которая развивается на фоне другой патологии (гемобластозы, гепатиты с хроническим течением, новообразования, системная красная волчанка, ревматоидный артрит, лимфогранулематоз и др.);
- Идиопатический вариант АИГА, провоцируемый различными факторами (инфекция, прием лекарств, травма, беременность, роды), которые не являются прямой причиной болезни, просто какой-то гаптен сел на поверхность эритроцита, чем вызвал выработку антител. Но какой это был гаптен? Как правило, этот провокатор так и остался незамеченным и невыясненным.
АИГА в чистом виде – это ее идиопатическая форма, которая нередко развивается после родов, абортов, пищевых отравлений, неупорядоченного приема некоторых лекарств.
Патогенез АИГА до развития болезни проходит два этапа:
- На первом этапе под воздействием неблагоприятных факторов (лекарства, бактерии, вирусы) или в результате соматической мутации единичного иммуноцита меняется антигенная структура эритроцитов;
- На втором этапе патогенеза – непосредственное взаимодействие между выработанными антителами и собственными антигенами, которое лежит в основе формирования иммунологического процесса с развитием гемолиза (свободный гемоглобин уже не ограничен клеточной мембраной) и анемии (разрушенные красные кровяные тельца – уже не эритроциты, ровно, как и вышедший на свободу гемоглобин).
Иммунную агрессию, направленную на себя самого, могут вызывать различные антитела:
-
Неполные тепловые агглютинины (в основном, класс G – IgG, изредка – класс А), которые садятся на поверхность эритроцитарной клетки и начинают самую активную деятельность при температуре 37°С. Как правило, при таком взаимодействии эритроциты не гибнут в кровотоке, а направляются «умирать» в селезенку;
- Холодовые неполные агглютинины (класс М – IgМ), реагирующие с эритроцитами при участии комплемента при температуре 32°С. Эти антитела безвозвратно разрушают эритроциты в мелких сосудах тех участков, где температура может снижаться до указанных значений (пальцы рук и ног, уши, нос);
- Двухфазные гемолизины (класс G – IgG) – эти антитела находят свой антиген при охлаждении, садятся на поверхность клетки и ждут, пока температура поднимется до 37°С – вот тогда они и начнут проявлять агрессию (в результате – гемолиз).
Симптомы АИГА многообразны и зависят от многих обстоятельств, в число которых входят:
- Скорость гемолиза (криз или «спокойствие»);
- Тепло или холод;
- Место гибели эритроцитов;
- Изменения внутренних органов;
- Фоновая патология.
К опорным признакам АИГИ относят:
- Гемолитический криз с желтухой;
- Анемию (снижение и уровня гемоглобина, и количества эритроцитов);
- Повышение температуры тела;
- Присутствие гемоглобина в моче;
- Увеличение селезенки.
Симптомы, которые могут присутствовать при гемолитической анемии, но не являются для нее обязательными и определяющими:
- Слабость, утомляемость;
- Снижение аппетита;
- Увеличение печени.
Лабораторная диагностика АИГА, помимо биохимии (билирубин), общего анализа крови (с подсчетом ретикулоцитов и определением осмотической резистентности эритроцитов) и мочи, включает обязательное проведение иммунологических тестов (проба Кумбса), позволяющих выявить тип антител.
Лечение аутоиммунной гемолитической анемии в период криза осуществляется в стационарных условиях, где больной получает кортикостероиды, иммунодепрессанты, а при неэффективности принятых мероприятий ставится вопрос о проведении спленэктомии.
Переливание компонентов крови (эритроцитарная масса) проводится только по жизненным показаниям и только после индивидуального подбора (проба Кумбса)!
источник
Гемолитическая анемия – комплекс заболеваний, которые объединены в одну группу из-за того, что при всех из них снижается продолжительность жизни эритроцитов. Это способствует потере гемоглобина и приводит к гемолизу. Эти патологии схожи друг с другом, но их происхождение, течение и даже клинические проявления разнятся. Гемолитическая анемия у детей также имеет свои особенности.
Гемолиз представляет собой массовую гибель форменных элементов крови. По своей сути это патологический процесс, который может происходить в двух пространствах организма.
- Экстраваскулярно, то есть вне сосудов. Чаще всего очагами являются паренхиматозные органы – печень, почки, селезенка, а также красный костный мозг. Такой вид гемолиза протекает схоже с физиологическим;
- Интраваскулярно, когда кровяные клетки разрушаются в просвете кровеносных сосудов.
Массовая деструкция эритроцитов протекает с типичным симптомокомплексом, при этом проявления интраваскулярного и экстраваскулярного гемолиза различны. Они определяются при общем осмотре больного, помогут установить диагноз общий анализ крови и другие специфические тесты.
Нефизиологическая гибель красных клеток крови возникает по разным причинам, среди которых одно из самых главных мест занимает дефицит железа в организме. Однако это состояние следует разграничивать с нарушениями синтеза эритроцитов и гемоглобина, в чем помогают лабораторные анализы, клинические симптомы.
- Желтушность кожных покровов, которая отображается повышением общего билирубина и его свободной фракции.
- Несколько отдаленным проявлением становится повышенная вязкость и густота желчи с повышенной склонностью к камнеобразованию. Она также меняет свою окраску, поскольку содержание желчных пигментов увеличивается. Этот процесс обусловлен тем, что клетки печени стараются обезвредить избыток билирубина.
- Кал также меняет свою окраску, поскольку желчные пигменты «добираются» и до него, провоцируя рост показателей стеркобилина, уробилиногена.
- При экстраваскулярной гибели клеток крови повышается уровень уробилина, что отображается потемнением мочи.
- Общий анализ крови реагирует снижением эритроцитов, падением гемоглобина. Компенсаторно растут молодые формы клеток – ретикулоциты.
Разрушение эритроцитов происходит или в просвете кровеносных сосудов, или в паренхиматозных органах. Поскольку экстраваскулярный гемолиз по своему патофизиологическому механизму схож с нормальной гибелью эритроцитов в паренхиматозных органах, различие заключается лишь в его скорости, и он частично описан выше.
При разрушении эритроцитов внутри просвета сосудов развиваются:
- повышение свободного гемоглобина, кровь приобретает так называемый лаковый оттенок;
- изменение цвета мочи за счет свободного гемоглобина или гемосидерина;
- гемосидероз – состояние, когда железосодержащий пигмент откладывается в паренхиматозных органах.
По своей сути гемолитическая анемия представляет собой патологию, при котором продолжительность жизни эритроцитов значительно снижается. Это обуславливается большим количеством факторов, при этом они бывают внешними или внутренними. Гемоглобин во время деструкции форменных элементов частично разрушается, а частично приобретает свободную форму. Снижение гемоглобина менее 110 г/л указывает на развитие анемии. Крайне редко гемолитическая анемия имеет связь со снижением количества железа.
Внутренними факторами, способствующими развитию заболевания, служат аномалии строения кровяных клеток, а внешними – иммунные конфликты, инфекционные агенты, механические повреждения.
Заболевание может быть врожденным или приобретенным, при этом развитие гемолитической анемии после рождения ребенка называется приобретенным.
Врожденная разделяется на мембранопатии, ферментопатии и гемоглобинопатии, а приобретенная на иммунные, приобретенные мембранопатии, механические повреждения форменных элементов, по причине инфекционных процессов.
На сегодняшний день врачи не разделяют форму гемолитической анемии по месту деструкции эритроцитов. Наиболее часто фиксируется аутоиммунная. Также, большая часть всех фиксированных патологий этой группы приходится на долю приобретенных гемолитических анемий, при этом они характерны для всех возрастов, начиная с первых месяцев жизни. У детей следует проявить особую преднастороженность, поскольку эти процессы могут быть наследственными. Их развитие обусловлено несколькими механизмами.
- Появлением антиэритроцитарных антител, которые попадают извне. При гемолитической болезни новорожденных речь идет об изоиммунных процессах.
- Соматическими мутациями, что служит одним из триггеров хронической гемолитической анемии. Это не может стать генетическим наследственным фактором.
- Механическое повреждение эритроцитов возникает как результат воздействия тяжелых физических нагрузок или протезирования клапанов сердца.
- Гиповитаминоз, особую роль играет витамин Е.
- Малярийный плазмодий.
- Воздействие отравляющих веществ.
При аутоиммунных анемиях организм отвечает повышенной восприимчивостью к любым чужеродным белкам, а также имеет повышенную склонность к аллергическим реакциям. Это обусловлено увеличением активности собственной иммунной системы. В крови могут изменяться следующие показатели: специфические иммуноглобулины, количество базофилов и эозинофилов.
Аутоиммунные анемии характеризуются выработкой антител к нормальным кровяным клеткам, что приводит к нарушению распознавания своих клеток. Подвидом такой патологии является трансиммунная анемия, при которой мишенью иммунной системы плода становится материнский организм.
Для обнаружения процесса применяются тесты Кумбса. Они позволяют выявить циркулирующие иммунные комплексы, которые нет при полном здоровье. Лечением занимается аллерголог либо иммунолог.
Заболевание развивается по ряду причин, также они могут быть врожденными или приобретенными. Примерно 50% случаев заболевания остаются без выясненной причины, такая форма называется идиопатической. Среди причин гемолитической анемии важно выделить те, которые провоцируют процесс чаще других, а именно:
- переливание несовместимой крови при гемотрансфузиях, в том числе по резус-фактору;
- воздействие отравляющих веществ, токсические эффекты лекарственных препаратов;
- аномалии развития малышей, пороки сердца;
- лейкозы;
- изменения, провоцируемые жизнедеятельностью паразитов.
Под воздействием вышеперечисленных триггеров и наличии других пусковых механизмов форменные клетки разрушаются, способствуя появлению типичной для анемии симптоматики.
Клинические проявления гемолитической анемии достаточно обширные, но их характер всегда зависит от причины, вызвавшей заболевание, тот или иной его тип. Иногда патология проявляется лишь тогда, когда развивается криз или обострение, а ремиссия протекает бессимптомно, человек не предъявляет никаких жалоб.
Все симптомы процесса можно обнаружить только при декомпенсации состояния, когда имеет место выраженный дисбаланс между здоровыми, формирующимися и разрушенными форменными элементами крови, а костный мозг не справляется с возложенной на него нагрузка.
Классические клинические проявления представлены тремя симптомокомплексами:
- анемическим;
- желтушным;
- увеличение печени и селезенки – гепатоспленомегалия.
Обычно они развиваются при внесосудистой деструкции форменных элементов.
Серповидно-клеточная, аутоиммунная и другие гемолитические анемии проявляются такими характерными признаками.
- Повышенная температура тела, головокружение. Встречается при стремительном развитии заболевания в детском возрасте, а сама температура достигает 38С.
- Синдром желтухи. Появление этого признака обусловлено деструкцией эритроцитов, что приводит к повышению уровня непрямого билирубина, который перерабатывается печенью. Его высокая концентрация способствует росту стеркобилина и уробилина кишечника, за счет чего окрашивается кал, кожа, слизистые оболочки.
- По мере развития желтухи спленомегалия также развивается. Этот синдром достаточно часто протекает с гепатомегалией, то есть одновременно увеличиваются и печень, и селезенка.
- Анемия. Сопровождается снижением количества гемоглобина в крови.
Другими признаками гемолитической анемии бывают:
- болевые ощущения в эпигастрии, животе, поясничной области, почках, костях;
- инфарктоподобные боли;
- пороки развития детей, сопровождающиеся признаками нарушения внутриутробного формирования плода;
- изменение характера стула.
Диагностика гемолитической анемии проводится врачом-гематологом. Он устанавливает диагноз на основании данных, полученных при обследовании больного. Сначала происходит сбор анамнестических данных, уточняется наличие триггерных факторов. Врач оценивает степень бледности кожных покровов и видимых слизистых оболочек, проводит пальпаторное исследование органов живота, при котором можно определить увеличение печени, селезенки.
Следующим этапом служит лабораторное и инструментальное обследование. Проводится общий анализ мочи, крови, биохимическое обследование, при котором можно установить наличие в крови высокого уровня непрямого билирубина. Также выполняется УЗИ органов брюшной полости.
В особо тяжелых случаях назначается биопсия костного мозга, при которой можно определить, как развиваются эритроциты при гемолитической анемии. Важно провести правильную дифференциальную диагностику, чтобы исключить такие патологии, как вирусные гепатиты, гемобластозы, онкологические процессы, цирроз печени, механическую желтуху.
Каждая отдельно взятая форма заболевания требует своего подходу к лечению по причине особенностей возникновения. Важно сразу же устранить все гемолизирующие факторы, если речь идет о приобретенном процессе. Если лечение гемолитических анемий происходит во время криза, то больной должен получать большой объем гемотрансфузий – плазма крови, эритроцитарная масса, также проводят метаболическую и витаминотерапии, при этом особую роль играет компенсация дефицита витамина е.
Иногда возникает потребность назначения гормонов и антибиотиков. В случае установки диагноза микросфероцитоза единственным вариантом лечения является спленэктомия.
Аутоиммунные процессы подразумевают применение стероидных гормонов. Препаратом выбора считается преднизолон. Такая терапия снижает гемолиз, а иногда прекращает его полностью. Особо тяжелые случаи требуют назначение иммунодепрессантов. Если заболевание полностью резистентно к медикаментозным лекарственным средствам, врачи прибегают к удалению селезенки.
При токсической форме заболевания возникает необходимость в проведении дезинтоксикационной интенсивной терапии – гемодиализ, лечение антидотами, форсированный диурез при сохраненной работоспособности почек.
Как уже было сказано ранее, гемолитические анемии – группа патологических процессов, которая по своему механизму развития может значительно отличаться, но у всех заболеваний есть одна общая черта – гемолиз. Он происходит не только в кровяном русле, но и в паренхиматозных органах.
Первые признаки развития процесса зачастую не вызывают никаких подозрений у заболевших лиц. Если у ребенка малокровие развивается стремительно, то появляются раздражительность, быстрая утомляемость, плаксивость, а также бледность кожи. Эти признаки могут быть легко приняты за особенности характера малыша. Особенно если речь идет о часто болеющих детях. И это неудивительно, поскольку при наличии этой патологии люди подвержены развитию инфекционных процессов.
Основные симптомы анемии у детей – бледность кожи, которую необходимо дифференцировать с почечными патологиями, туберкулезом, интоксикацией различного генеза.
Главным признаком, который позволит определить наличие именно анемии без определения лабораторных показателей – при малокровии слизистые оболочки также приобретают бледный оттенок.
Основными осложнениями гемолитических анемий являются:
- самое страшное – анемическая кома и летальный исход;
- снижение показателей артериального давления, сопровождающееся учащенным пульсом;
- олигоурия;
- образование камней в желчном пузыре и желчевыводящих протоках.
Следует отметить, что некоторые пациенты отмечают обострение заболевания в холодное время года. Таким пациентам врачи рекомендуют не переохлаждаться.
Профилактические мероприятия бывают первичными и вторичными:
- первичные способствуют предотвращению развития заболевания;
- вторичные превентивные меры борются с обострениями патологии.
Если развивается анемия врожденная, то сразу нужно приступать ко вторичным мероприятиям. Единственный верный способ предупреждения заболевания – соблюдение принципов здорового образа жизни, отдавать предпочтение натуральным продуктам питания, своевременная терапия любых патологических процессов.
источник
Гемолитическая анемия – патология эритроцитов, отличительным признаком которой является ускоренное разрушение красных кровяных телец с высвобождением повышенного количества непрямого билирубина. Для данной группы заболеваний типично сочетание анемического синдрома, желтухи и увеличения размеров селезенки. В процессе диагностики исследуется общий анализ крови, уровень билирубина, анализ кала и мочи, УЗИ органов брюшной полости; проводится биопсия костного мозга, иммунологические исследования. В качестве методов лечения используется медикаментозная, гемотрансфузионная терапия; при гиперспленизме показана спленэктомия.
Гемолитическая анемия (ГА) — малокровие, обусловленное нарушением жизненного цикла эритроцитов, а именно преобладанием процессов их разрушения (эритроцитолиза) над образованием и созреванием (эритропоэзом). Данная группа анемий очень обширна. Их распространенность неодинакова в различных географических широтах и возрастных когортах; в среднем патология встречается у 1% населения. Среди прочих видов анемий на долю гемолитических приходится 11%. Патология характеризуется укорочением жизненного цикла эритроцитов и их распадом (гемолизом) раньше времени (через 14-21 день вместо 100-120 суток в норме). При этом разрушение эритроцитов может происходить непосредственно в сосудистом русле (внутрисосудистый гемолиз) или в селезенке, печени, костном мозге (внесосудистый гемолиз).
Этиопатогенетическую основу наследственных гемолитических синдромов составляют генетические дефекты мембран эритроцитов, их ферментных систем либо структуры гемоглобина. Данные предпосылки обусловливают морфофункциональную неполноценность эритроцитов и их повышенное разрушение. Гемолиз эритроцитов при приобретенных анемиях наступает под влиянием внутренних факторов или факторов окружающей среды, среди которых:
- Аутоиммунные процессы. Образование антител, агглютинирующих эритроциты, возможно при гемобластозах (остром лейкозе, хроническом лимфолейкозе, лимфогранулематозе), аутоиммунной патологии (СКВ, неспецифическом язвенном колите), инфекционных заболеваниях (инфекционном мононуклеозе, токсоплазмозе, сифилисе, вирусной пневмонии). Развитию иммунных гемолитических анемий могут способствовать посттрансфузионные реакции, профилактическая вакцинация, гемолитическая болезнь плода.
- Токсическое действие на эритроциты. В ряде случаев острому внутрисосудистому гемолизу предшествует отравление мышьяковистыми соединениями, тяжелыми металлами, уксусной кислотой, грибными ядами, алкоголем и др. Вызывать разрушение клеток крови может прием определенных лекарств (противомалярийных препаратов, сульфаниламидов, производных нитрофуранового ряда, анальгетиков).
- Механическое повреждение эритроцитов. Гемолиз эритроцитов может наблюдаться при тяжелых физических нагрузках (длительной ходьбе, беге, лыжном переходе), при ДВС-синдроме, малярии, злокачественной артериальной гипертензии, протезировании клапанов сердца и сосудов, проведении гипербарической оксигенации, сепсисе, обширных ожогах. В этих случаях под действием тех или иных факторов происходит травматизация и разрыв мембран изначально полноценных эритроцитов.
Центральным звеном патогенеза ГА является повышенное разрушение эритроцитов в органах ретикулоэндотелиальной системы (селезенке, печени, костном мозге, лимфатических узлах) или непосредственно в сосудистом русле. При аутоиммунном механизме анемии происходит образование антиэритроцитарных АТ (тепловых, холодовых), которые вызывают ферментативный лизис мембраны эритроцитов. Токсические вещества, являясь сильнейшими окислителями, разрушают эритроцит за счет развития метаболических, функциональных и морфологических изменений оболочки и стромы красных кровяных телец. Механические факторы оказывают прямое воздействие на клеточную мембрану. Под влиянием этих механизмов из эритроцитов выходят ионы калия и фосфора, а внутрь поступают ионы натрия. Клетка разбухает, при критическом увеличении ее объема наступает гемолиз. Распад эритроцитов сопровождаются развитием анемического и желтушного синдромов (так называемой «бледной желтухой»). Возможно интенсивное окрашивание кала и мочи, увеличение селезенки и печени.
В гематологии гемолитические анемии подразделяются на две большие группы: врожденные (наследственные) и приобретенные. Наследственные ГА включают следующие формы:
- эритроцитарные мембранопатии (микросфероцитоз – болезнь Минковского-Шоффара, овалоцитоз, акантоцитоз) – анемии, обусловлены структурными аномалиями мембран эритроцитов
- ферментопении (энзимопении) – анемии, вызванные дефицитом тех или иных ферментов (глюкозо-6-фосфатдегидрогеназы, пируваткиназы и др.)
- гемоглобинопатии— анемии, связанные с качественными нарушениями структуры гемоглобина или изменением соотношения его нормальных форм (талассемия, серповидно-клеточная анемия).
Приобретенные ГА подразделяются на:
- мембранопатии приобретенные (пароксизмальная ночная гемоглобинурия – б-нь Маркиафавы-Микели, шпороклеточная анемия)
- иммунные (ауто- и изоиммунные) – обусловлены воздействием антител
- токсические – анемии, обусловленные воздействием химических веществ, биологических ядов, бактериальных токсинов
- механические — анемии, вызванные механическим повреждением структуры эритроцитов (тромбоцитопеническая пурпура, маршевая гемоглобинурия)
Наиболее распространенной формой данной группы анемий является микросфероцитоз, или болезнь Минковского-Шоффара. Наследуется по аутосомно-доминантному типу; обычно прослеживается у нескольких представителей семьи. Дефектность эритроцитов обусловлена дефицитом в мембране актомиозиноподобного белка и липидов, что приводит к изменению формы и диаметра эритроцитов, их массивному и преждевременному гемолизу в селезенке. Манифестация микросфероцитарной ГА возможна в любом возрасте (в младенчестве, юношестве, старости), однако обычно проявления возникают у детей старшего возраста и подростков. Тяжесть заболевания варьирует от субклинического течения до тяжелых форм, характеризующихся часто повторяющимися гемолитическими кризами. В момент криза нарастает температура тела, головокружение, слабость; возникают боли в животе и рвота.
Основным признаком микросфероцитарной гемолитической анемии служит желтуха различной степени интенсивности. Вследствие высокого содержания стеркобилина кал становится интенсивно окрашенным в темно-коричневый цвет. У пациентов с болезнь Минковского-Шоффара наблюдается склонность к образованию камней в желчном пузыре, поэтому часто развиваются признаки обострения калькулезного холецистита, возникают приступы желчной колики, а при закупорке холедоха конкрементом — обтурационная желтуха. При микросфероцитозе во всех случаях увеличена селезенка, а у половины пациентов – еще и печень. Кроме наследственной микросфероцитарной анемии, у детей часто встречаются другие врожденные дисплазии: башенный череп, косоглазие, седловидная деформация носа, аномалии прикуса, готическое нёбо, полидактилия или брадидактилия и пр. Пациенты среднего и пожилого возраста страдают трофическими язвами голени, которые возникают в результате гемолиза эритроцитов в капиллярах конечностей и плохо поддаются лечению.
Энзимопенические анемии связаны с недостатком определенных ферментов эритроцитов (чаще — Г-6-ФД, глутатион-зависимых ферментов, пируваткиназы и др). Гемолитическая анемия может впервые заявлять о себе после перенесенного интеркуррентного заболевания или приема медикаментов (салицилатов, сульфаниламидов, нитрофуранов). Обычно заболевание имеет ровное течение; типична «бледная желтуха», умеренная гепатоспленомегалия, сердечные шумы. В тяжелых случаях развивается ярко выраженная картина гемолитического криза (слабость, рвота, одышка, сердцебиение, коллаптоидное состояние). В связи с внутрисосудистым гемолизом эритроцитов и выделением гемосидерина с мочой последняя приобретает темный (иногда черный) цвет. Особенностям клинического течения гемоглобинопатий — талассемии и серповидно-клеточной анемии посвящены самостоятельные обзоры.
Среди различных приобретенных вариантов чаще других встречаются аутоиммунные анемии. Для них общим пусковым фактором выступает образование антител к антигенам собственных эритроцитов. Гемолиз эритроцитов может носить как внутрисосудистый, так и внутриклеточный характер. Гемолитический криз при аутоиммунной анемии развивается остро и внезапно. Он протекает с лихорадкой, резкой слабостью, головокружением, сердцебиением, одышкой, болями в эпигастрии и пояснице. Иногда острым проявлениям предшествуют предвестники в виде субфебрилитета и артралгий. В период криза стремительно нарастает желтуха, не сопровождающаяся кожным зудом, увеличивается печень и селезенка. При некоторых формах аутоиммунных анемий больные плохо переносят холод; в условиях низких температур у них может развиваться синдром Рейно, крапивница, гемоглобинурия. Вследствие недостаточности кровообращения в мелких сосудах возможны осложнения в виде гангрены пальцев ног и рук.
Токсические анемии протекают с прогрессирующей слабостью, болями в правом подреберье и поясничной области, рвотой, гемоглобинурией, высокой температурой тела. Со 2-3 суток присоединяется желтуха и билирубинемия; на 3-5 сутки возникает печеночная и почечная недостаточность, признаками которых служат гепатомегалия, ферментемия, азотемия, анурия. Отдельные виды приобретенных гемолитических анемий рассмотрены в соответствующих статьях: «Гемоглобинурия» и «Тромбоцитопеническая пурпура», «Гемолитическая болезнь плода».
Каждый вид ГА имеет свои специфические осложнения: например, ЖКБ – при микросфероцитозе, печеночная недостаточность – при токсических формах и т.д. К числу общих осложнений относятся гемолитические кризы, которые могут провоцироваться инфекциями, стрессами, родами у женщин. При остром массивном гемолизе возможно развитие гемолитической комы, характеризующейся коллапсом, спутанным сознанием, олигурией, усилением желтухи. Угрозу жизни больного несут ДВС-синдром, инфаркт селезенки или спонтанный разрыв органа. Неотложной медицинской помощи требуют острая сердечно-сосудистая и почечная недостаточность.
Определение формы ГА на основе анализа причин, симптоматики и объективных данных относится к компетенции гематолога. При первичной беседе выясняется семейный анамнез, частота и тяжесть протекания гемолитических кризов. В процессе осмотра оценивается окраска кожных покровов, склер и видимых слизистых, производится пальпация живота для оценки величины печени и селезенки. Сплено- и гепатомегалия подтверждается при проведении УЗИ печени и селезенки. Лабораторный диагностический комплекс включает:
- Исследование крови. Изменения в гемограмме характеризуются нормо- или гипохромной анемией, лейкопенией, тромбоцитопенией, ретикулоцитозом, ускорением СОЭ. В биохимических пробах крови определяется гипербилирубинемия (увеличение фракции непрямого билирубина), увеличение активности лактатдегидрогеназы. При аутоиммунных анемиях большое диагностическое значение имеет положительная проба Кумбса.
- Анализы мочи и кала. Исследование мочи выявляет протеинурию, уробилинурию, гемосидеринурию, гемоглобинурию. В копрограмме повышено содержание стеркобилина.
- Миелограмму. Для цитологического подтверждения выполняется стернальная пункция. Исследование пунктата костного мозга обнаруживает гиперплазию эритроидного ростка.
В процессе дифференциальной диагностики исключаются гепатиты, цирроз печени, портальная гипертензия, гепатолиенальный синдром, порфирии, гемобластозы. Пациента консультируют гастроэнтеролог, клинический фармаколог, инфекционист и другие специалисты.
Различные формы ГА имеют свои особенности и подходы к лечению. При всех вариантах приобретенной гемолитической анемии необходимо позаботиться об устранении влияния гемолизирующих факторов. Во время гемолитических кризов больным необходимы инфузии растворов, плазмы крови; витаминотерапия, по необходимости – гормоно- и антибиотикотерапия. При микросфероцитозе единственно эффективным методом, приводящим к 100 % прекращению гемолиза, является спленэктомия.
При аутоиммунной анемии показана терапия глюкокортикоидными гормонами (преднизолоном), сокращающая или прекращающая гемолиз. В некоторых случаях требуемый эффект достигается назначением иммунодепрессантов (азатиоприна, 6-меркаптопурина, хлорамбуцила), противомалярийных препаратов (хлорохина). При резистентных к медикаментозной терапии формах аутоиммунной анемии выполняется спленэктомия. Лечение гемоглобинурии предполагает переливание отмытых эритроцитов, плазмозаменителей, назначение антикоагулянтов и антиагрегантов. Развитие токсической гемолитической анемии диктует необходимость проведения интенсивной терапии: дезинтоксикации, форсированного диуреза, гемодиализа, по показаниям – введение антидотов.
Течение и исход зависят от вида анемии, тяжести протекания кризов, полноты патогенетической терапии. При многих приобретенных вариантах устранение причин и полноценное лечение приводит к полному выздоровлению. Излечения врожденных анемий добиться нельзя, однако возможно достижение длительной ремиссии. При развитии почечной недостаточности и других фатальных осложнений прогноз неблагоприятен. Предупредить развитие ГА позволяет профилактика острых инфекционных заболеваний, интоксикаций, отравлений. Запрещается бесконтрольное самостоятельное использование лекарственных препаратов. Необходимо тщательная подготовка пациентов к гемотрансфузиям, вакцинации с проведением всего комплекса необходимых обследований.
источник
Поскольку симптомокомплекс гемолитических анемий одинаков для большинства вызвавших их причин, огромное значение приобретает правильно собранный анамнез, а также дополнительные лабораторные и параклинические исследования.
Лечение гемолитических анемий должно проводиться лишь после установления окончательного диагноза, однако далеко не всегда это представляется возможным ввиду высоких темпов разрушения эритроцитов и недостаточности времени на постановку диагноза. В таких случаях на первый план выступают мероприятия, направленные на жизнеобеспечение пациента, такие как переливание донорской крови, плазмаферез, эмпирическое лечение антибактериальными препаратами и глюкокортикоидными гормональными препаратами.
Интересные факты
- Среднее количество железа, содержащееся в крови взрослого человека, составляет порядка 4 грамм.
- Суммарное количество эритроцитов в теле взрослого человека в пересчете на сухую массу составляет в среднем 2 кг.
- Регенераторная способность эритроцитарного ростка костного мозга достаточно велика. Однако, для того чтобы регенераторные механизмы успели активизироваться, требуется длительное время. По этой причине хронический гемолиз значительно легче переносится пациентами, чем острый, даже если при этом уровень гемоглобина достигает 40 – 50 г\л.
Нормальный эритроцит обладает рядом параметров, которые обеспечивают успешное выполнение им своих функций.
Основными параметрами эритроцитов являются:
- форма двояковогнутого диска;
- средний диаметр — 7,2 – 7,5 мкм;
- средний объем — 90 мкм 3 ;
- длительность «жизни» — 90 – 120 дней;
- нормальная концентрация у мужчин — 3,9 – 5,2 х 10 12 \л;
- нормальная концентрация у женщин — 3,7 – 4,9 х 10 12 \л;
- нормальная концентрация гемоглобина у мужчин — 130 – 160 г\л;
- нормальная концентрация гемоглобина у женщин — 120 – 150 г\л;
- гематокрит (соотношение форменных элементов крови к жидкой ее части) у мужчин — 0,40 – 0,48;
- гематокрит у женщин — 0,36 – 0,46.
Изменение формы и размера эритроцитов отрицательно отражается на их функции. Например, уменьшение размеров эритроцита свидетельствует о меньшем содержании гемоглобина в нем. В таком случае количество эритроцитов может быть в норме, но, тем не менее, анемия будет присутствовать, поскольку общий уровень гемоглобина будет снижен. Увеличение диаметра эритроцита часто свидетельствует о мегалобластной B12-дефицитной или фолиеводефицитной анемии. Присутствие в анализе крови эритроцитов разного диаметра называется анизоцитозом.
Правильная форма эритроцита с точки зрения физиологии имеет большое значение. Во-первых, она обеспечивает наибольшую площадь соприкосновения эритроцита с сосудистой стенкой во время прохождения по капилляру, а соответственно и высокую скорость газообмена. Во-вторых, измененная форма эритроцитов часто свидетельствует о низких пластических свойствах цитоскелета эритроцита (система белков, организованных в сеть, поддерживающую необходимую форму клетки). Вследствие изменения нормальной формы клетки происходит преждевременное разрушение таких эритроцитов при прохождении через капилляры селезенки. Присутствие в периферической крови эритроцитов различной формы именуется пойкилоцитозом.
Цитоскелет эритроцита является системой микротрубочек и микрофиламентов, придающих эритроциту ту или иную форму. Микрофиламенты состоят из трех видов белков — актина, миозина и тубулина. Данные белки способны активно сокращаться, изменяя форму эритроцита для осуществления необходимой задачи. Например, для прохождения через капилляры эритроцит вытягивается, а по выходу из узкого участка снова принимает первоначальную форму. Данные преобразования происходят при использовании энергии АТФ (аденозинтрифосфат) и ионов кальция, являющихся пусковым фактором в перестройке цитоскелета.
Еще одной особенностью эритроцита является отсутствие ядра. Данное свойство крайне выгодно с эволюционной точки зрения, поскольку позволяет более рационально использовать пространство, которое бы занимало ядро, и вместо него поместить в эритроцит большее количество гемоглобина. Более того, ядро значительно бы ухудшило пластические свойства эритроцита, что недопустимо, учитывая, что данная клетка должна проникать через капилляры, диаметр которых в несколько раз меньше ее собственного.
Гемоглобин является макромолекулой, заполняющей 98% объема зрелого эритроцита. Он располагается в ячейках цитоскелета клетки. Подсчитано, что в среднем эритроците содержится приблизительно 280 – 400 миллионов молекул гемоглобина. Он состоит из белковой части – глобина и небелковой части – гема. Глобин, в свою очередь, состоит из четырех мономеров, два из которых мономеры α (альфа) и остальные два – мономеры β (бета). Гем является сложной неорганической молекулой, в центре которой располагается железо, способное окисляться и восстанавливаться в зависимости от условий среды. Основной функцией гемоглобина является захват, транспортировка и высвобождение кислорода и углекислого газа. Данные процессы регулируются кислотностью среды, парциальным давлением газов крови и другими факторами.
Различают следующие виды гемоглобина:
- гемоглобин А (HbA);
- гемоглобин А2 (HbA2);
- гемоглобин F (HbF);
- гемоглобин Н (HbH);
- гемоглобин S (HbS).
Гемоглобин А является наиболее численной фракцией, доля которой составляет 95 – 98%. Данный гемоглобин является нормальным, а его строение соответствует описанному выше. Гемоглобин А2 состоит из двух цепей α и двух цепей δ (дельта). Данный тип гемоглобина не менее функционален, чем гемоглобин А, однако его доля составляет всего 2 – 3% . Гемоглобин F является детской или фетальной фракцией гемоглобина и встречается в среднем до 1 года. Непосредственно после рождения фракция такого гемоглобина наиболее высока и составляет 70 – 90%. К концу первого года жизни фетальный гемоглобин разрушается, а его место занимает гемоглобин А. Гемоглобин Н встречается при талассемии, при этом он формируется из 4-х мономеров β. Гемоглобин S является диагностическим признаком серповидноклеточной анемии.
Мембрана эритроцита состоит из двойного липидного слоя, пронизанного различными белками, выполняющими роль насосов для разнообразных микроэлементов. К внутренней поверхности мембраны прикрепляются элементы цитоскелета. На внешней поверхности эритроцита располагается большое количество гликопротеидов, выполняющих роль рецепторов и антигенов – молекул, определяющих уникальность клетки. На сегодняшний день на поверхности эритроцитов обнаружено более 250 видов антигенов, наиболее изученными из которых являются антигены системы АВ0 и системы резус-фактора.
По системе АВ0 различают 4 группы крови, а по резус-фактору – 2 группы. Открытие данных групп крови ознаменовало начало новой эры в медицине, поскольку позволило производить переливание крови и ее компонентов пациентам со злокачественными заболеваниями крови, массивными кровопотерями и др. Также благодаря переливанию крови значительно возросла выживаемость пациентов после массивных хирургических вмешательств.
По системе АВ0 различают следующие группы крови:
- агглютиногены (антигены на поверхности эритроцитов, которые при контакте с одноименными агглютининами вызывают осаждение красных кровяных телец) на поверхности эритроцитов отсутствуют;
- присутствуют агглютиногены А;
- присутствуют агглютиногены В;
- присутствуют агглютиногены А и В.
По наличию резус-фактора различают следующие группы крови:
- резус-положительная – 85% населения;
- резус-отрицательная – 15% населения.
Несмотря на тот факт, что, теоретически, переливая полностью совместимую кровь от одного пациента другому анафилактических реакций быть не должно, периодически они случаются. Причиной такого осложнения является несовместимость по остальным типам эритроцитарных антигенов, которые, к сожалению, практически не изучены на сегодняшний день. Кроме того, причиной анафилаксии могут быть некоторые компоненты плазмы – жидкой части крови, Поэтому согласно последним рекомендациям международных медицинских гидов переливание цельной крови не приветствуется. Вместо этого переливаются компоненты крови – эритроцитарная масса, тромбоцитарная масса, альбумины, свежезамороженная плазма концентраты факторов свертывания и т. д.
Упомянутые ранее гликопротеиды, расположенные на поверхности мембраны эритроцитов, формируют слой, называющийся гликокаликсом. Важной особенностью данного слоя является отрицательный заряд на его поверхности. Поверхность внутреннего слоя сосудов также имеет отрицательный заряд. Соответственно, в кровеносном русле эритроциты отталкиваются от стенок сосуда и друг от друга, что предотвращает образование кровяных сгустков. Однако стоит произойти повреждению эритроцита или ранению стенки сосуда, как отрицательный их заряд постепенно сменяется на положительный, здоровые эритроциты группируются вокруг места повреждения, и формируется тромб.
Понятие деформируемости и цитоплазматической вязкости эритроцита тесно сопряжено с функциями цитоскелета и концентрацией гемоглобина в клетке. Деформируемостью называется способность эритроцита клетки произвольно изменять свою форму для преодоления препятствий. Цитоплазматическая вязкость обратно пропорциональна деформируемости и возрастает вместе с увеличением содержания гемоглобина по отношению к жидкой части клетки. Увеличение вязкости происходит при старении эритроцита и является физиологическим процессом. Параллельно с увеличением вязкости происходит уменьшение деформируемости.
Тем не менее, изменение данных показателей может иметь место не только при физиологическом процессе старения эритроцита, но еще и при многих врожденных и приобретенных патологиях, таких как наследственные мембранопатии, ферментопатии и гемоглобинопатии, которые более подробно будут описаны далее.
Эритроцит, как и любая другая живая клетка, нуждается в энергии для успешного функционирования. Энергию эритроцит получает при окислительно-восстановительных процессах, происходящих в митохондриях. Митохондрии сравниваются с электростанциями клетки, поскольку преобразуют глюкозу в АТФ в ходе процесса, именуемого гликолизом. Отличительной способностью эритроцита является то, что его митохондрии образуют АТФ только путем анаэробного гликолиза. Иными словами, данные клетки не нуждаются в кислороде для обеспечения своей жизнедеятельности и поэтому доставляют тканям ровно столько кислорода, сколько получили при прохождении через легочные альвеолы.
Несмотря на то, что об эритроцитах сложилось мнение как об основных переносчиках кислорода и углекислого газа, помимо этого они выполняют еще ряд важных функций.
Второстепенными функциями эритроцитов являются:
- регуляция кислотно-щелочного равновесия крови посредством карбонатной буферной системы;
- гемостаз – процесс, направленный на остановку кровотечения;
- определение реологических свойств крови – изменение численности эритроцитов по отношению к общему количеству плазмы приводит к сгущению или разжижению крови.
- участие в иммунных процессах – на поверхности эритроцита находятся рецепторы для прикрепления антител;
- пищеварительная функция – распадаясь, эритроциты высвобождают гем, самостоятельно трансформирующийся в свободный билирубин. В печени свободный билирубин превращается в желчь, использующуюся для расщепления жиров пищи.
Эритроциты образуются в красном костном мозге, проходя через многочисленные стадии роста и созревания. Все промежуточные формы предшественников эритроцитов объединяются в единый термин – эритроцитарный росток.
По мере созревания предшественники эритроцита претерпевают изменение кислотности цитоплазмы (жидкой части клетки), самопереваривание ядра и накопление гемоглобина. Непосредственным предшественником эритроцита является ретикулоцит – клетка, в которой при рассмотрении под микроскопом можно встретить некоторые плотные включения, являвшиеся некогда ядром. Ретикулоциты циркулируют в крови от 36 до 44 часов, за которые они избавляются от остатков ядра и заканчивают синтез гемоглобина из остаточных цепей матричной РНК (рибонуклеиновой кислоты).
Регуляция созревания новых эритроцитов осуществляется посредством прямого механизма обратной связи. Веществом, стимулирующим рост числа эритроцитов, является эритропоэтин – гормон, вырабатываемый паренхимой почек. При кислородном голодании выработка эритропоэтина усиливается, что приводит к ускорению созревания эритроцитов и в конечном итоге – восстановлению оптимального уровня насыщения тканей кислородом. Второстепенная регуляция деятельности эритроцитарного ростка осуществляется посредством интерлейкина-3, фактора стволовых клеток, витамина В12, гормонов (тироксин, соматостатин, андрогены, эстрогены, кортикостероиды) и микроэлементов (селен, железо, цинк, медь и др.).
По истечении 3 – 4 месяцев существования эритроцита происходит его постепенная инволюция, проявляющаяся выходом внутриклеточной жидкости из него по причине износа большинства транспортных ферментных систем. Вслед за этим происходит уплотнение эритроцита, сопровождающееся снижением его пластических свойств. Снижение пластических свойств ухудшает проходимость эритроцита через капилляры. В конечном итоге такой эритроцит попадает в селезенку, застревает в ее капиллярах и разрушается лейкоцитами и макрофагами, располагающимися вокруг них.
После разрушения эритроцита в кровеносное русло выделяется свободный гемоглобин. При скорости гемолиза менее 10% от общего числа эритроцитов в сутки гемоглобин захватывается белком под названием гаптоглобин и оседает в селезенке и внутреннем слое сосудов, где разрушается макрофагами. Макрофаги уничтожают белковую часть гемоглобина, но высвобождают гем. Гем под действием ряда ферментов крови трансформируется в свободный билирубин, после чего транспортируется в печень белком альбумином. Наличие в крови большого количества свободного билирубина сопровождается появлением желтухи лимонного оттенка. В печени свободный билирубин связывается с глюкуроновой кислотой и выделяется в кишечник в виде желчи. При наличии препятствия оттоку желчи она поступает обратно в кровь и циркулирует в виде связанного билирубина. В таком случае также появляется желтуха, однако более темного оттенка (слизистые и кожные покровы оранжевого или красноватого цвета).
После выхода связанного билирубина в кишечник в виде желчи происходит его восстановление до стеркобилиногена и уробилиногена при помощи кишечной флоры. Большая часть стеркобилиногена превращается в стеркобилин, который выделяется с калом и окрашивает его в коричневый цвет. Остаточная часть стеркобилиногена и уробилиноген всасывается в кишечнике и поступает обратно в кровоток. Уробилиноген трансформируется в уробилин и выделяется с мочой, а стеркобилиноген повторно поступает в печень и выводится с желчью. Данный цикл с первого взгляда может показаться бессмысленным, однако, это заблуждение. Во время повторного попадания продуктов распада эритроцитов в кровь осуществляется стимуляция активности иммунной системы.
При увеличении скорости гемолиза от 10% до 17 – 18% от общего числа эритроцитов в сутки резервов гаптоглобина становится недостаточно, для того чтобы захватывать высвобождающийся гемоглобин и утилизировать его путем, описанным выше. В таком случае свободный гемоглобин с током крови поступает в почечные капилляры, отфильтровывается в первичную мочу и окисляется до гемосидерина. Затем гемосидерин поступает во вторичную мочу и выводится из организма.
При крайне выраженном гемолизе, темпы которого превышают 17 – 18% от общего количества эритроцитов в сутки, гемоглобин поступает в почки в слишком большом количестве. Из-за этого не успевает происходить его окисление и в мочу поступает чистый гемоглобин. Таким образом, определение в моче избытка уробилина является признаком легкой гемолитической анемии. Появление гемосидерина свидетельствует о переходе в среднюю степень гемолиза. Обнаружение гемоглобина в моче говорит о высокой интенсивности разрушения эритроцитов.
Гемолитические анемии классифицируются на врожденные и приобретенные.
Различают следующие виды врожденных гемолитических анемий:
- мембранопатии;
- ферментопатии;
- гемоглобинопатии.
Различают следующие виды приобретенных гемолитических анемий:
- иммунные гемолитические анемии;
- приобретенные мембранопатии;
- анемии из-за механического разрушения эритроцитов;
- гемолитические анемии, вызванные инфекционными агентами.
Как описывалось ранее, нормальной формой эритроцита является форма двояковогнутого диска. Такая форма соответствует правильному белковому составу мембраны и позволяет эритроциту проникать через капилляры, диаметр которых в несколько раз меньше диаметра самого эритроцита. Высокая проникающая способность эритроцитов, с одной стороны, позволяет им максимально эффективно выполнять основную свою функцию – обмен газов между внутренней средой организма и внешней средой, а с другой стороны – избегать избыточного их разрушения в селезенке.
Дефект определенных белков мембраны приводит к нарушению ее формы. С нарушением формы происходит снижение деформируемости эритроцитов и как следствие усиленное их разрушение в селезенке.
На сегодняшний день различают 3 вида врожденных мембранопатий:
- акантоцитоз
- микросфероцитоз
- овалоцитоз
С детства у таких пациентов происходит гипертрофия эритроцитарного костномозгового ростка, компенсирующая гемолиз. Поэтому при микросфероцитозе чаще наблюдается легкая и средней тяжести анемия, появляющаяся преимущественно в моменты ослабления организма вирусными заболеваниями, недостаточным питанием или интенсивным физическим трудом.
Эритроцит содержит ряд ферментов, при помощи которых поддерживается постоянство его внутренней среды, осуществляется переработка глюкозы в АТФ и регуляция кислотно-щелочного баланса крови.
Соответственно вышеуказанным направлениям различают 3 вида ферментопатий:
- дефицит ферментов, участвующих в окислении и восстановлении глутатиона (см. ниже);
- дефицит ферментов гликолиза;
- дефицит ферментов, использующих АТФ.
Глутатион является трипептидным комплексом, участвующим в большинстве окислительно-восстановительных процессов организма. В частности, он необходим для работы митохондрий – энергетических станций любой клетки, в том числе и эритроцита. Врожденные дефекты ферментов, участвующих в окислении и восстановлении глутатиона эритроцитов, приводят к снижению скорости продукции молекул АТФ – основного энергетического субстрата для большинства энергозависимых систем клетки. Дефицит АТФ приводит к замедлению обмена веществ эритроцитов и их скорому самостоятельному уничтожению, называемому апоптозом.
Гликолиз является процессом распада глюкозы с образованием молекул АТФ. Для осуществления гликолиза необходимо присутствие ряда ферментов, которые многократно преобразуют глюкозу в промежуточные соединения и в итоге высвобождают АТФ. Как указывалось ранее, эритроцит является клеткой, не использующей кислород для образования молекул АТФ. Такой тип гликолиза является анаэробным (безвоздушным). В результате из одной молекулы глюкозы в эритроците образуется 2 молекулы АТФ, использующиеся для поддержания работоспособности большинства ферментных систем клетки. Соответственно врожденный дефект ферментов гликолиза лишает эритроцит необходимого количества энергии для поддержания жизнедеятельности, и он разрушается.
АТФ является универсальной молекулой, окисление которой высвобождает энергию, необходимую для работы более чем 90% ферментных систем всех клеток организма. Эритроцит также содержит множество ферментных систем, субстратом которых является АТФ. Высвобождаемая энергия расходуется на процесс газообмена, поддержание постоянного ионного равновесия внутри и снаружи клетки, поддержание постоянного осмотического и онкотического давления клетки, а также на активную работу цитоскелета и многое другое. Нарушение утилизации глюкозы как минимум в одной из вышеупомянутых систем приводит к выпадению ее функции и дальнейшей цепной реакции, итогом которой является разрушение эритроцита.
Гемоглобин – молекула, занимающая 98% объема эритроцита, ответственная за обеспечение процессов захвата и высвобождения газов, а также за их транспортировку от легочных альвеол к периферическим тканям и обратно. При некоторых дефектах гемоглобина эритроциты значительно хуже осуществляют перенос газов. Кроме того, на фоне изменения молекулы гемоглобина попутно изменяется и форма самого эритроцита, что также отрицательно отражается на длительности их циркуляции в кровеносном русле.
Различают 2 вида гемоглобинопатий:
- количественные – талассемии;
- качественные – серповидноклеточная анемия или дрепаноцитоз.
Талассемии являются наследственными заболеваниями, связанными с нарушением синтеза гемоглобина. По своей структуре гемоглобин является сложной молекулой, состоящей из двух альфа-мономеров и двух бета-мономеров, связанных между собой. Альфа цепь синтезируется с 4-х участков ДНК. Цепь бета – с 2-х участков. Таким образом, при возникновении мутации в одном из 6 участков снижается или прекращается синтез того мономера, ген которого поврежден. Здоровые гены продолжают синтез мономеров, что со временем приводит к количественному преобладанию одних цепей над другими. Те мономеры, которые оказываются в избытке, образуют непрочные соединения, функция которых значительно уступает нормальному гемоглобину. Соответственно той цепи, синтез которой нарушен, выделяют 3 основных типа талассемий – альфа, бета и смешанная альфа-бета талассемия. Клиническая картина зависит от количества мутировавших генов.
Серповидноклеточная анемия является наследственным заболеванием, при котором вместо нормального гемоглобина А формируется аномальный гемоглобин S. Данный аномальный гемоглобин значительно уступает в функциональности гемоглобину А, а также изменяет форму эритроцита на серповидную. Такая форма приводит к разрушению эритроцитов в срок от 5 до 70 дней в сравнении с нормальной длительностью их существования – от 90 до 120 дней. В результате в крови появляется доля серповидных эритроцитов, величина которой зависит от того, является мутация гетерозиготной или гомозиготной. При гетерозиготной мутации доля аномальных эритроцитов редко достигает 50%, а больной испытывает симптомы анемии только при значительной физической нагрузке или в условиях сниженной концентрации кислорода в атмосферном воздухе. При гомозиготной мутации все эритроциты больного являются серповидными и поэтому симптомы анемии проявляются с рождения ребенка, а болезнь характеризуется тяжелым течением.
При данном типе анемий разрушение эритроцитов происходит под действием иммунной системы организма.
Различают 4 типа иммунных гемолитических анемий:
- аутоиммунные;
- изоиммунные;
- гетероиммунные;
- трансиммунные.
При аутоиммунных анемиях собственный организм пациента вырабатывает антитела к нормальным эритроцитам крови вследствие сбоя в работе иммунной системы и нарушения распознавания лимфоцитами своих и чужих клеток.
Изоиммунные анемии развиваются при переливании пациенту крови несовместимой по АВ0 системе и резус-фактору или, иными словами, крови другой группы. В данном случае накануне перелитые эритроциты разрушаются клетками иммунной системы и антителами реципиента. Аналогичный иммунный конфликт развивается при положительном резус-факторе в крови плода и отрицательном – в крови беременной матери. Такая патология именуется гемолитической болезнью новорожденных детей.
Гетероиммунные анемии развиваются в случае появления на мембране эритроцита чужеродных антигенов, признаваемых иммунной системой пациента как чужеродные. Чужеродные антигены могут появиться на поверхности эритроцита в случае употребления некоторых медикаментов или после перенесенных острых вирусных инфекций.
Трансиммунные анемии развиваются у плода, когда в организме матери присутствуют антитела против эритроцитов (аутоиммунная анемия). В данном случае мишенью иммунной системы становятся как эритроциты матери, так и эритроциты плода, даже если не выявляется несовместимость по резус-фактору, как при гемолитической болезни новорожденных.
К данной группе заболеваний относят:
- маршевую гемоглобинурию;
- микроангиопатическую гемолитическую анемию;
- анемию при пересадке механических клапанов сердца.
Маршевая гемоглобинурия, исходя из названия, развивается при длительном маршировании. Форменные элементы крови, находящиеся в ступнях, при длительном регулярном сдавлении подошв подвергаются деформации и даже разрушаются. В результате в кровь выделяется большое количество несвязанного гемоглобина, который выделяется с мочой.
Микроангиопатическая гемолитическая анемия развивается из-за деформации и последующего разрушения эритроцитов при острых гломерулонефритах и синдроме диссеминированного внутрисосудистого свертывания. В первом случае по причине воспаления почечных канальцев и соответственно окружающих их капилляров просвет их сужается, а эритроциты деформируются при трении с их внутренней оболочкой. Во втором случае во всей кровеносной системе происходит молниеносная агрегация тромбоцитов, сопровождающаяся образованием множества фибриновых нитей, перекрывающих просвет сосудов. Часть эритроцитов сразу застревает в образовавшейся сети и образует множественные тромбы, а оставшаяся часть на высокой скорости проскальзывает через данную сеть, попутно деформируясь. В результате деформированные таким образом эритроциты, называющиеся «венценосными», какое-то время еще циркулируют в крови, а затем разрушаются самостоятельно или при прохождении через капилляры селезенки.
Анемия при пересадке механических клапанов сердца развивается при столкновении эритроцитов, двигающихся с высокой скоростью, с плотным пластиком или металлом, из которого состоит искусственный клапан сердца. Темпы разрушения зависят от скорости кровотока в области клапана. Гемолиз усиливается при совершении физической работы, эмоциональных переживаниях, резком повышении или снижении артериального давления и повышении температуры тела.
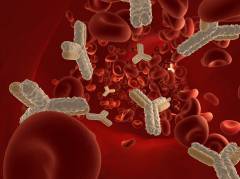
Таким образом, гемолитическая анемия может развиться по следующим причинам:
- попадание в кровь различных токсинов и ядов (ядохимикаты, пестициды, укусы змей и т. д.);
- механическое разрушение эритроцитов (во время многочасового хождения, после имплантации искусственного клапана сердца и др.);
- синдром диссеминированного внутрисосудистого свертывания;
- различные генетические аномалии строения эритроцитов;
- аутоиммунные болезни;
- паранеопластический синдром (перекрестное иммунное уничтожение эритроцитов вместе с опухолевыми клетками);
- осложнения после переливания донорской крови;
- заражение некоторыми инфекционными болезнями (малярия, токсоплазмоз);
- хронический гломерулонефрит;
- тяжелые гнойные инфекции, сопровождающиеся сепсисом;
- инфекционный гепатит B, реже С и D;
- беременность;
- авитаминозы и др.

Анемический синдром проявляется следующими симптомами:
- бледность кожных покровов и слизистых оболочек;
- головокружение;
- выраженная общая слабость;
- скорая утомляемость;
- одышка при обычной физической нагрузке;
- сердцебиение;
- частый пульс и др.
Гемолитический синдром проявляется следующими симптомами:
- желтушно-бледный окрас кожных покровов и слизистых оболочек;
- моча темно-коричневого, вишневого или алого цвета;
- увеличение размеров селезенки;
- болезненность в левом подреберьи и др.
Гемолиз эритроцитов бывает двух видов. Первый вид гемолиза называется внутриклеточным, то есть разрушение эритроцитов происходит в селезенке посредством поглощения дефектных эритроцитов лимфоцитами и фагоцитами. Второй вид гемолиза называется внутрисосудистым, то есть разрушение эритроцитов имеет место в кровеносном русле под действием циркулирующих в крови лимфоцитов, антител и комплемента. Определение вида гемолиза крайне важно, поскольку дает исследователю подсказку, в каком направлении далее продолжать поиски причины разрушения красных кровяных телец.
Подтверждение внутриклеточного гемолиза осуществляется при помощи следующих лабораторных показателей:
- гемоглобинемия – наличие свободного гемоглобина в крови вследствие активного разрушения эритроцитов;
- гемосидеринурия – наличие в моче гемосидерина – продукта окисления в почках избыточного гемоглобина;
- гемоглобинурия – наличие в моче неизмененного гемоглобина, признака крайне высокой скорости разрушения эритроцитов.
Подтверждение внутрисосудистого гемолиза осуществляется при помощи следующих лабораторных анализов:
- общий анализ крови – снижение количества эритроцитов и\или гемоглобина, увеличение количества ретикулоцитов;
- биохимический анализ крови – увеличение общего билирубина за счет непрямой фракции.
- мазок периферической крови – при различных способах окраски и фиксации мазка определяется большинство аномалии строения эритроцита.
При исключении гемолиза исследователь переключается на поиск иной причины анемии.
Причин развития гемолиза огромное множество, соответственно их поиск может занять непозволительно много времени. В таком случае необходимо максимально детально выяснить анамнез заболевания. Иными словами, требуется выяснить места, которые посещал пациент в последние полгода, где работал, в каких условиях жил, очередность появления симптомов заболевания, интенсивность их развития и многое другое. Такая информация может оказаться полезной для сужения круга поиска причин гемолиза. При отсутствии таковой информации осуществляется ряд анализов на определение субстрата наиболее частых заболеваний, приводящих к разрушению эритроцитов.
Анализами второго этапа диагностики являются:
- прямой и непрямой тест Кумбса;
- циркулирующие иммунные комплексы;
- осмотическая резистентность эритроцитов;
- исследование активности ферментов эритроцита (глюкоза-6-фосфатдегидрогназа (Г-6-ФДГ), пируваткиназа и др.);
- электрофорез гемоглобина;
- проба на серповидность эритроцитов;
- проба на тельца Гейнца;
- бактериологический посев крови;
- исследование «толстой капли» крови;
- миелограмма;
- проба Хема, проба Хартмана (сахарозная проба).
Прямой и непрямой тест Кумбса
Данные тесты осуществляются с целью подтверждения или исключения аутоиммунной гемолитической анемии. Циркулирующие иммунные комплексы косвенно свидетельствуют об аутоиммунной природе гемолиза.
Осмотическая резистентность эритроцитов
Снижение осмотической резистентности эритроцитов чаще развивается при врожденных формах гемолитических анемий, таких как сфероцитоз, овалоцитоз и акантоцитоз. При талассемии, напротив, наблюдается увеличение осмотической резистентности эритроцитов.
Исследование активности ферментов эритроцитов
С данной целью сначала осуществляют качественные анализы на наличие или отсутствие искомых ферментов, а затем прибегают к количественным анализам, осуществляемым при помощи ПЦР (полимеразной цепной реакции). Количественное определение ферментов эритроцитов позволяет выявить их снижение по отношению к нормальным значениям и диагностировать скрытые формы эритроцитарных ферментопатий.
Электрофорез гемоглобина
Исследование осуществляется с целью исключения как качественных, так и количественных гемоглобинопатий (талассемий и серповидноклеточной анемии).
Проба на серповидность эритроцитов
Сутью данного исследования является определение изменения формы эритроцитов по мере снижения парциального давления кислорода в крови. В случае если эритроциты принимают серповидную форму, то диагноз серповидноклеточной анемии считается подтвержденным.
Проба на тельца Гейнца
Целью данной пробы является обнаружение в мазке крови специальных включений, являющихся нерастворимым гемоглобином. Данная проба осуществляется для подтверждения такой ферментопатии как дефицит Г-6-ФДГ. Однако нужно помнить, что тельца Гейнца могут появиться в мазке крови при передозировке сульфаниламидов или анилиновых красителей. Определение данных образований осуществляется в темнопольном микроскопе или в обычном световом микроскопе при специальном окрашивании.
Бактериологический посев крови
Бак-посев проводится с целью определения видов циркулирующих в крови инфекционных агентов, которые могут взаимодействовать с эритроцитами и вызывать их разрушение прямым путем или посредством иммунных механизмов.
Исследование «толстой капли» крови
Данное исследование проводится с целью выявления возбудителей малярии, жизненный цикл которых тесно сопряжен с разрушением эритроцитов.
Миелограмма
Миелограмма является результатом пункции костного мозга. Данный параклинический метод позволяет выявить такие патологии как злокачественные заболевания крови, которые посредством перекрестной иммунной атаки при паранеопластическом синдроме разрушают и эритроциты. Помимо этого в пунктате костного мозга определяется разрастание эритроидного ростка, что свидетельствует о высоких темпах компенсаторной продукции эритроцитов в ответ на гемолиз.
Проба Хема. Проба Хартмана (сахарозная проба)
Обе пробы проводятся с целью определения длительности существования эритроцитов того или иного пациента. Для того чтобы ускорить процесс их разрушения, тестируемый образец крови помещают в слабый раствор кислоты или сахарозы, а затем оценивают процент разрушенных эритроцитов. Проба Хема считается положительной при разрушении более 5% эритроцитов. Проба Хартмана считается положительной, когда разрушается более 4% эритроцитов. Положительная проба свидетельствует о пароксизмальной ночной гемоглобинурии.
Помимо представленных лабораторных тестов для установления причины гемолитической анемии могут быть проведены другие дополнительные тесты и инструментальные исследования, назначаемые специалистом в области того заболевания, которое предположительно является причиной гемолиза.
Лечением первичных идиопатических (неясной причины) гемолитических анемий, а также вторичных гемолитических анемий вследствие заболеваний системы крови занимается врач-гематолог. Лечение вторичных гемолитических анемий по причине других заболеваний выпадает на долю того специалиста, в поле деятельности которого находится данное заболевание. Таким образом, анемию, вызванную малярией, будет лечить врач-инфекционист. Аутоиммунную анемию будет лечить врач-иммунолог или аллерголог. Анемию вследствие паранеопластического синдрома при злокачественной опухоли будет лечить онкохирург и т. д.
Основой лечения аутоиммунных болезней и, в частности, гемолитической анемии являются глюкокортикоидные гормоны. Они применяются длительное время – сначала для купирования обострения гемолиза, а затем в качестве поддерживающего лечения. Поскольку глюкокортикоиды обладают рядом побочных действий, то для их профилактики осуществляется вспомогательное лечение витаминами группы B и препаратами, снижающими кислотность желудочного сока.
Помимо снижения аутоиммунной активности большое внимание должно уделяться профилактике ДВС-синдрома (нарушение процесса свертываемости крови), в особенности при средней и высокой интенсивности гемолиза. При низкой эффективности глюкокортикоидной терапии препаратами последней линии лечения являются иммунодепрессанты.
| Медикамент | Механизм действия | Способ применения |
| Преднизолон | Является представителем глюкокортикоидных гормонов, обладающих наиболее выраженным противовоспалительным и иммуносупрессивным действием. | 1 – 2 мг\кг\сутки внутривенно, капельно. При выраженном гемолизе дозу препарата увеличивают до 150 мг\сутки. После нормализации показателей гемоглобина дозу медленно снижают до 15 – 20 мг\сутки и продолжают лечение еще 3 – 4 месяца. После этого дозу снижают по 5 мг каждые 2 – 3 дня до полной отмены препарата. |
| Гепарин | Является прямым антикоагулянтом короткого действия (4 – 6 часов). Данный препарат назначается для профилактики ДВС-синдрома, часто развивающегося при остром гемолизе. Применяется при нестабильном состоянии пациента для более совершенного контроля свертываемости. | 2500 – 5000 МЕ подкожно каждые 6 часов под контролем коагулограммы. |
| Надропарин | Является прямым антикоагулянтом длительного действия (24 – 48 часов). Назначается пациентам со стабильным состоянием для профилактики тромбоэмболических осложнений и ДВС. | 0,3 мл\сутки подкожно под контролем коагулограммы. |
| Пентоксифиллин | Периферический вазодилататор с умеренным антиагрегантным действием. Увеличивает поступление кислорода к периферическим тканям. | 400 – 600 мг\сутки в 2 – 3 приема внутрь в течение минимум 2 недель. Рекомендуемая длительность лечения 1 – 3 месяца. |
| Фолиевая кислота | Относится к группе витаминов. При аутоиммунной гемолитической анемии используется с целью восполнения его запасов в организме. | Лечение начинают с дозы 1 мг\сутки, а затем увеличивают ее до появления стойкого клинического эффекта. Максимальная суточная доза – 5 мг. |
| Витамин В12 | При хроническом гемолизе запасы витамина В12 постепенно истощаются, что приводит к увеличению диаметра эритроцита и снижению его пластических свойств. Во избежание данных осложнений осуществляется дополнительное назначение данного препарата. | 100 – 200 мкг\сутки внутримышечно. |
| Ранитидин | Назначается с целью снижения агрессивного действия преднизолона на слизистую желудка посредством снижения кислотности желудочного сока. | 300 мг\сутки в 1 – 2 приема внутрь. |
| Хлористый калий | Является внешним источником ионов калия, которые вымываются из организма в процессе лечения глюкокортикоидами. | 2 – 3 г в сутки под ежедневным контролем ионограммы. |
| Циклоспорин А | Препарат из группы иммунодепрессантов. Применяется в качестве последней линии лечения при неэффективности глюкокортикоидов и спленэктомии. | 3 мг\кг\сутки внутривенно, капельно. При выраженных побочных эффектах осуществляется отмена препарата с переходом к другому иммунодепрессанту. |
| Азатиоприн | Иммунодепрессант. | 100 – 200 мг\сутки в течение 2 – 3 недель. |
| Циклофосфамид | Иммунодепрессант. | 100 – 200 мг\сутки в течение 2 – 3 недель. |
| Винкристин | Иммунодепрессант. | 1 – 2 мг\неделю капельно в течение 3 – 4 недель. |
При дефиците Г-6-ФДГ рекомендуется избегать применения препаратов, входящих в группу риска. Тем не менее, при развитии острого гемолиза на фоне данного заболевания осуществляется немедленная отмена препарата, вызвавшего разрушение эритроцитов, и при острой необходимости переливается отмытая донорская эритроцитарная масса.
При тяжелых формах серповидноклеточной анемии или талассемии, требующих частых переливаний крови, назначается Дефероксамин – препарат, связывающий избыток железа и выводящий его из организма. Таким образом осуществляется профилактика гемохроматоза. Еще одним выходом для пациентов с тяжелой формой гемоглобинопатий является пересадка костного мозга от совместимого донора. При успешности данной процедуры существует вероятность значительного улучшения общего состояния пациента, вплоть до полного выздоровления.
В случае, когда гемолиз выступает в качестве осложнения определенного системного заболевания и является вторичным, все лечебные мероприятия должны быть направлены на излечение заболевания, ставшего причиной разрушения красных кровяных телец. После излечения первичного заболевания прекращается и разрушение эритроцитов.
При гемолитической анемии наиболее практикующейся операцией является спленэктомия (удаление селезенки). Данная операция показана при первом рецидиве гемолиза после проведенного лечения глюкокортикоидными гормонами аутоиммунной гемолитической анемии. Помимо этого спленэктомия является предпочтительным методом лечения таких наследственных форм гемолитических анемий как сфероцитоз, акантоцитоз, овалоцитоз. Оптимальным возрастом, при котором рекомендуется удаление селезенки в случае вышеперечисленных заболеваний, является возраст 4 – 5 лет, однако в индивидуальных случаях операция может быть проведена и в более раннем возрасте.
Талассемия и серповидноклеточная анемия длительное время может лечиться посредством переливания донорских отмытых эритроцитов, однако при наличии признаков гиперспленизма, сопровождающегося снижением количества и остальных клеточных элементов крови, операция по удалению селезенки является оправданной.

Первичная профилактика идиопатических аутоиммунных анемий не производится за отсутствием причин таковых.
Первичная профилактика вторичных аутоиммунных анемий заключается в:
- избегании сопутствующих инфекций;
- избегании нахождения в среде с низкой температурой при анемии с холодовыми антителами и с высокой температурой при анемии с тепловыми антителами;
- избегании укусов змей и нахождении в среде с высоким содержанием токсинов и солей тяжелых металлов;
- избегании употребления медикаментов из расположенного ниже списка при дефиците фермента Г-6-ФДГ.
При дефиците Г-6-ФДГ гемолиз вызывают следующие медикаменты:
- антималярийные средства — примахин, памахин, пентахин;
- обезболивающие и жаропонижающие — ацетилсалициловая кислота (аспирин);
- сульфаниламиды — сульфапиридин, сульфаметоксазол, сульфацетамид, дапсон;
- другие антибактериальные препараты — хлорамфеникол, налидиксовая кислота, ципрофлоксацин, нитрофураны;
- противотуберкулезные средства — этамбутол, изониазид, рифампицин;
- препараты других групп — пробенецид, метиленовый синий, аскорбиновая кислота, аналоги витамина К.
Вторичная профилактика заключается в своевременной диагностике и соответствующем лечении инфекционных заболеваний, способных вызвать обострение гемолитических анемий.
источник
 Неполные тепловые агглютинины (в основном, класс G – IgG, изредка – класс А), которые садятся на поверхность эритроцитарной клетки и начинают самую активную деятельность при температуре 37°С. Как правило, при таком взаимодействии эритроциты не гибнут в кровотоке, а направляются «умирать» в селезенку;
Неполные тепловые агглютинины (в основном, класс G – IgG, изредка – класс А), которые садятся на поверхность эритроцитарной клетки и начинают самую активную деятельность при температуре 37°С. Как правило, при таком взаимодействии эритроциты не гибнут в кровотоке, а направляются «умирать» в селезенку;