Анемия — это довольно серьезное заболевание, которое, если его не лечить правильно, может привести к развитию кислородной недостаточности или гипоксии, в результате чего страдают все органы и ткани.
В роли основных этиопатогенетических манифистаторов анемии может выступать кровопотеря, недостаточное содержание в организме человека веществ, необходимых для осуществления процессов кровеобразования, токсическое влияние на костный мозг, нарушение гуморальной регуляции эритропоэза, что наблюдается при гипотиреоидизме, гипоадренализме, гипопитуитаризме, гипогонадизме, опухолевом поражении структур костного мозга, повышении активности процессов разрушения эритроцитарных кровяных клеток.
Эритроцитарные кровяные клетки являются главными «транспортировщиками» газов, а именно кислорода и углекислоты благодаря наличию гемоглобина в их составе. В связи с этим, даже минимальный дефицит кровяных клеток эритроцитарного типа, а соответственно и гемоглобина провоцирует развитие гипоксического поражения чувствительных к дефициту кислорода структур человеческого организма, а также избыточному накоплению недоокисленных веществ, нарушающих нормальную жизнедеятельность органов. Степень выраженности клинических проявлений, сопутствующих гипоксии при анемии напрямую зависит от величины и скорости снижения показателей красной крови, а также компенсаторных способностей организма.
В первую очередь при анемии страдают структуры центральной нервной системы, а именно кора головного мозга. Проявлениями анемии в отношении влияния на головной мозг является головная боль диффузного характера малой интенсивности, снижение когнитивных способностей, постоянная сонливость и одновременно с тем нарушение глубокого ночного сна, нарушение координационных способностей и постоянное ощущение шума в ушах.
Анемия тяжелой степени любой этиопатогенетической формы проявляется грубой неврологической симптоматикой и в первую очередь развитием нарушения сознания различной степени интенсивности (от обморока до анемической комы).
В отношении гипоксического влияния анемии на миокард наблюдается прогрессирующее развитие дистрофических изменений, проявляющихся в виде ощущения перебоев в работе сердца, прогрессирующей одышки, склонности к понижению показателей артериального давления, неспецифического болевого синдрома в проекции расположения сердца.
Хроническая анемия при прогрессирующем течении сопровождается развитием кардиосклероза, провоцирующего нарушения со стороны сократительных возможностей миокарда, что становится причиной формирования типичного клинического симптомокомплекса недостаточности кровообращения тяжелой стадии.
Рассмотрим прогрессирование заболевания более подробно.
Каждая анемия в своем развитии проходит определенные стадии:
- Предлатентный дефицит железа — истощение тканевых запасов железа, при этом уровень гемоглобина в периферической крови остается в пределах возрастной нормы; несмотря на то что содержание железа в тканях уменьшается, его усвоение из пищевых продуктов не увеличивается, а, наоборот, уменьшается, что объясняется снижением активности кишечных ферментов.
- Латентный (скрытый) дефицит железа — уменьшаются не только тканевые запасы железа, но и депонированные, а также транспортное его количество — снижается содержание железа в сыворотке крови.
- Заключительная стадия дефицита железа в организме, характеризующаяся снижением уровня гемоглобина, зачастую сочетающаяся с уменьшением количества эритроцитов в единице объема, собственно и есть железодефицитная анемия.
Содержание железа в пищевых продуктах (в мг на 100 г съедобной части)
| Какао-порошок | 14,8 | Яйцо куриное | 2,5 | Горох | 6,8 | Картофель | 0,9 |
| Крупа гречневая | 6,65 | Куры | 1,6 | Крупа «Геркулес» | 3,63 | Перец сладкий | 0,6 |
| Хлеб ржаной | 3,9 | Свинина жирная | 1,94 | Макароны, в.с. | 1,58 | Яблоки | 2,2 |
| Мясо кролика | 3,3 | Сыры твердые | 1,2 | Крупа ячневая | 1,81 | Орехи грецкие | 2,3 |
| Говядина | 2,9 | Рыба | 2,45 | Крупа пшенная | 2,7 | Клубника | 1,2 |
| Почки говяжьи | 5,95 | Печень трески | 1,9 | Крупа рисовая | 1,02 | Арбуз | 1,0 |
| Колбаса вареная | 2,1 | Творог | 0,46 | Булка сдобная | 1,97 | Морковь | 0,7 |
| Печень говяжья | 6,9 | Молоко коровье | 0,2 | Крупа манная | 0,96 | Помидоры | 0,9 |
ДИАГНОСТИКА
Для диагностики В12-дефицитной анемии необходимо проведение дополнительных исследований:
- Определение уровня витамина В12 в крови.
- Аспирационная биопсия костного мозга (при отсутствии возможности определения витамина В12 в крови, либо при отсутствии ответа на лечение в течение 5-8 дней).
ОСНОВНЫЕ ПРИНЦИПЫ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ
Подростки от 12 до 16 лет
Через 4 недели от начала лечения необходимо провести повторное определение уровней гемоглобина и гематокрита. При положительном результате (увеличение уровня гемоглобина на 10 г/л или гематокрита на 3%) прием препаратов железа необходимо продолжать еще 2 месяца. При отсутствии эффекта от лечения больной должен быть направлен к гематологу. После завершения курса лечения и нормализации уровня гемоглобина рекомендовано продолжать прием препаратов железа с профилактической целью 1 раз в неделю в течение 6 месяцев. Доза элементарного железа для детей в возрасте от 6 до 12 месяцев составляет 3 мг/кг, от 12 до 18 месяцев – 60 мг, от 2 до 12 лет – 60 мг, для подростков – 120 мг.
Девочкам подросткового возраста рекомендуется лечение, аналогичное лечению небеременных женщин фертильного возраста.
Медикаментозная профилактика ЖДА проводится у недоношенных детей и детей, родившихся с малым весом, путем назначения элементарного железа в дозе 2 мг/кг веса в сутки с первого месяца жизни до 12-ти месячного возраста (уровень доказательности А). Препараты железа применяются в виде сиропа или других форм.
Не медикаментозная профилактика ЖДА заключается в рекомендациях по питанию ребенка. Необходимо поощрять матерей к грудному вскармливанию. Детям до 6 месячного возраста необходимо проведение только грудного вскармливания. Кроме того, следует проводить коррекцию ЖДА у матери (уровень доказательности В).
Детям, находящимся на грудном вскармливании, с 6 месяцев, а без грудного вскармливания – с 4–6 месячного возраста, рекомендовано вводить в прикорм продукты питания с высоким содержанием железа (уровень доказательности В).
Рекомендовано также добавлять в рацион питания продукты с достаточным содержанием аскорбиновой кислоты, которая способствует лучшему всасыванию железа.
1. Причиной развития ЖДА может быть:
Б. Прием противосудорожных препаратов.
В. Отсутствие внутреннего фактора Кастла.
Г. Инвазия широким лентецом.
2. Лечение ЖДА обычно проводится:
А. Препаратами железа для парентерального
Б. Препаратами железа для перорального
Д. Витаминами группы В + препаратами железа для
3. Выберите вариант лечения для больной ЖДА среднетяжелого течения:
А. Железа сульфат 240 мг 2 раза в сутки внутрь +
диета с достаточным содержанием мяса, овощей
Б. Феррум-лек в/в + витамины В6, В1, В12.
В. Железа сульфат 60 мг в сутки + полноценное пи-
Г. Железа сульфат 120 мг 2 раза в сутки + полно-
Д. Диета с достаточным содержанием мяса и вита-
4. Какое из исследований не надо проводить у больной ЖДА, получающей препараты железа?
А. Определение цветного показателя.
Б. Исследование уровня сывороточного железа.
В. Определение содержания гемоглобина в крови.
5. Расчет лечебной дозы железа должен проводиться по содержанию в лекарственных препаратах:
6. Препараты железа при приеме внутрь рекомендовано запивать:
7. Какие изменения периферической крови характерны для ЖДА?
А. Гипохромная микроцитарная.
Б. Гиперхромная макроцитарная.
В. Нормохромная макроцитарная.
Г. Гиперхромная микроцетарная.
Д. Нормохромная микроцетарная.
8. Для диагноза ЖДА и анемий, связанных с нарушением синтеза гема, основным дифференциально-диагностическим признаком является:
Д. Содержание ферритина в сыворотке крови.
1. К врачу обратилась женщина в возрасте 48 лет с жалобами на общую слабость, головную боль, головокружение, сердцебиение и одышку, возникающую при незначительной физической нагрузке. Из анамнеза: в течение 3 лет наблюдается у гинеколога по поводу фибромиомы матки. Страдает частыми маточными кровотечениями. При осмотре кожные покровы и видимые слизистые оболочки бледные. Кожа сухая, трещины в углах рта, ногти вогнутые и испещрены поперечными складками. При аускультации сердца и сосудов выслушивается систолический шум на верхушке и «шум волчка» на яремной вене справа. Анализ крови: концентрация Нв– 85 г/л, ЦП 0,7; гипохромия эритроцитов; уровень ферритина сыворотки – 10 мкг/л, уровень билирубина – 13.24 мкмоль/л.
А. ЖДА средней степени тяжести.
В. Фолиеводефицитная анемия.
2. К семейному врачу обратилась молодая женщина с жалобами на желание постоянно есть мел (съедает 50-70 гр в сутки), на общую слабость, одышку при физической нагрузке и снижение работоспособности. Вышеописанные жалобы наблюдаются в течение 3 лет. В анамнезе — 8 беременностей. Из них трое родов и пять абортов. Последние роды — 2 года назад. В рационе питания больной преобладают хлеб, молочные продукты и овощи. Мясо употребляет в пищу 1-2 раза в неделю не более 50 гр/сут. Бобовые (горох и фасоль) в семье не едят.Объективно: больная пониженного питания, кожные покровы бледные, сухие; волосы тусклые, ломкие; трещины в углах рта. Конъюнктива глаз бледная, ладони желтоватого цвета, бледные. При аускультации сердца на верхушке выслушивается систолический шум. В анализе крови: Нв 80 г/л, ЦП 0,6, гипохромия эритроцитов, анизоцитоз, пойкилоцитоз. Уровень ферритина сыворотки 8,0 мкг/л.
Отметьте правильный вариант лечения:
А. Диета с достаточным содержанием фруктов, овощей.
Б. Сульфат железа 120 мг 2 раза в сутки внутрь + диета с
достаточным содержанием мяса и мясных продуктов.
В. Препараты железа, содержащие 120 мг элементарного железа, 2 р/сут внутрь + полноценная диета с достаточным содержанием мяса, овощей и фруктов.
Г. Сульфат железа 100 мг р/сут + фолиевая кислота внутрь.
Д. Витамин В12 внутримышечно + препараты железа, содержащие 60 мг элементарного железа, 2 раза в сутки внутрь.
1. Причиной развития ЖДА может быть:
Б. Прием противосудорожных препаратов.
В. Отсутствие внутреннего фактора Кастла.
Лечение любого вида тяжелой анемии зависит от факторов, ее вызвавших. Наилучших результатов можно добиться, если ввести больному отдельные недостающие вещества. Например, при пернициозной анемии делают инъекции витамина В12, при железодефицитной – прописывают железосодержащие препараты и так далее.
1. Дисэритропоэтические анемии
В основе развития железодефицитных анемий лежат хронические кровопотери (желудочные, маточные), недостаточное поступление железа с пищей, особенно при повышенной потребности организма в железе (у детей первых лет жизни, …
Диагноз заболевания подтверждает выявление антител Доната—Ландштейнера. Методика включает в себя инкубацию смешанной с нормальными эритроцитами группы О (I) сыворотки больного в течение 30 мин. при 4°С и при 37°С. При проведении контрольной пробы инактивированную нагреванием сыворотку больного надо инкубировать со здоровыми эритроцитами сначала при 37°С, затем при 4°С.
Средством выбора при лечении аутоиммунной гемолитической анемии являются глюкокортикоидные гормоны, которыепрактически всегда прекращают или уменьшают гемолиз. Необходимым условием гормональной терапии является достаточная дозировка и длительность курса лечения. В острой фазе преднизолон назначают в больших дозах — 60-80 мг/сут (из расчета 1 мг/кг массы) или эквивалентные дозы других глюкокортикоидов. После наступления ремиссии доза преднизолона постепенно уменьшается. Поддерживающая доза составляет 5-10 мг/сут. Лечение проводят на протяжении 2-3 месяцев, до исчезновения всех признаков гемолиза и негативации пробы Кумбса. У некоторых больных эффект оказывают иммунодепрессанты (6-мер-каптопурин, азатиоприн, хлорамбуцил), а также противомалярийные препараты (делагил, резохин). Особенно выраженный эффект иммунодепрессанты оказывают при аутоиммунной гемолитической анемии, связанной с Холодовыми агглютининами. Доза 6-меркаптопурина и азатиоприна составляет 100-150 мг/сут, хлорамбуцил назначают в дозе 10-15 мг. При рецидивирующих формах заболевания и отсутствии эффекта от применения глюкокортикоидов и иммунодепрессантов показана спленэктомия. Гемотрансфузии у больных аутоиммунной гемолитической анемией следует проводить только по жизненным показаниям (резкое падение гемоглобина, сопорозное состояние). Рекомендуется специально подбирать доноров, чьи эритроциты дают отрицательную пробу Кумбса.
Болезнь Маркиафавы—Микели. Гемолитическая анемия с постоянной гемосидеринурией и пароксизмальной ночной гемоглобинурией, обусловленная изменением структуры мембраны эритроцитов (болезнь Маркиафавы—Микели) представляет собой приобретенную гемолитическую анемию с постоянным внутрисосудистым гемолизом и выделением с мочой гемосидерина.
Заболевание возникает в результате соматической мутации эритроидных клеток, вследствие чего вырабатывается патологический клон эритроцитов с повышенной чувствительностью к различным гемолитическим агентам. Интенсивность гемолиза повышается при развитии ацидоза, а также под влиянием пропердина, комплемента и тромбина. Морфологической особенностью заболевания является гемосидероз почек. Гемосидероза в других органах не наблюдается. В печени отмечают дистрофические и некробиотические изменения, связанные с венозными тромбозами и анемией. Селезенка увеличена, за счет множественных сосудистых тромбозов и развития периваскулярного склероза.
Больные предъявляют жалобы на слабость, головокружения, одышку, сердцебиения, боли в животе различной локализации и интенсивности. Все это связано с гемолитическим кризом и капиллярными тромбозами мезентериальных сосудов. Нередко бывают тромбозы периферических сосудов, чаще вен верхних и нижних конечностей, а также других сосудов (мозговых, селезеночных, почечных). В период криза у больных может повышаться температура. В связи с гемоглобинурией и гемосидеринемией моча окрашена в черный цвет. Нередко гемоглобинурия возникает в ночное время, что объясняется физиологическим ацидозом во время сна, активацией пропердина и других факторов, усиливающих гемолиз. Гемоглобинурия не является обязательным симптомом заболевания. При объективном исследовании отмечают бледность кожи с небольшим желтушным оттенком, умеренное увеличение селезенки и печени.
Анемия в течение длительного времени носит нормохромный характер. При значительных потерях железа цветовой показатель становится ниже нормы. Количество ретикулоцитов повышено незначительно. Часто наблюдается лейкопения и тромбо-цитопения. В костном мозге — гиперплазия эритроидного ростка нередко сопровождается угнетением гранулоцитарного и мегакариоцитарного ростков. Следует дифференцировать болезнь Маркиафавы—Микели с гемолитической анемией, резистентной к лечению, сопровождающейся лейко- и тромбоцитопенией без значительного увеличения селезенки. Важное диагностическое значение имеет микроскопия осадка на гемосидеринурию. Среди лабораторных тестов в диагностике болезни Маркиафавы—Микели важны кислотный тест Хэма (гемолиз эритроцитов больного в подкисленной сыворотке здорового человека), тест Кросби (усиление гемолиза под влиянием тромбина) и сахарозный тест (гемолиз эритроцитов больных в свежей донорской крови при добавлении сахарозы).
Эффективным методом терапии болезни Маркиафавы—Микели является трансфузия трижды отмытых физиологическим раствором хлорида натрия эритроцитов. Такие эритроциты переливают раз в 4-5 дней, в количестве 200-400 мл не позднее 48 ч. после взятия. Для профилактики и лечения тромбозов показана терапия антикоагулянтами. В период гемолитического криза некоторое уменьшение гемолиза достигается при введении плазмозаменителей, в частности декстрана или полиглюкина в количестве 500-1000 мл. Глюкокортикоиды и препараты железа при болезни Маркиафавы—Микели противопоказаны.
Лекарственная иммунная гемолитическая анемия составляет около 20% от всех приобретенных иммунных гемолитических анемий. Важную роль в патогенезе заболевания играют:
Первый и наиболее важный этап лечения лекарственной иммунной гемолитической анемии — отмена препарата, вызвавшего ее. При гемолизе, вызванном иммунными комплексами, после этого быстро наступает выздоровление. При гемолизе,вызванном аутоантителами, выздоровление более медленное (обычно несколько недель). Проба Кумбса может оставаться положительной в течение 1-2 лет.
Гемолитическая болезнь новорожденных обычно развивается при несовместимости матери и плода по Rh-фактору и системе АВО, гораздо реже — по антигенам систем Келл, Даффи и MNSs. Сюда относятся изоиммунные гемолитические анемии, т.е. заболевания, возникающие при воздействии изоиммунных антител (гемолитические анемии, связанные с резус-несовместимостью или несовместимостью по группе АВО между матерью и плодом) и посттрансфузионные анемии, обусловленные несовместимостью по групповой или резус-принадлежности.
Гемолитическая болезнь новорожденных, вызванная несовместимостью по антигенам системы Rh. Выработка антител к антигенам системы Rh, в отличие от антител к антигенам системы АВО, происходит только при попадании этого антигена в кровь матери. При нормально протекающей беременности количество эритроцитов плода, проникающих в кровь матери, слишком мало, и иммунизации не происходит. Достаточное для иммунизации количество крови плода может попасть в кровь матери в третьем периоде родов. При первой беременности гемолитическая болезнь новорожденных, вызванная несовместимостью по антигенам системы Rh, возникает только в тех случаях, если матери раньше переливали кровь, несовместимую по антигенам системы Rh, или мать была иммунизирована при амниоцентезе. В отличие от этого, при несовместимости по антигенам системы АВО гемолитическая болезнь новорожденных может возникнуть даже во время первой беременности, потому что антитела к этим антигенам постоянно присутствуют в крови матери. Чаще всего при гемолитической болезни новорожденных, обусловленной несовместимостью по антигенам системы Rh, вырабатываются антитела к D-антигену. Этот антиген отсутствует примерно у 15% белых и 7% негров.
У плода развивается гемолитическая анемия, которая в тяжелых случаях приводит к сердечной недостаточности, водянке и гибели. Гипербилирубинемии у плода не возникает, так как билирубин свободно проникает через плаценту и попадает в кровь матери. У новорожденного, напротив, наибольшую опасность представляет гипербилирубинемия, поскольку она может привести к билирубиновой энцефалопатии. Иногда наблюдается ге-патоспленомегалия. Дифференциальную диагностику проводят с гепатитом, инфекциями, болезнями обмена веществ и геморрагической болезнью новорожденных.
На ранних сроках беременности определяют групповую (по системам АВО и Rh) принадлежность крови беременной и исследуют ее сыворотку на антитела к редким антигенам эритроцитов. Если у матери Rh — отрицательный, определяют Rh-принадлежность отца ребенка. Во время беременности регулярно определяют титр антирезусных антител. При появлении анти-резусных антител оценивают интенсивность гемолиза. Для этого проводят спектрофотометрический анализ околоплодных вод, полученных при амниоцентезе. При несовместимости по антигенам системы Rh сразу после рождения определяют уровни гемоглобина и билирубина в пуповинной крови. Проводят прямую пробу Кумбса с эритроцитами новорожденного. При положительной пробе определяют, к каким эритроцитарным антигенам направлены антитела. Если в материнской крови антитела к этим антигенам отсутствуют, выясняют, почему прямая проба Кумбса положительна.
Интенсивное раннее лечение позволяет снизить риск осложнений. Лечение надо начинать во внутриутробном периоде. Если титр антирезусных антител у матери превышает 1:8, проводят амниоцентез. Для косвенного определения уровня билирубина и оценки тяжести гемолиза измеряют оптическую плотность околоплодных вод при длине волны 450 нм. Высокая оптическая плотность околоплодных вод в середине и конце беременности — свидетельство тяжелого гемолиза у плода. В этом случае необходимо провести общий анализ крови плода. Ее получают при кордоцентезе. Снижение гематокрита до 18% и менее служит показанием для внутриутробного переливания эритроцитарной массы Rh-отрицательной крови группы 0 (I). При необходимости переливание эритроцитарной массы повторяют каждые 2-3 недели. Повторные переливания эритроцитарной массы могут частично или полностью подавить эритропоэз у плода. Если развитие плода соответствует гестационному возрасту, на 33-36-й неделе беременности проводят кесарево сечение. Сразу после рождения ребенка определяют его группу крови и проводят прямую пробу Кумбса. После внутриутробного переливания эритроцитарной массы кровь новорожденного может стать Rh-отрицательной. Если прямая проба Кумбса у новорожденного положительна, может потребоваться обменное переливание крови. Лечение новорожденного ребенка: при гипербилирубинемии применяют светолечение и обменное переливание крови. Для светолечения используют синий свет, который способствует превращению билирубина в водорастворимые продукты. Светолечение используют в дополнение к обменному переливанию крови — до и после него. Светолечение не должно заменять диагностических мероприятий, направленных на выяснение причин желтухи. Во время светолечения необходимо регулярно определять уровень билирбина в сыворотке, поскольку интенсивность желтухи у новорожденных не соответствует тяжести гемолиза. Чтобы предупредить повреждение сетчатки во время светолечения, глаза ребенка закрывают повязкой. При анемии (уровень гемоглобина ниже 70-100 г/л) может потребоваться переливание эритроцитарной массы. Эритроциты, покрытые антирезусными антителами, иногда разрушаются медленно, что может привести к анемии в отсутствие гипербилирубинемии через 3-6 недель после рождения.
Гемолитическая болезнь новорожденных, вызванная несовместимостью по антигенам системы АВО, обычно встречается у детей с группой крови А или В, рожденных матерями с группой крови 0 (I). В сыворотке матери с группой крови 0 (I) присутствуют изогемагглютинины к эритроцитарным антигенам А и В. Предсказать развитие гемолитической болезни новорожденного по титру этих антител у матери нельзя.
Гемолитическая болезнь может возникнуть даже у ребенка, рожденного от первой беременности. У доношенных новорожденных тяжелая анемия и водянка встречаются редко. Иногда в первые сутки жизни появляется желтуха, однако гемолиз выражен значительно слабее, чем при несовместимости по антигенам системы Rh.
Дифференциальная диагностика заболевания обосновывается исключением других причин гипербилирубинемии и обнаружением в мазке крови новорожденных сфероцитов, а иногда — фрагментированных эритроцитов.
Гемолитическую болезнь новорожденных, вызванную несовместимостью по антигенам системы АВО, бывает трудно отличить от наследственного микросфероцитоза. Прямая проба Кумбса с эритроцитами новорожденного обычно отрицательна или слабо положительна, поскольку они несут незначительное количество антигенов А и В, а чувствительность пробы невысока. Антитела, смытые с эритроцитов новорожденного, связываются с эритроцитами взрослых с группами крови А, В и АВ.
Лечение направлено на снижение гипербилирубинемии. Светолечение снижает потребность в кровозаместительной терапии, которую в настоящее время проводят лишь у 1 из 3000 новорожденных с гемолитической болезнью, вызванной несовместимостью по антигенам системы АВО. Если все же необходимо переливание крови, используют эритроцитарную массу группы 0 (I) с низким титром антител к антигенам А и В.
Эритробластоз — гемолитическая болезнь новорожденных может возникнуть при беременности резус-отрицательной матери резус-положительным плодом, когда в организме матери начинают вырабатываться антитела, вызывающие агглютинацию эритроцитов плода. Особую опасность в этом отношении представляют повторные беременности, когда в крови матери уже есть антитела после предшествовавших беременностей.
Эта группа анемий объединяет гемолитические состояния, при которых полноценные в морфофункциональном отношении эритроциты разрушаются вследствие гиперреактивности РЭС или под действием гемолитических (фенилгидразий, свинец, бензол, мышьяковистый водород, анилиновые красители, змеиный и грибной яды и др.), бактериальных (токсины гемолитического стрептококка, стафилококка и др.), паразитарных (малярия) и других факторов. Патогенез этих анемий различен: разрушение мембраны эритроцитов, истощение их ферментных систем и т. д.
Гиперспленизм, застойная спленомегалия — состояние, при котором происходит увеличение селезенки с увеличением ее фагоцитарной функции. При этом наблюдается панцитопения, а секвестрация эритроцитов обусловлена механическим «эффектом сита». Объем плазмы увеличивается — гемоделюция. Выработка селезенкой антител усугубляет ситуацию за счет аутоиммунного фактора.
Степень анемии находится в прямой зависимости от размеров селезенки: увеличение селезенки на 2 см за край реберной дуги примерно соответствует уменьшению количества гемоглобина на 1 г. Величина гематокрита соответствует величине гемодилюции. Специфические изменения морфологии эритроцитов в мазках периферической крови отсутствуют. Время жизни эритроцитов укорочено.
Терапия направлена на основное заболевание, вызвавшее гиперспленизм. Спленэктомия, как правило, не показана.
Анемии как следствие механического повреждения эритроцитов. При избыточной деформации или под воздействием сил турбулентности в мазках периферической крови появляются фрагменты эритроцитов (шизоциты, шлемовидные клетки), которые и являются основным критерием диагноза анемии. Причина разрушения эритроцитов может находиться вне сосудов (маршевая гемоглобинурия), в сердце (обызвествление и стеноз аортального клапана или дефекты его протеза), в артериолах (злокачественная гипертония, злокачественная опухоль) и внутри сосудов (диссеминированное внутрисосудистое свертывание). Иногда гемолиз осложняется железодефицитной анемией в результате хронической гемосидеринурии. Терапия направлена на основное заболевания, показано применение препаратов железа.
Гемолиз, вызванный действием бактериальных гемолизинов. Гемолиз эритроцитов может быть связан с цитотоксичностью экстрацеллюлярных бактериальных гемолизинов, например, стрептококков, стафилококков, Haemophilus ducreyi или Clostridium perfringens.
Эти экзотоксины, действуя непосредственно на клеточную мембрану, вызывают лизис эритроцитов, тромбоцитов и макрофагов. Например, гемолизин Clostridium perfringens, термолабильный белок, гемолитическая и летальная активность которого возрастает после обработки цистеином и столь же резко утрачивается под действием кислорода, лизирует эритроциты в сосудистом русле. Внутривенное ведение 10-18 мкг гемолизина кроликам приводит к их гибели в течение от 2 до 24 часов. Клиническая картина заболеваний в основном определяется характером инфекционного процесса. Общими симптомами являются слабость, вялость, плохой аппетит, температурная реакция, бледность кожи и слизистых оболочек. В мазках крови — признаки нормо- или гипохромной анемии, анизоцитоз; количество ретикулоцитов не увеличено. Картина костного мозга непатогномонична. Иногда отмечаются редукция эритроидного ростка, задержка созревания клеток эритрона. Уровень железа в сыворотке снижен. Развивающаяся при этом анемия носит симптоматический характер и прекращается при эффективной антибактериальной терапии. При гипохромии применяют препараты железа. Прогноз заболевания после ликвидации инфекционного процесса в большинстве случаев благоприятный.
Анемии, связанные с воздействием прямых гемолизинов и других повреждающих факторов. Причиной острого массивного внутрисосудисгого разрушения эритроцитов с выведением гемоглобина с мочой могут быть различные облигатные и факультативные факторы: отравление уксусной эссенцией, попадание в кровь змеиного, грибного, рыбного ядов. Для клинической картины характерны резкая бледность кожных покровов без выраженной желтухи. Селезенка, как правило, не увеличивается. Отмечается умеренная гепатомегалия. Моча темной окраски, цвета черного пива или крепкого раствора калия перманганата. Умеренная билирубинемия за счет непрямой фракции, положительные проба Хэма и сахарозный тест, гиперсидеремия. В мазках крови признаки выраженной анемии, ретикулоцитоз, иногда лейкемоидная реакция; Течение острое. Различают тяжелую, средней тяжести и легкую формы заболевания.
Диагноз основывается на клинико-гематологической картине и характерной окраске мочи. Прогноз чаще благоприятный, но возможны рецидивы.
При терапии применяют кортикостероидные гормоны (преднизолон до 1,5-2,0 мг/кг), анаболические стероиды, трансфузии отмытых эритроцитов. Препараты железа, витамин В12 и переливание цельной крови противопоказаны. Спленэктомия неэффективна.
источник
Сайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна!
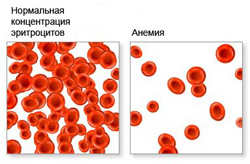
Эритроциты формируются в красном костном мозге из белковых фракций и небелковых компонентов под воздействием эритропоэтина (синтезируется почками). Эритроциты в течение трех дней обеспечивают транспорт, главным образом, кислорода и углекислого газа, а также питательных веществ и продуктов метаболизма от клеток и тканей. Срок жизни эритроцита сто двадцать дней, после чего он разрушается. Старые эритроциты накапливаются в селезенке, где утилизируются небелковые фракции, а белковые поступают в красный костный мозг, участвуя в синтезе новых эритроцитов.
Вся полость эритроцита наполнена белком, гемоглобином, в состав которого входит железо. Гемоглобин придает эритроциту красную окраску, а также помогает ему переносить кислород и углекислый газ. Его работа начинается в легких, куда эритроциты поступают с током крови. Молекулы гемоглобина захватывают кислород, после чего обогащенные кислородом эритроциты направляются сначала по крупным сосудам, а затем и по мелким капиллярам к каждому органу, отдавая клеткам и тканям необходимый для жизни и нормальной деятельности кислород.
Анемия ослабляет способность организма к газовому обмену, за счет сокращения числа эритроцитов нарушается транспортировка кислорода и углекислого газа. Вследствие этого у человека могут наблюдаться такие признаки анемии как чувство постоянной усталости, упадок сил, сонливость, а также повышенная раздражительность.
Анемия является проявлением основного заболевания и не является самостоятельным диагнозом. Многие болезни, включая инфекционные заболевания, доброкачественные или злокачественные опухоли могут быть связаны с анемией. Именно поэтому анемия является важным признаком, который требует проведения необходимых исследований для выявления основной причины, которая привела к ее развитию.
Тяжелые формы анемии вследствие тканевой гипоксии могут привести к серьезным осложнениям, таким как шоковые состояния (например, геморрагический шок), гипотония, коронарная или легочная недостаточность.
- по механизму развития;
- по степени тяжести;
- по цветному показателю;
- по морфологическому признаку;
- по способности костного мозга к регенерации.
| По патогенезу анемия может развиться вследствие кровопотери, нарушения образования эритроцитов или из-за их выраженного разрушения. По механизму развития выделяют:
|
- потеря крови (острые или хронические кровотечения);
- повышенное разрушение эритроцитов (гемолиз);
- уменьшенное производство эритроцитов.
Также следует заметить, что в зависимости от вида анемии причины ее возникновения могут отличаться.
Факторы, влияющие на развитие анемии
- гемоглобинопатии (изменение строения гемоглобина наблюдается при талассемии, серповидноклеточной анемии);
- анемия Фанкони (развивается вследствие имеющегося дефекта в кластере белков, которые отвечают за восстановление ДНК);
- ферментативные дефекты в эритроцитах;
- дефекты цитоскелета (клеточный каркас, располагающийся в цитоплазме клетки) эритроцита;
- врожденная дизэритропоэтическая анемия (характеризуется нарушением образования эритроцитов);
- абеталипопротеинемия или синдром Бассена-Корнцвейга (характеризуется нехваткой бета-липопротеина в клетках кишечника, что ведет к нарушению всасываемости питательных веществ);
- наследственный сфероцитоз или болезнь Минковского-Шоффара (вследствие нарушения клеточной мембраны эритроциты принимают шарообразную форму).
- дефицит железа;
- дефицит витамина B12;
- дефицит фолиевой кислоты;
- дефицит аскорбиновой кислоты (витамин С);
- голодание и недоедание.
Хронические заболевания и новообразования
- почечные заболевания (например, туберкулез печени, гломерулонефрит);
- заболевания печени (например, гепатит, цирроз);
- заболевания желудочно-кишечного тракта (например, язва желудка и двенадцатиперстной кишки, атрофический гастрит, неспецифический язвенный колит, болезнь Крона);
- коллагеновые сосудистые болезни (например, системная красная волчанка, ревматоидный артрит);
- доброкачественные и злокачественные опухоли (например, миома матки, полипы в кишечнике, рак почек, легких, кишечника).
- вирусные заболевания (гепатит, инфекционный мононуклеоз, цитомегаловирус);
- бактериальные заболевания (туберкулез легких или почек, лептоспироз, обструктивный бронхит);
- протозойные заболевания (малярия, лейшманиоз, токсоплазмоз).
Ядохимикаты и медикаментозные средства
- неорганический мышьяк, бензол;
- радиация;
- цитостатики (химиотерапевтические препараты, используемые для лечения опухолевых заболеваний);
- антибиотики;
- нестероидные противовоспалительные средства;
- антитиреоидные препараты (снижают синтез гормонов щитовидной железы);
- противоэпилептические препараты.
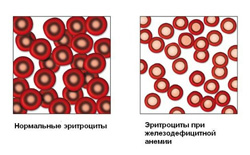
Для железодефицитной анемии характерно снижение эритроцитов, гемоглобина и цветового показателя.
Железо — это жизненно важный элемент, участвующий во многих метаболических процессах организма. У человека с весом семьдесят килограмм запас железа в организме составляет примерно четыре грамма. Данное количество поддерживается благодаря сохранению баланса между регулярными потерями железа из организма и его поступлением. Для поддержания равновесия суточная потребность железа составляет 20 – 25 мг. Большая часть поступающего железа в организм затрачивается на его нужды, остальное депонируется в виде ферритина или гемосидерина и при необходимости расходуется.
Нарушение поступления железа в организм
- вегетарианство вследствие неупотребления белков животного происхождения (мясо, рыба, яйца, молочные продукты);
- социально-экономическая составляющая (например, недостаточно денег для полноценного питания).
Нарушение усвоения железа
Всасывание железа происходит на уровне слизистых желудка, поэтому такие заболевания желудка как гастриты, язвенная болезнь или резекция желудка приводят к нарушению всасывания железа.
Повышенная потребность организма в железе
- беременность, в том числе многоплодная беременность;
- период лактации;
- подростковый возраст (за счет быстрого роста);
- хронические заболевания, сопровождающиеся гипоксией (например, хронический бронхит, пороки сердца);
- хронические нагноительные заболевания (например, хронические абсцессы, бронхоэктатическая болезнь, сепсис).
Потери железа из организма
- легочные кровотечения (например, при раке легких, туберкулезе);
- желудочно-кишечные кровотечения (например, язва желудка и двенадцатиперстной кишки, рак желудка, рак кишечника, варикозное расширение вен пищевода и прямой кишки, неспецифический язвенный колит, глистные инвазии);
- маточные кровотечения (например, преждевременная отслойка плаценты, разрыв матки, рак матки или шейки матки, прервавшаяся внематочная беременность, миома матки);
- почечные кровотечения (например, рак почек, туберкулез почек).
Питание при анемии
В питании железо делится на:
- гемовое, которое поступает в организм с продуктами животного происхождения;
- негемовое, которое поступает в организм с продуктами растительного происхождения.
Следует заметить, что гемовое железо усваивается в организме значительно лучше, нежели негемовое.
Количество железа на сто миллиграмм
Продукты питания
животного
происхождения
- печень;
- язык говяжий;
- мясо кролика;
- индюшатина;
- гусиное мясо;
- говядина;
- рыба.
- 9 мг;
- 5 мг;
- 4,4 мг;
- 4 мг;
- 3 мг;
- 2,8 мг;
- 2,3 мг.
Продукты питания растительного происхождения
- сушеные грибы;
- свежий горох;
- гречка;
- геркулес;
- свежие грибы;
- абрикосы;
- груша;
- яблоки;
- сливы;
- черешня;
- свекла.
- 35 мг;
- 11,5 мг;
- 7,8 мг;
- 7,8 мг;
- 5,2 мг;
- 4,1 мг;
- 2,3 мг;
- 2,2 мг;
- 2,1 мг;
- 1,8 мг;
- 1,4 мг.
При соблюдении диеты также следует увеличить потребление продуктов, содержащих витамин C, а также белок мяса (они повышают усвояемость железа в организме) и снизить потребление яиц, соли, кофеина и кальция (они уменьшают всасываемость железа).
Медикаментозное лечение
При лечении железодефицитной анемии больному параллельно с диетой назначается прием препаратов железа. Данные лекарственные средства предназначены для восполнения дефицита железа в организме. Они выпускаются в виде капсул, драже, инъекций, сиропов и таблеток.
Доза и длительность лечения подбирается индивидуально в зависимости от следующих показателей:
- возраста пациента;
- степени тяжести заболевания;
- причины, вызвавшей железодефицитную анемию;
- на основе результатов анализов.
Препараты железа принимаются за один час до еды или через два часа после приема пищи. Данные лекарственные средства нельзя запивать чаем или кофе, так как снижается всасываемость железа, поэтому их рекомендуется запивать водой или соком.
Принимать внутрь по одному грамму три – четыре раза в сутки.
Принимать по одной таблетке в день, с утра за тридцать минут до приема пищи.
Принимать по одной таблетке один – два раза в день.
Данные препараты рекомендуется назначать совместно с витамином C (по одной таблетке один раз в день), так как последний увеличивает всасываемость железа.
Препараты железа в виде инъекций (внутримышечных или внутривенных) применяются в следующих случаях:
- при тяжелой степени анемии;
- если анемия прогрессирует, несмотря на принимаемые дозы железа в виде таблеток, капсул или сиропа;
- если у больного имеются заболевания желудочно-кишечного тракта (например, язва желудка и двенадцатиперстной кишки, неспецифический язвенный колит, болезнь Крона), так как принимаемый препарат железа может усугубить имеющееся заболевание;
- перед оперативными вмешательствами с целью ускоренного насыщения организма железом;
- если у пациента имеется непереносимость препаратов железа при их приеме внутрь.
Хирургическое лечение
Хирургическое вмешательство производится при наличии у больного острого или хронического кровотечения. Так, например, при желудочно-кишечном кровотечении может применяться фиброгастродуоденоскопия или колоноскопия с выявлением области кровотечения и последующей его остановкой (например, удаляется кровоточащий полип, коагулируется язва желудка и двенадцатиперстной кишки). При маточных кровотечениях, а также при кровотечениях в органах, находящихся в брюшной полости, может применяться лапароскопия.
При необходимости больному может быть назначено переливание эритроцитарной массы для восполнения объема циркулирующей крови.

В норме витамин В12 поступает в организм с пищевыми продуктами. На уровне желудка В12 связывается с продуцируемым в нем белком, гастромукопротеидом (внутренний фактор Касла). Данный белок защищает поступивший в организм витамин от негативного воздействия микрофлоры кишечника, а также способствует его усвоению.
Комплекс гастромукопротеид и витамин В12 доходит до дистального отдела (нижний отдел) тонкого кишечника, где происходит распад этого комплекса, всасывание витамина В12 в слизистый слой кишечника и дальнейшее поступление его в кровь.
Из кровяного русла данный витамин поступает:
- в красный костный мозг для участия в синтезе эритроцитов;
- в печень, где происходит его депонирование;
- в центральную нервную систему для синтеза миелиновой оболочки (покрывает аксоны нейронов).
Клиническая картина В12 и фолиево-дефицитной анемии основывается на развитии у больного следующих синдромов:
- анемический синдром;
- желудочно-кишечный синдром;
- невралгический синдром.
| |
Данные симптомы развиваются вследствие атрофических изменений слизистого слоя ротовой полости, желудка и кишечника. |
|
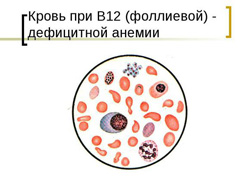
- снижение уровня эритроцитов и гемоглобина;
- гиперхромия (выраженная окраска эритроцитов);
- макроцитоз (увеличенный размер эритроцитов);
- пойкилоцитоз (различная форма эритроцитов);
- при микроскопии эритроцитов выявляются кольца Кебота и тельца Жолли;
- ретикулоциты снижены или в норме;
- снижение уровня лейкоцитов (лейкопения);
- повышение уровня лимфоцитов (лимфоцитоз);
- снижение уровня тромбоцитов (тромбоцитопения).
В биохимическом анализе крови наблюдается гипербилирубинемия, а также снижение уровня витамина В12.
При пункции красного костного мозга выявляется повышение мегалобластов.
Больному могут быть назначены следующие инструментальные исследования:
- исследование желудка (фиброгастродуоденоскопия, биопсия);
- исследование кишечника (колоноскопия, ирригоскопия);
- ультразвуковое исследование печени.
Данные исследования помогают выявить атрофические изменения слизистой оболочки желудка и кишечника, а также обнаружить заболевания, которые привели к развитию В12-дефицитной анемии (например, злокачественные образования, цирроз печени).
Все больные госпитализируются в отделение гематологии, где проходят соответствующее лечение.
Питание при В12-дефицитной анемии
Назначается диетотерапия, при которой увеличивается потребление продуктов, богатых витамином В12.
Суточная норма витамина В12 составляет три микрограмма.
Количество витамина В12 на сто миллиграмм
Медикаментозное лечение
Медикаментозное лечение назначается больному по следующей схеме:
- В течение двух недель больной ежедневно получает по 1000 мкг Цианокобаламина внутримышечно. За две недели у пациента исчезает неврологическая симптоматика.
- В течение последующих четырех – восьми недель больной получает по 500 мкг ежедневно внутримышечно для насыщения депо витамина В12 в организме.
- Впоследствии больной пожизненно получает внутримышечные инъекции один раз в неделю по 500 мкг.
Во время лечения одновременно с Цианокобаламином больному могут назначить прием фолиевой кислоты.
Больной В12-дефицитной анемией должен пожизненно наблюдаться у гематолога, гастролога и семейного врача.
Фолиевая кислота (витамин B9) является водорастворимым витамином, который отчасти продуцируется клетками кишечника, но в основном должен поступать извне для восполнения необходимой для организма нормы. Суточная норма фолиевой кислоты составляет прием 200 – 400 мкг.
В пищевых продуктах, а также в клетках организма фолиевая кислота находится в форме фолатов (полиглутаматы).
Фолиевая кислота играет большую роль в организме человека:
- участвует в развитии организма во внутриутробном периоде (способствует формированию нервной проводимости тканей, кровеносной системы плода, предупреждает развитие некоторых пороков развития);
- участвует в росте ребенка (например, в первый год жизни, в период полового созревания);
- влияет на процессы кроветворения;
- совместно с витамином В12 участвует в синтезе ДНК;
- препятствует образованию тромбов в организме;
- улучшает процессы регенерации органов и тканей;
- участвует в обновлении тканей (например, кожи).
Абсорбция (всасывание) фолатов в организме осуществляется в двенадцатиперстной кишке и в верхнем отделе тонкого кишечника.
При фолиеводефицитной анемии у больного наблюдается анемический синдром (такие симптомы как повышенная утомляемость, сердцебиение, бледность кожных покровов, снижение работоспособности). Неврологический синдром, а также атрофические изменения слизистой оболочки ротовой полости, желудка и кишечника при данном виде анемии отсутствуют.
Также у больного может наблюдаться увеличение размеров селезенки.
При общем анализе крови наблюдаются следующие изменения:
- гиперхромия;
- снижение уровня эритроцитов и гемоглобина;
- макроцитоз;
- лейкопения;
- тромбоцитопения.
В результатах биохимического анализа крови наблюдается снижение уровня фолиевой кислоты (менее 3 мг/мл), а также повышение непрямого билирубина.
При проведении миелограммы выявляется повышенное содержание мегалобластов и гиперсегментированных нейтрофилов.
Питание при фолиеводефицитной анемии играет большую роль, больному необходимо ежедневно потреблять продукты, богатые фолиевой кислотой.
Следует заметить, что при любой кулинарной обработке продуктов фолаты разрушаются приблизительно на пятьдесят процентов и более. Поэтому для обеспечения организма необходимой суточной нормой продукты рекомендуется употреблять в свежем виде (овощи и фрукты).
| Продукты питания | Наименование продуктов | Количество железа на сто миллиграмм |
| Продукты питания животного происхождения |
|
|
| Продукты питания растительного происхождения |
|
|
Медикаментозное лечение фолиеводефицитной анемии включает прием фолиевой кислоты в количестве от пяти до пятнадцати миллиграмм в сутки. Необходимую дозировку устанавливает лечащий врач в зависимости от возраста пациента, тяжести течения анемии и результатов исследований.
Профилактическая доза включает прием одного – пяти миллиграмм витамина в сутки.
Апластическая анемия может быть врожденной или приобретенной.
Клинические проявления апластической анемии зависят от степени выраженности панцитопении.
При апластической анемии у больного наблюдаются следующие симптомы:
- бледность кожных покровов и слизистых;
- головная боль;
- учащенное сердцебиение;
- одышка;
- повышенная усталость;
- отеки на ногах;
- десневые кровотечения (вследствие снижения уровня тромбоцитов в крови);
- петехиальная сыпь (красные пятна на коже маленьких размеров), синяки на коже;
- острые или хронические инфекции (вследствие снижения уровня лейкоцитов в крови);
- изъязвления орофарингеальной зоны (поражается слизистая полости рта, язык, щеки, десна и глотка);
- желтушность кожных покровов (симптом поражения печени).
При биохимическом анализе крови наблюдается:
- повышение сывороточного железа;
- насыщение трансферрина (белок, переносящий железо) железом на 100%;
- повышение билирубина;
- повышение лактатдегидрогеназы.
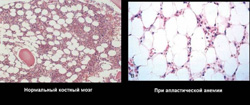
При пункции красного мозга и последующем гистологическом исследовании выявляются:
- недоразвитие всех ростков (эритроцитарный, гранулоцитарный, лимфоцитарный, моноцитарный и макрофагальный);
- замещение костного мозга жировым (желтый костный мозг).
Среди инструментальных методов исследований больному может быть назначено:
- ультразвуковое исследование паренхиматозных органов;
- электрокардиография (ЭКГ) и эхокардиография;
- фиброгастродуоденоскопия;
- колоноскопия;
- компьютерная томография.
При правильно подобранном поддерживающем лечении состояние пациентов с апластической анемией существенно улучшается.
При лечении апластической анемии больному назначаются:
- иммунодепрессивные препараты (например, Циклоспорин, Метотрексат);
- глюкокортикостероиды (например, Метилпреднизолон);
- антилимфоцитарный и антитромбоцитарный иммуноглобулины;
- антиметаболиты (например, Флударабин);
- эритропоэтин (стимулирует образование эритроцитов и стволовых клеток).
Немедикаментозное лечение включает:
- трансплантацию костного мозга (от совместимого донора);
- переливание компонентов крови (эритроциты, тромбоциты);
- плазмаферез (механическое очищение крови);
- соблюдение правил асептики и антисептики с целью предотвращения развития инфекции.
Также при тяжелом течении апластической анемии больному может понадобиться хирургическое лечение, при котором производится удаление селезенки (спленэктомия).
В зависимости от эффективности проводимого лечения у больного при апластической анемии может наблюдаться:
- полная ремиссия (затухание или полное исчезновение симптомов);
- частичная ремиссия;
- клиническое улучшение;
- отсутствие эффекта от лечения.
|
|
|
|

Гемолитическая анемия может развиться вследствие наследственных или приобретенных заболеваний.
По локализации гемолиз может быть:
- внутриклеточным (например, аутоиммунная гемолитическая анемия);
- внутрисосудистым (например, переливание несовместимой крови, диссеминированное внутрисосудистое свертывание).
У пациентов с легкой степенью гемолиза уровень гемоглобина может быть нормальным, если производство эритроцитов соответствует темпу их разрушения.
Преждевременное разрушение эритроцита может быть связано со следующими причинами:
- внутренними мембранными дефектами эритроцитов;
- дефектами структуры и синтеза белка гемоглобина;
- ферментативными дефектами в эритроците;
- гиперспленомегалией (увеличение размеров печени и селезенки).
Наследственные заболевания могут вызвать гемолиз в результате отклонений мембраны эритроцита, ферментативных дефектов и отклонений гемоглобина.
Существуют следующие наследственные гемолитические анемии:
- энзимопатии (анемии, при которых наблюдается недостаток фермента, дефицит глюкозо-6-фосфатдегидрогеназы);
- наследственный сфероцитоз или болезнь Минковского-Шоффара (эритроциты неправильной шарообразной формы);
- талассемия (нарушение синтеза полипептидных цепей, входящих в строение нормального гемоглобина);
- серповидно-клеточная анемия (изменение строения гемоглобина приводит к тому, что эритроциты принимают серпообразную форму).
Приобретенные причины гемолитической анемии включают иммунные и не иммунные нарушения.
Иммунные нарушения характеризуются аутоиммунной гемолитической анемией.
Не иммунные нарушения могут быть вызваны:
- ядохимикатами (например, пестициды, бензол);
- лекарственными средствами (например, противовирусные препараты, антибиотики);
- физическим повреждением;
- инфекциями (например, малярия).
Гемолитическая микроангиопатическая анемия приводит к производству фрагментированных эритроцитов и может быть вызвана:
- дефектным искусственным сердечным клапаном;
- диссеминированным внутрисосудистым свертыванием;
- гемолитическим уремическим синдромом;
- тромбоцитопенической пурпурой.
Симптомы и проявления гемолитической анемии разнообразны и зависят от вида анемии, степени компенсации, а также от того, какое лечение получал больной.
Следует заметить, что гемолитическая анемия может протекать бессимптомно, а гемолиз выявляться случайно во время обычного лабораторного тестирования.
При гемолитической анемии могут наблюдаться следующие симптомы:
- бледность кожи и слизистых;
- ломкость ногтей;
- тахикардия;
- учащение дыхательных движений;
- снижение артериального давления;
- желтушность кожных покровов (из-за увеличения уровня билирубина);
- на ногах могут наблюдаться язвы;
- гиперпигментация кожи;
- желудочно-кишечные проявления (например, боль в животе, нарушение стула, тошнота).
Следует заметить, что при внутрисосудистом гемолизе у больного наблюдается дефицит железа из-за хронической гемоглобинурии (наличие гемоглобина в моче). Вследствие кислородного голодания нарушается сердечная функция, что приводит к развитию у пациента таких симптомов как слабость, тахикардия, одышка и стенокардия (при тяжелой форме анемии). Из-за гемоглобинурии у больного также наблюдается потемнение мочи.
Длительный гемолиз может привести к развитию желчных камней вследствие нарушения обмена билирубина. При этом пациенты могут жаловаться на боль в животе и бронзовый цвет кожи.
В общем анализе крови наблюдается:
- снижение уровня гемоглобина;
- снижение уровня эритроцитов;
- увеличение ретикулоцитов.
При микроскопии эритроцитов выявляется их серпообразная форма, а также кольца Кебота и тельца Жолли.
В биохимическом анализе крови наблюдается повышение уровня билирубина, а также гемоглобинемия (увеличение свободного гемоглобина в плазме крови).
Также необходимо сдать анализ мочи на выявление наличия гемоглобинурии.
При пункции костного мозга наблюдается выраженная гиперплазия эритроцитарного ростка.
Существует много видов гемолитической анемии, поэтому лечение может отличаться в зависимости от причины, вызвавшей анемию, а также от типа гемолиза.
При лечении гемолитической анемии больному могут назначаться следующие препараты:
- Фолиевая кислота. Профилактическая доза фолиевой кислоты назначается, потому что активный гемолиз может потреблять фолат и впоследствии привести к развитию мегалобластоза.
- Глюкокортикостероиды (например, Преднизолон) и иммунодепрессанты (например, Циклофосфан). Данные группы препаратов назначаются при аутоиммунной гемолитической анемии.
- Переливание эритроцитарной массы. Больному индивидуально подбираются отмытые эритроциты, так как существует высокий риск разрушения перелитой крови.
Спленэктомия
Спленэктомия может быть первоначальным вариантом в лечении некоторых типов гемолитической анемии, таких как, например, наследственный сфероцитоз. В других случаях, например, при аутоиммунной гемолитической анемии, спленэктомия рекомендуется тогда, когда другие методы лечения потерпели неудачу.
Терапия препаратами железа
При гемолитической анемии применение препаратов железа в большинстве случаев противопоказано. Это связано с тем, что уровень железа при данной анемии не снижается. Однако если у больного наблюдается постоянная гемоглобинурия, то происходит существенная потеря железа из организма. Поэтому при выявлении дефицита железа пациенту может быть назначено соответствующее лечение.
Проявления анемии будут зависеть от следующих факторов:
- какое количество крови было потеряно;
- с какой скоростью происходит кровопотеря.
Симптомами постгеморрагической анемии являются:
- слабость;
- головокружение;
- бледность кожных покровов;
- сердцебиение;
- одышка;
- тошнота, рвота;
- сечение волос и ломкость ногтей;
- шум в ушах;
- мелькание мушек перед глазами;
- жажда.
При острой кровопотере у больного может развиться геморрагический шок.
Выделяют четыре степени геморрагического шока.
источник