Единой классификации, полностью отражающей суть артериальной аневризмы, не существует. Поэтому все классификации предлагается проводить с учетом: а) локализации; б) генеза
(происхождения); в) морфогистологических проявлений; г) клинических проявлений.
Патогенетическая классификация
- Истинные аневризмы.
- Ложные аневризмы.
- Расслаивающие аневризмы.
Морфологическая классификация
По форме:
- Мешковидная.
- Веретенообразная. По размерам:
- Малые аневризмы (D 3—5 см).
- Средние (D 5-7 см).
- Большие (D более 7 см).
- «Гигантские» (в 8-10 раз превышают диаметр инфраре-нального сегмента аорты).
Этиологическая классификация аневризм брюшной аорты
- «Врожденные».
- Травматические.
- Воспалительные (неинфекционные).
- Инфекционные — бактериальные, микотические, вирусные.
- Дегенеративные — диспластические (чаще вызванные атеросклерозом).
- Постартериотомические и анастомотические.
Классификация АБА по течению и клинике заболевания
- Асимптомное течение.
- Безболевое течение.
- Болевая стадия заболевания.
- Стадия осложнений:
- угрожающий разрыв;
- разрыв, прорыв;
- расслоение;
- некоронарогенная эмболизация в артерии. Поскольку наш клинический материал представлен неослож-
ненными формами АБА (324 операции), клиническое течение этих аневризм, наблюдаемое у наших больных, можно распределить следующим образом:
- асимптомное;
- безболевое;
- болевое.
В соответствующих разделах работы классификационные особенности аневризм брюшной аорты будут рассмотрены подробнее.
Разработанная и применяемая в НЦССХ хирургическая классификация (А. А. Спиридонов, 1992 г.) составлена с учетом двух основных критериев, определяющих оперативную тактику: проксимального уровня аневризмы и ее распространения на бифуркацию брюшной аорты (рис. 2). В связи с этим следует различать следующие аневризмы:
- Супраренальные:
- изолированные;
—диффузные, без вовлечения в процесс бифуркации брюшной
аорты;
- диффузные с вовлечением ее.
- Субренальные:
- изолированные, без вовлечения в процесс бифуркации брюшной аорты;
- диффузные с вовлечением ее.
- Инфраренальные:
- без вовлечения в процесс бифуркации брюшной аорты;
- с вовлечением ее.
Супраренальные изолированные аневризмы брюшной аорты, вовлекающие в процесс только проксимальные висцеральные ветви,
- чрезвычайно редкий вариант локализации процесса. Он чаще обусловлен неспецифическим аортитом, специфическими аортитами, а также может возникать в результате операции (эндартерэктомии) или ангиографического исследования. При этом оперативный доступ
- левосторонняя торакофренолюмбо-томия с укладкой больного на операционном столе на правый бок.
РУС. 2. Хирургическая классификация АБА по А. А. Спиридонову (1992 г.): а — супраренальные; 6 — субренальные; в —
инфрареналъные.
Супраренальные диффузные аневризмы без вовлечения в процесс бифуркации также чаще связаны с аортитом; при вовлечении бифуркации этиология их может быть как воспалительного, так и атеросклеротического характера. Инфраренальные аневризмы с выраженными атеросклеротическими бляшками (по данным Bergman, Yao, 1974 г.; Шалимова А. А. и др., 1979 г.) составляют 95-96%. Оперативный доступ — полная срединная ла-паротомия.
Учитывая, что наиболее распространенные на сегодняшний день хирургические классификации относят супраренальные аневризмы к аневризмам торакоабдоминального отдела аорты, хотелось бы подробнее остановиться на этом вопросе.
Общепринятой является классификация аневризм торакоабдоминального отдела аорты Е. S. Crawford (рис. 3), в основе которой лежит распространенность процесса и вовлечение магистральных ветвей аорты:
Классификация аневризм торакоабдоминального (ТАА) отдела аорты по Е. S. Crawford
- тип — от левой подключичной артерии до интерренального сегмента аорты;
- тип — от левой подключичной артерии до уровня бифуркации аорты;
- тип — от середины нисходящего отдела грудной аорты до бифуркации аорты;
- тип — от двенадцатого межреберья до бифуркации аорты.
Являясь в целом сторонниками классификации Е. S. Crawford, не можем не отметить имеющиеся в ней недостатки и противоречия:
- Относить ли истинные аневризмы грудной аорты с протяженностью поражения от перешейка до уровня диафрагмы к ТАА
- типа (если да, то каковы минимальные размеры этих поражений)?
Рис. 3. Классификация аневризм торакоабдоминального (ТАА) отдела аорты по Е. S. Crawford.
- К какой группе относить сегментарные поражения верхне-и среднегрудного отдела аорты?
- Подразумевает ли 1 тип возможность поражения дуги аорты и ее ветвей?
- Почему IV тип поражения, захватывая только брюшной отдел аорты, определяется как торакоабдоминальная аневризма и т. д.
Более логичной является классификация истинных аневризм грудной и брюшной аорты по локализации, которая считается общепризнанной. С учетом классификации Е. S. Crawford и нашими уточнениями современная классификация подобных поражений должна выглядеть следующим образом:
Классификация аневризм аорты по локализации
- Синуса Вальсальвы.
- Восходящей аорты.
- Дуги аорты.
- Перешейка аорты.
- Нисходящей грудной аорты.
- Торакоабдоминальной аорты:
- I тип — от левой подключичной артерии до интерренального сегмента аорты;
- II тип — от левой подключичной артерии до уровня бифуркации аорты;
- Ill тип — от середины нисходящего отдела грудной аорты до бифуркации аорты.
- Аневризмы брюшной аорты:
1)супраренальные:
- изолированные с вовлечением только висцеральных артерий;
- диффузные с вовлечением инфраренального сегмента аорты;
- диффузные с вовлечением бифуркации аорты и подвздошных артерий;
- субренальные (изолированные и диффузные);
- инфраренальные (изолированные, диффузные).
- Комбинированные аневризмы.
- Аневризмы анастомозов.
Принципиальным считаем выделение в отдельную группу субренальных аневризм в связи с высокой вероятностью поражения почечных артерий в этой группе, а также хирургической тактикой, требующей выполнения операции из торакофрено-люмботомии для ревизии почечных артерий и адекватной их пластики.
В заключение еще раз подчеркнем, что предложенные уточнения к существующим и признанным классификациям основаны на собственном клиническом материале более 1000 операций по поводу аневризм аорты и периферических артерий и обоснованы стремлением устранить существующий хаос в определении аневризм.
источник
I71.0 Расслоение аорты (любой части)
I71.1 Аневризма грудной части аорты разорванная
I71.2 Аневризма грудной части аорты без упоминания о разрыве
I71.3 Аневризма брюшной аорты разорванная
I71.4 Аневризма брюшной аорты без упоминания о разрыве
I71.5 Аневризма грудной и брюшной аорты разорванная
I71.6 Аневризма грудной и брюшной аорты без упоминания о разрыве
I71.8 Аневризма аорты неуточненной локализации разорванная
I71.9 Аневризма аорты неуточненной локализации без упоминания о разрыве
Определение: Под термином «Расслаивающая аневризма аорты» подразумевают внезапное образование вследствие различных причин дефекта внутренней оболочки стенки аорты с последующим проникновением потока крови в дегенеративно измененный средний слой, образованием внутристеночной гематомы и продольным расслоением стенки аорты преимущественно в дистальном или реже в проксимальном направлении.
Тип А: в процесс вовлечен восходящий отдел аорты, независимо от места разрыва и дистального расширения
Тип В: вовлечены поперечный и (или) нисходящий отделы аорты, без вовлечения восходящего отдела аорты.
1 тип расслаивающей аневризмы: поражена аорта от восходящего к нисходящему отделам
2 тип расслаивающей аневризмы: поражен восходящий или поперечный отделы без вовлечения нисходящего отдела
3 тип расслаивающей аневризмы: вовлечен лишь нисходящий отдел аорты
I30.0 Острый неспецифический идиопатический перикардит
I30.1 Инфекционный перикардит
I30.8 другие формы острого перикардита
I30.9 Острый перикардит неуточненный
I31 Другие болезни перикарда
I31.0 хронический адгезивный перикардит
I31.1 Хронический констриктивный перикардит
I31.2 Гемоперикард, неклассифицированный в других рубриках
I31.3 перикардиальный выпот (невоспалительный)
I31.8 Другие уточненные болезни перикарда
I31.9 болезни перикарда неуточненные
I32 перикардит при болезнях, классифицированных в других рубриках
I32.0 Перикардит при бактериальных болезнях, классифицированных в других рубриках
I32.1 Перикардит при других инфекционных и паразитарных болезнях, классифицированных в других рубриках
I32.8 Перикардит при других болезнях, классифицированных в других рубриках
Вид перикардита и его этиология
Вирусный (вирусы Коксаки А9 и В1-4, ЕНСО-8, Эпштейна-Барр, эпидемического паротита, ветряной оспы, краснухи, иммунодефицита человека, цитомегаловирус, парвовирус В19 и др.)
Бактериальный (Streptococcus pneumoniae, Neisseria meningitides, Neisseria gonorrhoeae, Haemophilus, Treponema pallidum, Borrelia, Chlamidia, Mycobacterium tuberculosis.)
Грибковый (Candida, Histoplasma и др.)
Паразитарный (Entamoeba histolitica, Echinococcus, Toxoplasma и др.)
ОПРЕДЕЛЕНИЕ, ЭТИОЛОГИЯ И ПАТОГЕНЕЗнаверх
Расслоение аорты — разрыв интимы и проникновение крови в толщу медии, что вызывает отслоение интимы от медии и адвентиция, а также появление псевдопросвета аорты. Классификация:
Стенфорд: тип А — расслоение, охватывающее восходящую аорту независимо от места возникновения (70 %); тип В — расслоение аорты, не охватывающее восходящую аорту.
Дебейки : тип I — место разрыва — восходящая аорта, расслоение распространяется на дугу и дистальнее, тип II — место разрыва — восходящая аорта, расслоение только в восходящем отделе, тип III – место разрыва — нисходящая грудная аорта, расслоение распространяется чаще антеградно — дистальнее, реже — ретроградно на дугу и восходящий отдел.
Факторы риска расслоения аорты: артериальная гипертензия (обычно недостаточно контролируемая), двустворчатый аортальный клапан и коарктация аорты (в том числе состояние после оперативного лечения этих пороков), ранее возникшее заболевание аорты (например, аневризма) или аортального клапана, отягощенный семейный анамнез по заболеваниям аорты, генетически детерминированные болезни соединительной ткани (синдром Марфана, синдром Элерса-Данлоса), кистозная дегенерация медии (у больных старше 50 лет), воспаление аорты, травмы (коммуникационные, ятрогенные), гемодинамические и гормональные факторы во время беременности (50 % расслоений аорты у лиц в возрасте
Обычно сильная боль в грудной клетке (особенности →табл. 1.6-1), нередко приводящая к потере сознания, не исчезающая после приёма нитратов п/я или п/о. Могут появиться: симптомы шока, неврологические (ишемия мозга, реже параплегии, ишемическая нейропатия верхних или нижних конечностей, синдром Горнера, хрипота), инфаркта миокарда (при охватывании расслоением устьев коронарных артерий), сердечной недостаточности (в случае тяжелой аортальной недостаточности) и тампонады сердца, плевральный выпот, острое повреждение почек (вовлечение устьев почечных артерий), боль в животе (вовлечение устьев брыжеечных артерий), симптомы острой ишемии конечностей, парез конечностей в результате ишемии спинного мозга. При объективном исследовании можно обнаружить высокое артериальное давление (у 50 % больных) или гипотензию, диастолический шум над устьем аорты, вызванный острой недостаточностью аортального клапана, ослабление или отсутствие пульса на одной конечности (у ≈30 % больных с расслоением восходящей аорты). Первым симптомом может быть также потеря сознания без боли и неврологических симптомов. Часто существенная разница при измерении АД на разных руках, пульс на разных лучевых артериях разного наполнения.
Симптомы, свидетельствующие о нестабильном клиническом состоянии: очень сильная боль, тахикардия, тахипноэ, гипотония, цианоз и/или шок.
Необходимо диагностировать немедленно (не следует продолжать диагностику в учреждении, не располагающем возможностью инвазивного лечения). Оцените клиническую возможность расслоения→табл. 2.23-1. Проводится дифференциация с другими причинами боли в грудной клетке →разд. 1.4. Необходимо подтверждение с помощью визуализирующего исследования (предпочтительна ангио-КТ, у нестабильных пациентов равнозначным исследованием является чреспищеводная эхокардиография). РГ грудной клетки может обнаружить расширение границ сердца, редко верхнего средостения, а при разрыве в плевральную полость — жидкость в ней; нормальная картина не исключает расслоения аорты. В случае стойкого подозрения на расслоение аорты при нормальном исходном визуализирующем исследовании рекомендована повторная визуализация с помощью ангио-КТ или МРТ. Диагностический алгоритм →рис. 2.23-1.
синдром Марфана (или другое заболевание соединительной ткани)
заболевания аорты в семейном анамнезе
диагностированные заболевания аортального клапана
распознанная аневризма грудной аорты
предшествующие вмешательства, затрагивавшие аорту (в том числе кардиохирургическая операция)
боль в груди, спине или животе, характеризующаяся ≥1 из следующих признаков:
– разрывающий или раздирающий характер
доказательства снижения перфузии:
– разница систолического артериального давления на обеих верхних конечностях
– очаговый неврологический дефицит (в сочетании с болью)
диастолический аортальный шум (новый и связанный с болью)
Обнаружение каких-либо признаков из одной из 3 вышеуказанных групп соответствует 1 баллу, из 2 групп — 2 баллам, 3 групп — 3 баллам. Чем больше баллов по шкале 0–3, тем выше вероятность острого аортального синдрома (до выполнения дополнительных диагностических тестов).
на основе руководящих принципов ACC и AHA (2010)
Рисунок 2.23-1. Диагностический алгоритм при подозрении острого аортального синдрома (на основании рекомендаций ESC 2014, модифицировано)
Необходимо обеспечить доступ к магистральной и периферической вене, а также мониторировать (в том числе и во время транспортировки в специализированный центр) диурез, пульс, артериальное давление, ЭКГ, SaO 2 .
1) вводится морфин в/в для купирования боли;
2) необходимо быстро снизить артериальное давление (систолическое до 100–120 мм рт. ст., сперва исключите существенную аортальную недостаточность), вводя в/в:
а) β-адреноблокатор — например пропранолол 1 мг через каждые 3‑5 мин до ожидаемого эффекта (максимально 10 мг), а потом через каждые 4–6 ч, или эсмолол (дозирование →табл. 2.20-7); у больных с бронхиальной астмой или тяжелым ХОЗЛ используют блокаторы кальциевых каналов вместо β-адреноблокаторов, возможно применение эсмолола короткого действия);
б) у некоторых больных дополнительно нитроглицерин в/в, а при его неэффективности — нитропруссид натрия в/в (препараты и дозирование →табл. 2.20-7); при устойчивой артериальной гипертензии можно добавить эналаприл (в начале 0,625–1,25 мг в/в через каждые 6 ч [до макс. 5 мг]).
2. Инвазивное лечение: ургентная операция является тактикой выбора у большинства больных с расслоением типа А (КТ только, если больной гемодинамически стабилен, а исследование не задержит транспортировки в кардиохирургический центр). Показания к имплантации стентграфта (метод выбора) или к операции при расслоении типа В: постоянная или рецидивирующая боль в грудной клетке, неконтролируемая артериальная гипертензия, несмотря на соответствующую фармакотерапию, расширение аорты, гипоперфузия органов, симптомы разрыва (гемоторакс, увеличивающаяся гематома в области аорты или в средостении).
Недостаточность аортального клапана (при расслоении восходящей аорты), ишемия конечностей, висцеральная ишемия, инсульт, параплегия, ишемия кишечника, разрыв аорты.
Фармацевтика, медицина, биология
Расслоение аорты (англ. Aortic dissection) — расслоение стенки аорты.
Расслоение происходит благодаря потоку крови, попадает между слоями стенки аорты. Расслоение аорты считается состоянием, угрожающим жизни пациента, поэтому в медицине (кардиохирургия) ее относят к неотложных состояний. Несвоевременная диагностика и оказание кардиохирургической помощи приводят к смерти пациента в результате массивного кровотечения.
Как известно, стенка аорты суммируется с троьх слоев. Внутренний слой, который безпосереднто контактирует с кровью называется интима, от лат. Tunica intima. Интима преимущественно состоит из эндотелиальных клеток. За ней следует средний слой стенки аорты — медиа, от лат. Tunica media. Она в основном состоит из эластичных волокон и небольшого количества непосмугованих мышечной ткани. Благодаря этому аорту относят к сосудам эластичного типа. Хотя существует мнение о рассмотрении аорты, как отдельного органа сердечно-сосудистой системы. Внешний слой аорты видомия как адвентиция, от лат. Tunica adventitia. Этот слой полностью состоит из соединительной ткани.
При диссекции аорты, кровь через поврежденную интима попадает в медиа. Благодаря большому давлению в просвете аорты, кровь расслаивает медию, фактически создавая новую полость, которая со временем начинает увеличиваться и распространяться дальше вдоль аорты.
Опасность заключается в том, что в любое время может произойти разрыв аорты, следствием которого является массивное кровотечение и внезапная смерть.
Предложенная в 1965 году Майклом Дебейки. Представляет собой анатомическую классификацию диссекции аорты. Она различает разные типы диссекции в зависимости от места повреждения интимы и протяженности вдоль аорты самой диссекции (локализация только в восходящей аорте или восходящей аорте, или охватывает восходящую и нисходящую аорту одновременно).
- Тип I — начинается в восходящей аорте, распространяется на дугу аорты и, как правило, продолжается далее по нисходящей аорте.
- Тип II — начинается и заканчивается только в пределах восходящей аорты.
- Тип III — начинается в нисходящей аорте.
Предложенная в 1970 году в Стэнфордском Университете. Расслоение аорты делится на 2 группы; A и B в зависимости от поражения восходящей аорты.
- A =Тип I andТип II по классификации Дебейки
- B =Тип III по классификации Дебейки
Инфаркт миокарда возникает в 1-2% случаев при диссекции аорты. Это связано с вовлечением в патологический процесс коронарных артерий. Правая коронарная артерия привлекается чаще, чем левая. При этом, если проводится тромболитическая терапия инфаркта миокарда, это пидвищуюе смертность от диссекции аорты на госпитальном этапе до 70%. Как правило, смерть пациентов наступает вследствие кровотечения в перикардиальную полость, которая в свою очередь вызывает тампонаду сердца. Поэтому необходима осторожность при применении тромболитической терапии.
В том числе и трансезофагеальна (чреспищеводная) эхокардиография
Острый коронарный синдром с или без поднятия сегмента ST
Аортальная регургитация без диссекции
Аневризма аорты без диссекции
Атеросклеротическая или холестерольна эмболия
источник
Рис 12. Операция Короткова — Кикудзи.
Паллиативные операции рассчитаны на создание условий, способствующих тромбозу и запустеванию аневризматического мешка. В связи с малой эффективностью, частыми рецидивами и тяжелыми расстройствами кровообращения они применяются только вынужденно. К ним относятся: перевязка приводящей артерии по Гунтеру (на протяжении) и Анелю (вблизи анервизмы); выше и ниже анервизмы — артериальной (по Вредену) или комбинированной (по Xорели); неполная перевязка приводящей артерии (по Е. В. Смирнову); лигатура периферического отдела артерии вблизи анервизмы (по Браз¬дору), на расстоянии от нее (по Вардропу). В порядке подготовки к радикальной операции предложена перевязка центрального [Холмен (Е. Holman)], центрального и периферического (С. П. Шиловцев) участков поврежденной вены, неполная лигатура приводящей артерии (Е.В. Смирнов).
Профилактика травматических анервизм сводится к наиболее раннему выявлению и оперативному лечению повреждений кровеносных сосудов. Наряду с доводами сторонников выжидательной тактики существует мнение, что установленный диагноз свежего ранения сосуда сам по себе служит показанием к немедленному вмешательству на нем, несмотря на отсутствие и малую веро¬ятность наружного кровотечения, быстро нарастающей гематомы и других непосредственно угрожающих явлений. Исключение составляет ранение бедренной артерии с одновре¬менным открытым перелохмом бедра. В этих случаях нужно, по возможности, выждать формирование анервизмы и сращение перелома, а в ранние сроки оперировать только вынужденно, по жизненным показаниям, так как перевязка артерии при свежем переломе бедра почти всегда гибельна для конечности, а возможность наложения сосудистого шва нельзя определить до ревизии сосуда (С. А. Русанов). Другое исключение — ранение сонной артерии, при котором также выгоднее, по возможности, дождаться формирования анервизмы.
К травматическим анервизмам во многом близки ложные анервизмы нетравматического происхождения (аррозия сосуда, разрыв истинной анервизмы и тому подобного). Отличия в их симптоматике, течении и особенно в лечении определяются характером патологического процесса, вызвавшего ложную анервизму.
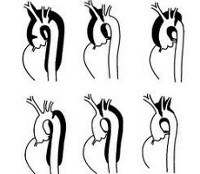
ОПРЕДЕЛЕНИЕ И КЛАССИФИКАЦИЯ РАССЛАИВАЮЩЕЙ АНЕВРИЗМЫ АОРТЫ

Расслаивающую аневризму аорты считают острой, если она диагностирована в течение 2 нед со времени появления симптомов (в раннюю фазу периода высокой смертности). Случаи, когда больные остаются в живых без лечения в течение 2 нед, относят к подострым случаям, а в течение 8 нед и более — к хроническим. У одной трети больных расслоение аорты принимает хроническую форму. Расслаивающие аневризмы аорты дополнительно подразделяют в соответствие с их анатомическим расположением с использованием классификации Стэнфорда и Де Бейки (DeBakey).
Основное различие между ними состоит в том, является ли расслоение проксимальным (с вовлечением корня аорты или восходящей аорты) или дистальным (ниже левой подключичной артерии). В классификации расслаивающей аневризмы Стэнфорда выделяют тип А и тип В (рис. 1). Тип А характеризуется вовлечением восходящей аорты, а тип В — нет. Классификация Де Бейки подразделяет расслоение на тип I с вовлечением всей аорты, тип II с вовлечением только восходящей аорты и тип III, захватывающий восходящую аорту и дугу аорты. Многочисленные попытки дополнительно разделить обе классификации на подтипы не увенчались успехом, хотя область дуги требует отдельного включения в современную классификацию.
Полученные в последнее время данные подчеркивают важность повреждений, предшествующих развитию типичной расслаивающей аневризмы, а именно интрамуральной гематомы, проникающих язв аорты и ограниченных надрывов интимы как разновидностей процессов, связанных с расслоением стенки аорты (рис. 2).
Рис. 1. Наиболее общая система классификации расслоений грудной аорты
Рис. 2. Схематическое представление расслоения аорты (слева), пенетрирующей язвы (посередине) и внутристеночной гематомы (справа).
Классическая расслаивающая аневризма аорты
Острая расслаивающая аневризма аорты проявляется быстрым образованием лоскута интимы, разделяющего истинный и ложный просвет сосуда. В большинстве случаев (приблизительно в 90%) именно надрыв интимы становится местом сообщения между истинным и ложным просветами аорты. Расслоение может распространяться в антеградном или ретроградном направлении, с вовлечением боковых ветвей и развитием осложнений (ишемии за счет динамической или статической обструкции ветвей аорты: от венечных до подвздошных артерий, тампонады сердца и недостаточности АК).
Условную классификацию расслаивающей аневризмы на острую, подострую и хроническую, по-видимому, нельзя назвать полезной ни с исследовательской точки зрения, ни с точки зрения выбора лечебных подходов, но ее можно использовать для описания индивидуальных особенностей и выживаемости больных. С патофизиологической точки зрения предсказать, будет ли прогрессировать расслоение аорты, достаточно трудно, особенно в случае, если больной остался в живых в течение двух первых недель после возникновения расслоения, хотя со временем объем ложного просвета обычно расширяется. Для приблизительной оценки риска можно использовать некоторые клинические признаки (например, данные о постоянном сообщении истинного и ложного просветов, наличие открытого ложного канала и др.).
Интрамуральную гематому аорты рассматривают в качестве состояния, предшествующего классическому расслоению. Она возникает в результате разрыва vasa vasorum в срединных слоях стенки, в конечном итоге способствуя возникновению вторичного сообщения с просветом аорты. Эти изменения могут возникать при «инфаркте стенки аорты». Подобно классической расслаивающей аневризме аорты, интрамуральная гематома может распространяться вдоль аорты и способна увеличиваться, уменьшаться и подвергаться обратному развитию. Встречаемость интрамурального кровоизлияния составляет 10-30%. Интрамуральная гематома может приводить к острому расслоению аорты у 21-47% больных, подвергаться обратному развитию в 10% случаев. Вовлечение в процесс восходящей аорты — показание для неотложного хирургического вмешательства вследствие высокого риска разрыва, тампонады и сдавления устий венечных артерий. Дистальная интрамуральная гематома заслуживает тщательного медицинского наблюдения, и в некоторых случаях показана установка стент-графта (рис. 3).

Рис. 3. Развитие в течение 4 мес острой внутристеночной гематомы нисходящей аорты (слева) до ограниченного расслоения и образования аневризмы (МСКТ с контрастным усилением изображения; реконструкция расслоенной аорты, исключение аневризмы после операции по установке стент-графта).
Исследования больных из Азии (в частности, из Японии и Кореи) показали, что интрамуральная гематома — относительно доброкачественное состояние, при котором полноценное медикаментозное лечение и оценка области повреждения с помощью лучевых методов диагностики дают возможность ограничиться выжидательным подходом с тщательным наблюдением. Причины этого противоречия могут быть связаны с различными генотипами больных азиатской и европеоидной расы или семантическими различиями. Однако в настоящее время кардиологи и хирурги пришли к выводу, что острую интрамуральную гематому, затрагивающую восходящую аорту, следует лечить хирургическим способом, подобно расслаивающей аневризме типа А.
Изъязвление атеросклеротической бляшки, расположенной в аорте, может приводить к возникновению расслаивающей аневризмы аорты или перфорации аорты. Неинвазивная лучевая диагностика изъязвления аорты стала более совершенной после внедрения сканирующей томографии, что позволило пролить свет на этиологию и патогенез данного расстройства. Язвы аорты возникают в основном в нисходящей грудной и брюшной аорте, проникают в интиму, имеют форму соска с соседствующей гематомой. Более высокий риск разрыва характерен для язв, сопровождающихся возникновением клинических симптомов и/или имеющих признаки глубокой эрозии.
Christoph A. Nienaber, Ibrahim Akin, Raimund Erbel и Axel Haverich
Заболевания аорты. Травмы сердца и аорты

Первые описания аневризмы брюшной аорты относятся к XVI в. (Vesalius, 1557 г.; A. Pare, 1561 г.). Laennek впервые описал симптомы разрыва аневризмы брюшной аорты. Среди аневризм всех локализаций аневризмы брюшной аорты составляют 29-37,8%. Из всех патологических расширений аорты на долю брюшной ее части приходится 80%. Это тяжелое заболевание в клиническом и прогностическом плане и часто осложняется разрывом аневризмы. В последние годы отмечается рост числа больных этой патологией, что связывают с увеличением продолжительности жизни населения, распространенностью атеросклероза и совершенствованием диагностических методов. Частота аневризм брюшной аорты в России составляет 10-40 случаев на 100 тыс. населения. Около 80% больных старше 60 лет. Соотношение мужчин и женщин составляет примерно 10:1.
Причины развития аневризм брюшного отдела аорты разнообразны. Они указаны в ниже приведенной классификации. Основной причиной (80-85%) является атеросклероз. Современные представления (П.О. Казанчан, В.А. Попов, 2002) о патогенезе развития аневризмы брюшной аорты (АБА) можно свести к следующим механизмам :
1) атеросклеротические изменения стенки аорты;
2) изменения в матриксе аортальной стенки;
3) активация протеолиза в стенке брюшной аорты;
4) воспалительные изменения в стенке аорты;
5) генетические дефекты в синтезе фибриллярных белков брюшной аорты.
У 95-96% больных аневризмы расположены ниже почечных артерий, что связано, вероятно, с нарушением кровотока vasa vasorum этой области.
Наиболее рациональная классификация аневризм брюшной аорты, которой пользуется большинство авторов, предложена А.В. Покровским и Р.С. Ермолюк (1968 г.). Она построена с учетом этиологии, морфологического признака, локализации, клинического течения аневризмы.
невоспалительные (атеросклеротические, травматические).
воспалительные (специфические — сифилитические, инфекционные; неспецифические — при аортоартериите).
2. Врожденные (вследствие фибромускулярной дисплазии, кистозного медионекроза Эрдгейма, синдрома Марфана и др.).
II. По морфологическому признаку:
IV. По клиническому течению:
1-й тип — аневризма проксимального сегмента брюшной аорты с вовлечением висцеральных ветвей.
2-й тип — аневризма инфраренального отдела без вовлечения бифуркации.
3-й тип — аневризма инфраренального отдела с вовлечением бифуркации аорты и подвздошных артерий.
4-й тип — тотальное поражение брюшной аорты.
Важно отметить, что большинство аневризм (90-95%) локализуются в инфраренальном отделе.
Представленная ниже классификация аневризм по Алленбергу (Allenberg) в модификации Рейтеля (Reithel) учитывает только анатомическое положение аневризмы и ориентирует хирурга на выбор метода хирургической реконструкции.
Тип 1 — инфраренальная аневризма с адекватным проксимальным и дистальным перешейком.
Тип 1а — изолированная инфраренальная аневризма.
Тип 1в — инфраренальная аневризма с адекватным дистальным перешейком.
Тип 2 — адекватный проксимальный перешеек.
Тип 2а — аневризма, распространяющаяся до бифуркации аорты.
Тип 2в — аневризма с вовлечением общих подвздошных артерий.
Тип 2с — аневризма, распространяющаяся до подвздошных артерий, с вовлечением устий внутренних подвздошных артерий. Тип 3 — отсутствие адекватного проксимального перешейка.
Аневризмы до 4-7 см в диаметре не вызывают субъективных жалоб. Иногда аневризма аорты выявляется случайно. Асимптомное течение болезни может наблюдаться у 25-45% больных. При наличии симптомов больные отмечают тупые, ноющие боли в животе (в 90% случаев), наличие пульсирующего образования (60%). Над аневризматическим расширением выслушивается систолический шум (75%). Это основные симптомы аневризмы брюшной аорты (АБА). Почти у 1/4 больных имеет место отсутствие аппетита, похудание, отрыжка, рвота, неустойчивый стул или запоры, что может быть обусловлено компрессией двенадцатиперстной кишки или вовлечением в патологический процесс висцеральных ветвей аорты. Артериальная гипертензия выявляется у 60% больных. Может наблюдаться ишиорадикулярный синдром с чувствительными и двигательными расстройствами. Он вызван компрессией корешков спинного мозга в поясничном отделе. Симптомы ишемии нижних конечностей могут быть связаны с эмболией фрагментированными тромботическими массами из полости аневризмы и сопутствующими окклюзирующими поражениями магистральных и периферических артерий.
Тяжесть клинического состояния пациентов преимущественно пожилого возраста диктует необходимость правильной оценки состояния как самой аневризмы, так и сопутствующих заболеваний. В диагностическом алгоритме обследования больных, помимо общеклинических, применяются следующие методы исследования:
обзорная рентгенография брюшной полости;
рентгенологическое исследование органов грудной полости;
ультразвуковое дуплексное сканирование брюшной аорты, артерий нижних конечностей и брахиоцефальных артерий;
компьютерная томография брюшной аорты;
ядерно-магнитно-резонансная томография брюшной аорты;
исследование функции почек (выделительная урография и изотопная ренография);
исследование функции внешнего дыхания;
исследования состояния желудочно-кишечного тракта;

У большинства больных диагноз аневризмы можно поставить без использования инвазивных методов исследования, но перед хирургическим вмешательством рентгеноконтрастная аортоартериография необходима для уточнения состояния магистральных и периферических артерий.
Дифференциальный диагноз проводится с забрюшинной липомой, пакетом увеличенных забрюшинных лимфатических узлов, лимфосаркомой, опухолями желудка, кишечника, поджелудочной железы. Ошибочный диагноз возможен при наличии опухоли или подковообразной почки, при опущенной, блуждающей почке, когда она прилежит к аорте и имеет передаточную пульсацию. Данные проведенного исследования уточняют клиническую картину.
Прогноз неблагоприятный. Только 10-36,4% больных живут свыше 5 лет после установления диагноза без оперативного вмешательства, 50-70% пациентов умирают от разрыва аневризмы и кровотечения.
Наблюдения за больными показали, что аневризмы диаметром менее 3 см увеличиваются за год в среднем на 0,21 см, диаметром 3-4,9 см — на 0,43 см и при диаметре 6 см — до 0,75 см в год. Более 80% аневризм прогрессивно увеличивается в размерах, 15 — 20% — не изменяется. Аневризмы диаметром 4 см и менее осложняются расслоением и разрывом в 9,5% случаев, диаметром 4 — 6 см — в 23,4% и диаметром 7 — 10 см — в 45,6% случаев. На этом строятся показания к хирургическому лечению. При увеличении диаметра аневризмы более 5 см в год показания к операции абсолютные. Возраст сам по себе не является противопоказанием к операции.
При определении риска операции следует выделить три уровня:
первый — возраст больных старше 75-85 лет, легкой степени нестабильная стенокардия с фракцией выброса менее 50%, но выше 30%, креатининемия менее 2 мг%;
второй — возраст 85-90 лет, стабильная стенокардия, инфаркт миокарда в анамнезе, фракция выброса менее 30%, но выше 20%, нарушение функции легких, креатининемия 2-3,5 мг%;
третий — возраст старше 90 лет, стенокардия II-III классов.
Впервые в мире успешную резекцию аневризмы брюшной аорты с замещением ее гомотрансплантатом выполнил Шарль Дюбост (С. Dubost) в 1951 г. во Франции. Большой вклад в развитие хирургического лечения этой патологии внесли Де Беки, Е. Крауфорд и Кули (М. De Bakey, Е. Crawford, D. Cooley), применившие гофрированные синтетические протезы. В России аналогичное вмешательство при данной патологии впервые выполнено В.А. Жмуром в 1958 г.
Лечение аневризм только хирургическое и заключается в резекции аневризмы с замещением ее синтетическим протезом. Противопоказания к плановой операции: свежий инфаркт миокарда (менее 1 месяца.), острое расстройство мозгового кровообращения (до 6 недель), тяжелая легочная недостаточность, недостаточность кровообращения II Б-III степени, выраженное нарушение функции печени, почечная недостаточность, распространенная окклюзия подвздошных и бедренных артерий.
В профилактике различных послеоперационных осложнений большое значение имеет выбор оптимального оперативного доступа. При инфраренальных АБА наиболее рациональной является полная срединная лапаротомия. В некоторых случаях возможно применение и внебрюшинных доступов — левостороннего параректального и доступа по Робу.
Резекция аневризм надпочечной локализации — одна из наиболее сложных и продолжительных операций. Адекватный подход ко всему брюшному отделу аорты, к висцеральным и почечным артериям обеспечивает комбинированный торакоабдоминальный доступ: торакофренолюмботомия или торакофренолапаротомия. Для пластики висцеральных ветвей используют аллопротезирование их отдельными протезами, которые вшивают в аортальный протез, или производят реплантацию артерий в аортальный протез. При необходимости реваскуляризации нижних конечностей эти доступы дополняются бедренными разрезами.
Новым методом лечения АБА является дистанционное эндоваскулярное протезирование пораженного сегмента аорты трансплантатом, вводимым через разрез бедренной или чаще подвздошной артерий и фиксируемым в области шейки и дистально от аневризматического мешка с помощью каркасных конструкций-стентов. Существуют различные модификации этого метода. Подобные вмешательства позволяют свести до минимума риск у тяжелых больных и получить хорошие результаты.
Задачей ближайшего послеоперационного периода после резекции АБА является поддержание стабильной гемодинамики, адекватного внешнего дыхания и хорошей функции почек. Серьезным осложнением может быть кровотечение, которое является абсолютным показанием к повторной операции.
Летальность при плановых операциях в большинстве клиник составляет 3,5-5%. Осложнения, которые могут иметь место в отдаленные после операции сроки, следующие: аортокишечные свищи, ложные аневризмы, ишемия кишечника, инфицирование протеза.
Избранные лекции по ангиологии. Е.П. Кохан, И.К. Заварина
источник
Расслаивающая аневризма аорты – дефект внутренней оболочки аневризматически расширенной аорты, сопровождающийся образованием гематомы, продольно расслаивающей сосудистую стенку с формированием ложного канала. Расслаивающая аневризма аорты проявляется внезапной интенсивной болью, мигрирующей по ходу расслоения, подъемом артериального давления, признаками ишемии сердца, головного и спинного мозга, почек, внутреннего кровотечения. Диагноз расслоения сосудистой стенки основан на данных ЭхоКГ, КТ и МРТ грудной/брюшной аорты, аортографии. Лечение осложненной аневризмы включает интенсивную медикаментозную терапию, резекцию поврежденного участка аорты с последующей реконструктивной пластикой.
Расслаивающая аневризма аорты – продольное расслоение стенки аорты в дистальном или проксимальном направлении на различном протяжении, обусловленное разрывом ее внутренней оболочки и проникновением крови в толщу дегенеративно-измененного среднего слоя. Расширение аорты при расслаивании ее стенки может носить умеренный характер или отсутствовать, поэтому расслаивающую аневризму аорты часто называют расслоением аорты.
Большинство аневризм локализуются в наиболее гемодинамически уязвимых зонах аорты: около 70% — в восходящем отделе в нескольких сантиметрах от аортального клапана, 10% случаев – в дуге, 20% — в нисходящем отделе аорты дистальнее устья левой подключичной артерии. Расслаивающая аневризма в кардиологии относится к угрожающим жизни состояниям с риском массивного кровотечения при разрыве аорты или острой ишемии жизненно важных органов (сердца, мозга, почек и др.) при окклюзии магистральных артерий. Обычно расслоение аневризмы аорты возникает в возрасте 60-70 лет, у мужчин в 2-3 раза чаще, чем у женщин.
Причинами патологии являются заболевания и состояния, приводящие к дегенеративным изменениям мышечных и эластичных структур средней оболочки аорты (медиа). Пожилой возраст пациентов (старше 60-70 лет), травмы грудной клетки, III триместр беременности у женщин старше 40 лет считаются факторами риска расслоения аневризмы аорты. К основным причинам относятся:
- Стабильно повышенное АД. Основной риск расслоения аорты связан с длительной артериальной гипертензией (70-90% случаев), сопровождающейся гемодинамическим напряжением и хронической травматизацией аорты.
- Наследственные дефекты соединительной ткани. Расслаивающая аневризма может развиваться как осложнение синдромов Марфана, Тернера, Элерса-Данлоса.
- Болезни сердца и сосудов. В группе риска — пациенты с аортальными пороками, коарктацией аорты, выраженным атеросклерозом аорты, системными васкулитами.
- Перенесенные кардиохирургические операции и манипуляции. В ранний и поздний послеоперационный период после хирургических вмешательств на сердце и аорте (протезирования аортального клапана, резекции аорты) существует повышенный риск расслаивания аневризм. Ятрогенные расслаивающие аневризмы связаны с техническими погрешностями при выполнении аортографии и баллонной дилатации, канюляции аорты для обеспечения искусственного кровообращения.
Первичным патогенетическим звеном в большинстве случаев является надрыв интимы с последующим образованием внутристеночной гематомы. Примерно в 10% случаев расслаивающую аневризму аорты может инициировать кровоизлияние в медиа при спонтанном разрыве капилляров, разветвляющихся в стенке аорты. Распространение интрамуральной гематомы в пределах медиа обычно сопровождается последующим разрывом интимы, но может происходить без него (в 3-13% случаев). В редких случаях расслоение аорты может наблюдаться при пенетрации атеросклеротической язвы.
Согласно классификации ДеБейки, определяют 3 типа расслоения:
- I – надрыв интимы в восходящем сегменте аорты, расслоение распространяется до грудного и брюшного отделов;
- II – место надрыва и расслоение ограничено восходящим отделом аорты,
- III – надрыв интимы в нисходящей аорте, расслоение может распространяться до дистальных отделов брюшной аорты, иногда ретроградно на дугу и восходящую часть.
Стэнфордская классификация выделяет расслаивающие аневризмы аорты типа A — с проксимальным расслоением, затрагивающим ее восходящий отдел, и типа B — с дистальным расслоением дуги и нисходящей части аорты. Тип A характеризуется более высокой частотой развития ранних осложнений и высокой догоспитальной летальностью. По течению расслаивающие аневризмы аорты могут быть острыми (от нескольких часов до 1-2 дней), подострыми (от нескольких дней до 3-4 недель) и хроническими (несколько месяцев).
Клиническая картина заболевания обусловлена наличием и протяженностью расслоения аорты, внутристеночной гематомой, сдавлением и окклюзией ветвей аорты, ишемией жизненно важных органов. Различают несколько вариантов развития расслаивающей аневризмы аорты: образование обширной непрорвавшейся гематомы; расслоение стенки и прорыв гематомы в просвет аорты; расслоение стенки и прорыв гематомы в окружающие аорту ткани; разрыв аорты без расслоения стенки.
Для расслаивающей аневризмы аорты характерно внезапное начало с имитацией симптомов различных сердечно-сосудистых, неврологических, урологических заболеваний. Расслоение аорты проявляется резким нарастанием раздирающей, нестерпимой боли с широкой областью иррадиации (за грудиной, между лопатками и по ходу позвоночника, в эпигастральной области, пояснице), мигрирующей по ходу расслоения. Отмечается повышение артериального давления с последующим спадом, асимметрия пульса на верхних и нижних конечностях, обильное потоотделение, слабость, синюшность, двигательное беспокойство. Большая часть больных с расслаивающей аневризмой аорты умирает от развития осложнений.
Неврологическими проявлениями патологии могут служить ишемическое поражение головного или спинного мозга (гемипарез, параплегия), периферическая нейропатия, нарушения сознания (обморок, кома). Расслаивающая аневризма восходящей аорты может сопровождаться ишемией миокарда, сдавлением органов средостения (появлением охриплости, дисфагии, одышки, синдрома Горнера, синдрома верхней полой вены), развитием острой аортальной регургитации, гемоперикарда, тампонады сердца. Расслоение стенок нисходящей грудной и брюшной части аорты выражается развитием тяжелой вазоренальной гипертензии и острой почечной недостаточности, острой ишемии органов пищеварения, мезентериальной ишемии, острой ишемии нижних конечностей.
При подозрении на расслаивающую аневризму аорты необходима срочная и точная оценка состояния больного. Основными методами диагностики, позволяющими визуализировать поражение аорты, являются рентгенография грудной клетки, ЭхоКГ (трансторакальная и чреспищеводная), УЗДГ, МРТ и КТ грудной/брюшной аорты, аортография.
- Рентгенография грудной клетки. Выявляет признаки спонтанного расслоения аорты: расширение аорты и верхнего средостения (в 90% случаев), деформацию тени контуров аорты или средостения, наличие плеврального выпота (чаще слева), снижение или отсутствие пульсации расширенной аорты.
- ЭхоКГ. Трансторакальная или чреспищеводная эхокардиография помогают определить состояние грудной аорты, выявить отслоившийся лоскут интимы, истинный и ложный каналы, оценить состоятельность аортального клапана, распространенность атеросклеротического поражения аорты.
- Томография. Выполнение КТ и МРТ при расслаивающей аневризме аорты требует стабильного состояния больного для транспортировки и проведения процедуры. КТ применяют для обнаружения интрамуральной гематомы, пенетрации атеросклеротических язв грудного отдела аорты. МРТ позволяет без использования внутривенного введения контрастного вещества точно определить локализацию разрыва интимы, направление расслоения по направлению кровотока в ложном канале, оценить вовлеченность основных ветвей аорты, состояние аортального клапана.
- Аортография. Является инвазивным, но высокочувствительным методом исследования расслаивающей аневризмы аорты; позволяет увидеть место начального надрыва, локализацию и протяженность расслоения, истинный и ложный просветы, наличие проксимальной и дистальной фенестрации, степень состоятельности аортального клапана и коронарных артерий, целостность ветвей аорты.
Необходимо проводить дифференциальную диагностику расслаивающей аневризмы аорты с острым инфарктом миокарда, окклюзией мезентеральных сосудов, почечной коликой, инфарктом почки, тромбоэмболией бифуркации аорты, острой аортальной недостаточностью без расслоения аорты, нерасслаивающей аневризмой грудной или брюшной аорты, инсультом, опухолью средостения.
Больных с осложненной аневризмой аорты экстренно госпитализируют в отделение кардиохирургии. Консервативная терапия показана при любых формах заболевания на начальном этапе лечения с целью остановки прогрессирования расслоения сосудистой стенки, стабилизации состояния больного. Проводится:
- Интенсивная терапия. Направлена на купирование болевого синдрома (путем введения ненаркотических и наркотических анальгетиков), выведение из шокового состояния, снижение артериального давления. Проводится мониторинг гемодинамики, сердечного ритма, диуреза, ЦВД, давления в легочной артерии. При клинически значимой гипотонии важно быстрое восстановление ОЦК за счет внутривенной инфузии растворов.
- Медикаментозное лечение. Является основным у большинства больных с неосложненными расслаивающими аневризмами типа B (с дистальным расслоением), при стабильном изолированном расслоении дуги аорты и стабильном неосложненном хроническом расслоении. При неэффективности проводимой терапии, прогрессировании расслоения и развитии осложнений, а также больным с острым проксимальным расслоением стенки аорты (типа A) сразу же после стабилизации состояния показано экстренное оперативное вмешательство.
- Оперативное лечение. При расслаивающей аневризме аорты выполняют резекцию поврежденного участка аорты с надрывом, удаление интимального лоскута, ликвидацию ложного просвета и восстановление иссеченного фрагмента аорты (иногда одномоментную реконструкцию нескольких ветвей аорты) методом протезирования или сближения концов. В большинстве случаев операция выполняется в условиях искусственного кровообращения. По показаниям осуществляют вальвулопластику или протезирование аортального клапана, реимплантацию коронарных артерий.
При отсутствии лечения расслаивающей аневризмы аорты летальность высокая, в течение первых 3 месяцев может достигать 90%. Послеоперационная выживаемость при расслоении типа A составляет 80%, типа B – 90%. Долгосрочный прогноз в целом благоприятный: десятилетняя выживаемость составляет 60%. Профилактика формирования расслаивающей аневризмы аорты заключается в контроле за течением сердечно-сосудистых заболеваний. Предупреждение расслоения аорты включает наблюдение кардиолога, мониторинг артериального давления и уровня холестерина крови, периодическое УЗДГ или УЗДС аорты.
источник
Боль в груди — одна из самых частых причин обращения за врачебной помощью. Причина боли в груди может быть ясной, но часто бывает атипичной. Случаи, когда пациенты жалуются на боль в груди, представляют наибольшие трудности для диагностики.
Дифференциально-диагностический ряд в таких случаях чрезвычайно широк и включает, в том числе, заболевания, представляющие непосредственную угрозу жизни, такие как инфаркт миокарда с подъемом и без подъема сегмента ST, нестабильную стенокардию, тромбоэмболию легочной артерии и расслаивающую аневризму аорты.
Расслаивающая аневризма аорты (РАА) представляет достаточно сложную проблему в плане первичной диагностики. Причиной этого является как низкая частота данной патологии, так и большая вариабельность клинических проявлений.
Без применения кардиохирургических методов в ранние сроки заболевания прогноз крайне неблагоприятен, а двухнедельная выживаемость не превышает 20 % , поэтому своевременная диагностика РАА является важнейшей задачей.
Под термином «расслаивающая аневризма аорты» подразумевают внезапное образование вследствие различных причин дефекта интимы аорты с последующим проникновением крови через этот дефект в дегенеративно измененную срединную оболочку, образованием гематомы и продольным расслоением стенки аорты.
Расслоение (диссекция) происходит преимущественно в дистальном, реже в проксимальном отделе. Гематома может развиваться по ходу аорты и закупоривать одну из ее ветвей, начиная от ветвей дуги аорты и заканчивая кишечными артериями.
Ретроградная диссекция может поражать коронарные артерии. Чаще вовлекается правая коронарная артерия. Ретроградное расслоение может привести к нарушению прочности одной или нескольких створок аортального клапана и его недостаточности.
Ложный канал располагается в наружной половине средней оболочки аорты. Наружная его стенка составляет всего четверть первоначальной толщины стенки аорты. Это является причиной частых разрывов аорты у больных с расслаивающей аневризмой.
Разрыв аневризмы дуги аорты происходит чаще всего в полость средостения, разрыв нисходящей аорты — в левую плевральную полость, брюшной аорты — в забрюшинную клетчатку. Так как париетальный перикард прикрепляется к восходящей части аорты, непосредственно проксимальнее места отхождения плечеголовного ствола, разрыв любого отдела восходящей части аорты может привести к тампонаде перикарда.
Классификации расслаивающих аневризм аорты обычно основаны на локализации проксимального разрыва внутренней оболочки аорты и протяженности расслоения стенки аорты. Поскольку разрыв внутренней оболочки аорты может теоретически произойти в любом сегменте и быть множественным, варианты расслоения аорты весьма разнообразны.
Однако на практике разрыв внутренней оболочки чаще всего происходит в передней стенке восходящей части аорты на границе проксимальной и средней трети, а также в начальном сегменте нисходящей части аорты дистальнее русла левой подключичной артерии.
Именно на этом принципе основана простая и широко распространенная Стэндфордская классификация, согласно которой выделяют несколько типов расслоения:
- тип А — разрыв интимы находится в восходящей аорте с поражением дуги или нисходящей аорты, или без них;
- тип В — надрыв находится в нисходящей аорте, при этом расслоение распространяется проксимально и дистально.
Для определения прогноза болезни и выработки консервативной и оперативной тактики в клинике применяется модификация классификации М. DeBakey:
- тип I — разрыв внутренней оболочки локализуется в восходящей части аорты, а расслоение ее стенок распространяется до брюшной части аорты;
- тип II — разрыв внутренней оболочки локализуется в восходящей части аорты, расслоение заканчивается слепым мешком проксимальнее плечеголовного ствола;
- тип III — разрыв внутренней оболочки аорты локализуется в начальном отделе нисходящей части грудной аорты дистальнее устья левой подключичной артерии.
Классификация расслаивающей аневризмы аорты
Согласно другой классификации, выделяют пять классов диссекции аорты.
- К 1-му классу относят классическое расслоение аорты с формированием ложного и истинного ходов без образования сообщения между ними,
- к 2-му— интрамуральную гематому или кровоизлияние,
- к 3-му — пенетрирующее изъявление атеросклеротической бляшки стенки аорты вследствие надрыва ее капсулы,
- к 4-му — небольшие ограниченные или частичные диссекции аорты с образованием выпячивания ее стенки
- к 5-му — ятрогенные или посттравматические диссекции аорты (например, расслоение аорты проведенным в нее для катетеризации сердца катетером).
Классификация диссекций аорты по L. G. Svensson и соавт.
Разрыв интимы, являющийся началом расслаивающей аневризмы, обнаруживается в восходящей части аорты примерно в 70 % случаев. В 10 % случаев его находят в дуге, в 20 % — в нисходящей части грудной аорты. В редких случаях наблюдается надрыв интимы брюшной аорты.
Диссекция (расслоение) аорты может быть острой (до 2 недель) и хронической (более 2 недель).
Распространенность РАА оценивается в среднем как 1 на 10 000 госпитализированных (однако значительная часть больных погибает на догоспитальном этапе). Данная патология является причиной 1,1 % случаев внезапной смерти и 3-4 % случаев всех внезапных смертей от сердечно-сосудистых заболеваний; выявляется в 1 случае на 400 аутопсий.
К предрасполагающим факторам расслоений аорты относятся заболевания и состояния, сопровождающиеся кистозной дегенерацией медии:
- длительно существующая артериальная гипертензия,
- врожденные дефекты соединительной ткани (синдромы Марфана, Элерса — Данлоса, Тернера),
- поликистозная болезнь почек,
- пожилой возраст (60-70 лет);
- врожденные пороки сердца (коарктация аорты, бикуспидальный или одностворчатый клапан);
- атеросклероз аорты;
- беременность;
- травма грудной клетки,
- сильное физическое и эмоциональное напряжение;
- системные васкулиты (особенно часто гранулематозный, гигантоклеточный артериит);
- химические и токсические воздействия (наркотики, например, кокаин);
- ятрогенные причины.
Наиболее частыми симптомами при РАА являются внезапное начало боли с молниеносным достижением максимальной интенсивности, локализация боли в грудной клетке, боль в спине. Боль описывается пациентами как очень интенсивная или нестерпимая, самая сильная боль, которую они когда-либо испытывали, боль острая или рвущая.
У значительной части пациентов могут наблюдаться те или иные изменения сегмента ST или зубца Т.
При проксимальном типе расслоения может выслушиваться шум аортальной регургитации.
Как при проксимальном, так и при дистальном типе расслоения может определяться асимметрия пульса (снижение его наполнения или отсутствие) и артериального давления на верхних или нижних конечностях.
У части пациентов могут выявляться те или иные неврологические нарушения.
Относительно редко встречается вторичный (чаще всего задненижний) инфаркт миокарда, связанный с распространением расслоения на устье коронарной артерии.
К заболеваниям, имеющим сходную с РАА клиническую картину, относятся:
- острый коронарный синдром;
- аортальная недостаточность без диссекции (расслоения);
- аневризма аорты без диссекции (расслоения);
- костно-мышечные;
- перикардит;
- опухоль средостения;
- плеврит;
- тромбоэмболия легочной артерии;
- холецистит.
Наличие РАА можно подозревать, если у пациента имеется боль; боль в сочетании с обмороком (синкопе); боль в сочетании с симптомами сердечной недостаточности; боль в сочетании с симптомами поражения ЦНС (инсульт); сердечная недостаточность без болевого синдрома; симптомы поражения ЦНС (инсульт) без болевого синдрома; изменения на рентгенограмме органов грудной клетки без болевого синдрома; отсутствие пульса без болевого синдрома.
Согласно рекомендациям рабочей группы Европейского общества кардиологов, для подтверждения диагноза, уточнения типа расслоения (локализация, протяженность), диагностики и уточнения тяжести аортальной недостаточности и диагностики экстравазации (периаортальная или медиастинальная гематома, плевральный или перикардиальный выпот) предпочтение следует отдавать трансторакальной ЭхоКГ с последующей трансэзофагеальной ЭхоКГ и внутрисосудистым УЗИ, мультиспиральной компьютерной томографии или магнитно-резонансной томографии.
Ангиография может проводиться для определения анатомического субстрата при планируемом чрескожном вмешательстве у гемодинамически стабильных и нестабильных пациентов, но не рутинно. Рентгенография грудной клетки не дает дополнительной информации.
Ниже представлены начальные лечебно-диагностические мероприятия, которые следует проводить при подозрении на РАА в соответствии с рекомендациями группы экспертов Европейского общества кардиологов.
- Сбор детального анамнеза и полный осмотр (при возможности).
- Обеспечение венозного доступа, анализы крови (ОАК, КФК, тропонин I (Т), Д-димер, гематокрит, липиды).
- Мониторирование артериального давления и ЭКГ.
- Снижение систолического артериального давления, предпочтительно β-адреноблокаторы (пропранолол, метопролол, эсмолол), при противопоказаниях — антагонисты кальция.
- При тяжелой артериальной гипертензии дополнительно вазодилататоры.
- Трансторакальная (трансэзофагеальная) ЭхоКГ.
Всем пациентам с расслаивающей аневризмой аорты показано хирургическое лечение.
Представляем клинический пример прижизненной диагностики РАА на основании особенностей течения заболевания и клинической картины.
Пациентка А., 59 лет. Жалоб в момент поступления нет. Ранее сердечно-сосудистых заболеваний не переносила.
Впервые за 3 дня до обращения в стационар возникла колющая, пронизывающая боль умеренной интенсивности в области сердца и между лопатками без связи с физической нагрузкой и движением, усиливавшаяся при пальпации, сохранялась несколько часов после самостоятельного приема анальгетиков. Повторный подобный приступ развился накануне поступления в стационар.
Консультирована неврологом, высказано предположение о вертеброгенной торакалгии. Проведена ЭКГ, выявлены изменения (отрицательные зубцы Т в отведениях III и aVF), по поводу которых пациентка направлена в стационар с диагнозом: «ИБС. Заднедиафрагмальный инфаркт миокарда».
При объективном обследовании обращал на себя внимание умеренно интенсивный диастолический шум, выслушивавшийся над аортой и по правому краю грудины.
С учетом острого характера и длительности боли в грудной клетке в сочетании с выявленными признаками аортальной недостаточности, предположительно остро развившейся (не было сведений о существовавшем ранее пороке сердца, границы сердца в пределах нормы, отсутствовали признаки хронической сердечной недостаточности) было высказано предположение о наличии РАА восходящего отдела аорты.
Пациентка была госпитализирована в ОРИТ, где планировалось начать инфузию эсмолола, провести трансторакальную и, при необходимости, трансэзофагеальную ЭхоКГ.
Через 10 мин после поступления больная внезапно потеряла сознание, диагностировано прекращение кровообращения (электромеханическая диссоциация). Реанимационные мероприятия безуспешны.
Диагноз: «Расслаивающая аневризма восходящей аорты. Гемоперикард. Тампонада сердца».
При патологоанатомическом исследовании было обнаружено непротяженное расслоение восходящей аорты с надклапанным разрывом и кровоизлиянием в полость перикарда.
П. В. Долотовская, И. В. Грайфер, С. В. Ефремов, Н. В. Фурман
источник