Аневризмой называют патологическое образование в виде местного расширения кровеносной артерии головного мозга из-за слабой, неэластичной, истонченной сосудистой стенки. Заболевание серьезное, способное привести к смертельному исходу. Оно опасно разрывом сосуда в месте расширения, после чего происходит субарахноидальная или внутримозговая геморрагия.
Аневризма на результатах ангиографии.
До момента криза болезнь может развиваться бессимптомно, иногда давать несильную неврологическую симптоматику, которую легко спутать с другими неопасными патологиями. Зачастую человек не предполагает, что у него в голове «бомба», которая «прячется» годами, но может разорваться в любой момент. После того как сосуд лопается и из него изливается кровь, заполняющая структуры головного мозга, аневризма уже проявляется в полную мощь. Основополагающими признаками произошедшего кровоизлияния являются внезапная жуткая головная боль и потеря сознания. К сожалению, позднее оказание медицинской помощи, как правило, оканчивается трагедией.
Заболевание может возникнуть в любом возрасте, однако чаще встречается у молодых людей (20-45 лет) и лиц среднего возраста (45-60 лет). Общий процент заболеваемости у взрослого населения составляет от 0,3% до 5%, у детей аневризмы – явление очень редкое. По статистике, из-за внезапного кровоизлияния в мозг вследствие аневризм 30%-50% людей погибает, 15%-30% становится инвалидами и только примерно к 20% возвращается относительно нормальная трудоспособность. Да, цифры неутешительные, но при ранней диагностике и своевременном лечении даже такой грозный очаг в головном мозге может быть успешно обезврежен.
Что может повлиять на образование сосудистой аневризмы, каких видов она бывает, как предотвратить трагедию, об этом важно знать абсолютно каждому. Итак, подробно переходим к главному.
Неблагополучными факторами, увеличивающими риски к тяжелой болезни, являются последствия некоторых патологий и образа жизни, это:
- любые заболевания соединительной ткани (они воздействуют на сосуды, делая их слабыми и неупругими);
- артериальная гипертензия и гипертония (высокое АД усиливает нагрузку на сосудистые образования, приводят к перерастяжению их стенок);
- пристрастие к курению, алкоголю, наркотикам (под действием токсических веществ ткани сосудов активно разрушаются, что чревато возникновением аневризмы, быстрым увеличением ее объема и стимуляцией разрыва);
- механические повреждения (травмы головы), спровоцировавшие функциональные и дегенеративные изменения в мозговых артериях;
- атеросклеротические и инфекционные явления (менингит, грибковая инфекция, эндокардит и пр.), от которых сильно страдает качество артериального компонента головного мозга;
- внутричерепные новообразования доброкачественной или злокачественной формы (они нарушают прочность сосудистых стенок, могут ускорить разрыв уже существующей аневризмы).
В формировании аневризм сосудов головного мозга нередко виноват генетический фактор. Вам и всем членам семьи следует срочно обследоваться, если известно, что кто-то из прямых родственников связан с данным диагнозом.
Сосудистые аневризмы головного мозга в нейрохирургии принято классифицировать по локализации, форме, размеру, количеству камер в образовании. Рассмотрим каждый параметр.
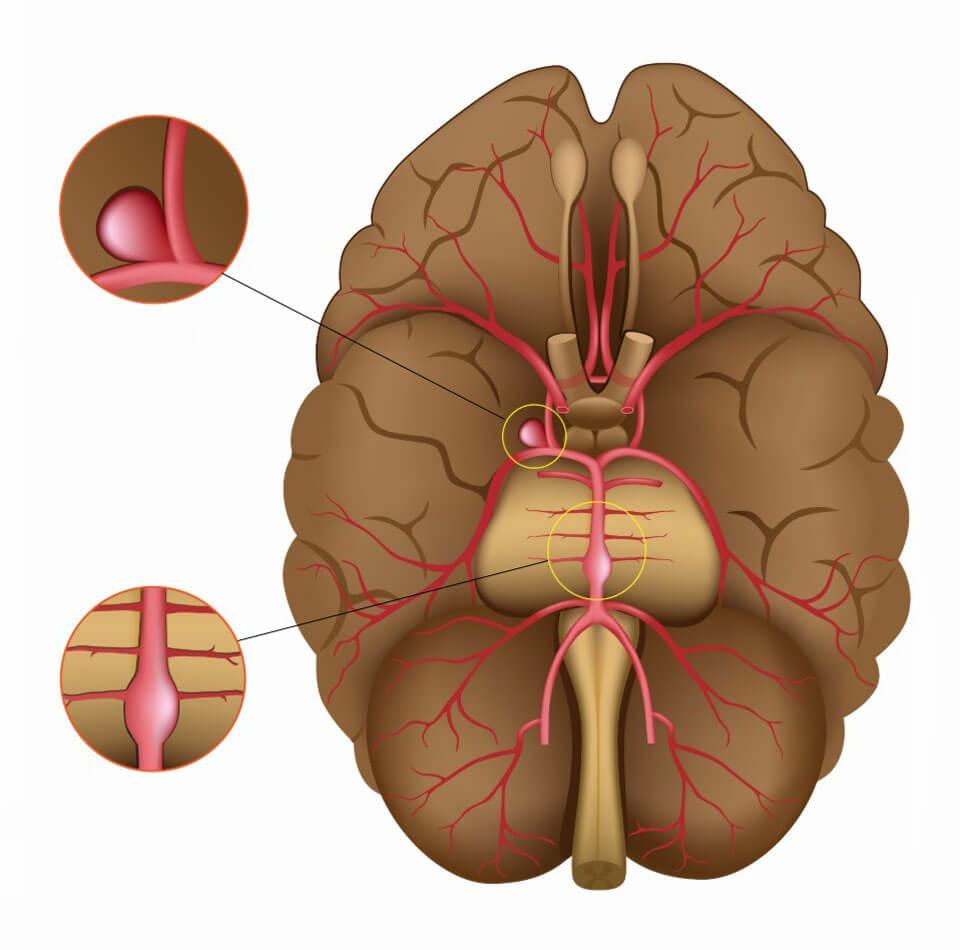
- По локальному признаку патологическое выпячивание бывает:
- передней мозговой/соединительной артерии (встречается в 45% случаев);
- внутреннего разделения сонной артерии (в 30%);
- средней мозговой артерии (в 20%);
- вертебробазилярного бассейна (4-5%);
- смешанного вида – поражены одновременно 2 и более отделов сосудистой сети (множественные очаги диагностируется у 10 % пациентов, у остальных же 90% определяется одиночная аневризма).
- По форме аневризматические расширения делят на:
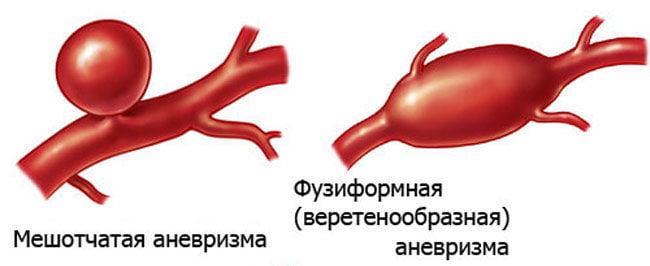
- мешковидные (мешотчатые) – самый распространенный вид формирований (98%), более других склонный к прободению;
- веретенообразные (фузиформные) – менее агрессивный и редкий тип образований, в структуре всех аневризм занимает лишь 2%;
- расслаивающиеся – образуются в межслойном пространстве сосудистой стенки, которое возникло из-за неплотного соединения ее слоев, куда под давлением попадает кровь (в артериях основания мозга развиваются в самых единичных случаях).
- Выпирание артериальной стенки по величине может быть:
- незначительным, или малым – до 4 мм;
- обычным, или средним – 5-15 мм;
- большим – 16-24 мм;
- гигантским – от 25 мм и более.
- По числу камер различают аневризму:
- однокамерную – состоит из одной камеры (типичное строение);
- многокамерную – ее рост происходит с формированием нескольких полостей.
Специалисты установили закономерность развития патологии у взрослых мужчин и женщин. Мужское население в 1,5 раза реже страдает от нее, чем женская популяция. В детском возрасте, напротив, болезнь преобладает немного чаще у мальчиков, чем у девочек (соотношение 3:2). У молодежи эпидемиология одинаковая.
Схематичное изображение очагов в зависимости от расположения.
Как мы ранее отметили, в большинстве случаев аневризма клинически не проявляется, пока не наступит острая фаза разрыва. Но при крупных размерах, когда очаг серьезно давит на близлежащие структуры и нарушает передачу нервных импульсов, неврогенные симптомы обычно ощущаются. Поскольку мозговая аневризма ставит под угрозу жизнь человека, ее важно выявить на ранних стадиях, но беда в том, что никому и в голову не приходит обращаться в больницу при отсутствии или минимуме жалоб.
Врачи призывают каждого взрослого человека, тем более в возрасте после 35 лет, хотя бы 1 раз в год проходить диагностику сосудов головного мозга для своего же блага.
Теперь озвучим все возможные клинические признаки, которые в основном начинают тревожить при опасных объемах неразорвавшегося дефекта, когда затронуты черепные нервы:
- боль в области глаз, снижение или затуманенность зрения;
- расстройство слуха (снижение, ощущение шума),
- осиплость голоса;
- онемение, слабость, боль по ходу лицевого нерва, обычно с одной стороны лица;
- мышечный спазм в области шеи (невозможность коснуться подбородком груди);
- судороги скелетных мышц;
- слабость в руке или ноге;
- снижение чувствительности, нарушение тактильного восприятия на отдельных участках кожи;
- проблемы с координацией;
- головокружение, тошнота;
- необоснованная сонливость или, наоборот, бессонница;
- заторможенность движений и мыслительной деятельности.
Чтобы исключить или определить патологию, незамедлительно пройдите целевой медицинский осмотр, если отмечаете у себя хотя бы один симптом!
Если сосуд разрывается, кровь изливается в головной мозг, специфика клинических признаков отличается большей конкретикой и выраженностью. Патогностический сценарий, присущий аневризматическому шоку, следующий:
- внезапная интенсивная головная боль, которая быстро распространяется и доходит до ужасного болевого пика;
- тошнота, многократная рвота;
- угнетение сознания различной продолжительности;
- менингеальный синдром;
- могут возникать судорожные припадки, напоминающие эпилептические;
- иногда повышение общей температуры тела, тахикардия, повышение/снижение АД;
- при массивной геморрагии из-за глубокого торможения в коре головного мозга человек впадает в кому с нарушением функций дыхания.
Тем, кто оказался рядом с таким пострадавшим (простой прохожий, друзья или родные), примите во внимание! От скорости вашей реакции сейчас зависит жизнь человека. Возникновение описанного симптомокомплекса (главные признаки в начале разрыва – первые 3 пункта) – сигнал к немедленному вызову бригады скорой помощи. Квалифицированные врачи окажут на месте адекватную первую помощь больному, отвезут в медучреждение для полного обследования и получения экстренной терапии.
Обследование, позволяющее диагностировать аневризму сосудов головного мозга, построено на применении комплексной диагностики. Комплексный подход позволит выявить заболевание, установить его причину, точный участок эпицентра, количество поражений, разновидность, размер, взаимосвязь с мозговыми отделами и другими артериями.
Если говорить не об уже состоявшихся разрывах, а о намерении пациента обследоваться в целях проверки состояния сосудов, визит начинается с обращения к неврологу. Врач, досконально выслушав анамнез пациента, проводит общий физикальный осмотр, включающий:
- пальпацию отдельных частей тела на определение болезненных зон;
- перкуссию, или выстукивание участков тела для определения по характеру звука состояние испытуемых внутренних органов;
- аускультацию, которая помогает услышать ненормальные шумы в области сердца, сонной артерии как косвенный признак аневризмы мозга;
- стандартное измерение давления, позволяющее оценить уровень давления циркулирующей крови по артериям;
- оценку сердечного ритма, частоты дыхания (нередко патологические отклонения данных параметров свидетельствует о дисплазии соединительных тканей, инфекционных процессах);
- неврологические тесты, суть которых заключается в исследовании сухожильных, мышечных, кожных рефлексов, двигательных функций костно-мышечной системы, степень чувствительности в конечностях и туловище, пр.
На основании всех перечисленных методов предварительной оценки состояния поставить диагноз еще невозможно. Все эти способы могут лишь чисто гипотетически указывать на возможное (неточное) наличие данной болезни при обнаружении факторов риска. Поэтому далее специалист выписывает направления на базовые диагностические процедуры – прохождение инструментальных методов визуализации структур головного мозга. Их проводят на специальных аппаратах:
- компьютерной томографии (КТ);
- магниторезонансной томографии (МРТ);
- церебральной ангиографии.
Стандартная ангиография наиболее выгодна по доступности цены для пациентов, пожелавших пройти первичный профилактический осмотр. Ее точность, конечно, ниже, чем у перспективных КТ и МРТ. Однако и ангиографическое исследование достаточно успешно справляется с задачей выявления аневризм, в том числе дает информацию о локализации, виде и масштабе расширения. Но для больных, поступивших в стационар с признаками разорвавшегося сосуда или давнего кровоизлияния, стандартом диагностики является использование всех указанных процедур. Наряду с ними выполняется электроэнцефалография (ЭЭГ) и транскраниальная допплерография (ТКДГ).
До прибытия врачей те, кто находится рядом с больным, должны уметь оказать ему элементарную первую помощь. Инструкция срочных мер, направленных на спасение жизни до врачебного визита, понятно изложена далее.
- Уложить пострадавшего на ровную поверхность, голова обязательно должна находиться в возвышенном положении. Высокое положение головы поможет улучшить венозную циркуляцию крови, тем самым предупредить быстрое накопление жидкости в церебральных тканях и отекание мозга.
- Создать условия для хорошего притока свежего воздуха в месте, где произошел клинический инцидент. И крайне значимо освободить шею от стягивающих вещей, например, снять галстук, шейный платок, расстегнуть пуговицы на рубашке и т. п. Такая мера позволит посодействовать поддержанию функций кровообращения и притормозить процесс массовой гибели нервных клеток.
- Если больного человека настиг обморок, следует осуществить проверку дыхательных путей на проходимость. При запрокинутой голове нужно сделать нажатие на лоб с одновременным выдвижением нижней челюсти, захватив снизу подбородок. Открыв рот больного, произвести ревизию ротовой полости (пальцами) на присутствие инородного содержимого, западания языка. Надо извлечь съемные зубные протезы, если они есть. Чтобы человек не захлебнулся рвотными массами, вернуть голову на высокую подушку, повернув ее на бок.
- Для профилактики отека головного мозга и сокращения объемов кровоизлияния важно прикладывать к голове компрессы изо льда (можно использовать замороженные продукты, пакеты со льдом и др.).
- По возможности стоит наблюдать за изменением кровяного давления, используя тонометр, а также прослушивать биение сердца, следить за дыханием. Если в отсутствие врачей человек перестал дышать или его сердце прекратило биться, неотложно начинайте реанимационные мероприятия (искусственное дыхание, непрямой массаж сердца). Без них в этой ситуации риск трагического конца огромный.
К сожалению, даже все эти мероприятия не всегда оказываются эффективными после состоявшегося разрыва аневризмы. Смертельный исход у некоторых наступает молниеносно – в первые же минуты. Но без специального медоборудования и профессиональных знаний сложно понять, что творится в организме. Поэтому ценно не терять самообладания и веры в результат. Продолжайте беспрестанно бороться за жизнь, пока больного лично не передадите в руки специалистам.
Лечебная методика (хирургическая или безоперационная) определяется узкопрофильными докторами индивидуально на основании диагностических данных. При мелких аневризмах, которые не прогрессируют, могут быть предложены консервативные тактики. Их предназначение – уменьшение потенциала роста образования, снижение риска разрыва, купирование неврологических симптомов. Неинвазивная терапия – это обеспечение пациента качественным медикаментозным пособием, оказывающим поддерживающее действие за счет:
- сосудосуживающих средств;
- кардиотоников с антигипертензивным эффектом;
- противоэпилептических препаратов;
- обезболивающих таблеток;
- дофаминолитиков (от рвоты, тошноты).
Маленькие аневризмы, которые не оперируются, требуют постоянного наблюдения. При этом специалисты предупреждают, что избавиться от них консервативно нельзя. Поэтому основной подход в устранении заболевания и его последствий – нейрохирургическое лечение, то есть своеобразная операция на проблемном сосуде головного мозга.
Выбор вида оперативного вмешательства зависит от показаний, места локализации, целостности, анатомических особенностей аневризмы сосуда, общего состояния пациента, степени угрозы жизни, технических возможностей нейрохирургического центра. Вмешательство может быть выполнено согласно одной из тактик хирургии.
- Эндоваскулярная операция – в полость сосуда (внутрь) чрескожным доступом (без вскрытия черепной коробки) под рентген-контролем вводится микрокатетер для установки сосудистого стента или спирали. Устройства полностью или субтотально «выключают» артерию из кровотока. Со временем аневризма тромбируется и уменьшается в размерах.
- Микрохирургическая (открытая под контролем микроскопа) – выполняется экономная трепанация черепа с последующим выделением несущей артерии и выполнением окклюзии путем наложения клипсы у основания шейки аневризмы. Клипсирование (сверху сосуда) позволяет пережать аневризматическую шейку, чем исключить из кровотока сосудистый дефект и свести к предельному минимуму вероятность его разрыва.
Видео как проходит операция по эндоваскулярному лечению нейрососудистой аневризмы головного мозга:
И лечебно-профилактические операции, и вмешательства по поводу разорванной аневризмы – сложнейший интраоперационный процесс, требующий величайшего опыта от микрохирурга, изумительного владения новыми нейрохирургическими технологиями, безупречной комплектации операционного блока. Следует заметить, в России и постсоветских странах нейрохирургическая помощь по данному направлению все еще остается на ненадлежащем уровне.Видео открытой операции по удалению:
Чего не скажешь о Чехии, это – одно из немногих в мире государств, где приемы миниинвазивной современной нейрохирургии мозга освоены и отточены в совершенстве, послеоперационное ведение пациентов на высоте. Чешские нейрохирурги проводят ювелирной точности манипуляции даже в труднодоступных местах мозга, не прибегая к агрессивным открытым приемам. На заметку скажем, что стоимость нейрохирургических операций и реабилитации в Чехии в разы ниже, чем в Германии и Израиле.https://medlineplus.gov/ency/article/007372.htm
https://www.mayoclinic.org/diseases-conditions/brain-aneurysm/diagnosis-treatment/drc-20361595
https://www.webmd.com/brain/news/20001030/brain-aneurysms-to-operate-not-to-operate
https://cyberleninka.ru/article/v/anevrizmy-sosudov-golovnogo-mozga-v-aspekte-endovaskulyarnogo-lecheniya
https://cyberleninka.ru/article/v/endovaskulyarnoe-lechenie-slozhnyh-sluchaev-arterialnyh-anevrizm-sosudov-golovnogo-mozga
https://cyberleninka.ru/article/v/rezultaty-hirurgicheskogo-lecheniya-anevrizm-sosudov-golovnogo-mozga
источник
Аневризмы сосудов головного мозга — это патологические локальные выпячивания стенок артериальных сосудов мозга. При опухолеподобном течении аневризма сосудов головного мозга имитирует клинику объемного образования с поражением зрительного, тройничного и глазодвигательных нервов. При апоплексическом течении аневризма сосудов головного мозга проявляется симптомами субарахноидального или внутримозгового кровоизлияния, внезапно возникающими в результате ее разрыва. Аневризма сосудов головного мозга диагностируется на основании данных анамнеза, неврологического осмотра, рентгенографии черепа, исследования цереброспинальной жидкости, КТ, МРТ и МРА головного мозга. При наличии показаний аневризма сосудов головного мозга подлежит хирургическому лечению: эндоваскулярной окклюзии или клипированию.
По некоторым данным, аневризма сосудов головного мозга имеется у 5% населения. Однако зачастую она протекает бессимптомно. Увеличение аневризматического расширения сопровождается истончением его стенок и может привести к разрыву аневризмы и геморрагическому инсульту. Аневризма имеет шейку, тело и купол. Шейка подобно стенке сосуда характеризуется трехслойным строением. Купол состоит только из интимы и является наиболее слабым местом, в котором аневризма сосудов головного мозга может разорваться. Наиболее часто разрыв наблюдается у пациентов в возрасте 30-50 лет. По данным статистики именно разорвавшаяся аневризма обуславливает до 85% нетравматических субарахноидальных кровоизлияний (САК).
Врожденное выпячивание сосудов головного мозга является следствием аномалий развития, приводящих к нарушению нормального анатомического строения их стенки. Оно часто сочетается с другой врожденной патологией: поликистозом почек, коарктацией аорты, дисплазией соединительной ткани, артериовенозной мальформацией головного мозга и т. п.
Приобретенная аневризма сосудов головного мозга может развиться в результате изменений, происходящих в стенке сосуда после перенесенной черепно-мозговой травмы, на фоне гипертонической болезни, при атеросклерозе и гиалинозе сосудов. В отдельных случаях она бывает вызвана заносом в мозговые артерии инфекционных эмболов. Такая аневризма в современной неврологии носит название микотической. Формированию патологии способствуют такие гемодинамические факторы, как неравномерность кровотока и артериальная гипертензия.
Аневризма сосудов головного мозга является следствием изменения в строении сосудистой стенки, которая в норме имеет 3 слоя: внутренний — интиму, мышечный слой и наружный — адвентицию. Дегенеративные изменения, недоразвитие или повреждение одного или нескольких слоев сосудистой стенки приводят к истончению и потере эластичности пораженного участка стенки сосуда. В результате в ослабленном месте под давлением тока крови происходит выпячивание сосудистой стенки, образуется аневризма. Наиболее часто выпячивание локализуется в местах разветвления артерий, поскольку там оказываемое на стенку сосуда давление наиболее высоко.
По своей форме аневризма сосудов головного мозга бывает мешотчатая и веретенообразная. Причем первые встречаются намного чаще, в соотношении примерно 50:1. В свою очередь мешотчатая форма может быть одно- или многокамерной. По локализации выделяют аневризму передней мозговой артерии, средней мозговой артерии, внутренней сонной артерии и вертебро-базилярной системы. В 13% случаях наблюдаются множественные аневризмы, располагающиеся на нескольких артериях. Существует также классификация по величине. Согласно ей выделяют аневризмы :
- милиарные — размером до 3 мм
- малые — до 10 мм
- средние — 11-15 мм
- большие — 16-25 мм
- гигантские — более 25 мм.
По своим клиническим проявлениям патология может иметь опухолеподобное или апоплексическое течение. При опухолеподобном варианте аневризма сосудов головного мозга прогрессивно увеличивается и, достигая значительных размеров, начинает сдавливать расположенные рядом с ней анатомические образования головного мозга, что приводит к появлению соответствующих клинических симптомов. Опухолеподобная форма характеризуется клинической картиной внутричерепной опухоли. Наиболее часто выявляется в области зрительного перекреста (хиазмы) и в кавернозном синусе.
Аномалия сосудов хиазмальной области сопровождается нарушениями остроты и полей зрения; при длительном существовании может привести к атрофии зрительного нерва. Аневризма сосудов головного мозга, располагающаяся в кавернозном синусе, может сопровождаться одним из трех синдромов кавернозного синуса, представляющих собой сочетание пареза III, IV и VI пары ЧМН с поражением различных ветвей тройничного нерва. Парез III, IV и VI пары клинически проявляется глазодвигательными нарушениями (ослаблением или невозможностью конвергенции, развитием косоглазия); поражение тройничного нерва — симптомами тройничной невралгии. Длительно существующая может сопровождаться деструкцией костей черепа, выявляемой при проведении рентгенографии.
Зачастую заболевание имеет апоплексическое течение с внезапным появлением клинических симптомов в результате разрыва аневризмы. Лишь изредка разрыву аневризмы предшествуют головные боли в лобно-глазничной области.
Первым симптомом разрыва является внезапная очень интенсивная головная боль. Вначале она может носить локальный характер, соответствующий месту расположения аневризмы, затем становится диффузной. Головная боль сопровождается тошнотой и многократно повторяющейся рвотой. Возникают менингеальные симптомы: гиперестезия, ригидность затылочных мышц, симптомы Брудзинского и Кернига. Затем происходит потеря сознания, которая может длиться различный период времени. Могут наблюдаться эпилептиформные приступы и психические расстройства от небольшой спутанности сознания до психозов. Субарахноидальное кровоизлияние, возникающее при разрыве аневризматического расширения, сопровождается длительным спазмом расположенных вблизи аневризмы артерий. Примерно в 65% случаев этот сосудистый спазм приводит к поражению вещества головного мозга по типу ишемического инсульта.
Помимо субарахноидального кровоизлияния разорвавшаяся аневризма сосудов головного мозга может вызвать кровоизлияние в вещество или желудочки головного мозга. Внутримозговая гематома наблюдается в 22% случаев разрыва. Кроме общемозговой симптоматики она проявляется нарастающей очаговой симптоматикой, зависящей от локализации гематомы. В 14% случаев разорвавшаяся аневризма становиться причиной кровоизлияния в желудочки. Это наиболее тяжелый вариант развития заболевания, часто приводящий к летальному исходу.
Возникающая при разрыве очаговая симптоматика может носить разнообразный характер и зависит от места локализации аневризмы. При расположеннаи в области бифуркации сонной артерии возникают расстройства зрительной функции. Поражение передней мозговой артерии сопровождается парезами нижних конечностей и психическими нарушениями, средней мозговой — гемипарезом на противоположной стороне и нарушениями речи. Локализующаяся в вертебро-базилярной системе аневризма при разрыве характеризуется дисфагией, дизартрией, нистагмом, атаксией, альтернирующими синдромами, центральным парезом лицевого нерва и поражением тройничного нерва. Выпячивание сосудов головного мозга, расположенное в кавернозном синусе, находится за пределами твердой мозговой оболочки и поэтому ее разрыв не сопровождается кровоизлиянием в полость черепа.
Достаточно часто заболевание характеризуется бессимптомным течением и может быть выявлена случайным образом при обследовании пациента в связи с совершенно другой патологией. При развитии клинических симптомов диагностика осуществляется неврологом на основании данных анамнеза, неврологического осмотра пациента, рентгенологических и томографических обследований, исследования цереброспинальной жидкости.
Неврологический осмотр позволяет выявить менингеальные и очаговые симптомы, на основании которых можно поставить топический диагноз, т. е. определить место локализации патологического процесса. Интсрументальная диагностика включает:
- Рентгенографию. Рентгенография черепа помогает обнаружить петрифицированные аневризмы и деструкцию костей основания черепа. Более точную диагностику дает проведение КТ и МРТ головного мозга.
- Ангиографию. Церебральная ангиография позволяет установить расположение, форму и размеры аневризмы. В отличие от рентгенологической ангиографии магнитно-резонансная (МРА) не требует введения контрастных веществ и может проводиться даже в остром периоде разрыва аневризмы сосудов головного мозга. Она дает двухмерное изображение поперечного сечения сосудов или их объемное трехмерное изображение.
- Люмбальную пункцию. При отсутствии более информативных способов диагностики разорвавшаяся аневризма сосудов головного мозга может быть диагностирована путем проведения люмбальной пункции. Обнаружение крови в полученной цереброспинальной жидкости свидетельствует о наличие субарахноидального или внутримозгового кровоизлияния.
В ходе диагностики опухолеподобная аневризма сосудов головного мозга должна быть дифференцирована от опухоли, кисты и абсцесса головного мозга. Апоплексическая аневризма сосудов головного мозга требует дифференцировки от эпилептического приступа, транзиторной ишемической атаки, ишемического инсульта, менингита.
Пациенты, у которых аневризма сосудов головного мозга имеет небольшие размеры, должны постоянно наблюдаются у невролога или оперирующего нейрохирурга, поскольку такая аневризма не является показанием для хирургического лечения, но нуждается в контроле за ее размерами и течением. Консервативные терапевтические мероприятия при этом направлены на предупреждение увеличения размеров аневризмы. Они могут включать нормализацию артериального давления или сердечного ритма, коррекцию уровня холестерина крови, лечение последствий ЧМТ или имеющихся инфекционных заболеваний.
Оперативное лечение направлено на предотвращение разрыва аневризмы. Его основными методами являются клипирование шейки аневризмы и эндоваскулярная окклюзия. Может применяться стереотаксическая электрокоагуляция и искусственное тромбирование аневризмы при помощи коагулянтов. В отношении сосудистых мальформаций производят радиохирургическое или транскраниальное удаление АВМ.
Разорвавшаяся аневризма сосудов головного мозга является неотложным состоянием и требует консервативного лечения аналогичного лечению геморрагического инсульта. По показаниям проводят хирургическое лечение: удаление гематомы, ее эндоскопическую эвакуацию или стереотаксическую аспирацию. Если аневризма сосудов головного мозга сопровождается кровоизлиянием в желудочки производят вентрикулярное дренирование.
Прогноз заболевания зависит от места, где располагается сосудистое выпячивание, от его размеров, а также от наличия патологии, ведущей к дегенеративным изменениям сосудистой стенки или гемодинамическим нарушениям. Не увеличивающаяся в размерах церебральная аневризма может существовать в течение всей жизни пациента не вызывая каких-либо клинических изменений. В случае разрыва 30-50% пациентов погибают, у 25-35% остаются стойкие инвалидизирующие последствия. Повторное кровоизлияние наблюдается у 20-25% пациентов, летальность после него составляет достигает 70%.
источник
Лечение аневризмы в России ведется по передовым методикам, которые эффективно избавляют человека от болезни, устраняют угрозу жизни и возвращают к полноценной деятельности. В тех случаях, когда медики из других стран дают неутешительные прогнозы, лечение аневризмы сосудов головного мозга в России проходит с большой успешностью. Прогрессивные способы проведения операций обеспечивают наиболее сильный эффект при щадящем воздействии на организм. Эндоваскулярная хирургия является визитной карточкой страны: операция при аневризме в России считается наиболее успешной и безопасной для пациента.Местные клиники оборудованы высокоточными приборами и современной аппаратурой для детальной и точной диагностики – это служит залогом выбора оптимального способа терапии. Отзывы о лечении аневризмы в России подтверждают: порядка 90% пациентов благополучно излечиваются и навсегда забывают о страшном диагнозе.
Для иностранных граждан готовится индивидуальная программа пребывания, прохождения диагностических и лечебных процедур. Пациент из СНГ обеспечивается русскоговорящим сопровождающим, ему помогают решить вопросы, связанные с приездом и проживанием в стране.
Обратите внимание на другие 18 клиник России, которые работают и помогают пациентам по направлению Нейрохирургия
При поражениях сосудов головного мозга с подозрением на аневризму важно как можно раньше получить полную клиническую картину заболевания. Точная, качественная диагностика дает возможность оценить риски и то, насколько срочно необходимо начинать лечение. Во многих случаях это спасает пациента от тяжелой инвалидности и даже смерти. Поэтому в клиниках России рекомендуют всем, даже тем, кто прошел обследование у себя на родине, обязательно пройти диагностику в Россияском исследовательском центре. К сожалению, далеко не во всех странах есть необходимое диагностическое оборудование. Довольно часто пациенту ставят неправильный диагноз, например, вместо аневризмы устанавливают кисту головного мозга, злокачественную опухоль, абсцесс головного мозга и так далее.
В российских же лечебных центрах, где диагностике уделяется первостепенное значение, введено за правило использование только прогрессивных технологий, поэтому ошибочный диагноз исключен.
Если у врачей есть подозрение на патологию сосудов головного мозга, проводят такие диагностико-исследовательские мероприятия:
- Осмотр и консультация невропатолога, нейрохирурга.
- КТ, МРТ с тем, чтобы определить локализацию аневризмы.
- Ангиографическое исследование сосудов для того, чтобы точно установить размер, форму, расположение аневризмы.
- Люмбальная пункция для исследования церебральной жидкости.
Вслед за тем, как становятся известны результаты обследования, собирается экспертная группа врачей-невропатологов и нейрохирургов, на консилиуме уточняется диагноз и разрабатывается терапевтический план.
Ведущий способ лечения при аневризме – эндоваскулярная хирургия, которая считается наиболее эффективным и безопасным методом. Малая степень травматизации тканей при проведении операций на сосудах данным методом способствует быстрому восстановлению пациента и его скорейшему возвращению к привычной активности. Во время малоинвазивных хирургических вмешательств не делается больших разрезов, не вскрывается черепная коробка. Ход операции отслеживается с помощью новейших хирургических навигационных систем, которые позволяют свести к минимуму риски для пациента.
Наряду с проведением операции, назначается поддерживающая терапия с целью купирования тяжелых симптомов, вызванных аневризмой. Также учитываются наличие сопутствующих заболеваний и возраст пациента.
- Эмболизация сосудов. Для того чтобы ликвидировать опасность разрыва аневризмы, в российских медцентрах проводят сложнейшие операции по эндоваскулярному типу, без вскрытия черепа. Хирург делает разрез на бедре, вставляет в бедренную артерию специальный катетер. По артерии он доставляется к сосуду в головном мозге, на котором образовалась аневризма. По катетеру к месту расширения сосуда поступают специальные микроспирали, которые блокируют ток крови. Данная процедура проходит под постоянным контролем специальной аппаратуры.
- Эндоваскулярное стентирование. Часто его комбинируют с эмболизацией аневризмы для наиболее успешного лечения и обеспечения стойкого результата. Катетер, который также вводят через артерию на бедре, доставляет к месту поражения эластичный стент. Установка совершается так, чтобы он плотно прилегал к стенкам сосуда, иногда для этого используют баллон: его в сдутом состоянии доставляют к поврежденному месту, там надувают, расширяя сосуд, а затем уже устанавливают стент. Стент направляет поток крови непосредственно по сосуду, минуя аневризму, также он устраняет возможное смещение микроспиралей. С течением времени стент врастает в ткани сосуда, таким, образом, устраняя сосуд от расширения.
- Микрохирургическое клиппирование. Процедура заключается в том, что на область шейки аневризмы устанавливают специальный зажим-клипсу из титана. Он полностью перекрывает просвет между аневризмой и сосудом, тем самым устраняет риск истончения или разрыва, который может произойти вследствие давления кровотока. Операция происходит минимально травматично, без краниотомии (трепанации): в черепной коробке делаются небольшие отверстия, через которые в поврежденный сосуд вводится клипса. Клиппирование – процедура, при которой зажим остается в сосуде на постоянной основе.
- Шунтирование. При аневризме больших размеров или патологии, расположенной в важнейших сосудах, нарушение кровообращения в которых грозит быстрыми и серьезными последствиями, проводят операцию по шунтированию. Во время сложнейшего микрохирургического вмешательства вокруг поврежденного участка сосуда создается новый обходной путь для кровотока с установлением протеза фрагмента сосуда.
Цены в местных клиниках вполне адекватны, если учитывать высокий уровень оказания медицинских услуг. Как правило, еще до отправления в клинику пациент получает информацию о стоимости диагностических исследований и отдельных процедур. На основании имеющейся информации о диагнозе, который больному поставили на родине, представитель международного отдела клиники сообщает примерную цену лечения. Однако точная стоимость становится понятна только после того, как проведено обследование в России и врачи определили стратегию терапии. Стоит иметь в виду, что затраты на лечение аневризмы головного мозга в России зависят от стадии болезни, например, при ее разрыве цена будет выше, так как требуются более сложные и дорогостоящие лечебные меры.
источник
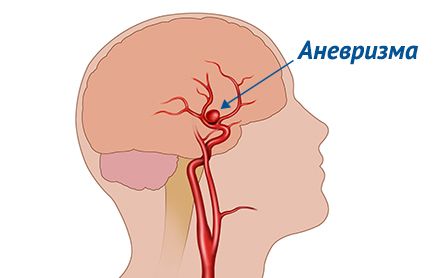
До разрыва аневризмы, как правило, не вызывают никаких симптомов и диагностируются случайно во время обследования по другим причинам. Пациентам с диагностированной аневризмой необходимо находиться под наблюдением врача, регулярно проходить обследования, позволяющие оценить прогрессирование заболевания.
Разрыв аневризмы приводит к внутричерепному кровоизлиянию. Чаще всего происходит кровоизлияние в субарахноидальное пространство – область между мозгом и паутинной оболочкой.
Разрыв аневризмы – жизнеугрожающее состояние, требующее немедленного медицинского вмешательства. При диагнозе аневризма головного мозга лечение проводится с применением самого современного диагностического и операционного оборудования.
При разрыве аневризмы возникает резкая и очень сильная головная боль. Пациент может описывать ее как сильнейшую головную боль, когда-либо испытанную.
Кроме того, разрыв аневризмы сосудов головного мозга может сопровождаться:
затуманенностью зрения или диплопией (раздвоением видимого изображения)
ригидностью затылочных мышц
Неразорвавшаяся аневризма никак себя не проявляет до тех пор, пока по мере роста не происходит сдавливания близлежащих нервов. В этом случае могут появиться различные симптомы, в том числе нарушения зрения, боль в глазах, паралич или онемение лица.
Основной причиной возникновения аневризм является утончение стенок сосудов. Поэтому очень часто аневризмы появляются на месте разветвления артерий, где сосуды становятся наиболее уязвимыми.
Обычно аневризмы образуются на участках артерий головного мозга, проходящих в области основания черепа (внутричерепная порция внутренней сонной артерии, средняя и передняя мозговые артерии, основная артерия и её ветви).
Среди факторов риска развития аневризм различают врожденные и приобретенные. Приобретенные факторы риска в основном связаны с образом жизни и сопутствующими заболеваниями, такими как:
употребление наркотичесих веществ, в особенности кокаина
Врожденные факторы риска:
Наследственные заболевания соединительных тканей, такие как синдром Элерса Данлоса, которые ослабляют кровеносные сосуды
Поликистозная болезнь почек, наследственное нарушение, которое приводит к формированию множественных кист в обеих почках и повышению артериального давления
Патологическое сужение просвета аорты (коарктация аорты), самого большого кровеносного сосуда в нашем организме, переносящего кровь от сердца по всему организму.
Артериовенозная мальформация, врожденный порок развития сосудов головного мозга, беспорядочное переплетение артерий и вен в головном мозге, которое приводит к нарушению нормального кровотока.
Случаи аневризмы у ближайших родственников (родителей, братьев, сестер)
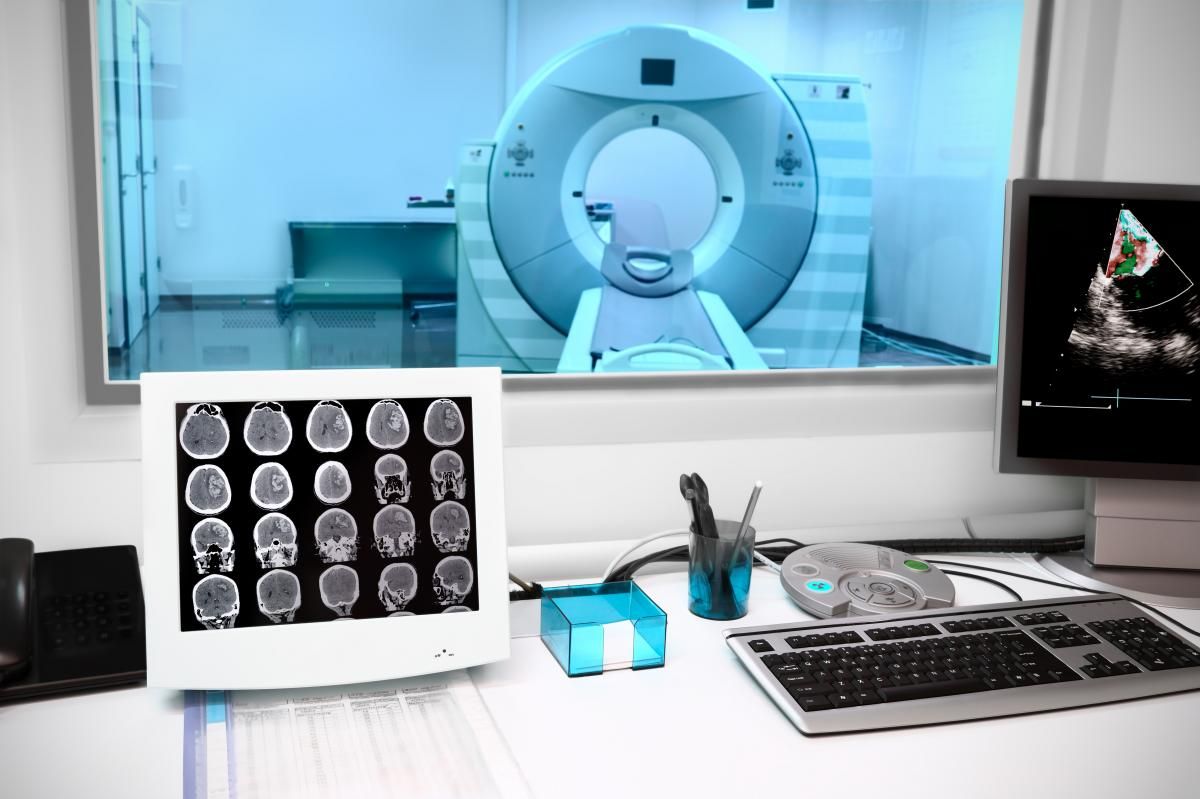
Пациенту с подозрением на разрыв аневризмы проводится в первую очередь компьютерная томография, что позволяет определить наличие кровоизлияния в головном мозге. Одновременно может быть проведена КТ-ангиография с введением контрастного вещества для получения изображения сосудов головного мозга и обнаружения места разрыва аневризмы (КТ-ангиография).
МРТ также применяется в диагностике аневризм. МР-исследование позволяет получать двухмерные и трехмерные изображения головного мозга, а детальное исследование артерий (МР-ангиография) позволяет обнаружить место разрыва аневризмы.
Дигитальная субтракционная ангиография сосудов головного мозга – во время этой процедуры в бедренную артерию вводится катетер, который подводится к артериям в головном мозге. Через катетер в сосуды поступает контрастное вещество, после чего выполняются рентгеновские снимки. Ангиография позволяет детально оценить состояние артерий головного мозга и место разрыва аневризмы. Это инвазивная процедура, и она используется в тех случаях, когда другие методы недостаточно информативны.
Вы можете обсудить с врачом необходимость проведения скрининговых обследований в том случае, если у ваших ближайших родственников были случаи разрыва аневризм или если у вас есть врожденные факторы риска развития аневризм сосудов головного мозга.
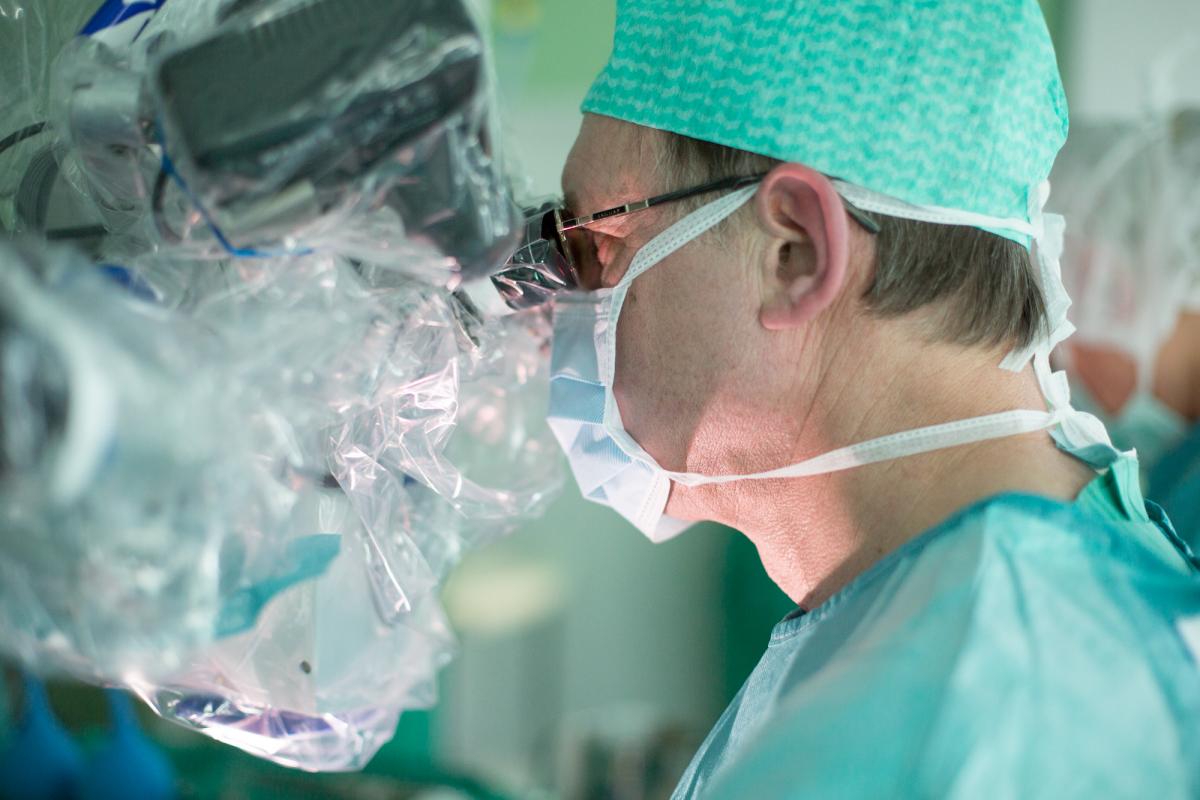
Существуют два основных варианта лечения аневризм:
Клипирование аневризмы – открытая операция, целью которой является выключение аневризмы из кровотока путем наложения специального металлического микрозажиа (микроклипсы) на шейку аневризмы в месте её отхождения от несущей артерии.
Эндоваскулярное лечение – малоинвазивная операция, в ходе которой в полость аневризмы вводятся микроспирали для выключения ее из кровотока.
Оптимальный вариант хирургического лечения аневризмы определяется нейрохирургом, исходя из размеров аневризмы, ее локализации, состояния здоровья пациента и других факторов.
В Клинике нейрохирургии Европейского медицинского центра под руководством всемирно известного нейрохирурга, д.м.н., профессора, член-корр. РАН Алексея Леонидовича Кривошапкина проводится хирургическое лечение аневризм и артериовенозных мальформаций сосудов головного мозга любой сложности. Многофункциональный госпиталь EMС на ул. Щепкина, Москва, располагает прекрасно оснащенными нейрохирургическими операционными и ангиографической операционной с системой последнего поколения Siemens Artis Zee Biplane для проведения как микрохирургических, так и эндоваскулярных операций на сосудах головного мозга с высочайшей точностью, что очень важно при лечении аневризмы головного мозга. Лечение в клинике включает весь комплекс восстановительных мероприятий с участием реабилитологов, физиотерапевтов, нейропсихологов, логопедов и других специалистов.
Сегодня, в день праздника медицинского работника, я Вас прошу передать слова благодарности профессору Дерлону. 20 сентября 2012 года он прооперировал мне поясничный отдел позвоночника. У меня все отлично! ( подробнее )
Сегодня, в день праздника медицинского работника, я Вас прошу передать слова благодарности профессору Дерлону. 20 сентября 2012 года он прооперировал мне поясничный отдел позвоночника. У меня все отлично! ( Скрыть )
Месяц назад у 1,5-годовалого Саши был обнаружен тяжелый порок развития – опухоль ствола головного мозга. Состояние ребенка ухудшалось с каждым днем вследствие прогрессирующего роста опухоли, которая вызывала повышение давления спинномозговой жидкости, выраженную гидроцефалию и связанные с ней тяжелые неврологические нарушения.
Мне 25 лет, вес примерно 54 кг. 05.09.12 была выполнена операция ляминэктомия Th10- L1 позвонков, макроскопическое тотальное удаление опухоли. ПГИ№63082-86 от 06.08.12 ( подробнее )
Мне 25 лет, вес примерно 54 кг. 05.09.12 была выполнена операция ляминэктомия Th10- L1 позвонков, макроскопическое тотальное удаление опухоли. ПГИ№63082-86 от 06.08.12 — миксопапилярная эпендимома. Состояние после: периферический нижний парапарез, нарушение функций тазовых органов (не могла пошевелить даже пальчиками ног, жгучая боль ниже грудной клетки до пальчиков ног). Далее лечение 25дней на аппарате «ЛУ» в режиме среднего факционирования. Осложнение заболевания: правосторонняя люмбоишалгия, нижний дистальный парапарез. Далее проведение МХТ (ломустин и ондансетрон). МРТ (от 26.03.13, 28.06.13, 09.12.13) и от 23.09.2014г. получены Т1 и Т2 взвешенные изображения поясночного отдела позвоночника в саггиттальной, корональной и аксиальной проекциях в нативном виде и с внутривенным введением контрастного препарата. В сравнении с МРТ-сканами от 09.12.13 г. определяется: поясничный лордоз умеренно сглажен, состояние после ляминэктомии Th10-L1позвонков, оперативного лечения опухоли. Интрадурально, на уровне Th8-L1, сохраняется объемное образование полиморфной (кистозно-солидной) структуры, с неровными, довольно четкими контурами, примерно прежними размерами : 145 мм. Образование располагается преимущественно спереди спинного мозга, оттесняя последний, за исключением кистоного компонента на уровне Th-12, с вовлечением спинного мозга. Образование слабо неравномерно накапливает контрастный препарат солидным компонентом образования. В спинном мозге на уровне Th11-L1 повышение МР-сигнала на Т2-ВИ. Высота м/п дисков равномерно уменьшена на уровне L4-5 и L5-S1, сигнал от дисков на Т2-ВИ снижен. Определяются умеренные дорсальные протрузии дисков до 3-4 мм. Заключение: интрадуральное экстрамедуллярное объемное образование на уровне Th8-L1, состояние после ляминэктомии Th10-L1 позвонков, оперативного лечения опухоли. Послеоперационные изменения: миелопатия на уровне Th11-L1, в сравнении с МРТ от 09.12.2013 г. образование без существенной динамики. Скажите, можно мне забеременить? Можно рожать или только кесарево сечение? Во время беременности может парализовать ноги? Заболевание может отразится на развитии и формировании плода? Можно повторно сделать операцию? Если нет, то почему?
Для определения дальнейшей тактики необходимо предоставить изображения МРТ с контрастированием за период 2012-2014. Также нужно предоставить недавний (или выполнить новый) осмотр неврологом с описанием ( подробнее )
Для определения дальнейшей тактики необходимо предоставить изображения МРТ с контрастированием за период 2012-2014. Также нужно предоставить недавний (или выполнить новый) осмотр неврологом с описанием динамики жалоб после операции в период 2012-2014 гг., описанием текущего неврологического статуса. Для оценки всех нюансов клинической картины и прецизионного определения дальнейшей тактики оптимальна очная консультация нейрохирурга EMC.
источник
Если у вас наблюдаются подобные симптомы, советуем записаться на прием к врачу. Своевременная консультация предупредит негативные последствия для вашего здоровья. Телефон для записи: +7 (495) 777-48-49
Аневризма сосудов головного мозга — это выпячивание стенки одной из главных артерий, снабжающих кровью головной мозг. Это выпячивание быстро растет и пополняется кровью. Аневризма начинает давить на мозговые ткани и окончания нервов, провоцируя ухудшение мозгового кровообращения. Существует риск разрыва выпячивания, после чего происходит кровоизлияние в мозг, проявляются расстройства неврологического спектра.
Заболевание годами может не проявляться у пациентов и выявляется случайно во время обследования. Для предотвращения риска, связанного с разрывом выпячивания стоит обратиться к неврологу, если вы заметили у себя такие признаки:
- нарушения зрения
- нарушения чувствительности рук и ног
- ухудшение двигательных функций
- эпилептические припадки
- глазная боль
- онемение лица
Признаки разрыва аневризмы:
- головная боль сильной интенсивности, имеющая определенную локализацию
- головокружение
- светобоязнь
- резкая боль в голове
- опущение века
- двоение в глазах
- тошнота, рвота
- потеря сознания
- судорожные припадки.
Заболевание бывает врожденным и приобретенным. Возникновению врожденной аневризмы способствуют аномалии развития, которые нарушают нормальную анатомию сосудов. Приобретенные аневризмы могут возникнуть после действия следующих факторов:
- травмы головы
- наследственность
- гипертензия
- опухоли
- занос инфекции через сосуды головного мозга
- атеросклероз
- наркомания
- прием препаратов оральной контрацепции
Учитывая влияние наследственных факторов, обследование на предмет аневризмы сосудов головного мозга должно проводится ближайшим родственникам пациента с таким заболеванием. В клинике «СМ-Клиника» есть все необходимые диагностические возможности для постановления такого диагноза.
Опытный невролог «СМ-Клиника» может предположить наличие аневризмы во время консультации пациента. После тщательного опроса и осмотра врач назначит рентгенологическое исследование для выявления выпячивания, после чего решит, как его вылечить.
Первым делом для диагностики аневризмы в центре «СМ-Клиника» проводится компьютерная томография. Эта методика обследования выявляет аневризму или кровоизлияние после ее разрыва.
Внутримозговая ангиограмма — это рентгенологическое исследование мозговых сосудов, которое проводится после внутривенного введения контрастных веществ. Оно показывает изменения в артериальных и венозных сосудах. В случае с аневризмой — исследование определяет расположение выпячивания, его форму и размер.
С помощью магнитно-резонансной томографии доктора «СМ-Клиника» получают двухмерные и трехмерные сечения мозга и сосудов и определяют особенности аневризмы.
Для выявления субарахноидального кровоизлияния после разрыва выпячивания в «СМ-Клиника» проводится поясничная пункция и проводится анализ цереброспинальной жидкости.
Способы лечения заболевания, используемые неврологами «СМ-Клиника» Москвы, делятся на консервативные и хирургические. Выбор метода терапии зависит от типа выпячивания, вероятности разрыва, его расположения, размера, физического состояния больного и рисков, сопряженных с лечением.
Безоперационное лечение заключается в назначении следующих средств:
- анальгетики
- противорвотные
- противосудорожные
- стабилизирующие кровяное давление
- антагонисты кальция и др.
Профилактика основана на своевременном обследовании людей, имеющих наследственную предрасположенность к появлению аневризм, контроле кровяного давления и соблюдении здорового образа жизни.
Если встал вопрос — где лечить аневризму сосудов головного мозга, не мешкайте — звоните по телефону +7 (495) 777-48-49 чтобы записаться на консультацию к врачу и узнать стоимость услуг.
источник
Ведущий врач отделения инвазивной нейрорадиологии
Аневризма сосудов головного мозга успешно лечится в Израиле в Топ Ассута, которая обладает мощнейшей технологической базой, позволяющей опытным врачам клиники быстро и очень точно устанавливать диагноз и избавлять пациентов от этой очень опасной патологии. Ранняя диагностика в клинике осуществляется с помощью специальных зрительных тестов и приборов видеоангиографии последнего поколения. Лечение проводится с применением самых современных и эффективных методов катетеризации в сочетании с такими инновационными методами, как стентирование, применение баллона или блокада аневризмы с помощью микроскопических спиралей.

Все эти составляющие, объединенные в стенах клиники Топ Ассута, дают возможность каждому пациенту получить профессиональное лечение и обрести шанс на новую жизнь – жизнь без болезни.
Аневризма лечится по индивидуально составленной лечебной программе, основанной на результатах точнейшей диагностики и особенностях патологического сосудистого образования.
- Медикаментозное лечение. Этот метод избирают в том случае, если в ходе диагностики установлено, что размеры аневризмы не превышают 1 см, ее стенки не повреждены и риск кровоизлияния отсутствует. Пациент находится под постоянным наблюдением врача, который контролирует состояние аневризмы посредством лекарственных препаратов. При лечении аневризмы головного мозга применяют:
- противосудорожные препараты;
- препараты для стабилизации кровяного давления;
- обезболивающие и противорвотные препараты;
- блокаторы кальциевых каналов.
- Хирургическое лечение. На сегодняшний день операция по удалению аневризмы сосудов головного мозга является единственным действенным способом полностью избавиться от опасной для жизни сосудистой патологии. После проведения тщательной диагностики врач разрабатывает индивидуальный план хирургического вмешательства. Благодаря современным технологиям и высокому уровню профессионализма нейрохирурги клиники Топ Ассута осуществляют лечение аневризмы мозга в Израиле малоинвазивным методом эндоваскулярной эмболизации.
- Эндоваскулярная эмболизация – уникальная и сложная нейрохирургическая операция, характеризующаяся минимальной травматичностью для пациента. В ходе проведения операции специальное оборудование позволяет врачам следить за каждым движением катетера в режиме реального времени. На специальный экран в операционной выводится трехмерное изображение кровеносных сосудов пациента, увеличенное в 50 раз. Таким образом, врачи полностью контролируют каждое движение катетера. Сначала в крупный сосуд вводят катетер, который подводят к аневризме мозга. После того как с помощью высокотехнологичной аппаратуры врачи подвели катетер к аневризме, к ней доставляются небольшие платиновые спирали, последовательность движений которых контролирует специальный баллон на конце катетера. Эти спирали выполняют роль искусственного тромба, выключающего аневризму из системы кровообращения. Манипуляции с сосудами головного мозга осуществляются в течение 5 минут, что позволяет избежать негативных последствий операции. Длительность оперативного вмешательства составляет 1 час 10 минут.
Загрузка формы. » data-toggle=»modal» data-form- >Консультация эксперта по ценам
Аневризма головного мозга – это заболевание, требующее тщательной и очень точной диагностики, которую качественно выполняют только в Израиле. В ходе диагностического обследования специалисты определяют точную локализацию аневризмы, ее тип, размер и степень вероятности ее разрыва. Диагностика в Топ Ассута длится 3 дня – этого времени опытнейшим врачам клиники вполне хватает для установления точнейшего диагноза с использованием ультрасовременного и инновационного оборудования.

- Развернутый анализ крови.
- Компьютерная томография (КТ).
- Магнитно-резонансная томография (МРТ).
- Позитронно-эмиссионная томография + КТ (ПЭТ-КТ).
- Спинномозговая пункция.
- Ангиография.
Специально сформированная комиссия специалистов клиники в области нейрохирургии изучает результаты всех проведенных исследований и обсуждает план предстоящего лечения аневризмы мозга. Все обсуждения происходят в непосредственном присутствии пациента. Коллегиальное решение позволяет достичь максимальной объективности и точности при планировании тактики терапии.
Один из немаловажных факторов в принятии решения относительно лечения аневризмы в Израиле – стоимость. На сегодняшний день лечение в израильских клиниках обходится пациентам на 50% дешевле, чем в заграничных учреждениях соответствующего уровня. Это обусловлено тем, что правительство Израиля стабильно финансирует научные исследования в области медицины и оказывает поддержку большинству клиник страны.
Получите информацию о стоимости лечения в клинике Топ Ассута у наших консультантов – заполните форму заявки или закажите бесплатный звонок оператора нашего call-центра.
источник
Версия: Клинические рекомендации РФ (Россия)
Ассоциация нейрохирургов России
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ЛЕЧЕНИЮ НЕРАЗОРВАВШИХСЯ АНЕВРИЗМ ГОЛОВНОГО МОЗГА (Москва, 2015)
Клинические рекомендации утверждены на Пленуме Правления Ассоциации нейрохирургов России 14.10.2015 г. Красноярск
Введение
В последние годы число обращений пациентов с неразорвавшимися аневризмами (НА) в нейрохирургические учреждения неуклонно возрастает. Опубликованные в зарубежной литературе серии по анализу этой патологии содержат до нескольких сотен, а кооперативные исследования – до нескольких тысяч больных.
Учитывая, что неразорвавшиеся аневризмы потенциально могут стать источником внутричерепного кровоизлияния, возникла необходимость определения тактики ведения и лечения этих больных. Единой точки зрения по этому вопросу не существует, хотя в последние годы рекомендации различных клиник все более совпадают по различным позициям и становятся более конкретными. Основной проблемой при выявлении неразорвавшейся аневризмы является оценка вероятного риска ее разрыва. Несмотря на опубликованные незначительные показатели первичных кровоизлияний из ранее неразорвавшихся аневризм [28, 75, 90], существуют группы больных с высоким риском разрыва аневризм. К таким факторам риска относят как морфологические особенности выявленной аневризмы (несколько куполов, неровность тела аневризмы, соотношение размера аневризмы к диаметру несущего сосуда, расположение, большой и гигантский размеры, увеличение размеров аневризмы с течением времени и т.д.), так и семейный анамнез кровоизлияния из аневризмы, наличие ряда вредных привычек, таких как курение, присутствие сопутствующих заболеваний (артериальная гипертензия). Существенное увеличение пациентов с диагностированными неразорвавшимися аневризмами в РФ и накопление значительного опыта хирургического лечения этой патологии явилось обоснованием для создания российского рекомендательного протокола по ведению и лечению больных с НА.
В настоящее время этиология и патогенез НА рассматриваются в рамках этиологии и патогенеза аневризм в целом. Факторы, лежащие в основе заболевания, принято делить на немодифицируемые и модифицируемые. К первым относят: генетические факторы [12, 26, 100]; ряд наследственных заболеваний [4, 9, 13, 19, 21, 84, 85, 99, 106, 120]; возраст и пол [6, 30, 31, 35, 40, 41, 62, 66, 71, 97, 103, 114, 115]. Во вторую группу входят: артериальная гипертония, курение, алкоголь, лекарства и вещества с симптомиметическим действием, пероральные контрацептивы [31, 32, 36, 45, 52, 53, 114]. Доказательность степени влияния этих факторов на формирование аневризм, в том числе, неразорвавшихся, различна.
Многие десятилетия распространенность аневризм в популяции определяли по частоте клинически проявившихся аневризм. Эта цифра составляла, с учетом всех типов проявления, не более 15 человек на 100 000 населения (0,015%).
Появление и повсеместное распространение неинвазивных методов исследования мозга, особенно неинвазивной ангиографии, привело к выявлению аневризм, не проявившихся клинически, что принципиально изменило представления о распространенности патологии.
По результатам метаанализа наиболее крупных исследований (68 исследований, 1931 – 2008гг) анализировавших распространенность НА [105], носителями аневризм в популяции в целом являются в среднем 2,8% человек. Было выявлено, что чаще аневризмы встречаются у женщин, а также в возрастной группе старше 30 лет.
Для людей без сопутствующей патологии со средним возрастом 50 лет эта цифра составляет 3,2% [96]. В различных исследованиях распространенность НА колеблется в зависимости от года исследования и его дизайна (метод обследования, возрастная группа, пол, сопутствующие заболевания и т.д.) [28, 49, 65, 103, 110]. Эти различия позволили авторам американского протокола по неразорвавшимся аневризмам (Guidelines for the Management of Patients With Unruptured Intracranial Aneurysms: A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association) сделать заключение о том, что распространенность НА неизвестна и требует дальнейшего проспективного изучения [96].
Множественные (2 и более) аневризмы были найдены у 15% — 30% пациентов с НА [23, 38, 43, 67, 73, 102]. Факторы риска выявления множественных аневризм – женский пол, курение, наличие артериальной гипертензии, семейный анамнез цереброваскулярных заболеваний и применение гормональной заместительной терапии в постменопаузальный период [36, 52].
Несмотря на различия ряда данных, в целом сведения о распространённости НА в разных исследованиях, особенно последних лет, схожи, и можно ориентироваться на цифру около 3%. Эктраполяция полученных данных на население РФ позволяет предположить, что около 4 млн человек в нашей стране являются носителями НА.
Группы повышенного риска выявления НА
Пол и возраст
Частота выявления НА увеличивается с возрастом, достигая максимума в возрастной группе от 50 до 60 лет. Чаще аневризмы выявляются у женщин, в независимости от возрастной категории [6, 30, 31, 35, 40, 41, 62, 66, 71, 97, 103, 114, 115].
Сопутствующие заболевания
Пациенты с перечисленными ниже заболеваниями входят в группу повышенного риска обнаружения неразорвавшихся аневризм [4, 9, 13, 19, 21, 84, 85, 99, 106, 120]:
— аутосомно-доминантный поликистоз почек (частота обнаружения аневризм в 3-14 раз выше по сравнению с основной популяцией)
— синдром Элерса-Данло IV типа
— синдром Марфана
— коарктация аорты
— двустворчатый аортальный клапан
— эластическая псевдоксантома
— наследственная геморрагическая телеангиэктазия
— нейрофиброматоз 1 типа
— недостаточность α1-антитрипсина
— фиброзномышечная дисплазия
— феохромацитома
— сидром Кляйнфельтера
— туберозный склероз
— Синдром Нунан (наследственное сочетание стеноза клапанов лёгочной артерии, гипертелоризма, оттопыренных ушных раковин и др. нарушений)
— недостаточность α-глюкозидазы
— первичная карликовость с микроцефалией и остеодисплазией
— внутричерепные артериовенозные мальформации
«Семейные аневризмы»
По данным различных исследований [9, 55, 56, 76-78, 83, 86, 94] частота встречаемости «семейных аневризм» составляет от 7 до 20% в зависимости от различных методов оценки семейного анамнеза и анализа полученных данных. Чаще выявляют неразорвавшиеся аневризмы среди родственников первого поколения пациента с разрывом аневризмы – около 4% [74, 94], с некоторой большей встречаемостью среди сибсов пациента, чем среди его детей.
К факторам, повышающим вероятность обнаружения аневризмы среди родственников больного, перенесшего САК, относят следующие: старший возраст, женский пол, курение, наличие в анамнезе гипертонической болезни, гиперхолестеринемия, семейный анамнез поликистозной болезни почек, семейный анамнез наличия САК или аневризмы у 2 и более родственников [74]. Частота выявления неразорвавшихся аневризм у родственников первой степени родства при наличии в анамнезе аневризм и/или САК у 2 и более членов их семей составляет от 8,7% [76] до 19,1% (старше 30 лет, наличие таких отягощающих факторов, как курение и гипертоническая болезнь) [9].
Риск разрыва аневризмы
Данные рандомизированных исследований
В настоящее время доступны данные двух крупных рандомизированных мультицентровых проспективных исследований, в которых оценивали риск разрыва случайно выявленной асимптомной аневризмы – UCAS (The Unruptured Cerebral Aneurysms Study) [97] и ISUIA (The International Study of Unruptured Intracranial Aneurysms) [114].
По данным исследования ISUIA факторами риска разрыва НА являлись: размер 7 и более мм, локализация в вертебробазилярном бассейне или в области задней соединительной артерии, наличие в анамнезе САК из другой аневризмы (разница значима для аневризм размером менее 7 мм) (см. таблицу 1) [114].
По данным исследования UCAS [97], проведенного в Японии, ежегодный риск разрыва аневризмы сильно варьировал в зависимости от размера аневризмы: 0.36% для аневризм размерами 3-4 мм, 0.50% — 5-6 мм, 1.69% — 7-9 мм, 4.37% — 10-24 мм и 33.4% для гигантских аневризм (размером 25 и более мм). Риск разрыва увеличивался при расположении аневризмы в области ПСА или ЗСА и при наличии дочерних куполов. Авторы отметили, что данные, полученные в ходе этого исследования, отражают более высокий риск разрыва аневризм в японской популяции и не могут быть перенесены на другие популяции.
Таблица 1. Риск разрыва НА в зависимости от ее размера и локализации (по данным ISUIA [114]).
| Пятилетний кумулятивный риск разрыва в соответствии с размером и расположением аневризмы | |||||
| 7-12 мм | 13-24 мм | 25 мм | |||
| Группа 1 | Группа 2 | ||||
| Кавернозный отдел ВСА (n=210) | 3.0% | 6.4% | |||
| ПСА и ПМА/СМА/ВСА | |||||
(n=1037)
средняя мозговая артерия, ВСА – внутренняя сонная артерия, ВББ – вертебробазилярный бассейн, ЗМА – задняя мозговая артерия, ЗСА – задняя соединительная артерия
Группа 1 – пациентов без САК
Группа 2 – пациенты с САК в анамнезе при разрыве другой аневризмы
Предрасполагающие факторы риска разрыва аневризмы
Рост аневризмы
К факторам, ответственным за рост аневризм с течением времени, относят повышенное АД, гемодинамический стресс в зависимости от формы аневризмы и ее расположения, изначальный размер аневризмы, воспаление в стенке аневризмы, женский пол, курение, молодой возраст, избыточное употребление алкоголя. Отмечается повышенный риск роста аневризм у пациентов с наличием инсульта или транзиторной ишемической атакой в анамнезе, и при выявлении множественных аневризм [39, 58, 89].
Проспективное исследование, проведенное в США и включавшее пациентов с аневризмами диаметром менее 7 мм и без наличия САК в анамнезе (всего 319 аневризм) не зафиксировало ни одного разрыва аневризмы за период наблюдения в течение 2,4 лет. Однако за период наблюдения был отмечен рост аневризмы как минимум на 0,75 мм у 5,4% пациентов в течение года [10].
Отмечено, что ежегодный риск разрыва «растущей» аневризмы может превышать данный показатель у аневризмы без роста в 12 раз [58, 71, 104].
Морфологические параметры и локализация
Наибольшая частота кровоизлияний характерна для аневризм в вертебробазилярном бассейне, в области ПСА и перикаллезной артерии [111,121]. Аневризмы в области СМА менее подвержены риску разрыва.
Больший риск разрыва аневризмы отмечают при выявлении следующих морфологических параметров: больший размер, неправильная форма и/или наличие дивертикулов, узкая шейка аневризмы, соотношение максимального размера аневризмы к диаметру несущей артерии более 2,05, соотношение высоты аневризмы к диаметру шейки более 1,6 [47, 80, 111, 121].
Другие факторы
Факторами риска разрыва НА являются молодой возраст, курение, артериальная гипертензия, женский пол, наличие в анамнезе САК из другой аневризмы, семейный анамнез САК [10, 61].
НА наиболее часто определяются в ходе обследования больных после кровоизлияния из другой аневризмы, а также при наличии у больного неврологической симптоматики или возникновения внезапной головной боли или изменения ее характера. В исследовании ISUIA неразорвавшаяся аневризма была выявлена у пациентов в ходе обследования по поводу кровоизлияния из другой аневризмы (30.4%), головной боли (23.7%), ТИА или ОНМК по ишемическому типу (10.5% и 10.6% соответственно), поражения черепных нервов (8.0%), судорожных припадков (2.9%), появления симптомов объемного образования головного мозга (2.7%), субдуральной или внутримозговой гематомы (1.2%), опухоли головного мозга (0.8%), демиелинизирующих заболеваний головного мозга (0.4%) и неопределенных “приступов” (7.1%) [114].
Характер проявления НА влияет на естественное течение заболевания и на выбор тактики лечения. Отмечено, что среди неразорвавшихся симптомных аневризм риск кровоизлияния в 4 раза выше по сравнению с асимптомными, случайно выявленными, аневризмами [111].
Диагностика
Возможности методов нейровизуализации аневризм резко расширились в последнее десятилетие, включая применение дигитальной субтракционной ангиографии в 2D и 3D режимах, МР-ангиографии и КТ-ангиографии.
После выявления неразорвавшейся аневризмы необходимо оценить ее анатомические особенности (и, что возможно будет доступно в широкой практике в будущем, гемодинамические параметры) как при первичном исследовании, так и при обследовании в динамике для определения дальнейшей тактики лечения [22, 63, 122].
Методы обследования
Магнитно-резонансная томография (МР-ангиография)
Для выявлении аневризм используют времяпролетную (TOF) МР-ангиографию и/или контрастные методы, чувствительность составляет от 74% до 98% [81]. Исследование необходимо проводить на аппаратах с напряжением магнитного поля не менее 1,5 Тесла. Чувствительность метода повышается размере аневризм 3 и более мм [51, 68, 72]. Недавно проведенный анализ результатов диагностики аневризм размерами 5 мм и менее с использованием 3T TOF МР-ангиографии с объемной визуализацией показал высокую точность данного метода — 96.4%–97.3% [50].
К преимуществам данного метода, благодаря которым его можно использовать как метод выбора для скриннинга, направленного на выявление НА [рекомендация], относят неинвазивность и отсутствие рентгеновского облучения.
Компьютерная томография в ангиографическом режиме (КТ-ангиография)
Чувствительность, специфичность и точность КТ-ангиографии в диагностике аневризм составляет 96.3%, 100% и 94.6% соответственно. При милиарных аневризмах размером менее 3 мм эти показатели составляют 81.8%, 100% и 93.3% соответственно [108].
При проведенном в 2003 мета-анализе 21 исследования, включавших 1251 пациентов, выявлено, что чувствительность и специфичность КТ-ангиографии составляет 93.3% и 87.8% соответственно в сравнении с цифровой церебральной ангиографией [14]. Выполнение КТ-ангиографии позволяет оценить наличие кальцификатов в стенке аневризмы и тромбов в ее полости [70]. Однако 3D-реконструкция может не совсем точно отражать истинную анатомию и размеры шейки/купола/несущего сосуда, особенно при аневризмах малых размеров (менее 5 мм) [29].
Дигитальная субтракционная ангиография (ДСА)
ДСА остается «золотым стандартом» в диагностике аневризм, особенно с введением в рутинную практику 3D-ротационной ангиографии, для выявления аневризм менее 3 мм и сосудов малого диаметра (в том числе, перфорирующих артерий) [20, 29, 46, 60, 91, 95, 101, 102, 116]. ДСА не может быть использована как скриннинговое исследование в связи с необходимостью госпитализации пациентов и наличием вероятных осложнений при проведении манипуляции, таких как аллергическая реакция на контраст, ОНМК по ишемическому типу, разрыв аневризмы, повреждение артерии, гематома в области пункции артерии и другие [34, 82]. Количество осложнения при проведении ДСА, включая постоянный неврологический дефицит у пациентов с аневризмами, САК и АВМ, не превышает 0.07% [17].
Проведение ДСА нецелесообразно [рекомендация] у пациентов с аутосомно-доминатным поликистозом почек, почечной недостаточностью, синдромом Элерса-Данло.
Анализ изображений [рекомендации]
При выявлении аневризмы, независимо от того, какой метод использовался, необходимо определить ряд параметров для уточнения тактики лечения и проведения динамического наблюдения. Необходимо оценить размеры шейки аневризмы, соотношение диаметра купола к диаметру шейки, угол расположения аневризмы относительно несущего сосуда (для латеральных аневризм), соотношение максимального размера купола к диаметру несущего сосуда, размеры аневризмы в 3 плоскостях [63].
Скриннинг
Определенные группы в популяции, имеющие повышенный риск обнаружения аневризм головного мозга, подлежат проведению скрининга. Пациент перед проведением обследования должен быть информирован о возможных последствиях как проведения самого исследования, так и различных видов лечения или консервативного лечения, включая такие психологические факторы, как стресс и тревогу, если аневризма будет обнаружена. Учитывая данные эпидемиологических исследований, можно рекомендовать проводить неинвазивные методы скрининга каждому человеку в общей популяции после 30 лет в независимости от наличия или отсутствия факторов риска обнаружения аневризмы. Если при первом обследовании данных за аневризму не обнаружено, повторное обследование можно рекомендовать по достижении 50 лет.
Проведение скрининга показано [рекомендации]:
— среди семей с наличием 1 и более членов с церебральной аневризмой в анамнезе;
— пациентам с семейным аневризматическим анамнезом/наличием геморрагического инсульта у одного и более членов семьи и наличием аутосомно-доминатного поликистоза почек, синдромом Элерса-Данло IV типа — частота обнаружения НА достигает 6% — 23% [69,118]
— пациентам с первичной карликовостью с микроцефалией и остеодисплазией [5] – у 52% обнаруживаются НА
— у пациентов с коарктацией аорты (выявляемость НА достигает 10.3% [18] или двустворчатым аортальным клапаном [18, 27, 118]
— родственникам первой линии больных с САК — частота обнаружения неразорвавшихся аневризм среди этой группы достигает 4%-19% с некоторым преобладанием среди сибсов в сравнении с детьми пациентов с САК [44, 54, 109, 117]
— пациентам с аутосомно-доминантным поликистозом почек и без семейного анамнеза аневризмы/геморрагического инсульта — у 6% — 11% выявляется церебральная аневризма [69, 118]
К факторам, повышающим риск обнаружения аневризм у всех популяционных групп, перечисленных выше, относят женский пол, курение, артериальную гипертензию [7, 9]
Получить консультацию по медтуризму
Получить консультацию по медтуризму
Хирургическое лечение пациентов с неразорвавшимися аневризмами
Отбор пациентов с неразорвавшимися аневризмами на операцию [рекомендации]
Проведение операции по поводу НА сосудов головного мозга показано при наличии одного и/или нескольких следующих факторов риска разрыва аневризмы:
• размер аневризмы 7 и более мм
• несферическая форма и наличие дивертикулов
• латеральное расположение аневризмы
• коэффициент соотношения высоты купола аневризмы к диаметру шейки аневризмы более 1,6
• коэффициент соотношения максимального размера аневризмы к диаметру несущего сосуда более 2,05
• угол отклонения латеральной аневризмы от несущей артерии более 1120
• рост размера аневризмы на 0,75 мм и более в течение 6 месяцев
• появление новых клинических проявлений (симптомы поражения черепных нервов, появление и/или изменение характера головных болей, ишемические нарушения в бассейне несущей аневризму артерии)
• незамкнутость артериального круга большого мозга
• «перианевризматическое» окружение – контакт аневризмы с ТМО, костями черепа, черепными нервами, артериями и венами
• множественные аневризмы
• наличие в анамнезе кровоизлияния из другой аневризмы
• курение
• артериальная гипертензия
При выявлении у больного НА размерами 3 мм и менее хирургическое лечение не показано, больному необходимо проведение динамического наблюдения с повторными обследованиями через 6, 12 месяцев и затем каждые 2 года [стандарт]. Подобному же наблюдению подлежат пациенты, отказавшиеся от хирургического лечения [стандарт].
При выявлении аневризм размерами от 3 до 7 мм необходимо измерение морфологических параметров аневризмы, вопрос о проведении хирургического лечения принимается индивидуально с учетом факторов риска (возраст, пол, наличие в анамнезе курения, гипертонической болезни, наличие «семейного» анамнеза, наличие генетических заболеваний) [рекомендации].
Больной с НА должен быть информирован о характере болезни, возможных вариантах течения, возможных осложнениях хирургического вмешательства [стандарт].
Обследование в нейрохирургическом стационаре [рекомендации]
После поступления больного в специализированный нейрохирургический стационар, помимо общих клинических исследований, необходимо провести:
— подробный неврологический осмотр;
— КТ-АГ или МР-АГ головного мозга при поступлении в том случае, если: с момента предыдущего исследования прошло более 6 месяцев; отмечено изменение в неврологическом статусе больного за время с момента выявления аневризмы до госпитализации; качество ранее выполненных КТ и/или МРТ низкое.
— проведение ДСА (в 2D и 3D режимах) показано пациентам со «сложными» аневризмами для оценки их морфологических особенностей и выбором тактики хирургического лечения; также больным с аневризмами размерами менее 7 мм для оценки их морфологических параметров и уточнения рисков разрыва.
Хирургические вмешательства у пациентов с неразорвавшимися церебральными аневризмами [рекомендации]
1) Микрохирургическое лечение:
— пациенты в возрасте до 60 лет
— аневризмы доступной локализации
— аневризмы большого и гигантского размера, оказывающие объемное воздействие на окружающие структуры
— частично тромбированные аневризмы
— при необходимости выполнения комбинированных (микрохирургическое выключение аневризмы из кровотока и реваскуляризирующие вмешательства) операций.
2) Эндоваскулярное лечение:
— пациенты в возрасте старше 60 лет
— локализация аневризм в вертебробазилярном бассейне, в области кавернозного отдела или офтальмического сегмента ВСА
— наличие декомпенсированных соматических заболеваний
Интраоперационный контроль эффективности прямого хирургического вмешательства [рекомендации]
Для подтверждения радикальности клипирования аневризмы и состоятельности кровотока по несущей артерии и функционально значимым ветвям выполняют следующее:
— пункция аневризмы и/или вскрытие просвета аневризмы
— визуальная оценка области клипирования (через микроскоп и/или эндоскоп)
— контактная интраоперационной допплерографии/флуометрия
— интраоперационная ангиография с использованием индоцианина зеленого
Оценка результатов операции и исходов лечения больных, динамическое наблюдение за пациентами после выключения аневризмы из кровотока
Окончательную оценку исходов проводят в сроки не ранее 6 месяцев после операции. Более раннюю оценку (при выписке больного) выполняют как промежуточный этап. Оценку исходов лечения проводят по шкале исходов Глазго.
Пациентам с оперированными церебральными аневризмами, вне зависимости от типа хирургического вмешательства, необходимо проведение контрольных обследований для исключения повторного заполнения аневризмы, оценки остаточной заполняющейся части аневризмы, а также для выявления аневризм de novo [63] [стандарт].
Для проведения динамического наблюдения за пациентами после операции возможно выполнение МР-ангиографии, КТ-ангиографии или ДСА.
Несмотря на то, что применение МР-ангиографии и КТ-ангиографии ограничивается наличием возможных артефактов от металлических имплантов, таких как клипсы, стенты и спирали, эти методы остаются достаточно эффективными для послеоперационного контроля [1, 2, 48, 88, 92]. Напряженность поля при выполнении контрольной МР-ангиографии должна быть 1,5 Тесла [опция].
Применение КТ-ангиографии для динамического наблюдения может быть ограничено в связи с нежелательностью рентгеновского облучения у ряда пациентов [70, 79, 98, 107].
Использование ДСА в качестве контрольного обследования у пациентов с оперированными аневризмами ограничено в связи с инвазивностью обследования и наличием радиационной нагрузки [24, 76].
После проведенного хирургического лечения контрольную ДСА в ранние сроки (до 2 недель после операции) выполняют в том случае, если аневризма не была полностью выключена, при сомнении хирурга в радикальности проведенной операции, или при подозрении на миграцию наложенного клипса. Повторное исследование после микрохирургической операции необходимо провести в течение 6-12 месяцев после вмешательства [рекомендация].
После выполнения эндоваскулярного вмешательства необходимо выполнение контрольного обследования (ДСА) в период от 6 до 12 месяцев после операции [1, 2, 3, 48, 72, 87, 92] [рекомендации]. Время последующих контрольных обследований зависит от характера окклюзии аневризмы при вмешательстве и первом контрольном обследовании, а также от состояния пациента. При наличии резидуальной аневризмы после эмболизации или стентирования обязательно проведение обследований в отдаленном периоде, так как возможны кровоизлияния и рост остаточной части аневризмы. Показано проведение серии контрольных обследований при аневризмах с широкой шейкой, больших и гигантских аневризмах, так как у них имеется высокий риск повторного заполнения [10, 93].
Всем пациентам, входящим в популяционные группы риска по формированию аневризм, независимо от вида оперативного вмешательства, после завершения периода наблюдения можно рекомендовать выполнение неинвазивных методов обследования (МР- или КТ-ангиографии) 1 раз в 5 лет для исключения формирования аневризм de novo [рекомендация].
Динамическое наблюдение за пациентами с неразорвавшимися церебральными аневризмами, не получавшими хирургического лечения [рекомендации]
Пациентам с неразорвавшимися аневризмами сосудов головного мозга, которые не получали хирургического лечения, необходимо проведение нейровизуализационного обследования в динамике для исключения роста аневризмы, изменения ее формы и появление других факторов риска ее разрыва [4, 11, 24, 25, 37, 42, 59, 64].
1) При отсутствии противопоказаний основной методикой для проведения динамического наблюдения является TOF MRA (времяпролётная магнитно-резонансная ангиография), а также у пациентов с почечной недостаточностью и тем, у кого имеет значение доза полученного рентгеновского облучения.
2) КТ-ангиография головного мозга является методом выбора у пациентов с противопоказаниями к проведению МРТ или при наличии аневризм, которые не могут быть правильно оценены с помощью МРТ (милиарные аневризмы менее 3 мм, «сложные» аневризмы).
3) Первое динамическое обследование после выявления неразорвавшейся аневризмы необходимо проводить в период от 6 до 12 месяцев [8, 33, 56, 112, 113]. Затем рекомендуется проводить обследование 1 раз в год или каждые 2 года при отсутствии признаков роста аневризмы и/или изменения ее других морфологических параметров (формы, расположение относительно несущего сосуда и т.д.) [113].
Больного с неразорвавшейся аневризмой сосудов головного мозга, при наличии показаний к хирургическому лечению, необходимо госпитализировать в плановом порядке в стационары, где имеются:
— нейрохирургическое отделение;
— специалисты, владеющие опытом прямых микрохирургических операций по поводу церебральных аневризм;
— специалисты, владеющие опытом эндоваскулярного выключения аневризм;
— отделение лучевой диагностики, оснащенное аппаратурой для проведения КТ или МРТ, спиральной КТ-ангиографии, МР-ангиографии, ангиографическая операционная для проведения ДСА и выполнения эндовазальных операций;
— операционная, оснащенная оборудованием для микрохирургии церебральных аневризм (операционный микроскоп, микрохирургический инструментарий, съемные и постоянные немагнитные клипсы);
— отделение нейрореанимации.
- Клинические рекомендации Ассоциации нейрохирургов России
- 1.Agid R, Schaaf M, Farb R. CE-MRA for follow-up of aneurysms post stent-assisted coiling. Interv Neuroradiol. 2012;18:275–283. 2. Anzalone N, Scomazzoni F, Cirillo M, Cadioli M, Iadanza A, Kirchin MA, Scotti G. Follow-up of coiled cerebral aneurysms: comparison of three-dimensional time-of-flight magnetic resonance angiography at 3 tesla with three-dimensional time-of-flight magnetic resonance angiography and contrast-enhanced magnetic resonance angiography at 1.5 Tesla. Invest Radiol. 2008;43:559–567. doi: 10.1097/RLI.0b013e31817e9b0b. 3. Anzalone N, Scomazzoni F, Cirillo M, Righi C, Simionato F, Cadioli M, Iadanza A, Kirchin MA, Scotti G. Follow-up of coiled cerebral aneurysms at 3T: comparison of 3D time-of-flight MR angiography and contrast-enhanced MR angiography. AJNR Am J Neuroradiol. 2008;29:1530–1536. doi: 10.3174/ajnr.A1166. 4. Badani KK, Hemal AK, Menon M. Autosomal dominant polycystic kidney disease and pain: a review of the disease from aetiology, evaluation, past surgical treatment options to current practice. J Postgrad Med. 2004;50:222–226. 5. Bober MB, Khan N, Kaplan J, Lewis K, Feinstein JA, Scott CI Jr, Steinberg GK. Majewski osteodysplastic primordial dwarfism type II (MOPD II): expanding the vascular phenotype. Am J Med Genet A. 2010;152A:960–965. doi: 10.1002/ajmg.a.33252. 6. Brinjikji W, Rabinstein AA, Lanzino G, Cloft HJ. Racial and ethnic disparities in the treatment of unruptured intracranial aneurysms: a study of the Nationwide Inpatient Sample 2001–2009. Stroke. 2012;43:3200–3206. doi: 10.1161/STROKEAHA.112.671214. 7. Broderick JP, Brown RD Jr, Sauerbeck L, Hornung R, Huston J 3rd, Woo D, Anderson C, Rouleau G, Kleindorfer D, Flaherty ML, Meissner I, Foroud T, Moomaw EC, Connolly ES; FIA Study Investigators. Greater rupture risk for familial as compared to sporadic unruptured intracranial aneurysms. Stroke. 2009;40:1952–1957. doi: 10.1161/STROKEAHA.108.542571. 8. Brown RD. Unruptured intracranial aneurysms. Semin Neurol. 2010;30:537–544. doi: 10.1055/s-0030-1268858. 9. Brown RD Jr, Huston J, Hornung R, Foroud T, Kallmes DF, Kleindorfer D, Meissner I, Woo D, Sauerbeck L, Broderick J. Screening for brain aneurysm in the Familial Intracranial Aneurysm study: frequency and predictors of lesion detection. J Neurosurg. 2008;108:1132–1138. doi:10.3171/JNS/2008/108/6/1132. 10. Bruneau M, Rynkowski M, Smida-Rynkowska K, Brotchi J, De Witte O, Lubicz B. Long-term follow-up survey reveals a high yield, up to 30% of atients presenting newly detected aneurysms more than 10 years after ruptured intracranial aneurysms clipping. Neurosurg Rev. 2011;34:485– 496. doi: 10.1007/s10143-011-0332-7. 11. Burns JD, Huston J 3rd, Layton KF, Piepgras DG, Brown RD Jr. Intracranial aneurysm enlargement on serial magnetic resonance angiography: frequency and risk factors. Stroke. 2009;40:406–411. doi: 10.1161/STROKEAHA.108.519165. 12. Caranci F, Briganti F, Cirillo L, Leonardi M, Muto M. Epidemiology and genetics of intracranial aneurysms. Eur J Radiol. 2013;82:1598–1605. doi: 10.1016/j.ejrad.2012.12.026 13.Chapman AB, Rubinstein D, Hughes R, Stears JC, Earnest MP, Johnson AM, Gabow PA, Kaehny WD. Intracranial aneurysms in autosomal dominant polycystic kidney disease. N Engl J Med. 1992;327:916– 920. doi: 10.1056/NEJM199209243271303. 14. Chappell ET, Moure FC, Good MC. Comparison of computed tomographic angiography with digital subtraction angiography in the diagnosis of cerebral aneurysms: a meta-analysis. Neurosurgery. 2003;52:624–631. 15. Chen M, Ouyang B, Goldstein-Smith L, Feldman L. Oral contraceptive and hormone replacement therapy in women with cerebral aneurysms. J Neurointerv Surg. 2011;3:163–166. doi: 10.1136/jnis.2010.003855. 16. Chien A, Liang F, Sayre J, Salamon N, Villablanca P, Viсuela F. Enlargement of small, asymptomatic, unruptured intracranial aneurysms in patients with no history of subarachnoid hemorrhage: the different factors related to the growth of single and multiple aneurysms. J Neurosurg. 2013;119:190–197. doi: 10.3171/2013.3.JNS121469. 17. Cloft HJ, Joseph GJ, Dion JE. Risk of cerebral angiography in patients with subarachnoid hemorrhage, cerebral aneurysm, and arteriovenous malformation: a meta-analysis. Stroke. 1999;30:317–320. doi:10.1161/01.STR.30.2.317. 18. Connolly HM, Huston J 3rd, Brown RD Jr, Warnes CA, Ammash NM, Tajik AJ. Intracranial aneurysms in patients with coarctation of the aorta: a prospective magnetic resonance angiographic study of 100 patients. Mayo Clin Proc. 2003;78:1491–1499. doi: 10.4065/78.12.1491. 19. Conway JE, Hutchins GM, Tamargo RJ. Marfan syndrome is not associated with intracranial aneurysms. Stroke. 1999;30:1632–1636. 20. Dammert S, Krings T, Moller-Hartmann W, Ueffing E, Hans FJ, Willmes K, Mull M, Thron A. Detection of intracranial aneurysms with multislice CT: comparison with conventional angiography. Neuroradiology. 2004;46:427–434. doi: 10.1007/s00234-003-1155-1. 21. DeMeo DL, Silverman EK. Alpha1-antitrypsin deficiency, 2: genetic aspects of alpha(1)-antitrypsin deficiency: phenotypes and genetic modifiers of emphysema risk. Thorax. 2004;59:259–264. 22. Delgado Almandoz JE, Jagadeesan BD, Refai D, Moran CJ, Cross DT 3rd, Chicoine MR, Rich KM, Diringer MN, Dacey RG Jr, Derdeyn CP, Zipfel GJ. Diagnostic yield of computed tomography angiography and magnetic resonance angiography in patients with catheter angiographynegative subarachnoid hemorrhage. J Neurosurg. 2012;117:309–315. doi: 10.3171/2012.4.JNS112306. 23. Ellamushi HE, Grieve JP, Jager HR, Kitchen ND. Risk factors for the formation of multiple intracranial aneurysms. J Neurosurg. 2001;94:728– 732. doi: 10.3171/jns.2001.94.5.0728. 24. Ferns SP, Sprengers ME, van Rooij WJ, van den Berg R, Velthuis BK, de Kort GA, Sluzewski M, van Zwam WH, Rinkel GJ, Majoie CB. De novo aneurysm formation and growth of untreated aneurysms: a 5-year MRA follow-up in a large cohort of patients with coiled aneurysms and review of the literature. Stroke. 2011;42:313–318. doi: 10.1161/STROKEAHA.110.591594. 25. Ferns SP, Majoie CB, Sluzewski M, van Rooij WJ. Late adverse events in coiled ruptured aneurysms with incomplete occlusion at 6-month angiographic follow-up. AJNR Am J Neuroradiol. 2010;31:464–469. doi: 10.3174/ajnr.A1841. 26. Foroud T, Koller DL, Lai D, Sauerbeck L, Anderson C, Ko N, Deka R, Mosley TH, Fornage M, Woo D, Moomaw CJ, Hornung R, Huston J, Meissner I, Bailey-Wilson JE, Langefeld C, Rouleau G, Connolly ES, Worrall BB, Kleindorfer D, Flaherty ML, Martini S, Mackey J, De Los Rios La Rosa F, Brown RD Jr, Broderick JP; FIA Study Investigators. Genome-wide association study of intracranial aneurysms confirms role of Anril and SOX17 in disease risk. Stroke. 2012;43:2846–2852. doi: 10.1161/STROKEAHA.112.656397. 27. Germain DP, Herrera-Guzman Y. Vascular Ehlers-Danlos syndrome. Ann Genet. 2004;47:1–9 28.34. Go AS, Mozaffarian D, Roger VL, Benjamin EJ, Berry JD, Blaha MJ, Dai S, Ford ES, Fox CS, Franco S, Fullerton HJ, Gillespie C, Hailpern SM, Heit JA, Howard VJ, Huffman MD, Judd SE, Kissela BM, Kittner SJ, Lackland DT, Lichtman JH, Lisabeth LD, Mackey RH, Magid DJ, Marcus GM, Marelli A, Matchar DB, McGuire DK, Mohler ER 3rd, Moy CS, Mussolino ME, Neumar RW, Nichol G, Pandey DK, Paynter NP, Reeves MJ, Sorlie PD, Stein J, Towfighi A, Turan TN, Virani SS, Wong ND, Woo D, Turner MB; on behalf of the American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Heart disease and stroke statistics—2014 update: a report from the American Heart Association. Circulation. 2014;129:e28–e292. doi: 10.1161/01. cir.0000441139.02102.80. 29. Hirai T, Korogi Y, Ono K, Murata Y, Suginohara K, Omori T, Uemura S, Takahashi M. Preoperative evaluation of intracranial aneurysms: usefulness of intraarterial 3D CT angiography and conventional angiography with a combined unit: initial experience. Radiology. 2001;220:499–505. doi: 10.1148/radiology.220.2.r01au20499. 30. Horikoshi T, Akiyama I, Yamagata Z, Nukui H. Retrospective analysis of the prevalence of asymptomatic cerebral aneurysm in 4518 patients undergoing magnetic resonance angiography: when does cerebral aneurysm develop? Neurol Med Chir (Tokyo). 2002;42:105–112. 31. International Study of Unruptured Intracranial Aneurysms Investigators. Unruptured intracranial aneurysms: risk of rupture and risks of surgical intervention [published correction appears in N Engl J Med. 1999;340:744]. N Engl J Med. 1998;339:1725–1733. 32. Irazabal MV, Huston J 3rd, Kubly V, Rossetti S, Sundsbak JL, Hogan MC, Harris PC, Brown RD Jr, Torres VE. Extended follow-up of unruptured intracranial aneurysms detected by presymptomatic screening in patients with autosomal dominant polycystic kidney disease. Clin J Am Soc Nephrol. 2011;6:1274–1285. doi: 10.2215/CJN.09731110. 33. Ishibashi T, Murayama Y, Urashima M, Saguchi T, Ebara M, Arakawa H, Irie K, Takao H, Abe T. Unruptured intracranial aneurysms: incidence of rupture and risk factors. Stroke. 2009;40:313–316. doi: 10.1161/ STROKEAHA.108.521674. 34. Jackson A, Stewart G, Wood A, Gillespie JE. Transient global amnesia and cortical blindness after vertebral angiography: further evidence for the role of arterial spasm. AJNR Am J Neuroradiol. 1995;16(suppl):955–959. 35. Jeon TY, Jeon P, Kim KH. Prevalence of unruptured intracranial aneurysm on MR angiography. Korean J Radiol. 2011;12:547–553. doi:10.3348/kjr.2011.12.5.547. 36. Johnston SC, Colford JM Jr, Gress DR. Oral contraceptives and the risk of subarachnoid hemorrhage: a meta-analysis. Neurology. 1998;51:411–418. 37. Jiang T, Wang P, Qian Y, Zheng X, Xiao L, Yu S, Liu S. A follow-up study of autosomal dominant polycystic kidney disease with intracranial aneurysms using 3.0 T three-dimensional time-of-flight magnetic resonance angiography. Eur J Radiol. 2013;82:1840–1845. doi: 10.1016/j.ejrad.2013.01.024. 38. Juvela S. Risk factors for multiple intracranial aneurysms. Stroke.2000;31:392–397. doi: 10.1161/01.STR.31.2.392. 39. Juvela S. Natural history of unruptured intracranial aneurysms: risks for aneurysm formation, growth, and rupture. Acta Neurochir Suppl. 2002;82:27–30. 40. Juvela S, Porras M, Heiskanen O. Natural history of unruptured intracranial aneurysms: a long-term follow-up study. J Neurosurg. 1993;79:174– 182. doi: 10.3171/jns.1993.79.2.0174. 41. Juvela S, Porras M, Poussa K. Natural history of unruptured intracranial aneurysms: probability of and risk factors for aneurysm rupture. J Neurosurg. 2000;93:379–387. doi: 10.3171/jns.2000.93.3.0379. 42. Juvela S, Poussa K, Porras M. Factors affecting formation and growth of intracranial aneurysms: a long-term follow-up study. Stroke. 2001;32:485– 491. doi: 10.1161/01.STR.32.2.485. 43. Kaminogo M, Yonekura M, Shibata S. Incidence and outcome of multiple intracranial aneurysms in a defined population. Stroke. 2003;34:16–21. doi: 10.1161/01.STR.0000046763.48330.AD. 44. Kissela BM, Sauerbeck L, Woo D, Khoury J, Carrozzella J, Pancioli A, Jauch E, Moomaw CJ, Shukla R, Gebel J, Fontaine R, Broderick J. Subarachnoid hemorrhage: a preventable disease with a heritable component. Stroke. 2002;33:1321–1326. doi: 10.1161/01.STR.0000014773.5773. 45. Klatsky AL, Armstrong MA, Friedman GD. Alcohol use and subsequent cerebrovascular disease hospitalizations. Stroke. 1989;20:741–746. doi: 10.1161/01.STR.20.6.741. 46. Kucukay F, Okten RS, Tekiner A, Dagli M, Gocek C, Bayar MA, Cumhur T. Three-dimensional volume rendering digital subtraction angiography in comparison with two-dimensional digital subtraction angiography and rotational angiography for detecting aneurysms and their morphological properties in patients with subarachnoid hemorrhage. Eur J Radiol. 2012;81:2794–2800. doi: 10.1016/j.ejrad.2011.10.006. 47. Lall RR, Eddleman CS, Bendok BR, Batjer HH. Unruptured intracranial aneurysms and the assessment of rupture risk based on anatomical and morphological factors: sifting through the sands of data. Neurosurg Focus. 2009;26:E2. doi: 10.3171/2009.2.FOCUS0921. 48. Lavoie P, Gariйpy JL, Milot G, Jodoin S, Bйdard F, Trottier F, Verreault R. Residual flow after cerebral aneurysm coil occlusion: diagnostic accuracy of MR angiography. Stroke. 2012;43:740–746. doi: 10.1161/ STROKEAHA.111.635300. 49. Li MH, Chen SW, Li YD, Chen YC, Cheng YS, Hu DJ, Tan HQ, Wu Q, Wang W, Sun ZK, Wei XE, Zhang JY, Qiao RH, Zong WH, Zhang Y, Lou W, Chen ZY, Zhu Y, Peng DR, Ding SX, Xu XF, Hou XH, Jia WP. Prevalence of unruptured cerebral aneurysms in Chinese adults aged 35 to 75 years: a cross- sectional study. Ann Intern Med. 2013;159:514–521. doi: 10.7326/0003-4819-159-8-201310150-00004. 50. Li MH, Li YD, Gu BX, Cheng YS, Wang W, Tan HQ, Chen YC. Accurate diagnosis of small cerebral aneurysms ≤5 mm in diameter with 3.0-T MR angiography. Radiology. 2014;271:553–560. doi: 10.1148/radiol.14122770. 51.Li MH, Cheng YS, Li YD, Fang C, Chen SW, Wang W, Hu DJ, Xu HW. Large-cohort comparison between three-dimensional time-of-flight magnetic resonance and rotational digital subtraction angiographies in intracranial aneurysm detection. Stroke. 2009;40:3127–3129. doi: 10.1161/ STROKEAHA.109.553800. 52.Lindegеrd B, Hillbom M, Brody S. High-dose estrogen-progestagen oral contraceptives: a risk factor for aneurysmal subarachnoid hemorrhage? Acta Neurol Scand. 1987;76:37–45. 53. Lindgren AE, Kurki MI, Riihinen A, Koivisto T, Ronkainen A, Rinne J, Hernesniemi J, Eriksson JG, Jддskelдinen JE, von und zu Fraunberg M. Hypertension predisposes to the formation of saccular intracranial aneurysms in 467 unruptured and 1053 ruptured patients in Eastern Finland. Ann Med. 2014;46:169–176. doi: 10.3109/07853890.2014.883168. 54. Longstreth WT Jr, Nelson LM, Koepsell TD, van Belle G. Cigarette smoking, alcohol use, and subarachnoid hemorrhage. Stroke. 1992;23:1242–1249. doi: 10.1161/01.STR.23.9.1242. 55.64. Lozano AM, Leblanc R. Familial intracranial aneurysms. J Neurosurg. 1987;66:522–528. doi: 10.3171/jns.1987.66.4.0522. 56. Loumiotis I, Wagenbach A, Brown RD Jr, Lanzino G. Small (
Крылов Владимир Викторович академик РАН, профессор, доктор медицинских наук, заведующий научным отделением неотложной нейрохирургии НИИ скорой помощи им. Н.В. Склифосовского, заведующий кафедрой нейрохирургии и нейрореанимации Московского государственного медико-стоматологического университета им. А.И. Евдокимова, главный внештатный специалист нейрохирург Министерства Здравоохранения Российской Федерации Элиава Шалва Шалвович Доктор медицинских наук, профессор, заведующий отделением сосудистой нейрохирургии НИИ НХ им. акад. Н.Н. Бурденко Яковлев Сергей Борисович Доктор медицинских наук, заведующий отделением эндоваскулярной нейрохирургии НИИ НХ им. акад. Н.Н. Бурденко Хейреддин Али Садек Доктор медицинских наук, врач отделения сосудистой нейрохирургии НИИ НХ им. акад. Н.Н. Бурденко Белоусова Ольга Бенуановна Доктор медицинских наук, ведущий научный сотрудник отделения сосудистой нейрохирургии НИИ НХ им. акад. Н.Н. Бурденко Полунина Наталья Алексеевна Кандидат медицинских наук, научный сотрудник отделения неотложной нейрохирургии НИИ СП им. Н.В. Склифосовского Определение понятий
Стандарт
Общепринятые принципы диагностики и лечения, которые могут рассматриваться в качестве обязательной лечебной тактики (эффективность подтверждена несколькими рандомизированными исследованиями, мета-анализами или когортными клиническими исследованиями).Рекомендация
Лечебные и диагностические мероприятия, рекомендованные к использованию большинством экспертов по данным вопросам. Могут рассматриваться как варианты выбора лечения в конкретных клинических ситуациях (эффективность подтверждена отдельными рандомизированными исследованиями или когортными клиническими исследованиями).Опция
Лечебные и диагностические мероприятия, которые могут быть полезны (эффективность подтверждена мнением отдельных экспертов, в отдельных клинических случаях).Не рекомендуется
Лечебные и диагностические мероприятия, не имеющие положительного эффекта или могущие принести вред (любой уровень подтверждения).источник