*Импакт фактор за 2017 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
На основании данных современной литературы и анализа собственных клинических наблюдений освещены клинико-анамнестические и лабораторные особенности железодефицитной, фолиеводефицитной и витамин В12-дефицитной анемий у детей. Представлены основные принципы верификации причин анемического синдрома, обусловленного недостаточностью в организме ребенка железа, фолиевой кислоты и витамина В12. Изложены ключевые положения, лежащие в основе дифференциального диагноза между железодефицитной, фолиеводефицитной и витамин В12-дефицитной анемиями. Представлены принципы лечения указанных дефицитных анемий у детей. Выявление анемии у ребенка определяет необходимость обязательного уточнения причин указанного патологического состояния. При этом своевременная верификация этиологии анемии позволяет без промедления начать адекватную терапию, что определяет ее эффективность и улучшает качество жизни ребенка в целом. Поздняя диагностика и отсутствие адекватной терапии при этом приводят к прогрессированию патологических процессов. Это негативно сказывается на росте и развитии детского организма, ухудшает качество жизни ребенка. Принимая во внимание актуальность данной проблемы, авторы пришли к выводу о необходимости представить для практикующих врачей-педиатров ключевые положения по дифференциальной диагностике и лечению анемий, обусловленных дефицитом железа, фолиевой кислоты и витамина В12 у детей.
Ключевые слова: анемия, витамин В12-дефицитная анемия, дети, железодефицитная анемия, фолиеводефицитная анемия.
Для цитирования: Заплатников А.Л., Османов И.М., Ефимов М.С., Дементьев А.А., Чабаидзе Ж.Л., Майкова И.Д., О.А. Кузнецова, А.С. Воробьева, Е.Р. Радченко, Гончарова Л.В., Гавеля Н.В. Диагностика и принципы лечения дефицитных анемий у детей (в таблицах и схемах) // РМЖ. Медицинское обозрение. 2019. №3. С. 2-5
Diagnosis and treatment principles of deficiency anemia in children (in tables and diagrams)
A.L. Zaplatnikov 1,2 , I.M. Osmanov 2 , M.S. Efimov 1 , A.A. Dementiev1, Zh.L. Chabaidze 1 , I.D. Maikova 2 , O.A. Kuznetsova 2 , A.S. Vorobieva 2 , E.R. Radchenko 2 , L.V. Goncharova 2 , N.V. Gavelia 2
1 Russian Medical Academy of Continuous Professional Education, Moscow
2 Z.A. Bashlyaeva Children’s City Clinical Hospital, Moscow
The article highlights the clinical, anamnestic and laboratory properties of iron-deficiency, folic acid-deficiency, and vitamin B12-deficiency anemia in children, based on the data of modern literature and in-house clinical observation analysis. The basic verification principles of the anemic syndrome causes associated with iron, folic acid and vitamin B12 deficiency in children are presented. The fundamental provisions underlying the differential diagnosis between iron-deficiency, folic acid-deficiency, and vitamin B12-deficiency anemia are also reviewed. In addition, the article describes the treatment principles in children with nutritional deficiency anemia. Anemia manifestation in a child determines the need for mandatory cause clarification of this pathological condition. At the same time, timely verification of the anemia etiology allows starting adequate therapy without delay, which determines its effectiveness and improves the child’s life quality as a whole. Late diagnosis and lack of adequate therapy, however, lead to the pathological processes progression. This has a negative impact on the child’s body growth and development and worsens his life quality in general. The authors came to the conclusion that it is necessary to present fundamental provisions for practicing pediatricians on anemia differential diagnosis and treatment associated with iron, folic acid and vitamin B12 deficiency in children, taking into account this problem urgency.
Keywords: anemia, vitamin B12-deficiency anemia, children, iron-deficiency anemia, folic acid- deficiency anemia.
For citation: Zaplatnikov A.L., Osmanov I.M., Efimov M.S. et al. Diagnosis and treatment principles of deficiency anemia in children (in tables and diagrams). RMJ. Medical Review. 2019;3:6–9.
В статье освещены клинико-анамнестические и лабораторные особенности железодефицитной, фолиеводефицитной и витамин В12-дефицитной анемий у детей. Представлены основные принципы дифференциальной диагностики и лечения указанных дефицитных анемий у детей.
Критерием анемии, независимо от этиологии, является снижение уровня гемоглобина (Hb) ниже возрастной нормы. Так, синдром анемии констатируют, если концентрация Hb в капиллярной крови ниже: 110 г/л — у детей в возрасте от 1 мес. до 5 лет, 115 г/л — у детей 6–12 лет, 120 г/л — у детей старше 12 лет и подростков. Кроме этого, зная уровень Hb, можно определить тяжесть анемического синдрома. Так, для детей, достигших месячного возраста и старше, снижение Нb до 90 г/л является признаком анемии легкой степени, уровень Нb в пределах 70–90 г/л характерен для анемии средней тяжести, а падение Нb ниже 70 г/л определяет тяжелую степень анемии [1–4].
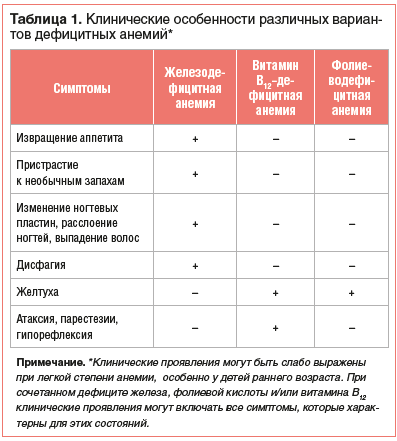
Нозологическая верификация характера анемии проводится на основе анализа клинико-анамнестических данных, результатов лабораторного и, если необходимо, инструментального обследования пациента. Общими клиническими проявлениями анемии, независимо от этиологии, являются повышенная утомляемость, снижение работоспособности, склонность к инфекциям. Среди дополнительных симптомов, которые могут отмечаться при ЖДА, — извращение аппетита и пристрастие к необычным запахам, изменение ногтевых пластин, расслоение ногтей, выпадение волос, атрофия сосочков языка, дисфагия. В свою очередь, при витамин В12-дефицитной анемии имеют место неврологические нарушения (атаксия, парестезии, гипорефлексия и другие проявления фуникулярного миелоза), «лакированный» язык и желтуха. Непрямая гипербилирубинемия может также отмечаться и при фолиеводефицитной анемии (табл. 1).
Наличие желтухи и анемии при этом нередко становится причиной ошибочного заключения о гемолитическом характере анемии, если врач не обращает внимания на отсутствие ретикулоцитоза. Следует отметить, что иктеричность при анемиях, обусловленных дефицитом витамина В12 или фолиевой кислоты, связана с неэффективным эритропоэзом и повышенным разрушением предшественников эритроцитов в костном мозге [1–3, 5–7].
Несмотря на описанные выше симптомы, типичные для конкретных ДА, их клинические проявления могут быть слабо выражены при легкой степени анемии, особенно у детей раннего возраста. В связи с этим этиологическая верификация генеза анемического синдрома проводится на основании не только клинических проявлений и анамнестических данных. Обязательным условием установления диагноза является корректная трактовка результатов лабораторного обследования. При этом минимально достаточным уровнем лабораторного обследования является проведение клинического и биохимического анализов крови.
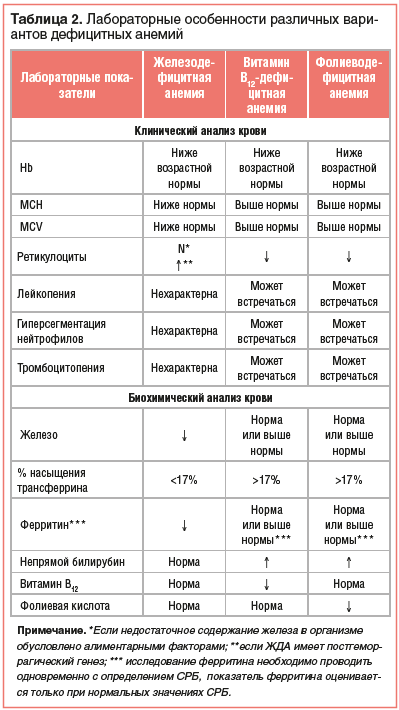
Хорошо известно, что показаниями к исследованию клинического анализа крови для исключения анемии у детей являются анамнестические (недоношенность, задержка внутриутробного развития, исключительно грудное вскармливание ребенка, если мать имеет хронические заболевания кишечника или является вегетарианкой и др.) и/или клинические факторы риска (геморрагический синдром, синдром мальабсорбции, инфекционно-воспалительные заболевания, желтуха, лимфаденопатия, гепато- или спленомегалия и другие патологические состояния). При оценке результатов клинического анализа крови нельзя ограничиваться только поиском лабораторных признаков анемии. Обязательно должны быть проанализированы все параметры гемограммы (эритроциты и их индексы, ретикулоциты, тромбоциты и их индексы, общее количество лейкоцитов, лейкоцитарная формула, а также абсолютное количество нейтрофилов, лимфоцитов, моноцитов и эозинофилов, СОЭ). Это позволяет уже при первичном обращении пациента очертить круг основных причин выявленной анемии и наметить основные диагностические мероприятия для расшифровки генеза заболевания [1–4].
Так, для ЖДА типичными признаками являются: гипохромия и микроцитоз эритроцитов при нормальном уровне ретикулоцитов, если недостаточное содержание железа в организме обусловлено алиментарными факторами или синдромом мальабсорбции. В тех же случаях, когда ЖДА имеет постгеморрагический генез, гипохромия и микроцитоз эритроцитов будут сопровождаться ретикулоцитозом [1–4]. В свою очередь для анемий, обусловленных недостатком в организме как фолиевой кислоты, так и витамина В12, характерны гиперхромия и макроцитоз эритроцитов, а также ретикулоцитопения (табл. 2).
Кроме этого, при фолиево- и витамин В12-дефицитной анемиях могут встречаться лейко- и тромбоцитопения, гиперсегментация нейтрофилов. С учетом того, что в ряде случаев ДА имеет комбинированный генез, при котором дефицит железа сочетается с дефицитом фолиевой кислоты или витамина В12, типичные гематологические признаки могут не выявляться или быть разнонаправленными. Это определяет необходимость обязательного проведения биохимического анализа крови с определением, кроме общепринятых показателей, таких параметров, как железо, железосвязывающая способность, процент насыщения трансферрина, ферритин, фолиевая кислота и витамин В12 [6, 7]. Особо следует подчеркнуть, что ферритин должен определяться вместе с С-реактивным белком (СРБ). При этом оценивать уровень ферритина можно только в тех случаях, когда значения СРБ находятся в пределах нормативных. Это объясняется тем, что ферритин относится к протеинам воспаления и его уровень повышается при воспалительных процессах в организме. В связи с этим нормальный или высокий уровень ферритина при повышенных значениях СРБ может стать причиной ошибочного заключения об отсутствии железодефицитного состояния [2–4]. Особенности биохимического анализа крови при различных вариантах ДА представлены в таблице 2.
Только для зарегистрированных пользователей
источник
Н.И. Стуклов, Е.Н. Семенова
ФГБОУ ВПО Российский университет дружбы народов, Москва
Рассмотрен современный взгляд на проблему железодефицитной анемии (ЖДА) с точки зрения эпидемиологии, этиологии, патогенеза. Описаны известные в настоящее время механизмы регуляции обмена железа, приведены наиболее важные данные литературы и результаты собственных исследований. Основываясь на рекомендациях по лечению больных ЖДА, авторы представляют описанный в литературе и собственный клинический опыт использования железосодержащих препаратов и рассматривают полученные результаты. В рамках статьи авторы объясняют механизмы низкой эффективности лечения при ЖДА и предлагают способы решения проблемы с учетом опубликованных в литературе последних научных исследований.
Ключевые слова: анемия; обмен железа; сидеропенический синдром; лечение железодефицитной анемии.
N.I. Stuklov, E.N. Semenova
Russian University of People’s Friendship, Moscow, Russia
Modern views of epidemiology, etiology and pathogenesis of iron deficiency anemia are considered. Mechanisms of iron metabolism regulation are described based on the most important literature data and the results of the authors ’ research. The authors present their own and literature clinical experience of using iron-containing drugs with reference to the existing recommendations on the treatment of iron deficiency anemia. Causes of low treatment efficiency are discussed and the ways to address this problem are proposed based on the published results of clinical research.
Key words: anemia; iron metabolism; sideropenic syndrome; treatment of iron deficiency anemia.
Анемии (греч. αναιμια — бескровие) определяются как ряд клинических состояний, связанных со снижением уровня гемоглобина менее 120 г/л у женщин и менее 130 г/л у мужчин; (ВОЗ, 2001) и (или) гематокрита ( менее 36,4% соответственно), что обусловлено уменьшением количества эритроцитов или содержания гемоглобина в них [1]. В настоящее время железодефицитная анемия (ЖДА) является самым распространенным состоянием, связанным со снижением уровня гемоглобина, поэтому ее признают государственной проблемой более чем в 100 странах мира, где разрабатываются программы, направленные на профилактику и снижение заболеваемости. ЖДА чаще выявляется у представителей наиболее социально значимых и незащищенных слоев населения — у женщин детородного возраста и детей. Количество больных анемией в указанных группах, по данным ВОЗ (2001), превышает 1 млрд [2]. В итоге ЖДА является причиной роста материнской и детской смертности [3].
Регуляция обмена железа.
Ежедневно организму для нормальной жизнедеятельности требуется 20—25 мг железа, причем экзогенного железа необходимо только 1— 2 мг: женщинам — 2 мг (из-за физиологической кровопотери), а мужчинам — 1—1,5 мг. Около 20 мг железа поступает из «старых» разрушенных эритроцитов, столько же расходуется на синтез нового гемоглобина.
Железо накапливается в органах ретикулоэндотелиальной системы (до 500 мг), остальные запасы железа на 70% сосредоточены в гемоглобине, что и обусловливает развитие ЖДА при хронической кровопотере (рис. 1).
Рис. 1. Схема обмена железа.
Всасывание железа происходит в верхних отделах тонкой кишки, причем этот процесс требует участия множества белков. В основном до 70—80% железа усваивается в двухвалентном состоянии (гемовое железо, содержащееся в основном в мясе, меньше — в печени и рыбе). При поступлении в кишечник растительного трехвалентного железа с помощью медьзависимой ферроредуктазы на апикальной мембране энтероцитов или под действием витамина С оно восстанавливается до двухвалентного. Двухвалентное железо через марганецзависимые белки — транспортеры двухвалентных металлов (ДМТ — двухвалентный металлотранспортер) поступает в энтероцит, а затем через белок ферропортин на базальной мембране — в кровь, где с помощью медьзависимых феррооксидаз (гефестина, расположенного на базальной мембране и связанного с ферропортином, и церулоплазмина, находящегося в плазме) окисляется до трехвалентного состояния, чтобы связаться с транспортным белком — трансферрином (рис. 2). Только очень незначительная часть железа, образуя комплекс с муцином, может поступить в энтероциты путем пиноцитоза [4, 5].
Рис. 2. Схема регуляции обмена железа.
Универсальным регулятором метаболизма железа является гепцидин [6—9], который блокирует транспорт железа, причем этот механизм реализуется с помощью регуляции активности белка ферропортина, т.е. путем воздействия на высвобождение железа из клеток кишечника и макрофагов ретикулоэндотелиальной системы [10—13]. Увеличение количества железа в организме ведет к стимуляции синтеза гепцидина, что уменьшает абсорбцию железа в кишечнике и его транспорт в циркуляцию. В свою очередь уменьшение абсорбции железа в кишечнике ведет к угнетению синтеза гепцидина в печени и по обратной связи — к восстановлению захвата железа из пищи и кишечника (см. рис. 2) [14—18]. Помимо железорегуляторной функции, гепцидин оказывает выраженное бактерицидное действие, является белком воспаления, его уровень повышается при инфекционных, воспалительных, опухолевых заболеваниях, блокируя выход железа в кровь [6]. Такой эффект гепцидина отрицательно влияет на рост бактерий, опухолей, блокирует избыточный воспалительный процесс. В работе, проведенной в 2011 г. [19], доказана роль гепцидина как основного фактора развития ЖДА у женщин с гинекологическими заболеваниями без патологической кровопотери. Показатели гепцидина в указанной группе составили 108,75 ± 40,08 нг/л (референсные значения 60— 85 нг/л), что обусловило резкое уменьшение содержания ферропортина — 0,43 ± 0,21 нг/л (референсные значения 3,1 ± 0,2 нг/л) и привело к нарушению поступления железа из кишечника в кровь [19].
Железо, которое остается внутри клеток, депонируется в виде ферритина, количество которого в крови прямо пропорционально содержанию железа в депо [20].
Клиническая картина и диагностические критерии.
Дефицит железа приводит к нарушению синтеза гемоглобина в эритрокариоцитах костного мозга, уменьшению содержания миоглобина в мышцах, активности цитохромов и каталаз в митохондриях клеток, миелопероксидазы в нейтрофилах [21—23].
В настоящее время выделяют несколько этапов развития дефицита железа [5, 24].
1. Предрасположенность к развитию дефицита железа (вегетарианство, подростковый возраст в сочетании с нарушением менструального цикла у девочек, частые роды, наличие хронических болезней желудочно-кишечного тракта — ЖКТ, заболеваний женской репродуктивной системы, связанных с кровопотерей).
2. Предлатентный дефицит железа. На этой стадии нет никаких лабораторных критериев дефицита железа, однако можно определить повышение абсорбции трехвалентного железа в ЖКТ, которое может превышать 50% (в норме 10—15%).
3. Латентный дефицит железа характеризуется развитием сидеропенического синдрома и уменьшением запасов железа в организме (по данным лабораторных исследований).
4. ЖДА. Диагноз устанавливается при уровне гомоглобина менее 120 г/л у женщин и 130 г/л у мужчин. Выделяют следующие стадии ЖДА:
В основе патологии эритропоэза при дефиците железа лежит нарушение синтеза гема, в результате которого уменьшается количество гемоглобина в эритрокариоцитах костного мозга, что проявляется на первом этапе гипохромией эритроцитов, а в дальнейшем — развитием гипохромной микроцитарной анемии.
Клинические проявления ЖДА связаны с развитием как сидеропенического синдрома, для которого характерны выраженная мышечная слабость, нарушение целостности слизистых оболочек, кожи, ее придатков (ломкость и расслаивание ногтей, выпадение волос), снижение иммунитета, так и непосредственно симптомов анемии (головокружение, мелькание «мушек» перед глазами, сонливость, снижение работоспособности).
Наиболее характерным лабораторным признаком ЖДА являются гипохромия, микроцитоз эритроцитов, анизоцитоз. О гипохромии эритроцитов свидетельствуют цветовой показатель менее 0,8, среднее содержание гемоглобина в эритроците менее 28 пг, средняя концентрация гемоглобина в эритроците менее 290 г/л. О микроцитозе говорят, когда средний диаметр эритроцита менее 7 мкм, а средний объем эритроцита — менее 80 фл [21, 22, 24].
Параметры обмена железа широко используются в клинической практике, но в связи с отсутствием четко определенных значений, доказывающих наличие ЖДА, высокой стоимостью исследования и большим количеством больных их применение не всегда оправдано. Так, показатель ферритина сыворотки (ФС) как единственный маркер, отражающий запасы железа в организме и используемый для верификации и дифференциальной диагностики ЖДА, по мнению разных исследователей [5, 20], варьирует от 15 до 100 мкг/л. Известно, что показатель ФС является положительным маркером воспаления, а количество его определяется белково-синтетической функцией печени. В настоящее время для установления диагноза ЖДА принято считать достоверным показатель ФС менее 30 мкг/л [25]. Уровень такого транспортного белка, как трансферрин, как правило, повышен при недостатке железа, однако при наличии инфекции его содержание уменьшается и не может использоваться в диагностике ЖДА [26]. Тем более изменчивы такие параметры обмена железа, как железосвязывающая способность (общая и латентная) и коэффициент насыщения трансферрина железом, так как они рассчитываются исходя из содержания трансферрина и сывороточного железа, а последний показатель вообще не имеет связи с содержанием железа в организме и зависит от времени, в которое проведено исследование, и приема пищи [21]. Значения коэффициента насыщения трансферрина железом у больных ЖДА, по опубликованным данным, могут составлять от 15 до 20%. Наиболее точным методом диагностики ЖДА в настоящее время считается подсчет растворимых рецепторов для трансферрина, однако этот метод не используется в качестве рутинного из-за отсутствия единого способа детекции, высокой стоимости исследования, невозможности интерпретировать результат при наличии любых пролиферативных процессов [26].
Наиболее частыми причинами ЖДА являются как физиологические, так и патологические состояния. В группу риска развития ЖДА входят недоношенные дети, так как у них не успевает сформироваться депо железа, и подростки, которым требуется больше железа в связи с быстрым ростом организма [27]. Наиболее часто ЖДА развивается при беременности. В период беременности, родов и лактации в среднем расходуется до 1000 мг железа, что в 2 раза больше его запасов в депо [28]. Репродуктивный возраст у женщин связан с повышенной потерей железа при менструациях; этот недостаток компенсируется увеличением всасывания железа в ЖКТ, что в настоящее время объясняется изменением влияния гепцидина. При наличии гиперполименореи, однако, такой баланс нарушается в связи с увеличением кровопотери [29, 30], при сопутствующих заболеваниях ЖКТ нарушается всасывание железа и развивается ЖДА [6, 19]. Часто у женщин меноррагии имеют органические причины: полипы, эндометрит, миома матки, аденомиоз, открывающийся в полость матки; мало того, такие заболевания, как миома матки и дисплазия шейки матки, оказывают влияние на развитие анемии и без патологической кровопотери [5, 19, 30]. Указанный механизм связан с увеличением содержания гепцидина в крови и снижением активности эритропоэза, доказанным синдромом неадекватной выработки эритропоэтина. В настоящее время продукцию эритропоэтина принято считать неадекватной при отношении определяемого эритропоэтина к предполагаемому (О/П log эритропоэтина менее 0,9) [28, 31]. Так, В.А. Бурлевым и Е.Н. Коноводовой [32] при обследовании женщин с миомой матки выявлено отношение О/П log эритропоэтина менее 0,8, а при обследовании гинекологических больных с анемией без нарушения менструальной функции в 2011 г. отношение О/П log эритропоэтина составило 0,89 (рис. 3). Для всех женщин с диагностированной ЖДА необходимо обязательное обследование у гинеколога. В случае обнаружении ЖДА у мужчин, наоборот, показано исключение заболеваний ЖКТ.
Рис. 3. Зависимость между уровнем гемоглобина и сывороточного эритропоэтина (логарифмическая шкала и экспоненциальные кривые) у больных с постгеморрагической ЖДА при заболеваниях ЖКТ (предполагаемый эритропоэтин) и анемии при гинекологических заболеваниях (определяемый эритропоэтин) [5].
Помимо повышенной потребности в железе и хронической кровопотери, патологическими состояниями, способными вызывать развитие ЖДА, являются различные нарушения всасывания железа и поступления его с пищей (в том числе и обусловленные вегетарианством), нарушения транспорта железа (гипотрансферринемии при заболеваниях печени и наследственные атрансферринемии) [21].
Таким образом, гипохромная микроцитарная анемия, особенно при наличии характерной для сидеропенического синдрома клинической картины, даже без исследования обмена железа может определяться как ЖДА при условии полноценного клинического и инструментального обследования больного и установления причины ее развития [5].
Лечение.
Современная тактика лечения при ЖДА в настоящее время направлена на устранение этиологического фактора и восполнение запасов железа в организме [4, 5]. Наиболее оправдано более физиологическое пероральное применение препаратов железа; парентерально препараты можно использовать только при доказанном дефиците железа. Перорально следует назначать препараты железа в высоких дозах (от 200 до 300 мг/сут), что, однако, может приводить к возникновению диспепсических явлений, поэтому (особенно в детской и акушерской практике) рекомендуется постепенное повышение дозы до терапевтической, а при достижении нормальных значений уровня гемоглобина — ее снижение [20].
Степень абсорбции двухвалентных солей железа в несколько раз выше, чем трехвалентных, так как они пассивно диффундируют через каналы ДМТ-белков [33], поэтому препараты, содержащие двухвалентное железо, дают быстрый эффект и нормализуют уровень гемоглобина в среднем через 1—2 мес, а нормализация депо железа происходит уже через 3—4 мес от начала лечения в зависимости от степени тяжести анемии и дозы препарата. Препараты, содержащие железо в трехвалентном состоянии, требуют более длительного применения, а в случае дефицита меди в организме будут неэффективны. Нормализация уровня гемоглобина при лечении препаратом трехвалентного железа наступит только через 2—4 мес, а нормализация показателей депо железа — через 5—7 мес от начала терапии [5, 19, 33]. Степень абсорбции отражается и на частоте развития побочных эффектов. Уменьшить нежелательное влияние таблетированных препаратов железа на ЖКТ можно, принимая их во время еды, но при этом уменьшается всасывание железа. Лучше (но также с потерей эффективности) использовать формы с замедленным высвобождением, так как часть препарата будет высвобождаться в нижних отделах ЖКТ, где железо практически не всасывается [34]. Несмотря на рекомендации ВОЗ по применению для лечения ЖДА препаратов двухвалентного железа как более эффективных, препараты с низкой биодоступностью на основе трехвалентного железа активно применяются благодаря их лучшей переносимости.
В современной клинической практике используются различные варианты сочетаний двухвалентного железа с витаминами С, В9, В12, что позволяет минимизировать побочные эффекты и одновременно повысить эффективность терапии, однако переносимость такого лечения до настоящего времени была основным лимитирующим фактором [20, 33]. Анализ переносимости различных препаратов железа более чем у тысячи пациентов показал, что современная жидкая форма двухвалентного железа (препарат тотема, лаборатория Иннотек Интернасиональ, Франция) по количеству побочных эффектов не превышает таковые у трехвалентного (рис. 4) [4]. Такой эффект достигается равномерным распределением препарата по слизистой оболочке желудка и его высокой биодоступностью. Двухвалентное железо равномерно и максимально эффективно проникает в энтероциты и, не накапливаясь в них, поступает в кровь. Это обусловлено наличием в составе препарата меди и марганца, которые входят в состав ДМТ-белков и гефестина, окисляющего железо, что способствует наилучшему его метаболизму (см. рис. 2) [33]. Помимо этого, указанные металлы участвуют в работе системы антиоксидантов, наиболее важными составляющими которой являются Cu, Zn-супероксиддисмутаза, Mn-супероксиддисмутаза (в митохондриях), каталаза, глутатионпероксидаза и глутатион. При уменьшении антиоксидантной защиты происходит сдвиг в сторону избыточного накопления свободных радикалов, что обусловливает их повреждающее действие на клетки. Следует понимать, что процесс активации перекисного окисления липидов запускается ионами двухвалентного железа, что проявляется частым развитием побочных эффектов при лечении препаратами железа. Наличие меди и марганца в составе тотемы уменьшает образование свободных радикалов, что улучшает переносимость препаратов железа [37].
Пациентам с заболеваниями ЖКТ назначать препараты железа перорально следует с осторожностью, причем острые заболевания, такие как язва желудка и двенадцатиперстной кишки, эрозивный гастрит, являются противопоказаниями; также не следует использовать указанный метод лечения у больных с заболеваниями тонкой кишки (болезнь Крона, целиакия, мальабсорбция) или отсутствием ее части.
Рис. 4. Сравнение результатов исследований безопасности применения различных железосодержащих препаратов.
При лечении больных ЖДА остро стоит вопрос оценки эффективности терапии, так как часто ЖДА диагностируется у соматически тяжелых больных с крайне низким уровнем гемоглобина. Попытки ранней диагностики, как правило, связаны с исследованием количества ретикулоцитов [38], однако в настоящее время такой подход не является доказательным, так как часто ретикулоцитоз возникает компенсаторно при наличии кровотечения. В работе [5, 9] показано, что наиболее достоверными показателями, указывающими на хороший эффект препаратов железа, служат появление молодых форм ретикулоцитов и увеличение дельты гемоглобина (разницы между средним содержанием гемоглобина в ретикулоците и эритроците) уже через 1 нед после начала лечения (рис. 5).
Рис. 5. Динамика гемоглобина эритроцитов (RBC), количества ретикулоцитов (Ret), фракции незрелых ретикулоцитов (IRF-) среднего содержания гемоглобина в эритроците (RBC-Hb), среднего содержания гемоглобина в ретикулоците (Ret-Hb), дельты гемоглобина (D-Hb) при лечении ЖДА в течение 1 мес.
Основным критерием положительного ответа на терапию ЖДА является прирост уровня гемоглобина через 1 мес после начала применения препаратов железа, однако рекомендации разных организаций по этому вопросу не согласуются друг с другом. Минимальным приростом уровня гемоглобина в периферической крови для признания терапии эффективной является его увеличение более чем на 10 г/л за 1 мес (Центр по контролю и профилактике заболеваний в США) [39]. В нашем исследовании, проведенном при лечении 61 пациентки с гинекологической патологией и заболеваниями ЖКТ, у которых лечение привело к полному восстановлению показателей гемоглобина и обмена железа, прирост уровня гемоглобина в течение первого месяца составил от 10 до 50 г/л с медианой прироста 30 г/л [19]. Поэтому с учетом большого количества сопутствующих заболеваний у больных ЖДА и доказанной роли гепцидина в нарушении метаболизма железа за оптимальный критерий оценки эффективности терапии лучше принять прирост уровня гемоглобина более 10 г/л за 1 мес [5].
При отсутствии прироста уровня гемоглобина, согласно указанным критериям, необходимо обязательно исследовать обмен железа, провести диагностический поиск, исключить другой механизм развития анемии. При подтверждении абсолютного дефицита железа и отсутствии злокачественной опухоли следует перейти на парентеральное применение препаратов железа со строго рассчитанной терапевтической дозой. При назначении препаратов парентерально предпочтение следует отдавать внутривенному пути введения. Наиболее часто в настоящее время используются венофер (100 мг в 5 мл), космофер, феринъект (50 мг в 1 мл). За один раз, как правило, вводят 100—200 мг, но, используя феринъект, это количество можно увеличить до 1000 мг. Эти препараты должны применяться только при наличии показаний, доказанном абсолютном дефиците железа и невозможности перорального применения. Существенным недостатком парентерального применения является то, что необходимо использовать строго рассчитанное количество препарата, врач может назначать препараты только в условиях стационара, применение препаратов ограничено из-за наличия большого количества тяжелых побочных реакций (анафилактический шок, аллергические реакции, передозировка железа, системный гемосидероз, локальный гемосидероз тканей). Кроме того, как правило, есть ограничения парентерального применения препаратов при беременности, особенно в ранние сроки.
В случае отсутствия гипоферритинемии есть основания проводить лечение анемии с использованием препаратов рекомбинантного человеческого эритропоэтина, эффективность которого доказана при терапии ЖДА в поздние сроки беременности [28] и у больных с миомой матки [40, 41]. Такую тактику необходимо выбирать у больных с доказанными хроническими воспалительными или инфекционными заболеваниями, доброкачественными опухолями при наличии синдрома неадекватной степени тяжести анемии выработки эритропоэтина [5, 19, 28].
Таким образом, оптимальным у больных с наличием гипохромной микроцитарной анемии является выявление причины развития дефицита железа, после чего следует начинать лечение. Если есть сомнения в железодефицитном характере анемии, лучше проверить обмен железа, подтвердив диагноз ЖДА низкими показателями ФС и насыщения трансферрина железом. Далее следует устранить хроническое заболевание, остановить кровотечение, убрать погрешности в диете и начать пероральный прием препаратов железа (с обязательным учетом противопоказаний). Лечение следует начинать с двухвалентных препаратов железа. При наличии хронических воспалительных, пролиферативных, инфекционных заболеваний лучше использовать жидкую лекарственную форму (препарат тотема), содержащую в своем составе глюконат двухвалентного железа, медь и марганец. Через 1 мес следует определить прирост уровня гемоглобина и если он выше 10 г/л в месяц — продолжить лечение, если нет — пересмотреть диагноз (рис. 6).
Рис. 6. Схема лечения ЖДА.
При использовании препаратов железа необходимо ориентироваться на показатель ФС, целевое значение которого должно составлять около 100 мкг/л, после чего можно остановить лечение (поздние критерии эффективности терапии [39]). При пероральном приеме препаратов достаточно подтвердить нормализацию содержания ФС через 3 мес терапии, при назначении препаратов железа внутривенно этот показатель необходимо проверять каждую неделю. Лечение препаратами рекомбинантного человеческого эритропоэтина опасно из-за возможности развития эритроцитоза и тромботических осложнений, поэтому ориентироваться прежде всего необходимо на уровень гемоглобина, целевая концентрация которого не должна превышать 120 г/л [42].
Таким образом, ЖДА представляет собой важную социально значимую проблему, а ее диагностика и лечение до сих пор являются трудной задачей. Только выполнение современных рекомендаций позволит существенно повысить качество и эффективность оказания медицинской помощи больным ЖДА.
Сведения об авторах:
Российский университет дружбы народов, Москва
Кафедра госпитальной терапии с курсом клинической лабораторной диагностики Стуклов Николай Игоревич — д-р мед. наук, проф. кафедры; руководитель курса гематологии;
Семенова Елена Николаевна — учебный мастер кафедры.
источник
Анемия – патологическое состояние, при котором снижается уровень эритроцитов и гемоглобина в единице крови. Анемии встречаются достаточно часто, способны утяжелять течение других заболеваний. В основе развития лежит нарушение эритропоэза, которое обеспечивает достаточное количество веществ для образования эритроцитов: медь, железо, кобальт, цинк, витамины группы В.
? Гемоглобин 180-240 г/л так как внутриутробная гипоксия
Преобладание фетального гемоглобина (70-80%), у 6-12 месячных детей и взрослых фетальный гемоглобин менее 12%. Первая неделя – анизоцитоз, полихроматофильный ретикулоцитоз 10-50 промилле, единичные нормобластные, т.е. усилена регенерация. Эритроциты и гемоглобин после рождения начинают снижаться, идет распад фетального гемоглобина, к концу 10 дня эритроциты составляют 5*10 12/л, а гемоглобин 180 г/л. В дальнейшем продолжают снижаться, но медленнее. Минимальный уровень в 4-6 месяцев: эритроциты равны 3,8*10 12/л гемоглобин 110 г/л. У доношенных физиологическая анемия, у недоношенных снижение эритроцитов и гемоглобина более выражены и равны 2,5 – 3*10 12/л и 80-100 эритроцитов и гемоглобина соответственно. Наступает раньше (1,5 месяца) – это ранняя анемия. Снижение эритроцитов и гемоглобина в первый месяц является результатом снижения продукции эритроцитов, увеличение скорости их разрушения, вслествии относительной гемодилюции. Через 4-6 месяцев эритроциты и гемоглобин увеличиваются ; эритроциты 4,2 – 4,5*10 12/л , а гемоглобин 130-150 г/л. Длительность жизни составляет 60-80 дней (120 в отличии от новорожденных).
Классификация (Мысягин):
- Дефицитная
? белководефицитная
- гипо- и апластическая
? хроническая кровопотеря
- Гемолитическая
? обусловленная наследственными аномалиями эритроцитов (микросфероцитарная, несфероцитарная, овалоклеточная)
? аномалии эритроцитов обусловленные химическими и лекарственными веществами (эритропатии, порфирии)
? приобретенные (ночная пароксизмальная гемоглобинурия)
? вызванные неиммунными агрессивными факторами (токсическая, ожоговая, внутри эритроцитарная инвазия)
- Анемия при других заболеваниях
? диффузные заболевания соединительной ткани и.т.д
- Анемия новорожденных (тур. )
Каждая анемия по тяжести делится на легкую(Hb 110-83 г/л. эритроциты 3,5*10 12/л), среднюю(Hb 82-66 г/л, эритроциты 3,4-2,5 10 12/л), тяжелая (Hb менее 66 г/л, эритроциты менее 2,5*10 12/л).
Функциональные возможности оцениваются по ретикулоцитам:
? регенераторная (норморегенераторная) количество ретикулоцитов 5-50%
? гиперрегенераторная – количество ретикулоцитов более 50%
? гипорегенераторная — количество ретикулоцитов менее 5% или ретикулоцитоз не соответствует тяжести анемии. В норме у здорового человека 5-12%
При снижении эритроцитов уменьшается перенос кислорода к органам и тканям, развивается кислородное голодание. Наиболее чувствительными являются ЦНС и сердечно-сосудистая система: головная боль, головокружение, быстрая утомляемость, малоподвижность, снижение аппетита, тахикардия, одышка при физической нагрузке, приглушение сердечных тонов, систолический шум на верхушке и основании сердца. Ведущий симптом — бледность кожных покровов и слизистых, иногда желтушность.
Железодефицитная анемия (78% от всех анемий)
Наблюдается у 70% детей раннего возраста. В этом возрасте в организме около 4,5гр железа, 2/3 его в эритроцитах, остальное в костном мозге и клетках РЭС. Находится в двух формах: гем (гемоглобин, миоглобин, эритроциты), ферритин и гемосидерин (печень и селезенка). В физиологических условиях потребность растущего организма обусловлена:
- потерями железа
- увеличением массы тела, следовательно, и увеличение количества крови (у взрослых только 1е).
Потеря железа у мужчины 1,0-1,5 мг/сутки с калом, с мочой, с желчью, часть с эпителием кожи и потом, расход на ногти, волосы, явные и скрытые кровотечения, инвазии глистов. У доношенных новорожденных всего 250 мг железа в организме накопление железа у плода наиболее интенсивно в последние 3 месяца. У недоношенных детей железа меньше. К году 430 мг, ежедневный прирост 0,5 мг, следовательно, для компенсации потерь и обеспечения роста необходимо 1,0 мг/сутки. У ребенка теряется 0,5 мг/сутки. В период полового созревания потребность 1-2 мг/сутки. Всасывание железа происходит с пищей в 12-перстной и тощей кишке, гемовое железо всасывается лучше, негемовое ( трехвалентное) под действием желудочного сока превращается в закисное двухвалентное, часть трехвалентного связывается с аскорбиновой кислотой и образует растворимый комплекс. Гемовое железо всасывается независимо от желудочного сока. В слизистой кишечника распадается до двухвалентного железа (до этого без изменений). Далее железо попадает энтероциты, а оттуда в плазму крови где связывается с трансферрином, далее поступает в ткани и органы. При дефиците скорость перехода из плазмы в ткани увеличивается. Железо поступает в организм с пищей, содержится в растительных и животных продуктах: в печени, мясе, бобах, сои, петрушке, шпинате, яблоках, гранатах, черносливе, хлебе, рисе, гречке. Из растительной пищи всасывается ограниченно, из животной пищи всасывается полнее. Лучше всасывается в виде гема, следовательно, из печени (ферритин, гемосидерин) хуже, чем из мяса (90%). Отрицательно действуют на всасывание оксалаты, фосфаты, фитаты, тошен. Усиливает всасывание: витамин С, пировиноградная кислота, янтарная кислота, сорбит, фруктоза. При дефиците железа различают:
- железодефицитные состояния – отсутствие депо железа в организме (скрытый дефицит железа)
- железодефицитная анемия (неполноценные эритроциты).
? В результате недостаточного поступления с пищей
? Избыточное выведение (дисфункция кишечника)
? Повышенная потливость (препубертатный).
Чаще ращвивается от 6 месяцев до 1,5 лет – так как у ребенка неправильное питание (молочное), питание растительной пище приводит к дефициту железа из-за недостаточного всасывания, уязвимы недоношенные дети, с крупным весом, от многоплодной беременности, от женщин с анемией.
Зависит от тяжести.
- Общеанемические симптомы: головокружение, гепатоспленомегалия (увеличение на 10%), обморок, бледность кожи и слизистых оболочек.
- Сидеропеническая анемия: изменяются ЦНС, ЖКТ, ССС, кожа и слизистая, придатки кожи: ногти, волосы, извращение вкуса и обоняния, сухость кожи с трещинами, ангулярный стоматит, ногти сначала выпуклые затем становятся вогнутой формы, повышена ломкость ногтей и волос
? снижение общего гемоглобина и снижение содержания гемоглобина в эритроцитах
? гипохромная (цветной показатель до 0,4-0,6)
? микроцитоз (анизо- и пойкилоцитоз)
? количество ретикулоцитов обычно в норме ( на фоне лечения увеличивается)
? снижения железа в сыворотке
? увеличение общей и латентной железосвязывающей способности сыворотки крови
? снижение коэффициента насыщения железом трансферрина ( в норме 6-24%).
В костном мозге наблюдается эритроидная гиперплазия с уменьшением количества сидеробластов.
Клиника латентного периода: аналогична или отсутствует, в общем, анализе крови нет анемии, признаки только в биохимическом анализе. Течение скрытой анемии такое же как при железодефициной.
Устранение причин анемии, правильный режим (воздух, массаж, гимнастика) и питание (своевременные добавки и прикормы, увеличение количества мяса). Препараты железа назначаются только при убеждении в дефиците железа. Если передозировка железа, то можно отравить ребенка, а также может произойти поражение ЖКТ, гемосидероз, почечно-печеночная недостаточность. Препараты железа принимаются per os, внутримышечно и внутривенно.
Ионные препараты – на основе солей двухвалентного железа или полисахаридных комплексов с железом: сульфат железа, аскорбинат железа, ферроплекс, актиферрин, феррональ (44 мг), конферон (51мг железа+янтарная кислота).
Неионные препараты — с витамином С – полимальтозные содержащие компонент трехвалентного железа: мальтофер, феррум лек, ферлатум, эти препараты менее опасные. Суточная доза 4-6 мг/кг массы тела. Первые 2-3 дня вводят половинную дозу (чтобы избежать побочного действия –диспепсия), к 4-6 дню доводят до полной дозы, перед едой до 3 раз в сутки, в сочетании с витамином С если о не входит в состав препарата, не следует запивать, чаем и молоком т.к. они снижают всасывание железа в тонком кишечнике. В рационе следует снизить содержание злаковых, молока. Эффект развивается через 2 недели: повышается уровень гемоглобина, необходимо еще 6-8 недель для создания запасов, затем еще 8-12 недель принимают половинную дозу. Если отсутствует эффект через 2-3 недели то следовательно имеет место нарушение всасывания или нерегулярность приема. Внутримышечное и внутривенное введение проводят по показаниям:
? непереносимость перорального приема
Возможно развитие аллергических реакций и гемосидероза, исходя из этого, внутривенный и внутримышечный прием проводят только в стационаре.
Препараты трехвалентного железа: феррум лек, эктофер, фербитал.
Ферум лек: полиизомальтаза + железо назначают внутримышечно. 1 ампула – 100 мг железа.
Натрийсахаратный комплекс + железо назначают внутривенно. 1 ампула – 100 мг железа.
Расчет курсовой дозы:
- (120-Hb)*0,4* массу ребенка в килограммах = курсовая доза (мг)
- (масса ребенка*0,78 – 0,35)*Hb = курсовая доза (г/л)
вводят через день, первая инъекция меньше чем последующая. Эктофер и фербитол содержат сорбитовые компоненты их нельзя вводить внутривенно и внутримышечно вместе с преоральным приемом. Внутривенно и внутримышечно нельзя вводить при нарушении функции печени и почек – возможно развитие гемосидероза.
Дисферал – внутримышечно 60-80 мг/кг.
Тетацил натрия – 15-25 мг/кг, внутривенно, капельно. Дополнительно назначают витамины С, В1, В2. В6 и В12 не назначают (В6 способствует протопорфиринам).
Переливание эритроцитарной массы проводить не следует, так как эритроциты через 2-3 недели разрушаются (сенсибилизируют организм). Критерии эффективности лечения: появление ретикулоцитарного криза на 7-10 день от начала лечения (в 2 раза больше нормы), нарастание гемоглобина на 10 мг/л в неделю, клинико-лабораторная ремиссия в конце лечения.
У недоношенных анемия развивается в 60-90% случаях.
Классифицируют ее по срокам: ранняя ( первые 3 месяца), поздняя (после 3 месяцев). Раннюю анемию нельзя предупредить.
Патогенез: наличие усиленного гемолиза и функциональной незрелости костномозгового кроветворения. Гемолиз – недостаток фетального гемоглобина, недостаток витамина Е. Незрелость кроветворных органов – снижение эритропоэтических процессов в костном мозге. Ранняя анемия еще не железодефицитная (препараты железа не назначают).
Лечение: препараты железа назначать не надо, принимают витамин Е, аскорбиновая кислота, фолиевая кислота,витамины группы В. Через 3-4 месяца спонтанное повышение уровня эритроцитов, иногда впоследствие снова снижается. Поздняя анемия железодефицитная клиника ее соответствующая.
Лечение: препараты железа, витамин С, фолиевая кислота 1-5 мг/сутки, витамин Е 10-20 мг/сутки в течении 2-3 недель, далее поддерживающая терапия.
- Антенатальная: правильное питание беременных, своевременное лечение анемии беременных с препаратами железа.
- Постнатальная: своевременное введение соков, прикормов, массаж гимнастика, воздух, профилактика заболевания сопровождающих анемию (дистрофии, инфекции, рахит)
- Особенное внимание недоношенным, с крупной массой тела, от многоплодной беременности, от женщины с анемией. Недоношенным 2-12 месяцев – препараты железа 1-2 мг/кг/сутки. Детям от матерей с анемией: 1 месяц – 10 дней метаболитические комплексы, пантенат кальция, тиамин, липамид, токоферол, 2-3 месяц курс повторить 10 дней. 2 полугодие если гемоглобин снижен до 120 г/л назначают этот комплекс на 10 дней и в течении месяца необходимо принимать железо с фетином в разные часы.
Развивается при длительном белковом голодании, при вскармливании растительной, углеводной пищей, преимущественно у детей африки. Дефицт белка нарушает всасывание железа и витаминов следовательно развивается анемия.
Клиника: общеанемические симптомы сопровождаются отеками.
Лечение: препараты железа, достаточное количество белка и витаминов.
Витаминодефицитная анемия занимает второе место. В12 и фолиевая кислота нарушает созревание клеток в костном мозге и развивается мегалобластическое кроветворение страдает и тремоцитопоэз, и лейкопоэз, снижается продолжительностьжизни эритроцитов. Уровень железа в тканях и плазме увеличивается. Наиболее чувствительны дети младшего возраста. Могут быть обусловлены глитной инвазией6 развивается анемический синдром, поражается ЖКТ (глоссит, лакированный язык, неврологические симптомы, парастезии). Эритроциты уменьшаются в большей степени чем гемоглобин. В крови: макроцитоз, нормо или гиперхр, анизо и пойкилоцитоз, при тяжелой анемии – миелобласты в периферической крови. Лейкоцитопения, тромбоцитопения (геморрагический сиптом), в костном мозге мегалобластный эритропоэз.
Лечение: фолиевая кислота 10-30 мг/сутки в течении 2-3 недель, витамин В12 100-200 мк/гр в сутки, витамин С, препараты железа если оно снижено.
Гипо- и апластические анемии.
Снижение гемопоэза в костном мозге (все 3 ростка). Признаки: бледность , геморрагии на коже, слабость, в крови снижение эритроцитов,, особенно ретикулоцитов. Клиника и лабораторные изменения нарастают. При отсутствии лечения прогноз неблаагоприятный. Печень и селезенка не увеличиваются. Костный мозг беден ябросодержащими элементами, происходит замещение его жировой тканью.
Анемия Фанкони: снижение эритроцитов, лейкоцитов, эритропоэза, характеризуется врожденными уродствами (скелет, сердечно-сосудистая анемия). Наследственная патология, передается по рецессивному типу, прододжительность жизни 2 года.
Гипопластическая анемия Эстрена-Доминика: угнетает все 3 ростка кроветворения, но врожденных уродств нет.
Анемия Даймонда- Блэкфона: угнетается только эритропоэз, проявляется рано, живут до 10 и долее лет.
Лечение: премодическое переливание эритромассы, использование кортикостероидов и анаболических гормонов, витаминотерапия, спленэктомия. Оптимальное лечение – пересадка костного мозга.
Гемолитические анемии
Повышен распад эритроцитов в крови, наследственная микросфероцитарная, гемолитическая анемия, Минковского-Шоффара. Тип наследования доминантный. Дефект мембраны эритроцитов : мембрана эритроцитов проницаема для ионов натрия следовательно жидкость поступает в эритроциты и они превращаются в микроциты в селезенке происходит их изменения (микросфероциты) его устойчивость снижается, он проходит через селезенку 2-3 раза.
Клиника: волнообразное течение с кризами, основные симптомы: анемия желтуха спленомегалия. В кризе: 1,5-2*10 12 эритроцитов, ЦП в норме. Продукты распада не теряются, так как нет потери железа. Желтуха отчетлива в кризе из-за гемолиза эритроцитов и накапливается непрямой биллирубин. Селезенка увеличивается после первого года жизни. При длительном течении заболевание у детей башенный череп широкая переносица, отставание в психическом и нервно-психическом развитии. В крови признаки повышенной регенерации ( ретикулоцитоз, полихроматофиллия и.т.д.), диаметр эритроциты снижены до 5,4-6,0 микрон, характерно снижение максимальной осмотической устойчивости эритроцитов. Норма 0,44-0,48. При анемии минимальное снижение 0,6-0,7% во время криза увеличение соэ лейкоцитоз. В костном мозге интенсивная эритроидная реакция нормобластного типа. Криз может быть гипо или апластическим (при ошибочном диагнозе).
Леченпие кризов: эритромасса, гормоны, инфузионная терапия, если кризы частые спленэктомия желательно до 5 лет.
источник
ЖЕЛЕЗОДЕФИЦИТНАЯ АНЕМИЯ У ДЕТЕЙ
Железодефицитная анемия (ЖД) – патологическое состояние, для которого характерно снижение содержания Hb из-за дефицита железа в организме в результате нарушения его поступления, усвоения или вследствие патологических его потерь. Шифр D 50 (МКБ-10).
Актуальность ЖДА в детском возрасте. Анемия в раннем возрасте ведет к повышенной заболеваемости и смертности детей, такие дети страдают отставанием в психомоторном развитии. Анемичные дети плохо учатся в школе, коэффициент их интеллектуального развития по сравнению с неанемичными детьми значительно ниже. Эксперты Микронутриентной Инициативы (США) установили, что ЖДА приводит к снижению умственного развития у 40% растущих младенцев в мире.
ЖДА ответственна более чем за 60.000 смертей новорожденных детей в мире ежегодно.
Отрицательное влияние ЖДА на физическое, умственное и психическое развитие детей делает эту проблему достаточно актуальной. Как показывают исследования, проведенные в странах Центральной Азии, проблема ЖДА стоит настолько остро, что представляет угрозу не только для нынешних поколений, но и в целом для будущего наших государств.
Распространенность. ЖДА является самой распространенной сравнительно с остальными анемиями и составляет 80% среди всех анемий. Железодефицитные состояния (латентный дефицит железа) встречаются примерно в 1,5-2 раза чаще, чем ЖДА. По данным ВОЗ, у 3.6 миллиарда человек на Земле выявлены признаки латентного дефицита железа (ЛДС), и еще 1,8 миллиарда страдают ЖДА. Железодефицитная анемия имеется примерно у 1/4-1/3 детей, с максимальной частотой встречаясь у детей второго полугодия жизни (около 50%) и в подростковом периоде (30-40%).
Эксперты ВОЗ считают, что при распространенности анемий более 40%, проблема перестает быть только медицинской и требует принятия мер на государственном уровне. По данным последнего демографического исследования (2002), в Кыргызской Республике ЖДА регистрируется у 85% детей первых трех лет жизни и у 60% женщин детородного возраста.
Дефицит железа многие напрасно считают безобидным состоянием. Ежегодно около 1,5% смертей в мире связано с дефицитом железа, что в абсолютном количестве составляет 0,5 миллионов человек. В мире материнская смертность, связанная с анемией, составляет 500.000 случае в год.
Причины ЖДА у детей. Основными причинами ЖДА у детей следует считать различные отягощения беременности и родов, а также ряд постнатальных состояний.
Антенатальные причины: 1) нарушение маточно-плацентарного кровообращения, плацентарная недостаточность (токсикозы, угроза прерывания и перенашивание беременности, гипоксический синдром, острые или хронические в стадии обострения соматические и инфекционные заболевания);
2) фетоматеринские кровотечения; синдром фетальной трансфузии при многоплодной беременности; внутриутробная мелена;
3) недоношенность, задержка внутриутробного развития, многоплодие, крупная масса при рождении;
4) глубокий и длительный дефицит железа в организме беременной женщины (в том числе – вследствие короткого интервала между родами (рождение второго ребенка через 9-12 месяцев после первого).
Интранальные причины: 1) фетоплацентарная трансфузия;
2) преждевременная или поздняя перевязка пуповины.
Постнатальные причины: 1) недостаточное поступление железа с пищей (раннее искусственное вскармливание; использование неадаптированных – без добавления железа – молочных смесей; вскармливание коровьим или козьим молоком; мучной, молочный – более 0,5 литров у детей старше года – или молочно-вегетарианский рацион в любом возрасте, позднее и нерациональное введение прикорма, несбалансированная диета, лишенная достаточного содержания мясных продуктов, а также голодание);
2) повышенные потребности в железе у детей с ускоренными темпами роста (недоношенные, дети с лимфатическим типом конституции, дети второго полугодия и второго года жизни, дети пре- и пубертатного возраста, дети-спортсмены);
3) повышенные потери железа из-за кровотечений различной этиологии, нарушения кишечного всасывания (наследственные и приобретенные синдромы мальабсорбции, хронические заболевания кишечника, гельминтозы), а также обильные и длительные метроррагии у девочек в период становления менструального цикла в пубертатном периоде;
4) нарушения обмена железа в организме из-за гормональных изменений (пре- и пубертатный дисбаланс);
5) токсические факторы (хронические отравления солями свинца, ртути);
6) нарушения транспорта железа из-за недостаточной активности и/или снижения содержания трансферрина в организме.
Таким образом, наибольшая уязвимость детей раннего возраста в отношении развития ЖДА обусловлена сочетанием повышенной потребности в железе, ускоренного физического роста и низкого содержания железа в пищевом рационе.
Патогенез ЖДА у детей. Под ЖДА понимается патологическое состояние, обусловленное снижением Hb из-за дефицита железа в организме. Развивается ЖДА тогда, когда все запасы железа в организме исчерпаны.
Железо – один из важнейших микроэлементов организма. Железо является обязательным и незаменимым компонентом различных белков и ферментативных систем организма, обеспечивающих необходимый уровень системного и клеточного аэробного метаболизма, а также окислительного гомеостаза в организме в целом.
Основные железосодержащие субстраты (белки и ферменты организма) и их функции представлены в таблице:
Основные железосодержащие субстраты (белки и ферменты организма) и их функции
| Железосодержащие субстраты | Основная физиологическая функция |
| Гемоглобин Дегидрогеназы | Транспорт кислорода Транспорт и депонирование кислорода в мышцах Разложение перекиси водорода Окисление веществ с помощью Н2О2 Тканевое депонирование железа Тканевое депонирование железа Образование мочевой кислоты Катализ окислительно-восстановительных реакций |
Кроме этого, железо играет важную роль в поддержании высокого уровня иммунной резистентности организма. Нормальное содержание железа в организме необходимо для полноценного фагоцитоза, высокой активности естественных киллеров и бактерицидной способности сыворотки, а также достаточного синтеза пропердина, комплемента, лизоцима, интерферона, секреторного иммуноглобулина А.
Обмен железа в организме. Железо поступает в организм главным образом с пищей, где оно присутствует в двух формах: как составная часть гема, так называемое гемовое железо (органическое, двухвалентное), и негемовое железо (неорганическое) в виде двухвалентных (закисных) и трехвалентных (окисных) ионов. Лучше всего всасывается железо, входящее в состав гема, а негемовое трехвалентное железо для своего всасывания нуждается в соляной кислоте, под действием которой переводится в закисную форму.
Ведущая роль в регуляции всасывания железа принадлежит слизистой оболочке тонкого кишечника. Всасывание железа происходит главным образом в 12-перстной кишке и в верхних отделах тощей кишки. Захват железа из просвета кишечника осуществляется энтероцитами, где оно соединяется с белком апоферритином и образует жедезопротеиновый комплекс. Небольшая часть этого белковосвязанного железа успевает переноситься в кровь, а основная часть теряется вместе со слущенным эпителием в просвет кишечника, поэтому всасывание железа из пищи ограничено. У взрослых, как бы много железа ни поступало в организм с пищей, обычно всасывается 1-1,5 мг железа в сутки, а максимально при повышенных потребностях организма из пищи может всосаться только 2-2,5 мг. При составлении суточного рациона детям раннего возраста необходимо учитывать тот факт, что из пищи усваивается не более 10% железа, содержащегося в пищевом продукте.
Поступившее и кровь железо связывается с транспортным белком – трансферрином (глобулин, синтезируемый в печени) и доставляется к эритрокариоцитам костного мозга (используется для синтеза гемоглобина) и в органы-депо (гепатоциты, костный мозг, селезенка, мышцы, макрофаги), где содержится в форме ферритина. Ферритин является внутриклеточным железосодержащим белком, откуда железо мобилизуется по мере необходимости. В небольшом количестве ферритин содержится и в плазме. Некоторая часть ферритина превращается в гемосидерин – соединение, хранящее железо в большем количестве, чем ферритин, но в менее доступной форме. Для мобилизации запасов железа из депо необходима медь (дефицит ее в организме также может приводить к ЖДА).
Выведение железа из организма осуществляется в небольшом количестве со слущенным эпителием, эпидермисом, волосами, ногтями, калом, потом, мочой. Физиологические потери железа у детей не превышают 0,1-0,3 мг в сутки, увеличиваются до 0,5-0,7 мг в сутки у подростков.
Большая часть суточной потребности (90%) удовлетворяется за счет реутилизации эндогенного железа, освобождающегося при разрушении эритроцитов в клетках ретикулогистиоцитарной системы, а компенсация остальных 10%, которые теряет организм, обеспечивается за счет экзогенного железа, всасывающегося из кишечника.
В организме человека распределяется следующим образом:
1) построение Hb созревающих эритроцитов в костном мозге (составляет около 55% общего пула железа); 2) построение миоглобина – дыхательного фермента мышц (составляет 20-25% общего пула железа); 3) депонированное железо в виде ферритина и гемосидерина – костный мозг, печень, селезенка (25%); 4) включение в состав ферментов тканевого дыхания (0,1%).
Обмен железа в детском организме протекает с некоторыми особенностями сравнительно с взрослыми. Установлено, что первоначальные запасы железа у ребенка создаются благодаря антенатальному его поступлению через плаценту от матери. При неосложненном течении беременности женщина передает плоду около 300 мг железа. Этот процесс происходит на протяжении всей беременности, но наиболее активно – начиная с 28-32 недели гестации. Интенсивность трансплацентарного переноса железа нарастает параллельно сроку гестации, как и увеличение массы плода. Транспорт железа через плаценту – активный процесс, осуществляемый против градиента концентрации и возможен только в одном направлении – от беременной к плоду.
После поступления железа в плаценту часть его депонируется в составе плацентарного ферритина, а другая часть связывается с фетальным трансферрином и поступает в кровоток плода. Трансферрин плода доставляет железо в костный мозг, где происходит синтез эритроцитов, и в ткани, где железо входит в состав различных ферментных систем, необходимых для внутриклеточного метаболизма. Избыток железа депонируется в печени и мышцах в виде ферритина. Механизм передачи железа против градиента концентрации приводит к тому, что у плода уже после 37 недели гестации уровень сывороточного железа выше, чем у матери.
Решающую роль в процессах антенатального поступления железа в организм плода играют состояние маточно-плацентарного кровообращения и функциональный статус плаценты. Патологическое течение беременности (токсикозы, угроза прерывания и перенашивания беременности, гипоксический синдром, острые инфекции или активизация хронических инфекционных заболеваний и др.), сопровождающееся нарушением маточно-плацентарного кровотока и плацентарной недостаточностью, приводит к уменьшению поступления железа в организм плода.
Недостаточное антенатальное накопление железа отмечается при фетоматеринских и фетоплацентарных кровотечениях, внутриутробной мелене. Синдром фетальной трансфузии при многоплодной беременности также способствует недополучению железа.
Установлено, что как преждевременная перевязка пуповины (в первые 1-2 минуты, т.е. еще до прекращения пульсации ее сосудов), так и поздняя, приводят к недополучению новорожденным 30-40 мг железа.
После рождения источниками железа для развивающегося организма являются поступление экзогенного железа в составе пищевых продуктов утилизация железа из эндогенных запасов. В связи с высокой интенсивностью метаболических процессов антенатальные запасы железа быстро истощаются. Развитию сидеропении (железодефицита), особенно у недоношенных, способствуют также низкая активность низкая активность процессов реутилизации эндогенного железа и отсутствие полного покрытия физиологических потребностей в железе алиментарными факторами. Если не проводится профилактика сидеропении, то уже к 3-му месяцу жизни у недоношенных и к 5-6 месяцу у доношенных, даже при естественном вскармливании, есть все предпосылки для развития ЖДА.
Физиологическая потребность детей раннего возраста в железе складывается из:
1) необходимости компенсировать текущие естественные потери железа с калом, мочой, потом и т.п.;
2) необходимости расходовать железо для синтеза Hb, миоглобина, различных железосодержащих энзимов, обязательных для нормального обмена веществ и поддержания гомеостаза в условиях интенсивного анаболического метаболизма;
3) необходимости поддерживать резервы железа для продолжающегося развития и роста организма.
Потребности ребенка в железе при пересчете на 1 кг массы тела более высокие, чем у взрослого, хотя общее количество железа в диете ненамного выше. Ежедневная физиологическая потребность детского организма в железе составляет в первые 6 месяцев жизни 6 мг, от 6 месяцев до 10 лет – 10 мг, старше 10 лет – 12 мг (мальчики) и 15 мг (девочки).
Для детей первых месяцев жизни материнское молоко является естественным физиологическим продуктом питания, который обеспечивает равновесие обмена железа в организме. Это достигается благодаря сбалансированности состава грудного молока по всем ингредиентам и их соответствию физиологическим потребностям растущего организма. Хотя в женском организме содержание железа и невелико (0,2-0,5 мг/литр), существуют специальные механизмы для более эффективного его усвоения. Интенсивное всасывание железа из грудного молока обусловлено прежде всего формой, в которой оно представлено. Наличие в женском молоке лактоферрина (железосодержащего белка, выполняющего функции фактора защиты), способствует высокой степени абсорбции железа из женского молока. Известно, что из коровьего молока ребенком утилизируется 10% железа, а из женского – 50%.
Как указывалось выше, интенсивные обменные процессы у детей раннего возраста приводят к тому, что к 5-6 месяцу жизни антенатальные запасы железа истощаются даже у детей с благополучным перинатальным анамнезом и вскармливаемых грудным молоком. Железа, поступающего в организм с грудным молоком, становится уже недостаточно. С этого срока создание положительного баланса железа во многом обусловлено характером прикорма и пищевой коррекцией.
Установлено, что при выборе продуктов для восполнения запасов железа необходимо учитывать не только суммарное количество железа в продуктах, но и качественную форму его соединений. Так, несмотря на то, что общее содержание железа в сухофруктах примерно в 5-6 раз выше, чем в говядине (соответственно 15/100 г и 2,6/100 г), все же из одинакового количества сравниваемых продуктов больше железа всасывается из мяса. Объясняется это значительно большей эффективностью абсорбции гемового железа по сравнению с негемовым. Гем быстрее соединяется со специфическими рецепторами слизистых тонкого кишечника и активно всасывается в неизмененном виде. Процессы абсорбции гема в кишечнике не зависят от кислотности среды и пищевых факторов ингибиции всасывания железа. Благодаря перечисленным факторам, утилизация железа, входящего в состав гема, значительно выше, чем из других соединений.
Усиливают всасывание железа аскорбиновая, янтарная и пировиноградная кислоты, фруктоза, сорбит, алкоголь, цитраты, содержащиеся в свежих фруктовых соках, бананах, красных бобах, цветной капусте. Всасывание пищевого железа значительно усиливается при повышении содержания белка в рационе. Фосфаты, дубящие вещества, комплексные полисахариды, полифенолы, оксалаты, фитаты, танин (содержатся в крупах, яйцах, сыре, чае) уменьшают всасывание железа из пищи.
Избыток цельного коровьего молока в питании (более 0,5 литра в сутки) за счет своего альбумина усиливает потери крови кишечником у детей старше 7 месяцев и взрослых, что также приводит к развитию ЖДА. Кипячение молока уменьшает кровопотерю.
Здоровый ребенок теряет в кишечнике примерно 0,5 мл крови в сутки. Кишечную кровопотерю увеличивают любое воспалительное заболевание ЖКТ (от 0,7 до 5 мл в сутки), экссудативно-катаральный диатез, пищевая аллергия, мальабсорбция (целиакия, муковисцидоз), дефицит витамина А, паразитозы (гельминтозы, лямблиоз).
Всосавшееся в ЖКТ железо связывается с трансферрином и доставляется к эритрокариоцитам костного мозга, в клеточные железосодержащие ферментативные системы и тканевые депо. Основная масса реутилизированного эндогенного железа поступает в костный мозг из фагоцитирующих макрофагов.
В нормальных условиях «стареющие» эритроциты разрушаются фагоцитами селезенки и, в меньшей степени, фагоцитирующими мононуклеарами печени и костного мозга. Одновременно с разрушением стромы эритроцитов происходит распад Hb. При этом из разрушающегося Hb образуются непрямой билирубин, окись углерода и железо.
Обратный транспорт железа в костный мозг из макрофагов, где происходит реутилизация железа из естественно отмирающих эритроцитов, также осуществляется трансферрином. Железо, доставленное трансферрином в костный мозг, поступает в митохондрии нормобластов, где происходит взаимодействие железа с протопорфирином с образованием гема. Соединение гема с полипептидными цепями глобина приводит к синтезу в нормобластах Hb.
Гуморальная регуляция эритропоэза осуществляется эритропоэтином (в нормальных условиях синтезируется, в основном, в почках). Однако при анемии часть эритропоэтина синтезируется дополнительно в печени. Эритропоэтин поддерживает пролиферативный пул эритроидных коммитированных предшественников, способствует их дифференцировке и ускоряет выход ретикулоцитов из костного мозга.
При начальном (прелатентном) дефиците железа первые изменения происходят в тканях – уменьшаются тканевые запасы железа. При этом уровень транспортного фонда железа и Hb остаются в пределах возрастных нормативов. Дефицит железа в тканях снижает активность иммунной системы – нарушает синтез интерлейкина-2, уменьшается активность фагоцитоза, Т-хелперов, что сопровождается повышением инфекционной заболеваемости.
В связи с истощением тканевых запасов железа начинает использоваться «транспортный фонд», что находит отражение в снижении уровня ферритина в сыворотки крови (при средней величине 35 нг/мл – до 10 нг/мл и ниже). Далее снижается насыщение трансферрина железом (ниже 25%), повышается общая железосвязывающая способность сыворотки. Все указанные изменения развиваются у ребенка еще до снижения уровня сывороточного железа (ниже 11,6 мкмоль/л) и гемоглобина, что соответствует понятию «латентный дефицит железа».
Железодефицитная анемия развивается при выраженном опустошении тканевых резервов железа и истощении механизмов компенсации, когда нарушаются процессы гемоглобинообразования. Уменьшается как общее количество Hb, так и его концентрация в эритроцитах. Поскольку такая анемия в детском возрасте относится к разряду регенераторных, то эффективность и скорость эритропоэза при этом снижаются в меньшей степени и поэтому количество эритроцитов долгое время остается в пределах нормы и незначительно уменьшается.
Дефицит железа в организме обусловливает недостаточное его поступление в эритрокариоциты костного мозга, что ведет к резкому снижению в них синтеза гемоглобина, а также образованию железосодержащих ферментов, участвующих в метаболизме самих эритроцитов (каталазы, глутатионпероксидазы). Вследствие недостатка этих ферментов в клетках эритроидного ряда снижается их резистентность к повреждающему действию перекисных соединений, повышается их гемолиз и в конечном итоге увеличивается доля неэффективного эритропоэза.
Наряду с патологическими изменениями эритропоэза дефицит железа в организме приводит к уменьшению синтеза железосодержащих и железозависимых ферментов, участвующих в процессах тканевого дыхания (миоглобина, цитохрома С, цитохромоксидазы, пероксидазы, сукционатдегидрогеназы). Недостаток этих ферментов и гемоглобина вызывает развитие гемической и тканевой гипоксии, следствием которой становятся дистрофические и атрофические процессы в различных тканях и органах, особенно в слизистой оболочке полости рта, желудка.
Нарушение синтеза Hb при незначительном уменьшении количества эритроцитов приводит к снижению насыщения эритроцитов Hb. При этом к уже описанному выше сидеропеническому синдрому присоединяются общеанемические симптомы, патогенетически обусловленные развитием анемической гипоксии. При длительном существовании ЖДА присоединяются изменения со стороны сердечно-сердечной системы (тахикардия, приглушенность тонов, систолический шум, тенденция к гипотонии, токсические и дистрофические изменения на ЭКГ).
Последствиями дефицита железа являются задержка физического развития детей, снижение иммунитета и бактерицидной активности нейтрофилов, высокая инфекционная заболеваемость, высокая младенческая и детская смертность от интеркуррентных инфекций.
Клинические проявления железодефицитных состояний у детей. Выделяют три последовательно развивающиеся стадии дефицита железа: 1. Прелатентный дефицит железа. 2. Латентный дефицит железа (ЛДЖ). 3. Железодефицитная анемия (ЖДА).
Прелатентный дефицит железа в организме – первая стадия развития железодефицитного состояния, характеризующаяся истощением тканевых запасов железа. Клинических проявлений прелатентный дефицит железа практически не имеет.
Латентный дефицит железа в организме – вторая стадия железодефицитного состояния. Развивается на фоне «обеднения» тканевых запасов железа и уменьшения транспортного его фонда, но без снижения Hb и развития анемии.
ЛДЖ в ранней стадии (до снижения уровня сывороточного железа) не имеет характерных клинических проявлений и диагностируется по изменению показателей ферритина, трансферрина и общей железосвязывающей способности сыворотки. Для исключения ЛДЖ обследуются дети из групп риска: имеющие низкую массу при рождении, питающиеся исключительно грудным молоком в возрасте старше 7 месяцев, потребляющие цельное коровье молоко (более 0,5 литра в возрасте старше года), дети с перинатальными потерями крови, дети от ежегодно рожающих матерей, дети из семей с низким социальным статусом, девочки-подростки с обильными месячными кровотечениями.
Истощение резервов железа в организме и снижение активности железосодержащих тканевых ферментов (цитохромоксидазы, цитохрома С, сукдинатдегидрогеназы) обусловливают нарушение окислительно-восстановительных процессов с развитием комплекса трофических (сидеропенических) расстройств. При этом клинические признаки ЛДЖ обусловлены снижением как активности железосодержащих ферментов, так и уровня сывороточного железа, когда развивается сидеропенический синдром. Последний включает в себя: эпителиальные изменения (трофические нарушения кожи, ногтей, волос, слизистых оболочек); извращение вкуса (pica chloritica) и обоняния; астеновегетативные нарушения; нарушение процессов кишечного всасывания; дисфагию (затрудненное глотание) и диспепсические изменения; снижение местного иммунитета (повышенная заболеваемость острыми кишечными и респираторными инфекциями).
Железодефицитная анемия проявляет себя рядом синдромов. Астеноневротический синдром включает в себя следующие признаки: повышенная утомляемость, раздражительность, эмоциональная неустойчивость, потливость; отставание в психомоторном развитии; вялость, астения, сонливость, апатия; снижение аппетита и способности концентрировать внимание; негативизим.
У старших детей отмечаются головные боли, головокружения, шум в ушах, мелькание «мушек» перед глазами, боли в сердце, извращенный аппетит (pica chloritica, от латинского – pica, «сорока, поедающая землю») с поеданием мела, извести, сырого мяса, мясного фарша, сырого картофеля, теста, круп, вермишели, макарон, геофагия (поедание земли, глины), пагофагия (поедание избытка льда, мороженого), извращение обоняние (пристрастие к бензину, керосину, ацетону, нафталину, обувному крему, выхлопным газам), дизурия.
«Эпителиальный» синдром характеризуется бледностью кожи (особенно ладоней и ногтевых лож), слизистых оболочек (бледность конъюнктив век) и ушных раковин. У больных регистрируются сухость и шелушение кожи (особенно на лице и кистях рук), а также дистрофические изменения кожи, ногтей (мягкость, ломкость, расслоение с продольной или поперечной исчерченностью, плоскость – платонихия, приподнятость или вогнутость краев – койлонихия), волос (тусклость, повышенная ломкость, тонкость, выпадение), слизистых оболочек полости рта и языка («заеды» в углах рта, ангулярный стоматит, сглаженность сосочков – «полированный язык», покраснение и жжение языка). Возможен атрофический эзофагит (дисфагия) с хрипотой и затруднением дыхания. Изменены зубы (кариес, крошение, дефекты эмали). Возможен симптом Пламмера-Винсон – нарушение глотания твердой пищи. Со стороны органов ЖКТ вследствие недостаточным образованием соляной кислоты и пепсина развиваются атрофический гастрит, дуоденит, мальабсорбция с признаками нарушения переваривания пищевых веществ в копрограмме, неустойчивый стул, тошнота. Иногда описываю голубые склеры и хлороз (алебастрово-зеленый цвет кожи).
Сердечно-сосудистый синдром: тахикардия (одышка возможна при сердечной декомпенсации), тенденция к артериальной гипотонии, ослабление сердечных тонов, расширение границ относительной сердечной тупости, функциональный систолический шум на верхушке (следствие слабости папиллярных мышц митрального клапана), иногда жужжащие шумы над крупными сосудами (шум «волчка» над яремными венами).
Мышечный синдром: мышечная гипотония, быстрая утомляемость, ночное и дневное недержание мочи из-за слабости мышечного аппарата мочевыводящих путей, запор, непроизвольное отхождение кала и мочи при кашле и смехе (из-за слабости сфинктеров).
Синдром вторичного иммунодефицита: субфебрилитет с присоединением частых ОРВИ, пневмоний, кишечных инфекций. К редким синдромам дефицита железа относятся увеличение печени и селезенки, битурия (красный цвет мочи после употребления в пищу свеклы), отечность. У девочек-подростков возможно расстройство менструального цикла – дисменорея.
При типичных формах ЖДА выделяют легкую, среднетяжелую и тяжелую степени процесса.
Легкая степень ЖДА: в 5-6 месяцев ребенок становится вялым, нарушается аппетит, появляется умеренная бледность, раздражительность. Объективно определяется край печени, можно пропальпировать край селезенки.
Среднетяжелая ЖДА: состояние страдает более выражено – наблюдаются значительная вялость, апатия, адинамия, плаксивость, анорексия. Кожа сухая, а волосы тонкие и редкие. Язык обложен, с атрофией нитевидных сосочков на кончике. Пульс частый, на верхушке сердца прослушивается систолический шум функционального характера. Возможно умеренное увеличение печени и селезенки.
Тяжелая степень ЖДА: ребенок резко заторможен, вял, апатичен, аппетита нет, характерны запоры, извращенный вкус. Изменены волосы (тусклость, алопеция), ногти (истончение, слоистость, ломкость, койлонихии). В углах рта – «заеды». Язык «лакированный». Тахикардия и систолический шум усиливаются, прослушивается хлопающий I тон, яремные вены набухают. На ЭКГ регистрируются дистрофические изменения. Отмечаются одутловатость лица и пастозность нижних конечностей. Регистрируется выраженная гепатоспленомегалия. При развитии сердечной декомпенсации старшие дети жалуются на затруднение дыхание в спокойном состоянии, головокружение, мелькание мушек перед глазами, головные боли из-за длительной гипоксии.
Лабораторные критерии диагностики ЖДА у детей. Состояние железодефицитной анемии характеризуют следующие показатели клинического анализа крови: количество эритроцитов, уровень Hb, цветовой показатель, среднее содержание Hb в эритроците, средний объем эритроцитов, количество ретикулоцитов, морфоцитометрия эритроцитов, показатели обмена железа.
Основным гематологический показателем ЖДА является значительное уменьшение содержания гемоглобина, поскольку при дефиците железа в первую очередь страдает синтез гемоглобина, а не созревание самих эритроцитов. И только при выраженной недостаточности железа уменьшается образование эритроцитов вследствие нарушения процессов пролиферации клеток эритроидного ряда в костном мозге и усиления неэффективного зритропоэза, поэтому для ЖДА характерно сочетание нормального или незначительно сниженного количества эритроцитов с резко сниженным количеством гемоглобина.
Количество эритроцитов может определяться двумя унифицированными методами – под микроскопом в счетной камере Горяева или с помощью автоматического счетчика. Нормальные пределы колебаний числа эритроцитов (по данным Мазурина А.В.): до 6 лет 3,66-5,08 млн. в 1 мкл, у мальчиков 7 лет и старше 4,00-5,12 млн. в 1 мкл, у девочек 7 лет и старше 3,99-4,41 млн. в 1 мкл. Анемию легкой степени характеризует снижение эритроцитов от 3,5 до 3,0 млн. в 1 мкл, средней степени – 2,5-3,0 млн. в 1 мкл, тяжелой степени – менее 2,5 млн. в 1 мкл.
Содержание Hb в крови определяется унифицированным гемоглобинцианидным методом. Согласно рекомендациям WHO ВОЗ, нижней границей нормы следует считать уровень Hb 110 г/л у детей до 5 лет и 120 г/л у детей старше 5 лет, лабораторные критерии анемии в возрастном аспекте при этом следующие: у детей 0-14 дней Hb 3 . При ЖДА эта величина уменьшается.
Число ретикулоцитов позволяет определить состояние эритропоэза: регенераторная анемия (ретикулоцитоз 5-50%о); гиперрегенераторная анемия (ретикулоцитоз свыше 50%о); гипорегенераторная анемия (ретикулоцитоз менее 5%о); арегенераторная анемия (ретикулоциты отсутствуют). Содержание ретикулоцитов при ЖДА колеблется в пределах нормы, но при анемиях, связанных с кровопотерями (обильные носовые, маточные кровотечения), или на фоне лечения препаратами железа может быть повышенным.
Морфологическое исследование эритроцитов определяет следующие изменения. Для ЖДА характерна неодинаковая величина эритроцитов (анизоцитоз) со склонностью к микроцитозу (средний диаметр в норме 7,1-7,9 мкм). Выраженный микроцитоз относится к поздним проявлениям прогрессирующей анемии. При данной анемии выражен пойкилоцитоз, эритроциты бывают самой различной формы. Количество сидероцитов (эритроциты с гранулами железа, выявляемого при специальной окраске) резко снижено по сравнению с нормой, вплоть до полного их отсутствия.
Количество лейкоцитов при ЖДА имеет тенденцию к снижению чаще всего за счет нейтрофилов. В некоторых случаях количество лейкоцитов может быть слегка повышенным. Содержание лимфоцитов, моноцитов не меняется, иногда отмечается лимфопения.
Содержание тромбоцитов в большинстве случаев ЖДА оказывается в пределах нормы. У некоторых больных может наблюдаться тромбоцитоз.
Показатели обмена железа определяют состояние фонда железа в организме. К ним относятся: сывороточное железо (СЖ), общая железосвязывающая способность сыворотки (ОЖСС), коэффициент насыщения трансферрина (КНТ).
Сывороточное железо (СЖ) – биохимический лабораторный показатель, отражающий количество негеминового железа, находящегося в сыворотке (входит в состав трансферрина и ферритина сыворотки). Нормативы СЖ для новорожденных 5,0-19,3 мкмоль/л, у детей старше 1 месяца 12,5-33,6 мкмоль/л. При ЖДА показатель СЖ резко снижается (состояние сидеропении).
Общая железосвязывающая способность сыворотки (ОЖСС) – биохимический лабораторный показатель, характеризующий общее количество железа, которое может связываться с имеющимся в плазме трансферрином. Нормальные значения ОЖСС 40,6-62,5 мкмоль/л. При ЖДА показатель ОЖСС повышается.
Коэффициент насыщения трансферрина (КНТ) – производный показатель, отражающий удельный вес сывороточного железа от ОЖСС: КНТ = (СЖ : ОЖСС) х 100%. В норме значение КНТ не должны быть менее 17%.
Сывороточное железо в нормальных условиях составляет около 1/3 ОЖСС. При снижении СЖ отмечается повышение ОЖСС. Это происходит за счет возрастания значения латентной железосвязывающей способности. Соответственно одновременно отмечается и снижение КНТ, так как при этом уменьшается удельный вес связанного с железом трансферрина.
Десфераловый тест отражает уровень запасов железа в организме и основан на способности десферала организовывать соединения с железом, входящим в состав железосодержащих белков запаса (гемосидерин, ферритин), и выводиться из организма с мочой в виде комплексов.
По Бабаш Г.В. с соавторами, 1980, в норме средние уровни экскреции железа с десфералом (мг/сутки) у доношенных новорожденных 0,164±0,019, у недоношенных 0,092±0,014, у детей до 4 лет 0,41±0,03, у детей 5-6 лет 0,57±0,09, у детей 7-14 лет 0,71±0,05, у детей старше 12 лет 0,73±0,07.
Критериями ЛДЖ являются снижение уровня ферритина сыворотки, изменение показателей транспортного фонда железа, но без лабораторных признаков анемии.
Дифференциальный диагноз. ЖДА дифференцируется с другими микроцитарными гипохромными анемиями: талассемией, отравлением свинцом, сидеробластными анемиями (с нарушением синтеза порфиринов и гема).
Лабораторные критерии ЛДЖ и ЖДА
источник