Серповидноклеточная анемия (СКА) – гемоглобинопатия, дрепаноцитоз, гемоглобиноз SS или «молекулярная болезнь», как назвал ее Полинг, который совместно с другим исследователем (Итано) в 1949 году обнаружил, что гемоглобин больных, имеющих этот тяжелый недуг, отличается физико-химическими характеристиками от нормального гемоглобина. В этом же году был точно установлено, что заболевание наследуется из поколения в поколение, однако имеет неравномерное географическое распространение.
Сама болезнь впервые была описана еще в 1910 году, и сделал это врач из Америки по фамилии Херрик. Он, обследуя молодого негра, проживающего на Антильских островах, обнаружил тяжелую анемию и выраженную желтизну склер и слизистых оболочек.
Врача заинтересовала болезнь, поскольку ранее он ничего подобного не видел, поэтому он решил изучить и описать ее. При более детальном исследовании крови больного Херрик увидел необычные эритроциты, которые поразительно напоминали серп. Такие красные кровяные клетки стали называться дрепаноцитами, а патология именоваться серповидноклеточной анемией.
Причины этого тяжкого недуга кроются в физико-химических свойствах (растворимость, эритрофоретическая подвижность) гемоглобина, но не того, который признан нормальным (HbA), способным обеспечивать дыхание и питание тканей. Все дело в аномальном гемоглобине HbS, который образовался в результате мутации и присутствует у больных данным заболеванием вместо нормального – HbA. Кстати, гемоглобин S стал первым описанным и расшифрованным красным кровяным пигментом из всех дефектных гемоглобинов (есть и другие аномальные Hb, например, C, G Сан-Хосе, которые, впрочем, не дают такое тяжелое течение патологии).
Гемоглобин, содержащийся в эритроцитах больных серповидноклеточной анемией, имеет, на первый взгляд, совсем небольшие отличия. Всего-то замещение одной аминокислоты другой в 6-ом положении β-цепи (в нормальном располагается глютаминовая кислота, а в аномальном – валин). Однако глютаминовая кислота – кислая, а валин – нейтральный, что приводит к существенному изменению заряда молекулы, а, следовательно, изменению всех характеристик красного пигмента крови.
аномальное строение аминокислотной цепи гемоглобина S
Коль заболевание наследуется от родителей детям, то естественно было предположить, что причиной подобного дефекта является какой-то ген, возникший в ходе патологической мутации. (мутации генов происходят постоянно – как полезные, так и вредные). Изучение на генетическом уровне показало, что это действительно так. Аномалия нашла себе место в структурном гене бета-цепи, из-за него происходит подмена в 6-ой аминокислоте одного основания на другое (аденин на тимин). Однако, чтобы читателю было легче разобраться, есть необходимость очень коротко объяснить некоторые термины, употребляемые генетиками, иначе причины появления такой тяжелой патологии так и останутся непонятными. Таким образом, последовательность аминокислот в белке (а гемоглобин, как известно, белок) кодируют 3 нуклеотида, которые контролируются определенными генами и называются кодирующими тринуклеотидами, кодонами или триплетами.
В данном случае получается, что:
- Не тронутый мутацией ген (триплет у людей здоровых – ГАГ), обеспечивает формирование нормального гемоглобина (HbA);
- У больных, в результате точечной мутации, появления патологического гена серповидноклеточной анемии происходит замена аденина на тимин и кодирующим тринуклеотидом является уже ГТГ.
По причине подобных изменений на генетическом уровне возникает такое нехорошее следствие, как:
- Замещение отрицательно заряженной глютаминовой кислоты на нейтральный валин;
- Изменение заряда молекулы HbS, а, стало быть, физико-химических свойств гемоглобина.
Наследование гемоглобиноза SS происходит по законам Менделя (в данном случае – патология наследуется по аутосомно-рецессивному типу с неполным доминированием). Если ребенок получил ген серповидноклеточной анемии и от отца, и от матери, он становится гомозиготой по данному признаку («гомо» – похожий, удвоенный, спаренный, то есть, SS), его красный кровяной пигмент будет иметь вид HbSS и вскоре после рождения у него проявится тяжелое заболевание. Повезет больше, если малыш окажется гетерозиготным (с гемоглобином HbAS), ведь, поскольку эта болезнь является гомозиготной формой HbS, то патология будет скрыта в нормальных условиях, но, вместе с тем, серповидноклеточная аномалия тоже никуда не денется. Она может дать о себе знать в будущем поколении, если встретит ген, несущий подобную информацию. Или же проявится у самого носителя гена серповидноклеточной анемии, если человек попадет в экстремальную ситуацию (недостаток кислорода, обезвоживание).
наследование серповидноклеточной анемии (по аутосомно-рецессивному типу с неполным доминированием)
Еще в 20-х годах прошлого столетия было установлено, что приобретение эритроцитами формы серпа связано с недостатком кислорода. Дефицит такого необходимого для нормальной жизнедеятельности организма элемента приводит к тому, что:
- В HbSS между остатками чуждого для нормального гемоглобина валина образуются гидрофобные связи;
- Молекула гемоглобина начинает «бояться» воды;
- Формируется линейная кристаллизация молекул HbSS;
- Кристаллы внутри гемоглобина S нарушают структурное строение мембран красных кровяных телец, заставляя последние приобрести форму серпа.
Следует заметить, что не все клетки навсегда теряют свой естественный вид. Для отдельных кровяных телец этот процесс оказывается обратимым, почему в мазках крови среди серповидных форм встречаются и нормальные эритроциты.
Прийти в норму красные клетки крови могут «успеть» при повышении парциального давления О2. Те же эритроциты, которых «заметила» система мононуклеарных фагоцитов, преждевременно погибают и удаляются из сообщества. Так развивается анемия, для которой, кстати, характерна не только склонность к тромботическим эпизодам, но и повышенная скорость разрушения кровяных телец, несущих аномальный гемоглобин (особенно, если имеет место необратимая серповидность).Такие эритроциты долго не живут. Если нормальные клетки могут циркулировать в крови до 3,5 месяцев, то серпообразные погибают в течение 15 – 20 – 30 дней. Анемия требует образования новых эритроцитов, в крови увеличивается количество молодых форм – ретикулоцитов., развивается эритроидная гиперплазия костного мозга, сопровождаемая изменениями в костной системе (скелет, череп).
- Замедление кровотока (особенно, в микроциркуляторном русле);
- Очаговые нарушения кровообращения (инфаркты) в костной системе и внутренних органах, причиной которых стали тромбозы сосудов мелкого калибра серпообразными кровяными тельцами;
- Хроническая гемолитическая гиперплазия костного мозга;
- Эпизодические кризы, сопровождающиеся болями в животе, а также суставными и мышечными болями.
Наиболее уязвимыми при замедлении кровотока оказываются те органы, которые особо нуждаются в кислороде. Разрушение серпообразных эритроцитов в кровеносных сосудах селезенки нередко заканчивается тромбозом этих сосудов, что, в свою очередь, может приводить к повторным инфарктам органа. Результатом этого становится атрофия селезенки.
Иногда серпообразные красные кровяные тельца очень пугают врачей, появляясь у людей, имеющих вполне нормальный гемоглобин и никогда не слышащих о таком тяжком недуге, как СКА. Когда это происходит? Дело в том, что на образование серпообразных форм может влиять ряд внеэритроцитарных факторов:
- Низкие значения водородного показателя (рН) – они способствуют удалению кислорода из крови, чем провоцируют изменение формы эритроцитов;
- Повышение температуры тела (увеличивается поглощение кислорода);
- Анемия любого происхождения (кровь недостаточно насыщается кислородом);
- Беременность и роды.
Безусловно, в данных случаях приобретая серповидную форму, красные клетки крови также теряют свойства, также повышается вязкость крови и затрудняется кровоток в микроциркуляторном русле. Однако с внеэритроцитарными факторами (если в эритроцитах содержится нормальный гемоглобин) можно как-то бороться, используя адекватную терапию, или они могут уйти сами по себе, если это были временные обстоятельства (лихорадка, беременность). В случае серповидноклеточной анемии все перечисленные выше факторы еще больше усугубят ситуацию и окончательно замкнут порочный круг.
Такая патология, как серповидноклеточная анемия, неравномерно распространена на планете. В основном, эта болезнь «выбирает» тропический и субтропический климат Западного полушария. Наиболее часто аномальный гемоглобин S встречается в Африке (Уганда, Камерун, Конго, побережье Гвинейского залива и т. д.), поэтому некоторые считают HbS специфическим «африканским» гемоглобином. Однако это не совсем правильно.
Нередко аномальную форму красного кровяного пигмента можно встретить в странах Азии и Ближнего Востока. Привлекает ген серповидноклеточной анемии и теплый климат некоторых европейских стран, например, Греции, Италии, Португалии (в отдельных районах частота встречаемости его достигает 27 – 32%).
А вот народы севера и северо-запада Европы пока могут быть спокойны, здесь аномальный гемоглобин HbS – крайняя редкость. Между тем, не следует забывать об активной миграции последних лет. Конечно, на лодках до Европы добираются гетерозиготы, больной серповидноклеточной анемией вряд ли отправится в путешествие. Но ведь эти люди, обжившись на новом месте, будут жениться и заводить детей, то есть, становится возможным появление гомозигот и самой болезни. В конце-концов, не исключены и межэтнические браки, и тогда распространенность на земном шаре гемоглобиноза SS, возможно, приобретет другие очертания.
Заболевание (гомозиготная форма HbS), как правило, дебютирует между 3 и 6 месяцем жизни ребенка, обычно протекая по типу кризов и прогрессируя, задерживает и сильно изменяет общее развитие маленького человека. Дети погибают в возрасте 3 – 5 лет, некоторые доживают до 10-летнего возраста и лишь единицам в Африке удается достигнуть взрослого состояния. Правда, в экономически развитых странах (Великобритания, Германия, США и пр.) болезнь может иметь несколько иное течение, ведь питание и лечение, которые могут позволить себе жители данных регионов, повышают и качество жизни, и ее продолжительность. В США зарегистрированы случаи, когда больные серповидноклеточной анемией встретили и 50-, и 60-летний юбилей.
Что же представляет собой это тяжелое заболевание? Какие изменения в организме оно привносит?
Оказалось, что симптомы болезни настольно многообразны, что недуг «удостоился звания Великого имитатора».
Серповидноклеточную анемию, поскольку она проявляется вскоре после рождения, причисляют к патологии детского возраста. Очень редко болезнь дебютирует у подростков и, тем более, у взрослых, хотя и молодых, людей. Наличие СКА в среднем возрасте – исключение, которое можно встретить в богатой семье, проживающей, например, в США. Однако в той же Африке до 50% малышей погибают на первом году жизни, то есть, практически сразу после появления симптомов.
Некоторые исследователи условно разделяют течение заболевания на три периода:
- От 5-6 месяцев жизни до 2-3 лет;
- От 3 до 10 лет;
- Старше 10 лет (затяжная форма).
Следует отметить, что у новорожденных всякие симптомы болезни, как правило, отсутствуют (о наличии гена сеповидноклеточной анемии можно судить только после проведения генетического анализа). А так, эритроциты младенцев – двояковогнутые диски, как им и надлежит быть, ребенок внешне здоров. Это происходит за счет фетального гемоглобина, который, однако, вскоре начнет замещаться гемоглобином S. Где-то к полугоду фетальный Hb окончательно покинет красные клетки крови и тогда начнется развитие болезни, если ген серповидноклеточной анемии достался малышу от обоих родителей. Кодировать последовательность аминокислот в глобине будет триплет ГТГ (вместо ГАГ), который станет причиной синтеза патологического гемоглобина и изменения формы красных кровяных телец. Направить этот процесс в нужное русло на таком уровне просто невозможно, поскольку ген серповидноклеточной анемии в гомозиготном состоянии этого не позволит.
У маленьких детей после ухода фетального гемоглобина и замещения его HbSS появляются первые признаки болезни:
- Потеря аппетита;
- Повышенная восприимчивость к различным инфекциям;
- Раздражительность и беспокойство;
- Желтушность кожи и видимых слизистых;
- Увеличение селезенки;
- Замедление общего развития.
Но так как болезнь имеет три периода и ее называют «великим имитатором», возможно, читателю будет интересно более детально изучить ее.
Иной раз в первом периоде появляются симптомы гемолитической анемии (ГА) и больше никаких признаков патологии не следует. Но подобное, когда ГА является единственным признаком болезни, случается очень редко. Вместе с тем, анемия даже не определяет тяжесть течения болезни. Ее пациенты неплохо переносят и особо не жалуются на здоровье. Такой феномен можно объяснить тем, что кривая диссоциации патологического гемоглобина смещена вправо (по сравнению с аналогичной кривой нормального гемоглобина), а сродство к О2 снижено, поэтому гемоглобин легче отдает кислород тканям.
Классический же вариант первого периода имеет три главных симптома:
- Болезненная припухлость костей конечностей;
- Появление гемолитических кризов (наиболее частая причина смерти);
- Инфаркты в легких.
На первом этапе болезни воспалительный характер припухлости, распространяющейся на различные участки костно-суставной системы (стопы, голени, кисти рук, нередко – суставы), дает интенсивную болезненность. Морфология данного симптома заключается в появлении тромбозов сосудов, которые обеспечивают питание тканей, серпообразными кровяными тельцами.
Второе (самое страшное и опасное) проявление патологического состояния – гемолитический криз, который у 12% больных выступает в качестве дебюта заболевания. Причиной гемолитического криза нередко становятся перенесенные инфекции (корь, пневмония, малярия). Присоединение криза к воспалительно-инфекционному процессу сильно усугубляет течение болезни и ухудшает состояние больного, что отмечается при лабораторном исследовании крови:
- Гемоглобин стремительно падает;
- Общее количество эритроцитов также уменьшается, ведь серповидные клетки долго не живут, а нормальных красных телец в мазке практически нет;
- Резко снижается гематокрит.
Клинически все это проявляется ознобом, значительным повышением температуры тела, возбуждением, нарастанием анемической комы. К сожалению, большинство детей через несколько часов (от начала столь бурных событий) погибает. Однако, если больного удалось «вытащить», то в дальнейшем можно ожидать изменение лабораторных показателей (повышение неконъюгированного билирубина и уробилина в моче) интенсивно-желтую окраску кожи (разумеется, если больной относится к белой расе), склер и видимых слизистых.
Иногда в первом периоде имеют место другие кризы – апластические, для которых характерна гипоплазия костного мозга, дающая выраженную анемию и уменьшение молодых форм эритроцитов (ретикулоцитов) в крови. Апластические кризы чаще всего возникают на фоне инфекционных болезней и более характерны для африканского континента, поскольку там перед сезоном дождей – настоящий «разгул» инфекций. Симптомы апластического криза: слабость, головокружение, резкое ухудшение состояния, развитие сердечной недостаточность.
Между тем, это не все кризы, которые могут подстерегать больного ребенка. У детей могут встречаться секвестрационные кризы, причиной которых является застой крови в печени и селезенке, хотя явные признаки гемолиза могут отсутствовать. Зато симптомы такого криза очень красноречиво свидетельствуют о тяжелом состоянии малыша:
- Стремительное увеличение селезенки и печени;
- Сильнейшие боли в животе, поэтому колени ребенка согнуты и прижаты к животу;
- Желтуха становится более выраженной;
- Уровень гемоглобина падает до 20г/л;
- Нередко – коллапс.
Причиной подобного криза в большинстве случаев является пневмония.
Таким образом, для описываемой болезни характерны два главных вида криза:
- Тромботический или болевой (ревматоидный, абдоминальный, сочетанный);
- Анемический (гемолитический, апластический, секвестрационный).
И, наконец, еще один важный признак, присутствующий в начале болезни – инфаркты легких, которые обычно повторяются и возникают в результате тромбоза легочных сосудов аномальными кровяными тельцами. Симптомы (внезапная боль в грудной клетке, одышка, кашель) указывают на тяжелое состояние больного, хотя, следует заметить, смерть в подобных случаях наступает сравнительно редко.
На втором этапе развития болезни первая роль достается хронической гемолитической анемии, которая может прийти сразу после гемолитического криза или развиваться постепенно, а также новые симптомы, причиной которых выступают тромбозы внутренних органов. Симптомы второго периода, в общем-то, типичны:
- Слабость, утомляемость;
- Бледность кожных покровов с присутствием некоторой желтизны;
- Продолжительность жизни красных клеток крови не больше 1 месяца;
- Гиперплазия костного мозга;
- Изменения костной системы («башенный» череп, искривленный позвоночник, тонкие длинные конечности);
- Сплено- и гепатомегалия (за счет чего сильно увеличен живот), поражения печени (причина – ишемия с последующим некрозом гепатоцитов), протекающие по типу гепатитов, усиленный гемолиз с вторичным гемохроматозом, холангит, калькулезный холецистит (камни в желчном пузыре). В большинстве случаев исход – развитие цирроза;
- Страдания сердечно-сосудистой системы: увеличенное сердце, частый пульс, изменения на ЭКГ. Нередким последствием ГА является сердечная недостаточность, причиной которой одни авторы считают ишемию миокарда, другие – тромбозы легочных сосудов и кардиодистрофию (поражения сердца в иных случаях приводят к диагностической ошибке, поскольку симптомы могут свидетельствовать о ревматическом пороке сердца, тем более, что у таких больных присутствуют суставные изменения);
- Тромбозы почечных сосудов, инфаркты и кровотечения (макро- и микрогематурия) приводящие к развитию железодефецитной анемии и почечной недостаточности;
- Неврологическая симптоматика, напоминающая диффузный энцефалит и возникающая на фоне сосудистых нарушений (головная боль, головокружение, судорожный синдром, парестезии, параличи черепно-мозговых нервов, гемиплегии);
- Зрительные нарушения вплоть до слепоты (отслойка сетчатки, изменения глазного дна, кровоизлияния);
- Образование трофических язв;
- Абдоминальные кризы (причина – тромбоз мелких сосудов брыжейки), которые из-за сильной боли могут закончиться шоком и гибелью больного.
Большая часть детей, серповидной анемией погибает именно во втором периоде. Причиной смерти, как правило, являются: гемолитическая анемия, сердечная недостаточность, нарушение мозгового кровообращения. И без того тяжелое течение сильно усугубляют инфекции, на фоне их дети, в основном, не доживают даже до 5-летнего возраста.
Больше 10 лет больные с СКА живут очень редко, но с улучшением жизненных условий и качества медицинского обслуживания отдельные пациенты достигают взрослого состояния. Однако следует отметить, эти люди не совсем полноценны, они инфантильны, астеничны, плохо развиты во всех смыслах. Как правило, по жизни их сопровождает гемолитическая анемия, аспления в результате аутоспленэктомии (инфаркты селезенки приводят к образованию рубцов, сморщиванию органа и уменьшению его размеров). По причине несостоятельности селезенки затормаживается образование иммуноглобулинов, от чего сильно страдает иммунитет – любая инфекция может привести к сепсису и летальному исходу.
В этом периоде нередки абдоминальные кризы и неврологические расстройства, которые дают усиление гемолиза и желтухи.
Беременность у женщин, доживших до половой зрелости, протекает очень тяжело и заканчивается выкидышем или рождением мертвого ребенка. Сама женщина также часто погибает, поскольку во время беременности развивается тяжелейшая анемия, за которой следует шок, кома и смерть.
Такого лечения, которое избавило бы человека от тяжелого недуга раз и навсегда просто не существует. Если гетерозиготам (HbAS), то есть, носителям, можно порекомендовать придерживаться некоторых правил (не пить, не курить, в горы не ходить, тяжелой работой себя не загружать, чтобы патологический гемоглобин «сидел тихо» в эритроцитах), то гомозиготам (больным СКА) потребуется настоящее лечение, направленное на:
- Борьбу с анемией и повышение качества красных клеток крови (трансфузии эритроцитарной массы, гидроксимочевина в капсулах);
- Устранение болевого синдрома (наркотические анальгетики: промедол, морфий, трамадол);
- Ликвидацию излишков железа, вышедшего из разрушенных эритроцитов (десферал, эксиджад);
- Лечение инфекционных заболеваний (антибиотики);
- Предотвращение образования, а затем распада серпообразных кровяных телец (кислородотерапия).
В иных случаях при СКА приходится прибегать к хирургическому лечению. Например, почечные кровотечения бывают столь длительны и интенсивны, что приходится удалять кровоточащий участок почки или даже целую почку. Но иногда оперативное вмешательство бывает и неоправданным, когда встречаются такие абдоминальные кризы, которые имитируют хирургическую патологию (аппендицит, холецистит, кишечная непроходимость).
источник
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Серповидноклеточная анемия (гемоглобинопатии) является хронической гемолитической анемией, встречающейся преимущественно у чернокожих жителей Америки и Африки, обусловлена гомозиготным наследованием HbS. Серповидные эритроциты блокируют капилляры, вызывая ишемию органов. Периодически развиваются кризы, сопровождаемые болями. Инфекционные осложнения, аплазия костного мозга, легочные осложнения (острый респираторный синдром) могут характеризоваться острым развитием и летальным исходом. Наиболее типична при этом нормоцитарная гемолитическая анемия. Для постановки диагноза требуется проведение электрофореза гемоглобина и демонстрация серповидности формы эритроцитов в неокрашенной капле крови. Терапия кризов состоит в назначении анальгетиков и поддерживающей терапии. Иногда требуется трансфузионная терапия. Вакцинация против бактериальных инфекций, профилактическое назначение антибиотиков и интенсивное лечение инфекционных осложнений продлевает выживаемость больных. Гидроксимочевина уменьшает частоту возникновения кризов.
У гомозигот (около 0,3 % лиц негроидной расы) заболевание протекает в виде тяжелой гемолитической анемии, при гетерозиготной форме (от 8 до 13 % лиц негроидной расы) анемия не проявляется.

В гемоглобине S глутаминовая кислота в 6-й позиции бета-цепи замещена валином. Растворимость деоксигенированного гемоглобина S значительно меньше, чем деоксигенированного гемоглобина А, что приводит к формированию полутвердого геля и серповидной деформации эритроцитов в условиях низкого рО2. Деформированные, неэластичные эритроциты адгезируют к эндотелию сосудов и закупоривают мелкие артериолы и капилляры, что приводит к ишемии. Венозные агрегаты эритроцитов предрасполагают к развитию тромбозов. Так как серповидные эритроциты имеют повышенную хрупкость, механическая травма сосудов приводит к гемолизу. Хроническая компенсаторная гиперплазия костного мозга вызывает деформацию костей.

Острые обострения (кризы) происходят периодически, часто без видимой причины. В некоторых случаях повышенная температура тела, вирусная инфекция, местная травма способствуют обострению заболевания. Наиболее частым видом обострения заболевания является болевой криз, обусловленный ишемией и инфарктом костей, но может происходить и в селезенке, легких, почках. Апластический криз происходит в случаях замедления костномозгового эритропоэза в период острой инфекции (особенно вирусной), когда может проявляться острая эритробластопения.
Большинство симптомов проявляется у гомозигот и являются результатом анемии и окклюзии сосудов, приводя к ишемии тканей и инфаркту. Анемия обычно тяжелой степени, но сильно варьируют среди больных. Типичными проявлениями являются умеренная желтушность и бледность.
Больные могут быть плохо развиты и часто имеют относительно короткое туловище с длинными конечностями и череп «башенной» формы. Гепатоспленомега-лия типична для детей, но из-за частых инфарктов и последующих фиброзных изменений (аутоспленэктомия) селезенка у взрослых обычно очень маленькая. Часто отмечаются кардиомегалия и систолические шумы изгнания, а также холелитиаз и хронические язвы голеней.
Болевые кризы вызывают выраженные боли в трубчатых костях (например, большеберцовой), руках, кистях и стопах (синдром «кисть-стопа»), суставах. Типично появление гемартрозов и некрозов головки бедра. Сильные боли в животе могут развиваться с тошнотой или без нее и, если они обусловлены серповидными эритроцитами, обычно сопровождаются болями в спине или в суставах. У детей анемия может обостряться в результате острого разрушения серповидных эритроцитов в селезенке.
Острый «торакальный» синдром, обусловленный микроваскулярной окклюзией, является основной причиной смерти и встречается у 10 % больных. Синдром встречается в любом возрасте, но наиболее типичен для детей. Характеризуется внезапной лихорадкой, болью в груди и появлением легочных инфильтратов. Инфильтраты появляются в нижних долях, в 1/3 случаев с двух сторон, и могут сопровождаться плевральным выпотом. Впоследствии может развиваться бактериальная пневмония, быстро развивающаяся гипоксемия. Повторяющиеся эпизоды предрасполагают к развитию хронической легочной гипертензии.
Приапизм является серьезным осложнением, которое может вызвать эректильную дисфункцию, и встречается чаще у молодых мужчин. Возможно развитие ишемических инсультов и поражение сосудов ЦНС.
При гетерозиготной форме (HbAS) не развиваются гемолиз, болевые кризы или тромботические осложнения, кроме возможных гипоксических состояний(например, при подъеме в горы). Рабдомиолиз и внезапная смерть может развиться в период выраженных физических нагрузок. Нарушение способности концентрировать мочу (гипостенурия) является типичным осложнением. Унилатеральная гематурия (неизвестной природы и обычно из левой почки) может встречаться у половины больных. Иногда диагностируется папиллярный некроз почек, но он более характерен для гомозигот.
Поздние осложнения проявляются в задержке роста и развития. Отмечается также повышенная чувствительность к инфекции, особенно пневмококковой и Salmonella (включая остеомиелит, вызванный Salmonella). Эти инфекции особенно типичны для раннего детского возраста и могут быть фатальными. Среди других осложнений могут встречаться аваскулярный некроз головки бедренной кости, нарушение концентрирующей функции почек, почечная недостаточность и фиброз легких.

У больных с семейным анамнезом, но без признаков заболевания проводится скрининг быстрым пробирочным тестом, который зависит от различной растворимости HbS.
Больные с симптомами или признаками заболевания или его осложнениями (например, задержка роста, острые необъяснимые боли в костях, асептический некроз головки бедра) и чернокожие с нормоцитарной анемией (особенно при наличии гемолиза) нуждаются в проведении лабораторных исследований для гемолитической анемии, электрофорезе гемоглобина и изучении эритроцитов на наличие серповидности. Число эритроцитов в крови обычно около 2-3 млн в мкл с пропорциональным снижением гемоглобина, обычно определяются нормоциты (в то время как микроциты предполагают наличие а-талассемии). В крови часто обнаруживаются ядросодержащие эритроциты, ретикулоцитоз > 10 %. Уровень лейкоцитов повышен, часто со сдвигом влево в период криза или бактериальной инфекции. Количество тромбоцитов обычно повышено. Сывороточный билирубин также часто выше нормы (например, 34-68 мкмоль/л), моча содержит уробилиноген. Высохшие окрашенные мазки могут содержать только небольшое количество серповидных эритроцитов (формы полумесяца с растянутыми или остроконечными концами). Патогномоничным критерием при всех S-гемоглобинопатиях является серповидность в неокрашенной капле крови, которую оберегают от высыхания или обрабатывают сохраняющим реактивом (например, метабисульфитом натрия). Серповидность может быть также вызвана снижением напряжения О2. Такие условия обеспечивают герметизацию капли крови под покровным стеклом с масляным гелем.
Изучение костного мозга при необходимости дифференциальной диагностики с другими анемиями демонстрирует гиперплазию с преобладанием нормобластов при кризах или выраженной инфекции, может определяться аплазия. СОЭ в случае ее измерения с целью исключения других заболеваний (например, ювенильного ревматоидного артрита, вызывающего боли в кистях и стопах) низкое. Случайной находкой при рентгенографии костей может быть выявление расширения диплопических пространств в костях черепа со структурой в виде «солнечных лучей». В трубчатых костях часто выявляется утончение кортикального слоя, неравномерная плотность и новые костные формирования в пределах медуллярного канала.
Гомозиготное состояние дифференцируется от других серповидных гемоглобинопатии путем обнаружения только HbS с вариабельным количеством HbF при электрофорезе. Гетерозиготная форма определяется обнаружением большего количества НbА, чем HbS при электрофорезе. HbS необходимо дифференцировать от других гемоглобинов, имеющих сходную картину электрофореза, путем выявления патогномоничной морфологии эритроцитов. Диагноз важен для проведения последующих генетических исследований. Чувствительность пренатальной диагностики может быть значительно улучшена с помощью ПЦР-технологии.
У больных с серповидноклеточной анемией в период обострения, сопровождаемого болью, лихорадкой, симптомами инфекции, рассматривается возможность возникновения апластического криза, выполняются исследования гемоглобина и определение ретикулоцитов. У пациентов с болями в грудной клетке и затруднением дыхания рассматривается возможность наличия острого торакального синдрома и эмболии легочной артерии; необходимо выполнение рентгенографии легких и оценка артериальной оксигенации. Гипоксемия или наличие инфильтратов при рентгенографии легких предполагает возникновение острого «торакального» синдрома или пневмонии. При гипоксемии без наличия инфильтратов в легких следует думать об эмболии легких. У больных с лихорадкой, инфекцией или острым торакальным синдромом выполняют посевы и другие соответствующие диагностические исследования. При необъяснимой гематурии, даже если у больного не подозревается наличие серповидноклеточной анемии, следует рассмотреть возможность наличия этого заболевания.

источник

Серповидноклеточная анемия (СКА) является наиболее тяжелой формой наследственных гемоглобинопатий (генетически обусловленных нарушений строения гемоглобина). Серповидные эритроциты быстро разрушаются в организме, а также закупоривают множество сосудов по всему организму, что может стать причиной тяжелых осложнений и даже смерти.
Данное заболевание крови широко распространено в странах Африки и является частой причиной смерти лиц негроидной расы. Это связано с широким распространением малярии в данном регионе (инфекционного заболевания, поражающего эритроциты человека). Ввиду миграции населения и смешивания этнических групп сегодня данный вид анемии может встречаться у людей любой расы в самых различных регионах мира. Мужчины и женщины болеют одинаково часто.
Интересные факты
- Первое документированное упоминание о серповидноклеточной анемии датируется 1846 годом.
- Около 0,5% населения Земли являются здоровыми носителями гена серповидноклеточной анемии.
- Как больные серповидноклеточной анемией, так и бессимптомные носители мутантного гена практически невосприимчивы к малярии. Это связано с тем, что возбудитель малярии (малярийный плазмодий) способен поражать только нормальные эритроциты.
- На сегодняшний день серповидноклеточная анемия считается неизлечимым заболеванием, однако при адекватном лечении больные люди могут доживать до глубокой старости и иметь детей.
Внутреннее пространство эритроцита почти полностью заполнено гемоглобином – особым белково-пигментным комплексом, состоящим из белка глобина и железосодержащего элемента – гема. Именно гемоглобин играет главную роль в транспорте газов в организме.
Каждый эритроцит содержит, в среднем, 30 пикограмм (пг) гемоглобина, что соответствует 300 миллионам молекул данного вещества. Молекула гемоглобина состоит из двух альфа (а1 и а2) и двух бета (b1 и b2) белковых цепей глобина, которые образуются путем соединения множества аминокислот (структурных компонентов белков) в строго определенной последовательности. В каждой цепи глобина находится молекула гема, включающая в себя атом железа.
Образование глобиновых цепей запрограммировано генетически и контролируется генами, расположенными в различных хромосомах. Всего в организме человека 23 пары хромосом, каждая из которых представляет собой длинную и компактную молекулу ДНК (дезоксирибонуклеиновой кислоты), которая включает в себя огромное число генов. Избирательная активация того или иного гена приводит к синтезу определенных внутриклеточных белков, которые в конечном итоге и определяют структуру и функцию каждой клетки организма.
За синтез а-цепей глобина ответственны четыре гена с 16 пары хромосом (ребенок получает по 2 гена от каждого из родителей, а синтез каждой цепи контролируется двумя генами). В то же время синтез b-цепей контролируется только двумя генами, расположенными в 11 паре хромосом (каждый ген отвечает за синтез одной цепи). К каждой образовавшейся цепи глобина присоединяется гем, в результате чего формируется полноценная молекула гемоглобина.
Важно отметить, что кроме альфа-цепей и бета-цепей, в эритроцитах могут образовываться и другие цепи глобина (дельта, гамма, сигма). Их комбинации приводят к образованию различных видов гемоглобина, что характерно для определенных периодов развития человека.
В организме человека определяется:
- HbA. Нормальный гемоглобин, состоящий из двух альфа и двух бета-цепей. В норме данная форма составляет более 95% гемоглобина взрослого человека.
- HbA2. Малая фракция, в норме составляющая не более 2% всего гемоглобина взрослого человека. Состоит из двух альфа и двух сигма-цепей глобина.
- HbF (фетальный гемоглобин). Данная форма состоит из двух альфа и двух гамма-цепей и преобладает в период внутриутробного развития плода. Она обладает большим сродством к кислороду, что обеспечивает тканевое дыхание ребенка в период рождения (когда доступ кислорода из организма матери ограничен). У взрослого человека доля HbF не превышает 1 – 1,5% и встречается в 1 – 5% эритроцитов.
- HbU (эмбриональный гемоглобин). Начинает образовываться в эритроцитах со 2 недели после зачатия и полностью замещается фетальным гемоглобином после начала кроветворения в печени.
Транспортная функция эритроцитов обусловлена наличием атомов железа в составе гемоглобина. При прохождении через легочные капилляры железо присоединяет к себе молекулы кислорода и транспортирует их ко всем тканям организма, где происходит отделение кислорода от гемоглобина и переход его в клетки различных органов. В живых клетках кислород принимает участие в клеточном дыхании, а побочным продуктом данного процесса является углекислый газ, который выделяется из клеток и также связывается с гемоглобином.
При повторном прохождении через легочные капилляры углекислый газ отсоединяется от гемоглобина и выделяется из организма с выдыхаемым воздухом, а к освободившемуся железу присоединяются новые молекулы кислорода.
Образование эритроцитов (эритропоэз) впервые отмечается на 19 день эмбрионального развития в желточном мешке (особом структурном компоненте эмбриона). По мере роста и развития человеческого организма кроветворение происходит в различных органах. Начиная с 6 недели внутриутробного развития основным местом образования эритроцитов являются печень и селезенка, а на 4 месяце появляются первые очаги кроветворения в красном костном мозге (ККМ).
Красный костный мозг представляет собой совокупность стволовых кроветворных клеток, расположенных в полостях костей организма. Больше всего вещества ККМ находится в губчатых костях (костях таза, черепа, тел позвонков), а также в длинных трубчатых костях (плеча и предплечья, бедра и голени). Постепенно доля кроветворения в ККМ увеличивается. После рождения ребенка кроветворная функция печени и селезенки угнетается, и костный мозг становится единственным местом образования эритроцитов и других клеток крови – тромбоцитов, обеспечивающих свертываемость крови, и лейкоцитов, выполняющих защитную функцию.
Все клетки крови образуются из так называемых стволовых клеток, которые появляются в организме плода на раннем этапе эмбрионального развития в небольшом количестве. Данные клетки считаются практически бессмертными и уникальными. Они содержат ядро, в котором располагается ДНК, а также множество других структурных компонентов (органоидов), необходимых для роста и размножения.
В скором времени после образования стволовая клетка начинает делиться (размножаться), в результате чего появляется множество ее клонов, которые дают начало другим клеткам крови.
Из стволовой клетки образуется:
- Клетка-предшественница миелопоэза. Эта клетка схожа со стволовой, но обладает меньшим потенциалом к дифференцировке (приобретению специфических функций). Под влиянием различных регуляторных факторов она может начать делиться, при этом происходит постепенная утрата ядра и большинства органоидов, а результатом описанных процессов является образование эритроцитов, тромбоцитов или лейкоцитов.
- Клетка-предшественница лимфопоэза. Данная клетка обладает еще меньшей способностью к дифференцировке. Из нее образуются лимфоциты (разновидность лейкоцитов).
Процесс дифференцировки (превращения) клетки-предшественницы миелопоэза в эритроцит стимулируется особым биологическим веществом – эритропоэтином. Он выделяется почками, если ткани организма начинают испытывать недостаток в кислороде. Эритропоэтин усиливает образование эритроцитов в красном костном мозге, их количество в крови повышается, что увеличивает доставку кислорода к тканям и органам.
Эритропоэз в красном костном мозге длится около 4 – 6 дней, после чего в кровоток выделяются ретикулоциты (молодые формы эритроцитов), которые в течение суток окончательно созревают, превращаясь в нормальные эритроциты, способные выполнять транспортную функцию.
Средняя продолжительность жизни нормального эритроцита оставляет 100 – 120 дней. Все это время они циркулируют в крови, постоянно изменяясь и деформируясь при прохождении через капилляры органов и тканей. С возрастом происходит уменьшение пластических свойств эритроцитов, они становятся более округлыми и утрачивают способность к деформации.
В норме небольшая доля красных клеток крови разрушается в красном костном мозге, в печени или непосредственно в сосудистом русле, однако абсолютное большинство стареющих эритроцитов разрушается в селезенке. Ткань данного органа представлена множеством синусоидных капилляров, имеющих в своих стенках узкие щели. Нормальные эритроциты без труда проходят через них, после чего возвращаются в кровоток. Старые эритроциты менее пластичны, в результате чего они застревают в синусоидах селезенки и разрушаются специальными клетками данного органа (макрофагами). Кроме того, изъятию из кровообращения и разрушению подвергаются эритроциты с нарушенной структурой (как при серповидноклеточной анемии) либо зараженные различными вирусами или микроорганизмами.
В результате разрушения эритроцитов, образуется и выделяется в кровоток пигмент желтого цвета – билирубин (непрямой, несвязанный). Это вещество плохо растворяется в воде. С током крови оно переносится в клетки печени, где связывается с глюкуроновой кислотой – образуется связанный, или прямой, билирубин, который включается в состав желчи и выделяется с калом. Часть его всасывается в кишечнике и выделяется с мочой, придавая ей желтоватый оттенок.
Железо, входящее в состав гема, также выделяется в кровоток при разрушении эритроцитов. В свободной форме железо токсично для организма, поэтому оно быстро связывается со специальным белком плазмы – трансферрином. Трансферрин переносит железо в красный костный мозг, где оно вновь используется для синтеза эритроцитов.
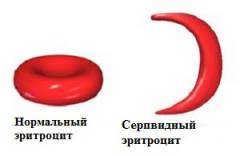
Артериальная кровь, оттекающая от легких, насыщена кислородом, поэтому никаких изменений в структуре гемоглобина не происходит. На тканевом уровне молекулы кислорода переходят в клетки различных органов, что приводит к полимеризации гемоглобина и образованию серповидных эритроцитов.
На начальных этапах заболевания данный процесс обратим — при повторном прохождении через легочные капилляры кровь насыщается кислородом, и эритроциты приобретают свою нормальную форму. Однако такие изменения повторяются каждый раз, когда эритроциты проходят через различные ткани и отдают им кислород (сотни или даже тысячи раз в день). В результате этого строение мембраны эритроцитов нарушается, повышается ее проницаемость для различных ионов (из клетки выходит калий и вода), что привод к необратимому изменению формы эритроцитов.
Пластические способности серповидного эритроцита значительно снижены, он не способен обратимо деформироваться при прохождении через капилляры и может закупоривать их. Нарушение кровоснабжения различных тканей и органов обуславливает развитие тканевой гипоксии (недостатка кислорода на тканевом уровне), что приводит к образованию еще большего количества серповидных эритроцитов (образуется так называемый порочный круг).
Мембрана серповидных эритроцитов отличается повышенной ломкостью, в результате чего продолжительность их жизни значительно укорачивается. Уменьшение общего количества эритроцитов в крови, а также местные нарушение кровообращения на уровне различных органов (в результате закупорки сосудов) стимулирует образование эритропоэтина в почках. Это усиливает эритропоэз в красном костном мозге и может частично или полностью компенсировать проявления анемии.
Важной отметить, что HbF (состоящий из альфа-цепей и гамма-цепей), концентрация которого в некоторых эритроцитах достигает 5 – 10%, не подвергается полимеризации и предотвращает серповидную трансформацию эритроцитов. Клетки с малым содержанием HbF подвергаются изменениям в первую очередь.
Половые клетки мужчины и женщины содержат в себе по 23 хромосомы. В процессе оплодотворения происходит их слияние, в результате чего образуется качественно новая клетка (зигота), из которой и начинает развиваться плод. Ядра мужских и женских половых клеток также сливаются между собой, восстанавливая, таким образом, полноценный набор хромосом (23 пары), присущий клеткам человеческого организма. При этом ребенок наследует генетический материал от обоих родителей.
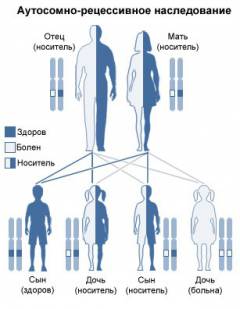
Серповидноклеточная анемия наследуется по аутосомно-рецессивному типу, то есть, чтобы родился больной ребенок, он должен унаследовать мутантные гены от обоих родителей.
В зависимости от набора генов, полученных от родителей, может родиться:
- Ребенок, больной серповидноклеточной анемией. Такой вариант возможен в том и только в том случае, если и отец, и мать ребенка больны данным заболеванием либо являются его бессимптомными носителями. При этом ребенок должен унаследовать по одному дефектному гену от обоих родителей (гомозиготная форма заболевания).
- Бессимптомный носитель. Данный вариант развивается в том случае, если ребенок наследует один дефектный и один нормальный ген, который кодирует образование нормальных цепей глобина (гетерозиготная форма заболевания). В результате в эритроците будет примерно одинаковое количество как гемоглобина S, так и гемоглобина А, которого достаточно для поддержания нормальной формы и функции эритроцита в обычных условиях.
На сегодняшний день не удалось установить точную причину возникновения генных мутаций, приводящих к возникновению серповидноклеточной анемии. Однако исследованиями последних лет выявлен ряд факторов (мутагенов), воздействие которых на организм может приводить к повреждению генетического аппарата клеток, вызывая целый ряд хромосомных заболеваний.
Причиной генетических мутаций может быть:
- Малярийная инфекция. Данное заболевание вызывается малярийными плазмодиями, которые при попадании в организм человека поражают эритроциты, вызывая их массовую гибель. Это может приводить к мутациям на уровне генетического аппарата красных клеток крови, обуславливая появление различных заболеваний, в том числе серповидноклеточной анемии и других гемоглобинопатий. Некоторые исследователи склонны считать, что хромосомные мутации в эритроцитах являются своего рода защитной реакцией организма против малярии, так как серповидные эритроциты практически не поражаются малярийным плазмодием.
- Вирусная инфекция. Вирус представляет собой неклеточную форму жизни, состоящую из нуклеиновых кислот РНК (рибонуклеиновой кислоты) или ДНК (дезоксирибонуклеиновой кислоты). Данный инфекционный агент способен размножаться только внутри клеток живого организма. Поражая клетку, вирус встраивается в ее генетический аппарат, изменяя его таким образом, что клетка начинает продуцировать новые фрагменты вируса. Данный процесс может вызывать возникновение различных хромосомных мутаций. В качестве мутагена могут выступать цитомегаловирусы, вирусы краснухи и кори, гепатита и многие другие.
- Ионизирующее излучение. Представляет собой поток невидимых невооруженным глазом частиц, которые способны воздействовать на генетический аппарат абсолютно всех живых клеток, приводя к возникновению множества мутаций. Количество и выраженность мутаций зависит от дозы и длительность облучения. Помимо естественного радиационного фона Земли дополнительными источниками радиации могут стать аварии на АЭС (атомных электростанциях) и взрывы атомных бомб, частные рентгенологические исследования.
- Вредные факторы окружающей среды. В данную группу входят различные химические вещества, с которыми сталкивается человек в процессе своей жизнедеятельности. Сильнейшими мутагенами являются эпихлоргидрин, используемый в производстве множества медикаментов, стирол, использующийся при изготовлении пластмасс, соединения тяжелых металлов (свинца, цинка, ртути, хрома), табачный дым и множество других химических соединений. Все они обладают высокой мутагенной и канцерогенной (вызывающей рак) активностью.
- Лекарственные препараты. Действие некоторых медикаментов обусловлено их влиянием на генетический аппарат клеток, что связано с риском возникновения различных мутаций. Наиболее опасными лекарственными мутагенами являются большинство противоопухолевых препаратов (цитостатиков), препараты ртути, иммунодепрессанты (угнетающие деятельность иммунной системы).
На тяжесть клинического течения серповидноклеточной анемии влияют:
- Наличие гемоглобина F. Чем его больше, тем менее выражена симптоматика заболевания. Этим объясняется отсутствие симптомов СКА у новорожденных – большая часть HbF замещается на HbA к шестому месяцу жизни ребенка.
- Климатические и географические условия. Давление кислорода во вдыхаемом воздухе обратно пропорционально высоте над уровнем моря. Другими словами, чем выше находится человек, тем меньше кислорода поступает в его легкие при каждом вдохе. Симптомы серповидноклеточной анемии могут проявляться и ухудшаться уже через несколько часов после поднятия на высоту более 2000 метров над уровнем моря (даже у людей с гетерозиготной формой заболевания). Больным СКА абсолютно противопоказано проживание в условиях высокогорья (некоторые города Америки и Европы располагаются на высоте в несколько километров).
- Социально-экономические факторы. Доступность и своевременность лечения осложнений серповидноклеточной анемии также влияет на выраженность клинических проявлений заболевания.
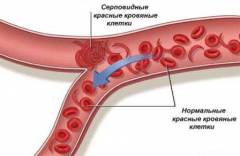
Внешние проявления серповидноклеточной анемии обусловлены, в первую очередь, скоростью разрушения (гемолиза) серповидных эритроцитов (срок жизни которых укорачивается до 10 – 15 дней), а также различными осложнениями, возникающими в результате закупорки серповидными эритроцитами капилляров по всему организму.
Среди симптомов серповидноклеточной анемии выделяют:
- симптомы, связанные с разрушением эритроцитов;
- гемолитические кризы;
- симптомы, обусловленные закупоркой мелких сосудов;
- увеличение селезенки;
- склонность к тяжелым инфекциям.
Данная группа симптомов обычно начинает проявляться через полгода жизни ребенка, когда уменьшается количество гемоглобина F (в тяжелых случаях гомозиготной формы заболевания) либо в более поздние сроки.
Наиболее ранними проявлениями серповидноклеточной анемии являются:
- Бледность. Развивается из-за уменьшения количества красных клеток в крови. Кожа и видимые слизистые оболочки (полости рта, конъюнктивы глаза и другие) становятся бледными и сухими, кожа становится менее эластичной.
- Повышенная утомляемость. Дети с серповидноклеточной анемией характеризуются вялым и малоподвижным образом жизни. При любой физической нагрузке увеличивается потребность организма в кислороде, то есть развивается гипоксия. Это приводит к тому, что большее число эритроцитов приобретают серповидную форму и разрушается. Транспортная функция крови снижается, в результате чего быстро появляется чувство усталости.
- Частые головокружения. Обусловлены недостатком кислорода на уровне головного мозга, что является опасным для жизни состоянием.
- Одышка. Данный термин подразумевает увеличение частоты и глубины дыхательных движений, возникающее в результате ощущения нехватки воздуха. У больных серповидноклеточной анемией этот симптом обычно возникает в периоды физической активности, однако возможно его появление и в покое (при тяжелых формах заболевания, в условиях высокогорья).
- Отставание в росте и развитии. Ввиду того, что транспортная функция крови значительно снижена, ткани и органы не получают достаточного количества кислорода, необходимого для нормального роста и развития организма. Следствием этого является отставание в физическом и умственном развитии — дети позже, чем их сверстники, начинают ходить, говорить, им хуже дается школьная программа. Также отмечается задержка в половом созревании ребенка.
- Желтушность кожи. Пигмент билирубин, выделяющийся в кровоток при разрушении эритроцитов, придает коже и видимым слизистым оболочкам желтоватую окраску. В норме данное вещество довольно быстро нейтрализуется в печени и выводится из организма, однако при серповидноклеточной анемии количество разрушающихся эритроцитов настолько велико, что печень оказывается не в состоянии обезвредить весь образующийся билирубин.
- Темная моча. Цвет мочи изменяется из-за увеличения концентрации билирубина в ней.
- Избыток железа в организме. Данное состояние может развиться в результате тяжелых, часто повторяющихся гемолитических кризов, когда в кровоток выделяется слишком много свободного железа. Это может привести к возникновению гемосидероза – патологического состояния, характеризующегося отложением оксида железа в различных тканях (в ткани печени, селезенки, почек, легких и так далее), что приведет к нарушению функции пораженных органов.
Гемолитические кризы могут возникать в различные периоды жизни. Длительность ремиссии (периода без кризов) может исчисляться месяцами или годами, после чего может наступить целый ряд приступов.
Развитию гемолитического криза может предшествовать:
- тяжелая генерализованная инфекция;
- тяжелая физическая работа;
- подъем на большую высоту (более 2000 метров над уровнем моря);
- воздействие чрезмерно высоких или низких температур;
- обезвоживание (истощение запасов жидкости в организме).
Для гемолитического криза характерно быстрое образование большого числа серповидных эритроцитов, которые закупоривают мелкие сосуды и разрушаются в селезенке, печени, красном костном мозге и других органах, а также непосредственно в сосудистом русле. Это приводит к резкому уменьшению количества красных клеток крови в организме, что проявляется нарастанием одышки, частыми головокружениями (вплоть до потери сознания) и другими симптомами, описанными ранее.
Как уже говорилось, серповидные эритроциты не способны проходить через мелкие сосуды, поэтому застревают в них, что приводит к нарушению кровообращения практически в любых органах.
Симптомами серповидноклеточной анемии являются:
- Болевые кризы. Возникают в результате закупорки сосудов, питающих определенные органы. Это приводит к развитию недостатка кислорода на тканевом уровне, что сопровождается приступами сильной острой боли, которые могут длиться от нескольких часов до нескольких дней. Результатом описанных процессов является гибель участка ткани или органа, доставка кислорода к которому нарушена. Болевые кризы могут возникать внезапно на фоне полного благополучия, однако чаще всего им предшествуют вирусные и бактериальные инфекции, выраженная физическая нагрузка или другие состояния, сопровождающиеся развитием гипоксии.
- Кожные язвы. Развиваются в результате закупорки мелких сосудов и нарушения кровообращения в различных участках кожных покровов. Пораженный участок изъязвляется и довольно часто инфицируется, что может стать причиной развития тяжелых инфекционных заболеваний. Наиболее характерным расположением язв является кожа верхних и нижних конечностей, однако возможно поражение кожи туловища, шеи и головы.
- Нарушения зрения. Развиваются в результате закупорки артерии, питающей сетчатку глаза. В зависимости от диаметра пораженного сосуда могут появляться различные нарушения, начиная от снижения остроты зрения и заканчивая отслойкой сетчатки и развитием слепоты.
- Сердечная недостаточность. Причиной поражения сердца может быть закупорка серповидными эритроцитами коронарных артерий (сосудов, доставляющих кровь к сердечной мышце) и развитие острого инфаркта миокарда (гибели части сердечной мышцы, вызванной нарушением доставки кислорода). Кроме того, длительная анемия и гипоксия рефлекторно вызывают увеличение частоты сердечных сокращений. Это может привести к гипертрофии (увеличению в размерах) сердечной мышцы с последующим истощением компенсаторных механизмов и развитием сердечной недостаточности.
- Гематурия (кровь в моче). Данный симптом может появляться в результате тромбоза почечных вен и поражения нефронов (функциональных единиц почечной ткани, в которых происходит образование мочи), в результате чего они становятся проницаемыми для эритроцитов. При длительном течении заболевания может наступить гибель более 75% нефронов и развитие почечной недостаточности, что является неблагоприятным прогностическим признаком.
- Приапизм. Данный термин подразумевает спонтанное возникновение длительной и болезненной эрекции полового члена у мужчин. Этот симптом обусловлен закупоркой мелких капилляров и вен, через которые происходит отток крови от органа, что иногда может привести к развитию импотенции.
- Изменение структуры костей. Для серповидноклеточной анемии характерны частые инфаркты костной ткани, что приводит к изменению структуры костей, они становятся менее прочными. Кроме того длительная гипоксия стимулирует выделение большого количества эритропоэтина почками, что приводит к разрастанию эритроидного ростка кроветворения в красном костном мозге и деформации костей черепа позвонков, ребер.
- Поражение суставов. Отмечаются припухлость и болезненность суставов конечностей (стоп, голеней, кистей, пальцев тук и ног).
- Неврологические проявления. Являются результатом закупорки артерий, питающих различные участки головного и спинного мозга. Неврологическая симптоматика у больных серповидноклеточной анемией может проявляться нарушениями чувствительности, парезами (нарушением двигательных функции), плегиями (полной утратой двигательных функций в конечностях), а также острым ишемическим инсультом (возникающим в результате закупорки артерии головного мозга), что может привести к смерти человека.
Увеличение селезенки происходит в результате задерживания и разрушения в ней большого числа серповидных эритроцитов. Кроме того, могут развиваться инфаркты селезенки, в результате чего значительно снижаются ее функциональные способности.
На начальных этапах серповидноклеточной анемии в селезенке задерживаются и разрушаются только серповидные эритроциты. По мере прогрессирования заболевания происходит закупорка синусоидов органа, что нарушает прохождение (фильтрацию) всех остальных клеток крови и обуславливает увеличение органа в размерах (спленомегалию).
В результате застоя крови в увеличенной селезенке может развиться состояние, называемое гиперспленизмом. Оно характеризуется разрушением не только поврежденных, но и нормальных клеточных элементов (тромбоцитов, лейкоцитов, неизмененных эритроцитов). Это сопровождается быстрым уменьшением количества данных клеток в периферической крови и развитием соответствующих симптомов (частых кровотечений, нарушения защитных свойств организма). Развитие гиперспленизма особенно опасно в раннем детском возрасте, когда в увеличенной селезенке может произойти быстрое разрушение большинства эритроцитов крови, что приведет к смерти ребенка.

В диагностике серповидноклеточной анемии применяется:
- общий анализ крови;
- биохимический анализ крови;
- электрофорез гемоглобина;
- ультразвуковое исследование (УЗИ);
- рентгенологическое исследование.
Один из первых анализов, назначаемых всем пациентам при подозрении на заболевание крови. Он позволяет оценить клеточный состав периферической крови, что дает информацию о функциональном состоянии различных внутренних органов, а также о кроветворении в красном костном мозге, наличии инфекции в организме. Для общего анализа могут брать как капиллярную кровь (из пальца), так и венозную.
Техника взятия капиллярной крови
Кровь берут утром, натощак. Накануне перед сдачей анализа не рекомендуется употреблять алкогольные напитки, курить или принимать наркотические препараты. Непосредственно перед взятием крови следует согреть пальцы левой руки, что улучшит микроциркуляцию и облегчит процедуру.
Забор материала для анализа производится медицинской сестрой в процедурном кабинете поликлиники. Кожу кончика пальца обрабатывают ватным тампоном, который предварительно смачивают 70% раствором спирта (с целью предотвращения занесения инфекции). После этого специальной иглой-скарификатором производят прокол кожи на боковой поверхности пальца (обычно используется 4 палец левой руки, однако это не принципиально). Первая появившаяся капля крови удаляется ватным тампоном, после чего медсестра начинает поочередно сдавливать и отпускать кончик пальца, набирая в стерильную градуированную трубку несколько миллилитров крови.
При подозрении на серповидноклеточную анемию палец, из которого будет браться кровь, предварительно перевязывают веревкой или жгутом (на 2 – 3 минуты). Это создает условия гипоксии, в результате чего образуется большее число серповидных эритроцитов, что облегчит постановку диагноза.
Техника взятия венозной крови
Забор крови также производится медицинской сестрой. Правила подготовки к анализу такие же, как при взятии крови из пальца. Обычно кровь берут из подкожных вен локтевой области, расположение которых довольно легко определить.
Пациент присаживается и кладет руку на спинку стула, максимально разгибая ее в локтевом суставе. Медсестра накладывает резиновый жгут в плечевой области (сдавливание подкожных вен приводит к переполнению их кровью и выбуханию над поверхностью кожи) и просит пациента несколько секунд «поработать кулаком» (сжимать и разжимать кулак), что также способствует наполнению вен кровью и облегчает их определение под кожей.
Определив расположение вены, медсестра дважды обрабатывает локтевую область ватным тампоном, предварительно пропитанным 70% спиртовым раствором. После этого стерильным одноразовым шприцем прокалывается кожа и стенка вены и производится забор необходимого количества крови (обычно нескольких миллилитров). К месту прокола прижимается чистый ватный тампон (также смоченный в спирте), и игла извлекается. Пациенту рекомендуют подождать в коридоре 10 – 15 минут, так как возможно возникновение определенных побочных реакций (головокружения, потери сознания).
Микроскопическое исследование крови
Несколько капель полученной крови переносится на предметное стекло, окрашивается специальными красителями (обычно метиленовым синим) и исследуется в световом микроскопе. Данный метод позволяет примерно определить количество клеточных элементов крови, оценить их размеры и строение.
При серповидноклеточной анемии возможно выявление серповидных эритроцитов (при исследовании венозной крови), однако их отсутствие не исключает диагноза. Обычное микроскопическое исследование не всегда позволяет выявить серповидные эритроциты, поэтому применяется исследование «влажного мазка» крови. Суть исследования заключается в следующем — каплю крови переносят на предметное стекло и обрабатывают особым веществом – пиросульфитом натрия. Он «вытягивает» кислород из эритроцитов, в результате чего они приобретают серповидную форму (если человек действительно болен серповидноклеточной анемией), что обнаруживается при исследовании в обычном световом микроскопе. Данное исследование является высокоспецифичным и позволяет подтвердить диагноз в большинстве случаев.
Исследование крови в гематологическом анализаторе
Большинство современных лабораторий оборудованы гематологическими анализаторами – аппаратами, позволяющими быстро и точно определить количественный состав всех клеточных элементов, а также многие другие параметры крови.
| Исследуемый показатель | Что обозначает? | Норма | Возможные изменения при серповидноклеточной анемии |
| Концентрация эритроцитов (RBC) | При серповидноклеточной анемии отмечается выраженное разрушение эритроцитов (гемолиз), в результате чего их концентрация в крови будет снижена. Данное состояние особенно характерно для гемолитических кризов, когда может разрушаться более половины циркулирующих в крови эритроцитов. | Мужчины (М): 4,0 – 5,0 х 10 12 /л. | Менее 4,0 х 10 12 /л. |
| Женщины (Ж): 3,5 – 4,7 х 10 12 /л. | Менее 3,5 х 10 12 /л. | ||
| Общий уровень гемоглобина (HGB) | В результате разрушения эритроцитов снижается и общий уровень гемоглобина в крови. | М: 130 – 170 г/л. | Менее 130 г/л. |
| Ж: 120 – 150 г/л. | Менее 120 г/л. | ||
| Концентрация лейкоцитов (WBC) | Лейкоциты защищают организм от различных инфекционных агентов. При серповидноклеточной анемии отмечается предрасположенность к инфекционным заболеваниям, ввиду чего данный показатель может повышаться. | 4,0 – 9,0 х 10 9 /л. | Повышение уровня лейкоцитов выше 9,0 х 10 9 /л говорит о наличии инфекционного процесса в организме. |
| Концентрация тромбоцитов (PLT) | В случае развития гиперспленизма в увеличенной селезенке разрушаются не только серповидные эритроциты, но и нормальные клетки крови. | 180 – 320 х 10 9 /л. | В норме или снижена. |
| Концентрация ретикулоцитов (RET) | Уменьшение концентрации эритроцитов стимулирует выделение эритропоэтина почками, что усиливает процессы кроветворения в красном костном мозге. Результатом этого является выделение в периферический кровоток большого количества ретикулоцитов. | М: 0,24 – 1,7%. | Повышена, особенно после гемолитических кризов. |
| Ж: 0,12 – 2,05%. | |||
| Гематокрит (Hct) | Гематокрит – лабораторный показатель, отражающий количественное соотношение между клеточными элементами крови и объемом плазмы. Выраженный гемолиз приводит к уменьшению общего количества эритроцитов и, следовательно, к уменьшению гематокрита. | М: 42 – 50%. | Ниже нормы, вплоть до 15 – 20% в периоды гемолитических кризов. |
| Ж: 38 – 47%. | |||
| Скорость оседания эритроцитов (СОЭ) | Определяется время, в течение которого произойдет оседание эритроцитов на дно пробирки. В нормальных условиях наружная поверхность мембран эритроцитов несет отрицательный заряд, в результате чего клетки отталкиваются друг от друга. Уменьшение концентрации эритроцитов, а также различные инфекционные процессы в организме способствуют более быстрому оседанию эритроцитов. | М: 3 – 10 мм/час. | Более 10 мм/час. |
| Ж: 5 – 15 мм/час. | Более 15 мм/час. |
| Исследуемый показатель | Что обозначает? | Норма | Возможные изменения при серповидноклеточной анемии |
| Уровень билирубина (несвязанная фракция) | Данный показатель отображает интенсивность процессов разрушения эритроцитов как в селезенке, так и непосредственно в сосудистом русле. | 4,5 – 17,1 мкмоль/л. | Значительно выше нормы. |
| Свободный гемоглобин плазмы | Данный показатель отображает интенсивность процесса разрушения эритроцитов непосредственно внутри сосудов (внутрисосудистого гемолиза), при котором в кровь выделяется большое количество свободного гемоглобина. | Менее 220 мг/л. | Значительно выше нормы, особенно в период гемолитического криза. |
| Уровень гаптоглобина в плазме | Гаптоглобин – это белок плазмы крови, образующийся в печени. Одной из основных его функций является связывание свободного гемоглобина в крови и транспортировка его в селезенку, где он подвергается разрушению. При гемолизе эритроцитов в сосудистом русле количество выделяемого в кровь гемоглобина настолько велико, что весь гаптоглобин находится в связанном с ним состоянии, поэтому его количество уменьшается. | 0,8 – 2,7 г/л. | Значительно ниже нормы, особенно в период гемолитических кризов. |
| Концентрация свободного железа в крови | Повышение количества свободного железа в плазме крови обычно характерно для гемолитического криза. Белок трансферрин не успевает связать все железо, поступающее в кровь в результате разрушения большого количества эритроцитов, поэтому его концентрация повышается. | М: 17,9 – 22,5 мкмоль/л. | В период гемолитического криза данный показатель может быть в несколько раз выше нормы. |
| Ж: 14,3 – 17,9 мкмоль/л. | |||
| Уровень аланинаминотрансферазы (АлАТ) и аспартатаминотрансферазы (АсАТ) | Данные вещества являются внутриклеточными ферментами, содержащимися в клетках печени в больших количествах. Увеличение их концентрации в крови является маркером разрушения ткани печени, что может быть следствием микроинфарктов (в результате закупорки печеночных сосудов серповидными эритроцитами). | М: до 41 Ед/л. | При тяжелом течении заболевания значительно превышает норму. |
| Ж: до 31 Ед/л. |
Широко распространенный научный метод исследования, позволяющий определить качественный состав гемоглобина в крови. Суть метода заключается в следующем — на бумагу, расположенную в стационарном электрическом поле между двумя электродами, помещают раствор, содержащий различные белки, которые начинают перемещаться от катода (отрицательно заряженного электрода) к аноду (положительно заряженному электроду).
Скорость перемещения белковых молекул зависит от их молекулярной массы, пространственной конфигурации и электрического заряда. Данные параметры строго специфичны для каждой отдельной цепи глобина (как нормальной, так и патологической), в результате чего их электрофоретическая подвижность будет различной. На основании контрольных маркеров определяют виды гемоглобина в исследуемой крови и количество каждого из них.
| Вид гемоглобина | Нормальные значения | Возможные изменения при серповидноклеточной анемии |
| HbA | Более 95%. | Менее 50%. |
| HbA2 | Менее 2%. | В норме или снижено. |
| HbF | 1 – 1,5 %. | В норме или слегка повышено. |
| HbS | Отсутствует. | 50% и более. |
Современный метод исследования внутренних органов, основанный на принципе эхолокации, позволяющий определить расположение и структуру объекта по скорости возвращения звуковой волны, отраженной от его поверхности.
УЗИ является одним из наиболее простых и безвредных диагностических методов. За несколько часов перед исследованием пациенту необходимо исключить прием пищи и больших объемов жидкости. Сама процедура может проводиться как в специально оборудованном кабинете, так и непосредственно у постели больного. На кожу исследуемой области наносится специальный гель (это предотвращает попадание воздуха между датчиком и кожей пациента, что могло бы исказить результаты исследования). После этого врач прикладывает к коже пациента специальный датчик, излучающий ультразвуковые волны, и начинает перемещать его над исследуемой областью. Звуковые волны отражаются от поверхностей различных органов и структур, находящихся на их пути, и улавливаются специальным приемником. После компьютерной обработки на мониторе появляется примерное изображение исследуемых тканей и органов.
Разновидностью ультразвукового исследования является допплерография – метод, позволяющий оценить характер кровотока в сосудах.
При серповидноклеточной анемии метод УЗИ может выявить:
- увеличение селезенки и печени;
- наличие инфарктов во внутренних органах (в селезенке, печени, почках и других);
- нарушение кровообращения во внутренних органах;
- нарушение кровотока в конечностях.
Это исследование основано на способности рентгеновских лучей проходить через организм человека. При этом они частично поглощаются различными тканевыми структурами, в результате чего на специальной пленке формируется теневое отображение всех органов и тканей, оказавшихся на их пути.
Наибольшей поглощающей способностью в организме человека обладает костная ткань, что позволяет использовать данный метод для определения наличия и выраженности поражений костей при серповидноклеточной анемии.
Рентгенологическое исследование позволяет выявить:
- деформацию и расширение тел позвонков (из-за множественных инфарктов);
- деформацию и истончение костей скелета (из-за избыточного разрастания костномозговой ткани);
- наличие остеомиелита (гнойного инфекционного процесса в костной ткани).
Эффективного лечения серповидноклеточной анемии, позволяющего раз и навсегда избавиться от данного недуга, на сегодняшний день не существует. Помощь больным заключаются в предотвращении образования большого количества серповидных эритроцитов, а также в устранении симптомов заболевания.
Принципами лечения серповидноклеточной анемии являются:
- правильный образ жизни;
- повышение количества эритроцитов и гемоглобина;
- кислородотерапия;
- устранение болевого синдрома;
- устранение избытка железа в организме;
- профилактика и лечение инфекционных заболеваний.
Если у человека диагностирована серповидноклеточная анемия, ему следует соблюдать определенные рекомендации, которые позволят облегчить течение заболевания и минимизировать риск развития осложнений.
Пациентам с серповидноклеточной анемией рекомендуется:
- проживать на высоте не более 1500 метров над уровнем моря;
- проживать в зоне с умеренным климатом (исключающим воздействие экстремально низких или высоких температур);
- употреблять не менее 1,5 литров жидкости ежедневно;
- исключить прием алкогольных напитков и наркотиков;
- отказаться от курения (как самому больному человеку, так и членам его семьи);
- избегать тяжелых физических нагрузок;
- выбирать профессию, не связанную с тяжелой физической работой или воздействием высоких/низких температур.
| Название препарата | Механизм леченого действия | Способ применения и дозы | Оценка эффективности лечения | |
| Немедикаментозные методы | ||||
| Эритроцитарная масса | Перелитые донорские эритроциты в течение некоторого времени (обычно не более 100 дней) могут транспортировать дыхательные газы в организме больного. Данный метод используется крайне редко, ввиду возможности развития тяжелых побочных реакций. | Основным показанием для переливания донорских эритроцитов является резкое снижение уровня гемоглобина ниже 70 г/л (например, при гемолитическом кризе). В таком случае устанавливается катетер в одну или сразу в несколько центральных вен (в яремные, расположенные на шее или в подключичные), и производится переливание эритроцитарной массы. Целевой уровень гемоглобина при этом составляет не менее 100 г/л. | ||
Перед началом переливания проводится целый ряд тестов, направленных на определение совместимости крови донора и реципиента.
- повышение уровня гемоглобина (определенное лабораторно);
- исчезновение одышки;
- нормализация цвета кожи.
Применение гидроксимочевины в лечении серповидноклеточной анемии считается экспериментальной методикой. Широкомасштабных исследований, оценивающих эффективность препарата и возможные побочные реакции, еще не проводилось.
Частота и выраженность гемолитических кризов определяет тяжесть клинического течения серповидноклеточной анемии. Как уже говорилось, развитию гемолитического криза предшествуют различные состояния, сопровождающиеся гипоксией. Применение кислорода в первые минуты или часы после начала гемолиза предотвращает образование и последующее разрушение серповидных эритроцитов. Это облегчает течение заболевания, уменьшает риск развития осложнений и улучшает качество жизни пациента.
Пациент с развивающимся гемолитическим кризом должен быть госпитализирован как можно скорее. Непосредственно в машине скорой помощи ему дается кислородная маска, которая обеспечивает подачу кислорода со скоростью 4 – 6 литров в минуту. После поступления в стационар кислородотерапия продолжается на протяжении нескольких часов или дней.
| Название медикамента | Механизм лечебного действия | Способ применения и дозы | Оценка эффективности лечения |
| Трамадол | Синтетическое наркотическое обезболивающее средство, действующее на уровне головного и спинного мозга. Активирует опиоидные рецепторы в организме, что уменьшает интенсивность болевого синдрома. | Внутривенно или внутрь, в дозе 50 – 100 мг. Максимальная суточная доза – 400 мг. Не рекомендуется принимать детям младше 1 года. | Обезболивающий эффект развивается примерно через 15 минут после приема внутрь (при внутривенном введении – через 5 – 10 минут) и длится до 6 часов. |
| Промедол | Активирует опиоидные рецепторы и нарушает передачу болевых импульсов в центральной нервной системе, чем и обусловлено его обезболивающее, противошоковое и легкое снотворное действие. | Внутрь, 3 – 4 раза в день. |
Рекомендуемые дозы:
- детям старше 2 лет – 0,1 – 0,5 мг/кг;
- взрослым – 25 – 50 мг.
Рекомендуемые дозы:
- детям – 0,2 – 0,8 мг/кг;
- взрослым – 10 – 20 мг.
| Название медикамента | Механизм лечебного действия | Способ применения и дозы | Оценка эффективности лечения |
| Десферал (Дефероксамин) | Комплексообразующий препарат, который обладает способностью связывать и выводить свободное железо из организма. | Данный медикамент назначается после гемолитических кризов, при повышении уровня сывороточного железа. Вводится внутривенно. Начальная доза составляет 20 мг/кг. При повторном возникновении кризов доза может быть увеличена до 40 мг/кг. | Лечение проводится до нормализации уровня железа в крови, подтвержденной лабораторно. |
| Эксиджад | Препарат для приема внутрь, обладающий железосвязывающей способностью. Усиливает выведение железа из организма преимущественно с калом. | Внутрь, 1 раз в день, в дозе 10 – 30 мг/кг. | Лечение проводится до нормализации уровня железа в крови. |
| Название медикамента | Механизм лечебного действия | Способ применения и дозы |
| Амоксициллин | Полусинтетический антибиотик, подавляющий образование клеточной стенки различных видов бактерий (стафилококков, стрептококков, пневмококков и других), что приводит к их гибели. | Может назначаться с профилактической целью, начиная с шестимесячного возраста (при тяжелом течении гомозиготной формы серповидноклеточной анемии). Принимается внутрь, 2 – 3 раза в сутки. |
Рекомендуемые дозы:
- детям младше 2 лет – 20 мг/кг;
- детям от 2 до 5 лет – 125 мг;
- детям от 5 до 10 лет – 250 мг;
- детям старше 10 лет и взрослым – 500 мг.
Рекомендуемые дозы:
- детям – 10 – 30 мг/кг, 3 раза в сутки;
- взрослым – 750 мг 3 раза в сутки.
Рекомендуемые дозы:
- детям – 10 – 15 мг/кг, 2 – 3 раза в сутки;
- взрослым – 250 – 500 мг 3 – 4 раза в сутки.
Если один или оба родителя больны серповидноклеточной анемией, то их ребенок также может унаследовать данный недуг. Одним из методов, позволяющим определить вероятность наследования гена, ответственного за развитие данного заболевания, является полимеразная цепная реакция (ПЦР). Суть метода заключается в исследовании генетического материала обоих родителей и выявлении мутантных генов. При этом определяется как их наличие (или отсутствие), так и форма заболевания (гомозиготная или гетерозиготная).
Результаты генетического исследования могут быть следующими:
- Оба родителя больны. Это подразумевает, что у обоих родителей имеется по 2 мутантных гена, кодирующих образование b-цепей глобина. Рождение здорового ребенка в таком случае практически невозможно.
- Оба родителя являются бессимптомными носителями. В данном случае вероятность рождения здорового ребенка составляет 25%, вероятность рождения больного ребенка (с гомозиготной формой заболевания) – 25%, и вероятность рождения бессимптомного носителя (с гетерозиготной формой заболевания) – 50%.
- Один из родителей болен, а второй является бессимптомным носителем. У таких родителей с одинаковой долей вероятности может родиться либо больной ребенок, либо бессимптомный носитель. Рождение абсолютно здорового ребенка в данном случае невозможно.
- Один из родителей болен, а второй здоров. В данном случае ребенок унаследует один мутантный ген от больного родителя и один нормальный ген от здорового родителя, то есть он будет бессимптомным носителем гена серповидноклеточной анемии.
С помощью ПЦР возможно выявить наличие мутантных генов у плода на ранних этапах внутриутробного развития и определить форму заболевания. Это позволяет своевременно поднять вопрос о прерывании беременности.
источник