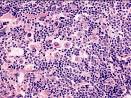
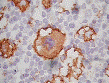
Заболевания органов кроветворения и лимфоидной ткани
Анемия (общее малокровие) — это состояние, характеризующееся уменьшением концентрации гемоглобина в единице объема крови, что часто сопровождается и снижением количества эритроцитов.
Принципы классификации анемий: этиологии и патогенезу (анемии вследствие кровопотери, анемии вследствие усиленного разрушения эритроцитов, анемии, обусловленные недостаточностью эритропоэза), по морфологической характеристике эритроцитов, среднему содержанию гемоглобина в эритроците, характеру течения, функциональному состоянию костного мозга, особенностям метаболизма железа.
Виды анемий: постгеморрагическая (острая и хроническая), гемолитическая, дисэритропоэтическая, железодефицитная, мегалобластная (Аддисона-Бирмера, пернициозная, В12-дефицитная и др. подобные), апластическая (гипопластическая).
Полицитемии – противоположные анемиям состояния, при которых повышается количество эритроцитов в периферической крови.
Опухоли кроветворной и лимфоидной тканей – это клональные разрастания трансформированных (в результате мутации) клеток гемо- или лимфопоэза. Все опухоли гемопоэтической и лимфоидной тканей делят на две большие группы — лейкозы (лейкемии) и лимфомы. При лейкозах первично поражается костный мозг. По гистогенезу лейкозы делят на миелоидные и лимфоидные, по степени дифференцировки клеток (способности клеток к созреванию) — на острые и хронические.
Классификация лейкозов: острые (бластные) — лимфобластные В- и Т-лейкозы и миелобластные. Острые миелобластные лейкозы: с минимальной дифференцировкой, без созревания, с частичным созреванием, миеломонобластный, монобластный, эритробластный и мегакариобластный. Отдельную подгруппу формируют острые миелоидные лейкозы со стойкими цитогенетическими аномалиями (промиелоцитарный и ряд других).
Хронические лейкозы миелоидного происхождения (хронические миелопролиферативные заболевания): хронический миелоидный (миелоцитарный) лейкоз (миелолейкоз), истинная полицитемия (Вакеза-Ослера), хронический (идиопатический) миелофиброз, эссенциальная тромбоцитемия.
Хронические лейкозы лимфоидного происхождения: В-клеточные (хронический лимфоцитарный лейкоз [лимфолейкоз], пролимфоцитарный, волосатоклеточный) и Т-клеточные.
Плазмоклеточные опухоли (миеломная болезнь и др.) состоят из терминально дифференцированных В-клеток (плазмоцитов), с очаговым или диффузным ростом в костном мозге, но без выхода опухолевых клеток в периферическую кровь.
Лимфомы — это первичные регионарные опухоли лимфоидной ткани. Опухоль может локализоваться в лимфатических узлах, селезенке, тимусе, мукоз-ассоциированной лимфоидной ткани (MALT), реже – в любых других тканях и органах (экстранодальные лимфомы). При прогрессии опухоли развивается опухолевая инфильтрация костного мозга, других органов, опухолевые клетки выходят в периферическую кровь (лейкемизация).
Классификация лимфом:лимфома Ходжкина (болезнь Ходжкина, лимфогранулематоз) и неходжкинские лимфомы: лимфомы из В-, Т- и NK-клеток.
Перечень препаратов, изучаемых на занятии (отмечены значком : 
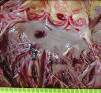
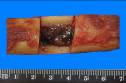
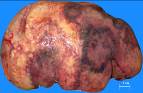
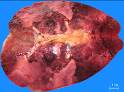
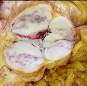
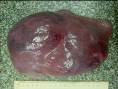
макропрепараты – шоковая почка при геморрагическом шоке (некротический нефроз, острый тубулонекроз), острое малокровие почек (см. рис. 4-23), острое малокровие селезенки (см. рис. 4-24), гиперплазия костного мозга при хронической постгеморрагической анемии, жировая дистрофия миокарда (см. рис. 2-14), хроническое малокровие почки (см. рис. 4-23), хроническое малокровие селезенки (см. рис. 4 – 24), гемосидероз селезенки при гемолитической анемии, некроз миндалин при остром лейкозе, пиоидный (гноевидный) костный мозг при хроническом миелолейкозе, печень при хроническом миелолейкозе, селезенка при хроническом миелолейкозе, лимфатические узлы при хроническом лимфолейкозе, деструкция костей черепа при миеломной болезни, селезенка при лимфоме Ходжкина (лимфогранулематозе);
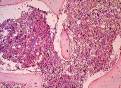
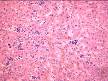
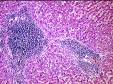
микропрепараты — экстрамедуллярное (внекостномозговое) кроветворение в печени при хронической постгеморрагической анемии, атрофический гастрит при пернициозной анемии (см. рис. 8-21), диапедезные кровоизлияния в головной мозг (см. рис. 4-13), жировая дистрофия миокарда (см. рис. 2-15), гемосидероз печени при гемолитической анемии (см. рис. 3-6), головной мозг при остром миелолейкозе, печень при хроническом миелолейкозе, печень при хроническом лимфолейкозе, фолликулярная лимфома (гистологическое и иммуноморфологическое исследования); лимфатический узел при лимфоме Ходжкина (лимфогранулематозе), гистологическое и иммуноморфологическое исследования;
электронограммы – нормальные эритроциты и серповидные эритроциты при серповидноклеточной анемии, лейкозная клетка при остром недифференцированном лейкозе, миеломная клетка.

Рис. 14-2. Макропрепарат. Шоковое легкое (легочный или респираторный дистресс-синдром взрослых [РДС, РДСВ]) при геморрагическом шоке. Объем и масса легких увеличены, консистенция плотноватая, умеренно полнокровные, синюшные, отечные, как бы пропитаны водой (с поверхности разреза стекает много умеренно пенистой жидкости), пониженной воздушности, их кусочки тонут в воде. Могут наблюдаться разной величины кровоизлияния и ателектазы. Плевра тонкая, гладкая, блестящая, может быть с кровоизлияниями (см. также рис. 5-26).
Рис. 14-3. Макропрепарат. Селезенка при геморрагическом шоке.Селезенка чаще уменьшена, дряблой консистенции, серовато-красного цвета, с умеренным или выраженным соскобом на разрезе.
Рис. 14-4. Макропрепараты (а, б). Кровоизлияния под эндокард левого желудочка при геморрагическом шоке.Петехиальные и сливные кровоизлияния под эндокардом левого желудочка сердца в области его выносящего тракта. Такие кровоизлияния наблюдаются при разных видах шока, массивной тромбоэмболии легочной артерии.

Рис. 14-6. Макропрепарат. Печень при хронической постгеморрагической анемии. Печень увеличена в размерах, плотно-эластической консистенции, с гладкой капсулой, закругленным передним краем, с поверхности и на разрезе однородного вида, бледная, малокровная, серовато-желтого цвета (сочетание малокровия с жировой дистрофией).
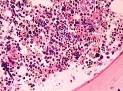
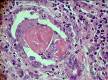
Рис. 14-7. Микропрепарат «Трепанобиоптат костного мозга при мегалобластной анемии».Гиперплазия эритрокариоцитов (эритробластов и эритроцитов с ядрами); х 400 (препарат Г.А.Франка).

Рис. 14-9. Макропрепарат. Гемосидероз печени при гемолитической анемии. Печень увеличена в размерах, плотно-эластической консистенции, с гладкой капсулой, с поверхности и на разрезе темно-бурого цвета (общий гемосидероз).

Рис. 14-11. Макропрепарат. Костный мозг диафиза бедренной кости при апластической анемии.Костный мозг бедренной кости желтого цвета (без очагов кроветворения).
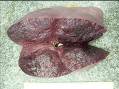
Рис. 14-12. Макропрепарат. Спленомегалия при аутоиммунной гемолитической анемии.Селезенка значительно увеличена в размерах (масса селезенки 2800 г.), с множественными очажками белого цвета (гиперплазия белой пульпы — лимфоидной ткани), красная пульпа серовато-красного, но чаще бурого цвета (общий гемосидероз). Препарат И.Н.Шестаковой.

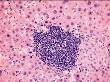
Рис. 14-14. Микропрепараты (а, б). Костный мозг тела позвонка при остром недифференцированном лейкозе.Костный мозг инфильтрирован однородного вида недифференцированными клетками гемопоэза; а – х 100, б – х 400.

Рис. 14-16. Микропрепарат. Печень при остром мегакариобластном лейкозе.Выраженная инфильтрация опухолевыми мегакариобластами паренхиматозных долек по ходу синусоидов, жировая дистрофия и липофусциноз гепатоцитов. В портальных трактах инфильтрация не выражена; х 200.
Рис. 14-17. Микропрепарат. Трепанобиоптат костного мозга при остром миелобластном лейкозе. Положительная иммуногистохимическая реакция (желтовато-коричневое окрашивание) на миелопероксидазу в бластных клетках; х 200 (препарат Г.А.Франка).

Рис. 14-19. Микропрепарат. Лейкозная инфильтрация почек при остром лейкозе.Выраженная инфильтрация ткани почек недифференцированными лейкозными клетками. Склероз и гиалиноз клубочков, белковая дистрофия, атрофия и некроз эпителия канальцев; х 100.

Рис. 14-21. Макропрепараты (а – г). Геморрагический синдром (пурпура) при остром лейкозе. Множественные петехиальные и сливные кровоизлияния в кожу (а), слизистую оболочку желудка (б), эпикард (в), мягкие мозговые оболочки (г). Препараты И.Н.Шестаковой.





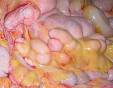

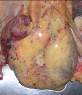
Рис. 14-28. Макропрепараты (а, б). Селезенка при хроническом лимфолейкозе.Размеры и масса селезенки увеличены (спленомегалия), поверхность может быть неровной или гладкой, консистенция плотно-эластическая. На разрезе рисунок строения стерт, серовато-красного цвета, с кровоизлияниями, прослойками серого цвета.

Рис. 14-30. Макропрепарат. Деструкция ребер при миеломной болезни. Крупные очаги деструкции (остеолиза) преимущественно губчатого вещества ребер.

Рис. 14-32. Микропрепараты (а, б). Миеломная почка.Белковые цилиндры в канальцах и собирательных трубочках (белок Бенс-Джонса – легкие цепи иммуноглобулинов — парапротеины, продуцируемые миеломными клетками), окруженные многоядерными гигантскими клетками, атрофия и некроз эпителия канальцев, склероз стромы; а – х 120, б – х 400 (препараты Е.С.Столяревич)
Рис. 14-33. Макропрепараты (а, б). Злокачественная лимфома переднего средостения.В переднем средостении обширные разрастания опухолевой ткани серовато-белого цвета с множественными очагами некроза и кровоизлияний. Опухоль не имеет четких границ, прорастает в грудину, ребра, перикард, плевру.
Рис. 14-34. Макропрепарат. Злокачественная лимфома брыжеечных лимфатических узлов.Лимфатические узлы значительно увеличены, эластической консистенции, на разрезе серовато-белого цвета с очагами некроза и кровоизлияний (препарат И.Н.Шестаковой).
Рис. 14-35. Микропрепараты (а, б). Биоптат лимфатического узла. Т-клеточная лимфоболастная лимфома, а — диффузная пролиферация лимфобластов, б — экспрессия CD10 в лимфобластах (коричневое окрашивание); б – непрямой иммунопероксидазный метод с антителами к CD10, а, б — х 400 (препараты Г.А.Франка).
Рис. 14-36. Микропрепарат. Биоптат лимфатического узла. Лимфома Беркитта. Рисунок строения лимфатического узла стерт, рассеянные среди лимфоидных клеток опухоли крупные макрофаги со светлой цитоплазмой создают картину «звездного неба»; х 100 (препарат Г.А.Франка).

Рис. 14-38. Микропрепараты (а, б). Биоптат лимфатического узла. Лимфома из клеток мантийной зоны,а – рисунок строения лимфатического узла стерт, диффузная пролиферация лимфоцитоподобных клеток; б – экспрессия клетками опухоли cyclin D1 (коричневое окрашивание); б – непрямой иммунопероксидазный метод с антителами к cyclin D1; а — х 100, б – х 200 (препараты Г.А.Франка).
Рис. 14-39. Микропрепараты (а, б). Биоптат лимфатического узла. Анапластическая крупноклеточная лимфома, а — рисунок строения лимфатического узла стерт, диффузная пролиферация крупных полиморфных лимфоцитоподобных клеток; б – экспрессия клетками опухоли CD30 (коричневое окрашивание); б – непрямой иммунопероксидазный метод с антителами к CD30; а- х 100, б – х 200 (препараты Г.А.Франка).
Рис. 14-40. Микропрепарат. Лимфома кожи.Биоптат кожи.В дерме массивный инфильтрат из мономорфных крупных округлых клеток. Для уточнения вида лимфомы необходимо иммуноморфологическое исследование, х 120.
Рис. 14-41. Микропрепарат. Лимфома почки.Биоптат почки смассивным инфильтратом из мономорфных крупных округлых клеток. Для уточнения вида лимфомы необходимо иммуноморфологическое исследование. PAS-реакция, х 100.
Рис. 14-42. Микропрепараты (а, б). MALT-лимфома желудка (лимфома из мукоз-ассоциированной лимфоидной ткани),а — слизистая оболочка и подслизистый слой желудка густо инфильтрированы лимфоцитоподобными клетками, среднего размера с бледной цитоплазмой и полиморфным ядром, не образующими каких-либо структур, убыль желез собственной пластинки; б — положительная иммуноморфологическая реакция опухолевых клеток (коричневое окрашивание) с антителами к одному из антигенов лимфоцитов CD20; б – непрямая иммунопероксидазная реакция с антителами к CD20, а – х 100, б – х 200.

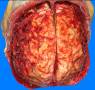
Рис. 14-44. Макропрепарат. Лимфома Ходжкина с поражением лимфатических узлов бифуркации трахеи.Лимфатические узлы увеличены, спаяны между собой, плотно-эластической консистенции, на разрезе серовато-белого цвета (препарат Л.В.Кактурского).



Дата добавления: 2016-06-05 ; просмотров: 2048 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
источник
Мотивационная характеристика темы: знание темы необходимо для изучения на клинических кафедрах заболеваний кроветворной ткани и в практической деятельности врача для сопоставления клинических данных с данными биопсий и патологоанатомических вскрытий.
Общая цель обучения: изучить этиологию, патогенез, классификацию, осложнения, причины смерти и патоморфоз анемий, а также уметь различать их виды по морфологической картине.
1. Уметь дать общую характеристику анемий: определение, причины возникновения, механизмы развития, принципы классификации, морфологические проявления;
2. Уметь диагностировать различные виды анемий на основании их микроскопической ихарактеристик;
3. Уметь дать характеристику постгеморрагической анемии, объяснить причины возникновения, механизм развития, назвать формы, представить морфологическую характеристику;
4. Уметь дать характеристику анемий вследствие нарушенного кровообразования, объяснить причины возникновения, механизм развития, назвать формы, представить особенности морфологической картины;
5. Уметь дать характеристику гемолитических анемий, объяснить причины возникновения, патогенез, назвать виды, указать особенности морфологических проявлений;
6. Уметь назвать осложнения и причины смерти больных с анемиями;
7. Уметь объяснить патоморфоз анемий.
Необходимый исходный уровень знаний: студент должен вспомнить анатомическое и гистологическое строение кроветворной и лимфатической системы, а также из курса общей патологической анатомии – морфологическую характеристику повреждения, нарушений кровообращения, воспаления и регенерации.
Вопросы для самоподготовки (исходный уровень знаний):
1. Принципы классификации анемий;
2. Этиология, патогенез и морфологическая характеристика отдельных видов анемий (постгеморрагическая, гемолитическая, вследствие нарушения кровообразования);
3. Осложнения и причины смерти при анемиях;
Анемия, малокровие (an – отрицательная приставка, haima – кровь) – группа заболеваний и состояний, характеризующихся уменьшением числа эритроцитов и количества гемоглобина в единице объема крови. Пернициозный – от perniciosus – гибельный, пагубный.
Гемофилия (haemophilia – кровоточивость) – врожденное заболевание, характеризующееся замедленной свертываемостью крови.
Содержание самостоятельной работы студентов
1. Изучить морфологические проявления постгеморрагической анемии на примере макропрепаратов «Малокровие почки при острой постгеморрагической анемии», «Костный мозг при хронической
постгеморрагической анемии» и микропрепарата вое кроветворение в печени при анемии».
2. Изучить морфологические проявления анемий вследствие нарушения кровообразования на примере макропрепаратов «Жировая дистрофия миокарда», «Гемосидероз селезенки» и микропрепаратов «Атрофия слизистой оболочки желудка при пернициозной анемии», «Петехиальные кровоизлияния в головной мозг», «Жировая дистрофия миокарда», «Гемосидероз печени».
Оснащение занятия, характеристика изучаемых препаратов
1. Костный мозг при апластической анемии (окраска гематоксилином и эозином) – обращает на себя внимание тотальное опустошение костного мозга, замещение его жировой тканью, островки гемопоэза мелкие, единичные.
2. кроветворение в печени при анемии (окраска гематоксилином и эозином) – обращает на себя внимание жировая дистрофия гепатоцитов, появление в просвете синусоидов островков кроветворной ткани.
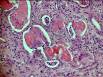
3. Атрофия слизистой оболочки желудка при пернициозной анемии (окраска гематоксилином и эозином) – слизистая оболочка желудка истончена, встречаются единичные железистые структуры, в которых отмечается исчезновение добавочных и обкладочных клеток, подслизистый слой инфильтрирован лимфоидными клетками, в собственном слое слизистой оболочки разрастание соединительной ткани. Лимфоидные фолликулы атрофичны.
4. Петехиальные кровоизлияния в головном мозге (окраска гематоксилином и эозином) – видно скопление эритроцитов, располагающихся вокруг капилляров или венул с анатомически неповрежденными стенками, просвет сосудов несколько спавшийся. Окружающая ткань мозга базофильна, отечна.
5. Жировая дистрофия миокарда (окраска суданом III) в цитоплазме карциомиоцитов видны пылевидные жировые включения, окрашенные в цвет суданом. Жировая дистрофия миокарда имеет очаговый характер, что макроскопически проявляется картиной «тигрового сердца».
6. Гемосидероз печени (реакция Перлса) в звездчатых ретикулоэндотелиоцитах и гепатоцитах скопления зерен красителя (берлинской лазури), соответствующих отложениям пигмента гемосидерина.
1. Костный мозг при анемии. Обращает на себя внимание внешний вид костного мозга плоских костей и диафизов трубчатых костей, который становится сочным и ярким. Жировой костный мозг трубчатых костей замещается красным кроветворным.
2. Почка при острой постгеморрагической анемии. Почка уменьшена в размерах, дряблой консистенции, цвета, капсула морщинистая. На разрезе корковое вещество более бледно окрашено, чем пирамидки мозгового слоя.
3. Жировая дистрофия миокарда. Обратить внимание на увеличенные размеры сердца, расширение его полостей. Ткань миокарда дряблой консистенции, на поверхности разреза глинистого цвета. Со стороны эндокарда в папиллярных мышцах и трабекулах, задней стенке левого желудочка просвечивает характерная исчерченность («тигровое сердце»).
4. Гемосидероз селезенки. Следует обратить внимание на умеренную спленомегалию, дряблую консистенцию органа, ткань на разрезе ро- с ржавым оттенком, красная пульпа гиперплазирована, сочная, фолликулы белой пульпы атрофичны.
1. Серповидноклеточная анемия. Обратить внимание, что на сканирующей электронограмме хорошо видны серповидноклеточные эритроциты в объемном трехмерном изображении.
Анемия (малокровие) – состояние, характеризующееся уменьшением содержания эритроцитов и гемоглобина в единице объема крови. Причинами анемий могут быть кровопотеря, недостаточная эритропоэтическая функция костного мозга, повышенное кроверазрушение.
При кровопотере анемия возникает в том случае, когда убыль эритроцитов в крови превышает регенераторные возможности костного мозга. То же следует сказать и о кроверазрушении, т.е. гемолизе, который может быть связан с эндогенными, экзогенными факторами. Недостаточность эритропоэтической функции костного мозга зависит от дефицита необходимых для нормального кроветворения веществ: железа, витамина В 12 , фолиевой кислоты (так называемые дефицитные анемии) – или от не усвоения этих веществ костным мозгом (так называемые ахрестические анемии).
В зависимости от этиологии и патогенеза различают 3 основные группы анемий: 1) вследствие кровопотери (постгеморрагические
анемии); 2) вследствие нарушенного кровообразования; 3) вследствие повышенного кроверазрушения (гемолитические анемии). В каждой группе выделяют различные формы заболеваний. По характеру течения анемии делят на острые и хронические. В соответствии с морфологическим и функциональным состоянием костного мозга, отражающим его регенераторные возможности, анемия может быть регенераторной, гипорегенераторной, гипопластической, апластической, диспластической.
Примечание: на педиатрическом факультете дополнительно рассматривается ювенильный хлороз, анемия при глистной инвазии, врожденные гипопластические анемии (Фанкони, Эрлиха), гемолитическая болезнь новорожденных, эритроцитопатии, гемоглобинопатии. Нафакультете подчеркнуть значение профессиональных вредностей и ядов в возникновении токсических анемий.
Тема занятия. АТЕРОСКЛЕРОЗ И АРТЕРИОСКЛЕРОЗ. ИШЕМИЧЕСКАЯ БОЛЕЗНЬ СЕРДЦА
Мотивационная характеристика темы: знание темы необходимо для изучения заболеваний системы на клинических кафедрах, а также для анализа в практической работе врача.
Общая цель обучения: изучить этиологию, патогенез, морфологию, морфогенез, патологическую анатомию атеросклероза и ишемической болезни сердца (ИБС), а также уметь различатьфологические формы атеросклероза и ИБС и их наиболее частые осложнения.
2. Уметь дать определение атеросклероза и ИБС;
3. Уметь назвать и объяснить современные теории развития атеросклероза;
4. Уметь различать стадии атеросклероза на основании данных ма- микроскопического иисследования;
5. Уметь назвать формы атеросклероза;
6. Уметь назвать и оценить осложнения при различных фологических формах атеросклероза;
7. Уметь выделить основные этиологические и патогенетические факторы развития ИБС, назвать фоновые заболевания;
8. Уметь назвать различные формы ИБС;
9. Уметь диагностировать формы ИБС на основании их микроскопической ихарактеристик;
10. Уметь объяснить осложнения и причины смерти при различных формах ИБС.
Необходимый исходный уровень знаний: студент должен вспомнить ана-
томическое и гистологическое строение сердца и артерий разного калибра, а также темы общего курса патологической анатомии – дистрофии, некроз, нарушения кровообращения, репаративные процессы.
Вопросы для самоподготовки (исходный уровень знаний):
1. Определение атеросклероза. Патологическая анатомия и морфогенез.
2. Теории, объясняющие механизмы развития атеросклероза. Факторы, способствующие его развитию.
4. Определение, этиология, патогенез и классификация ИБС.
5. Острая ИБС (инфаркт миокарда), формы, стадии.
6. Макроскопическая, микроскопическая, ультраструктурная характеристика острой и хронической ИБС.
7. Исходы, осложнения, причины смерти при ИБС.
8. Отличие морфологических проявлений ИБС на фоне гипертонической болезни и атеросклероза.
Атеросклероз (от athere – кашица, sclerosis – плотный, твердый) – хроническое заболевание, возникающее в результате нарушения жиробелкового обмена, характеризующееся поражением артерий эластичного и типа в виде очагового отложения в интиме липидов и белков и реактивного разрастания соединительной ткани.
Ишемия (ischo – задерживаю) – уменьшение кровоснабжения участка органа или ткани.
Содержание самостоятельной работы студентов
1. Изучить морфологию стадий атеросклероза на примере макропрепарата «Атеросклероз аорты с аневризмой брюшного отдела» и микропрепаратов «Липоидоз артерии», «Липосклероз аорты».
2. Изучить формы атеросклероза на примере макропрепаратов «Ишемический инфаркт (серое размягчение) головного мозга», «Атеросклеротический нефросклероз», «Гангрена нижней конечности» и микропрепарата «Инфаркт миокарда».
3. Изучить ишемическую болезнь сердца на примере макропрепаратов «Инфаркт миокарда», «Субэндокардиальный инфаркт миокарда с пристеночным тромбом», «Трансмуральный инфаркт миокарда с разрывом сердца», «Хроническая аневризма сердца».
4. Изучить ишемическую болезнь сердца на примере микропрепаратов «Атеросклероз и тромбоз венечных артерий сердца», «Исчезновение гликогена из мышечных клеток в зоне ишемии миокарда», «Острый инфаркт миокарда», «Рубцующийся инфаркт миокарда», «Крупноочаговый кардиосклероз».
Оснащение занятия, характеристика изучаемых препаратов
1. Атеросклероз коронарной артерии (окраска гематоксилином и эозином) – просвет сосуда сужен за счет атеросклеротической бляшки, в центре которой видны жиробелковые массы, игольчатые кристаллы холестерина и отложения извести (стадия атероматоза с обызвествлением). Покрышка бляшки представлена гиалинизированной соединительной тканью. Просвет артерии обтурирован тромботическими массами, состоящими из фибрина, лейкоцитов, эритроцитов.
2. Атеросклероз аорты (окраска гематоксилином и эозином) – вокруг участков отложения и распада липидов в интиме видны разрастания элементов. В периферических участках отложений много макрофагов, которые называются ксантомными клетками.
3. Инфаркт миокарда (окраска гематоксилином и эозином) – в зоне некроза отмечаются безъядерные эозинофильные массы. Область некроза отграничена от сохранившегося миокарда зоной полнокровия и лейкоцитарной инфильтрации (демаркационное воспаление). Видна веточка артерии сердца, просвет которой сужен атеросклеротической бляшкой.
4. Инфаркт миокарда (окраска по Бесту на гликоген) – в препарате кардиомиоциты в стадии некробиоза, вблизи мелких сосудов имеются немногочисленные клетки сгранулами гликогена.
5. Крупноочаговый постинфарктный кардиосклероз (окраска по Ван Гизону) – в миокарде видно обширное поле рубцовой соединительной ткани (на месте бывшего инфаркта миокарда). Мышечные волокна вокруг рубца утолщены, с крупными ядрами (проявление регенерационной гипертрофии). При окраске пикрофуксином волокна соединительной ткани мышечные волокна – зеленые.
6. Участок хронической аневризмы сердца (окраска гематоксилином и эозином) – миокард левого желудочка истончен, замещен соединительной тканью, сохранившиеся кардиомиоциты дистрофичны, на эндокарде массивные тромботические наложения.
1. Атеросклероз аорты с аневризмой брюшного отдела. Интима аорты пестрого вида. Видны участки желтого и цвета (жировые пятна), которые в отдельных местах сливаются (жировые полоски), но не возвышаются над поверхностью интимы. Большие участки занимают округлые белые илиобразования, возвышающиеся над поверхностью (фиброзные бляшки). Местами они сливаются между собой, придавая интиме бугристый вид, местами изъязвляются. В брюшном отделе имеется мешковидное выпячивание стенки аорты (аневризма), выполненное сухимитромботическими массами.
2. Стадии атеросклероза аорты. Стенка аорты деформирована, имеются аневризматические расширения и очаговые сужения. Интима неровная с наличием атеросклеротических бляшек, липоматозных пятен, атероматозных язв. Кроме того, имеется смешанный пристеночный тромб как осложнение атеросклероза.
3. Трансмуральный инфаркт миокарда. Сердце увеличено в размерах, толщина левого желудочка около 2 см. В заднебоковом отделе, распространяясь на верхушку левого желудочка, имеется участок некроза неправильной формы, цвета, занимающий всю толщу миокарда. Структура миокарда в этом участке нарушена, гомогенная.
4. Крупноочаговый кардиосклероз. Сердце увеличено в размерах. Толщина левого желудочка около 2 см. На продольном разрезе в миокарде имеются множественные прослойки плотной беловатой фи-
брозной ткани. Кроме того, виден очаг постинфарктного кардиосклероза размером 2,5×2 см.
5. Тампонада сердечной сорочки кровью. Полость перикарда плотно заполнена свертками крови, в стенке левого желудочка инфаркт, разрыв.
6. Атеросклероз сосудов мозга. В просвете сосудов основания головного мозга видны множественные атеросклеротические бляшки, перекрывающие просвет артерий на одну треть.
7. Ишемический инфаркт (серое размягчение) головного мозга. В подкорковой области виден очаг, где ткань мозга представлена кашицеобразными массами серого цвета (очаг серого размягчения).
8. Атеросклеротический нефросклероз. Почки несколько уменьшены вразмерах.Наихповерхностивиднымножественныерубцовыевтяжения, как следствие клиновидной атрофии или инфарктов. Между рубцовыми втяжениями ткань почек набухает (крупнобугристые почки.)
9. Гангрена стопы. Ткань стопы черного цвета, плотной консистенции. Четко выражена демаркационная зона.
10. Хроническая аневризма левого желудочка сердца. В переднебоковом отделе левого желудочка сердца очаговое расширение стенки с истончениеммиокардадо0,5см(аневризма).Полостьаневризмыполностью заполнена тромботическими массами. Образующиеся в аневризме тромбы могут явиться источником тромбоэмболических осложнений.
1. Долипидная стадия атеросклероза. Ультраструктурные изменения эндотелиальной клетки отражают резко повышенную трансцеллюлярную транспортную активность с элементами ее недостаточности. В эндотелиальной клетке появляется большое количество липоцитозных везикул, увеличивается зона пластинчатого комплекса, расширяются каналы эндоплазматической сети, в клетке появляются липиды. Базальная мембрана разрыхляется, местами разрушается.
2. Ишемическая дистрофия миокарда – набухание и вакуолизация митохондрий, распад крист, исчезновение гранул гликогена.
Атеросклероз – хроническое заболевание, возникающее в результате нарушения жиробелкового обмена, характеризующееся поражением артерий эластичного и типа в виде очагового отложения в интиме липидов и белков и реактивного разрастания соединительной ткани. Атеросклеротический процесс проходит определенные стадии (фазы), которые имеют макроскопическую и микроскопическую характеристику (морфогенез атеросклероза). В развитии атеросклероза наибольшее значение имеют следующие факторы: 1) обменные нарушения, 2) гормональные факторы, 3) артериальная гипертензия, 4) стрессовые и конфликтные ситуации, ведущие к психоэмоциональному перенапряжению, 5) состояние сосудистой стенки, 6) наследственные и этнические факторы.
Макроскопически различают несколько видов атеросклеротических изменений, отражающих динамику процесса: 1) жировые пятна или полоски; 2) фиброзные бляшки; 3) осложненные поражения, представленные фиброзными бляшками с изъязвлением, кровоизлияниями иналожениямитромботическихмасс;4)кальцинозилиатерокальциноз.
Данные микроскопического исследования позволяют уточнить характер изменений при разных макроскопических видах атеросклеротических поражений сосудов и на этом основании выделить несколько стадий морфогенеза атеросклероза: 1) долипидная, 2) липидоз, 3) липосклероз, 4) атероматоз, 5) изъязвление, 6) атерокальциноз. Атеросклероз имеет хроническое волнообразное течение, очередная волна липидоза характеризует активацию процесса.
В зависимости от преимущественной локализации атеросклеротического процесса в том или ином сосудистом бассейне, осложнений и исходов, к которым он ведет, выделяют несколько мических форм атеросклероза:
2. Атеросклероз коронарных артерий сердца (сердечная форма, ишемическая болезнь сердца);
3. Атеросклероз артерий головного мозга (цереброваскулярная болезнь);
4. Атеросклероз сосудов почек;
5. Атеросклероз артерий кишечника (мезентериальная форма);
6. Атеросклероз нижних конечностей.
При каждой из этих форм в органах и тканях могут возникать двоякие изменения: при острой окклюзии питающей артерии и острой недостаточности кровообращения – некротические изменения (инфаркт, гангрена), при медленном атеросклеротическом сужении питающей артерии и хронической недостаточности кровообращения – дистрофия и атрофия паренхиматозных элементов, очаговый или диффузный склероз.
Ишемическая болезнь сердца – заболевание сердца, обусловленное абсолютной или относительной недостаточностью коронарного кровообращения, поэтому ИБС – это коронарная болезнь сердца. Как самостоятельное заболевание ИБС выделена экспертами ВОЗ в 1965 году в связи с большой социальной значимостью. Генетически ишемическая болезнь связана с атеросклерозом и гипертонической болезнью и, по существу, является сердечной формой атеросклероза и гипертонической болезни. ИБС течет волнообразно, сопровождаясь коронарными кризами, т.е. эпизодами острой (абсолютной) коронарной недостаточности, возникающими на фоне хронической (относительной) недостаточности коронарного кровообращения. Различают острую и хроническую формы ИБС.
Морфологическим субстратом ИБС является инфаркт миокарда. Инфаркт миокарда понятие временное, он занимает примерно
источник
приобретенные
| Токсическая гемолитические яды, соединения мышьяка, свинца; возбудители инфекций: гемолитический стрептококк, малярийный плазмодий) | Иммунная (перелива-ние несов-местимой крови; Rh-несов-местимость крови матери и плода | Механическая (механическое повреждение эритроцитов при протезировании сосудов и клапанов сердца | Приобретенная (соматические мутации при образовании аутоантител против собственных эритроцитов под влиянием вирусов и лекарств с образованием патологических популяций эритроцитов с нарушенной мембраной |
Наследственная гемолитическая анемия— наследственный микросфероцитоз или болезнь Минковского-Шоффара. Неполноценность эритроцитов при болезни Минковского-Шоффара обусловлена генуинной недостаточностью синтеза АТФ, необходимого для поддержания двояковогнутой формы эритроцитов. При снижении содержания АТФ ниже 10 % от нормы эритроциты теряют ионы калия, в них поступает избыточное количество ионов Nа + и воды, эритроциты изменяют свою форму и превращаются в сфероциты. Кроме того, понижается их осмотическая резистентность, что связано с уменьшением содержания в мембране актомиозиноподобного белка, падением количества фосфолипидов и холестерина. Эритроциты живут 2-3 недели. Селезенка увеличена у всех больных, а печень — у половины пациентов.
Картина крови при наследственных гемолитических анемиях. Отмечается усиленная регенерация эритроцитарного ростка. При частых гемолитических кризисах может быть регенераторная анемия. В мазке крови, наряду с регенеративными формами (высокий ретикулоцитоз — до 50-60 %, полихроматофилия, ядерные формы эритроцитов), находится дегенеративно измененные эритроциты малого размера —
Отечная формахарактеризуется общими выраженными отеками, кожа плода бледная, полупрозрачная, в полостях тела — транссудат. Сердце, печень, селезенка значительно увеличены, почки полнокровны. Мягкая мозговая оболочка и ткань мозга отечны и полнокровны.
При анемической формевыражены общая бледность покровов и малокровие внутренних органов. В печени и селезенке — умеренный эритробластоз. Изменения головного мозга менее выражены, чем при отечной форме.
Желтушная формахарактеризуется желтухой покровов, подкожно-жирового слоя и интимы крупных сосудов. Количество непрямого биллирубина в сыворотке крови достигает 20-40 мг %. Ядра головного мозга прокрашены в охряно-желтый цвет. Тяжесть поражения усугубляется гипоксией из-за повреждений мелких сосудов.
Аналогично, но менее выраженно, протекает гемолитическая желтуха при несовместимости групп крови плода и матери.
Картина крови при приобретенных гемолитических анемиях. Приобретенная гемолитическая анемия может быть по типу кроветворения нормобластической, по регенераторной способности костного мозга — регенераторной, по цветовому показателю — нормо- или гиперхромной.
Степень уменьшения количества эритроцитов и гемоглобина зависит от интенсивности гемолиза. В мазке крови обнаруживают клетки физиологической регенерации и дегенеративно измененные эритроциты (пойкилоцитоз, анизоцитоз). Появление большого количества эритробластов и нормобластов характерно для гемолитической болезни новорожденных. Профилактика — обменное переливание крови отца или введение матери антирезусных антител.
Аутоиммунные гемолитические анемиивозникают при изменении антигенной структуры мембраны эритроцитов при переохлаждении, ожогах, инфекциях и действии лекарственных препаратов. В патогенезе главным является разрушение эритроцитов, образование аутоантител, стимуляция иммунного ответа и образуется порочный круг (самая опасная анемия). Лечение этого процесса — подавление иммунного ответа гормонами и иммунодепрессантами.
Патогенез и гематологическая характеристика. Гемолиз эритроцитов происходит внутри сосудов с образованием непрямого биллирубина. Развивается желтуха. Цветовой показатель может быть в норме или повышен. Размер эритроцитов — нормоциты и умеренный макроцитоз, пойкилоцитоз. Повышена регенерация эритроцитов, гипер- или нормохромия, повышена регенерация эритроцитов.
Анемии вследствие нарушения кровообразования. Витамин В12— и фолиеводефицитные анемии- это анемии, связанные с нарушением синтеза нуклеиновых кислот и заменой нормобластического типа кроветворения мегалобластическим из-за недостатка в организме витамина В12 и фолиевой кислоты.
В патогенезевитаминВ12-и-фолиеводефицитной анемии различают 3 основные ветви:
а) нарушение костномозгового кроветворения (что ведет к гипоксии);
б) нарушение миелинизации нервных волокон (нарушения чувствительности от парестезий до синдрома демиелинизации);
в) желудочно-кишечные (нарушение образования сосочков языка — глоссит, патология пристеночного пищеварения).
Дефицит витамина В12 и фолиевой кислоты, участвующих в образовании тимина, входящего в состав ДНК, снижает скорость ее образования. Нарушение клеточного деления приводит к формированию крупных клеток крови: мегалоцитов, мегалобластов, гигантских мегакариоцитов. Созревание мегалобластов до мегалоцитов сопровождается нарушением энуклеации — об этом свидетельствуют появление в мегалоцитах телец Жолли (остатки ядра) и колец Кебота (остатки ядерной оболочки). Наличие большого количества мегалобластов и мегалоцитов, насыщенных гемоглобином, обуславливает гиперхромию (ЦП>1,5).
Картина крови. Витамин В12-и-фолиеводефицитная анемия — это анемия мегалобластическая, гиперхромная, диспластическая, макроцитарная. В мазке крови появляются мегалобласты — клетки патологической регенерации костного мозга и мегалоциты (крупные клетки с базофильной, полихроматофильной или оксифильной цитоплазмой, для которых характерна ранняя гемоглобинизация). В крови встречается много дегенеративно измененных эритроцитов: пойкилоцитоз, анизоцитоз с микроцитозом, гипохромные эритроциты, мегалоциты с патологическими включениями. Уменьшается количество клеток физиологической регенерации (ретикулоциты, полихроматофилы), т.к. в костном мозге наблюдается раздражение эритроцитарного ростка с преобладанием мегалобластического типа кроветворения над нормобластическим. Наблюдается тромбоцитопения и лейкоцитопения с атипическими клетками.
Железодефицитная анемия (сидеропеническая) — это анемия, вызванная недостатком железа в организме в результате нарушения баланса между его поступлением, потреблением и потерей. Это самый распространенный вид анемии (80-90 % всех анемий). Недостаток железа в организме проявляется исчезновением гемосидерина в клетках печени и селезенки, снижением количества сидеробластов и сидероцитов в костном мозге. В крови уменьшается содержание сывороточного железа и степень насыщения им трансферрина (белка-переносчика железа), что ведет к снижению транспорта железа в костный мозг. Нарушается включение железа в эритроцитарные клетки, при этом снижается синтез гема и глобина, уменьшается активность некоторых ферментов в эритроцитах, что вызывает повышение их чувствительности к окислителям (т.к. неполноценность ферментативных процессов ведет к неустойчивости клеточных мембран), эритроциты подвергаются гемолизу под действием окислителей и продолжительность жизни эритроцитов уменьшается.
Картина крови. Железодефицитная анемия — это нормобластическая, гипохромная анемия (из-за недостаточной гемоглобинизации). В мазке крови наблюдается анизоцитоз (микроцитоз), пойкилоцитоз, шизоцитоз — обломки эритроцитов. Количество ретикулоцитов зависит от регенерирующей способности костного мозга (анемия может быть сначала регенераторной, а затем гипорегенераторной).
Железорефрактерная анемия —(рефрактерный — невосприимчивый)- сидероахрестическая, сидеробластическая, железонасыщенная анемия — обширная группа анемических состояний с высоким содержанием сывороточного железа, костномозговым сидеробластозом (отложение органических и неорганических соединений железа) и рефрактерностью к лечению железом. Анемии могут быть наследственными и приобретенными.
Этиология и патогенез связаны с нарушением активности ферментных систем, участвующих в биосинтезе гема. Наследственные анемии встречаются почти исключительно у мальчиков и молодых мужчин, приобретенные первичные формы чаще у пожилых лиц обоего пола, а вторичные — в любом возрасте.
Картина крови: выраженная анемия (возможно снижение гемоглобина до 3 г%, эритроцитов до 1 млн в микролитре). Процент ретикулоцитов в пределах нормы. Величина эритроцитов в норме или несколько завышена за счет макроцитов. Нередко отмечается клеточный диморфизм с наличием двух популяций эритроцитов: гипохромно-микроцитарной и нормохромно-макроцитарной. Лечение и прогноз зависит от формы анемии.
Не нашли то, что искали? Воспользуйтесь поиском:
источник
К гемолитической анемии относятся те патологические состояния, которые сопровождаются уменьшением количества гемоглобина в крови, в большинстве случаев и количества эритроцитов вследствие повышенного распада (разрушения) эритроцитов, нарушенного пигментного обмена, кроветворения и развития анемии.
При этом заболевании в одних случаях превалируют явления внутрисосудистого гемолиза эритроцитов, в других — разрушение эритроцитов происходит преимущественно внутриклеточно в органах, богатых элементами ретикуло-энлотелиальной системы, — селезенка, печень, костный мозг, лимфоузлы. В данном разделе освещаются тс гемолитические анемии, которые протекают преимущественно с внутрисосудистым гемолизом, при которых оперативное вмешательство — спленэктомия — является одним из наиболее эффективных средств лечения.
Существуют две формы гемолитической анемии — врожденная и приобретенная.
Врожденная гемолитическая анемия. В происхождении заболевания ведущее место занимает повышенный гемолиз в клетках ретикулоэндотелиальной системы, главным образом в селезенке, в меньшей степени в купферовских клетках печени, костном мозгу, лимфатических узлах. Данную форму анемии называют также врожденной гемолитической желтухой, наследственной (семейной) сфероцитарной анемией, микросферошггарной гемолитической болезнью.
Причина бурного распада эритроцитов недостаточно выяснена. Считают, что причина заболевания заключается в повышенной гемолитической активности селезенки, вследствие чего в ней разрушаются нормальные, патологически не измененные эритроциты, что повышенный распад эритроцитов в селезенке обусловлен функциональной неполноценностью костного мозга, в результате чего в кровь поступают измененные эритроциты, подготовленные к быстрому разрушению. Это заболевание наследуется по аутосомно-доминантному признаку и связано с дефектом строения эритроцитарной мембраны, с проницаемостью натрия.
Последняя приводит к увеличению осмотического давления внутри эритроцита, в результате которого он приобретает сферическую форму и становится более хрупким. Подобные неполноценные эритроциты захватываются селезенкой и подвергаются быстрому разрушению, что и приводит к развитию гемолитической анемии. Существует также мнение о том, что при этом заболевании селезенка продуцирует избыточное количество аутогемолизинов. Спленомегалия возникает за счет усиленной рабочей нагрузки.
Врожденную гемолитическую анемию подразделяют на микросфероцитарную (болезнь Минковского—Шоффара, наследственный микросфероцитоз), микроцитарную и овалоцитарную.
Заболевание протекает циклически, периоды обострения чередуются с периодами ремиссии. Начинается обычно с раннего детского возраста, а иногда с момента рождения. Нередко наблюдается у нескольких членов семьи. При раннем развитии заболевания у больных может наблюдаться задержка физического и умственного развития, полидактилия, высокое стояние неба, неправильное стояние зубов, башенная форма черепа, язвы голеней и т.д.
Клиника и диагностика. При развитии гемолитических кризов наблюдаются быстрое (в течение нескольких дней) нарастание анемии и появление гемолитической желтухи. В этот период у больного возникают тошнота, рвота, боли в верхней части живота, тахикардия, одышка, гипертермия, бледность кожного покрова, которая быстро сменяется нарастающей желтухой. Нередко гемолитические кризы у детей могут провоцировать острые инфекционные заболевания.
При обследовании больных отмечается желтушное окрашивание кожных покровов и видимых слизистых. У больного отмечаются явления анемии, слабость, головокружение, потеря аппетита. Важным диагностическим признаком является увеличение селезенки. Последняя плотной консистенции, малоподвижна.
Печень увеличена в меньшей степени, ее функциональные пробы не изменены. Повышенное содержание пигментов печени у 50-60 % больных способствует образованию камней и развитию желчнокаменной болезни, что клинически проявляется приступами печеночной колики, острого или хронического холецистита. В связи с этим обнаружение камней в желчном пузыре у детей, особенно в возрасте до 10 лет, является поводом для тщательного обследования их в целях установления врожденной гемолитической анемии.
Нередко наблюдают аномалии развития скелета, ретикулоцитоз: микросфероцитоз — диаметр эритроцитов менее 7 мкм (при макроцитарной форме — выше 7мкм), понижение осмотической резистентности эритроцитов: начало гемолиза — 0,60-0,70 (норма 0,48), конец — 0,40 (норма 0,32); билирубинемия (непрямой билирубин — 15-200 мкмоль/л). В миелограмме гиперплазия эритробластных элементов до 60-70 %.
При овалоцитарной форме 50% эритроцитов имеют овальную форму.
В норме эритроциты начинают разрушаться в 0,47%-м растворе хлорида натрия, при гемолитической анемии этот процесс начинается уже в 0,6%-м растворе и более концентрированных растворах хлорида натрия. При исследовании мазка костного мозга выявляют гиперплазию красного ростка. Во время криза наблюдают ретикулоцитопению и гипоплазию красного ростка костного мозга. После криза число ретикулоцитов существенно увеличивается.
Характерными признаками гемолитической анемии являются анемия, увеличение концентрации непрямого билирубина в крови, повышенное содержание уробилина в моче и стеркобилина в кале.
В постановке диагноза решающее значение имеют данные исследования крови: умеренное снижение гемоглобина (до 7-8 г%/л) и эритроцитов (до 2-3 млн) и малые изменения количества лейкоцитов и тромбоцитов. Наблюдается умеренное снижение количества эритроцитов и содержания гемоглобина. Количество эритробластов в пунктате костного мозга достигает 60 % всех клеток костного мозга, усиливается кроветворение в ответ на повышенный гемолиз эритроцитов.
Характерна выраженная билирубинемия, микросфероцитоз, повышение осмотической резистентности эритроцитов и высокий ретикулоцитоз.
При проведении дифференциальной диагностики между гемолитической и механической желтухой большое значение имеет определение непрямой реакции билирубинемии. В пользу гемолитического характера желтухи также говорит отсутствие у больных кожного зуда, брадикардии, билирубина и желчных кислот в моче и ахолического кала и наличие насыщенной окраски фекальных масс. Избыточное выделение уробилиногена с мочой способствует резкому повышению суточного содержания уробилина в моче.
При проведении дифференциальной диагностики важно исключить гемолитические анемии, протекающие преимущественно с внутрисосудистым гемолизом. Для последних наряду с анамнезом характерны гемоглобинемия, малое изменение осмотической резистентности эритроцитов, острое начало, резко выраженная желтуха и анемия, отсутствие увеличения селезенки.
Билиарный ЦП, протекающий с желтухой, в отличие от гемолитической анемии сопровождается более тяжелым состоянием больного, нарушением функциональных проб печени, положительной прямой реакцией на билирубин и нормальной осмотической резистентностью эритроцитов, макрошпозом, лейкопенией, тромбоцитопенией, выраженными симптомами ПГ.
Нередко заболевание может длиться десятки лет, мало нарушая общее состояние, больные даже могут дожить до глубокой старости. Но часто заболевание протекает очень тяжело и ведет к развитию анемизации, к физической и умственной отсталости, снижению и даже потере трудоспособности.
Лечение. Консервативное лечение дает временный эффект и не предотвращает рецидива гемолитических кризов. Малоэффективность консервативного лечения, угроза развития тяжелых, опасных для жизни осложнений являются основанием для производства оперативного вмешательства — спленэктомии. От хирургического вмешательства считается допустимым воздержаться в тех случаях, когда заболевание протекает легко, доброкачественно, не нарушая работоспособности и общего состояния больного.
Спленэктомия показана особенно у тех больных, у которых заболевание протекает с выраженными явлениями гемолиза, с частыми обострениями и рецидивами гемолитического криза, развивается нарушение общего состояния, понижается трудоспособность, отмечается задержка развития и тд. Спленэктомия наиболее эффективна у больных с селезеночным типом гемолиза и в период ремиссии болезни.
После спленэктомии наступает клиническое выздоровление, прекращается гемолиз, длительность жизни эритроцитов существенно увеличивается, исчезает анемия, хотя эритроциты сохраняют патологические качества. Отдаленные результаты после спленэктомии хорошие, больные становятся трудоспособными.
При наличии калькулезного холецистита операция может быть одномоментной, вначале производят спленэктомию, а затем, если позволяет состояние больного, холецистэктомию [Б.В. Петровский, 1980; М.И. Кузин, 1987].
В послеоперационном периоде возможен тромбоз портальной системы, в связи с этим рекомендуют провести динамический контроль показателей свертывающей системы крови.
Перейти к списку условных сокращений
источник