Токсическая анемия (Anaemia toxica) – анемия, вызванная гемолитическими факторами, и гематологически характеризуется нормохромной и нормоцитарной картиной крови.
Этиология. Причинами заболевания токсической анемией являются отравления животных гемолитическими ядами (ртуть, свинец, мышьяк, госсипол, сапонины, фенилгидразин, хлороформ, сероуглерод, яды насекомых и змей), ожоги, а также токсины бактериального, кишечного происхождения и гемоспоридиозы (пироплазмоз, бабезиеллез, тейлериоз и др.). Ядовитые вещества проникают в организм животного через кожу, слизистые оболочки, через легкие, желудочно – кишечный тракт или могут образовываться внутри самого организма больного животного.
В зависимости от реактивности организма и характера интоксикации различают острые и хронические формы анемии.
Патогенез. Несмотря на некоторую «специфичность» отдельных кровяных ядов их механизм действия в основном сводится к разрушению эритроцитов, лейкоцитов и тромбоцитов.
При попадании в организм животного кровяные яды вызывают раздражение тканевых и сосудистых рецепторов. От этих рецепторов в центральную нервную систему устремляются потоки необычных для организма животного импульсов, которые извращают характер эфферентных влияний на кровеносные органы и приводят к расстройствам их функций.
Прямое действие яда на циркулирующие в крови эритроциты хотя и сохраняется, но кора головного мозга рефлекторно и через нейрогуморальное звено изменяет (повышает или понижает) чувствительность эритроцитов к патогенному раздражителю.
В патогенезе гемолитической анемии имеет место усиленное разрушение эритроцитов в кровяном русле с реактивной гиперплазией кроветворных органов и повышенной гемолитической деятельностью ретикулоэндотелиальной ткани. На этой почве в организме больного животного возникает гемолитическая желтуха.
Патологоанатомические изменения у больных токсической анемией сопровождаются желтушностью слизистых оболочек и серозных покровов, нередко имеют место кровоизлияния в коже, слизистых оболочках и различных органах. Селезенка увеличена в объеме и полнокровная. В печени находим дегенеративные изменения. Масса красного костного мозга увеличена за счет желтого. В результате повышенного распада эритроцитов в эндотелии селезенки, костного мозга откладывается железосодержащий пигмент (гемосидероз). При интоксикации большими дозами замена желтого мозга отсутствует.
Клиническая картина. Для больных токсической анемией характерна депрессия, анемичность и желтушность видимых слизистых оболочек и кожных покровов, увеличение селезенки и ее чувствительность. Иногда на первый план у больного животного выступают симптомы свойственные анемии: сердцебиение, одышка, при незначительной физической нагрузке больное животное испытывает слабость. Если в процессе болезни происходит разрушение 1/60 всего количества эритроцитов, то у больного животного регистрируем признаки гемоглобинурии. В связи с усиленным гемолизом эритроцитов сыворотка крови приобретает насыщенно золотистый цвет. Происходит повышение количества билирубина, дающего непрямую диазореакцию, у лошадей количество билирубина повышается до 12,8 мг%, у крупного рогатого скота и свиней – до 1,6 мг%, в моче происходит увеличение содержания уробилина, из-за чего моча имеет красновато-бурый оттенок.
Наиболее характерным, ярким симптомом тяжелого отравления животного гемолитическими ядами является обилие в крови холестерина, липидов, а также сахара, вследствие чего у животного появляется временная глюкозурия. Выше указанные симптомы говорят о нарушении функции печени. Выявляемые в ходе клинического обследования, симптомы со стороны других внутренних органов, являются нехарактерными для этого заболевания. К 5-7дню болезни в картине крови отмечается резкое падение количества эритроцитов, притом более сильное, чем уменьшение содержания гемоглобина. Цветной показатель, который вначале болезни достигает 1,3-1,4 (гипохромная анемия), а затем (на 6-8-е сутки) постепенно возвращается к исходной величине. Происходит понижение резистентности эритроцитов – когда впервые дни начинают появляться тени эритроцитов, регистрируем анизоцитоз. Диаметр красных кровяных телец колеблется в пределах 3,3-10,2µ. Количество ретикулоцитов к 5-7-му дню болезни в 5-10 раз превышает исходные цифры (у свиней, рогатого скота). При исследовании крови, кроме ретикулоцитов, находят полихроматофилы, эритроциты с базофильной пунктацией, нормобласты. Количество тромбоцитов в крови падает. В первые дни болезни, у больного животного в 1мм³ крови насчитывают до 20тысяч лейкоцитов, а к 20-му дню количество лейкоцитов снижается до нормы. Лейкоцитарная формула дает нейтрофилию с выраженным сдвигом влево. В нейтрофилах отмечаем дегенеративные изменения ядра и протоплазмы. В зависимости от вида пораженного токсической анемией животного к 20-25-му дню (свиньи, собаки) морфологический состав крови приходит к норме.
При остром течении анемии в костномозговом пуктате отмечаем увеличение количества ядерных форм на 20-30%. Костномозговой индекс приобретает ясно выраженный эритробластический характер. В эритробластограмме происходит увеличение процента молодых эритробластических форм при одновременном уменьшении процента нормобластов. Количество ретикулоцитов (гранулофилоцитов) повышается по сравнению с нормой в несколько раз с преобладанием в эритрограмме форм, насыщенных субстанцией. Одновременно с регенеративными изменениями в костном мозге отчетливо выступают и признаки дегенеративного характера.
Течение. Учитывая, что причины токсической анемии действуют на организм больного животного обычно ограниченный промежуток времени, у организма сохраняется значительная способность к регенерации. Это проявляется также миелоидной метаплазией в селезенке и печени животного. Интенсивность регенерации крови напрямую зависит от резистентности организма, вида животного, его возраста, условий содержания, кормления и своевременно начатого лечения. В случае отравления животного малыми дозами гемолитических ядов, токсическая анемия у животного протекает легко; при поступлении в организм больших доз сильнодействующих веществ у животного может наступить смертельный исход.
Диагноз. Диагноз на токсическую анемию, как и при других болезнях животных, ставится комплексно с учетом анамнеза, клинической картины, изучения причинных факторов и условий развития заболевания, результатов гематологических данных и исследования размеров эритроцитов, костномозгового кроветворения и пигментного обмена. Характерным признаком токсической анемии является легкая желтушность видимых слизистых оболочек, повышенное количество непрямого билирубина в крови, увеличение содержания стеркобилина в фекалиях и уробилина в моче, гиперфункция селезенки наряду с признаками гемолиза (гемосидероз печени, селезенки, костного мозга и др.) и, наконец, картина изменений количественного и качественного состав красной крови.
Дифференциальный диагноз. Необходимо исключить инфекционные и гемоспоридиозные заболевания, сопровождающиеся изменением картины крови, особенно инфекционную анемию лошадей).
Лечение. Лечение больных токсической анемией животных начинают с создания для них хороших условий ухода, содержания, назначают диету, богатую белками и витаминами (А, В и С), а также организуют ежедневное пребывание больного на свежем воздухе. В том случае, если анемия вызвана действием ядов, ветспециалистам необходимо срочно их вывести из организма путем промывания желудочно-кишечного тракта, дачей слабительных и мочегонных. В случае острого отравления животного гемолитическими ядами проводят кровопускание, с последующим вливанием физиологического раствора вместе с плазмой или сывороткой. Отдельным больным животным можно провести переливание крови.
Для борьбы с возникшей интоксикацией организма показано внутривенное введение гипертонических растворов хлорида натрия, кальция и глюкозы. С целью стимуляции гемопоэза, при недостаточной регенерации крови, больным животным назначают камполон, антианемин (для крупного рогатого скота и лошадей 0,05 -0,08 мл, для свиней и овец 0,1-0,2 мл на 1кг живого веса), витогепат, витамин В12 (внутримышечно крупным животным 300-500мкг, мелким — 30-50 мкг 1 раз в 2 дня), а также препараты железа, мышьяка и аскорбиновой кислоты. Для профилактики закупорки почечных канальцев гемоглобиновым детритом больным животным вводят щелочи и большое количество жидкости.
Профилактика. Для предупреждения токсической анемии животных необходимо предохранять от соприкосновения с гематологическими ядами, а также проводить профилактические мероприятия против инфекционных и инвазионных заболеваний распространенных в данной местности.
источник
Отравление гемолитическими ядами
яд токсикология гемолитический анилин
Химические травмы — структурные и функциональные изменения организма, вызванные внешними химическими факторами. Понятие химическая травма совпадает с понятием отравление.
Яд — это вещество, поступающее в организм извне, обладающее свойством оказывать химическое и физико-химическое воздействие и при определенных условиях способное, даже в малых дозах, вызывать отравление.
В данном реферате речь пойдет об отравлениях гемолитическими ядами, которые, согласно судебно-медицинской классификации, относятся к так называемым «кровяным ядам».
Гемолитические яды — вещества, вызывающие гемолиз при проникновении в организм.
Проблема отравлений гемолитическими ядами довольно актуальна на сегодняшний день в связи с их высоким распространением в промышленной деятельности, распространением в природных условиях (яды грибов, яды змей) и условиях военных действий, а так же с возможностью их использования с целью совершения преступлений.
В своей работе я хотела бы отметить лишь некоторых основных представителей данной группы с описанием их токсического действия на организм.
1. Общие вопросы токсикологии гемолитических ядов
Гемолитические яды — вещества, вызывающие гемолиз при проникновении в организм.
Под гемолизом подразумевается процесс повреждения эритроцитов, при котором гемоглобин выходит в окружающую их среду. Гемолизированная кровь представляет собой однородную, прозрачную, окрашенную в интенсивный красный цвет жидкость без осадка эритроцитов («лаковая кровь»).
Гемолитичекие яды вызывают два вида гемолиза —
химический гемолиз — при действии на мембраны эритроцитов химических веществ (механизм рассмотрен ниже)
биологический гемолиз — при действии токсинов змей, членистоногих, микроорганизмов и др. (что будет так же частично рассмотрено в данном реферате)
Механизм токсического действия гемолитиков
Механизм первичного гемолиза под влиянием гемолитических ядов бывает двояким: гемолиз может быть вызван либо повреждающим действием яда на оболочку эритроцитов, либо за счет вмешательства в течение ферментативных процессов, обеспечивающих целостность эритроцитов.
Повреждающим действием непосредственно на оболочку эритроцитов обладают мышьяковистый водород, нафталины и некоторые другие соединения. Конкретный механизм их действия заключается в первичной блокаде сульфгидрильных групп белков в мембранах эритроцитов. В результате происходят конформационные изменения белковых структур мембраны, нарушаются их связи с липидами, вплоть до разрыва. В итоге повреждается оболочка эритроцитов. Как правило, наряду с блокадой SH-групп мембраны блокируются SH-группы молекулы гемоглобина и снижается уровень восстановленного глутатиона, который играет важную роль в поддержании стабильного состояния структуры мембраны эритроцитов. Это обусловлено тем, что система восстановленный глутатион — окисленный глутатион — своего рода буферная защита эритроцитов от действия окислителей. Содержание глутатиона может снижаться за счет окисления его гемолитиком, угнетения его синтеза, увеличения распада или дисбаланса ферментных систем, регулирующих его уровень в клетке. Во всех этих случаях возможно развитие гемолиза.
Второй вариант механизма гемолиза заключается в ингибировании химическими веществами ряда ферментных систем эритроцитов. К таким веществам относятся, прежде всего, фенилгидратан и его производные. Под их влиянием угнетается Г-6-ФДГ (Глюкозо -6 — фосфат — дегидрогеназа) как первичное звено патологического процесса, что приводит к снижению уровня восстановленной формы глутатиона (Г-8Н). Конкретный механизм такого явления заключается в том, что гемолитик, угнетая активность Г-6-ФДГ, тем самым угнетает образование НАДФ-Н, который в качестве кофактора необходим для восстановления окисленной формы глютатиона (Г-8-3-Н) в восстановленную Г-8Н. Иными словами, гемолитик подавляет активность глютатионредукгазы, за счет чего падает содержание Г-8Н.
Нельзя упускать из вида еще один возможный механизм действия гемолитиков. Речь идет об образовании избыточного количества эндогенной перекиси водорода за счет угнетения активности таких ферментных систем, как глютатионпероксидаза и каталаза. Так, действие ряда гемолитиков обусловлено накоплением эндогенной перекиси водорода, а также экзогенного ее поступления, что сопряжено с угнетением активности ферментов системой глютатиона, а также каталазы. Это влечет за собой снижение гемолитической стойкости эритроцитов и как следствие гемолиз. Именно так действуют органические перекиси.
Расшифровка механизма развития гемолиза позволяет объяснить факт существования достаточно выраженной индивидуальной чувствительности к веществам — гемолитикам. Впервые это было обнаружено на примере некоторых лекарственных препаратов с антималярийной активностью, в первую очередь примахина. Как оказалось, он вызывает гемолиз у лиц с выраженной недостаточностью фермента Г-6-ФДГ и нестабильностью в связи с этим Г-8Н.
Среди анемий химической этиологии, гемолитические — встречаются наиболее часто. Вещества, вызывающие внутрисосудистый гемолиз можно разделить на три группы:
. Разрушающие эритроциты (при определённой дозе) у всех отравленных
. Гемолизирующие форменные элементы у лиц с врождённой
недостаточностью Г-6Ф-ДГ (глюкозо-6-фосфат-дегидрогеназа)
. Вызывающие иммунные гемолитические анемии
Вещества разрушающие эритроциты
— вызывающие химический гемолиз — анилин, мышьяк и его соединения, бромат калия, бензол, хлорат калия (натрия), хлористый метил, хлороформ, медь, динитробензол, фенол, нафтален, нитриты, нитраты свинец, сульфоны, толуол, трибромметанол, тринитробензол, тринитротолуол, нитробензол, цинкэтиленбисдитиокарбамат -8, гидрохинон, лецитин, мезантоин.
— вызывающие биологический гемолиз — яды пауков, яды змей (кобра), яды некоторых грибов, яды скорпионов, пчёл.
Токсиканты, вызывающие гемолиз у лиц с дефицитом Г-6Ф-ДГ
В основном, к этой группе относятся лекарственные препараты
ацетанилид, ацетилсалициловая кислота, аскорбиновая кислота, гидразин, метиленовый синий, хлорамфеникол, дифенилсульфон, фенилгидразин, фуразолидин, Н-ацетилсульфамид, нафтален, нитрофурантион, примахин, сульфаметоксипиридазин, сульфаниламиды, сульфапиридин, тиозосульфон.
Токсиканты, вызывающие иммуноаллергические гемолитические анемии
парааминосалициловая кислота, альфаметилдофа, цефалоспорины, хинидин, хинин, хлордиазепоксид, фенилбутазон, индометацин, изониазид, меолфалан, пенициллин, рифампицин, хлорпромазин, хлорпропамид, дифенилгидантион, фенацетин, стибофен, сульфаниламиды, толбутамид.
Часть веществ, относящихся к первой группе, такие как бензол, толуол, динитробензол, хлороформ действуют непосредственно на мембрану эритроцитов разрушая её. Другие являются метгемоглобинообразователями и развивающийся при интоксикации ими гемолиз является вторичным явлением. Особенно чувствительны к таким токсикантам лица с дефицитом глутатионредуктазы и Г-6-ФД, что объединяет их с веществами составляющими вторую группу. Действуя в высоких дозах, препараты второй группы вызывают гемолиз и у лиц без дефектов энзимов. Таким образом различие между группами достаточно условно.
В основе иммунологических анемий лежат два механизма. Первый связан с фиксацией токсиканта на мембране эритроцита с образованием комплексного антигена. Гемолиз развивается вследствие атаки изменённых мембран эритроцитов антителами (IgG) в присутствии комплемента.
Второй механизм состоит в образовании комплексного антигена токсикант-белок плазмы крови. После фиксации комплексного антигена на мембране эритроцитов также в присутствии антител (IgM) и комплемента происходит их гемолиз. Во втором случае гемолиз происходит более бурно, но, как правило, иммуноаллергические анемии, в целом, выражены умеренно.
Примером токсикантов, действующих по первому механизму является пенициллин, по второму — хинин, хинидин.
Гемолитики разрушают эритроциты и гемоглобин выходит в плазму крови. Растворенный в плазме гемоглобин способен связывать кислород в такой же степени, как и заключенный в эритроциты. Поэтому в первые часы после острого воздействия токсикантов клиника гипоксии практически не выражена. Однако гемолиз сопровождается:
существенным повышением коллоидно-осмотических свойств крови (содержание белка в плазме возрастает с 7 до 20%);
ускоренным разрушением гемоглобина. В эритроцитах гемоглобин сохраняется в среднем около 100 дней, т.е. весь период жизни клетки. В случае тяжелого гемолиза уже через сутки уровень Нb составляет менее 30% от нормы;
затруднением диссоциации оксигемоглобина и, следовательно, ухудшением оксигенации тканей. Одна из причин явления существенно более низкое содержание в плазме крови, в сравнении с эритроцитами, основного биорегулятора сродства кислорода к гемоглобину — 2,3 — дифосфоглицерата;
нефротоксическим действие гемоглобина, свободно циркулирующего в плазме крови.
. Характеристика некоторых токсикантов
Отравление мышьяком и его соединениями
Мышьяк — простое вещество представляет собой хрупкий полуметалл стального цвета с зеленоватым оттенком.
Широко распространен в промышленности и в быту.
Чистый мышьяк нерастворим ни в воде, ни в липидах и потому не ядовит, но на воздухе легко окисляется с образованием токсических соединений, например — мышьяковистого ангидрида. Известно большое количесиво органических и неорганических соединений мышьяка.
Не имеет запаха и вкуса. LD = 0,2 г, при хронических интоксикациях — длительное попадание в организм в дозировке 1-5 мг в сутки.
Пути попадания в организм:
вдыхание паров (пыли) мышьяковистых соединений
Соединения мышьяка блокируют сульфгидрильные группы ферментов, в частности оксидазы пировиноградной кислоты, нарушая окислительные процессы.
Клинически отравление соединениями мышьяка проявляется металлическим вкусом во рту, жжением в полости рта, глотке и острым гастроэнтеритом. Данные признакми характерны для первых 1-2 часов острого отравления.
Наиболее характерный признак — профузная диарея, причем выделяются обильные жидкие массы с хлопьями, напоминающие рисовый отвар. Развиваются также анурия (вследствие дегидратации) и судороги, особенно в икроножных мышцах. Этот синдром иногда называют мышьяковой холерой, однако при настоящей холере сначала возникает понос, а не рвота, и не бывает болей. Если пострадавший не умирает, возникают явления полиневрита.
Поражение печени является постоянным симптомом; нарушение функции почек наблюдается с 4-6 суток — признаки почечной недостаточности.
При введении больших доз желудочно-кишечные симптомы выражены мало, а преобладает поражение нервной системы — возникает так называемая паралитическая форма, проявляющаяся головокружением, головной болью, болезненными тоническими судорогами в разных мышцах, бредом, а, затем комой и остановкой дыхания. В данном случае смерть возникает в первые часы после отравления.
Мышьяк имеет свойство накапливаться в костях, волосах и ногтях, что позволяет обнаруживать его судебно-химическими методами даже после эксгумации.
Для хронических отравлений мышьяком типичны белые поперечные полоски на ногтях — полосы Мееса (появляются через некоторое время после отравления у ногтевого ложа — вследствие исчезновения пигмента ногтей), полиневриты, диспепсия, кахексия и алопеция.
Желтушность кожных покровов и склер. Трупное окоченение наступает медленно.
Отёк и полнокровие головного мозга, мелкие кровоизлияния в его вещество.
Острое фибринозно-геморрагическое воспаление слизистой желудка и кишечника: покраснение, набухание, фибриновые наложения и кровоизлияния, поверхностные некрозы и эрозии. Между складками слизистой иногда обнаруживаются кристаллы яда. Содержимое тонкого кишечника обильное, жидкое, мутное, с хлопьями, в толстом кишечнике — слизь. Пейеровы бляшки набухают и изъязвляются. Кровеносныесосуды в подслизистом слое расширены и переполнены кровью.
Брюшина покрыта клейкими наложениями фибрина.
Мышца сердца дряблая, на разрезах тусклая, имеет глинистый вид. Печень и почки также выглядят набухшими, тусклыми и дряблыми.
Для отравлений соединениями мышьяка характерна не только белковая, но и жировая дистрофия кардиомиоцитов, гепатоцитов и нефротелия, особенно в затянувшихся случаях.
В почках — наличие буро-красной исчерченности пирамид.
Диагностика: лабораторные исследования — яд в крови, моче и внутренних органах трупа — в особенности — волосы и ногти, кости, затем печень и почки, селезенка.
Анилин — органическое соединение, простейший ароматический амин. Представляет собой бесцветную маслянистую жидкость с характерным запахом, немного тяжелее воды и плохо в ней растворим, хорошо растворяется в органических растворителях. На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит. Название «анилин» происходит от названия одного из растений, содержащих индиго — Indigofera anil (современное международное название растения — Indigofera suffruticosa).
Обладает не только гемолитическим действием, но и является метгемоглобинобразователем.
Он имеет большое значение в производстве более сложных промежуточных продуктов, красителей, химических добавок к полимерам, фармацевтических препаратов, пестицидов и др.
через неповрежденную кожу
Клинически отравление анилином проявляется следующими симптомами: головная боль, рвота, сонливость, шатающаяся походка. Отмечаются признаки метгемоглобинемии — выраженный цианоз, сине-серая, аспидная, иногда «чугунная» окраска кожи лица, ушных раковин, кончиков пальцев, слизистых оболочек губ. Отмечается желтушность кожных покровов, склер. Может возникать учащенное мочеиспускание, а затем — анурия.
Отмечается учащение пульса, увеличение печени. Могут возникать судороги.
Смерть наступает от явлений паралича дыхательного центра и острой сердечно-сосудистой недостаточности.
Отмечаются серо-фиолетовая или коричневато-серая окраска трупных пятен и слизистых, шоколадный цвет сгустившейся крови и коричневый оттенок внутренних органов. Выявляются признаки смерти от острой гипоксии (жидкое состояние крови, венозное полнокровие внутренних органов, оболочек и вещества головного мозга, отек мозга, отек и острая эмфизема легких, мелкие дисциркуляторно-гипоксические кровоизлияния — чаще всего в слизистую желудка, под эпикард и под плевру, но также в строму и паренхиму разных органов). Если успевает развиться тяжелая анемия, полнокровие внутренних органов не выражено. Гемолиз проявляется увеличением селезенки и печени, желтухой.
Для поражения мозга наиболее типичны изменения нейронов в виде вакуольной дистрофии. В селезенке и лимфатических узлах — гиперплазия ретикулоэндотелия, эритрофагия, позже гемосидероз. В печени наблюдается дискомплексация балок, белковая дистрофия, отложения гемосидерина в гепатоцитах. Жировое перерождение печени и почек.
Диагностика: лабораторные исследования — яд в крови, моче и внутренних органах трупа. Наличие метгемоглобина в крови. Плазма крови интенсивно окрашивается эозином в связи с наличием в ней растворенного гемоглобина и метгемоглобина. Гистологическое исследование внутренних органов.
Отравление уксусной кислотой
Уксусная кислота — слабая, предельная одноосноовная карбоновая кислота.
Является летучим соединением
Уксусная кислота — 96% раствор
Водные растворы уксусной кислоты широко используются в пищевой промышленности (пищевая добавка E260) и бытовой кулинарии, а также в консервировании. Уксусную кислоту применяют для получения лекарственных и душистых веществ, как растворитель (например, в производстве ацетилцеллюлозы, ацетона). Она используется в книгопечатании и крашении.
при вдыхании паров — повреждение дыхательных путей — возникновение пневмоний
LD безводной уксусной кислоты составляет 12-15 г., уксусной эссенции — 30-40 мл, столового уксуса — около 200 мл
Обладает прижигающим действием, но оказывает общее гемолитическое действие.
После приема кислоты появляется сильная рвота бурыми массами, издающими характерный запах уксуса. Появляются сильные боли по ходу пищеварительного тракта, отек слизистой верхних дыхательных путей, иногда резкий кашель при отравлении концентрированной кислотой.
Смерть наступает быстро. У отравившегося человека развивается желтуха вследствие гемолиза эритроцитов, присоединяется понос бурыми массами с примесью алой крови, повышается температура, в моче обнаруживается кровь. Смерть может наступить в первые часы от шока, иногда через более продолжительный срок после отравления. Исход может быть такой же, как и при отравлении человека неорганическими кислотами.
При пероральном отравлении едкими ядами наблюдаются химические ожоги кожи губ, подбородка, щек, иногда шеи, имеющие форму вертикальных потеков, ожоги слизистой оболочки рта, глотки, пищевода, желудка и двенадцатиперстной кишки. Рвота приводит к образованию химических ожогов кожи вокруг рта и к аспирации желудочного содержимого, содержащего яд, в дыхательные пути с развитием отека гортани и пневмонии.
При вскрытии от органов и полостей трупа ощущается характерный запах. Уксусная кислота действует более поверхностно и редко вызывает перфорации, но ее общее действие, в частности гемолитическое, сильнее, чем у неорганических кислот. Определяются признаки гемолиза: желтуха, гемоглобинурия, прижизненная имбибиция стенки сосудов. Некрозы и кровоизлияния в печени. Гемоглобинурийный нефроз.
В канальцах почек, в печени и моче — возможно обнаружение мелкокристаллического осадка оксалата Са.
Диагностика: судебно-химическое исследование внутренних органов, тканей и жидких сред организма.
Гемолитическим действием обладают яды таких грибов как сморчки, бледная поганка и мухомор.
Главным токсином строчков (Gyromitra esculenta и близких видов) раньше считалась так называемая гельвелловая кислота. Новые исследования показали, что такого вещества не существует, а имеется смесь органических кислот. Токсичными свойствами обладает гиромитрин , разрушающийся при сушке на открытом воздухе, но не при кипячении. Его содержание в строчках может колебаться от смертельных доз до практически безвредных. Действие гиромитрина сходно с действием аманитинов и фаллоидинов, но больше выражен гемолитический эффект.
Клиническая симптоматика при отравлении строчками возникает уже через 6-10 часов после их употребления. Явления гастроэнтерита выражены меньше, зато к паренхиматозной желтухе (связанной с гепатотоксическим действием) почти всегда присоединяется гемолитическая. Более выражены также слабость, головная боль, увеличение печени, наблюдается увеличение селезенки.
LD гиромитрина (строчки) — 20-50 мг/кг, что соответствует примерно 0,4-1 кг свежих грибов.
В бледной поганке содержатся аманитины и фаллоидины, отравление которыми проявляется длительным скрытым (бессимптомным) периодом, составляющии в среднем 12 часов с момента употребления грибов. Затем развиваются явления острого гастроэнтерита с жаждой, неукротимой рвотой, кишечными коликами, холероподобным поносом с примесью крови, тоническими судорогами икроножных мышц, коллапсом и олигурией. Через 1-3 суток увеличивается печень, присоединяется желтуха и печеночная недостаточность, возникают судороги и развивается кома.
Для человека LD фаллоидина — 20-30 мг. (в 100 граммах свежих грибов — 10 мг фаллоидина)
Буфотенин и производные иботеновой кислоты (трихоломовая кислота, мусцимол и мусказон), содержащиеся в мухоморах красном (Amanita muscaria), порфировом (Amanita porphyria) и пантерном (Amanita pantherina), вызывают острый психоз с галлюцинациями, коллапс и кому. Такие отравления могут привести к смерти.
Алкалоиды мускарин и мускаридин — наиболее токсичные вещества из мухоморов красного, порфирового и пантерного, а также из свинушки тонкой (Paxillus involutus) — являются М-холиномиметиками. Холинергический синдром при наличии в грибах мускарина возникает через 0,5-2 часа после употребления грибов и включает слюно- и слезотечение, потливость, тошноту и рвоту, обильный водянистый понос, сужение зрачков, брадикардию.
LD красного мухомора для человека — примерно 15 шляпок.
Трупное окоченение при отравлении грибными ядами выражено слабо или отсутствует. Отмечается дегидратация (западение глазных яблок, снижение тургора кожи, ее сухость и т.д.). Обнаруживаются также признаки быстрой смерти по типу асфиксии (кровоизлияния под серозными и слизистыми оболочками, отек легких и т.д.). Возможны желтуха и увеличение печени, желтый цвет ее ткани на разрезе. Кровь находится в состоянии гемолиза, характерно также увеличение селезенки. Гистологически определяются жировая дистрофия миокарда, эпителия почек, гепатоцитов и поперечно-полосатых мышечных волокон, токсический гепатит (иногда массивный некроз печени) и некротический нефроз. Выявляется также картина гемоглобинурийного нефроза.
Диагностика: исследование крови, судебно-химическое исследование внутренних органов, тканей и жидких сред организма.
При обнаружении частиц грибов в рвотных массах и содержимом желудка необходимо их микологическое исследование.
Гемолитические яды — вещества, нарушающие кислородно-транспортные функции крови обладают высоким тропизмом к компонентам крови и приводят к первичному гемолизу эритроцитов. Это ведет к расстройству системы кровообращения и последовательно в патологический процесс включаются остальные системы жизнеобеспечения, что, в дальнейшем, может привести к смерти.
Список использованной литературы (источников)
1. «Судебная медицина. Избранные лекции», В.Л. Попов, О.Д. Ягмуров, издательство ПСПбГМУ им. И.П. Павлова 2013 год
2. «Судебная медицина. Учебное пособие» — Пиголкин Ю.И., Дубровин И.А., издательство ГЭОТАР-Медиа, 2011 год
. «Особенности токсического действия гемолитических ядов» — Романчук В.Г., Еремина М.В. — ВГМУ 2009 год (реферат)
. «Физиология крови» — методическое пособие — С.В. Барабанов, М.В. Лиознов, Л.Н. Шалковская — издательство ПСПбГМУ им. ак. И.П. Павлова — 2005 год
Наши специалисты проконсультируют или окажут репетиторские услуги по интересующей вас тематике.
Отправь заявку с указанием темы прямо сейчас, чтобы узнать о возможности получения консультации.
источник
Токсическая гемолитическая анемия (ТГА) относится к группе гемолитических анемий, обусловливаемых действием химических или медикаментозных агентов на эритроциты. С патологической точки зрения, равно как и в отношении клинических проявлений группа токсическая гемолитическая анемия не представляет собой обособленную нозологическую форму.
Тем не менее практические соображения побуждают нас рассмотреть, в отдельной статье, ряд гемолитических анемий по критерию их этиологии за счет клеточных токсических факторов.
Хотя токсическая гемолитическая анемия значительно реже иных видов гемолитических анемий (например АИГА) (Wintrobe и сотр.) в последнее время она приобретает все больший удельный вес в связи с увеличением профессиональных факторов отрицательного воздействия все растущего загрязнения среды и выпуска новых фармацевтических препаратов.
Ниже приведены этиологические факторы, способствующие развитию токсической гемолитической анемии.
Основные этиологические факторы, обусловливающие развитие токсической гемолитической анемии (ТГА):
1. Токсические для оболочки вещества:
Хлороформ, четыреххлористый углерод, бензол, толуол, тотрадецилсульфат, дигитонин, сапонин, катионное мыло, яд кобры.
2. Токсические вещества в отношении клеточных ферментов и/или гемоглобина:
Анилин, ацетанилид, нитриты, нитраты, хлораты, нитробензол, нитротолуол, фенацетин, антипирин, пирамидон, сульфонамиды, примахин, памахин, квинакрин, хинин, хинидин, нитрофурантоин, изониазид, синтетические заменители витамина К, фенилгидразин, пробенецид, хлорамфеникол, растительные вещества (Vicia faba), свинец.
3. Медикаменты «сенсибилизирующего» действия:
Пенициллин, цефалоспорины, хинидин, фенацетин, сульфонамиды, гидразид, хлорпромазин, инсулин, рифампицин, метилдопа.
В общих чертах воздействие токсических гемолитических (химических и медикаментозных) факторов на красные кроявные тельца осуществляется следующими тремя путями:
а) непосредственным действием на составные элементы клеточной оболочки;
б) взаимодействием с отдельными клеточными ферментативными механизмами и/или их чрезмерной нагрузкой;
в) иммунологическими механизмами.
а) Непосредственное действие токсических веществ на составные элементы оболочки красных кровяных телец видимо последствие их адсорбции липопротеидами оболочки или комбинирования с последними. При этом нарушаются проницаемость и элластичность оболочки, происходит диффузия гемоглобина и прочих внутриклеточных составных, а в клетку проникают вода и натрий. Эритроциты приобретают «предшествующие расплавлению » формы, которые наблюдаются на мазках (сфероциты, зубчатые эритроциты). Сокращение элластичности оболочки приводит к понижению ее сопротивления непрерывным механическим воздействиям в потоке кровообращения.
Процесс расплавления крови, вызываемый токсическими веществами оболочки прямо пропорционален дозе и длительности воздействия. Субстрат, на который действует гемолитический фактор, был уточнен в нескольких случаях (Douste-Blazy). Так, хлороформ, четыреххлористый углерод, бензол, толуол действуют на полюсные группы жировых цепей; анионовые детергенты (тетрадецилсульфат) закрепляются на цефалине; растительные вещества (дигитонин, сапонин) и отдельные катионовые мыла вступают в комбинацию с холестерином; змеиный яд (кобры) преобразовывает лецитин в лизолецитин.
б) Группа веществ взаимодействует с отдельными клеточными ферментативными механизмами и/или подвергает их большой нагрузке. «Окисляющие » медикаментозные препараты действуют на эритроциты в норме, с большой нагрузкой на механизмы, сохраняющие гемоглобин в восстановленном виде, вплоть до их истощения. В результате образуется метгемоглобин и появляются тельца Гейнца. Влияние окислительных веществ слабее при наличии врожденного дефекта глютатионредуктазы или в условиях неустойчивого гемоглобина (гемоглобина Н или Цюрих). К гемоглобинизирующим веществам относятся: анилин, ацетанилид, нитриты, нитраты, хлораты, нитробензол, нитротолуол, фенацетин, сульфамиды.
Отдельные вещества вызывают расплавление крови у лиц с врожденным недостатком Г-6-ФД (Wintrobe и сотр.), в том числе, примахин, памахин, хинакрин, хинин, сульфонамиды, сульфоны, нитрофурантоин, фуразолидон, ацетанилид, фенацетин, антипирин, пирамидон, пробенецид, синтетические заместители витамина К, фенилгидразин, изониазид, хлорамфеникол, хинидин, нафталин, тринитротолуол, метиленблау, растительные вещества (фасоль «Vicia faba»). Следует отметить, что некоторые медикаментозные препараты, вызывающие метгемоглобинизанию обусловливают расплавление крови и у лиц с недостатком Г-6-ФД.
Объяснение этого явления следует искать в том, что Г-6-ФД действует в качестве донора восстановленного НАДФ для цепи реакций, нацеленных на борьбу с излишним образованием внутриклеточных окисленных соединений.
Развивающаяся при сатурнизме анемия по комплексности и специфичности обусловливающего ее механизма занимает особое место. Свинец нарушает синтез гемоглобина на всех трех основных уровнях этого процесса — угнетает синтез гема, соединение железа с протопорфирином и синтез глобина. Влияя на синтез гема блокированием активности отдельных, богатых сульфгидрильными группами митохондриальных ферментов, таких как, дегидраза дельта-амино-левулиновой кислоты (ДДАЛК) и гемсинтетаза (Albahary) свинец обусловливает нарушение метаболизма порфиринов.
Угнетение активности дегидразы ДАЛК препятствует синтезу содержащегося в последней порфобилиногена (ПБГ). Избыток ДДАЛК выделяется с мочой. Угнетение активности гемсинтетазы препятствует включению железа в протопорфирин. В таких условиях в эритроцитах скопляется значительное количество свободного протопорфирина (500—600 мкг/100 мл) (Кондаксе и сотр.), в то время как в митохондриях — нейтрализованного железа. Отравление свинцом обусловливает также выделение с мочой значительного количества копропорфирина III (1—2 мг в сутки) (Кондаксе и сотр.), видимо в связи с неиспользованием этого предшественника. Влияние свинца на глобин отражается в нарушениях, подобных наблюдаемым при легкой форме талассемии — примерно у 15% больных повышается процент гемоглобина А2 и F (Albahary).
Отравление свинцом — болезнь не редкая. Ею заболевают наборщики, типографы, красильщики, шахтеры, потребители спиртных напитков, перегоняемых в самодельных установках и пр. К ведущим клиническим признакам относятся бледность, рези в желудке и неврологические проявления (полиневрит, нарушение поведения, энцефалопатия). Гематологические признаки определяет анемия, которая носит гипохромный и слегка микроцитный характер (Wintrobe и сотр.). Отмечается наличие точечно-базофильных эритроцитов. Показатель частоты последних не связан с интенсивностью воздействия токсического вещества. Число ретикулоцитов повышено, в частности при резко развившемся отравлении.
На мазках периферической крови обнаруживаются также нормобласты, эритроциты с тельцами Жолли или кольцами Кабо. В костном мозге наблюдается эритроидная гиперплазия. В отдельных случаях отмечено наличие мнегоядерных эритробластов (Moore) или кольцевых сидеробластов (Wintrobe). Продолжительность жизни эритроцитов несколько меньше (Albahary). Интенсивность и скорость обмена железа плазмы занижены. Наблюдается рост показателя выделения желчных пигментов. Отмеченные аспекты могут подсказать мысль о неэффективности эритропоеза (Wintrobe). По мнению отдельных авторов анемию, вызываемую отравлением свинцом можно отнести к группе сидеробластических анемий (Moore).
Уточнению диагноза способствуют обнаружение высокого показателя выделения АЛК и копропорфирина III с мочой (тест разборки) и нормальной концентрации свинца в крови и моче. При скрытом отравлении, когда наличие токсического вещества в крови и моче не выявимо постановке диагноза способствует исследование протопорфирина эритроцитов, при этом нормальный уровень исключает возможность отравления (Кондаксе и сотр.). Определение свинца в моче после введения стандартного количества ЭДТА—-еще один способ уточнения диагноза (Albahary).
После введения комплексонов (БАЛ, ЭДТА) отмечается быстрая нормализация нарушенного метаболизма порфиринов, однако продолжительность жизни эритроцитов восстанавливается лишь после замены неполноценных эритроцитов нормальными (Wintrobe). Показатель гемоглобина нормализуется спустя несколько недель после назначения лечения.
Изложенное приводит к следующему выводу большого практического значения: ряд химических веществ, оказывающих токсическое влияние на красную кровяную клетку обусловливают гемолитический эффект различными механизмами. Соединения бензола и толуола вызывают метгемоглобинемию и гемолиз, а иногда и аплазию, определяя развитие процесса относительной костномозговой недостаточности. В последнем случае анемия, хотя и представляется как результат гемолитического процесса, тем не менее не сопровождается численным ростом ретикулоцитоза. Ретикулоцитоз выявляется лишь после прекращения воздействия токсического вещества и восстановления костномозговой способности вырабатывать клетки, пропорционально интенсивности анемии.
Подобно этому некоторые медикаменты, в том числе сульфонамиды, хинидин, фенацетин и пр., обусловливают расплавление крови либо посредством ферментного механизма, либо путем иммунологической агрессии.
Выявление механизма, определяющего расплавление крови путем токсических веществ составляет решающий этап в процессе уточнения терапевтического подхода. Так, например, выявление телец Гейнца подсказывает мысль о возможной анемии под влиянием окисляющих метгемоглобинизирующих токсических веществ, или о наличии скрытого недостатжа Г-6-ФД и тем самым дает соответствующее направление исследованиям.
источник
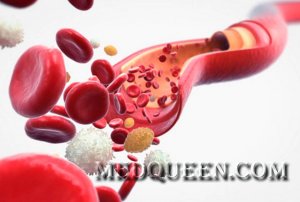
Анемия всегда является вторичным заболеванием, то есть является следствием какого-либо другого заболевания или причины.
Постгеморрагическая анемия развивается в результате острой и обильной кровопотери.
Причинами острой кровопотери могут быть хирургические вмешательства, травмы, кровотечения из варикозно расширенных вен пищевода (при циррозе печени), легочные кровотечения при туберкулезе, желудочно-кишечные кровотечения (в результате язвенной болезни желудка или двенадцатиперстной кишки), гинекологические или акушерские кровотечения у женщин и др.
Во время, или сразу после острой кровопотери (превышающей 500 мл крови), у больного проявляются признаки геморрагического шока. Позднее, когда больному оказывается интенсивная терапия, явления геморрагического шока проходят и на первый план выступают симптомы анемии: слабость, бледность, одышка, изменения в анализе крови (результаты анализа крови показывают снижения уровня гемоглобина (Hb) ниже 130-110 г/л и может составлять (в зависимости от количества потерянной крови) 100-50 г/л (бывали случаи, когда уровень гемоглобина снижался до 18 г/л и при этом состоянии больной был относительно активным: самостоятельно передвигался, сам себя обслуживал и др). В результате острой кровопотери также снижается уровень гематокрита (отношение жидкой части крови с элементов крови: эритроцитов, тромбоцитов, лимфоцитов и др), который в норме должен быть примерно 35-45% (в зависимости от пола и возраста). При кровопотерях организм, с целью восполнения объема крови, выбрасывает в кровеносную систему плазму, однако количество оставшихся после кровопотери эритроцитов восполняется намного медленнее. Поэтому уровень гематокрита (Н+) может понижаться до 25% (бывает и ниже). Еще один показатель, который характеризует анемию – цветной показатель крови, который в норме составляет 1,0-0,9, а при анемии он снижается. Цветной показатель крови показывает так называемую степень содержания эритроцитов в гемоглобине. При постгеморрагических анемиях цветной показатель крови как правило не изменяется, так как в этих случаях количество гемоглобина снижается вместе с количеством эритроцитов, а оставшиеся эритроциты не отличаются от эритроцитов до кровопотери.
Лечение острой кровопотери направлено прежде всего на остановку кровотечения, противошоковых мероприятиях и лечение постгеморрагической анемии.
С целью лечения анемии применяется переливание плазмы крови и эритроцитарной массы. Используемые препараты должны совпадать с группой крови пострадавшего (каждый раз перед применением препаратов крови врач должен проводить соответствующие пробы). После восполнения основной кровопотери больному назначаются препараты железа, которые стимулируют образование собственных эритроцитов костным мозгом: гемостимулин, ферум-лек, ферум-аллоэ и др), витаминотерапия. При этом питание больного должно быть полноценным (если у больного нет других противопоказаний по питанию), достаточным и разнообразным.
Железодефицитные анемии вызваны недостаточным количеством железа в организме.
Причинами дефицита железа могут как быть хронические кровопотери, так и недостаточное количество железа в организме, которое может быть вызвано неполноценным рационом и режимом питания или разного родами заболеваниями (острые и хронические заболевания пищеварительной системы, гиповитаминоз и др). Особую группу составляют больные с поражениями тонкого кишечника, после хирургических операций проводимых на желудке (резекция желудка), язвенной болезнью желудка или двенадцатиперстной кишки, онкологическими заболеваниями (рак).
У больных железодефицитной анемией наблюдаются повышенная усталость, слабость, головные боли, запоры, извращение вкуса (больные могут есть глину, мел, у них появляется тяга к острой и соленной пище и др), ломкость ногтей (искривление, поперечная исчерченность), бледность, тахикардия (учащенное сердцебиение), одышка, выпадение волос. Характерны сильные позывы на мочеиспускание, недержание мочи.
Анализ крови при анемии показывает сниженное количество гемоглобина и цветного показателя крови (может быть ниже 0,5). Для диагностики анемий могут использовать и другие анализы.
При лечении железодефицитной анемии врач должен определить причину данного состояния, а после ликвидации данной причины приступить непосредственно к лечению самой анемии. При необходимости (на усмотрение врача) лечение анемии начинают параллельно с лечением основного заболевания. Для этого назначают препараты железа (феррокаль, гемостимулин, ферум-аллоэ, ферроплекс, ферум-лек и др). Стоит отметить, что в основном данные препараты назначают внутренне, так как при введении препаратов железа внутривенно или внутримышечно не оказывает ощутимого результата. Также усвоению железа способствует аскорбиновая кислота.
Прием препаратов железа оказывает стимулирующее внимание на костно-мозговую продукцию эритроцитов.
Если железодефицитная анемия вызвана инфекционными процессами в организме, больному назначают антибактериальную терапию. В остром периоде инфекционного заболевания назначать препараты железа нецелесообразно (конечно, если анемия обусловлена только этим заболеванием).
В большинстве случаев лечение анемии с помощью препаратов железа проводят амбулаторно. Анализы крови имеет смысл делать повторно через 7-14 дней после начала лечения.
При железодефицитных анемиях переливания эритроцитарной массы не показаны (кроме состояний, которые вызванные обильными кровопотерями).
Для пожилых людей страдающих железодефицитной анемией при лечении включают кардиотонические средства.
Любая анемия этого типа, в независимости от причины ее возникновения, характеризуется не только поражением эритроцитов, но и снижением уровня тромбоцитов (элементы крови, которые отвечают за ее свертываемость), поражением нервной системы, изменениями в костном мозге, атрофическими изменениями оболочки желудочно-кишечного тракта.
Этот вид анемии развивается в результате недостатка витамина В12 и встречается в большинстве случаев у людей пожилого возраста. Такое состояние вызвано как правило недостатком специального белка, который называют внутренним фактором, и который обеспечивает усвоение витамина В12 в кишечнике (в основном после перенесенного энтерита или гепатита). Также этот вид анемии может развиваться через несколько (5-8) лет после тотальной гатрэктомии (удаление желудка, связанное с язвенной болезнью или опухолью) – на протяжении этого времени организм больного использует запася витамина в печени.
Еще одной причиной развития В12-дефицитной анемии может быть (очень редко) заражение рыбьим солитером (ланцетом широким). Этот паразит питается содержимым тонкого кишечника, поглощая большое количество витаминов и микроэлементов.
Дивертикулез тонкого кишечника, хронический энтерит, петля тонкого кишечника также могут быть причинами развития данного вида анемии. В этом случае витамин В12 поглощают микроорганизмы, которые живут в кишечнике.
Алкогольная интоксикация, при которой страдает слизистая оболочка желудочно-кишечного тракта тоже является одной из причин развития анемии.
Существуют и наследственные формы анемии (наследуется по рецессивному типу).
Больной В12-дефицитной анемией жалуется на повышенную утомляемость, слабость, тахикардию, в языке появляется ощущение жжения (при этом язык воспален и становится «полированным»). По причине повышения уровня билирубина в крови, который образуется из гемоглобина разрушенных эритроцитов, кожа может иметь желтушный оттенок. Печень и селезенка незначительно увеличены. Происходит угнетение желудочной секреции, что приводит к снижению выработки соляной кислоты и пепсина в желудке и, как следствие, приводит к нарушению пищеварения.
При диагностике наблюдаются значительные изменения в косном мозге и крови.
Лечение В12-дефицитной анемии заключается в введении витамина В12 (курс лечения составляет 4-6 месяца). Как правило лечение проводят в амбулаторных условиях (на дому). Конечно же необходимо диагностировать и лечить заболевание, которое вызывает анемию. Длительность нетрудоспособности определяется выраженностью анемии и неврологическими нарушениями (например, фуникулярный миелоз). Устойчивая потеря трудоспособности при этом заболевании не происходит.
Фолиево-дефицитная анемия очень похожа на В12-дефицитную анемию, но причиной ее возникновения является дефицит фолиевой кислоты (витамин В9).
Нарушение усвоения фолиевой кислоты можно наблюдать у беременных, которые страдают гемолитической анемией, при злоупотреблении алкоголем до беременности, при алкоголизме, после операций на тонком кишечнике, энтерите, у недоношенных детей (особенно при вскармливании их козьим молоком), при длительном приеме противосудорожных препаратов (дифенин, фенобарбитал и др).
Симптомы (проявления) болезни такие же, как при В12-дефицитной анемии, только отсутствует неврологическая симптоматика и не воспаляется язык.
Для профилактики развития фолиево-дефицитной анемии назначается прием фолиевой кислоты. Также фолиевую кислоту следует назначать людям, страдающим вышеперечисленными заболеваниями, беременным и болеющим гемолитическую анемию.
Анемия при отравлении свинцом развивается в результате блокады свинцом ферментов, которые принимают участие небелковой железосодержащей части гемоглобина – гемы. Также свинец повреждает оболочку эритроцитов, что приводит к повышению гемолиза (разрушения эритроцитов).
В случае острых отравлений свинцом у больных наблюдается симптомы полиневрита (воспаление периферических нервов, которое проявляется нарушением чувствительных и двигательных функций), анемический синдром, приступообразные боли в области живота.
Отравление свинцом возможно при употреблении пищи из свинцовой посуды (даже существует гипотеза, что древние римляне поголовно страдали от отравления свинцом, так как их водопроводы делались из свинца) и работе со свинцом (у аккумуляторщиков, которые часто разбирают свинцовые аккумуляторы; людей, занимающихся литьем дроби или деталей из свинца).
При отравлении свинцом больного помещают в токсикологическое отделение, где он проходит соответствующее лечение.
Гемолитическая анемия развивается из-за высокого уровня разрушения эритроцитов (гемолиза). Все типы гемолитической анемии характеризуются повышенным уровнем содержания в крови продукта распада эритроцитов – билирубина, а также появлением гемосидерина – продукт превращения гемоглобина в моче.
Среди гемолитических анемий наиболее распространенными типами являются серповидно-клеточная анемия, талассемия, гемолитическая анемия (обусловленная дефицитом глюкозо-6-фосфатдегидрогеназы – фавизм), микросфероцитоз, овалоцитоз. Все эти заболевания наследственные.
Общими симптомами является анемия, увеличение селезенки и печени, желтуха.
При лечении используется либо переливание крови, либо удаление селезенки.
Иммунные анемии развиваются в результате действия иммунных тел на эритроциты. Основными формами заболевания являются аутоиммунные (обусловленные появлением в организме антител, которые атакуют собственные эритроциты), вызванные оседанием веществ на эритроцитах (некоторых вирусов, лекарств и др), изоиммунные (связанные с проникновением в организм новорожденного антител матери, которые направлены против эритроцитов ребенка).
Лечение таких анемий комплексное и проводится в гемотологических отделениях, где врачи обязательно учитывают причины заболевания и его развитие.
источник
Среди разнообразных токсических факторов производственной среды выделяется группа веществ, обладающих способностью вызывать повреждение эритроцитов, т. е. гемолитическим действием. Гемолитические анемии — группа заболеваний, объединяемая одним общим признаком — укорочением продолжительности жизни эритроцитов. В последнем случае возможно использование термина «неэффективный эритропоэз». Следствием этих изменений является та или иная степень малокровия, раздражение эритропоэза, ретикулоцитоз. В течение многих лет среди гематологов обсуждался вопрос о правомерности использования термина «гемолитическая анемия» применительно к больным с нормальным уровнем гемоглобина, но укороченной жизнью эритроцитов. В настоящее время он принят во всем мире и используется независимо от уровня гемоглобина у больных.
Гемолитические анемии делятся на наследственные и приобретенные.
Наследственные гемолитические анемии можно дифференцировать по локализации поражения: мембраны эритроцита, его ферментов, структуры гемоглобина.
Приобретенные гемолитические анемии разделяются по принципу уточнения фактора, вызывающего гемолиз: антитела, механическая травма эритроцитов, химические яды. Среди последних выделяются вещества, обладающие прямым или непосредственным гемолитическим действием, выраженность которого определяется уровнем и временем воздействия, путями проникновения в организм. К этой группе относятся следующие химические соединения:
— Мышьяковистый водород — тяжелый бесцветный газ, в производственных условиях образование его происходит при воздействии технических кислот на металлы и соединения, содержащие мышьяк. Водород, образующийся в ходе реакции, восстанавливает элементарный мышьяк. При распаде его образуется диэтиларсин, вследствие чего появляется характерный чесночный запах. Основной путь поступления в организм — ингаляционный.
— Фенилгидразин — используется в фармацевтической промышленности для изготовления препаратов пирамидона.
— Толуилендиамин — используется преимущественно в производстве красителей и некоторых полимерных соединений.
— Гидроперекись изопропилбензола (гипериз), находит применение как катализатор в производстве полиэфирных и эпоксидных смол, каучуков, стеклопластиков и др.; применяется как промежуточный продукт в производстве фенола и ацетона.
— Острый внутрисосудистый гемолиз могут вызвать при приеме внутрь уксусная эссенция, бертолетова соль, ядовитые грибы.
Патогенез гемолитических анемий. Развитие гемолитических анемий связано с ускоренной гибелью эритроцитов в результате нарушения их целостности. Гемолитические эффекты токсических веществ обусловлены либо их непосредственным воздействием на основные липидные и белковые элементы мембраны, либо влиянием на ферменты эритроцита, регулирующие энергетические процессы (в эритроците) и синтез гемоглобина.
Согласно современным представлениям, в основе гемолитического действия токсических химических веществ, по аналогии с лекарственными препаратами, лежит их способность вызывать патологическое окисление, — так называемый оксидантный гемолиз, что сопровождается накоплением перекисных соединений. Это приводит к функциональным и структурным изменениям в гемоглобине, необратимым сдвигам в липидах мембран эритроцита и ингибированию активности сульфгидрильных групп. Большинство токсических веществ образуют оксидирующие дериваты только в организме при условии нарушения функционального состояния защитных систем. К последним относятся некоторые ферменты — каталаза, пероксидаза, глюкозо-6-фосфатдегидрогеназа, а также система глютатиона, который является важнейшим биокатализатором, осуществляющим защиту гемоглобина, серу содержащих ферментов и мембрану эритроцитов от токсических веществ, обладающих окислительным действием. Так, острый внутрисосудистый гемолиз, вызываемый AsH3, развивается в результате не только его прямого действия на мембрану эритроцита, но и ингибиции активности каталазы эритроцита и редуктазы глютатиона.
Некоторые химические вещества вызывают «вторичное» гемолитическое действие вследствие особенностей их метаболизма и токсикокинетики в организме. Таков механизм гемолитической анемии, сопутствующей острой интоксикации метгемоглобино-образователями.
Эти же соединения при продолжительном воздействии способны вызывать хронический компенсированный гемолиз, который обусловлен укорочением продолжительности жизни эритроцитов и протекает в клетках ретикулогистиоцитарной системы. Подобные же изменения жизненного цикла эритроцитов являются одним из патогенетических механизмов развивающейся анемии при выраженной свинцовой интоксикации.
В последние годы установлено, что при длительном воздействии различных токсических химических веществ или их комплексов, часто включающих органические растворители в концентрациях, не вызывающих клинических проявлений интоксикации, и в том числе анемии, могут наблюдаться изменения морфофункционального состояния эритроцитов и сдвиги в их метаболизме. При этом в первую очередь страдают мембраны эритроцитов, о чем свидетельствуют нарушения фосфолипидного состава мембран, сдвиги калийнатриевого баланса и повышение проницаемости мембран для радиоактивного фосфора. Структурные и функциональные нарушения эритроцитов могут приводить к изменению процессов их жизнедеятельности и сокращению продолжительности жизни.
Наблюдаемые изменения, очевидно, можно рассматривать как одно из проявлений своеобразного действия химических факторов, на эритроцит, которое носит гемолитический характер. Однако при воздействии малой интенсивности эти состояния вполне компенсированы за счет некоторого усиления регенерации, о чем свидетельствует определяемый в крови умеренный ретикулоцитоз. Содержание эритроцитов и гемоглобина остается нормальным или наблюдается небольшое снижение. Срыв компенсации и развитие анемии возможны лишь в исключительных случаях, в основном у женщин под влиянием непрофессиональных факторов, главным образом кровопотерь. Этиология такой анемии становится смешанной, патогенез ее более сложен и требует пристального изучения.
Симптомы гемолитической анемии. Острые внутрисосудистые гемолитические анемии, вызванные токсическими веществами, обладающими прямым гемолитическим действием, имеют во многом сходную клиническую картину. Поскольку наиболее типичным представителем гемолитической группы ядов является мышьяковистый водород, клиника острой интоксикации приводится на модели гемолиза этим веществом.
Легкие формы интоксикации AsH3 характеризуются скудной клинической симптоматикой: слабость, головная боль, тошнота, небольшой озноб. Возможна легкая иктеричность склер. Как правило, при этих формах больные поступают в стационар только в случае групповых интоксикаций. Наиболее характерным признаком выраженных форм отравления является наличие скрытого периода продолжительностью 2-8 ч, хотя гемолиз начинается сра-зу после поступления яда в организм.
Следующий период прогрессирующего гемолиза, который характеризуется появлением нарастающей общей слабости, головной болью, болями в эпигастральной области и правом подреберье, в пояснице, тошнотой, рвотой, лихорадкой. В это же время отмечается появление гемоглобинурии (моча приобретает темно-красный цвет). Нередко гемоглобинурия является первым признаком отравления, развивающимся ранее остальных симптомов.
Бурное развитие гемолиза приводит к выраженной эритроцитопении и снижению гемоглобина, сопровождающихся значительной активацией эритропоэза. Ретикулоцитоз периферической крови может достигать 200-300%, отмечается значительное увеличение количества эритроцитов с базофильной пунктацией. Как правило» наблюдается нейтрофильный лейкоцитоз со сдвигом влево, иногда лимфо- и эозинопения. При развитии выраженного гемолиза повышается температура тела до высоких цифр (38-39 °С). В связи с бурным распадом эритроцитов развивается гемоглобинурия и значительная протеинурия. Вследствие присутствия в моче гема и гемосидерина она имеет характерный темно-красный, а иногда и черный цвет.
Обычно на 2-3-е сутки, а иногда и раньше появляется желтуха, нарастает билирубинемия, первоначально преимущественно за счет непрямой фракции. Следует отметить, что между выраженностью билирубинемии и интенсивностью гемолиза нет прямой зависимости, поскольку уровень билирубина определяется функциональным состоянием печени. В тех случаях, когда функция печени сохранена, даже при значительном разрушении эритроцитов может быть лишь умеренная гипербилирубинемия. При сочетании гемолиза с нарушением функциональной способности печени отмечается более высокое содержание билирубина за счет обеих фракций. На 3-5-е сутки в процесс вовлекается печень и развивается печеночная недостаточность, увеличиваются размеры печени, нарастает интенсивность желтухи, ферментемия. Нередко в те же сроки обнаруживается почечная недостаточность, характеризующаяся прогрессирующей олигурией вплоть до анурии, азотемией, нарушениями фильтрации, реабсорбции, экскреторной функции. Почечные расстройства обусловлены, с одной стороны, закупоркой почечных канальцев продуктами распада гемоглобина, а с другой — ранним развитием признаков дегенеративного поражения проксимальных отделов канальцев, ишемией коры органа. На высоте нефропатии моча светлая, определяется только микрогематурия.
При своевременном лечении отмечается регрессия симптомов почечной недостаточности и наступает период выздоровления или обратного развития, который продолжается от 4 до 6-8 недель. Особенностью интоксикаций AsH3 является довольно длительное сохранение (иногда до полугода) некоторых нарушений со стороны крови (анемизация), нервной системы (полиневритический синдром), почек (нарушение некоторых функциональных проб, иногда присоединение пиелонефрита).
Диагностика. При отравлениях мышьяковистым водородом в типичных случаях диагностика не вызывает особых затруднений и базируется на данных о загрязнении воздуха рабочей зоны AsH3 и характерной клинико-лабораторной симптоматике. Имеет значение обнаружение мышьяка в биосубстратах и диализируемой жидкости, так как проникший в организм мышьяковистый водород подвергается процессам окисления и переходит в элементарный мышьяк, выделение которого из организма происходит с мочой и калом. Как отмечают Н. Н. Молодкина и Ю. С. Гольдфарб, максимальное содержание мышьяка в крови и моче наблюдается на 2-3-й сутки после отравления и при тяжелых формах интоксикации превышает исходные величины в 100-300 раз. Авторы указывают на довольно длительную циркуляцию яда в крови при выраженных формах отравления.
В отличие от гемолитических анемий, наблюдаемых в общей клинике, при отравлениях арсином отмечаются также симптомы его общего токсического действия, проявляющиеся изменениями сердечно-сосудистой и нервной систем (миокардиопатия, артериальная гипотония, синдром сенсорного полиневрита и др.).
Первая помощь и лечение гемолитической анемии. В первую очередь пострадавшего необходимо удалить из загазованного помещения, обеспечив ему полный покой.
Комплексное лечение при интоксикации мышьяковистым водородом должно быть направлено на скорейшее выведение мышьяка из организма, дезинтоксикацию, ликвидацию симптомов печеночной и почечной недостаточности. С этой целью используют форсированный диурез, ощелачивание плазмы, витаминотерапию. Рекомендуется бужирование пупочной вены с трансумбиликальным введением лекарств, раннее проведение гемодиализа. Показана обязательная защитная антибактериальная терапия.
В качестве антидотов при отравлении арсином используют тиоловые соединения: мекаптид, антарсин, унитиол. Эффективность первых двух значительно возрастает при раннем их введении, желательно до госпитализации.
Мекаптид вводят внутримышечно в виде 40% масляного раствора в дозе 1 мл. При тяжелых интоксикациях возможны увеличение дозы до 2 мл и повторное введение препарата через 6-8 ч.
Антарсин используют в виде 5% раствора, который вводят внутримышечно в дозе 1 мл.
Что касается унитиола, то до недавнего времени считалось, что введение его возможно только на 5-7-е сутки. Однако Центр по лечению отравлений института скорой помощи им. Н. В. Склифосовского рекомендует введение 5% раствора унитиола непосредственно с момента отравления наряду с указанными двумя препаратами.
Экспертиза трудоспособности. Решение вопросов экспертизы трудоспособности при острых гемолитических состояниях определяется тяжестью перенесенной интоксикации.
При легких формах отравления, когда основные проявления интоксикации сводятся к обратимым гематологическим сдвигам, наблюдается восстановление трудоспособности после соответствующего лечения. В этих случаях рабочие могут возвратиться на прежнюю работу.
При тяжелых формах отравления, когда, несмотря на длительное лечение, наблюдаются остаточные явления интоксикации (симптомы функциональной недостаточности печени, почек, анемия), необходимо прекращение контакта с веществами гемолитического действия. На срок переквалификации возможен перевод больного на III профессиональную группу инвалидности.
Профилактика. На производствах, где возможно образование AsH3, необходимы герметизация аппаратуры и механизация производственных процессов, а также рациональная вентиляция. На соответствующих предприятиях широко используют химический контроль за воздушной средой с целью предупреждения о превышении ПДК AsH3, а также сигнализацию о наличии в воздухе рабочей зоны мышьяковистого водорода.
источник