Различают острую и хроническую постгеморрагическую анемии.
Возникает в результате острой массивной потери крови в объеме от 5 мл/кг массы тела и выше (травма, хирургическое вмешательство, желудочные, маточные, кишечные кровотечения, разрыв фаллопиевых труб, нарушение гемостаза и др.). Сразу после потери крови вследствие уменьшения ее массы появляется общеанемические признаки — тахикардия, одышка, бледность кожных покровов и слизистых оболочек, падение АД. Содержание эритроцитов и гемоглобина снижается равномерно (нормоцитемическая гиповолемия), развивается нормохромная анемия. Изменения периферической крови носят стадийный характер. На 2–3-е сутки после кровотечения в кровь поступает тканевая жидкость, масса ее восстанавливается (гидремическая фаза), а количество эритроцитов и гемоглобина снижается, падает гематокрит, но в связи с выходом эритроцитов из депо цветовой показатель сохраняется в норме (нормохромная анемия), развивается лейкопения (утрата лейкоцитов во время кровотечения, гемодиллюция), тромбоцитопения (утрата тромбоцитов при потере крови, потребление при образовании тромба). Наблюдается умеренный анизоцитоз и пойкилоцитоз эритроцитов. Возникшая гипоксия ведет к повышению уровня эритропоэтина и на 4–5-е сутки после кровотечения активируется функция костного мозга (костномозговая фаза компенсации) появляются регенеративные формы эритроцитов — полихроматофилы, единичные нормобласты (полихроматофильные, оксифильные), ретикулоцитоз. Анемия приобретает гипохромный характер, т. к. ускоренная регенерация опережает созревание эритроцитов из-за возникшего дефицита железа. Развивается нейтрофильный лейкоцитоз со сдвигом влево по регенеративному типу.
Данные нарушения обусловлены уменьшением объема циркулирующей крови и гипоксией. В ответ на кровопотерю включаются механизмы компенсации, направленные на восстановление утерянного объема крови и на борьбу с анемическим состоянием (гипоксией).
Развивается в результате длительно повторяющихся небольших кровотечений. Является вариантом железодефицитных анемий, патогенез и проявления обусловлены нарастающим дефицитом железа.
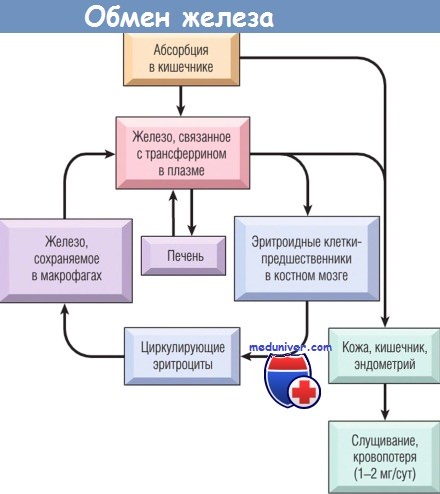
Железо — один из важнейших микроэлементов, входящих в состав организма человека. Взрослому человеку требуется 15–18 мг/сут железа, из которых всасывается 2–2,5 мг. При этом биодоступность содержащегося в пище гемового железа существенно выше, чем негемового. Основные депо железа: печень (гепатоциты и макрофаги), костный мозг, селезёнка, мышцы. Если метаболизм железа нормален, 30–40 % нормобластов костного мозга содержат гранулы ферритина (сидеробласты). Отсутствие сидеробластов характерно для железодефицита. Избыток гранул в сидеробласте служит признаком переполнения организма железом (гемосидероз) или неспособности утилизировать его (сидеробластная анемия). На рис. 2 представлена схема метаболизма железа.
Дефицит железа в организме существует в двух формах, представляющих собой две последовательные стадии одного процесса: латентный (тканевый) дефицит железа (ЛДЖ) и собственно железодефицитная анемия (ЖДА).
ЖДА составляет около 80–90 % всех случаев анемий и является одной из самых распространенных ее форм. Женщины страдают данным заболеванием чаще, чем мужчины, поскольку запасы железа у последних значительно превышают (на 100–200 %) таковые у женщин. Явный и скрытый дефицит железа отмечается почти у 60 % женщин земного шара. Железодефицитные анемии встречаются во всех возрастных группах. Различают «истинные» ЖДА — при абсолютном дефиците железа и «ложные» — при нарушении включения железа в гемм, в отсутствие первичного истинного железодефицита.
Рисунок 2 – Схема метаболизма железа в организме
По патогенетическому принципу с учетом основных этиологических причин железодефицитные анемии делят на пять основных подгрупп (Л.И. Идельсон): 1) связанные с повышенной потерей железа; 2) связанные с недостаточным исходным уровнем железа; 3) связанные с повышенным расходованием железа; 4) связанные с нарушением всасывания железа и недостаточным поступлением его с пищей (алиментарные); 5) связанные с нарушением транспорта железа.
Таблица 3.Причины и механизмы развития железодефицитных состояний
Группы этиологических факторов
Дети недоношенные и новорожденные
Недостаточный исходный уровень железа
Интенсивный рост (пубертатный период)
Повышенное расходование железа
Хроническая кровопотеря: при частых лечебных кровопусканиях, донорстве;
При заболеваниях ССС (гипертоническая болезнь, геморрагическая телеангиэктазия и др.);
При патологии ЖКТ (варикозное расширение вен пищевода, диафрагмальная грыжа, язва желудка и 12-перстной кишки, язвенный колит, дивертикулёз, геморрой и др.);
Из органов мочеполовой системы (алкогольная нефропатия, туберкулёз почек, почечнокаменная болезнь, полипы и рак мочевого пузыря, обильные меноррагии, эндометриоз, миома матки и др.);
Из органов дыхательной системы (рак лёгкого, туберкулёз, бронхоэктазия и др.);
При заболеваниях системы крови (лейкозы, апластическая анемия и др.);
Припатологии системы гемостаза (аутоиммунная тромбоцитопения, гемофилии, ДВС-синдром и др.)
Патологические состояния и болезни
Резекция желудка и кишечника;
Гипосекреция желудочного сока;
Нарушение всасывания железа
Приобретённая гипотрансферринемия (при нарушении белоксинтезирующей функции печени)
Нарушение транспорта железа
Недостаточное поступление железа; нарушение транспорта железа; нарушение всасывания железа; потеря железа
Нарушение всасывания железа
Искусственное вскармливание грудных детей
Недостаточное поступление железа
Избыточные физические нагрузки
Повышенное расходование железа
Нередко действуют комбинации указанных факторов, вызывающих отрицательный баланс железа. Примером ЖДА, развивающейся вследствие комплексного влияния нескольких факторов, является хлороз (от греч. «хлорос» — бледно-зеленый, или «бледная немочь»). Название связано со специфическим цветом лица таких больных. При ЖДА уменьшается содержание железа в плазме крови, костном мозге и в тканевых депо.
Основным звеном патогенеза заболевания является снижение содержания железа в депо, сыворотке крови и костном мозгу. В результате нарушается синтез гемоглобина, возникают гипохромная анемия и трофические расстройства в тканях, признаками которых являются: сухость и вялость кожи, ломкость ногтей, выпадение волос, атрофия слизистой оболочки языка, повышенное разрушение зубов, дисфагия, извращение вкуса, мышечная слабость и др.. В патогенезе клинических проявлений болезни имеет значение: нарушение активности железосодержащих ферментов в тканях организма (цитохром С, цитохромоксидаза, сукцинатдегидрогеназа, пероксидаза, митохондриальная моноаминооксидаза, α-глицерофосфатоксидаза) и недостаточное снабжение тканей кислородом. Признаки гипоксии тканей появляются лишь при значительной выраженности малокровия, когда наступает истощение компенсаторных механизмов, обеспечивающих на ранних этапах развития дефицита железа нормализацию отдачи кислорода из гемоглобина тканям.
Клиническая картина складывается из двух основных синдромов: общеанемического и сидеропенического.
Общеанемический синдром проявляется симптомами, характерными для всех видов анемии: бледность, общая слабость, быстрая утомляемость, обмороки, одышка, тахикардия, систолический шум.
Сидеропенический синдром характеризуется рядом трофических нарушений. Отмечаются: сухость и трещины кожи, преждевременные морщины, ломкость ногтей, койлонихия (катлонихия) — ложкообразные ногти, ангулярный стоматит, атрофия слизистых оболочек рта, пищевода, желудка, дыхательных путей. Нарушается иммунитет, что приводит к хронизации инфекций, частым ОРЗ; развивается мышечная слабость, слабость физиологических сфинктеров. Может возникнуть извращение вкуса (поедание несъедобных продуктов — мела, бумаги и др.), пристрастие к необычным запахам (ацетон, бензин, краска). Нарушается память, концентрация внимания. При дефиците железа резко усиливается абсорбция свинца, и у детей на этом фоне развивается необратимая задержка интеллектуального развития. Нарушение проницаемости мелких сосудов ведет к отекам лица. Иногда возникает «сидеропенический субфебрилитет».
Картина крови. Основным признаком железодефицитной анемии является гипохромия со снижением цветового показателя ниже 0,8 и, соответственно, уменьшением содержания гемоглобина ниже 110 г/л. Количество эритроцитов, как правило, остается на исходном уровне, но в ряде случаев может оказаться сниженным до 2,0-1,5×10 12 /л вследствие нарушения процессов пролиферации клеток эритроидного ряда в костном мозгу и усиления неэффективного эритропоэза (в норме разрушение эритронормобластов в костном мозгу не превышает 10-15%). Ретикулоциты в норме или незначительно увеличены, при прогрессировании ЖДА их количество снижается. Важным морфологическим признаком железодефицитных анемий является анизоцитоз эритроцитов с преобладанием микроцитов.
Нередко развивается нейтропения (в результате уменьшения содержания железосодержащих ферментов в лейкоцитах). СОЭ в норме или незначительно увеличена.
Уровень тромбоцитов может быть незначительно повышен (на фоне кровотечений).
Исследование костного мозга.В КМ определяется нормобластическая гиперплазия с нарушением гемоглобинизации (преобладание базофильных и полихроматофильных нормобластов при снижении оксифильных), снижение индекса созревания нормобластов, снижение количества сидеробластов вплоть до полного их отсутствия. Миелоидный и мегакариоцитарный ростки не изменены.
Биохимический анализ крови – основной диагностический критерий при ЖДА, включающий набор тестов, при помощи которых подтверждается факт дефицита железа в организме:
снижение уровня сывороточного железа,
снижение уровня сывороточного ферритина,
снижение степени насыщения трансферрина железом,
увеличение содержания трансферрина в сыворотке,
повышение общей и латентной железосвязывающей способности сыворотки,
увеличение содержания растворимых рецепторов к трансферритину в сыворотке,
повышение свободного протопорфирина IX в эритроцитах.
Количество железа в сыворотке крови при выраженной ЖДА падает до 5,4–1,8 мкмоль/л при норме 12,5–30,4 мкмоль/л (мужчины; у женщин этот показатель на 10–15% ниже. Под общей железосвязывающей способностью сыворотки понимается количество железа, которое может связаться с трансферрином (в норме 54,0–72,0 мкмоль/л). В норме одна треть трансферрина насыщена железом, а две трети — свободны. Об уровне депонированного железа можно судить по содержанию железа в суточной моче после однократного введения больному 500 мг десферала (продукт метаболизма актиномицетов, избирательно выводящий ион железа из организма). В норме этот показатель соответствует 0,6–1,3 мг железа, а при железодефицитной анемии снижается до 0,2 мг в сутки и менее.
Сывороточный ферритин— очень точный индикатор резервных запасов железа. Он содержит примерно 15-20% общего запаса железа в организме взрослого человека. Определяется почти во всех тканях, особенно высока его концентрация и синтетическая способность в печени, селезенке и костном мозге. Белок в свободном от железа виде называется апоферритином. Ферритин состоит из белковой оболочки, которая окружает ядро трехвалентного железа в виде комплексов окиси и фосфата железа. Каждая молекула апоферритина может сорбировать до 5000 атомов железа, однако большинство молекул ферритина содержат от 1000 до 3000 атомов железа.
Анемии, ассоциированные с заболеваниями внутренних органов, включают анемии при эндокринных заболеваниях, заболеваниях печени и почек.
К числу анемий при эндокринных заболеванияхотносятся анемии при заболеваниях щитовидной и паращитовидных желез, надпочечников, половых желез, гипопитуитаризме и др., в основе патогенеза которых лежит депрессия эритропоэза при дефиците или, напротив, гиперсекреции ряда гормонов. В частности, такие гормоны, как тироксин, кортизол, тестостерон в очень высоких концентрациях вызывают угнетение пролиферативной активности эритроидных прекурсоров. В случае сгущения крови в результате дегидратации (при надпочечниковой недостаточности, гипотиреозе) диагностика анемии может быть затруднена.
К анемиям при заболеваниях печени относятся анемии, возникающие при диффузных поражениях органа (циррозе, хроническом гепатите, гемохроматозе и др.).
Патогенез анемии при заболеваниях печени отличается многообразием патогенетических факторов, что определяется особенностями патогенеза основного заболевания. Выделяют следующие механизмы развития анемии:
угнетение процессов кроветворения в костном мозгу вследствие прямого токсического влияния на клетки-предшественницы гемопоэза алкоголя (при алкогольном поражении печени) и эндогенных токсинов (при нарушениях обезвреживающей и клиренсной функции печени), при нарушениях метаболизма железа и депонирования витамина В12и фолиевой кислоты в пораженной печени;
укорочение продолжительности жизни эритроцитов в результате прямого повреждающего действия токсических продуктов экзогенного (алкоголь) и эндогенного (при эндотоксемии) происхождения, гиперспленизма, при нарушениях внутриклеточного метаболизма эритроцитов (например, в связи с дефицитом в клетках НАДФ + ) и их способности к деформации (вследствие патологии клеточной мембраны при изменениях фракционного состава фосфолипидов, снижении содержания сиаловых кислот);
кровотечения из расширенных вен желудочно-кишечного тракта (при циррозе печени), носовые, геморроидальные и иной локализации (при формирующейся недостаточности синтеза факторов свертывания крови вследствие нарушений белкового обмена).
В подавляющем большинстве случаев при заболеваниях печени регистрируется нормохромная нормоцитарная анемия, при присоединяющемся дефиците железа — микроцитарная нормоили гипохромная, при недостаточности витамина В12и фолиевой кислоты, метастазах рака желудка в печень — макроцитарная анемия нормо- или гиперхромного типа.
Анемии при заболеваниях почекмогут выявляться у больных острым гломерулонефритом, интерстициальным нефритом, хронической почечной недостаточностью. Патогенез анемии при заболеваниях почек определяется снижением продукции эритропоэтина клетками юкстагломерулярного аппарата, депрессией кроветворения в костном мозгу (в результате нарушения пролиферативной активности эритроидных клеток, торможения процессов синтеза гема) и сокращением срока жизни эритроцитов (до 40-50 дней) при действии токсических продуктов азотистого обмена.
Контрольные вопросы по теме:
Охарактеризуйте типовые формы изменений общего объема циркулирующей крови.
Какова этиология олигоцитемических и полицитемических гиповолемий?
Какова этиология олигоцитемических и полицитемических гиперволемий?
Укажите общие механизмы формирования компенсаторно-приспособительных механизмов при кровопотере.
Каков механизм формирования экстренных защитно-приспособительных реакций организма при кровопотерях?
Каков механизм формирования долговременных защитно-приспособительных реакций организма при кровопотерях?
Дайте определение понятию анемия, каковы принципы классификации?
Назовите основные фонды железа в организме?
Перечислите лабораторные показатели, характеризующие состояние красной крови при острой кровопотере?
Перечислите лабораторные показатели, характеризующие состояние красной крови при хронической кровопотере?
Какие Вы знаете анемии, ассоциированные с заболеваниями внутренних органов, какие особенности для них характерны?
Темы реферативных сообщений:
Этиологи и патогенез ювенильного хлороза (у девочек в пубертатный период) при ЖДА
источник
Дефицит железа — наиболее распространенное во всем мире расстройство, связанное с дефицитом питания. Железодефицитная анемия больше распространена в развивающихся странах, но эта форма анемии часто встречается в США, особенно у детей младшего возраста, молодых девушек и женщин в репродуктивном возрасте. Факторы, лежащие в основе железодефицитной анемии, в разных популяционных группах несколько различаются, и эти факторы лучше рассматривать в контексте нормального метаболизма железа.
а) Метаболизм железа. Среднесуточная диета в западных странах обычно содержит 10-20 мг железа, в основном в виде гема, присутствующего в продуктах животного происхождения (оставшаяся часть представляет собой неорганическое железо в растительной пище). Всасывается 20% железа, входящего в состав гема (гемовое железо), и 1-2% железа, не входящего в состав гема (негемовое железо).
Таким образом, среднего содержания железа в диете западных стран достаточно, чтобы сбалансировать его ежедневную потерю. Общее содержание железа в организме в норме составляет 2 г у женщин и до 6 г у мужчин. Выделяют функциональный и запасной пулы железа. Около 80% функционального железа находятся в гемоглобине, остальные 20% приходятся на долю миоглобина и железосодержащих ферментов, таких как каталаза и цитохромы.
Запасной пул, состоящий из гемосидерина и ферритина, содержит от 15 до 20% общего железа организма. Этот пул у здоровых молодых женщин меньше, чем у мужчин, главным образом из-за потери крови во время менструаций, но дефицит железа у женщин часто наблюдается в результате обильных менструаций или при повышенной потребности в железе во время беременности.
В организме происходит интенсивный обмен (рециклирование) железа между функциональным и запасным пулами. Железо в плазме транспортирует железосвязывающий гликопротеин (трансферрин), синтезируемый в печени. У здоровых людей трансферрин на 35% насыщен железом, и нормальный уровень железа в сыворотке составляет в среднем 120 мкг/дл у мужчин и 100 мкг/дл у женщин. Главная функция трансферрина — доставка железа клеткам, включая эритроидные клетки-предшественники, которым железо необходимо для синтеза гемоглобина. Эритроидные клетки-предшественники имеют высокоаффинные рецепторы трансферрина, опосредующие импорт железа путем эндоцитоза.
Свободное железо высокотоксично, поэтому важно, чтобы железо запасного пула было секвестрировано. Это осуществляется путем прочного связывания железа запасного пула с ферритином или гемосидерином. Ферритин представляет собой распространенный во всех тканях организма комплекс белок-железо, в наибольшем количестве присутствующий в печени, селезенке, костном мозге и скелетных мышцах. В печени большая часть ферритина находится в гепатоцитах. В других тканях, в частности селезенке и костном мозге, ферритин содержится в макрофагах. Гематоциты получают железо из плазмы крови, тогда как железо в макрофагах накапливается в результате разрушения эритроцитов.
В клетках ферритин содержится в цитозоле и лизосомах, в которых частично деградированная белковая оболочка ферритина агрегирует в гранулы гемосидерина. Железо в составе гемосидерина метаболически активно и окрашивается в сине-черный цвет при воздействии ферроцианида калия, составляющего основу красителя берлинская лазурь. В нормальных условиях в организме обнаруживаются лишь следовые количества гемосидерина, в основном в макрофагах костного мозга, селезенки и печени. В перегруженных железом клетках большая часть железа хранится в виде гемосидерина.
Поскольку ферритин поступает в плазму главным образом из запасного пула, уровень железа в плазме хорошо коррелирует с запасами железа в организме. При дефиците железа уровень ферритина в сыворотке всегда ниже 12 мкг/л, тогда как при перегрузке железом этот показатель достигает 5000 мкг/л. Физиологическое значение запасного пула железа состоит в том, что оно может быть быстро мобилизовано в случае возрастания потребности в нем, например после кровопотери.
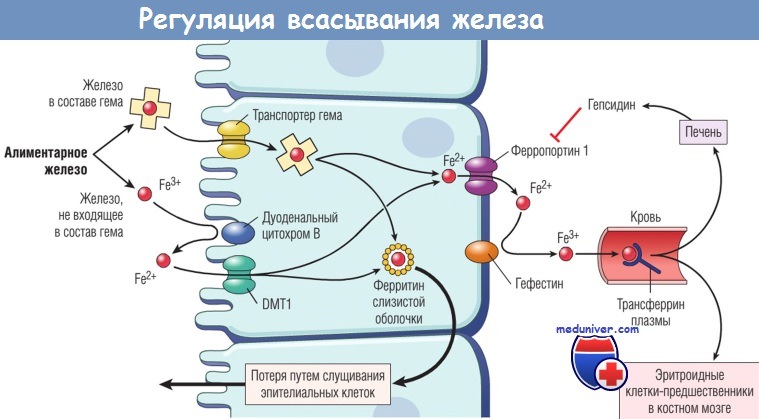
Баланс железа поддерживается в основном за счет регуляции абсорбции алиментарного железа в проксимальном отделе двенадцатиперстной кишки. Железо необходимо для клеточного метаболизма, но высокотоксично в избытке, поэтому общие запасы железа в организме должны тщательно регулироваться. Не существует регулируемого пути экскреции железа, которая ограничена 1-2 мг/сут за счет слущивания эпителиальных клеток слизистой оболочки и кожи. По мере возрастания запасов железа абсорбция падает и наоборот. Пути, ответственные за абсорбцию железа, к настоящему времени изучены достаточно детально и немного различаются у гемового и негемового.
Негемовое железо в просвете кишечника находится главным образом в трехвалентном состоянии (Fe3+) и сначала должно быть восстановлено до двухвалентного (Fe21) посредством ферриредуктаз — цитохрома В и STEAP3. Затем Fe2+ транспортируется через апикальную мембрану двухвалентным металлотранспортером 1. Абсорбция негемового железа вариабельна и часто неэффективна; ее могут подавлять вещества, присутствующие в пище и стабилизирующие Fe3+, и усиливать агенты, стабилизирующие Fe2+. Часто абсорбируются менее 5% негемового железа из пищи.
В отличие от этого количество абсорбируемого гемового железа из гемоглобина, миоглобина и других продуктов животного происхождения достигает 25%. Гемовое железо переходит через апикальную мембрану в цитоплазму с помощью транспортеров, характеристики которых изучены не до конца. Здесь оно метаболизируется с высвобождением Fe2+, которое поступает в общий пул вместе с Fe2+, высвобожденным из негемового железа. Поступившее в дуоденальные клетки железо может транспортироваться в кровь или нет, что зависит от запасов железа в организме. Fe2+, предназначенное для поступления в циркуляцию, транспортируется из цитоплазмы через базолатеральную мембрану энтероцитов ферропортином. Этот процесс сопряжен с окислением Fe2+ до Fe3+, осуществляемым ферриоксидазами гефестином и церулоплазмином.
Вновь абсорбируемое Fe3+ быстро связывается с белком плазмы трансферрином, который доставляет железо клеткам-предшественникам эритроцитов в костном мозге.
Двухвалентный металлотранспортер 1 и ферропортин, широко распространенные в организме, участвуют в транспорте железа в другие ткани. Например, двухвалентный металлотранспортер 1 опосредует поступление функционального железа, высвободившегося из эндоцитированного трансферрина, в цитозоль клеток-предшественников эритроцитов в костном мозге через мембраны лизосом, а ферропортин играет важную роль в высвобождении железа из запасного пула в макрофагах.
Абсорбцию железа регулирует гепсидин — небольшой циркулирующий пептид, синтезируемый в печени и высвобождаемый в ответ на повышение уровня железа в печени. Гепсидин ингибирует перенос железа из энтероцитов в плазму, связывая ферропортин и вызывая его эндоцитоз и деградацию. В результате, как только уровень гепсидина возрастает, железо захватывается дуоденальными клетками в форме ферритина слизистых оболочек и утрачивается при отторжении этих клеток. Таким образом, когда организм переполняется железом, высокий уровень гепсидина ингибирует его абсорбцию в кровь.
И наоборот, при низких запасах железа в организме синтез гепсидина падает, и это облегчает абсорбцию железа. Ингибируя ферропортин, гепсидин не только снижает захват железа из энтероцитов, но и супрессирует высвобождение железа из макрофагов, которые представляют собой важный источник железа, используемого эритроидными клетками-предшественниками для синтеза гемоглобина. Это обстоятельство играет важную роль в патогенезе анемии при хронических заболеваниях.
Изменение уровня гепсидина имеет первостепенное значение при заболеваниях, сопровождающихся нарушениями метаболизма железа. Как будет указано далее, анемию при хронических заболеваниях частично вызывают воспалительные медиаторы, повышающие продукцию гепсидина в печени. Редкую форму микроцитарной анемии вызывают мутации, блокирующие TMPRSS6 — печеночную трансмембранную серинпротеазу, в норме супрессирующую продукцию гепсидина, когда запасы железа снижены.
У пациентов с такой мутацией повышен уровень гепсидина, что приводит к падению абсорбции железа и отсутствию ответа на терапию железосодержащими препаратами. И наоборот, активность гепсидина несоразмерно низка как при первичном, так и при вторичном гемохроматозе — синдроме, возникающем при системной перегрузке железом. Вторичный гемохроматоз может развиться при заболеваниях, ассоциированных с неэффективным гемопоэзом, например при большой b-талассемии и МДС. Посредством еще недостаточно изученных механизмов неэффективный эритропоэз супрессирует образование гепсидина в печени даже при высоком уровне запасов железа. Как указано в главе 18, различные наследственные формы первичного гемохроматоза ассоциируются с мутациями гепсидина или генов, регулирующих его экспрессию.
Железо, абсорбированное из кишечника, связывается с трансферрином плазмы и транспортируется в костный мозг,
где доставляется развивающимся эритроцитам и включается в гемоглобин.
Зрелые эритроциты поступают в кровоток, и через 120 сут их захватывают и разрушают макрофаги,
главным образом в селезенке, печени и костном мозге.
Там железо высвобождается из гемоглобина и включается в новый цикл, связываясь с трансферрином плазмы.
Количество абсорбируемого из кишечника железа сбалансировано его потерей за счет слущивания кератиноцитов,
энтероцитов и клеток эндометрия (у женщин).
б) Этиология. Причинами дефицита железа могут быть:
(1) недостаток железа в пище;
(2) нарушение абсорбции;
(3) повышенная потребность в железе;
(4) хроническая кровопотеря (что наиболее важно).
Чтобы поддерживать нормальный баланс железа, каждые сутки из пищи должно абсорбироваться 1 мг железа. Поскольку из поступающего с пищей железа абсорбируется только 10-15%, то ежедневно в организм взрослого мужчины должно поступать 7-10 мг железа, а взрослой женщины — 7-20 мг. Среднесуточный прием железа с пищей в западных странах составляет 15-20 мг, это количество для большинства мужчин избыточно, а для многих женщин — минимально необходимо. Биодоступность железа в пище — столь же важный фактор, как и его общий уровень.
Железо гема абсорбируется в гораздо большей степени, чем неорганическое железо, на абсорбцию которого влияют другие компоненты пищи. Абсорбцию неорганического железа повышают аскорбиновая кислота, лимонная кислота, аминокислоты и сахара, присутствующие в пище, а ингибируют абсорбцию соли дубильной кислоты (содержатся в чае), карбонаты, оксалаты и фосфаты.
Недостаток железа в пище редко встречается в развитых странах, где 65% алиментарного железа представлено в легко абсорбируемой гемовой форме, обеспечиваемой мясной пищей. Иное наблюдается в развивающихся странах, где источником железа служит в основном растительная пища, в которой оно присутствует в плохо абсорбируемой неорганической форме. Недостаток железа в пище отмечается в особых группах населения:
— грудные дети, составляющие группу высокого риска вследствие очень малого содержания железа в грудном молоке. Грудное молоко человека содержит лишь
0,3 мг/л железа. Количество железа в коровьем молоке в 2 раза выше, однако его биодоступность низкая;
— бедные люди, питание которых недостаточно в любом возрасте вследствие социально-экономических причин;
— пожилые люди, употребляющие мало мяса в силу низких доходов или плохого состояния зубов;
— подростки, употребляющие нездоровую (суррогатную) пищу.
Нарушение абсорбции происходит при спру, стеаторее и хронической диарее. Гастрэктомия ухудшает абсорбцию, уменьшая содержание соляной кислоты и время прохождения пищи через двенадцатиперстную кишку. Как указано ранее, на абсорбцию влияют также специфические компоненты пищи.
Повышенная потребность в железе служит важной причиной его дефицита у детей и подростков, а также у женщин во время беременности и в период предменопаузы. Женщины из бедных слоев общества, много и часто рожающие, имеют крайне высокий риск развития дефицита железа.
Наиболее распространенной причиной дефицита железа в западных странах является хроническая кровопотеря. Наружное кровотечение или геморрагии в желудочно-кишечный, мочевой либо половой тракты истощают запасы железа. При дефиците железа у взрослых мужчин и женщин после менопаузы в западных странах следует прежде всего думать о кровотечении в желудочно-кишечном тракте, если не доказано иное. Сразу же пытаться объяснить дефицит железа у таких лиц другими причинами — значит пропустить скрытый рак органов пищеварения или другое поражение с кровотечением.
При внимательном клиническом исследовании пациента с необъяснимой железодефицитной анемией иногда обнаруживают скрытое кровотечение или опухоль и тем самым спасают жизнь больного.
Показан захват железа эпителиальными клетками двенадцатиперстной кишки.
Если запасов железа в организме достаточно и эритропоэтическая активность в норме, уровень гепсидина в плазме повышается.
Это ведет к снижению уровня ферропортина и захватыванию абсорбированного железа,
которое утрачивается при слущивании эпителиальных клеток двенадцатиперстной кишки.
И наоборот, когда запасы железа в организме уменьшаются или усиливается эритропоэз,
уровень гепсидина падает и активность ферропортина возрастает,
в результате чего большее количество абсорбированного железа переносится на ферритин плазмы.
DMT1 — двухвалентный металлотранспортер 1.
в) Патогенез. Независимо от причин дефицит железа приводит к микроцитарной гипохромной анемии. В начале хронической кровопотери или развития других состояний на фоне отрицательного баланса железа его резервов в форме ферритина и гемосидерина может быть достаточно, чтобы поддержать нормальные уровни гемоглобина, гематокрита, железа в сыворотке и насыщение им трансферрина. В результате прогрессирующего истощения этих резервов сначала снижаются уровни железа в сыворотке и насыщения им трансферрина, не вызывая анемии. На этой ранней стадии возрастает эритроидная активность в костном мозге.
Анемия появляется лишь тогда, когда запасы железа истощены полностью, что сопровождается снижением содержания железа в сыворотке, ферритина и уровня насыщения железом трансферрина.
г) Морфология. В костном мозге повышается (от низкого уровня до умеренного) количество эритроидных клеток-предшественников. Диагностически важным признаком служит отсутствие железа в макрофагах костного мозга, лучше всего определяемое с помощью окрашивания аспиратов костного мозга берлинской лазурью. В мазках периферической крови эритроциты выглядят небольшими (микроцитарными) и бледными (гипохромными). Нормальные эритроциты с достаточным содержанием гемоглобина имеют центральную зону просветления величиной примерно 1/3 диаметра клетки.
При развившейся железодефицитной анемии эта зона увеличена, а гемоглобин виден лишь как узкий ободок. Характерным является также пойкилоцитоз.
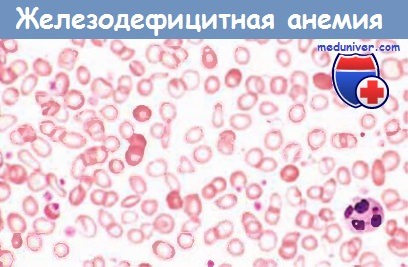
Обратите внимание на мелкие эритроциты с узким ободком из гемоглобина.
Некоторые из них имеют вытянутую форму («клетки-карандаши»).
От этих клеток разительно отличаются немногочисленные, содержащие нормальное количество гемоглобина эритроциты,
присутствующие в крови пациента после недавно проведенной гемотрансфузии.
д) Клинические признаки. Клинические проявления анемии неспецифичны и подробно были описаны ранее. Доминирующие признаки и симптомы часто обусловлены причинами развития анемии, например желудочно-кишечными или гинекологическими заболеваниями, недостаточным питанием, беременностью и мальабсорбцией. При тяжелом и продолжительном дефиците железа истощение железосодержащих ферментов в клетках всего организма проявляется также койлонихией (вогнутые ногти), алопецией, атрофическими изменениями языка и слизистой оболочки желудка и кишечной мальабсорбцией.
Снижение количества железа в центральной нервной системе может привести к извращению аппетита (пикацизму), при котором больные начинают употреблять в пищу несъедобные предметы, например глину, или такие пищевые ингредиенты, как мука. У больных периодически отмечаются движения нижних конечностей во время сна. Дегенерация мышц пищевода, микроцитарная гипохромная анемия и атрофический глоссит — триада главных признаков редкого синдрома Пламмера-Винсона.
Диагноз «железодефицитная анемия» основывают на данных лабораторных исследований. Уровни гемоглобина и гематокрита обычно умеренно снижены. Также наблюдаются микроцитоз, гипохромия и умеренная степень пойкилоцитоза. Содержание железа и ферритина в сыворотке снижено, а общая железосвязывающая способность плазмы, отражающая уровень трансферрина, высока. Низкий уровень железа в сыворотке в совокупности с повышенной железосвязывающей способностью плазмы приводит к падению насыщения трансферрина ниже 15%. Уменьшение запасов железа ингибирует синтез гепсидина, и его уровень в сыворотке снижается.
При неосложненном дефиците железа терапия железосодержащими препаратами per os примерно через 5-7 сут приводит к повышению количества ретикулоцитов, затем наблюдается постепенное увеличение количества эритроцитов и нормализация показателей красной крови.
источник
Весьма характерным является синдром сидеропенической дисфагии (синдром Пламмера-Вильсона), проявляющийся затруднением при глотании сухой и плотной пищи и, чувством першения и ощущения наличия инородного тела в глотке, «застревания пищи» при глотании. Рентгенологическая картина при этом синдроме характеризуется появлением перепончатого образования на границе глотки и пищевода, спастического втяжения на передней и боковой стенках глотки с некоторым ее расширением над местом сужения. Морфологическим субстратом этих нарушений глотания являются дистрофические изменения слизистой оболочки и мышечного слоя пищевода.
Это может быть и при скрытом дефиците железа. Установлено, что атрофические явления при дефиците железа возникают и в желудке, и в тонкой кишке. Это сопровождается снижением аппетита, отрыжкой, ощущением тяжести в животе после еды, тошнота.
У девочек, реже у взрослых женщин возможны дизурические расстройства, иногда недержание мочи при кашле, смехе, что придаст урологическую направленность обследования подобных пациентов. У детей могут наблюдаться симптомы ночного энуреза.
В механизме компенсации анемической гипоксемии при железодефицитной анемии ведущая роль принадлежит сердечно-сосудистой системе. При этом возникает компенсаторное напряжение кровообращения, благодаря чему увеличивается скорость кровотока, возрастает минутный объем крови и падает периферическое сопротивление. Больные железодефицитной анемией жалуются на одышку, сердцебиение, боль в груди, отеки. При снижении содержания гемоглобина у больных ишемической болезнью сердца (ИБС) могут учащаться приступы стенокардии, увеличивается потребность в нитроглицерине, снижается толерантность к физической нагрузке. В ряде случаев стенокардитические жалобы являются ведущими в клинической картине, в связи с чем больные госпитализируются по поводу нестабильной стенокардии или с подозрением на инфаркт миокарда. При наличии выраженной анемии могут появляться признаки сердечной недостаточности, характеризующейся увеличением минутного объема крови (анемическое сердце), а в случаях предшествующей сердечной недостаточности последняя на фоне развития анемии может усугубляться, становиться рефрактерной к лечению. У больных с дисциркуляторными энцефалопатиями, особенно в пожилом возрасте, на фоне развития ЖДА и тканевой гипоксии головного мозга наступает декомпенсация имеющегося сосудистого поражения головного мозга. При объективном исследовании определяются расширение границ сердечной тупости влево, систолический шум на верхушке и легочной артерии, «шум волчка» на яремной вене, тахикардия и гипотензия.
Изменения в миокарде при железодефицитной анемии зависят от глубины сидеропении и являются результатом нарушения биохимических процессов в мышце сердца в связи с уменьшением содержания железа, снижением активности железосодержащих ферментов, тканевого дыхания и соответствуют истинной дистрофии миокарда. Бледность кожных покровов встречается и при скрытом дефиците железа. Она зависит от состояния капиллярно-сосудистого ложа и обусловлена феноменом шунтирования — сбросом крови в более крупные сосуды кожи.
Патологическое влечение к поеданию различных часто несъедобных веществ («извращенный вкус») вызвано не самой анемией, а тканевым дефицитом железа, недостатком железодефицитных ферментов в различных тканях, в том числе и в центральной нервной системе.
При постановке диагноза железодефицитной анемии решающее значение имеют данные лабораторных исследований крови, костного мозга и обмена железа.
Картина крови характеризуется наличием признаков гипохромной микроцитарной анемии. Обнаруживается снижение концентрации гемоглобина. Количество эритроцитов вначале может быть нормальным. При значительном дефиците железа оно также снижается, но в меньшей степени, чем уровень гемоглобина. Отмечаются низкий цветовой показатель (0,7 — 0,5) и уменьшение средней концентрации гемоглобина в эритроцитах. Уменьшаются размер эритроцитов (микроцитов) и их насыщенность гемоглобином (гипохромия). В мазках крови преобладают небольшие гипохромные эритроциты, аннулоциты (эритроциты с отсутствием гемоглобина в центре, в виде колец), эритроциты неодинакового размера и формы (анизоцитоз, пойкилоцитоз). При тяжелых анемиях могут появляться отдельные эритробласты. Количество ретикулоцитов не изменено. Только при анемии, развившейся на фоне кровопотери, непосредственно после кровотечения количество ретикулоцитов повышается, что является важным признаком кровотечения. Осмотическая резистентность эритроцитов мало изменена или несколько повышена. Количество лейкоцитов имеет нерезко выраженную тенденцию к снижению.
Лейкоцитарная формула мало изменена. Количество тромбоцитов остается нормальным, а при кровотечениях несколько повышено.
В костном мозге при железодефицитной анемии можно обнаружить эритробластическую реакцию с задержкой созревания и гемоглобинизации эритробластов на уровне полихроматофильного нормоцита. Костный мозг в большинстве случаев гиперпластичен. Увеличивается соотношение клеток белого и красного ряда, количество последних преобладает. Эритробласты составляют 40 — 60 % всех клеток, во многих из них появляются дегенеративные изменения в виде вакуолизации цитоплазмы, пикноза ядер, отсутствует цитоплазма (голые ядра). Лейкопоэз характеризуется некоторым увеличением количества незрелых гранулоцитов. Стадии развития болезни основаны на лабораторных исследованиях. Регенераторная стадия: снижается количество гемоглобина, а количество эритроцитов — в пределах нормы. Цветной показатель будет низким. Содержание лейкоцитов, тромбоцитов — в пределах нормы. Отмечается анизоцитоз (микроцитоз), гипохромия эритроцитов, незначительный ретикулоцитоз. Выявляется эритробластоз (раздражение красного ростка).
Гипорегенераторная стадия: снижено количество гемоглобина и эритроцитов. Цветной показатель в пределах нормы (0,8—0,9). Содержание лейкоцитов, тромбоцитов несколько уменьшено, ретикулоцитоза нет. Микро- и макроцитоз (анизоцитоз) эритроцитов, анизохромия (гипо- и гиперхромия). Костный мозг клеточный, но не активный, снижено количество эритробластов, они различной формы (пойкилоцитоз) и различного размера (анизоцитоз).
Существует целый ряд тестов, позволяющих изучить динамику обмена железа в организме и ее нарушения.
Уровень железа в сыворотке крови здоровых людей, определяемый по методу Henry, составляет 0,7 — 1,7 мг/л, или 12,5 — 30,4 мкмоль/л, при дефиците железа он снижается до 0,1 — 0,3 мг/л, или 1,8 — 5,4 мкмоль/л.
Общая железосвязывающая способность плазмы крови (или общий трансферрин сыворотки) при железодефицитной анемии увеличивается (норма — 1,7 — 4,7 мг/л, или 30,6 — 84,6 мкмоль/л). Около 1/3 (30 — 35 %) всего количества трансферрина сыворотки связано с железом (показатель насыщения трансферрина железом). Остальное количество трансферрина свободно и характеризует скрытую железосвязывающую способность сыворотки крови. У больных с дефицитом железа процент насыщения трансферрином снижается до 10 — 20, при этом увеличивается скрытая железосвязывающаяся способность плазмы.
Больным анемией и при диагностике этого заболевания проводят десфераловый тест — определяют количество железа, выведенное с мочой после внутримышечного введения десферала. Этот показатель характеризует величину запаса железа в организме, у здоровых людей после введения 500 мг десферала выводится за сутки 0,8 — 1,3 мг железа, а при его дефиците — менее 0,4 мг.
Содержание ферритина в сыворотке крови является важным показателем запасов железа в организме. У здоровых людей концентрация ферритина составляет (106 ± 21,5) мкг/л у мужчин и (65 ± 18,6) мкг/л у женщин. При железодефицитной анемии содержание ферритина ниже 10 мкг/л.
Лабораторные критерии ЖДА: снижение уровня Hb 9 на литр).
3. Снижение цветного показателя (ниже 0.85).
4. Количество железа в сыворотке крови (негемоглобиновое железо). В норме 12-30 мкмоль в час. Определяется методом комплексования железа с бета-фенантронином.
5. Общая железосвязывающая способность сыворотки: измеряется количеством железа, которое может связать 100 мл или 1 л сыворотки крови, в норме она равняется 30 — 80 мкмоль на литр.
6. В норме свободный сидероферрин составляет 2/3 — 3/4 абсолютной способности сыворотки связывать железо.
Главными критериями железодефицитной анемии являются снижение количества железа в сыворотке крови и повышение общей железосвязывающей способности сыворотки.
После установления по клиническим и лабораторным данным железодефицитного характера анемии, необходимо определить причину малокровия. Следует учесть, что источник кровопотери может быть не один. Так, гиперполименоррея нередко сочетается с хронической кровопотерей из желудочно-кишечного тракта, что обусловлено язвенно-эрозивным поражением слизистой оболочки желудка. Систематическое донорство как причина ЖДА встречается в 6% случаев. Очень важно изучение профессионального анамнеза для выявления отрицательного влияния на кровь, так как отмечено более высокая частота анемий в группе лиц, имеющих контакт, например, с органическими растворителями.
Для установления причин и факторов, сопутствующих развитию анемии, часто необходимы:
источник
Расстановка ударений: АНЕМИ`Я
Анемия (anaemia; греч. отрицательная приставка an- и haima — кровь; син. малокровие) — состояние, характеризующееся уменьшением количества эритроцитов и снижением содержания гемоглобина в единице объема крови. При А. в периферической крови нередко обнаруживаются и качественные изменения эритроцитов — их величины, формы и окраски. При нек-рых А. в крови появляются ядерные предстадии эритроцитов (эритробласты, нормобласты, мегалобласты), незрелые формы эритроцитов (полихроматофилы), эритроциты, содержащие различные включения: цитоплазматические — сидероциты, базофильно- и аурофилъно-пунктированные эритроциты и ядерные — хроматиновые пылинки, кольца Кебота, тельца Жолли (цветн. табл., рис. 1).
12(фолиево)-дефицитной анемии (анентеральная спру-анемия). Анизопойкилоцитоз, гиперхромия, полихроматофилия эритроцитов. Рис. 3. Мегалобластическое кроветворение (стернальный пунктат) при анентеральной спру-анемии). Мегалобласты: 1 — полихроматофильный; 2 — в стадии митоза; 3 — оксифильный с «трефовым» ядром; 4 — оксифильный с пикнотическим ядром. Рис. 4. Метастатические раковые клетки (1) в костномозговом пунктате; 2 — нейтрофилы; 3 — эритроциты. Рис. 5. Эритроциты с базофильной пунктацией. Рис. 6. Костный мозг при железо-рефрактерной (сидероахрестической) анемии: 1 — грубозернистый кольцевидный сидеробласт; 2 — грубозернистые сидероциты. Рис. 7. Кровь ребенка при простой гипохромной алиментарной анемии: 1 и 3 — сегментоядерный нейтрофил; 2 — большой лимфоцит; 4 — ортохромный нормобласт. Пойкилоцитоз, анизоцитоз, олигохромемия. Рис. 8. Кровь ребенка при анемии Якша-Гайема: 1 — базофильный мегалобласт; 2 — полихроматофильный эритроцит; 3 — нейтрофильный миелоцит; 4 — полихроматофильный нормобласт; 5 — палочкоядерный нейтрофил. Пойкилоцитоз, анизоцитоз, олигохромемия. Рис. 9. Кровь ребенка при анемии на почве чрезмерного употребления козьего молока: 1 — лимфоцит; 2 — полихроматофильный эритроцит; 3 — базофильный нормобласт; 4 — полихроматофильный нормобласт; 5 — полихроматофильный пойкилоцит (эритроцит); 6 — кровяные пластинки. Пойкилоцитоз, анизоцитоз»>
Рис. 1. Различные формы эритроцитов крови при анемических состояниях: 1 и 2 — нормобласты в стадии кариорекеиса; 3 и 4 — энуклеация нормобластов путем выталкивания ядра; 5-9 — распад ядра с образованием телец Жолли в базофильно пунктированных эритроцитах (5 и 6) и полихроматофильных эритроцитах (7-9); 10 и 11-тельца Жолли в ортохромных эритроцитах (после спленэктомии); 12 — хроматиновые пылинки в эритроцитах; 13 — микроциты; 14 — полихроматофильный эритроцит (макроцит); 15 — нормоцит. Рис. 2. Кровь при гиперхромной мегалоцитарной B12(фолиево)-дефицитной анемии (анентеральная спру-анемия). Анизопойкилоцитоз, гиперхромия, полихроматофилия эритроцитов. Рис. 3. Мегалобластическое кроветворение (стернальный пунктат) при анентеральной спру-анемии). Мегалобласты: 1 — полихроматофильный; 2 — в стадии митоза; 3 — оксифильный с «трефовым» ядром; 4 — оксифильный с пикнотическим ядром. Рис. 4. Метастатические раковые клетки (1) в костномозговом пунктате; 2 — нейтрофилы; 3 — эритроциты. Рис. 5. Эритроциты с базофильной пунктацией. Рис. 6. Костный мозг при железо-рефрактерной (сидероахрестической) анемии: 1 — грубозернистый кольцевидный сидеробласт; 2 — грубозернистые сидероциты. Рис. 7. Кровь ребенка при простой гипохромной алиментарной анемии: 1 и 3 — сегментоядерный нейтрофил; 2 — большой лимфоцит; 4 — ортохромный нормобласт. Пойкилоцитоз, анизоцитоз, олигохромемия. Рис. 8. Кровь ребенка при анемии Якша-Гайема: 1 — базофильный мегалобласт; 2 — полихроматофильный эритроцит; 3 — нейтрофильный миелоцит; 4 — полихроматофильный нормобласт; 5 — палочкоядерный нейтрофил. Пойкилоцитоз, анизоцитоз, олигохромемия. Рис. 9. Кровь ребенка при анемии на почве чрезмерного употребления козьего молока: 1 — лимфоцит; 2 — полихроматофильный эритроцит; 3 — базофильный нормобласт; 4 — полихроматофильный нормобласт; 5 — полихроматофильный пойкилоцит (эритроцит); 6 — кровяные пластинки. Пойкилоцитоз, анизоцитоз
От истинной А. следует отличать гемодилюцию, т. е. разжижение крови за счет обильного притока тканевой жидкости, наблюдаемое, напр., у больных в период схождения отеков, после операции с применением искусственного кровообращения. Подобная псевдоанемия проходит по мере того, как исчезает вызвавший ее «отек крови». Истинная А. может маскироваться сгущением крови, напр., при обильной рвоте или профузных поносах; при этом вследствие уменьшения объема плазмы количество эритроцитов в единице объема крови может оказаться нормальным и даже повышенным.
Характерной особенностью истинной А. является либо абсолютное уменьшение массы эритроцитов — эритрона, либо функциональная недостаточность эритрона вследствие уменьшения содержания гемоглобина в каждом отдельном эритроците.
При малокровии в организме нарушаются окислительные процессы и развивается гипоксия (см.). На развитие гипоксии влияет не только степень малокровия, но и быстрота его развития, а также степень и быстрота адаптации организма к изменившимся условиям существования.
Клиницист нередко наблюдает несоответствие между тяжестью малокровия и активным состоянием больного, что объясняется компенсаторными механизмами, обеспечивающими физиологическую потребность тканей в кислороде.
Основная роль в компенсации анемического состояния принадлежит нервной и сердечно-сосудистой системам: гипоксия приводит к тому, что в кровь поступают недоокисленные продукты обмена веществ. Последние, воздействуя на центральную регуляцию кровообращения, а также на нервно-мышечный аппарат сердца, вызывают учащение сердечного ритма и ускорение кровотока, в результате чего минутный объем крови, выбрасываемой левым желудочком, увеличивается вдвое (до 8 л вместо 4 л в норме). Кроме того, при А. развивается спазм периферических сосудов и в кровеносное русло поступают кровяные резервы из тканевых депо, гл. обр. из подкожной клетчатки. В более легких случаях А. обеспечение тканей достаточным количеством кислорода достигается повышением физиологической активности эритроцитов и проницаемости капиллярной стенки для газов крови. Известное значение в компенсации гипоксии придают железосодержащим энзимам (цитохромоксидаза, каталаза), являющимся потенциальными носителями кислорода, а также процессам бескислородного дыхания при участии глутатиона.
Важнейшая роль в устранении А. и восстановлении нормального состава крови принадлежит костному мозгу, его эритропоэтической функции.
О состоянии эритропоэтической функции костного мозга судят по морфологической картине стернального пунктата (по методу М. И. Аринкина), в частности по количественному соотношению эритро- и лейкобластических элементов; в нормальных условиях это соотношение составляет 1:3 или 1:4. При повышенной регенерации красной крови, когда костный мозг функционирует преимущественно в направлении эритропоэза, соотношение эритро:лейко изменяется в пользу эритробластов, достигая 1:1 или 2:1 и даже 3:1.
В зависимости от преобладания в стернальном пунктате того или иного вида эритробластов различают следующие типы эритропоэза: а) эритробластический, б) пронормобластический, в) нормобластический, г) мегалобластический.
Завершающим этапом эритропоэтической функции костного мозга является процесс поступления зрелых, безъядерных эритроцитов из костного мозга в циркулирующую кровь. Эта важнейшая элиминирующая функция костного мозга выявляется динамическим исследованием основных показателей красной крови — содержания гемоглобина, количества эритроцитов и процента ретикулоцитов.
А. возникает либо когда убыль эритроцитов в крови (вследствие кровопотери или, кроворазрушения) на данном отрезке времени превышает максимальные возможности регенерации костного мозга, либо вследствие недостаточной эритропоэтической функции костного мозга. Последняя в свою очередь зависит либо от дефицита необходимых для нормального кроветворения веществ (железа, витамина B12, фолиевой к-ты — так наз. дефицитные анемии), либо от неусвоения (неиспользования) данных веществ костным мозгом (так наз. ахрестические анемии).
Патогенез нек-рых А. связан с генетическими особенностями: в одних случаях могут нарушаться энзимные структуры эритроцитов, что приводит к их повышенной чувствительности по отношению к различным внешним агентам (медикаментам, растительным продуктам) с последующим массивным внутрисосудистым гемолизом; в других случаях под влиянием наследственных или приобретенных факторов нарушается синтез тема (см. Гемоглобин), что приводит к состоянию ахрезии, т. е. неиспользованию ряда метаболитов, в первую очередь железа и витаминов кроветворения (витаминов B12, B6, фолиевой к-ты).
Разработано множество классификаций А. В соответствии с морфологическим и функциональным состоянием костного мозга, его способностью к регенерации и компенсации анемического состояния различают следующие формы А.: гиперрегенераторную, регенераторную (при острой кровопотере, гемолизе), гипорегенераторную (при хронической кровопотере), пшопластическую, апластическую (при панмиелофтизе), диспластическую или дизэритропоэтическую [при B12-(фолиево)дефицитных состояниях, врожденном многоядерном эритробластозе].
По классификации, предложенной Г. А. Алексеевым, различают три основные группы анемий: А. вследствие кровопотерь — постгеморрагические; А. вследствие нарушенного кровообразования; А. вследствие повышенного кроворазрушения — гемолитические (см. табл. на стр.517). Различают также острую и хрон. А.
При А. выявляется комплекс изменений, отражающих острую или хрон. недостаточность кровоснабжения. Характер изменений зависит от формы А., фазы развития и проводимой терапии. Макроскопически отмечается бледность и нередко желтушность кожи. При хрон. А. отмечается развитие подкожной жировой клетчатки, жировой ткани в брыжейке, сальнике и вокруг внутренних органов. Мышца сердца дряблая, тусклая, в области папиллярных мышц может наблюдаться желтый крап. Печень на разрезе бледно-серого цвета, рисунок долек стерт. Селезенка часто уменьшена в размерах, капсула морщиниста, на разрезе пульпа дает соскоб. В толще жировой ткани брыжеек могут выявляться множественные мелкие (0,3—0,4 см в диаметре) лимф, узлы темно-красного цвета. Костный мозг плоских костей обычного вида, в средней и нижней трети бедра жировой, с участками кроветворения розово-красного цвета. Иногда костный мозг становится деятельным на всем протяжении бедра. Микроскопическое исследование выявляет жировую дистрофию в мышце сердца и в печени, а также отложение липидов в цитоплазме клеток эндотелия сосудов головного мозга, паренхиматозных органов. Обнаруживаемые в костном мозге изменения различны в зависимости от остроты и формы процесса и эффективности проведенного лечения. Гистологическое исследование биопсий костного мозга позволяет уточнить степень его поражения и способствует дифференциации с другими заболеваниями. Изучение биопсий костного мозга в динамике болезни позволяет установить эффективность терапии и активность процессов регенерации костного мозга.
| Патогенетическая группировка | Основные формы |
|---|---|
| I. Анемии вследствие кровопотерь (постгеморрагические) | а) Острая постгеморрагическая (нормохромная) анемия б) Хроническая постгеморрагическая (гипохромная)анемия |
| II. Анемии вследствие нарушенного кровообразования | |
| А. Железодефицитные анемии | Гипохромные анемии |
| 1. Экзогенная (алиментарная) недостаточность железа | Нутритивная (алиментарная) железодефицитная анемия детского возраста |
| 2. Экзогенная недостаточность железа в связи с повышенными запросами организма | а) Ювенильный хлороз б) Железодефицитная анемия беременных и кормящих женщин в) Инфекционная анемия |
| 3. Резорбционная недостаточность железа (при патологических состояниях желудочно-кишечного тракта), «хирургические» железодефицитные анемии | а) Агастрическая железодефицитная анемия (после резекции желудка) б) Аненторальная железодефицитная анемия (после резекции кишечника) |
| Б. Железорефрактерные (син. сидероахрестические) анемии | а) Наследственная б) Приобретенная |
| В. B12-(фолиево)дефицитные, пернициозные анемии | Мегалобластные гиперхромные анемии |
| 1. Экзогенная недостаточность витамина B12-(фолиевой кислоты) | а) Нутритивная (алиментарная) B12-(фолиево)дефицитная анемия детей при вскармливании козьим молоком, молочным порошком б) Радиационная B12-(фолиево)дефицитная анемия в) Медикаментозная (фенобарбиталовая) B12-(фолиево)дефицитная анемия |
| 2. Эндогенная недостаточность витамина B12-(фолиевой кислоты) вследствие нарушенной ассимиляции пищевого витамина B12; вследствие выпадения секреции желудочного мукопротеина | а) Пернициозная (B12-дефицитная) анемия Аддисона—Бирмера б) Симптоматическая анемия пернициозного (B12-дефицитного) типа при раке, сифилисе, лимфогранулематозе, полипозе желудка, ожогах (коррозивный гастрит), азотемии (экскреторный гастрит) в) Агастрическая анемия пернициозного (B12-дефицитного) типа (гастрэктомия, субтотальная резекция желудка, эзофагоеюно-анастомоз) |
| 3. Нарушенная ассимиляция витамина B12-(фолиевой кислоты) в кишечнике | а) Глистная (дифиллоботриозная) перющиозная B12-(фолиево)дефицитная анемия б) B12-(фолиево)дефицитная спру-анемия, целиакия в) Анентеральная B12-(фолиево) дефицитная анемия (резекция тонкой кишки, дивертикул слепой кишки, терминальный илеит) |
| 4. Повышенное расходование витамина B12-(фолиевой кислоты) | а) Пернициозная B12-(фолиево)дефицитная анемия беременных б) Симптоматическая макроцитарная B12-(фолисво)дефицитная анемия при циррозах печени |
| Г. B12-(фолиево) ахрестические анемии вследствие нарушенной ассимиляции витамина B12-(фолиевой кислоты) костным мозгом | Гиперхромная мегалобластная анемия |
| Д. Дизэритропоэтические анемии, анемии вследствие неэффективного эритропоэза | а) Врожденная (семейно-наследственная) дизэритропоэтическая анемия. Врожденный многоядерный эритробластоз б) Приобретенная дизэритропоэтическая анемия («прелейкозное» состояние) |
| Е. Гипопластические анемии | |
| 1. Воздействие экзогенных факторов (миелотоксическая) | а) Радиационная б) Бензольная в) Медикаментозная |
| 2. Эндогенная аплазия костного мозга | а) Семейная апластическая анемия (Фанкони) б) Детская апластическая анемия (Даймонда—Блекфена) в) Гипоапластическая анемия (Эрлиха) г) Остеопетоозная анемия («мраморная болезнь») |
| Ж. Метапластические анемии вследствие замещения костного мозга | Анемии при лейкозах, миелокарципозах |
| III. Анемии вследствие повышенного кроворазрушения (гемолитические) | |
| А. Анемии, обусловленные экзоэритроцитарными гемолитическими факторами | а) Токсические: при отравлениях гемолитическими ядами (мышьяковистый водород, фосфор, фенилгидразин, сапонины, змеиный яд, грибной яд), при тяжелых ожогах; б) Инфекционные: при малярии, сепсисе (анаэробном, стрептококковом) в) Посттрапсфузионные: вследствие переливания группонесовместимой или резуснесовместимой крови г) Иммунные: изоиммунная гемолитическая болезнь («эритробластоз» плода и новорожденных); аутоиммунные: хроничеолая приобретенная гемолитическая болезнь (Гайема—Видаля), симптоматические — спленогенные при хроническом лимфолейкозе, карциноматозе костного мозга, вирусных инфекциях д) Пароксизмальная холодовая гемоглобинурия е) Механические: в связи с операциями протезирования клапанов и перегородки сердца |
| Б. Анемии, обусловленные эндоэритроцитарными факторами | |
| 1. Эритроцитопатии | а) Врожденные (наследственно-семейные): 1) микросфероцитарная гемолитическая анемия(Минковского—Шоффара); 2) овалоцитарная гемолитическая анемия б) Приобретенная хроническая гемолитическая анемия с постоянной гемосидершгурней и пароксизмальной ночной гемоглобинурией (болезнь Штрюбпнга—Маркиафавы—Микели) |
| 2. Эритроцитоэнзимопении | а) Дефицит глюкозо-6-фосфат-дегицрогеназы: острые гемолитические кризы с гсмоглобинурией, спровоцированные медикаментами, вирусами, растениями (фавизм) б) Дефицит пируваткиназы: врожденная хроническая «несфероцитарная» гемолитическая анемия |
| 3. Гемоглобинопатии | а) β-Талассемии (большая, малая, минимальная) б) α-Талассемия (Н-гемоглобинопатия) в) Дрепаноцитоз (S-гемоглобинопатия, серповидпоклеточиая анемия) г) С-, D-, Е- и другие гемоглобинопатии |
Симптомы заболевания бывают более или менее выражены в зависимости от степени анемизации и адаптации больного. Обычно отмечается слабость, быстрая утомляемость, одышка и сердцебиение при физической нагрузке, бледность кожи и слизистых оболочек. При глубокой А., особенно при ее быстром развитии, возникают частые головокружения, шум в ушах, нарушение зрения в виде мелькания «мушек» перед глазами, снижение остроты зрения, иногда вплоть до полного амавроза в связи с нарушением питания зрительных нервов в результате гипоксии. При выслушивании сердца определяется «дующий» систолический шум у верхушки и на соустьях, возникающий в результате гидремии и компенсаторного ускорения кровотока.
Анемия агастрическая возникает обычно после полного удаления (гастрэктомип) или субтотальной резекции желудка. Частичная резекция, широко применяемая при язве желудка, как правило, не сопровождается А. Лишь у части больных (преимущественно у женщин) наблюдается железодефицитная А.
Агастрическая А. бывает железодефицитная и B12-(фолиево)дефицитная; проявляется обычно в сроки от 3 до 5 лет после операции гастрэктомии, иногда раньше — через 1— 1 /2 года.
От классической пернициозной анемии Аддисона—Бирмера агастрическая B12-дефицитная А. отличается меньшей выраженностью симптомов внутрикостномозгового гемолиза (на почве дизэритропоэза).
Лечение агастрической А. проводится по тем же принципам, что и лечение пернициозной анемии (см.) пли железодефицитной анемии (см.).
Профилактика агастрической А. заключается в своевременном (еще до развития явлений B12-недостаточности) назначении витамина B12 в инъекциях до 100—200 мкг 1—2 раза в месяц, начиная с первых месяцев после операции. Препараты железа применяют по показаниям (при гипохромии эритроцитов, сидеропении).
Анемия анкилостомная вызывается паразитическими червями из класса нематод — анкилостомами (см. Анкилостомидозы). Гризингер (W. Griesinger, 1854) показал, что анкилостомы являются возбудителями так наз. египетского хлороза; «горная анемия», или анемия шахтеров, наблюдавшаяся как массовое заболевание землекопов, работавших при прокладывании Сен-Готардского туннеля, была также анкилостомного происхождения. Патогенез анкилостомной А. связан с потерей крови. Она протекает по типу железодефицитной А. с низким цветным показателем (0,4—0,6), микроцитозом и умеренным ретикулоцито-зом. В тяжелых случаях количество гемоглобина падает до 2—3 г%. Картина белой крови характеризуется лейкопенией и высокой эози-нофилией (до 74%). Диагноз ставят на основании обнаружения яиц анкилостом в фекалиях или дуоденальном содержимом; в последнем можно обнаружить и живые половозрелые особи. Важнейшим лечебным и профилактическим мероприятием является дегельминтизация (см.), при выраженной А. — после предварительного курса антианемического лечения большими дозами железа.
Анемия анентеральная. Под этим названием объединяют различные формы А., связанные с нарушением всасывания в тонкой кишке белков, минералов и витаминов. Наиболее известны пернициозно-анемические состояния, возникающие при затяжных энтеритах, особенно при спру (так наз. пернициозная спру-анемия — цветн. табл., рис. 2 и 3). Пернициозоподобные А. возникают нередко в связи с органическими поражениями кишечника (полипоз, злокачественные опухоли, ретикулосаркоматоз, лимфогранулематоз), при дивертикулах, стриктурах и обширных резекциях тонкой, особенно подвздошной, кишки, при региональных (терминальных) илеитах. Патогенез B12-дефицитной А. в последних случаях связывают с выпадением функции кишечного белка-акцептора. В происхождении этих форм А. имеет значение нарушение всасывания в пораженном кишечнике как железа, так и антианемических факторов — витамина B12, фолиевой к-ты. Имеет значение и дисбактериоз, в результате к-рого нарушаются процессы биосинтеза фолиевой к-ты молочнокислыми бактериями, а размножающаяся в тонкой кишке кишечная палочка конкурирует с макроорганизмом в использовании пищевого витамина B12 и фолиевой к-ты.
Поражения тонкой кишки, сопровождающиеся общей (белковой, минеральной и поливитаминной) недостаточностью, ведут к возникновению смешанной, B12-(фолиево)-железодефицитной, А. Известны также анентеральные железодефицитные А., протекающие по типу хлороза, с низким цветным показателем, низким содержанием железа плазмы, но с макроцитозом эритроцитов.
Лечение анентеральных А. проводят по общим правилам лечения железо-, витамино, B12-(фолиево)дефицитных анемий. Учитывая нарушение кишечной абсорбции, все антианемические препараты следует назначать парентерально.
Анемия ахрестическая (Израэльса—Уилкинсона болезнь) возникает вследствие того, что костный мозг не в состоянии использовать имеющиеся в организме антианемические субстанции. В наст. время рассматривается нек-рыми учеными как эритромиелоз (см.).
Анемия B12-(фолиево)дефицитная. Под этим названием объединяют группу анемических состояний различной этиологии, возникающих в результате недостаточности витамина B12 и (или) фолиевой к-ты, для к-рых характерно, в частности, повышение цветного показателя (1,2—1,8) и появление патологических форм эритроцитов (цветн. табл., рис. 2). См. Пернициозная анемия.
Анемия бензольная — см. Гипопластическая анемия.
Анемия гемолитическая — см. Гемолитическая анемия.
Анемия гипохромная — см. Железодефицитная анемия.
Анемия гиперхромная — см. Пернициозная анемия.
Анемия гипорегенераторная чаще всего возникает как конечная стадия хрон. постгеморрагической А., а также в связи с общей интоксикацией, кахексией и истощением необходимых для построения эритроцитов субстанций — железа, белков, витаминов, микроэлементов. Картина крови при гипорегенераторной А. характеризуется нормо- или гипохромазией, редко гиперхромазией, с выраженными дегенеративными изменениями эритроцитов (анизо- или нойкилоцитоз) при нормальном или незначительно пониженном количестве лейкоцитов (гранулоцитов) и нормальном количестве кровяных пластинок.
Отличие гипорегенераторной А. от собственно гипопластической А. заключается в следующем: 1) как правило, первичным моментом в развитии гипорегенераторной А. является кровотечение, следовательно, патогенетически эта анемия — постгеморрагическая; 2) гипорегенераторная А. никогда не переходит в полную аплазию; 3) костномозговое кроветворение больше соответствует состоянию гипорегенерации (а не гипоплазии); среди эритробластов преобладают базофильные формы; следовательно, имеется не аплазия родоначальных элементов эритропоэза, а истощение фондов железа, белков и витаминов, необходимых для построения зрелых форм красной крови; 4) данное состояние обратимо: длительное и систематическое комплексное лечение выводит костный мозг из торпидного состояния, наступает практическое выздоровление.
Анемия дизэритропоэтическая — см. Дизэритропоэтическая анемия.
Анемия дифиллоботриозная. Этиологическая роль широкого лентеца в развитии А. доказана излечением больных после изгнания паразита, на что впервые обратил внимание С. П. Боткин (1884). Исследование желудочного сока у лиц, инвазированных широким лентецом, показало нормальное содержание внутреннего антианемического фактора. Возникновение А. связывают с нарушением усвоения или разрушением антианемических веществ (витамина B12, фолиевой к-ты). Картина крови в разгар болезни аналогична таковой при пернициозной А. и отличается лишь выраженной эозинофилией (до 30—40%). Костномозговое кроветворение представляет картину мегалобластического эритропоэза. Лечение глистной А. сводится к изгнанию паразита. При истинной дифиллоботриозной А. после дегельминтизации больные быстро выздоравливают без специальной антианемической терапии. При тяжелом течении необходима предшествующая антианемическая терапия (витамин B12), эффект к-рой проявляется еще до изгнания паразита. Профилактика заключается в предупреждении глистных инвазий.
Анемия железодефицитная — см. Железодефицитная анемия.
Анемия железорефрактерная (цветн. табл., рис. 6) — общее название для обширной группы анемических состояний, объединяемых по признаку высокого содержания железа в плазме и рефрактерности к лечению железом, подробнее — см. Железорефрактерная анемия.
Анемия Ледерера — см. Гемолитическая анемия.
Анемия медикаментозная — не столь частое явление, если принять во внимание современные масштабы применения химиотерапевтических средств и антибиотиков. В широком плане различают две группы лекарственных А.
К первой группе относят миелотоксические А., возникающие в связи с цитостатической (химио- или лучевой) терапией, проводимой по поводу опухолевого заболевания или системной патологии крови. Потенциально любое цитостатическое средство, обладающее миелодепрессивным действием, способно вызвать А. гипопластического типа. Ко второй группе относят медикаментозные А., возникновение к-рых связано с индивидуально повышенной чувствительностью организма к определенным лекарственным веществам.
Большинство медикаментозных А. рассматривают либо в плане антивитаминной активности препарата, либо в аспекте аутоиммунной агрессии, где лекарство играет роль гаптена (см. Антигены), либо в аспекте индивидуальной неполноценности энзимных структур эритроцитов, обусловливающей «гемолитическую готовность» в связи с приемом нек-рых медикаментов. При длительном применении массивных доз сульфаниламидов и нек-рых антибиотиков (биомицина, хлорамфеникола, синтомицина, левомицетина) проявляется бактериостатическое действие данных препаратов на микробную флору тонкой кишки; в результате дисбактериоза нарушается биосинтез ряда витаминов, в частности фолиевой к-ты.
Представляют интерес B12-(фолиево) дефицитные А., спровоцированные приемом некоторых противомалярийных, (дараприм) и противоэпилептических средств — дифенина (дифенил-гидантоина, фенитоина), гексамидина (примидона), мезантоина, люминала (фенобарбитала) и других барбитуратов, а также фурадонина (нитрофурантоина) и бутадиена (фенилбутазона). Патогенетическая связь А. с антифолиевой активностью данных препаратов доказывается понижением концентрации фолиевой к-ты в крови лиц, принимавших их, и положительным эффектом лечения фолиевой к-той (в дозах 50—100 мг в день). Менее эффективно лечение витамином B12.
B12-(фолиево)дефицитная А. медикаментозного генеза сопровождается признаками недостаточности витаминов группы В, в частности фолиевой и никотиновой кислот (глоссит, гиперкератоз, понос, изменения психики), чаще развивается у слабых, истощенных больных.
От классической пернициозной анемии Аддисона—Бирмера медикаментозная B12-(фолиево)дефицитная А. отличается сохранностью желудочной секреции, нормальной концентрацией витамина B12 в крови (при нормальной абсорбции меченного по кобальту витамина B12 в кишечнике) и отсутствием неврологических симптомов.
Имеются описания А., возникающей в связи с приемом противотуберкулезных препаратов. Патогенез этой А. сложный; есть основания рассматривать ее как железорефрактерную анемию, обусловленную нарушением синтеза тема в связи с расстройством обмена витамина B6(пиридоксин-пиридоксаль-фосфата).
Лечение медикаментозных А. заключается в прекращении приема препарата, вызвавшего А., и введении фолиевой к-ты.
Анемия медикаментозная гемолитическая (энзимодефицитная) — см. Энзимопеническая анемия.
Анемия миелотоксическая — А. вследствие токсического угнетения костного мозга при различных экзогенных (бензол) и эндогенных (при поражении почек, печени) интоксикациях (см. Гипопластическая анемия).
Анемия мишеневидноклеточная — см. Талассемия.
Анемия пернициозная — см. Пернициозная анемия.
Анемия при почечной недостаточности в большинстве случаев носит гипохромный характер,свойственный железодефицитной А. У нек-рых больных развивается гиперхромная пернициозоподобная А. Отмечается нейтрофильный лейкоцитоз (с сохранением эозинофилов), при уремии до 12000—20000 в 1 мкл. Известную роль в развитии А. при почечной недостаточности играет поражение жел.-киш. тракта. В свете данных об эритропоэтинах (см.) высказывается мнение, что причиной А. при почечной недостаточности является нарушение функции юкстагломерулярного аппарата почек. Согласно другим авторам, установившим тормозящее влияние сыворотки крови почечных больных на пролиферативную активность эритробластов костного мозга, А. при почечной недостаточности возникает под влиянием накопления в крови ингибиторов эритропоэтина. Инактивация ингибиторов эритропоэтина связана с неизвестной еще функцией почек.
Лечение — витаминотерапия, переливание эритроцитной массы. В перспективе — разработка получения эритропоэтинов.
Анемия при поражениях печени. При хрон. диффузных поражениях печени (гепатиты), независимо от этиологии процесса, возникает макроцитарная А. нормохромного или умеренно гиперхромного типа, что связано с нарушением депонирования и утилизации витамина B12, а также фолиевой к-ты. При подострой дистрофии печени макроцитарная А. гиперхромного типа является одним из важнейших показателей тяжелого нарушения функции печени и имеет серьезное прогностическое значение.
Развитие тяжелой пернициозоподобной А. при метастатическом раке печени может служить указанием на первичную локализацию рака в желудке.
При хрон. активных (так наз. люпоидных) гепатитах, циррозах печени, развивающихся по аутоагрессивному механизму, нередко возникает гемолитическая А., протекающая по типу приобретенного аутоиммунного гемолиза, с положительной прямой пробой Кумбса (см. Кумбса реакция).
Анемия при метастазах рака в костный мозг чаще всего развивается при раке предстательной, молочной, щитовидной желез, раке легких, гипернефроме. При метастазировании злокачественной опухоли в костный мозг (миелокарциноз) синдром А. занимает ведущее место в клинической картине заболевания. Исходный очаг процесса (опухоль, давшая метастаз рака в кость) нередко настолько мал, что никакими методами исследования не выявляется. Отличительными особенностями этой А. являются необычайно выраженный эритронормобластоз и лейкемоидная картина крови. Однако в трети случаев, даже при очень значительном распространении метастазов по костям, лейкемоидная реакция может не наблюдаться. Картина крови зависит не только от механического фактора — имплантации в костный мозг раковых клеток, но и от реактивности костного мозга. Между типом опухоли и характером реакции костного мозга не существует видимой связи.
Стернальная пункция (см.) дает возможность диагностировать метастазы в костный мозг даже при отсутствии клинических данных (цветн. табл., рис. 4). Цитологическая диагностика не представляет особых трудностей; наиболее важным признаком раковых клеток является их атипия по сравнению с окружающей миелоидной тканью. Наряду с атипическими, не свойственными костному мозгу клетками, в костномозговом пунктате встречаются неопластические клетки, к-рые в условиях среды костного мозга подвергаются своеобразной метаплазии, приобретая нек-рые свойства миелоидных элементов, в частности азурофильную зернистость. При диффузной метаплазии костного мозга инородной тканью картина крови может приближаться к той, какая наблюдается при хрон. миелолейкозе или остром миелобластном лейкозе (см.).
Анемия свинцовая развивается под влиянием интоксикации организма свинцом (см.) или его соединениями. В наст. время рассматривается как прототип А., связанной с нарушением синтеза тема.
Римингтон (Rimington, 1938) впервые высказал мнение о том, что свинец препятствует вхождению железа в порфириновое кольцо и тем самым нарушает формирование тема из про-топорфирина и железа. Современные исследователи обнаружили в моче больных свинцовой А. значительное содержание δ-аминолевулиновой к-ты (δ-АЛК). Свинец, блокируя ферментные системы, участвующие в синтезе порфиринов, тормозит синтез тема и на более ранней стадии — образование из δ-АЛК порфобилиногена. Как полагают, основная сущность токсического действия свинца заключается в блокировании сульфгидрильных групп ферментов. Непосредственную роль в нарушении синтеза тема играет подавление активности следующих ферментных систем: дегидразы δ-АЛК, декарбоксилазы уропорфириногена, гемсинтетазы. Следствием (не причиной!) неполноценного кроветворения является укорочение жизненного цикла эритроцитов и ускоренный эритролиз, сопровождающийся симптомами квазигемолитической желтухи (гипербилирубинемия, уробилинурия, повышенное содержание стеркобилина в кале).
Клиническая картина свинцовой интоксикации многообразна: симптомы поражения жел.-киш. тракта, нервной и сердечно-сосудистой систем, кроветворных органов. Уже в начальной стадии и при легкой степени свинцовой интоксикации картина крови (цветн. табл., рис. 5) обнаруживает характерные изменения в виде значительного ретикулоцитоза и базофильной пунк-тации эритроцитов. При более выраженной интоксикации развивается А. обычно гипохромного типа, со снижением гемоглобина в тяжелых случаях до 8—6 г%. Наряду с выраженной гипохромией эритроцитов отмечается высокое содержание железа в сыворотке. Костномозговой пунктат характеризуется выраженной эритронормобластической реакцией и сидеробластозом с преобладанием кольцевидных форм.
Диагноз свинцовой интоксикации ставят на основании анамнеза, характерной картины крови (базофильная пунктация эритроцитов и гиперретикулоцитоз, неадекватные степени анемии и гемолиза); окончательно подтверждается обнаружением в моче свинца; особенно большие количества свинца (до 2 мг на 1 л мочи) выделяются после введения комплексона. Известное диагностическое значение, особенно на ранней стадии свинцовой интоксикации, может иметь обнаружение в моче δ-аминолевулиновой к-ты, являющейся наиболее ранним биохимическим признаком нарушенного синтеза тема.
Для лечения в качестве специфического антидота применяют комплексен — динатрийкальциевую соль этилендиаминтетрауксусной к-ты (тетацин-кальций), образующую со свинцом прочный комплекс, легко удаляемый из организма. Препарат вводят в вену в виде 10% раствора по 20 мл ежедневно в течение 5 дней. Обычно проводят 3—4 курса с 4—5-дневными интервалами. Применяют и другие комплексоны: комплецин — внутрь в таблетках (по 2 г через день в течение 20 дней) или в вену (в виде 10% раствора по 20 мл в день в течение 5 дней), Д-пеницилламин (в вену в разовой дозе 1 г).
Разработанная в СССР система диспансерного наблюдения за работниками производств, связанных с добычей, выплавкой или применением свинца, способствует своевременному выявлению легких форм и предупреждению тяжелых форм свинцовой интоксикации.
Анемия серповидноклеточная — см. Серповидноклеточная анемия.
Анемия спленогенная рассматривается в наст. время как первая стадия системного заболевания селезенки, печени и костного мозга, так наз. миело-гепато-лиенального синдрома, или Банти синдрома (см.). Картина периферической крови характеризуется панцитопенией, т. е. количественным уменьшением всех клеточных форм. При этом собственно анемия, т. е. эритроцитопения, не столь выражена; нередко на первый план выступает лейкопения (так наз. селезеночная гиполейкия) или тромбоцитопения, к-рой иногда сопутствует геморрагический диатез (см. Пурпура тромбоцитопеническая). От собственно спленогенной А. следует отличать А., развивающуюся вследствие жел.-киш. кровотечений на почве тромбоза селезеночной вены у больных с тромбофлебитической спленомегалией (см.). При спленогенной А. показана операция удаления селезенки, однако показания к операции должны рассматриваться индивидуально.
Анемия сфероцитарная — см. Гемолитическая анемия.
Анемия тиреопривная развивается на почве гипотиреоза (см.). Различают три вида тиреопривной А.: нормохромную, гипохромную, гиперхромную (пернициозоподобную). Полагают, что дефицит тироксина приводит к расстройству утилизации специфических факторов кроветворения (железа, фолиевой к-ты, витамина B12).
Анемию при зобе Хасимото (см. Хасимото болезнь) рассматривают в наст, время в аспекте аутоиммунного конфликта. В этой связи сочетание гипотиреоза с пернициозной (B12-дефицитной) А. может быть истолковано как результат органоспецифической иммунизации, что доказывается обнаружением антител направленного действия как против клеток щитовидной железы (тиреоглобулина), так и против париетальных клеток фундальных желез (внутреннего фактора Касла).
При А., протекающей на фоне гипотиреоза, наилучший лечебный эффект достигается применением железа и цианокобаламина (витамина B12 в обычной дозировке) в сочетании с тиреоидином (0,1—0,2 г 3 раза в день).
В раннем возрасте А. наблюдается очень часто, что объясняется функциональной лабильностью кроветворного аппарата ребенка. Даже незначительные и недлительные погрешности в питании, неблагоприятные условия быта, недостаточное использование свежего воздуха и дневного света, случайные заболевания и т. д. легко вызывают А., причем большое значение имеют индивидуальные особенности ребенка; велика роль наследственности. Нарушенный гемопоэз у детей, особенно в первые годы жизни, приобретает черты эмбрионального типа со склонностью к развитию лейкемоидных реакций. Вместе с тем при устранении причины, вызвавшей А., отмечается выраженная способность кроветворного аппарата к регенерации и восстановлению нормального состава крови.
Алиментарная анемия обычно наблюдается у детей 6—18 мес., получающих однообразную молочную или мучную пищу (цветн. табл., рис. 7).
По клинической картине различают формы легкие, когда общее состояние ребенка почти не нарушено, средней тяжести и тяжелые. При А. средней тяжести отмечается общая пастозность, бледность кожи и слизистых оболочек, увеличение живота, умеренная гиперплазия лимф, узлов и миндалин, запоры. Количество гемоглобина понижается до 8—10 г%, число эритроцитов — до 4000000, редко до 3000000, цветной показатель 0,5—0,7; полихроматофилия, умеренный ретикулоцитоз, единичные нормобласты; число лейкоцитов, лейкоцитарная формула, тромбоциты — в пределах нормы. Сочетание алиментарного фактора с инфекцией значительно ухудшает течение А.
Тяжелая форма А. (алиментарно-инфекционная, анемия Якша—Гайема; цветн. табл., рис. 8) в наст, время почти не встречается. Общее состояние ребенка тяжелое, слизистые оболочки очень бледны, кожа восковидного или желтоватого цвета с кровоизлияниями, почти всегда наблюдается тяжелый рахит, печень и селезенка сильно увеличены; количество гемоглобина и число эритроцитов резко снижены, число лейкоцитов достигает 15—20 тыс., иногда больше, в лейкоцитарной формуле преобладают лимфоциты или нейтрофилы, много ядерных форм эритроцитов и незрелых форм нейтрофильных лейкоцитов.
Иногда алиментарная А. по общей клинической и гематологической картине (цветн. табл., рис. 9) сближается с пернициозной; описывают ее под названием псевдопер-нициозной или алиментарной (нутритивной) мегалобластической А., к-рая развивается на почве однообразного вскармливания козьим молоком или сухими молочными смесями. В патогенезе — недостаточное количество в пище фолиевой к-ты и витамина B12; имеет значение и дефицит витамина C, принимающего участие в образовании из фолиевой к-ты тетрагидрофолиевой; недостаточная продукция гастромукопротеина, нарушение кислотно-щелочного равновесия, аутоинтоксикация в результате усиленных процессов гниения в кишечнике. Дети беспокойны, плохо едят, прибавка в весе недостаточна, слизистые оболочки бледны, кожа с сероватым оттенком; печень и селезенка увеличены. А. нормо-, иногда гиперхромного, реже гипохромыого характера.
Число эритроцитов может уменьшаться до 1000000 и ниже, анизоцитоз, пойкилоцитоз, ядерные формы эритроцитов, ретикулоцнтов мало, базофильная зернистость в эритроцитах, реже — единичные мегалобласты, тельца Жолли, кольца Кебота. Число лейкоцитов несколько снижено или в пределах нормы, наклонность к гиперсегментации нейтрофильных лейкоцитов; число тромбоцитов снижено, нередко снижен также уровень железа сыворотки; в картине миелограммы — усиленный мегалобластический эритропоэз.
Такой же характер А. бывает при целиакии (см.) и других заболеваниях кишечника, когда нарушаются процессы всасывания; относительно часто болеют недоношенные дети (см.).
В лечении главное — рациональное питание с достаточным содержанием белков, витаминов, железа. Показаны препараты с аскорбиновой к-той, способствующей стабилизации легко усвояемого двухвалентного железа, и 1—2% раствором разведенной соляной к-ты, необходимой для ассимиляции пищевого железа. Восстановленное железо дают по 0,1—0,3 г 3—4 раза в день; соли двухвалентного железа (глюконат и аскорбинат железа) — по 0,2—0,5 г 2—3 раза в день, они не уступают по эффективности восстановленному железу и не вызывают у детей диспептических явлений. При затруднениях в приеме порошков и таблеток можно назначать 10% водный раствор лимонно-аммиачного железа по 1 чайы. л. 2—3 раза в день. Хорошее действие оказывает гемостимулин (см.), к-рый применяют по 0,25—0,5 г 3 раза в день. Препараты железа целесообразно назначать в промежутках между приемами пищи. Перед и сразу после приема железа не рекомендуется давать чай, жирные и мучные продукты во избежание образования нерастворимых соединений. При упорных А. более эффективно комбинированное лечение препаратами железа и витамина B12 по 50—100 мкг через день, 10—15 инъекций. При непереносимости приема препаратов перорально и нарушении всасывания может быть применен ферковен по 1—2 мл внутривенно только в стационарных условиях. В резистентных случаях применяют трансфузию зритроцитной массы по 30—75 мл ежедневно 5—7 дней.
Анемия Фанкони — врожденная семейная панцитопения, отчетливо выявляющаяся чаще всего в возрасте 5—7 лет, — см. Гипопластическая анемия.
Семейная гипопластическая анемия Эстрена—Дамешека — см. Гипопластическая анемия.
Анемия Даймонда—Блекфана — см. Гипопластическая анемия.
Пернициозная анемия типа Аддисона—Бирмера у детей наблюдается крайне редко — см. Пернициозная анемия.
В последнее время описано несколько редких форм пернициозопо-добных А., в том числе болезнь Имерслунд (О. Imerslund) — семейная B12-дефицитная А. с сохраненным внутренним фактором Касла и протеинурией, и ювенильная B12-дефицитная А. — следствие функциональной недостаточности желез желудка, вырабатывающих гландулярный мукопротеин при нормальном морфологическом состоянии слизистой оболочки желудка и сохраненной секреции соляной к-ты.
Наследственная мегалобластическая анемия (нарушение метаболизма пиримидинов, в частности оротовой кислоты) описана у двух детей трехмесячного возраста; наследуется, по-видимому, по аутосомно-рецессивному типу. Эта форма А. имеет пернициозоподобный характер с выраженным анизопойкилоцитозом и анизохромией; эритробласты, тельца Жолли, кольца Кебота; нейтропения, умеренная тромбоцитопения; в костном мозге — мегалобластический эритропоэз, сужение гранулоцитарного ростка при наличии гигантских миело- и метамиелоцитов. Оротацидурия. Задержка физического развития. С лечебной целью назначают уридин.
От истинной А. надо отличать кажущуюся, или мнимую, анемию. Дети — практически здоровы и обычно жалоб нет; в периферической крови нормальное содержание гемоглобина и эритроцитов. Бледность кожи у таких детей объясняется особенностями расположения и кровенаполнения кожных капилляров, иногда несколько пониженным артериальным давлением. Эти дети требуют только тщательного соблюдения режима, соответствующего их возрасту.
Беременность — особое физиологическое состояние, сопровождающееся глубокой перестройкой всех видов обмена, к-рая, однако, не обусловливает развития особых форм А., присущих лишь беременным женщинам. Беременность здоровой до этого женщины, по-видимому, не часто провоцирует развитие А. Чаще беременность выявляет латентно протекавший патологический процесс или усугубляет течение существовавшего ранее заболевания. У беременных встречаются обычные клинические формы А., к-рые распространены среди населения вообще.
Следует отличать от истинной А. у беременных иногда сопутствующее беременности состояние гемодилюции — разжижение крови непропорционально возрастающим объемом плазмы, неправильно называемое «псевдоанемией» или «физиологической анемией» беременных. Эдейер (F. L. Adair) и соавт. подсчитали, что объем крови у здоровых женщин за время беременности увеличивается в среднем на 23% (плазмы — на 25%, массы эритроцитов — на 20%). На 16-й нед. беременности обнаруживается нарастающая тенденция к снижению количества эритроцитов и гемоглобина. К 32-й нед. содержание гемоглобина в периферической крови уменьшается на 15% от исходной величины. Показатели допустимой нижней границы гемодилю-ции: гематокрит — 33/67—30/70, гемоглобин — 11 г% и число эритроцитов — 3600000. Гемодилющш клинически не проявляется, причины ее развития не ясны. Определенное значение имеет, вероятно, усиление секреции кортикостероидов, к-рые, несомненно, участвуют в мобилизации жидкости из внутри- и внеклеточных пространств в кровь [М. Г. Колпаков; Блумстедт (Blomstedt)]. Гемодилюция не свойственна здоровым женщинам с неосложненным течением беременности [Хюттен, Пейнтин, Бает, Лунд, Сиссон (Hytten и Paintin; Bast; Lund и Sisson].
Железодефицитная анемия занимает первое место среди А. у беременных. Она обнаруживается у 15—30% беременных, что составляет 75—95% среди больных А. беременных.
По статистике ВОЗ, железодефицитная А. выявляется у 21—80% беременных при исследовании только гемоглобина и у 40—99% при применении более точного диагностического теста — насыщения трансферина. Ведущим фактором в патогенезе является недостаток железа, чаще утилизационного характера. При беременности организму женщины дополнительно требуется 900—1100 мг железа, причем на нужды плода и построение плаценты расходуется от 375 до 500 мг (ВОЗ; Бает). Чем меньше железа поступает в организм беременной извне или резорбируется из жел.-киш. тракта, тем быстрее развивается дефицит. В подобных случаях расходуется депонированное железо. Истощению резервов железа способствуют частые роды, продолжительная лактация, длительные нарушения режима питания, паразитарные заболевания. Несомненно и значение дефицита витамина D, А, С, комплекса В. Угнетению эритропоэза способствует также избыток стероидов, особенно эстрадиола-17β и эстрона.
Беременных с гемоглобином ниже 11 г%, цветным показателем ниже 0,8, числом эритроцитов менее 3600000, гематокритом менее 33/67 и содержанием сывороточного железа ниже 60 мкг% рассматривают как больных железодефицитной А. (ВОЗ). Клиника железодефицитной анемии у беременных проявляется обычными симптомами для этой формы А. (см. Железодефицитная анемия). Значительную .опасность представляют осложнения беременности на фоне А., особенно поздние токсикозы и преждевременная отслойка нормально расположенной плаценты. Полная отслойка плаценты наблюдается в 2,9% случаев, преждевременные роды — в 11,3%, перинатальная детская смертность — от 4,5 до 20,7%.
Пернициозоподобная, B12-(фолиево) дефицитная анемия беременных учащается в декабре — апреле. Средний возраст больных 28—30 лет, преобладают повторнородящие. Заболевание начинается преимущественно во второй половине беременности, реже — в послеродовом периоде. После родов обычно наступает выздоровление, но возможны обострения при последующих беременностях. Заболевание начинается медленно. Иногда присоединяются расстройства жел.-киш. тракта. Отеки, гипертензия и протеинурия часто маскируют истинную природу болезни. В отличие от пернициозной А., тяжелых поражений нервной системы не наблюдается, иногда отмечаются парестезии. Прогноз неблагоприятный как для матери (летальность 4%), так и для плода; преждевременные роды составляют 36%, мертворождаемость — 12% [Гузен (С. J. G. Goosen)].
Дифференциальная диагностика между тяжелой формой железодефицитной и мегалобластной А. основывается на совокупности клинических признаков, картине периферической крови и пунктата костного мозга.
Лечение А. у беременных зависит от характера А. При дефиците железа рекомендуется одновременно назначать препараты, содержащие железо, медь и кобальт (феррокаль, ферробион, ферратол, гемостимулин, феррогематоген, ферковен). При B12-(фолиево) дефицитных анемиях — витамин B12 и фолиевую к-ту.
Следует учитывать и интересы плода, развивающегося в условиях хрон. гипоксии, нарастающего авитаминоза и метаболического ацидоза. Поэтому витамины следует вводить в максимальных дозах, проводить оксигенотерапию и коррекцию кислотно-щелочного равновесия крови. По показаниям — переливания крови. Вопрос о сохранении беременности при А. необходимо решать терапевту и акушеру совместно.
С помощью радиоактивных изотопов можно определить истинную или ложную А., синтез гемоглобина, величину эритропоэза, скорость и места преимущественного разрушения эритроцитов.
51 (в днях): 1 — норма; 2 — врожденная микросфероцитарная гемолитическая анемия; 3 — анемия Маркиафавы—Микели»>
Рис. 1. Продолжительность жизни эритроцитов, меченных Cr 51 (в днях): 1 — норма; 2 — врожденная микросфероцитарная гемолитическая анемия; 3 — анемия Маркиафавы—Микели
Основные методики и препараты: определение объема циркулирующих эритроцитов проводится с помощью Cr 51 , исследование продолжительности жизни эритроцитов — с Cr 51 или P 32 (диизопропилфлюоро-фосфонатом), места преимущественного разрушения эритроцитов — с Cr 51 , наличия и величины скрытых кровотечений — с Cr 51 , интенсивности эритропоэза — с Cr 51 или Fe 59 , всасывания железа — с Fe 59 и всасывания витамина B12 — с Co 58 (см. Всасывание, радиоизотопное исследование). Большинство тестов проводят in vivo; синтез гемоглобина изучают in vitro.
14 -аспарагиновой кислоты в α- и β-цепи глобина в норме и при α- и β-талаееемии. По оси ординат — импульсы за минуту на микромоль вещества (по Дидковскому)»>
Рис. 2. Включение C 14 -аспарагиновой кислоты в α- и β-цепи глобина в норме и при α- и β-талаееемии. По оси ординат — импульсы за минуту на микромоль вещества (по Дидковскому)
Индикаторные количества препаратов в зависимости от пробы колеблются от 1—5 мккюри Cr 51 , Co 58 , Fe 59 до 200 мккюри Cr 51 . Измерительная аппаратура: счетчики сцинтилляционные жидкостные, а также с цельным и колодезным кристаллами, сканеры и гамма-камеры. Показатели нормы для большинства методов имеют относительное значение, т. к. зависят от деталей применяемых методик.
Информативность радиоизотопных методов больше, чем неизотопных.
В отличие от ранее распространенного метода дифференциальной агглютинации, при к-ром определяется продолжительность жизни только донорских (перелитых) эритроцитов, радиоизотопный метод позволяет определить продолжительность жизни и эритроцитов реципиента. В клинической практике единственным методом, позволяющим определить массу депонированных эритроцитов, является изотопный метод. Радиоизотопный метод более чувствителен, чем неизотопные методы выявления жел.-киш. кровотечений. Он дает возможность количественно определить величину кровопотери на протяжении достаточно долгого времени, что важно в оценке кровопотери как фактора, вызывающего постгеморрагическую А. (см. Желудочно-кишечное кровотечение, радиоизотопная диагностика).
Особенно целесообразно применение радиоизотопных тестов при затруднениях в диагностике таких анемий, как железо- и B12-дефицитные, железорефрактерные, Маркиафавы—Микели (рис. 1), апластическая. Диагноз α-талассемии можно поставить только с помощью радиоизотопного метода. На рис. 2 показано, что в норме включение C 14 -аспарагиновой к-ты в α- и β-цепи глобина почти одинаково. При β-талассемии уменьшено включение C 14 -аспарагиновой к-ты в β-цепи, при α-талассемии — в α-цепи.
Радиоизотопное определение степени разрушения эритроцитов в селезенке при гемолитической А. помогает установить показания к спленэктомии.
См. также Кровь, радиоизотопные исследования, Эритроциты, радиоизотопные исследования.
С целью изучения механизма возникновения А., процессов регенерации крови, выявления недостаточности кроветворной системы и разработки методов терапии искусственно воспроизводится малокровие у животных.
Экспериментальную А. можно вызвать кровопусканием, разрушением эритроцитов гемолитическими ядами, нарушением целостности различных структурных образований нервной системы, удалением органов и др.
Постгеморрагическую анемию вызывают кровопусканием, к-рое делают однократно в количестве 30 — 40% объема циркулирующей крови (28—35 мл/кг) или повторно 10—15 раз по 10—12%; у кошек можно удалить 40—50% объема крови, у крыс и кроликов — не более 30%. Потеря 60—70% крови смертельна.
Массивное кровопускание вызывает у собак торможение функции коры больших полушарий в течение 7—8 дней, изменение сосудистых и дыхательных рефлексов, понижение артериального давления, гипоксемию и кислородное голодание. Объем крови уменьшается лишь в самом начале кровопотери, затем восстанавливается за счет жидкости, поступающей из тканей. Снижается гемоглобин, число эритроцитов, содержание белков плазмы. Сыворотка животных в течение 5—7 дней приобретает гемолитические свойства: происходит разрушение части эритроцитов и дальнейшее снижение количества эритроцитов и гемоглобина. Эти изменения тем более выражены, чем массивнее кровопускание. Продукты распада эритроцитов способствуют усилению выработки эритропоэтина, стимулирующего эритропоэз. Количество лейкоцитов в течение 4—8 дней увеличивается в основном за счет нейтрофильных со сдвигом влево до юных. Число ретикулоцитов начинает увеличиваться уже через несколько часов и достигает максимальной величины на 5—6-й день, затем постепенно уменьшается. Число тромбоцитов вначале несколько снижается, но быстро восстанавливается и превышает исходный уровень в течение нескольких дней. Эритропоэтическая активность костного мозга усиливается без качественных нарушений кроветворения.
Характер и течение А. зависят от величины кровопотери и регенераторной способности кроветворной ткани.
При многократных кровопусканиях усиление кроветворения может смениться угнетением в связи с истощением кроветворной ткани. После потери 40% объема крови восстановление показателей периферической крови наступает через 20—25 дней.
При повторных кровопотерях восстановление содержания гемоглобина отстает от восстановления количества эритроцитов в связи с истощением запаса железа; соответственно снижается цветной показатель; наблюдается анизо-, пойкилоцитоз, полихромазия эритроцитов, появляются нормобласты в периферической крови. При истощении кроветворной ткани снижается число ретикулоцитов и лейкоцитов. Сроки регенерации зависят от исходного функционального состояния организма и регенераторной способности кроветворной ткани, пола, питания, сезонных колебаний, условий содержания животных в виварии и др.
Гемолитическая анемия вызывается чаще всего введением фенил гидразина, к-рый разрушает старые эритроциты. В то же время продукты распада эритроцитов стимулируют эритропоэз; поэтому восстановление показателей периферической крови происходит быстрее, чем при постгеморрагической А.
2—5% водный раствор фенилгидразина вводят собакам и кроликам под кожу или внутримышечно 4—12 раз с промежутками в 2—3 дня или ежедневно из расчета 0,02—0,04 мг/кг на инъекцию; крысам и мышам вводят однократно внутрибрюшинно из расчета 2—8 мг на 100 г веса.
Степень и быстрота развития А. зависят от дозы фенил гидразина. Под влиянием больших доз количество эритроцитов снижается через 2—3 дня на 40—50%, повышается цветной показатель, появляются в периферической крови полихроматофильные, вакуолизированные и содержащие патологические структуры эритроциты; значительно увеличивается максимальная осмотическая резистентность эритроцитов, повышается число ретикулоцитов; развивается умеренный лейкоцитоз без нарушения лейкоцитарной формулы; увеличивается вязкость и свертываемость крови.
При длительном введении фенил-гидразина появляются мегалоциты и мегалобласты, наблюдается отложение гемосидерина в костном мозге, селезенке и печени. С 8—10-го дня развиваются очаги экстрамедуллярного гемоцоэза, увеличиваются в размере селезенка и печень. В лейкоцитарной формуле — сдвиг влево до миелоцитов. Большие дозы фенил гидразина могут вызвать апластическую А.
Гиперхромная мегалобластическая анемия у животных вызывается внутривенным введением водного раствора сапонина в количестве 1—5 мг/кг в течение 5 дней в возрастающей (по 1 мг в день) дозе. Число эритроцитов уменьшается на 50%, гемоглобина — на 25—30%. Показатели периферической крови восстанавливаются через 20—25 дней. При комбинации сапонина с колларголом (0,3—0,5 мг/кг) А. поддерживается до 40 дней. Аллоксан (180 мг/кг в виде 10% раствора) вызывает А. у животных через 2—3 дня. Как гемолитический яд применяют свинец, толуилендиамин, пирогаллол, мышьяковистый водород, но они вызывают и другие проявления интоксикации.
Нейрогенная анемия может быть вызвана нарушением целостности различных структурных образований нервной системы, напр, денервацией синокаротидной рефлексогенной зоны, селезенки, почек, тонкой кишки и др. А. можно вызвать также повторным введением животным под кожу ацетилхолина, карбохолина и других холинергических веществ. Развивается умеренная гипохромная А. Количество гемоглобина и эритроцитов максимально снижается на 9—15-й день после операции. В крови при этом обнаруживают вещества, угнетающие эритропоэз. Восстановление показателей периферической крови происходит в течение 20—40 дней.
Органопривные анемии развиваются у животных после удаления части или всего желудка, части тонкой кишки или печени, при хрон. потере желчи (через фистулу желчного пузыря), после гипофизэктомии. При сочетании гастрэктомии с нарушением питания у собак развивается гипопластическая А.
Алиментарная анемия. Длительное снижение калорийности пищи, особенно обеднение ее белками, а также недостаток железа, меди, кобальта вызывает у животных А. различного характер а; дефицит фолиевой к-ты и витамина B12 вызывает гиперхромную мегалобластическую А.
Библиогр.: Воспроизведение заболеваний у животных для экспериментально-терапевтических исследований, под ред. Н. В. Лазарева, с. 296, Л., 1954; Гольдберг А. И. Агастрические B12-дефицитные анемии, Томск, 1962, библиогр.; Железодефицитное малокровие и некоторые вопросы регуляции эритропоэза, под ред. С. И. Рябова, Л., 1970; Идельсон Л. И. Нарушения порфиринового обмена в клинике, Л., 1968, библиогр.; Кассирский И. А. и Алексеев Г. А. Клиническая гематология, с. 149, М., 1970, библиогр,; Мосягина Е. Н. Анемии детского возраста, М., 1969, библиогр.; Мухамедзянова Г. С. Гипопластические анемии у детей, М., 1970, библиогр.; Саркисов Д. С. и Ремезов П. И. Воспроизведение болезней человека в эксперименте, с. 84, М., 1960; Фаинштейн Ф. Э. Апластические и гипопластические анемии, М., 1965; Begemann H., Rastetter J. u. Kaboth W. Klinische Hämatologie, Stuttgart, 1970, Bibliogr.; Recent advances in haematology, ed. by A. Goldberg a. M. G. Brain, Edinburgh, 1971, bibliogr.
Патологическая анатомия А. — Абрикосов А. И. Частная патологическая анатомия, в. 1, с. 274, М.—Л., 1947; Давыдовский И. В. Патологическая анатомия и патогенеэ болезней человека, т. 2, М., 1958; Неменова Н. М., Протасова Т. Г. и Воронин В. М. Биопсия костного мозга в диагностике заболеваний системы крови, Арх. патол., т. 33, № 3, с. 3, 1971; Струков А. И. Патологическая анатомия, с. 286, М., 1971; Burkhardt R. Farbatlas der klinischen Histiopathologie, B. u. a., 1970.
Радиоизотопная диагностика А. — Лайта Л. Г. Применение изотопов в гематологии, пер. с англ., М., 1963, библиогр.; Цфасман А. З. Применение радиоактивного хрома в клинике, М., 1964; Radioisotopes in medical diagnosis, ed. by E. H. Belchek a. H. Vetter, L., 1971.
А. беременных — Абдурахманов М. К. Некоторые показатели обмена витаминов B1, B2, B6, C, A, D при нормальной и осложненной железодефицитной гипохромной анемии у беременных, Акуш. и гинек., № 6, с. 10, 1971, библиогр.; Хакимова С. Х. К этиологии и патогенезу железодефицитной анемии у беременных, там же, с. 3, библиогр.; André R. et Najman A. Interprétation des anémies de la grossesse, Sem. Hop. Paris, t. 45, p. 2306, 1965; Bast G. Anämien in der Schwangerschaft, Z. ges. inn. Med., S. 46, 49, 1966, Bibliogr.; Goosen G. J. Anaemias of pregnancy in afr leans, J. Obstet. Gynaec. Brit. Emp., v, 68, p. 994, 1961, bibliogr.; Malinac P. Les frontières de l’anémie &##225;u cours de la grossesse, Concours méd., t. 90, p. 1527, 1968; Nair G. T. R., Agarwal K. N. a. Kotwani B. G. Nutrition deficiency anaemias in later months of pregnancy, J. Obstet. Gynaec. India, v. 20, p. 594, 1970; Rothman D. Folic acid in pregnancy, Amer. J. Obstet. Gynec., v. 108, p. 149, 1970, bibliogr.
Г. А. Алексеев; Н. М. Неменова (пат. ан.), А. Ф. Тур (пед.), Н. А. Федоров, М. Г. Катехелидзе (А. экспериментальная), С. X. Хакимова (А. беременных), А. З. Цфасман (рад.).
- Большая медицинская энциклопедия. Том 1/Главный редактор академик Б. В. Петровский; издательство «Советская энциклопедия»; Москва, 1974.- 576 с.
источник