Med-books.by — Библиотека медицинской литературы . Книги, аудиокниги по медицине. Банк рефератов. Медицинские рефераты. Всё для студента-медика .
Скачать бесплатно без регистрации или купить электронные и печатные бумажные медицинские книги (DJVU, PDF, DOC, CHM, FB2, TXT), истории болезней, рефераты, монографии, лекции, презентации по медицине.
Med-books.by — Библиотека медицинской литературы » Истории: Внутренние болезни (Терапия) » История болезни: Аутоиммунная гемолитическая анемия, ср. степени тяжести, протекающая с мегалобластоидностью костного мозга.
История болезни: Аутоиммунная гемолитическая анемия, ср. степени тяжести, протекающая с мегалобластоидностью костного мозга.
Ф.И.О.: _____________
Возраст: 02.10.1953
Пол: женский
Национальность: белоруска
Семейное положение: замужем
Место работы: пенсионерка
Домашний адрес: _________________
Дата поступления в клинику: 14.11.2013
Группа крови: А(II) Rh-
Диагноз направившей организации: Анемия
Диагноз при поступлении: Аутоиммунная гемолитическая анемия
Клинический диагноз: Аутоиммунная гемолитическая анемия, ср. степени тяжести, протекающая с мегалобластоидностью костного мозга. Кардиомиопатия смешанного генеза Н 1. АГ 2ст риск 4.
На момент поступления: общая слабость, головокружение, одышка при физических нагрузках и в покое, повышенную утомляемость.
На момент курации: общая слабость, одышка при физических нагрузках, утомляемость.
Заболела в августе 2013 года, когда почувствовала резкую слабость. Обратились к терапевту по месту жительства. Была госпитализирована в стационар(по направлению поликлиники № 4) в гематологическое отделение УЗ ВОКБ. Отмечалось улучшение после лечения и была выписана. Однако 20 сентября вернулась в стационар. Месяц проходила лечение и была выписана. 14 ноября вновь поступила в стационар. Причиной был низкий гемоглобин в ОАК, а также жалобы пациентки на общую слабость и усталость.
Паротит, менингит, АГ. Миома матки.
Родилась в срок. Росла и развивалась нормально. Замужем. Двое детей.
Из перенесенных заболеваний отмечает простудные заболевания, паротит, менингит, АГ, миома матки. Туберкулез, вирусный гепатит, онкологические и венерические заболевания отрицает.
Было проведено переливание крови (14.11.2013, 16.11.2013). Аллерго-анамнез не отягощен.
Жилищно-бытовые условия удовлетворительные, питание регулярное.
Не курит, алкоголь не употребляет.
Наследственный анамнез не отягощён.
Общее состояние удовлетворительное. Сознание ясное. Настроение спо-койное. Телосложение правильное. Рост 163 см., вес 72 кг. Кожа сухая, чистая, окраска кожных покровов бледная, эластичность кожи сохранена. Видимые слизистые бледные. Сыпи, расчёсов, петехий, рубцов нет.
Периферические лимфатические узлы (подчелюстные, околоушные, шей-ные, затылочные, над- и подключичные, подмышечные, паховые) не увеличены. Шея правильной формы, видимой пульсации сосудов нет. Щитовидная железа не увеличена, доли не пальпируются. Молочная железа правильной формы, при пальпации патологических образований не выявлено. Позвоночник обычной конфигурации, без патологических искривлений, движения- в полном объеме. Походка нормальная.
Костно-мышечно-суставная система
Мышечная система развита умеренно, тонус и сила мышц несколько снижены. Мышцы при пальпации безболезненны. Ограничения движения в суставах нет.
Система органов дыхания
Грудная клетка нормостенической формы. Дыхание через нос. Число дыхательных движений 18 в минуту. При сравнительной перкуссии звук над обоими легкими ясный легочный. Тип дыхания — грудной. Форма грудной клетки правильная. При аускультации дыхание везикулярное. Границы легких в пределах нормы. Дыхание через нос, свободное. Тип дыхания грудной. Число дыханий – 16 в мин. Дыхание ритмичное.
Система органов кровообращения
При осмотре верхушечный толчок не виден. Патологической пульсации нет. Верхушечный толчок пальпируется в V-ом межреберье слева на 1,5 см кнутри от срединно-ключичной линии, площадь его 1,5 см, умеренной высоты и резистентности. Сердечный толчок не выявляется. Симптом кошачьего мурлыканья отсутствует. При аускультации тоны сердца приглушены, ритмичные, ЧСС- 78 в 1 мин. Патологические шумы не выслушиваются. При исследовании сосудов определяется мягкая, эластичная, ровная, плоская стенка лучевой артерии. Пульс — одинаковый на обеих руках, ритмичный, частота-78 пульсовых волны в минуту, удовлетворительного напряжения, полный. Дефицита пульса нет. Артериальное давление: 150/90 мм рт.ст на обеих руках.
Система органов пищеварения
Слизистые щек, губ, твердого неба розового цвета. Язык обычных размеров, розовый, влажный, чистый, сосочки сохранены; обложенность, трещины, опухоли, язвы отсутствуют. Полость рта санирована удовлетворительно. Миндалины не изменены, гнойные пробки и налет отсутствуют. Слизистая сухая, гладкая. Живот округлой формы, симметричный, брюшная стенка равномерно участвует в акте дыхания. При поверхностной пальпации живот мягкий. Глубокая пальпация затруднена. Перистальтика кишечника обычная. Перитонеальные симптомы отсутствуют. Пальпация безболезненная. Стул 1 раз в сутки, не нарушен. Печень без-болезненна, границы в норме. Селезёнка не увеличена.
Мочеполовая система
Мочеиспускание свободное, безболезненное. Почки не пальпируются. Точки почек и мочевыводящих путей безболезненны. Симптом поколачивания отрицательный с обеих сторон. Диурез достаточный.
6. ПРЕДВАРИТЕЛЬНЫЙ ДИАГНОЗ
На основании жалоб больной (общая слабость, головокружение, одышка при физических нагрузках и в покое, повышенную утомляемость); анамнеза (больна с августа 2013, 2 раза проходила лечение в стационаре); данных объективного исследования (бледность кожных покровов) можно выставить предварительный диагноз – Аутоиммунная гемолитическая анемия.
7. ПЛАН ОБСЛЕДОВАНИЯ БОЛЬНОГО
ОАК, ОАМ, БАК
Иммунологический анализ
Кровь на RW, Hbs, анти HCV
УЗИ ОБП
ЭКГ
8. РЕЗУЛЬТАТЫ ЛАБОРАТОРНЫХ И ИНСТРУМЕНТАЛЬНЫХ
МЕТОДОВ ИССЛЕДОВАНИЯ
1. Общий анализ крови (15.11.13)
Гемоглобин: 81 г/л (ниже нормы)
Эритроциты: 2,33х1012 /л (ниже нормы)
СОЭ:29 мм в ч. (выше нормы)
Лейкоциты: 5.9 х109 /л
-миелоциты: 1%
-палочкоядерные: 9%
-сегментоядерные: 46%
-лимфоциты: 40%
-моноциты:4%
Токсическая зернистость нейтрофилов ++
Тромбоциты: 283х109/л
Общий анализ крови (18.11.13)
Гемоглобин: 113 г/л (ниже нормы)
Эритроциты: 3,2 х1012 /л (ниже нормы)
СОЭ:21 мм в ч. (выше нормы)
Лейкоциты: 6,3 х109 /л
-миелоциты: 1%
-юные: 1%
-палочкоядерные: 3%
-сегментоядерные: 40%
-лимфоциты: 41%
-моноциты:12%
-базофилы: 1%
-эозинофилы: 2%
Тромбоциты: 295х109/л
2. Биохимический анализ крови (15.11.13)
АЛТ: 32 Е/л
АСТ: 25 Е/л
Глюкоза: 6,1 ммоль/л
Билирубин: общий – 17,7 мкмоль/л, прямой -2,5 мкмоль/л
Щелочная фосфатаза: 38 Ед/л
Общий белок: 59 г/л
Мочевина: 9,5
Креатинин: 0,098
ЛДГ: 639 ед/л
Биохимический анализ крови (18.11.13)
АЛТ: 47 Е/л
АСТ: 41 Е/л
Глюкоза: 5,3 ммоль/л
Билирубин: общий – 10,7 мкмоль/л
Общий белок: 65 г/л
Мочевина: 5,7
Креатинин: 0,062
ЛДГ: 639 ед/л
3. Общий анализ мочи (15.11.13)
Цвет: соломенно-желтый
Реакция: кислая
Удельный вес: 1,011 г/мл
Прозрачность: мутная
Белок: нет
Сахар: нет
Эпителий (плоский): 1-2 в поле зрения
Лейкоциты: 3-4 в поле зрения
Ураты ++
4. Иммунологический анализ(16.11.2013)
Увеличение циркулирующих иммунных комплексов. Относительное сни-жение показателей Т-клеточного иммунитета.
9. КЛИНИЧЕСКИЙ ДИАГНОЗ И ЕГО ОБОСНОВАНИЕ
На основании жалоб больной (общая слабость, головокружение, одышка при физических нагрузках и в покое, повышенную утомляемость); анамнеза (больна с августа 2013, 2 раза проходила лечение в стационаре); данных объективного исследования (бледность кожных покровов); данных лабораторных и инструментальных исследований (низкий уровень гемоглобина, эритроцитов; миелоциты,юные, токсическая зернистость нейтрофилов в ОАК) выставляется окончательный диагноз – Аутоиммунная гемолитическая анемия, ср. степени тяжести, протекающая с мегалобластоидностью костного мозга. Кардиомиопатия смешанного генеза Н 1. АГ 2ст риск 4.
10. ДИФФЕРЕНЦИАЛЬНЫЙ ДИАГНОЗ
Дифференциальная диагностика проводится с:
• А. Мегалобластными анемиями (заболевания, характеризующиеся изменениями морфологии клеток к.м. вследствие нарушения синтеза ДНК. Более 90 % — В-12 и фолиево-дефицитные анемии).
После начала терапии витамином В-12 или фолиевой кислотой в анализе крови выявляется ретикулярный криз на 5-7 сутки и повышение показателей красной крови, что нехарактерно для больных рефрактерной анемией. Изменения кариотипа клеток костного мозга не встречаются при мегалобластных анемиях.
• Б. Апластической анемией.
Апластическая анемия может быть врождённой, приобретённой и идиопатиче-ской. Врождённая апластическая анемия — анемия Фанкони сочетается с другими генетическими аномалиями (кожная пигментация, гипоплазия по-чек, микроцефалия), приобретённая связана с действием химических и физических агентов, инфекциями, нарушениями обмена веществ.
Для АА нехарактерны изменение кариотипа, гиперклеточный костный мозг.
• В. Анемии при ХПН.
• В. Анемии при хроническом активном гепатите характерно выявление маркеров вирусных инфекций, гепатоспленомегалия, клиническая картина хр. гепатита, изменения биохимических показателей крови (метаболизма билирубина, функции печени).
План лечения:
Режим П, Стол Г., поливитамины.
1. Переливание Эр. Массы
2. Глюкокортикоиды — Преднизолон в суточной дозе 60—80 мг
3. Иммунодепрессанты – Метотрексат, циклофосфамид
4. Дезинтоксикационная терапия.
20.11. Жалобы на общую слабость, головокружение, одышка при физических нагрузках, повышенную утомляемость.
Состояние больной удовлетворительное. Сознание ясное. Кожный покров и видимые слизистые оболочки бледного цвета, сухие, чистые, тургор удовлетворительный. Тоны сердца ритмичные, приглушены. ЧСС – 58 уд. в мин. АД – 140/80 мм.рт.ст.. Дыхание везикулярное. ЧД – 16 в мин. Живот мягкий, безболезненный. Стул в норме. Мочеиспускание свободное, безболезненное.
Рекомендовано: Лечение продолжить
21.11. Жалобы на общую слабость, головокружение, одышка при физических нагрузках, повышенную утомляемость.
Состояние больной удовлетворительное. Сознание ясное. Кожный покров и водимые слизистые без особенностей. Тоны сердца ритмичные, приглушены. ЧСС – 64 в мин. АД – 150/85 мм.рт.ст. Дыхание везикулярное. ЧД – 17 в мин. Живот мягкий, безболезненный. Стул был. Удовлетворительных свойств. Мочеиспускание свободное, безболезненное.
Лечение продолжать.
13. ЭПИКРИЗ
Больная ___________, 02.10.1953 г. р., пенсионерка, поступила 14.11.13. в гематологическое отделение УЗ ВОКБ в плановом порядке для лечения с жалобами на общую слабость, головокружение, одышка при физических нагрузках и в покое, повышенную утомляемость. Болеет с августа 2013. Два раза проходила лечение в стационаре.
Объективное исследование- бледность кожных покровов. Лабораторные данные – снижен уровень гемоглобина, эритроцитов; наличие юных, миелоцитов, токсической зернистости нейтрофилов.
На основании комплексного клинико-лабороторного обследования выставлен диагноз: Аутоиммунная гемолитическая анемия, ср. степени тяжести, протекающая с мегалобластоидностью костного мозга. Кардиомиопатия смешанного генеза Н 1. АГ 2ст риск 4.
Пациентка находится в стационаре. Отмечается положительная динамика.
Рекомендовано – лечение продолжить.
источник
Этиология и патогенез. В патогенезе приобретенной аутоиммунной гемолитической анемии (anaemia haemolytica chronica) основное значение придается иммунопатологическим сдвигам, заключающимся в выработке антител к собственным эритроцитам — аутоагглютининов. Спровоцировать эту выработку антител могут некоторые острые инфекции, интоксикации, в том числе и лекарственные, особо тяжелые формы злокачественных лимфом и коллагенозов, а также другие факторы. Эти антитела относятся к фракции иммуноглобулинов и являются неполными, «слабыми», антителами: фиксируясь на поверхности эритроцитов в кровяном русле, они не вызывают агглютинации, но «блокируют» эритроциты, облегчая их оседание в депо ретикулогистиоцитарной системы (прежде всего в венозных синусах селезенки), а затем захват и разрушение макрофагами.
Иногда аутоиммунная гемолитическая анемия связана с возникновением Холодовых которые вместе с комплементом фиксируются на эритроцитах. Их действие проявляется в периферических участках тела (кончики пальцев, уши) при переохлаждении. У некоторых больных, помимо аутоагглютининов, выявляются также аутогемолизины; в этих случаях заболевание может протекать с признаками не тольконо и внутрисосудистого гемолиза.
Клиническая картина. Болезнь начинается или постепенно, незаметно, или остро, с гемолитического криза. Основными являются жалобы на слабость, головокружение, утомляемость, незначительное повышение температуры тела. Все эти явления резко усиливаются в период гемолитических кризов. Кожного зуда не бывает. Кожа больных бледная, с несколько желтушным оттенком. Давление на грудину и перкуссия по ней болезненны. Палъпаторно определяется увеличенная и уплотненная селезенка, отмечается небольшое увеличение печени.
В крови снижено содержание эритроцитов и гемоглобина при нормальном цветовом показателе. Эритроциты неодинаковой формы, размеров и окраски (пойкилоцитоз, анизоцитоз, анизохромия); средний размер их несколько меньше, чем в норме (микроцитоз). В отличие от врожденной гемолитической анемии при приобретенной, как и у здоровых лиц, эритроциты в центре окрашены слабее, чем по краям, что зависит
от их формы (планоциты). Много ретикулоцитов, особенно выражен ретикулоцитоз при значительной анемизации и в период после гемолитических кризов. Осмотическая резистентность эритроцитов существенно не изменена. Сыворотка крови больных имеет желтоватую окраску — исследование крови подтверждает повышение содержания свободного билирубина, от которого и зависит ее цвет. Определяется также гипергаммаглобулинемия, повышено содержание железа сыворотки, которое высвобождается в большом количестве при гемолизе эритроцитов. Вследствие повышенного выделения билирубина желчь, полученная при дуоденальном зондировании, имеет очень темную окраску. Моча и кал больного также окрашены темнее, чем у здоровых лиц, суточное выделение стеркобилина с калом и уробилина с мочой увеличено. Пунктат костного мозга свидетельствует о более или менее значительном усилении эритропоэза.
В крови больных аутоиммунной гемолитической анемией выявляются антитела, как фиксированные на поверхности эритроцитов (блокирующие), так и находящиеся в свободном состоянии в плазме (конглютинины). Для их обнаружения применяется реакция Кумбса, которая производится в двух вариантах
— прямом и непрямом. Для выявления антител, фиксированных на поверхности эритроцитов, производится прямая реакция Кумбса, сущность которой заключается в том, что к сыворотке кролика, иммунизированного глобулинами человеческой сыворотки, добавляется суспензия отмытых в изотоническом растворе хлорида натрия эритроцитов обследуемого: при наличии на поверхности эритроцитов антиэритроцитарных антител происходит агглютинация эритроцитов. Эритроциты лиц, не страдающих приобретенной гемолитической анемией, не агглютинируются. Для выявления конглютининов в начале к сыворотке больного добавляют эритроциты здорового человека, чтобы фиксировать на них антитела, затем их отмывают и проводят с ними прямую реакцию Кумбса. В данном варианте она носит название непрямой.
Течение и осложнения. В большинстве случаев течение волнообразное; обострения наступают под влиянием инфекций, приема больших доз некоторых лекарственных препаратов, например салицилатов, и других преходящих факторов. В тяжелых, длительно протекающих случаях может наступить истощение костного мозга, и анемия принимает гипорегенераторный характер. В ряде случаев подавление активности костного мозга, возможно, обусловлено также выработкой аутоантител к клеткам эритробластического ростка. Осложнением болезни является образование пигментных камней в желчном пузыре. Могут наблюдаться тромбофлебиты, тромбоз селезеночной вены.
Лечение. Проводят терапию кортикостероидами, которые подавляют выработку антиэритроцитарных аутоантител. Переливания крови производят лишь в крайних случаях, так как гемотрансфузия может резко усилить гемолиз.
Миелоапластический синдром объединяет большую группу состояний, различных по этиологии и патогенезу, основные клинические проявления которых обусловлены подавлениемкроветворения. По происхождению различают врожденные, т. е. генетически обусловленные, и приобретенные формы миелоидной аплазии; по течению — острые и хронические. Выделяют также формы, характеризующиеся неполным угнетением регенераторной способности костного мозга, его гипоплазией и полным подавлением его функции— аплазией.
Различные варианты миелоидной гипо- и аплазии, обусловленные преимущественно парциальным (т. е. частичным, в одном направлении) или тотальным (во всех направлениях) подавлением регенераторной способности костного мозга, в клинике выделяются под разными названиями. Наиболее яркими формами являются гипо- и апластическая анемии, при которых в первую очередь подавляется эритропоэтическая функция костного мозга, агранулоцитоз, характеризующийся подавлением гранулоцитопоэтической функции костного мозга, а также панмиелофтиз, при котором нарушена регенеративная функция костномозговой ткани во всех направлениях (т. е. более или менее равномерно нарушена продукция как эритроцитов, так и гранулоцитов и тромбоцитов).
С гипо- и апластическими состояниями костного мозга, в частности с гипопластической анемией, не следует смешивать его гипорегенераторные состояния, развивающиеся, например, при хронической постгеморрагической анемии, тяжелой гемолитической анемии и в некоторых других случаях. В отличие от гипопластических анемий при гипорегенераторных анемиях в костном мозге сохраняется довольно большое количество родоначальных клеток эритробластического ростка, не наблюдается неуклонно прогрессирующего течения болезни: при ликвидации причины, приведшей к
истощению костного мозга, его функция восстанавливается. К миелоапластическим состояниям также не относятся случаи, когда уменьшение содержания в периферической крови форменных элементов (эритроцитов, нейтрофилов, тромбоцитов) обусловлено их повышенным разрушением в селезенке, «гиперспленизмом». Такие состояния наблюдаются при значительном увеличении селезенки, например при циррозах печени, поскольку при этих состояниях активность костного мозга не снижена, а, наоборот, повышена. Не попадают в эту группу и цитопении, обусловленные метаплазией костного мозга (при злокачественных лимфомах, лейкозах) и вытеснением миелопролиферативной ткани (при миеломной болезни, множественных метастазах рака и др.).
Этиология и патогенез. Этиологические факторы миелоидной гипо- и аплазии разнообразны. В одних случаях это эндогенные причины, например гипофункция вилочковой железы, наследственная предрасположенность и др. Однако чаще всего на первом месте находятся экзогенные факторы, среди которых наибольшее значение имеют следующие: а) интоксикация химическими веществами, например отравление бензолом, тетраэтилсвинцом; б) длительный бесконтрольный прием некоторых лекарственных препаратов, например амидопирина, бутадиона, цитостатических средств (эмбихин, ТиоТЭФ, меркаптопурин), метилтиоурацила, сульфаниламидов, некоторых антибиотиков (левомицетин) или повышенная чувствительность к ним; в)факторы (туберкулез, сепсис, сифилис); г) употребление в пищу продуктов растительного происхождения, в которых при определенных условиях могут образоваться токсичные вещества (зерно перезимовавших в поле злаков); д) действие ионизирующей радиации (радиоактивные вещества, рентгеновское излучение и др.). Считается, что действие перечисленных факторов в основном заключается в угнетении ферментов нуклеопротеидного ряда, что приводит к задержке митотического деления клеток.
В последнее время в развитии ряда форм миелоидной гипоплазии и аплазии придается значение аутоагрессивному механизму — выработке организмом антител против собственных клеток крови и костного мозга. Возможно, однако, что выработка аутоантител не является пусковым механизмом болезни, а происходит вторично, к уже измененным клеткам. В ряде случаев причины миелоидной аплазии остаются неясными.
Патологоанатомическая картина. В классических случаях обнаруживаются резкое малокровие органов, дистрофические изменения в них, а также следы множественных кровоизлияний. «Территория» красного костного мозга резко сужена за счет замещения его жировой тканью.
Клиническая картина. В зависимости от преимущественной направленности подавления функции костного мозга клиническая картина различна. Однако наиболее характерные симптомы бывают обусловлены анемизацией, геморрагическим диатезом, появлением некрозов тканей и присоединением вторичной инфекции (например, при агранулоцитозе). В процессе развития заболевания нередко отмечается определенная динамичность клинической картины: если вначале доминировалсиндром, то затем присоединяются другие синдромы и проявления болезни все более свидетельствуют о тотальном подавлении регенераторной способности костного мозга. Если заболевание начинается постепенно и незаметно, первыми обычно являются жалобы на слабость, одышку, немотивированную быструю утомляемость, снижение трудоспособности. При тромбоцитопении возможны геморрагические явления — кровотечения из носа, множественные «синяки» на коже, возникающие при малейшей травме, а иногда и спонтанно,маточные кровотечения и др. Как правило, наблюдается лихорадочное состояние.
При общем осмотре обращает на себя внимание бледность больных; могут быть следы подкожных кровоизлияний в видепятен, в дальнейшем приобретающих бурую, а затем желтую окраску. Кожа влажная, ее тургор нерезко снижен. При выраженной тромбоцитопении бывают положительные симптомы «щипка» и «жгута». Изменения в сердце, легких, почках итракте в
большинстве случаев малохарактерны, однако при возникновении геморрагического синдрома возможны кровоизлияния в различные органы и кровотечения, как внутренние, так и наружные. Лимфатические узлы, печень и селезенка обычно не увеличены.
Картина крови отражает различную направленность и степень нарушения регенераторной способности костного мозга. При гипо- и апластической анемии в крови резко уменьшено содержание эритроцитов — дои менее. Как правило, эритропении сопутствуют более или менее выраженные лейко- и тромбоцитопения. Резко уменьшено количество ретикулоцитов.
При агранулоцитозе наиболее выражена нейтропения: количество лейкоцитов уменьшается до 1,5*10 9 и даже допричем в первую очередь снижается содержание гранулоцитов, которое не превышаетот общего количества лейкоцитов. За счет этого возникают относительный лимфоцитоз и моноцитоз, хотя абсолютное содержание в крови этих клеточных форм лейкоцитов обычно не изменено или незначительно уменьшено. Более молодые формы нейтрофильных лейкоцитов — палочкоядерные — в периферической крови практически отсутствуют. Не удается обнаружить и эозинофилы. Наблюдается ряд патологических изменений в ядрах и цитоплазме нейтрофилов: пикноз ядер, токсическая зернистость цитоплазмы. Анемия и тромбоцитопения в начальном периоде нерезко выражены, однако затем прогрессируют.
Наконец, в некоторых случаях анемия, лейкопения и тромбоцитопения развиваются почти параллельно, что соответствует клинической картине панмиелофтиза (panmyelophthisis — от греч.— pan — «охватывающий все», myelos — костный мозг, При уровне тромбоцитов ниже 9 /л крови возникает геморрагический синдром.
В начальных стадиях заболевания картина стернального пунктата существенно не изменена; может наблюдаться относительное уменьшение клеток эритробластического или миелобластического ростка. В выраженных случаях отмечается бедность стернального пунктата клеточными элементами, преобладают ретикулярные и плазматические клетки. Поскольку аплазия костномозговой ткани развивается неравномерно, в стернальный пунктат могут случайно попасть участки костного мозга с наименее выраженными изменениями, что иногда вводит в заблуждение врача относительно тяжести процесса. Более четкую и точную картину костномозгового кроветворения дает трепанобиопсия гребешка подвздошной кости, позволяющая приготовить гистологические препараты костного мозга.
Течение. Различают острые формы, в ряде случаев с молниеносным течением (описаны случаи агранулоцитоза, когда смерть больных наступала через 2 дня), подострые и хронические формы. Формы с подавлением лейкопоэза в большинстве случаев протекают быстрее, чем с преимущественным подавлением эритропоэза, что в известной степени определяется неравной продолжительностью жизни белых и красных кровяных клеток.
Прогноз крайне неблагоприятен при врожденной и генуинной формах миелоидной аплазии: заболевание прогрессирует и через определенный срок заканчивается смертью больного. При миелотоксической форме болезни, например при передозировке анальгина, бутадиона или цитостатических препаратов, если вовремя прекратить их прием и провести соответствующее лечение, нередко удается приостановить развитие заболевания и даже добиться излечения. При агранулоцитозе частой причиной смерти больных является сепсис.
Лечение. Проводится обязательно в стационарных условиях. С целью воздействия на аутоиммунный механизм развития болезни назначают кортикостероидные препараты, например преднизолон.
При значительной анемизации проводят повторные переливания крови и эритроцитной массы. Больным лейкопенией и тромбоцитопенией переливают не только кровь, но и специально приготовленные лейкоцитную и тромбоцитную массы. Для стимуляции лейкопоэза назначают натрия нуклеинат и пентоксил, анаболические стероидные
источник
Среди приобретенных экзоэритроцитных гемолитических анемий аутоиммунные гемолитические анемии (АИГА) наиболее часто встречается в клинической практике, даже чаще микросфероцитной гемолитической анемии и талассемии.
По механизму развития они рассматриваются как типично аутоиммунные заболевания, при этом гемолиз — характерное поражение — происходит под непосредственным воздействием антител на оболочку эритроцита. По классификации Gell и Coombs (Берчану) этот механизм поражения отнесен к типу 2.
Проведенные после 1960 г. исследования уточнили механизм расплавления и природу антител, однако, также как и при других аутоиммунных болезнях, еще не подтверждена гипотеза о развитии состояния сельф-сенсибилизации, нарушения иммунной переносимости и появления иммунной реакции антителом в отношении собственных структур — антигены эритроцита.
В генуинных формах заболевания аутоиммунный патогенез нелегко объяснить, тем не менее знание вторичных форм, с определенным патогенезом, подсказывает новые патогенетические гипотезы и в отношении генуинных форм.
В существующих двух монографиях (Месробяну и Берчану) дано общее описание этих патогенетических механизмов, как в специальных главах с аутоиммунной гемолитической анемией (АИГА), так и в главах общей патологии явлений аутоиммунизации.
Современные знания о аутоиммунной гемолитической анемии (АИГА) результат продолжительных наблюдений и исследований, началом которых являются описанные во Франции случаи аутоиммунной гемолитической анемии (АИГА), рассматриваемые как спленомегалическая хроническая инфекционная желтуха (Hayem), а позже как «приобретенная гемолитическая желтуха», отличающаяся от врожденной выявлением Видали, Абрами и Брюле аутоагглютинин — характерных серологических факторов.
В течение того же периода, так же во Франции, Chauffatd и его сотрудники Troisier и Vincent описали гемолизиновую гемоглобинурию и желтуху. В своей монографии о гемолитической анемии Dacie дает полное описание эволюции знаний и в частности серологических методов, уточнивших диагностику всех существующих в то время форм аутоиммунной гемолитической анемии (АИГА).
Лишь спустя 20 лет после первых, проведенных во Франции наблюдений, были описаны Brill и Ledderer новые формы острого аутоиммунного гемолиза, но без серологической ссылки. Позже Dyke и Young выделили формы макроцитной гемолитической анемии — различные с гематологической точки зрения и по реакции на удаление селезенки — и сфероцитной анемии, однако не опирающиеся на серологическое исследование.
В 1940 г. Dameshek и Schwartz внесли новый серологический вклад описанием аномальных гемолизинов при приобретенной острой гемолитической анемии.
Крутой поворот произошел в 1945 году после уточнения Coombs, Mourand и Rice теста агглютинации антиглобулиновой сывороткой. При этом были вскрыты «неполные» антитела, по началу в случаях изоиммунизации за счет несовместимости в Rh-системе. До 1950 г. было установлено, что прямая реакция Кумбса дает положительный результат в приобретенных формах гемолитической анемии, отличающихся по своему течению от микросфероцитной гемолитической анемии (Loutit и Mollison). Так, были выделены генуинные приобретенные гемолитические анемии с неполными антителами. В 1947 г. Morton и Pickles внедрили трипсинизацию, как метод сенсибилизации реакции агглютинации посредством аутоантител.
После 1950 г., в связи с развитием концепции аутоиммунного заболевания, гемолитическая анемия с неполными антителами была отнесена к группе аутоиммунных болезней, при этом развитие новых методов, применяемых этой группе болезней способствует дифференциации всех видов аутоиммунной гемолитической анемии (АИГА) с уточнением биологической и биохимической характеристикой природой аутоантител.
Вскрытие аутоиммунной гемолитической анемии (АИГА) у животных, в частности у мышей NZB (Бильшовский и сотр.) освещает под новым углом патогенетическую взаиосвязь гемолитических аутоантител и лимфопролиферативных заболеваний. Даются ценные сведения о аутоиммунной гемолитической анемии (АИГА) при хронической лимфоцитной анемии (Pisciotta), рассматриваемой как злокачественное заболевание иммуной лимфоидной системы, способствующее утрате врожденной иммунной переносимости и развитию аутоантител (Burnet, Dameshek, Mackay и Burnet).
Проведенные после 1965 г. исследования уточнили диагностику отдельных форм аутоиммунной гемолитической анемии (АИГА) и описали некоторые частные виды, уточнение которых осуществляется также специфической иммуносерологической реакцией.
В настоящее время в нашем распоряжении имеется достаточное число клинических и биологических параметров, делаюших возможной классификацию аутоиммунной гемолитической анемии (АИГА) по научной номенклатуре. Считаем нецелесообразным применение прежней номенклатуры классических авторов, поскольку отграниченные ими формы гемолитической анемии крайне полиморфны, и большинство их не основывается на серологическом исследовании. Так, на современной стадии, представляют лишь историческое значение термины приобретенной гемолитической анемии вида Hayem-Vidal, Dyke-Young, Ledderer-Brill и пр.
Сохраняется термин острой гемолтическоий анемии с двухфазными агглютининами Donath-Landsteiner, описанной в 1904 г., но в настоящее время известной больше под названием холодовой пароксизмальной анемии; также название болезни Marchiafava-Michelli заменено термином ночной пароксизмальной гемоглобинурии.
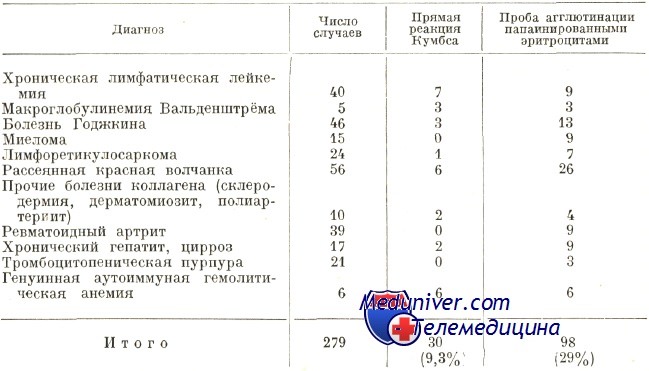
Статистика частоты генуинной аутоиммунной гемолитической анемии в Бухарестском Институте внутренней медицины (по Георгиу и сотр.)
Современная классификация основывается на внесенный иммуносерологической методологией вклад в дело уточнения механизмов аутоиммунного гемолиза с помощью полных и неполных антител (Dacie, Van Loghen, Worlledge, Dacie и Worlledge, Pirofsky, Leddy и сотр.), которые действуют при тепловых и Холодовых реакциях в процессе диагностирования. С клинической точки зрения понятия полных или неполных холодовых или тепловых антител в настоящее время достаточны для определения серологической характеристики той или иной АИГА.
Однако исследование специфической природы гемолитических аутоантител уточнило, что их наибольшая часть специфична для определенных групп крови. В то же время поскольку речь идет о иммуноглобулинах, они принадлежат основным классам IgG, IgM или IgA и в реакциях с антигенами связывают или не связывают комплемент (Werner и Vos, Worlledge, Leddy и сотр., Dacie и Worlledge).
С практической точки зрения постановкой диагноза аутоиммунной гемолитической анемии (АИГА) преследуется выделение двух основных групп — аутоиммунной гемолитической анемии с тепловыми антителами и аутоиммунной гемолитической анемии с холодовыми антителами. В обеих группах антитела бывают полными и неполными, однако, в принципе, в группе тепловых антител преобладают неполные. Следует отметить, что, при аутоиммунной гемолитической анемии с холодовыми антителами у данного больного в течение острого периода наблюдается одновременное наличие обоих видов — полных и неполных —, в то время как на хронической стадии — в основном неполные антитела.
В начале аутоиммунной гемолитической анемии были описаны как генуинные заболевания, тем не менее во всех последних статистиках первичные генуинные формы реже наблюдаются, в то время как вторичные — преобладают. В таблице на 279 случаях, находящихся под наблюдением Института внутренней медицины (Георгиу и сотр.), можно проследить распределение вторичных форм по отдельным группам заболеваний и невысокий показатель частоты генуинных форм, что противоречит статистике Worlledge. В иных статистиках значатся вторичные аутоиммунной гемолитической анемии при неоплазии, в основном яичников (Van Loghen), также при затяжных хронических инфекциях.
По Dacie распределение равномерное, по 50% на генуинную и соответственно вторичную формы; Worlledge говорит о 80% генуинных форм, вто время как Dausset и Colombani о 30%, a Pirofsky на 234 случаях отметил лишь 18,8%. Известно, что генуинные формы рассматриваются как таковые, поскольку отсутствуют признаки иных первичных или вторичных заболеваний. Во многих случаях после определенного периода эволюции генуинной АИГА появляются симптомы лимфопролиферативной или другой комплексной аутоиммунной болезни, такой как, РКВ, склеродермия, ЭХП (РСЕ). Однако, в отдельных случаях, генуинная форма диагностируется как аутоиммунный гемолиз лишь при использовании всего набора иммунологических тестов.
Недавно составленная нами в гематологической клинике больницы Фундень статистика на 70 случаях свидетельствует о 24 генуинных (34,2%) и 46 вторичных (67,8%) формах. В злокачественных заболеваниях крови наблюдается преобладание вторичных форм. Отнесение случаев к первичной или вторичной категории возможно зависит от профиля медицинского учреждения, под наблюдением которого находились больные. Это может объяснить высокий показатель численности форм вторичного заболевания, особенно при РКВ и ХЛЛ по более старым статистикам Института внутренней медицины.
Тяжелые формы аутоиммунной гемолитической анемии определяются характеризующим их видом антитела — холодовым и тепловым.
По нашему мнению формы с холодовыми антителами не выделяются в особую группу (Issit) и следовательно оба вида составляют одну лишь единицу аутоиммунной гемолитической анемии с серологической и клинической разницами (Brown, Берчану).
источник
Гемолитическая анемия – патология эритроцитов, отличительным признаком которой является ускоренное разрушение красных кровяных телец с высвобождением повышенного количества непрямого билирубина. Для гемолитических анемий типично сочетание анемического синдрома, желтухи и увеличения размеров селезенки. В процессе диагностики исследуется общий анализ крови, уровень билирубина, анализ кала и мочи, УЗИ органов брюшной полости; проводится биопсия костного мозга, иммунологические исследования. В качестве методов лечения гемолитической анемии используется медикаментозная, гемотрансфузионная терапия; при гиперспленизме показана спленэктомия.
Гемолитическая анемия — анемия, обусловленная нарушением жизненного цикла эритроцитов, а именно преобладанием процессов их разрушения (эритроцитолиза) над образованием и созреванием (эритропоэзом). Группа гемолитических анемий очень обширна. Их распространенность неодинакова в различных географических широтах и возрастных группах; в среднем патология встречается у 1% населения. Среди прочих видов анемий на долю гемолитических приходится 11%. При гемолитической анемии жизненный цикл эритроцитов укорочен и их распад (гемолиз) происходит раньше времени (через 14-21 день вместо 100-120 суток в норме). При этом разрушение эритроцитов может происходить непосредственно в сосудистом русле (внутрисосудистый гемолиз) или в селезенке, печени, костном мозге (внесосудистый гемолиз).
В гематологии гемолитические анемии подразделяются на две большие группы: врожденные (наследственные) и приобретенные.
Наследственные гемолитические анемии включают следующие формы:
- эритроцитарные мембранопатии (микросфероцитоз – болезнь Минковского-Шоффара, овалоцитоз, акантоцитоз) – гемолитические анемии, обусловлены структурными аномалиями мембран эритроцитов
- ферментопении (энзимопении) – гемолитические анемии, вызванные дефицитом тех или иных ферментов (глюкозо-6-фосфатдегидрогеназы, пируваткиназы и др.)
- гемоглобинопатии — гемолитические анемии, связанные с качественными нарушениями структуры гемоглобина или изменением соотношения его нормальных форм (талассемия, серповидно-клеточная анемия).
Приобретенные гемолитические анемии подразделяются на:
- мембранопатии приобретенные (пароксизмальная ночная гемоглобинурия – б-нь Маркиафавы-Микели, шпороклеточная анемия)
- иммунные (ауто- и изоиммунные анемии) – обусловлены воздействием антител
- токсические – гемолитические анемии, обусловленные воздействием химических веществ, биологических ядов, бактериальных токсинов
- гемолитические анемии, вызванные механическим повреждением структуры эритроцитов (тромбоцитопеническая пурпура, маршевая гемоглобинурия)
Патогенетическую основу наследственных гемолитических анемий составляют генетические дефекты мембран эритроцитов, их ферментных систем либо структуры гемоглобина. Данные предпосылки обусловливают морфо-функциональную неполноценность эритроцитов и их повышенное разрушение. Гемолиз эритроцитов при приобретенных анемиях наступает под влиянием внутренних факторов или факторов окружающей среды.
Развитию иммунных гемолитических анемий могут способствовать посттрансфузионные реакции, профилактическая вакцинация, гемолитическая болезнь плода, прием определенных лекарств (противомалярийных препаратов, сульфаниламидов, производных нитрофуранового ряда, анальгетиков). Аутоиммунные реакции с образованием антител, агглютинирующих эритроциты, возможны при гемобластозах (остром лейкозе, хроническом лимфолейкозе, лимфогранулематозе, миеломной болезни), аутоиммунной патологии (СКВ, неспецифическом язвенном колите), инфекционных заболеваниях (инфекционном мононуклеозе, токсоплазмозе, сифилисе, вирусной пневмонии).
В ряде случаев острому внутрисосудистому гемолизу предшествует отравление мышьяковистыми соединениями, тяжелыми металлами, уксусной кислотой, грибными ядами, алкоголем и др. Механическое повреждение и гемолиз эритроцитов может наблюдаться при тяжелых физических нагрузках (длительной ходьбе, беге, лыжном переходе), при ДВС-синдроме, малярии, злокачественной артериальной гипертензии, протезировании клапанов сердца и сосудов, проведении гипербарической оксигенации, сепсисе, обширных ожогах. В этих случаях под действием тех или иных факторов происходит травматизация и разрыв мембран изначально полноценных эритроцитов.
Центральным звеном патогенеза гемолитических анемий является повышенное разрушение эритроцитов в органах ретикулоэндотелиальной системы (селезенке, печени, костном мозге, лимфатических узлах) или непосредственно в сосудистом русле. Эти процессы сопровождаются развитием анемического и желтушного синдромов (так называемой «бледной желтухой»). Возможно интенсивное окрашивание кала и мочи, увеличение селезенки и печени.
Наиболее распространенной формой данной группы гемолитических анемий является микросфероцитоз, или болезнь Минковского-Шоффара. Наследуется по аутосомно-доминантному типу; обычно прослеживается у нескольких представителей семьи. Дефектность эритроцитов обусловлена дефицитом в мембране актомиозиноподобного белка и липидов, что приводит к изменению формы и диаметра эритроцитов, их массивному и преждевременному гемолизу в селезенке.
Манифестация микросфероцитарной гемолитической анемии возможна в любом возрасте (в младенчестве, юношестве, старости), однако обычно проявления возникают у детей старшего возраста и подростков. Тяжесть заболевания варьирует от субклинического течения до тяжелых форм, характеризующихся часто повторяющимися гемолитическими кризами. В момент криза нарастает температура тела, головокружение, слабость; возникают боли в животе и рвота.
Основным признаком микросфероцитарной гемолитической анемии служит желтуха различной степени интенсивности. Вследствие высокого содержания стеркобилина кал становится интенсивно окрашенным в темно-коричневый цвет. У пациентов с болезнь Минковского-Шоффара наблюдается склонность к образованию камней в желчном пузыре, поэтому часто развиваются признаки обострения калькулезного холецистита, возникают приступы желчной колики, а при закупорке холедоха конкрементом — обтурационная желтуха. При микросфероцитарной гемолитической анемии во всех случаях увеличена селезенка, а у половины пациентов – еще и печень.
Кроме наследственной микросфероцитарной гемолитической анемии, у детей часто встречаются другие врожденные дисплазии: башенный череп, косоглазие, седловидная деформация носа, аномалии прикуса, готическое нёбо, полидактилия или брадидактилия и пр. Пациенты среднего и пожилого возраста страдают трофическими язвами голени, которые возникают в результате гемолиза эритроцитов в капиллярах конечностей и плохо поддаются лечению.
Энзимопенические гемолитические анемии связаны с недостатком определенных ферментов эритроцитов (чаще — Г-6-ФД, глутатион-зависимых ферментов, пируваткиназы и др). Гемолитическая анемия может впервые заявлять о себе после перенесенного интеркуррентного заболевания или приема медикаментов (салицилатов, сульфаниламидов, нитрофуранов). Обычно заболевание имеет ровное течение; типична «бледная желтуха», умеренная гепатоспленомегалия, сердечные шумы. В тяжелых случаях развивается ярко выраженная картина гемолитического криза (слабость, рвота, одышка, сердцебиение, коллаптоидное состояние). В связи с внутрисосудистым гемолизом эритроцитов и выделением гемосидерина с мочой последняя приобретает темный (иногда черный) цвет.
Особенностям клинического течения гемоглобинопатий — талассемии и серповидно-клеточной анемии посвящены самостоятельные обзоры.
Среди различных вариантов приобретенных гемолитических анемий чаще других встречаются аутоиммунные анемии. Для них общим пусковым фактором выступает образование антител к антигенам собственных эритроцитов. Гемолиз эритроцитов может носить как внутрисосудистый, так и внутриклеточный характер.
Гемолитический криз при аутоиммунной анемии развивается остро и внезапно. Он протекает с лихорадкой, резкой слабостью, головокружением, сердцебиением, одышкой, болями в эпигастрии и пояснице. Иногда острым проявлениям предшествуют предвестники в виде субфебрилитета и артралгий. В период криза стремительно нарастает желтуха, не сопровождающаяся кожным зудом, увеличивается печень и селезенка.
При некоторых формах аутоиммунных гемолитических анемий больные плохо переносят холод; в условиях низких температур у них может развиваться синдром Рейно, крапивница, гемоглобинурия. Вследствие недостаточности кровообращения в мелких сосудах возможны осложнения в виде гангрены пальцев ног и рук.
Токсические гемолитические анемии протекают с прогрессирующей слабостью, болями в правом подреберье и поясничной области, рвотой, гемоглобинурией, высокой температурой тела. Со 2-3 суток присоединяется желтуха и билирубинемия; на 3-5 сутки возникает печеночная и почечная недостаточность, признаками которых служат гепатомегалия, ферментемия, азотемия, анурия.
Отдельные виды приобретенных гемолитических анемий рассмотрены в соответствующих статьях: «Гемоглобинурия» и «Тромбоцитопеническая пурпура», «Гемолитическая болезнь плода».
Определение формы гемолитической анемии на основе анализа причин, симптоматики и объективных данных относится к компетенции гематолога. При первичной беседе выясняется семейный анамнез, частота и тяжесть протекания гемолитических кризов. В процессе осмотра оценивается окраска кожных покровов, склер и видимых слизистых, производится пальпация живота для оценки величины печени и селезенки. Сплено- и гепатомегалия подтверждается при проведении УЗИ печени и селезенки.
Изменения в гемограмме характеризуются нормо- или гипохромной анемией, лейкопенией, тромбоцитопенией, ретикулоцитозом, ускорением СОЭ. При аутоиммунных гемолитических анемиях большое диагностическое значение имеет положительная проба Кумбса. В биохимических пробах крови определяется гипербилирубинемия (увеличение фракции непрямого билирубина), увеличение активности лактатдегидрогеназы. Исследование мочи выявляет протеинурию, уробилинурию, гемосидеринурию, гемоглобинурию. В копрограмме повышено содержание стеркобилина. Исследование пунктата костного мозга обнаруживает гиперплазию эритроидного ростка.
В процессе дифференциальной диагностики исключаются гепатиты, цирроз печени, портальная гипертензия, гепатолиенальный синдром, гемобластозы.
Различные формы гемолитической анемии имеют свои особенности и подходы к лечению. При всех формах приобретенной гемолитической анемии необходимо позаботиться об устранении влияния гемолизирующих факторов. Во время гемолитических кризов больным необходимы инфузии растворов, плазмы крови; витаминотерапия, по необходимости – гормоно- и антибиотикотерапия. При микросфероцитозе единственно эффективным методом, приводящим к 100 % прекращению гемолиза, является спленэктомия.
При аутоиммунной гемолитической анемии показана терапия глюкокортикоидными гормонами (преднизолоном), сокращающая или прекращающая гемолиз. В некоторых случаях требуемый эффект достигается назначением иммунодепрессантов (азатиоприна, 6-меркаптопурина, хлорамбуцила), противомалярийных препаратов (хлорохина). При резистентных к медикаментозной терапии формах аутоиммунной гемолитической анемии выполняется спленэктомия.
Лечение гемоглобинурии предполагает переливание отмытых эритроцитов, плазмозаменителей, назначение антикоагулянтов и антиагрегантов. Развитие токсической гемолитической анемии диктует необходимость проведения интенсивной терапии: дезинтоксикации, форсированного диуреза, гемодиализа, по показаниям – введение антидотов. При развитии почечной недостаточности прогноз неблагоприятен.
источник
РЦРЗ (Республиканский центр развития здравоохранения МЗ РК)
Версия: Клинические протоколы МЗ РК — 2016
Аутоиммунные гемолитические анемии (АИГА) — гетерогенная группа аутоагрессивных заболеваний и синдромов, обусловленных разрушением эритроцитов, которое вызвано неконтролируемой продукцией антител против собственных эритроцитов.
Соотношение кодов МКБ-10 и МКБ-9:
| МКБ-10 | МКБ-9 | ||
| Код | Название | Код | Название |
| D59.0 | Медикаментозная аутоиммунная гемолитическая анемия | 283.0 | Аутоиммунные гемолитические анемии |
| D59.1 | Другие аутоиммунные гемолитические анемии Аутоиммунная гемолитическая болезнь (холодовый тип) (тепловой тип) Хроническая болезнь, вызываемая холодовыми гемагглютининами «Холодовая агглютининовая»: болезнь . гемоглобинурия Гемолитическая анемия: . холодовый тип (вторичная) (симптоматическая) . тепловой тип (вторичная) (симптоматическая) Исключены: синдром Эванса (D69.3) гемолитическая болезнь плода и новорожденного (P55.-) пароксизмальная холодовая гемоглобинурия (D59.6) | ||
Дата разработки/пересмотра протокола: 2016 год.
Пользователи протокола: врачи скорой медицинской помощи, врачи общей практики, терапевты, гематологи.
Категория пациентов: взрослые.
Шкала уровня доказательности:
| A | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки результаты которых могут быть распространены на соответствующую популяцию. |
| B | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| C | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+). Результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов. |
Классификация [2]:
АИГА делят на идиопатические (первичные) и симптоматические (вторичные). У более чем 50% пациентов развитие АИГА имеет вторичный характер (таблица 1).
В 10% случаев АИГА причиной гемолиза являются различные лекарственные препараты. [2] Список препаратов, которые могут вызывать развитие аутоиммунного гемолиза или приводить к выявлению антиэритроцитарных антител – см. приложение 1.
Cерологические свойства аутоантител легли в основу деления АИГА на четыре формы:
· с неполными тепловыми агглютининами (80% всех больных);
· с полными холодовыми агглютининами (12—15% всех случаев);
· с тепловыми гемолизинами;
· с двухфазными холодовыми гемолизинами Доната—Ландштейнера (крайне редкая и, как правило, вторичная форма при сифилисе и вирусных инфекциях).
Таблица 1 — Частота и типы антител при вторичной АИГА[1]
| Заболевание или состояние * | Частота АИГА, % | АИГА с тепловыми аутоантителами | АИГА с холодовыми аутоантителами |
| ХЛЛ | 2.3-4.3 | 87% | 7% |
| НХЛ (кроме ХЛЛ) | 2,6 | Более часто | м |
| IgM гаммапатия | 1,1 | нет | все |
| Лимфома Ходжкина | 0,19-1,7 | Почти все | редко |
| Солидные опухоли | Очень редко | 2/3 | 1/3 |
| Дермоидная киста яичников | Очень редко | все | нет |
| СКВ | 6,1 | Почти все | редко |
| Неспецифический язвенный колит | 1,7 | все | нет |
| Общий вариабельный иммунодефицит | 5,5 | все | нет |
| Аутоиммунные лимфопролиферативные заболевания | 50 | все | нет |
| После аллогенной ТКМ | 44 | да | да |
| После трансплантации органов | 5,6 (поджелудочная железа) | да | нет |
| Медикаментозно-индуцированная при ХЛЛ | 2.9-10.5 очень редко | Почти все | редко |
| Интерферон | Частота 11.5/100 000 пациент-лет | все | нет |
ДИАГНОСТИКА НА АМБУЛАТОРНОМ УРОВНЕ (УД – В) [1]
Диагностические критерии:
Жалобы и анамнез:
Основными синдромами при гемолитических анемиях являются:
· нормоцитарная анемия с быстро нарастающей слабостью и плохой адаптацией даже к умеренному снижению гемоглобина.
В зависимости от уровня гемоглобина выделяют 3 степени тяжести анемии:
· I (легкая степень)- Нв более 90 г/л;
· II (средняя степень)- от 90 до 70 г/л;
· III (тяжелая степень)- менее 70 г/л.
Клинически тяжесть состояния пациента не всегда соответствует уровню гемоглобина: остро развившаяся анемия сопровождается значительно более выраженной симптоматикой, чем хроническая, при которой есть время для адаптации органов и тканей. Пожилые пациенты переносят анемию хуже, чем молодые, поскольку компенсаторные возможности сердечно-сосудистой системы у них, как правило, снижены.
При гемолитическом кризе признаки тяжелой анемии являются выраженными на фоне острого начала:
· лихорадки;
· боли в животе;
· головной боли;
· рвоты;
· олигурии и анурии с последующим развитием шока.
Синдром гемолиза, который может проявляться жалобами на:
· иктеричность кожи и видимых слизистых оболочек (желтуха);
· потемнение мочи.
· при внутрисосудистом гемолизе цвет мочи может быть от розового до почти черного. Цвет зависит от концентрации гемоглобина, степени диссоциации гема. Цвет мочи при гемоглобинурии необходимо отличать от гематурии, когда при микроскопическом исследовании видны целые эритроциты. Цвет мочи может быть также красным из-за приема лекарственных препаратов (антипирин), пищи (свеклы) или при порфирии, миоглобинурии, которая развивается при определенных состояниях (массивное травматичное повреждение мышц, электрический шок, артериальный тромбоз и др.).
· появление чувствительности при давлении, чувства тяжести или боли в левом подреберье, связанные с увеличением селезенки. Чаще степень увеличения селезенки имеет незначительный или умеренный характер.
У более чем 50% пациентов развитие АИГА имеет вторичный характер, в связи с чем в клинической картине могут доминировать симптомы основного заболевания (таблица 1).
Физикальное обследование:
Результаты физикального обследования определяются темпом и степенью гемолиза, наличием или отсутствием коморбидности, заболеваний, вызвавших развитие АИГА. В стадии компенсации состояние удовлетворительное, может отмечаться легкая субиктеричность кожных покровов, видимых слизистых, небольшая спленомегалия, признаки основного заболевания, например, СКВ, лимфопролиферативного заболевания и др. В этой ситуации наличие легкой АИГА может быть не диагностировано.
При гемолитическом кризе:
· состояние средней тяжести или тяжелое;
· бледность кожи и слизистых;
· расширение границ сердца, глухость тонов, тахикардия, систолический шум на верхушке;
· одышка;
· слабость;
· головокружение;
· билирубиновая интоксикация: иктеричность кожи и слизистых, тошнота, рвота, боли в животе, головокружение, головные боли, лихорадка, в некоторых случаях расстройства сознания, судороги;
· при внутриклеточном гемолизе: гепатоспленомегалия;
· при смешанном и внутрисосудистом гемолизе: изменение мочи за счет гемоглобинурии.
Лабораторные исследования:
· Общий анализ крови, в т. ч. тромбоцитов и ретикулоцитов: анемия разной степени тяжести нормохромная; ретикулоцитоз, лейкоцитоз со сдвигом лейкоцитарной формулы влево в период криза; в мазке периферической крови, как правило, микросфероциты;
· биохимический анализ крови:
· билирубин с фракциями (гипербилирубинемия, преобладает непрямая, неконъюгированная фракция),
· ЛДГ (повышение активности ЛДГ в сыворотке в 2—8 раз в зависимости от интенсивности гемолиза),
· гаптоглобин – показатель гемолиза;
· общий белок, альбумин, креатинин, мочевина, АЛТ, АСТ, ГГТП, С-реактивный белок, щелочная фосфотаза – оценка состояния печени, почек
· глюкоза – исключение диабета;
· прямая проба Кумбса в большинстве случаев – положительная, но при массивном гемолизе, а также при холодовых и гемолизиновых формах АИГА, вызванных IgА или IgM- аутоантителами, может быть отрицательной.
· титр холодовых агглютининов;
· непрямая проба Кумбса (обязательна при интенсивном гемолизе и предшествующих трансфузиях эритроцитов);
· гемосидерин в моче – исключение внутрисосудистого гемолиза;
· общий анализ мочи (обязательна визуальная оценка цвета мочи);
· определение меди в суточной моче, церулоплазмина в сыворотке крови – исключение болезни Вильсона-Коновалова;
· пункция костного мозга (гиперплазия и морфология эритроидного ростка, количество и морфология лимфоцитов, комплексы метастатических клеток);
· трепанобиопсия (при необходимости) – исключение вторичной АИГА;
· иммунофенотипирование лимфоцитов (при лимфоцитозе периферической крови и удаленной селезенке) – исключение вторичной АИГА;
· витамин В12, фолат – исключение мегалобластных анемий ;
· показатели обмена железа (в том числе трансферрин, ферритин сыворотки и эритроцитов)- исключение железодефицита;
· развернутая коагулограмма + волчаночный антикоагулянт – оценка состояния гемостаза, исключение АФС;
· ревматологические пробы (антитела к нативной ДНК, ревматоидный фактор, антинуклеарный фактор, антитела к кардиолипиновому антигену) — исключение вторичной АИГА;
· иммуноглобулины сыворотки (G, A, M) + криоглобулины;
· при необходимости—гормоны щитовидной железы, простатический специфический антиген, онкомаркеры- исключение вторичной АИГА;
· определение группы крови по системе АВ0, резус-фактора;
· анализ крови на ВИЧ – при необходимости трансфузии;
· анализ крови на сифилис – стандартное обследование на любом уровне;
· определение HBsAg в сыворотке крови методом ИФА – скрининг на гепатит В;
· определение суммарных антител к вирусу гепатита С (HCV) в сыворотке крови методом ИФА – скрининг на гепатит С.
Инструментальные исследования:
· рентгенография легких (при необходимости КТ);
· ФГДС;
· ирригоскопия/ректороманоскопия/колоноскопия;
· УЗИ органов брюшной полости и внутрибрюшных лимфатических узлов, малого таза, предстательной железы, щитовидной железы.
Диагностический алгоритм (схема 1 [1]):
ДИАГНОСТИКА И ЛЕЧЕНИЕ НА ЭТАПЕ СКОРОЙ НЕОТЛОЖНОЙ ПОМОЩИ [1]
Диагностические мероприятия:
· сбор жалоб, анамнеза;
· физикальное обследование.
Медикаментозное лечение: нет.
ДИАГНОСТИКА НА СТАЦИОНАРНОМ УРОВНЕ [1,5]
Диагностические критерии: см. амбулаторный уровень.
Диагностический алгоритм: см. амбулаторный уровень.
Перечень основных диагностических мероприятий:
· общий анализ крови (подсчет лейкоформулы, тромбоцитов и ретикулоцитов в мазке);
· биохимический анализ крови (общий билирубин, прямой билирубин, ЛДГ);
· прямая проба Кумбса.
Перечень дополнительных диагностических мероприятий:
· определение уровня гаптоглобина;
· группа крови и резус фактор;
· биохимический анализ крови (общий белок, альбумин, общий билирубин, прямой билирубин, креатинин, мочевина, АЛаТ, АСаТ, глюкоза, ЛДГ, ГГТП, С-реактивный белок, щелочная фосфотаза);
· обмен железа (определение уровня сывороточного железа, общей железосвязывающей способности сыворотки и уровень ферритина);
· определение концентрации фолиевой кислоты и витамина В12;
· иммунофенотипирование лимфоцитов (при лимфоцитозе, подозрении на лимфопролиферативное заболевание, неэффективности терапии кортикостероидами);
· Электрофорез белков сыворотки и мочи с иммунофиксацией (при лимфоцитозе, подозрении на лимфопролиферативное заболевание, неэффективности терапии кортикостероидами);
· миелограмма;
· ИФА на маркеры вирусных гепатитов;
· ИФА на маркеры ВИЧ;
· ИФА на маркеры вирусов герпес-группы;
· коагулограмма, волчаночный антикоагулянт;
· проба Реберга-Тареева (определение скорости клубочковой фильтрации);
· титр холодовых агглютининов;
· непрямая проба Кумбса (обязательна при интенсивном гемолизе и предшествующих трансфузиях эритроцитов);
· определение гемосидерина, меди и гемоглобина в моче;
· трепанобиопсия костного мозга с гистологическим исследованием;
· витамин В12, фолат;
· показатели обмена железа (в том числе трансферрин, ферритин сыворотки и эритроцитов);
· коагулограмма + волчаночный антикоагулянт;
· ревматологические пробы (антитела к нативной ДНК, ревматоидный
· фактор, антинуклеарный фактор, антитела к кардиолипиновому антигену);
· иммуноглобулины сыворотки (G, A, M) + криоглобулины;
· гормоны щитовидной железы, простатический специфический антиген, онкомаркеры;
· общий анализ мочи;
· рентгенография органов грудной клетки;
· эзофагогастродуоденоскопия;
· ирригоскопия/ректороманоскопия/колоноскопия;
· УЗИ органов брюшной полости и внутрибрюшных лимфатических узлов, малого таза, предстательной железы, щитовидной железы;
· УЗДГ артерий и вен;
· ЭКГ;
· эхокардиография;
· суточное мониторирования АД;
· суточное мониторирование ЭКГ.
Дифференциальный диагноз и обоснование дополнительных исследований:
| Диагноз | Обоснование для дифференциальной диагностики | Обследования | Критерии подтверждения диагноза |
| АИГА с неполными тепловыми агглютининами (первичная) | Наличие анемии, гемолиза | Прямая проба Кумбса, пункция костного мозга (гиперплазия и морфология эритроидного ростка, количество и морфология лимфоцитов, комплексы метастатических клеток); иммунофенотипирование лимфоцитов (при лимфоцитозе периферической крови и удаленной селезенке); Ревматологические пробы (антитела к нативной ДНК, ревматоидный фактор, антинуклеарный фактор, антитела к кардиолипиновому антигену); иммуноглобулины сыворотки (G, A, M) + криоглобулины; гормоны щитовидной железы, простатический специфический антиген, онкомаркеры); • УЗИ органов брюшной полости и внутрибрюшных лимфатических узлов, малого таза, предстательной железы, щитовидной железы; • рентгенография легких (при необходимости КТ); колоноскопия | положительная прямая проба Кумбса, отсутствие данных за вторичный характер анемии |
| АИГА с полными холодовыми агглютининами | Наличие анемии, синдрома гемолиза | титр холодовых агглютининов; общий анализ мочи (обязательна визуальная оценка цвета мочи); определение гемосидерина иммуноглобулины сыворотки (G, A, M) + криоглобулины; | В клинической картине- непереносимость холода (посинение, а затем побеление пальцев рук, ног, ушей, кончика носа, резкая боль в конечностях), сезонность заболевания. При обследовании- невозможность определения группы крови и подсчета эритроцитов, появление М-градиента, высокий титр холодовых антител при t 4 0 |
| Наследственные гемолитические анемии | Наличие анемии, синдрома гемолиза | Прямая проба Кумбса, УЗИ желчного пузыря, селезенки, морфология эритроцитов, при необходимости- определение активности ферментов эритроцитов, электроферез гемоглобина | Анамнез с детства, оттягощенная наследственность, при осмотре- стигмы эмбриогенеза, отрицательная прямая проба Кумбса |
| В12-дефицитная анемия | Наличие анемии, синдрома гемолиза | Исследование витамина В12 | Фуникулярный миелоз, снижение витамина В12 Отрицательная прямая проба Кумбса |
| Болезнь Вильсона | Наличие анемии, синдрома гемолиза в дебюте заболевания | Прямая проба Кумбса, исследование меди в моче, церулоплазмина в крови, консультация невропатолога, окулиста | Признаки поражения нервной системы, печени, наличие колец Кайзера — Флейшера, снижение уровня церулоплазмина в плазме крови, снижение содержания меди в плазме крови, повышение экскреции меди с мочой |
| ПНГ | Наличие анемии, синдрома гемолиза | иммунофенотипирование периферической крови для выяления процента ПНГ эритроцитов I, II и III типов методом проточной цитофлуориметрии | пробы сахарозная и Хема положительные; иммунофенотипирование- экспрессия GPI-связанных протеинов; сыворотка больного не вызывает гемолиз эритроцитов донора |
Получить консультацию по медтуризму
Получить консультацию по медтуризму
| Азатиоприн (Azathioprine) |
| Алемтузумаб (Alemtuzumab) |
| Алендроновая кислота (Alendronic acid) |
| Альфакальцидол (Alfakaltsidol) |
| Амикацин (Amikacin) |
| Амлодипин (Amlodipine) |
| Амоксициллин (Amoxicillin) |
| Атенолол (Atenolol) |
| Ацикловир (Acyclovir) |
| Валацикловир (Valacyclovir) |
| Валганцикловир (Valganciclovir) |
| Вода для инъекций (Water for Injection) |
| Ганцикловир (Ganciclovir) |
| Декстроза (Dextrose) |
| Допамин (Dopamine) |
| Дротаверин (Drotaverinum) |
| Золедроновая кислота (Zoledronic Acid) |
| Имипенем (Imipenem) |
| Калия хлорид (Potassium chloride) |
| Кальция карбонат (Calcium carbonate) |
| Каптоприл (Captopril) |
| Кетопрофен (Ketoprofen) |
| Клавулановая кислота (Clavulanic acid) |
| Левофлоксацин (Levofloxacin) |
| Лизиноприл (Lisinopril) |
| Маннитол (Mannitol) |
| Меропенем (Meropenem) |
| Метилпреднизолон (Methylprednisolone) |
| Микофеноловая кислота (Микофенолата мофетил) (Mycophenolic acid (Mycophenolate mofetil)) |
| Надропарин кальция (Nadroparin calcium) |
| Натрия хлорид (Sodium chloride) |
| Небиволол (Nebivolol) |
| Омепразол (Omeprazole) |
| Парацетамол (Paracetamol) |
| Пневмококковая вакцина (Pneumococcal vaccine) |
| Преднизолон (Prednisolone) |
| Рабепразол (Rabeprazole) |
| Ризедроновая кислота (Risedronic acid) |
| Ритуксимаб (Rituximab) |
| Торасемид (Torasemide) |
| Фамцикловир (Famciclovir) |
| Флуконазол (Fluconazole) |
| Фолиевая кислота (Folic acid) |
| Хлоропирамин (Chloropyramine) |
| Циклоспорин (Cyclosporine) |
| Циклофосфамид (Cyclophosphamide) |
| Ципрофлоксацин (Ciprofloxacin) |
| Эноксапарин натрия (Enoxaparin sodium) |
| Эритроцитная взвесь лейкофильтрованная |
ЛЕЧЕНИЕ НА АМБУЛАТОРНОМ УРОВНЕ (УД – В) [1]
Тактика лечения [3]: только при отсутствии показаний к госпитализации: на амбулаторном этапе часто продолжается лечение, начатое в стационаре, мониторинг клинико-лабораторных показателей с дальнейшей коррекцией терапии.
Немедикаментозное лечение:
Режим II. При длительной терапии ГКС регулярные физические упражнения, устранение факторов риска случайных потерь равновесия, падений (С), отказ от курения. При АИГА с холодовыми антителами избегать переохлаждений.
Диета: с целью профилактики глюкокортикоидного остеопороза адекватное потребление кальция и витамина D, ограничение потребления алкоголя (D).
Медикаментозное лечение:
Перечень основных лекарственных средств:
· Преднизолон;
Перечень дополнительных лекарственных средств
· Ритуксимаб концентрат для приготовления раствора для инфузии 100 мг;
· Циклоспорин;
· Амлодипин;
· лизиноприл;
· атенолол;
· торасемид;
· фолиевая кислота;
· алендронат;
· ризедронат;
· золендронат;
· альфакальцидол;
· карбонат кальция;
· парацетамол;
· хлорпирамин;
· омепразол;
· эноксапарин;
· надропарин;
· амоксициллин/клавулановая кислота;
· левофлоксацин;
· раствор натрия хлорида.
Терапия АИГА в настоящее время не базируется исключительно на основе ретроспективных и нескольких проспективных исследований при отсутствии рандомизированных исследований и не имеет высокого уровня доказательности. Также отсутствуют формальные консенсусы по определению полной или частичной ремиссии. Таким образом, описанные далее рекомендации по терапии АИГА имеют уровень доказательности Д.
Первая линия терапии.
Глюкокортикостероиды.
Первой линией терапии для пациентов с АИГА с тепловыми антителами являются глюкокортикостероиды. Стартовая доза преднизолона или метипреднизолона 1 мг/кг (внутрь или внутривенно[1]). Обычно в течение 1-3 недель стартовой терапии (проводимой в стационаре) уровень гематокрита увеличивается более чем 30% или уровень гемоглобина более 100 г/л (необходимости в нормализации уровня гемоглобина нет). В случае, если терапевтическая цель достигнута, доза преднизолона снижается до 20-30 мг в сутки в течение нескольких недель. В случае, если данные цели не достигаются к концу 3й недели, то подключают терапию второй линии. Снижение дозы преднизолона продолжается на амбулаторном этапе. Медленное снижение дозы преднизолона проводят в случае достижения терапевтического эффекта. Снижать дозу преднизолона начинают по 5—10 мг за 2—3 дня и продолжают до тех пор, пока суточная доза не достигнет 20—30 мг. Далее отмена препарата проводится значительно медленнее — по 2,5 мг за 5—7 дней. После достижения дозы ниже 10—15 мг темп отмены должен быть еще больше замедлен: по 2,5 мг каждые 2 недели с целью полной отмены препарата. Такая тактика предполагает продолжительность приема преднизолона в течение 3—4 месяцев. Проводится мониторинг уровня гемоглобина, ретикулоцитов. В случае, если в течение 3-4 месяцев при приеме преднизолона в дозе 5 мг в сутки сохраняется ремиссия, должна быть предпринята попытка полной отмены препарата. Стремление к быстрому уменьшению дозы с момента нормализации гемоглобина из-за побочного действия ГК (кушингоид, стероидные язвы, артериальная гипертензия, угревая сыпь с формированием гнойничков на коже, бактериальные инфекции, сахарный диабет, остеопороз, венозные тромбозы) всегда приводит к рецидиву гемолиза. Фактически, пациенты, получающие низкие дозы ГКС более 6 месяцев имеют меньшую частоту рецидивов и большую продолжительность ремиссии по сравнению с пациентами, которые прекратили терапию до 6 месяцев терапии [2]. Сопроводительная терапия при лечении стероидами может включать бифосфонаты, витамин Д, кальций, поддерживающую терапию фолиевой кислотой. Проводится мониторинг уровня глюкозы крови и активное лечение диабета, так диабет является большим фактором риска смерти из-за инфекции. Необходимо оценивать риска тромбоэмболии легочной артерии, особенно у пациентов с АИГА и волчаночным антикоагулянтом или рецидивом АИГА после спленэктомии 38.
Терапия 1 линии ГКС эффективна у 70–85% пациентов; однако большинству пациентов для сохранения уровня гемоглобина в пределах 90-100 г/л требуется поддерживающая терапия ГКС, у 50% достаточной является доза 15 мг/сутки и меньше и приблизительно 20-30% пациентов необходимы более высокие дозы преднизолона. Считают, что монотерапия ГКС эффективна менее чем у 20% пациентов[3]. У пациентов с резистентностью к 1 линии терапии необходимо повторно оценить возможность вторичной АИГА, так как АИГА с тепловыми агглютининами, ассоциированная с злокачественными опухолями, НЯК, тератомой яичников или с IgM являются часто стероидорефрактерными.
Вторая линия терапии.
Спленэктомия.
После проведения спленэктомии повышается риск тяжелых инфекций, связанных с Streptococcus pneumoniae, Neisseria meningitidis, Haemophilus influenzae. Пациентам назначаются поливалентные пневмококковые, менингококковые, Капсулярный полисахарид Haemophilus influenzaе типа b (PRP) конъюгированного со столбнячным анатоксином (TT) вакцины за 2-4 недели до спленэктомии. У пациентов, получавших в последние 6 месяцев ритуксимаб вакцинация может быть неэффективной. После операции- тромбопрофилактика низкими дозами низкомолекулярных гепаринов; постепенная отмена ГКС согласно описанной выше схеме, пневмококковая вакцина- каждые 5 лет. Пациенты после спленэктомии должны быть информированы о риске инфекций и необходимости при любом фебрильном эпизоде принимать антибиотики из группы пенициллинов или респираторных фторхинолонов (левофлоксацин); также они должны быть информированы о риске венозных тромбоэмболий.
Ритуксимаб.
Показания для назначения ритуксимаба:
· резистентные формы АИГА с нарастающим количеством различных осложнений;
· отказ от спленэктомии;
· пожилой возраст с высокой степенью риска осложнений первой и второй линий терапии
· противопоказания к спленэктомии, высокий риск венозных тромбоэмболий.
Противопоказания к назначению ритуксимаба:
· непереносимость препарата;
· активный гепатит В и С;
· острая вирусная или бактериальная инфекция.
Стандартный режим — 375 мг/м2 в 1, 8, 15 и 22й дни. Пациенты, находящиеся на терапии ГКС до начала терапии ритуксимабом, должны продолжать прием ГКС до первых признаков ответа на ритуксимаб.
Эффективность ритуксимаба в стандартной дозе при АИГА с тепловыми антителами: общий ответ 83-87%, полный ответ 54-60, безрецидивная выживаемость у 72% в течение 1 года и 56%- в течение 2 лет [4].
Время наступления ответа варьирует от 1 месяца у 87,5% до 3 месяцев- 12,5 % [5]. При повторном курсе эффективность ритуксимаба может быть более высокой по сравнению с первым курсом. Ответ на терапию наблюдается в монорежиме или в комбинации с ГКС, иммуносупресантами иинтерфероном –α и не зависит от первичной терапии [7].
Токсичность терапии: Препарат имеет хороший профиль безопасности. Очень редко, как правило, после первой инфузии лихорадка, озноб, сыпь, или боль в горле. Более серьезные реакции включают сывороточную болезнь и (очень редко), бронхоспазм, анафилактический шок, тромбоэмболии легочной артерии, тромбоз артерий сетчатки, инфекции (эпизоды инфекции приблизительно у 7%), и развитие фульминантного гепатита за счёт реактивации гепатита В. В редких случаях прогрессивная мультифокальная лейкоэнцефалопатия.
Ритуксимаб в низкой дозе (100 мг/неделю в течение 4 недель) в качестве первой или второй линии терапии дает общий ответ в 89% (полный ответ в 67%) и безрецидивный период в течение 36 месяцев у 68%. Приблизительно 70% пациентов, получавших ГКС и ритуксимаб имели ремиссию 36 месяцев по сравнению с 45% пациентов, которые получали монотерапию стероидами [6].
Иммуносупрессивные препараты.
Основным фактором выбора иммуносупрессивного препарата должна быть безопасность пациента, потому что ожидаемая эффективность всех препаратов низкая и лечение может быть более опасным для пациента, чем лечение заболевания (таблица 2). При длительном лечении поддерживающая терапия может проводиться на амбулаторном этапе под контролем специалиста.
Таблица 2 — Иммуносупрессивная терапия АИГА
| Препарат | Дозировка | Эффективность | Примечание |
| Азатиоприн | 100-150 мг/день или 1—2,5 мг/сут на длительный период (4—6 мес). Поддерживающая терапия (25 мг через день) в последующем может продолжаться от 4 месяцев до 5—6 лет | Ответ меньше, чем у 1/3 пациентов[1] | Трудности дозировки из-за узкого терапевтического окна, гиперчувствительности из-за генетических особенностей или взаимодействия с другими препаратами. Редко проявляются: слабость, потливость, повышение трансаминаз, тяжелая нейтропения с инфекцией, панкреатит. |
| Циклофосфамид | 100 мг/день | Ответ меньше, чем у 1/3 пациентов | При длительном лечении имеет существенный мутагенный потенциал |
| Циклоспорин А | 5 мг/кг/сут 6 дней, затем до 3 мг/кг/сут (уровень циклоспорина в крови в пределах 200-400пг/мл) | Имеются ограниченные сведения об эффективности у ¾ пациентов с АИГА с тепловыми антителами и жизнеугрожающим, рефрактерным гемолизом 48 Комбинация циклоспорина, преднизолона и даназола дала полный ответ у 89% по сравнению с 58% пациентов, находящихся на терапии преднизолоном и даназолом. | увеличение креатинина в сыворотке крови, гипертония, повышенная утомляемость, парестезии, гиперплазия десен, миалгия, диспепсия, гипертрихоз, тремор |
| Микофенолата мофетил | Начальная доза 500 мг/сут с увеличением до 1000 мг/сут от 2 до 13 мес | Ограниченные данные по применению у пациентов с рефрактерной АИГА с тепловыми антителами. Был успешно применен в сочетании с ритуксимабом в случае рефрактерной АИГА после ТГСК [7] | головная боль, боли в пояснице, вздутие живота, анорексия, тошнота |
Алгоритм действий при неотложных ситуациях:
· при подозрении на наличие гемолитического криза (лихорадка, бледность, желтушность кожных покровов, потемнение мочи, спленомегалия, сердечно-сосудистая недостаточность, анемический шок, анемическая кома) – вызов бригады СМП для экстренной транспортировки пациента в гематологическое отделение или отделение интенсивной терапии в зависимости от тяжести состояния;
· мониторинг жизненно-важных функций: частота и характер дыхания, частота и ритмичность пульса, показатели систолического и диастолического АД, количество и цвет мочи;
· при наличии признаков нарушения витальных функций (острая сердечная недостаточность, признаки шока, почечной недостаточности) – неотложная помощь: обеспечение венозного доступа, инфузия коллоидных препаратов, при подозрении на внутрисосудистый гемолиз – профилактика почечной недостаточности (фуросемид), оксигенация кислородом.
Показания для консультации специалистов:
· консультация врача по рентгенэндоваскулярной диагностике и лечению – установка центрального венозного катетера из периферического доступа (PICC);
· консультация гепатолога – для диагностики и лечения вирусного гепатита;
· консультация гинеколога – при беременности, метроррагии, меноррагии, консультация при назначении комбинированных оральных контрацептивов;
· консультация дерматовенеролога – при кожном синдроме;
· консультация инфекциониста – при подозрении на вирусные инфекции;
· консультация кардиолога – при неконтролируемом АГ, хроническая сердечная недостаточность, нарушения сердечного ритма и проводимости;
· консультация невропатолога – при остром нарушении мозгового кровообращения, менингите, энцефалите, нейролейкозе;
· консультация нейрохирурга – при остром нарушении мозгового кровообращения, дислокационный синдром;
· консультация нефролога (эфферентолог) – при почечной недостаточности;
· консультация онколога – при подозрении на солидные опухоли;
· консультация оториноларинголога – для диагностики и лечения воспалительных заболеваний придаточных пазух носа и среднего уха;
· консультация офтальмолога – при нарушении зрения, воспалительные заболевания глаза и придатков;
· консультация проктолога – при анальной трещине, парапроктите;
· консультация психиатра – при психозах;
· консультация психолога – при депрессиях, анорексии и т.п.;
· консультация реаниматолога – при лечении тяжелого сепсиса, септического шока, синдрома острого легочного повреждения при синдроме дифференцировки и терминальных состояний, установка центральных венозных катетеров.
· консультация ревматолога – при СКВ;
· консультация торакального хирурга –при экссудативном плеврите, пневмотораксе, зигомикозе легких;
· консультация трансфузиолога – для подбора трансфузионных сред при положительном непрямом антиглобулиновом тесте, неэффективности трансфузий, остром массивном гемолизе;
· консультация уролога – при инфекционно-воспалительных заболеваниях мочевыделительной системы;
· консультация фтизиатра – при подозрении на туберкулез;
· консультация хирурга –при хирургических осложнениях (инфекционные, геморрагические);
· консультация челюстно-лицевого хирурга – при инфекционно-воспалительных заболеваниях зубо-челюстной системы.
Профилактические мероприятия:
· при вторичной АИГА- адекватное лечение основного заболевания;
· при АИГА с холодовыми антителами – избегать переохлаждений.
Мониторинг состояния пациента:
Для мониторинга эффективности лечения в амбулаторной карте отмечается: общее состояние пациента, показатели общего анализа крови, включая ретикулоциты и тромбоциты, биохимические показатели – уровень билирубина, ЛДГ, иммуноферментное определение количества иммуноглобулинов на мембране эритроцитов, прямую пробу Кумбса.
Индивидуальная карта наблюдения пациента
| Категория пациентов | Общий анализ крови, включая ретикулоциты | Биохимический анализ (билирубин с фракциями, ЛДГ) | Прямая проба Кумбса | Иммуноферментное определение количества иммуноглобулинов на мембране эритроцитов | Консультация гематолога |
| Консервативное лечение | В процессе лечения-не реже 1 раз в 10 дней; После достижения ремиссии –1 раз в месяц; | В процессе лечения-не реже 1 раз в 10 дней; После достижения ремиссии –1 раз в 2 месяца; | 1 раз в 3-6 месяцев | 1 раз в 2 месяца | Д учёт и наблюдение у гематолога по месту жительства в течение 5 лет. |
Индикаторы эффективности лечения [12]:
Критерии ответа
· Критерии ремиссии: полное восстановление показателей гемограммы (гемоглобин > 120 г/л, ретикулоциты 100 г/л, ретикулоциты менее двух норм, уровень непрямого билирубина 25 мкмоль/л и ниже продолжительностью не менее 2 месяцев.
· Отсутствие ответа на терапию констатируют при незначительной положительной динамике или ответе продолжительностью менее 1 месяца.
источник