В12-дефицитная и фолиеводефицитная анемии — это анемии, обусловленные дефицитом витамина В12 или фолиевой кислоты, что приводит к нарушению синтеза ДНК и неэффективному эритропоэзу (мегалобластному типу кроветворения). Чаще всего наблюдается изолированный дефицит одного из них.
Причины дефицита витамина B12 в организме:
1. Нарушение секреции внутреннего фактора Кастла (гастромукопротеина) при наследственной атрофии желез желудка, при органических заболеваниях желудка, после гастроэктомии, аутоиммунной реакции с продукцией антител к париетальным клеткам дна желудка и к гастромукопротеину, при злоупотреблении алкоголем.
2. Нарушение всасывания витамина В12 в тонком кишечнике (органические заболевания кишечника, после резекции тонкого кишечника, наследственное нарушение всасывания при синдроме Имерслунд-Гресбека).
3. Конкурентный расход витамина В12 (инвазия широким лентецом, власоглавом, выраженный дисбактериоз кишечника).
4. Нарушение транспорта витамина B12 к тканям вследствие снижения продукции в печени белка транскобаламина-2 (например, при циррозе печени).
Основные причины дефицита фолиевой кислоты:
1. .Недостаточное поступление с пищей продуктов, содержащих фолиевую кислоту (свежие овощи и фрукты, мясо, молочные продукты; вскармливание новорожденных козьим молоком).
2. Нарушение всасывания в тонком кишечнике (резекция тонкого кишечника, органические заболевания, сопровождающиеся синдромом мальабсорбции, злоупотребление алкоголем).
3. Прием некоторых лекарственных средств: антагонистов фолиевой кислоты (метотрексата и других цитостатиков); аналогов пурина и пиримидина; противосудорожных препаратов (дифенина, фенобарбитала), контрацептивов
4. Повышенная потребность в фолиевой кислоте (при беременности ,в период новорожденности,, серповидно-клеточной анемии, миелопролиферативных синдромах и др.)
Независимо от причины развития дефицита витамина В12 клиническая картина болезни определяется следующей триадой синдромов, выраженных в период обострения заболевания:
1. поражение кроветворной системы;
2. поражение желудочно-кишечного тракта;
3. поражение нервной системы.
Поражение кроветворной системы проявляется общеанемической симптоматикой. При этом у больных объективно отмечается резкая бледность кожи с лимонно-желтым оттенком, небольшое увеличение селезенки и печени. В периферической крови — гиперхромная анемия, анизо- и пойкилоцитоз эритроцитов, их базофильнаяпунктация, макроцитоз, мегалоцитоз, тельца Жолли, кольца Кебота, лейко- и тромбоцитопения, сдвиг вправо в лейкоцитарной формуле, гиперсегментация нейтрофилов, пониженное количество ретикулоцитов, гипербилирубинемия, нормальное или несколько повышенное содержание железа. В костном мозге — раздражение красного ростка, наличие мегалобластов, гигантских метамиелоцитов, палочкоядерных клеток, уменьшения количества мегакариоцитов.
О поражении желудочно-кишечного тракта свидетельствуют потеря аппетита, отрыжка, чувство тяжести в подложечной области, поносы, боли, чувство жжения в языке. Объективно отмечаются гунтеровский глоссит, гистаминорезистентная ахилия, рентгенологически — нарушение эвакуаторной способности желудка, уплошенные и сглаженные складки, при ФГДС — атрофия слизистой желудка, что подтверждается гистологически.
О поражении нервной системы (фуникулярноммиелозе) свидетельствуют парестезии, нарушение чувствительности, болевые ощущения и ощущения холода в конечностях, боли типа табетических, выраженная мышечная слабость, нарушение вибрационной чувствительности, арефлексия, атаксия, положительные рефлексы Бабинского, Оппенгеймера, спастические параличи, нарушение функции тазовых органов
В тех случаях, когда при фиброгастроскопии с биопсией выявляется практически полная атрофия слизистой желудка, в том числе фундальной его части, где вырабатывается гастромукопротеин, с гистаминорезистентной ахилией диагностируется самостоятельное заболевание — анемия Аддисона-Бирмера (истинная, эссенииальная В12-дефицитная анемия). Во всех других случаях имеют место симптоматические формы мегалобластной анемии.
Макроцитарныегиперхромные анемии встречаются редко, при этом на фоне общеанемического синдрома преобладают клинические признаки основного заболевания.
В практике возможно сочетание дефицита витамина B12 и фолиевой кислоты, обычно наблюдающееся при нарушении кишечного всасывания.
Клинические признаки, картина крови и костного мозга при дефиците фолиевой кислоты аналогичны В12-дефицитной анемии, за исключением симптомов фуникулярногомиелоза, которые не наблюдаются при фолиеводефицитной анемии. Вместе с тем ярко могут быть выражены психические расстройства (табл. 2).
Таблица 2
Дифференциальный диагноз В12- и фолиеводефицитной анемий
| Признак | Дефицит витамина В12 | Дефицит фолиевой кислоты |
| Возраст | Пожилой | Любой |
| Гистаминорезистентная ахилия | Часто | Редко (может иметь место понижение желудочной секреции) |
| Полнота, одутловатость лица | Характерно | Не характерно |
| Глоссит | Характерно | Крайне редко |
| Фуникулярныймиелоз | Часто | Не наблюдается |
| Назначение витамина В12 | Повышает уровень ретикулоцитов в периферической крови | Не влияет на уровень ретикулоцитов в периферической крови |
| Назначение фолиевой кислоты | Повышает уровень ретикулоцитов в периферической крови | Повышает уровень ретикулоцитов в периферической крови |
| Содержание фолиевой кислоты в сыворотке и эритроцитах | В сыворотке часто повышено, в эритроцитах незначительно снижено или в норме | Понижено |
| Наличие метилмалоновой кислоты в моче | Характерно | Отсутствует |
Однако полностью отдифференцировать эти два дефицита друг от друга в амбулаторно-поликлинических условиях невозможно, поэтому в диагнозе такой вид анемии фигурирует как B12 (фолиево)-дефицитная анемия.
Нормохромные анемии могут быть следствием:
2. Ускоренного гемолиза эритрорцитов (гемолитические анемии);
3.Поражения костного мозга (апластические анемии).
В результате быстрой потери значительного количества крови при ранениях. легочных, желудочно-кишечных, маточных и носовых, реже — почечных кровотечениях развивается острая постгеморрагическая анемия.
Уменьшение количества циркулирующих эритроцитов приводит к острой гипоксии, а потеря плазмы крови — к коллапсу или гипотонии Возникает общеанемический синдром, степень выраженности которого определяется скоростью кровотечения и объемом теряемой крови.
Имеется несколько методов для определения объема кровопотере. В экстренных случаях судить об объеме циркулирующей крови (ОЦК) позволяет индекс Алговера или шоковый индекс (ШИ равный отношению частоты пульса к систолическому артериальному давлению (АД). При индексе, равном:
0,5-0,8 (10-15 %) — 500-700 мл крови;
1,0 (20-30 %) — 750-1500 мл;
1,2 (30-40 %) — 1500-2000 мл;
1,5 (40-50 %) — больше 2000 мл.
Для оценки кровопотери рекомендуют использовать формулу: П = К + 44 lq ШИ,
где: П — потеря крови в %; К — коэффициент, равный 27 при желудочно-кишечной кровопотере; 33 — при полостных кровотечениях; 24 — при ранениях конечностей и 22 — при поражении грудной клетки; ШИ — шоковый индекс.
Тяжесть кровопотери можно определить с учетом комплекса показателей периферической крови:
1. легкая степень кровопотери: эр. — более 3,5Т012/л, Нв — более 100 г/л, гематокрит — более 30 %, пульс до 80 уд./мин., систолическое АД — более 110 мм рт. ст., дефицит ОЦК до 20 %;
2. средняя степень кровопотери: эр. — более 3,5-2,5-1012/л, Нв — 80-100 г/л, гематокрит — более 30-25 %, пульс до 80-100 уд./мин., систолическое АД — 110- 100 мм рт. ст., дефицит ОЦК до 20-30 %;
3. тяжелая степень кровопотери: эр. — менее 2.51012/л, Нв — менее 80 г/л, гематокрит — ниже 25 %, пульс — более 100 уд./мин., систолическое АД — менее 100 мм рт ст., дефицит ОЦК — 30 % и более.
В первые сутки после острой кровопотери: анемия выражена умеренно, нормохромная и не отражает истинной степени анемизации, так как происходит рефлекторное сужение капилляров и уменьшение общей массы крови. На 2-3 день, даже если кровотечение не повторяется и улучшается общее состояние больного, анемия усугубляется. К этому времени или днем позже в периферической крови появляется ретикулоцитоз, полихроматофилия, нейтрофильный лейкоцитоз со сдвигом влево, тромбоцитоз, который в последующем сменяется тромбоцитопенией.
При повторяющихся острых кровопотерях нормохромия эритроцитов, характерная для острой постгеморрагической анемии, сменяется гипохромией вследствие возникновения дефицита железа и развивается типичная железодефицитная анемия.
Гемолитические анемии (ГА) — гетерогенная группа заболеваний, которая характеризуется укорочением жизни эритроцитов (их преждевременным разрушением — гемолизом) с компенсаторным усилением эритропоэтической функции костного мозга. При этом процессы кроворазрушения преобладают над процессами кроветворения.
Гемолиз может происходить внутриклеточно (в селезенке, как обычный физиологический процесс — «селезеночный» гемолиз) и непосредственно в сосудах (внутрисосудистый или внеклеточный) — «почечный» гемолиз Их дифференциальная диагностика представлена в табл. 3.
Из наследственных ГА в Республике Беларусь наиболее часто встречается микросфероцитарная анемия (болезнь Минковского-Шоффара), а из приобретенных — аутоиммунная ГА, при которой гемолиз обусловлен появлением антител к собственным антигенам эритроцитов или к клеткам эритропоэза (табл 4,5).
Известны следующие виды антител к эритроцитам при аутоиммунной ГА: неполные тепловые агглютинины, тепловые гемолизины, холодовые агглютинины. двухфазные холодовые гемолизины и эритроопсонины. Тепловые антитела активно связываются с эритроцитами при 37° С, а холодовые — при понижении температуры.
Таблица 3
Дифференциально-диагностические признаки внутрисосудистого
и внутриклеточного типов гемолиза эритроцитов
| Признак | Внутрисосудистый гемолиз | Внутриклеточный гемолиз |
| Способствующие факторы | Охлаждение, ацидоз, мышечное напряжение, прием медикаментов, переливание крови | Вторичный (функциональный) гиперспленизм или реактивная гиперплазия селезенки как следствие инфекции |
| Течение болезни | Острое, редко хроническое | Хроническое с обострениями в виде гемолитических кризов |
| Желтуха (гемолитическая, «надпеченочная») | Резко выраженная | Выраженная в период обострения |
| Увеличение селезенки и печени | Острое, незначительное увеличение | Хроническое, постоянное значительное увеличение |
| Морфологические изменения эритроцитов | Отсутствуют | Как правило (микросфероцитоз, эллиптоцитоз, стоматоци- тоз и др.) |
| Осмотическая резистентность эритроцитов | Нормальная или повышена | При микросфероцитозеснижена |
| Гемоглобинурия | Как правило | Отсутствует |
| Гемосидероз почек (гемосидеринурия) | Как правило | Отсутствует |
| Гемосидероз селезенки. печени, костного мозга | Отсутствует | Постоянный симптом |
| Спленэктомия | Неэффективна и не показана | Эффективна |
| Признак | Наследственные | Приобретенные |
| I. Начало болезни | В раннем детском возрасте | В более зрелом возрасте |
| 2. Семейно-наследственный характер заболевания | Часто | Отсутствует |
| 3 Способствующие факторы | Инфекция | Охлаждение, ацидоз (во время сна), некоторые медикаменты, переливание крови. |
| 4. Длительность заболевания | Несколько десятков лет | От нескольких недель до нескольких лет |
| 5. Течение болезни | Хроническое с длительными ремиссиями, и периодическими обострениями | Чаще острое, возможно хроническое с обострениями |
| 6 Желтуха | Значительно выражена | Нерезко выражена |
| 7. Аномалии развития скелета (монголоиидное лицо, «башенный» череп, череп в виде «щетки», или «ежика», высокое стояние неба, микрофтальмия | Часто | Отсутствуют |
| 8. Трофические язвы голеней | Часто | Отсутствуют |
| 9 Селезенка | Хроническое значительное увеличение, пальпация безболезненная | Острое, нерезкое увеличение, болезненность при пальпации |
| 10. Анемия | Умеренно выраженная | Тяжелой степени |
| И. Морфологические изменения эритроцитов (микросфероцитоз, эллипсоцитоз, стоматоцитоз и др.) | В большинстве случаев | Редко |
| 12. Осмотическая резистентность эритроцитов | При мембранопатиях понижена, в других случаях повышена | Не изменена или повышена |
| 13. Гемоглобинурия | Отсутствует | Часто |
| 14. Гемосидероз органов | Часто | Отсутствует |
| 15. Проба Кумбса | Отрицательная | Положительная |
| Признак | Болезнь Минковского- Шоффара | Талассемии | Серповидно- клеточная анемия | Дефицит Г-6-ФДГ | |
| «большая» | «малая» | ||||
| Аномалии скелета | часто | часто | часто | нет | нет |
| Трофические язвы голеней | нечасто | нет | нет | часто | нет |
| Морфологические изменения эритроцитов | микросферо- цитоз | мишене- видные эритроци ты | серповидные эритроциты | норма | |
| Осмотическая резистентность эритроцитов | понижена | максималь-наярезистент-ность повышена | норма | норма | |
| Патологический тип гемоглобина при электрофорезе | нет | фетальный (F) гемоглобин | S-гемо глобин | нет |
Более 90 % всех аутоиммунных ГА составляют анемии с неполными тепловыми агглютининами, в большинстве случаев они относятся к классу G, реже А фиксируются на поверхности эритроцитов. Разрушение таких эритроцитов осуществляется макрофагами селезенки, реже в фагоцитозе эритроцитов могут принимать участие макрофаги печени, костного мозга.
Аутоиммунные ГА могут быть идиопатическими (неизвестной этиологии) и симптоматическими, развивающимися на фоне других заболеваний, чаще всего аутоиммунных — системной красной волчанки, заболеваний крови, аутоиммунного гепатита, аутоиммунного тиреоидита. СПИДа и др. Диагноз идиопатической аутоиммунной ГА правомочен лишь после исключения всех возможных причин симптоматических аутоиммунных ГА.
В периферической крови наблюдается нормохромная, нормоцитарная анемия. Гемоглобин в период гемолитического криза может снижаться до 40-30 г л. Отмечается ретикулоцитоз — в начале незначительный (3-4 %), позже, при выходе из гемолитического криза, до 20-30 % и более. Признак усиленного эритропоэза — появление нормобластов от 2-3 : 100 до 8-10 100. Имеются резкий анизо- , пойкилоцитоз, единичные микросфероциты, макроциты, полихроматофилы, умеренный лейкоцитоз (до 20Т09/л) со сдвигом нейтрофилов до юных и единичных миелоцитов, что отражает лейкемоидную реакцию на гемолиз. Уровень тромбоцитов нормальный, иногда умеренно снижен, что является свидетельством сочетания аутоиммунной ГА с аутоиммунной тромбоцитопенической пурпурой. Такое сочетание принято называть синдромом Фишера-Эванса. СОЭ умеренно ускорена. Решающим в диагностике является положительная прямая проба Кумбса, увеличение гамма-глобулинов в крови, положительный эффект терапии глюкокортикостероидами, спленэктомия и др.
Апластическая анемия — патологическое состояние кроветворной системы, характеризующееся депрессией трех ростков костномозгового кроветворения (красного, миелоидного, и мегакариоцитарного), развитием панцитопении и жировым перерождением костного мозга.
Причины апластических анемий:
1. Идиопатическая (причина неизвестна);
2. Наследственная по аутосомно-рецессивному типу (конституциональная анемия Фанкони), обычно выявляется в возрасте после 5 лет
3. Воздействие физических и химических факторов (ионизирующей радиации, инсектофунгицидов, бензола и его производных, мышьяка, различных красок, лаков и др.)
4. Влияние некоторых лекарственных средств (левомицетин, бутадион, цитостатики, препараты золота, противотуберкулезные, противомалярийные и антитиреоидные средства и др.).
5. Некоторые вирусные инфекции (вирусный гепатит, инфекционный мононуклеоз, бруцеллез, цитомегаловирусный сепсис) и другие заболевания (милиарный туберкулез легких, зоб Хашимото, тимома, злокачественные опухоли с метастазами в костный мозг).
Клиническая картина разнообразна. Существуют переходные формы от частичного угнетения кроветворения до выраженной аплазии костного мозга. Обычно имеются три синдрома:
1. Анемический, различной степени выраженности;
1. Геморрагический (кровоподтеки, петехиальные высыпания на коже, носовые кровотечения, меноррагии у женщин и пр.);
2. Септико-некротический (некротические изменения слизистых оболочек ротовой полости, прямой кишки, женских половых органов), а также вторичные инфекционно-воспалительные процессы различных локализаций (некротическая ангина, отит, пневмония, пиелонефрит и др.).
Увеличение печени, селезенки, лимфатических узлов не характерно для данных анемий.
В периферической крови отмечается тяжелая нормохромнаямакроцитарная анемия, резкое снижение ретикулоцитов (менее 0,5 %), лейкоцитопения, гранулоцитопения, вплоть до агранулоцитоза, тромбоцитопения (30-109/л и ниже), увеличение СОЭ.
Решающая роль в диагностике принадлежит исследованию костномозгового пунктата и (или) трепанобиопсии, позволяющих выявить резкое уменьшение мега- и миелокариоцитов, увеличение количества лимфоцитов, плазматических и тучных клеток. Мегакариоциты могут полностью отсутствовать. При гистологическом исследовании костного мозга наблюдается почти полное исчезновение костномозговых элементов и замещение их жировой тканью.
Дифференцировать апластические анемии следует с алейкемической формой острого лейкоза, идиопатической тромбоцитопенией и гемолитической анемией с преимущественно внутрисосудистым гемолизом.
Большинство больных с анемическим синдромом обследуются и лечатся в амбулаторно-поликлинических условиях участковыми врачами, в ряде случаев после консультации гематолога. Это больные с ЖДА и В12 — фолиеводефицитными анемиями. Больные с гемолитическими, апластическими и другими анемиями постоянно наблюдаются гематологами. Показания к госпитализации больных с анемиями — острая постгеморрагическая анемия; гемолитические и апластические анемии; прекоматозное и коматозное состояния при любом типе анемий; тяжелые степени анемий; уточнение причины анемии, если возможности поликлиники в этом отношении исчерпаны; безуспешная амбулаторная терапия, необходимость хирургического или интенсивного лечения заболеваний, являющихся причиной анемического синдрома (фибромиома матки, кровоточашаягастродуоденальная язва, геморрой, опухоль и др. ).
Дата добавления: 2016-07-29 ; просмотров: 1853 | Нарушение авторских прав
источник
Кандидат медицинских наук, доцент В.А. Ткачев
В12-дефицитная анемия – это тяжелая прогрессирующая анемия, возникающая при нарушении усвоения витамина В12, поступающего с пищей, вследствие пониженной (или при отсутствии) секреции внутреннего желудочного фактора.
Номенклатура названия этого заболевания разная, и оно нередко обозначается в литературе как пернициозная анемия (perniciosa – гибельная), злокачественная болезнь Аддисона–Бирмера (по фамилии авторов), а также мегалобластная анемия (по типу кроветворения).
Болеют лица старше 40 лет. Женщины подвержены этому заболеванию в два раза чаще, чем мужчины и, прежде всего, в возрасте старше 50–60 лет. Известны случаи В12-дефицитной анемии у детей, вскармливаемых козьим молоком или сухими молочными смесями. Заболеваемость составляет от 20 до 60 случаев на 10 000 населения.
Историческая справка. Первое описание этого заболевания сделал Кумбс в 1822 г. и назвал его тяжелым первичным малокровием. В 1855 г. врач Аддисон описал это страдание под названием «идиопатическая анемия». В 1872 г. Бирмер опубликовал результаты наблюдения за группой больных, страдавших прогрессирующей пернициозной анемией. Однако возможность излечения этого заболевания появилась только в 1926 г., когда Майнот и Мерфи обнаружили выраженный лечебный эффект от назначения сырой печени.
Через три года американский физиолог Кастл показал, что сырое мясо, печень, дрожжи, обработанные желудочным соком здорового человека, обладают свойством вызывать ремиссию у больного пернициозной анемией. Исследования Кастла легли в основу концепции, согласно которой в результате взаимодействия двух факторов – внешнего, содержащегося в сыром мясе, сырой печени, дрожжах, и внутреннего, вырабатываемого слизистой оболочкой желудка, создается антианемическое соединение, которое обеспечивает физиологическое вызревание костномозговых клеток.
Природа внешнего фактора была установлена – им является цианкобаламин (витамин В12). Витамин В12 по потребности организма используется не только для гемопоэза в костном мозге, но и для нормального функционирования нервной ткани и органов пищеварения.
Комплексное соединение, состоящее из пептидов (появляющихся в процессе превращения пепсиногена в пепсин) и мукоидов (выделяемых добавочными клетками слизистой оболочки желудка) было названо гастромукопротеидом или внутренним фактором Кастла. Роль внутреннего фактора (гастромукопротеида) заключается в образовании с витамином В12 комплекса, обеспечивающего транспорт цианкобаламина по кишечнику и препятствующего его распаду и инактивации. Резорбция (всасывание) витамина В12 происходит в подвздошной кишке. Дальнейшее поступление его в портальный кровоток осуществляется при помощи белковых переносчиков: транскобаламина-1 (-глобулина) и транскобаламина-2 (-глобулина), которые образуют белково-В12-витаминный комплекс, способный депонироваться в печени.
Этиология. Ведущим фактором в этиологии заболевания является эндогеннная недостаточность витамина В12, возникающая вследствие нарушения его всасывания из-за прекращения секреции внутреннего фактора (гастромукопротеида).
Нарушение всасывания В12 может возникнуть в результате поражения желудочно-кишечного тракта воспалительным или злокачественным процессом, после субтотального или тотального удаления желудка, после обширной резекции части тонкого кишечника. В редких случаях пернициозная анемия развивается при нормальной секреции внутреннего желудочного фактора и обусловлена врожденным отсутствием транскобаламина-2, с которым витамин В12 связывается и доставляется в печень, либо в результате отсутствия в кишечнике белкового акцептора (воспринимающего) витамина В12, необходимого для поступления цианкобаламина из кишечника в кровеносное русло. В отдельных случаях имеет место генетический фактор развития В12-дефицитной анемии вследствие врожденного нарушения выработки желудочного фактора или наличия антител против париетальных клеток.
К возникновению В12-дефицитной анемии могут привести и следующие факторы:
нарушение всасывания В12 в тонком кишечнике в результате хронического энтерита или глютеновой энтеропатии;
конкурентное поглощение витамина В12 в тонком кишечнике широким лентецом или микроорганизмами;
полное исключение пищи животного происхождения;
длительное снижение внешнесекреторной активности поджелудочной железы, следствием чего является нарушение расщепления протеина R, без которого витамин В12 не может связаться с мукополисахаридом;
длительное назначение некоторых лекарственных препаратов: метотрексат, сульфасалазин, триамтерен, 6-меркаптопурин, азатиоприн, ацикловир, фторурацил, цитозар, фенобарбитал и др.
Патогенез. Нарушение кроветворения при В12-дефицитной анемии характеризуется мегалобластическим типом для всех трех ростков крови: эритроидного, гранулоцитарного и мегакариоцитарного. Отмечается неэффективность красного кроветворения: нарушение дифференцировки эритроидных клеток и появление аномальных клеток типа промегалобластов, мегалобластов (большого размера клеток с базофильной цитоплазмой и ядром, содержащим ядрышки).
В результате дефектного метаболизма фолиевой кислоты (из-за дефицита В12), которая участвует в образовании ДНК, нарушается клеточное деление. Следствием этого является выраженная интрамедуллярная гибель эритроидных элементов и снижение количества эритроцитов на периферии.
Из-за несостоятельности клеточных элементов крови усилен гемолиз, который проявляется гипербилирубинемией, уробилинурией, увеличением стеркобилина в кале.
Патологоанатомические изменения характеризуются общим малокровием, желтушностью кожи и слизистых, жировой дистрофией миокарда, печени, почек. Костный мозг сочный, малинового цвета из-за гиперплазии.
Со стороны органов пищеварения выявляются атрофические изменения сосочков языка (их сглаженность), воспалительные его изменения (глоссит), афтозные высыпания, трещины (Гунтеровский глоссит), а также атрофия слизистой оболочки щек, неба, глотки, пищевода. Наибольшая атрофия регистрируется в желудке, которая характеризуется истончением его стенок, формированием полипов. Слизистая оболочка кишечника также атрофирована. Селезенка, как правило, нормальных размеров или увеличена.
Гепатомегалия невыраженная. Выявляется гемосидероз в печени, селезенке, почках (ржавый оттенок на разрезе) в результате гемолиза эритроцитов.
В нервных волокнах языка (нервных сплетениях Мейснера и Ауэрбаха), а также в задних столбах спинного мозга (очаговое набухание с распадом миелиновых нервных волокон) отмечаются дистрофические изменения.
Клинические проявления В12-дефицитной анемии чаще развиваются постепенно: нарастает слабость, недомогание, головокружение, диспепсические расстройства, шум в ушах, склонность к ожирению. Редко заболевание начинается остро, с подъема температуры тела до 38 С, выраженной слабости.
Анемический синдром характеризуется вялостью, бледностью кожных покровов с лимонно-желтым оттенком, иногда (у 12% больных) субиктеричностью склер. В периферической крови регистрируется анемия, чаще (58%) тяжелая, с увеличением цветного показателя до 1,4, снижением ретикулоцитов до 0,5 – 1,0% (у трети больных – ретикулоцитоз), пойкилоцитозом и наличием телец Жолли и колец Кэбота в эритроцитах. Часто выявляется лейкопения, лимфоцитоз, но тромбоцитопения.
В костном мозге определяются признаки мегалобластического типа кроветворения.
Синдром желудочной диспепсии (37,% наблюдений) проявляется отрыжкой, тошнотой, потерей вкусовых ощущений, снижением аппетита вплоть до отвращения к пище, тяжестью в эпигастрии, иногда дисфагией, чувством жжения языка, слизистой оболочки рта. На ЭГДС выявляются атрофические изменения в слизистой оболочки пищевода и желудка.
Синдром кишечной диспепсии характеризуется неустойчивым стулом, похуданием.
Глоссит проявляется наличием «ошпаренного» (красного) или «лакированного» с трещинами языка. Боли в языке отмечаются у 30% больных с В12-дефицитной анемией.
Синдром желтухи бывает у 50% больных и проявляется субиктеричностью склер и гипербилирубинемией.
Синдром фуникулярного миелоза (сенсорная атаксия – нарушение координации движений) отмечается у больных с В12-дефицитной анемией в 11% случаев и развивается в результате нарушения проприорецептивной чувствительности из-за атрофических процессов в задних рогах спинного мозга. Могут быть и другие симптомы поражения нервной системы: парестезии, расстройства функции тазовых органов, снижение рефлексов.
Синдром межреберной невралгии встречается существенно чаще (до 30% случаев), чем признаки фуникулярного миелоза, проявляется невралгическими болями по ходу межреберий и также обусловлен функциональной недостаточностью нервной ткани проводников.
У части больных отмечается поражение черепномозговых нервов (зрительного, слухового, обонятельного), наличие симптомов спинального паралича (спастический парапарез с повышенными рефлексами и клонусами) Может обнаруживаться центральная скотома (дефект поля зрения) с потерей зрения.
Изменения со стороны центральной нервной системы могут проявляться синдромом психомоторного возбуждения (маниакальное состояние с эйфорией или синдромом депрессии с нарушением памяти и критики — мегалобластное слабоумие).
Кардиальный синдром (в 15–20% наблюдений) характеризуется одышкой, сердцебиением, болями в области сердца, миокардиодистрофией. При аускультации сердца выслушивается функциональный анемический шум. На ЭКГ определяется снижение ST, расширение желудочкового комплекса.
Отечный синдром встречается при В12-дефицитной анемии в 80% случаев и проявляется периферическими отеками, могущими достигать степени анасарки, как результат недостаточности кровообращения.
Увеличение печени (синдром гепатомегалии) встречается у 22% больных, увеличение селезенки (синдром спленомегалии) в 10% случаях.
При нелеченной В12-дефицитной анемии может развиться синдром пернициозной комы, проявляющийся ишемией головного мозга, потерей сознания, арефлексией, падением температуры тела, снижением АД, рвотой, непроизвольным мочеиспусканием.
С целью диагностики заболевания проводится тщательное гематологическое исследование, включающее изучение картины периферической крови, стернального пунктата и сывороточных факторов, участвующих в гемопоэзе. Точный диагноз очень важен, т.к. эти больные в ряде случаев нуждаются в пожизненном лечении.
Гиперсегментация нейтрофилов (более пяти ядерных долей) периферической крови является первой гематологической патологией при мегалобластном статусе. У здорового человека могут циркулировать в крови до 2% гиперсегментированных нейтрофилов. У больных мегалобластной анемией количество гиперсегментированных нейтрофилов превышает 5%.
Для костномозгового кроветворения характерен мегалобластический тип, для которого типично раздражение красного ростка и появление мегалобластов. Костный мозг гиперклеточный за счет увеличения количества ядросодержащих клеток красного ряда. В результате нарушения клеточного деления эритроидные клетки становятся очень крупными (мегалобласты). Они характеризуются большой величиной, нежной структурой и необычным расположением хроматина в ядре, асинхронной дифференцировкой ядра и цитоплазмы.
В сыворотке крови у больных с В12-дефицитной анемией повышена концентрация билирубина, железа, ферритина (железосодержащий белок печени). Активность сывороточной лактатдегидрогеназы (ЛДГ) значительно повышена и увеличивается по мере прогрессирования заболевания. Уровень сывороточного цианкобаламина обычно низкий, но может быть нормальным.
Дифференциальная диагностика проводится с фолиево-дефицитной анемией. Дефицит фолиевой кислоты наблюдается обычно в более молодом возрасте, не сопровождается атрофическими изменениями слизистой оболочки желудка и неврологической симптоматикой.
Для исключения фолиево-дефицитной анемии проводится тест Шиллинга: вводят витамин В12 парентерально, который определяется в моче в минимальных количествах при В12-дефицитной анемии и в больших количествах — при фолиево-дефицитной. Важно учитывать, что назначение больным с В12-дефицитной анемией фолиевой кислоты быстро способствует развитию фуникулярного миелоза.
Следует помнить, что симптоматическую мегалобластную анемию вызывают опухоли желудка, тонкой и слепой кишки, а также глистная инвазия (глистная В12-дефицитная анемия), что необходимо исключить при верификации диагноза.
Дифференцировать следует и с эритромиелозами (начальные формы проявления лейкоза), которые сопровождаются анемией, протекающей с повышенным содержанием в крови витамина В12 и резистентной к лечению цианкобаламином.
При проведении дифференциальной диагностики В12-дефицитной анемии необходимо установить ее причины.
Лечение В12-дефицитной анемии включает парентеральное введение витамина В12 или гидрооксикобаламина (метаболит цианкобаламина) в дозах, обеспечивающих удовлетворение дневной потребности и удвоение запасов депо. Витамин В12 вводят по 1000 мкг внутримышечно ежедневно в течение двух недель, затем один раз в неделю до нормализации уровня гемоглобина, после чего переходят на введение 1 раз в месяц в течение всей жизни.
Оксикобаламин по фармакологическим свойствам близок к цианкобаламину, но сравнительно с последним быстрее превращается в организме в активную коферментную форму и дольше сохраняется в крови. Вводится оксикобаламин в дозе 500–1000 мкг через день или ежедневно. При наличии неврологической симптоматики необходимо введение препарата в дозе 1000 мкг каждые две недели в течение шести месяцев.
При фуникулярном миелозе назначаются массивные дозы цианкобаламина по 1000 мкг ежедневно в течение 7–10 дней, далее два раза в неделю до исчезновения неврологических признаков.
Начало терапии кобаламином быстро улучшает самочувствие больных. Костномозговой эритропоэз превращается из мегалобластного в нормобластный уже через 12 часов после введения витамина В12. Поэтому назначение витамина В12 при коматозном состоянии относится к неотложным мероприятиям. Ретикулоцитоз появляется на 3–5 день, пик его (ретикулоцитарный криз) наиболее выражен на 4–10 день. Концентрация гемоглобина нормализуется через 1–2 месяца. Гиперсегментация нейтрофилов сохраняется до 10–14 дней.
Трансфузии эритроцитарной массы показаны для срочной ликвидации симптомов гипоксии.
После терапии кобаламином может развиться тяжелая гипокалиемия. Поэтому в процессе лечения витамином В12 необходимо тщательно контролировать содержание калия в крови и при необходимости проводить заместительную терапию.
Лечение кобаламином следует назначать всем больным после тотальной гастрэктомии. Для предупреждения обострения витамин В12 вводится один раз в две недели по 100 – 200 мкг.
Диспансеризация. Больные В12-дефицитной анемией подлежат диспансерному наблюдению, в ходе которого проводится мониторинг состояния периферической крови 1-2 раза в год, а также лечение заболеваний и состояний, приведших к развитию данного вида анемии.
Существуют разные схемы поддерживающей терапии кобаламинами. При назначении цианкобаламина рекомендуются пожизненно ежегодные профилактические трехнедельные курсы по 400-500 мкг через день либо ежемесячное введение 500-1000 мкг препарата. Гидроксикобаламин рекомендуется ежегодными профилактическими курсами по одной инъекции в неделю (1 мг) в течение 2-х месяцев.
источник
В12-дефицитная анемия — довольно опасное заболевание, которое связано с нарушением нормальных процессов кроветворения, возникающих на фоне дефицита кобаламина в организме.
Современной медицине известно достаточно много причин, которые провоцируют развитие патологического состояния, но все они сводятся к недостатку витамина Б12 в организме человека. Поэтому причины В12 дефицитной анемии должны рассматриваться именно вкупе с причинами недостатка витамина.
Главными причинами развития заболевания являются:
Недостаточное поступление витамина B12 с пищей. Организм человека не в состоянии самостоятельно синтезировать данный витамин, он поступает только с пищей. Растения не содержат витамин B12, его источником служат только мясо, рыба, кисломолочные продукты. Как правило, эти продукты входят в рацион питания каждого человека, но в случае развития хронического алкоголизма или голодания, развитие В12 дефицитной анемии практически неминуемо.
Нарушение всасывания витамина В12 в кишечнике. Факторами, приводящими к нарушенной работе кишечника, являются:
- гастрит аутоиммунный или атрофический;
- рак желудка;
- врожденный дефицит внутреннего фактора Касла;
- воспалительные заболевания тонкого кишечника (энтериты);
- опухоли кишечника;
- паразитарные инфекции.
Повышенное использование организмом витамина B12. Взрослому человеку, для нормальной деятельности организма, требуется в сутки 3-5 мкг витамина. Но при определенных условиях потребность организма в витамине B12 значительно повышается, а произойти это может при:
- беременности – в плоде стремительно протекают процессы роста и деления клеток, что и требует большего количества витамина В12;
- гипертиреозе – в кровоток поступает большое количество гормонов щитовидной железы, обменные процессы усиливаются и организм требует большего количества рассматриваемого витамина;
- злокачественные опухоли – витамин Б12 активно потребляется такими новообразованиями и остальным отделам организма ничего не достается.
Наследственные заболевания, которые сопровождаются нарушением обмена витамина В12. К этому фактору можно отнести достаточно большую группу патологий, но мы выделим только несколько из них:
- синдром Имерслунд-Гресбека;
- дефицит транскобаламина II;
- нарушение использования витамина В12 в клетках.
Часто B12 дефицитная анемия развивается у веганов, не употребляющих животную пищу. Дело в том, что в пище растительного происхождения данный витамин не содержится, поэтому веганам следует употреблять продукты, искусственно обогащенные B12, а также специальные витаминные комплексы.
Запасы витамина B12 в организме человека достаточно большие, поэтому клинических проявлений анемии может и не быть длительное время. Заболевание развивается очень медленно и на начальных стадиях характеризуется слабостью, повышенной утомляемостью и сонливостью – абсолютно неспецифическими симптомами.
К основным клиническим проявлениям B12 дефицитной анемии относятся:
- головокружениями и частыми обмороками;
- бледностью кожных покровов;
- желтушностью слизистых оболочек;
- непереносимостью физических нагрузок;
- болями в области сердца;
- учащенным сердцебиением;
- появлением «мушек» перед глазами ;
- увеличением селезенки.
В принципе, при появлении только одного из вышеперечисленных проявлений, человек должен обратиться за квалифицированной помощью, ведь совсем необязательно, что одновременно будет присутствовать комплекс симптомов нарушения образования клеток крови.
Именно этот симптом является самым ранним признаком B 12 дефицитной анемии, а проявляться он будет:
- нарушением пищеварения;
- снижением аппетита;
- болью и жжением в полости рта;
- нарушением вкуса;
- боль в эпигастральной области после приема пищи;
- часто возникающими инфекциями в ротовой полости.
Обычно симптомы проявляются только в случае запущенной формы В12 дефицитной анемии и представляют собой:
- нарушения чувствительности в пальцах рук и запястьях;
- парестезии – онемения, «покалывания» в определенных местах тела;
- снижения мышечных сил;
- проблемы с мочеиспусканием и дефекацией.
Обратите внимание: все симптомы рассматриваемого заболевания являются неспецифичными, то есть могут свидетельствовать и о развитии других заболеваний. Поэтому врачи всегда их рассматривают только в комплексе с другими диагностическими данными.
Только лишь жалобы пациента на имеющиеся симптомы, которые описаны выше, не являются поводом диагностировать заболевание. Процесс диагностики Б12 дефицитной анемии достаточно сложный, так как понадобится провести следующие мероприятия:
- исследовать кровь путем проведения общего клинического и биохимического анализа в лабораторных условиях;
- сделать пункцию костного мозга.
А еще больного с подозрением или уже установленной В12 дефицитной анемией обязательно полностью обследуют, так как понадобится выяснить причину патологии.
Лечение проводится только комплексно, потому что перед врачами стоит задача максимально быстро восстановить нормальное функционирование кроветворной, пищеварительной и нервной систем.
Суть этого типа терапии заключается в введении витамина В 12 извне. Показаниями к назначению такого лечения являются подтвержденный диагноз Б12 дефицитной анемии и выраженная клиническая картина заболевания.
Чаще всего препарат витамина В12 вводится внутримышечно, но допускается и прием его внутрь в виде таблеток в случае точного установления факта недостаточного поступления витамина B12 с пищей.
Лечение заболевания начинают с внутримышечного введения 500-1000 мкг витамина В12 один раз в сутки. Продолжительность медикаментозного лечения составляет не менее 6 недель, затем врачи переводят пациента на поддерживающую терапию – дозировка в этом случае будет составлять 200-400 мкг препарата 2-4 раза в месяц. В некоторых случаях такая поддерживающая терапия проводится на протяжении всей жизни больного.
В период медикаментозного лечения B12 дефицитной анемии пациенту обязательно должен проводиться контроль эффективности терапии – 2-3 раза в неделю производят забор крови для лабораторного исследования. Как правило, уже через 1 месяц происходит полная нормализация показателей периферической крови, ослабление неврологических проявлений, восстанавливается работа пищеварительной системы. Как только пациент переводится на поддерживающую терапию, забор крови для анализа осуществляется один раз в месяц.

- тяжелая анемия, когда у пациента уровень гемоглобина составляет менее 70 г/л;
- анемическая кома, проявляющаяся потерей сознания.
Так как переливание крови назначается только при подтвержденном диагнозе, то одновременно с этой процедурой назначают и внутримышечное введение препарата витамина Б12. Но переливание крови или эритроцитарной массы прекращают сразу же, как только устранено угрожающее жизни состояние.
Часто В12 дефицитная анемия лечится диетой, но такое возможно только при своевременной диагностике заболевания. В меню больного должны быть включены продукты, богатые витамином B12 и важные для лечения анемии:
- сок сливы;
- зеленые овощи, зелень, салаты и зерновые завтраки;
- мясо, сливки и масло;
- свекла, морковь, кукуруза, помидоры;
- субпродукты – говяжья и куриная печень, сердце;
- треска, карп, скумбрия;
- крольчатина.
Важно питаться полноценно и разнообразно. Вот примерное меню на день для больных с диагностированной В12 дефицитной анемией:
- 1 завтрак – салат из свежей капусты с добавлением яблок и сметаны, омлет, каша овсяная молочная с молоком;
- 2 завтрак – чай и 100 грамм сыра (максимальное количество);
- обед – борщ на мясном бульоне со сметаной, курица жареная с отварным рисом и компот;
- полдник – отвар шиповника;
- ужин – зразы мясные с луком и яйцом, морковное пюре, запеканка из гречневой крупы с творогом, некрепкий чай;
- на ночь – кефир.
Если рассматриваемое заболевание было диагностировано на ранней стадии своего развития, сразу же было назначено и проводится лечение, а нормализация показателей периферической крови произошла уже через месяц — полтора, то прогнозы будут исключительно благоприятными. Как только будет проведена основная терапия, состояние здоровья восстанавливается и пациент возвращается к привычному ритму жизни. Но если есть:
- позднее начало лечения;
- симптомы поражения центральной нервной системы;
- отсутствие эффекта от проводимого лечения;
- наследственная форма В12 дефицитной анемии.
То прогнозы будут неблагоприятными. Скорее всего, больной вынужден будет проходить лечение всю жизнь, нередко тяжелая форма В12 дефицитной анемии заканчивается комой и летальным исходом.
B12 дефицитная анемия – состояние, не опасное для жизни, но весьма коварное. Если человек обращает внимание на самые ранние признаки болезни, то врач сможет быстро и установить причину развития заболевания, и провести эффективное лечение.
Данное заболевание крови встречается у 0,1% всего населения, однако среди пожилых людей данный показатель повышается до 1%. Чаще болеют женщины, причем развитие дефицита витамина В12 обычно связано с беременностью и может самостоятельно исчезать после рождения ребенка.
Интересные факты
- Дефицит витамина В12 отмечается у 10% людей в возрасте старше 70 лет, однако не у всех из них развиваются клинические проявления В12 дефицитной анемии.
- Ни одно животное или растение на земле не способно синтезировать витамин В12.
- Витамин В12 вырабатывается исключительно микроорганизмами (бактериями), обитающими в конечном отделе пищеварительного тракта животных и человека, однако он неспособен попасть в кровоток, так как его всасывание происходит в тощей кишке, которая расположена в начальных отделах кишечника.
Образование эритроцитов начинается еще на ранних стадиях эмбрионального развития. Первые клетки крови у эмбриона образуются из мезенхимы (особой эмбриональной ткани) в конце 3 недели беременности. По мере роста и развития выделяются основные органы, которые обеспечивают кроветворение.
Основными кроветворными органами являются:
- Печень – выполняет кроветворную функцию с 6 недели внутриутробного развития и до рождения ребенка.
- Селезенка – участвует в процессе кроветворения с 12 недели внутриутробного развития и до рождения ребенка.
- Красный костный мозг – начинает выполнять кроветворную функцию с 12 недели внутриутробного развития и является единственным кроветворным органом после рождения ребенка.
Образование эритроцитов происходит из так называемых полипотентных стволовых клеток (ПСК). В организме человека имеется около 40 тысяч ПСК, которые образуются в периоде внутриутробного развития. Они содержат ядро, в котором располагается ДНК (дезоксирибонуклеиновая кислота), регулирующая процессы клеточного деления и дифференцировки (приобретения клеткой специфической функции). Кроме ядра в стволовых клетках имеется множество других структур (органелл), которые нужны для обеспечения процессов их жизнедеятельности и размножения.
Молекула ДНК человека имеет форму двух нитей, спирально перекрученных между собой. Каждая нить состоит из множества особых химических соединений – нуклеозидов. Нуклеозиды могут соединяться друг с другом в различных комбинациях, от чего в конечном итоге и зависит вид клетки, ее форма, состав и выполняемые ею функции. Другими словами, любые проявления живой клетки зависят от того, какие нуклеозиды и в какой последовательности будут взаимодействовать в каждой определенной молекуле ДНК.
Уникальной особенностью ПСК является то, что под действием различных регуляторных факторов они могут превращаться в любую клетку крови — эритроцит (обеспечивающий транспорт газов), тромбоцит (отвечающий за остановку кровотечений), лейкоцит или лимфоцит (выполняющие защитные функции).
Процесс роста и развития эритроцитов регулируется эритропоэтином – особым веществом, которое вырабатывается почками, если ткани организма испытывают недостаток в кислороде (кислородное голодание). Эритропоэтин активирует образование эритроцитов в красном костном мозге, в результате чего увеличивается их количество в периферической крови, что улучшает доставку кислорода к органам и тканям организма. Устранение кислородного голодания на тканевом уровне уменьшает продукцию эритропоэтина, что приводит к уменьшению синтеза эритроцитов.
Процесс дифференцировки (образования эритроцита из стволовой клетки) можно представить следующим образом:
- Полипотентная стволовая клетка через несколько промежуточных делений превращается в клетку-предшественницу эритропоэза, которая также содержит ядро и органеллы.
- Под воздействием эритропоэтина клетка-предшественница эритропоэза начинает активно делиться, при этом в ней происходит ряд структурных и функциональных изменений — она в несколько раз уменьшается в размерах, теряется ядро и большинство органелл (следовательно, и способность к дальнейшему размножению) и накапливает гемоглобин.
- Все описанные выше процессы происходят в красном костном мозге, а их результатом является образование ретикулоцитов (незрелых форм эритроцитов). За сутки в костном мозге образуется около 3 х 10 9 ретикулоцитов, которые выделяются в периферический кровоток. Они содержат некоторые органеллы и способны в небольших количествах образовывать гемоглобин.
- В течение 24 часов происходит полная утрата всех оставшихся органелл, в результате чего формируется зрелый эритроцит.
Для образования эритроцитов необходимы:
- Железо – включается в состав гемоглобина, являясь основным микроэлементом, обеспечивающим транспорт кислорода в организме.
- Витамин В12 (кобаламин) – принимает участие в образовании ДНК.
- Витамин В9 (фолиевая кислота) – также участвует в процессе образования ДНК.
- Витамин В6 (пиридоксин) – участвует в процессе образования гемоглобина.
- Витамин В2 (рибофлавин) – участвует в процессе дифференцировки эритроцитов.
Конечным этапом эритропоэза является зрелый эритроцит. Он не содержит ядра, практически полностью лишен органелл и не способен делиться. Его красный цвет обусловлен наличием железа, входящего в состав гемоглобина, который заполняет почти все внутреннее пространство клетки (в каждом эритроците содержится от 250 до 400 миллионов молекул гемоглобина, что равняется 25 – 40 пикограммам).
Эритроцит имеет форму уплощенного двояковогнутого диска с более толстыми краями и углублением в центре. Внутренняя поверхность его клеточной мембраны выстлана специальным белком – спектрином, который отвечает за поддержание формы клетки. Диаметр клетки равен в среднем 7,5 – 8,3 мкм.
Перечисленные особенности строения позволяют эритроциту видоизменяться и проходить через мельчайшие кровеносные сосуды организма, диаметр которых в 2 – 3 раза меньше диаметра самих эритроцитов, возвращаясь после этого к первоначальной форме (благодаря наличию спектрина).
Эритроциты не способны передвигаться самостоятельно и транспортируются в организме с током крови. Наружные поверхности их мембран обладают определенным отрицательным зарядом, в результате чего отталкиваются друг от друга, от остальных клеток крови и от стенок сосудов (которые также заряжены отрицательно). Это обеспечивает поддержание всех клеток крови во взвешенном состоянии, предотвращая их слипание и образование сгустков.
Средний срок жизни эритроцитов составляет 120 дней, в течение которых они циркулируют в крови, выполняя свои функции. Так как данные клетки практически лишены органелл, их способности к устранению повреждений (неизменно возникающих в процессе циркуляции в организме) довольно ограничены.
С течением времени эритроциты несколько уменьшаются в объеме (однако количество гемоглобина в них остается прежним), клеточная мембрана утрачивает эластичность и способность видоизменяться. Кроме того, наружная поверхность мембран старых эритроцитов теряет свой отрицательный заряд. Результатом этих процессов является уменьшение прочности и изменение формы красных клеток крови, что способствует их разрушению.
Разрушение эритроцитов (гемолиз) происходит:
- в селезенке;
- в сосудистом русле.
Разрушение эритроцитов в селезенке (внутриклеточный гемолиз)
Селезенка является основным органом, в котором разрушается до 90% эритроцитов, а также других клеток крови. Этому процессу способствует наличие большого количества так называемых синусоидных капилляров, имеющих в своей стенке небольшие отверстия. Эритроциты при прохождении через такие капилляры выходят из них и проходят через узкие щели в ткани селезенки (диаметр которых составляет 0,5 – 0,7 мкм). Старые или деформированные клетки не способны пройти через эти щели, поэтому задерживаются в них и разрушаются специальными клетками – макрофагами, которые находятся в данном органе в большом количестве.
При разрушении эритроцита железо, входящее в состав гемоглобина, высвобождается в кровоток, связывается с особым транспортным белком трансферрином и переносится в костный мозг, где вновь используется для образования эритроцитов. Оставшийся гемоглобин в результате нескольких химических реакций превращается в билирубин (несвязанную фракцию) – вещество желтого цвета, которое выделяется в кровоток при разрушении эритроцитов. Билирубин транспортируется в печень, где связывается с глюкуроновой кислотой, образуя связанную фракцию билирубина, которая включается в состав желчи и выводится из организма с калом.
Разрушение эритроцитов в сосудистом русле (внеклеточный гемолиз)
Данный термин подразумевает разрушение эритроцитов (и других клеток крови) непосредственно в просвете кровеносных сосудов. Примерно 10% эритроцитов разрушается путем внеклеточного гемолиза. Гемоглобин, попадающий при этом в кровоток, связывается с особым белком плазмы – гаптоглобином. Образующийся комплекс переносится в селезенку и разрушается ее макрофагами.
Организм человека не в состоянии синтезировать витамин В12, поэтому его количество полностью зависит от поступления с пищей (преимущественно животного происхождения).
Всасывание кобаламина происходит в кишечнике и только в присутствии особого фермента – внутреннего фактора Касла, который вырабатывается париетальными клетками слизистой оболочкой желудка. Поступающий с пищей витамин В12 связывается с данным ферментом в желудке. Образовавшийся комплекс взаимодействует (в присутствии ионов кальция) со специфическими рецепторами клеток слизистой оболочки тощей кишки (являющейся частью тонкого кишечника), в результате чего кобаламин переносится в кровоток, а внутренний фактор Касла остается в просвете кишечника.
Попавший в кровоток витамин В12 связывается со специальным транспортным белком – транскобаламином I или II и в таком виде доставляется в костный мозг, где принимает участие в процессе кроветворения, и в печень, являющуюся местом его депонирования. Важно отметить, что в клетки организма витамин В12 может попасть, только находясь в комплексе с транскобаламином II.
При сбалансированном питании и прочих нормальных условиях в кишечнике ежедневно всасывается 30 – 50 мкг витамина В12. Он депонируется в печени, которая у взрослого человека может содержать до 3 – 5 миллиграмм витамина. Если учесть, что суточная потребность организма в нем составляет 3 – 5 мкг, то становится понятным, почему первые признаки В12 дефицитной анемии начинают появляться не ранее чем через 2 – 3 года после нарушения процессов поступления кобаламина в организм.
Недостаток витамина В12 приводит к нарушению синтеза ДНК во всех клетках организма. В первую очередь это проявляется в тканях, в которых процессы клеточного деления происходят наиболее интенсивно — в кроветворной ткани и в слизистых оболочках.
Попавший в клетку кобаламин превращается в одну из двух активных форм:
- Дезоксиаденозилкобаламин (ДА-В12). Участвует в образовании жирных кислот. При их недостатке в организме поражается нервная система.
- Метил-кобаламин (метил-В12). Принимает активное участие в процессе образования компонентов ДНК, а именно в синтезе тимидина – одного из пиримидиновых нуклеозидов. Недостаток витамина В12 в организме приводит к остановке синтеза данного нуклеозида, в результате чего образуется структурно неполноценная молекула ДНК. Она быстро разрушается, что делает невозможным дальнейшее деление и дифференцировку клеток. Кроме того, метил-В12 также необходим для образования миелина, из которого состоят оболочки нервных волокон. При недостатке данного вещества нарушается проведение нервного импульса по нервам, что может проявляться разнообразными неврологическими симптомами.
Нарушение синтеза ДНК в процессе кроветворения происходит в начальных стадиях эритропоэза, в результате чего дальнейшее развитие эритроцитов становится невозможным. Образующиеся при этом кроветворные клетки (называемые мегалобластами) имеют большие размеры (10 – 20 мкм), содержат остатки разрушенного ядра и множество органелл, а также большое количество гемоглобина. Большинство из них разрушается прямо в костном мозге – развивается так называемый неэффективный эритропоэз. Те мегалобласты, которые все-таки выделяются в кровоток, неспособны выполнять транспортную функцию и при первом же прохождении через селезенку задерживаются и разрушаются в ней.
Важно отметить, что при недостатке витамина В12 в костном мозге нарушается образование не только эритроцитов, но и других клеток – лейкоцитов и тромбоцитов. Обычно эти изменения выражены менее значительно, чем дефицит эритроцитов, однако при длительном течении заболевания и отсутствии адекватного лечения может развиться панцитопения – клинический синдром, характеризующийся недостатком всех клеточных элементов в крови.

Причинами развития дефицита витамина В12 являются:
- недостаточное поступление с пищей;
- нарушение всасывания в кишечнике;
- повышенное использование витамина В12 в организме;
- наследственные заболевания, нарушающие обмен витамина В12.
Как было сказано ранее, организм человека неспособен самостоятельно синтезировать кобаламин, поэтому он должен присутствовать в потребляемой пище. Растения не содержат витамин В12, поэтому единственным его источником являются продукты животного происхождения — мясо, рыба, кисломолочные продукты и так далее. В нормальных условиях данные продукты включены в рацион почти каждого человека, поэтому дефицита витамина В12 не развивается.
Причинами недостаточного поступления витамина В12 с пищей могут быть:
- нарушение питания;
- хронический алкоголизм.
Нарушение питания
Одной из частых причин дефицита кобаламина в организме может быть вегетарианство. Вегетарианцами называется определенная группа людей, которые полностью отказались не только от мяса, но и от всех продуктов животного происхождения (яиц, рыбы, молока, сливочного масла и других). Так как данные продукты являются единственным источником кобаламина, вполне логично, что в скором времени у таких людей может развиться дефицит витамина В12 в организме.
Кроме вегетарианцев риск развития В12 дефицитной анемии повышен у бедных слоев населения, которые из-за недостатка средств не могут позволить себе употребление достаточного количества продуктов животного происхождения.
Хронический алкоголизм
Употребление больших доз алкоголя препятствует взаимодействию кобаламина с внутренним фактором Касла, а также повреждает слизистую оболочку желудка, нарушая выработку данного фактора париетальными клетками. Результатом этого становится резкое уменьшение количества кобаламина, поступающего в кровь.
Кроме того, длительное злоупотребление алкогольными напитками может привести к развитию таких заболеваний как алкогольный гепатит и цирроз. Результатом этого является уменьшение запасов кобаламина в печени, что снижает компенсаторные возможности организма при нарушении поступления данного витамина с пищей.
В данном случае с пищей поступает достаточное количество кобаламина, однако нарушены процессы его транспортировки из просвета кишечника в кровь.
Причинами нарушения всасывания витамина В12 могут быть:
- нарушение образования внутреннего фактора Касла;
- поражение тонкого кишечника;
- паразитарные инфекции.
Нарушение образования внутреннего фактора Касла
Как уже говорилось, наличие данного фактора является необходимым условием для всасывания витамина В12. При его недостатке поступающий с пищей кобаламин не способен пройти через слизистую оболочку кишечника и полностью выделяется с калом.
Причинами недостатка внутреннего фактора Касла могут быть:
- Атрофический гастрит. Данное заболевание характеризуется атрофией (уменьшением размеров и снижением функциональной активности) всех клеток слизистой оболочки желудка, что приводит к снижению или полному прекращению синтеза внутреннего фактора Касла париетальными клетками.
- Аутоиммунный гастрит. Характеризуется нарушением деятельности иммунной (защитной) функции организма, в результате чего собственные клетки начинают восприниматься как чужеродные, к ним образуются специфические антитела, которые их разрушают. При аутоиммунном гастрите антитела могут образовываться как к париетальным клеткам слизистой оболочки желудка, так и к самому фактору Касла.
- Рак желудка. Это опухолевое заболевание, в процессе которого происходит неконтролируемый рост и размножение опухолевых клеток, что приводит к постепенному разрушению и вытеснению париетальных клеток слизистой оболочки.
- Удаление желудка. Лечение некоторых заболеваний (прободной язвы, рака) заключается в частичном или полном удалении желудка, что приводит к уменьшению либо полному исчезновению париетальных клеток и, следовательно, к уменьшению количества образующегося внутреннего фактора Касла.
- Врожденный дефицит внутреннего фактора Касла. Данное заболевание передается по наследству и характеризуется дефектом гена, ответственного за образование этого фактора, что приводит к нарушению его секреции железами желудка.
Поражение тонкого кишечника
Всасывание витамина В12 происходит в тощей кишке. Различные повреждения данного отдела тонкого кишечника могут привести к нарушению процессов всасывания в нем.
Причинами поражения тощей кишки могут быть:
- Воспалительные заболевания (энтериты). Воспалению тонкого кишечника могут способствовать инфекции желудочно-кишечной системы, пищевые отравления, различные аллергии. При длительном течении воспалительных процессов происходит атрофия клеток слизистой оболочки кишечника, что делает невозможным всасывание кобаламина.
- Опухоли. Опухоли кишечника, по описанному ранее механизму, могут приводить к разрушению его слизистой оболочки.
- Удаление тонкой кишки (из-за опухоли или по другой причине).
Паразитарные инфекции
Исследованиями последних лет установлено, что более чем у 90% населения в кишечнике обитают различные паразиты (глисты). Им, как любым живым организмам, для роста и развития требуются определенные питательные вещества, в том числе и витамины. Некоторые глисты (например, широкий ланцет, вызывающий развитие дифиллоботриоза) могут достигать огромных размеров, в результате чего практически весь витамин В12, поступающий с пищей, не всасывается, а потребляется паразитом.
Как упоминалось ранее, взрослому человеку необходимо всего лишь 3 – 5 мкг кобаламина в сутки. Однако при определенных условиях и заболеваниях потребность в данном витамине может значительно увеличиваться.
Причинами усиленного использования витамина В12 в организме могут быть:
- Беременность. В развивающемся плоде процессы роста и деления клеток происходят максимально интенсивно, что увеличивает потребность матери в витамине В12 в несколько раз.
- Гипертиреоз. Данное заболевание характеризуется увеличенным образованием и поступлением в кровоток гормонов щитовидной железы (трийодтиронина и тироксина). Это приводит к повышению обмена веществ в организме, что характеризуется усилением процессов клеточного деления во многих органах и требует больших количеств кобаламина.
- Злокачественные опухоли. Злокачественный процесс характеризуется неконтролируемым и непрерывным размножением опухолевой клетки, в результате чего образуется множество ее копий. При массивных опухолях большая часть кобаламина может потребляться опухолевой тканью, в результате чего другие органы будут испытывать недостаток в данном витамине.
Это довольно большая группа патологических состояний, характеризующаяся нарушением образования определенных веществ, которые в норме обеспечивают всасывание и утилизацию кобаламина в организме.
Нарушение обмена витамина В12 может быть обусловлено:
- Наследственным дефицитом транскобаламина II. Заболевание наследуется по аутосомно-рецессивному типу, то есть ребенок будет болеть только в том случае, если оба родителя страдали данным заболеванием (либо являлись его бессимптомными носителями). Характеризуется уменьшением образования или полным отсутствием транскобаламина II в организме. В этом случае количество витамина В12 в крови нормальное или даже увеличенное, однако он не может попасть в клетки организма, в результате чего развивается клиническая картина В12 дефицитной анемии.
- Синдромом Имерслунд-Гресбека. Данное заболевание также передается по аутосомно-рецессивному типу и характеризуется нарушением всасывания витамина В12 в кишечнике. Механизм этого процесса окончательно не установлен, так как секреция и взаимодействие внутреннего фактора Касла с кобаламином происходят нормально, и никаких органических поражений тонкого кишечника не наблюдается. Предполагается нарушение транспортных систем в клетках слизистой оболочки тощей кишки.
- Нарушением использования витамина В12 в клетках. Как говорилось ранее, в клетках организма кобаламин превращается в метил-кобаламин и дезоксиаденозилкобаламин. Эти процессы требуют наличия определенных веществ (ферментов), при отсутствии которых использование витамина В12 клетками становится невозможным.

Заболевание развивается медленно и в начальных стадиях характеризуется неспецифическими симптомами – слабостью, повышенной утомляемостью. С течением времени состояние пациента ухудшается, а проявления дефицита витамина В12 становятся более явными.
Основные клинические проявления В12 дефицитной анемии обусловлены:
- нарушением образования клеток крови;
- поражением пищеварительной системы;
- поражением нервной системы.
В результате нарушения процесса кроветворения в циркулирующей крови снижается количество эритроцитов. Это ухудшает транспорт газов в организме и приводит к кислородному голоданию всех тканей и органов.
Нарушение кроветворения проявляется:
- Бледностью и желтушностью кожи и слизистых оболочек. Розоватый цвет кожи и слизистых оболочек обусловлен белково-пигментным комплексом – гемоглобином, входящим в состав эритроцитов. При В12 дефицитной анемии бледность развивается постепенно, усиливаясь в течение нескольких месяцев. Кроме того, из-за усиленного разрушения эритроцитов (происходящего в костном мозге и в селезенке), в кровь выделяется большое количество пигмента билирубина, который придает коже и слизистым оболочкам желтоватый оттенок.
- Учащенным сердцебиением. Если организм испытывает недостаток в кислороде – активируются определенные защитные реакции, одной из которых является увеличение частоты сердечных сокращений (ЧСС). Это приводит к увеличению объема крови, проходящей через каждый орган за единицу времени, что улучшает доставку кислорода.
- Болями в сердце. Увеличение частоты сердечных сокращений улучшает доставку кислорода ко всем органам. Однако само сердце при этом выполняет большую работу и получает меньше кислорода, что может привести к появлению колющих болей в груди, которые могут распространяться в область левого плеча и живота.
- Непереносимостью физических нагрузок. При физических нагрузках увеличивается потребность мышц в энергии, которая образуется только при достаточном количестве поступающего кислорода. В нормальных условиях эти потребность восполняются за счет увеличения частоты сердечных сокращений. Однако при В12 дефицитной анемии ЧСС и так увеличена, что усугубляется нарушенной транспортной функцией эритроцитов, в результате чего физические нагрузки различной интенсивности приводят к быстрой утомляемости, появлению чувства нехватки воздуха, головокружениям или потере сознания.
- Головокружениями и частыми обмороками. Данные симптомы являются признаками выраженного дефицита эритроцитов в крови, когда головной мозг начинает испытывать недостаток в кислороде.
- Появлением «мушек» перед глазами. Это обусловлено недостаточным кровоснабжением сетчатки глаза (которая весьма чувствительна к кислородному голоданию) и стекловидного тела, что приводит к нарушению в них обмена веществ, ухудшению остроты зрения и появлению перед глазами маленьких темных пятен в форме колец, молний, ниточек и др.
- Увеличением селезенки. Большие эритроциты, попадающие в кровоток, задерживаются в капиллярах селезенки, закупоривая их. Это приводит к скоплению большого количества клеток крови в органе и увеличению его в размерах.
Поражение желудочно-кишечной системы является наиболее ранним признаком дефицита витамина В12 в организме, что обусловлено интенсивным клеточным делением в слизистых оболочках полости рта, желудка, кишечника. При нарушении данных процессов быстро развиваются атрофические изменения и нарушение функции органов.
Поражение пищеварительной системы может проявляться:
- Нарушением пищеварения. Процесс пищеварения полностью зависит от нормального функционирования слизистых оболочек полости рта, желудка и кишечника. В них располагается множество желез, выделяющих особые пищеварительные соки, которые способствуют переработке пищевых продуктов. При недостаточности данных соков пища не проходит должной обработки, в результате чего нарушаются процессы всасывания питательных веществ, витаминов, микроэлементов.
- Неустойчивым стулом. В результате нарушения процессов пищеварения пища может дольше задерживаться в желудке или в кишечнике, приводя к вздутию живота, изжоге, запорам, которые могут чередоваться с диареей (поносом).
- Снижением аппетита. Появляется в результате снижения секреции желудочного сока атрофированной слизистой оболочкой желудка.
- Снижением массы тела. Является результатом снижения аппетита и нарушения пищеварения.
- Изменением цвета и формы языка. Поверхность языка образована огромным множеством мелких ворсинок, называемых сосочками. При В12 дефицитной анемии происходит атрофия слизистой оболочки языка, то есть постепенное уменьшение и исчезновение всех сосочков. В результате язык становится гладким, ярко-малинового цвета.
- Нарушением вкуса. Человек чувствует вкус различных продуктов благодаря наличию множества вкусовых рецепторов, расположенных в слизистой оболочке языка (преимущественно в сосочках). Следствием ее поражения является снижение или полная утрата вкусовых ощущений. Кроме того, у человека может появляться различные вкусовые отклонения – он может испытывать отвращение к различным продуктам питания (например, к мясу, рыбным изделиям и т. д.).
- Частыми инфекциями ротовой полости. Слизистая оболочка ротовой полости играет важную защитную роль, предотвращая рост и развитие патогенной микрофлоры. При ее атрофии увеличивается частота инфекционных заболеваний полости рта, может развиваться глоссит (воспаление языка), гингивит (воспаление десен).
- Болью и жжением в полости рта. Возникает в результате атрофических изменений слизистой оболочки и поражения нервных окончаний ротовой полости.
- Болью в животе после еды. Нормальная слизистая оболочка желудка выполняет защитную функцию, предохраняя желудок от агрессивного воздействия пищевых продуктов. При нарушении процессов клеточного деления повышается риск ее воспаления (развития гастрита) и образования язв, что может проявляться режущими болями в животе, усиливающимися после приема пищи (особенно острой, грубой, плохо обработанной).
Поражения нервной системы при дефиците витамина В12 обусловлены участием кобаламина в образовании миелиновых оболочек, которые являются составной частью большинства нервных волокон организма и обеспечивают передачу нервного импульса по ним. При нарушении образования миелина происходит повреждение и склероз (замещение рубцовой тканью) нервных клеток и нервных волокон, что может проявляться всевозможными неврологическими нарушениями (в зависимости от того, какие нервы были поражены).
Наиболее опасным считается поражение головного мозга, являющегося центром всей нервной системы, и спинного мозга, который представляет собой совокупность нервных волокон, идущих от головного мозга ко всем органам и тканям организма и в обратном направлении.
Симптомами поражения нервной системы при В12 дефицитной анемии могут быть:
- Нарушение чувствительности. Одно из первых проявлений поражения нервной системы. Чувствительность может нарушаться в любых участках тела, однако это наиболее заметно, когда поражаются пальцы рук, запястья. Больной человек может не ощущать прикосновение, тепло, холод и даже боль. Чаще поражение носит двусторонний характер и без соответствующего лечения постоянно прогрессирует.
- Парестезии. Один из видов нарушения чувствительности, характеризующийся онемением, покалыванием, «ползанием мурашек» в определенной области кожи.
- Атаксия. Данный термин подразумевает нарушение согласованной работы мышц. Это может проявляться нарушением равновесия, неуклюжестью и несогласованностью движений рук и ног, туловища.
- Снижение мышечной силы. Чтобы мышца сокращалась, необходимо поступление достаточного количества нервных импульсов из головного мозга. Кроме того, даже в покое головной мозг постоянно посылает к мышцам небольшое количество импульсов, что обеспечивает поддержание мышечного тонуса. При поражении спинного мозга импульсы не могут достичь мышц, в результате чего происходит их атрофия (уменьшение массы и размеров). При отсутствии своевременного лечения данное состояние может прогрессировать и привести к параличу – полной утрате способности выполнять произвольные движения.
- Нарушение процессов дефекации и мочеиспускания. Развиваются при длительном недостатке витамина В12 в организме и могут проявляться задержкой или, наоборот, недержанием кала и/или мочи (в зависимости от того, какие участки спинного мозга поражены).
- Нарушения психики. Является одним из наиболее неблагоприятных (в прогностическом плане) симптомов заболевания и характеризуется поражением коры головного мозга. Выраженность психических расстройств варьирует в зависимости от пораженного участка и выраженности склеротических изменений и может проявляться как бессонницей, незначительным ухудшением памяти или легкой депрессией, так и тяжелыми психозами, судорогами, галлюцинациями.
При В12 дефицитной анемии неврологические симптомы появляются в определенной последовательности — вначале происходит симметричное поражение ног, затем живота и туловища. В более поздних стадиях в процесс вовлекаются пальцы рук, плечевой пояс, шея, может поражаться область лица и головы. В последнюю очередь появляются психические расстройства.
Диагностикой и лечением В12 дефицитной анемии занимается врач-гематолог, который, при необходимости, может привлекать других специалистов (гастролога, невролога).
Процесс диагностики В12 дефицитной анемии включает:
- общий анализ крови;
- биохимический анализ крови;
- пункцию костного мозга;
- установление причины В12 дефицитной анемии.
Целью данного исследования является определение клеточного состава периферической крови, а также детальное исследование полученного материала под микроскопом, что позволяет выявить отклонения в размерах, форме или составе клеток в крови.
Забор крови для анализа
Процедуру производит медсестра в специальном процедурном кабинете. Кровь берется утром, натощак. За 2 – 3 часа до сдачи анализа рекомендуется исключить курение и тяжелые физические нагрузки.
Для клинического анализа кровь могут брать:
- Из пальца (капиллярную). Капиллярную кровь берут из кончика пальца руки. Вначале с целью дезинфекции медсестра обрабатывает палец пациента ватой, смоченной в 70% спирте. После этого скарификатором (тонкой одноразовой стерильной пластинкой, которая заточена с обеих сторон) делается прокол кожи на глубину 2 – 4 мм. Первая появившаяся капля крови удаляется ватным тампоном, после чего в специальную промаркированную стеклянную трубку набирается несколько миллилитров крови. По окончании процедуры к месту прокола на 2 – 3 минуты прикладывается ватный тампон, пропитанный спиртом.
- Из вены. Кровь обычно берут из вен локтевой области, которые наиболее хорошо определяются под кожей. Если определить расположение вены в данной области не удается, кровь можно взять из любой другой вены. Пациент садится на стул и кладет руку на его спинку таким образом, чтобы локтевой сустав оказался в разогнутом состоянии. Медсестра накладывает тугой жгут на область плеча и определяет местоположение вены. Локтевая область дважды обрабатывается ватой, смоченной в спирте, после чего одноразовой стерильной иглой, присоединенной к шприцу, производится прокол вены и забор нескольких миллилитров крови. Потом игла извлекается, а к месту прокола на 5 – 7 минут прикладывается пропитанный спиртом ватный тампон.
Микроскопическое исследование
Для определения формы и размеров различных клеток в исследуемой крови, одну или несколько капель переносят на специально стекло, окрашивают специальными красителями и исследуют в световом микроскопе. Таким же способом можно подсчитать примерное содержание клеток в исследуемом образце.
Нормальный размер эритроцитов – 7,5 – 8,3 мкм. При микроскопическом исследовании они определяются как клетки красного цвета, одинаковых размеров, кольцевидной формы, не содержащие ядра или других включений.
При дефиците витамина В12 в костном мозге образуются мегалобласты. Часть из них сразу разрушается, а остальные поступают в кровоток.
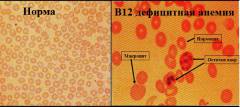
При В12 дефицитной анемии микроскопическая картина периферической крови характеризуется:
- Пойкилоцитозом – наличием эритроцитов различной формы.
- Анизоцитозом – наличием эритроцитов различных размеров.
- Макроцитозом – наличием эритроцитов, увеличенных в диаметре (более 8,5мкм).
- Внутриклеточными включениями – в эритроцитах определяются остатки разрушенного ядра и некоторые органеллы.
- Гиперхромией – эритроциты имеют более выраженную окраску, чем в норме (что обусловлено большой концентрацией гемоглобина и отсутствием сужения в центре клетки).
Исследование в гематологическом анализаторе
В большинстве современных лаборатории имеются специальные гематологические анализаторы, которые позволяют в довольно короткие сроки получить точную информацию о количестве клеточных элементов в исследуемой крови, а также некоторые другие показатели.
| Исследуемый показатель | Что обозначает | Норма | Изменения при В12 дефицитной анемии |
| Данный показатель более точно отображает средние размеры эритроцитов в исследуемой крови, так как оценивает большее количество клеток, чем то, которое исследует врач при обычной микроскопии. | 75 – 100 кубических микрометров (мкм 3 ). | 100 – 110 мкм 3 и более. | |
| Концентрация эритроцитов (RBC) | В результате усиленного разрушения эритроцитов в костном мозге и в селезенке количество их в периферической крови будет снижено. | Мужчины (М): 4,0 – 5,0 х 10 12 /л. | Менее 4,0 х 10 12 /л. |
| Женщины (Ж): 3,5 – 4,7 х 10 12 /л. | Менее 3,5 х 10 12 /л. | ||
| Концентрация тромбоцитов (PLT) | При в12 дефицитной анемии нарушается образование не только эритроцитов, но и остальных клеток крови. | 180 – 320 х 10 9 /л. | Менее 180 х 10 9 /л. |
| Концентрация лейкоцитов (WBC) | Лейкоциты выполняют защитную функцию. В норме их концентрация увеличивается при различных инфекциях. При дефиците витамина В12 образование лейкоцитов нарушается, и их количество в крови может быть уменьшено даже при тяжелых инфекционных заболеваниях. | 4,0 – 9,0 х 10 9 /л. | Менее 4,0 х 10 9 /л. |
| Концентрация ретикулоцитов (RET) | При дефиците витамина В12 кроветворение в костном мозге неэффективно, клетки не созревают до стадии ретикулоцитов, в результате чего их количество в крови будет снижено. | М: 0,24 – 1,7%. | Может быть в несколько раз ниже нормы. |
| Ж: 0,12 – 2,05%. | |||
| Общий уровень гемоглобина (HGB) | При В12 дефицитной анемии количество эритроцитов снижено, однако концентрация гемоглобина в каждом из них увеличена, что может поддерживать общий уровень гемоглобина в крови на нормальном уровне. | М: 130 – 170 г/л. | Может быть нормальным или слегка сниженным. |
| Ж: 120 – 150 г/л. | |||
| Средняя концентрация гемоглобина в эритроцитах (MCHC) | Дает более точную информацию о насыщении эритроцитов гемоглобином, так как не учитывается объем плазмы, в которой находятся клетки крови. | 320 – 360 г/л. | Более 400 г/л. |
| Среднее содержание гемоглобина в одном эритроците (MCH) | Определяется посредством деления уровня гемоглобина на количество эритроцитов (вычисления производятся гематологическим анализатором автоматически). | 27 – 33 пикограмм (пг). | Более 35 пг. |
| Гематокрит (Hct) | Данный показатель выражается в процентах и определяет долю клеточных элементов в общем объеме крови. | М: 42 – 50%. | Снижен из-за значительного уменьшения количества эритроцитов в крови. |
| Ж: 38 – 47%. | |||
| Цветовой показатель (ЦП) | Характеризует степень насыщения эритроцитов гемоглобином — чем его больше, тем выше будет цветовой показатель. | 0,85 – 1,05. | Более 1,1. |
| Скорость оседания эритроцитов (СОЭ) | Так как наружные поверхности эритроцитов заряжены отрицательно, они отталкиваются друг от друга, что препятствует их склеиванию. Суть определения СОЭ заключается в склеивании эритроцитов в крови и оседании их на дно пробирки под действием силы тяжести. Скорость данного процесса зависит от концентрации клеток в крови — чем их меньше, тем слабее они отталкиваются друг от друга, и тем быстрее будет СОЭ. | М: 3 – 10 мм/час. | Более 15 мм/час. |
| Ж: 5 – 15 мм/час. | Более 20 мм/час. |
Данное исследование позволяет определить наличие растворенных в крови веществ (белков, ферментов, витаминов и других). Практически любое заболевание (в том числе и В12 дефицитная анемия) характеризуется увеличением или снижением концентрации различных веществ в крови, что позволяет судить о выраженности патологического процесса и степени повреждения внутренних органов, а также контролировать эффективность проводимого лечения.
Кровь для биохимического исследования берется из вены (подготовка пациента и методика забора материала были описаны выше), после чего в специальной пробирке направляется в лабораторию.
| Исследуемый показатель | Что обозначает | Норма | Изменения при В12 дефицитной анемии |
| Содержание кобаламина в крови | Обычно заболевание характеризуется снижением уровня витамина В12. Однако в некоторых случаях (при нарушениях обмена кобаламина в организме) концентрация данного витамина в крови будет увеличена, несмотря на клинические проявления В12 дефицитной анемии, поэтому данный показатель необходимо оценивать, учитывая данные других анализов. | 200 – 900 пг/мл. |
|
| Уровень метилмалоновой кислоты в крови | Данное вещество участвует в процессах жизнедеятельности клеток. Для его использования необходимо наличие активной формы кобаламина (ДА-В12), в отсутствии которой метилмалоновая кислота не может использоваться клетками организма, в результате чего ее концентрация в крови повышается. | 73 – 270 нмоль/мл. | Значительно выше нормы. |
| Уровень гомоцистеина в крови | Гомоцистеин – аминокислота, которая участвует в образовании вещества метионина, входящего в состав миелиновых оболочек нервных клеток. Этот процесс также требует присутствия активной формы кобаламина (метил-В12). При его недостатке количество свободного гомоцистеина в плазме крови повышается. | 5 – 16 мкмоль/л. | Значительно выше нормы. |
| Концентрация билирубина (несвязанной фракции). | Уровень несвязанного билирубина может повышаться при массивном разрушении мегалобластов в красном костном мозге и в селезенке. | 4,5 – 17,1 мкмоль/л. | Может быть увеличен в несколько раз, особенно при длительном течении заболевания. |
| Концентрация сывороточного железа | При интенсивном разрушении эритроцитов и их предшественников из них выделяется большое количество железа. В нормальных условиях оно используется для синтеза новых эритроцитов, однако при В12 дефицитной анемии данный процесс нарушен, в результате чего концентрация железа в крови может повышаться. | М: 17,9 – 22,5 мкмоль/л. | Может повышаться при длительном течении заболевания. |
| Ж: 14,3 – 17,9 мкмоль/л. |
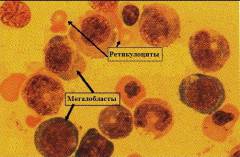
Обычно костный мозг берут из грудины. Процедура выполняется только специально обученным врачом в условиях стерильной операционной. Место пункции дважды обрабатывается 70% спиртовым или йодным раствором. После этого специальным шприцем с полой иглой, установленной под прямым углом к грудине, прокалывают кожу и надкостницу и продвигают иглу на 1 – 2 см в вещество кости. Убедившись, что игла находится в полости кости, производится забор нескольких миллилитров костного мозга, который имеет вид густого, желтовато-красно вещества. Полученный материал направляется в лабораторию для микроскопического исследования.
При В12 дефицитной анемии в костном мозге определяется увеличение клеточных элементов (преимущественно за счет предшественников эритроцитов). Клетки увеличены в размерах, содержат слишком большое количество гемоглобина (по сравнению с нормой). Также отмечается нарушение созревания мегакариоцитов (предшественников тромбоцитов) и промиелоцитов (предшественников лейкоцитов).
При подтверждении диагноза не менее важным моментом является выявление его причины, так как ее устранение (если оно возможно) может привести к излечению пациента.
Для выявления причины В12 дефицитной анемии используется:
- Оценка рациона пациента. Уточняется, как питается пациент, потребляет ли достаточное количество животных продуктов, как часто употребляет алкогольные напитки.
- Фиброгастродуоденоскопия (ФГДС). Метод исследования внутренней поверхности желудка и начального отдела кишечника посредством введения специальной трубки с видеокамерой на конце. Позволяет выявить атрофию слизистой, наличие рака или язвы.
- Биопсия слизистой оболочки желудка и/или кишечника. Подразумевает прижизненное взятие кусочка ткани слизистой оболочки и исследование его клеточного строения. Позволяет выявить атрофические процессы, а также различить доброкачественные и злокачественные опухоли.
- Анализ кала на яйца гельминтов (глистов). С помощью данного метода можно установить само наличие паразитов, а также определить их чувствительность к различным противопаразитарным препаратам, что позволит назначить максимально эффективное лечение.
- Определение специфических антител. В крови могут определяться антитела к внутреннему фактору Касла либо к париетальным клеткам слизистой оболочки, которые его продуцируют.
- Оценка функции печени. Определяется уровень печеночных ферментов в крови, проводится ультразвуковое исследование (УЗИ) органа.
- Определение уровня гормонов щитовидной железы в крови. При их увеличении потребление кобаламина организмом возрастает, что со временем может привести к развитию В12 дефицитной анемии.
Суть медикаментозной терапии данного недуга заключается в ведении витамина В12 извне. Поступив в организм, кобаламин быстро включается в процессы кроветворения, что приводит к устранению симптомов анемии в довольно короткие сроки.
Показаниями к началу лечения витамином В12 являются:
- подтвержденный (лабораторно) диагноз В12 дефицитной анемии;
- концентрация кобаламина в плазме крови менее 220 пг/мл;
- выраженная клиническая картина анемии (даже при более высокой концентрации кобаламина в крови).
Способ применения и дозировка
В большинстве случаев препарат витамина В12 (цианокобаламин) вводится внутримышечно. Прием внутрь (в виде таблеток) допускается, если достоверно установлено, что причиной дефицита витамина является недостаточное его количество в пище, а общее состояние организма не критично (легкое снижение показателей крови, отсутствие неврологических проявлений).
Лечение начинают с внутримышечного введения 500 – 1000 мкг цианокобаламина 1 раз в сутки. Минимальный курс лечения – 6 недель, после чего переходят на поддерживающую терапию. Дозировка препарата на данном этапе лечения зависит от причины и выраженности дефицита витамина В12 в организме. Обычно назначается внутримышечное введение 200 – 400 мкг цианокобаламина 2 – 4 раза в месяц. Поддерживающая терапия может проводиться пожизненно.
Контроль эффективности лечения
В период лечения рекомендуется сдавать общий анализ крови 2 – 3 раза в неделю.
Первым признаком эффективности терапии, а также достоверным подтверждением диагноза является «ретикулоцитарный криз», возникающий на 3 – 5 день после начала введения витамина В12 в организм. Данное состояние характеризующийся резким увеличением количества ретикулоцитов в крови (в 10 – 20 раз), что свидетельствует о начале нормального кроветворения в косном мозге.
В течение 1 – 1,5 месяцев происходит постепенная нормализация состава периферической крови, ослабление неврологических проявлений, нормализация работы пищеварительной системы, что свидетельствует об эффективности проводимого лечения. На этапе поддерживающей терапии рекомендуется ежемесячное проведение общего анализа крови и определение уровня кобаламина в крови.
Суть метода заключается в переливании пациенту крови или, чаще, отдельной эритроцитарной массы. Переливание крови является опасной процедурой, поэтому данный метод используется только при угрожающих жизни состояниях.
Показаниями к переливанию эритроцитов при В12 дефицитной анемии являются:
- Тяжелая анемия – уровень гемоглобина менее 70 г/л;
- Анемическая кома – потеря сознания, обусловленная выраженным нарушением доставки кислорода к мозгу.
Перед началом процедуры проводятся тесты на совместимость крови донора и реципиента (того, кому переливается кровь), после чего в одну из больших вен организма вводится катетер, через который переливается эритроцитарная масса. Так как данная процедура сопряжена с риском развития множества побочных реакций, в течение всего периода переливания крови в палате должен присутствовать врач.
При подтвержденном диагнозе В12 дефицитной анемии одновременно с переливанием донорских эритроцитов начинают внутримышечное введение витамина В12. Переливание крови следует прекратить как можно раньше, как только устранено угрожающее жизни состояние.
Как говорилось ранее, суточная потребность в витамине В12 составляет 3 – 5 мкг, а запасы данного витамина в печени настолько велики, что даже при прекращении поступления кобаламина в организм признаки его дефицита появятся не ранее, чем через 2 – 3 года. Тем не менее, диета играет определенную роль в процессе лечения заболевания, особенно когда запасы витаминов В12 в организме снижаются.
Причинами снижения запасов витамина В12 в организме могут быть:
- Заболевания печени. Такие заболевания как цирроз и рак печени, приводят к уменьшению количества нормальных клеток органа, и замещению их соединительно тканью, которая неспособна депонировать витамин В12. В результате запасы данного витамина в организме снижаются, а при нарушении его поступления признаки заболевания могут появляться в более ранние сроки.
- Беременность. В данном случае матери необходимо обеспечивать витамином В12 не только свой, но и быстро развивающийся организм ребенка, поэтому суточная потребность в витамине В12 может увеличиваться на 50%, а в случае многоплодной беременности – еще больше. В нормальных условиях (при отсутствии заболеваний печени) запасов кобаламина в организме достаточно, чтобы покрыть потребности матери и плода в данном веществе. Однако при частых беременностях запасы кобаламина могут истощаться, особенно если у матери имеются какие-либо заболевания печени, поэтому беременным женщинам особенно важно потреблять достаточное количество этого витамина с пищей.
| Наименование продукта | Содержание витамина В12 в 100г продукта |
| Печень говяжья | 60 мкг |
| Печень свиная | 30 мкг |
| Печень куриная | 16 мкг |
| Скумбрия | 12 мкг |
| Мясо кролика | 4,3 мкг |
| Говядина | 2,6 мкг |
| Морской окунь | 2,4 мкг |
| Свинина | 2 мкг |
| Треска | 1,6 мкг |
| Карп | 1,5 мкг |
| Куриное яйцо | 0,5 мкг |
| Сметана | до 0,4 мкг |

С тех пор как в лечении В12 дефицитной анемии начали применять внутримышечное введение цианокобаламина прогноз для жизни и здоровья пациентов значительно улучшился. При соблюдении режима приема препарата люди могут доживать до глубокой старости без каких-либо проявлений заболевания.
источник




