При апластической анемии терапией намечаются следующие цели (Берчану):
1) устранение обусловившей заболевание причины;
2) достижение наиболее полной ремиссии путем:
а) замещающего лечения, чтобы обеспечить необходимое время для восстановления костного мозга;
б) лечения инфекционных осложнений;
3) стимулирование кроветворения.
Отдельные гигиенические мероприятия представляются обязательными, в этой связи больным указывать на необходимость избегать кожные инфекции — применением антисептических веществ, инфекции дыхательных путей — избегая места большого скопления людей. Рекомендуется также избегать физическую травму вызывающую кровотечение.
Замещающее лечение при апластической анемии. Наиболее целесообразным представляется переливание крови. Всеми рекомендуется этот способ лечения когда показатель гемоглобина понижается до менее 8 г/100 мл. Перфузия тромбоцитной массой показана при тяжелом геморрагическом синдроме, в то время как переливание концентрата гранулоцитов необходимо при осложнении болезни инфекцией неподдающейся обычной антибиотикотерапии.
Терапия инфекций при апластической анемии. Рекомендуются культуры крови, мочи, желчи, кожных поражений, мокроты и пр. в целях выявления возбудителя. Однако в срочных случаях до получения результата от культур и антибиограммы, целесообразно назначать антибиотик широкого диапазона действия, например ампициллин. Полезно не забывать, что у таких больных довольно редкие инфекции как, например, гистоплазмой, кандидой, аспергиллом — частое явление.
Страдающих тяжелой формой агранулоцитоза или нейтропении (менее 500/мм3) изолировать, преимущественно в стерильные комнаты.
Лечение кортикостероидными гормонами при апластической анемии. Такое мероприятие оправдывает себя во многих случаях апластической анемии (для стимулирования кроветворения, при геморрагическом синдроме, сопутствующем расплавлении крови и пр.). Большинством авторов рекомендуется 1—2 -месячный курс лечения умеренными дозами (от 30 до 50 мг. в сутки). Если за этот срок не отмечаются положительные результаты, прекратить лечение.
Лечение, стимулирующее костный мозг при апластической анемии. До настоящего времени, в частности у больных детского возраста, наиболее эффективным представляется применение андрогенных гормонов.
Видимо мужские гормоны обусловливают выделение эритропоэтина и сенсибилизацию кроветворной ткани к этому веществу. С особым успехом, в частности детям, применяется синтетический тестостерон (оксиметолон), причем медикамент назначается внутрь, дозами от 2 до 4 мг на кг. веса тела в сутки. Когда этот медикамент отсутствует, может оказаться полезным и тестостерон-пропионат принимаемый также внутрь из расчета 0,25 мг/кг веса тела/сутки. Лечение проводить не менее 3 месяцев.
Отдельные авторы назначают это лечение на сроки, достигающие 9 месяцев. Разные статистические материалы и данные разведочных исследований не выявляют какой-либо существенной разницы между леченными андрогенами и иными способами.
Многочисленные эксперименты доказали роль карбоната лития в поощрении продукции моноцитами фактора, стимулирующего колонии. До настоящего времени не проводились разведочные работы, однако авторы, сделавшие попытки в этом направлении рекомендуют назначение карбоната лития из расчета 450—600 мг/сутки в течении 3—4 недель, при условии наличия в костном мозге гранулоцитных предшественников и периодической проверки уровня лития в крови. Отсутствие положительного результата вскрывает нецелесообразность дальнейшего применения этого лечения (Williams, Ward).
При костномозговой аплазии после облучения смертельными дозами Mathe применял пересадку костного мозга с весьма хорошими результатами. После успешного завершения этого эксперимента и до настоящего времени в технике пересадки органов — — вообще, и костного мозга — в частности, достигнуты существенные прогрессы.
В данный момент пересадка составляет терапевтический метод выбора в случаях заболевания молодых людей тяжелой апластической анемией (Geary).
Критерии для постановки диагноза тяжелой апластической анемии следующие: анемия с наличием 1% ретикулоцитов, 500/мм3 гранулоцитов, 20 000/мм3 тромбоцитов и в результате биоптического исследования пораженного гипоплазией костного мозга — 25% нормальной клеточной массы.
Статистические данные центров (Seattle), применяющих эту терапию, указывают на полную ремиссию у 50% больных, в противоположность 10% — леченных условными способами (Thomas D., Sterb).
При этом возникают следующие проблемы:
— отбор доноров костного мозга путем стандартизации по системе «Human Leucocytes Antigen» (HLA) и осуществеления смешанных культур лимфоцитов. По статистическим материалам в системе HLA, у половины какой-либо данной группы больных отмечено сходство с их родственниками, в то же время в пределах семьи шансы совместимости оцениваются до 25%;
— даже при строгой совместимости — отдача трансплантата наблюдается в 26% случаев.
Существует ряд способов годготовки больных в целях облегчения пересадки и избежания явления отдачи.
Применение циклофосфамида составляет стандартный метод лечения, но больным, в отношении которых тест лимфоцитотоксичности показывает предварительную сенсибилизацию к костному мозгу донора, назначаются прокарбазин, глобулин антитимоцит и общее облучение. Недавно в Seattle начало применяться циклофосфамид в сочетании с периферическими одноядерными клетками донора для дополнения клеток-штамм, при этом полученные результаты — обнадеживающие.
Известно, что у примерно 80% больных с предварительной сенсибилизацией наблюдается явление отдачи трансплантата.
После пересадки назначается метотрексат в целях предупреждения явления «трансплантат против хозяина», которое, в течение ближайших трех месяцев после операции, составляет причину 20% смертных исходов.
Однако тяжелые инфекции составляют причину остальных, быть может даже большинства, смертных исходов.
Отмечается также развитие интерстициальной пневмонии у 68% больных и заболевание вызываемое цитомегалическим вирусом или Pneumocystis carinii (Silver).
До настоящего времени результаты обнадеживающие. В этой связи отмечаются большая продолжительность выживаемости страдающих костномозговой аплазией с хорощо приживленным трансплантатом, чем у леченных условными способами (Storb и Thomas) и, как уже было сказано, более высокий процент полной ремиссии.
Иммуносупрессорная терапия (циклофосфамидом и пр. средствами) испробована при генуинной апластической анемии, поскольку были выявлены некоторые иммунологические механизмы (Ascensao). Недавно была сделана попытка лечения этого заболевания либо только антилимфоцитным глубилином, либо сочетая его с костномозговой пересадкой (Geary). Статистическими данными еще не подтверждена эффективность такого лечения, однако прогрессы, достигнутые в деле выявления иммунологических механизмов при апластической анемии сделают возможным отбор больных для иммуносупрессорной терапии.
С той же иммуносупрессорной целью проводилась спленэктомия, но лишь с частично положительными результатами (Берчану).
источник
Одним из самых редких, но тяжелых заболеваний системы кровообращения считается апластическая анемия, симптомы, причины, методы лечения этого вида малокровия бывают различны. Все зависит от формы, вида и степени тяжести данной патологии.
Люди, далекие от медицины, зачастую не имеют представления о том, что такое апластическая анемия. Так называется расстройство кроветворной функции костного мозга, ведущее к снижению выработки кровяных клеток. Это приводит к серьезным патологическим изменениям во всех системах человеческого организма. Очень часто заболевание заканчивается летально.
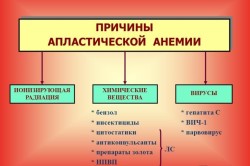
Этиология апластической анемии до сих пор досконально не изучена. Поэтому окончательный список причин данного заболевания все еще полностью не составлен. На данный момент основными причинами апластического малокровия считаются:
- плохая экология в регионе проживания;
- ионизирующая радиация;
- постоянные контакты с опасными химическими веществами в течение долгого времени;
- отдельные инфекционные заболевания: гепатит, цитомегаловирус;
- разрушение костного мозга под воздействием некоторых медикаментозных средств при их длительном приеме в высоких дозах, особенно левомицетина, мышьяка, бензола, химических препаратов, противоопухолевых средств, антибиотиков;
- генетическая предрасположенность;
- беременность;
- патологии костного мозга;
- злоупотребление алкоголем.
Возникновение апластической анемии у детей сразу после рождения может быть спровоцировано такими причинами, как:
- врожденный сифилис;
- токсоплазмоз;
- генерализованный мегалоцитоз.
Часто у детей диагностируется идиопатическая апластическая анемия. В этом случае определить точную причину возникновения патологии не представляется сегодня возможным.
При гипопластической анемии наблюдается еще более серьезное расстройство кроветворной функции костного мозга. В целом гипопластические и апластические анемии вызывают сходные патологии органов и систем организма, имеют похожую симптоматику и лечатся примерно одинаково.
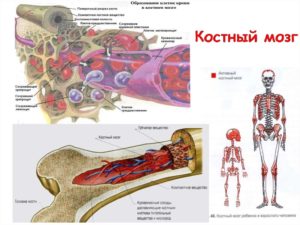
Костный мозг образуется губчатой структурой и располагается в глубине трубчатых костей. Посредством его структуры происходит выработка различных клеток крови: лейкоцитов, тромбоцитов, эритроцитов.
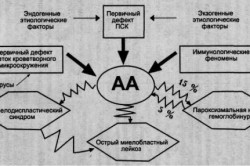
При апластической анемии, прежде всего, нарушается эритрогенез. Стимулировать этот процесс медикаментозными средствами невозможно. В этом случае может помочь только пересадка донорского костного мозга.
Помимо этого, апластичная анемия развивается на фоне уменьшения количества и изменения функций стволовых клеток.
Причиной этого становится нарушение микроокружения, клеточное или гуморальное воздействие иммунного характера, препятствующее нормальному функционированию стволовых клеток.
Апластическая анемия, симптомы которой часто незаметны, является серьезной патологией. В отдельных случаях недуг начинается в острой форме с быстрым нарастанием симптоматических проявлений. Развитие болезни может быстро прогрессировать, приводя к летальному исходу. Возможно также хроническое с периодическими ремиссиями и рецидивами протекание анемии.
Апластическая анемия симптомы имеет следующие: анемический, геморрагический и лейкоцитопенический синдромы. Для каждого из них характерны определенные признаки.
Анемический синдром (снижение уровня гемоглобина) возникает при нарушении формирования эритроцитов и сопровождается такими симптомами, как:
- общая слабость;
- сонливость;
- бессонница;
- раздражительность;
- одышка;
- шум в ушах;
- тахикардия;
- бледность кожных покровов;
- быстрая утомляемость.
Геморрагический синдром (повышение кровоточивости) вызван понижением уровня тромбоцитов в крови. Его сопровождают такие симптомы, как:
- петехии, т. е. точечные кровоизлияния на коже и слизистых оболочках и гематомы;
- плохая свертываемость крови;
- десневые и носовые кровотечения;
- появление крови в моче;
- обильные менструальные выделения у женщин.

Он сопровождается следующими симптомами:
- появление хронических очагов инфекции в различных органах и на поверхности кожи больного;
- учащение инфекционных заболеваний, протекающих длительно и со многими осложнениями;
- стоматит;
- внезапная гипертермия без видимых причин.
По форме апластическая и гипопластическая анемия может быть как врожденной, так и приобретенной.
После проведения анамнестической беседы врач проводит общий осмотр пациента. При этом обязательно применяются такие методы, как:
- выслушивание (аускультация) сердечных шумов;
- простукивание (перкуссия) живота, показывающая увеличение таких органов, как печень и селезенка;
- прощупывание (пальпация) для уточнения результатов перкуссии.
Для получения дополнительных сведений больному назначается:
- общий анализ крови;
- биохимический анализ крови;
- клинический анализ крови — гемограмма;
- забор мазка — биопсия, костного мозга;
- анализ мазка костного мозга, на основании которого составляется миелограмма.
При необходимости больному проводятся специальное тестирование, помогающее уточнить причину заболевания.
На основании всех полученных данных составляется точная клиническая картина заболевания, необходимая для определения курса лечения.
Когда больному диагностируется апластическая анемия, лечение проводится по 3 направлениям: этиологическому, симптоматическому и патогенетическому. Если известна точная причина возникновения заболевания, ее необходимо ликвидировать: прекратить контакт с токсинами, сменить лекарственные препараты, используемые для лечения других заболеваний и т. д.
Восстановлению кроветворного функционирования костного мозга помогают следующие препараты:
- кортикостероиды;
- андрогены;
- цитоксины;
- иммуносупрессоры.
Помимо медикаментозной терапии лечение апластической анемии проводится при помощи таких процедур, как переливание крови и ТКМ. Посредством переливания донорской крови организм больного частично обеспечивается недостающими кровяными клетками.
В особых случаях больным проводится трансплантация костного мозга. Костный мозг донора должен максимально соответствовать костному мозгу реципиента. Поэтому этот метод особенно эффективен, если у больного есть однояйцевый близнец. Процент выживаемости после трансплантации костного мозга выше у реципиентов более молодого возраста.

Основными факторами, влияющими на получение положительных эффектов, являются:
- Степень тяжести заболевания.
- Правильный выбор и хорошая переносимость лечения.
- Возраст больного. Легкая апластическая анемия у детей и молодых людей, не достигших 30-летнего возраста, полностью вылечивается чаще, чем у людей среднего и старшего возраста. При тяжелых формах болезни прогнозы не столь благоприятные.
Основным условием ремиссии и значительного продления жизненного срока является хорошая переносимость патогенетической терапии и успешное проведение трансплантации костного мозга.
Профилактика анемии различного вида может быть первичной или вторичной. Первичная профилактика предполагает исключение возможности развития данной патологии у относительно здорового человека. Этого можно добиться при помощи таких способов, как:
- ведение здорового образа жизни;
- правильное питание;
- постоянное укрепление иммунной системы;
- исключение или сведение к минимуму контакта с ионизирующими излучателями и токсичными веществами, вызывающими патологии костного мозга;
- контролированный прием лекарственных препаратов во время лечения других заболеваний;
- периодические визиты к терапевту и гематологу;
- полный отказ от употребления алкоголя и никотина.
Вторичная профилактика анемии проводится для замедления развития заболевания, избегания его осложнения сопутствующими патологиями. Для этого необходимо:
- аккуратное проведение лечения;
- постоянный контроль специалистов — гематолога и терапевта;
- тщательное контролирование больным своего состояния, немедленное посещение врача при появлении новых симптомов;
- постоянный прием поддерживающих препаратов в течение долгого времени.
Апластическая анемия — опасная патология, которую лечат годами. Только под наблюдением специалиста можно добиться стойкой ремиссии патологии. Самолечение в этом случае неприемлемо и может привести к плачевным последствиям.
источник
Автор: Аверина Олеся Валерьевна, к.м.н., врач-патолог, преподаватель кафедры паталогической анатомии и патологической физиологии
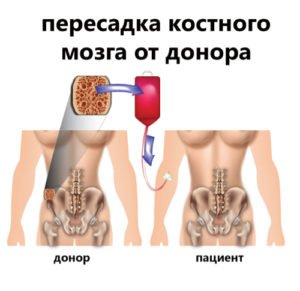
Пересадка костного мозга относится к разряду сложнейших и весьма дорогостоящих процедур. Только эта операция может вернуть пациента с тяжелой патологией кроветворения к жизни.
Число проводимых в мире трансплантаций постепенно растет, но и оно не способно обеспечить всех нуждающихся в таком лечении. Во-первых, трансплантация требует подбора донора, во-вторых, сама процедура подразумевает большие затраты на подготовку и донора, и пациента, а также на последующее лечение и наблюдение. Только крупные клиники с соответствующим оборудованием и высококлассными специалистами могут предложить такую услугу, но не каждый больной и его семья «потянут» лечение в финансовом плане.
Трансплантация костного мозга (КМ)– очень серьезная и длительная процедура. Без пересадки донорской кроветворной ткани больной погибнет. Показания к пересадке:
- Острые и хронические лейкозы;
- Апластическая анемия;
- Тяжелые наследственные формы иммунодефицитных синдромов и некоторые виды нарушений обмена веществ;
- Аутоиммунные заболевания;
- Лимфомы;
- Отдельные виды внекостномозговых опухолей (рак груди, например).

На сегодняшний день существует три вида пересадки кроветворной ткани:
- Пересадка костного мозга.
- Трансплантация стволовых клеток крови (СКК).
- Переливание пуповинной крови.
При трансплантации стволовых клеток последние отбираются из периферической крови донора во время соответствующей процедуры и подготовки. Пуповинная кровь – хороший источник стволовых клеток, подготовки донора и сложных мероприятий по забору материала при этом виде трансплантации не требуется. Самым первым способом пересадки кроветворной ткани была трансплантация именно костного мозга, поэтому зачастую и остальные виды операций именуют этим словосочетанием.
В зависимости от того, откуда получены стволовые клетки, различают пересадку:
Аутологичная трансплантация заключается в пересадке “родных” стволовых клеток больного, приготовленных заранее. Этот вариант лечения подходит лицам, чей костный мозг изначально не был поражен опухолью. Например, лимфома растет в лимфоузлах, но со временем способна внедриться в костный мозг, превратившись в лейкоз. В этом случае возможно произвести взятие неповрежденной костномозговой ткани в целях последующей трансплантации. Планируемая в будущем пересадка СКК позволяет прибегнуть к более агрессивной химиотерапии.
Аутологичная трансплантация костного мозга
Аллогенная трансплантация означает пересадку костного мозга от донора, будь то родственника или чужого человека. Этот вид операции показан больным лейкозами и апластическими анемиями, когда «добыть» свой здоровый костный мозг не представляется возможным. На помощь таким пациентам приходят добровольцы, желающие поделиться своими тканями ради спасения жизни.
Основным видом трансплантации сегодня является пересадка донорского костного мозга, полученного от постороннего лица. Донор – это человек, добровольно согласившийся поделиться своей кроветворной тканью или СКК. Это серьезный шаг, поэтому большинство потенциальных доноров осознают всю степень ответственности и взятых на себя обязательств.
Донором может быть каждый желающий, достигший совершеннолетия и до 55 лет, никогда не болевший гепатитами В и С, не являющийся носителем ВИЧ-инфекции и не страдающий психическим заболеванием, туберкулезом, злокачественными опухолями. Сегодня уже созданы регистры доноров КМ, насчитывающие свыше 25 млн лиц. Наиболее их число – жители США, среди стран Европы лидирует Германия (около 7 млн человек), в соседней Беларуси их уже 28 тысяч, а в России банк доноров составляет лишь около 10 тысяч человек.
Поиск донора – очень сложный и ответственный этап. При подборе подходящего донора первым делом обследуются ближайшие родственники, степень совпадения с которыми по антигенам гистосовместимости наиболее высока. Вероятность совместимости с братьями и сестрами достигает 25%, но если таковых нет либо они не могут стать донорами, больной вынужден обращаться к международным регистрам.
Большое значение имеет расовая и этническая принадлежность донора и реципиента, поскольку европейцы, американцы или россияне имеют различающийся спектр антигенов гистосовместимости. Малым народностям и вовсе практически нереально подобрать донора среди иностранцев.

Лейкоцитарные антигены системы HLA кодируются участками ДНК, расположенными на шестой хромосоме и составляющими так называемый главный комплекс гистосовместимости. В момент оплодотворения плод получает половину генов от матери и половину от отца, поэтому степень совпадения с близкими родственниками наиболее высока. Однояйцевые близнецы обладают и вовсе одинаковым набором антигенов, поэтому они считаются самой лучшей парой донор-реципиент. Необходимость в пересадках между близнецами возникает очень редко, а абсолютному большинству больных приходится искать неродственный костный мозг.
Подбор донора подразумевает поиск лица, максимально совпадающего по набору антигенов HLA с реципиентом. Известны антигены, которые очень схожи между собой по строению, их называют перекрестно реагирующими, и они повышают степень совпадения.
Почему так важно подобрать максимально подходящий вариант донорского костного мозга? Все дело в иммунных реакциях. С одной стороны, организм реципиента способен распознать донорскую ткань как чужеродную, с другой – пересаженная ткань может вызвать иммунную реакцию в отношении тканей реципиента. И в том, и в другом случае возникнет реакция отторжения пересаженной ткани, что сведет результат процедуры к нулю и может стоить жизни реципиенту.
забор костного мозга у донора
Поскольку при пересадке костного мозга происходит полная ликвидация собственной кроветворной ткани и угнетение иммунитета, то при этом виде трансплантации более вероятна реакция «трансплантат против хозяина». В организме реципиента не происходит иммунного ответа на чужеродное, но зато пересаженный активный донорский костный мозг способен развить сильную иммунологическую реакцию с отторжением трансплантата.
Потенциальные доноры проходят типирование по антигенам HLA, проводимое с использованием сложнейших и дорогостоящих тестов. Перед процедурой пересадки эти тесты повторяют, чтобы убедиться в хорошей совместимости донора и реципиента. Обязательным считается определение так называемых предсуществующих антител, которые могли образоваться у потенциального донора при предшествующих переливаниях крови, беременностях у женщин. Наличие таких антител даже при высокой степени совпадения по антигенам гистосовместимости считается противопоказанием к трансплантации, так как вызовет острое отторжение пересаженной ткани.
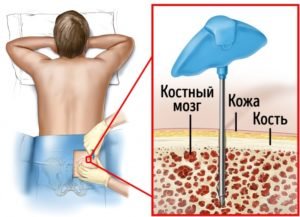
Когда подходящий донор найден, ему предстоит пройти забор ткани для пересадки реципиенту. Само по себе донорство костного мозга предполагает сложные и даже болезненные процедуры, поэтому потенциальные доноры, будучи информированными о предстоящем развитии событий, уже осознают важность своего участия и степень ответственности в процессе трансплантации, и случаев отказа практически не случается.
Отказ от донорства недопустим на том этапе, когда пациент уже прошел стадию кондиционирования, то есть за 10 дней до планируемой трансплантации. Лишившись собственной кроветворной ткани, реципиент без пересадки погибнет, и донор должен это четко осознавать.
Для изъятия кроветворной ткани донора помещают в стационар на 1 день. Процедуру проводят под общей анестезией. Врач при помощи специальных игл пунктирует подвздошные кости (там костномозговой ткани больше всего), мест уколов может быть до ста и более. В течение примерно двух часов удается получить около литра костномозговой ткани, но этот объем способен дать жизнь реципиенту и обеспечить его новым органом кроветворения. При аутологичной пересадке полученный материал предварительно замораживается.
После получения костного мозга донор может чувствовать болезненность в участках прокола кости, но она благополучно снимается приемом анальгетиков. Удаленный объем кроветворной ткани восполняется на протяжении последующих двух недель.
При пересадке СКК методика получения материала несколько отлична. На протяжении пяти дней перед планируемым изъятием клеток доброволец принимает препараты, усиливающие их миграцию в сосуды, – ростовые факторы. В конце подготовительного этапа назначается процедура афереза, занимающая до пяти часов, когда донор находится на аппарате, «фильтрующем» его кровь, отбирая стволовые клетки и возвращая обратно все остальные.
За время афереза сквозь аппарат протекает до 15 литров крови, при этом удается получить не более 200 мл, содержащих стволовые клетки. После афереза возможна болезненность в костях, связанная со стимуляцией и увеличением объема собственного костного мозга.
Процедура трансплантации КМ происходит подобно обычному переливанию крови: реципиенту вводят жидкий донорский костный мозг или СКК, взятые из периферической или пуповинной крови.
Подготовка к трансплантации КМ имеет определенные отличия от других операций и является наиважнейшим мероприятием, направленным на обеспечение приживления донорской ткани. На этом этапе реципиент проходит кондиционирование, включающее в себя агрессивную химиотерапию, необходимую для полного уничтожения собственного КМ и опухолевых клеток в нем при лейкозах. Кондиционирование приводит к подавлению возможных иммунных реакций, препятствующих приживлению донорской ткани.
Тотальная ликвидация кроветворения требует обязательной последующей пересадки, без которой реципиент погибнет, о чем многократно предупреждают подходящего донора.
Перед планируемой трансплантацией костного мозга пациент подвергается тщательнейшему обследованию, ведь от состояния функции его органов и систем зависит и исход лечения. Процедура пересадки требует хорошего, насколько это возможно в данной ситуации, здоровья реципиента.
Весь подготовительный этап проходит в центре трансплантации под постоянным контролем высококвалифицированных специалистов. Ввиду подавления иммунитета, реципиент становится очень уязвимым не только к инфекционным заболеваниям, но и к обычным микробам, которые каждый из нас носит на себе. В связи с этим, для больного создаются максимально стерильные условия, исключающие контакт даже с самыми близкими членами семьи.
По истечении этапа кондиционирования, который длится всего несколько дней, приступают к собственно пересадке кроветворной ткани. Эта операция не похожа на привычные нам хирургические вмешательства, она производится в палате, где реципиенту вливают жидкий костный мозг или стволовые клетки внутривенно. Больной находится под контролем персонала, который следит за его температурой, фиксирует появление болезненности или ухудшение самочувствия.
После трансплантации костного мозга начинается приживление донорской ткани, которое растягивается на недели и месяцы, требующие постоянного наблюдения. Для приживления кроветворной ткани нужно около 20 дней, на протяжении который риск отторжения максимален.
Ожидание приживления донорской ткани – тяжелый этап не только физически, но и психологически. Пациент фактически без иммунитета, очень подверженный разного рода инфекциям, склонный к кровотечениям оказывается в почти полной изоляции, не имея возможности общения с самыми близкими ему людьми.
На этой стадии лечения принимаются беспрецедентные меры по предотвращению инфицирования больного. Медикаментозная терапия состоит в назначении антибиотиков, тромбоцитарной массы для препятствия кровотечениям, медикаментов, предотвращающих реакцию «трансплантат против хозяина».
Весь персонал, который входит в палату к пациенту, моет руки растворами антисептиков, надевает чистую одежду. Ежедневно производятся исследования крови в целях контроля приживления. Посещения родными и передача вещей запрещены. При необходимости покинуть палату, пациент надевает защитный халат, перчатки и маску. Нельзя передавать ему продукты питания, цветы, предметы обихода, в палате есть только все самое необходимое и безопасное.
После трансплантации больной проводит в клинике около 1-2 месяцев, по истечении которых в случае успешного приживления донорской ткани он может покинуть больницу. Не рекомендуется уезжать далеко, а если дом находится в другом городе, то лучше на ближайшее время снять квартиру близ клиники, чтобы в любой момент была возможность туда вернуться.
Во время трансплантации костного мозга и периода приживления пациент чувствует себя очень больным, испытывает сильную утомляемость, слабость, тошноту, отсутствие аппетита, вероятна лихорадка, нарушения стула в виде поносов. Особое внимание заслуживает психоэмоциональное состояние. Чувство подавленности, страх и депрессия – частые спутники пересадки донорских тканей. Многие реципиенты отмечают, что психологический стресс и переживания были для них более тяжелым испытанием, нежели физические ощущения нездоровья, поэтому очень важно обеспечить пациенту максимальный психологический комфорт и поддержку, а, возможно, потребуется помощь психолога или психотерапевта.
Почти половина пациентов, нуждающихся в пересадке КМ, – дети, больные злокачественными опухолями крови. У детей пересадка костного мозга подразумевает проведение тех же этапов и мероприятий, что и у взрослых, но лечение может потребовать более дорогостоящих препаратов и оборудования.

Около года после процедуры пересадки костного мозга пациент находится под наблюдением врачей, регулярно сдает анализы крови и проходит другие необходимые обследования. Этот срок обычно необходим для того, чтобы пересаженная ткань начала работать как своя собственная, обеспечивая иммунитет, правильное свертывание крови и работу других органов.
По отзывам пациентов, перенесших успешную трансплантацию, их жизнь стала после операции лучше. Это вполне естественно, ведь до лечения больной находился в шаге от смерти, а пересадка позволила вернуться к нормальной жизни. Вместе с тем, чувство беспокойства и тревоги может еще долгое время не покидать реципиента из-за страха развития осложнений.
На выживаемость пациентов, перенесших трансплантацию костного мозга, оказывает влияние возраст, характер основного заболевания и его продолжительность до операции, пол. У больных до 30 лет, женского пола, при длительности болезни не более двух лет до пересадки, выживаемость более 6-8 лет достигает 80%. Другие исходные характеристики снижают ее до 40-50%.
Пересадка костного мозга весьма дорогостояща. Пациенту придется заплатить за все подготовительные этапы, медикаменты, саму процедуру и последующее наблюдение. Стоимость в Москве начинается от 1 млн рублей, в Санкт-Петербурге – 2 млн и выше. Зарубежные клиники предлагают эту услугу за 100 и более тысяч евро. Доверием пользуется трансплантология в Беларуси, но и там лечение для иностранцев по стоимости сравнимо с таковым в европейских клиниках.
Бесплатно в России трансплантаций проводится ничтожно мало ввиду ограниченности бюджета и отсутствия подходящих доноров из числа соотечественников. При поиске иностранных доноров или направлении на пересадку в другую страну оно только платное.
В России трансплантацию КМ можно произвести в крупных клиниках Москвы и Санкт-Петербурга: Институте детской гематологии и трансплантологии им. Р. М. Горбачевой в Санкт-Петербурге, Российской детской клинической больнице и гематологическом научном центре Минздрава РФ в Москве и некоторых других.
В России основной проблемой трансплантологии костного мозга является не только малое количество стационаров, проводящих такое лечение, но и огромный недостаток доноров и отсутствие собственного регистра. Расходы на типирование не несет государство, равно как и на поиск подходящих кандидатов за рубежом. Только активное привлечение волонтеров и высокий уровень сознательности граждан могут в какой-то степени улучшить ситуацию донорства.
источник
Новые медикаменты и пересадка костного мозга помогут людям с апластической анемией жить полноценной жизнью гораздо дольше.
Кровь — это жизнь. Но редкая болезнь под названием апластическая анемия лишает организм жизни, лишая организм крови. (23.03.2008 — HealthDay Новости). Кровь пациентов с апластической анемией становится обедненной клетками крови, так как костный мозг замедляет их производство. Симптомы заболевания могут варьироваться в зависимости от того, какого типа клеток крови больше всего не хватает. Это может быть хроническая усталость, болезни сердца, бесконечные инфекций, понижение свертываемости крови.
Но есть надежда. Не смотря на то, что как два десятилетия назад, так и как в последнее время, болезнь часто оканчивается смертельным исходом, в настоящее время апластическая анемия становится гораздо более управляемым заболеванием. Достижения в области медикаментозной терапии и успехи в области трансплантации позволили сократить число летальных исходов, что позволяет пациентам жить полноценной жизнью гораздо дольше.
«Мы совершенствуем методы лечение апластической анемии — либо полностью вылечиваем заболевание, либо лечим ее симптомы», говорит д-р Ярослав П. Мациежевский (Dr. Jaroslaw P. Maciejewski, Cleveland Clinic’s Department of Hematologic Oncology and Blood Disorders). И эти успехи помогают врачам лучше понять другие, имеющие более широкое распространение заболевания, такие как болезни сердца и лейкемия.
По данным Национальных институтов здравоохранения ежегодно в США регистрируется 50 тысяч случаев апластической анемии и 20-30 тысяч случаев миелодиспластического синдрома (миелодиспластический синдром или МДС — это подобное апластической анемии заболевание крови, которое возникает тогда, когда костный мозг начинает производить плохо функционирующие или незрелые клетки крови).
Важно отметить, что многие симптомы апластической анемии, такие как усталость и инфекции, также могут быть вызваны другими заболеваниями, говорит д-р Роналд Пакетт (Dr. Ronald Paquette, a blood disease researcher with the University of California, Los Angeles’ Jonsson Comprehensive Cancer Center) специалист по заболеваниям крови в Калифорнийском университете.
Костный мозг — это губчатый материал внутри кости, который производит стволовые клетки, которые в свою очередь превращаются в три типа клеток крови — эритроциты, лейкоциты и тромбоциты. «По существу, костный мозг – это завод крови», — говорит Мациежевский. У больных с апластической анемией, стволовые клетки повреждаются, вследствие чего происходит замедление или остановка производства всех клеток крови.
Причина повреждения стволовых клеток остается неизвестной в более чем половине случаев заболеваний апластической анемией. Согласно научным исследованиям Национального института здоровья есть предположение, что стволовые клетки повреждаются, когда иммунная система человека атакует свои собственные клетки организма по ошибке.
Некоторые случаи апластической анемии были связаны с воздействием токсинов, таких как пестициды, мышьяк и бензол. Инфекционные заболевания также могут привести к нарушениям приводящим к апластической анемии. Это инфекционные заболевания как гепатит, вирус Эпштейна-Барра, цитомегаловирус, парвовирус B19, ВИЧ, а также аутоиммунные заболевания, такие как системная красная волчанка и ревматоидный артрит. Наконец, некоторые генетические нарушения могут привести к апластической анемии.
Симптомы апластической анемии зависят от типа клеток крови, которых больше всего не хватает в организме:
— Недостаток эритроцитов может привести к нехватке кислорода в организме. Люди, у которых низкий уровень эритроцитов нередко чувствуют себя усталыми. Из-за того, что сердце должно работать быстрее и напряженнее, чтобы снабдить органы и ткани кислородом, со временем могут развиться сердечно-сосудистые заболевания.
— Недостаток лейкоцитов может ослабить иммунитет человека. Человек может чаще болеть инфекционными заболеваниями, и обычные болезни могут проходить в тяжелой форме.
— Недостаток тромбоцитов, снижает способность крови свертываться. Пациенты с низким уровнем тромбоцитов могут иметь большое количество синяков и гематом. Возможны кровотечения, которые трудно остановить.
«После того, как человеку поставлен диагноз апластическая анемия необходимо сразу начать лечение», — говорит д-р Пакетт. «Очень важно, чтобы лечение было в специализированном центре, так как это очень редкое заболевание» — сказал он. «Самое главное заключается в том, чтобы вас наблюдал специалист с большим опытом лечения заболеваний на ранней стадии».
Для пациентов моложе 30 лет трансплантация стволовых клеток является предпочтительным методом лечения. Для тех, у кого есть родственный донор (подходящие брат или сестра), проводят трансплантацию стволовых клеток, здоровые стволовые клетки донора заменяет дефектные клетки костного мозга больного человека. По данным Международного фонда апластической анемии и МДС более 80% процентов пациентов полностью выздоравливают (Aplastic Anemia & MDS International Foundation Inc.)
По мнению д-ра Пакетта достижения в области исследования стволовых клеток и препаратов против отторжения донорских клеток привели к тому, что трансплантации от неродственных доноров также становятся все более успешными.
Одним из перспективных направлений лечения является трансплантация стволовых клеток пуповинной крови. «Стволовые клетки пуповинной крови новорожденных младенцев можно замораживать и сохранять в банке клеток, чтобы позже использовать как донорские клетки, как для новорожденного (в случае возникновения у него тяжелых заболеваний), так и для неродственной трансплантации», говорит д-р Пакетт. — «Это очень обнадеживает».
Для пациентов с апластической анемией важно начать лечение как можно скорее. «Как показывают исследования, чем раньше была сделана пересадка костного мозга с момента постановки диагноза, тем лучше результат» — считает Пакетт.
Больные, у которых нет донора, или те, для которых трансплантация невозможна по медицинским показаниям, часто получают иммуносупрессивную терапию такими препаратами как антитимоцитарный глобулин и циклоспорин. По данным Международного фонда апластической анемии и МДС положительная динамика в результате иммуносупрессивной терапии наблюдается в 70-80% случаев.
Переливание крови от подходящего донора также помогает поддержать показатели крови на высоком уровне. Это помогает облегчить симптомы заболевания, хотя этот метод не является эффективными при длительном лечении.
«Так или иначе, вылечиваем ли мы болезнь или нет, в любом случае состояние пациента можно улучшить «, говорит д-р Ярослав П. Мациежевский. — «Теперь мы можем сохранить жизнь людям с апластической анемией или продлить им жизнь на долгие годы».
источник
Впервые с положительным исходом она была проведена в Америке, в 1968 году. Со временем методы пересадки существенно модернизировались, расширяя круг болезней, которые отступали после ее применения.
В современных условиях, пересадка костного мозга уже каждый день позволяет достичь успеха в продлении жизни свыше 1000 людей. При таких заболеваниях, как лимфома, лейкемия, сложная форма анемии, злокачественные образования различного генеза, патологии аутоиммунного характера, указанная процедура является практически единственным спасением.
Чтобы понять колоссальную роль костного мозга в жизнедеятельности человека, обратимся к его «функциональным обязанностям». Ежедневно наш организм должен непрерывно вырабатывать приблизительно пятьсот миллиардов кровяных клеток, и этот процесс возложен на работу костного мозга. Таким образом, данный орган является ключевым компонентом в деятельности кроветворной системы, отвечающей за формирование новых иммунных клеток.
Костный мозг по своей структуре представляет собой «жидкое» вещество, расположенное в полости костей и содержащее в себе множество стволовых клеток, которые и являются объектом пересадки при рассматриваемой процедуре. Время трансплантации костного мозга занимает от одного до двух часов. Длительным процессом является период подготовки к операции и пост трансплантационный этап приживления костной ткани.
Пересадка костного мозга проводится при таких заболеваниях как:
- Онкология различного генеза (саркома, рак крови (лейкоз), спинного мозга и легких, миеломная болезнь, лимфомы, рак груди и мужских половых желез);
- Анемия апластическая (тяжелая болезнь, при которой нарушается функция кроветворной системы костного мозга и его способность к выработке клеток крови);
- Наследственные анемические патологии (анемия Кули или талассемия – снижение синтеза пептидов, являющихся элементами гемоглобина, серповидная анемия –врожденное нарушение структуры белка гемоглобина);
- Мукополисахаридоз I типа (МПС I)и мукополисахаридоз типа I-Н (синдром Гурлер) – генетическая патология, связанная с нарушением расщепления вредных ферментов и накопления их в организме;
- Аплазия лимфоцитарная, тяжелый комбинированный иммунодефицит, синдром Вискотта–Олдрича. Все эти болезни связанны с дисфункцией работы лимфоцитов в различной степени.
Кроме перечисленного, пересадка костного мозга показана для регенерации ткани хряща при заболеваниях суставов (артрозы, остеопорозы и др.). В отдельных случаях применяется хирургический метод, т.н. спондилодез, сращивающий позвонки посредством трансплантации костной ткани. Этот вид операции проводится на позвоночнике путем осуществления на коже небольшого надреза между позвонками скальпелем.
Процедура пересадки костного мозга предусматривает изъятие у донора гемопоэтических стволовых клеток и их пересадку в другой организм с последующей выработкой ими новых кровеносных клеток – тромбоцитов, эритроцитов и лейкоцитов.
Трансплантация костного мозга противопоказана беременным женщинам.
- Аутотрансплантация(аутологичная трансплантация). Данный метод предусматривает использование собственных стволовых клеток больного в том случае если костный мозг еще не был поврежден. Специалисты производят взятие кроветворных клеток, подвергают их заморозке, проводят курс химической терапии в больших дозах и после вводят размороженные клетки в пораженный участок. Подобный вариант процедуры применим при нейробластоме (опухоль симпатической нервной системы злокачественной этиологии) и лимфоме. При проведении такого варианта лечения необходим контроль над тем, чтобы число вводимых стволовых клеток было достаточным для приживления ткани, а раковые клетки не вызывали рецидива;
- Изотрансплантация (сингенная трансплантация).При такой процедуре осуществляется забор клеток у человека с аналогичным набором ген – однояйцевые близнецы, что полностью нейтрализует риск возникновения постпересадочных последствий, в виде иммунологических реакций;
- Аллотрансплантация (аллогенная трансплантация). В данном случае объектом пересадки становятся стволовые клетки донора. Чем опасна такая разновидность? В отличие от других двух процедур, данный способ более сопряжен с рисками различных постоперационных реакций, в числе которых, отторжение трансплантационной ткани либо РТПХ, когда пересаженные клетки начинают атаковать клетки организма получателя, иммунитет которого полностью подавлен в связи с отсутствием собственной кроветворной ткани. Такой вид операции применяется больным раком крови и апластической анемией.
Наряду с указанными процедурами пересадки, применяется также трансплантация сниженной интенсивности (не миелоаблативная аллогенная трансплантация), не требующая сложных подготовительных мероприятий. В этом случае клетки реципиента начинают замещаться пересаженными на протяжение многих месяцев, не вызывая радикальных реакций и процессов. Обычно, такая операция применяется в отношении старых людей, больных тяжелой формой других заболеваний, инфекционных больных со слабой иммунной системой. Период реабилитации длится недолго.
Однако, трансплантация может быть успешной и в случае если донор и пациент имеют частичную совместимость, при этом, их HLA-белки должны быть идентичны, хотя бы на пятьдесят процентов. Название процедуры – гаплоидентичная.
Важно: Чтобы быстро и правильно найти подходящего донора необходимо максимально расширить поиск кандидатов. Содействие в их подборе оказывают специализированные донорские программы. На сегодняшний день, в России такие программы отсутствуют, в связи, с чем пациенты пользуются иностранными проектами. Необходимо знать, что при выборе донора, существенное значение имеет расовый и этнический фактор реципиента и донора, так как гистосовместимость лиц с разных континентов очень редко совпадает.
Кто может стать донором, и какие требования предъявляются к ним:
- Совершеннолетние лица и люди не старше 55 лет;
- Лица, никогда не болевшие вирусной формой гепатита (В и С) и не являющиеся носителями вируса иммунодефицита;
- Психически здоровые;
- Не болеющие туберкулезом и не имеющие злокачественных образований.
На сегодняшний день, в мировой список доноров по пересадке костного мозга внесено свыше 25 миллионов человек. В разрезе страновой категории лидирующими реципиентами являются доноры из США и стран Европы (особенно Германия – семь миллионов человек), а также из Беларуси (двадцать восемь тысяч) и России (десять тысяч человек).
Откуда берутся клетки для пересадки? В современной медицинской практике, извлечение стволовых клеток осуществляется из трех источников: костный мозг, кровь или пуповинная кровь. Как происходит их получение, и каким способом берут костный мозг у доноров? После прохождения всех процедур на предмет совместимости стволовых клеток, донор начинает готовится к забору костного мозга для дальнейшей пересадки.
При пересадке стволовых клеток крови способ извлечения немного иной, чем в описанной выше процедуре. В течение 5 дней до начала запланированного изъятия клеток, донор начинает прием медикаментов, запускающих процесс их передвижения по сосудам, т.н. факторы роста. По прошествии окончания лекарственной терапии начинается процедура извлечения стволовых клеток из крови (аферез), которая в общей сложности занимает около 5-ти часов. Донор подключается к аппарату, который прогоняет кровь и делит ее компоненты крови, извлекая стволовые клетки.
За время прохождения процедуры отфильтровывается до пятнадцати литров крови, однако на выходе удается извлечь лишь двести миллиграммов, с концентратом стволовых клеток. После такого процесса организм донора начинает увеличивать объем выработки кроветворных клеток, в связи с чем не исключается вероятность болезненных ощущений в костях.
Подготовка больного к трансплантации костного мозга или СКК является жизненно важной частью всего процесса пересадки КМ. За десять дней до трансплантации пациент подвергается этапу кондиционирования (иммуносупрессивная терапия), который направлен на:
- Полную ликвидацию собственного костного мозга, который не способен выполнять кроветворные функции;
- Угнетение иммунитета организма посредством разрушения оставшихся белых кровяных телец в крови и печени.
Важно: иммуносупрессивная терапия – это необратимый процесс и поскольку пациент лишается собственных кроветворных тканей, при отказе донора от дальнейших процедур либо неудавшейся трансплантации, больной умирает.
Совет: Применение лучевой терапии в преддверие пересадки костного мозга нарушает работу щитовидной железы, в связи с чем больной в обязательном порядке должен начать прием тиреоидных гормонов.
После завершения этапа иммуносупрессивной терапии проходит операция по пересадке костного мозга, посредством внутривенного введения пациенту донорской костной ткани либо стволовых клеток крови, изъятых из обычной или пуповинной крови.
* Только при условии получения данных о заболевании пациента, представитель клиники сможет рассчитать точную цену на лечение.
Приживление костного мозга или стволовых клеток крови исчисляется неделями и годами, однако медики считают, что изначальный и самый важный этап «адаптации» новой ткани приходится на первые двадцать дней после пересадки. В это время ключевая задача врачей – не допустить, чтобы пациент «подцепил» какое-либо вирусное или инфекционное заболевание. Для этого:
- Назначается курс антибиотикотерапии, тромбоцитарной терапии и других препаратов, нейтрализующих атаку новых клеток на организм;
- Обеспечивается соблюдение всех правил гигиены при контакте с пациентом;
- Для определения степени приживления костной ткани производятся ежедневные исследования анализов крови;
- Вводится режим изоляции больного от контакта со всеми, кроме медицинского персонала, запрещается передача продуктов питания и личных вещей. Если пациенту необходимо выйти из палаты, обязательным условием является ношение защитного халата и обуви, перчаток и маски.
По статистике, почти 50% пациентов по трансплантации костного мозга являются дети, у которых диагностирован рак крови. У детей пересадка данного органа имеет аналогичные этапы лечения, что и у взрослых, однако в их случае, применяются более дорогие медикаменты.
Обратите внимание: в этот период существенно нарушается психическое состояние больного – постоянное присутствует чувство боязни и апатия, которые являются очень частыми явлениями при трансплантации донорских тканей. По отзывам отдельных пациентов, психоэмоциональное напряжение и депрессия отягчали их состояние больше, чем физические боли. По этой причине, весьма важно чтобы больной находился в благоприятном психологическом климате и не подвергался негативному воздействию.
После трансплантации костного мозга жизнь реципиента некоторое время должна быть подчинена определённому порядку, иначе последствия могут быть опасными, а осложнения непоправимыми. В первые полгода, пока организм восстанавливается, противопоказано заниматься как физическим, так и умственным трудом, посещать места большого скопления людей во избежание заражения какой-либо инфекцией.
В общей сложности в течение одного года после операции, пациент должен проходить постоянный контроль за своим состоянием у специалистов и вовремя сдавать необходимые анализы. Именно этот период очень важен с точки зрения приживления пересаженного органа, запуска процесса его полноценной работы с выработкой иммунных клеток и всех важных элементов кроветворной системы. Ключевая задача – восстановить все функции организма.
Прогноз выживаемости перенесших пересадку костного мозга пациентов во многом зависит от возраста, характера заболевания и его развития до пересадки, а также от гендерного фактора. 80% женщин возрастом до 30 лет, имеющих продолжительность болезни менее 2 лет до операции, в среднем от 6 до 8 лет. При заболеваниях онкологического характера, продолжительность жизни связанна с фактором рецидива – если в течение пяти 5 лет не наблюдалось повторного образования, то риски существенно снижаются.
Многие задаются вопросом, сколько стоит пересадка такого важного орган? Процедура трансплантации костного мозга является достаточно затратной.
В России диапазон цен разнится в зависимости от городов – в г. Москва от одного миллиона рублей, в г. Санкт-Петербург (СПБ) от двух миллионов и выше.
В других странах СНГ (Минске, Киеве) и в западных клиниках стоимость такой операции составляет сто и более тысяч евро. Наиболее успешно делают пересадку КМ в Беларуси и странах Европы (преимущественно в Германии).
На бесплатной основе в Российской Федерации трансплантация костного мозга проводится по ограниченной квоте, поскольку на эти цели из государственного бюджета выделяется слишком мало средств и очень сложно подобрать донора из России ввиду отсутствия российского списка доноров. Эту ситуацию пытаются исправить и ежегодно проводят акции по пополнению базы доноров. В 2016 году в результате проведения ряда мероприятий в Новосибирске количество доноров по пересадке костного мозга увеличилось на 600 человек.
источник