Апластическая анемия – это патология костного мозга, при которой он не в состоянии вырабатывать клетки крови. При этом опухолевые поражения самого мозга не развиваются. Апластическую анемию также называют гипопластической. Эти два термина являются синонимами, хотя в последнем случае работа костного мозга угнетена не слишком сильно.
При апластической анемии наблюдается резкое падение уровня всех клеток крови: лейкоцитов, эритроцитов и тромбоцитов. Ведь самый главный орган просто перестает их вырабатывать. Такое состояние является очень опасным не только для здоровья, но и для жизни больного.
Апластическую анемия очень сложно лечить, она протекает тяжело, риск летального исхода в первые несколько недель от начала заболевания крайне высок. Самой опасной формой считается идиопатическая апластическая анемия, которая имеет острое течение и является жизнеугрожающим состоянием. К счастью, заболевание встречается нечасто, в среднем, его регистрируют у 2 человек из одного миллиона людей.
Апластическая анемия – это расстройство гемопоэза, которое сопровождается анемическим и геморрагическим синдромом, а также различными инфекциями, которые выступают в качестве осложнения. Пациент, задающийся вопросом, апластическая анемия – что это такое, должен четко понимать лишь одно: данный вид анемии является крайне тяжелым нарушением, которое требует безотлагательной медицинской помощи.
Если апластическая анемия развивается в течение жизни, то это заболевание является приобретенным. Зачастую установить его причину не удается. В этом случае говорят об идиопатической анемии. Кроме того, апластическая анемия может быть врожденной и наследственной.
Между апластической и гипопластической анемией имеются ряд различий, но они не слишком существенные. Поэтому если врач видит в карте пациента диагноз «гипопластическая анемия», он рассматривает его как «апластическая анемия».
Тем не менее, следует внести некоторые уточнения:
Апластическая анемия развивается в результате нарушений в строении стволовых клеток, а гипопластическая анемия манифестирует на фоне аутоиммунных патологий.
При апластической анемии костный мозг поражается очень сильно, в результате чего он не в состоянии продуцировать никакие клетки. Гипопластическая анемия характеризуется не столь интенсивным угнетением функции кроветворения.
Различается механизм развития апластической и гипопластической анемии.
Если лечение будет подобранно верно, то гипопластическую анемию можно ввести в стадию ремиссии, которая продлится довольно долго. В то время как апластическая анемия очень сложно поддается лечению.
Прогноз на выживаемость более благоприятный именно при гипопластической анемии.
Некоторое время назад гипопластическую и апластическую анемию считали одним и тем же патологическим процессом, просто характеризовали они разные стадии его развития. Хотя до настоящего времени в ученых кругах по этому поводу имеются разногласия. В любом случае, в статье оба этих термина будут характеризовать одно и то же нарушение.
Терапия апластической анемии — это сложная задача, разрешить которую даже самым лучшим врачам не всегда под силу. О возможных направлениях в лечении будет сказано далее.
Апластическая анемия, как заболевание, было открыто еще в 19 веке. Однако тенденция его развития абсолютно не радует. С каждым годом заболевших становится все больше. Радует лишь то, что апластическая анемия – это не всегда смертельный приговор. Развитие современной трансплантологии позволяет пересаживать костный мозг человеку и спасать ему жизнь. Также определенный вклад в лечение данного нарушения вносит схема лечения иммуносупрессорами.
Современная медицина выделяет 2 вида апластической анемии (приобретенную и врожденную/наследственную), которые, в свою очередь, разделяются на несколько подвидов. Каждый из них необходимо рассматривать отдельно.
Подвиды апластической анемии приобретенной формы:
Истинная анемия, которая в половине случаев является идиопатической, то есть причины ее возникновения установить невозможно. При истинной анемии происходит угнетение всех направлений системы кроветворения.
Варианты развития заболевания могут быть следующими:
Острая анемия продолжается не более 60 дней и всегда заканчивается летальным исходом.
Подострая форма болезни может длиться от 60 дней и более. Если речь идет об апластической анемии, то состояние больного может стабилизироваться, но на непродолжительный отрезок времени. При гипопластической анемии ремиссии могут быть более длительными, но они все равно будут сменяться острыми фазами.
Хроническая форма болезни. Течение анемии сглажено, летальный исход наступает спустя 3-5 лет от манифестации болезни, в редких случаях пациенты живут до 10 лет. Еще реже у больных наступает выздоровление.
Парциальная красноклеточная аплазия костного мозга (ПККА) – это приобретенная апластическая анемия, которая имеет аутоиммунную природу. Костный мозг не в состоянии выполнять свои привычные функции, так как на антигены его эритрокарцитов воздействуют аутоантитела, разрушая их. Чаще всего причину парциальной аплазии уточнить не удается. Хотя в ряде случаев заболевание может развиваться на фоне опухолевых новообразований вилочковой железы. В подростковом возрасте парциальная красноклеточная аплазия может заканчиваться выздоровлением больного. Поэтому специалисты выделяют эту патологию в отдельную форму, называя ее подростковой ПККА.
Гипопластическая анемия с гемолитическим компонентом. Многие ученые утверждают, что это разновидность заболевания является лишь стадией пароксизмальной ночной гемоглобинурии. Отличительной чертой этой разновидности болезни является то, что она периодически сопровождается гемолитическими кризами.
Кроме приобретенной апластической анемии, различают врожденную и наследственную форму болезниг.
Они, в свою очередь, подразделяются на следующие виды:
Анемия Фанкони, которая передается по аутосомно-рецессивному типу. Проявляется у носителей гомозигот в период от 4 до 10 лет. Анемия Фанкони может сопровождаться грубыми изменениями в развитии внутренних органов, а может протекать с незначительными их повреждениями.
Анемия Джозефа-Даймонда-Блекфена. По какому типу наследуется эта патология до настоящего момента времени учеными не установлено. Имеются предположения, что передача дефективных генов происходит по аутосомно-доминантному типу, хотя другие ученые настаивают на аутосомно-рецессивном способе передачи. Единой точки зрения по этому вопросу нет. Патология манифестирует практически сразу после появления ребенка на свет. Как правило, к 4 месяцем у 2/3 детей уже имеются первые ее признаки. Если их нет, то они обязательно появятся к тому времени, когда ребенку исполнится год. Этот вид анемии может сопровождаться тяжелыми повреждениями внутренних органов, либо протекать без подобных изменений.
Гипопластическая анемия Эстрена-Дамешека. В этом случае у больного ребенка будут наблюдаться нарушения функции кроветворения, но аномалии развития не обнаруживаются.
Если гипопластическая анемия развивается на фоне врожденных аномалий развития, то заболевание манифестирует в раннем возрасте. При приобретенной форме болезни человек рождается абсолютно здоровым.
Апластическая анемия будет являться приобретенной в том случае, когда человек рождается абсолютно здоровым, но болезнь у него все-таки манифестирует. При этом аналогичные нарушения не прослеживаются в анамнезе кровных родственников.
Виды приобретенной апластической анемии:
Идиопатическая болезнь, причины которой установить не удается. Как показывает анализ статистических данных, такой вид анемии диагностируются в 50-80% случаев.
Вирусная анемия, к которой может приводить вирус Эпштейн-Барра, вирусы гепатита и парвовирус В19.
Аутоиммунная апластическая анемия развивается в том случае, когда клетки костного мозга атакуют собственные антитела организма.
Транзиторная апластическая анемия встречается преимущественно в детском возрасте. Среди иных аплазий костного мозга, которые поражают детей, именно эта разновидность анемии является самой распространенной. Чаще всего спустя 30-60 дней от старта патологии, наступает полное выздоровление, но лишь при условии оказания качественной и своевременной терапии.
Различают 3 степени тяжести приобретенной апластической анемии:
Сверхтяжелая анемия имеет острое течение. Выздоровление невозможно.
Тяжелая форма апластической анемии.
Легкое течение болезни характеризуется удовлетворительным самочувствием человека.
Причины, которые приводят к развитию приобретенной апластической анемии, могут быть разнообразными. Они будут рассмотрены ниже.
К экзогенным факторам, которые способны спровоцировать развитие заболевания, относят:
Перенесенные человеком инфекции. Причем речь не идет о какой-либо конкретной болезни. Опасность представляют все инфекции, которые перенес человек, начиная с раннего детства. Сюда относятся: ветрянка, корь, краснуха, туберкулез, грипп, паротит, гепатит, герпес, парвовирус В19, цитомегаловирус, вирус Эпштейн-Барра и многие другие. Каждое заболевание может спровоцировать развитие апластической анемии.
Постановка профилактических прививок.
Воздействие на организм отравляющих веществ и аллергенов, которые попали в него из внешней среды.
Препараты, которые человек принимает на постоянной основе, либо время от времени. Сюда относят: антибиотики, лекарственные средства на основе золота, препараты, содержащие ацетилсалициловую кислоту, лекарственные средства для лечения туберкулеза, анальгетики, цитостатики и пр.
Воздействие на организм токсических химических веществ. Причем оказано патологическое влияние может быть в повседневной жизни. Опасность представляют такие вещества, как: бензин, бензол, пестициды, пары ртути, свинец, углеводороды и пр.
Облучение ионизирующей радиацией может спровоцировать угнетение костного мозга.
Трудовая деятельность в условиях повышенной вибрации, при искусственном освещении, в условиях воздействия высоких частот.
Полученные травмы. Особую опасность представляют черепно-мозговые травмы.
Частые стрессы и хроническое нервное перенапряжение.
Также спровоцировать развитие апластической анемии могут эндогенные факторы, среди которых:
Заболевания щитовидной железы, яичников и тимуса.
Системные заболевания соединительной ткани: системная красная волчанка, синдром Шегрена, ревматоидный артрит.
Период вынашивания ребенка. Чаще всего симптомы заболевания будут купированы после его рождения.
Есть данные, что к развитию апластической анемии могут приводить паразитарные инвазии и микотические инфекции.
При апластической анемии повреждаются стволовые клетки, нарушаются ростовые факторы, страдает строма клеток костного мозга, что приводит к тому, что его корректная работа становится невозможной.
Нарушения в работе костного мозга не могут протекать бессимптомно. В анализе крови появятся характерные изменения, а именно, все форменные элементы крови будут иметь запредельно низкий уровень. Безусловно, что качество жизни больного значительно ухудшится.
Иногда случается резкое начало анемии, когда на фоне общего здоровья, человек резко начинает себя плохо чувствовать. При этом развивается патология очень быстро, а лечение оказывается малоэффективным. Подобная клиническая картина наблюдается редко. Чаще всего анемия прогрессирует постепенно, поэтому человек долгое время может даже не подозревать о своем страшном диагнозе. Организм играет «злую шутку», включая адаптационные механизмы, тем самым перекрывая симптомы имеющегося нарушения. Это не позволяет начать своевременное лечение. Однако рано или поздно, признаки имеющегося нарушения все-таки себя проявляют, что заставляет человека обращаться за врачебной помощью. Поражение костного мозга приводит к тому, что у больного развиваются следующие патологические синдромы: анемический и геморрагический. Кроме того, повышается вероятность возникновения инфекционных осложнений.
К основным симптомам апластической анемии относят:
Если кроме нарушения формирования красных кровяных телец в костном мозге в недостаточной мере вырабатываются тромбоциты, то это будет сопровождаться кровотечениями. Ткани страдают от кислородного голодания, кожные покровы приобретают неестественную бледность. Человек часто испытывает головные боли, у него возникают приступы головокружения. При незначительном физическом усилии появляется одышка, которая в дальнейшем начнет развиваться даже в состоянии покоя. Ротовая полость подвергается атакам различных инфекционных агентов. В целом, человек испытывает постоянное недомогание и очень быстро устает.
Снижение уровня тромбоцитов влечет за собой появление подкожных кровоизлияний, десна начинают кровоточить. Время от времени возникают носовые кровотечения, у женщин усиливаются маточные кровотечения.
Уменьшение числа лейкоцитов ведет к падению иммунных сил организма. Ему будет все сложнее бороться с инфекциями, человек начинает часто и долго болеть. У него возникают отиты, воспаление легких, подкожные кровоизлияния могут осложняться гнойными инфекциями, нельзя даже исключать сепсис. Все заболевания сопровождаются значительным повышением температуры тела.
В сердце появляются шумы, которые врач может прослушать во время аускультации.
Эритроциты в крови подвергаются массивному разрушению, что влечет за собой выделение в окружающую среду гемоглобина. В результате процесса гемолиза кожные покровы человека начинают отдавать желтизной. Гемолиз является признаком того, что имеется не только снижение уровня эритроцитов в крови, но и их качественные повреждения.
По мере прогрессирования заболевания, в размерах начинает увеличиваться печень и селезенка.
Острая анемия чаще всего развивается именно при приобретенной форме болезни. Сверхтяжелая степень заболевания очень быстро прогрессирует, лечить ее сложно. Буквально за несколько недель человека может не стать. Установлено, что лечение Левомицетином в 10 раз повышает вероятность развития сверхтяжелой апластической анемии.
Хроническое течение патологического процесса чаще всего наблюдается при врожденной и наследственной анемии. Периоды затишья сменяются периодами обострения. При такой клинической картине сохраняются шансы на полноценное выздоровление.
Если человеку выставлен диагноз апластическая анемия, то лечение должно быть начато незамедлительно. Обязательно нужно устранить все факторы воздействия на организм, которые могли бы привести к развитию данной патологии. Если этого не сделать, то болезнь обязательно рецидивирует, что приведет к ухудшению самочувствия, либо летальному исходу.
Ранее апластическую анемию лечили андрогенами и кортикостероидными гормональными препаратами. Современная медицина отказывается от подобной терапии, либо дополняют прием Оксиметалона и Преднизолона иммуносупрессорами (Циклоспорин-А и АЛГ).
Также ранее практиковали удаление селезенки, что позволяло несколько отрегулировать кроветворную функцию костного мозга. Хотя современные взгляды на проблему лечения апластической анемии не отрицают положительного эффекта от проведенной операции, тем не менее, этот метод рассматривается лишь в качестве вспомогательного. Назначают операцию только пациентам с тяжелой анемией, которая не поддается консервативному лечению, либо требует регулярного переливания тромботической массы.
Лечение препаратами гемопоэтинами также не позволила добиться значительных успехов. Использование колониестимулирующих факторов и интерлейкинов позволяет на время повысить уровень лейкоцитов, но на течение болезни значительного влияния не оказывает.
Единственным действенным методом лечения тяжелой анемии является пересадка костного мозга. Однако это сложная операция, подбор донора — это серьезное препятствие для ее реализации. Более того, процедура сопряжена с различными иммунологическими осложнениями. Высокой остается вероятность отторжения чужеродного органа кроветворения.
Начинается диагностика пациента с тщательного опроса его жалоб и со сбора анамнеза. Обязательно нужно уточнить, имелась ли апластическая анемия у близких кровных родственников человека, пришедшего на прием.
Обнаружить снижение форменных элементов крови можно при проведении общего анализа крови.
Чтобы подтвердить или опровергнуть диагноз, врач назначит пациенту следующий комплекс обследований:
Повторная сдача крови на определение уровня в ней ретикулоцитов и тромбоцитов.
Проведение биохимического анализа крови.
Забор пункции костного мозга, что позволяет с высокой степенью вероятность обнаружить апластическую анемию.
Выполнение трепанобиопсии. В этом случае может быть обнаружено жировое перерождение клеток, отвечающих за образование кровяных телец с формированием воспалительных инфильтратов. Как вариант, могут быть визуализированы мелкие очаги, которые подавляют выработку эритроцитов.
В качестве вспомогательных методов исследования применяют следующие процедуры:
Цитогенетическое исследование костного мозга и периферических лимфоцитов. Это позволит обнаружить хромосомные аберрации.
УЗИ внутренних органов: печени и селезенки. У детей дополнительно проверяют вилочковую железу. Также исследуют лимфатические узлы.
Выполнение анализов направленных на обнаружение вирусных инфекций, например, ВИЧ, ВПГ, цитомегаловирус и пр.
Оценка иммунитета (гуморального и клеточного).
При планировании трансплантации костного мозга выполняют типирование антигенов HLA II класса.
Если необходимо выполнение инвазивных методов обследования в отношении ребенка, то доктор должен получить письменное согласие его родителей на проведение подобной процедуры. Эта же мера справедлива в отношении оперативного вмешательства.
Следует проводить дифференциальную диагностику апластической анемии с иными состояниями. Так, аналогичными симптомами проявляется метапластическая анемия, которая характеризуется разрастанием в костной ткани патологических клеток. Этот вид анемии наблюдается на фоне острого лейкоза, миеломы, миелофиброза, при проникновении в ткани костного мозга метастаз иных опухолей.
Видео лекция: Масчан А.А. — оптимизация лечения приобретенной апластической анемии у детей и подростков:
Летальный исход при апластической анемии развивается на фоне различных инфекций, либо по причине кровотечения, которое невозможно остановить. Делает прогноз менее благоприятным прохождение лечения Левомицетином, либо перенесенный ранее инфекционный гепатит.
Однако считать апластическую анемию смертельным приговором тоже не верно. Современная медицина дает возможность людям не только продлить жизнь, но и полностью излечиться.
Использование иммуносупрессоров позволяет увеличить продолжительность жизни больных с апластической анемией на 10 и более лет. Если пациент дождался пересадки костного мозга, то это делает прогноз еще более благоприятным.
В целом, многое зависит от конкретного вида болезни. Идиопатическая анемия, которая не имеет тяжелого течения, позволяет больным прожить долго, а иногда люди от нее полностью избавляются. В любом случае, подход к каждому пациенту, так же как и составление прогноза – дело сугубо индивидуальное.
Автор статьи: Шутов Максим Евгеньевич | Врач-гематолог
Образование: В 2013 году закончен Курский государственный медицинский университет и получен диплом «Лечебное дело». Спустя 2 года окончена ординатура по специальности «Онкология». В 2016 году пройдена аспирантура в Национальном медико-хирургическом центре имени Н. И. Пирогова.
10 продуктов, которые заменяют мясо
Вот к чему приводит курение при беременности
источник

Болезнь достаточно редкая. Сложность лечения связана с тем, что самым простым разделом кроме лекарственной является заместительная трансфузионная терапия эритроцитарной и/или тромбоцитарной массы. Для сложных случаев остается только пересадка костного мозга – дорогая, с целым рядом осложнений операция.
По статистике в зоне риска апластической анемии молодые люди до 20 лет (преобладает вирусная природа патологии), а также люди старше 65-ти лет (накопленные возрастные сбои биохимических процессов как причина).
Статистику можно посмотреть в видео в конце статьи.
В зависимости от степени выраженности угнетения кроветворения различают две формы:
- гипопластическая анемия (при этой форме функция кроветворения сохранена, но значительно снижена),
- апластическая анемия (полное угнетение кроветворения).
По сути они являются одним и тем же заболеванием разной степени выраженности. Нарушается продукция эритроцитов, тромбоцитов и лейкоцитов.
Клинические проявления могут быть разнообразными и на первых этапах напоминать общее недомогание за счет снижения эритроцитов – возникают слабость, головокружения, могут появиться обмороки.
За счет нехватки тромбоцитов развиваются кровотечения, кожные геморрагические высыпания.
Выделить единственную причину невозможно, так как вызвать апластическую анемию могут различные факторы. Они разительно отличаются друг от друга, но могут приводить к одинаково тяжелым последствиям.
Клиническая картина этих вариантов отличается. Во-первых, врожденные формы часто проявляются на ранних сроках жизни. Во-вторых, они могут сочетаться с аномалиями развития различных органов.
При манифестации во взрослом возрасте первыми симптомами могут быть общее недомогание и головокружение, которые являются неспецифичным и возникают при многих заболеваниях. Скорость прогрессирования апластической анемии зависит от выраженности нарушения кроветворной функции.
Врожденные формы включают в себя следующие варианты:
- Синдром Даймонда-Блекфена. При данной патологии происходит нарушение на уровне клеток-предшественников эритроцитов. Фенотипическим симптомом является бледная кожа. Увеличение печени и селезенки не характерно, но может развиваться с течением времени.
- Анемия Фанкони. Наследственное заболевание, которое проявляется на пятом десятке жизни. Возникает острый лейкоз и апластическая анемия. Для данной генной мутации характерны аномалии развития, которые проявляются уже на ранних сроках жизни. В основном это аномалии костной системы (низкий рост, маленький череп, недоразвитие первого пальца верхних конечностей, лучевой кости, тяжелая дисплазия бедра, дополнительное ребро) и неврологический дефицит (аномалии глазных яблок, косоглазие, птоз, нарушение слуха, умственные нарушения развития).
- Синдром Эстрена-Дамешека. Помимо нарушения кроветворения для данных детей характерна определенная внешность – светлые волосы, широко расставленные глаза, курносый нос. Апластическую анемию в этом варианте сопровождает увеличение печени и селезенки.
Приобретенные формы различают по факторам, которые вызывают апластическую анемию.
- Внешние (экзогенные) факторы:
- Медикаментозное влияние – прием сульфаниламидов, антибактериальных средств (тетрациклин, левомицитин, стрептомицин), средств для лечения туберкулеза (изониазид, ПАСК), анальгина, цитостатиков.
- Воздействие химических агентов – наиболее опасны нефтепродукты, бензольные производные, ртуть.
- Радиоактивное воздействие.
- Инфекции. Наиболее опасными являются вирус, вызывающий гепатит С, цитомегаловирус, герпес-вирус. Чаще всего они оказывают выраженное повреждающее действие лишь при активно перенесенном заболевании.
- Внутренние (эндогенные) факторы:
- Аутоиммунное поражение костного мозга. Чаще наблюдается в пожилом возрасте.
- Эндокринное влияние. Выявлена связь с нарушением функции щитовидной железы, и с заболеваниями яичников у женщин.
В настоящее время существует три теории, объясняющих механизм развития апластической анемии. Каждая из них получила подтверждение в ходе исследований.
Поэтому официально теории приняты, но изучение механизмов возникновения апластической анемии продолжается.
Теории патогенеза (возникновения) апластической анемии:
- аутоиммунная;
- стромальная;
- преждевременный апоптоз.
Возникла она в результате исследования материала биоптата костного мозга после развития апластической анемии.
В большом количестве случаев ученые увидели присутствие клеточного иммунитета (моноциты, Т-киллеры), а также факторов воспаления – фактор некроза опухолей, интенферон альфа и гамма.
После более детального изучения стало понятно, что скапливаются они из-за генной мутации. В результате нарушения работы гена PIG-A возникает дефицит специального гликопротеина, который необходим для того, чтобы снижать активность системы комплемента, входящей в состав иммунной системы.
В результате этой поломки защита собственных клеток костного мозга слабеет, они начинают восприниматься, как чужеродные и развивается аутоиммунная реакция. В зависимости от количества поврежденных клеток степень выраженности симптомов разнится.

Строма отвечает за выработку специальных веществ (интерлейкины и факторы стволовых клеток), которые необходимы для направления недифференцированных молодых клеток по пути образования эритроцитов, тромбоцитов или лейкоцитов.
Стимулируется эта выработка эритропоэтином.
В случае нарушения выделения факторов роста на уровне стромы возникают низкодифференцированные клетки, которые не могут выполнять свои функции. Они не достигают дифференцировки, достаточной для определения в крови при анализе.
Термином апоптоз в медицине обозначают естественный процесс гибели клетки, когда она в полном объеме выполнила свою функцию. Происходит это во всех тканях организма. После определенного времени клетки подвергаются мутации, начинают восприниматься организмом, как старые, и удаляются.
В норме процесс представляет собой защитный механизм, который способствует обновлению тканей. Мутировавшие клетки могут переродиться в опухолевый процесс, и функция апоптоза – не допустить этого. Однако, если этот процесс начинает происходить раньше времени, возможно чрезмерное удаление клеток ткани. При недостаточном синтезе новых клеток этот процесс приводит к нарушению функции.
Изучение механизмов развития апластической анемии до сих пор является зоной научных интересов исследователей всего мира. Однако это может внести вклад в лечение заболевания в будущем, но никак не сказывается на современных пациентах.
Дело в том, что на сегодняшний момент самым эффективным методом лечения апластической анемии остается пересадка костного мозга. Для замедления процесса используют стероидные гормоны.
Учитывая угнетение выработки кровяных телец, выделяют следующие синдромы апластической анемии:
- Анемический (возникает за счет недостаточности эритроцитов и, соответственно, гемоглобина);
- Геморрагический (возникает в результате нехватки тромбоцитов, которые в норме останавливают кровотечение, образовывая тромботические массы);
- Токсико-инфекционный (недостаточность лейкоцитов – клеток иммунитета, в результате чего даже незначительная инфекция может развиться до гнойного процесса).
Клиническая картина каждого синдрома отличается. Может наблюдаться как сочетание всех синдромов, так и превалирование одного.
- При анемическом синдроме преобладают:
- повышенная утомляемость;
- головокружение;
- тошнота;
- одышка даже при минимальной нагрузке;
- тахикардия;
- потемнение в глазах.
- При геморрагическом:
- Множественные, легко образующиеся синяки;
- Излишне замедленная остановка любого кровотечения;
- Возникновение носовых кровотечений;
- Обильные месячные;
- Кровоточивость из десен;
- Возникновение специфических высыпаний – тромбоцитопеническая пурпура (является по факту пропитыванием кожи кровью).
- При токсико-инфекционном:
- Тяжелое течение легких инфекционных заболеваний;
- Медленное заживление ран, часто с нагноением.
Эти признаки более характеры для развития апластической анемии во взрослом возрасте. Эти пациенты могут анализировать свое состояние и предъявлять жалобы на приеме у врача.
Апластическая анемия у детей имеет свои особенности. При возникновении заболевания в совсем раннем возрасте они не могут объяснить свои ощущения, но существуют так называемые стигмы (или особенности), которые позволяют заподозрить различные наследственные формы анемии и провести генетическое тестирование.
Обычно у детей при наличии апластической анемии отмечаются следующие особенности:
- маленькая голова,
- укорочение первого пальца верхних конечностей,
- дисплазия тазобедренного сустава при синдроме Фанконе,
- специфический фенотип (светлые волосы, курносый нос, широко поставленные глаза при синдроме Эстрена-Дамешека),
- гепато- и спленомегалия.
Сбор жалоб и осмотр пациента является первым звеном в постановке диагноза и дает врачу первоначальный вектор для дальнейшего 
Самым важным этапом является инструментальная и лабораторная диагностика, которая включает в себя:
- Стернальную пункцию костного мозга;
- Трепанобиопсию;
- биохимический анализ крови;
- общий анализ крови.
С помощью трепанобиопсии производят забор костного мозга из крыла подвздошной кости. Данный метод помогает помимо анализа клеток (цитологического) провести гистологический анализ. Это помогает получить информацию о строме, ее представленности, а также соотношении желтого (неактивного) и красного костного мозга.
Биохимический анализ позволяет получить информацию о:
- содержании сывороточного железа (необходимо для подтверждения анемии),
- эритропоэтина (повышается при недостаточной выработке факторов роста стромой), – антителах к вирусам (которые могут быть причиной заболевания),
- С-реактивного белка (высокоспецифичный показатель воспалительного процесса).
Общий анализ крови показывает количественное содержание клеток крови (эритроциты, тромбоциты, лейкоциты), а также оценивает качественные характеристики клеток.

Для симптоматического лечения синдромов могу применяться антибиотики, препараты для коррекции артериального давления, ферментные препараты.
Иммуносупрессивную терапию в качестве единственного лечения применяют лишь в начале апластической анемии. Далее стараются комбинировать с цитостатиками и препаратами для симптоматического лечения в зависимости от преобладания синдромов.
К сожалению, она не всегда проходит гладко. Выделяют несколько наиболее частых осложнений процедуры.
К основным осложнениям относят следующие:
- инфекционные осложнения. Как и при любом оперативном вмешательстве существует риск нагноения места пункции. У пациентов с апластической анемией снижен иммунитет, поэтому даже при должном соблюдении правил асептики и антисептики не исключено появление данного осложнения.
- Отторжение трансплантата. Любой пересаженный орган воспринимается иммунными клетками организма, как чужеродный. Возникает иммунная реакция с попыткой уничтожить инородную ткань.
- Реакция трансплантата против организма пациента. При пересадке стволовых клеток возникает образование клеточного иммунитета донора. Новые клетки начинают агрессивно себя вести по отношению к лимфоцитам пациента. Этот процесс приводит к образованию высыпаний, нарушениями работы сердечно-сосудистой системы и желудочно-кишечного тракта.
- отказ работы жизненно важных органов. Возникает из-за массивного стресса, оказываемого на организм процессом пересадки костного мозга, а также приемом большого количества препаратов.
Несмотря на возможность тяжелых осложнений, трансплантация костного мозга остается самым эффективным методом лечением апластической анемии.
Врожденные формы часто сложнее поддаются лечению, так как костный мозг первоначально генетически не полноценен. Так, при анемии Фалкони, медикаментозное лечение протекает крайне сложно, а пересадка костного мозга может иметь противопоказания из-за аномалий развития.
Кроме того, выраженность симптомов может варьировать в зависимости от выраженности повреждения костного мозга. При медленно текущем процессе с минимальными повреждениями, даже медикаментозное лечение протекает легче и приносит существенное облегчение.
источник
Диагноз выставляется исходя из клинической картины, анализов крови и пункции костного мозга. Лечение в большинстве случаев предполагает пересадку здоровых стволовых клеток. Эффективность лечения зависит от множества факторов, основными из которых являются антигенная совместимость стволовых клеток донора и реципиента, внутренние резервы организма реципиента, качество посттрансплантационного ведения больного и др. Прогноз заболевания скорее отрицательный ввиду сложности нахождения подходящего донора костного мозга, высокого числа осложнений со стороны иммунной системы больного, высокой частоты развития инфекционных осложнений и острой полиорганной недостаточности.
Интересные факты
- В теле взрослого человека содержится в среднем 25 – 30 х 10 12 эритроцитов, что приблизительно равно 2 кг.
- Костный мозг производит в среднем 10 миллиардов эритроцитов в час.
- Благодаря особой форме и структуре эритроцит проходит через сосуды шириной 0,5 – 0,7 мкм.
- Впервые идея о пересадке костного мозга возникла в конце 19 века и успешно осуществилась в 1968 г. в США.
Эритроциты, или красные кровяные тельца, являются наиболее многочисленными клетками крови. Они представляют собой безъядерные клетки в форме двояковогнутого диска. При рассмотрении под микроскопом они выглядят как круги с просветлением посередине. Существуют определенные показатели нормального состояния эритроцита. В первую очередь, форма эритроцита, упомянутая выше. Измененная форма эритроцита часто указывает на определенные виды наследственных анемий. Наличие в крови измененных красных кровяных клеток различной формы называется пойкилоцитозом.
Диаметр эритроцита находится в пределах 7,2 – 7,5 мкм. Увеличение или уменьшение диаметра может свидетельствовать в пользу определенных видов анемий. Присутствие в периферической крови эритроцитов с различным диаметром именуется анизоцитозом.
Средний объем эритроцита равняется 90 мкм 3 . Длительность жизни эритроцита составляет 90 – 120 дней. Физиологическая норма количества эритроцитов и концентрации гемоглобина зависит от пола. У мужчин – 3,9 – 5,2 х 10 12 \л; у женщин – 3,7 – 4,9 х 10 12 \л. Уровень гемоглобина у мужчин колеблется в пределах 130 – 160 г\л, у женщин – 120 – 150 г\л.
Особенности структуры эритроцита
Внутри эритроцита, а точнее, в ячейках цитоскелета (комплекс белков, обеспечивающих поддержание формы клетки) содержится вещество под названием гемоглобин. Подсчитано, что в одном эритроците может находиться от 280 до 400 миллионов молекул данного вещества. Гемоглобин представляет собой белковый комплекс, состоящий из белка глобина и гемма (сложная молекула, в центре которой располагается железо). Основной функцией гемоглобина является перенос молекул кислорода к тканям и удаление из них углекислого газа. Существует несколько разновидностей гемоглобина (Hb). Гемоглобин А (HbA) является наиболее численной фракцией (95 – 98%) и представляет собой обычный гемоглобин, находящийся в кровеносной системе взрослого человека. Гемоглобин А2 (HbA2) является структурной модификацией стандартного гемоглобина и отличается некоторыми особенностями, проявляющимися в неблагоприятных условиях среды. Его количество равно 2 – 3% от общего пула эритроцитов. Гемоглобин F (HbF) – фетальная фракция, у взрослых практически отсутствует (1 – 2%), однако превалирует у новорожденных детей (70 – 90%). К концу первого года жизни эритроциты, содержащие фетальный гемоглобин, разрушаются, а их место занимают эритроциты, заполненные взрослым HbA.
Мембрана эритроцита состоит из двойного слоя липидов, пронизанных белками, выполняющими функцию транспорта ионов и поддержания оптимального электролитного равновесия. На поверхности клеточной мембраны располагается особый слой гликопротеидов, называющийся гликокаликс. Различные молекулы, входящие в его состав, играют роль рецепторов и антигенов гистосовместимости, отличающих эритроцит от других клеток организма. По приблизительным подсчетам на поверхности красных кровяных телец находится как минимум 250 видов различных антигенов, наиболее изученными из которых являются антигены системы АВ0 и резус-фактора. Согласно системе АВ0 эритроциты разделяются на 4 группы, а по резус-фактору различают две группы. Данные группы исключительно важны при переливании крови или эритроцитарной массы от доноров к реципиентам.
По системе АВ0 различают 4 группы крови:
- отсутствие агглютиногенов на поверхности эритроцитов;
- присутствие агглютиногенов А;
- присутствие агглютиногенов В;
- присутствие агглютиногенов А и В.
По резус-фактору различают 2 группы крови:
- резус-положительная (у 85% населения);
- резус-отрицательная (у 15 % населения).
Однако даже при переливании крови пациентам с одинаковой группой крови по обеим группам антигенов случаются анафилактические реакции. Данный феномен объясняется несовместимостью крови донора и реципиента по остальным типам антигенов. Учитывая различные комбинации между ними, вероятность переливания абсолютно идентичной группы крови ничтожно мала. Практически со стопроцентной вероятностью можно утверждать, что, сколько на планете людей, столько и групп крови.
Гликокаликс на поверхности мембраны здорового эритроцита имеет еще одну важную особенность – отрицательный заряд. Благодаря тому, что поверхность всех эритроцитов носит одинаковый заряд, согласно законам физики происходит их взаимное отталкивание. Более того, эндотелиоциты (клетки, выстилающие внутреннюю поверхность кровеносных сосудов) также обладают отрицательным зарядом. Таким образом, предотвращается слипание эритроцитов между собой и их прикрепление к стенкам сосудов, что, в свою очередь, снижает вероятность образования тромбов. Соответственно, при нарушении метаболизма эритроцитов или при повреждении эндотелия сосудов возрастает риск образования тромбов.
Отличительной особенностью эритроцитов является их поразительная способность проникать через сосуды, диаметр которых менее диаметра эритроцита в 2 – 3 раза. С этой целью в процессе созревания эритроцита происходит разрушение его ядра и большинства органелл. Свойство эритроцита изменять свою форму называется деформируемостью и обеспечивается устойчивой работой цитоскелета клетки. Цитоскелет является системой продольных внутриклеточных белков, которые, выстраиваясь определенным образом, придают клетке необходимую форму и способствуют ее активному передвижению. Основными структурами цитоскелета являются микротрубочки и микрофиламенты, а белки, из которых они состоят, называются актин, миозин и тубулин. При необходимости удлинения и сужения эритроцита для прохождения через узкий сосуд происходит активное нагнетание в него ионов кальция, под действием которых происходит перестроение цитоскелета. После прохождения узкой зоны происходит выход кальция из клетки, приводящий к восстановлению его формы.
Однако в определенных случаях пластичность цитоскелета эритроцитов может ухудшаться, приводя к замедленному их прохождению по микроциркуляторному руслу и даже застреванию. При прохождении через селезенку эритроциты с пониженной деформируемостью задерживаются в ее сосудах и уничтожаются клетками макрофагальной системы. Наиболее частыми причинами, ведущими к этому, являются высокие показатели гемоглобина при эритремии, повышенная жирность крови и выход ее температуры за пределы оптимальных величин.
Как и любая живая клетка, эритроцит нуждается в питательных веществах для поддержания работоспособности. Занимательно то, что клетки, переносящие кислород во все уголки тела человека, не нуждаются в нем и соответственно не потребляют его в процессе транспортировки. Образование молекул АТФ (аденозинтрифосфат), являющихся топливом для большинства ферментных систем клетки, происходит анаэробным, то есть безвоздушным путем. Таким образом, эритроциты абсолютно не чувствительны к недостатку кислорода, однако могут страдать от снижения уровня глюкозы в крови.
Помимо функции газообмена эритроциты выполняют еще ряд важных функций:
- поддержание кислотно-щелочного равновесия крови – посредством карбонатной буферной системы, второй по важности в организме.
- определение реологии крови – посредством изменения численности клеточных элементов крови по отношению к жидкой части.
- гемостаз – участие в образовании тромба в месте повреждения сосудистой стенки.
- участие в иммунных процессах – посредством специфических рецепторов к иммуноглобулинам и комплементу на мембране эритроцита.
Созревание и старение эритроцита
Первичной клеткой, из которой происходит рост и дифференцировка эритроцита, является стволовая мультипотентная клетка. Из всех клеток организма она обладает наиболее высоким потенциалом к делению и самым широким спектром возможностей к дифференцировке. Иными словами, она является клеткой предшественницей всех тканей организма, и поэтому уровень ее дифференцированности приравнивается к нулевому. При стимуляции малоизученными наукой медиаторами данная клетка трансформируется в тотипотентные клетки, способность которых к размножению также велика, а уровень дифференцированности выше. Впоследствии при дальнейшей дифференцировке тотипотентной клетки образуется колониеобразующая единица эритроцитарного ряда, иначе именуемая эритроцитарным ростком, являющимся непосредственным и первым предшественником красных кровяных телец.
По мере созревания клетки состав ее органелл значительно изменяется, среда из кислой становится нейтральной, а затем щелочной. Эти изменения соответствуют стадиям проэритробласта и эритробласта. Непосредственным предшественником эритроцита является ретикулоцит. Данная клетка в начале своего развития располагается в костном мозге в течение 24 – 30 часов, после чего выходит в кровеносное русло и дозревает в течение 36 – 44 часов. Отличительной особенностью данных клеток является больший размер по сравнению с эритроцитом, скопления распавшегося ядра в виде небольших включений, незначительная сине-фиолетовая исчерченность. По мере полного созревания ретикулоцита его размер уменьшается за счет удаления из клетки остатков ядра и органелл, связанных с синтезом веществ. Освободившееся место занимается молекулами гемоглобина, располагающимися в ячейках цитоскелета. В сформировавшемся эритроците еще в течение некоторого времени происходит синтез гемоглобина из остаточных цепей матричной РНК. По мере ее распада все синтетические процессы замирают, и эритроцит переходит в режим полноценной работы и параллельного поддержания жизнеспособности.
Регуляция роста и дифференцировки всех клеток эритроидного ряда осуществляется при непосредственном влиянии эритропоэтина. Данное вещество является одним из гормонов, синтезируемых почками. Точкой приложения его действия является проэритробласт. Регуляция осуществляется по механизму обратной связи. Иными словами, при снижении количества эритроцитов или гемоглобина в периферической крови происходит компенсаторный выброс эритропоэтина и наоборот – при высокой концентрации гемоглобина и эритроцитов образование эритропоэтина приостанавливается. Эритропоэтин стимулирует рост, размножение и дифференцировку клеток эритроидного ряда, непосредственно воздействуя на них. Косвенная регуляция скорости эритропоэза (процесс образования эритроцитов в костном мозге) осуществляется посредством фактора стволовых клеток, интерлейкиа-3, витамина В12, микроэлементов (цинк, медь, железо, селен и др.), гормонов (соматостатин, тироксин, кортикостероиды и половые гормоны).
По прошествии 90 – 120 дней ферментные системы эритроцита постепенно изнашиваются, в результате чего размеры эритроцита уменьшаются, а содержание гемоглобина остается без существенных изменений. В результате происходит относительное повышение вязкости цитоплазмы, при котором относительная концентрация гемоглобина составляет 360 – 380 г\л. Возрастает и плотность эритроцита, которая отражается в снижении его деформируемости. При прохождении через узкие сосуды селезенки старые непластичные эритроциты застревают в них, поглощаются и разрушаются макрофагами.
Лейкоциты, или белые кровяные тельца, изначально были выделены в отдельную подгруппу, поскольку содержали ядро и не имели собственной окраски. Данный тип клеток подразделяется на множество видов по форме и выполняемой функции. Их деятельность можно резюмировать в обеспечении активных и пассивных иммунных реакций организма. На поверхности лейкоцитов находятся два комплекса гистосовместимости. Первый хранит информацию о собственных тканях организма, препятствуя их разрушению. Второй содержит информацию об антигенах чужеродных веществ, которые когда-либо попадали в организм, для того чтобы при встрече незамедлительно их атаковать.
Лейкоциты обладают способностью к самостоятельному передвижению в направлении увеличения концентрации определенного вещества. Такое движение называется хемотаксисом. Веществами, притягивающими лейкоциты, являются биологически активные соединения, высвобождающиеся при разрушении любых других лейкоцитов в процессе борьбы с патогенными бактериями, простейшими, грибками и вирусами, попавшими в организм. Физиологическая норма лейкоцитов 4 – 9 х 10 9 \л.
Длительность жизни лейкоцитов разнообразна и зависит преимущественно от функции, которую выполняет клетка. В среднем она колеблется от нескольких десятков дней до нескольких десятков лет. Образование лейкоцитов происходит в красном костном мозге из общего лейкоцитарного ростка. Первичное обучение, в процессе которого лейкоциты приобретают первый комплекс гистосовместимости, осуществляется в тимусе. Вторичное обучение, в процессе которого лейкоциты приобретают второй комплекс гистосовместимости, осуществляется в периферических лимфатических узлах.
Тромбоциты являются третьей и последней разновидностью клеточных элементов крови. Сразу же необходимо заметить, что тромбоциты не являются самостоятельными клетками. Их образование происходит также в красном костном мозге из клеток, называемых мегакариоцитами. Мегакариоцит представляет собой наиболее крупный кроветворный росток по сравнению с эритроцитарным и лейкоцитарным. В диаметре он может достигать 20 – 25 мкм. В центре мегакариоцита располагается крупное ядро. В цитоплазме синтезируется большой спектр биологически активных веществ, которые впоследствии становятся содержимым тромбоцита. Клеточная мембрана образует множество выростов, края которых постоянно отрываются. Мембраны оторвавшихся фрагментов смыкаются, образуя то, что, по сути, и является тромбоцитом.
Тромбоцит выполняет преимущественно функцию гемостаза – сохранения целостности кровеносного русла. Он первый среди остальных клеточных элементов реагирует на повреждение сосудистой стенки и образует первичный тромб, к усилению которого впоследствии привлекаются лейкоциты и эритроциты. Располагаясь непосредственно над сосудистым дефектом, тромбоциты формируют мелкую сеть, в которую попадают эритроциты и лейкоциты. Таким образом образуется сгусток. По мере закрытия сгустком всей поврежденной поверхности тромбоциты выделяют определенные вещества, приводящие к стягиванию сети и ретракции сгустка. При этом из него удаляется большая часть жидкости, а сам тромб становится плотнее.
По данным последних исследований обнаружена еще одна важнейшая функция тромбоцитов, которая заключается в стимуляции процессов роста и регенерации тканей в поврежденной области. Таким образом, тромбоцит играет роль не только в обеспечении гемостаза, но еще и в росте и функциональном восстановлении поврежденных тканей. Физиологическая норма тромбоцитов находится в пределах 180 – 320 х 10 9 \л.
По происхождению апластические анемии делятся на:
- врожденные;
- приобретенные.
В большинстве случаев наблюдается угнетение всех трех ростков кроветворения, однако клинически замечено, что в различные фазы болезни может наблюдаться более выраженное угнетение какого-то одного из ростков. В подтверждение этому был проведен ряд экспериментов, в результате которых было продемонстрировано различное по выраженности эффекта влияние разнообразных неблагоприятных факторов на костный мозг.
По преимущественному поражению костномозговых ростков выделяют:
- угнетение одного кроветворного ростка (эритроцитарного, лейкоцитарного или тромбоцитарного);
- угнетение двух кроветворных ростков;
- угнетение трех кроветворных ростков.

Наиболее распространенным видом врожденной апластической анемией является анемия Фанкони. Непосредственной причиной заболевания является повышенная чувствительность ДНК клеток к повреждающим агентам. Данное заболевание наследуется по аутосомно-рецессивному типу. Это значит, что, для того чтобы оно проявилось, необходимо, чтобы у обоих родителей присутствовал дефект причинного гена. Лишь только в подобном случае вероятность развития клинических признаков заболевания у ребенка составляет приблизительно 25%. Соответственно, предотвратить данное заболевание можно, если заранее знать, что в роду обоих родителей имелись больные данным типом анемии, и предостеречь данную пару от зачатия ребенка.
Различают следующие причины приобретенных апластических анемий:
- ионизирующее излучение;
- лекарственные препараты (декарис, анальгин, левомицетин, тетрациклин, бутадион и др.);
- химические соединения (пестициды, бензол);
- заболевания (вирусные гепатиты А, В и С, вирус Эпштейн-Барр, цитомегаловирус, вирус герпеса, ВИЧ, парвовирус В19 и др.).
- гормональные нарушения со стороны яичников, щитовидной шелезы и вилочковой железы.
Различают следующие теории патогенеза апластической анемии:
- стромальная;
- аутоиммунная;
- преждевременный апоптоз.
Доказано, что рост и созревание клеток костного мозга невозможен без влияния факторов, вырабатываемых стромой. Строма является скоплением соединительнотканных клеток, образующих своего рода «скелет» или «ложе» в котором залегают клетки костного мозга. Строма вырабатывает такие вещества как ИЛ (интерлейкины) 1, 3 и 6 и фактор стволовых клеток. Данные вещества направляют развитие клеток предшественников в то или иное русло на различных стадиях их развития.
В 15 – 20% случаев апластических анемий причинной их развития становится недостаточное формирование и выделение стромальных факторов роста. По этой причине дифференцировка клеток крови останавливается на определенной стадии развития. В костном мозге при специальном исследовании можно обнаружить скопление предшественников клеток крови. В периферической крови отмечается увеличение эритропоэтина, который в норме влияет на строму костного мозга.
Апоптоз является физиологическим процессом, при котором происходит самостоятельное разрушение клеток с определенными мутационными аномалиями или клеток, изживших отведенный им срок. Посредством апоптоза организм защищается от накопления мутаций и вызванных этим осложнений преимущественно опухолевого происхождения. Однако апоптоз может стать и патологическим процессом, когда будет приводить к преждевременному саморазрушению клеток. Причина преждевременного апоптоза заключается в мутации гена, синтезирующего белок Р-450.
Несмотря на существование нескольких успешных теорий развития апластических анемий, в научном мире по-прежнему ведутся многочисленные исследования в данном направлении. Однако для практикующего врача, и тем более для пациента, поиск механизма, по которому происходит развитие заболевания, практически никогда не имеет смысла. Это связано с тем, что на сегодняшний день не существует более или менее эффективных препаратов, помимо стероидных гормонов, способных замедлить прогрессию анемии или хотя бы частично ее компенсировать. К тому же, наиболее эффективным лечением сегодня является трансплантация костного мозга. Поэтому изучение механизма развития апластической анемии имеет исключительно научный интерес.
Редкая врожденная апластическая анемия с тяжелым течением, диагностируемая в возрасте от 4 до 10 лет. Поражает с одинаковой частотой мужской и женский пол. Развивается по причине высокой подверженности ДНК клеток тела, и костного мозга в частности, к различного рода мутациям. Клинически проявляется тремя вышеперечисленными синдромами. Степень выраженности симптомов болезни имеет волнообразный характер с периодами ремиссий и обострений. Отмечается высокий риск развития злокачественных опухолевых процессов.
До 80% больных рождаются со следующими телесными аномалиями:
- Со стороны мышечно-костной системы — добавочные, отсутствующие или сращенные пальцы, недоразвитие или отсутствие лопаток, незаращение твердого неба (волчья пасть, заячья губа), отсутствие ушных раковин, деформация хрящей носа, добавочные позвонки, сколиоз и др.
- Со стороны нервной системы — микроэнцефалия или анэнцефалия, макроцефалия, спинномозговые грыжи, слепота, глухота, миастения, парапарезы и тетрапарезы, умственная отсталость.
- Со стороны мочеполовой системы — недоразвитие или отсутствие почек, добавочные почки, почечный поликистоз, S-образная почка, подковообразная почка (сращение одного из полюсов) эктопия мочеточников, экстрофия (выворот) мочевого пузыря, агенезия (отсутствие развития) матки, двурогая матка, полное заращение девственной плевы, анорхия (отсутствие яичек), агенезия уретры и пениса и др.
- Со стороны сердечно-сосудистой системы — незаращение овального отверстия и межпредсердной перегородки, открытый баталов проток, стенозы аорты на различных уровнях, инверсия магистральных сосудов сердца и др.
- Со стороны пищеварительной системы — стенозы и аневризмы кишечника, дивертикулез, атрезия кишечника (слепо заканчивающийся кишечник), бронхопищеводные свищи на различных уровнях.
Данный тип анемии считается парциально пластическим, поскольку проявляется угнетением исключительно эритроцитарного ростка костного мозга без вовлечения лейкоцитарного и тромбоцитарного ростков. Заболевание носит семейный характер и может проявиться, если хотя бы один родитель болен им. Поскольку заболевание является аутосомно-доминантным, то вероятность проявления колеблется в пределах 50 – 100% в зависимости от комбинации генов родителей.
Непосредственная причина заболевания – низкая чувствительность клеток костного мозга к эритропоэтину. Клинически наблюдается только анемический синдром. Замечена высокая вероятность развития острых лейкозов. В большинстве случаев определяются антитела к эритрокариоцитам, поэтому часто эффективным оказывается иммуносупрессивное лечение. Поддерживающее лечение осуществляется посредством регулярных переливаний эритроцитарной массы.
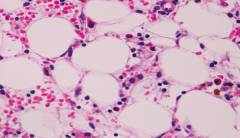
Наиболее ценными дополнительными исследованиями являются:
- общий анализ крови (ОАК);
- биохимический анализ крови (БАК);
- стернальная пункция;
- трепанобиопсия.
Данные общего анализа крови при апластической анемии свидетельствуют в пользу панцитопении (снижение количества всех трех типов клеток костного мозга). Уменьшение количества лейкоцитов наблюдается преимущественно за счет снижения гранулоцитов (нейтрофилы, эозинофилы и базофилы). Таким образом, относительно увеличивается процент лимфоцитов и моноцитов в лейкоцитарной формуле. На различных стадиях заболевания могут быть выявлены воспалительные признаки в той или иной мере.
Ориентировочными показателями ОАК при апластической анемии являются:
- Гемоглобин (Hb) – менее 110 г\л (норма 120 – 160 г\л). Уменьшение за счет снижения числа эритроцитов.
- Эритроциты – 0,7 – 2,5 х 10 12 \л (норма 3,7 х 10 12 \л). Снижение количества зрелых эритроцитов.
- Ретикулоциты — менее 0,2% (норма 0,3 – 2,0%). Снижение количества молодых форм эритроцитов.
- Цветовой показатель – 0,85 – 1,05 (норма 0,85 – 1,05) свидетельствует о нормохромном характере анемии (содержание гемоглобина в эритроците в пределах нормы).
- Гематокрит (Ht) – менее 30 (норма 35 – 42 у женщин и 40 – 46 у мужчин). Соотношение клеточного состава крови к ее жидкой части. Наблюдается явное уменьшение доли клеток в периферической крови.
- Тромбоциты – менее 35 промилле или 100 х 10 9 \л. Снижение количества тромбоцитов.
- Лейкоциты – 0,5 – 2,5 х 10 9 \л (норма 4 – 9 х 10 9 \л). Выраженная лейкопения за счет снижения числа гранулоцитов (нейтрофилы, эозинофилы и базофилы).
- Палочкоядерные нейтрофилы – 0 – 2% (норма менее 6%). Снижение выработки молодых форм лейкоцитов.
- Сегментоядерные нейтрофилы – 0 – 40% (норма 47 – 72%). Снижение количества зрелых форм нейтрофилов.
- Миелоциты – 0 – 2% (в норме отсутствуют). В условиях гранулоцитопении и наслоения бактериальной инфекции наблюдается более выраженный, чем обычно, сдвиг лейкоцитарной формулы влево с появлением клеток предшественников лейкопоэза.
- Эозинофилы – 0 – 1% (норма 1 – 5%). Снижение количества эозинофилов.
- Базофилы – 0% (норма 0 – 1%). Единичные или полное отсутствие базофилов.
- Лимфоциты – более 40% (норма 19 – 37%). Численное количество лимфоцитов остается в норме. За счет снижения фракции гранулоцитов наблюдается относительный лимфоцитоз (увеличение доли лимфоцитов в крови). Крайне выраженный лимфоцитоз может наблюдаться при наслоении вирусных инфекций.
- Моноциты – более 8% (норма 6 – 8%). Количество моноцитов неизменно и находится в пределах нормы. Моноцитоз (увеличение доли моноцитов в крови) объясняется снижением процентной доли гранулоцитов в лейкоцитарной формуле.
- Скорость оседания эритроцитов – более 15 – 20 мм\час (норма до 10 мм/час у мужчин и до 15 мм/час у женщин). Данный показатель отражает степень выраженности воспалительной реакции в организме.
- Анизоцитоз – наличие в крови эритроцитов различного размера.
- Пойкилоцитоз – наличие в крови эритроцитов различной формы.
Некоторые виды биохимических анализов крови могут акцентировать внимание врача на отклонениях в организме, которые косвенно вписываются в три вышеперечисленных анемических синдрома.
Ориентировочными показателями БАК при апластической анемии являются:
- Сывороточное железо более 30 мкмоль\л (норма 9 – 30 мкмоль/л). Увеличение сывороточного железа на фоне частых переливаний крови. Высокий риск развития гемохроматоза.
- Эритропоэтин более 30 МЕ\л (норма 8 – 30 МЕ/л у женщин и 9 – 28 МЕ\л у мужчин). Увеличение эритропоэтина происходит по двум причинам. Во-первых, не происходит его потребления клетками эритроцитарного ростка. Во-вторых, компенсаторно усиливается его синтез в ответ на анемию.
- НBs-АГ и анти HBcor иммуноглобулины G – положительны (в норме — отрицательны). Данный анализ указывает на наличие вирусного гепатита В. В ряде случаев данный вирус провоцирует развитие аутоиммунной реакции против клеток костного мозга.
- С-реактивный белок – более 10 – 15 мг\л (норма 0 – 5 мг\л). Выявляется при воспалительной реакции на фоне ослабленного иммунитета.
- Тимоловая проба – более 4 (норма 0 — 4). Выявляет признаки воспаления при ослабленном иммунитете.
Данный вид исследования используется с целью визуализации клеток костного мозга и их процентного соотношения. Пункция осуществляется в процедурном кабинете с применением стерильного инструментария и обезболивающих препаратов, преимущественно ингаляторного действия. Обработка места прокола осуществляется попеременно несколькими антисептическими растворами. Пациент находится в положении лежа на спине. Для пункции используются специальные широкие иглы с ограничителем глубины ввода. Шприц и поршень должны обеспечивать достаточный уровень компрессии, поэтому предпочтительнее использовать стеклянные шприцы с железным поршнем. Классически прокол осуществляется в теле грудины на уровне 2 – 3 ребра медленными вращательными движениями до ощущения провала. Резкое прободение повышает риск соскальзывания иглы с грудины и ранение органов грудной полости. После ощущения провала игла фиксируется одной рукой, а второй рукой производится тракция стержня шприца. Забор пунктата осуществляется до отметки 0,3 – 0,5 мм, после чего иглу извлекают, а отверстие заклеивают лейкопластырем. При отсутствии пунктата в месте прокола пункцию выполняют повторно на несколько сантиметров ниже. После пункции пациент должен продолжать находиться в горизонтальном положении под наблюдением медицинского персонала еще в течение 30 минут.
После извлечения шприца выполняется его опорожнение на несколько предметных стекол, из которых впоследствии будут изготовлены 10 – 15 мазков. Мазки фиксируются, окрашиваются и исследуются согласно соответствующим методикам. Результат исследования именуется миелограммой. Миелограмма отражает фактический и относительный клеточный состав костного мозга.
При апластической анемии миелограмма будет скудной, количество клеточных элементов значительно снижено. Камбиальные клетки эритроцитарного и лейкоцитарного ряда единичны или отсутствуют. Мегакариобласты отсутствуют. В редких случаях при пункции случается встретить сгруппированные очаги повышенной пролиферации клеток как компенсаторную реакцию здорового костного мозга на анемию. Такая миелограмма может сбить с толку, поскольку будет свидетельствовать в пользу отсутствия апластической анемии и поэтому будет ложноотрицательной.
Трепанобиопсия является способом изъятия части костного мозга из крыла подвздошной кости пациента. Преимущество данной процедуры над стернальной пункцией заключается в возможности забора большего количества материала с сохранением его структуры. Большее количество материала уменьшает вероятность ложноотрицательного результата апластической анемии, а изучение структуры костного мозга позволяет помимо цитологического исследования (миелограммы) провести еще и гистологическое.
При трепанобиопсии пациент находится в положении лежа на животе. Иглы для проведения данной процедуры схожи с иглами при стернальной пункции, но больше в размерах. Обезболивание и техника забора материала идентична вышеописанной. Результаты трепанобиопсии повторяют результаты стернальной пункции. Вдобавок к этому определяется увеличение процентной доли стромы по отношению к кроветворным клеткам, а также увеличение доли желтого неактивного костного мозга по отношению к красному активному.
При помощи анализа крови и результатов трепанобиопсии возможно определение степени тяжести апластической анемии.
Апластическая анемия средней тяжести определяется следующими показателями:
- гранулоциты менее 2,0 х 109\л;
- тромбоциты менее 100 х 109\л;
- ретикулоциты менее 2 – 3%;
- гипоплазия костного мозга на трепанобиопсии.
Апластическая анемия тяжелой степени определяется следующими показателями:
- гранулоциты менее 0,5 х 109\л;
- тромбоциты менее 20 х 109\л;
- ретикулоциты менее 1%;
- аплазия костного мозга на трепанобиопсии.
Апластическая анемия крайне тяжелой степени определяется следующими показателями:
- гранулоциты менее 0,2 х 109\л;
- тромбоциты единичные или отсутствуют;
- ретикулоциты единичные или отсутствуют;
- аплазия костного мозга на трепанобиопсии.

Медикаменты являются неотъемлемой частью лечения апластической анемии. Наиболее часто используются три группы препаратов — иммунодепрессанты (дексаметазон, метилпреднизолон и др.), цитостатики (циклофосфан, 6-меркаптопурил, циклоспорин А, метотрексат, имуран и др.) и антибиотики (цефалоспорины, макролиды, азалиды, хлорхинолоны и др.). Реже могут использоваться препараты для коррекции артериального давления, нарушений перистальтики микрофлоры кишечника, ферментные препараты и др.
Иммуносупрессоры могут быть использованы в виде монотерапии лишь в начальных стадиях заболевания и в процессе диагностики. Цитостатики при апластической анемии могут применяться в комбинации с иммуносупрессорами. Также важным их предназначением является очистка концентрата стволовых клеток от примесей злокачественных клеток. Антибиотики применяются во всех стадиях заболевания с целью лечения сопутствующих инфекционных осложнений, возникающих на фоне ослабленного или даже отсутствующего иммунитета.
По мере прогрессирования панцитопении возникает необходимость в трансплантации костного мозга – единственного радикального способа излечения апластической анемии. Проблема заключается в том, что для пересадки необходим донор, который предоставит костный мозг совместимый или хотя бы частично совместимый по антигенному составу с костным мозгом реципиента. Нахождение донора может занять длительное время, которым больной в большинстве случаев не располагает. В таких случаях пациенту осуществляются переливания цельной донорской крови или ее компонентов с целью поддержания компенсированного состояния его здоровья.
В данном разделе необходимо указать, что операция, как таковая, производится только донору костного мозга. Реципиент не оперируется. На протяжении десятилетий с момента первой трансплантации костного мозга в 1968 году изучались различные способы введения в организм больного стволовых клеток. Из всех методов наиболее эффективным оказалось внутривенное их введение. Именно по этой причине в дальнейшем операция при апластической анемии будет именоваться трансплантацией стволовых клеток.
Существуют следующие виды трансплантации стволовых клеток:
- аллогенная трансплантация костного мозга;
- аллогенная трансплантация периферических стволовых клеток крови;
- аутологичная трансплантация пуповинной крови;
- аутологичная трансплантация костного мозга;
- аутологичная трансплантация периферических стволовых клеток крови;
- сингенная трансплантация костного мозга.
Данный вид лечения подразумевает извлечение костного мозга донора и трансплантацию его больному реципиенту. Выполнение данной процедуры является технически сложным процессом и подразумевает соблюдение определенных правил.
В первую очередь донор должен быть совместим с организмом реципиента по трем антигенам в двух комплексах гистосовместимости HLA. В итоге ожидается полное сходство донора и реципиента по 6 антигенам. Минимальным порогом, при котором может осуществиться трансплантация является совпадение по 4 из 6 антигенов, однако в этом случае риски различного рода осложнений возрастают в несколько раз. По приблизительным подсчетам только в 30% случаев среди ближайших родственников больного отыскиваются доноры, полностью совместимые по всем 6 антигенам. Не имеет значения ни возраст, ни пол донора. Самым молодым донором в мире являлся четырехмесячный ребенок с весом тела 3,6 кг.
Операция по извлечению костного мозга является модификацией трепанобиопсии с некоторыми изменениями. В первую очередь данное вмешательство значительно более болезненно, поэтому обязательно использование общей или эпидуральной анестезии. Использующиеся иглы обладают большим диаметром. Пункция выполняется от 10 до 20 раз в гребешок каждой подвздошной кости. Количество забираемого материала значительно выше и составляет 10 – 15 мл на килограмм массы тела донора. Таким образом, у донора весом 70 кг будет взято количество костного мозга равное 700 – 1050 мл. Осложнения после подобной процедуры развиваются менее чем в 1% случаев. Подавляющее большинство осложнений связано с анестезией и острой сердечной недостаточностью при массивной кровопотере.
В дальнейшем полученный костный мозг медленно переливается в организм реципиента при помощи внутривенного доступа. Однако подобные случаи достаточно редки, и чаще костный мозг получается из специальных банков-хранилищ биологических материалов. Данные банки пополняются донорами по всему миру. На сегодняшний день насчитывается более 50 национальных банков-хранилищ биологических материалов и более 4 миллионов доноров по всему миру. После выделения костного мозга его необходимо сохранить на длительное время. Для этого он помещается в специальный раствор, не образующий кристаллов льда при замораживании и размораживании. Темпы охлаждения равняются 3 градусам в минуту. При температуре -85 градусов стволовые клетки сохраняются в течение 6 месяцев. При температуре -196 градусов стволовые клетки сохраняются в течение десятков лет. При необходимости использования стволовые клетки размораживаются при температуре 44 – 45 градусов.
Перед введением взвеси стволовых клеток производится их обработка цитостатиками с целью уничтожения примеси злокачественных клеток. Длительный период после трансплантации пациент должен получать интенсивную иммуносупрессивную терапию с целью предотвращения отторжения трансплантата и других нежелательных иммунных реакций.
Несмотря на то, что наиболее распространенным способом добывания стволовых клеток из организма донора является вышеописанная операция, в последние годы активно исследуется метод получения стволовых клеток из периферической крови. Его суть заключается в отделении определенный видов клеток при помощи физического явления, называемого лейкаферезом, с последующей фильтрацией крови в специальных клеточных сепараторах. В данном случае источником стволовых клеток является донорская кровь. После извлечения она обогащается рекомбинантными факторами роста, что приводит к ускорению темпов деления стволовых клеток и увеличению их количества.
Такой метод имеет ряд преимуществ. Во-первых, его побочные эффекты такие же, как при обычном заборе донорской крови. Во-вторых, не страдает костный мозг донора, который при операции должен восстанавливаться в течение как минимум полугода. В-третьих, после трансплантации добытых таким образом стволовых клеток реже развиваются побочные иммунные реакции.
Трансплантация стволовых клеток производится от донора, которым является гомозиготный (однояйцевый) близнец больного. Антигены на поверхности клеток их организмов идентичны, поэтому такой трансплантат не вызовет реакции отторжения и приравнивается к аутологичному.
После проведенной пересадки стволовых клеток пациент должен находиться под бдительным контролем медицинского персонала. Обязательно проведение активной иммуносупрессивной терапии. Низкий иммунитет больного подразумевает его нахождение в специализированных стерильных палатах с замкнутой системой вентиляции, бактериальными фильтрами и т. п. Перед тем как войти в палату медицинский персонал должен быть одет в стерильные костюмы и пройти через санпропускник.
Суть данного осложнения заключается в конфликте иммунных клеток организма хозяина со свежесформированными иммунными клетками донорских стволовых клеток. При этом донорские лимфоциты проявляют выраженную агрессию по отношению к лимфоцитам хозяина. Клинически это проявляется обильной сыпью, кожными буллами, язвами, нарушением функций желудочно-кишечного тракта, сердечно-сосудистой системы и т. д.
Данное осложнение развивается исключительно при пересадке костного мозга или стволовых клеток от аллогенного донора. При пересадке собственных, замороженных ранее стволовых клеток, такое осложнение не развивается. Данное осложнение происходит при полной совместимости костного мозга донора и реципиента по всем 6 антигенам в 30% случаев. При частичной совместимости риск такого осложнения возрастает до 80%. С целью профилактики данной патологической реакции применяются цитостатики. Наиболее часто препаратом выбора является циклоспорин А в паре с одним из следующих препаратов — метотрексат, имуран или глюкокортикоиды (дексаметазон, метилпреднизолон и др.)

Врожденная апластическая анемия Фанкони в большинстве случаев крайне тяжело поддается лечению, поскольку костный мозг никогда не был здоровым и, соответственно, очень сложно восстанавливается. Наличие врожденных аномалий развития сильно ограничивает показания к пересадке костного мозга таким пациентам. В большинстве случаев больные погибают в детском возрасте от аномалий развития или инфекционных осложнений.
Приобретенные апластические анемии имеют более благоприятный прогноз, поскольку в некоторых случаях являются обратимыми после прекращения действия повреждающего фактора на костный мозг.
Применение методов консервации пуповинной крови, стволовых клеток костного мозга и периферической крови повышает шансы на полное выздоровление до 75 – 80%.
источник

