Апластическая анемия – это состояние, при котором организм перестает вырабатывать достаточное количество новых кровяных телец.
Апластическая анемия вызывает у больных слабость и утомляемость, а также делает их очень подверженными инфекциям и кровотечениям.
Апластическая анемия, редкое и серьезное состояние, может возникнуть в любом возрасте.
Апластическая анемия может развиться внезапно, но может прогрессировать медленно, месяцами ухудшая состояние больного. Современное лечение апластической анемии включает переливания крови, лекарственные препараты и трансплантацию костного мозга.
Апластическая анемия возникает при повреждении костного мозга, которое приводит к замедлению или полному прекращению выработки клеток крови. Костный мозг представляет собой красное губчатое вещество внутри костей, которое постоянно вырабатывает новые клетки крови – эритроциты, лейкоциты, тромбоциты. При апластической анемии больной костный мозг описывают терминами «апластический» или «гипопластический», что означает либо полное отсутствие в нем молодых кровяных телец, либо очень малое их количество.
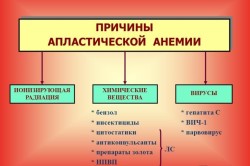
Факторы, которые временно или необратимо нарушают кроветворную функцию костного мозга, включают:
• Радиоактивное облучение. Человек может стать жертвой радиации как в результате аварий на атомных объектах, так и в результате медицинского облучения – например, при лечении рака.
• Химиотерапия при раке. Воздействие многих химиотерапевтических препаратов плохо сказывается не только на раковых клетках, но и на других интенсивно делящихся клетках организма.
• Токсичные вещества. Воздействие токсинов из окружающей среды, таких как инсектициды, пестициды, лабораторные реактивы, может пагубно повлиять на костный мозг. При этом больному иногда становится лучше, если воздействие химикатов прекратится.
• Некоторые лекарства. Препараты для лечения ревматоидного артрита, некоторые антибиотики могут вызывать апластическую анемию. Данный побочный эффект обязательно должен быть указан в инструкции к препарату.
• Аутоиммунные заболевания. Это большая группа заболеваний, при которых иммунная система организма ошибочно атакует клетки хозяина. Жертвами иммунитета могут стать и клетки костного мозга.
• Вирусная инфекция. Некоторые вирусы играют роль в развитии апластической анемии. Последние исследования позволяют причислить к таким опасным организмам вирус Эпштейна-Барр, цитомегаловирус (ЦМВ), парвовирус В19 и вирус иммунодефицита человека (ВИЧ).
• Беременность. Апластическая анемия, которая возникает при беременности, может быть связана с аутоиммунной проблемой – иммунная система беременной иногда ошибочно атакует костный мозг.
• Неизвестные факторы. Во многих случаях врачи не могут установить точную причину апластической анемии. Тогда говорят о так называемой идиопатической апластической анемии.
Апластическую анемию не стоит путать с миелодиспластическим синдромом.
Это группа заболеваний, при которых костный мозг вырабатывает новые кровяные клетки, но они деформированы или недоразвиты. При миелодиспластическом синдроме костный мозг иногда характеризуют как «гиперпластический» — это означает, что в нем содержится много кровяных телец. Но у некоторых больных с этим синдромом костный мозг почти пуст, поэтому болезнь иногда путают с апластической анемией.
Апластическая анемия связана с некоторыми другими заболеваниями. У части больных с апластической анемией имеется другая редкая болезнь – пароксизмальная ночная гемоглобинурия. Эта болезнь характеризуется слишком быстрым разрушением эритроцитов.
Анемия Фанкони – это редкая, наследственная болезнь, которая приводит к апластической анемии. Дети с болезнью Фанкони могут иметь различные врожденные дефекты, такие как недоразвитие конечностей. Болезнь диагностируется при помощи генетического анализа.
Апластическая анемия встречается редко.
• Лучевая или химиотерапия рака в прошлом.
• Воздействие токсичных веществ на производстве и в быту.
• Использование рецептурных препаратов, таких как хлорамфеникол (Левомицетин) и некоторые средства против ревматоидного артрита.
• Некоторые заболевания кроветворной системы.
• Тяжелые инфекционные заболевания.
• Аутоиммунные процессы.
• Беременность (редко).
Признаки болезни появляются в результате снижения количества тех или иных кровяных телец.
Признаки апластической анемии могут быть следующими:
• Слабость.
• Одышка при напряжении.
• Быстрое или нерегулярное сердцебиение.
• Бледность кожных покровов.
• Частые и тяжелые инфекции.
• Склонность к появлению синяков.
• Кровотечения из десен и носа.
• Длительные кровотечения после порезов.
• Кожная сыпь.
• Головокружение.
• Головные боли.
Апластическая анемия может прогрессировать медленно, неделями и месяцами. Болезнь может быть короткой и проходящей, а может стать хронической. Апластическая анемия требует серьезного отношения, потому что в тяжелых случаях она заканчивается фатально.
Для диагностики этого заболевания врач может назначить следующее:
• Анализы крови. В крови здорового человека уровень эритроцитов, лейкоцитов и тромбоцитов находится в определенных пределах. Эти пределы могут варьировать в зависимости от возраста, пола, расы и других особенностей организма. Но если в анализах обнаружится очень низкий уровень всех трех классов клеток крови, то врач заподозрит апластическую анемию.
• Биопсия костного мозга. Для подтверждения диагноза больному придется пройти болезненную, но необходимую процедуру биопсии. Во время биопсии врач введет специальную иглу в одну из костей и возьмет образец костного мозга. Клетки костного мозга изучат под микроскопом, чтобы увидеть признаки апластической анемии или других заболеваний. При апластической анемии костный мозг будет содержать мало кровяных клеток.
После того, как подтвердится апластическая анемия, врачи назначат дополнительные обследования, чтобы выяснить причину болезни. Это может быть длительный и сложный процесс.
Лечение апластической анемии в легких случаях может состоять в простом наблюдении за пациентом. При более тяжелой форме болезни могут применяться переливания крови, трансплантация костного мозга и специальные препараты, которые стимулируют кроветворение. Тяжелая апластическая анемия угрожает жизни человека и требует обязательной госпитализации.
При низком уровне тромбоцитов или эритроцитов больным переливают донорскую кровь. Это не вылечит апластическую анемию, но поможет контролировать ее симптомы, восполняя кровяные клетки, которые не вырабатывает больной костный мозг. Для переливания могут использовать отдельную массу, состоящую из эритроцитов или тромбоцитов – в зависимости от потребностей больного.
Обычно нет ограничения количества переливаний для одного больного. Но у такой процедуры могут быть осложнения. Переливаемые кровяные тельца содержат железо, которое высвобождается при их разрушении и накапливается в теле. При многократном переливании в организме откладываются большие запасы железа, которые повреждают жизненно важные органы, если не назначить специальные препараты для его выведения.
Другое осложнение заключается в том, что организм может вырабатывать антитела к переливаемым клетках. А это сделает лечение менее эффективным.
Пересадка стволовых клеток, чтобы «перезапустить» костный мозг больного – это иногда единственный способ успешного лечения апластической анемии. Трансплантация стволовых клеток, иногда называемая пересадкой костного мозга, является методом выбора для больных молодого возраста, имеющих подходящего донора. Чаще всего подходящим донором выступает брат или сестра.
Если донор найден, то костный мозг больного сначала истощают высокими дозами радиации или химиотерапией. Далее здоровые стволовые клетки донора фильтруют из его крови, после чего вводят их в кровоток больного. Клетки сами мигрируют в полости костей и начинают там вырабатывать кровяные тельца, как это предусмотрено природой. Но вся процедура очень сложная, дорогостоящая и требует длительного пребывания в больнице. После трансплантации больной должен получать лекарства для профилактики отторжения донорских клеток.
Трансплантация влечет за собой риски. Есть вероятность, что организм начнет отторгать трансплантат. Эта реакция может быть фатальной для реципиента. Кроме того, не каждому больному удается найти донора, который совместим по всем параметрам.
Больные с аутоиммунными заболеваниями, которые повредили костный мозг, нуждаются в лечении иммуносупрессорами – препаратами, подавляющими иммунитет.
Препарат циклоспорин (Генграф, Неорал) и антитимоцитарный глобулин (Тимоглобулин) могут использоваться в качестве примера. Эти лекарства подавляют активность иммунных клеток, которые атакуют костный мозг. Лечение помогает восстановить костный мозг и повысить уровень клеток крови. Два названных выше препарата нередко используют в комбинации.
Кортикостероидные гормоны, такие как метилпреднизолон (Солу-Медрол, Медрол, Метипред), также назначают для подавления иммунитета, иногда наряду с другими лекарствами.
Иммуносупрессоры могут быть очень эффективными при апластической анемии. Обратной стороной медали является то, что подавление иммунитета приводит к риску инфекций. Кроме того, есть возможность, что после отмены лекарств апластическая анемия вернется.
Некоторые препараты помогают усилить кроветворение в костном мозге. Среди них колониестимулирующие факторы, такие как сарграмостин (Лейкин), филграстим (Нейпоген), пегфилграстим (Нейласта) и эпоэтин-альфа (Прокрит, Эпоген). Эти препараты разработаны относительно недавно, их получение является очень дорогим и трудоемким процессом, поэтому стоимость препаратов для среднестатистического больного просто фантастическая. Колониестимулирующие факторы нередко назначают наряду с иммуносупрессорами.
Апластическая анемия сопровождается понижением уровня лейкоцитов и ослаблением иммунной защиты организма. Это делает организм больного очень восприимчивым к различным бактериальным, вирусным и грибковым инфекциям.
При первых признаках инфекций, таких как жар, следует сразу же обращаться к врачу. У человека с ослабленным иммунитетом мало шансов на то, что банальная простуда пройдет «просто так». Безобидная для других людей инфекция может стать опасной для жизни, поэтому врач будет использовать антибиотики, противовирусные и другие препараты для лечения и профилактики.
Апластическая анемия, вызванная радиацией или химиотерапией рака, обычно улучшается после отмены лечения. То же самое касается многих лекарств и токсинов, которые поражают костный мозг.
Беременные женщины с апластической анемией получают переливания крови, потому что другие способы лечения нанесут непоправимый вред ребенку. У многих беременных апластическая анемия проходит сама по себе вскоре после родов. Если этого не произошло, требуется дальнейшее лечение.
Советы для больных апластической анемией:
• Отдыхайте, когда вам это нужно. Анемия может вызвать утомляемость и одышку, даже при незначительной нагрузке. Делайте перерывы в работе, если вы устали, берегите свои силы.
• Избегайте контактных видов спорта. Из-за высокого риска кровотечений, связанных с тромбоцитопенией, контактный спорт может вызвать проблемы. Незначительный порез, синяк, падение – и кровь будет трудно остановить.
• Защитите себя от микробов. Вы можете уменьшить риск инфекций, если будете чаще мыть руки, избегать больных людей и соблюдать правила гигиены. При первых незначительных признаках инфекции немедленно обращайтесь к врачу.
источник
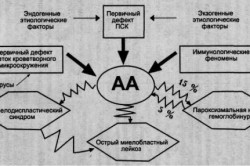
Апластическая анемия – угнетение функции кроветворения красного костного мозга (эритроцитопоэза, лейкопоэза и тромбоцитопоэза), приводящее к пангемоцитопении. К основным клиническим проявлениям гематологического синдрома принадлежат головокружение, слабость, обмороки, одышка, покалывание в груди, кожные геморрагии, кровотечения, склонность к развитию инфекционно-воспалительных и гнойных процессов. Заболевание диагностируется на основании характерных изменений гемограммы, миелограммы и гистологического исследования трепанобиоптата. Лечение патологии включает проведение гемотрансфузий, иммуносупрессивной терапии, миелотрансплантации.
Апластическая (гипопластическая) анемия – тяжелое расстройство гемопоэза (чаще всех его звеньев), сопровождающееся развитием анемического, геморрагического синдромов и инфекционных осложнений. Развивается в среднем у 2 человек на 1 млн. населения в год. Приблизительно с одинаковой частотой патология поражает мужчин и женщин. Возрастные пики заболеваемости приходятся на возраст 10–25 и старше 50 лет. При данной патологии в костном мозге чаще нарушается образование всех трех типов клеточных элементов крови (эритроцитов, лейкоцитов и тромбоцитов), иногда — только одних эритроцитов; в зависимости от этого различают истинную и парциальную апластическую анемию. В гематологии данный вид анемии относится к числу потенциально фатальных заболеваний, приводящих к гибели 2/3 заболевших.
По происхождению апластическая анемия может быть врожденной (связанной с хромосомными аберрациями) и приобретенной (развившейся в течение жизни). Принято считать, что угнетение миелопоэза связано с появлением в красном костном мозге и крови цитотоксических T-лимфоцитов, производящих фактор некроза опухолей и γ-интерферон, которые в свою очередь подавляют ростки кроветворения. Запускать этот механизм могут различные внешнесредовые (химические соединения, физические явления, лекарственные вещества), а также эндогенные факторы (вирусы, аутоиммунные реакции). К числу наиболее значимых причин относят:
- Прием миелотоксических препаратов. Достоверно установлена связь анемии с приемом некоторых противоопухолевых, противосудорожных, антибактериальных, антитиреоидных, противомалярийных препаратов, транквилизаторов, препаратов золота и др., обладающих потенциальным миелотоксическим эффектом. Лекарственные вещества могут вызывать как прямое повреждение стволовых кроветворных клеток, так и опосредованное — через аутоиммунные реакции. Анемии, связанные с таким механизмом развития, называются лекарственными.
- Контакт с химическими и физическими агентами. Супрессию костного мозга может вызывать взаимодействие с органическими растворителями, соединениями мышьяка, бензольными соединениями, пестицидами, облучение всего тела. В некоторых случаях недостаточность гемопоэза является временной и обратимой — главными факторами здесь являются концентрация/доза вещества и время контакта. супрессию костного мозга.
- Вирусные инфекции. Из вирусных агентов наибольшее значение уделяется возбудителям гепатитов В, С и D. В этом случае гипопластическая анемия обычно развивается в течение полугода после перенесенного вирусного гепатита. При изучении патогенеза было замечено, что репликация вируса происходит в мононуклеарах крови и костного мозга, а также в иммунных клетках. Предполагается, что подавление миелопоэза в этом случае является своеобразным иммунным ответом, возникающим против клеток, несущих на своей поверхности вирусные антигены. Такой вид анемии выделяется в отдельную форму – постгепатитную. Среди других вирусных инфекций называются ЦМВ, инфекционный мононуклеоз, грипп.
Также описаны случаи панцитопении, вызванные инфицированием туберкулезом, интоксикацией, лучевой болезнью, лимфопролиферативными заболеваниями (тимомой, лимфомой, хроническим лимфобластным лейкозом), беременностью. Почти в половине наблюдений причину анемии выявить не удается — такие случаи относят к идиопатической форме.
В основе апластической анемии может лежать либо первичное повреждение гемопоэтических стволовых клеток, либо нарушение их эффективной дифференцировки. При наследственных анемиях недостаточность гемопоэза опосредована кариотипическими аберрациями, приводящими к нарушению репарации ДНК и невозможности репликации стволовых клеток костного мозга. В случае приобретенной анемии под влиянием этиофакторов наблюдается активация Т-клеток, которые начинают продуцировать цитокины (интерферон-гамма, ФНО), поражающие клетки-предшественники гемопоэза. В стволовых клетках костного мозга повышается экспрессия генов, отвечающих за апоптоз и активизацию клеточной гибели. Основные клинические проявления обусловлены пангемоцитопенией – снижением в составе крови всех ее форменных элементов (эритроцитов, лейкоцитов, тромбоцитов).
Кроме различных этиологических вариантов (лекарственного, постгепатитного, идиопатического), различают острую (до 1 мес. течения), подострую (от 1 до 6 мес.) и хроническую (более 6 мес.) форму заболевания. Анемию, протекающую с избирательным угнетением эритропоэза, называют парциальной красноклеточной аплазией. На основании выраженности тромбо- и гранулоцитопении данная форма анемии подразделяется на 3 степени тяжести:
- очень тяжелую (тромбоцитов менее 20,0х109/л; гранулоцитов менее 0,2х109/л)
- тяжелую (тромбоцитов менее 20,0х109/л; гранулоцитов менее 0,5х109/л), по данным трепанобиопсии – низкая клеточность костного мозга (менее 30% от нормы)
- умеренную (тромбоцитов более 20,0х109/л; гранулоцитов более 0,5х109/л)
Поражение трех гемопоэтических ростков (эритро-, тромбоцито- и лейкопоэза) обусловливает развитие анемического и геморрагического синдромов, инфекционных осложнений. Дебют апластической анемии обычно происходит остро. Анемический синдром сопровождается общей слабостью и утомляемостью, бледностью кожи и видимых слизистых, шумом в ушах, головокружением, покалыванием в груди, одышкой при нагрузке.
Основным проявлением тромбоцитопении выступает геморрагический синдром. Больные отмечают появление петехий и экхимозов на коже, повышенную кровоточивость десен, спонтанные носовые кровотечения, меноррагии. Возможно возникновение гематурии, маточных и желудочно-кишечных кровотечений. Следствием лейкопении и агранулоцитоза служит частое развитие инфекционных процессов – стоматитов, пневмоний, инфекций кожи и мочевыводящих путей. Для апластической анемий нехарактерны похудание, лимфаденопатия, гепато- и спленомегалия – при этих признаках следует искать другую причину пангемоцитопении.
Врожденная апластическая анемия (синдром Фанкони) обычно развивается у детей в возрасте до 10 лет и кроме аплазии костного мозга характеризуется другими нарушениями: микроцефалией, гипоплазией почек, низкорослостью, аномалиями развития верхних конечностей (гипоплазией первой пястной и лучевой кости), гипоспадией, гиперпигментацией кожи, крайней степенью тугоухости и др. При наследственной анемии Эстрена-Дамешека отмечается тотальное поражение кроветворения и панцитопения при отсутствии врожденных аномалий развития. Для анемии Даймонда-Блекфена или парциальной красноклеточной аплазии характерно только снижение количества эритроцитов.
Летальный исход может быть обусловлен кровоизлияниями во внутренние органы, массивными кровотечениями, инфекционными осложнениями, анемической комой. Наиболее грозное из геморрагических осложнений – кровоизлияние в головной мозг (геморрагический инсульт). Больные склонны к частым и тяжело протекающим вирусным и бактериальным инфекциям респираторного тракта. Значительное или стремительное снижение уровня красных кровяных телец может привести к анемической коме. При молниеносной форме крайне быстро развиваются тяжелейшая анемия, иммунодефицит, коагулопатии, имеющие фатальные последствия.
Оценка гематологического статуса включает внимательный клинический осмотр и проведение тщательной лабораторной диагностики. При физикальном обследовании выявляется выраженная бледность или желтушность кожи, артериальная гипотония, тахикардия. Основу диагностического алгоритма составляет проведение общего и биохимического анализа крови, стернальной пункции, трепанобиопсии:
- Исследования крови. Для гемограммы при гипопластической анемии типичны эритро-, лейкоцито- и тромбоцитопения, нейтропения и относительный лимфоцитоз. Оценка биохимических показателей (печеночных проб, нефрологического комплекса, сывороточного железа, билирубина) информативна для исключения других анемий.
- Исследованиепунктата костного мозга. В миелограмме обнаруживается уменьшение количества миелокариоцитов и мегакариоцитов, снижение клеточности. В трепанобиоптате определяется замещение красного костного мозга жировым (желтым).
В рамках диагностического поиска апластическую анемию необходимо дифференцировать с мегабластными (В12-дефицитными, фолиеводефицитными) анемиями, идиопатической тромбоцитопенической пурпурой, пароксизмальной ночной гемоглобинурией, острым лейкозом.
Больные с апластической анемией госпитализируются в специализированные отделения. Им обеспечиваются полная изоляция и асептические условия для предупреждения возможных инфекционных осложнений. Проведение эффективного лечения является сложной проблемой практической гематологии. В зависимости от уровня цитопении используются следующие лечебные подходы:
- Иммуносупрессиная терапия. При умеренной цитопении назначается фармакотерапия, включающая комбинацию антитимоцитарного иммуноглобулина и циклоспорина А. Поддерживающая терапия проводится анаболическими стероидами или их сочетанием с циклоспоринами.
- Гемотрансфузии. В комплексе с курсом иммуносупрессивной терапии при низких показателях красной крови показано проведение заместительной гемотрансфузионной терапии (переливание тромбоцитов и эритроцитарной массы), плазмафереза. Данная мера не оказывает воздействия на патогенетическое звено заболевания, но позволяет восполнить дефицит кровяных телец, не вырабатываемых костным мозгом.
- Трансплантация КМ и СК. Наиболее благоприятные прогнозы на долгосрочную выживаемость оказывает выполнение аллогенной трансплантации костного мозга. Однако ввиду сложности подбора иммунологически совместимого донора процедура используется ограниченно. В качестве экспериментальных подходов рассматриваются аутологичные трансплантации, пересадка стволовых клеток периферической крови. Больным с нетяжелой формой анемии может быть показано проведение спленэктомии, эндоваскулярной окклюзии селезеночной артерии.
Прогноз определяется этиологической формой, тяжестью и остротой течения анемии. Критериями неблагоприятного исхода служат быстрое прогрессирование заболевания, тяжелый геморрагический синдром и инфекционные осложнения. После трансплантации костного мозга ремиссии удается достичь у 75–90% пациентов. Первичная профилактика данной разновидности анемии предполагает исключение влияния неблагоприятных внешнесредовых факторов, необоснованного применения лекарственных препаратов, предупреждение инфекционной заболеваемости и др. Пациентам с уже развившимся заболеванием требуется диспансерное наблюдение гематолога, систематическое обследование и длительная поддерживающая терапия.
источник
Отмечается эритропения, снижение содержания гемоглобина до 30-40 г/л, анизоцитоз, пойкилоцитоз, гипохромия, снижение ретикулоцитарного индекса, лейкопения за счет снижения количества нейтрофилов.
Патогномоничный признак железодефицита в костном мозге – резкое снижение местных запасов железа (снижается количество сидеробластов – клеток, содержащих гранулы железа). Отмечается умеренная гиперплазия эритроидного ростка. Гемоглобинизация клеток эритрона нарушена: увеличено количество базофильных и полихроматофильных форм, снижено количество оксифильных. По мере истощения запасов железа ферритин и гемосидерин исчезают и из костного мозга, и из других мест хранения.
Особую роль в диагностике играют биохимические показатели:
Уровень ферритина сыворотки снижен – менее 12 нг/мл.
Увеличена общая железосвязывающая способность.
Увеличена ненасыщенная, латентная железосвязывающая способность.
Резко снижено насыщение трансферрина.
Витамин В12 содержится в мясе, яйцах, сыре, молоке, почках, печени. Витамин В12 в продуктах связан с белком, от которого он освобождается в процессе кулинарной обработки и под воздействием протеолитических ферментов ЖКТ, после чего он связывается в желудке с внутренним фактором Кастла. Внутренний фактор – это гликопротеид, который образуется в фундальной части и в области тела желудка париетальными клетками. Комплекс «витамин В12 – фактор Кастла» связывается со специфическими рецепторами клеток подвздошной кишки. Витамин В12 всасывается медленно, за сутки может всосаться не более 6-9 мкг. Незначительная часть витамина В12 может всосаться без фактора Кастла.
Витамин В12 в плазме связывается с транскобаламинами. Известно три транскобаламина – I, II, III. Основное количество витамина переносится транскобаламином II. Этот белок синтезируется в печени.
Содержание витамина В12 в организме здорового человека составляет 2-5 мг, депо находится в печени. Запасы витамина В12 настолько велики, что их хватает на 3-6 лет.
Все клетки организма имеют рецепторы для комплекса «транскобаламин II – витамин В12».
У человека выявлены две метаболически активные формы витамина В12:
1. Метилкобаламин. Эта активная форма обеспечивает нормальное эритробластическое кроветворение и нормально протекающие метотические процессы в других клетках организма. В ходе реакции с метилкобаламином из уридинмонофосфата образуется тимидинмонофосфат, который включается в ДНК. Необходимым условием для течения этой реакции является участие активной коферментной формы фолиевой кислоты – 5, 10 – метилен-тетрагидрофолиевой кислоты.
Метилкобаламин участвует в метилировании гомоцистеина в метионин.
2. 5-дезоксиаденозилкобаламин. Этот метаболит необходим для нормального обмена жирных кислот. Так при распаде некоторых жирных кислот образуется пропионовая кислота. Распад пропионовой кислоты обеспечивается рядом ферментативных реакций, в ходе которых синтезируются производные янтарной кислоты, входящие в цикл Кребса. Одним из промежуточных продуктов является метилмалоновая кислота. Метилмалоновая кислота образуется также при распаде валина и метионина. 5-дезоксиаденозилкобаламин участвует в образовании янтарной кислоты из метилмалоновой. Предполагается участие аденозилкобаламина в биосинтезе миелина. При дефиците витамина В12 накапливается избыток пропионовой и метилмалоновой кислот. Они переходят в жирные кислоты с физиологическим нечетным числом атомов углерода в молекуле. Включаясь в липиды нейронов, они нарушают процессы миелинизации и вызывают жировую дистрофию клеток.
источник
Костный мозг — это один из важных кроветворных органов человеческого организма, от состояния которого во многом зависит и иммунитет, сопротивляемость различным заболеваниям. В костном мозге вырабатываются клетки крови, которые затем будут циркулировать по всему организму.
Любое нарушение работы костного мозга грозит отсутствием обновления крови, ведь выработка новых клеток и замена ими отмирающих, старых, может быть замедлена или существенно сокращена. Из-за этого кровь обедняется, и организм начинает страдать. Также сам костный мозг может быть заражен вредоносными раковыми клетками, которые могут быть разнесены током крови по всем органам человеческого организма, включая и этот важный орган.
Рак костного мозга – опасное онкологическое заболевание
В крупных и средних трубчатых, то есть полых костях организма человека содержится особая рыхлая ткань красноватого цвета. Это костный мозг, играющий огромную роль в здоровье человеческого организма. С возрастом человека красная ткань постепенно становится желтой, так как замещается жировыми клетками. С этим процессом постепенно приходит старость, организм все хуже и медленнее обновляется, возникают разнообразные заболевание костного мозга, симптомы которых вначале напоминают простуду с лихорадкой, а затем становятся более выраженными и характерными.
Так как в костном мозге формируются новые клетки, то имеется возможность возникновения их мутаций. Образующиеся дефектные клетки становятся причиной злокачественных новообразований, а также вытесняют нормально функционирующие здоровые клетки.
В результате человек заболевает опаснейшим из существующих заболеваний — раком.
Существует множество различных заболеваний костного мозга, из которых более других распространены следующие:
- апластическая анемия
- железодефицитная анемия
- группа заболеваний MDS
- группа заболеваний MPD
- лейкоз и многие другие
Анемии достаточно распространены и могут неплохо поддаваться терапии. Лейкоз, или рак белых кровяных телец, несет огромную угрозу не только здоровью, но и жизни пациента. Однако при современном уровне медицины и ранней диагностики есть возможность не только максимально продлить жизнь больному, но и полностью излечить заболевание.
Симптомы заболевания костного мозга зависят от стадии и формы болезни
Заболевание костного мозга, симптомы которого достаточно разнообразны, возникает по разным причинам. Огромное значение играет образ жизни человека, наличие вредных привычек, постоянные или острые стрессы, слабое здоровье и отягощенная наследственность. Особенный риск для здоровья несет наличие внутри семьи заболеваний кроветворных органов, а также наследственная склонность к онкологическим заболеваниям.
Первичный рак костного мозга диагностируется крайне редко. В основном онкологические заболевания этого органа являются метастазами, которые переносятся током крови из раковых опухолей в легких и эндокринных железах человека. Некоторые ученые считают, что есть возможность развития рака костного мозга из-за первичного очага в толстом кишечнике больного.
Симптомы заболевания достаточно характерны:
- Анемия.
- Сильная слабость, быстрая утомляемость.
- Снижение свертывания крови, что приводит к частым носовым и другим кровотечениям, а также к возникновению синяков и кровоподтеков на теле от малейшего прикосновения. У больного могут сильно кровоточить десны даже при полном здоровье зубов.
- Постоянная сонливость, человек не чувствует себя выспавшимся даже при длительном сне.
- Головные боли.
- Снижение зрения.
- Боли в кишечнике.
- Проблемы со стулом.
- Тошнота, рвота.
- Сильная жажда.
- Боли в мышцах ног.
- Боли в костях.
- Повышенная хрупкость костной ткани и как следствие — частые трещины и переломы при минимальном воздействии.
- Деформация позвоночника.
- Снижение массы тела.
- Склонность к инфекционным заболеваниям из-за очень слабого иммунитета.
Такие симптомы несколько расплывчаты и не указывают на конкретное заболевание или его локализацию, однако являются настоящим тревожным сигналом, требующим неотложного визита к врачу.
Больше информации о пересадке костного мозга можно узнать из видео:
Костный мозг – наиболее важный орган кроветворной системы, в котором образуются новые красные и некоторые белые кровяные клетки. Заболевания костного мозга на практике встречаются чаще, чем предполагалось ранее. Костный мозг чрезмерно чувствителен и может быть легко поврежден факторами окружающей среды. Наиболее частые заболевания – отек и злокачественные новообразования. Диагностика осуществляется с помощью инструментальных и лабораторных методов. Лечение во многом зависит от основного заболевания.
Вес тканей костного мозга во всём организме – около трёх килограмм, больше всего их в костях таза, грудины, рёбрах, черепе и позвоночнике
Кость – твердый элемент, который состоит из коллагеновых волокон, окруженных кристаллами гидроксиапатита. В полостях костей содержится костный мозг. Он отвечает за образование крови (так называемый гематопоэз). Каждую секунду в костном мозге их образуется около 2 миллионов. Красные кровяные клетки являются составной частью крови. С помощью гемоглобина эритроциты переносят кислород и углекислый газ в человеческом организме.
У взрослого человека масса костного мозга составляет около 2,6 кг. Кроме того, около 10% крови хранится в костном мозге. Если возникает быстрая кровопотеря, эти запасы используются для восполнения утраченных эритроцитов.
По цвету и функции различают 3 типа костного мозга:
- Красный: присутствует почти во всех костях у младенцев. Отвечает за образование крови.
- Желтый: жировая ткань с отдельными островками ретикулярной ткани. Костный мозг теряет кроветворную способность с возрастом. Однако если производство крови необходимо увеличить, красный костный мозг может расширяться.
- Белый: со временем желтый костный мозг наполняется водой, вытесняя жир. Полученный белый костный мозг не выполняет никаких физиологически значимых функций. Его также можно назвать «мертвым костным мозгом».
Клеточность костного мозга зависит от возраста. У новорожденных имеется 100% клеточность, тогда как у пожилых людей количество жировой ткани в значительной степени увеличено. Длинные кости в большинстве содержат только белый костный мозг. Нормальная клеточность колеблется в пределах между 30-70%. В патологических условиях может возникать гиперклеточность (более 70%) и гипоклеточность (до 30%).
Любые нарушения в работе костного мозга несут серьезную угрозу для всего организма, поэтому нельзя медлить с обращением к врачу, поскольку чаще всего прогноз для таких больных напрямую зависит от стадии заболевания, на которой начато лечение
Заболевания, которые возникают в костном мозге, чаще встречаются, чем ранее считалось в научном обществе. Костный мозг чрезвычайно чувствителен и может быть поврежден наследственными или экологическими воздействиями. Типичными заболеваниями, которые сопровождаются дисфункцией образования крови, являются опухоли или прием лекарственных средств.
Наиболее частые патологии костного мозга:
- Синдром первичного отека.
- Лейкемия.
- Миелодиспластический синдром.
- Остеомиелит (воспалительные процессы в костях).
- Лейкопения (уменьшение концентрации лейкоцитов).
- Анемия (малокровие).
Синдром первичного отека костного мозга (синдром транзиторного остеопороза) характеризуется болью и резким появлением остеопороза головки и других частей кости. Чаще всего патология встречается в тазобедренном суставе. У пациентов наблюдается нарушение работы тазобедренного сустава и сильная боль.
Впервые синдром был описан в 1959 году Кертис и Кинкейд у трех женщин во время беременности. Некоторые ученые классифицируют переходный остеопороз как обратимую первую стадию некроза костей. С другой стороны, существует согласие, что переходный остеопороз является самоограничивающим расстройством и не превращается в некроз кости.
Переходный остеопороз также может возникать вторично:
- В течение последнего триместра беременности и во время грудного вскармливания (после родов).
- При болезни Судека.
- При травматическом ушибе костного мозга.
У пациентов возникает острая и медленнорастущая боль в паху. В редких случаях боль появляется в ночное время суток. В большинстве случаев сгибание и внутреннее вращение конечности незначительно ограничены.
Анализы крови остаются нормальными при отсутствии воспалительных заболеваний (С-реактивный белок и скорость оседания эритроцитов). Ревматоидная серология также относительно нормальная.
Остеопения становится заметной на рентгенограмме только после потери 40% плотности костного мозга. Иногда через 4-6 недель может проявляться только очаговая остеопения (переходный остеопороз). Подтвердить диагноз обычно можно с помощью магнитно-резонансной томографии (МРТ).
Заболевание не передаётся другим людям, а может возникнуть вследствие длительной химио- или радиотерапии
Миелодиспластический синдром включает в себя ряд заболеваний костного мозга, при которых образуются недостаточно функционирующие клетки крови. Индивидуальные формы миелодиспластического синдрома различаются по своему течению, вариантам лечения и риску перехода в острый лейкоз. Лейкоз является одним из наиболее распространенных злокачественных заболеваний крови взрослых, особенно пациентов старше 60 лет.
Характерной особенностью миелодиспластических синдромов является дефицит нормальных эритроцитов, определенных лейкоцитов и тромбоцитов в крови. Хотя эти три типа клеток образуются из стволовых клеток в костном мозге у здоровых людей, процесс кроветворения нарушается у больных: стволовые клетки не созревают полностью, а зрелые не функционируют или образуются только в малых количествах. Иногда у клеток уменьшается продолжительность жизни.
По мере прогрессирования заболевания в костном мозге может образовываться больше незрелых клеток, которые вытесняют здоровые. Некоторые пациенты с миелодиспластическим синдромом подвержены риску развития острого миелоидного лейкоза.
Миелодиспластические синдромы не являются наследственными заболеваниями и, как и другие формы рака, не могут передаваться другим людям. Причинами миелодиспластического синдрома являются злокачественные генетические мутации гемопоэтических клеток в костном мозге, которые случайно возникают в течение жизни из-за наследственной предрасположенности или факторов окружающей среды. К факторам риска относят ионизирующее излучение и некоторые химические вещества. Примерно у 10% пациентов миелодиспластический синдром возникает вследствие длительной химио- или радиотерапии.
Ежегодно появляется от 4 до 5 новых случаев на 100 000 человек. Миелодиспластические синдромы являются одним из наиболее распространенных злокачественных заболеваний костного мозга. Хотя болезнь может возникать в любом возрасте, она чаще всего встречается у пациентов старше 60 лет. Около половины пациентов старше 75 лет страдают от заболевания. Мужчины несколько чаще заболевают, чем женщины.
Лейкемия – злокачественное заболевание, при котором клетки костного мозга мутируют и начинают бесконтрольно размножаться. Мужчины страдают от патологии чаще (57%), чем женщины (43%). У детей лейкемия является наиболее распространенным типом рака: 1/3 всех раковых больных детей страдает от этой болезни.
Классификация лейкемии основана на клетках-предшественниках белых кровяных клеток:
- Лимфатические лейкозы возникают из клеток-предшественников лимфоцитов.
- Миелоидные лейкозы возникают из клеток-предшественников гранулоцитов и редко – из эритроцитов и тромбоцитов.
Лейкемия может иметь острый или хронический курс:
- Острые формы возникают быстро и должны немедленно лечиться.
- Хронические формы имеют более медленный курс развития, чем острые.
Остеомиелит – воспалительное заболевание кости, которое начинается в костном мозге и затем распространяется на надкостницу. Наиболее распространенными причинами остеомиелита являются бактериальные заболевания.
Наиболее распространенной бактерией, вызывающей патологию, является золотистый стафилококк. В зависимости от того, как этот патоген попадает в костный мозг, развивается внутренняя или внешняя инфекция костного мозга. Гематогенный остеомиелит возникает, когда патогены от источника инфекции вне кости (например, тонзиллит) попадают в костный мозг через кровоток. Такое состояние возникает главным образом у детей и подростков. Экзогенный остеомиелит является результатом несчастных случаев (посттравматический) или хирургии (послеоперационный). Патогены проникают извне и распространяются в кости. Особенно уязвимыми являются люди с ослабленной иммунной системой или с хроническими заболеваниями – сахарным диабетом или атеросклерозом.
Признаки воспалительного поражения кости зависят от формы инфекции и возраста человека. Наиболее распространенные симптомы – лихорадка, боль, воспаление – ограничены пораженной остеомиелитом областью.
В некоторых случаях вместе с антибиотикотерапией необходимо хирургическим путем удалить мертвую или инфицированную ткань.
Прогноз остеомиелита зависит от того, что вызвало воспаление костного мозга и как быстро оно прогрессирует. Любая инфекция может быть острой и хронической. Острый остеомиелит можно полностью вылечить. Хронический с трудом поддается лечению.
Заболевание возникает, когда концентрация гемоглобина в крови опускается ниже нормы
Анемия является симптомом, который возникает вследствие различных заболеваний кроветворной системы. Независимо от причины анемии, при всех формах наблюдается недостаток кислорода в тканях. Причиной отсутствия кислорода могут быть разные факторы:
- Дефицит красного пигмента крови. Гемоглобин является важной молекулой, потому что он связывает кислород. Если имеется слишком мало гемоглобина, эритроциты связывают и переносят меньше кислорода.
- Отсутствие эритроцитов. Слишком малое их количество – значит, слишком мало гемоглобина, низкая способность связывать кислород.
- Уменьшение гематокрита. Гематокрит отражает долю эритроцитов в общем объеме крови. Оставшийся объем состоит из плазмы и других клеток крови – лейкоцитов и тромбоцитов.
По определению, анемия возникает, когда концентрации гемоглобина в крови (Hb) или гематокрита (HK) ниже нормального уровня. Нормальные значения гемоглобина и гематокрита в зависимости от половой принадлежности:
- Женщины: значение Hb ниже 12 г/дл, а HK – ниже 37%.
- Мужчины: значение Hb ниже 14 г/дл, а HK – ниже 41%.
Большинство цитотоксических препаратов – Хлорамбуцил, Мелфалан, Бусульфан, Тиогуанин, Циклофосфамид – повреждают костный мозг. Многие другие классы препаратов – сульфонамиды – влияют на образование лейкоцитов и тромбоцитов. Отмена лекарственной терапии приводит к полному выздоровлению пациента в течение 2-4 недель.
Классическими симптомами анемии являются: бледность кожи, увеличение слизистых оболочек, быстрая утомляемость, головная боль, головокружение, сердечная боль и одышка.
Лейкозные клетки размножаются бесконтрольно, поэтому вытесняют здоровые и распространяются по всему телу. Лейкемия может вызвать:
- Тенденцию к кровотечению: синяки, кровотечение из носа или десен, длительное кровотечение после травмы.
- Восприимчивость к инфекционным заболеваниям: лихорадку, воспаление кожи или слизистых оболочек.
Другая симптоматика заболеваний или разрушения костного мозга может включать увеличение лимфатических узлов, боль в печени и селезенке, а также в костях.
При проведении биопсии костного мозга берутся образцы костной ткани, а также небольшое количество жидкости и клеток
После сбора анамнеза следует физический осмотр. Врач исследует печень, селезенку и лимфатические узлы. Поскольку миелодиспластический синдром является прежде всего расстройством крови, также требуется провести анализ крови. Он помогает выявить другие возможные причины симптомов.
Образец крови больного обычно содержит меньше кровяных клеток. Различные типы клеток могут быть затронуты в разных комбинациях или отдельно. В основном при заболеваниях костного мозга уменьшается количество эритроцитов. Однако, в отличие от железодефицитной анемии, содержание железа в этих клетках не изменяется и даже не увеличивается. Иногда может снижаться концентрация лейкоцитов и тромбоцитов.
Миелодиспластический синдром может также влиять на содержание гемоглобина в эритроцитах в дополнение к изменению количества клеток. Эритроциты могут быть увеличены или уменьшены, а также иметь измененную форму и пониженное или повышенное содержание гемоглобина. Врач оценивает наличие более незрелых клеток-предшественников в анализах (исследовании) крови. Это также указывает на нарушение состава крови. Для того чтобы уточнить другие возможные причины симптомов, рекомендуется провести анализ на ферритин и параметры клеточного распада ЛДГА.
Биопсия костного мозга может подтвердить диагноз. У пациентов могут наблюдаться незрелые предшественники нормального кроветворения. При этом обследовании взрослому пациенту обычно дают успокоительное средство. Детям биопсию проводят под общей анестезией. Сначала область в подвздошном гребне или грудине дезинфицируется и покрывается стерильными полотенцами. Если вводится местный анестетик, пациент не будет чувствовать боли в области биопсии. Затем врач может использовать иглу для удаления клеток и ткани из костного мозга. Впоследствии клетки и ткани исследуются гистологическими методами в лаборатории.
Врач, который специализируется на заболеваниях крови, называется гематологом. Раковыми заболеваниями занимается онколог. Воспалительными заболеваниями суставов занимаются артрологи и ревматологи. При выписке направления к узкоспециализированному специалисту семейный терапевт сначала соберет анамнез и обнаружит первичные проявления угнетения костного мозга.
Методы лечения в первую очередь зависят от причинного заболевания. При малокровии вследствие кровопотери рекомендуется использовать препараты, которые стимулируют образование новых эритроцитов. В редких случаях требуется переливание крови. При железодефицитной анемии назначают витаминные препараты с железом и витамином В12.
Рак костного мозга требует комбинированного лечения: химио- и радиотерапии. В более тяжелых случаях может потребоваться высокодозная химиотерапия с трансплантацией костного мозга. При ревматологических заболеваниях может потребоваться лечение иммунодепрессантами или биологическая терапия.
источник
Одним из самых редких, но тяжелых заболеваний системы кровообращения считается апластическая анемия, симптомы, причины, методы лечения этого вида малокровия бывают различны. Все зависит от формы, вида и степени тяжести данной патологии.
Люди, далекие от медицины, зачастую не имеют представления о том, что такое апластическая анемия. Так называется расстройство кроветворной функции костного мозга, ведущее к снижению выработки кровяных клеток. Это приводит к серьезным патологическим изменениям во всех системах человеческого организма. Очень часто заболевание заканчивается летально.
Этиология апластической анемии до сих пор досконально не изучена. Поэтому окончательный список причин данного заболевания все еще полностью не составлен. На данный момент основными причинами апластического малокровия считаются:
- плохая экология в регионе проживания;
- ионизирующая радиация;
- постоянные контакты с опасными химическими веществами в течение долгого времени;
- отдельные инфекционные заболевания: гепатит, цитомегаловирус;
- разрушение костного мозга под воздействием некоторых медикаментозных средств при их длительном приеме в высоких дозах, особенно левомицетина, мышьяка, бензола, химических препаратов, противоопухолевых средств, антибиотиков;
- генетическая предрасположенность;
- беременность;
- патологии костного мозга;
- злоупотребление алкоголем.
Возникновение апластической анемии у детей сразу после рождения может быть спровоцировано такими причинами, как:
- врожденный сифилис;
- токсоплазмоз;
- генерализованный мегалоцитоз.
Часто у детей диагностируется идиопатическая апластическая анемия. В этом случае определить точную причину возникновения патологии не представляется сегодня возможным.
При гипопластической анемии наблюдается еще более серьезное расстройство кроветворной функции костного мозга. В целом гипопластические и апластические анемии вызывают сходные патологии органов и систем организма, имеют похожую симптоматику и лечатся примерно одинаково.
Костный мозг образуется губчатой структурой и располагается в глубине трубчатых костей. Посредством его структуры происходит выработка различных клеток крови: лейкоцитов, тромбоцитов, эритроцитов.
При апластической анемии, прежде всего, нарушается эритрогенез. Стимулировать этот процесс медикаментозными средствами невозможно. В этом случае может помочь только пересадка донорского костного мозга.
Помимо этого, апластичная анемия развивается на фоне уменьшения количества и изменения функций стволовых клеток.
Причиной этого становится нарушение микроокружения, клеточное или гуморальное воздействие иммунного характера, препятствующее нормальному функционированию стволовых клеток.
Апластическая анемия, симптомы которой часто незаметны, является серьезной патологией. В отдельных случаях недуг начинается в острой форме с быстрым нарастанием симптоматических проявлений. Развитие болезни может быстро прогрессировать, приводя к летальному исходу. Возможно также хроническое с периодическими ремиссиями и рецидивами протекание анемии.
Апластическая анемия симптомы имеет следующие: анемический, геморрагический и лейкоцитопенический синдромы. Для каждого из них характерны определенные признаки.
Анемический синдром (снижение уровня гемоглобина) возникает при нарушении формирования эритроцитов и сопровождается такими симптомами, как:
- общая слабость;
- сонливость;
- бессонница;
- раздражительность;
- одышка;
- шум в ушах;
- тахикардия;
- бледность кожных покровов;
- быстрая утомляемость.
Геморрагический синдром (повышение кровоточивости) вызван понижением уровня тромбоцитов в крови. Его сопровождают такие симптомы, как:
- петехии, т. е. точечные кровоизлияния на коже и слизистых оболочках и гематомы;
- плохая свертываемость крови;
- десневые и носовые кровотечения;
- появление крови в моче;
- обильные менструальные выделения у женщин.

Он сопровождается следующими симптомами:
- появление хронических очагов инфекции в различных органах и на поверхности кожи больного;
- учащение инфекционных заболеваний, протекающих длительно и со многими осложнениями;
- стоматит;
- внезапная гипертермия без видимых причин.
По форме апластическая и гипопластическая анемия может быть как врожденной, так и приобретенной.
После проведения анамнестической беседы врач проводит общий осмотр пациента. При этом обязательно применяются такие методы, как:
- выслушивание (аускультация) сердечных шумов;
- простукивание (перкуссия) живота, показывающая увеличение таких органов, как печень и селезенка;
- прощупывание (пальпация) для уточнения результатов перкуссии.
Для получения дополнительных сведений больному назначается:
- общий анализ крови;
- биохимический анализ крови;
- клинический анализ крови — гемограмма;
- забор мазка — биопсия, костного мозга;
- анализ мазка костного мозга, на основании которого составляется миелограмма.
При необходимости больному проводятся специальное тестирование, помогающее уточнить причину заболевания.
На основании всех полученных данных составляется точная клиническая картина заболевания, необходимая для определения курса лечения.
Когда больному диагностируется апластическая анемия, лечение проводится по 3 направлениям: этиологическому, симптоматическому и патогенетическому. Если известна точная причина возникновения заболевания, ее необходимо ликвидировать: прекратить контакт с токсинами, сменить лекарственные препараты, используемые для лечения других заболеваний и т. д.
Восстановлению кроветворного функционирования костного мозга помогают следующие препараты:
- кортикостероиды;
- андрогены;
- цитоксины;
- иммуносупрессоры.
Помимо медикаментозной терапии лечение апластической анемии проводится при помощи таких процедур, как переливание крови и ТКМ. Посредством переливания донорской крови организм больного частично обеспечивается недостающими кровяными клетками.
В особых случаях больным проводится трансплантация костного мозга. Костный мозг донора должен максимально соответствовать костному мозгу реципиента. Поэтому этот метод особенно эффективен, если у больного есть однояйцевый близнец. Процент выживаемости после трансплантации костного мозга выше у реципиентов более молодого возраста.

Основными факторами, влияющими на получение положительных эффектов, являются:
- Степень тяжести заболевания.
- Правильный выбор и хорошая переносимость лечения.
- Возраст больного. Легкая апластическая анемия у детей и молодых людей, не достигших 30-летнего возраста, полностью вылечивается чаще, чем у людей среднего и старшего возраста. При тяжелых формах болезни прогнозы не столь благоприятные.
Основным условием ремиссии и значительного продления жизненного срока является хорошая переносимость патогенетической терапии и успешное проведение трансплантации костного мозга.
Профилактика анемии различного вида может быть первичной или вторичной. Первичная профилактика предполагает исключение возможности развития данной патологии у относительно здорового человека. Этого можно добиться при помощи таких способов, как:
- ведение здорового образа жизни;
- правильное питание;
- постоянное укрепление иммунной системы;
- исключение или сведение к минимуму контакта с ионизирующими излучателями и токсичными веществами, вызывающими патологии костного мозга;
- контролированный прием лекарственных препаратов во время лечения других заболеваний;
- периодические визиты к терапевту и гематологу;
- полный отказ от употребления алкоголя и никотина.
Вторичная профилактика анемии проводится для замедления развития заболевания, избегания его осложнения сопутствующими патологиями. Для этого необходимо:
- аккуратное проведение лечения;
- постоянный контроль специалистов — гематолога и терапевта;
- тщательное контролирование больным своего состояния, немедленное посещение врача при появлении новых симптомов;
- постоянный прием поддерживающих препаратов в течение долгого времени.
Апластическая анемия — опасная патология, которую лечат годами. Только под наблюдением специалиста можно добиться стойкой ремиссии патологии. Самолечение в этом случае неприемлемо и может привести к плачевным последствиям.
источник