*Импакт фактор за 2017 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Статья посвящена патологии сердечно-сосудистой системы при акромегалии, особое внимание уделено кардиореспираторным нарушентям при акромегалии
Для цитирования. Ковалева Ю.А., Иловайская И.А., Древаль А.В., Старостина Е.Г. Кардиореспираторные нарушения при акромегалии // РМЖ. 2016. No 1. С. 19–24.
Акромегалия является тяжелым нейроэндокринным заболеванием, которое характеризуется избыточной секрецией соматотропного гормона (СТГ) и инсулиноподобного ростового фактора 1 (ИРФ-1) [1, 2].
Несмотря на то что акромегалия – достаточно редкое заболевание и, по данным скрининговых эпидемиологических исследований, наблюдается в 90–100 случаях на 1 млн населения [3], а также в настоящее время имеется достаточно широкий спектр методов ее лечения, тем не менее смертность при этом заболевании, по данным метаанализа Dekkers, превышает смертность в популяции на 32% [4], а продолжительность жизни при активной акромегалии снижается в среднем на 10 лет [5]. В первую очередь это обусловлено развитием сердечно-сосудистой и респираторной патологии, которая у больных акромегалией является основной причиной смерти: 60 и 25% соответственно [6, 7]. Так, если на момент заболевания акромегалией у больного имеется хроническая сердечная недостаточность со снижением систолической функции, то продолжительность жизни таких больных не превышает 15 лет [8]. Важную роль в развитии сердечной патологии при акромегалии играет избыточная секреция СТГ, в результате которой наступают структурные и функциональные изменения сердечной мышцы, а также провоспалительные и метаболические эффекты [9].
Кардиомиопатия. Среди сердечно-сосудистых структурных нарушений, наиболее часто встречающихся при акромегалии, отмечено развитие гипертрофии миокарда и интерстициального фиброза [9–12]. Концентрическая гипертрофия обоих желудочков сердца с последующим присоединением диастолической дисфункции, приводящая в итоге к сердечной недостаточности в отсутствие других факторов, называется акромегалической кардиомиопатией [6].
Морфологические изменения сердечной мышцы при акромегалической кардиомиопатии в первую очередь выражаются в увеличении массы миокарда левого желудочка [12], одним из механизмов развития которого служит увеличение размера кардиомиоцитов [13, 14]. В ряде исследований доказано, что ИРФ-1 увеличивает размер кардиомиоцитов [15] и активизирует синтез белка [16, 17] in vitro. При этом высказывается предположение, что СТГ напрямую может вызвать изменения в метаболизме кардиомиоцитов и стимулировать рост сердечной мышцы, осуществляя свое действие независимо от ИРФ-1 [18, 19].
Следовательно, СТГ может влиять на сердечно-сосудистую систему как напрямую, так и опосредованно через ИРФ-1, который, в свою очередь, оказывает на сердце эндокринное или аутокринное (паракринное) действие [20].
Важно отметить, что, кроме очевидного стимулирования роста кардиомиоцитов, СТГ и ИРФ–1 также могут моделировать структуру миокарда, предотвращая уменьшение количества кардиомиоцитов путем ингибирования апоптоза. Возможно, антиапоптозный эффект может служить для защиты миокарда в условиях ишемического повреждения [21, 22].
Ассоциированная с акромегалией гипертрофия миокарда является следствием сопутствующего ремоделирования сердца, в процессе которого важную роль играет внеклеточный матрикс. Показано, что ИРФ-1 стимулирует синтез коллагена фибробластами [23], а СТГ увеличивает скорость осаждения коллагена в сердце [24]. Однако нельзя исключить и вклад сопутствующей артериальной гипертензии (АГ), которая характерна для больных акромегалией [25].
Представляет интерес также вопрос, имеется ли у СТГ и ИРФ-1 прямое стимулирующее влияние на сократимость миокарда. Ответ на этот вопрос неоднозначен. Введение животным экзогенного СТГ in vivo приводило к стимуляции синтеза ИРФ-1, а последующее исследование кардиомиоцитов in vitro демонстрировало улучшение сократимости миокарда [26, 27]. В свою очередь, у карликовых крыс с дефицитом СТГ и ИРФ-1 было выявлено снижение сократимости миокарда [28, 29]. Для объяснения влияния СТГ и ИРФ-1 на увеличение сердечной сократимости было предложено по меньшей мере три возможных различных механизма: изменение содержания внутриклеточного Ca2+, повышение чувствительности миофиламентов к Ca2+ и изменение изоформ миозина [30].
Кардиомиопатия выявляется у большинства больных акромегалией. По данным Colao et al., распространенность различных проявлений кардиомиопатии при акромегалии в 3,3–14,2 раза выше, чем в популяции, а относительный риск развития гипертрофии левого желудочка почти в 12 раз выше, чем у лиц соответствующего пола и возраста без акромегалии. Основным фактором, определяющим риск развития кардиомиопатии, является длительность заболевания [31]. У больных с длительностью акромегалии до установления диагноза более 10 лет риск гипертрофии левого желудочка в 10раз выше, чем у больных с меньшей длительностью заболевания, что, вероятно, связано с продолжительностью воздействия высокого уровня СТГ и ИРФ-1 на кардиомиоциты, а также более высоким уровнем артериального давления у пациентов с большей длительностью заболевания. Однако структурные изменения миокарда возможны и до появления каких-либо клинических проявлений кардиальной дисфункции [32], вследствие чего гипертрофия левого желудочка может выявляться даже у молодых пациентов с небольшой длительностью заболевания. Наличие сопутствующих АГ и сахарного диабета (СД), как правило, усугубляет имеющиеся нарушения [33].
Артериальная гипертензия. Помимо стимулирования увеличения размеров сердца и, возможно, сократимости, СТГ и ИРФ-1 играют важную роль, влияя на сосудистый тонус и периферическое сопротивление. АГ встречается у 40–50% больных акромегалией [1, 5, 6, 34]. В развитие АГ вовлечен ряд механизмов действия СТГ и ИРФ-1, включая увеличение объема циркулирующей плазмы, изменения в ренин-ангиотензиновой системе, инсулинорезистентность и увеличение сосудистого сопротивления. Предполагается, что регулирующее влияние на периферическое сосудистое сопротивление оказывает как ИРФ-1, так и СТГ. Однако выявить различие между прямыми эффектами СТГ и эффектами, опосредованными ИРФ-1, достаточно трудно.
Ранняя диагностика АГ и своевременная эффективная гипотензивная терапия являются важными факторами профилактики необратимого поражения сердечно-сосудистой системы и сокращения продолжительности жизни вне зависимости от способа лечения основного заболевания [34]. Как правило, АГ при акромегалии протекает мягко и эффективно корректируется гипотензивными препаратами [35] при условии адекватного снижения уровней СТГ и ИРФ-1. То есть для успешного лечения АГ при акромегалии крайне важно добиваться контроля над основным заболеванием. Выбор гипотензивных препаратов проводится по тем же принципам, что и у больных АГ без акромегалии. Влияние различных методов лечения акромегалии на течение АГ в настоящее время недостаточно ясно [34].
Нарушения ритма и проводимости. Аритмия, выявляемая при проведении холтеровского мониторирования электрокардиограммы (фибрилляция предсердий, суправентрикулярная тахикардия и желудочковая аритмия), по данным Kahaly et al., возникает у больных акромегалией чаще, чем в общей популяции, – у 48 и 12% соответственно (особенно во время физической нагрузки) [36]. Возникновение желудочковых аритмий при этом коррелирует с массой миокарда левого желудочка и длительностью акромегалии. Herrmann et al. обнаружили, что поздний потенциал желудочков при активной акромегалии является ранним маркером кардиальных изменений [37]. Поздний низкоамплитудный потенциал, высокочастотные волны в терминальном отделе комплекса QRS на электрокардиограмме являются сильным предиктором возникновения аритмии у больных, перенесших острый инфаркт миокарда. Поздний потенциал желудочков определяется у 56% больных с активной акромегалией и лишь у 6% лиц в общей популяции (независимо от возраста, пола, длительности заболевания, индекса массы тела, гипертрофии левого желудочка). У больных акромегалией также значительно чаще выявляется увеличение продолжительности интервала QT, что служит одним из факторов риска развития жизнеугрожающих аритмий.
Клапанные нарушения. Выраженность клапанных нарушений зависит от степени гипертрофии миокарда [38]. Висследовании Colao et al. у пациентов с недавно диагностированной активной акромегалией и у тех больных, у которых после успешного хирургического лечения стадия заболевания не менее года контролировалась, отмечалась очень высокая распространенность морфологических и функциональных изменений митрального и аортального клапанов. Сохранение этих нарушений у больных с контролируемой стадией заболевания, вероятно, связано с сохранением гипертрофии миокарда левого желудочка, т. к. у пациентов без акромегалии также отмечена ассоциация гипертрофии миокарда левого желудочка с высокой частотой клапанных нарушений.
При этом в исследовании Colao et al. в когорте больных с активной акромегалией средний возраст был ниже, чем у пациентов в исследованиях Lindroos et al. [39] и Palmieri et al. [40], в то время как распространенность клапанных нарушений была значительно выше как при активной акромегалии (86%), так и при контролируемой стадии заболевания (73%). Выявлялись фиброз, фибросклероз, утолщение с кальцификацией (и без кальцификации) створок либо кольца митрального или аортального клапана. Кроме того, легкая митральная регургитация была выявлена у 26% больных в активной стадии и 27% больных в контролируемой стадии заболевания, тогда как регургитация аортального клапана от легкой степени до умеренной выявлялась у 31% больных с активной акромегалией и у 18% – с контролируемой. Таким образом, выявляемые клапанные нарушения легкой и умеренной степени редко были клинически значимыми [38]. При этом, учитывая сохранение высокой распространенности дисфункции митрального и аортального клапана у пациентов после достижения целевых значений СТГ и ИРФ-1, крайне актуальной следует признать необходимость тщательного контроля состояния сердца и клапанного аппарата, выполняя эхокардиографию на протяжении всего периода наблюдения за больным акромегалией. Это особенно актуально у пациентов со стойкой АГ, поскольку среди этих лиц отмечается особенно высокая распространенность гипертрофии левого желудочка и дисфункции клапанов.
Ишемическая болезнь сердца (ИБС). Вопрос о том, имеют ли больные акромегалией повышенный риск развития ИБС, до настоящего времени остается неясным, и результаты исследований дают на него неоднозначные ответы. Для оценки выраженности атеросклеротических изменений в некоторых исследованиях проводят определение толщины комплекса интима – медиа сонных артерий, в других – анализируют степень кальцификации коронарных артерий посредством электронно-лучевой компьютерной томографии. Для оценки суммарного сердечно-сосудистого риска наиболее часто применяют различные модели калькуляторов, созданные путем интерполяции результатов крупных эпидемиологических исследований. Оценка риска производится на основе анализа обычных факторов риска, таких как пол, возраст, масса миокарда левого желудочка, АГ, курение, СД и липидный статус. Примером такого калькулятора может служить Фремингемская шкала SCORE.
В настоящее время результаты ряда исследований доказывают, что у больных акромегалией, в сравнении с лицами соответствующего пола и возраста без акромегалии, гораздо чаще встречаются сердечно-сосудистые факторы риска: АГ – в 1,4–1,7 раза, аритмии – в 4,9раза, нарушение углеводного обмена – нарушенная толерантность к глюкозе (НТГ) и СД – в 2,6 и 2,1 раза соответственно [31, 41]. Вследствие этого коронарные факторы риска, такие как АГ, инсулинорезистентность, СД и дислипидемия, являются частыми осложнениями акромегалии, обеспечивая тем самым возможную связь между гиперсекрецией СТГ и ИБС [6, 42, 43].
Ряд исследований подтверждают это предположение. Так, в исследовании Berg et al. у больных с неконтролируемой акромегалией и длительным ее течением отмечено увеличение 10-летней вероятности развития ИБС в 1,5 раза в сравнении с общей популяцией, сопоставимой по полу и возрасту [41].
В другом проспективном исследовании кальцификация коронарных артерий у больных акромегалией была выявлена в 53% случаев, при этом 37% пациентов были отнесены к группе высокого сердечно-сосудистого риска, рассчитанного по Фремингемской шкале SCORE. Наряду с этим выявлено увеличение массы миокарда левого желудочка в 53% случаев, гиперхолестеринемия – в 63%, АГ – в 43%, СД либо НТГ – в 27% случаев. Степень кальцификации коронарных артерий коррелировала с индексом массы миокарда левого желудочка (р=0,02, R(2)=0,17) и длительностью акромегалии (р=0,004, R(2)=0,36). Эти результаты позволили сделать вывод о том, что длительность заболевания и, соответственно, воздействие сопутствующих метаболических расстройств оказывают влияние на степень кальцификации коронарных артерий у больных акромегалией, особенно при наличии высокого сердечно-сосудистого риска [44].
По данным поперечного (одномоментного) исследования Cannavo et al., в котором у больных акромегалией также рассчитывался сердечно-сосудистый риск по Фремингемской шкале SCORE и проводился скрининг на выявление кальцификации коронарных артерий с использованием компьютерной томографии, у 41% обследованных выявлен риск развития ИБС [45], причем у половины больных с высоким риском ИБС имелась кальцификация коронарных артерий. Достижение целевых значений СТГ и ИРФ-1 в ходе лечения акромегалии не влияло на выраженность атеросклероза. Также в исследовании были получены косвенные доказательства того, что отложения кальция могут прогрессировать не так быстро при акромегалии, как в общей популяции, что может быть связано с протективным эффектом избытка СТГ [45].
В исследовании Colao et al. у больных акромегалией в активной и контролируемой фазе заболевания наблюдалось значительное увеличение толщины интима – медиа общих сонных артерий, но при этом в них не было зафиксировано увеличения распространенности четко определенных атеросклеротических бляшек в сравнении с контрольной группой [46]. В исследовании Lie et al. при проведении аутопсии только у 11% больных акромегалией имелись морфологические изменения сердечно-сосудистой системы, что оказалось значительно ниже ожидаемого результата [47].
Ряд исследований вообще ставят под сомнение повышение риска ИБС у больных акромегалией или даже предполагают антиатерогенные эффекты избытка СТГ и ИРФ-1 [47, 48]. В одном из исследований показано, что толщина интима – медиа у пациентов с акромегалией была значительно меньше, чем в группе контроля, сопоставимой по возрасту, полу и наличию факторов риска[48]. В другом исследовании риск развития ИБС у больных с впервые диагностированной и нелеченной акромегалией в 84% случаев был низким и оставался стабильным после достижения клинико-лабораторной ремиссии. Выраженность кальцификации коронарных артерий была даже меньше, чем в контрольной группе, сопоставимой по полу, возрасту и основным факторам коронарного риска [49]. Кроме того, Otsuki et al. обнаружили, что пациенты без атеросклеротических изменений сонных артерий имели более высокую плазменную концентрацию ИРФ-1, чем те, у кого были атеросклеротические изменения [48]. Авторы предположили, что повышенный уровень ИРФ-1 препятствует развитию атеросклеротического процесса, по крайней мере у некоторых пациентов с акромегалией. В основе этого предположительно может лежать механизм регулирования местного кровотока через ИРФ-1, который является медиатором продукции оксида азота сосудистым эндотелием [50]. Тем не менее прямых доказательств этой гипотезы пока нет.
Причинами несовпадения результатов, полученных в этих исследованиях, могут быть, во-первых, отсутствие в большинстве из них однородных и крупных когорт больных акромегалией, что затрудняет интерпретацию данных, во-вторых, отсутствие эпидемиологических данных в общей популяции, сопоставимой по полу и возрасту. В более позднем исследовании, где изучались факторы сердечно-сосудистого риска у больных акромегалией, в котором была сформирована достаточно однородная группа больных с активной акромегалией и было проведено сравнение с популяционными эпидемиологическими данными, выявлено увеличение частоты развития АГ в 1,5 раза, СД – в 2,9 раза, повышение уровня триглицеридов, снижение уровней холестерина липопротеидов высокой плотности (ХС-ЛПВП) и холестерина липопротеидов низкой плотности (ХС-ЛПНП). В результате расчет факторов сердечно-сосудистого риска показал, что общий процент пациентов с акромегалией имел среднюю или высокую степень риска, а 10–летняя вероятность развития ИБС была в 1,5 аза выше, чем в общей популяции, особенно выраженное повышение риска отмечено у женщин. При этом нормализация ИРФ-1 сопровождалась снижением риска [41]. Но и в этом исследовании группа больных акромегалией хоть и была достаточно однородной, но имела ряд особенностей. С одной стороны, это были больные, рефрактерные к получаемой терапии (аналоги соматостатина, хирургическое и лучевое лечение), с другой стороны, заболевание у них протекало длительно, что само по себе коррелирует с более высокой степенью кальцификации коронарных артерий [51]. Следовательно, эта группа больных вряд ли объективно отражала закономерности атеросклеротического процесса, свойственные всем больным с активной акромегалией.
Таким образом, информация о коронарной патологии у больных акромегалией несколько противоречива, и пока окончательно не решен вопрос о том, есть ли у пациентов с акромегалией повышенный риск развития ИБС. У больных акромегалией может иметь место сочетание ишемического и неишемического поражения сердца, при этом интерес вызывает изучение вклада атеросклеротического и неатеросклеротического механизма в развитие кардиальной патологии у таких больных. Следовательно, необходимы дальнейшие, хорошо спланированные проспективные исследования с целью выяснить, увеличивает ли акромегалия риск развития ИБС.
Нарушение дыхания во сне у больных акромегалией. Нарушение дыхания во сне является серьезной проблемой как в общей популяции, так и у больных акромегалией.
Наиболее неблагоприятными последствиями остановок дыхания во сне являются сердечно-сосудистые осложнения и ухудшение качества жизни пациентов[52], что приводит к значительному увеличению смертности. В настоящее время существуют убедительные доказательства связи между АГ [53, 54], нарушениями ритма и проводимости [55], ИБС [56], увеличением сердечно-сосудистой смертности [57] и апноэ сна.
Синдром обструктивного апноэ сна (СОАС) служит причиной развития сердечно-сосудистых заболеваний (ССЗ) вследствие ряда патофизиологических механизмов. СОАС является уникальной формой гипоксии, характеризующейся, кроме фрагментации сна, перепадами внутригрудного давления и рецидивирующей гиперкапнией, повторяющимися короткими циклами десатурации с последующим быстрым периодом реоксигенации. Данное состояние называется прерывистой гипоксией и играет ключевую роль в развитии ССЗ. Патогенез данного состояния, вероятно, многофакторный, но основные, наиболее важные механизмы включают гиперактивность симпатической нервной системы, системное воспаление и окислительный стресс, приводящий к дисфункции эндотелия и, возможно, метаболическим нарушениям.
По данным различных авторов, распространенность нарушения дыхания во сне при акромегалии варьирует от 19 до 81%, такой разброс данных связан с особенностями исследования и критериями диагностики [58]. Учитывая, что эти показатели отличаются от распространенности апноэ во сне среди населения в целом (2и 4% для женщин и мужчин соответственно) [59], следует предположить, что акромегалия является фактором риска развития СОАС.
В структуре нарушения дыхания во сне у больных акромегалией наиболее часто встречается СОАС, при этом распространенность центрального апноэ более высокая в сравнении с таковым в общей популяции. Основными причинами возникновения обструктивной формы апноэ являются черепно-лицевая деформация, гипертрофия мягких тканей глотки, слизистых оболочек, макроглоссия, утолщение верхних дыхательных путей и бронхов. В патогенезе центрального апноэ сна, вероятно, основное влияние принадлежит ингибирующему действию на дыхательный центр повышенного уровня СТГ и ИРФ-1 или повышенному уровню соматостатина [60].
В ряде исследований отмечаются высокая частота нарушения дыхания во сне у больных акромегалией в активной фазе заболевания и положительная корреляция с уровнем СТГ и ИРФ-1 [61, 62, 63]. С другой стороны, в исследовании Grunstein et al. с активностью акромегалии коррелировало только центральное апноэ и не было отмечено связи между активностью заболевания и степенью дыхательных нарушений [60]. В разных исследованиях факторами риска развития нарушений дыхания во сне у больных акромегалией названы возраст, мужской пол, повышенный индекс массы тела, длительность заболевания, окружность шеи, размер языка.
Таким образом, корреляция между концентрацией СТГ и ИРФ-1 в крови и тяжестью нарушения дыхания во сне является спорным вопросом, но высокий риск сердечно-сосудистой патологии у больных акромегалией может быть, по крайней мере частично, обусловлен наличием у них высокой частоты развития апноэ сна, которое можно считать независимым фактором риска сердечно-сосудистой заболеваемости.
Лечение акромегалии и кардиореспираторные нарушения. Лечение больных акромегалией включает хирургические, фармакологические методы и лучевую терапию. Хирургический способ лечения заключается в транссфеноидальной аденомэктомии. Из медикаментозных средств наиболее часто используются аналоги соматостатина длительного действия, агонисты дофамина и антагонисты рецепторов гормона роста. В резистентных случаях в качестве дополнительной опции может быть использована лучевая терапия.
Лечение акромегалии, как правило, уменьшает проявления гипертрофии миокарда и сердечной дисфункции, если оно начато на начальном и промежуточном этапах развития сердечной патологии [34]. Метаанализ 18 исследований, изучавших влияние аналогов соматостатина на сердечно-сосудистую систему у больных акромегалией, подтверждает, что данная терапия при достижении строгого контроля уровня СТГ и ИРФ-1 ассоциирована со значительным положительным влиянием на морфологические и функциональные параметры гемодинамики, такие как ЧСС, индекс массы миокарда левого желудочка, толщина межжелудочковой перегородки, толщина задней стенки левого желудочка, а также с увеличением толерантности к физической нагрузке[64]. Степень улучшения зависит от возраста, наличия АГ и длительности заболевания [34].
В обзоре Colao et al. показано, что подавление секреции СТГ и ИРФ-1 вследствие хирургического лечения или применения аналогов соматостатина эффективно снижает гипертрофию левого желудочка с последующим улучшением функции сердца [65]. Назначение аналогов соматостатина как терапии первой линии приводит к более выраженному улучшению сердечно-сосудистых исходов в сравнении с первоначальным применением хирургического лечения. Дополнительный положительный эффект в отношении состояния сердечно-сосудистой системы отмечен при назначении аналогов соматостатина в сочетании с оперативным вмешательством. У пациентов, у которых не был достигнут полный биохимический контроль, также отмечено улучшение сердечной деятельности на фоне лечения аналогами соматостатина. При этом было продемонстрировано, что лечение пегвисомантом приводит к уменьшению гипертрофии левого желудочка и улучшению как диастолической, так и систолической функции.
Данные, касающиеся влияния агониста дофамина каберголина на сердечно-сосудистую систему, противоречивы. В обзоре Colao et al. показано, что лечение акромегалии каберголином приводит к увеличению частоты клапанных нарушений [65], тогда как, по данным Maione et al., назначение каберголина не было ассоциировано с повышенным риском развития регургитации на клапанах сердца [66].
Что касается влияния лечения акромегалии на нарушение дыхания во сне, то в настоящее время результаты, полученные в отношении обратимости СОАС после хирургического или медикаментозного лечения, не однозначны. Некоторые исследования показали значительное улучшение или излечение СОАС после аденом-эктомии [67, 68], в то время как в других исследованиях после хирургического лечения акромегалии сохранялись стойкие нарушения дыхания во сне [69] либо отмечалось незначительное улучшение, несмотря на достижение контролируемой стадии акромегалии [70]. Отсутствие явного улучшения в данном случае может быть объяснено необратимостью краниофасциальной деформации и изменениями в верхних дыхательных путях. Учитывая данные исследований, показавших связь между апноэ сна и гормональной активностью опухоли, можно предположить, что использование аналогов соматостатина длительного действия приводит к снижению частоты развития апноэ сна и связанных с ним осложнений благодаря уменьшению излишней секреторной активности опухоли, а также отека мягких тканей глотки и корня языка. В настоящее время имеются сообщения об уменьшении СОАС во время лечения аналогами соматостатина [71], но при этом достижение контролируемой стадии заболевания не всегда сопровождается нормализацией дыхания во сне [71, 72].
Принимая во внимание изложенное, следует у каждого больного на момент установления диагноза акромегалии проводить тщательную оценку имеющейся симптоматики (например, используя шкалу Epworth), а при необходимости – инструментальное исследование с целью исключения апноэ сна. Несмотря на успешное лечение основного заболевания, у ряда больных не происходит значительного уменьшения проявлений апноэ сна, что делает актуальной диагностику апноэ и после лечения акромегалии [34]. Все усилия должны быть направлены на строгое соблюдение предписанных процедур, в т. ч. проведение СРАР (Continuous Positive Airway Pressure – постоянное положительное давление в дыхательных путях) терапии, включать консультации челюстно-лицевых хирургов, а при необходимости и хирургическое вмешательство. Электрокардиография, эхокардиография, измерение артериального давления, а также тестирование на апноэ сна должны быть включены в план лечения и наблюдения за больными акромегалией как обязательные диагностические исследования [34].
источник
Акромегалия – это редкое гормональное заболевание, которое развивается из-за повышенной выработки гормона роста гипофизом человека.
Почти всегда причиной акромегалии является доброкачественная опухоль гипофиза. Избыток гормона роста вызывает утолщение кожи, усиленный рост скелета и органов, укрупнение черт лица.
Акромегалия возникает во взрослом возрасте, обычно после 30 лет. У растущих детей избыток гормона роста может вызвать состояние, называемое гигантизмом. Оно приводит к аномально высокому росту.
Из-за того что акромегалия встречается редко и физические изменения развиваются очень медленно, эту болезнь зачастую не распознают. В то же время невылеченная акромегалия может приводить к серьезным заболеваниям и преждевременной смерти. Существующие сегодня методы лечения позволяют снизить риск осложнений и существенно уменьшить выраженность симптомов.
Источником выработки гормона роста почти всегда является гипофиз – маленькая структура, расположенная у основания головного мозга позади носа. Гормон роста – это лишь один из нескольких важных гормонов, которые производит гипофиз.
Гормон роста играет важную роль в регенерации и росте костей и других тканей, он стимулирует выработку в печени другого гормона, который называется инсулиноподобный ростовой фактор (IGF-1).
У взрослых опухоли почти всегда являются причиной избыточной выработки гормона роста.
Опухоли могут быть разными:
1. Опухоли гипофиза. Большинство случаев акромегалии вызвано доброкачественной опухолью (аденомой) гипофиза. Кроме повышенной выработки гормона, эти опухоли могут сдавливать соседние мозговые структуры, вызывая головные боли, нарушение зрения и другие неврологические симптомы.
2. Опухоли других органов. В редких случаях доброкачественные опухоли или рак в других частях тела (легкие, поджелудочная железа, надпочечники) становятся причиной акромегалии. Эти опухоли могут производить гормон роста наряду с гипофизом. В других случаях они вырабатывают особый рилизинг-гормон, который стимулирует сам гипофиз.
Одним из наиболее частых симптомов акромегалии является увеличение рук и ступней. Человек может отмечать, что ему больше не подходит обручальное кольцо или любимая обувь. Также могут быть жалобы на боль в спине и суставах.
Акромегалия может вызывать постепенные изменения черт лица, такие как увеличение носа, утолщение губ, расширение щелей между зубами, выступание челюсти. Акромегалия очень медленно прогрессирует, поэтому симптомы болезни могут оставаться незамеченными до 10 лет и более. Иногда люди случайно замечают изменения в своем облике по сравнению со старыми фотографиями.
Типичные признаки и симптомы акромегалии включают:
• Увеличение рук и ступней.
• Укрупнение черт лица.
• Выпячивание нижней челюсти.
• Толстая и жирная кожа.
• Сильный запах пота и кожи.
• Маленькие кожные наросты.
• Утомляемость и мышечная слабость.
• Глубокий и грубый голос из-за увеличения голосовых связок и синусов.
• Сильный храп и ночные пробуждения из-за нарушения дыхания во сне (апноэ сна).
• Нарушения зрения (двоение в глазах, нечеткое зрение).
• Головные боли.
• Увеличенный язык.
• Боль в спине.
• Боль и ограничение подвижности суставов.
• Нарушения менструального цикла у женщин.
• Пониженное либидо и эректильная дисфункция.
• Увеличение печени, сердца, почек, селезенки и других органов.
• Бочкообразная грудная клетка.
Если вы замечаете любые постепенно прогрессирующие изменения в своей внешности, будет не лишним проконсультироваться с врачом. Акромегалия развивается медленно, даже члены вашей семьи могут не заметить физических изменений, постепенно привыкнув к вашему облику. В то же время быстрая постановка диагноза очень важна, потому что за этой болезнью может стоять опухоль мозга или рак в других частях тела. Без лечения акромегалия может приводить к серьезным, необратимым последствиям.
Первым шагом при выявлении акромегалии будет внимательное изучение истории болезни и физический осмотр.
Затем врач может порекомендовать такие исследования:
1. Измерение уровня инсулиноподобного ростового фактора. Как уже говорилось, гормон роста стимулирует продукцию IGF-1 в печени. Именно это можно определить при помощи анализов крови.
2. Измерение уровня гормона роста до и после приема глюкозы. При этом тесте врач будет брать анализы крови до и после употребления богатого сахаром (глюкозой) напитка. В норме прием глюкозы приводит к падению уровня гормона роста. Но если организм вырабатывает слишком много этого гормона, то даже после теста с глюкозой его уровень останется повышенным.
3. Визуализация. После подтверждения акромегалии предыдущими тестами врач может порекомендовать магнитно-резонансную томографию (МРТ) или компьютерную томографию (КТ) мозга, чтобы выявить опухоль гипофиза. Если причиной является другая опухоль, то будут назначены дополнительные исследования.
Врачи лечат акромегалию, вызванную опухолью гипофиза, хирургическими методами, облучением и медикаментами. План лечения зависит от возраста больного, размера и расположения опухоли, общего состояния здоровья. Целью терапии является возвращение уровня гормона роста и инсулиноподобного ростового фактора к норме, а также предотвращение серьезных осложнений. При успешном лечении разрастание мягких тканей может постепенно пойти на убыль. Лечение не способно обратить вспять увеличение костей, но оно предотвратит их дальнейший рост.
Если акромегалия вызвана опухолью вне гипофиза, то лечение будет направлено на устранение этой опухоли – практически это будет лечение определенного вида рака.
Врач может удалить опухоль гипофиза методом транссфеноидальной хирургии. При этой процедуре, названной в честь одного из синусов – воздушных карманов позади носа, хирург удалит опухоль через минимальный разрез в задней стенке носа.
Транссфеноидальная хирургия сложна, поэтому очень важно, чтобы операцию проводили опытные хирурги. Исследования показывают, что у более опытных хирургов исход таких операций намного лучше.
Успешное удаление опухоли может быстро вернуть уровень гормонов к норме и облегчит давление, которое опухоль оказывала на мозговые структуры. Но даже самый лучший хирург не в состоянии удалить все клетки опухоли, а неполное удаление иногда приводит к тому, что уровень гормонов после операции остается высоким. Поэтому после операции может быть назначено облучение или химиотерапия.
Если оперировать опухоль невозможно или очень рискованно, то врач может назначить медикаментозное лечение. Больному может понадобиться прием некоторых препаратов до конца жизни.
Лекарства, используемые при лечении акромегалии, включают:
1. Аналоги соматостатина. Препараты окреотид (Сандостатин) и ланреотид (Соматулин Депо) являются синтетическими аналогами соматостатина – вещества, которое подавляет выработку гормона роста. Эти препараты могут понижать уровень гормона роста в крови, а со временем могут и сокращать размеры опухоли.
2. Антагонисты рецепторов гормона роста. Препарат пегвизомант (Сомаверт) блокирует эффекты гормона роста на клетки организма. Этот препарат вводят ежедневно в виде подкожных инъекций. Сомаверт нормализует уровень инсулиноподобного ростового фактора и облегчает симптомы у большинства больных акромегалией, но не уменьшает размеры опухоли гипофиза.
3. Агонисты дофамина. Препараты карбеголин (Достинекс) и бромокриптин по-другому действуют на выработку гормона, а также уменьшают размер опухоли. Оба препарата могут приниматься в виде таблеток, но они эффективны у гораздо меньшего количества больных, чем аналоги соматостатина и антагонисты рецепторов гормона роста. В США агонисты дофамина иногда назначают параллельно с аналогами соматостатина.
Врач может порекомендовать лучевую терапию для уничтожения клеток опухоли, которые остались после операции. Этот метод применяют и самостоятельно, если медикаменты не помогают, а операция по определенной причине невозможна. Но могут потребоваться годы и многочисленные курсы лечения, чтобы облучение принесло результат.
Отдельно стоит отметить метод стереотактической радиохирургии, при котором опухоль облучают одновременно из нескольких направлений точно сфокусированными лучами. Этот метод дает возможность доставить высокую дозу радиации прямо в опухоль, ограничив при этом облучение окружающих здоровых тканей. Недостатком является дороговизна этого метода. Даже в Соединенных Штатах только ограниченное число медицинских центров может позволить себе такие процедуры.
После лечения акромегалии больному потребуется постоянное наблюдение и периодическая сдача анализов. Это наблюдение будет длиться всю оставшуюся жизнь, поскольку опухоль может в любое время начать вновь расти.
Кроме того, акромегалия статистически связана с риском предраковых полипов кишечника, поэтому время от времени больному нужно делать колоноскопию, чтобы вовремя обнаружить проблему.
Прогрессирование акромегалии может привести к таким осложнениям:
• Высокое артериальное давление (гипертония).
• Заболевания сердца (кардиомиопатия).
• Поражение суставов (артрит).
• Сахарный диабет.
• Полипы кишечника.
• Обструктивное апноэ сна.
• Запястный туннельный синдром.
• Подавление выработки других гормонов гипофиза.
• Доброкачественные опухоли матки.
• Сжатие спинного мозга.
• Потеря зрения.
Раннее лечение акромегалии может предотвратить эти осложнения. При отсутствии лечения болезнь может приводить к инвалидности и преждевременной смерти.
Константин Моканов: магистр фармации и профессиональный медицинский переводчик
источник
Акромегалия — патологическое увеличение отдельных частей тела, связанное с повышенной выработкой соматотропного гормона (гормона роста) передней долей гипофиза в результате ее опухолевого поражения. Возникает у взрослых людей и проявляется укрупнением черт лица (носа, ушей, губ, нижней челюсти), увеличением стоп и кистей рук, постоянными головными болями и болями в суставах, нарушением половой и репродуктивной функций у мужчин и женщин. Повышенный уровень гормона роста в крови вызывает раннюю смертность от онкологических, легочных, сердечно-сосудистых заболеваний.
Акромегалия — патологическое увеличение отдельных частей тела, связанное с повышенной выработкой соматотропного гормона (гормона роста) передней долей гипофиза в результате ее опухолевого поражения. Возникает у взрослых людей и проявляется укрупнением черт лица (носа, ушей, губ, нижней челюсти), увеличением стоп и кистей рук, постоянными головными болями и болями в суставах, нарушением половой и репродуктивной функций у мужчин и женщин. Повышенный уровень гормона роста в крови вызывает раннюю смертность от онкологических, легочных, сердечно-сосудистых заболеваний.
Акромегалия начинает развиваться после прекращения роста организма. Постепенно, на протяжении длительного периода, нарастает симптоматика, и происходят изменения внешности. В среднем акромегалия диагностируется спустя 7 лет от действительного начала болезни. Заболевание одинаково встречается среди женщин и мужчин, преимущественно в возрасте 40-60 лет. Акромегалия является редкой эндокринной патологией и наблюдается у 40 человек на 1 млн. населения.
Секреция соматотропного гормона (соматотропина, СТГ) осуществляется гипофизом. В детском возрасте соматотропный гормон управляет процессами формирования костно-мышечного скелета и линейного роста, а у взрослых осуществляет контроль за углеводным, жировым, водно-солевым обменом веществ. Секреция гормона роста регулируется гипоталамусом, вырабатывающим специальные нейросекреты: соматолиберин (стимулирует выработку СТГ) и соматостатин (тормозит выработку СТГ).
В норме содержание соматотропина в крови колеблется в течение суток, достигая своего максимума в предутренние часы. У пациентов с акромегалией наблюдается не только повышение концентрации СТГ в крови, но и нарушение нормального ритма его секреции. Клетки передней доли гипофиза в силу различных причин не подчиняются регулирующему влиянию гипоталамуса и начинают активно размножаться. Разрастание клеток гипофиза приводит к возникновению доброкачественной железистой опухоли — аденомы гипофиза, усиленно продуцирующей соматотропин. Размеры аденомы могут достигать нескольких сантиметров и превышать размер самой железы, сдавливая и разрушая нормальные клетки гипофиза.
У 45%пациентов с акромегалией опухоли гипофиза вырабатывают только соматотропин, еще у 30% дополнительно продуцируют пролактин, у остальных 25%, кроме того, секретируют лютеинизирующий, фолликулостимулирующий, тиреотропный гормоны, А-субъединицу. В 99 % именно аденома гипофиза служит причиной акромегалии. Факторами, вызывающими развитие аденомы гипофиза, служат черепно-мозговые травмы, опухоли гипоталамуса, хроническое воспаление пазух носа (синусит). Определенная роль в развитии акромегалии отводится наследственности, так как заболевание чаще наблюдается у родственников.
В детском и подростковом возрасте на фоне продолжающегося роста хроническая гиперсекреция СТГ вызывает гигантизм, характеризующийся чрезмерным, но относительно пропорциональным увеличением костей, органов и мягких тканей. С завершением физиологического роста и окостенения скелета развиваются нарушения по типу акромегалии — диспропорциональное утолщение костей, увеличение внутренних органов и характерные нарушения обмена веществ. При акромегалии происходит гипертрофия паренхимы и стромы внутренних органов: сердца, легких, поджелудочной железы, печени, селезенки, кишечника. Разрастание соединительной ткани ведет к склеротическим изменениям этих органов, повышается угроза развития доброкачественных и злокачественных опухолей, в т. ч. эндокринных.
Акромегалия характеризуется длительным, многолетним течением. В зависимости от выраженности симптоматики в развитии акромегалии различают несколько этапов:
- Стадию преакромегалии – появляются начальные, слабо выраженные признаки заболевания. На этой стадии акромегалия диагностируется редко, исключительно по показателям уровня соматотропного гормона в крови и данным КТ головного мозга.
- Гипертрофическую стадию – наблюдается ярко выраженная симптоматика акромегалии.
- Опухолевую стадию – на первый план выходят симптомы сдавления расположенных рядом отделов головного мозга (повышение внутричерепного давления, нервные и глазные нарушения).
- Стадию кахексии – истощение как исход акромегалии.
Проявления акромегалии могут быть обусловлены избытком соматотропина или воздействием аденомы гипофиза на зрительные нервы и близлежащие структуры головного мозга.
Избыток гормона роста вызывает характерные изменения внешности пациентов с акромегалией: увеличение нижней челюсти, скуловых костей, надбровных дуг, гипертрофию губ, носа, ушей, приводящих к огрубению черт лица. С увеличением нижней челюсти происходит расхождение межзубных промежутков и изменение прикуса. Отмечается увеличение языка (макроглоссия), на котором отпечатываются следы зубов. За счет гипертрофии языка, гортани и голосовых связок меняется голос — становится низким и хрипловатым. Изменения во внешности при акромегалии происходят постепенно, незаметно для самого пациента. Наблюдается утолщение пальцев, увеличение в размерах черепа, стоп и кистей настолько, что пациент вынужден приобретать головные уборы, обувь и перчатки на несколько размеров больше, чем ранее.
При акромегалии происходит деформация скелета: искривляется позвоночник, увеличивается грудная клетка в переднезаднем размере, приобретая бочкообразную форму, расширяются межреберные промежутки. Развивающаяся гипертрофия соединительной и хрящевой тканей вызывает деформацию и ограничение подвижности суставов, артралгии.
При акромегалии отмечается избыточная потливость и салоотделение, обусловленные увеличением количества и повышенной активностью потовых и сальных желез. Кожа у пациентов с акромегалией уплотняется, утолщается, собирается в глубокие складки, особенно в волосистой части головы.
При акромегалии происходит увеличение в размерах мышц и внутренних органов (сердца, печени, почек) с постепенной нарастающей дистрофией мышечных волокон. Пациентов начинает беспокоить слабость, утомляемость, прогрессирующее снижение работоспособности. Развивается гипертрофия миокарда, которая сменяется затем миокардиодистрофией и нарастающей сердечной недостаточностью. У трети пациентов с акромегалией наблюдается артериальная гипертензия, почти у 90% — развивается синдром сонных апноэ, связанный с гипертрофией мягких тканей верхних дыхательных путей и нарушением работы дыхательного центра.
При акромегалии страдает половая функция. У большинства женщин при избытке пролактина и дефиците гонадотропинов развиваются нарушения менструального цикла и бесплодие, появляется галакторея — выделение из сосков молока, не вызванное беременностью и родами. У 30% мужчин происходит снижение половой потенции. Гипосекреция антидиуретического гормона при акромегалии проявляется развитием несахарного диабета.
По мере увеличения опухоли гипофиза и сдавления нервов и тканей возникает повышение внутричерепного давления, светобоязнь, двоение в глазах, боли в области скул и лба, головокружение, рвота, снижение слуха и обоняния, онемение конечностей. У пациентов, страдающих акромегалией, повышается риск развития опухолей щитовидной железы, органов желудочно-кишечного тракта, матки.
Течение акромегалии сопровождается развитием осложнений со стороны практически всех органов. Наиболее часто у пациентов с акромегалией встречается гипертрофия сердца, миокардиодистрофия, артериальная гипертония, сердечная недостаточность. Более чем у трети пациентов развивается сахарный диабет, наблюдаются дистрофия печени и эмфизема легких.
Гиперпродукция факторов роста при акромегалии приводит к развитию опухолей различных органов, как доброкачественных, так и злокачественных. Акромегалии часто сопутствуют диффузный или узловой зоб, фиброзно-кистозная мастопатия, аденоматозная гиперплазия надпочечников, поликистоз яичников, миома матки, полипоз кишечника. Развивающаяся гипофизарная недостаточность (пангипопитуитаризм) обусловлена сдавлением и разрушением опухолью гипофиза.
В поздних стадиях (через 5-6 лет от начала заболевания) акромегалию можно заподозрить на основании увеличения частей тела и других внешних признаков, заметных при осмотре. В таких случаях пациент направляется на консультацию эндокринолога и сдачу анализов для проведения лабораторной диагностики.
Главными лабораторными критериями диагностики акромегалии являются определение содержания в крови:
- соматотропного гормона утром и после теста с глюкозой;
- ИРФ I — инсулиноподобного ростового фактора.
Повышение уровня соматотропина определяется практически у всех пациентов с акромегалией. Оральная проба с нагрузкой глюкозы при акромегалии подразумевает определение исходного значения СТГ, а затем после приема глюкозы — через полчаса, час, 1,5 и 2 часа. В норме после приема глюкозы уровень соматотропного гормона снижается, а при активной фазе акромегалии, напротив, отмечается его повышение. Проведение глюкозотолерантного теста особо информативно в случаях умеренного повышения уровня СТГ, либо его нормальных значениях. Также тест с нагрузкой глюкозы используется при оценке эффективности лечения акромегалии.
Соматотропный гормон действует на организм через инсулиноподобные ростовые факторы (ИРФ). Концентрация в плазме крови ИРФ I отражает суммарное выделение СТГ за сутки. Повышение ИРФ I в крови взрослого человека прямо указывает на развитие акромегалии.
При офтальмологическом обследовании у пациентов с акромегалией отмечается сужение зрительных полей, т. к. анатомически зрительные пути расположены в головном мозге рядом с гипофизом. При рентгенографии черепа выявляется увеличение в размерах турецкого седла, где располагается гипофиз. Для визуализации опухоли гипофиза проводится компьютерная диагностика и МРТ головного мозга. Кроме того, пациенты с акромегалией обследуются на предмет выявления различных осложнений: полипоза кишечника, сахарного диабета, многоузлового зоба и т. д.
При акромегалии основной целью лечения является достижение ремиссии заболевания путем ликвидации гиперсекреции соматотропина и нормализации концентрации ИРФ I. Для лечения акромегалии современная эндокринология применяет медикаментозный, хирургический, лучевой и комбинированный методы.
Для нормализации в крови уровня соматотропина назначают прием аналогов соматостатина — нейросекрета гипоталамуса, подавляющего секрецию гормона роста (октреотида, ланреотида). При акромегалии показано назначение половых гормонов, агонистов дофамина (бромокриптина, каберголина). В последующем обычно проводится одноразовая гамма- или лучевая терапия на область гипофиза.
При акромегалии наиболее эффективным является хирургическое удаление опухоли в основании черепа через клиновидную кость. При небольших размерах аденом после операции у 85% пациентов отмечается нормализация уровня соматотропина и стойкая ремиссия заболевания. При значительных размерах опухоли процент излеченности в результате первой операции достигает 30%. Показатель смертности при хирургическом лечении акромегалии составляет от 0,2 до 5%.
Отсутствие лечения акромегалии приводит к инвалидизации пациентов активного и трудоспособного возраста, повышает риск преждевременной смертности. При акромегалии сокращается продолжительность жизни: 90% пациентов не доживают до 60 лет. Смерть обычно наступает в результате сердечно-сосудистых заболеваний. Результаты оперативного лечения акромегалии лучше при небольших размерах аденом. При крупных опухолях гипофиза резко возрастает частота их рецидивов.
Для профилактики акромегалии следует избегать травм головы, санировать хронические очаги инфекции носоглотки. Раннее выявление акромегалии и нормализация уровня гормона роста позволят избежать осложнений и вызвать стойкую ремиссию заболевания.
источник
В медицине существует мало областей, в которых базисные научные разработки настолько приближены к клинической практике, как в области сердечно-сосудистой эндокринологии. Знание клеточных и молекулярных эффектов различных гормонов помогает лучше понять клинические проявления состояний с избытком секреции гормонов и их дефицитом. Более 200 лет назад Caleb Hillier Parry, английский терапевт, описал женщину с зобом и сердцебиением, у которой «каждый удар сердца сотрясал грудную клетку». Он был первым, кто высказал предположение о связи между заболеванием сердца и увеличением щитовидной железы.
Аномалии сердечно-сосудистой системы, связанные с патологией желез внутренней секреции, были описаны еще до того, как смогли идентифицировать гормоны, продуцируемые данными органами. Эта и последующие статьи на сайте посвящены заболеваниям сердца, причинами которых являются изменения функционирования органов эндокринной системы. Такой подход позволяет оценить клеточные механизмы повреждения сердечнососудистой системы различными гормонами вследствие их влияния на кардиомиоциты, гладкомышечные клетки сосудов и другие органы и ткани.
Гипофиз состоит из двух различных анатомических долей. Передняя доля (аденогипофиз) содержит 6 типов клеток, 5 из которых продуцируют пептидные или гликопротеиновые гормоны, 6-й тип — это несекретирующие хромофобные клетки. Развитию сердечно-сосудистых заболеваний (ССЗ) могут способствовать изменения функции как соматотрофных клеток, продуцирующих соматотропный гормон (СТГ), так и кортикогропных клеток, адренокортикотропный гормон (АКТГ). В задней доле гипофиза (нейрогипофизе) находятся окончания аксонов нейросекреторных клеток, выделяющие в кровь вазопрессин (антидиуретический гормон) и окситоцин.
У взрослых повышение секреции СТГ до закрытия зон роста в костях скелета приводит к гигантизму, а после окостенения эпифизов — к акромегалии. Фактор, ускоряющий рост, был выделен из экстрактов гипофиза и идентифицирован Evans и Long в начале 1920-х гг. Через почти 50 лет были установлены белковая последовательность и структура СТГ и его роль как одного из членов семейства факторов, ускоряющих рост (соматических).
Гормон роста действует на клетки двумя различными путями. Один из них — связывание СТГ с гормон-специфичны-ми рецепторами на клетках-мишенях. Такие рецепторы были обнаружены в сердце, скелетных мышцах, жировой ткани, печени, почках и на многих других клетках, существующих в процессе развития плода. Второй путь влияния СТГ на клеточный рост — стимуляция синтеза инсулиноподобного фактора роста 1 (IGF-1). Этот белок первичновырабатывающих продуцируется печенью, но и другие типы клеток могут синтезировать его под влиянием СТГ.
Вскоре после идентификации семейства инсулиноподобных факторов роста было высказано предположение об их способности опосредовать клеточные эффекты СТГ. Выраженность клинических проявлений акромегалии в большей степени коррелирует с IGF-1, чем с СТГ. Способность данных факторов усиливать потребление глюкозы и синтез белка клетками легла в основу термина «инсулиноподобные факторы». IGF-1 связывается со специфичным рецептором (IGF-1-рецептором), расположенным фактически на всех типах клеток. При проведении экспериментов на трансгенных животных было показано, что наличие данного типа рецепторов тесно связано со способностью клеток к делению.
В оригинальных экспериментах при повышении экспрессии IGF-1-рецепторов на кардиомиоцитах увеличилось число клеток, возросла степень митозов и повысилась способность миоцитов к репликации после дифференцировки. Эти изменения могут служить основанием для дальнейших генетических манипуляций и исследований но восстановлению повреждений миокарда.
Инфузия СТГ или IGF-1 остро меняет гемодинамику. Повышение сократимости миокарда и СВ могут быть связаны со снижением системного сосудистого сопротивления и постнагрузки. Кратковременное введение СТГ и IGF-1 не повышает АД, поскольку, как предполагается, увеличение СВ является следствием именно изменений системного сосудистого сопротивления.
а) Сердечно-сосудистые проявления акромегалии. Акромегалия — относительно редкое заболевание в США (900 новых случаев в год). Несмотря на это, акромегалия и гипофизарный гигантизм ассоциированы со значимым ростом заболеваемости и смертности от сердечно-сосудистой патологии. Акромегалия, диагностированная по клинической симптоматике и повышению секреции СТГ, без лечения значительно укорачивает продолжительность жизни ( 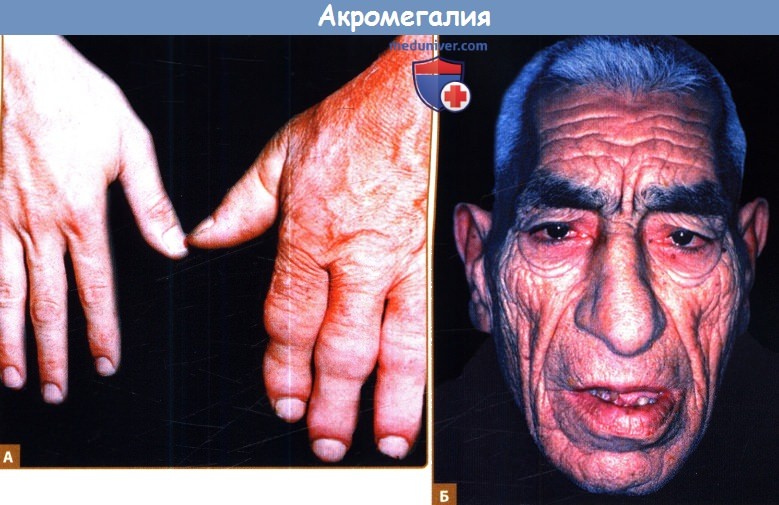
Б. У пациентов развиваются глубокие борозды на лбу и вокруг носогубных складок. При увеличении челюсти могут наблюдаться промежутки между зубами.
Функциональные изменения сердца при акромегалии идут параллельно патогистологическим. Хотя только около 10% вновь выявленных пациентов с акромегалией имеют кардиальные симптомы, этот процент значительно растет с увеличением длительности заболевания. Некоторые исследования показали низкую частоту встречаемости клинически явной левожелудочковой недостаточности, поэтому можно предположить, что для нарушения функции сердца необходимы такие сопутствующие факторы, как гипертензия, СД-2, гиперлипидемия. При акромегалии левожелудочковая недостаточность и ХСН могут развиться без гипертензии в анамнезе, что свидетельствует о роли высоких уровней гормона роста и IGF-1 в развитии патологии кардиомиоцитов без участия каких-либо дополнительных факторов. Следует отметить, что эффективная терапия приводит к регрессу многих, если не всех, изменений миокарда.
Аномалии на ЭКГ, включающие отклонение электрической оси сердца влево, септальные зубцы Q, депрессию интервала ST-T, изменение длительности сегмента QT и нарушения проводящей системы сердца, присутствуют у 50% больных акромегалией. Встречаются различные виды нарушений ритма: предсердная и желудочковая экстрасистолия, синдром слабости синусового узла, наджелудочковые и желудочковые тахикардии. Увеличение в 4 раза частоты сложных желудочковых аритмий и поздних потенциалов на сигнал-усредненной ЭКГ хотя и может быть предиктором электрической нестабильности миокарда желудочков, но более часто отмечается при активной акромегалии, чем у пациентов, получающих лечение. Напротив, нагрузочные тесты не приводят к аритмии или ишемии миокарда, что свидетельствует об отсутствии связи желудочковых аритмий со скрытой ишемией.
У 20-40% больных развивается симптоматическая АГ. Учитывая ее широкое распространение во взрослой популяции и часто постепенное развитие акромегалии, определить, какой характер носит АГ — первичный или вторичный (т.е. сопутствующая патология), — достаточно трудно. Нормализация АД на фоне терапии акромегалии позволяет предположить ее симптоматический характер. Первоначально эпидемиологические исследования выживаемости при акромегалии показали, что гипертензия является независимым ФР летального исхода, но у пациентов, умерших от акромегалии, среднее АД было выше, чем у выживших. Механизмы развития гипертензии при акромегалии недостаточно ясны. У пациентов с небольшой длительностью заболевания показатели САД и ДАД не отличаются от показателей в сходной по возрасту и полу популяционной группе, но сердечный индекс существенно выше.
Создается впечатление, что при большей длительности заболевания увеличивается толщина интимы артерий, которая может уменьшаться в ответ на снижение СТГ.
Назначение гормона роста приводит к задержке натрия и гиперволемии и, по-видимому, оказывает потенциальный антинатрийуретический эффект, независимый от влияния альдостерона. В исследованиях РААС не удалось добиться оптимальной блокады высвобождения ренина при гиперволемии. У пациентов с акромегалией при терапии ингибиторами ангиотензина II АД повышается парадоксальным образом. Обсуждается также роль гиперинсулинизма. Повышение концентрации инсулина может способствовать задержке натрия почками, нарушению эндотелий-зависимой вазодилатации и росту активности СНС.
б) Диагностика акромегалии. В 99% случаев причиной акромегалии является аденома передней доли гипофиза. К моменту постановки диагноза размер опухоли у большинства пациентов составляет > 10 мм (макроаденома), а симптомы заболевания присутствуют свыше 10 лет. Диагноз можно подтвердить уровнями СТГ > 5 нг/дл и IGF-1 > 300 мкМЕ/мл в сыворотке через 1 час после нагрузки глюкозой (100 г). У большинства больных уровень гормона роста натощак составляет > 10 пг/мл. Локализацию опухоли можно определить с помощью МРТ. Реже причиной акромегалии является избыточная секреция соматотропинрилизинг-гормона, что приводит к диффузной гиперплазии гипофиза. Кроме того, возможно развитие эктопической неоплазии эндокринных клеток.
в) Лечение акромегалии и поражения сердца. Методом выбора является транссфеноидальная резекция аденомы. Если уровни СТГ и/или IGF-1 остаются повышенными, для их снижения можно использовать как лучевую терапию (у пожилых пациентов), так и агонисты допаминовых или соматостатиновых рецепторов (у молодых пациентов). Октреотида ацетат, фармакологический аналог соматостатина, эффективен у большинства пациентов для снижения уровня СТГ
Редактор: Искандер Милевски. Дата публикации: 19.2.2019
источник
Акромегалия – заболевание, известное с древних времен и характеризующееся патологическим увеличением каких-либо отдельных частей тела, что связано с усиленной продукцией соматотропного гормона, называемого еще гормоном роста. Болезнь возникает чаще всего после завершения роста организма в 20-40 лет у лиц обоих полов и проявляется в увеличении кистей рук и стоп, гипертрофированном увеличении черт лица. Симптомы акромегалии проявляются постоянными головными и суставными болями, нарушением репродуктивной функции. Очень часто повышение уровня соматотропного гормона в крови способствует возникновению тяжелых сердечнососудистых, легочных или онкологических заболеваний и раннюю смертность.
Эта достаточно редкая болезнь, а диагностируется она у 40 человек из миллиона, начинается незаметно и протекает постепенно, и становится заметной приблизительно, спустя 7 лет после возникновения.
Болезнь протекает в четырех стадиях, каждая из которых характеризуется определенными процессами.
- На начальной преакромегалической стадии признаки очень слабы и редко выявляются. Диагностирование возможно исключительно по данным компьютерной томографии головного мозга и показателям уровня соматотропного гормона в крови.
- На гипертрофической стадии симптомы акромегалии ярко выражены.
- На опухолевой стадии появляются симптомы сдавливания, соседних с опухолью, отделов головного мозга. Повышается внутричерепное давление, появляются нервные и глазные нарушения.
- Стадия кахексии – последняя фаза болезни, характеризуется истощением вследствие акромегалии.
Соматотропный гормон роста вырабатывается в гипофизе, эндокринной железе, расположенной в основании головного мозга. Этот гормон отвечает за процесс роста ребенка, формирование мышц и скелета. У взрослых он обеспечивает контроль над обменом веществ, в том числе и над водно-солевым, углеводным и жировом балансами.
Контроль над функцией гипофиза ведется из другой части головного мозга, называемой гипоталамусом, который вырабатывает вещества, стимулирующие или тормозящие работу гипофиза.
У здорового человека содержание соматотропного гормона на протяжении суток колеблется, подъемы чередуются со снижением. В силу ряда причин, клетки гипофиза выпадают из-под контроля гипоталамуса и начинают активно размножаться. Нарушается ритм выделения гормона и повышается его уровень в крови. Продолжающийся длительное время рост этих клеток приводит к образованию «аденомы гипофиза» – доброкачественного новообразования, достигающего размеров в несколько сантиметров. Опухоль начинает сдавливать гипофиз, иногда разрушая здоровые клетки. Именно опухоль и является причиной, по которой возникает акромегалия.
Другие косвенные причины акромегалии это неблагоприятное течение беременности, опухоли центральной нервной системы, психические или черепные травмы, хронические инфекции – грипп, корь и др. Определенную роль в развитии отводят наследственности.
Избыточный уровень гормона роста в крови вызывает изменение внешности пациента: увеличиваются надбровные дуги, скуловые кости, нижняя челюсть, губы, нос, уши. Гипертрофия гортани, языка, голосовых связок приводит к изменению голоса. Значительно увеличиваются размеры черепа, кистей, стоп.
Деформируется скелет, происходит увеличение грудной клетки, расширение межреберных промежутков, искривляется позвоночник. Рост хрящевой и соединительной ткани приводит к ограничению подвижности суставов, их деформации, возникают суставные боли.
Кожа у больных уплотняется. Увеличивается сало- и потоотделение. Чрезмерное увеличение внутренних органов и мышц вызывает дистрофию мышечных волокон. Больной жалуется на утомляемость, слабость, снижение работоспособности, жажду, частое мочеиспускание, резкие подъемы температуры. Развивается гипертрофия миокарда, перерастающая в сердечную недостаточность. У 90% больных, в связи с гипертрофией верхних дыхательных путей и нарушением работы дыхательного центра, развивается храп и синдром обструктивного апноэ во сне.
С ростом опухоли гипофиза повышается внутричерепное давление», головные боли, головокружение, двоение в глазах, светобоязнь, снижение слуха, онемение конечностей, часто возникает рвота. У больных женщин нарушается менструальный цикл, возникает бесплодие, появляется галакторея (выделение молока из молочных желез в отсутствии беременности). У мужчин угасает половая потенция.
Возможно развитие несахарного диабета, опухолей матки, органов желудочно-кишечного тракта, щитовидной железы.
Определяется уровень содержания соматотропного гормона в крови на основании глюкозотолерантного теста. Определяется исходное значение СТГ, а затем после приема глюкозы – четыре теста каждые полчаса. Если в норме, после приема глюкозы, уровень СТГ должен снижаться, в активной фазе акромегалии, он повышается. Данный тест используется также при оценке эффективности проведения терапии, только с ее помощью можно назначить адекватное лечение акромегалии.
Определяется концентрация в плазме крови инсулиноподобных ростовых факторов (ИРФ), повышение указывает на развитие акромегалии. Проводится рентгенография костей черепа на предмет выявления увеличения размеров турецкого седла, магнитно-резонансная и компьютерная диагностика. Офтальмологическое обследование пациентов с акромегалией выявляет сужение зрительных полей.
Помимо прочего, больные обследуются с целью выявления осложнений вследствие акромегалии на наличие сахарного диабета, полипоза кишечника, заболеваний щитовидной железы и так далее.
Лечение заболевания состоит из медикаментозного, хирургического, лучевого и комбинированного методов и направлено на снижение концентрации соматотропного гормона, ликвидацию его гиперсекреции и нормализации концентрации ИРФ I. В результате лечения должны значительно снижаться или полностью исчезать проявления заболевания.
Назначается прием аналогов соматостатина, подавляющего секрецию гормона роста (ланреотид, октреотид, сандостатин, соматулин). Впоследствии, назначается одноразовая лучевая или гамма-терапия на область гипофиза. Опухоль гипофиза удаляется хирургическим путем. Эффективность операции составляет 85% при небольших опухолях и 30% при значительных. В этом случае возможно повторная операция.
Прогноз лечения зависит от продолжительности болезни. При отсутствии лечения при тяжелом течении продолжительность жизни больного составляет около 3-4 года, при медленном развитии от 10 до 30 лет. Своевременная диагностика акромегалии и вовремя начатое лечение дает благоприятный прогноз, возможно полное выздоровление.
источник