Состояние, связанное с уменьшением выработки гормонов, вырабатываемых именно в коре надпочечников, называется «надпочечниковая недостаточность» или «гипокортицизм». Бывает оно острым и хроническим.
Имея не слишком заметные симптомы, хроническая надпочечниковая недостаточность часто длительное время не распознается и не лечится (один из симптомов – любовь к соленой пище, которая редко настораживает), и это приводит к тяжелым осложнениям.
Острая же недостаточность коры незамеченной не остается: здесь развивается шок с падением артериального давления (читай про норму артериального давления), одышкой, иногда – судорогами и потерей сознания. Такой криз может возникать без видимой причины и напоминать заболевание органов брюшной полости, но чаще его вызывает резкое снижение дозировки или отмена гормонов, которые были назначены для лечения хронического гипокортицизма.
Возникать недостаточность надпочечниковых гормонов может как вследствие поражения самих надпочечников, так и в результате патологии центральных органов, которые регулируют деятельность всех эндокринных органов.
Знание симптомов надпочечниковой недостаточности и своевременное ее выявление в современном мире, где можно полностью заменить нехватку собственных гормонов синтетическими аналогами, способно значительно улучшить прогноз.
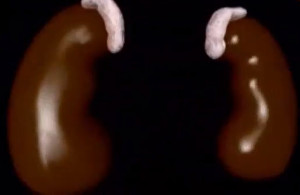
Надпочечники – это маленький парный орган треугольной формы размерами 4*0,3*2 см, располагающийся прямо над почками. Масса каждого из них около 5 граммов.
Надпочечники состоят из двух слоев. Широкий наружный называется корковым (cortex, отсюда и название – «гипокортицизм»), тогда как центральный, на который приходится 20% массы органа – мозговым. В последнем синтезируются гормоны, регулирующие артериальное давление: адреналин, дофамин, норадреналин. Недостаточность гормонов этой части органа не называются надпочечниковой недостаточностью, поэтому рассматривать мы их не будем.
В корковом слое синтезируются несколько видов гормонов:
- Глюкокортикоиды: коризол.
- Минералокортикоиды: альдостерон.
- Мужские половые гормоны – у лиц обоего пола: андростендион, дегидроэпиандростерон.
- Женские половые гормоны (минимальные количества): эстроген и прогестерон (читайте о нормах прогестерона у женщин).
Руководят выработкой всех этих биоактивных веществ центральные эндокринные органы, локализованные в полости черепа и анатомически неотделимые от мозга – гипоталамус и гипофиз. Гипоталамус вырабатывает кортиколиберин, последний, доходя до гипофиза, командует выработкой адренокортикотропного гормона (АКТГ) и уже он влияет на работу непосредственно надпочечников.
Надпочечниковой недостаточностью называют состояние, когда в организме образуется дефицит двух гормонов:
| Кортизол | Альдостерон | |
| Название гормона и его метаболитов | Глюкокортикостероиды | Минералокортикоиды |
| Влияние на углеводный обмен | Повышают уровень глюкозы в крови путем ускорения образования глюкозы из белков в печени, одновременно со снижением утилизации ее в мышечной ткани | Не влияют |
| Влияние на обмен электролитов | Влияют только на кальций, ускоряя его выделение в кровь и уменьшение всасывания костями | Поддерживают баланс натрия, калия, хлора и бикарбонатов:
|
| Обмен белков | Увеличивают распад белков до аминокислот, уменьшают скорость образования протеина из аминокислот | Не влияют |
| Обмен липидов | Усиливают отложение жира под кожей туловища и лица. Одновременно происходит расщепление жира на конечностях | Не влияют |
| Влияние на иммунитет | Будучи противовоспалительными веществами, в больших объемах подавляют иммунитет. Из-за этого синтетические глюкокортикоиды используют для лечения аутоиммунных болезней, для профилактики отторжения пересаженного органа | Не влияют |
| Побочные эффекты | При повышении выше необходимого уровня подавляют синтез новых элементов кожи, в результате чего она истончается. Уменьшают также мышечную массу, подавляя в них выработку новых белков | В большом количестве, из-за задержки натрия, который притягивает воду в сосуды, повышает артериальное давление |
Выработка как глюко-, так и минералокортикоидов, как уже говорилось, имеет тройную регуляцию: гипоталамус – гипофиз – надпочечники. То есть снизиться уровень гормонов может вследствие нарушения их синтеза в одном из этих органов. В зависимости от локализации патологии надпочечниковая недостаточность может быть:
- первичной , когда имеется поражение самих надпочечников;
- вторичной . Она связана с заболеванием гипофиза, который синтезирует мало или не синтезирует гормона АКТГ вообще;
- третичной , когда самый центр, гипоталамус, продуцирует мало кортиколиберина.
Гипокортицизм может быть также вызван состоянием, когда гормонов синтезируется достаточное количество, но рецепторы или заняты веществами, которые блокируют рецепторы к кортизолу или альдостерону, или нечувствительны.
Первичная надпочечниковая недостаточность протекает тяжелее вторичной и третичной форм.
В зависимости от характера развивающегося процесса надпочечниковая недостаточность бывает:
- острой (это называется также аддисоническим кризом, а если его вызвало кровоизлияние в ткань надпочечников – то синдромом Уотерхауза-Фридериксена) – смертельно опасным заболеванием, требующим экстренной коррекции;
- хронической – это состояние при наличии грамотной своевременной коррекции можно долгие годы держать под контролем. Недостаточность может находиться в стадии компенсации, субкомпенсации и декомпенсации.
Надпочечники – орган парный, к тому же обладающий большими компенсаторными возможностями. Так, симптомы его хронического поражения развиваются только тогда, когда пострадало более 90% коры. Первичная надпочечниковая недостаточность развивается при патологии самих надпочечников. Это может быть:
- аутоиммунное поражение (то есть атака собственной ткани своими же антителами) – причина почти 98% случаев гипокортицизма. Причина этого состояния неизвестна, чаще всего оно сочетается с аутоиммунными поражениями других эндокринных органов;
- врожденное недоразвитие коры органа;
- синдром Алгроува;
- туберкулезный процесс — он вначале развивается в легких (см. как передается туберкулез);
- амилоидоз – отложение в ткани надпочечников аномального белка, образующегося при наличии длительного хронического заболевания;
- адренолейкодистрофия – генетическая, передающаяся через X-хромосому патология накопления в организме жирных кислот, которая приводит к прогрессирующему поражению отдельных участков головного мозга и надпочечников;
- метастазы опухолей в ткань надпочечников;
- кровоизлияние в ткань надпочечников. В основном, развивается при тяжелых инфекциях, сопровождающихся выделением большого количества бактерий в кровь: менингококковой инфекции, сепсисе, скарлатине, тяжелой дифтерии;
- тромбоз сосудов, питающих надпочечники;
- опухоли самих надпочечников;
- некроз ткани органа при ВИЧ-инфекции;
- у новорожденного подобное состояние может развиться, если в родах он какое-то время оставался без кислорода;
- синдром Кернса, заключающийся в поражении ткани глаз и мышц;
- синдром Смита-Опица: сочетание нескольких патологий: маленького объема мозгового черепа, задержки психического развития, а также аномалии строения гениталий.
Если речь идет о вторичной недостаточности, причины ее – патологии гипофиза:
- инфекционного характера (чаще – вызванной вирусной инфекцией);
- возникшем из-за кровоизлиянием вследствие травмы;
- спровоцированным опухолью;
- связанны с деструкцией в результате облучения органа, проведения на нем операции или длительного лечения синтетическими глюкокортикоидами;
- врожденного уменьшения массы органа (при этом может наблюдаться нехватка как только АКТГ, так и всех гипофизарных гормонов);
- поражения гипофиза собственными антителами.
Третичная надпочечниковая недостаточность появляется вследствие врожденной или приобретенной (опухоль, гамма-лучи, инфекция, кровоизлияния) патологии гипоталамуса.
При нехватке альдостерона в организме развивается обезвоживание (читайте о симптомах обезвоживания), которое прогрессирует, так как продолжает теряться натрий (а с ним и вода). Вместе с этим калий, наоборот, накапливается. Это вызывает нарушение функции пищеварительного тракта, нарушение сердечного ритма. Если концентрация калия превысит 7 ммоль/л, может развиться остановка сердца.
Уменьшение выработки кортизола вызывает уменьшение образования гликогена – своеобразного хранилища глюкозы в печени. Реагируя на дефицит этого гормона, гипофиз начинает вырабатывать АКТГ в повышенном количестве, но последний, имея широкий спектр действия, пытается «заставить» синтезироваться не только кортизол, но также и меланотропин – вещество, усиливающее выработку пигмента меланина клетками кожи, сетчатки и волос. Это приводит к потемнению кожи.
Симптомы надпочечниковой недостаточности будут зависеть от того, насколько быстро поражается ткань надпочечников. Если гибнет сразу большое количество клеток органа, развивается острая недостаточность, имеющая одни симптомы. Если же процесс гибели клеток надпочечника происходит постепенно, то есть развивается хронический гипокортицизм, на передний план выступают другие признаки.
Это состояние имеет несколько основных симптомов. Развиваются они чаще всего после стрессовых ситуаций, в качестве которых могут выступать травма, роды, грипп или другая инфекция, психоэмоциональный стресс, обострение хронического заболевания.
Для первичного гипокортицизма характерно окрашивание кожи в коричневатый цвет, слизистые оболочки при этом также темнеют. По этому признаку гипокортицизм также называют «бронзовой болезнью».
Вначале темнеют те части тела, которые не защищаются одеждой: лицо, ладони рук, шея. Параллельно более коричневыми становятся те места, которые и в норме темнее: мошонка, ареолы сосков, подмышечные ямки, промежность. Появляется пигментация и на участках кожи, соприкасающихся с одеждой (область воротника или пояса), что особенно заметно на фоне обычно окрашенной кожи.
Интенсивность окрашивания зависит от давности заболевания. Она может иметь оттенок легкого загара, окрашивать кожу бронзой, застилать «дымкой», создающей эффект грязной кожи, и даже красить в темный цвет.
Окрашиваются и слизистые, что заметно на языке, прилежащей к зубам поверхности щек, деснам, небе (окрашиваются также влагалище и прямая кишка).
Если речь идет об аутоиммунном первичном гипокортицизме, на фоне темных участков часто появляются депигментированные участки – пятна витилиго.
Вторичная и третичная надпочечниковая недостаточность протекают без окрашивания кожи и слизистых.
В связи с выраженным недостатком питательных веществ снижается вес человека: от умеренной степени (3-5 кг) до состояния, называемого гипотрофией (дефицит 15 или более килограммов).
Для хронической первичной недостаточности надпочечников характерны:
- раздражительность;
- апатия;
- выраженная мышечная слабость – до полной утраты работоспособности;
- депрессивные расстройства.
Для первичного хронического гипокортицизма характерны:
- снижение аппетита;
- тошнота;
- боль в животе, которая не имеет четкого местоположения, «блуждает»;
- анорексия;
- рвота без головной боли или предыдущей тошноты;
- запор и понос чередуются.
Хроническую первичную надпочечниковую недостаточность можно заподозрить уже по тому факту, что повышенное или нормальное ранее давление постепенно снизилось. Теперь человек – при относительно нормальном самочувствии – измеряет у себя цифры на 5-10 мм рт.ст. ниже того, что фиксировалось ранее.
Для хронического поражения коры надпочечников характерно пристрастие к соленой пище. А натощак возникают слабость, дрожь мышц, которые проходят после приема пищи – признак снижения глюкозы в крови.
При вторичном гипокортицизме пристрастия к соленому нет, но после еды через несколько часов развиваются приступы слабости и дрожи.
Острая надпочечниковая недостаточность у детей до 3 лет может возникнуть вследствие даже, казалось бы, незначительных внешних факторов: ОРВИ, кишечной инфекции, стресса, прививки. Она развивается сразу после родов, если они проходили с гипоксией плода, или если малыш рождался из тазового предлежания. Это обусловлено тем, что ткань надпочечников у таких малышей еще недостаточно зрелая.
Острый гиперкортицизм возникает при:
- менингококковой инфекции (она чаще развивается у детей, тогда как взрослые часто являются просто носителями бактерии-менингококка носоглотке);
- тромбозе надпочечниковой вены;
- инфекциях: листериозе, цитомегаловирусной инфекции, токсоплазмозе, дифтерии;
- удалении части надпочечника;
- резкой отмене синтетических глюкокортикоидов.
Острый гипокортицизм может развиться без каких-либо предшествующих симптомов. О его появлении свидетельствуют:
- резкая бледность;
- слабость – до состояния прострации;
- ощущение сердцебиения;
- рвота;
- нелокализованная боль в животе;
- частый жидкий стул;
- уменьшение количества мочи;
- кожа становится «мраморной», кончики пальцев синеют;
- могут быть судороги;
- если причина – менингококковая инфекция, на коже появляется сыпь коричнево-черного цвета, не исчезающая при надавливании стаканом или прозрачным стеклом.
Если вовремя не оказать помощь, наступает кома, которая может иметь летальный исход.
Для определения, о какой надпочечниковой недостаточности идет речь – первичной, вторичной или третичной, выполняют:
- УЗИ надпочечников, которое может вообще не показать орган даже при наличии в нем туберкулезного или опухолевого процесса. В этом случае дополнительно проводят КТ надпочечников;
- МРТ головного мозга с прицельным осмотром области гипоталамуса и гипофиза.
Но основная диагностика заболевания – лабораторная. Для того, чтобы выяснить, недостаток каких гормонов возник, и насколько он выражен, изучаются:
- уровень кортизола в крови: он снижен при любом типе недостаточности;
- 17-ОКС и 17-КС в моче, собираемой за сутки: эти метаболиты кортизола также снижены при первичном и вторичном типе гипокортицизма;
- АКТГ в крови: он уменьшается при вторично-третичной недостаточности, возрастает – при заболевании самих напочечников;
- определение альдостерона в крови: насколько он снижен;
- скрытые формы гипокортицизма выявляет стимуляционный тест с АКТГ: определяется кортизол исходный, а также через полчаса и час после введения синтетического АКТГ. Если уровень кортизола повысился менее, чем на 550 нмоль/л – значит, есть недостаточность надпочечников. В норме уровень кортизола повышается в 4-6 раз. Тест проводят в определенное время – в 8:00, когда наблюдается естественный пик активности изучаемых гормонов.
Диагноз установлен. Теперь нужно определить, насколько пострадали электролитный, белковый, углеводный и липидный виды обмена, насколько снижена иммунная защита. Для этого сдается общий анализ крови, в венозной крови определяются натрий, калий, кальций, белок и его фракции, глюкоза; проводится липидограмма. Обязательно выполняется электрокардиограмма – так можно судить о том, насколько сердце отреагировало на изменение электролитного состава крови.
Лечение заключается в введении синтетических гормонов – тех, дефицит которых образовался, в рассчитанной дозе. Почти всегда это – глюкокортикоиды, которые выбирают в зависимости от их минералокортикоидной активности, длительности действия, выраженности побочных эффектов:
| Препарат | Сколько действует (часов) | Сренесуточная дозировка (в миллиграммах на квадратный метр площади тела) | Глюкокорти-коидная активность | Минерало- кортикоидная активность | Подавление синтеза АКТГ |
| Гидрокортизон | 8-12 | 10-12 | 1 | 1 | Умеренно |
| Кортизон | 8-12 | 12-15 | 0,8 | 1 | Умеренно |
| Преднизолон | 18-36 | 2-3 | 4 | 0,5 | Средне |
| Дексаметазон | 36-54 | 0,3-0,4 | 30 | 0,05 | Сильно |
| Флудрокортизон | 18-36 | 0,05-0,2 мг/сут | 15 | 150 | Не подавляет |
2/3 нужной дозировки принимают утром, в 10:00, 1/3 – в дневные часы.
Обычно при легкой степени назначается только Кортизон, если же недостаточность гормонов выражена более существенно, требуется комбинация Преднизолона, Кортизона и Флудрокортизона.
Последний в таблице препарат – Флудрокортизон – это аналог минералокортикоида альдостерона. Его применяют всегда, даже при минимальной минералокортикоидной недостаточности, не рассчитывая на минералокортикоидную активность глюкокортикоидов. Ведь если пить только глюкокортикостероиды, у маленьких детей начнется плохая прибавка в весе, отставание психомоторного развития, обезвоживание, что может привести к накоплению в организме смертельной дозы калия. У подростков и взрослых лечение только глюкокортикоидами может приводить не только к ухудшению самочувствия, но и увеличивает шанс развития сольтеряющих кризов.
Назначение одних только глюкокортикоидов, и о, только в начале заболевания, оправдано только при аутоиммунной недостаточности и адренолейкодистрофии.
О том, что Флудрокортизона назначено достаточное количество, свидетельствует:
- снижение натрия в крови;
- повышение концентрации калия;
- рост активности ренина в крови.
Если же появляются отеки (особенно на лице), повышается давление, сон становится беспокойным и болит голова, а лабораторно – мало калия и много натрия, это говорит о передозировке Флудрокортизона, из-за чего необходимо снижать его дозу, но не отменять совсем.
Увеличивают дозировку Флудрокортизона при проживании в жарком климате (так как человек будет терять много пота, а с ним и натрия), при беременности – со второго триместра.
Если человек с надпочечниковой недостаточностью заболевает инфекционным заболеванием с повышением температуры, или ему требуется проводить травматичную манипуляцию или операцию, то во избежание развития аддисонического криза ему нужно увеличить дозировку принимаемого глюкокортикоидного препарата в 3-5 раз. Минералокортикоиды при этом не корректируются.
Контроль эффективности лечения осуществляется вначале каждый месяц (с обязательным определением уровней гормонов и электролитов в крови), затем – 1 раз в 2-3 месяца. В случае надпочечниковой недостаточности ситуация такая, что лучше превысить дозировку глюкокортикоидов на 1-2 суток, чем повысить шанс развития острой недостаточности.
Криз чаще всего развивается при отсутствии увеличения дозировки препарата на фоне инфекционного заболевания, при пропуске приема глюкокортикоида или при их своевольной отмене.
Лечится такое состояние в отделении реанимации. Лечение заключается в:
- внутривенном введении большого количества растворов натрия хлорида и глюкозы – для коррекции водно-электролитных нарушений. Глюкозы должно вводиться достаточное количество, и все время инфузии непрерывно проводится мониторинг в крови натрия и калия;
- замещении возникшего дефицита глюкокортикоидов с помощью внутримышечного и внутривенного введения синтетических препаратов. Начинают с Преднизолона в дозе 2,5-7 мг/кг веса. Его вводят капельно или внутривенно струйно. Как только явления шока купированы, этот препарат можно вводить внутримышечно ;
- при выраженном снижении артериального давления вводят препараты-вазопрессоры: Добутамин, Дофамин, Мезатон, Адреналин;
- лечении заболевания, вызвавшего криз. Так, при инфекционной патологии назначаются противовирусные, противогрибковые или антибактериальные средства, при хирургической патологии – после стабилизации состояния выполняется необходимое вмешательство.
После того, как артериальное давление, уровни калия и натрия нормализуются, можно переводить больного на прием таблетированных препаратов глюкокортикоидов и возвращать прежнюю дозу минералокортикоидов. После этого пациента переводят в общую палату.
Если вовремя и адекватно начать лечить заболевание, не пропускать прием препаратов и увеличивать их дозировку при развитии инфекционных заболеваний или возникновении потребности в плановых или экстренных хирургических вмешательствах, прогноз относительно благоприятен.
Надпочечниковая недостаточность у детей чаще всего возникает в виде вторичного процесса. Если и развивается первичный гипокортицизм, то происходит это вследствие:
- аутоиммунного поражения надпочечников (чаще всего это сочетается с сахарным диабетом, недостаточностью щитовидной и паращитовидной желез). Дебютирует чае всего после 5 лет;
- кровоизлияния в надпочечники вследствие тяжелых родов, сепсиса, в том числе менингококкового. Состояние, причиной которому стали роды, развивается сразу же после рождения. Менингкокцемия наиболее опасна для детей до 5 лет;
- врожденной гипоплазии коры надпочечников. Дебют болезни – на первом месяце жизни;
- адренолейкодистрофии. Первые признаки появляются после 3 лет. Обычно это головные боли, тошнота, слабость, нарушение слуха или зрения. Заболевание опасно тем, что на фоне вышеуказанных симптомов (они говорят о поражении мозга) надпочечниковая недостаточность не заметна и может быть пропущена;
- врожденной дисфункции коры надпочечников, что проявляется не только симптомами хронической надпочечниковой недостаточностью, но и преждевременным половым развитием у мальчиков, а у девочек – ложным гермафродитизмом. Дебют этой патологии – на первом месяце жизни;
- семейной глюкокортикоидной недостаточностью. Это заболевание проявляется только гипокортицизмом, его признаки появляются уже в первый месяц жизни;
- синдромом Смита-Лемли-Опица. Здесь кроме недостаточности надпочечников наблюдается маленький объем черепа, пороки развития гениталий. Такие дети отстают в психомоторном развитии. Дебютирует патология на первом году жизни;
- синдромом Кернса-Сейра, который будет иметь также глазные симптомы (нарушение зрения вследствие слабости глазных мышц), слабость и замедленное развитие поперечно-полосатой мускулатуры. Дебют патологии – после 5 лет,
- редко – туберкулеза, который может дебютировать в любом возрасте.
Симптомы хронической надпочечниковой недостаточностью у детей – это:
- коричневая пигментация шрамов, кожных складок, десен;
- сонливость;
- беспричинная рвота;
- любовь к соленой пище.
При развитии острого состояния у ребенка обычно развивается понос, рвота, боли в животе. Он теряет много жидкости, его конечности быстро становятся прохладными и приобретают синюшную окраску. Малыш или теряет сознание, или становится крайне сонливым; могут развиваться судороги.
Диагностика заболевания у детей не отличается от таковой у взрослых: исследование уровня кортизола, альдостерона и АКТГ, 17-корикостероидов в моче, активности ренина плазмы. Обязательно определяются электролитные и биохимические показатели.
Лечение проводится обычно гидрокортизоном. Начальная суточная его дозировка – 10-12 мг на каждый квадратный метр поверхности тела, она разбивается на три равных дозы и принимается в 7:00, 14:00 и 21:00. Если ребенку уже более 14 лет и он достиг конечного роста, вместо гидрокортизона может использоваться Преднизолон или Дексаметазон, которые можно принимать 1 раз в сутки. В большинстве случаев показано лечение Флудрокортизоном под контролем электролитов и активности ренина в крови.
Острая надпочечниковая недостаточность требует экстренного вызова «Скорой помощи», которая начнет введение растворов натрия хлорида и 5% глюкозы (у детей соотношение этих растворов – 1:1). Внутривенно вводится 5-7,5 мг/кг гидрокортизона водорастворимого, при низком давлении подключается капельное или микроструйное инъецирование вазопрессорных аминов (Дофамин, Добутамин). Проводится терапия заболевания, вызвавшего криз.
Ребенок переводится в общую палату из реанимации только при полном купировании явлений острой надпочечниковой недостаточности.
источник
Адреногенитальный синдром или Врожденная дисфункция коры надпочечников (ВДКН): Причины, Патогенез, Классификация, Симптомы, Диагностика, Лечение, Профилактика, Осложнения
Одним из наиболее серьезных врождённых заболеваний, является адреногенитальный синдром, который является следствием врождённой дисфункции коры надпочечников (ВДКН). Это тяжёлое патологическое состояние условно подразделяется на несколько клинических форм, для которых характерны отдельные изменения в организме человека, а также клинические проявления и последствия.
Для данного патологического состояния характерен аутосомно-рецессивный вариант наследования. Адреногенитальный синдром с одинаковой частотой встречается как у пациентов мужского, так и женского пола. Многие заболевания, из группы ВДКН, можно без труда диагностировать ещё с момента появления ребенка на свет. Адреногенитальный синдром относится к тем заболеваниям, которые нуждаются в своевременной диагностике и вовремя начатом лечении, без которого человек подвергается высокому риску появления тяжёлых осложнений.
Одной из наиболее вероятных причин формирования врожденной дисфункции коры надпочечников, является генетический сбой, результатом которого становится нехватка специфического фермента, принимающего участие в выработке стероидных гормонов, которые образуются в надпочечниках. Как правило, речь идёт о генной недостаточности, местом локализации которой является область короткого плеча 6 хромосомы.
Менее распространенной причиной возникновения данного состояния, является дефицит фермента 3 — бета –ол — дегидрогеназы или 11 – бета — гидроксилазы.
Если говорить о том, что это ВДКН, то можно сказать, что данное состояние связано напрямую с уменьшением уровня кортизола в сыворотке крови под воздействием вышеупомянутых ферментов. На фоне снижения сывороточного кортизола наблюдается увеличение секреции адреногенитальных гормонов, провоцирующих гиперпластические изменения в коре надпочечников. Результатом этого процесса, является повышенная выработка андрогенов. На фоне сложных биохимических процессов, формирующихся при адреногенитальном синдроме, наблюдается каскад последовательных реакций:
- Недостаточная выработка кортизола.
- Компенсаторное увеличение показателей адренокортикотропного гормона.
- Снижение уровня альдостерона в организме.
- Увеличение концентрации таких биологически активных веществ, как андрогены, 17-гидроксипрогестерон и прогестерон.
Для удобства постановки диагноза, в медицинской практике адреногенитальный синдром условно классифицируется на несколько основных форм, среди которых выделяют:
- Сольтеряющая форма. Данная разновидность заболевания является наиболее распространенной. Чаще всего, сольтеряющий адреногенитальный синдром диагностируется в периоде новорожденности, а также у детей в возрасте до 1 года. Для данного состояния характерно нарушение гормонального баланса и функциональная недостаточность коры надпочечников. В момент обследования таких детей, выявляется снижение альдостерона до минимальных показателей. Гормон альдостерон обеспечивает баланс воды и электролитов в организме человека, поэтому его нехватка приводит к функциональным расстройствам сердечно-сосудистой системы, а также к нестабильности показателей артериального давления.
- Вирильная форма. Данное состояние относится к классическим вариантам течения адреногенитального синдрома. В данной ситуации не наблюдается недостаточность надпочечников. Изменения затрагивают только область наружных половых органов. Клинические проявления вирильный формы адреногенитального синдрома дают о себе знать с самого момента рождения. Какие-либо другие изменения в органах и системах при этом отсутствуют.
- Постпубертатная форма. Данная форма адреногенитального синдрома относится к неклассической форме ВДКН, и, как правило, диагностируется чаще у женщин с повышенной сексуальной активностью. К наиболее вероятным причинам возникновения данного состояния, относят не только генные мутации, но и опухоли корковой части надпочечников. Постпубертатная форма адреногенитального синдрома является одной из потенциальных причин развития бесплодия.
Клиническая картина адреногенитального синдрома, включает перечень общих и частных проявлений, характерных для данного состояния у пациентов женского и мужского пола. В качестве общих проявлений данного патологического состояния, выделяют:
- Ещё в детском возрасте, пациенты, независимо от пола, отличается высоким ростом и повышенной массой тела. Кроме того, наблюдается постепенное изменение внешних данных. Достигая взрослого возраста, такие пациенты имеют астеническое телосложение и низкий рост.
- У пациента мужского пола возникает аномалия, при которой наблюдаются большие размеры полового члена и малые размеры яичек. У пациентов женского пола, данное состояние сопровождается увеличением клитора, а также оволосением по мужскому типу.
- Быстрый рост в детском возрасте, приводит к деформирующим изменениям в структурах опорно-двигательного аппарата.
- Такие пациенты отличаются психоэмоциональной нестабильностью.
- На поверхности кожных покровов отмечаются участки избыточной пигментации.
У пациентов мужского пола, данное патологическое состояние может сопровождаться рядом таких симптомов:
- Наблюдается избыточный рост волос в ушных раковинах.
- Происходит значительное увеличение размеров полового члена.
- Наблюдается избыточная пигментация перианальной области и мошонки.
- Возникают эпизоды эрекции в детском возрасте.
- На кожных покровах лицевой части формируется угревая сыпь.
Постпубертатная форма данного патологического состояния, сопровождается перечнем таких клинических проявлений:
- Позднее наступление менструаций.
- Малый размер молочных желез, которые представляют собой небольшие кожные складки с недоразвитыми сосками.
- Мужской тип телосложения, характеризующийся узким тазом и сравнительно широкими плечами.
- Расширение кожных пор в области лица, а также чрезмерная продукция секрета сальных желез.
- Избыточный рост волос по мужскому типу.
- Нерегулярный, скудный менструальный цикл, а также склонность к олигоменореи.
Вирильная форма адреногенитального синдрома сопровождается набором таких клинических признаков:
- Чрезмерный рост волос в подмышечных впадинах и на мошонке.
- У женщин форма и размер половых губ напоминает мошонку.
- Значительное увеличение размеров клитора, а также экстензия уретры.
В периоде новорожденности, внешний вид половых органов затрудняет определение пола ребёнка, так как наружные половые органы новорожденных девочек имеют мужские признаки.
При развитии сольтеряющей формы данного патологического состояния, клиническая картина включает такой симптомокомплекс:
- Новорожденный ребёнок очень медленно набирает массу тела.
- С момента появления ребенка на свет, у него отсутствует аппетит, наблюдается интенсивная многократная рвота, происходит напряжение мышц передней брюшной стенки, а также эпизоды срыгивания после каждого кормления.
- Развивается обезвоживание организма, при котором наблюдается стремительная потеря натрия и увеличение показателей калия в системном кровотоке.
В течение нескольких суток с момента рождения, дети с сольтеряющей формой адреногенитального синдрома перестают употреблять пищу, становятся вялыми, у них развивается коллаптоидное состояние, чреватое кардиогенным шоком или летальным исходом. При своевременном диагностировании адреногенитального синдрома и оказании необходимой помощи, имеются все шансы для нормализации общего состояния ребенка.
На первичном этапе диагностики врожденного адреногенитального синдрома, большое значение имеет анализ жалоб, которые предъявляет пациент. Далее, медицинский специалист выполняет общий осмотр пациента, оценивает состояние опорно-двигательного аппарата, кожных покровов и слизистых оболочек. Особое внимание уделяется росту и телосложению пациента. Также, оценивается степень и характер оволосения. Лабораторная диагностика врождённой формы адреногенитального синдрома, включает такие варианты обследования:
- Общеклиническое исследование крови, а также биохимический анализ крови, включающий оценку уровня электролитов. Особое внимание уделяется таким элементам, как натрий, хлориды и калий.
- Лабораторная оценка уровня тестостерона, эстрогенов, а также гормонов, вырабатываемых корковой частью надпочечников. Информативным методом диагностики, является лабораторная оценка уровня 17-гидроксипрогестерона. Если исследование выполняется женщине, то забор крови для исследования ведётся только в фолликулярную фазу менструального цикла. Результат исследования можно считать отрицательным в том случае, если показатели 17-гидроксипрогестерона составляют менее 200 нг/дл. Если концентрация данного вещества превышает цифру 500 нг/дл, то клинический диагноз подтверждается. Встречаются также ситуации, при которых уровень 17-гидроксипрогестерона составляет более 200 и менее 500 нг/дл. В данном случае, пациентам назначают дополнительный тест с адренокортикотропным гормоном. Если результаты теста составляют более 1000 нг/дл, то диагноз врождённого адреногенитального синдрома подтверждается.
- Общеклиническое исследование мочи.
Наиболее информативным методом инструментальной диагностики при подозрении на адреногенитальный синдром, является методика ультразвукового исследования. При подозрении на данный синдром у женщины, ей выполняется ультразвуковое исследование матки и ее придатков. У пациентов мужского пола, является обязательным исследование мошонки. Независимо от пола, пациентам назначается ультразвуковое исследование органов забрюшинного пространства, что позволяет оценить состояние почек и надпочечников.
При недостаточной информативности ультразвуковой методики, пациентам назначается магнитно-резонансная томография головного мозга, которая позволяет выявить очаговые опухолевидные изменения, а также гипертрофические изменения в гипофизе.
Наряду с общими диагностическими мероприятиями, пациентам с подозрением на врождённую форму адреногенитального синдрома, рекомендована дифференциальная диагностика, которая помогает исключить другие патологии со схожей клинической картиной. К таким патологиям относят:
- Функциональная недостаточность надпочечников. Характерным отличием является то, что проявления надпочечниковой недостаточности дают о себе знать только после воздействия провоцирующего фактора.
- Гермафродитизм. Очень часто, внешние проявления гермафродитизма протекают в сочетании с патологическими изменениями во внутренних половых органах.
- Пилоростеноз. Данное состояние имеет много общего с сольтеряющей формой врождённого адреногенитального синдрома.
- Опухоль надпочечников, продуцирующая андрогены. Как правило, данное состояние очень редко диагностируется в периоде новорожденности и в детском возрасте. Клинические проявления опухоли дают о себе знать во взрослом возрасте.
Основой комплексного лечения врожденной формы адреногенитального синдрома, является медикаментозная терапия. Препаратами выбора для лечения этого заболевания, являются такие глюкокортикостероиды, как Дексаметазон и Преднизолон. По сравнению с Преднизолоном, Дексаметазон отличается меньшим числом побочных реакций, поэтому данный препарат чаще используется в терапии адреногенитального синдрома у детей. Расчёт дозировки глюкокортикостероидного препарата ведётся с учётом показателей 17-гидроксипрогестерона.
Как правило, суточную дозировку препарата разделяют на несколько приемов, при этом основной объем препарата рекомендуют употреблять в вечернее время, что связано с ускорением синтеза гормонов. Если у пациента развилась сольтеряющая форма адреногенитального синдрома, то в дополнение к глюкокортикостероидам, ему назначается препарат Флудрокортизон. Для нормализации функционального состояния яичников у женщин, пациенткам назначается терапия комбинированными оральными контрацептивами, которые угнетают влияние андрогенов. Если данное состояние было диагностировано у женщины в период вынашивания ребенка, то с целью профилактики выкидыша назначается препарат Дюфастон, создающий благоприятные условия для вынашивания плода. Сохранить беременность на фоне адреногенитального синдрома помогает препарат Утрожестан, который назначается беременным женщинам до 32 недели гестации.
В медицинской практике отсутствуют какие-либо методы оперативного лечения адреногенитального синдрома. Оперативные методики могут использоваться только для коррекции внешнего вида наружных половых органов.
В современной медицинской практике не существует отдельных мер по профилактике врождённой формы адреногенитального синдрома. Для того чтобы предупредить внутриутробное формирование данного синдрома, еще на этапе планирования ребёнка, будущим родителям необходимо получить консультацию специалиста генетика, который позволит оценить возможные риски. Если в семье ранее отмечались случаи возникновения адреногенитального синдрома, то беременной женщине необходимо выполнить кариотипирование плода.
Вероятные осложнения данного патологического состояния, напрямую зависят от его формы. Если у ребёнка развилась сольтеряющая форма адреногенитального синдрома, то данное состояние несёт угрозу не только здоровью, но и жизни ребёнка. У пациентов с подобным диагнозом существенно увеличивается риск возникновения бесплодия.
Если речь идет об адреногенитальном синдроме у беременной женщины, то у неё существует повышенный риск самопроизвольного прерывания гестации. Сохранить беременность помогает только своевременная диагностика и комплексное лечение. Кроме того, пациенты с подобным диагнозом нередко имеют психоэмоциональные расстройства, включая депрессивные состояния. У таких пациентов нередко возникают суицидальные наклонности.
источник
Адреногенитальный синдром (АГС) является тяжелым эндокринным заболеванием. Он носит аутосомно-рецессивный тип наследования. Может встречаться одинаково, как у мужчин, так и у женщин. Выявить большинство форм можно уже с момента рождения. Данное состояние требует обязательного лечения, так как может за короткий срок вызвать развитие осложнений.
В качестве основной причины, приводящей к развитию адреногенитального синдрома, является генетическое нарушение, приводящее к недостатку фермента, участвующего в синтезировании гормонов стероидный группы, осуществляемой в надпочечниках.
Чаще всего это недостаточность гена, располагающегося в области короткого плеча, относящегося к шестой хромосоме. Реже причиной выступает недостаток такого фермента, как 3-бета-ол-дегидрогеназы и 11-бета-Гидроксилаза.
Патогенез заболевания сложный, связан он с тем, что вышеперечисленные ферменты понижают кортизол в сыворотке крови.
Из-за того, что уровень кортизола снижается, повышается секреция адреногенитальных гормонов, способствующих гиперплазии зоны в коре надпочечников, отвечающей за синтезирование андрогена.
В результате нарушения сложных биохимических процессов происходит:
- кортизоловая недостаточность.
- компенсаторно увеличивается адренокортикотропный гормон.
- снижается уровень альдостерона.
- наблюдается увеличение таких веществ, как прогестерон, 17-гидроксипрогестерон и андрогены.
Среди основных форм заболевания следует выделить:
- Адреногенитальный синдром в сольтеряющей форме. Является самой распространённой формой, которую диагностируют в детском возрасте от момента рождения до одного года. Характеризуется заболевание нарушением в гормональном балансе и недостаточности функциональной активности в коре надпочечников. При диагностике определяется альдостерон в низких для своей нормы значениях. За счёт него поддерживается водно-солевой баланс. Поэтому, при недостаточности альдостерона нарушается работа сердечно-сосудистой системы и проявляется нестабильность в артериальном давлении. В почечной лоханке появляется значительной отложение солей.
- Адреногенитальный синдром в вирильной форме. Является одним из классических вариантов патологического процесса. Надпочечниковая недостаточность в подобном случае не развивается. Изменяются лишь наружные половые органы. Проявляется он сразу с момента рождения. Со стороны внутренних органов нарушений репродуктивной системы не наблюдается.
- Адреногенитальный синдром в постпубертатной форме. Подобное течение заболевания нетипичное, встречаться может у сексуально активных женщин. В качестве причины можно определить не только наличие мутации, но и опухоли в надпочечниковой коре. Наиболее частым проявлением является развитие бесплодия. Иногда выявляться он может и при привычном невынашивании.
Симптомов адреногенитального синдрома достаточно много, зависеть они могут от преимущественной формы.
Среди них следует выделить основные проявления, типичные для всех форм:
- дети раннего возраста характеризуются высоким ростом и большой массой тела. Постепенно идёт изменение внешнего вида. К подростковому периоду наблюдается остановка в росте, масса тела подвергается нормализации. Во взрослом возрасте, люди, страдающие адреногенитальным синдромом, имеют низкий рост и худощавое телосложение;
- гиперандрогения характеризуется большими размерами полового члена и небольшими яичками у лиц мужского пола. У девочек адреногенитальный синдром проявляется пенисообразным клитором, оволосением имеющим преимущественно мужской тип (см. фото выше). Кроме того, девочки имеют признаки гиперсексуальности и грубого голоса;
- на фоне быстрого роста наблюдается выраженная деформация опорно—двигательной системы;
- люди характеризуются нестабильностью в психическом состоянии;
- в области кожных покровов имеются участки гиперпигментации;
- периодически появляется судорожный синдром.
При простой форме адреногенитальный синдром у мальчиков проявляется:
- увеличенным в несколько раз половым членом;
- мошонка приобретает выраженную гиперпигментацию, так же как и анальная область;
- отмечается выраженный гипертрихоз;
- уже в детском возрасте возникает эрекция;
- голос у мальчика грубый, имеет низкий тембр;
- на кожных покровах появляются вульгарные угри;
- идёт выраженная преждевременная маскулинизация и ускоренное формирование костной ткани.;
- рост может быть достаточно низким.
Постпубертатный врожденный адреногенитальный синдром проявляется:
- поздним наступлением менструации;
- менструальный цикл характеризуется выраженной нестабильностью, с нарушенной периодичностью и длительностью.имеется склонность к олигоменорее;
- отмечается избыточное оволосение, преимущественно по мужскому типу;
- кожа становится более жирной, расширяются поры в области лица;
- телосложение мужеподобное, характеризуется развитием широких плеч и узким тазом;
- молочные железы имеют небольшой размер, чаще это лишь кожная складка с недоразвитым соском.
Характеризуется тем, что строение наружных половых органов имеет интерсексуальные признаки.
- клитор имеет большие размеры, в области головки имеется экстензия уретры;
- размер и форма половых губ напоминает мошонку;
- в области мошонки и подмышечных впадин определяется избыточное оволосение;
- адреногенитальный синдром у новорожденных не всегда позволяет идентифицировать половую принадлежность. Девочки имеют большую внешнюю схожесть с мальчиками. В области молочных желёз в пубертатном периоде не отмечается роста.
- характеризуется у ребёнка наблюдается медленный прирост массы.
- сразу после рождения появляется сильная рвота, носящая повторный характер, аппетит отсутствует, в области живота появляются сильные боли с напряжением передней брюшной стенки, после каждого кормления срыгивание;
- достаточно быстро развивается обезвоживание, при котором снижается натрий, а калий повышается;
- ребёнок в течение нескольких суток становится вялым, перестаёт нормально сосать, сознание переходит в коллаптоидное вплоть до того, что развивается кардиогенный шок и возможный летальный исход при несвоевременно оказанной помощи.
Диагностика начинается с жалоб и анамнестических данных. Это могут быть изменения состояния ребёнка после рождения, нарушения репродуктивной функции, развитие привычного невынашивания.
Проводится обязательный внешний осмотр с оценкой состояния всех систем. Значительное внимание следует уделить фигуре, росту, и его соответствию возрастным параметрам, продлится осмотр характера оволосения и органов репродуктивной системы.
Обязательно требуется проведение лабораторных и инструментальных методов.
- общий анализ крови и биохимическое исследование с определением электролитов. Среди них обязательно определить уровень таких электролитов, как хлориды, натрий, калий и т.д;
- обязательной является оценка гормонального профиля. Требуется определить уровень гормонов коры надпочечников, эстрогенов и тестостерона, как свободного, так и связанного:
- большое значение играет определение уровня 17-гидроксипрогестерона. Для женщин измерение проводится только в период фолликулярной фазы. Исключить диагноз можно только в том случае, если его показатель будет ниже 200 нг/дл;
- при превышении значения больше 500 нг/ дл диагноз полностью подтверждают и не всегда требуются дополнительные методы;
- если значение больше 200, но при этом меньше 500 необходимо в целях постановки диагноза провести тест с АКТГ. При проведении теста АКТГ и получении значения выше 1000 нг/ дл выставляют диагноз адреногенитального синдрома;
- требуется оценить состояние мочи;
- из инструментальных методов большой популярностью пользуется ультразвуковое исследование органов.
- для девочек обязательно проводить УЗИ матки и придатков на момент оценки функции и наличии органической патологии;
- для мальчиков требуется оценить состояние органов мошонки при ультразвуковом исследовании;
- для лиц каждого пола требуется проводить УЗИ органов забрюшинного пространства с целью определить размер, структуру, наличие опухолевых образований в области надпочечников.
- в том случае, если при УЗИ не удаётся выявить патологических состояний в надпочечниках следует выполнить рентгенограмму черепа или магнитно-резонансную томографию головного мозга на предмет выявления очаговых опухолевых образований или гиперплазии участков гипофиза;
- дополнительным методом является электрокардиография для оценки функционального состояния сердечно-сосудистой системы.
Обязательным моментом в диагностике адреногенитального синдрома требуется исключать другие патологии.
Среди самых наиболее похожих патологий выделяют:
- гермафродитизм. Часто внешние нарушения дифференцировали могут сочетаться в патологией внутренних половых органов;
- надпочечниковая недостаточность. В данном случае требуется оценить дополнительные симптомы и диагностические методы, поскольку они часто схожи. Но надпочечниковая недостаточность проявляется после провоцирующего фактора на фоне предшествующего здоровья;
- андрогенпродуцирующая опухоль в надпочечниках. Развивается подобное состояние спустя некоторое время, в детском возрасте это редко встречающаяся патология;
- пилоростеноз. Это патология, которая имеет характерные симптомы с сольтеряющей формой.
Основу терапии составляют медикаментозные средства, проявляющие заместительные свойства. К ним относят средства из группы глюкокортикостероидов, такие как Преднизолон или Дексаметазон.
Преднизолон или Дексаметазон
Последний обладает меньшим количеством побочных эффектов, поэтому его используют преимущественно для лиц детского возраста. Расчёт дозировки осуществляется в индивидуальном порядке, в зависимости от уровня гормона. Суточную дозу следует делить на несколько приемов, приветствуется двукратный приём с употреблением основной части вещества в вечернее время. Это связано с тем, что в ночное время идёт усиленная выработка гормонов.
Если у пациента выявлена сольтеряющая форма, дополнительно применяется и Флудрокортизон.
С целью нормализации функции яичников применяются комбинированные оральные контрацептивы, которые способны оказывать антиандрогенное действие.
Особое внимание уделяется беременным женщинам. Для предотвращения выкидыша требуется назначение Дюфастона, способствующего созданию благоприятного гормонального фона. В настоящее время предпочтение отдаётся Утрожестану, данная лекарственная форма прогестерона может применяться до 32 недели беременности, что даёт возможность пролонгировать беременность до полного развития плода.
Оперативное лечение в данном случае не применяется. Возможно лишь использование пластических реконструктивных операций, направленных на исправление косметического дефекта в области половых органов.
Народные средства при лечении адреногенитального синдрома не применяются. Это связано с тем, что ни одно растительное средство не способно в полной мере восполнить дефицит гормона.
Мер специфической профилактики для предотвращения адреногенитального синдрома не существует. Это связано с причиной его возникновения.
Для того, чтобы предупредить рождение ребёнка с данным заболеванием следует на этапе зачатия проконсультироваться с генетиком и определить степень риска в возникновении синдрома. Это особенно важно если будущие родители или близкие родственники имеют подобную патологию.
При развивающейся беременности, родителям, в семье которых встречаются случаи данной патологии следует провести кариотипирование плода, с целью проверки генотипа на наличие дефектов и соблюдать все рекомендации по ведению беременности.
Течение заболевания во многом зависит от формы процесса.Адреногенитальный синдром у детей в сольтеряющей форме может представлять угрозу для жизни. В данном случае, важно, как можно раньше диагностировать патологию и проводить адекватную терапию.
У людей, страдающих адреногенитальным синдромом, повышается риск развития бесплодия, как у мужчин, так и у женщин.
В случае развития беременности существует высокий риск невынашивания. Для сохранения жизнеспособности плода требуется проводить сохраняющую терапию с первых дней после оплодотворения.
Пациенты с адреногенитальным синдромом часто страдают от депрессивных состояний и других психологических расстройств. Среди данной группы людей повышена частота суицидальных попыток.
При своевременной диагностике формы адреногенитального синдрома прогноз будет относительно благоприятным. Во многом более легкое течение патологии связано с формой заболевания. Тяжелее протекает лишь сольтеряющая форма, которая требует срочного медицинского вмешательства с назначением лекарственных средств.
Именно поэтому важно своевременно поставить диагноз при появлении у ребёнка ухудшения самочувствия или наличия признаков, свойственных для данного синдрома.
источник
Больные отмечают постепенно нарастающую слабость, утомляемость. У большинства из них выявляются нарушения со стороны желудочно-кишечного тракта: потеря аппетита, тошнота, рвота, боли в животе, похудание. Характерно снижение силы мышц, апатия, иногда психоз. Наряду с дегидратацией отмечаются гипотония, тахикардия. В крови — гипогликемия, гиперкалиемия, небольшое повышение азотистых шлаков. Существенным, однако необязательным, признаком аддисоновой болезни является гиперпигментация кожи и слизистых оболочек, связанная с отложением меланина, напоминающая темный загар. Эта пигментация наиболее выражена в складках кожи, в местах, подвергающихся трению и давлению. Проявления болезни усиливаются во время травмы, инфекции, когда могут возникнуть так называемые адреналовые кризы. При этом возможны резкие боли в животе, адинамия, коллапс.
Лабораторная диагностика надпочечниковой недостаточности трудна. Она требует введения АКТГ с последующим определением в моче различных стероидных соединений, количество которых у больных аддисоновой болезнью мало меняется по сравнению с исходным периодом.
• История болезни или обследование. • Анализы крови и мочи для измерения содержания гормонов.
АТ к надпочечникам направлены против микросомальных структур клеток коры надпочечников. Они принадлежат к IgG, обладают органоспеци-фичностью и чаще появляются у женщин. Определение АТ в сыворотке крови используют для установления патогенетических механизмов развития первичной атрофии надпочечников. АТ выявляются у 38-60% больных идиопатической болезнью Аддисона. С течением времени концентрация АТ при болезни Аддисона может изменяться, и они могут исчезать. АТ к адреналовым Аг удаётся выявить у 7-18% пациентов с туберкулёзной этиологией болезни Аддисона и 1% пожилых больных.
АДРЕНОГЕНИТАЛЬНЫЙ СИНДРОМ связан с избыточным выделением корой надпочечников мужских половых гормонов. Это может быть связано как с опухолью коры надпочёчников, так и в ряде случаев с усиленным выделением гипофизом гормонов, стимулирующих функцию надпочечников. При этом у женщин развиваются нарушения менструального цикла, появляются признаки оволосения по мужскому типу (вырастают борода, усы, волосы на туловище), атрофируются молочные железы. При обследовании таких больных обнаруживают увеличенное выделение с мочой 17-кетостероидов. При выявлении опухоли у таких больных необходимо оперативное лечение.
Врожденная дисфункция коры надпочечников — группа передающихся по аутосомно-рецессивному типу наследования нарушений синтеза гормонов коры надпочечников, а именно кортикостероидов. Иногда в качестве синонима врожденной дисфункции коры надпочечников используют термин «адреногенитальный синдром». Данное утверждение является не вполне правильным, так как адреногенитальный синдром обозначает патологическое изменение наружных половых органов из-за нарушения выработки надпочечниковых гормонов, что может происходить и при других состояниях, например при некоторых опухолях.
Сущностью термина «дисфункция» применительно к коре надпочечников является угнетение выработки только кортикостероидов при одновременном увеличении выработки других гормонов этого органа. В соответствии с дефектом того или иного фермента, принимающего участие в образовании гормонов надпочечников (стероидогенез), в настоящее время описано 5 основных типов врожденной дисфункции коры надпочечников. Кроме того, по наличию или отсутствию увеличения образования мужских половых гормонов (надпочечниковых андрогенов) врожденную дисфункцию коры надпочечников подразделяют на: врожденную дисфункцию с увеличенным образованием андрогенов и врожденную дисфункцию коры надпочечников без увеличения образования андрогенов (мужских половых гормонов).
В результате воздействия избытка надпочечниковых андрогенов, которое начинается уже на ранних стадиях развития плода, у новорожденных девочек имеется интерсексуальное строение наружных гениталий. Такое состояние носит название женского псевдогермафродитизма. Выраженность изменений варьирует от простой гипертрофии клитора до полной маскулинизации гениталий, т. е. их изменения по мужскому типу. При этом клитор становится пенисообразным, а отверстие мочеиспускательного канала перемещается на его головку. Строение внутренних гениталий у плодов с женским генотипом при врожденной дисфункции коры надпочечников всегда нормальное. У генотипических мальчиков с вирильной и сольтеряющей формами дефицита фермента стероидогенеза отмечается увеличение размеров пениса и потемнение мошонки за счет отложения большого количества пигмента.
При отсутствии лечения после рождения ребенка происходит быстрое появление мужских черт под влиянием мужских гормонов. Быстро закрываются зоны роста костей, в результате чего у взрослых, как правило, отмечается низкорослость.
Указанные изменения обозначаются как ускоренный псевдопубертат. У девочек при отсутствии лечения определяется первичная аменорея (отсутствие менструаций), что также объясняется действием избыточного количества мужских гормонов (андрогенов).
Выделяют две наиболее часто встречающиеся формы врожденной гиперплазии коры надпочечников. Они различаются между собой по типу фермента, принимающего участие в образовании гормонов надпочечниками. Первой формой является недостаточность фермента под названием 21-гидроксилаза, второй — недостаточность 11-гидроксилазы.
В случае идиопатической формы болезни Аддисона очень важно обнаружение надпочечниковых аутоантител. Выявление аутоантител даже при нормальной концентрации кортизола, альдостерона и повышенной концентрации АКТГ в крови свидетельствует о скрытой надпочечниковой недостаточности. Своевременное обнаружение надпочечниковых аутоантител способствует ранней диагностике нарушений функции коры надпочечников. При аутоиммунном генезе болезнь Аддисона часто сочетается с симптомами других заболеваний аутоиммунного генеза, таких как аутоиммунный гипотиреоз, гипопаратиреоз, сахарный диабет, гипофункция яичников, заболевания ЖКТ. Возможны случаи развития надпочечниковой недостаточности при наличии АТ к рецепторам АКТГ.
источник



