Карциноматозный асцит — это патологическое накопление жидкости в брюшной полости, развивающееся вследствие опухолевого поражения брюшины. Асцит вызывает значительный дискомфорт и приводит к различным функциональным нарушениям у пациентов в запущенных стадиях онкологического заболевания и является сложной клинической проблемой. Однако наличие асцита далеко не всегда свидетельствует об онкологическом заболевании.
Так скопление жидкости в полости брюшины может возникать как следствие цирроза печени и сердечной недостаточности. Малигнизированный асцит составляет, примерно, 10% среди всех случаев асцита и наиболее часто развивается при раке молочной железы, яичников, желудка, поджелудочной железы и толстой кишки.
В основе скопления в брюшной полости жидкости при злокачественном асците лежит несколько основных причин. Это закупорка опухолевыми клетками лимфатических сосудов брюшины, что нарушает нормальный отток перитонеальной жидкости, увеличение количества сосудов в стенке брюшины и повышение их проницаемости, связанные с продукцией опухолевыми клетками ряда специфических веществ, нарушение в организме больного белкового обмена вследствие потери белка с асцитической жидкостью и повышенного его распада.
Повышение внутрибрюшного давления при асците, сопровождающееся болями, потерей аппетита, одышкой, снижением физической активности, тошнотой и рвотой, значительно истощает силы больных. Эвакуация асцитической жидкости улучшает качество жизни больных с асцитом и может увеличивать сроки выживаемости.
На сегодняшний день арсенал методов лечения злокачественного асцита достаточно разнообразен. При напряженном асците наиболее часто производят лапароцентез. Процедура заключается в выполнении прокола передней брюшной стенки и введении в брюшную полость дренажа, через который эвакуируется содержащаяся в брюшной полости асцитическая жидкость. Несмотря на широкое распространение метода, его выполнение часто болезненно для пациента, сопряжено с риском повреждения внутренних органов, увеличивающимся с каждой последующей процедурой.
Альтернативой лапароцентезу является установка постоянных катетеров и подкожных портов, позволяющих, с одной стороны, эвакуировать асцитическую жидкость по мере ее накопления, а с другой – предотвратить необходимость повторных проколов.
Однако и эти методы не лишены недостатков, так как являются более дорогостоящими, требуют постоянного ухода за катетером и могут сопровождаться такими соложениями, как воспаление брюшины (перитонит) и закупоркой катетера.
Важное место в терапии злокачественного асцита занимает внутрибрюшинная химиотерапия. Введение противоопухолевых препаратов в брюшную полость подавляет активность злокачественных клеток, что уменьшает скорость накопления асцитической жидкости и, таким образом, увеличивает срок между эвакуациями.
Дополнительное значение при лечении злокачественного асцита имеют диуретики. Данные об их эффективности противоречивы. В целом положительный эффект от назначения мочегонных препаратов наблюдается в 45% случаев. Однако необходимо подчеркнуть, что применение диуретиков имеет второстепенное значение и может проводиться только как дополнение к хирургическим методам и внутрибрюшинной химиотерапии.
Таким образом, несмотря на то, что проблема лечения злокачественного асцита остается не решенной, существующие методы терапии во многом позволяют облегчить страдания больных и существенно повысить их качество жизни.
Эвакуация асцитической жидкости, несомненно, приводит к улучшению самочувствия больных с напряженным асцитом, однако эта процедура представляет собой достаточно большую нагрузку на организм. Снижение давление в брюшной полости приводит к изменению работы сердца, почек, других органов и может сопровождаться в первые двое-трое суток после операции значительными нарушениями функционирования сердечно-сосудистой системы. Кроме того, при эвакуации асцита больной неизбежно теряет до 10, а иногда и более, литров жидкости, богатой белками и электролитами. Поэтому крайне важно своевременно и эффективно предотвратить возникающие расстройства правильно подобранной медикаментозной терапией.
— применение полностью имплантируемых порт-систем и постоянных катетеров.
Карциноматозный асцит является рецидивирующим заболеванием.
Эвакуация асцита не предотвращает повторное накопление асцитической жидкости в брюшной полости, что часто требует проведение повторных лапароцентезов и пункций брюшной полости. Одной из методик, позволяющих предотвратить необходимость повторных проколов, является установка постоянного катетера. После лапароцентеза в брюшную полость устанавливается постоянный катетер, изготавливаемый из специального материала, не вызывающего аллергических реакций, что позволяет оставлять катетер в брюшной полости на длительный период времени.
По мере накопления асцита жидкость откачивается через катетер, что облегчает состояние пациента. Важно отметить, что такой катетер требует тщательного систематического ухода за ним со стороны больного для предотвращения возможных инфекционных осложнений.
Перитонеальный порт представляет собой титановую камеру с силиконовой мембраной, к которой присоединяется катетер. Установка порта представляет собой хирургическую операцию, в ходе которой свободный конец катетера вводится в брюшную полость, а титановый порт, устанавливается подкожно в области реберной дуги. При необходимости эвакуировать скопившуюся в брюшной полости жидкость врач специальной иглой прокалывает кожу и силиконовую мембрану камеры, попадая, таким образом, иглой в полость камеры. Через иглу откачивается асцитическая жидкость и при необходимости вводятся противоопухолевые препараты. Таким образом, установка подкожного порта позволяет, с одной стороны, предотвратить необходимость повторных проколов брюшной стенки (всегда опасных с точки зрения возможного повреждения внутренних органов), а с другой стороны, уменьшить число инфекционных осложнений, так как сама камера не контактирует с внешней средой.
— экстракорпоральная ультрафильтрация и реинфузия асцитической жидкости у онкологических больных.
Асцитическая жидкость при карциноматозном асците представляет собой биологическую жидкость по своему составу близкую к плазме крови.
При эвакуации асцита больной неизбежно теряет до 10, а иногда и более, литров жидкости, богатой белками и электролитами, что в последующем часто требует введения больших доз белковых и других плазмозамещающих растворов. Метод реинфузии асцитической жидкости заключается в фильтрации и концентрации асцитической жидкости больного, что позволяет очистить асцитическую жидкость и обогатить ее белком, и дальнейшем ее внутривенном введении. Таким образом, с одной стороны, отпадает необходимость в приобретении дорогостоящих препаратов, а с другой –больному возвращаются его собственные белки, необходимые организму.
-внутрибрюшинная и внутриплевральная химиотерапия.
источник
Специалисты клиники лечат асцит разного происхождения. Существенную часть пациентов клиники с асцитом составляют онкологические больные. В Клинике есть уникальное интервенционное отделение, где размещают качественные порт — системы от лучших изготовителей медицинского оборудования.
Каждый год специалисты клиники выполняет множество процедур, позволяющие имплантировать специальные порты для лечения боли. Некоторым людям они устанавливаются на долгие годы, другим — всего лишь несколько месяцев. Период, на который имплантируется порт, определяется от способа лечения, а заодно от доктора, назначающего лечение. Причина, в связи с которой лечащий доктор решил имплантировать порт, состоит в желании избежать множественных инфузий проводимых непосредственно в одну из периферических вен.
Вероятно, пациенту уже было выполнено большое число инъекций, и лечащий доктор или медсестра считают, что теперь весьма непросто нащупывать вену для выполнения новых пункций. Вероятно, подобные инфузии являются чересчур болезненными для пациента. Какова бы ни была причина установки, размещение порта позволяет осуществлять инъекции без боли в любое время и по мере того, когда это необходимо.
Установка качественного порта никак не сказывается обычном образе жизни человека и не заставляет его отказываться от многого из того, сем он занимался ранее. После заживления шва от имплантированного порта, человек вновь сможет заниматься плаванием, купанием, бегом. Если пациент достаточно ведет достаточно подвижный образ жизни, рыбачит или охотится, занимается приусадебным хозяйством, то ему нужно рассказать об этом лечащему доктору до установки порта. В этом случае он заблаговременно установит место его имплантации так, чтобы порт не препятствовал заниматься обычным делом. Порт практически не заметен и выглядит лишь как малая припухлость, находящаяся под кожей.
Размещение эпидурального порта эффективно обезболивает тяжелых онкобольных. Причем доза местного анестетика уменьшается почти в сто раз!
Порт, который имплантируется, позволяет выполнять инъекции медпрепаратов в целях обезболивания непосредственно в эпидуральную область в позвоночнике в течение продолжительного времени.
Благодаря размещению порта пациент или его родные могут самостоятельно выполнять каждодневные инъекции обезболивающих средств для обезболивания. Это позволяет сэкономить время и усилия, которые затрачиваются на помещения медучреждения, и способствует значительному улучшению качества жизни человека.
Пациент пребывает в клинике приблизительно четыре-пять часов. Сюда входит:
- регистрация пациента;
- подготовка к установке порта;
- выполнение процедуры имплантации порта
- последующее мониторинг со стороны лечащих врачей перед тем, как пациент будет выписан из клиники.
В операционной пациента попросят прилечь на бок. Потом в кисть или предплечье ему будет размещен внутривенный катетер. При этом врачи станут отслеживать параметры работы сердца, дыхания и давления, используя специальный монитор. Человека попросят прилечь на стол, где проводятся операции. Для того, чтобы повысить безопасность лечебной процедуры, создания большего удобства и уменьшения дозы облучения доктор применит ультразвуковой медаппарат диагностики – это позволит локализовать место, куда будет введен катетер. Затем врач подберет самую подходящую траекторию вкалывания иглы благодаря УЗ навигации. Пациенту выполнят введение малой дозы успокаивающего медпрепарата в целях расслабления и минимизации дискомфортных ощущений, а заодно сделают инъекцию анестетика непосредственно в место, куда будет установлен порт.
Установка эпидурального катетера выполняется сквозь малый надрез в спине. После этого его проводят под кожей (туннелируют) и выводят на кожную поверхность впереди на грудной клетке. Под кожей формируется карман для размещения камеры медикаментов. Ее присоединяют к катетеру, после чего два надреза закрывают швами. В последующем заполнение помпы осуществляется благодаря игле Губера.
На то, чтобы восстановиться после процедуры размещения порта, пациенту понадобится совсем немного времени. Могут наблюдаться боли непосредственно в стенке живота в том месте, где выходит порт, а заодно раздражение спины там, где имплантирован катетер. Как правило, такие ощущения являются минимальными и не приносят дискомфорта.
источник
Потому что лечение асцита — это наша специализация
В Клинике Лечения Асцита открыто уникальное отделение интервенционной онкологии, где устанавливаются порт-системы.
Длительная и устойчивая ремиссия при введении химиопрепаратов. Повторное выведение жидкости не требуется как минимум 2 месяца.
Индивидуальное меню для оптимизации эффективности лечения. Заметное улучшение состояния больных в течение долгого времени.
Комплексный командный подход в ведении пациентов позволяет добиться заметного улучшения состояния даже в самых тяжелых случаях.
В Клинике Лечения Асцита используются следующие подходы
- Комплексное лечение, включающее лапароцентез с помощью временных и постоянных перитонеальных катетеров, не ограничивающих пациента в движении.
- В целях поддержания жизненно важных органов назначается многокомпонентная терапия.
- Химиотерапия для улучшения ситуации с онкологическим асцитом при прогрессирующем раке яичников и ободочной кишки.
- Для коррекции состояния больных в нашей клинике проводится дезинтоксикационное и общеукрепляющее лечение.
- Внутриполостная химиотерапия: после удаления жидкости в брюшную полость вводится химиопрепарат. Повторная эвакуация не требуется минимум 2 месяца.
Эффективность консервативного лечения 15%
Улучшение при онкологическом асците с помощью химиотерапии 50%
Эффективность внутриполостной химиотерапии 60%
Высокое качество жизни во время лечения 90%
Следует помнить, что образование асцита — признак серьёзных проблем со здоровьем, успешное решение которых напрямую зависит от своевременной диагностики. Не теряйте времени!
В Клинике Лечения Асцита мы работаем с асцитом различного происхождения.
Значительную часть наших пациентов с асцитом составляют онкобольные.
Чтобы подобрать лечение необходимо учитывать несколько факторов. Это причина возникновения асцита, объём накопленной жидкости и состояние сосудов. Последнее нужно для того, чтобы восстановившийся кровоток не привёл к отрыву тромба, если таковой имеется.
Она нужна для того, чтобы нормализовать водно-солевой обмен и уменьшить образование жидкости в брюшной полости.Консервативная терапия применяется в лечении небольших асцитов и средней степени выраженности.
Прокол брюшной стенки под контролем УЗИ. Метод используется не только для проведения однократного устранения асцита. Если состояние требует – устанавливается катетер, который позволит регулярно, безболезненно и безопасно эвакуировать жидкость.
В Клинике Лечения Асцита регулярно проводится постановка подкожных систем для введения химиопрепаратов. Эти системы называются перитонеальными портами или просто – порты.
Порт представляет собой титановую камеру с силиконовой мембраной, к которой присоединяется катетер. Во время выполнения процедуры имплантации пациент не чувствует никаких болезненных ощущений и дискомфорта. Через 2-3 часа после операции и проверки работоспособности порта пациент может отправляться домой или переходить к следующему этапу лечения – химиотерапии.
Устраняет необходимость частых и болезненных проколов и обеспечивает простое и надежное введение лекарственных препаратов.
Порт оптимален для осуществления внутриполостной химиотерапиии, которая может выполняться в амбулаторных условиях.
Порт незаметен под кожей, не создает дискомфорта при обычной жизни (работа, занятие спортом, принятие душа, бассейн и др.)
Имплантированный порт может использоваться до 12-24 месяцев без необходимости переустановки.
Мы помогаем даже в тех случаях, от которых другие отказываются.
В Клинике Лечения Асцита для этого есть квалификация врачей и необходимые технологии.
Главный врач Европейской клиники, врач-онколог, к.м.н.
Одна из причин асцита – канцероматоз (поражение раковыми клетками) брюшины. Это опасное состояние. Средняя продолжительность жизни таких больных составляет 2 месяца.
Гипертермическая интраперитонеальная химиотерапия (HIPEC) – инновационный метод лечения в онкологии. После того как хирурги удаляют из брюшной полости видимые опухолевые очаги, её промывают раствором химиопрепарата, подогретым до 42–43 °C.
За счет нагревания препарат проникает глубже в опухолевую ткань, эффективнее ее уничтожает.
Ниже риск побочных эффектов.
Можно применять более высокие дозы.
Химиопрепарат действует локально, непосредственно контактирует с опухолевыми клетками.
Средняя продолжительность жизни после HIPEC измеряется годами. Во время процедуры опухоль может быть уничтожена полностью.
Следует помнить, что образование асцита — признак серьёзных проблем со здоровьем, успешное решение которых напрямую зависит от своевременной диагностики. Не теряйте времени!
В тяжёлых случаях выводить жидкость нужно очень медленно, иногда в течение нескольких дней. Если курс лечения предполагает внутриполостную химиотерапию, то проводить её следует только под присмотром нескольких специалистов. Восстановление запаса белков, витаминов и микроэлементов, потерянных с выведенной жидкостью – это сложная процедура, также требующая стационарных условий.
В Европейской клинике действует специальное предложение
на дренирование асцита в условиях дневного стационара — 50000 руб.
- Осмотр и консультация хирурга-онколога.
- Общий анализ крови, биохимический анализ крови, ЭКГ.
- УЗИ органов брюшной полости с определением уровня свободной жидкости.
- Проведение лапароцентеза с УЗИ навигацией.
- Комплексная медикаментозная терапия, направленная на восстановление водно-электролитного баланса.
Лечение асцита проводится с применением наиболее современных методик, передового опыта российских и зарубежных врачей. Мы специализируемся на лечении рака и знаем, что можно сделать.
источник
Владельцы патента RU 2620150:
Изобретение относится к медицине, хирургии. Имплантируют подкожную порт-систему с внутрибрюшным катетером под спинальной анестезией. Формируют подкожный карман для камеры порта из разреза длиной 3 см в левой мезогастральной области по среднеключичной линии на уровне пупка. Рассекают апоневроз прямой мышцы живота и брюшину для проведения катетера в брюшную полость. Катетер вводят в брюшную полость на протяжении 10-12 см при помощи длинного анатомического пинцета и располагают свободно в малом тазу. Место вхождения катетера ушивают кисетным и 2-3 отдельными узловыми швами на передний листок апоневроза прямой мышцы живота. Камеру порта подшивают к апоневрозу прямой мышцы нерассасывающимся шовным материалом. Способ имплантации устройства для эвакуации асцитической жидкости и проведения внутрибрюшной химиотерапии позволяет уменьшить травматизацию тканей и снизить частоту послеоперационных осложнений. 2 пр.
Изобретение относится к медицине, а именно к хирургии, и может быть использовано для имплантации подкожной порт-системы с внутрибрюшным катетером.
Полностью имплантируемые порт-системы с катетером в брюшной полости обеспечивают простой и безопасный доступ для внутрибрюшного введения химиопрепарата. Они являются оптимальным методом для осуществления долгосрочного интраперитонеального доступа при проведении внутрибрюшной химиотерапии, которая может выполняться при диссеминированном раке желудка, тонкой и толстой кишки, яичника.
В мировой литературе описано множество методов установки порта, однако отсутствие точных рекомендаций по имплантации и обслуживанию подкожных порт-систем существенно замедляет процесс внедрения этого метода в стандартный объем медицинской помощи.
Известен способ интраоперационной имплантации системы в левую подреберную область. При этом катетер проводится в подкожной жировой клетчатке вниз до уровня пупка, где проникает в брюшную полость (Sugarbaker, P.H., Bijelic, L., Adjuvant bidirectional chemotherapy using an intraperitoneal port, Journal/Gastroenterol Res Pract, 2012, 752643 2012). В этом исследовании осложнения, связанные с порт-системой, развились у 8 (19,3%) пациентов, среди них инфицирование места расположения подкожной камеры, окклюзия просвета катетера и перфорация толстой кишки.
Недостатками данного способа являются: невозможность применения с использованием спинальной анестезии в качестве обезболивания в связи с высокой вероятностью возникновения дыхательной недостаточности на фоне «высокого блока». Риск возникновения осложнений во время общего наркоза среди больных, перенесших обширную циторедуктивную операцию, крайне высок и может стать противопоказанием к имплантации порт-системы. Кроме того, этот метод подразумевает протяженное туннелирование подкожной жировой клетчатки для проведения катетера от камеры порта то места вхождения в брюшную полость. Это сопровождается значительной травматизацией мягких тканей передней брюшной стенки с риском развития кровотечения и других осложнений.
Известен способ имплантации подкожного порта на реберной дуге с подшиванием его к реберной фасции (Black, D. Levine, D.A. Nicoll, L. Chou, J.F. Iasonos, A. Brown, C.L. Sonoda, Y. Chi, D.S. Leitao, M.M. Abu-Rustum, N.R. Ferguson, S.E., Barakat, R.R., Low risk of complications associated with the fenestrated peritoneal catheter used for intraperitoneal chemotherapy in ovarian cancer, Journal/Gynecol Oncol, 109, 39-42 2008).
Недостатки способа: такое расположение порта часто вызывает болевые ощущения в связи с раздражением межреберных нервов самой системой и фиксирующими ее швами. Среди пациенток кожа в проекции расположенной на передней поверхности нижних ребер камеры порт-системы постоянно натирается нижним бельем, к тому же сам порт может вызывать дискомфорт при лежании на боку.
Наиболее близким к заявляемому способу является способ имплантации инфузионной системы в правой или левой подвздошных областях (Emoto, S. Ishigami, H. Hidemura, A. Yamaguchi, H. Yamashita, H. Kitayama, J., Watanabe, T., Complications and management of an implanted intraperitoneal access port system for intraperitoneal chemotherapy for gastric cancer with peritoneal metastasis, Journal/Jpn J Clin Oncol, 42, 1013-1019, 2012). При этом под эндотрахеальным наркозом камеру порта имплантируют через небольшой разрез кожи по параректальной линии, а внутрибрюшной катетер располагают в малом тазу при помощи лапароскопии. Разработаны и варианты предотвращения рефлюкса препарата и миграции катетера путем наложения нескольких кисетных швов на брюшину вокруг места его вхождения в брюшную полость.
Недостатками способа являются: необходимость применения эндотрахеального наркоза и лапароскопии, что значительно увеличивает время операции и анестезиологический риск; высокий процент осложнений, связанных с установкой и эксплуатацией порт-системы — 27 (21%), в том числе инфицирование подкожного «кармана» в 6,9% случаев, формирование абсцессов малого таза, заброс химиопрепарата из брюшной полости в подкожную жировую клетчатку, а также образование имплантационных метастазов в области расположения порта и местах стояния троакаров.
Задачей заявляемого изобретения является снижение травматизации и частоты послеоперационных осложнений.
Технический результат состоит в возможности имплантации под спинальной анестезией и уменьшении времени операции.
Поставленная задача решается способом имплантации подкожной порт-системы с внутрибрюшным катетером, заключающимся в том, что установку производят под спинальной анестезией из доступа длиной 3 см в левой мезогастральной области по среднеключичной линии на уровне пупка, формируют подкожный карман для камеры порта и рассекают апоневроз прямой мышцы живота и брюшину для проведения катетера в брюшную полость, место вхождения катетера дополнительно укрывают кисетным и 2-3 отдельными узловыми швами на передний листок апоневроза прямой мышцы живота в продольном направлении, камеру порта подшивают к апоневрозу прямой мышцы в трех точках через отверстия на корпусе с помощью нерассасывающегося шовного материала.
Способ осуществляют следующим образом.
После двукратной обработки операционного поля раствором йодопирона по левой среднеключичной линии на уровне пупка производят горизонтальный кожный разрез длиной 3 см, рассекают подкожную жировую клетчатку до апоневроза. Далее тупым и частично острым путем с использованием электрокоагуляции отсепаровывают клетчатку вниз на 1,5-2 см и вверх на 4-5 см с формированием подкожного «кармана» для камеры порта. Затем на протяжении 1 см в продольном направлении чуть ниже кожного разреза рассекают передний листок апоневроза прямой мышцы живота, тупым путем расслаивают волокна прямой мышцы до достижения заднего листка ее апоневроза и париетальной брюшины. После рассечения брюшины накладывают кисетный шов с использованием нерассасывающегося шовного материала. Для обеспечения более эффективного распределения препарата и профилактики обтурации просвета фиброзными массами формируют несколько дополнительных отверстий диаметром до 3-4 мм по окружности катетера. Последний далее вводят в брюшную полость на протяжении 10-12 см при помощи длинного анатомического пинцета и располагают свободно в малом тазу, при этом оценивают степень адгезивного процесса. После этого кисетный шов на брюшине завязывают и накладывают 2-3 отдельных узловых шва на передний листок апоневроза прямой мышцы живота в продольном направлении для дополнительной фиксации катетера и дополнительного укрывания места его вхождения в брюшную полость. Следующим этапом устанавливают камеру порт-системы в сформированную ранее полость в подкожной жировой клетчатке. Катетер укорачивают таким образом, чтобы длины его подкожной части было достаточно для надежного соединения с камерой порта без натяжения или образования изгибов, затем фиксируют его к порту с помощью металлической манжеты. Камеру порта подшивают к апоневрозу прямой мышцы в трех точках через отверстия на корпусе с помощью нерассасывающегося шовного материала. Далее производят послойное ушивание раны.
Приводим конкретные примеры осуществления способа.
Диагноз: рак тела и кардиального отделов желудка, инфильтративно-язвенная форма, T4N1M0, IV стадия. Гистологически — низкодифференцированная аденокарцинома.
Операция: Лапароскопическая гастрэктомия с резекцией абдоминального отдела пищевода с формированием эзофагоеюноанастомоза по Ру из верхнесрединного минилапаротомного доступа, лимфаденэктомия D2, резекция мезоколон от 17.02.16 г.
Интраоперационно: в брюшной полости асцита нет, на париетальной поверхности брюшины во всех отделах отмечаются множественные просовидные высыпания до 3-4 мм диаметре. Желудок увеличен за счет субтотального опухолевого поражения. Опухоль размером 10×8×4 см, прорастающая все слои стенки, подрастающая в парапанкреатическую клетчатку в проекции перешейка поджелудочной железы, врастающая в мезоколон на протяжении 2 см и левее среднеободочных сосудов. Регионарные лимфатические узлы увеличены до 1 см, отмечаются увеличенные до 2 см лимфатические узлы по ходу в области чревного ствола.
Консультирована химиотерапевтом, рекомендована комбинированная химиотерапия кселодой 3500 мг в сутки (4 таблетки утром, 3 вечером) и карбоплатин 450 мг перитонеально. Через 14 дней после операции госпитализирована для имплантации подкожной порт-системы с перитонеальным катетером. Операция проведена под спинальной анестезией из доступа длиной 3 см в левой мезогастральной области по среднеключичной линии на уровне пупка, место вхождения катетера дополнительно укрыто кисетным и 3 отдельными узловыми швами, камера порта подшита к апоневрозу прямой мышцы в трех точках через отверстия на корпусе с помощью капроновой нити. Выписана на 4 день после операции, после удаления швов проведено первое внутрибрюшное введение препарата. Проведено 12 курсов внутрибрюшной химиотерапии. Осложнений не отмечено.
Диагноз: рак тела желудка, тотальное поражение с переходом на абдоминальный отдел пищевода, с прорастанием тела и хвоста поджелудочной железы, левого купола диафрагмы, левой доли печени, инфильтративно-язвенная форма, T4bN3M1, канцероматоз висцеральной и париетальной брюшины, асцит, гистологически — умереннодифференцированная аденокарцинома. Имплантационный метастаз в переднюю брюшную стенку.
Операция: лапаротомия, ревизия брюшной полости, гастрэктомия с резекцией нижнегрудного отдела пищевода, лимфаденэктомия, дренирование брюшной полости.
При ревизии: в брюшной полости до 600 мл асцитической жидкости, обширный канцероматоз, висцеральная и париетальная брюшины на фоне выраженного фибропластического процесса. Имеются множественные метастатические узлы диаметром до 3 см, покрывающие петли тонкой и толстой кишки и их брыжейки. Желудок ригиден, прорастает левый купол диафрагмы. Опухолевые конгломераты прорастают корень брыжейки поперечно-ободочной кишки в проекции средних ободочных и верхнебрыжеечных сосудов.
В качестве паллиативного лечения больному была рекомендована установка порт-системы для эвакуации асцитической жидкости, а также проведение внутрибрюшной химиотерапии. Имплантация выполнена на 10 сутки после операции под спинальной анестезией из доступа длиной 3 см в левой мезогастральной области по среднеключичной линии на уровне пупка, место вхождения катетера дополнительно укрыто кисетным и 2 отдельными узловыми швами, камера порта подшита к апоневрозу прямой мышцы в трех точках с помощью нити Пролен 2/0.
Проведено 8 курсов внутрибрюшной химиотерапии по рекомендованной схеме, на фоне которой удалось замедлить накопление асцита и упростить процедуру лапароцентеза.
Имплантация порт-системы по заявляемому способу проведена 104 пациентам. Все пациенты прослежены в течение шести и более месяцев. Из них нарушение протокола лечения (задержка на 3-4 недели) по причине осложнений, связанных с портом, отмечено у 3 (2,9%) больных.
Заявляемый способ имплантации порт-системы позволяет уменьшить травматизацию и снизить частоту послеоперационных осложнений до 2,9%, а также провести имплантацию порт-системы под спинальной анестезией и сократить время операции.
Способ имплантации подкожной порт-системы с внутрибрюшным катетером, заключающийся в том, что установку производят под спинальной анестезией из доступа длиной 3 см в левой мезогастральной области по среднеключичной линии на уровне пупка, формируют подкожный карман для камеры порта и рассекают апоневроз прямой мышцы живота и брюшину для проведения катетера в брюшную полость, место вхождения катетера дополнительно укрывают кисетным и 2-3 отдельными узловыми швами на передний листок апоневроза прямой мышцы живота в продольном направлении, камеру порта подшивают к апоневрозу прямой мышцы в трех точках через отверстия на корпусе с помощью нерассасывающегося шовного материала.
источник
Инновационные технологии в химиотерапии
В Европейской онкологической клинике регулярно проводится постановка подкожных систем для длительной внутривенной инфузии лекарственных веществ, включая химиопрепараты, забора крови на исследования и переливания кровекомпонентов. Эти системы называются инфузионными портами или для краткости используют профессиональный жаргонизм – порты.
Ежегодно множеству людей имплантируются порт-системы Селсайт (Celsite ® ). Некоторым на несколько месяцев, некоторым — на несколько лет; все зависит от продолжительности лечения.
Врач назначает имплантацию порт-системы чтобы избежать повторных внутривенных вмешательств, которые случаются всякий раз при назначении новых курсов химиотерапии. При повторных катетеризациях происходит значительное травмирование вен; частые инфузии в периферические вены и смена катетеров могут привести к развитию флебитов.
Применение порт-систем у больных с онкологическими заболеваниями это неотъемлемая часть «золотого стандарта» лечения.
Порты широко используются в странах Западной Европы у пациентов с впервые выявленным онкологическим заболеванием, которым планируется проведение множественных сеансов химиотерапии, особенно цитостатическими препаратами, которые вызывают повреждение периферических вен. Кроме того, инфузионные порты устанавливаются пациентам с тонкими периферическими венами на руках и ногах. В отечественной онкологической практике порты используются редко.
Согласно рекомендациям «Европейской онкологической ассоциации», наиболее рациональным является установка порт-системы на самом раннем этапе химиотерапии до появления периферических флебитов тем онкологическим пациентам, которым планируется проведение длительной химиотерапии.
В различных странах Западной Европы инфузионные порты устанавливают 95% всех пациентов, получающих длительные курсы химиотерапии.
Инфузионный порт позволяет упростить процедуры забора венозной крови на лабораторные исследования, существенно облегчить парентеральное питание, повысить эффективность переливания компонентов крови, особенно тромбоконцентрата, а также ряд других манипуляций, требующих постановки центрального внутривенного катетера.
Инфузионный порт представляет собой титановый резервуар в виде толстой монеты диаметром около 4-4,5 см и толщиной около 1 см, который покрыт изнутри биоинертным полимером. На верхней его плоской части установлена мембрана из многослойного силикона, через которую вводят лекарственные препараты. Порт имеет тонкую трубочку-катетер длиной до 10-15 см, которая пропускается в яремную вену и реже в артерию. Сам инфузионный порт устанавливается, как правило, под кожей в верхней трети грудной клетки во время небольшой хирургической операции. Место и способ постановки порт-системы определяется общим состоянием пациента и планируемого вида лечения.
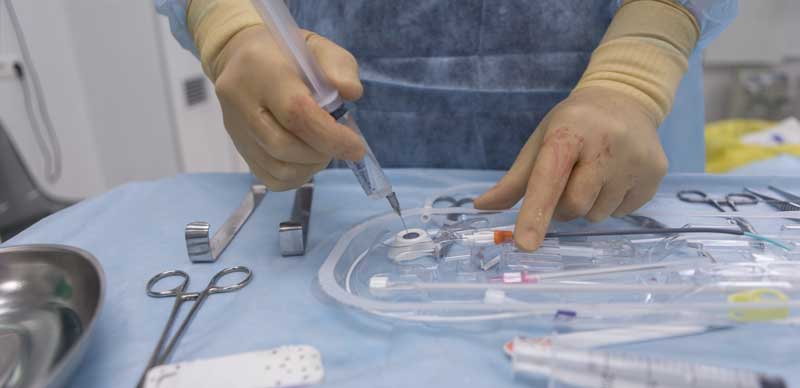
Процедура имплантации инфузионного порта проводится в условиях рентген-операционной под кратковременным наркозом. В нашей стране, к сожалению, крайне небольшое число специалистов имеет существенный опыт установки порт-систем. Наши врачи-рентгенхирурги имеют опыт установки порт-систем как под рентгеновским, так и ультразвуковым контролем.
Во время выполнения процедуры имплантации пациент не чувствует никаких болезненных ощущений и дискомфорта. Через 2-3 часа после операции и проверки работоспособности порта пациент может отправляться домой или переходить к следующему этапу лечения – химиотерапии.
После обработки кожи специальным дезинфицирующим раствором выполняют укол иглой в центральную вену, затем в иглу заводят тонкий металлический проводник, по которому вводят специальный катетер примерно 2 мм в диаметре. Выполняют небольшой разрез кожи и устанавливают порт под кожу, затем соединяют порт и установленный в вену катетер. Разрез ушивают несколькими косметическими швами.
- Установка инфузионной порт-системы, со стоимостью порта. Порт.
- Первичный осмотр врача-специалиста при госпитализации.
- Определение группы крови и резус-принадлежности.
- Установка катетера в периферическую вену.
- Забор крови.
- ЭКГ в 12 отведениях (кардиодом).
- Общий анализ крови (CITO).
- Общая биохимическая панель (ALB, ALP, ALT, AMY, AST, BUN, Ca, CRE, GGT, GLU, TBIL, TP, UA) (CITO).
- Пребывание в дневном стационаре — 1 час (до 3 часов).
- Консультация врача-эндоваскулярного хирурга, к.м.н., первичная.
Срок эксплуатации порт-системы зависит от длительности лечения и может составлять от 6 месяцев до нескольких лет. Если ваш лечащий врач принял решение о приостановке на время курса химиотерапии, порт – система останется работоспособной. В этом случае потребуется профилактический уход и промывание системы каждые 4-6 недель.
До инъекции кожа вокруг порта асептически обрабатывается. Специальной иглой Губера прокалывают мембрану порта и проверяют функциональность и проходимость катетера. Далее игла фиксируется с помощью стерильной салфетки и наклейки. По окончании инфузии химиопрепаратов систему промывают физраствором или физраствором с гепарином. Применения гепарина после окончания процедуры называют «гепариновый замок». Гепарин применяют в случае использования некоторых лекарственных препаратов, для предотвращения образования тромбов и закупоривания порт-системы.
Если вы испытываете дискомфорт, чувство жжения, наблюдаете покраснение кожи, следует немедленно обратиться к врачу. Правильно имплантированная и обслуживаемая порт-система не вызывает неприятных ощущений и делает процедуру инфузии безболезненной.
Большинство современных порт-систем не являются препятствием для проведения исследования. В Европейской онкологической клинике устанавливаются более 10 типов портов, в том числе системы для инфузии с высоким давлением и для компьютерной томографии с контрастированием. Об особенностях вашей системы проконсультируйтесь с лечащим врачом.
Необходимо спросить об этом своего лечащего врача. Ответ зависит от места установки порта.
Да, будет. Если порт установлен, а постоянная инфузионная терапия не проводится, или принято решение о временном прекращении химиотерапии, то инфузионный порт необходимо промывать каждые 4–6 недель во избежание его закупорки.
Мы рекомендуем установку порт-систем всем пациентам, которым планируется проведение многократных или длительных (до 46 часов) курсов химиотерапии. Кроме того, мы активно используем порт-системы у пациентов, находящихся на симптоматической паллиативной терапии, у которых затруднен обычный венозный доступ, и которые требуют парентерального питания из-за развившихся стенозов пищевода и кишечника.
Инфузионный порт помогает быстро и безболезненно осуществить забор крови, ввести лекарственные препараты в экстренной ситуации для спасения жизни пациента.
Порт-системы для длительного введения — это новая ступень развития техники внутривенных процедур после периферических и центральных венозных катетеров.
Основные преимущества применения инфузионной порт-системы для постоянного венозного доступа у онкологических пациентов:
- позволяет наладить быстрый венозный доступ при необходимости получения крови или экстренного введения препаратов с целью спасения жизни;
- существенно уменьшает риск развития флебитов на фоне постоянных внутривенных вмешательств во время специального лечения;
- создает возможность многократного введения препаратов раздражающего действия (химиопрепаратов), уменьшая неприятные ощущения;
- позволяет проводить регулярный безболезненный забор крови из вены для проведения лабораторных исследований;
- формирует психологический комфорт для большинства пациентов, поскольку устраняет боязнь частых и болезненных инъекций;
- порт может использоваться длительное время (в течение 12-24 мес.) без необходимости переустановки;
- инфузионный порт устанавливается незаметно под кожей, что обеспечивает хороший косметический эффект, уменьшает риск инфицирования при проведении регулярных внутривенных манипуляций;
- инфузионный порт не создает дискомфорта при обычной жизни (работа, занятие спортом, принятие душа, бассейн и др.);
Максимальный срок наблюдения пациентов с инфузионными порт-системами — 3-5 лет, при обеспечении правильного ухода за ними.
Современные порт-системы обеспечивают очень высокое качество жизни онкологических больных. Порт-система обычно размещается в мягких тканях в подключичной ямке над областью молочной железы, ближе к плечевому суставу. У большинства пациентов порт практически не заметен. У худощавых пациентов применяются специальные порт-системы для кахексичных больных. В любом случае, на коже нет никаких выступающих деталей. Каких-либо ограничений после постановки порта не возникает.
В Европейской онкологической клинике широко используются системы основных мировых производителей, которые обеспечивают простое и надежное введение лекарственных препаратов. Мы устанавливаем пациентам более 10 различных видов портов: стандартные подкожно- имплантируемые порты, порты низкого профиля, двойные порты с двухпросветным катетером, имплантируемые порт-системы для инфузии высокого давления и для контрастной компьютерной томографии, а также подкожные имплантируемые порт-системы сосудистого доступа.
В настоящий момент в силу ограниченности спроса и высокой технологичности изготовления порт-систем их стоимость достаточно высока. Кроме того, небольшое число врачей-специалистов имеют достаточный опыт постановки портов. Кроме того, порт-системы требуют правильного использования – допускается использование только специальных игл Губера при введении химиопрепаратов через порт-систему.
В Европейской онкологической клинике порт-системы устанавливает профессор, д.м.н., Лауреат Премии Ленинского комсомола, Лауреат Премии Правительства РФ, руководитель «Центра рентгенохирургии» НИИ Клинической хирургии РНИМУ Сергей Анатольевич Капранов.
источник
Московского
Онкологического
Общества
ПРОДВИЖЕНИЕ «В НОГУ СО ВРЕМЕНЕМ»: МОСКОВСКОЕ ОНКОЛОГИЧЕСКОЕ ОБЩЕСТВО ПРОДОЛЖАЕТ ОБСУЖДАТЬ РАЗРАБОТКИ СОВРЕМЕННОЙ ОНКОЛОГИИ
ЗАСЕДАНИЕ 565
состоится в четверг 25 февраля 2010 г. в 17:00
в конференц-зале
Российского онкологического научного центра им. Н.Н. Блохина
Президиум: проф. А.И. Пачес, чл.-корр. РАН, проф. М.Р. Личиницер, д.м.н. Ю.В. Буйденок
ИМПЛАНТИРУЕМЫЕ ИНФУЗИОННЫЕ СИСТЕМЫ
ИМПЛАНТИРУЕМЫЕ ИНФУЗИОННЫЕ СИСТЕМЫ ДЛЯ ДЛИТЕЛЬНОГО ВЕНОЗНОГО ДОСТУПА В ОНКОЛОГИИ
Буйденок Ю.В., Мещеряков А.А., Бредер В.В., Феденко А.А., Мачак Г.А., Буйденок В.Ю., Чернов И.С., Нисиченко Д.В.
(Российский онкологический научный центр им. Н.Н. Блохина)
ПРИМЕНЕНИЕ ИНТРАПЕРИТОНЕАЛЬНЫХ ПОРТ-СИСТЕМ ДЛЯ ВНУТРИБРЮШИННОЙ ХИМИОТЕРАПИИ ПРИ РАСПРОСТРАНЕННОМ РАКЕ ЯИЧНИКОВ
Тюляндина А.С., Буйденок Ю.В., Жорданиа К.И., Кузнецов В.В., Стенина М.Б.
(Российский онкологический научный центр им. Н.Н. Блохина)
ЗАСЕДАНИЯ БУДУЩЕГО
Организационный комитет предлагает специалистам, составляющим Московское Онкологическое общество, обсудить предлагаемую повестку дня предстоящих заседаний. В перечне актуальных проблем онкологии – организационная проблематика, возможности хирургического лечения онкологических больных при сопутствующей ИБС, современное состояние лечебных возможностей при раке молочной железы, опухолях билео-панкреато-дуоденальной зоны, нейроэндокринных новообразованиях. Предложены методики подавления болевого синдрома (нейролизис чревных ганглиев), определения предельно допустимых резекций печени; новые данные о ПЭТ-диагностике распространенности опухолевого процесса.
В ряде разработок представлены систематизированные результаты исследований и уже просматриваются подготовленные решения. Другие анонсы заседаний лишь в общих чертах обозначают проблемные положения, что предполагает вероятность разносторонних дискуссий. Оргкомитет готов рассмотреть (и передать авторам публикаций) острые вопросы, опубликовать поучительные случаи из медицинской практики, другие материалы по объявленной тематике.
В опубликованных анонсах заседаний обращает внимание значительная частота сообщений из НИИ клинической онкологии РОНЦ им. Н.Н. Блохина, что подтверждает должный научно-практический потенциал этого ведущего онкологического центра. Вместе с тем, оргкомитет просит потенциальных авторов дополнить предложенную тематику, обоснованно полагая, что представление результатов собственных исследований, как правило, отражает рейтинг специалистов в профессиональном сообществе.
PROCEEDINGS OF THE MOSCOW CANCER SOCIETY
№ 565 (February 25, 2010)
IMPLANTED PORT-SYSTEMS FOR LONG-TERM INTRAVENOUS ACCESS
Report-1: IMPLANTED PORT-SYSTEMS FOR LONG-TERM INTRAVENOUS ACCESS IN PATIENTS WITH CANCER. By Prof. Yu.Buidenok et al. (The N.N.Blokhin Cancer Research Center).
Report-2: THE USE OF INTRAPERITONEAL PORT-SYSTEMS FOR CHEMOTHERAPY IN PATIENTS WITH LOCALLY WIDESPREAD OVARIAN CARCINOMA. By Dr. A.Tuliandina et al. (The N.N.Blokhin Cancer Research Center).
ИМПЛАНТИРУЕМЫЕ ИНФУЗИОННЫЕ СИСТЕМЫ ДЛЯ ДЛИТЕЛЬНОГО ВЕНОЗНОГО ДОСТУПА В ОНКОЛОГИИ
Буйденок Ю.В., Мещеряков А.А., Бредер В.В., Феденко А.А., Мачак Г.А., Буйденок В.Ю., Чернов И.С., Нисиченко Д.В.
(Российский онкологический научный центр им. Н.Н. Блохина)
Повышение эффективности современной химиотерапии предполагает увеличение доз препаратов, продолжительности и кратности курсов лечения. При этом введение химиопрепаратов, как правило, внутривенное, сопряжено с раздражением сосудистой стенки, флебитами/флеботромбозами, некрозом тканей при случайной экстравазации ряда лекарственных средств. Неоднократные пункции и катетеризации периферических вен для диагностических тестов, в целях химиотерапии, поддерживающего лечения и парентерального питания снижают качество жизни. Применение центрального венозного доступа позволяет избежать большинства указанных выше проблем, однако связано с риском инфекционных и тромботических осложнений, опасностью воздушной эмболии. Кроме того, при наличии центрального венозного катетера неизбежны дискомфорт и трудности выполнения гигиенических процедур.
В этой связи значительным преимуществом обладают полностью имплантируемые порт-системы. Они (в перерывах между инфузиями) не подвержены каким-либо внешним факторам воздействия, обеспечивают максимальный комфорт и качество жизни. Во многих развитых странах имплантация венозного порта предусматривается требованиями международных исследовательских протоколов, входит в современные стандарты химиотерапии.
За 2000-2009 гг. в РОНЦ имплантировано более 600 порт-систем центрального венозного доступа. Эти устройства применялись у больных раком толстой и прямой кишки (200; 36%), молочной железы (126; 24%), костными и мягкотканными саркомами (73; 14%), а в остальных случаях – при злокачественных новообразованиях иных локализаций.
Порт – это небольшая емкость, чья конструкция выполнена из металла (титан) или пластика (полисульфон), имеет в основании элементы крепления, а в верхней части силиконовую мембрану, через которую специальной иглой выполняются пункции для забора крови, введения препаратов и промывания устройства. В боковую часть порта подсоединяется катетер; другой его конец размещается в центральной вене. При необходимости одномоментного введения препаратов, которые несовместимы друг с другом, устанавливается двухканальный, двухкамерный порт*.
* Полный ассортимент имплантируемых порт-систем с оптимальным соотношением цены-качества представлен компанией Б.Браун (Б.Браун Медикал: 117105 Москва, Варшавское шоссе, д.17. Тел./факс +7 (495) 747-5191; www.bbraun.ru). См. также сайт: www.intravena.ru
Установка порта проводится в асептических условиях, в операционной, под местной анестезией. Также возможна установка порта как этап планового хирургического вмешательства.
Для успешной имплантации подкожного венозного порта требуется чрезкожная катетеризация верхней полой вены доступом через наружную яремную или подключичную вену; в том числе – с применением современной ультразвуковой техники для визуализации и разметки сосудов перед началом процедуры.
Успешная установка и эксплуатация имплантируемой порт-системы возможны только при расположении дистального конца катетера в просвете верхней полой вены. Уровень установки кончика катетера в просвете верхней полой вены определяется (с наибольшей точностью) под контролем зрения при помощи рентгеноскопии, либо (с достаточной точностью) – с помощью эндокардиальной кардиограммы, либо (ориентировочно) – по анатомическим ориентирам. В нашей практике наиболее часто установка катетера выполняется под контролем ЭКГ. После установки катетера в нескольких сантиметрах от пункции создается подкожный «карман» и формируется подкожный тоннель для катетера. Катетер соединяется с портом. Порт погружается в подготовленный «карман» и фиксируется отдельными швами к прилежащим тканям. Ушивается кожный разрез. На всех этапах имплантации контролируется состояние (проходимость) катетера и порта аспирацией крови из катетера или при пункции порта специальной иглой Губера. Порт может использоваться для проведения инфузий уже через несколько часов после установки.
Наиболее тяжелые осложнения при имплантации венозного порта соответствуют проблемам, возникающим при чрезкожной пункции и катетеризации центральной вены. Но поскольку венозный порт устанавливается однократно на несколько лет, вероятность возникновения осложнений снижается во много раз. Даже применение современной ультразвуковой техники не исключает возможности повреждения легкого с развитием пневмо- и гемоторакса, дыхательной недостаточности. Ятрогенная пункция артериального сосуда особо опасна у больных с выраженной коагулопатией на фоне тромбоцитопении в связи с вероятностью фатального кровотечения. После катетеризации центральной вены обязательно контрольное рентгенологическое исследование органов грудной клетки для оценки положения центрального катетера и состояния сердечно-легочных структур (в сомнительных случаях – с контрастированием инфузионной системы).
Рис. 2. Установка иглы Губера в подкожный венозный порт.
Для пункции порта используется специальная игла Губера, которая имеет особую форму острия, исключающую повреждение силиконовой мембраны порта. Ретроградный ток крови из венозного порта при легкой аспирации указывает на удовлетворительную работу всей инфузионной системы.
Игла Губера отличается от обычной тем, что при введении не режет, а раздвигает силиконовую мембрану порта, поддерживая герметичность порт-системы в течение нескольких лет. Пункции порта легко выполнимы, однако работа с инфузионной системой требует привлечение квалифицированного, инструктированного персонала.
При работе с портом следует особенно тщательно соблюдать правила асептики. Установку иглы необходимо выполнять в стерильных перчатках, для обработки кожи над портом применять современные антисептики. Полученные при аспирации первые 1-2 мл крови необходимо удалить, а порт незамедлительно промыть 20,0 мл 0,9%-го раствора NaCL. Перед удалением иглы порт следует промывать 0,9%-ным раствором NaCL в объеме не менее 20,0 мл и выполнять гепариновый «затвор» объемом не более 5,0 мл (из расчета 100 ЕД гепарина на 1,0 мл 0,9%-ного раствора NaCl). Используются только ампулированные растворы ex tempore. Введение в порт растворов из ранее вскрытых флаконов недопустимо!
После окончания инфузии и удаления иглы, больной может вернуться к привычному образу жизни, принимать водные процедуры, включая занятия в бассейне.
Осложнения при установке центрального катетера или порта однотипны для продолжительного использования центрального венозного доступа – это локальный тромбофлебит в месте установки катетера и/или инфицирование инфузионной системы.
Тромбоз возникает вследствие известной тромбофилии онкологических больных и провоцируется наличием инородного тела (катетера). Выраженность тромбоза и его течение подлежат контролю при ультразвуковых исследованиях. В некоторых случаях удается сохранить подкожный венозный порт благодаря своевременному назначению антикоагулянтов.
Инфицирование инфузионной системы опасно развитием генерализованного септического состояния. Возникновение катетер-ассоциированого сепсиса требует незамедлительного удаления инфузионной системы, назначения адекватной антибактериальной (а при показаниях – и интенсивной) терапии.
Следует подчеркнуть, что основа инфицирования инфузионных систем – это несоблюдение медицинским персоналом элементарных правил асептики, таких как мытье рук, использование стерильных перчаток, масок и, что особо важно, использование растворов для промывания порта из ранее вскрытых флаконов, а также растворов, хранившихся без соблюдения надлежащих условий.
Очевидно, что отсутствие готовых лекарственных форм, предназначенных специально для промывки и «затворов» катеров, устанавливаемых в периферические и центральные вены, приводит к тяжелым последствиям и экономическим потерям, связанным с длительным лечением тяжелых катетер-ассоциированных инфекций. В связи с этим представляет интерес новый препарат Тауролок (Taurolock™) предназначенный для «закрытия» инфузионных систем в перерывах между циклами инфузий. Препарат проходит процедуру регистрации в России.
Рис. 3. Рентгенограмма больного после имплантации венозного порта в левой подключичной области. Катетер проведен через левую подключичную в верхнюю полую вену.
Наш многолетний опыт показал высокую надежность и целесообразность применения подкожных венозных портов в клинической практике.
Следует отметить значительные возможности имплантируемых инфузионных систем для проведения локальной (внутриартериальной) химиотерапии; лечения пациентов с хроническим болевым синдромом (имплантация порта в целях длительной спинномозговой анестезии); при опухолевых плевритах и асцитах (для эвакуации экссудата и внутриполостного введения препаратов).
ПРИМЕНЕНИЕ ИНТРАПЕРИТОНЕАЛЬНЫХ ПОРТ-СИСТЕМ ДЛЯ ВНУТРИБРЮШИННОЙ ХИМИОТЕРАПИИ ПРИ РАСПРОСТРАНЕННОМ РАКЕ ЯИЧНИКОВ
Тюляндина А.С., Буйденок Ю.В., Жорданиа К.И., Кузнецов В.В., Стенина М.Б.
(Российский онкологический научный центр им. Н.Н. Блохина)
Рак яичников, третье по частоте новообразование в онкогинекологии, является причиной смерти около 7000 больных в России ежегодно (Аксель Е.М., Давыдов М.И.; 2008). Прогресс в лечении рака яичников связан с появлением в 1990-х гг. таксанов. Рак яичников считается химиочувствительной опухолью (Ozols R.F.; 2003): полная клиническая регрессия после циторедуктивной операции и современной химиотерапии производными платины и таксанами достигается примерно у 70% пациентов, однако в большинстве случаев возникают рецидивы, обусловленные преимущественно диссеминацией по брюшине.
В связи с этим интраперитонеальная химиотерапия считается одним из перспективных направлений современного научного поиска. Интраперитонеальное введение лекарственных средств создает более высокую концентрацию химиотерапевтических препаратов в брюшной полости – в 20 раз более высокую для препаратов платины и в 1000 раз – для таксанов (Lopez J., 1985; Francis P., 1995). Кроме того, при внутрибрюшинном введении достигается сравнительно высокая системная концентрация за счет всасывания через брюшину, что, безусловно, следует учитывать при прогнозировании токсических эффектов (Dedrick R.; 1997).
Наиболее значимыми разработками в области интраперитонеальной химиотерапии являются 3 крупных рандомизированных клинических исследования III фазы: GOG-104, GOG-114, GOG-172.
В исследовании GOG-104 больным с III стадией рака яичников (с остаточными после циторедуктивной операции размерами опухолевых узлов до 2 см) системная химиотерапия проводилась препаратами цисплатин и циклофосфамид. В исследовательской группе цисплатин вводился интраперитонеально, в контрольной – внутривенно; циклофосфамид вводился внутривенно в обеих группах (Alberts D.S.; 1996). Медиана общей продолжительности жизни составила 41 мес. при внутривенном и 49 мес. – при внутрибрюшинном введении цисплатина (р = 0,02). В исследовательской группе отмечена более низкая частота проявлений системной ото- и гематологической токсичности. Данная методика интраперитонеальной химиотерапии не была внедрена в клиническую практику, поскольку появление таксанов позволило получить аналогичные результаты с помощью внутривенного введения препаратов.
В исследовании GOG-114 больные контрольной группы получали цисплатин и паклитаксел внутривенно. Больные исследовательской группы первоначально получали карбоплатин в высоких дозах (AUC9), а затем цисплатин внутрибрюшинно и паклитаксел внутривенно (Markman M.; 2001). В исследовательской группе отмечена большая продолжительность жизни, как общей (52,2 и 63,2 мес.; р=0,05), так и безрецидивной (до начала прогрессирования) – 22,2 и 27,9 мес.; р=0,01. При этом в группе внутрибрюшинной химиотерапии чаще развивалась тяжелая миелосупрессия.
В исследовании GOG-172 (Armstrong D.; 2006) при сравнении внутривенной и внутрибрюшинной химиотерапии после циторедуктивных операций подтверждена б?льшая эффективность внутрибрюшинного введения цисплатина и паклитаксела: сроки до начала прогрессирования процесса составили 18,3 и 23,8 мес. (р=0,027), медиана общей продолжительности жизни – 49,7 и 65,6 мес. (р=0,017), достигнув максимального значения за всю историю изучения данного вопроса. Следует особо отметить, что запланированное лечение в группе внутрибрюшинной терапии смогли получить лишь 42% больных, у остальных больных лечение было прекращено в связи с катетер-ассоциированной инфекцией, нарушениями проходимости и целостности катетера, выходом из строя установленного лапаропорта.
Результаты исследования GOG-172 стали основой рекомендаций Национального противоракового института США (NCI), опубликованного в 2006 г., согласно которому внутрибрюшинная терапия может быть показана больным с III стадией рака яичников после оптимальной циторедукции. Вместе с тем, указанные выше исследования отразили проблемы технического осуществления интраперитонеальной химиотерапии, необходимость совершенствования имплантируемой порт-системы.
Отечественный опыт применения интраперитонеальной химиотерапии минимален. В связи с этим в 2009 г. в РОНЦ инициировано экспериментальное («pilot») исследование по внутрибрюшинной химиотерапии при распространенном раке яичников. Согласно протоколу лапаропорт устанавливается интраоперационно по окончании циторедуктивной операции. Имплантационная порт-система устанавливается на передней брюшной стенке в области VIII-IX межреберья и фиксируется к реберной дуге. Химиотерапия начинается через 3 недели после оперативного вмешательства и предполагает проведение 6 курсов химиотерапии каждые 3 недели по следующей схеме: паклитаксел 135 мг/м 2 внутривенно в 1-й день, цисплатин 75 мг/м 2 внутрибрюшинно во 2-й день и паклитаксел 60 мг/м 2 внутрибрюшинно в 8-й день. В дни интраперитонеального введения препаратов обязательна гидратация (2000 мл физиологического раствора внутрибрюшинно) для равномерного распределения цитостатических агентов в брюшной полости.
Внутрибрюшинная химиотерапия проведена 2 пациенткам по поводу распространенного рака яичников после выполнения оптимальной циторедуктивной операции. Имплантированы лапаропорты Celsite (компания B.Braun)*. Обе больные перенесли все 6 курсов химиотерапии без выраженных проявлений системной токсичности и местных осложнений. Все курсы лечения проведены в запланированные сроки без редукции доз препаратов. В обоих случаях отмечались кратковременные умереные боли в животе, связанные с внутрибрюшинным введением паклитаксела и купировавшиеся ненаркотическими аналгетиками. Достигнут полный клинический эффект с нормализацией уровня маркера СА-125. После окончания химиотерапии имплантационные порт-системы были удалены. Пациенты наблюдаются в течение 5 месяцев после окончания лечения без признаков заболевания.
* Б.Браун Медикал: 117105, Москва, Варшавское шоссе, д.17. Тел./факс (495) 747-5191; www.bbraun.ru
ЭПИДЕМИОЛОГИЧЕСКИЙ СЛОВАРЬ. IV издание. Под редакцией Джона М. Ласта для Международной эпидемиологической ассоциации.*
Русское издание – одно из 14-язычных переводов эпидемиологического словаря. Книга издана Открытым Институтом Здоровья в рамках программы «Глобус». Ответственный редактор русского издания – проф. В.В. Власов – передал Московскому Онкологическому обществу достаточное количество экземпляров словаря. Общество готово распространять среди действительных членов Общества и даже выслать (!) им эти экземпляры за пределы Московского региона согласно заявляемым потребностям.
ИЗ ПРЕДИСЛОВИЯ РЕДАКТОРОВ РУССКОГО ИЗДАНИЯ
Русское издание «Эпидемиологического словаря» – важное, давно ожидавшееся событие. По известным причинам развитие эпидемиологии в России и во всем, как принято говорить, «русскоязычном пространстве» отличалось от развития этой науки на Западе. Однако всегда было очевидным, что взаимопонимание профессионалов крайне необходимо. Эту задачу и должен решить данный словарь.
…Одна из проблем, которую систематически старались решить редакторы словаря – его применение при чтении как русской, так и иностранной научной литературы. Поэтому в словаре, помимо собственно словаря эпидемиологических терминов, создан еще англо-русский указатель, который облегчит использование иностранной литературы и поиск русских эквивалентов английским терминам.
* ЭПИДЕМИОЛОГИЯ (ЕPIDEMIOLOGY) — наука о распространении относящихся к здоровью (человека) состояний или событий в определенных популяциях и их детерминант, а также применение этих исследований в контроле над проблемами здоровья… Существует много определений Э. … За последние более чем 50 лет определение расширилось от акцента на эпидемии заразных болезней до всех феноменов, относящихся к здоровью населения… (Эпидемиологический словарь. – Москва, 2009. – 316 с.)
источник