Лапароцентез при асците: понятие, определение, классификация, характеристика и методы проведения процедуры, показания и противопоказания
Одним из способов диагностики при водянке брюшной полости является лапароцентез. При асците эта процедура является наиболее информативной. Сама процедура представляет собой несложную хирургическую манипуляцию по проколу живота и забору содержимого с целью лабораторного исследования.
При асците этот вид диагностического хирургического вмешательства необходим для уточнения характера содержимого в брюшине. Первые попытки осуществить процедуру были предприняты в позапрошлом веке. Тогда лекари пытались проколоть живот при патологическом увеличении его объема. Лапароцентез при асците помог установить разрыв желчного пузыря после травмирования брюшной полости. В середине прошлого века методика активно осваивалась хирургами в разных странах. Сегодня манипуляция является не только одной из самых информативных и эффективных, но и безопасных для человека.
В наши дни такая хирургическая операция проводится не только при асците. К лапароцентезу брюшной полости часто прибегают при необходимости точного обследования пациентов после травм, при подозрении на кровотечение, прободение стенок кишечника. Благодаря малой инвазивности и минимальной травматичности, после лапароцентеза не развиваются осложнения. Главное – это соблюдение правил асептики и точной техники выполнения манипуляции врачом-хирургом.
Пункция брюшной полости назначается исключительно в целях диагностики и постановки точного достоверного диагноза при смазанной клинической картине. Отдельные техники лапароцентеза при асците позволяют использовать данную процедуру для лечения патологии путем эвакуации жидкости. Исследовательскую пункцию можно назвать лечебной в том случае, если, помимо обнаружения аномального образования, хирург сразу же удалит его.
Лапароцентез проводится амбулаторно, в стационарном отделении к нему прибегают в случае травматических повреждений и невыясненного диагноза. Процедуру проводят не только при асците. Показаниями для лапароцентеза могут служить и другие патологические состояния:
- подозрение на внутреннее кровотечение в животе;
- перитонит;
- перфорация кишечных стенок в результате закрытых травм;
- прободение язвы желудка или 12-перстной кишки;
- разрыв кисты;
- тупые травмы брюшной полости у пациента, находящегося в коме, тяжелом алкогольном или наркотическом опьянении и не способного указать конкретные симптомы;
- многочисленные травмы у человека без сознания в случае, если имели место серьезные повреждения и разрыв внутренних органов;
- раны с проникновением в область грудины из-за риска повреждения диафрагмы.
Жидкий материал, полученный через прокол брюшной полости, направляется на лабораторное исследование. Асцитический экссудат должен быть детально изучен на предмет примесей крови, гноя, фекалий, мочи, желчи и желудочного сока.
В некоторых случаях хирургическое вмешательство в брюшную полость является недопустимым из большой вероятности неблагоприятных последствий при асците. Лапароцентез зачастую служит единственным вариантом исследования, особенно тогда, когда другие способы диагностики оказываются недостаточно информативными по поводу содержимого брюшной полости.
Прокол живота противопоказан при:
- заболеваниях свертываемости крови из-за высоких рисков развития кровотечения;
- осложненной спаечной болезни;
- сильном вздутии живота;
- рецидивирующей пупочной или эпигастральной грыже;
- кишечная непроходимость;
- вероятности травматизации кишечника или опухоли;
- беременности.
Лапароцентез нужно крайне осторожно проводить на участке, близко расположенном к мочевому пузырю, а также органах, увеличенных в размере. Стоит отметить, что наличие спаек — это не абсолютное противопоказание для осуществления манипуляции. Все дело в том, что сама по себе патология обуславливает высокую вероятность повреждения кровеносных сосудов и соседних органов. Показания к лапароцентезу при асците должны оцениваться врачом в индивидуальном порядке.
В ходе подготовки к запланированному вмешательству в брюшную полость при асците, техника лапароцентеза подбирается индивидуально. Пациенту назначают предварительные стандартные обследования. Больной должен сдать общие анализы мочи и крови, коагулограмму, пройти УЗИ внутренних органов и, если врач посчитает нужным и необходимым, рентгенографию с контрастным веществом.
Лапароцентез брюшной полости при асците на дому не выполняется. Степень подготовки к проведению лапароцентеза приближена к такой, какая требуется перед любым другим хирургическим вмешательством. К тому же, хирург, выполняющий манипуляцию, всегда должен быть готов к переходу от диагностического лапароцентеза к лечебной лапаротомии.
За сутки до хирургического вмешательства больной должен отказаться от еды, а непосредственно перед манипуляцией опорожнить мочевой пузырь, кишечник и желудок. При серьезных повреждениях и тупых травмах живота, сопровождающихся шоком или коматозным состоянием, осуществляется искусственная вентиляция легких. Лапароцентез при асците проводят в операционной, где всегда имеется возможность экстренно перейти открытому хирургическому вмешательству.
Прокол живота осуществляется при местной анестезии, а в общем наркозе, как считают врачи, нет никакой необходимости. Перед лапароцентезом при асците, по отзывам некоторых пациентов, проводят премедикацию, которая показана людям с психическими отклонениями, а также особо впечатлительным и нервным лицам. Суть премедикации заключается в предварительном введении подкожной инъекции «Атропина сульфата», «Промедола», «Лидокаина» или «Новокаина».
Перед пункцией больному следует пройти тест на чувствительность к анестетикам, так как большинство обезболивающих препаратов вызывает аллергические реакции. Чтобы убедиться в безопасности выбранного средства, на коже предплечья пациенту делают легкую царапину стерильной иглой и наносят пару капель лекарства. Если спустя 20-30 минут никакой реакции не последовало, в том числе остался прежним цвет кожных покровов, отсутствует зуд и отечность, пробу считают удачной. При положительной реакции, сопровождающейся покраснением кожи, анестетик меняют.
Для осуществления данной процедуру потребуются специальные медицинские инструменты. Прокол брюшной стенки проводится с помощью специального троакара, трубки для отвода жидкости, шприцев и зажимов. Асцитическую жидкость, извлеченную из живота, собирают в стерильную емкость, которую впоследствии отправят на бактериологическое исследование. Хирург в обязательном порядке должен использовать стерильные перчатки.
Техника лапароцентеза при асците подразумевает сидячее положение пациента, но в некоторых случаях допускается проведение операции лежа на спине. Под его ягодицы кладут клеенчатый материал, одноразовую пеленку. Для хирурга такая манипуляция не представляет особой сложности. Перед проколом место предполагаемого доступа обрабатывают антисептическим раствором.
Пункцию делают посередине живота, отступив 2-3 см вниз от пупка, иногда немного левее. Намного реже иглу запускают в срединную точку между пупком и лобковой областью. Перед тем как проникнуть троакаром внутрь брюшной полости, врач делает незначительный надрез скальпелем, чтобы рассечь кожу, слой подкожно-жировой клетчатки и мышц. Хирург должен действовать максимально осторожно, чтобы случайно соскользнувший скальпель не повредил внутренности. Сегодня хирурги все чаще начинают операцию с раздвижения тканей тупым методом, без использования ножа.
По мере продвижения троакара вглубь полости задачей хирурга является своевременная остановка кровотечения из сосудов кожи и клетчатки. В противном случае не исключаются погрешности в результатах исследования асцитической жидкости. Троакар направляют в отверстие брюшины под острым углом в 45° по отношению к мечевидному отростку грудины. Врач должен обеспечить пространство для проникновения иглы, захватив пупочное кольцо и слегка приподняв брюшную стенку. Правильная техника выполнения лапароцентеза при асците позволит совершить пункцию безопасно для пациента. Часто в процессе хирурги используют специальную нить, которую вводят в область прокола живота через апоневроз прямой мышцы брюшного пресса. Прикрепив хирургическую нить к этому мускулу, появляется возможность приподнять мягкие ткани живота.
Техника выполнения лапароцентеза при асците брюшной полости не мешает проводить манипуляцию в амбулаторных условиях. Введение иглы осуществляется по описанному ранее принципу. Как только их полости троакара появится жидкость, инструмент наклоняют к емкости, приготовленной заранее. Во процессе оттока жидкости важно удерживать пальцами дистальный конец, чтобы он не соскочил.
При асците нельзя извлекать брюшную жидкость слишком быстро. Стремительная потеря асцитической воды может привести к резкому снижению артериального давления, в тяжелых случаях вплоть до коллапса. Это происходит из-за резкого перенаправления крови по сосудам брюшной полости, которые до этого были сдавлены жидкостью. Чтобы не допустить подобного осложнения, жидкость извлекают медленно – каждый час по 400 мл. При этом пациента не оставляют без внимания. Рядом с ним должен постоянно находиться персонал медучреждения. Ассистент хирурга в ходе процедуры, по мере уменьшения объемов живота, стягивает брюшную полость полотенцем с целью предотвращения гемодинамических расстройств.
После окончательного удаления асцитической жидкости, иглу осторожно извлекают, а разрез зашивают и накладывают стерильную повязку. Сжимающее полотенце нежелательно снимать, так как в первое время оно поможет создать правильное внутрибрюшное давление и помочь больному привыкнуть к новым условиям кровоснабжения. В случае оставления трубки для поэтапной эвакуации жидкости, больному следует периодически менять положение тела для улучшения оттока жидкости.
Если решение о проведении данной манипуляции принималось с целью полного обследования пациента, процедура будет проходить немного иначе. Для того чтобы обнаружить патологическое содержимое в брюшной полости, хирург использует так называемый шарящий катетер. Он соединяется со шприцем, который отсасывает асцитический экссудат. Если шприц остается пустым, то в живот вводится физраствор (приблизительно 300 мл), затем его извлекают и отправляют на исследование.
Если в ходе осуществления манипуляции потребуется осмотреть внутренние органы, то в трубку троакара помещают лапароскоп. Врач, обнаруживая тяжелые повреждения, может принять решение об оперативном лечении прямо в процессе лапароцентеза. В этом случае диагностическая процедура принимает масштабы серьезного полостного вмешательства.
По завершении лапароцентеза полученное содержимое отправляют на исследование в лабораторию. Там оценивается не только внешний вид жидкой массы, но и составляется заключение о ее биохимических показателях. Если в биоматериале обнаруживается кровь, присутствуют элементы фекалий или примеси мочи, пациента необходимо срочно оперировать. Вызывать серьезные опасения может и характерный для перитонита гнойный серо-зеленый или желтоватый цвет. Такой внешний вид брюшной жидкости, полученной в ходе лапароцентеза, может свидетельствовать о внутрибрюшном кровотечении, прободении стенки кишечника или желудка, гнойно-воспалительном или некротическом процессе, что означает лишь одно: нельзя терять ни минуты.
Распознать кровотечение при исследовании жидкой массы из живота пациента можно по примеси эритроцитов и лейкоцитов. Кстати, с помощью лапароцентеза могут проводиться пробы для уточнения, удалось ли остановить кровотечение или нет. При этом присутствие кровяных частиц в незначительном объеме может являться ложноположительным признаком активного кровотечения.
Если в асцитическом экссудате обнаружилась моча, скорее всего, имеет место разрыв стенки мочевого пузыря. Присутствие фекалий – прямое подтверждение прободения кишечной стенки. Мутный вид жидкости и большой процент фибрина (белка) в ней указывает на перитонит, который является показанием к экстренному хирургическому лечению.
Прокол живота чаще всего делают при асците. Лапароцентез может быть показан даже при стабильном состоянии больного и отсутствии патологического содержимого в животе, если факт тупой травмы живота не исключает вероятность повреждения органа или кровотечения. Так, например, при разрыве селезенки или гематоме печени возможно их увеличение в размере и излитие крови в полость. В подобных случаях хирург устанавливает силиконовый дренаж после лапароцентеза на двое суток, обеспечивая нормальный отток жидкости.
Негативные последствия манипуляции развиваются в исключительных случаях. С наибольшей вероятностью может развиться инфекционный процесс в месте пункции при игнорировании правил асептики. У больных с тяжелыми заболеваниями печени и желудочно-кишечного имеется риск появления флегмоны брюшной стенки. Если врач повредит крупные сосуды, не исключено внутреннее кровотечение. Причиной повреждения внутренних органов после лапароцентеза также может стать неосторожность хирурга.
Неблагоприятным последствием лапароцентеза брюшной полости при асците может стать коллапс и кровотечение на фоне длительного истечения асцитической жидкости после пункции. При этом послеоперационный период всегда протекает без осложнений, так как данное вмешательство не требует применения общего наркоза и значительного повреждения тканей. Швы после лапароцентеза снимают спустя неделю после операции. После прокола живота больному рекомендуют воздерживаться от физических нагрузок, придерживаться ограничений в питании и соблюдать постельный режим.
источник
В данной статье представлена тактика ведения пациентов с асцитом, отдельное внимание уделяется особенностям обследования данной группы пациентов, подробно освещаются вопросы лабораторной диагностики, методика и показания к диагностическому лапароцентезу, а также современные аспекты консервативной терапии с указанием наиболее частых осложнений и ошибок при ведении этих пациентов.
This paper introduces the tactics managing for patients with ascites, special attention is paid to the peculiarities of a survey of this group of patients, discussed in detail issues of laboratory diagnostic methods and indications for diagnostic laparocentesis, as well as modern aspects of conservative therapy with the most frequent complications and errors in managing these patients.
Асцит (от греческого «askos» — сумка, мешок) — это состояние, при котором наблюдается патологическое накопление жидкости в брюшной полости.
Фоном для развития асцита в 81,5% случаев являются заболевания печени (цирроз печени, острый алкогольный гепатит, цирроз-рак), в 10% — злокачественные опухоли, в 3% — застойная сердечная недостаточность, в 1,7% — туберкулезный перитонит. Более редкими причинами является нефротический синдром, острый панкреатит.
Осмотр пациента чрезвычайно информативен. Если жидкость в брюшной полости накопилась быстро, то кожа живота напряженная, блестящая, при пальпации может отмечаться диффузная болезненность. В случае постепенного накопления жидкости можно отметить расширение эпигастрального угла, нижние ребра перемещаются вперед и вверх, в силу чего грудная клетка расширяется. Повышение внутрибрюшного давления способствует возникновению пупочной, паховой, бедренной, послеоперационной грыжи. Наиболее выраженными бывают пупочная и пахово-мошоночная грыжи. Пациенту необходимо рекомендовать ношение корсета или бандажа. Необходимо тщательно осматривать кожу грыжевого мешка, так как она может истончаться. В нашей практике было 3 случая разрыва кожи грыжевого мешка с излитием асцитической жидкости. Чрезвычайно важно информировать пациентов с напряженным асцитом о возможной травматизации кожи выбухающего грыжевого мешка при надевании корсета, натуживании.
Перкуторно асцит выявляется при накоплении 1,5-2 л жидкости. При меньшем количестве жидкости тимпанический звук будет выявляться над всей поверхностью живота. При ненапряженном асците в вертикальном положении живот выглядит отвисшим, так как жидкость стекает вниз. Соответственно, при перкуссии живота стоя тимпанический звук отмечается в верхних отделах живота, притупление звука — в нижних. Если пациент лежит на спине, то содержащий воздух кишечник перемещается кверху, а жидкость смещается в задние части брюшной полости. Перкуторный звук будет тимпаническим над передней поверхностью живота и тупым над фланками (боками). Для того чтобы убедиться в наличии асцита, целесообразно перкутировать пациента в разных положениях: стоя, лежа на спине, а также на боках. При положении на правом боку тимпанический звук будет определяться над левым фланком, в положении на левом боку — над правым. Скопление жидкости в брюшной полости является самой частой, но не единственной причиной увеличения размера живота и растяжения его стенки. Также необходимо исключить беременность, растяжение кишечника газами, кисты (яичника, брыжейки, ретроперитонеальные), растяжение полых органов — желудка, мочевого пузыря и ожирение. Асцит в зависимости от количества асцитической жидкости подразделяют на минимальный (выявляется только при инструментальном ультразвуковом исследовании и компьютерной томографии брюшной полости), умеренный (легко выявляется при физикальном исследовании) и выраженный (при значительном увеличении размера живота).
К вторичным проявлениям асцита относятся:
• плевральный выпот, чаще правосторонний за счет движения перитонеальной жидкости вверх через диафрагмальные лимфатические сосуды, а также пропотевания асцитической жидкости через дефекты диафрагмы;
• высокое стояние диафрагмы, ведущее к развитию дисковидных ателектазов в нижних отделах легких и смещению сердца кверху;
• варикозное расширение геморроидальных вен;
• формирование диафрагмальной грыжи, нарастание пищеводного рефлюкса (объясняют механическими факторами в условиях повышения внутрибрюшного давления) усугубляют повреждение слизистой оболочки пищевода при наличии варикозного расширения вен.
При впервые выявленном асците, подозрении на инфицирование асцитической жидкости, злокачественную опухоль необходимо провести диагностический лапароцентез: извлечь небольшое количество асцитической жидкости (обычно 50-300 мл) для клинического, биохимического, бактериологического и цитологического исследования. Информативность анализа асцитической жидкости трудно переоценить.
Методика выполнения парацентеза и последующий уход за пациентом
Эвакуация асцитической жидкости (АЖ) осуществляется при помощи мягкого катетера, который входит в состав стерильного набора для выполнения парацентеза. Катетер вводится на 2 см ниже пупка по срединной линии тела либо на 2-4 см медиальнее и выше переднего верхнего отростка подвздошной кости (рис. 1). Для предотвращения последующего подтекания АЖ перед введением троакара кожа смещается вниз на 2 см.
Рисунок 1. Места введения катетера при выполнении парацентеза
Перед проведением парацентеза необходимо получить информированное согласие пациента на проведение процедуры.
Исследование асцитической жидкости начинают с визуальной оценки ее цвета: соломенно-желтый характерен для цирроза печени, нефротического синдрома, сердечной недостаточности; геморрагический — для канцероматоза, панкреатита; мутный — для перитонита, панкреатита, туберкулеза; молочно-белый — для хилезного асцита.
Исследование белка позволяет дифференцировать транссудат и экссудат: в транссудате белка менее 25 г/л (цирроз печени, гипоальбуминемия), в экссудате — более 30 г/л (малигнизация, воспаление). Общепринятым является подсчет градиента «сывороточный альбумин/альбумин асцитической жидкости» (SAAG), который позволяет предположить причину развития асцита, а также прогнозировать риск инфицирования асцитической жидкости. При SAAG менее 1,1 риск инфицирования возрастает в связи со снижением в асцитической жидкости содержания опсонинов.
SAAG более 1,1 выявляется при:
• острой печеночной недостаточности;
• метастатическом поражении печени;
• застойной печени при сердечной недостаточности;
SAAG менее 1,1 имеет место при:
• канцероматозе брюшины, мезотелиоме;
• спонтанном бактериальном перитоните;
Важным показателем является клеточный состав асцитической жидкости. Содержание более 250 нейтрофилов в 1 мм 3 свидетельствует об инфицировании жидкости. Любой бактериальный рост является патологическим. Важно помнить, что при посеве асцитической жидкости необходимо немедленно поместить ее в разные флаконы (по 10 мл), используемые для посева крови на анаэробную и аэробную флору. Информативность анализа при этом увеличивается до 90%.
Чрезвычайно важно цитологическое исследование, направленное на выявление атипичных клеток.
Повышенный уровень амилазы позволяет выявить панкреатогенный асцит. Увеличение триглицеридов более 5 ммоль/л свидетельствует о хилезном асците. При окраске жидкости в темно-желтый цвет необходимо определять в ней содержание билирубина: если в сыворотке крови оно меньше, чем в асцитической жидкости, это означает, что желчь поступает в брюшную полость.
Базисная терапия асцита состоит из нескольких этапов:
1. Лечение основного заболевания, приведшего к возникновению асцита.
2. Пациентам с выраженным асцитом рекомендуется постельный режим в первые 4-7 дней лечения. Постельный режим целесообразен, так как горизонтальное положение тела влияет на выработку ренин-ангиотензина и снижение тонуса симпатической нервной системы. Вертикальное положение способствует стимуляции симпатической нервной системы, уменьшению гломерулярной фильтрации и увеличению абсорбции натрия в канальцах, поэтому пациентам с выраженным асцитом в первые 4-7 дней лечения рекомендуется постельный режим.
3. Ограничение употребления соли. Каждый грамм натрия, принятый сверх меры, задерживает примерно 250-300 мл воды. При обнаружении сниженного уровня натрия в сыворотке крови не следует рекомендовать прием поваренной соли, так как общее содержание натрия в организме и так значительно повышено. Восполнять дефицит электролитов необходимо медикаментозно. При подозрении на то, что пациент не ограничивает суточного потребления соли, целесообразно определить суточную экскрецию натрия в моче. Если в сутки с мочой экскретируется больше натрия, чем предписано пациенту, это свидетельствует о несоблюдении рекомендаций.
4. Ограничение употребления жидкости до 750-1000 мл/сут при отсутствии лихорадки.
5. Диуретическая терапия. Применение диуретиков приводит к уменьшению объема плазмы, который восполняется, поскольку жидкость переходит из интерстициальной ткани (периферические отеки) и брюшной полости (асцит) в кровяное русло. Для лечения асцита наиболее часто применяют петлевые (фуросемид, этакриновая кислота) и калийсберегающие (спиронолактон, триамтерен) диуретики. Препаратом первой линии является спиронолактон (верошпирон), в случае недостаточности эффекта от которого назначаются петлевые диуретики. Подбор дозы диуретиков основывается на выраженности асцита и контролируется диурезом, уровнем электролитов. Больной должен быть ориентирован на ежедневный подсчет диуреза и взвешивание, что позволяет контролировать достаточность диуретической терапии. Мочегонная терапия считается достаточной, если превышение выделяемой жидкости над потребляемой составляет не более 500 мл для больных без периферических отеков и 800-1000 мл для больных с периферическими отеками. Контролировать эффективность мочегонной терапии целесообразно также при взвешивании пациента (снижение массы тела за 1 неделю должно составлять 2,5-3 кг) и измерении окружности талии. Контролировать уровень электролитов в сыворотке крови необходимо не реже 2 раз в неделю.
6. Динамический контроль эффективности диуретической терапии. Если состояние пациента стабильно, то он может измерять диурез 2-3 раза в неделю при ежедневном взвешивании. Целесообразна беседа лечащего врача с родственниками больного для разъяснения важности измерения диуреза и взвешивания, так как в силу наличия у пациентов энцефалопатии он может предоставлять врачу недостоверную информацию. Родственники должны быть предупреждены о том, что I стадия печеночной энцефалопатии может сопровождаться эйфорией, в силу чего пациент считает себя выздоровевшим и отказывается от назначенной терапии.
При малом и умеренном асците (у пациентов с циррозом печени классы А и В по Чайлду-Пью) ограничивают потребление соли до 2 г/сут и суточное потребление жидкости до 1 л, если содержание натрия в сыворотке крови не превышает 130 мэкв/л. Базовой терапией является спиронолактон (верошпирон) — 75-100 мг/сут. При необходимости дозу спиронолактона увеличивают по 100 мг каждые 4-5 дней до максимальной, которая составляет 300 мг/сут. Достаточно часто при умеренном асците (класс В) назначают комбинацию спиронолактона и фуросемида (примерное соотношение: на 100 мг спиронолактона 40 мг фуросемида). При сохранении асцита целесообразна госпитализация.
При выраженном асците (у пациентов с циррозом печени класс С по Чайлду-Пью) больные должны лечиться стационарно. В первые дни назначают бессолевую диету. Комбинируется терапия спиронолактоном и фуросемидом. Сохранение небольшого количества асцитической жидкости оправданно, поскольку реже нарушается функция почек.
7. Оценка эффективности диуретической терапии. В случае эффективности проводимой терапии при осмотре больного отмечается:
• уменьшение размера живота при измерении окружности талии;
• уменьшение периферических отеков;
• уменьшение выраженности печеночной энцефалопатии (тест связи чисел);
• положительный суточный диурез;
• уменьшение суточной экскреция натрия с мочой.
Рефрактерным называется персистирующий, несмотря на адекватное лечение, асцит. В этом случае ограничение приема натрия и назначение высоких доз диуретиков (400 мг/сут спиронолактона и 160 мг/сут фуросемида в течение 1-4 нед.) не приводят к эффективному диурезу, уменьшению массы тела, разрешению асцита. Диагностические критерии резистентного асцита указаны в таблице 1.
Диагностические критерии резистентного асцита (Moore K.P.)
| 1. Длительность лечения: интенсивная терапия мочегонными препаратами (максимальные дозировки: антагонисты альдостерона 400 мг/сут, фуросемид 160 мг/сут) в течение 1 недели при соблюдении диеты с содержанием соли до 5,2 г/сут2. Отсутствие ответа на лечение: снижение массы тела менее 0,8 кг каждые 4 дня 3. Ранний рецидив асцита: возврат асцита 2-3-й степени в течение 4 недель от начала лечения 4. Осложнения, связанные с приемом диуретических препаратов:
|
Причины возникновения рефрактерного асцита:
• слишком большое поступление натрия (с пищей, лекарствами);
• отсутствие ограничения приема жидкости при гипонатриемии;
• нарушение функции почек (с осторожностью необходимо применять нестероидные противовоспалительные препараты, аспирин, аминогликозиды, метоклопрамид).
Если развитие осложнений диуретической терапии не позволяет увеличивать дозу диуретиков, то возможно проведение гипербарической оксигенации, а в случае неэффективности — лечебного лапароцентеза.
Показаниями для лечебного лапароцентеза являются:
В этом случае одномоментно эвакуируют 4-6 л асцитической жидкости с последующим введением 20%-ного раствора альбумина из расчета 25 мл на 1 л удаленной жидкости для поддержания эффективного внутрисосудистого объема. Введение альбумина является обязательным и предупреждает развитие гепаторенального синдрома и гиповолемии. Необходимо помнить, что удаление большого количества асцитической жидкости приводит к значительному усугублению печеночной энцефалопатии.
При формировании правостороннего гидроторакса на фоне асцита торакоцентез показан с диагностической целью или при критическом накоплении уровня жидкости. Рефрактерный асцит часто формируется при злокачественных опухолях, поражающих органы брюшной полости и малого таза, и требует повторных лапароцентезов.
Осложнения диуретической терапии:
• энцефалопатия (в 25% случаев);
• электролитные нарушения (в 38-41% случаев);
• гепаторенальный синдром (ГРС).
Наиболее частыми осложнениями диуретической терапии являются электролитные нарушения, прогрессирование печеночной энцефалопатии, развитие гепаторенального синдрома (ГРС). Повышенное выделение калия, натрия и хлоридов при назначении диуретиков в больших дозах и избыточном диурезе может приводить к метаболическому алкалозу и усугублению респираторного алкалоза. Гипокалиемия приводит к уменьшению выделения аммиака почками. В условиях метаболического алкалоза повышается содержание в плазме свободного аммиака и облегчается его проникновение в клетки центральной нервной системы, что усугубляет энцефалопатию. Необходимо отменить салуретики и назначить заместительную терапию 3%-ным раствором калия в дозе 60-80 ммоль (4-6 г хлорида калия) в течение 4-6 дней. Кроме того, назначают терапию печеночной энцефалопатии.
Однако необходимо помнить о возможном развитии гиперкалиемии, которая манифестирует нарастанием слабости, признаками сердечной недостаточности, аритмиями. На электрокардиограмме выявляются высокий остроконечный зубец Т, расширение комплекса QRS, удлинение интервала QT.
Уменьшение суточного диуреза, нарастание уровня креатинина и мочевины могут быть обусловлены развитием ГРС, что требует прекращения лечения диуретиками. Если уровень мочевины превышает 10 мг/100 мл, а кретинин сыворотки более 0,5 мг/100 мл, то диуретики должны быть отменены, хотя бы временно.
ГРС — нарушение функции почек вследствие дилатации артерий и рефлекторной активации эндогенных вазоконстрикторных факторов, приводящих к снижению скорости клубочковой фильтрации.
ГРС 1-го типа — быстропрогрессирующее (менее чем за 2 нед) повышение (в 2 раза) исходного уровня креатинина крови или уменьшение на 50% от исходного суточного клиренса креатинина. При ГРС 2-го типа почечная недостаточность развивается постепенно. Лечение заключается во введении раствора альбумина и вазоконстрикторов (терлипрессин).
Неоднократное удаление большого количества асцитической жидкости приводит к снижению в ней концентрации белка и теоретически может предрасполагать к развитию спонтанного бактериального перитонита (СБП) — самопроизвольного инфицирования асцитической жидкости при отсутствии интраабдоминальных причин инфекции.
Диагноз СБП может подтверждаться при лапароцентезе:
• число нейтрофилов 250 в 1 мм 3 ;
• посев асцитической жидкости позволяет определить спектр патогенной флоры;
Отсутствие роста возбудителей в асцитической жидкости нейтрофилов 250 в 1 мм 3 свидетельствует о культуро-негативной форме СБП.
Для лечения СБП назначают цефалоспорины III поколения, фторхинолоны, амоксациллин и клавулановую кислоту.
Ведение пациента с асцитом является чрезвычайно непростой задачей, с которой сталкивается терапевт в своей ежедневной практике, и требует особого внимания лечащего врача и хорошей теоретической подготовки.
Пациенту с асцитом необходима срочная госпитализация, если асцит:
• осложняется гепаторенальным синдромом или СБП.
Наиболее типичными ошибками при ведении пациента с асцитом являются:
• интенсивная диуретическая терапия;
• форсированные лечебные лапароцентезы без адекватной заместительной терапии;
• недооценка значимости вторичной бактериальной инфекции в формировании СБП.
Таким образом, ведение пациентов с асцитом суммарно можно представить в виде следующей схемы (рис. 2).
Рисунок 2. Принципы терапии больных с асцитом 2-й и 3-й степени (по CаrdenasА.)
Казанская государственная медицинская академия
Галеева Зарина Мунировна — кандидат медицинских наук, ассистент кафедры терапии
1. Болезни печени и желчевыводящих путей. Руководство для врачей под редакцией В.Т. Ивашкина. М.: Издательский дом «М-Вести», 2002.
2. Буеверов А.О. Инфекционные осложнения цирроза печени // Русский медицинский журнал, 2008. — Т. 6. — № 19. — С. 15-19.
3. Ерамишанцев А.К., В.М. Лебезев, Р.А. Мусин. Хирургическое лечение резистентного асцита у больных с портальной гипертензией // Хирургия, 2003. — № 4. — С. 4-9.
4. Федосьина Е.А. Особенности течения заболевания и прогноз жизни больных циррозом печени с асцитом // Диссертация на соискание ученой степени кандидата медицинских наук. — Москва, 2006.
источник
Сайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна!
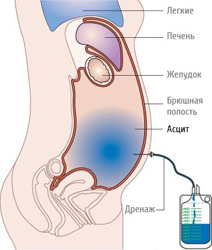
Подтвердить диагноз и установить причину асцита можно с помощью:
- перкуссии живота;
- пальпации живота;
- лабораторных анализов;
- ультразвукового исследования (УЗИ);
- магнитно-резонансной томографии (МРТ);
- диагностического лапароцентеза (прокола).
Пальпация (прощупывание) живота может дать важную информацию о состоянии внутренних органов и помочь врачу заподозрить ту или иную патологию. Определить наличие небольшого количества жидкости (менее 1 литра) методом пальпации довольно сложно. Однако на данном этапе развития заболевания можно выявить ряд других признаков, указывающих на поражение определенных органов.
С помощью пальпации можно обнаружить:
- Увеличение печени. Может быть признаком цирроза или рака печени. Печень при этом плотная, поверхность ее бугристая, неровная.
- Увеличение селезенки. У здоровых людей селезенка не пальпируется. Ее увеличение может быть признаком прогрессирующей портальной гипертензии (при циррозе или раке), метастазирования опухоли или гемолитических анемий (при которых клетки крови разрушаются в селезенке).
- Признаки воспаления брюшины (перитонита). Основным симптомом, указывающим на наличие воспалительного процесса в брюшной полости, является симптом Щеткина-Блюмберга. Для его выявления пациент ложится на спину и сгибает ноги в коленях, а врач медленно надавливает пальцами на переднюю брюшную стенку, после чего резко убирает руку. Появляющиеся при этом сильнейшие острые боли свидетельствуют в пользу перитонита.
При выраженном асците передняя брюшная стенка будет напряженной, твердой, болезненной, поэтому выявить выше перечисленные симптомы будет невозможно.
Симптом флюктуации (колебания) является важным признаком наличия жидкости в брюшной полости. Для его выявления пациент ложится на спину, врач левую руку прижимает к брюшной стенке пациента с одной стороны, а правой рукой слегка поколачивает по противоположной стенке живота. Если в брюшной полости имеется достаточное количество свободной жидкости, при постукивании будут образовываться характерные волнообразные толчки, которые будут ощущаться на противоположной стороне.
Симптом флюктуации может быть выявлен, если в брюшной полости имеется более 1 литра жидкости. В то же время, при выраженном асците он может быть малоинформативен, так как чрезмерно высокое давление в брюшной полости не позволит правильно провести исследование и оценить его результаты.
Лабораторные анализы назначаются после тщательного клинического обследования пациента, когда врач подозревает патологию того или иного органа. Целью лабораторных исследований является подтверждение диагноза, а также исключений других возможных заболеваний и патологических состояний.
При асците врач может назначить:
- общий анализ крови;
- биохимический анализ крови;
- общий анализ мочи;
- бактериологическое исследование;
- биопсию печени.
Общий анализ крови (ОАК)
Назначается с целью оценки общего состояния пациента и выявления различных отклонений, встречающихся при тех или иных заболеваниях. Так, например, у больных с циррозом печени и спленомегалией (увеличением селезенки) может отмечаться снижение концентрации эритроцитов (красных клеток крови), гемоглобина (дыхательного пигмента, транспортирующего кислород в организме), лейкоцитов (клеток иммунной системы) и тромбоцитов (кровяных пластинок, обеспечивающих остановку кровотечений). Объясняется это тем, что клетки крови задерживаются и разрушаются в увеличенной селезенке.
При инфекционно-воспалительных заболеваниях органов брюшной полости (в частности при перитоните и панкреатите) может отмечаться выраженное увеличение концентрации лейкоцитов (как ответ иммунной системы в ответ на внедрение чужеродной инфекции) и увеличение скорости оседания эритроцитов (СОЭ), что также указывает на наличие воспалительного процесса в организме.
Биохимический анализ крови (БАК)
При данном исследовании оценивается количество различных веществ в крови, что позволяет судить о функциональной активности определенных органов.
При циррозе печени будет отмечаться повышение концентрации билирубина (вследствие снижения обезвреживающей функции органа). Также для цирроза характерно уменьшение концентрации белков в крови, так как все они образуются в печени.
При воспалении брюшины или при панкреатите БАК позволяет выявить увеличение концентрации белков острой фазы воспаления (С-реактивного белка, фибриногена, церулоплазмина и других), причем их концентрация в крови напрямую зависит от выраженности и активности воспалительного процесса. Это позволяет вовремя распознать перитонит, а также контролировать состояние пациента в динамике в процессе лечения и вовремя выявить возможные осложнения.
При почечном асците (развивающемся в результате почечной недостаточности) в крови будет повышаться концентрации веществ, которые обычно выводятся почками. Особое значение имеют такие вещества как мочевина (норма 2,5 – 8,3 ммоль/литр), мочевая кислота (норма 120 – 350 мкмоль/литр) и креатинин (норма 44 – 100 мкмоль/литр).
БАК также важен при диагностике панкреатита (воспаления поджелудочной железы). Дело в том, что при прогрессировании заболевания происходит разрушение ткани железы, вследствие чего пищеварительные ферменты (панкреатическая амилаза) поступают в кровь. Повышение концентрации панкреатической амилазы более 50 Единиц действия/литр (Ед/л) позволяет подтвердить диагноз.
Общий анализ мочи (ОАМ)
Исследование мочи позволяет выявить отклонения в работе мочевыделительной системы. В нормальных условиях через почки ежедневно профильтровывается более 180 литров жидкости, однако около 99% из данного объема всасывается обратно в кровоток. На начальной стадии почечной недостаточности концентрационная и всасывающая функция почек может нарушаться, в результате чего будет выделяться большее количество менее плотной мочи (в норме удельный вес мочи колеблется в пределах от 1010 до 1022). При терминальной стадии заболевания удельный вес мочи может быть в норме или даже слегка повышенным, однако общее количество выделяемой в сутки мочи значительно снижается.
При нефротическом синдроме будет отмечаться выделение мочи повышенной плотности, в которой будет определяться увеличенная концентрация белков (более 3,5 грамм в сутки). Также ОАМ ценен при диагностике панкреатита, так как при данном заболевании концентрация амилазы повышается не только в крови, но и в моче (более 1000 Ед/л).
Бактериологическое исследование
Особую ценность данное исследование имеет при бактериальном и туберкулезном перитоните. Суть его заключается в заборе различного биологического материала (крови, асцитической жидкости, слюны) и выделении из него патогенных микроорганизмов, которые могли бы стать причиной развития инфекционно-воспалительного процесса. Это позволяет не только подтвердить диагноз, но и определить те антибиотики, которые лучше всего подойдут для лечения инфекции у данного пациента (чувствительность различных бактерий к антибактериальным препаратам различная, что можно определить в лабораторных условиях).
Биопсия печени
При биопсии производится прижизненное удаление небольшого фрагмента печеночной ткани пациента с целью его исследования в лаборатории под микроскопом. Это исследование позволяет подтвердить диагноз цирроза более чем в 90% случаев. При раке печени биопсия может оказаться неинформативной, так как никто не может гарантировать, что раковые клетки окажутся именно в том участке печеночной ткани, который будет исследован.
Принцип УЗИ основан на способности звуковых волн отражаться от объектов различной плотности (они легко проходят через воздух, однако преломляются и отражаются на границе воздуха и жидкости или плотной ткани органа). Отраженные волны регистрируются специальными приемниками и после компьютерной обработки представляются на мониторе в виде изображения исследуемой области.
Данное исследование абсолютно безвредно и безопасно, может выполняться множество раз в течение всего периода лечения для контроля состояния пациента и своевременного выявления возможных осложнений.
С помощью УЗИ можно выявить:
- Свободную жидкость в брюшной полости – определяется даже небольшое ее количество (несколько сотен миллилитров).
- Жидкость в плевральной полости и в полости перикарда – при системных воспалительных заболеваниях и опухолях.
- Увеличение печени – при циррозе, раке, тромбозе печеночных вен.
- Увеличение селезенки – при повышении давления в системе воротной вены (портальной гипертензии) и при гемолитических анемиях (сопровождающихся разрушением клеток крови).
- Расширение воротной вены – при портальной гипертензии.
- Расширение нижней полой вены – при сердечной недостаточности и застое крови в венах нижней части тела.
- Нарушение структуры почек – при почечной недостаточности.
- Нарушение структуры поджелудочной железы – при панкреатите.
- Аномалии развития плода.
- Опухоль и ее метастазы.
Данное исследование позволяет выявить даже небольшие количества асцитической жидкости, находящейся в труднодоступных местах брюшной полости, которые нельзя исследовать с помощью других методов. Также МРТ полезна при диагностике цирроза печени, доброкачественных и злокачественных опухолей любой локализации, при перитоните, панкреатите и других заболеваниях, которые могли бы стать причиной асцита.
Помимо УЗИ и МРТ врач может назначить целый ряд дополнительных инструментальных исследований, необходимых для установки диагноза и оценки состояния различных органов и систем.
Для выявления причины асцита врач может назначить:
- Электрокардиографию (ЭКГ). Данное исследование позволяет оценить электрическую активность сердца, выявить признаки увеличения сердечной мышцы, нарушение ритма сердечных сокращений и другие патологии.
- Эхокардиографию (ЭхоКГ). При данном исследовании оценивается характер сердечных сокращений при каждой систоле и диастоле, а также производится оценка структурных нарушений сердечной мышцы.
- Рентгенологическое исследование.Рентген грудной клетки назначается всем пациентам при подозрении на асцит. Это простое исследование позволяет исключить инфекционные заболевания легких, плеврит. Рентгенография брюшной полости позволяет выявить увеличение печени, наличие кишечной непроходимости или перфорацию (прободение) кишечника и выход части газов в брюшную полость.
- Допплерографию. Это исследование основано на принципе УЗИ с применением эффекта Доплера. Суть его заключается в том, что при ультразвуковом исследовании приближающиеся и отделяющиеся объекты (в частности кровь в кровеносных сосудах) будут отражать звуковые волны по-разному. По результатам данного исследования можно оценить характер кровотока по воротной вене и другим кровеносным сосудам, можно выявить наличие тромбов в печеночных венах и определить другие возможные нарушения.
Диагностическая пункция (то есть прокол передней брюшной стенки и откачивание небольшого количества асцитической жидкости) назначается пациентам, которым не удалось выставить диагноз на основании других методов исследования. Этот метод позволяет исследовать состав жидкости и ее свойства, что в некоторых случаях полезно для постановки диагноза.
Диагностический лапароцентез противопоказан:
- При нарушении свертывающей системы крови, так как при этом повышается риск кровотечения во время проведения исследования.
- При инфицировании кожи в области переднебоковой стенки живота, так как во время прокола возможно занесение инфекции в брюшную полость.
- При кишечной непроходимости (высок риск прободения иглой раздутых петель кишечника, что приведет к выходу каловых масс в брюшную полость и развитию калового перитонита).
- При подозрении на наличие опухоли вблизи места прокола (повреждение опухоли иглой может спровоцировать метастазирование и распространение опухолевых клеток по всему организму).
Также стоит отметить, что в третьем триместре беременности лапароцентез проводиться только по строгим показаниям и под контролем ультразвукового аппарата, помогающего контролировать глубину введения иглы и ее расположение по отношению к другим органам и к плоду.
Подготовка больного
Подготовка к процедуре заключается в опустошении мочевого пузыря (при необходимости в него может быть установлен специальный катетер), желудка (вплоть до промывания через зонд) и кишечника. Сама процедура выполняется под местным обезболиванием (то есть пациент при этом находится в сознании), поэтому особо чувствительным и эмоциональным пациентам можно назначить легкие успокоительные препараты.
Лидокаин и новокаин (местные анестетики, вводимые в мягкие ткани и угнетающие боль и другие виды чувствительности на некоторое время) довольно часто вызывают аллергические реакции (вплоть до анафилактического шока и смерти пациента). Вот почему перед началом обезболивания в обязательном порядке проводится тест на аллергию. На коже предплечья пациента стерильной иглой делается 2 царапины, на одну из которых наносится анестетик, а на другую – обычный физиологический раствор. Если через 5 – 10 минут цвет кожных покровов над ними одинаков, реакция считается отрицательной (аллергии нет). Если же над царапиной с анестетиком отмечается покраснение, отечность и припухлость кожи, это говорит о том, что у данного пациента имеется аллергия на данный анестетик, поэтому его применение категорически противопоказано.
Техника выполнения процедуры
Пациент принимает полусидячее или лежачее (на спине) положение. Непосредственно перед началом пункции его укрывают стерильными простынями таким образом, чтобы свободным осталась только область передней брюшной стенки, через которую будет осуществляться прокол. Это позволяет снизить риск развития инфекционных осложнений в послеоперационном периоде.
Прокол обычно производится по средней линии живота, между пупком и лобковой костью (в данной области находится меньше всего кровеносных сосудов, поэтому риск их травматизации минимален). Вначале врач обрабатывает место предполагаемой пункции раствором антисептика (йодным раствором, перекисью водорода), после чего обкалывает кожу, подкожную клетчатку и мышцы передней брюшной стенки раствором анестетика. После этого скальпелем выполняется небольшой разрез кожи, через который вводится троакар (специальный инструмент, представляющий собой трубку, внутри которой находится стилет). Троакар медленно, с помощью вращательных движений продвигают вглубь, пока врач не решит, что он находится в брюшной полости. После этого стилет извлекается. Вытекание асцитической жидкости через троакар говорит о правильно проведенной пункции. Производят забор необходимого количества жидкости, после чего троакар извлекают, и рану ушивают. Пробирка с полученной жидкостью отправляется в лабораторию для дальнейшего исследования.
Интерпретация результатов исследования
В зависимости от характера и состава различают два вида асцитической жидкости — транссудат и экссудат. Это крайне важно для дальнейшей диагностики, так как механизмы образования этих жидкостей различны.
Транссудат представляет собой ультрафильтрат плазмы, образующийся при пропотевании жидкости через кровеносные или лимфатические сосуды. Причиной скапливания транссудата в брюшной полости может быть сердечная недостаточность, нефротический синдром и другие патологии, сопровождающиеся повышением гидростатического и уменьшением онкотического давления крови. При лабораторном исследовании транссудат определяется как прозрачная жидкость пониженной плотности (удельный вес колеблется в пределах от 1,006 до 1,012). Концентрация белка в транссудате не превышает 25 г/л, что подтверждается специальными пробами.
Экссудат, в отличие от транссудата, представляет собой мутную, блестящую жидкость, богатую белками (более 25 г/л) и другими микромолекулярными веществами. Плотность экссудата обычно колеблется в пределах от 1,018 до 1,020, а концентрация лейкоцитов может превышать 1000 в одном микролитре исследуемой жидкости. Также в экссудате могут обнаруживаться примеси других биологических жидкостей (крови, лимфы, желчи, гноя), что будет свидетельствовать о поражении того или иного органа.
В клинической практике выделяют три стадии развития асцита, которые определяются в зависимости от количества свободной жидкости в брюшной полости.
Асцит может быть:
- Транзиторным. В данном случае в брюшной полости скапливается не более 400 мл жидкости, которая может быть выявлена только с помощью специальных исследований (УЗИ, МРТ). Транзиторный асцит не нарушает функцию органов брюшной полости или легких, поэтому все имеющиеся симптомы обусловлены основным заболеванием, адекватная терапия которого может привести к рассасыванию жидкости.
- Умеренным. При умеренном асците в брюшной полости может скапливаться до 4 литров асцитической жидкости. Живот у таких пациентов будет слегка увеличенным, в положении стоя будет отмечаться выпирание нижней части брюшной стенки, а в положении лежа может появляться одышка (чувство нехватки воздуха). Наличие асцитической жидкости может быть определено с помощью перкуссии или симптома флюктуации.
- Напряженным. В данном случае количество асцитической жидкости может превышать 10 – 15 литров. Давление в брюшной полости при этом повышается на столько, что может нарушать функции жизненно-важных органов (легких, сердца, кишечника). Состояние таких пациентов оценивается как крайне тяжелое, поэтому они должны быть немедленно госпитализированы в отделение реанимации для диагностики и лечения.
Также в клинической практике принято выделять рефрактерный (не поддающийся лечению) асцит. Данный диагноз выставляется в том случае, если на фоне проводимого лечения количество жидкости в брюшной полости продолжает увеличиваться. Прогноз в данном случае крайне неблагоприятный.
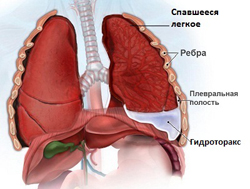
В лечении асцита применяются:
- мочегонные средства;
- диетотерапия;
- физические упражнения;
- лечебный лапароцентез;
- народные методы лечения.
Мочегонные препараты обладают способностью выводить жидкость из организма посредством различных механизмов. Уменьшение объема циркулирующей крови может способствовать переходу части жидкости из брюшной полости в кровеносное русло, что уменьшит выраженность клинических проявлений асцита.
Мочегонные средства при асците
Важно помнить, что скорость выведения асцитической жидкости не должна превышать 400 мл в сутки (именно столько может всасывать брюшина в сосудистое русло). При более интенсивном выведении жидкости (что может наблюдаться при неправильном и неконтролируемом приеме мочегонных средств) может развиться обезвоживание организма.
Помимо мочегонных препаратов может применяться целый ряд других медикаментов, влияющих на развитие асцита.
Медикаментозное лечение асцита может включать:
- Средства, укрепляющие сосудистую стенку (диосмин, витамины С, Р). Расширение сосудов и повышение проницаемости сосудистой стенки являются одними из основных элементов в развитии асцита. Применение препаратов, которые могут снизить проницаемость сосудов и повысить их устойчивость перед лицом различных патогенных факторов (повышенного внутрисосудистого давления, медиаторов воспаления и так далее) может значительно замедлить прогрессирование асцита.
- Средства, влияющие на систему крови (>полиглюкин, реополиглюкин, желатиноль). Введение данных препаратов в системный кровоток способствует удерживанию жидкости в сосудистом русле, препятствуя ее переходу в межклеточное пространство и в брюшную полость.
- Альбумин (белок).Альбумин является основным белком, обеспечивающим онкотическое давление крови (которое удерживает жидкость в сосудистом русле и не дает ей переходить в межклеточное пространство). При циррозе или раке печени, а также при нефротическом синдроме количество белка в крови может значительно снижаться, что нужно компенсировать внутривенным введением альбуминов.
- Антибиотики. Назначаются при бактериальном или туберкулезном перитоните.
Питание при асците должно быть высококалорийным, полноценным и сбалансированным, чтобы обеспечить организм всеми необходимыми питательными веществами, витаминами и микроэлементами. Также пациентам следует ограничить потребление ряда продуктов, которые могли бы усугубить течение заболевания.
Главными принципами диеты при асците являются:
- Ограничение потребления соли. Избыточное потребление соли способствует переходу жидкости из сосудистого русла в межклеточное пространство, то есть приводит к развитию отеков и асцита. Вот почему таким пациентам рекомендуется исключить из рациона соль в чистом виде, а соленую пищу принимать в ограниченном количестве.
- Ограничение потребления жидкости. Больным с умеренным или напряженным асцитом не рекомендуется принимать более 500 – 1000 мл жидкости (в чистом виде) в сутки, так как это может способствовать прогрессированию заболевания и ухудшению общего самочувствия.
- Достаточное потребление белков. Как уже говорилось, белковая недостаточность может стать причиной развития отеков. Вот почему в ежедневный рацион пациента с асцитом должны входить белки животного происхождения (содержащиеся в мясе, яйцах). Однако стоит помнить, что при циррозе печени избыточное потребление белковой пищи может стать причиной интоксикации организма (так как нарушается обезвреживающая функция печени), поэтому в данном случае лучше согласовать диету с лечащим врачом.
- Ограничение потребления жиров. Это правило особенно важно при асците, вызванном панкреатитом. Дело в том, что потребление жирной пищи стимулирует образование пищеварительных ферментов в поджелудочной железе, что может привести к обострению панкреатита.
Диета при асците
|
|
Планируя физическую активность при асците важно помнить, что данное состояние само по себе свидетельствует о выраженном нарушении функции одного или сразу нескольких внутренних органов, поэтому подбирать нагрузку рекомендуется совместно с лечащим врачом. В целом же вид и характер допустимых физических упражнений зависит от общего состояния пациента и причины асцита.
Основным «ограничителем» физической активности при асците является состояние сердечной и дыхательной систем. Так, например, при выраженной сердечной недостаточности (когда одышка возникает в покое) любая физическая активность противопоказана. В то же время, при более легком течении заболевания и транзиторном или умеренном асците пациенту рекомендуется ежедневно прогуливаться на свежем воздухе (легким, небыстрым шагом), заниматься утренней гимнастикой и другими легкими видами спорта. Особое внимание следует уделить плаванию, так как во время пребывания в воде улучшается циркуляция крови и, в то же время, снижается нагрузка на сердце, что замедляет прогрессирование асцита.
Также ограничить физическую активность пациента может напряженный асцит, при котором наблюдается сдавливание легких и органов брюшной полости. Выполнение обычных физических упражнений в данном случае невозможно, так как любая нагрузка может привести к декомпенсации состояния пациента и развитию острой дыхательной недостаточности.
Как говорилось ранее, пункция (прокол) передней брюшной стенки и удаление части асцитической жидкости из брюшной полости важно в диагностике асцита. В то же время, данная процедура может выполняться и в лечебных целях. Это показано при напряженном и/или рефрактерном асците, когда давление жидкости в брюшной полости настолько велико, что приводит к нарушению работы жизненно-важных органов (в первую очередь, сердца и легких). В данном случае единственным эффективным методом лечения является пункция брюшной полости, во время которой удаляют часть асцитической жидкости.
Техника и правила подготовки больного такие же, как при диагностическом лапароцентезе. После прокола передней брюшной стенки в брюшную полость устанавливается специальная дренажная трубка, по которой будет оттекать асцитическая жидкость. К другому концу трубки обязательно присоединяется емкость с градацией объема (чтобы контролировать количество удаленной жидкости).
Важно помнить, что в асцитической жидкости может содержаться большое количество белков (альбуминов). Одномоментное удаление большого объема жидкости (более 5 литров) может не только привести к падению артериального давления (вследствие расширения ранее сдавленных кровеносных сосудов), но и к выраженной белковой недостаточности. Вот почему количество удаляемой жидкости должно определяться в зависимости от характера асцитической жидкости (транссудат или экссудат) и общего состояния пациента.
Народные методы лечения широко применяются для лечения асцита при различных заболеваниях. Основной задачей лекарственных трав и растений является удаление асцитической жидкости из организма, поэтому все они обладают мочегонным действием.
В лечении асцита можно применять:
- Настой петрушки. 40 грамм измельченной зеленой травы и корней петрушки нужно залить 1 литром кипятка и настаивать при комнатной температуре в течение 12 часов. Принимать внутрь по 1 столовой ложке 3 – 4 раза в день (перед едой).
- Отвар из стручков фасоли. 2 столовых ложки измельченных стручков фасоли нужно залить литром воды, довести до кипения и кипятить на водяной бане в течение 20 – 30 минут. После этого охладить и принимать внутрь по 2 столовых ложки 4 – 5 раз в день перед едой.
- Отвар из листьев мать-и-мачехи. 1 столовую ложку измельченных листьев мать-и-мачехи залить 1 стаканом (200 мл) воды, довести до кипения и кипятить в течение 10 минут. Охладить, процедить и принимать внутрь по 1 столовой ложке 3 раза в сутки.
- Настойку пустырника. 1 столовую ложку измельченных листьев пустырника нужно поместить в стеклянную банку и залить 100 мл 70% спирта, после чего настаивать в темном месте при комнатной температуре в течение 3 – 5 дней. Принимать настойку следует трижды в день перед едой по 30 капель, разбавляемых в небольшом количестве кипяченой воды.
- Абрикосовый компот. Обладает не только мочегонным, но и калийсберегающим действием, что крайне важно при длительном применении мочегонных трав и препаратов. Компот лучше готовить из сушеных абрикосов, 300 – 400 грамм которых заливают 2 – 3 литрами воды и кипятят в течение 15 – 20 минут. Важно помнить, что при напряженном асците количество потребляемой жидкости должно быть ограниченным, поэтому не рекомендуется принимать более 200 – 300 мл компота в сутки.
Операция при асците показана в том случае, если причина его возникновения может быть устранена хирургически путем. В то же время, возможность хирургического лечения ограничивается количеством асцитической жидкости и общим состоянием пациента, которое может быть крайне тяжелым.
Хирургическое лечение может применяться:
- При раке печени. Удаление пораженной опухолью части печени может приостановить прогрессирование патологического процесса (при отсутствии метастазов в отдаленных органах).
- При пороках сердца. Коррекция клапанного порока сердца (замена поврежденного клапана искусственным) может привести к полному выздоровлению пациента, нормализации функции сердца и рассасыванию асцитической жидкости.
- При онкологии брюшной полости. Своевременное удаление опухоли, сдавливающей кровеносные сосуды системы воротной вены, может привести к полному излечению пациента.
- При перитоните. Бактериальный перитонит является показанием к хирургическому лечению. Брюшная полость вскрывается, очищается от гнойных масс и промывается растворами антисептиков.
- При хилезном асците. Если проникновение лимфы в брюшную полость обусловлено повреждением крупного лимфатического сосуда данной области, его ушивание во время хирургической операции может привести к полному выздоровлению пациента.
Хирургическое лечение асцита не выполняется при декомпенсированной сердечной и дыхательной недостаточности. В данном случае пациент просто не переживет наркоз и само оперативное вмешательство, поэтому перед операцией обычно назначается курс мочегонных препаратов, а при необходимости – лечебная пункция и удаление части асцитической жидкости. Также определенные трудности могут возникнуть при оперировании пациента с напряженным асцитом, так как одномоментное удаление большого объема жидкости может привести к развитию осложнений и смерти.
Сегодня широко применяется метод возвращения асцитической жидкости (точнее содержащихся в ней белков и других микроэлементов) в системный кровоток посредством внутривенных вливаний, что позволяет снизить риск смертельного исхода у таких больных.
Одним из основных этапов лечения асцита при циррозе печения является приостановление прогрессирования патологического процесса в ней и стимуляция восстановления нормальной печеночной ткани. Без соблюдения данных условий симптоматическое лечение асцита (применение мочегонных препаратов и повторные лечебные пункции) будет давать временный эффект, однако в конечном итоге все закончится смертью пациента.
Лечение цирроза печени включает:
- Гепатопротекторы (аллохол, урсодезоксихолевую кислоту) – препараты, улучшающие обмен веществ в клетках печени и защищающие их от повреждения различными токсинами.
- Эссенциальные фосфолипиды (фосфоглив, эссенциале) – восстанавливают поврежденные клетки и повышают их устойчивость при воздействии токсических факторов.
- Флавоноиды (гепабене, карсил) – нейтрализуют свободные радикалы кислорода и другие токсические вещества, образующиеся в печени при прогрессировании цирроза.
- Препараты аминокислот (гептрал, гепасол А) – покрывают потребность печени и всего организма в аминокислотах, необходимых для нормального роста и обновления всех тканей и органов.
- Противовирусные средства (пегасис, рибавирин) – назначаются при вирусном гепатите В или С.
- Витамины (А, В12, Д, К) – данные витамины образуются или депонируются (хранятся) в печени, а при развитии цирроза их концентрация в крови может значительно снижаться, что приведет к развитию ряда осложнений.
- Диетотерапию – рекомендуется исключить из рациона продукты, которые увеличивают нагрузку на печень (в частности жирную и жареную пищу, любые виды алкогольных напитков, чай, кофе).
- Пересадку печени – единственный метод, позволяющий радикально решить проблему цирроза. Однако стоит помнить, что даже после успешной пересадки следует выявить и устранить причину возникновения заболевания, так как в противном случае цирроз может поразить и новую (пересаженную) печень.
Причиной образования асцитической жидкости при опухоли может быть сдавливание кровеносных и лимфатических сосудов брюшной полости, а также поражение брюшины опухолевыми клетками. В любом случае для эффективного лечения заболевания необходимо полностью удалить злокачественное новообразование из организма.
В лечении онкологических заболеваний может применяться:
- Химиотерапия.Химиотерапия является основным методом лечения канцероматоза брюшины, при котором опухолевые клетки поражают оба листка серозной оболочки брюшной полости. Назначаются химические препараты (метотрексат, азатиоприн, цисплатин), которые нарушают процессы деления опухолевых клеток, тем самым приводя к уничтожению опухоли. Основной проблемой при этом является тот факт, что данные средства нарушают также деление нормальных клеток во всем организме. В результате этого в период лечения у пациента могут выпадать волосы, могут появляться язвы желудка и кишечника, может развиться апластическая анемия (недостаток красных клеток крови вследствие нарушения процесса их образования в красном костном мозге).
- Лучевая терапия. Суть данного метода заключается в высокоточном воздействии радиацией на опухолевую ткань, что приводит к гибели опухолевых клеток и уменьшению размеров новообразования.
- Хирургическое лечение. Заключается в удалении опухоли посредством хирургической операции. Данный метод особенно эффективен при доброкачественных опухолях либо в том случае, когда причиной асцита является сдавливание кровеносных или лимфатических сосудов растущей опухолью (ее удаление может привести к полному выздоровлению пациента).
Сердечная недостаточность характеризуется неспособностью сердечной мышцы перекачивать кровь в организме. Лечение данного заболевания заключается в уменьшении давления в кровеносной системе, устранении застоя крови в венах и улучшении работы сердечной мышцы.
Лечение сердечной недостаточности включает:
- Мочегонные препараты. Уменьшают объем циркулирующей крови, снижая нагрузку на сердце и давление в венах нижней части тела, тем самым предотвращая дальнейшее развитие асцита. Назначать их следует осторожно, под контролем артериального давления, чтобы не спровоцировать обезвоживание организма.
- Препараты, понижающие артериальное давление (рамиприл, лозартан). При повышенном артериальном давлении (АД) сердечной мышце нужно выполнять большую работу, выбрасывая кровь в аорту во время сокращения. Нормализация давления уменьшает нагрузку на сердце, тем самым способствуя устранению венозного застоя и отеков.
- Сердечные гликозиды (дигоксин, дигитоксин). Данные препараты увеличивают силу сердечных сокращений, что способствует устранению застоя в венах нижней части туловища. Принимать их следует осторожно, так как в случае передозировки может наступить смерть.
- Бессолевую диету. Потребление большого количества соли приводит к задержке жидкости в организме, что еще больше увеличивает нагрузку на сердце. Вот почему пациентам с сердечной недостаточностью не рекомендуется принимать более 3 – 5 грамм соли в сутки (включая соль, используемую при приготовлении различных блюд).
- Ограничение приема жидкости (не более 1 – 1,5 литров в сутки).
- Соблюдение режима дня. Если позволяет состояние сердечно-сосудистой системы, пациентам рекомендуется умеренная физическая активность (ходьба, утренняя гимнастика, плавание, занятия йогой).
При почечной недостаточности нарушается выделительная функция почек, в результате чего жидкость и побочные продукты обмена веществ (мочевина, мочевая кислота) задерживаются в организме в больших количествах. Лечение почечной недостаточности заключается в нормализации функций почек и удалении токсических веществ из организма.
Лечение почечной недостаточности включает:
- Мочегонные препараты. На начальных стадиях заболевания могут оказывать положительное действие, однако при терминальной стадии почечной недостаточности малоэффективны. Объясняется это тем, что механизм действия мочегонных препаратов заключается в регуляции (то есть в усилении) выделительной функции почечной ткани. При последней стадии заболевания количество функциональной почечной ткани крайне мало, что и обуславливает отсутствие эффекта при назначении мочегонных средств.
- Препараты, снижающие артериальное давление. При почечной недостаточности происходит нарушение кровоснабжения оставшейся функциональной почечной ткани, вследствие чего активируется ряд компенсаторных механизмов, направленных на поддержание почечного кровотока на адекватном уровне. Одним из таких механизмов является увеличение артериального давления. Однако повышение АД не улучшает состояния почек, а наоборот, способствует прогрессированию патологического процесса, развитию отеков и асцита. Вот почему нормализация показателей АД является важным этапом лечения, позволяющим замедлить скорость образования асцитической жидкости.
- Гемодиализ. Во время данной процедуры кровь пациента пропускается через специальный аппарат, в котором происходит ее очищение от побочных продуктов обмена веществ и других токсинов, после чего она возвращается обратно в кровеносное русло. Гемодиализ и другие методы очищения крови (плазмаферез, перитонеальный диализ, гемосорбция) являются последним эффективным способом продления жизни пациентов с хронической почечной недостаточностью.
- Пересадку почки. Радикальный метод лечения, при котором пациенту пересаживают донорскую почку. Если операция пройдет успешно и трансплантат приживется в организме хозяина, новая почка может в полном объеме выполнять выделительную функцию, обеспечивая нормальное качество и продолжительность жизни пациента.
Асцит может осложниться:
- воспалением брюшины (асцитом-перитонитом);
- сердечной недостаточностью;
- гидротораксом;
- дыхательной недостаточностью;
- диафрагмальной грыжей;
- пупочной грыжей;
- кишечной непроходимостью.
Асцит-перитонит
Данное состояние возникает в результате проникновения чужеродных бактерий в брюшную полость, что приводит к воспалению брюшины. Развитию данного осложнения способствует застой асцитической жидкости, нарушение моторики сдавленных кишечных петель, а также расширение и повышение проницаемости сосудов в системе воротной вены. Также важную роль в развитии инфекционных осложнений играет снижение общих защитных сил организма в результате прогрессирования основной патологии, ставшей причиной асцита (почечной, сердечной или печеночной недостаточности, опухоли и так далее).
Важным является тот факт, что какого-либо видимого дефекта брюшины или внутренних органов, который мог бы стать источником инфекции при этом не наблюдается. Предполагают, что бактерии просачиваются в брюшную полость через расширенные и перерастянутые стенки кишечных петель.
Независимо от механизма развития наличие перитонита требует госпитализации пациента и срочного хирургического лечения.
Сердечная недостаточность
Скапливание большого количества жидкости в брюшной полости приводит к сдавливанию расположенных там органов и кровеносных сосудов (артерий и вен), нарушая ток крови по ним. В результате этого сердцу требуется выполнять большую работу, чтобы перекачивать кровь по сосудам.
Если асцит развивается медленно, в сердце активируются компенсаторные механизмы, заключающиеся в разрастании мышечных волокон и увеличении размеров сердечной мышцы. Это позволяет до определенного момента компенсировать увеличение нагрузки. При дальнейшем прогрессировании асцита резервы сердечной мышцы могут истощаться, что и станет причиной развития сердечной недостаточности.
Если же асцит развивается быстро (в течение нескольких дней), сердце не успевает приспособиться к возрастающей нагрузке, вследствие чего может развиться острая сердечная недостаточность, требующая экстренной медицинской помощи.
Гидроторакс
Данным термином обозначается скапливание жидкости в грудной клетке. Развитию гидроторакса при асците способствует повышение давления асцитической жидкости, в результате чего жидкость из кровеносных и лимфатических сосудов брюшной полости может переходить в сосуды диафрагмы и грудной клетки. При прогрессировании заболевания количество свободной жидкости в грудной клетке будет увеличиваться, что приведет к сдавливанию легкого на стороне поражения (или обоих легких при двустороннем гидротораксе) и нарушению дыхания.
Дыхательная недостаточность
Развитию данного состояния может способствовать подъем и ограничение экскурсии диафрагмы в результате повышения давления в брюшной полости, а также прогрессирование гидроторакса. В отсутствии своевременного лечения дыхательная недостаточность приведет к выраженному снижению концентрации кислорода в крови, что может проявляться одышкой, синюшностью кожных покровов и нарушением сознания, вплоть до его утраты.
Диафрагмальная грыжа
Диафрагмальной грыжей называется выпячивание органа или ткани через дефект в диафрагме либо через ее пищеводное отверстие. Причиной этого является выраженное повышение внутрибрюшного давления.
Через грыжевое отверстие могут выпячиваться желудок, петли кишечника или серозная оболочка, наполненная асцитической жидкостью. Проявляется данное состояние болями в грудной клетке и в области сердца, в верхних отделах живота. Если в грыжевое отверстие выходит достаточно большой по объему участок органа, он может сдавливать легкие и сердце, приводя к нарушению дыхания и сердцебиения.
Лечение заболевания в основном хирургическое, заключающееся во вправлении грыжевого мешка и ушивание дефекта в диафрагме.
Пупочная грыжа
Причиной образования пупочной грыжи также является повышенное давление в брюшной полости. Передняя брюшная стенка почти на всем своем протяжении покрыта мышцами. Исключение составляет пупочная область и срединная линия живота, где данные мышцы сходятся вместе и формируют так называемый апоневроз передней брюшной стенки. Состоит данный апоневроз из сухожильной ткани, которая является «слабым местом» брюшной стенки (именно здесь чаще всего отмечается выпячивание грыжевого мешка). Лечения заболевания также хирургическое (производится вправление грыжи и ушивание грыжевых ворот).
Кишечная непроходимость
Развивается в результате сдавливания петель кишечника асцитической жидкостью, что обычно встречается при напряженном, рефрактерном асците. Нарушение проходимости кишечника приводит к скапливанию каловых масс выше места сдавливания и усиленной перистальтике (моторной активности) кишечника в данной области, что сопровождается выраженными приступообразными болями в животе. Если в течение нескольких часов кишечная непроходимость не разрешается, наступает паралич кишечника, расширение и повышение проницаемости кишечной стенки. В результате этого многочисленные бактерии (являющиеся постоянными обитателями толстого кишечника) проникают в кровь, вызывая развитие грозных, опасных для жизни пациента осложнений.
Лечение заключается во вскрытии брюшной полости и устранении кишечной непроходимости. Если поврежденные петли кишечника оказываются нежизнеспособны, их удаляют, а образовавшиеся концы пищеварительного канала соединяют между собой.

Исходя из вышесказанного следует, что прогноз при асците определяется не только количеством жидкости в брюшной полости и качеством проводимого лечения, но также и основным заболеванием, ставшим причиной скапливания жидкости в брюшной полости.
Срок жизни людей с диагностированным асцитом варьирует в широких пределах, что зависит от целого ряда факторов.
Продолжительность жизни пациента с асцитом обусловлена:
- Выраженностью асцита. Транзиторный (слабовыраженный) асцит не представляет непосредственной угрозы для жизни пациента, в то время как напряженный асцит, сопровождающийся скапливанием в брюшной полости десятков литров жидкости, может привести к развитию острой сердечной или дыхательной недостаточности и смерти пациента в течение часов или дней.
- Временем начала лечения. Если асцит выявлен на ранних стадиях развития, когда функции жизненно-важных органов не нарушены (или нарушены незначительно), устранение основного заболевания может привести к полному излечению пациента. В то же время, при длительно прогрессирующем асците может произойти поражение многих органов и систем (дыхательной, сердечно-сосудистой, выделительной), что приведет к смерти пациента.
- Основным заболеванием. Это, пожалуй, основной фактор, определяющий выживаемость пациентов с асцитом. Дело в том, что даже при проведении самого современного лечения благоприятный исход маловероятен, если у пациента имеется недостаточность сразу нескольких органов. Так, например, при декомпенсированном циррозе печени (когда функция органа практически полностью нарушена) шансы пациента на выживание в течение 5 лет после установки диагноза составляют менее 20%, а при декомпенсированной сердечной недостаточности – менее 10%. Более благоприятен прогноз при хронической почечной недостаточности, так как пациенты, находящиеся на гемодиализе и соблюдающие все предписания врача, могут прожить десятки лет и более.

Профилактика асцита включает:
- Своевременное лечение заболеваний печени. Развитию цирроза печени всегда предшествует длительное воспаление печеночной ткани (гепатит). Крайне важно вовремя установить причину данного заболевания и устранить ее (провести противовирусное лечение, отказаться от употребления алкоголя, начать принимать здоровую пищу и так далее). Это позволит приостановить прогрессирование патологического процесса и сохранить жизнеспособной большую часть печеночной ткани, что обеспечит пациенту полноценную жизнь в течение долгих лет.
- Своевременное лечение врожденных пороков сердца. На современном этапе развития операцию по замене поврежденного сердечного клапана или закрытию дефекта в стенках сердечной мышцы можно провести в раннем детском возрасте, что позволит ребенку нормально расти и развиваться и избавит его от сердечной недостаточности в будущем.
- Своевременное лечение заболеваний почек. Хотя гемодиализ может компенсировать выделительную функцию почки, он не в состоянии обеспечить целый ряд других функций данного органа. Вот почему гораздо легче вовремя и полноценно лечить различные инфекционные заболевания мочевыделительной системы, такие как цистит (воспаление мочевого пузыря), гломерулонефрит (воспаление почечной ткани), пиелонефрит (воспаление почечных лоханок), чем потом проводить на гемодиализе по 2 – 3 часа дважды в неделю на протяжении всей оставшейся жизни.
- Соблюдение диеты при панкреатите. При хроническом панкреатите спровоцировать обострение заболевания и разрушение ткани поджелудочной железы может прием большого количества алкоголя, сладостей, острой, копченой или жареной пищи. Однако следует понять, что такие пациенты не должны полностью исключать из рациона вышеперечисленные продукты. 1 конфета или 1 съеденный кусочек копченой колбасы в день не спровоцирует обострение панкреатита, поэтому больным крайне важно умеренно питаться и не переедать (особенно перед сном).
- Выполнение плановых УЗИ во время беременности. Беременным женщинам рекомендуется выполнять минимум три УЗИ в период вынашивания плода. Первое из них проводится в период от 10 до 14 недели беременности. К этому времени происходит закладка всех органов и тканей плода, что позволяет выявить грубые аномалии развития. Второе УЗИ выполняется на 18 – 22 неделе беременности. Оно также позволяет выявить различные аномалии развития и при необходимости поднять вопрос о прерывании беременности. Третье исследование выполняется на 30 – 34 неделе с целью выявления аномалий развития или положения плода. Прерывание беременности на таком сроке невозможно, однако врачи могут выявить ту или иную патологию и начать ее лечение сразу после рождения ребенка, что значительно повысит его шансы на выживание.
источник