Плеврит – различные в этиологическом отношении воспалительные поражения серозной оболочки, окружающей легкие. Плеврит сопровождается болями в грудной клетке, одышкой, кашлем, слабостью, повышением температуры, аускультативными феноменами (шумом трения плевры, ослаблением дыхания). Диагностика плеврита осуществляется с помощью рентгенографии (-скопии) грудной клетки, УЗИ плевральной полости, плевральной пункции, диагностической торакоскопии. Лечение может включать консервативную терапию (антибиотики, НПВС, ЛФК, физиотерапию), проведение серии лечебных пункций или дренирования плевральной полости, хирургическую тактику (плевродез, плеврэктомию).
Плеврит – воспаление висцерального (легочного) и париетального (пристеночного) листков плевры. Плеврит может сопровождаться накоплением выпота в плевральной полости (экссудативный плеврит) или же протекать с образованием на поверхности воспаленных плевральных листков фибринозных наложений (фибринозный или сухой плеврит). Диагноз «плеврит» ставится 5-10% всех больных, находящихся на лечении в терапевтических стационарах. Плевриты могут отягощать течение различных заболеваний в пульмонологии, фтизиатрии, кардиологии, ревматологии, онкологии. Статистически чаще плеврит диагностируется у мужчин среднего и пожилого возраста.
Зачастую плеврит не является самостоятельной патологией, а сопровождает ряд заболеваний легких и других органов. По причинам возникновения плевриты делятся на инфекционные и неинфекционные (асептические).
Причинами плевритов инфекционной этиологии служат:
- бактериальные инфекции (стафилококк, пневмококк, грамотрицательная флора и др.);
- грибковые инфекции (кандидоз, бластомикоз, кокцидиоидоз);
- вирусные, паразитарные (амебиаз, эхинококкоз), микоплазменные инфекции;
- туберкулезная инфекция (выявляется у 20% пациентов с плевритом);
- сифилис, сыпной и брюшной тифы, бруцеллез, туляремия;
- хирургические вмешательства и травмы грудной клетки;
Плевриты неинфекционной этиологии вызывают:
Механизм развития плевритов различной этиологии имеет свою специфику. Возбудители инфекционных плевритов непосредственно воздействуют на плевральную полость, проникая в нее различными путями. Контактный, лимфогенный или гематогенный пути проникновения возможны из субплеврально расположенных источников инфекции (при абсцессе, пневмонии, бронхоэктатической болезни, нагноившейся кисте, туберкулезе). Прямое попадание микроорганизмов в плевральную полость происходит при нарушении целостности грудной клетки (при ранениях, травмах, оперативных вмешательствах).
Плевриты могут развиваться в результате повышения проницаемости лимфатических и кровеносных сосудов при системных васкулитах, опухолевых процессах, остром панкреатите; нарушения оттока лимфы; снижения общей и местной реактивности организма.
Незначительное количество экссудата может обратно всасываться плеврой, оставляя на ее поверхности фибриновый слой. Так происходит формирование сухого (фибринозного) плеврита. Если образование и накопление выпота в плевральной полости превышает скорость и возможность его оттока, то развивается экссудативный плеврит.
Острая фаза плевритов характеризуется воспалительным отеком и клеточной инфильтрацией листков плевры, скоплением экссудата в плевральной полости. При рассасывании жидкой части экссудата на поверхности плевры могут образовываться шварты — фибринозные плевральные наложения, ведущие к частичному или полному плевросклерозу (облитерации плевральной полости).
Наиболее часто в клинической практике используется классификация плевритов, предложенная в 1984 г. профессором СПбГМУ Н.В. Путовым.
- инфекционные (по инфекционному возбудителю – пневмококковый, стафилококковый, туберкулезный и др. плевриты)
- неинфекционные (с обозначением заболевания, приводящего к развитию плеврита – рак легкого, ревматизм и т. д.)
- идиопатические (неясной этиологии)
По наличию и характеру экссудата:
- экссудативные (плевриты с серозным, серозно-фибринозным, гнойным, гнилостным, геморрагическим, холестериновым, эозинофильным, хилезным, смешанным выпотом)
- фибринозные (сухие)
- диффузные
- осумкованные или ограниченные (пристеночный, верхушечный, диафрагмальный, костодиафрагмальный, междолевой, парамедиастинальный).
Как правило, являясь вторичным процессом, осложнением или синдромом других заболеваний, симптомы плеврита могу превалировать, маскируя основную патологию. Клиника сухого плеврита характеризуется колющими болями в грудной клетке, усиливающимися при кашле, дыхании и движении. Пациент вынужден принимать положение, лежа на больном боку, для ограничения подвижности грудной клетки. Дыхание поверхностное, щадящее, пораженная половина грудной клетки заметно отстает при дыхательных движениях. Характерным симптомом сухого плеврита является выслушиваемый при аускультации шум трения плевры, ослабленное дыхание в зоне фибринозных плевральных наложений. Температура тела иногда повышается до субфебрильных значений, течение плеврита может сопровождаться ознобами, ночным потом, слабостью.
Диафрагмальные сухие плевриты имеют специфическую клинику: боли в подреберье, грудной клетке и брюшной полости, метеоризм, икота, напряжение мышц брюшного пресса.
Развитие фибринозного плеврита зависит от основного заболевания. У ряда пациентов проявления сухого плеврита проходят спустя 2-3 недели, однако, возможны рецидивы. При туберкулезе течение плеврита длительное, нередко сопровождающееся выпотеванием экссудата в плевральную полость.
Начало плевральной экссудации сопровождает тупая боль в пораженном боку, рефлекторно возникающий мучительный сухой кашель, отставание соответствующей половины грудной клетки в дыхании, шум трения плевры. По мере скапливания экссудата боль сменяется ощущением тяжести в боку, нарастающей одышкой, умеренным цианозом, сглаживанием межреберных промежутков. Для экссудативного плеврита характерна общая симптоматика: слабость, фебрильная температура тела (при эмпиеме плевры – с ознобами), потеря аппетита, потливость. При осумкованном парамедиастинальном плеврите наблюдается дисфагия, осиплость голоса, отеки лица и шеи. При серозном плеврите, вызванном бронхогенной формой рака, нередко наблюдается кровохарканье. Плевриты, вызванные системной красной волчанкой, часто сочетаются с перикардитами, поражениями почек и суставов. Метастатические плевриты характеризуются медленным накоплением экссудата и протекают малосимптомно.
Большое количество экссудата ведет к смещению средостения в противоположную сторону, нарушениям со стороны внешнего дыхания и сердечно-сосудистой системы (значительному уменьшению глубины дыхания, его учащению, развитию компенсаторной тахикардии, снижению АД).
Исход плеврита во многом зависит от его этиологии. В случаях упорного течения плеврита в дальнейшем не исключено развитие спаечного процесса в полости плевры, заращение междолевых щелей и плевральных полостей, образование массивных шварт, утолщение плевральных листков, развитие плевросклероза и дыхательной недостаточности, ограничение подвижности купола диафрагмы.
Наряду с клиническими проявлениями экссудативного плеврита при осмотре пациента выявляется асимметрия грудной клетки, выбухание межреберных промежутков на соответствующей половине грудной клетки, отставание пораженной стороны при дыхании. Перкуторный звук над экссудатом притуплен, бронхофония и голосовое дрожание ослаблены, дыхание слабое или не выслушивается. Верхняя граница выпота определяется перкуторно, при рентгенографии легких или при помощи УЗИ плевральной полости.
При проведении плевральной пункции получают жидкость, характер и объем которой зависит от причины плеврита. Цитологическое и бактериологическое исследование плеврального экссудата позволяет выяснить этиологию плеврита. Плевральный выпот характеризуется относительной плотностью выше 1018-1020, многообразием клеточных элементов, положительной реакцией Ривольта.
В крови определяются повышение СОЭ, нейтрофильный лейкоцитоз, увеличение значений серомукоидов, сиаловых кислот, фибрина. Для уточнения причины плеврита проводится торакоскопия с биопсией плевры.
Лечебные мероприятия при плеврите направлены на устранение этиологического фактора и облегчение симптоматики. При плевритах, вызванных пневмонией, назначается антибиотикотерапия. Ревматические плевриты лечатся нестероидными противовоспалительными препаратами, глюкокортикостероидами. При туберкулезных плевритах лечение проводится фтизиатром и заключается в специфической терапии рифампицином, изониазидом и стрептомицином на протяжении нескольких месяцев.
С симптоматической целью показано назначение анальгетиков, мочегонных, сердечно-сосудистых средств, после рассасывания выпота — физиотерапии и лечебной физкультуры.
При экссудативном плеврите с большим количеством выпота прибегают к его эвакуации путем проведения плевральной пункции (торакоцентеза) или дренирования. Одномоментно рекомендуется эвакуировать не более 1-1,5 л экссудата во избежание сердечно-сосудистых осложнений (вследствие резкого расправления легкого и обратного смещения средостения). При гнойных плевритах проводится промывание плевральной полости антисептическими растворами. По показаниям внутриплеврально вводятся антибиотики, ферменты, гидрокортизон и т. д.
В лечении сухого плеврита помимо этиологического лечения пациентам показан покой. Для облегчения болевого синдрома назначаются горчичники, банки, согревающие компрессы и тугое бинтование грудной клетки. С целью подавления кашля назначают прием кодеина, этилморфина гидрохлорида. В лечении сухого плеврита эффективны противовоспалительные средства: ацетилсалициловая кислота, ибупрофен и др. После нормализации самочувствия и показателей крови пациенту с сухим плевритом назначают дыхательную гимнастику для профилактики сращений в полости плевры.
С целью лечения рецидивирующих экссудативных плевритов проводят плевродез (введение в плевральную полость талька или химиопрепаратов для склеивания листков плевры). Для лечения хронического гнойного плеврита прибегают к хирургическому вмешательству – плеврэктомии с декорткацией легкого. При развитии плеврита в результате неоперабельного поражения плевры или легкого злокачественной опухолью по показаниям проводят паллиативную плеврэктомию.
Малое количество экссудата может рассасываться самостоятельно. Прекращение экссудации после устранения основного заболевания происходит в течение 2-4 недель. После эвакуации жидкости (в случае инфекционных плевритов, в т. ч. туберкулезной этиологии) возможно упорное течение с повторным скоплением выпота в полости плевры. Плевриты, вызванные онкологическими причинами, имеют прогрессирующее течение и неблагоприятный исход. Неблагоприятным течением отличается гнойный плеврит.
Пациенты, перенесшие плеврит, находятся на диспансерном наблюдении на протяжении 2-3 лет. Рекомендуется исключение профессиональных вредностей, витаминизированное и высококалорийное питание, исключение простудного фактора и переохлаждений.
В профилактике плевритов ведущая роль принадлежит предупреждению и лечению основных заболеваний, приводящих к их развитию: острой пневмонии, туберкулеза, ревматизма, а также повышению сопротивляемости организма по отношению к различным инфекциям.
источник
Асцит – это накопление жидкости в брюшной полости, вызванное, как правило, циррозом печени, но также может быть симптомом других заболеваний.
Рассмотрим виды и причины накопления жидкости в брюшной полости и мы проанализируем симптомы и типичные признаки.
Асцит – это медицинский термин, используемый в гастроэнтерологии для обозначения патологическогонакопление жидкости в брюшной полости.
Функцией жидкостей в брюшной полости является обеспечения свободного скольжения мембран брюшины и внутренних органов. В нормальных условиях в брюшной полости находится от 10 до 30 миллилитров жидкости, а в некоторых случаях тяжелого асцита может скопиться свыше 10 литров.
Накопление жидкости происходит двумя путями:
- Экссудация, то есть образование экссудата – жидкости, которая исходит из кровеносных сосудов, ввиду увеличения их проницаемости при местном воспалительном процессе. Воспаление, как известно, связано с образование целого ряда химических медиаторов, включая гистамин. Их задача – повысить проницаемость тканей для того, чтобы клеткам иммунной системы было проще достигать места воспаления. Увеличение проницаемости приводит к тому, что стенки кровеносных сосудов начинают пропускать сыворотку крови. Отсюда появляется асцитическая жидкость, которая в таких условиях богата белками, а также клетками крови (в частности, альбумин и лейкоциты).
- Транссудация, то есть образование транссудата, который также имеет сосудистое происхождение, но выделяется без воспаления, а вследствие увеличения гидростатического давления внутри сосуда. Асцитическая жидкость, образованная таким образом, бедна на белки и клетки крови, и, следовательно, имеет более низкий удельный вес.
Разницу между концентрацией альбумина в асцитической жидкости используют для оценки формы происхождения. Этот параметр обозначается как SAAG. Если значение SAAG ниже 1 мг/дл, то это экссудат, и, наоборот, если SAAG больше 1 мг/дл – это транссудат.
Общепринято классифицировать асцит в зависимости от его тяжести, т.е. в зависимости от объема жидкости, накопленной в брюшной полости.
Симптомы, которыми проявляется асцит, конечно, сильно зависят от тяжести состояния. Если асцит легкой степени заболевания, то не проявляется никаких симптомов, его трудно выявить даже с помощью инструментальных обследований, помогает только УЗИ или КТ брюшной полости.
Если асцит является серьезным, сопровождается следующими симптомами:
- Вздутие и тяжесть живота.
- Вздутие, разбухание и увеличение объема живота.
- Проблемы с дыханием из-за давления содержимого брюшного полости на диафрагму. Сдавливание приводит к диспноэ (одышка, короткое и быстрое дыхание).
- Боли в животе.
- Плоский пупок.
- Отсутствие аппетита и мгновенное ощущение сытости.
- Опухшие лодыжки (отёк) из-за избытка жидкости.
- Другие типичные симптомы заболевания, такие как портальная гипертензия (сопротивление прохождению потока крови) при отсутствии цирроза печени.
Если накопление жидкости в брюшной полости не превышает минимальный порог, что составляет около полулитра, то говорят о легком асците, который можно обнаружить только с помощью УЗИ брюшной полости. В случае объемов, превышающих указанный, диагностика возможна без дополнительных исследований.
Специалист, к которому вам следует обратиться, – это гастроэнтеролог. Он сформулирует диагноз и займётся поиском болезни, которая привела к накоплению жидкости в брюшной полости, воспользовавшись:
Анамнезом – история болезни пациента и семьи, информация о перенесённых заболеваниях, применяемой терапии, образе жизни, например, злоупотребление алкоголем, и др.
Анализом симптомов: асцит характеризуется рядом «безошибочных» признаков:
- Лягушачий живот. Его видно, когда пациент лежит на боку. В этом положении жидкость в брюшной полости стекает к одному боку и живот приобретает форму, похожий на лягушку или жабу.
- Тупой звук – характерный для бочки, заполненной жидкостью.
- Барабанный звук – типичный для пустой бочки или полости, содержащей газ.
- Звук всплеска – если ударить ладонью, а с другой стороны приложить ладонь.
Сформулированная гипотеза будет подтверждена серией клинических исследований:
Анализ крови, направленный на оценку:
- функций печени – ферменты (трансаминазы) и белки (альбумин, факторы свертываемости крови);
- функции почек – креатинин, азотемия;
Общий анализ крови – количество корпускулярных клеток в крови.
Концентрация электролитов – натрий, калий, хлор, которые влияют на задержку жидкости.
Исследование проколом. Заключается во введении через брюшную стенку тонкой иглы для получения образца жидкости и её анализа.
В частности, выполняют следующие анализы:
- Поиск и оценка концентрации альбумина.
- Посев культуры с целью обнаружения возможных инфекций и их возбудителей.
- Цитологический анализ для выявления возможных новообразований.
- Поиска и подсчет клеток крови, таких как лейкоциты.
- Поиск амилазы. Наличие амилазы, фермента, ускоряющего реакции распада сложных сахаров, является признаком повреждения поджелудочной железы и, следовательно, панкреатита.
Болезнью, которая наиболее часто приводит к асциту, является цирроз печени, на самом деле, более 70% пациентов с проблемами скопления жидкости в брюшной полости страдают от осложнений цирроза, и половина больных циррозом сталкивается с асцитом.
Однако, асцит также может иметь множество других причин, и все очень серьёзные, например: опухоли брюшной полости, сердечная недостаточность, и др.
В следующей таблице мы собрали основные причины (патологии, которые вызывают проблему), дали краткое описание и основные симптомы, которые сопровождают асцит.
Причины, которые определяют накопление жидкости в брюшной полости вследствие транссудации:
Цирроз печени. Нарушение физиологической структуры тканей печени, которая заменяется на фиброзную ткань, и происходит постепенная утрата функций органа. Причин этого процесса несколько – наиболее распространенными являются: вирусный гепатит и хронический алкоголизм.
- Асцит
- Портальная гипертензия
- Желтуха
- Низкий уровень тромбоцитов и проблемы свертывания крови (синяки, петехии, кровоточивость)
- Отёк (накопление жидкости) нижних конечностей
- Проблемы кожи
- Аномальное развитие молочных желез у мужчины
Синдром Бадда-Киари. Окклюзия вен, которые отводят бедную кислородом кровь из печени. Причины заболевания многочисленны и не всегда их удаётся идентифицировать (остаются незамеченными у половины пациентов).
- Асцит
- Боли в нижней части живота
- Увеличение печени
- Повышенные уровни ферментов печени, особенно трансаминаз
- Энцефалопатия. Синдром характеризуется нарушениями в работе мозга, такими как потеря познавательных способностей, изменения личности, сонливость, и др.
Сердечная недостаточность. Неспособность сердца обеспечить дальность прохождения крови, необходимую организму для нормального выполнения своих функций. Наиболее распространенной причиной сердечной недостаточности является состояние после инфаркта миокарда.
- Асцит
- Хронический кашель
- Затрудненное дыхание и одышка
- Усталость
- Отек нижних конечностей
- Выпот в плевральной полости
- Отёк легких
Перикардит. Хронического воспаления на перикард (оболочки сердца), что мешает расслаблению желудочков.
- Асцит
- Хронический кашель
- Затрудненное дыхание и одышка
- Усталость
- Отёк нижних конечностей
- Выпот в плевральной полости
- Отёк легких
Детский маразм или синдром Квашиоркора: Развивается из-за недополучения белка. В развитых странах практически не встречается, но довольно распространен в Африке.
- Асцит
- Увеличение печени
- Проблемы иммунной системы (невозможность развития некоторых типов антител)
- Задержка в психическом развитии
Причины, которые определяют накопление жидкости в брюшной полости ввиду экссудации:
Рак органов брюшной полости: злокачественные опухоли и метастазы. В этом случае говорят о неопластическом асците.
Туберкулез кишечника: кишечные инфекция от микобактерии Коха.
Хронический панкреатит: хроническое воспаление поджелудочной железы, которое может иметь различные причины.
- Асцит
- Боль в животе
- Желтуха
- Чередующиеся диарея и запоры.
- Чрезмерные уровни азотистых веществ в фекалиях.
Серозит и, в частности, перитонит. Серозное воспаление тканей брюшины, которое может быть спровоцировано многими аутоиммунными заболеваниями, такими как системная красная волчанка, ревматоидный артрит, болезнь Крона и др.
Гипотиреоз: слабое функционирование щитовидной железы с замедлением обмена веществ.
- Асцит
- Плевральный выпот
- Усталость
- Увеличение веса
- Ощущение постоянного холода (холодные руки и ноги)
- Брадикардия. Снижение частоты сердечных сокращений
- Отек конечностей
- Охриплость
- Проблемы с концентрацией внимания и потеря памяти
Так как асцит – это симптом, лечение предполагает терапию в направлении основного заболевания. Так, например, если асцит является следствием цирроза, то требуется пересадка печени, если же имеет место опухолевый асцит, необходимо провести хирургическое удаление опухоли и восстановительное лечение.
Однако, очень часто необходимо лечить симптом, тогда поступают следующим образом:
- Постельный режим.
- Диета с низким содержанием соли и, следовательно, с низким содержанием натрия. Это увеличивает диурез и, следовательно, способствует ликвидации жидкости, скопившейся в брюшине.
- Приём диуретиков. Наиболее часто используется спиронолактон.
- Терапевтический парацентез. Заключается в удалении с помощью иглы асцитической жидкости, скопившейся в брюшной полости. Используется в случае сильного напряжения в животе, больших объемов жидкости или нечувствительности пациента к действию мочегонных средств.
источник
Плевральный выпот — это накопление жидкости в плевральной полости. Причины выпотов могут быть весьма разнообразны, поэтому они обычно классифицируются как транссудаты или экссудаты. Выявляются при физикальном обследовании и рентгенографии органов грудной клетки; пункция плевральной полости с последующим исследованием плевральной жидкости часто позволяет определить причину выпота. Бессимптомные транссудаты не требуют лечения. Напротив, транссудаты, сопровождающиеся клинической симптоматикой, и почти все экссудаты требуют выполнения пункции плевральной полости, ее дренирования, плевродеза и/или плеврэктомии.
В норме между висцеральной и париетальной плеврой тонко распределены от 10 до 20 мл плевральной жидкости, похожей по составу на плазму крови, но с более низким содержанием белка ( 3 клеток/мл), не требующий проведения специальных процедур и назначения лечения, разрешение наступает по мере регрессии пневмонии.
Развитие осложненного парапневмонического выпота (также нейтрофильный экссудат) связывают с проникновением инфекционных агентов в плевральную полость. Бактерии вызывают перестройку метаболизма глюкозы на анаэробный путь, при этом происходит снижение концентрации глюкозы и развитие ацидоза плевральной жидкости, а в результате лизиса лейкоцитов определяют повышение активности ЛДГ выпота. Клиренс бактерий из плевральной полости осуществляется достаточно быстро, пациентам назначают антибактериальное лечение, поэтому осложненный парапневмонический выпот, как правило, стерильный. Персистирующее воспаление обусловливает отложение фибрина на висцеральных и париетальных листках плевры и приводит к развитию спаечного процесса и осумкования выпота.
Эмпиему плевры определяют как наличие гноя в плевральной полости. Данная стадия парапневмонического выпота характеризуется большим количеством бактерий (обнаруживают при окрашивании по Граму) и лейкоцитов (более 25х10 3 /мл, их присутствие обусловливает макроскопическую картину гнойного выпота). При образовании гнойного выпота практически всегда происходит формирование фибриновых сгустков и мембран на плевральных листках, а также осумкование выпота, кроме того, на поздних этапах (2-3 нед) отмечают миграцию фибробластов в фибриновые наложения, это приводит к организации плевральной полости. При развитии эмпиемы обязательно выполняют дренирование плевральной полости и, нередко, хирургическую декортикацию плевры.
Возникновение осложненных плевральных выпотов и эмпиемы чаще всего обусловлено наличием таких фоновых заболеваний, как сахарный диабет, алкоголизм, ХОБЛ, бронхоэктатическая болезнь, ревматоидный артрит. У мужчин данные формы плеврита диагностируют примерно в два раза чаще.
Микробиология парапневмонических выпотов отражает спектр причинных факторов пневмоний. Как показали исследования, в последние годы произошли значительные изменения свойств микроорганизмов, вызывающих парапневмонический плеврит (данный факт связывают с использованием антимикробных препаратов для лечения пневмоний). В настоящее время основной причиной развития осложненных парапневмонических выпотов считают проникновение в плевральную полость грамположительных (Streptococcus pneumoniae, Streptococcus pyogenes, Staphylococcus aureus) и грамотрицательных (Escherichia coli, Haemophilus influenzae, Klebsiella spp., Pseudomonas spp.) аэробных бактерий. Анаэробные микроорганизмы (как правило, вместе с аэробными бактериями) приводят к формированию 36-76% всех эмпием, однако примерно 15% парапневмонических выпотов возникают исключительно вследствие анаэробных инфекций Prevotella spp, Fusobacterium nucleatum, Streptococcus intermedius, Bacteroides spp — анаэробные микроорганизмы, наиболее часто приводящие к формированию осложненных парапневмонических выпотов.
Плевральный выпот небольшого объема обнаруживают у 40% пациентов, поступивших в стационар по поводу ТЭЛА. Среди них 80% выпотов — экссудаты, 20% — транссудаты, как правило, в плевральной жидкости присутствует примесь крови (в 80% случаев). При обнаружении большого количества эритроцитов в плевральной жидкости (более 100 000 клеток/мм 3 ) необходимо исключить злокачественное новообразование, инфаркт легкого или травму. Меньшее количество эритроцитов не имеет диагностического значения. Выпоты, вызванные ТЭЛА, не имеют специфических черт. Поэтому диагноз устанавливают на основании клинических данных, позволяющих заподозрить ТЭЛА с высокой вероятностью.
Кислотоустойчивые палочки в мазках обнаруживают только у 10-20% пациентов с туберкулёзным плевритом, причём посев плевральной жидкости позволяет определить микобактерии туберкулеза только в 25-50% случаев. Выполнение гистологического исследования и посева биоптата плевры улучшает диагностику туберкулеза до 90%. При туберкулезе, в отличие от экссудатов другой этиологии, в плевральной жидкости происходит повышение активности аденозиндезаминазы. Однако увеличение данного показателя регистрируют также при эмпиеме, ревматоидном плеврите и злокачественных заболеваниях, что приводит к снижению диагностической ценности анализа аденозиндезаминазы в странах с низкой заболеваемостью туберкулезом. Увеличения активности аденозиндезаминазы не происходит у пациентов с ВИЧ-инфекцией, страдающих туберкулезом.
Плевральный выпот диагностируют у 7-27% больных ВИЧ-инфекцией, госпитализированных в стационар Саркомы Капоши, парапневмонические выпоты и туберкулез — основные причины поражения плевры у таких пациентов. В проспективном исследовании принимали участие 58 человек, страдающих ВИЧ-инфекцией. У всех испытуемых обнаружили рентгенологические признаки плеврального выпота. Как показало исследование, причиной плеврального выпота у трети пациентов служила саркома Капоши, у 28% больных — парапневмонический выпот, а туберкулёз и пневмония, вызванная Pneumocystis jiroveci, — у 14% и 10% соответственно. Лимфому диагностировали у 7% пациентов, принимавших участие в исследовании.
Истинный хилоидный выпот возникает в результате разрыва грудного протока или его ветвей, что ведет к попаданию лимфы в плевральную полость. Примерно в 50% таких случаев у пациентов обнаруживают злокачественные новообразования (в основном лимфомы). Наличие травмы (особенно при хирургических вмешательствах) также обусловливает формирование истинного хилоидного выпота (25% случаев). Иногда причиной данного состояния служат такие заболевания, как туберкулёз, саркоидоз или амилоидоз.
Хилоторакс следует отличать от псевдохилоторакса, или «холестеринового плеврита», который образуется в результате скопления кристаллов холестерина в длительно существующем плевральном выпоте. При этом, как правило, обнаруживают значительное утолщение плевры и её фиброз. Основными причинами псевдохилоторакса считают туберкулёз и ревматоидный артрит. Диагноз хилоторакса и псевдохилоторакса устанавливают на основании анализа содержания липидов в плевральной жидкости.
В редких случаях при эмпиеме наблюдают выпот молочного цвета, похожий на хилоторакс. Эти состояния различают при центрифугировании. После него при эмпиеме плевры образуется прозрачный супернатант, а клеточная масса оседает. Хилезная жидкость после центрифугирования сохраняет молочный вид.

Диагностические исследования назначаются с целью документирования наличия плевральной жидкости и определения ее причины.
Рентгенография органов грудной клетки — первое исследование, выполняемое для подтверждения наличия плевральной жидкости. При подозрении на наличие плеврального выпота должна быть выполнена рентгенография органов грудной клетки в боковой проекции, в вертикальном положении пациента. В данном случае 75 мл жидкости локализуется в заднем реберно-диафрагмальном углу. Большие плевральные выпоты визуализируются как затемнения части грудной клетки; выпоты объемом более 4 л могут вызвать полное затемнение и даже смещение средостения.
Локализованные (осумкованные) выпоты — накопление жидкости, расположенной между плевральными спайками или в пределах междолевой щели. При неясности природы затемнения, а также определения того, является ли подозреваемый выпот осумкованным или свободным, должна быть выполнена рентгенография органов грудной клетки в боковой проекции, в положении лежа, КТ органов грудной клетки или ультразвуковое ее исследование. Данные исследования более чувствительны, чем рентгенография в вертикальном положении больного, и способны обнаружить жидкости объемом менее 10 мл. Осумкованная жидкость, особенно в горизонтальной или косой междолевой щели, может быть ошибочно принята за солидное образование легкого (ложную опухоль). Данное образование может изменять форму и размеры при изменении положения пациента и количества плеврального выпота.
КТ обычно не проводится, но имеет значение для оценки прилежащих отделов паренхимы легкого на предмет наличия инфильтратов или опухолей, когда легкое затемнено выпотом, и при дифференциальной диагностике осумкованного скопления жидкости и солидных образований.
Пункция плевральной полости должна быть выполнена почти у всех пациентов, объем впервые возникшего и имеющего неясную этиологию плеврального выпота у которых составляет более 10 мм в толщину на боковом рентгеновском снимке в положении лежа или при ультразвуковом исследовании. Несмотря на распространенную практику, рентгенография грудной клетки не должна повторяться после данной процедуры, за исключением случаев развития у пациента симптомов, позволяющих заподозрить пневмоторакс (одышка или боли в грудной клетке), либо возможного попадания воздуха в плевральную полость во время процедуры. Пункции плевральной полости и последующего исследования плеврального выпота часто не требуется и при хронических плевральных выпотах, имеющих известную причину и не вызывающих клинических проявлений.
Ультрасонография полезна для определения локализации плевральной жидкости перед пункцией, когда слепой плевроцентез оказался неудачен.
Исследование плевральной жидкости выполняется с целью диагностики причины плеврального выпота. Оно начинается с визуального осмотра, который позволяет дифференцировать геморрагический и хилезный (или хилоподобный) от других выпотов; можно также идентифицировать гнойные выпоты, свидетельствующие о наличии эмпиемы плевры, и вязкую жидкость, характерную для некоторых мезотелиом. Во всех случаях необходимо выполнение исследования на общее содержание белка, лактатдегидрогеназы, подсчета общего количества клеток и их состава, микроскопии после окрашивания по Граму и посева на аэробные и анаэробные питательные среды. Другие исследования (концентрация глюкозы, цитологическое, маркеров туберкулеза в жидкости (аденозиновой дезаминазы или интерферона гамма), амилазы, микобактерий и микроскопии после окрашивания на наличие грибов и выделения их культуры) используются в соответствующих клинических ситуациях.
Исследование химического состава жидкости позволяет дифференцировать транссудаты от экссудатов; существует много критериев, ни один из которых не является универсальным. При использовании критериев Лайта забор крови для определения концентраций ЛДГ и общего белка в ее сыворотке с целью сравнения с аналогичными показателями плевральной жидкости должен быть произведен как можно ближе ко времени плевроцентеза. Критерии Лайта правильно идентифицируют почти все экссудаты, но ложно определяют приблизительно 20 % транссудатов как экссудаты. Если подозревается наличие транссудата (например, при сердечной недостаточности или циррозе печени) и ни один из биохимических параметров не превышает более чем на 15 % пороговых значений критериев Лайта, то исследуются различие концентрации общего белка в сыворотке крови и плевральной жидкости. Если различие составляет более 3,1 г/дл, то, вероятно, речь идет о транссудате.
Если диагноз остается неясным и после того, как выполнено исследование плевральной жидкости, выполняется спиральная КТ, задачей которой является выявление эмболов в легочной артерии, инфильтратов легких или поражения средостения. Обнаружение эмбола в легочной артерии указывает на необходимость длительной антикоагулянтной терапии; паренхиматозный инфильтрат требует выполнения бронхоскопии, объемные образования средостения — трансторакальной аспирационной биопсии или медиастиноскопии. Однако для проведения спиральной КТ необходимо задержать дыхание на более чем 24 с, на что способны не все пациенты. Если спиральная КТ не информативна, наилучший вариант дальнейшего обследования — наблюдение, за исключением ситуации, когда в анамнезе пациента имеются злокачественные новообразования, снижение массы тела, постоянное повышение температуры тела или другие изменения, заставляющие заподозрить злокачественный процесс или туберкулез; в последней ситуации возможно выполнение торакоскопии. Пункционная биопсия плевры может быть выполнена при невозможности выполнения торакоскопии. При неинформативности торакоскопии в некоторых случаях должна выполняться торакотомия. Большинству пациентов с экссудативным выпотом также должна быть выполнена туберкулиновая проба с контролем.

Проводится лечение основного заболевания; собственно выпот не требует лечения, если является бессимптомным, так как многие из них разрешаются спонтанно, особенно возникшие вследствие неосложненных пневмоний, тромбоэмболии легочной артерии и хирургических вмешательств. Плевритическая боль обычно купируется приемом пероральных анальгетиков, лишь в некоторых случаях требуется проведение короткого курса пероральных опиоидов.
Пункция плевральной полости с эвакуацией экссудата — достаточное лечение для многих симптоматических выпотов и может выполняться повторно при повторном накоплении жидкости. Удаление более 1,5 л плевральной жидкости одновременно недопустимо, поскольку это может привести к отеку легких вследствие быстрого расширения альвеол, ранее сдавленных жидкостью.
Хронические рецидивирующие выпоты, сопровождающиеся клинической симптоматикой, могут лечиться путем периодических плевральных пункций или установкой постоянного дренажа плевральной полости. Выпоты, вызванные пневмонией и злокачественными новообразованиями, могут требовать проведения дополнительного специального лечения.
Транссудаты обычно не требуют механического удаления жидкости из плевральной полсти, за исключением случаев массивных плевральных выпотов, вызывающих выраженную одышку. Как правило, главным методом терапии транссудатов считают лечение основного заболевания, например улучшение сократимости миокарда и коррекцию водного обмена при застойной сердечной недостаточности. Назначение диуретиков и раствора альбумина оказывает достаточно хороший эффект при лечении больных с транссудатами на фоне гипопротеинемии. Коррекцию тяжёлой гипопротеинемии необходимо осуществлять постепенно, чтобы предупредить быстрое увеличение объема внутрисосудистой жидкости. Предпочтительнее производить длительные инфузии фуросемида (одновременно корректируя потерю калия и магния), а не вводить его болюсно. При тяжелых гипопротеинемических состояниях рекомендуют использовать спиронолактон Особую проблему представляет ведение пациентов с парапневмоническим плевральным выпотом и эмпиемой плевры.
Способ лечения парапневмонического плеврального выпота прежде всего зависит от его стадии и риска неблагоприятного исхода. В 2000 году на собрании American College of Chest Physicians предложили классификацию ABC парапневмонических плевральных выпотов, разработанную с учётом анатомических характеристик плеврального выпота (А), бактериологии плевральной жидкости (В) и данных биохимического анализа плевральной жидкости (С). На основании данной классификации в группе парапневмонических выпотов выделяют четыре прогностические категории, определяющие показания к установлению дренажной трубки (необходимо больным, составляющим группу III и IV категории риска).
При неосложнённом парапневмоническом плевральном выпоте осуществляют наблюдение за пациентом и назначают ему антимикробную терапию. Для лечения пациентов с внебольничной пневмонией рекомендуют использовать цефалоспорины второго или третьего поколения или ингибитор-защищенные пенициллины.
При подозрении на контаминацию анаэробной флорой назначают комбинированную терапию с метронидазолом или клиндамицином, ингибитор-защищённые пенициллины или карбапенемы. К антибиотикам, хорошо проникающим в плевральную полость, относят пенициллины, метронидазол, цефтриаксон, клиндамицин, ванкомицин. Аминогликозиды практически не проникают в полость плевры. Доказательства эффективности прямых инстилляций антибактериальных препаратов в плевральную полость на сегодняшний день отсутствуют.
Схемы назначения антибактериальных лекарственных средств, используемых для стартовой терапии плевральных выпотов с отрицательной культурой, обнаруженной в плевральной жидкости
Цефуроксим в дозе 1,5 г (3 раза в сутки внутривенно) в сочетании с 400 мг метронидазола (3 раза в сутки внутрь) или с 500 мг метронидазола (3 раза в сутки внутривенно)
Амоксициллин/клавуланат в дозе 825/125 мг (3 раза в сутки)
Амоксициллин/клавуланат в дозе 1,2 г (3 раза в сутки внутривенно) в сочетании с 400 мг ципрофлоксацина (2 раза в сутки внутривенно)
Амоксициллин в дозе 1 г (3 раза в сутки) в сочетании с 400 мг метронидазола (3 раза в сутки)
Меропенем в дозе 1 г (3 раза в сутки внутривенно) в сочетании с 400 мг метронидазола (3 раза в сутки внутрь) или с 500 мг метронидазола (3 раза в сутки внутривенно)
Клиндамицин в дозе 300 мг (4 раза в сутки)
Пиперациллин/тазобактам в дозе 4,5 г (3 раза в сутки внутривенно)
Цефтазидим в дозе 2 г (3 раза в сутки внутривенно)
Меропенем в дозе 1 г (3 раза в сутки внутривенно) иногда сочетают с 400 мг метронидазола (3 раза в сутки внутрь) или с 500 мг метронидазола (3 раза в сутки внутривенно)
При осложненном плевральном выпоте устанавливают дренажную трубку или выполняют торакоцентез (как повторные пункции). При эмпиеме методом выбора считают дренирование плевральной полости. Дренажную трубку, как правило, устанавливают под контролем рентгеноскопического исследования, УЗИ или КТ. При наличии нескольких осумкованных полостей применяют несколько дренажных трубок. Предпочтительнее использовать трубки большого диаметра (24-36 Р), особенно при наличии в плевральной полости вязкого экссудата. Обычно при проведении манипуляции устанавливают отрицательное давление (10-20 см. вод. ст.). При правильном расположении трубки происходит быстрая эвакуация жидкости и расправление лёгкого. При уменьшении плеврального отделяемого (до 50 мл в сутки) дренажную трубку удаляют.
При наличии спаечного процесса в плевральной полости или при обнаружении осумкованных полостей адекватного дренирования плевральной полости удаётся достичь введением в неё фибринолитиков, растворяющих фибриновые сгустки и мембраны. Чаще всего используют стрептокиназу (в дозе 250 000 ед) или урокиназу (в дозе 100 000 ед), препараты вводят в 100 мл физиологического раствора и перекрывают дренажную трубку на 2-4 ч, затем производят удаление плевральной жидкости. В зависимости от клинического ответа инстилляции фибринолитиков повторяют в течение 3-14 дней. Интраплевральное введение фибринолитиков не вызывает системного фибринолиза. Эффективность применения фибролитических лекарственных средств при лечении осумкованных плевральных выпотов составляет 70-90%.
Противопоказания к использованию фибринолитических препаратов
- Абсолютные противопоказания
- Предшествующие аллергические реакции
- Наличие бронхоплевральной фистулы
- Травма или операция (в течение предыдущих двух суток)
- Относительные противопоказания
- Большие оперативные вмешательства, выполненные в последние две недели
- Геморрагический инсульт в анамнезе
- Травма головы или операции (в течение предыдущих двух недель)
- Нарушения системы свертывания
- Предшествующие тромболизисы со стрептокиназой (противопоказание только для стрептокиназы)
- Предшествующие стрептококковые инфекции (противопоказание только для стрептокиназы)
Торакоскопия — альтернативный фибринолитическому метод терапии осумкованных плевральных выпотов. Эффективность торакоскопии при дренировании эмпиемы плевры достигает 90%. При отсутствии эффекта от дренирования плевральной полости, фибринолитической терапии и торакоскопии прибегают к хирургическому дренированию — открытой торакотомии и декортикации легкого.
Хирургические методы имеют высокую эффективность (до 95%), однако их выполнение сопряжено с определенным операционным риском.
При наличии неблагоприятных прогностических факторов (рН 1000 МЕ/л; выявление микроорганизмов при микроскопии после окраски по Граму или при посеве на питательную среду; эмпиема плевры) необходимо полностью удалить жидкость путем дренирования плевральной полости или ее пункции. При невозможности полного дренирования используются внутриплевральные введения фибринолитических средств (например, урокиназы в дозе 100 000 ЕД на 100 мл физиологического раствора). При отсутствии эффекта такого лечения выполняется торакоскопия, целью которой является разрушение спаек и обеспечение дренирования очага. При отсутствии ее эффекта выполняется торакотомия и декортикация легкого (с удалением спаек, сгустков или фиброзной капсулы, окружающих легкое).
Если одышка, вызванная злокачественным плевральным выпотом, уменьшается после плевроцентеза, но жидкость продолжает накапливаться, устанавливается постоянный дренаж в плевральную полость или плевродез; бессимптомные выпоты и выпоты, резистентные к плевроцентезу, не требуют дополнительного лечения.
Установка постоянного дренажа — предпочтительный метод лечения для амбулаторных пациентов, поскольку данная процедура может быть выполнена в амбулаторных условиях, после чего плевральная жидкость эвакуируется непосредственно в вакуумные флаконы. Шунтирование плевральной жидкости в брюшную полость (плевроперитонеальный шунт) применяется у больных выпотом, обусловленным злокачественными новообразованиями, при отсутствии эффекта плевродеза или развитии панцирного легкого.
Плевродез производится путем введения склерозирующего средства в плевральную полость с целью индукции сращения висцерального и париетального плевральных листков и облитерации плевральной полости. Самые эффективные и обычно используемые склерозирующие средства — это тальк, доксициклин и блеомицин, вводимые через плевральную дренажную трубку или во время торакоскопии. Плевродез противопоказан при смещении средостения в сторону выпота и при отсутствии расправления легкого после установки плеврального дренажа.
Прогноз плевральных выпотов зависит, в основном, от их природы Однако можно предположить, что формирование плеврального выпота ухудшает прогноз основного заболевания Плевральный выпот — один из самостоятельных прогностических факторов внебольничной пневмонии, входящий в состав некоторых прогностических индексов. Как показали исследования, плевральный выпот — неблагоприятный прогностический признак, особенно для пациентов с пневмонией, вызванной легионеллами, и для больных ВИЧ-инфекцией.
источник
Асцит – это вторичное состояние, характеризующееся накоплением экссудата или транссудата в свободной брюшной полости. Клинически проявляется увеличением объема живота, тяжестью, чувством распирания и болями в брюшной полости, одышкой. Диагностика асцита включает проведение УЗИ, КТ, УЗДГ, диагностической лапароскопии с исследованием асцитической жидкости. Для патогенетического лечения необходимо установить причину, вызвавшую скопление жидкости; к симптоматическим мероприятиям при асците относятся назначение мочегонных средств, пункционное удаление жидкости из брюшной полости.
Асцит или брюшная водянка может сопровождать течение самого широкого круга заболеваний в гастроэнтерологии, гинекологии, онкологии, урологии, кардиологии, эндокринологии, ревматологии, лимфологии. Накопление перитонеальной жидкости при асците сопровождается повышением внутрибрюшного давления, оттеснением купола диафрагмы в грудную полость. При этом значительно ограничивается дыхательная экскурсия легких, нарушается сердечная деятельность, кровообращение и функционирование органов брюшной полости. Массивный асцит может сопровождаться значительной потерей белка и электролитными нарушениями. Таким образом, при асците может развиваться дыхательная и сердечная недостаточность, выраженные обменные нарушения, что ухудшает прогноз основного заболевания.
Асцит у новорожденных часто встречается при гемолитической болезни плода; у детей раннего возраста – при гипотрофии, экссудативных энтеропатиях, врожденном нефротическом синдроме. Развитие асцита может сопровождать различные поражения брюшины: разлитой перитонит неспецифической, туберкулезной, грибковой, паразитарной этиологии; мезотелиому брюшины, псевдомиксому, перитонеальный карциноз вследствие рака желудка, толстого кишечника, молочной железы, яичников, эндометрия.
Асцит может служить проявлением полисерозита (одновременного перикардита, плеврита и водянки брюшной полости), который встречается при ревматизме, системной красной волчанке, ревматоидном артрите, уремии, а также синдрома Мейгса (включает фиброму яичника, асцит и гидроторакс).
Частыми причинами асцита выступают заболевания, протекающие с портальной гипертензией – повышением давления в портальной системе печени (воротной вене и ее притоках). Портальная гипертензия и асцит могут развиваться вследствие цирроза печени, саркоидоза, гепатоза, алкогольного гепатита; тромбоза печеночных вен, вызванного раком печени, гипернефромой, заболеваниями крови, распространенным тромбофлебитом и т. д.; стеноза (тромбоза) воротной или нижней полой вены; венозного застоя при правожелудочковой недостаточности.
К развитию асцита предрасполагает белковая недостаточность, заболевания почек (нефротический синдром, хронический гломерулонефрит), сердечная недостаточность, микседема, болезни ЖКТ (панкреатит, болезнь Крона, хроническая диарея), лимфостаз, связанный со сдавлением грудного лимфатического протока, лимфоангиоэктазиями и затруднением лимфооттока из брюшной полости.
В норме серозный покров брюшной полости – брюшина продуцирует незначительное количество жидкости, необходимое для свободного движения петель кишечника и предупреждения склеивания органов. Этот экссудат всасывается обратно самой же брюшиной. При целом ряде заболеваний секреторная, резорбтивная и барьерная функции брюшины нарушаются, что приводит к возникновению асцита.
Таким образом, в основе патогенеза асцита может лежать сложный комплекс воспалительных, гемодинамических, гидростатических, водно-электролитных, метаболических нарушений, вследствие чего происходит пропотевание интерстициальной жидкости и ее скопление в брюшной полости.
В зависимости от причин патология может развиваться внезапно или постепенно, нарастая на протяжении нескольких месяцев. Обычно пациент обращает внимание на изменение размера одежды и невозможность застегнуть пояс, увеличение веса. Клинические проявления асцита характеризуются ощущениями распирания в животе, тяжестью, абдоминальными болями, метеоризмом, изжогой и отрыжкой, тошнотой.
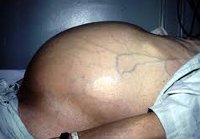
По мере нарастания количества жидкости живот увеличивается в объеме, пупок выпячивается. При этом в положении стоя живот выглядит отвисшим, а в положении лежа становится распластанным, выбухающим в боковых отделах («лягушачий живот»). При большом объеме перитонеального выпота появляется одышка, отеки на ногах, затрудняются движения, особенно повороты и наклоны туловища. Значительное повышение внутрибрюшного давления при асците может приводить к развитию пупочной или бедренной грыж, варикоцеле, геморрою, выпадению прямой кишки.
Асцит при туберкулезном перитоните вызван вторичным инфицированием брюшины вследствие генитального туберкулеза или туберкулеза кишечника. Для асцита туберкулезной этиологии также характерны похудание, лихорадка, явления общей интоксикации. В брюшной полости, кроме асцитической жидкости, определяются увеличенные лимфоузлы вдоль брыжейки кишечника. Экссудат, полученный при туберкулезном асците, имеет плотность >1016, содержание белка 40-60 г/л, положительную реакцию Ривальта, осадок, состоящий из лимфоцитов, эритроцитов, эндотелиальных клеток, содержит микобактерии туберкулеза.
Асцит, сопровождающий перитонеальный карциноз, протекает с множественными увеличенными лимфоузлами, которые пальпируются через переднюю брюшную стенку. Ведущие жалобы при данной форме асцита определяются локализацией первичной опухоли. Перитонеальный выпот практически всегда имеет геморрагический характер, иногда в осадке обнаруживаются атипичные клетки.
При синдроме Мейгса у пациенток выявляется фиброма яичника (иногда злокачественные опухоли яичника), асцит и гидроторакс. Характерны боли в животе, выраженная одышка. Правожелудочковая сердечная недостаточность, протекающая с асцитом, проявляется акроцианозом, отеками голеней и стоп, гепатомегалией, болезненностью в правом подреберье, гидротораксом. При почечной недостаточности асцит сочетается с диффузным отеком кожи и подкожной клетчатки – анасаркой.
Асцит, развивающийся на фоне тромбоза воротной вены, носит упорный характер, сопровождается выраженным болевым синдромом, спленомегалией, незначительной гепатомегалией. Вследствие развития коллатерального кровообращения нередко возникают массивные кровотечения из геморроидальных узлов или варикозно увеличенных вен пищевода. В периферической крови выявляется анемия, лейкопения, тромбоцитопения.
Асцит, сопровождающий внутрипеченочную портальную гипертензию, протекает с мышечной дистрофией, умеренной гепатомегалией. На коже живота при этом хорошо заметно расширение венозной сети в виде «головы медузы». При постпеченочной портальной гипертензии стойкий асцит сочетается с желтухой, выраженной гепатомегалией, тошнотой и рвотой.
Асцит при белковой недостаточности, как правило, небольшой; отмечаются периферические отеки, плевральный выпот. Полисерозиты при ревматических заболеваниях проявляются специфическими кожными симптомами, асцитом, наличием жидкости в полости перикарда и плевры, гломерулопатией, артралгиями. При нарушениях лимфооттока (хилезном асците) живот быстро увеличивается в размерах. Асцитическая жидкость имеет молочный цвет, пастообразную консистенцию; при лабораторном исследовании в ней выявляются жиры и липоиды. Количество жидкости в брюшинной полости при асците может достигать 5-10, а иногда и 20 литров.
В ходе осмотра гастроэнтеролога исключаются другие возможные причины увеличения объема живота – ожирение, киста яичника, беременность, опухоли брюшной полости и т. д. Для диагностики асцита и его причин проводится перкуссия и пальпация живота, УЗИ брюшной полости, УЗДГ венозных и лимфатических сосудов, МСКТ брюшной полости, сцинтиграфия печени, диагностическая лапароскопия, исследование асцитической жидкости.
Перкуссия живота при асците характеризуется притуплением звука, смещением границы тупости при изменениях положения тела. Прикладывание ладони к боковой поверхности живота позволяет ощутить толчки (симптом флюктуации) при постукивании пальцами по противоположной стенке живота. Обзорная рентгенография брюшной полости позволяет идентифицировать асцит при объеме свободной жидкости более 0,5 л.
Из лабораторный тестов при асците проводится исследование коагулограммы, биохимических проб печени, уровней IgA, IgM, IgG, общего анализа мочи. У пациентов с портальной гипертензией показано выполнение ЭГДС с целью обнаружения варикозно измененных вен пищевода или желудка. При рентгеноскопии грудной клетки может выявляться жидкость в плевральных полостях, высокое стояние дна диафрагмы, ограничение дыхательной экскурсии легких.
В ходе УЗИ органов брюшной полости при асците изучаются размеры, состояние тканей печени и селезенки, исключаются опухолевые процессы и поражения брюшины. Допплерография позволяет оценить кровоток в сосудах портальной системы. Гепатосцинтиграфия проводится для определения поглотительно-экскреторной функции печени, ее размеров и структуры, оценки выраженности цирротических изменений. С целью оценки состояния спленопортального русла проводится селективная ангиография – портография (спленопортография).
Всем пациентам с асцитом, выявленным впервые, выполняется диагностический лапароцентез для забора и исследования характера асцитической жидкости: определения плотности, клеточного состава, количества белка и бактериологического посева. При сложно дифференцируемых случаях асцита показано проведение диагностической лапароскопии или лапаротомии с прицельной биопсией брюшины.
Патогенетическое лечение требует устранения причины скопления жидкости, т. е. первичной патологии. Для уменьшения проявлений асцита назначаются бессолевая диета, ограничение приема жидкости, мочегонные препараты (спиронолактон, фуросемид под прикрытием препаратов калия), проводится коррекция нарушений водно-электролитного обмена и снижение портальной гипертензии с помощью антагонистов рецепторов ангиотензина II и ингибиторов АПФ. Одновременно показано применение гепатопротекторов, внутривенное введение белковых препаратов (нативной плазмы, раствора альбумина).
При асците, резистентном к проводимой медикаментозной терапии, прибегают к абдоминальному парацентезу (лапароцентезу) – пункционному удалению жидкости из брюшной полости. За одну пункцию рекомендуется эвакуировать не более 4-6 л асцитической жидкости ввиду опасности развития коллапса. Частые повторные пункции создают условия для воспаления брюшины, образования спаек и повышают вероятность осложнений последующих сеансов лапароцентеза. Поэтому при массивных асцитах для длительной эвакуации жидкости производят установку постоянного перитонеального катетера.
К вмешательствам, обеспечивающим условия для путей прямого оттока перитонеальной жидкости, относятся перитонеовенозный шунт и частичная деперитонизация стенок брюшной полости. К косвенным вмешательствам при асците относятся операции, снижающие давление в портальной системе. В их число входят вмешательства с наложением различных портокавальных анастомозов (портокавальное шунтирование, трансъюгулярное внутрипеченочное портосистемное шунтирование, редукция селезеночного кровотока), лимфовенозное соустье. В некоторых случаях при рефрактерном асците производится спленэктомия. При резистентном асците может быть показана трансплантация печени.
Наличие асцита существенно утяжеляет течение основного заболевания и ухудшает его прогноз. Осложнениями самого асцита могут стать спонтанный бактериальный перитонит, печеночная энцефалопатия, гепаторенальный синдром, кровотечения. К неблагоприятным прогностическим факторам у пациентов с асцитом относят возраст старше 60 лет, гипотонию (ниже 80 мм рт. ст), почечную недостаточность, гепатоцеллюлярную карциному, сахарный диабет, цирроз печени, печеночноклеточную недостаточность и др. По данным специалистов в сфере клинической гастроэнтерологии, двухлетняя выживаемость при асците составляет около 50%.
источник
Врачи Европейской клиники специализируются на работе с пациентами, имеющими асцит. Особенности лечения асцита у нас:
- Мы проводим комплексное лечение. При лапароцентезе (проколе брюшной стенки для удаления жидкости из живота) мы устанавливаем временные или постоянные перитонеальные катетеры. Это позволяет не ограничивать пациента в движении.
- Если это показано, пациенту назначают специальное питание с ограничением водно-солевой нагрузки.
- Если асцит возник на фоне онкологического заболевания, может быть проведена химиотерапия. Благодаря этому мы достигаем улучшения состояния пациентов с асцитом при прогрессирующем раке яичников и толстой кишки.
- Эффективна внутриполостная химиотерапия. После удаления жидкости, в брюшную полость вводится химиопрепарат. Примерно в половине случаев повторная эвакуация жидкости не требуется как минимум 2 месяца.
Когда пациент с онкологическим заболеванием и асцитом переходит на комплексную терапию, лапароцентез требуется в 2–3 раза реже, чем обычно.
Если в брюшной полости находится небольшое количество жидкости, это никак не проявляется. Кроме того, это нормально: в сутки организм человека производит и поглощает в брюшной полости примерно 1,5 л жидкости. При начальной стадии асцита особых жалоб у пациентов нет, и обнаружить патологическое состояние можно только во время ультразвукового исследования.
Когда асцит прогрессирует, человек чувствует тяжесть в области живота, а в нижней его части — тупые ноющие боли. Впоследствии возникает затруднение дыхания, расстройство пищеварения (тошнота, отрыжка, нарушения стула) и нарушение мочеиспускания. В наиболее тяжёлых формах асцит значительно ухудшает самочувствие, в животе появляются неприятные ощущения, возникает одышка, происходит раннее насыщение и формируется пупочная грыжа.
В брюшной полости может скопиться 5–10 л жидкости, а иногда и 20 л. Из-за этого сильно сдавливаются внутренние органы, повышается внутрибрюшное давление и диафрагма оттесняется в грудную полость. Это влечёт за собой сильное затруднение дыхания. Из-за того, что в органах брюшной полости увеличивается сопротивление кровотоку, возникает сердечная недостаточность. Следствием длительно существующего асцита становится нарушение дренирования лимфатической системы. Из-за этого также возникает нарушение лимфооттока в нижних конечностях и, как следствие, их отёк. Также может произойти обратный ход лимфы во внутренние органы. В результате раковые клетки попадают в здоровые органы из поражённых лимфоузлов. Это может спровоцировать развитие метастазов в печени, желудке, поджелудочной железе и других органах.
Когда в брюшной полости находится более одного литра жидкости, асцит можно заметить при обычном осмотре: живот увеличен или деформирован, в вертикальном положении выглядит отвисшим, в лежачем положении живот распластан, боковые отделы выглядят набухшими (так называемый «лягушачий живот»). У худых пациентов нередко выпирает пупок. У человека может также возникнуть гидроторакс — присутствие жидкости в плевральной полости. Обычно это состояние развивается у пациентов с застойной сердечной недостаточностью при длительно существующем асците.
Небольшой или умеренный асцит развивается у 15–50 процентов пациентов на ранних стадиях рака. На поздних стадиях тяжёлый асцит встречается у 7–15 процентов пациентов.
У пациентов с распространенным раком на поздней стадии чаще всего встречается асцит в области легкого или экссудативный плеврит.
При асците в брюшной полости происходит патологическое скопление жидкости. Дело в том, что при некоторых заболеваниях нарушается регуляция водно-солевого обмена и нормальная циркуляция жидкости в брюшной полости. Причиной могут быть:
- Онкологические заболевания: вторичный канцероматоз брюшины, лимфома и лейкоз, метастазы в области ворот печени, первичная мезотелиома.
- Болезни печени и её сосудов: рак печени, портальная гипертензия, цирроз печени, вено-окклюзионная болезнь, болезнь Бадда — Киари.
- Перитонит (воспаление брюшины) различного происхождения: панкреатический, грибковый, паразитарный, туберкулёзный.
- Застойная сердечная недостаточность, констриктивный перикардит.
- Другие болезни: опухоли и кисты яичников (синдром Мейгса), киста поджелудочной железы, болезнь Уиппла, саркоидоз, системная красная волчанка, микседема.
В Европейской клинике проводится лечение асцита различного происхождения. Но так как основная наша работа связана с лечением злокачественных новообразований, значительную часть наших пациентов составляют онкобольные.
Есть несколько основных методов лечения асцита у пациентов с онкологическими заболеваниями:
- консервативная терапия (антагонисты альдостерона, мочегонные препараты) — направлена на нормализацию водно-солевого обмена и уменьшение образования жидкости в брюшной полости;
- лапароцентез — прокол брюшной стенки под контролем ультразвука; используется не только для выведения жидкости, но и для установки дренажа, который будет служить для продолжительного вывода жидкости;
- паллиативные хирургические операции — перитонеовенозный шунт, оментогепатофренопексия, деперитонизация стенок брюшной полости и другие.
Народные методы лечения асцита, возникшего на фоне онкологического заболевания, не имеют доказанной эффективности и безопасности, поэтому в Европейской клинике не применяются.
Если вы обратились в нашу клинику по поводу асцита на фоне рака, мы рекомендуем получить «второе мнение» касательно лечения основного заболевания у наших клинических онкологов и химиотерапевтов.
В Европейскую клинику обратилась за помощью женщина Ш. 59 лет с диагнозом рак (аденокарцинома) яичников IV стадия, асцит, хронический болевой синдром 2 б по ШВО. Пациентка обратила внимание на увеличение живота в объеме до 120 см в окружности, затруднение дыхания, потерю веса. В специфическом лечении по месту жительства было отказано. Со слов пациентки её «отправили домой умирать». Читать далее…
В Европейскую клинику обратилась за помощью женщина Ш. 59 лет с диагнозом рак (аденокарцинома) яичников IV стадия, асцит, хронический болевой синдром 2 б по ШВО.
Пациентка обратила внимание на увеличение живота в объеме до 120 см в окружности, затруднение дыхания, потерю веса. В специфическом лечении по месту жительства было отказано. Со слов пациентки её «отправили домой умирать». Больная Ш. была экстренно госпитализирована в специализированное отделение Европейской клиники, после проведения активной симптоматической терапии, направленной на нормализацию показателей крови и восстановление водно-электролитного баланса, был установлен перитонеальный порт. Под контролем уровня белка плазмы проведено разрешение асцита. Использование перитонеальных портов позволяет осуществить удаление асцитической жидкости дробно, дозированно, что в конечном итоге исключает возникновение серьезных осложнений в виде геморрагического синдрома, связанных с гемодилюцией и коагулопатией в результате массивного поступления асцитического содержимого в венозное русло.
После стабилизации общего состояния, на фоне нутритивной поддержки, противорвотной и антисекреторной терапии пациентка Ш. получила специфическое химиотерапевтическое лечение с хорошим эффектом. По факту разрешения асцита при наличии перитонеального порта стало возможным проведение внутрибрюшной химиотерапии.
Спустя шесть месяцев после описанной госпитализации пациентка вернулась к привычному для нее образу жизни, продолжает получать системное лечение в амбулаторном режиме под контролем команды специалистов Европейской клиники. Ответ на лечение расценивается как положительный, при отсутствии асцита и суммарным уменьшением размеров очагов более чем на 70%. Комбинированное лечение в формате системной и локальной (внутрибрюшной) терапии с имплантацией порт-системы является оптимальным режимом ведения данной группы пациентов. В практике врачей Европейской клиники подобные случаи встречаются на регулярной основе. Скрыть
Чаще всего к накоплению жидкости приводят следующие онкологические заболевания:
- рак яичников (у 25–30 процентов пациентов),
- рак молочной железы,
- рак матки,
- рак желудка,
- рак толстой кишки.
Накопление жидкости в брюшной полости при раке происходит из-за того, что поражается брюшина (оболочка, выстилающая изнутри стенки брюшной полости и покрывающая расположенные в ней органы). На её париетальном и висцеральном листках поселяются опухолевые клетки, в результате чего происходит нарушение лимфатического дренажа. Это и вызывает ухудшение всасывания жидкости. Обычно причиной становятся опухоли желудочно-кишечного тракта и асцит при раке яичников.
Когда в печени образуется опухоль или метастазы, причина асцита в другом: сжимается венозная система печени и нарушается естественный венозный отток от кишечника. Такой асцит развивается быстро, и обычно течёт дольше и тяжелее. 15 процентов случаев скопления жидкости в брюшной полости при онкологических заболеваниях приходится именно на эту его форму.
Лимфома брюшной полости вызывает асцит через закупорку и выпот (просачивание) лимфы из внутрибрюшных лимфатических протоков.
В лечебных учреждениях, которые не специализируются на лечении онкологических заболеваний, подход к пациентам с асцитом может быть неэффективным из-за особенностей этого состояния. Например, основное лечение может заключаться в применении мочегонных препаратов, антагонистов альдостерона, изменении диеты для ограничения водной и солевой нагрузки. Эффективность этого подхода для уменьшения портальной гипертензии относительна, у онкобольных асцит вызван канцероматозом брюшины. Поэтому консервативная терапия не может быть основным методом лечения у таких пациентов.
Обычно жидкость удаляется из брюшной полости с помощью лапароцентеза (абдоминального парацентеза). Это хирургическая процедура, которая проводится хирургом и анестезиологом-реаниматологом.
Консервативная терапия применяется в лечении небольших асцитов и средней степени выраженности. Другими словами, если не возникают утомляющие и истощающие симптомы: боль, частое дыхание (тахипноэ) и др. До 65% пациентов имеют улучшение состояния при терапии мочегонными препаратами — так можно выводить до 1 литра жидкости в день. «Золотым стандартом» считается спиронолактон, его назначают в дозе от 100 до 200 мг 1–2 раза в сутки. Также используется его сочетание с фуросемидом в дозе 40–240 мг в сутки. Как долго и в каком объёме будет проводиться такая терапия, зависит от скорости потери жидкости, ее определяют по изменению массы тела.
На поздних стадиях онкологического заболевания уменьшение потребления соли и воды может снизить качество жизни. Поэтому в Европейской клинике такая коррекция диеты назначается редко.
Асцит при онкологическом заболевании необходимо лечить хирургическим путём, когда это:
- Рефрактерный, то есть не поддающийся консервативному лечению.
- Большой асцит, то есть если необходимо вывести до 6–10 л жидкости за один раз (эта тяжёлая процедура проводится по строгим медицинским показаниям).
- Гигантский асцит. В этом случае нужна комбинированная операция, которая включает выведение большого объёма жидкости (до 5–7 л) в первые сутки и выведение остального объёма со скоростью не больше, чем 1 л в сутки в течение 7–10 дней.
В классическом варианте лапароцентез проводится на пустой мочевой пузырь, пациент садится, тяжелобольного человека укладывают на бок.
Без соблюдения правил асептики и антисептики проводить лапароцентез опасно. Поэтому выпуск жидкости проводится только в специализированном лечебном учреждении с лицензией на выполнение хирургических вмешательств и имеющим стационар. Если пациент находится в тяжелом состоянии, сложно передвигается, для него вызывают скорую.
Сначала выполняется местная анестезия, затем под контролем ультразвука делается прокол троакаром (инструментом в виде тонкой трубки с острым концом) по средней линии живота или по линии, соединяющей пупок с гребнем подвздошной кости. Обычно за один раз выводится не больше 5–6 л жидкости. Чтобы артериальное давление резко не упало и не случился коллапс сосудов, жидкость выпускается медленно.
В соответствии с классической методикой пациенту необходимо лежать в течение нескольких часов на свободном от пункции боку. Если в это время незначительное количество жидкости продолжает выделяться, то при желании накладывается резервуар, который убирает через сутки или двое.
Если требуется удалить большое количество жидкости, то происходит потеря белка и солей, что становится причиной белковой недостаточности. Для предотвращения такого осложнения человеку вводят альбумин. При повторной пункции может возникнуть ещё одно осложнение — сращение сальника (части брюшины) или кишки с передней стенкой живота. Из-за этого работа кишечника значительно ухудшается, а при последующих пункциях могут развиться тяжёлые осложнения.
При современном подходе к проведению лапароцентеза отвод жидкости происходит преимущественно через постоянный перитонеальный катетер. Одновременно дефицит объёма циркулирующей крови замещается плазмаэкспандерами (от англ. plasma expander — увеличивающий объём плазмы). Обычно для этого используются 10-20-процентные растворы альбумина.В некоторых случаях вместо альбумина можно использовать аминостерил, полиглюкин, реополиглюкин (декстран-40), гемацелл и новые препараты на основе крахмала (рефортан, стабизол, ХАЕС-стерил). Такая альтернатива помогает лишь возместить дефицит жидкости в крови, но на дефицит белка эти препараты не влияют.
Некоторым больным асцитом проводят оментогепатофренопексию. Это лапароскопическая операция, при которой сальник подшивается к участкам поверхности печени и диафрагмы. Благодаря тому, что между сальником и печенью возникает контакт, появляются условия для всасывания асцитической жидкости находящимися рядом тканями. Если у пациента есть канцероматоз брюшины, операция выполняется ограниченно. Обычно у таких больных оментогепатофренопексия становится частью паллиативного лечения.
В Европейской клинике действует специальное предложение на дренирование асцита в условиях дневного стационара — 50000 руб.
- Осмотр и консультация хирурга-онколога.
- Общий анализ крови, биохимический анализ крови, ЭКГ.
- УЗИ органов брюшной полости с определением уровня свободной жидкости
- Проведение лапароцентеза с УЗИ навигацией.
- Комплексная медикаментозная терапия, направленная на восстановление водно-электролитного баланса.
Лечение асцита проводится с применением наиболее современных методик, передового опыта российских и зарубежных врачей. Мы специализируемся на лечении асцита и знаем, что можно сделать.
источник