Асцит – достаточно распространенный симптом при тяжелых хронических формах многих патологий внутренних органов. При отсутствии лечения брюшная водянка в течение 1-3 лет способна привести к летальному исходу. Смягчить негативную симптоматику и продлить жизнь при асците брюшной полости помогает применение мочегонных препаратов. Эффективность этих средств зависит от их грамотного подбора и правильного расчета дозы.

- хронической сердечно-сосудистой недостаточности (ХССН);
- хронической почечной недостаточности (ХПН);
- циррозу печени;
- онкологическим заболеваниям внутренних органов злокачественного характера.
Каждое мочегонное имеет свои специфические характеристики, которые необходимо изучить перед тем, как их употреблять. Некоторые патологии – например, ХПН или онкология, – исключают применение сильнодействующих мочегонных препаратов при асците брюшной полости, так как это может способствовать ухудшению состояния больного.
Для этих мочегонных характерно мягкое диуретическое воздействие. Если болезнь прогрессирует, происходит ухудшение кровообращения, возникает отечность конечностей и асцитные проявления. В этом случае необходимо применение диуретиков более сильного эффекта – «Фуросемида», «Торасемида», «Буметонида», этакриновой кислоты. Их действие сопровождается усиленным выведением из организма калия и магния, поэтому прием таких таблеток необходимо совмещать с приемом «Аспаркама», либо заменить на калийсберегающие диуретические препараты – «Спиронолактон», «Триамтерен».

Перегружать слабо функционирующие почки действием сильного диуретика не рекомендуется. Поэтому при ХПН следует отдавать предпочтение лекарствам, при изготовлении которых используются растительные составляющие. Это могут быть фармацевтические препараты, содержащие природные компоненты, обладающие более мягким действием, чем вещества химического происхождения – «Нефропил», «Канефрон», либо отвары на основе трав, обладающих мочегонным эффектом, – полевого хвоща, льна, расторопши. Полезен при почечном асците чай из душицы, зверобоя, ромашки. Если асцит спровоцирован воспалительной реакцией почечных тканей, врач может назначить таблетки «Фуросемида» в минимальной дозировке – по одной в сутки. Такая доза не производит угнетающего воздействия на функцию вывода натрия из организма.

Принимая мочегонные средства при асците, важно следить за соотношением потребляемой и выделяемой жидкости. Объем вырабатываемой почками мочи должен как минимум на 0,5 литров превышать объем попадающей в организм воды, включая бульоны, компоты, кисели и т.д.
Фармацевтические лекарственные препараты мочегонного действия способны давать аллергические реакции, из-за чего их применение приходится отменять или ограничивать, уменьшая дозировку. В этом случае на помощь придут народные средства на основе трав.
Хорошим диуретическим действием обладает петрушка с молоком. На 0,5 литра молока понадобится большой пучок петрушки, которую нужно крупно порезать и высыпать в кипящую жидкость. Убавив огонь до минимума, траву нужно томить два с половиной часа. Затем отвар остужают и процеживают, сливают в стерилизованную стеклянную емкость и хранят в холодильнике на нижней полке, принимая по 2 ст. ложки каждый час.
Отвар из кураги, содержащей большое количество калия, можно пить вместо чая. С этой же целью заваривают плоды шиповника, также богатые витаминами и микроэлементами.
Настои из плодов и трав могут принести большую пользу при асците. Однако применение рецептов «зеленой аптеки» имеет ограничения. Например, крапива, расторопша, кукурузные рыльца, птичий горец, пастушья сумка и другие травы-диуретики, содержащие витамин К, не могут применяться при асцитах, вызванных онкопатологией. Этот витамин способствует повышенной выработке тромбоцитов, что ускоряет развитие опухолей.
Давать разрешение на употребление фармацевтических препаратов и народных средств, определять их дозировку и контролировать прием может только врач, наблюдающий больного. Если же никакие мочегонные средства, назначаемые при асците, не помогают, врачи прибегают к дренированию брюшной полости. Терапевтический процесс должен проходить под постоянным наблюдением квалифицированных специалистов. Самолечение может привести к летальному исходу.
Врач терапевт второй категории, трансфузиолог, стаж 29 лет
Диагностика и лечение проблем с опорно-двигательный аппаратом (голень) и животом.
- боль и дискомфорт в животе;
- ушибы и травмы голени;
- кашель, боли в груди;
- ОРЗ, ОРВИ;
- пищевое отравление;
- простуда;
- насморк;
- общее недомогание;
- головная боль;
- ломота в суставах;
- повышенная температура.
- Диплом по специальности «Лечебное дело (Лечебно-профилактическое дело)», Чувашский государственный университет им. И.Н. Ульянова, медицинский факультет (1990 г.)
- Интернатура по специальности «Избранные вопросы терапии», Казанская государственная медицинская академия (1996 г.)
Курсы повышения квалификации
- «Вопросы нефрологии для терапевтов», Государственный институт для усовершенствования врачей имени В.И. Ленина (1995 г.)
- «Терапия», Казанская государственная медицинская академия (2001 г.)
- «Трансфузиология», Российская медицинская академия последипломного образования МЗ РФ (2003 г.)
- «Терапия и пульмонология», Санкт-Петербургская медицинская академия последипломного образования Федерального агентства по здравоохранению и социальному развитию (2006 г.)
- «Трансфузиология», Санкт-Петербургская медицинская академия последипломного образования Федерального агентства по здравоохранению и социальному развитию (2007 г.)
- «Трансфузиология», Институт усовершенствования врачей Министерства здравоохранения и социального развития Чувашии (2012 г.)
- «Терапия», Институт усовершенствования врачей Министерства здравоохранения и социального развития Чувашии (2013 г.)
- «Терапия», Российский университет дружбы народов (2017 г.)
Место работы: клиника МедЦентрСервис на Курской
источник
Оставьте комментарий 24,872
Мочегонные препараты являются неотъемлемой частью лечения водянки брюшной полости. Диуретики при асците успешно используются в традиционной медицине с 1940-х годов и неизменно показывают отличный результат. Народная медицина предлагает в качестве альтернативы мочегонные травы при асците, которые также дают положительный терапевтический эффект.
Асцит (водянка) — накапливание свободной жидкости в брюшной полости, вне органов. В большинстве случаев водянка является последствием другого заболевания — первопричины нарушения функционирования органов, приводящей к скоплению экссудата и транссудата. Объем жидкости в брюшине может достигать 25 л. Наиболее выраженными признаками наличия асцита является выпячивание брюшной полости и набор веса за счет увеличения объема живота. Диагностирование заболевания происходит при физическом осмотре у врача с помощью перкуссии и пальпации, а также УЗИ и КТ. Зачастую источником водянки является цирроз печени, туберкулез брюшины, метастазы в брюшину и печень при онкологии.
Причинами водянки брюшной полости могут быть:
- заболевания печени (цирроз, рак, гепатит, тромбоз печеночных вен);
- онкологические болезни (лимфома, саркоидоз, лейкоз, карциноматоз);
- сердечные заболевания (сердечная недостаточность, перикардит);
- заболевания брюшины (мезотелиома, перитонит, опухоли и кисты);
- почечная недостаточность.
Вернуться к оглавлению
Заболевание способно возникнуть скоропостижно (например, вследствие тромбоза портальной вены) или формироваться последовательно, на протяжении месяцев. При малом асците живот пациента в вертикальной позиции свисает вниз, а в горизонтальной позиции становится плоским, но выступает с боков. При большом объеме асцит ярко выражен, живот твердый и выпуклый, выглядит одинаково в горизонтальной и вертикальной позиции. Самочувствие пациента значительно ухудшается, появляются боли в брюшине и ощущение натянутости живота, нарушение двигательной функции, отеки конечностей. Скопление жидкости создает давление на органы и приводит к нарушению их работоспособности. Последствиями могут быть нарушения процессов обмена веществ, расстройство пищеварения, дыхательная и сердечная недостаточность. Часто водянка осложняется спонтанно возникающим вследствие инфицирования жидкости бактериальным перитонитом.
Асцит является опасным заболеванием, способным привести к летальному исходу в достаточно короткий срок, только около 50% пациентов проживает до 2-х лет с этим заболеванием. Поэтому при малейшем подозрении необходимо обратиться к врачу для диагностики и скорее начать терапию, вовремя проведенное лечение повышает выживаемость.
Для лечения водянки могут назначаться диеты с пониженным потреблением жидкости и соли. В тяжелых случаях проводится оперативное вмешательство — лапароцентез (пункция брюшной полости с целью удаления жидкости), возможна катетеризация. Более щадящим лечением является назначение диуретиков — с помощью мочегонных средств можно вывести около литра жидкости в день. Поскольку асцит в большинстве случаев является последствием другого заболевания, то и применяемое лечение зависит от заболевания, вызвавшего асцит.
При асците, вызванном сердечной недостаточностью, часто случаются отеки нижних конечностей. Удачный выбор мочегонных препаратов поможет уменьшить нагрузку на сердце и понизить внутрибрюшное давление. Эксперты советуют назначать диуретики больным сердечной недостаточностью 2―4-й степени. При легкой сердечной недостаточности эффективны тиазидные диуретики («Гидрохлортиазид», «Хлортизид», «Индапамед», «Хлорталидон»), но при ухудшении кровообращения необходимо применение петлевого диуретика («Фуросемид», «Торасемид», «Буметонид», этакриновая кислота). Побочным действием диуретиков может быть экскреция калия из организма, поэтому может понадобиться коррекция — одновременный прием препаратов калия или применение сберегающих калий диуретиков («Спиронолактон», «Триамтерен»).
При водянке с циррозом печени назначается бессолевая диета, прием питья ограничивается до 1 л в сутки. Для регуляции водно-солевого обмена применяются мочегонные средства. Одним из часто применяемых препаратов считается «Верошпирон», но он оказывает эффект только на 3-й день после приема, поэтому при тяжелой форме асцита целесообразно совмещение с «Фуросемидом». Менее эффективен «Амилорид». «Буметанид» может заменить «Фуросемид», т. к. имеет подобное действие и эффект.

При раковом асците наиболее популярным назначением является мочегонный препарат «Спиронолактон», часто используют его вместе с «Фуросемидом». Могут употребляться «Лазикс», «Диакарб» и прочие подобные средства. В этом случае врачи рекомендуют употреблять мочегонные препараты вне зависимости от того, дают ли они выраженный результат.
При лечении водянки брюшной полости мочегонными препаратами необходим контроль результативности терапии путем подсчета диуреза и взвешивания пациента. Терапия эффективна, если выделяемая жидкость превышает потребляемую. Допустимым показателем является разница не более 500 мл ― для больных, не имеющих периферической отечности, и до 1000 мл ― больным, страдающим периферическими отеками. Большинство описываемых препаратов, кроме имеющих растительное происхождение, противопоказаны к приему во время беременности и лактации. Они могут быть использованы только по назначению врача.
Чтобы избавиться от асцита, важно излечить заболевание, вызвавшее его. Но для облегчения текущего состояния больного альтернативные методы народной медицины способны дать положительный результат. Актуально использование растительных мочегонных средств пациентам с проблемами функционирования почек или имеющим гиперчувствительность к компонентам синтетических мочегонных средств.
При водянке на почве онкологии с метастазами в печень хорошо зарекомендовала себя петрушка с молоком. Понадобится 0,5 л молока и большой пучок петрушки. Молоко вскипятить, петрушку крупно нарезать и всыпать в молоко. Смесь томить на самом малом огне около 2,5 ч, затем остудить и процедить. Принимать ежечасно по 2 ст. ложки. Хранить в прохладном месте. Петрушку можно приготовить и на воде. Для этого большой пучок петрушки залить литром воды и проварить 30 мин. Принимать каждый час по 0,5 стакана в первой половине дня.
Пациентам с онкологическим асцитом следует избегать средств, повышающих выработку организмом тромбоцитов, поскольку это побуждает к росту рака. Это относится к расторопше, разновидностям горца, крапиве, кукурузным рыльцам, пастушьей сумке и прочим мочегонным травам, содержащим витамин К.
Полезны абрикосы — они не только обладают мочегонным воздействием, но и содержат калий, количество которого в организме важно восполнять при употреблении мочегонных средств. Абрикосы можно просто есть свежими или готовить отвар из сухих плодов. Помогает при отеках и настой шиповника, который употребляется в течение дня вместо чая.
Мочегонным эффектом обладают стручки фасоли. Хвощ и березовая листва в равном сочетании увеличивают действие друг друга. Сильная мочегонная трава толокнянка (медвежье ушко) — на стакан кипятка используется не более 2 г. В аптеках имеется большой выбор мочегонных и потогонных сборов, составленных из подходящих компонентов и расфасованных в одноразовые пакетики, которые удобно использовать вместо чая.
источник
Асцит — одно из самых значимых осложнений цирроза печени, которое возникает примерно у 40–50% пациентов за 10-летний период от постановки диагноза. Развитие асцита считают важным неблагоприятным прогностическим признаком прогрессии заболевания
Асцит — одно из самых значимых осложнений цирроза печени, которое возникает примерно у 40–50% пациентов за 10-летний период от постановки диагноза. Развитие асцита считают важным неблагоприятным прогностическим признаком прогрессии заболевания, так как он связан с50% смертностью втечение двух ближайших лет [23, 26].
До настоящего времени механизмы формирования асцита при циррозе печени остаются недостаточно ясными. Каким образом накапливается жидкость в брюшной полости, в чем физиологическая сущность данного процесса, какова его связь с центральной гемодинамикой, состоянием почек и брюшины? Почему именно данный синдром является поворотным в жизни пациентов с циррозом и независимо от этиологии заболевания определяет дальнейшую выживаемость и качество жизни этих больных?
Кроме того, прогрессивный рост фармакологического рынка почти не заметен в гепатологии. Тогда как в других областях медицины, например в кардиологии, ежегодно принимаются согласительные документы по лечению пациентов с сердечной недостаточностью (СН), куда включаются новые мочегонные препараты, оптимизируются схемы и подходы к терапии. Лечение отечно-асцитического синдрома у кардиологического больного четко отработано, тогда как обсуждение принципов курации гепатологического пациента влечет за собой целый ряд споров и разногласий.
Эти и многие другие вопросы уже сегодня требуют своего разрешения, прежде всего для врачей-специалистов, ежедневно участвующих в лечении больных хроническими заболеваниями печени.
Механизмы возникновения асцита у больных циррозом печени
Развитие асцита обусловлено повышенной лимфопродукцией в печени в связи с блокадой оттока из нее венозной крови, однако его возникновение начинается с момента повреждения гепатоцитов, т. е. с этапа гепатита.
Основными механизмами развития отечно-асцитического синдрома являются (рис.):
Остановимся на более детальном рассмотрении данных положений.
Развитие синдрома печеночно-клеточной недостаточности (ПКН) у больных циррозом печени. Характеризуется:
Выброс вазодилятаторов и цитокинов поврежденными гепатоцитами. Нарушение детоксицирующей функции печени, развитие ПКН и порто-кавального шунтирования способствуют проникновению в кровь из поврежденных гепатоцитов вазодилятаторов, таких как глюкагон, оксид азота, простагландин E2α, предсердный натрий-уретический гормон, вазоинтестинальный пептид, простациклин, что приводит к генерализованной вазодилятации и снижению общего периферического сопротивления сосудов (ОПС). При этом в эндотелии сосудов печени, под влиянием эндотоксинов и цитокинов, синтезируются мощные вазоконстрикторы, в частности эндотелин-1, что вызывает спазм сосудов. То есть происходит разобщение местного и общего кровотока, связанное с дисбалансом вазодилятирующих и вазоконстриктивных веществ, что приводит:
Активация САС и РААС. Активированные САС и РААС воздействуют на основные мишени:
Основными факторами поражения ССС при циррозе печени являются шунтирование крови с прямым токсическим воздействием на миокард биологически активных веществ (адреналина, гистамина, серотонина), дисметаболические расстройства, связанные с нарушением печеночных функций, вегетативные нарушения, длительная гиперактивация САС и РААС [7, 35, 38]. Совокупность нарушений обмена биологически активных веществ приводит к развитию так называемой метаболической кардиомиопатии с дилятацией полостей сердца и СН. Данное состояние усугубляется хронической функциональной перегрузкой сердца на фоне гиперкинетического типа кровообращения [2, 4, 6]. То есть при развитии заболевания печени развивается системная реакция, которая реализуется через вовлечение в процесс ССС, формируя аналогичные СН способы компенсации и декомпенсации с возникновением отечно-асцитического синдрома [11, 12, 34].
Основными факторами поражения почек при циррозе печени являются:
Поражение почек развивается вследствие нарушения баланса между системной вазодилятацией и почечной вазоконстрикцией. Несмотря на характерную для цирроза печени системную вазодилятацию, в почках, как и в печени, происходит вазоконстрикция, что приводит к снижению скорости клубочковой фильтрации, уровень ренина в плазме при этом возрастает. Натрий компенсаторно усиленно реабсорбируется в почечных канальцах, что вызывает повышение осмолярности мочи. Происходит накопление жидкости в организме, несмотря на нормальный объем мочи, малосолевую диету и диуретическую терапию. Во внепочечных сосудах преобладает расширение артерий, и в результате снижается ОПС с развитием артериальной гипотензии. Сердечный выброс не изменяется или даже повышен, однако эффективный почечный кровоток уменьшается в результате перераспределения кровотока в селезенку, кожу и другие органы, таким образом происходит шунтирование коркового слоя почек. Наиболее ранним признаком включения почечного механизма при развитии асцита у больных циррозом печени является задержка натрия в организме, что проявляется снижением суточной экскреции натрия с мочой менее 78 ммоль/сут [8, 16].
Задержка натрия почками — это одна из вероятных причин асцита, предшествующая накоплению асцитической жидкости. На ранних этапах она является результатом блокады венозного оттока из печени и первичной вазодилятации.
Формирование ПГ. Развитие мощного дисбаланса вазоактивных веществ, вызывающего спазм синусоидов, а также способствующего активному фиброгенезу в печени, с формированием цирротических узлов, приводят к нарушению венозного русла печени и развитию ПГ.
Обратимость асцита определяется стадией ПГ. Асцит потенциально обратим, если имеется функциональная ПГ, и необратим, если произошли изменения сосудистого русла печени и сформировалась органическая ПГ [1, 11].
Функциональная (синусоидальная) ПГ определяется [19, 23, 38]:
Органическая ПГ формируется на фоне нарушения цитоархитектоники печени, она определяется [23]:
При этом важно отметить, что даже на этапе органической ПГ сохраняется ее функциональный компонент, который можно уменьшить, используя медикаментозную терапию, направленную на коррекцию состояния САС, РААС, реологию крови и другие патогенетические звенья.
Блокада венозного и лимфатического оттока от печени. Повышенное давление в портальной системе приводит к нарушению венозного оттока из печени и непарных органов брюшной полости, что сопровождается переполнением синусоидов, усилением продукции лимфы в печени.
У больных циррозом печени объем суточного лимфооттока через грудной лимфатический проток может увеличиваться до 20 литров. Лимфа из сосудов печени и непарных органов пропотевает в брюшную полость, формирует асцит, устанавливая динамическое равновесие с процессом всасывания ее в кишечные капилляры.
Таким образом, условно можно выделить несколько уровней формирования асцита, тесно взаимосвязанных между собой:
При этом обратимость указанных изменений зависит от стадии ПГ (функциональной или органической).
Классификация асцита
В зависимости от количества асцитической жидкости и эффективности терапии выделяют:
Критериями резистентного (рефрактерного) асцита являются отсутствие снижения или снижение массы тела менее 200 г/сут у больного в течение 7 дней на фоне низкосолевой диеты (5,2 г поваренной соли в сутки) и интенсивной диуретической терапии (спиронолактон по 400 мг/сут и фуросемид по 160 мг/сут), а также уменьшение экскреции натрия с мочой менее 78 ммоль в сутки [16, 25]. О резистентном асците говорят также в тех случаях, когда он не уменьшается или быстро рецидивирует после парацентеза или осложнения диуретической терапии не позволяют назначать диуретики в эффективных дозах. В практике критерии резистентного асцита выявляются менее чем у 10% пациентов с циррозом печени.
Причинами резистентного асцита, как правило, являются:
Многие причины рефрактерности асцита являются потенциально обратимыми, поэтому своевременное их устранение может значительно повысить эффективность проводимой терапии.
Лечение асцита у больных циррозом печени
Следует отметить, что сама по себе задача терапии асцита у больных циррозом печени труднее, чем лечение других форм накопления жидкости в организме, потому что формирование отечно-асцитического синдрома является проявлением значительной декомпенсации заболевания. По результатам контролируемых исследований появление асцита значительно ухудшает качество жизни и увеличивает риск развития фатальных осложнений цирроза печени [27, 39], поэтому его терапия представляет собой одну из важнейших составляющих успешного лечения этих больных. Однако, с учетом того, что в развитии асцита задействованы сложные нейрогормональные механизмы, бездумная дегидратация может вызвать лишь побочные эффекты и «рикошетную» задержку жидкости.
Режим, диета и потребление жидкости больными циррозом печени и асцитом. У пациентов с асцитом, не ограничивающих потребление соли с пищей, суточная экскреция натрия с мочой снижена до 78 ммоль и менее, при этом внепочечные потери натрия могут достигать 10 ммоль/сут.
Употребление больными циррозом печени натрия более 90 ммоль/сут ведет к развитию асцита, так как каждый грамм натрия задерживает до 200 мл жидкости. Поэтому с пищей в течение суток рекомендуется употреблять не более 90 ммоль натрия (5,2 г поваренной соли), в сочетании с ограничением до 1 литра в сутки количества жидкости. При этом важно учитывать, что ограничение жидкости не показано больным с низким содержанием Nа в сыворотке крови (менее 120 ммоль/л) [16].
На сегодняшний день не опубликовано исследований, которые демонстрировали бы положительное или отрицательное влияние ограничения воды на разрешение асцита. Большинство экспертов считают, что у больных с неосложненным асцитом роль ограничения воды отсутствует. Несмотря на это во многих центрах диета с ограничением воды у пациентов с асцитом и гипонатриемией стала стандартом клинической практики. В этом вопросе существует много противоречий, и лучший подход пока не найден. Как правило, гепатологи лечат таких больных со строгим ограничением воды. С точки зрения патогенеза гипонатриемии, такое лечение является алогичным и может ухудшить тяжесть центральной гиповолемии, которая запускает неосмотическую секрецию АДГ. Еще большее повышение концентрации циркулирующего АДГ ведет к дальнейшему снижению почечной функции. Нарушенный клиренс свободной воды имеют 25–60% пациентов с цирротическим асцитом, при этом у них часто развивается спонтанная гипонатриемия.
Погрешности в диете часто служат причиной плохо поддающегося лечению (резистентного, рефрактерного) асцита. При употреблении большого количества соли применение современных мочегонных препаратов даже в высоких дозах окажется неэффективным.
Диета должна быть по существу вегетарианской, так как большинство продуктов с высоким содержанием белка (мясо, яйца и молочные продукты) содержат много натрия, поэтому в связи с этим рацион нужно дополнять белковой пищей с низким содержанием натрия. Рекомендуется употреблять бессолевой хлеб, масло и все блюда готовить без добавления соли. Показаны также продукты, богатые калием и микроэлементами. Энергетическая ценность диеты должна составлять
1500–2000 ккал с содержанием 70 г белка и 90 ммоль натрия в сутки.
Пациенту с асцитом рекомендуется ограничение физической активности, что способствует уменьшению количества метаболитов, образующихся в печени. Также в положении лежа несколько усиливается портальный венозный и почечный кровоток.
Общие подходы к терапии асцита у больных циррозом печени. Стратегические направления терапии асцита включают ограничение соли в пище и медикаментозное выведение избыточной жидкости из организма. Кроме этого, исходя из рассмотренных позиций патогенеза асцита у больных циррозом печени, важно решить терапевтические задачи по коррекции ПГ, ПКН, блокированию периферических вазодилятаторов, подавлению активности САС и РААС, нормализации функции ССС, почек и т. д.
Для безопасного медикаментозного выведения жидкости из организма необходимо соблюдение трех этапов:
Для перевода избыточной жидкости из внеклеточного пространства в сосудистое русло используются:
Наиболее оптимальными бета-блокаторами у пациентов с заболеваниями печени, эффективность которых подтверждена результатами метаанализа, являются неселективные производные группы пропранолола — Анаприлин в индивидуально подобранной дозе — 40–80 мг/сут или карведилол в индивидуальной дозе — 25–50 мг/сут [3, 14, 28, 31].
Среди ИАПФ у больных циррозом печени препаратами выбора является группа лизиноприла в индивидуально подобранной (2,5–20 мг/сут) дозе или препарат с двойным путем выведения спираприл по 6 мг/сут.
В отличие от других представителей этого класса они являются готовой лекарственной формой, а их эффективность подтверждена результатами сравнительных исследований [11, 17].
Из АРА у данной категории пациентов может использоваться эпросартан в индивидуально подобранной дозе — 300–600 мг/сут. В открытых исследованиях продемонстрирована эффективность препаратов данной группы у больных циррозом печени [32, 40].
Для доставки избыточной жидкости к почкам применяют положительные инотропные средства:
Для улучшения почечной фильтрации рекомендованы:
Для блокады реабсорбции первичной мочи в почечных канальцах применяются собственно диуретики (преимущественно петлевые диуретики и антагонисты альдостерона).
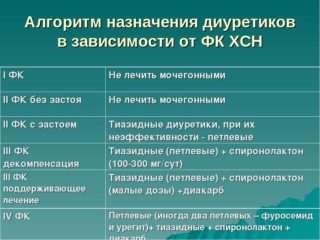
Диуретическая терапия больных циррозом печени с асцитом. Принимая во внимание сложный патогенез развития отечно-асцитического синдрома, при его терапии используют диуретики различных фармакологических групп: антагонисты рецепторов альдостерона, калийсберегающие, петлевые, тиазидные диуретики и ингибиторы карбоангидразы. Алгоритм назначения диуретиков больным циррозом печени представлен на схеме 1.
Действие диуретиков при циррозе печени и асците носит многогранный характер и состоит в их влиянии на почечные структуры и внепочечные механизмы регуляции водно-электролитного баланса [9, 10], включая воздействие на уровне:
Основным принципом разгрузочной терапии отечно-асцитического синдрома у больных циррозом печени является получение постепенно развивающегося и стабильного диуретического эффекта, при этом препаратом выбора является спиронолактон [15, 23].
В случаях рефрактерности к терапии антагонистами альдостерона перед назначением других диуретиков, действующих на иных участках нефрона, целесообразно оценить показания для использования дополнительных терапевтических мероприятий, в частности для введения альбумина и кровезамещающих коллоидных растворов.
При выраженном отечно-асцитическом синдроме объем диуретической терапии может быть расширен за счет петлевых или тиазидных диретиков, подавляющих реабсорбцию натрия и воды.
Рекомендуется комбинированное назначение калийвыводящих и калийсберегающих диуретиков, что способствует снижению риска возникновения электролитных нарушений [18, 21, 29].
Дозировку и частоту приема препарата подбирают индивидуально каждому больному. При поступлении пациента в стационар рекомендуется определить суточную экскрецию натрия, что облегчает подбор диуретика и контроль за эффектом лечения [16].
При начальных признаках асцита терапия начинается одним из препаратов группы калийсберегающих диуретиков, обычно спиронолактоном. В случае неэффективности добавляют петлевой диуретик.
Наличие признаков выраженного асцита требует изначального применения комбинированной терапии, при этом спиронолактон назначается в качестве надежного партнера петлевых диуретиков.
У больных циррозом печени с умеренной и выраженной ПГ возможно начало лечения курсами антагонистов альдостерона еще до формирования асцита в минимальных (25–50 мг/сут), не изменяющих диурез, дозировках в качестве нейрогуморального модулятора, однако данная точка зрения является авторской и не подтверждена широкими клиническими испытаниями.
При декомпенсации цирроза печени (в виде развития асцита) применение спиронолактона абсолютно необходимо и можно не бояться его сочетания с ИАПФ или АРА, если параллельно правильно использовать активные диуретики в достижении положительного диуреза. Препарат принимают в высоких дозах (100–300 мг, назначаемых однократно утром или в два приема утром и в обед) на период 1–3 недели до достижения компенсации. После этого доза спиронолактона должна быть уменьшена.
Нужно помнить, что концентрация спиронолактона в плазме крови выходит на плато к третьему дню лечения и после отмены (или уменьшения дозы препарата) его концентрация и действие пропадает (снижается) через трое суток. После достижения компенсации применение высоких доз спироналактона прекращается и рассматривается вопрос о назначении малых доз препарата в качестве дополнительного нейрогормонального модулятора.
Для длительной поддерживающей терапии больных циррозом печени рекомендуется использование малых (25–50 мг) доз спиронолактона дополнительно к ИАПФ и бета-адрено-блокаторам (БАБ), позволяющее более полно блокировать РААС и САС.
В случаях, когда необходима замена спиронолактона, препаратом выбора является амилорид по 10–15 мг/сут.
Оптимальное соотношение спиронолактона и фуросемида 5:2, например 100 мг спиронолактона и 40 мг фуросемида и т. д. Максимальные суточные дозы этих препаратов составляют 400 и 160 мг соответственно.
Фуросемид, в свою очередь, может быть неэффективен при выраженном гиперальдостеронизме, когда натрий, не реабсорбированный в петле Генле, всасывается в дистальном отделе нефрона. Вторая причина — гипокалиемия и алкалоз.
Альтернативными, в случаях неэффективности, фуросемиду петлевыми диуретиками для лечения асцита у больных циррозом печени могут рассматриваться: Урегит (этакриновая кислота) 25–50 мг/сут и буметанид, который не слабее фуросемида и применяется в дозах от 0,5 до 10 мг, что позволяет достичь оптимального диуреза.
Этакриновая кислота и тиазиды, как диуретики длительного действия, менее показаны больным циррозом печени, поскольку они способны усугублять развившиеся электролитные нарушения, и даже после их отмены могут продолжаться потеря калия с мочой и нарастание алкалоза.
Поэтому, в частности, тиазиды применяются преимущественно на этапе поддерживающей терапии и/или невозможности использовать спиронолактон. Принимая во внимания возможные побочные эффекты, тиазидные диуретики у больных циррозом печени назначают курсом не более 7–14 дней с перерывом на 3–4 дня.
Кроме вышеперечисленных, в 2006 году в России был зарегистрирован один из самых эффективных и безопасных петлевых диуретиков — торасемид (Диувер). Его стартовая доза составляет 5–10 мг, а при необходимости она может быть увеличена до 20 мг в сутки. Торасемид обладает не только более выраженным, чем фуросемид, мочегонным эффектом, но и имеет собственную активность в отношении рецепторов к альдостерону, что обеспечивает ему калийсберегающий эффект. Преимуществом является отсутствие нежелательных эффектов антагонистов альдостерона (гиперкалиемия, гирсутизм и другие), препарат обладает высокой биодоступностью (80% против 50% у фуросемида), пролонгированным эффектом (период полувыведения 3–5 часов против 1 часа у фуросемида) и мягким гипотензивным действием. Фармакокинетика торасемида мало зависит от функции почек и состояния кишечника, что обеспечивает низкий риск кумуляции препарата и меньшую, по сравнению с фуросемидом, экскрецию калия, кальция, неорганических фосфатов и магния.
При лечении отечно-асцитического синдрома у больных циррозом печени возможно использовать торасемид как в качестве монотерапии, так и в сочетании с Верошпироном. Терапия торасемидом показана при декомпенсации асцита, а также в целях профилактики его возникновения в дозировках 5–20 мг, не вызывающих гипокалиемии даже при длительном приеме. Рекомендуется использовать ступенчатый подход, начиная с 5 мг/сут, увеличивать дозу на 5 мг каждые 2–3 дня до достижения эффекта. На амбулаторном этапе не рекомендуется превышать суточную дозу 20 мг, так как большее количество препарата требует частого контроля уровня калия.
Для оценки эффективности мочегонной терапии у пациентов с циррозом печени и асцитом был проведен ряд сравнительных исследований торасемида и фуросемида. Так, в двойном слепом перекрестном исследовании были сопоставлены результаты однократного приема фуросемида (80 мг) и торасемида (20 мг) внутрь у 14 больных. Торасемид превосходил фуросемид по диуретической и натрийуретической активности. У 5 пациентов наблюдался слабый ответ на прием фуросемида, при этом торасемид вызвал значительное увеличение натрийуреза и диуреза [30, 33, 36].
Аналогично в двойном слепом рандомизированном исследовании у 28 пациентов с асцитом, получавших спиронолактон (200 мг/сут), были сопоставлены результаты 6-недельной терапии торасемидом (20 мг/сут) и фуросемидом (50 мг/сут). Оба препарата оказывали сопоставимое влияние на массу тела, диурез и экскрецию мочевой кислоты, натрия и хлоридов, однако в группе торасемида экскреция калия, кальция, неорганических фосфатов и магния была ниже [30, 33, 36].
В группе из 46 больных циррозом печени, осложнившимся асцитом (рандомизированное исследование), проводили лечение торасемидом 20 мг/сут или фуросемидом 40 мг/сут в сочетании со спиронолактоном 200 мг/сут. Если не удавалось добиться снижения массы тела на 300 г/сут, дозы диуретиков каждые 3 дня увеличивали до 40, 120 и 400 мг/сут соответственно. Торасемид вызывал более выраженное увеличение диуреза, чем фуросемид, хотя в целом результаты лечения в 2 группах оказались сопоставимыми. Увеличение доз диуретиков потребовалось у 2 больных группы торасемида и у 9 пациентов группы фуросемида [33, 36].
То есть по результатам исследований торасемид может рассматриваться как альтернатива комбинированной терапии Фуросемид + Верошпирон у больных циррозом печени и асцитом.
Ингибиторы карбоангидразы не нашли широкого применения у пациентов с асцитом, так как подавление ими реабсорбции натрия и воды в проксимальном канальце компенсируется усилением ее в дистально расположенных сегментах канальцев.
Препараты этой группы могут использоваться в качестве вспомогательного средства на фоне приема активных мочегонных (петлевых и/или тиазидных). Ингибиторы карбоангидразы блокируют фермент в области проксимальных почечных канальцев, что сопровождается незначительным диурезом (прирост до 10–15%), однако при этом усиливается «загрузка» натрием нижележащих отделов канальцев, что повышает эффективность более сильных диуретиков. При истощении фермента карбоангидразы через 3–4 дня непрерывного применения активность ацетазоламида падает, что требует перерыва в лечении.
Поэтому ацетазоламид (Диакарб) рекомендуется в дозе по 0,25 г трижды в день в течение 3–4 дней с двухнедельным перерывом. Данная терапевтическая тактика способствует подкислению среды, восстанавливает диуретическую активность тиазидных и петлевых диуретиков, при длительном применении которых развивается алкалоз. При сочетании с Эуфиллином мочегонный эффект Диакарба увеличивается.
Для избежания развития рефрактерности и побочного действия диуретиков на пациентов с асцитом важно оценивать эффективность лечения и проводить клинико-лабораторный скрининг с определением показаний для последующей коррекции режима дозирования или отмены препаратов.
Продолжение статьи читайте в следующем номере.
С. Н. Мехтиев, доктор медицинских наук, профессор
Ю. А. Кравчук, кандидат медицинских наук
И. В. Субботина
О. А. Мехтиева *
М. В. Шаповалов
ВМА им. С. М. Кирова, *СПб ГМА им. И. И. Мечникова, Санкт-Петербург
источник
В данной статье представлена тактика ведения пациентов с асцитом, отдельное внимание уделяется особенностям обследования данной группы пациентов, подробно освещаются вопросы лабораторной диагностики, методика и показания к диагностическому лапароцентезу, а также современные аспекты консервативной терапии с указанием наиболее частых осложнений и ошибок при ведении этих пациентов.
This paper introduces the tactics managing for patients with ascites, special attention is paid to the peculiarities of a survey of this group of patients, discussed in detail issues of laboratory diagnostic methods and indications for diagnostic laparocentesis, as well as modern aspects of conservative therapy with the most frequent complications and errors in managing these patients.
Асцит (от греческого «askos» — сумка, мешок) — это состояние, при котором наблюдается патологическое накопление жидкости в брюшной полости.
Фоном для развития асцита в 81,5% случаев являются заболевания печени (цирроз печени, острый алкогольный гепатит, цирроз-рак), в 10% — злокачественные опухоли, в 3% — застойная сердечная недостаточность, в 1,7% — туберкулезный перитонит. Более редкими причинами является нефротический синдром, острый панкреатит.
Осмотр пациента чрезвычайно информативен. Если жидкость в брюшной полости накопилась быстро, то кожа живота напряженная, блестящая, при пальпации может отмечаться диффузная болезненность. В случае постепенного накопления жидкости можно отметить расширение эпигастрального угла, нижние ребра перемещаются вперед и вверх, в силу чего грудная клетка расширяется. Повышение внутрибрюшного давления способствует возникновению пупочной, паховой, бедренной, послеоперационной грыжи. Наиболее выраженными бывают пупочная и пахово-мошоночная грыжи. Пациенту необходимо рекомендовать ношение корсета или бандажа. Необходимо тщательно осматривать кожу грыжевого мешка, так как она может истончаться. В нашей практике было 3 случая разрыва кожи грыжевого мешка с излитием асцитической жидкости. Чрезвычайно важно информировать пациентов с напряженным асцитом о возможной травматизации кожи выбухающего грыжевого мешка при надевании корсета, натуживании.
Перкуторно асцит выявляется при накоплении 1,5-2 л жидкости. При меньшем количестве жидкости тимпанический звук будет выявляться над всей поверхностью живота. При ненапряженном асците в вертикальном положении живот выглядит отвисшим, так как жидкость стекает вниз. Соответственно, при перкуссии живота стоя тимпанический звук отмечается в верхних отделах живота, притупление звука — в нижних. Если пациент лежит на спине, то содержащий воздух кишечник перемещается кверху, а жидкость смещается в задние части брюшной полости. Перкуторный звук будет тимпаническим над передней поверхностью живота и тупым над фланками (боками). Для того чтобы убедиться в наличии асцита, целесообразно перкутировать пациента в разных положениях: стоя, лежа на спине, а также на боках. При положении на правом боку тимпанический звук будет определяться над левым фланком, в положении на левом боку — над правым. Скопление жидкости в брюшной полости является самой частой, но не единственной причиной увеличения размера живота и растяжения его стенки. Также необходимо исключить беременность, растяжение кишечника газами, кисты (яичника, брыжейки, ретроперитонеальные), растяжение полых органов — желудка, мочевого пузыря и ожирение. Асцит в зависимости от количества асцитической жидкости подразделяют на минимальный (выявляется только при инструментальном ультразвуковом исследовании и компьютерной томографии брюшной полости), умеренный (легко выявляется при физикальном исследовании) и выраженный (при значительном увеличении размера живота).
К вторичным проявлениям асцита относятся:
• плевральный выпот, чаще правосторонний за счет движения перитонеальной жидкости вверх через диафрагмальные лимфатические сосуды, а также пропотевания асцитической жидкости через дефекты диафрагмы;
• высокое стояние диафрагмы, ведущее к развитию дисковидных ателектазов в нижних отделах легких и смещению сердца кверху;
• варикозное расширение геморроидальных вен;
• формирование диафрагмальной грыжи, нарастание пищеводного рефлюкса (объясняют механическими факторами в условиях повышения внутрибрюшного давления) усугубляют повреждение слизистой оболочки пищевода при наличии варикозного расширения вен.
При впервые выявленном асците, подозрении на инфицирование асцитической жидкости, злокачественную опухоль необходимо провести диагностический лапароцентез: извлечь небольшое количество асцитической жидкости (обычно 50-300 мл) для клинического, биохимического, бактериологического и цитологического исследования. Информативность анализа асцитической жидкости трудно переоценить.
Методика выполнения парацентеза и последующий уход за пациентом
Эвакуация асцитической жидкости (АЖ) осуществляется при помощи мягкого катетера, который входит в состав стерильного набора для выполнения парацентеза. Катетер вводится на 2 см ниже пупка по срединной линии тела либо на 2-4 см медиальнее и выше переднего верхнего отростка подвздошной кости (рис. 1). Для предотвращения последующего подтекания АЖ перед введением троакара кожа смещается вниз на 2 см.
Рисунок 1. Места введения катетера при выполнении парацентеза
Перед проведением парацентеза необходимо получить информированное согласие пациента на проведение процедуры.
Исследование асцитической жидкости начинают с визуальной оценки ее цвета: соломенно-желтый характерен для цирроза печени, нефротического синдрома, сердечной недостаточности; геморрагический — для канцероматоза, панкреатита; мутный — для перитонита, панкреатита, туберкулеза; молочно-белый — для хилезного асцита.
Исследование белка позволяет дифференцировать транссудат и экссудат: в транссудате белка менее 25 г/л (цирроз печени, гипоальбуминемия), в экссудате — более 30 г/л (малигнизация, воспаление). Общепринятым является подсчет градиента «сывороточный альбумин/альбумин асцитической жидкости» (SAAG), который позволяет предположить причину развития асцита, а также прогнозировать риск инфицирования асцитической жидкости. При SAAG менее 1,1 риск инфицирования возрастает в связи со снижением в асцитической жидкости содержания опсонинов.
SAAG более 1,1 выявляется при:
• острой печеночной недостаточности;
• метастатическом поражении печени;
• застойной печени при сердечной недостаточности;
SAAG менее 1,1 имеет место при:
• канцероматозе брюшины, мезотелиоме;
• спонтанном бактериальном перитоните;
Важным показателем является клеточный состав асцитической жидкости. Содержание более 250 нейтрофилов в 1 мм 3 свидетельствует об инфицировании жидкости. Любой бактериальный рост является патологическим. Важно помнить, что при посеве асцитической жидкости необходимо немедленно поместить ее в разные флаконы (по 10 мл), используемые для посева крови на анаэробную и аэробную флору. Информативность анализа при этом увеличивается до 90%.
Чрезвычайно важно цитологическое исследование, направленное на выявление атипичных клеток.
Повышенный уровень амилазы позволяет выявить панкреатогенный асцит. Увеличение триглицеридов более 5 ммоль/л свидетельствует о хилезном асците. При окраске жидкости в темно-желтый цвет необходимо определять в ней содержание билирубина: если в сыворотке крови оно меньше, чем в асцитической жидкости, это означает, что желчь поступает в брюшную полость.
Базисная терапия асцита состоит из нескольких этапов:
1. Лечение основного заболевания, приведшего к возникновению асцита.
2. Пациентам с выраженным асцитом рекомендуется постельный режим в первые 4-7 дней лечения. Постельный режим целесообразен, так как горизонтальное положение тела влияет на выработку ренин-ангиотензина и снижение тонуса симпатической нервной системы. Вертикальное положение способствует стимуляции симпатической нервной системы, уменьшению гломерулярной фильтрации и увеличению абсорбции натрия в канальцах, поэтому пациентам с выраженным асцитом в первые 4-7 дней лечения рекомендуется постельный режим.
3. Ограничение употребления соли. Каждый грамм натрия, принятый сверх меры, задерживает примерно 250-300 мл воды. При обнаружении сниженного уровня натрия в сыворотке крови не следует рекомендовать прием поваренной соли, так как общее содержание натрия в организме и так значительно повышено. Восполнять дефицит электролитов необходимо медикаментозно. При подозрении на то, что пациент не ограничивает суточного потребления соли, целесообразно определить суточную экскрецию натрия в моче. Если в сутки с мочой экскретируется больше натрия, чем предписано пациенту, это свидетельствует о несоблюдении рекомендаций.
4. Ограничение употребления жидкости до 750-1000 мл/сут при отсутствии лихорадки.
5. Диуретическая терапия. Применение диуретиков приводит к уменьшению объема плазмы, который восполняется, поскольку жидкость переходит из интерстициальной ткани (периферические отеки) и брюшной полости (асцит) в кровяное русло. Для лечения асцита наиболее часто применяют петлевые (фуросемид, этакриновая кислота) и калийсберегающие (спиронолактон, триамтерен) диуретики. Препаратом первой линии является спиронолактон (верошпирон), в случае недостаточности эффекта от которого назначаются петлевые диуретики. Подбор дозы диуретиков основывается на выраженности асцита и контролируется диурезом, уровнем электролитов. Больной должен быть ориентирован на ежедневный подсчет диуреза и взвешивание, что позволяет контролировать достаточность диуретической терапии. Мочегонная терапия считается достаточной, если превышение выделяемой жидкости над потребляемой составляет не более 500 мл для больных без периферических отеков и 800-1000 мл для больных с периферическими отеками. Контролировать эффективность мочегонной терапии целесообразно также при взвешивании пациента (снижение массы тела за 1 неделю должно составлять 2,5-3 кг) и измерении окружности талии. Контролировать уровень электролитов в сыворотке крови необходимо не реже 2 раз в неделю.
6. Динамический контроль эффективности диуретической терапии. Если состояние пациента стабильно, то он может измерять диурез 2-3 раза в неделю при ежедневном взвешивании. Целесообразна беседа лечащего врача с родственниками больного для разъяснения важности измерения диуреза и взвешивания, так как в силу наличия у пациентов энцефалопатии он может предоставлять врачу недостоверную информацию. Родственники должны быть предупреждены о том, что I стадия печеночной энцефалопатии может сопровождаться эйфорией, в силу чего пациент считает себя выздоровевшим и отказывается от назначенной терапии.
При малом и умеренном асците (у пациентов с циррозом печени классы А и В по Чайлду-Пью) ограничивают потребление соли до 2 г/сут и суточное потребление жидкости до 1 л, если содержание натрия в сыворотке крови не превышает 130 мэкв/л. Базовой терапией является спиронолактон (верошпирон) — 75-100 мг/сут. При необходимости дозу спиронолактона увеличивают по 100 мг каждые 4-5 дней до максимальной, которая составляет 300 мг/сут. Достаточно часто при умеренном асците (класс В) назначают комбинацию спиронолактона и фуросемида (примерное соотношение: на 100 мг спиронолактона 40 мг фуросемида). При сохранении асцита целесообразна госпитализация.
При выраженном асците (у пациентов с циррозом печени класс С по Чайлду-Пью) больные должны лечиться стационарно. В первые дни назначают бессолевую диету. Комбинируется терапия спиронолактоном и фуросемидом. Сохранение небольшого количества асцитической жидкости оправданно, поскольку реже нарушается функция почек.
7. Оценка эффективности диуретической терапии. В случае эффективности проводимой терапии при осмотре больного отмечается:
• уменьшение размера живота при измерении окружности талии;
• уменьшение периферических отеков;
• уменьшение выраженности печеночной энцефалопатии (тест связи чисел);
• положительный суточный диурез;
• уменьшение суточной экскреция натрия с мочой.
Рефрактерным называется персистирующий, несмотря на адекватное лечение, асцит. В этом случае ограничение приема натрия и назначение высоких доз диуретиков (400 мг/сут спиронолактона и 160 мг/сут фуросемида в течение 1-4 нед.) не приводят к эффективному диурезу, уменьшению массы тела, разрешению асцита. Диагностические критерии резистентного асцита указаны в таблице 1.
Диагностические критерии резистентного асцита (Moore K.P.)
| 1. Длительность лечения: интенсивная терапия мочегонными препаратами (максимальные дозировки: антагонисты альдостерона 400 мг/сут, фуросемид 160 мг/сут) в течение 1 недели при соблюдении диеты с содержанием соли до 5,2 г/сут2. Отсутствие ответа на лечение: снижение массы тела менее 0,8 кг каждые 4 дня 3. Ранний рецидив асцита: возврат асцита 2-3-й степени в течение 4 недель от начала лечения 4. Осложнения, связанные с приемом диуретических препаратов:
|
Причины возникновения рефрактерного асцита:
• слишком большое поступление натрия (с пищей, лекарствами);
• отсутствие ограничения приема жидкости при гипонатриемии;
• нарушение функции почек (с осторожностью необходимо применять нестероидные противовоспалительные препараты, аспирин, аминогликозиды, метоклопрамид).
Если развитие осложнений диуретической терапии не позволяет увеличивать дозу диуретиков, то возможно проведение гипербарической оксигенации, а в случае неэффективности — лечебного лапароцентеза.
Показаниями для лечебного лапароцентеза являются:
В этом случае одномоментно эвакуируют 4-6 л асцитической жидкости с последующим введением 20%-ного раствора альбумина из расчета 25 мл на 1 л удаленной жидкости для поддержания эффективного внутрисосудистого объема. Введение альбумина является обязательным и предупреждает развитие гепаторенального синдрома и гиповолемии. Необходимо помнить, что удаление большого количества асцитической жидкости приводит к значительному усугублению печеночной энцефалопатии.
При формировании правостороннего гидроторакса на фоне асцита торакоцентез показан с диагностической целью или при критическом накоплении уровня жидкости. Рефрактерный асцит часто формируется при злокачественных опухолях, поражающих органы брюшной полости и малого таза, и требует повторных лапароцентезов.
Осложнения диуретической терапии:
• энцефалопатия (в 25% случаев);
• электролитные нарушения (в 38-41% случаев);
• гепаторенальный синдром (ГРС).
Наиболее частыми осложнениями диуретической терапии являются электролитные нарушения, прогрессирование печеночной энцефалопатии, развитие гепаторенального синдрома (ГРС). Повышенное выделение калия, натрия и хлоридов при назначении диуретиков в больших дозах и избыточном диурезе может приводить к метаболическому алкалозу и усугублению респираторного алкалоза. Гипокалиемия приводит к уменьшению выделения аммиака почками. В условиях метаболического алкалоза повышается содержание в плазме свободного аммиака и облегчается его проникновение в клетки центральной нервной системы, что усугубляет энцефалопатию. Необходимо отменить салуретики и назначить заместительную терапию 3%-ным раствором калия в дозе 60-80 ммоль (4-6 г хлорида калия) в течение 4-6 дней. Кроме того, назначают терапию печеночной энцефалопатии.
Однако необходимо помнить о возможном развитии гиперкалиемии, которая манифестирует нарастанием слабости, признаками сердечной недостаточности, аритмиями. На электрокардиограмме выявляются высокий остроконечный зубец Т, расширение комплекса QRS, удлинение интервала QT.
Уменьшение суточного диуреза, нарастание уровня креатинина и мочевины могут быть обусловлены развитием ГРС, что требует прекращения лечения диуретиками. Если уровень мочевины превышает 10 мг/100 мл, а кретинин сыворотки более 0,5 мг/100 мл, то диуретики должны быть отменены, хотя бы временно.
ГРС — нарушение функции почек вследствие дилатации артерий и рефлекторной активации эндогенных вазоконстрикторных факторов, приводящих к снижению скорости клубочковой фильтрации.
ГРС 1-го типа — быстропрогрессирующее (менее чем за 2 нед) повышение (в 2 раза) исходного уровня креатинина крови или уменьшение на 50% от исходного суточного клиренса креатинина. При ГРС 2-го типа почечная недостаточность развивается постепенно. Лечение заключается во введении раствора альбумина и вазоконстрикторов (терлипрессин).
Неоднократное удаление большого количества асцитической жидкости приводит к снижению в ней концентрации белка и теоретически может предрасполагать к развитию спонтанного бактериального перитонита (СБП) — самопроизвольного инфицирования асцитической жидкости при отсутствии интраабдоминальных причин инфекции.
Диагноз СБП может подтверждаться при лапароцентезе:
• число нейтрофилов 250 в 1 мм 3 ;
• посев асцитической жидкости позволяет определить спектр патогенной флоры;
Отсутствие роста возбудителей в асцитической жидкости нейтрофилов 250 в 1 мм 3 свидетельствует о культуро-негативной форме СБП.
Для лечения СБП назначают цефалоспорины III поколения, фторхинолоны, амоксациллин и клавулановую кислоту.
Ведение пациента с асцитом является чрезвычайно непростой задачей, с которой сталкивается терапевт в своей ежедневной практике, и требует особого внимания лечащего врача и хорошей теоретической подготовки.
Пациенту с асцитом необходима срочная госпитализация, если асцит:
• осложняется гепаторенальным синдромом или СБП.
Наиболее типичными ошибками при ведении пациента с асцитом являются:
• интенсивная диуретическая терапия;
• форсированные лечебные лапароцентезы без адекватной заместительной терапии;
• недооценка значимости вторичной бактериальной инфекции в формировании СБП.
Таким образом, ведение пациентов с асцитом суммарно можно представить в виде следующей схемы (рис. 2).
Рисунок 2. Принципы терапии больных с асцитом 2-й и 3-й степени (по CаrdenasА.)
Казанская государственная медицинская академия
Галеева Зарина Мунировна — кандидат медицинских наук, ассистент кафедры терапии
1. Болезни печени и желчевыводящих путей. Руководство для врачей под редакцией В.Т. Ивашкина. М.: Издательский дом «М-Вести», 2002.
2. Буеверов А.О. Инфекционные осложнения цирроза печени // Русский медицинский журнал, 2008. — Т. 6. — № 19. — С. 15-19.
3. Ерамишанцев А.К., В.М. Лебезев, Р.А. Мусин. Хирургическое лечение резистентного асцита у больных с портальной гипертензией // Хирургия, 2003. — № 4. — С. 4-9.
4. Федосьина Е.А. Особенности течения заболевания и прогноз жизни больных циррозом печени с асцитом // Диссертация на соискание ученой степени кандидата медицинских наук. — Москва, 2006.
источник


