Асцит является одним из осложнений портальной гипертензии различного генеза. Риск развития асцита у пациента с циррозом печени составляет 60 % в течение 10 лет после установления диагноза при отсутствии этиотропного лечения. Появление асцита свидетельствует о декомпенсации заболевания и ухудшении его прогноза: выживаемость пациентов с циррозом печени в течение первого года от момента появления асцита составляет 45-82 %, в течение 5 лет — менее 50 % без трансплантации печени. Связано зто с усугублением гемодинамических нарушений, лежащих в основе развития других осложнений цирроза — синдрома гипо- патриемии, гепаторенального синдрома, спонтанного бактериального перитонита, влияющих на прогноз заболевания.
Портокавальный градиент давления крови в норме составляет 2-6 мм рт. ст. При повышении его до 10 мм рт. ст. появляется клинически значимая портальная гипертензия, формируются портосистемные анастомозы. При давлении более 12 мм рт. ст. отмечаются кровотечения из ВРВП.
Сообщение между портальным и системным кровотоком осуществляется через коронарные и короткие вены желудка, интеркостальные, пищеводные и v. azygos, геморроидальные воны, а также ретроперитоиеалыю (между селезеночной и левыми надпочечниковой и почечной венами; соединения с венами желудка, кишечника, селезенки и печени).
Нарушение архитектоники печени, разрастание соединительной ткани, появление узлов регенерации сопровождается сдавлением мелких венул, деформацией портальной системы и частичной облитерации венул. Формируются артериоловенозные анастомозы, через которые артериальная кровь попадает в воротную вену и наоборот. Повышение давления в воротной вене способствует развитию венозных коллатералей, через которые венозная кровь из портальной системы попадает в системный кровоток.
Ш унтировапие крови способствует не только сбросу токсинов в системный кровоток, но и развитию бактериемии, перитонита, сепсиса и других инфекционных осложнений, является одним из наиболее значимых факторов формирования энцефалопатии, дистрофических изменений различных органов.
Различают три формы портальной гипертензии: внутрипече- ночную, внепеченочную и смешанную.
Для дифференциальной диагностики следует учитывать различные причины портальной гипертензии:
- 1) предпеченочиая:
- ? тромбоз селезеночной вены;
- ? тромбоз воротной вены;
- ? кавериоматоз воротной вены;
- 2) внутрипеченочная:
- ? цирроз печени;
- ? тяжелый острый или хронический гепатит;
- ? гепатоцеллюлярпый рак;
- ? вепоокклюзиопная болезнь;
- ? конгенитальный фиброз печени;
- ? поликистоз печени;
- ? амилоидоз печени;
- ? острая жировая печень беременных;
- ? болезнь Rendu-Osler;
- ? туберкулез;
- ? заболевания крови;
- 3) постпеченочная:
- ? синдром Бадда-Киари;
- ? врожденная аномалия и тромбоз нижней полой вены;
- ? констриктивный перикардит;
- ? недостаточность трикуспидального клапана;
- 4) прочие причины: артериовенозные фистулы (селезеночная, аорто-мезеитериальная, аорто-портальная и печеночная артерио- портальная).
Портальная гипертензия при циррозе печени является результатом повышения внутрипеченочпого сопротивления и увеличения портального кровотока.
Повышение внутрипеченочпого сопротивления связано со сдавлением печеночных вен регенераторными узлами, перивенулярным и перисииусоидальным отложением коллагена, отеком гепатоци- тов. Клинические проявления портальной гипертензии связаны с формированием коллатералей в нескольких регионах:
- ? желудок, пищевод, прямая кишка;
- ? умбиликальные и параумбиликальпые вены;
- ? ретроперитонеальиые коллатерали между селезеночной веной и левыми надпочечниковой и почечной венами;
- ? ретроперитонеальиые соединения с венами желудка, кишечника, селезенки и печени.
Клинические проявления зависят от уровня блокады, однако при всех формах портальной гипертензии имеются и общие симптомы:
- ? диспептические расстройства (снижение аппетита, тошнота, метеоризм);
- ? слабость, быстрая утомляемость;
- ? чувство тяжести или боли в левом и правом подреберьях, желтуха, похудение;
- ? гепатосплепомегалия;
- ? синдром гиперспленизма — анемия, лейкопения и тромбо- цитопеиия, обусловленные повышенным разрушением и частичным депонированием форменных элементов крови в селезенке;
- ? асцит развивается при виутрипечеиочной и иадпечеиочпой портальной гипертензии, в последнем случае он является основным и ранним симптомом, отличается упорным течением, плохо поддается лечению; при внепечепочной портальной гипертензии асцит часто по возникает или присоединяется на поздних стадиях процесса;
- ? расширение портокавальных анастомозов и активизация коллатерального кровообращения по венам пищевода, кардиальной части желудка, передней брюшной стенки, прямой кишки (варикозное расширение вен пищевода, желудка, геморроидальных вен, околопупочпых вей).
Диагноз портальной гипертензии и ее форм устанавливают на основании:
- ? клинической картины;
- ? комплекса инструментальных исследований, основным из которых является рентгенографическое (кавография, мезеитерико- графия, аортография, сплепопортография, целиакография). Наиболее информативна в отношении уровня блокады и состояния сосудов спленопортография. При внепечеиочном блоке она позволяет выявить различные нарушения проходимости сосудистого русла вплоть до полного прекращения кровообращения, определить место блока, а также возможность наложения спленоренального анастомоза. При внутрипечеиочном блоке характерно контрастирование лишь основных стволов воротной вены при обеднении сосудистого рисунка печени. О надпеченочной портальной гипертензии наибольшую информацию получают при кавографии;
- ? измерения давления в системе воротной вены с помощью чрескожной спленоманометрии. При портальной гипертензии давление в селезенке может достигать 51 Па (500 мм вод. ст.), в то время как в норме оно не превышает 12,2 Па (120 мм вод. ст.);
- ? ЭГДС: расширение вен пищевода и желудка;
- ? ректоромапоскопии: расширение геморроидальных вен;
- ? УЗИ органов брюшной полости, допплерографического исследования сосудов портальной системы, пункционной биопсии печени, КТ, МРТ, лапароскопии, при необходимости — лапаротомии.
источник
Синдром портальной гипертензии не является самостоятельным заболеванием. Характеризуется рядом специфических клинических проявлений и встречается при некоторых внутренних болезнях. При этом в основе происходящих в организме изменений лежит повышение давления в системе воротной вены. В соответствии с уровнем препятствия для оттока крови по системе воротной вены и характером патологического процесса, вызвавшего это препятствие, различают четыре основные формы синдрома портальной гипертензии: предпеченочную (допеченочную), внутрипеченочную, надпеченочную и смешанную.
ФОРМЫ СИНДРОМА ПОРТАЛЬНОЙ ГИПЕРТЕНЗИИ:
Предпеченочная форма синдрома обусловлена врожденными аномалиями развития воротной вены и ее тромбозом. Врожденные аномалии развития воротной вены: врожденное отсутствие (аплазия, гипоплазия, атрезия, заращение просвета вены на всем протяжении или на каком-либо сегменте). Атрезия воротной вены связана с распространением на воротную вену нормального процесса облитерации, происходящего в пупочной вене и аранциевом протоке. Тромбоз воротной вены наблюдается при септических процессах (гнойных процессах в органах брюшной полости, сепсисе, септикопиемии, пупочном сепсисе) в результате ее сдавления воспалительным, опухолевидным инфильтратом, кистами и др.
Внутрипеченочная форма синдрома портальной гипертензии у подавляющего большинства больных связана с циррозом печени. Реже причиной блока могут быть очаговые склеротические рубцовые процессы в ткани печени. Около 80% больных с синдромом портальной гипертензии имеют внутрипеченочную форму блока.
Надпеченочная форма обусловлена затруднением оттока крови из печеночных вен. Причиной затруднения оттока крови из печени может быть эндофлебит печеночных вен с их частичной или полной непроходимостью (болезнь Киари). Выделяют также синдром Бадда-Киари, при котором надпеченочная форма портальной гипертензии связана с тромботической окклюзией полой вены на уровне печеночных вен или несколько проксимальнее. Одна из причин — аномалии развития нижней полой вены. Затруднение оттока крови из печени может быть связано также с констриктивным перикардитом, недостаточностью трикуспидального клапана, со сдавлением нижней полой вены извне (опухоли, кисты etc.).
Смешанная, или комбинированная форма синдрома портальной гипертензии связана с развитием тромбоза воротной вены у больных с циррозом печени.
КОМПЕНСАТОРНЫЕ ПРОЦЕССЫ:
При портальной гипертензии вследствие резкого повышения гидростатического давления в системе воротной вены до 350-450 мм. вод. ст. и выш (при норме 200 мм. вод. ст.) отток крови происходит через естественные портокавальные анастомозы.
Выделяют три группы портокавальных анастомозов.
1. Анастомозы в области кардиального отдела желудка и абдоминального отдела пищевода. Кровь из воротной вены попадает через венозные сплетения указанных органов по непарной вене в нижнюю полую вену. При варикозном расширении вен пищевода могут возникать кровотечения из них. Возникновению кровотечения способствуют изъязвления стенки, связанные с рефлюкс-эзофагитом.
2. Анастомозы между верхними, средними и нижними прямокишечными (ректальными) венами. При это кровь из верхних прямокишечных вен, относящихся к портальной системе, по системе анастомозов попадает во внутренние подвздошные вены и далее в нижнюю полую вену. При расширении вен подслизистого сплетения прямой кишки на фоне портальной гипертензии могут возникать довольно обильные ректальные кровотечения.
3. Анастомозы между околопупочными венами и пупочной (при ее незаращении), сбрасывающие кровь из воротной вены через пупочную и далее в вены передней брюшной стенки, откуда кровь оттекает как в нижнюю, так и верхнюю полую вену. При выраженном расширении этой группы портокавальных анастомозов можно отметить своеобразный рисунок извитых расширенных подкожных вен передней брюшной стенки, обозначаемый термином «голова медузы».
КЛИНИКА.Клинические проявления различных форм портальной гипертензии связаны прежде всего с тем первичным заболеванием, которое послужило причиной повышения давления в воротной вене. Это необходимо учитывать при расспросе больного и анализе клинической картины заболевания, когда возникли уже грозные осложнения портальной гипертензии — кровотечение, тромбоз воротной вены etc.
Для портальной гипертнезии характерны следующие симптомы и синдромы: спленомегалия, варикозное расширение вен пищевода и желудка, кровотечение из них, а также из геморроидальных вен, асцит, диспепсические явления (боли в эпигастральной области, отсутствие аппетита, тошнота, запоры), печеночные знаки («сосудистые звездочки», «печеночные ладони» etc.), гиперспленизм (тромбоцитопения, лейкопения, реже — анемия), нарушения свертывающей системы крови в сторону гипокоагуляции.
При предпеченочной форме синдрома заболевание возникает чаще в детском возрасте, протекает относительно благоприятно. Макроскопически у некоторых больных воротная вена замещена множеством мелких расширенных вен (кавернома). Наиболее частые проявления заболевания: кровотечения из вен пищевода (которые иногда являются первым симптомом заболевания), спленомегалия, гиперспленизм, тромбоз воротной вены.
При внутрипеченочной форме портальной гипертензии ведущими в клинике являются симптомы цирроза печени. Характер течения заболевания зависит от природы цирроза печени (постнекротический, алкогольный etc.), активности процесса, степени компенсации нарушенных функций печени. Портальная гипертензия проявляется у этих больных геморрагическими осложнениями, спленомегалией, расширением вен передней брюшной стенки, асцитом. Грозным осложнением является кровотечение из вен пищевода и желудка. При этом возникает срыгивание или рвота неизмененной кровью без предшествующих каких-либо болевых ощущений в эпигастральной области. При затекании крови в желудок, при массивном кровотечении можно наблюдать рвоту измененной кровью цвета кофейной гущи, мелену. Быстро возникают симптомы постгеморрагической анемии. Летальность при первом кровотечении из вен пищевода при циррозе высока — 30% и более. Повторные кровотечения, асцит, желтуха (за счет поражения паренхимы печени) — признаки запущенной стадии цирроза печени, что оставляет мало шансов на успех медикаментозного или хирургического лечения синдрома портальной гипертензии при этом заболевании.
Надпеченочная форма синдрома портальной гипертензии чаще обусловлена болезнью Киари или синдромом Бадда-Киари. При острой форме развития болезни внезапно возникают довольно сильные боли в эпигастральной области, правом подреберье, интенсивно нарастает гепатомегалия, гипертермия, асцит. Смерть больных наступает в результате профузных кровотечений из вен пищевода или от печеночно-почечной недостаточности.
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
источник
Портальная гипертензия (ПГ) — повышение давления в системе воротной вены, вызванное нарушением кровотока различного происхождения и локализации (в портальных сосудах, печеночных венах и нижней полой вене).
Основными причинами портальной гипертензии являются следующие:
— механическое препятствие оттоку крови,
— увеличение кровотока в портальных венах,
— увеличение резистентности портальных сосудов,
— образование коллатералей между бассейном воротной вены и системным кровотоком.
Клинически значимые последствия ПГ в основном зависят от развития коллатерального кровообращения. Определяющее значение имеют следующие коллатерали: а) в области кардиального отдела желудка, где левая, задняя и короткие желудочные вены портальной системы анастомозируют с межреберными, диафрагмально-пищеводными и v.аzуgоs minor венами кавальной системы, ток крови по этим сосудам ведет к развитию варикоза в подслизистом слое нижнего отдела пищевода и дна желудка; б) верхняя геморроидальная вена портальной системы анастомозирует со средней и нижней геморроидальными венами кавальной системы, что ведет к развитию ректального варикоза; в) коллатеральный ток через околопупочные вены; г) ток портальной крови непосредственно в левую почечную вену.
В соответствии с локализацией препятствия току крови выделяют следующие формы портальной гипертензии: предпеченочная (подпеченочная) — препятствие локализуется в стволе воротной вены или ее крупных ветвях;
внутрипеченочная – препятствие на уровне внутрипеченочных разветвлений воротной вены, т.е. в самой печени; в зависимости от отношения места блокирования к печеночным синусоидам подразделяется на постсинусоидальную, синусоидальную и пресинусоидальную;
постпеченочная (надпеченочная) – нарушение оттока крови на уровне внеорганных (внепеченочных) стволов печеночных вен или в нижней полой вене проксимальнее места впадения в нее;
смешанная — нарушение кровотока как в самой печени, так и во внепеченочных отделах воротной или печеночных вен.
Основными причинами предпеченочной портальной гипертензии являются увеличение портального венозного кровотока (артериовенозная фистула, спленомегалия, не связанная с заболеваниями печени, каверноматоз воротной вены) и тромбоз или окклюзия портальных или селезеночных вен. К внутрипеченочной портальной гипертензии могут привести как острые (алкогольный гепатит, вирусный гепатит), так и хронические заболевания печени (гепатит, цирроз, саркоидоз), заболевания печеночных вен, нижней полой вены (тромбоз, дефекты развития, опухолевое сдавление) и патология сердца (кардиомиопатия, пороки сердца с поражением клапанов, констриктивный перикардит).
Основные патогенетические факторы синдрома ПГ: 1) механическое препятствие оттоку крови — (обусловлено тромбозом, облитерацией или давлением извне крупных сосудов — воротной вены, печеночных вен); 2) увеличение кровотока в портальных венах (может быть обусловлено затруднением оттока крови из печени по печеночным венам, наличием артерио-венозныхфистул, циррозом печени, миелопролиферативными болезнями и т.д.); 3) увеличение резистентности ( сопротивления) портальных сосудов (обусловлено наличием узлов регенерации, сдавливающие печеночные и портальные вены, а также образованием коллагена вокруг синусоидов, терминальных печеночных венул, нарушением архитектоники печени); 4) образованием коллатералей между бассейном воротной вены и системным кровотоком, являющихся следствием ПГ: при предпечоночной ПГ развиваются портно-портальные анастамозы; при внутрипеченочной и подпечночной ПГ — порто-кавальные; большое значение имеют анастомозы в области кардиального отдела желудка и пищевода, так как кровотечения из этих вен
считаются тяжелым осложением синдрома ПГ; 5) развитие асцита, важнейшего сипмтома ПГ, обусловлено а) повышением лимфопродукции в печени в связи с блокадой оттока венозной крови из печени, б) падением коллоидно-осмотического давления плазмы крови, что связано с нарушением (снижением) синтеза белка в печени, и это способствует выходу воды во внесосудистое пространство, в) повышение активности ренин-ангиотензин-альдостероновой системы, г) нарушение функции почек (снижение почечного кровотока, клубочковой фильтрации, усиление реабсорбции натрия в связи с снарушением венозного оттока от почек иои снижением притока крови к почкам), д) повышение содержания в крови эстрогенов в связи с уменьшением их разрушения в печени (эстрогены обладают антидиуретическим эффектом); 6) спленомегалия — следствие ПГ (обусловлена застойными явлениями, разрастанием в селезенке соединительнойткани и гиперплазией клеток ретикулогистиоцитарной системы; 7) печеночная (порто-системная) энцефалопатия, обусловленная ПГ с развитием порто-кавальных анастомозом.
Клиника. Наиболее ранние симтпомы: метеоризм («ветер перед дождем»), чувство переполнения кишечника, тошнота, боли по всему животу, снижение аппетита; жалобы на увеличение живота, тяжесть в подреберьях, одышку, раздражительность, плохой сон, повышенную утомляемость.
При осмотре, как правило, определяются признаки «плохого питания» — минимально выраженная подкожная клетчатка, сухая кожа, атрофия мускулатуры; расширение вен брюшной стенки, просвечивающих сквозь кожу в области пупка и в боковых частях живота; асцит (при прогрессировании ПГ, более характерен для внутрипеченочной формы), отеки на ногах, кровотечения из варикозно расширенных вен пищевода и желудка, прямой кишки, возможны носовые кровотечения. Пальпаторно гепато- и спленомегалия (в зависимости от причины и характера заболевания, вызвавшего ПГ) — печень плотная, болезненная, край ее острый, при циррозе печени она бугристая, прощупываются узлы регенерации; увеличение cелезенки часто cопровождается развитием гиперспленизма (синдром панцитопении: анемия, лейкопения,тромбоцитопения); при длительно существующей и выраженной ПГ развивается портальная энцефалопатая: головные боли, головокружение, снижение памяти, нарушение алгоритма сна (бессоница ночью, сонливость днем), галлюцинации, бред, неадекватное поведение, неврологические проявления поражения ЦНС.
Дополнительные методы. Для исследования портальной венозной системы используют: цветное допплер-УЗ-сканирование (оптимальный неинвазивный метод, позволяющий визуализировать портосистемные шунты и направление в них тока крови); двойное допплеровское сканирование, которое дает возможность измерить портальный ток крови; КТ, МРТ, венографию, селезеночную венографию (контрастное вещество вводится в пульпу селезенки, быстро абсорбируется и попадает в селезеночную и портальную вены), транспеченочную портографию (высокоинформативный, но технически трудный метод с высоким риском развития осложнений).
Измерение портального венозного давления. Оптимальным методом является введение балонного катетера через бедренную или югулярную вены в одну из мелких печеночных вен до упора, что отражает давление, практически соответствующее портальному. Пока кончик катетера свободно лежит в вене, измеряют «свободное» венозное давление, после расширения баллона («заклинивания») — заклиненное венозное давление. Разность между заклиненным и свободным венозным давлением называется градиентом печеночного венозного давления и отражает величину синусоидального давления. Нормальный градиент — 5-6 мм рт. ст., повышение градиента до 12 мм рт. ст. и выше предполагает развитие варикоза коллатералей и соответственно кровотечения. Итак, УЗИ для определения признаков ПГ, сплено-, гепато-, портоманометрия (первая и последняя заканчивается спленопортографией и портогепатографией), гепатовенография и кавография (имеют значение в диагностике синдрома Бадда-Киари), эзофаго- и гастроскопия (диагностируют варикозно расширенные вены пищевода и желудка в 70% случаев), эзофагография (выявление варикозно расширенных венозных узлов пищевода с помощью рентгеноскопии и рентгенографии), ректороманоскопия ( обнаруживает варикозно расширенные вены при развитии коллатералей по мезентерикогеморроидальному пути), селективная артериография (целикография и др.), рентгенография брошной полости (способствует регистрации асцита, гепато- и спленомегалии, кальцификации печеночной и селезеночной артерий, кальцификатов в основном стволе или ветвях воротной вены.
Принципы лечения. Основное направление: предупреждение и лечение ЖКК преимущественно из варикозно расширенных вен пищевода и желудка. Для их профилактики используются пролонгированные нитраты и бета-блокаторы. Профилактическая склеротерапия вен пищевода не рекомендуется. При развитии острого кровотечения необходима совместная деятельность терапевта и хирурга. Кровопотерю возмещают внутривенной инфузией жидкостей, введением вазоактивных лекарств (вазопрессин в комбинации с нитроглицерином, сандостатин или его синтетический аналог октреотид), может потребоваться введение Н2-блокаторов гистамина. К неотложным методам лечения пищеводных кровотечений относится склерозирование и эндоскопическое лигирование варикозно-расширенных вен пищевода. Для снижения портального давления и профилактики кровотечений выполняют портосистемное шунтирование (портокавальные, селективные спленоренальные анастомозы) и трансюгулярный внутрипеченочный портосистемный шунт. Больным ЦП с выраженной печеночной недостаточностью и ЖКК показана трансплантация печени.
Асцит — скопление свободной жидкости в брюшной полости. Существует 3 гипотезы формирования асцита. Первая — гипотеза недонаполнения предполагает уменьшение эффективного объема артериальной крови из-за дренирования жидкости в интерстициальное пространство; ренальную задержку натрия и воды при участии ренин-ангиотензии-альдостероновой системы, симпатической регуляции, повышенного уровня простагландина Е2. Роль предсердного натрийуретического пептида незначительна. Согласно второй -гипотезы переполнения асцит возникает из-за первичной задержки почками натрия с последующим увеличением объема плазмы и избытком жидкости во внесосудистом пространстве. Увеличение внутрисинусоидального давления стимулирует образование лимфы, что является дополнительным фактором формирования асцита. Третья гипотеза основана на периферической артериальной дилатации: эффективный артериальный объем крови уменьшается вследствие расширения периферических артерий, что ведет к повышению уровней ренина, альдостерона, вазопрессина, симпатической стимуляции, задержке натрия и воды, ренальной вазоконстрикции, увеличению объема плазмы, а в сочетании с ПГ — к развитию асцита. Из вазодилататоров в данном случае значимы оксид азота и субстанция Р.
Клиническая картина. Асцит может развиваться постепенно, в течение месяцев, или появиться внезапно как следствие печеночно-клеточной недостаточности из-за остро развившихся клинических ситуаций (геморрагии, тяжелых инфекций, злоупотребления алкоголем и т.д.). Вследствие резкого увеличения размеров брюшной полости субъективно возможно ощущение диспепсии. Пациенты имеют болезненный вид, обезвожены, уменьшено потоотделение. Характерны тонкие конечности и выпирающий живот. Вокруг пупка часто видны радиально расположенные расширенные подкожные вены брюшной стенки (портосистемные коллатерали), сохраняющиеся даже при хорошем контроле асцита. Коллатерали нижней полой вены развиваются вторично и идут от паховой области к краям реберных дуг (исчезают при хорошем контроле асцита). Притупление перкуторного звука во фланках — ранний признак асцита, определяется уже при скоплении 2 л жидкости в брюшной полости. Перемещение области тупости при изменении положения тела позволяет дифференцировать асцит с другими состояниями (опухоль яичников, увеличение желчного пузыря, беременность). При напряженном асците пальпация внутренних органов затруднена, тем не менее печень и селезенка могут баллотировать. Вторичные эффекты асцита: пропотевание асцитической жидкости в правую плевральную полость, периферические отеки (вследствие гипоальбуминемии), смещение вверх верхушечного толчка и т.д.
Дополнительные методы исследования. Диагностический парацентез (= 50 мл): электролитный состав асцитической жидкости аналогичен таковому у других внеклеточных жидкостей. В норме асцитическая жидкость прозрачна, соломенного цвета, примесь крови наблюдается при злокачественном процессе, недавно проведенном парацентезе или инвазивных процедурах (биопсия печени, транспеченочная холангиография и т.д.). Концентрация протеина в асцитической жидкости обычно не превышает 1—2 г/100 мл, ее увеличение предполагает инфекцию. Содержание белка также повышается при синдроме Бадда – Киари, панкреатическом асците, злокачественных опухолях, туберкулезе. Высокий уровень белка в асцитической жидкости свидетельствует в пользу злокачественного асцита.
УЗИ и КТ можно использовать для выявления очень малых количеств жидкости в брюшной полости.
Принципы лечения асцита при циррозе печени: ограниченное потребление натрия; мочегонная терапия (спироналоктон + петлевые диуретики); терапевтический парацентез с внутривенным введением 6 г бессолевого альбумина на 1 л удаленной жидкости. Асцит, сохраняющийся или рецидивирующий при адекватной медикаментозной терапии, называется резистентным. При этом лечение предполагает удаление асцитической жидкости с помощью аппарата автоматической ультрафильтрации (до 13 л жидкости в течение 24 ч); портосистемное шунтирование ограничено в применении из-за высокого риска развития энцефалопатии; перитонеовенозное шунтирование.
Печеночная энцефалопатия (ПЭ) — обратимое нейропсихическое состояние, осложняющее течение заболеваний печени.
Факторы, играющие роль в ее развитии:
— острая печеночная недостаточность (без трансплантации печени выживаемость составляет 20%), развивающаяся на фоне вирусного, алкогольного, лекарственного гепатитов;
— цирроз печени с такими отягощающими факторами, как активный диурез, ЖКК, алкогольный эксцесс и т.д. (выживаемость – 70-80%);
— хроническая портосистемная энцефалопатии, обусловленная портосистемным шунтированием, провоцируемая пищевой белковой нагрузкой, избытком кишечной бактериальной флоры (выживаемость — 100%).
Механизм развития ПЭ до конца не ясен. В его основе лежат нарушение печеночного клиренса субстанций, продуцируемых в кишке; печеночная недостаточность и портосистемное шунтирование. В результате нейроактивные токсины, основным из которых является аммиак, проникают через гематоэнцефалический барьер и вызывают метаболические изменения в ЦНС. Развитию ПЭ способствует накопление ложных нейротрансмиттеров. Имеет значение изменение в соотношении ароматических аминокислот и аминокислот с разветвленной цепью. В патогенез включены такие соединения, как γ-аминомасляная кислота (ингибиторный нейротрансмиттер) и эндогенные бензодиазепины, влияние которых требует дальнейших исследований. Сниженный церебральный метаболизм кислорода и глюкозы обусловлен уменьшением активности нейронов. Превалирование в патогенезе ПЭ такого компонента, как портосистемное шунтирование, сопровождающееся церебральной интоксикацией кишечным содержимым, вызывает портосистемную энцефалопатию.
Клиническая картина ПЭ определяется психическими и неврологическими отклонениями. Прежде всего это расстройства сознания, связанные с нарушением ритма сна, который постепенно приобретает обратную реверсию. Ранние признаки ПЭ: уменьшение двигательной активности, фиксированный взгляд, замедленные и краткие ответы на вопросы; при прогрессировании состояния больной отвечает только на интенсивный стимул, затем развивается кома; быстропрогрессирующие изменения сознания могут сопровождаться бредом. Изменения личности более заметны при хронических заболеваниях печени. Это — ребяческое поведение, раздражительность, потеря интереса к семье. Даже в период ремиссии у больных отмечаются легкие личностные отклонения (веселое, эйфоричное настроение). Нарушения интеллекта проявляются прежде всего в изменении почерка, отсутствии пространственного мышления. Речь становится медленной и невнятной, голос — монотонным. У некоторых пациентов — «печеночный» запах изо рта, который не коррелирует со степенью энцефалопатии. Основным неврологическим симптомом является астериксис (хлопающий тремор согнутой в дорсальном положении кисти или ее ритмичное подергивание при попытке удержать кисть в неподвижном состоянии). Астериксис — неспецифичный симптом, он наблюдается также при уремии, дыхательной и тяжелой сердечной недостаточности. Усилены глубокие сухожильные рефлексы, повышен мышечный тонус, возможны хватательные и сосательные рефлексы. Клиническое течение ПЭ волнообразно, пациенты нуждаются в постоянном наблюдении. Для оценки психического и неврологического статуса больного выделяют 4 стадии ПЭ:
I — спутанность (изменения настроения и поведения, дефекты при выполнении психометрических тестов); II — сонливость (неадекватное поведение); III — ступор (выполнение простых команд, невнятная речь, выраженная спутанность сознания);
IУ — кома (контакт с больным невозможен).
Дополнительные методы исследования. Диагностика проста, если известны причина заболевания и провоцирующие факторы (кровотечение, сепсис и т.д.). Цереброспинальная жидкость обычно прозрачна, имеет нормальное давление и клеточный состав. Изменения на ЭЭГ наблюдаются раньше, чем психоневрологические и биохимические отклонения. КТ и МРТ позволяют выявить церебральную атрофию (последняя связана со степенью печеночной дисфункции) и отек мозга. Микроскопические изменения отражают преимущественные нарушения со стороны астроцитов.
Клинические формы ПЭ при ЦП. Доклиническая форма проявляется нарушением порядка повседневной жизни без клинического воплощения (незначительные отклонения в выполнении психометрических тестов). Острая форма развивается спонтанно, обычно провоцируется одним из следующих факторов: потерей большого количества жидкости и электролитным дисбалансом, ЖКК, хирургическими манипуляциями, приемом алкоголя, медикаментов (опиатов, бензодиазепинов, барбитуратов), инфекцией (особенно сопровождающейся бактериемией), пищевой белковой нагрузкой и запорами. Хроническая форма обычно связана с портосистемным шунтированием.
Лечение имеет 3 направления: 1) выявление и устранение провоцирующего фактора; 2) уменьшение продукции и всасывания в кишке аммония и других токсинов; 3) назначение агентов, прямо или косвенно изменяющих нейротрансмиттерный баланс (флумазенил и аминокислоты с разветвленной цепью соответственно). При лечении остро развившейся ПЭ (прекома и кома) выявляют провоцирующий фактор, удаляют из кишки азотсодержащие шлаки (останавливают кровотечение, используют фосфатную клизму), назначают безбелковую диету, лактулозу или лактиол, антибиотики (неомицин, метронидазол), поддерживают энергетический, водный и электролитный баланс, прекращают диуретическую терапию. При хронической ПЭ избегают применения азотсодержащих лекарств, ограничивают прием с пищей белка (около 50 г в день), используют лактулозу и лактиол, добиваются 2 свободных опорожнений кишки в день. Если симптомы прогрессируют, проводится лечение, которое необходимо при остро развившейся коме. Для профилактики ПЭ необходимо тщательное наблюдение за больным и своевременное врачебное вмешательство. Прогноз определяется степенью печеночно-клеточной недостаточности и стадией ПЭ.
Не нашли то, что искали? Воспользуйтесь поиском:
источник
Причины, приводящие к повышению сопротивления портальных сосудов току крови, можно разделить на предпеченочные, внутрипеченочные и постпеченочные.
Основными предпеченочными причинами являются тромбоз воротной вены, сужение ее просвета ниже места разделения на левую и правую ветви, а также массивная спленомегалия с резким увеличением оттока крови по селезеночной вене.
Важнейшие постпеченочные причины — тяжелая правожелудочковая недостаточность, констриктивный перикардит и обструкция печеночных вен.
Главная внутрипеченочная причина — цирроз печени, вызывающий портальную гипертензию. Редкими внутрипеченочными причинами являются шистосомоз, тяжелый жировой гепатоз, диффузные фиброзирующие гранулематозы (например, саркоидоз), а также заболевания, при которых нарушается портальная микроциркуляция (например, регенеративная узловая гиперплазия).
Патофизиологические основы развития портальной гипертензии сложны и включают:
— высокое сопротивление портальному кровотоку на уровне синусоидов. Связано с сокращением гладкомышечных клеток и миофибробластов сосудистой стенки, а также с нарушением кровотока, вызванным рубцеванием и образованием ложных долек. Эндотелиоциты синусоидов вносят свой вклад в развитие внутрипеченочной вазоконстрикции, связанной с портальной гипертензией, путем снижения синтеза оксида азота и выделения эндотелина-1, ангиотензиногена и эйкозаноидов.
Ремоделирование синусоидов и формирование в фиброзных септах анастомозов между системами печеночной артерии и воротной вены вносят свой вклад в развитие портальной гипертензии за счет увеличения давления в системе воротной вены, вызванного шунтированием артериальной крови под высоким давлением. Кроме того, ремоделирование синусоидов и внутрипеченочное шунтирование препятствуют обмену веществ между кровью в синусоидах и гепатоцитами;
— увеличение портального кровотока за счет гипердинамической циркуляции крови. Последняя вызвана расширением артерий (прежде всего артерий внутренних органов). Усиленный кровоток в артериях внутренних органов, в свою очередь, ведет к увеличению оттока крови в систему воротной вены.
За расширение артерий внутренних органов ответственны многочисленные медиаторы, например простагландин I2 и TNF, однако основная роль в этом процессе отводится оксиду азота. Считается, что повышение концентрации бактериальной ДНК в крови, всасываемой из просвета кишки, обусловленное снижением функции системы мононуклеарных фагоцитов и шунтированием крови из портальной циркуляции в системную, когда кровь минует основную массу клеток Купфера в печени, стимулирует выработку оксида азота.
Правильность этой гипотезы была доказана с помощью экспериментальных моделей портальной гипертензии, когда использование антибиотиков оказывало благоприятный эффект на течение заболевания.
Основные клинические проявления портальной гипертензии при циррозе печени:
(1) асцит;
(2) портокавальные анастомозы;
(3) спленомегалия;
(4) печеночная энцефалопатия.
1. Асцит. Асцит — накопление в брюшной полости избыточного количества жидкости. В 85% наблюдений причиной асцита является цирроз печени. Обычно асцит можно выявить только после того, как в брюшной полости накопилось более 500 мл жидкости. Асцитическая жидкость в большинстве случаев имеет характер серозной и содержит менее 3 г/дл белка (в основном альбумина), при этом разница сывороточного альбумина и асцитического альбумина >1,1 г/дл.
Концентрация в асцитической жидкости таких веществ, как глюкоза, натрий и калий, соответствует их концентрации в крови. Также в жидкости могут быть немногочисленные мезотелиальные клетки и мононуклеарные лейкоциты.
Наличие нейтрофилов свидетельствует о присоединении вторичной инфекции, тогда как наличие эритроцитов указывает на возможную диссеминацию злокачественной опухоли органов брюшной полости. Длительно существующий асцит может сопровождаться развитием гидроторакса, чаще правостороннего, за счет интенсивной фильтрации асцитической жидкости через трансдиафрагмальные лимфатические сосуды.
Патогенез асцита сложен, в него вовлечены следующие механизмы:
— повышение давления в синусоидах. Ведет к изменению направления действия сил Старлинга и выходу жидкости в пространства Диссе, откуда она удаляется через лимфатические сосуды печени. Выходу жидкости способствует также гипоальбуминемия;
— фильтрация лимфы, образовавшейся в печени, в брюшную полость. В норме через грудной лимфатический проток за сутки проходит 800— 1000 мл лимфы. При циррозе печени по ее лимфатическим сосудам за сутки может оттекать до 20 л лимфы, что значительно больше дренажной способности грудного лимфатического протока. Лимфа, образовавшаяся в печени, насыщена белками и содержит мало триглицеридов, что объясняет присутствие белка в асцитической жидкости;
— расширение сосудов внутренних органов и гипердинамическая циркуляция. Эти изменения были описаны ранее, когда речь шла о патофизиологических основах портальной гипертензии. Расширение артерий внутренних органов ведет к снижению артериального давления. По мере прогрессирования вазодилатации увеличение сердечного ритма и сердечного выброса уже не может компенсировать снижение давления. Это приводит к активации механизмов вазоконстрикции, включая РААС и увеличение выделения антидиуретического гормона.
Сочетание портальной гипертензии, вазодилатации и задержки в организме натрия и воды ведет к увеличению перфузионного давления в капиллярах межуточной ткани и выходу жидкости в брюшную полость.
2. Портокавальные анастомозы. По мере повышения давления в системе воротной вены кровь из нее начинает поступать в системный кровоток, минуя печень, по расширенным сосудистым анастомозам и по вновь образованным сосудам. В тех участках, где вены большого круга кровообращения связаны посредством капилляров с системой воротной вены, формируются портокавальные анастомозы: вены вокруг и внутри стенки прямой кишки (их расширение приводит к появлению геморроидальных узлов), вены пищеводно-желудочного соединения (варикозно расширяются), вены ретроперитонеального пространства и серповидной связки печени (с вовлечением околопупочных и других коллатералей брюшной стенки).
Геморроидальные узлы иногда могут быть источником кровотечений, но они редко угрожают жизни. Большее клиническое значение имеют варикозно расширенные вены пищеводно-желудочного соединения, наблюдаемые у 40% лиц с выраженным циррозом печени и являющиеся причиной массивной кровавой рвоты, которая в 50% случаев приводит к летальному исходу. Летальность при каждом эпизоде кровотечения достигает 30%. Важным симптомом портальной гипертензии является расширение подкожных вен на передней брюшной стенке от пупка до нижнего края ребер (признак «голова Медузы»).
3. Спленомегалия. Длительный застой крови в системе воротной вены может вести к застойной спленомегалии. Степень увеличения селезенки вариабельна, масса может достигать 1 кг, однако этот показатель не обязательно коррелирует с другими признаками портальной гипертензии. Массивная спленомегалия может вторично вести к патологии системы крови, характерной для гиперспленизма, например тромбоцитопении и даже панцитопении.
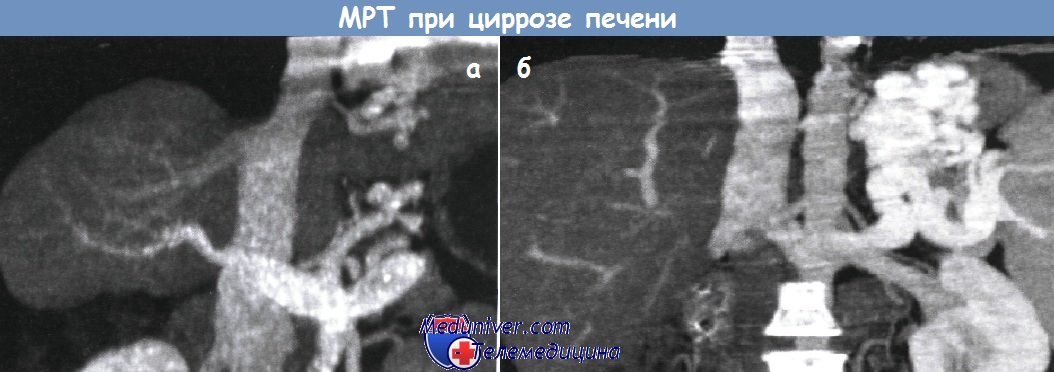
Магнитно-резонансная ангиография.
б — Магнитно-резонансная ангиография другого пациента с портальной гипертензией.
Определяется выраженное варикозное расширение вен и коллатеральный кровоток. 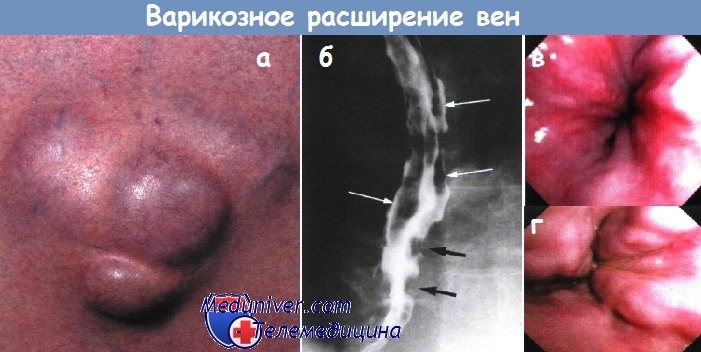
б — Варикозное расширение вен — многокамерные дефекты наполнения во фронтальной (белые стрелки) и сагиттальной (черные стрелки) проекции дистального отдела пищевода.
Рентгеноконтрастное исследование.
в — Первая степень варикозного расширения вен пищевода.
г — Вторая степень варикозного расширения вен пищевода. Извитые вены.
— Рекомендуем ознакомиться со следующей статьей «Обмен билирубина и образование желчи»
источник
Причины портальной гипертензии надо искать как в печени, так и вне ее. В большинстве случаев асцит вызывается внутрипеченочной блокадой (сдавление мельчайших собирающих веточек печеночной вены узелками регенерации). В меньшей части случаев блокада является внепеченочной: по отношению к направлению тока крови препятствие может возникать над печенью (надпеченочная блокада) или под печенью (подпеченочная).
- Внутрипеченочная блокада является причиной асцита при циррозе печени. Наиболее часто и рано асцит возникает при классическом циррозе Лаэннека или при циррозах портального происхождения. При билиарных циррозах асцит и «васкулярная декомпенсация» явления поздние.
Чаще всего диагноз не представляет трудностей и основывается на следующих симптомах: большая твердая печень с острым краем, увеличенная селезенка, в большинстве случаев положительные печеночные пробы, задержка бромсульфалеина, расширение вен пищевода, умеренная желтуха, эритема ладоней и ступней, сосудистые «звездочки» и др.
Пробы на лабильность белка и коллоидные пробы часто отрицательны, но очень редко отрицательна бромсульфалеиновая проба. В таких случаях диагноз может быть поставлен только на основе результатов биопсии печени.
В некоторых случаях при отечных формах острых гепатитов асцит может возникать рано и быть обратимым. Хронические гепатиты, при которых возникает асцит, с полным правом можно назвать циррозами. Постнекротический (грубоузелковый) цирроз обычно поздно приводит к портальной гипертензии и асциту.
- Надпеченочная блокада не всегда вызывает асцит. Такая блокада может возникнуть вследствие тромбоза или воспаления воротной вены или образования узлов в воротной вене и ее ветвях. Пилетромбоз, особенно же пилефлебит сопровождаются симптомами перитонита, внезапно развивающимся асцитом, сильными болями в животе.
Нередко при циррозе печени с портальной гипертензией и асцитом возникает тромбоз воротной вены, количество асцитической жидкости резко увеличивается. Лимфоидный лейкоз и лимфогранулематоз редко вызывают асцит, при них портальные лимфоузлы, как и при туберкулезе, часто являются причиной возникновения желтухи. Практически считаться с возможностью возникновения гуммы теперь не приходится. Редко асцит может вызвать карцинома поджелудочной железы, но не вследствие метастазов брюшины, а в результате распространения процесса на воротную вену.
Встречается асцит вследствие воспаления поджелудочной железы, скорее это образование воспалительной жидкости, однако хронический панкреатит вследствие повышения давления в воротной вене может вызывать рецидивирующее скопление жидкости в брюшной полости.
Асцит, вызванный надпеченочной блокадой, является поздним симптомом. Чаще встречается в молодом возрасте, при этом, в большинстве эпизодов, значительно увеличена селезенка — гиперспления, печень менее увеличена, печеночные пробы отрицательны, данные биопсии показывают отсутствие нарушений, подкожные вены на поверхности живота невидны. Внутрипеченочный барьер наблюдается в пожилом возрасте и встречается более часто. При этом асцит является ранним симптомом, селезенка увеличена незначительно или не увеличена, гиперспления наблюдается редко, но печень большая, печеночные пробы положительны, часто имеет место субиктеричность, биопсия печени дает картину цирроза, поверхностные вены живота чаще всего хорошо видны.
- Подпеченочная блокада возникает прежде всего при окклюзии печеночной вены. Это синдром Бадда-Киари, который может быть вызван опухолью, абсцессом печени, тромбозом, возникнуть по неизвестным причинам или вследствие облитерирующего эндофлебита (болезнь Бадда-Киари).
В некоторых случаях наблюдается у больного с тромбоцитемией (повышение числа тромбоцитов крови) развитие тромбоза конечностей, а затем появление синдрома Бадда-Киари.
Болезнь может возникнуть при любом заболевании, вызывающем склонность к тромбозам (например, при лейкозе). Развитие этого синдрома могут вызвать различные причины: наиболее часто – полицитемия, очень часто – противозачаточные средства, полиневрит, забрюшинная невринома, аспергиллез.
Болезнь острая, течение ее может быть бурным, со смертельным исходом, вызванным окклюзией всех ветвей печеночной вены. В других случаях болезнь развивается медленно, постепенно и отличается от цирроза только тем, что образование асцита и расширение поверхностных вен живота происходит относительно быстро.
Больной жалуется на очень сильные боли в животе. Характерно, что асцит обычно не уменьшается при применении диуретиков и после пункций быстро образуется вновь. Функциональные печеночные пробы постепенно становятся положительными, селезенка увеличивается. Диагноз подтверждается на секции, но если указанные симптомы развиваются на фоне известного основного заболевания, то нужно иметь в виду и эту возможность.
Сходную картину заболевания может вызвать тромбоз нижней полой вены, распространяющийся центрально, и часто сопровождающий тромбоз вен нижних конечностей. К синдрому Бадда-Киари присоединяется значительная альбуминурия. Синдром Бадда-Киари может быть вызван не только окклюзией нижней полой вены и печеночных вен, но и образованием сетчатого тромба в нижней полой вене и опухолью правого предсердия.
Если причина синдрома не может быть выявлена, то говорят о первичной болезни Бадда-Киари, хотя правомерность такого определения сомнительна.
Заболевание, связанное с окклюзией ветвей печеночной вены и даюшее сходную картину с синдромом Бадда-Киари, впервые описано на Ямайке, позднее оно было обнаружено и в других странах, главным образом, у детей. «Облитерирующая болезнь вен», которую приписывают влиянию растительного холестатического яда, встречается как самостоятельное заболевание, но может присоединяться и к тропическим алиментарным циррозам.
источник
Портальная гипертензия (ПГ) и сопровождающие ее осложнения в виде кровотечений из варикозно расширенных вен пищевода, энцефалопатии и асцита остаются одной из наиболее сложных проблем в интенсивной терапии и хирургии. Возникает этот симптомокомплекс в результате нарушений поpтальной гемодинамики, вызванных препятствием в системе притока либо оттока крови.
Большинство классификаций ПГ построено на принципе локализации обструкции в портальном кровотоке. Согласно этому выделяют две основные формы ПГ: внутрипеченочную и внепеченочную. Последнюю подразделяют на над- и подпеченочные формы.
Более точно учитывает уровень блока и этиопатогенетические механизмы развития патологического процесса классификация, предложенная McDermott, согласно которой все виды ПГ делят на три вида: пресинусоидальную, синусоидальную и постсинусоидальную.
I. Пресинусоидальная форма ПГ.
А. Внепеченочная — вызвана нарушением проходимости воротной или селезеночной вен вследствие тромбоза (пупочный сепсис, травмы и воспалительные заболевания брюшной полости, полицитемия) либо сдавления (перипортальная лимфаденопатия, опухоль, панкреатит).
Б. Внутрипеченочная — обусловлена закупоркой либо облитерацией крупных и средних внутрипеченочных ветвей воротной вены при атрезии желчных ходов: склерозирующем холангите, шистозоматозе, саркоидозе, иерсиниозе, врожденном печеночном фиброзе, миелопролиферативных заболеваниях, первичном билиарном циррозе, гепатопортальном склерозе (облитерирующая портальная венопатия печени).
II. Синусоидальная форма ПГ.
Встречается при первичном циррозе печени, токсическом гепатите, жировой трансформации печени.
III. Постсинусоидальная форма ПГ.
А. Внутрипеченочная — развивается при постнекротическом циррозе печени, портальном гемахроматозе, веноокклюзионной болезни печени (обструкция внутрипеченочных ветвей печеночных вен).
Б. Внепеченочная — связана с синдромом Бадда–Киари (СБК), мембранозным поражением устья печеночных вен, опухолью печени, применением оральных контрацептивов, беременностью, сердечной недостаточностью (констриктивный перикардит, ИБС), увеличением притока крови (артериовенозные фистулы: между селезеночной артерией и селезеночной веной, между печеночной артерией и воротной веной).
О распространенности синдрома ПГ судят по заболеваемости циррозом печени, которая в последние годы имеет отчетливую тенденцию к росту во многих странах мира. По данным вскрытий, частота циррозов печени колеблет-
ся между 1 и 11%, составляя в среднем 2–3%, в том числе в Европе около 1%. Наиболее часто это заболевание диагностируют у мужчин старше 40 лет. Смертность от цирроза печени составляет 14–47 случаев на 100 000 населения.
Более точно изучена статистика СБК, который чаще встречается в азиатских странах и в Японии. При этом определена распространенность этой патологии с учетом двух ее вариантов: тромбоза печеночных вен (классический СБК) и первичной обструкции ретропеченочного отдела НПВ. Частота встречаемости СБК среди всех пациентов с портальной гипертензией неопухолевого генеза составляет от 4,9 до 9%. В Японии зарегистрировано около 300 пациентов с СБК, в том числе 21 новый случай возникновения этой патологии ежегодно. Установлено также, что среди всех наблюдений СБК только у 5,7–9% больных отмечается тромбоз печеночных вен, у остальных эта патология связана с обструкцией НПВ.
В США тромбозы печеночных вен среди невыборочных вскрытий встречаются в 0,042–0,05% случаев.
Частота выявляемости мембранозной обструкции НПВ, по данным японского национального аутопсийного регистра, составляет 0,019% (92 случая на 473 520 вскрытий за период с 1975 по 1988 г.). В Непале среди всех пациентов с хроническими заболеваниями печени, включая опухоли, у 17,3% выявляется обструкция НПВ. В Южной Африке частота венозного блока среди умерших неестественной смертью составляет 0,047%, а среди пациентов с болезнями пе-
Портальная гипертензия в 70–80% случаев вызвана циррозом печени различного происхождения (преимущественно вирусного и алкогольного).
Подпеченочный блок портального кровообращения диагностируется в 6–27% наблюдений. В подавляющем большинстве случаев он — следствие различных воспалительных или опухолевых процессов в брюшной полости (сепсис, омфалит, тромбофлебит селезеночной, брыжеечной либо воротной вен; травма брюшной полости), а также врожденных аномалий развития портальной системы.
Надпеченочная форма портального блока включает различные патологические процессы окклюзионного характера, затрагивающие как мелкие и средние (веноокклюзионная болезнь), так и крупные печеночные вены, а также ретропеченочный отдел НПВ. Реже она может быть вызвана сдавлением печеночных вен или полой вены опухолями, паразитарными кистами и образованиями (эхинококкоз печени).
Синдром Бадда–Киари длительное время рассматривался как проявление окклюзионной патологии печеночных вен. Впервые она была описана в 1845 г. Баддом, позже, в 1899 г., аналогичные случаи облитерирующего флебита крупных печеночных вен обнаружены на вскрытии Киари. Во всех этих наблюдениях начальной зоной тромбообразования были печеночные вены, но НПВ была также вовлечена в процесс.
Главная причина тромбоза печеночных вен — различные нарушения
свертывающей и противосвертывающей активности крови (лейденовская мутация, дефицит АТ-III, протеинов С и S). В соответствии с недавно полученными данными, у значительного числа этих пациентов имеются скрытые миелопролиферативные заболевания, диагностика которых возможна только после пункции костного мозга. В большинстве же случаев точная этиология этого патологического процесса неизвестна.
В последующем появились данные о различных облитерирующих процессах, первично вовлекающих ретропеченочный сегмент НПВ и устья печеночных вен. Патологическая анатомия этих идиопатических обструктивных поражений различна. Это — и практически полная окклюзия НПВ, и наличие тонкой либо толстой мембраны с центральным каналом или отверстиями по периферии, и даже обструкция, захватывающая протяженный участок НПВ. Такая вариабельность поражений привела к появлению терминов «мембранозная» обструкция и «коарктация» полой вены. С развитием методов визуализации, а также на основе гистологических исследований доказано, что мембранозная обструкция НПВ и стеноз НПВ являются последствием тромбоза НПВ.
Общим как для первичного тромбоза печеночных вен (классический СБК), так и для облитерируюших заболеваний, преимущественно поражающих печеночный сегмент НПВ, является блокада венозного оттока. Следствие этого
— повышение давления в синусоидах с их переполнением и дилатацией, что ведет к гепатомегалии. В течение нескольких недель обструкции печеночных вен, начинает развиваться центролобулярный фиброз. Ишемические поражения печени способствуют формированию интра- и экстрапеченочных коллатералей, которые в основном и определяют прогноз. В случаях обструкции НПВ формируются выраженный окольный кровоток между полой веной и расширенными подкожными венами туловища.
Основной патогенетический механизм ПГ — повышение давления в системе воротной вены, которое развивается вследствие механического препятствия току портальной крови. Обструкция может локализоваться в любом участке портальной системы: на предпеченочном ее отрезке (предпеченочный блок или блок портального притока), на уровне внутрипеченочных разветвлений (внутрипеченочный блок), на уровне внепеченочных отделов печеночных вен или надпеченочного сегмента НПВ (постпеченочный блок или блок печеночного оттока).
Повышение давления в портальной системе наблюдается при циррозе печени любой этиологии и на любой стадии заболевания. Если в норме давление в воротной вене составляет около 7 мм рт. ст., то при развитии ПГ оно постепенно повышается, достигая максимума при показателях 25–30 мм рт. ст. Повышение механической резистентности току крови вследствие различных причин приводит к возникновению допеченочного сброса крови по естественным портосистемным коллатеральным путям. Анастомозы между системами воротной и нижней полой вен образуются в передней брюшной стенке, вокруг прямой кишки, между селезеночной и левой почечной венами. Особенно опасны ана-
стомозы, направляющие портальную кровь через непарную вену и левую коронарную вену желудка в тонкостенные подслизистые венозные сплетения нижней трети пищевода и кардиального отдела желудка.
Количество протекающей через печень крови уменьшается в 4–5 раз, что отрицательно сказывается на ее регенераторной функции. Сокращение количества притекающей к печени крови по воротной вене в среднем на 50% сопровождается компенсаторным расширением артериальных сосудов внутренних органов, что еще больше усугубляет ПГ.
Симптоматика ПГ при циррозе печени достаточно типична. Увеличение печени и селезенки, кровотечение из варикозно расширенных вен пищевода, асцит, выраженное расширение подкожных вен передней брюшной стенки («голова Медузы»), общая слабость, диспептические расстройства, желтуха, «печеночные знаки» («лакированный язык», сосудистые звездочки, пальмарная эритема) и др. — характерные проявления нарушений портальной гемодинамики вследствие поражения печени. Большинство больных с этой патологией указывают на перенесенный в прошлом вирусный гепатит либо на злоупотребление алкоголем.
У многих пациентов болезнь в течение нескольких лет или даже десятилетий может протекать скрыто и первыми ее проявлениями становятся нередко такие осложнения ПГ, как кровотечение из варикозных вен пищевода или прямой кишки, асцит, гепатоцеллюлярный рак.
Выраженность клинических проявлений ПГ цирротического генеза (варикозное расширение вен пищевода и желудка, осложняющееся кровотечением; спленомегалия) коррелирует с двумя гемодинамическими параметрами (как правило, сочетающимися): величиной портального давления (>30 см вод. ст.) и удлинением кардиопортального времени (до 40 с и более), характеризующих степень застоя крови в воротной системе.
Клинические проявления внепеченочной формы ПГ не столь характерны и разнообразны в сравнении с цирротической. Среди них превалируют диспептические расстройства, повышение температуры, увеличение селезенки, асцит. В анамнезе отмечается пупочный сепсис, интермитирующая лихорадка, хирургические вмешательства на органах брюшной полости.
Клиника обструкции печеночного оттока характеризуется различными симптомами и зависит от локализации тромба и степени блока. Тромбоз печеночных вен обычно протекает остро, проявляясь болями в животе, гепатомегалией, асцитом, желтухой, лихорадкой. Эта патология может возникать в любом возрасте, но чаще у людей в возрасте от 30 до 50 лет. Тяжесть симптоматики зависит как от протяженности поражения, так и от развития коллатералей. Если тромбирована одна печеночная вена, то заболевание протекает, как правило, асимптомно. У половины пациентов отмечается увеличение хвостатой доли печени, так как остается проходимой дорсальная ветвь правой печеночной вены (она поражается редко), дренирующая этот отдел печени.
Обструкция НПВ проявляется менее выраженной симптоматикой в срав-
источник
Версия: Справочник заболеваний MedElement
Портальная гипертензия — синдром повышенного давления в системе воротной вены, вызванного нарушением кровотока в портальных сосудах, печеночных венах и нижней полой вене. В норме давление в системе портальных вен составляет 5-10 мм рт.ст.; повышение давления выше 12 мм рт.ст. свидетельствует о развитии портальной гипертензии.
Примечание. Портальная гипертензия не является основным заболеванием, используется для кодировки осложнений и сопутствующей патологии. Возможно использование добавочных кодов для ассоциированных осложнений, например — K31.89 при гастропатии, ассоциированной с портальной гипертензией.
Классификация на основе локализации портального блока
2.1 Пресинусоидальная:
— болезнь Рандю-Ослера;
— врожденный фиброз печени;
— тромбоз ветвей портальной вены (тяжелый бактериальный холангит, злокачественные новообразования);
— первичный билиарный холангит, первичный склерозирующий холангит;
— гранулематозы (шистосомоз, саркоидоз, туберкулез);
— хронический вирусный гепатит;
— первичный билиарный цирроз;
— миелопролиферативные заболевания;
— нодулярная регенераторная гиперплазия;
— идиопатическая (нецирротическая) портальная гипертензия;
— болезнь Вильсона;
— гемохроматоз;
— поликистоз;
— амилоидоз;
— воздействие токсичных веществ (медь, мышьяк, 6-меркаптопурин);
2. 2 Синусоидальная:
— все случаи цирроза печени;
— острый алкогольный гепатит;
— тяжелый вирусный гепатит;
— острая жировая печень беременных;
— интоксикация витамином А;
— системный мастоцитоз;
— печеночная пурпура;
— цитотоксичные лекарства;
2.3 Постсинусоидальная:
— веноокклюзионная болезнь;
— алкогольный центролобулярный гиалиновый склероз;
3. Подпеченочная:
— тромбоз воротной вены;
— кавернозная трансформация воротной вены;
— тромбоз селезеночной вены;
— висцеральная артериовенозная фистула;
— идиопатическая тропическая спленомегалия (синдром Банти, см. также «Фиброз печени» — К74.0).
4. Смешанная.
Классификация портальной гипертензии по уровню повышения давления в портальной системе:
— III степень – вены сливаются по всей окружности пищевода.
Японское научное общество по изучению портальной гипертензии в 1991 году разработало правила для регистрации эндоскопических признаков варикозно расширенных вен (ВРВ) пищевода и желудка, состоящие из 6 основных позиций:
Типы «красных маркеров»
2. Гематоцистные пятна — расширенные интраэпителиальные венозные узлы. При эндоскопии выглядят как пузырьки красного цвета, обычно солитарные (одиночные), диаметром около 4 мм. Данный признак наблюдается у 8% пациентов с варикозными венами пищевода. Гематоцистные пятна являются наиболее слабыми участками варикозной стенки и местом развития профузного кровотечения.
3. Телеангиэктазии — сеть мелких извитых сосудов микроциркуляторного русла, расположенных субэпителиально, преимущественно в нижней трети пищевода.
Причины возникновения портальной гипертензии
1. Надпеченочной:
— тромбоз селезеночной вены;
— тромбоз воротной вены;
— врожденная аномалия воротной вены;
— сдавление воротной вены опухолью, паразитарными (альвеококкоз) и воспалительными (панкреатит) образованиями.
2. Панкреатобилиарной области: висцеральные артериовенозные фистулы .
3. Внутрипеченочной, преимущественно пресинусоидальной:
— ранние стадии первичного билиарного цирроза, идиопатической портальной гипертензии, шистосомоза, узловой регенеративной гиперплазии;
— миелопролиферативные заболевания;
— поликистоз печени;
— метастазы, гранулематозные заболевания печени.
Портальная гипертензия развивается в результате увеличения портального венозного кровотока и (или) повышения резистентности портальных или печеночных вен. В основе увеличения портального сопротивления лежат механическая обструкция и активное сокращение миофибробластов и гладкомышечного слоя внутрипеченочных вен.
— гастроэзофагеальные — соединяют воротную вену с верхней полой веной через венечную вену желудка, непарные и полунепарные вены;
— анастомозы между венозными сплетениями прямой кишки и нижней полой вены, через верхние и нижние геморроидальные вены, образованные околопупочными венами.
Анастомозы в пищеводе, кардиальном отделе желудка, вокруг прямой кишки способствуют возникновению в данных зонах потенциальных источников кровотечений. При повышении портального давления более 12 мм рт.ст. появляется риск разрыва варикозного расширения вен пищевода. Степень риска возникновения кровотечения зависит от класса цирроза, размера варикозных узлов и наличия «красных маркеров» (изменения сосудистой стенки).
Считается, что заболевание чаще наблюдается у мужчин (60%).
Средний возраст пациента не выяснен в связи с разнородностью патологии, приводящей к портальной гипертензии.
В благополучных странах, где проводится вакцинация от вирусного гепатита, тромбоз воротной вены и вторичный билиарный цирроз являются наиболее распространенными причинами варикозно расширенных вен пищевода у детей. Цирроз печени является наиболее распространенной причиной варикозного расширения вен пищевода у взрослых.
Выраженность клинических проявлений портальной гипертензии зависит от степени и уровня блокады портальной системы и развития портокавальных анастомозов.
Признаки формирования портосистемного шунтирования включают в себя следующее (кроме указанных выше):
В зависимости от этиологии также могут отмечаться следующие проявления:
— общие признаки недостаточности кровообращения;
— бледность — можно предположить активное внутреннее кровотечение;
— увеличение околоушной железы, может быть связано с злоупотреблением алкоголем и / или недоеданием;
— цианоз языка, губ, пальцев (в связи с низкой насыщенностью кислородом крови);
— одышка и тахипноэ Тахипноэ — учащенное дыхание без его углубления
;
— fetor hepaticus (зловонное дыхание, печеночный запах изо рта);
— уменьшение размеров печени;
— непрерывный венозный шум при аускультации живота.
Физикальные данные:
— расширение вен на передней и боковых отделах брюшной стенки;
— извитые коллатерали вокруг пупка, создающие картину «головы Медузы»;
— асцит;
— при ректальном осмотре — геморроидальные узлы;
— параумбиликальная грыжа;
— признаки хронического заболевания печени (см. цирроз печени — К74);
— признаки гипердинамического кровообращения.
Инструментальные методы
1. УЗИ — безопасный, экономичный и эффективный метод скрининга.
На УЗИ определяются следующие признаки:
1.1 Расширение и извитость сосудов. Признаками портальной гипертензии считаются увеличение диаметра воротной вены более 13 мм и замедление кровотока в ней. Согласно некоторым данным, увеличение диаметра воротной вены считается ненадежным признаком, т.к. в норме этот показатель весьма вариабелен. Необходимо также отметить, что увеличение диаметра воротной вены не является обязательным признаком, существующим постоянно. Это связано с тем, что после образования портокавальных анастомозов диаметр воротной вены может уменьшиться до нормальных величин.
1.3 Наличие асцита.
1.4 Изменение размеров и структуры печени и селезёнки. Линейные размеры селезёнки увеличены и составляют «по длиннику» — свыше 10-11 см, по толщине — 4-5,5 см, площадь селезёнки — свыше 40-50 см 2 (при косом сканировании вдоль левой реберной дуги при выведении на экран максимальной площади среза).
1.5 УЗИ применяется для определения скорости и объема кровотока в воротной вене и ее ветвях а также для визуализации тромбов.
У здоровых лиц линейная скорость кровотока находится в интервале от 18 до 23 см/с. Значение этой скорости резко возрастает при исследовании после приема пищи (на 100-200%) или при задержке дыхания в фазе глубокого вдоха (на 50-70%).
Ряд исследователей отмечает более низкие линейные скорости кровотока в воротной вене (в норме — до 15 ± 0.2 см/с), и достаточно высокую, в связи с этим, эффективность определения именно объемной скорости кровотока (до 845 ± 20 мл/мин в норме).
Корректная оценка гемодинамики возможна при оценке скоростей кровотока во внепеченочной части воротной вены, в области ворот печени и в долевых ветвях воротной вены. Замедление портального кровотока во внутрипеченочных ветвях, таким образом, будет свидетельствовать и о наличии повышенного сопротивления в связи с поражением паренхимы печени, и о наличии портосистемных анастомозов при ускорении кровотока по магистральному стволу.
3. МРТ-ангиография — применяется в случае недостаточно информативной допплерографии. Способствует выявлению портосистемных коллатералей и портальной обструкции. Позволяет получить количественные данные о кровотоке.
4. Радионуклидное исследование с99Тс: повышение радиоактивности селезёнки и костного мозга при портальной гипертензии малоинформативно (в норме значительно ниже, чем у печени).
5. Селективная ангиография — является «золотым стандартом» визуализации кровотока.
Транскавальная печеночная венография заключается во введении контрастного вещества через катетер, проведенный в нижнюю полую вену к устьям печеночных вен, или путем трансюгулярной катетеризации печеночных вен. Осуществляется для:
Портография
Серийные снимки, полученные при ангиографии, дают информацию о всех фазах кровотока в печени (артериальной, паренхиматозной и венозной). Изучение снимков венозной фазы используется для оценки состояния портальной системы. Для визуализации воротной вены и ее притоков применяются чрезартериальный и чрезвенозный доступы.
Чрезартериальный доступ с последующей селективной целиако- или мезентерикографией в венозной фазе исследования, позволяет четко визуализировать воротную вену и ее притоки.
К примеру, у больных, которым планируется наложение спленоренального анастомоза, применяется введение контрастного вещества в селезеночную артерию, поскольку в венозной фазе исследования четко идентифицируется селезеночная вена и ее основные притоки.
Введение в венозной фазе исследования контрастного вещества в верхнюю брыжеечную артерию позволяет получить визуализацию верхней брыжеечной и воротной вены.
При помощи чрезартериального доступа возможна также четкая идентификация размера сосудов, характера и направления кровотока в основных венозных коллатералях (например, в левой желудочной и нижней брыжеечной венах).
Чрезвенозный доступ применяется для контрастирования нижней полой, печеночных и левой почечной вен. Этот метод применяется для получения точной топической информации о локализации патологического процесса (это нужно для выбора места предполагаемого анастомоза).
7. ФГДС применяется для выявления и оценки варикозного расширения вен пищевода и желудка.
Осуществление ФГДС-скрининга варикозного расширения вен пищевода при циррозе печени:
— в начальных стадиях цирроза — 1 раз в 3 года;
— малые варикозные узлы пищевода без терапии бета-адреноблокаторами — 1 раз в 2 года;
— малые варикозные узлы пищевода при лечении бета-адреноблокаторами — не требуется;
— при декомпенсированном циррозе — немедленно по установлении диагноза, далее ежегодно.
Биопсия печени с гистологическим исследованием проводится для уточнения причин портальной гипертензии.
8. Лапароскопия используется в сомнительных случаях. Важно выявить характер патологических изменений в печени, взять биопсию; определить выраженность спленомегалии и степень расширения вен портальной системы; установить наличие асцита.
2. Биохимический анализ крови. Биохимические пробы печени могут не отличаться от нормальных величин даже при резко выраженной портальной гипертензии.
В биохимическом анализе крови пациентов с циррозом печени необходимо определять следующие показатели:
— аланинаминотрансфераза (АлАТ);
— трансферазы (АСТ и АЛТ);
— щелочная фосфатаза (ЩФ);
— гамма-глутамилтранспептидаза (ГГТП);
— билирубин;
— альбумин;
— калий;
— натрий;
— креатинин.
При компенсированном циррозе печени активность печеночных ферментов может быть нормальной.
При алкогольном гепатите с исходом в цирроз наблюдается существенное повышение АлАТ, АсАТ, ГГТП.
При первичном билиарном циррозе отмечается резкое повышение ЩФ .
Помимо этого у больных циррозом печени повышается общий билирубин, снижается содержание альбумина. Содержание аминотрансфераз в терминальной стадии цирроза печени всегда снижается (функционирующие гепатоциты и ферменты отсутствуют).
Показатели неблагополучного прогноза:
— билирубин выше 300 мкмоль/л;
— альбумин ниже 20 г/л;
— протромбиновый индекс менее 60%.
У больных с отечно-асцитическим синдромом необходимо определять содержание в крови электролитов, альбумина, мочевины, креатинина.
4. Анализы мочи.
При циррозе печени важно определение параметров, которые характеризуют почечную функцию (белок, лейкоциты, эритроциты, креатинин, мочевая кислота). У 57% пациентов с циррозом печени и асцитом выявляется почечная недостаточность (клиренс эндогенного креатинина менее 32 мл/мин. при нормальных показателях креатинина в сыворотке крови).
При отечно-асцитическом синдроме необходимо определять суточный диурез.
5. Специфические лабораторные тесты для установления этиологии портальной гипертензии:
— аутоантитела;
— серологическая диагностика гепатотропных вирусов;
— ферритин;
— церулоплазмин.
Также дифференциальная диагностика проводится с печеночной недостаточностью без портальной гипертензии, циррозом без сформировавшейся портальной гипертензии и выпотами в брюшную полость другой этиологии.
Кровотечения из желудочно-кишечного тракта, возникшие вследствие портальной гипертензии, дифференцируются с кровотечениями другой этиологии.
источник
