Для лечения гастрита и язвы наши читатели успешно используют Монастырский Чай. Видя, такую популярность этого средства мы решили предложить его и вашему вниманию.
Подробнее здесь…
Если обнаружен асцит при онкологии, сколько живут люди с таким заболеванием? На этот вопрос ответит врач-онколог. Асцит брюшной полости при онкологии — это когда в одной из частей тела скапливается большое количество жидкости. Место возникновения асцита зависит от того, какой орган поражен недугом. Чаще всего при асците происходит увеличение размера живота.
При асците в брюшной полости происходит скопление жидкости, у которой нет оттока. В большинстве случаев врачи связывают эту патологию с нарушением водно-соляного баланса и отеками. О том что у человека асцит, догадаться трудно. Человек продолжает жить как обычно до проявлений первых серьезных симптомов, пока патология не начинает негативно влиять на самочувствие больного.
Онкологический асцит может возникнуть на фоне многих серьезных заболеваний, когда тот или иной орган не в состоянии справляться с возложенной на него нагрузкой. Скопление жидкости в брюшине появляется при раке печени, сердца, почек. Именно эти органы участвуют в процедуре распределения жидкости по организму. Если проблемы со стороны сердечно-сосудистой системы, то вызваны они пороками клапанов, миокардитами.
Почечная недостаточность, вызванная гипоплазией, туберкулезом, раком, общей интоксикацией организма, также становится причиной скопления жидкости в брюшной полости. Гепатит и цирроз провоцируют развитие патологии.
Причиной патологии может стать онкология. Раковые клетки, размножаясь, влияют на работу многих органов и систем, особенно, если в этих органах возникли вторичные опухоли из-за попавших с кровью в орган раковых клеток. Орган перестает работать в привычном для него режиме, и как результат — скопление жидкости в большом количестве.
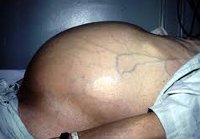
Асцит имеет особые характерные лишь для него признаки. К примеру, если человек располагается на спине, то живот начинает отвисать по бокам. Это происходит из-за того, что перераспределяется жидкость. Еще одним симптомом является выхождение пупка. Если по животу хлопнуть рукой, звук из-за скопившейся жидкости будет глухой. Недуг может сопровождаться повышенным давлением и проблемами с дыханием. В запущенном состоянии может произойти выпадение прямой кишки.
Лечение асцита зависит от причины, вызвавшей его образование. Для выведения скопившейся жидкости пациенту проводят лапароцентез, цель которого — откачивание жидкости после прокалывания живота.
При запущенных стадиях рака асцит обязательно проявляется выпячиванием стенок живота. Вены, проходящие в этом районе, сильно расширены. Жидкость может скапливаться и в плевральной области. При раковых заболеваниях вероятность развития асцита, по мнению медиков, равна 10%.
Но не всякий рак может сопровождаться асцитом. Развитие патологии вероятно, если у пациента:
- колоректальный рак,
- рак желудка или толстой кишки,
- злокачественные опухоли молочных желез или яичников.
При поражении поджелудочной железы шансы на развитие асцита немного меньше. Наиболее высоки они при раке яичников, до 50%. Смерть при этой патологии наступает не от рака, а именно от асцита. Что происходит при скоплении в брюшной полости жидкости?
Повышается внутрибрюшное давление, из-за него происходит смещение диафрагмы. Она сдвигается в грудную полость. Вполне естественно, что нарушается процесс дыхания и работа сердца.
В здоровом состоянии жидкость всегда присутствует в брюшной полости. Объемы ее невелики, присутствие необходимо. Она препятствует склеиванию внутренних органов и не дает им тереться друг об друга.
Объем жидкости в брюшной полости постоянно регулируется. Лишняя впитывается. При онкологии этот процесс полностью перестает функционировать. Возможно развитие событий в двух направлениях. В первом случае жидкости вырабатывается очень много, во втором она не может впитаться полностью. В итоге возникает асцит. Все свободное пространство оказывается занято жидкостью. Тяжелым считается состояние, когда объем скропившейся жидкости равен 25 л.
Раковые клетки способны проникать в брюшину, нарушая ее всасывающую функцию, количество жидкости растет.
Асцит не возникает в 1 момент. Накопление происходит постепенно — от нескольких недель до нескольких месяцев, поэтому начальная стадия протекает незаметно. Давление на грудную клетку возрастает. Больному становиться сложно выполнять простейшие действия.
На ход заболевания большое влияние оказывает первичный очаг — рак. Чем тяжелее состояние, тем реальнее наступление терминальной стадии. Вначале асцит не влияет на состояние больного, затем по мере накопления жидкости проявляется симптоматика, очень напоминающая аппендицит.
Если вовремя вмешаться и начать лечение, исход может быть благоприятным. Для этого необходимо удалять излишки жидкости и соблюдать диету. Многий раз жизнь пациента полностью зависит от течения основного заболевания, возраста и состояния организма.
На продолжительность жизни при скоплении жидкости влияют многие факторы: проводилось ли лечение, насколько оно было эффективно, как развивается злокачественная опухоль. Если состояние пациента крайне тяжелое, и рак находится в запущенной стадии с метастазами, а асцит продолжает стремительно развиваться, симптомы болезни нарастают, и лечение не дает положительных результатов. В этом случае пациенты могут прожить от нескольких недель до нескольких месяцев.
Если состояние легкой или средней степени тяжести, а лечение является эффективным, то такие больные могут прожить достаточно долго. В этом случае можно надеяться на то, что успешная терапия приведет к достижению полной или частичной ремиссии онкологического заболевания и асцита. Но необходимо соблюдать все рекомендации специалиста, быть постоянно под наблюдением и сообщать о малейших изменениях в организме лечащему врачу.
Аденокарцинома – это заболевание считается наиболее распространенной формой рака поджелудочной железы. Из всех злокачественных новообразований, которые могут возникнуть в этом органе, около 80% приходится именно на аденокарциному. В данном случае опухоль формируется из эпителиальных клеток слизистой оболочки или выводящих протоков поджелудочной железы.
Если верить статистике, эта болезнь чаще всего является последствием хронической формы панкреатита, и в большинстве случаев поражает мужчин старшего или преклонного возраста. Доказано, что очень большое влияние на возникновение такого опасного недуга, как аденокарцинома поджелудочной железы, оказывает также наличие у пациента вредных привычек. Так что же это за болезнь, и как определить ее на ранних этапах развития? Об этом и о многом другом читайте далее в нашей статье.
Известно, что аденокарцинома может поражать не только поджелудочную, но и молочную железу или любой другой орган, в составе которого есть клетки железистого эпителия. Причины возникновения этого злокачественного новообразования, как и любого другого онкологического заболевания до конца еще не изучены. Только один фактор, влияющий на развитие данной болезни, нельзя опровергнуть – это наследственность.
Генетическая предрасположенность к развитию рака у человека появляется вследствие мутации или уменьшения количества хромосом в определенных генах, отвечающих за предотвращение развития злокачественной опухоли. Иными словами здоровые, нормальные клетки организма мутируют и усиленно размножаются. Именно поэтому немалую роль в возникновении данного недуга играет предрасположенность ближайших родственников пациента к хроническому панкреатиту.
Аденокарцинома поджелудочной железы также может развиваться под влиянием следующих факторов:
- нерационального питания (бесконтрольного употребления острой и жирной пищи, а также продуктов, содержащих различные химические добавки);
- злоупотребления алкогольными напитками, курения;
- малоподвижного образа жизни;
- вредного производства, которое предполагает работу с различными химическими веществами (бензопирен, асбест, бензидин);
- ожирения;
- сахарного диабета;
- злоупотребления диетами;
- бесконтрольного или чрезмерного употребления кофе;
- других заболеваний ЖКТ (цирроза печени, холецистита, резекции желудка, холелитиаза).
Аденокарцинома поджелудочной железы проявляется целым рядом специфических симптомов, которые позволяют врачу довольно точно поставить диагноз. Но, несмотря на этот факт, таким пациентам в обязательном порядке назначается проведение дополнительных исследований, ведь причиной возникновения подобной симптоматики могут стать и другие патологии ЖКТ, например, желчекаменная болезнь.
При диагностике аденокарциномы поджелудочной, или той же молочной железы больному необходимо пройти УЗИ данного органа. Этот метод обследования пациента позволит врачу определить размер и расположение злокачественной опухоли. Также с помощью УЗИ можно узнать, на какой стадии развития находится рак и целесообразно ли проводить операцию по удалению новообразования в данном случае.
Еще одним, более современным методом диагностики онкологических заболеваний поджелудочной, молочной железы или других органов является компьютерная томография. Она дает возможность визуализировать пораженный орган на компьютере, более детально изучить строение новообразования, уточнить его локализацию и наличие, либо отсутствие метастазов в других органах.
В наше время большой популярностью при диагностике аденокарциномы или рака поджелудочной железы пользуется лабораторное исследование крови больного на онкомаркеры. Судя по данным медицинской статистики, точность такого диагностического обследования превышает 90%.
Поджелудочная железа хорошо снабжается кровью, и именно по этой причине часто становится местом развития различных онкологических патологий – первичных или вторичных. Аденокарцинома поджелудочной железы в статистике занимает последнее место из всех раковых заболеваний данного органа, так как процент выживаемости при этом недуге равняется всего 10%. Существует несколько разновидностей злокачественных опухолей поджелудочной железы.
- Аденокарцинома – этот вид онкологического заболевания возникает вследствие мутации железистого эпителия и наиболее часто поражает именно головку данного органа. Отличить это новообразование от других злокачественных патологий поджелудочной железы практически невозможно, так как оно не характеризуется такими специфическими симптомами, как, например, цистаденокарцинома. Аденокарцинома поджелудочной железы в большинстве случаев поражает мужскую часть населения, а вот у женщин этот недуг чаще имеет иную локализацию и возникает в области молочной железы. Что же касается прогноза, то при этом типе рака он крайне неблагоприятен – каждый год данная болезнь уносит жизни около 20 тысяч человек.
- Цистаденокарцинома – причиной возникновения этой опухоли является озлокачествление цистаденомы – доброкачественного новообразования поджелудочной. Цистаденокарцинома отличается от других злокачественных заболеваний этого органа очень яркой симптоматикой. Данный тип онкологической патологии можно определить с помощью любого метода исследования. Процент выживаемости при цистаденокарциноме достаточно высок, так как даже на раннем этапе ее развития уже наблюдается повышение уровня онкомаркеров, что существенно облегчает лабораторную диагностику болезни.
- Карцинома – из всех раковых заболеваний органов ЖКТ, около 10% приходится именно на карциному. Данное новообразование встречается чаще у мужчин, чем у женщин (примерно в 1,5 раза). Опухоль в большинстве случаев локализуется в головке железы, хвостовая часть органа поражается гораздо реже. Наиболее вероятной причиной возникновения карциномы является хроническая форма панкреатита. Превалирующими симптомами болезни является мигрень, депрессия, зуд и желтушность кожных покровов.
- Саркома поджелудочной железы – этот вид злокачественной патологии данного органа встречается сравнительно редко. При этой форме рака опухоль располагается в протоках, строме или сосудах поджелудочной железы. Специфических признаков, определяющих наличие данного новообразования в организме пациента, не существует, однако на ранней стадии развития заболевания возможно появление стеатореи (жир в каловых массах) и симптомов механической желтухи. Спустя некоторое время к этим клиническим признакам присоединяется асцит и тромбоз, увеличиваются размеры селезенки и печени. Прогноз при саркоме крайне неблагоприятный, так как эта опухоль характеризуется очень быстрым ростом и метастазированием.
- Карциноид – данная форма рака поджелудочной железы поражает преимущественно головку органа и обязательно дает метастазирование в близлежащие лимфатические узлы. Растет такое новообразование достаточно медленно, поэтому прогноз в данном случае сравнительно благоприятный.
Аденокарцинома поджелудочной железы может проявляться различными симптомами. На самом раннем этапе развития этого онкологического заболевания больной не отмечает каких-либо изменений в самочувствии – именно этот факт является причиной позднего обращения к врачу.
Приблизительно за несколько недель или месяцев до проявления развернутой симптоматики болезни, у пациентов возникает непереносимость определенных запахов и вкусов. Некоторые больные (около 1-2%) перед появлением аденокарциномы отмечали обострение хронического панкреатита.
Выделяют специфические и неспецифические признаки этой патологии.
Специфические симптомы аденокарциномы:
- желтушность кожи и слизистых;
- тошнота (иногда рвота);
- зуд кожных покровов;
- асцит (жидкость скапливается в брюшной полости);
- сахарный диабет (развивается вследствие поражения раком инсулин-вырабатывающих клеток железы);
- вторичный панкреатит (появляется из-за развернутого воспалительного процесса и серьезных функциональных нарушений в органе).
Неспецифические признаки болезни
К данным симптомам злокачественного новообразования можно отнести нарушения, которые возникают не только при каких-либо онкологических патологиях, но и в случае развития воспалительного процесса в организме или инфекции органов ЖКТ:
- нарушение пищеварительной функции организма – проявляется изжогой, тошнотой, метеоризмом, частыми запорами или поносами;
- снижение аппетита – вследствие чего больной достаточно быстро теряет вес;
- анемия;
- плохой сон, апатия, вялость;
- болевые ощущения – возникают в эпигастральной области и в правом подреберье. Боль может отдавать в лопатку, поясницу или носить опоясывающий характер;
- появление жира в испражнениях;
- каловые массы приобретают светлый цвет;
- потемнение мочи.
Для пациентов, чей возраст превышает сорокалетний рубеж, прогноз выживаемости минимальный – всего несколько лет. Аденокарцинома поджелудочной железы практически не встречается в возрасте до 25-30 лет. Большое влияние на развитие рака поджелудочной железы оказывает также расовая принадлежность. Так, у людей негроидной расы вероятность развития данной онкологической патологии намного выше, чем у представителей остальных рас. Следует добавить, что курение и алкоголизм также являются достаточно весомым фактором возникновения не только аденокарциномы, но и других злокачественных заболеваний.
источник
Панкреатический экссудат, попадая на поверхность забрюшинного пространства и брюшины, вызывает ее раздражение и скопление асцитической жидкости, количество которой в большинстве случаев незначительно. При ликвидации воспалительного процесса в поджелудочной железе асцит, как правило, рассасывается, но иногда остается неопределенно долгое время. Механизмы образования асцита при панкреатите могут быть следующие. Во-первых, нарушение целостности протока в результате паренхиматозного некроза, что сопровождается пропотеванием панкреатической жидкости в брюшную полость. Однако таким путем хронический асцит редко образуется, так как процесс отграничивается и образуется псевдокиста или флегмона.
С другой стороны, накопление асцита при выздоровлении от острого панкреатита можно связать с выделением небольших количеств ферментов поджелудочной железы и остаточными явлениями панкреатита. Эту гипотезу подтверждает выявление больных, у которых в асцитической жидкости содержится много амилазы при отсутствии разрыва протока или псевдокисты. Нельзя исключить также, что у этих больных разрыв протока или псевдокиста не были обнаружены при операции. При вялотекущем панкреатите накапливается асцит с относительно низкой концентрацией амилазы. Лечение путем повторных пункций брюшной полости дает хорошие результаты и в дальнейшем асцит не рецидивирует.
Асцит без острого панкреатита. Если асцит возникает после приступа панкреатита, то попадание ферментов поджелудочной железы на поверхность брюшины сопровождается болью в животе, имеющей диффузный характер. При асците, возникшем без предшествующего панкреатита, боли в животе нет, так как панкреатический сок содержит неактивированные ферменты. Клинические признаки такого асцита обобщены в ряде сообщений. Безболевая форма асцита, кахексия и прогрессирующее снижение массы тела возникают обычно у относительно молодых людей (20—50 лет), злоупотреблявших алкоголем и ранее не страдавших заболеванием поджелудочной железы. Живот обычно мягкий. В 10—30% случаев асцит сопровождается появлением выпота в плевральной полости в результате попадания жидкости по лимфатическим путям или через аортальное и пищеводное отверстия диафрагмы сначала в средостение, а затем в плевральную полость. Описано несколько случаев подкожного жирового некроза. Однако во время операции признаки жирового некроза и воспаления в брюшине были мало выражены.
Асцит при хроническом алкоголизме иногда ошибочно связывают с циррозом печени и портальной гипертензией. Постановке правильного диагноза способствует тщательное изучение истории болезни, указание на перенесенный болевой приступ, а также повышение уровня амилазы в сыворотке крови, хотя последнее может быть и при циррозе. Наиболее точную информацию дает диагностическая пункция брюшной полости. Экссудативная жидкость при панкреатическом асците прозрачна, малиновой окраски, серозно-кровянистая, содержит белка более 25 г/л (2,5 г/100 мл) (как правило, более 30 г/л или 3 г/100 мл) и большое количество эритроцитов и лейкоцитов. Наиболее важное значение имеет определение амилазы в асцитической жидкости, уровень которой повышен во всех случаях панкреатического асцита и, как правило, нормальный в асцитическом транссудате при циррозе печени. Повышение уровня амилазы в асцитической жидкости в случаях асцита, не связанного с поджелудочной железой, наблюдается при опухолях брюшной полости, секретирующих амилазу, раке поджелудочной железы, метастазах опухоли, разрушающей протоки, или при попадании амилазы в брюшную полость из псевдокисты (см. главу 6). Уровень липазы при панкреатическом асците повышен, а при опухоли, секретирующей амилазу, нормальный, за исключением тех случаев, когда злокачественная опухоль поражает и поджелудочную железу.
В механизме развития хронического панкреатического асцита играет роль нарушение целости протоков поджелудочной железы или просачивание панкреатического сока из псевдокисты. У некоторых больных возможны предшествующий панкреатит и травма поджелудочной железы, оставшиеся незамеченными. При рентгенологическом и ультразвуковом исследовании выявить такую псевдокисту не удается, по-видимому, в связи с ее небольшими размерами вследствие просачивания содержимого в брюшную полость. В плане предоперационной подготовки для выявления разрыва протока или псевдокисты важное значение имеет ЭРХП (рис. 29).
Рис. 29. Эндоскопическая ретроградная холецистопанкреатография. Псевдокиста поджелудочной железы и разрыв протока. Виден главный панкреатический проток (короткая контурная стрелка), большая псевдокиста хвоста поджелудочной железв (короткая черная стрелка) и выход контрастного вещества из области псевдокисты кзади в виде правильного горизонтального столбика, образовавшего затем вертикальный столб над позвоночником (длинная горизонтальная стрелка). При такой проекции эндоскоп маскирует вторую псевдокисту в нижней правой части рисунка. На операции — несколько псевдокист, из них одна со свежей перфорацией. Иссечены дистальные 2/з поджелудочной железы; спленэктомия с хорошим послеоперационным течением. Перфорация, которая распространяется кзади, как в данном случае, может достигнуть средостения и проникать в плевральное пространство, обусловив не поддающийся лечению плевральный выпот. Перфорация, которая распространяется кпереди, чаще вызывает панкреатический асцит. (Материал докт. R. Norton.)
Медикаментозное лечение асцита преследует две цели — подавление секреции поджелудочной железы и налаживание питания. Для этого применяют препараты, угнетающие секрецию соляной кислоты, такие, как циметидил и про-бантин, а также производят аспирацию желудочного содержимого с помощью зонда. Питание может быть частым дробным, небольшими порциями, пища — преимущественно углеводистой. Применяют также элементарную диету и полное парентеральное питание. Для удаления асцитической жидкости несколько раз пунктируют брюшную полость, после чего накопление асцита может быть минимальным. В некоторых исследованиях описано успешное применение дренажа наружного грудного протока, но в настоящее время этот метод не применяется. Для подавления секреции поджелудочной железы используют диамокс и атропин.
Не решен вопрос о том, когда прекращать лечение. По-видимому, если в течение нескольких недель не удается ликвидировать асцит путем интенсивного лечения с использованием антацидных препаратов, диетических мероприятий,повторных пункций брюшной полости, следует прибегнуть к хирургическим методам. Большинство неоперированных больных умирают, если медикаментозное лечение продолжается более 2 нед. Однако определенная тактика еще не выработана. В тяжелых случаях необходимо исключительно-парентеральное питание по меньшей мере в течение нескольких недель для улучшения общего состояния ослабленных больных с выраженной кахексией. Такая подготовка уменьшает риск операции, которая проходит более успешно. Необходимо проведение ЭРХП для уточнения локализации разрыва протока, псевдокисты или множественных псевдокист, поскольку при эхографии псевдокисты малого размера не видны. ЭРХП осуществляют лишь в тех случаях, когда обязательно проводится хирургическое лечение, так эта процедура может осложниться абсцессом поджелудочной железы. Если выявляется разрыв протока, то во избежание его- инфицирования и попадания бактерий в забрюшинное пространство назначают ампициллин внутривенно в дозе 1 г каждые 4 ч. Иногда антибиотики вводятся профилактически вместе с контрастным веществом прямо в проток или парентерально перед инструментальным исследованием. Небольшая псевдокиста без просачивания контрастного вещества, по-видимому, не требует лечения антибиотиками, если эндоскопическое исследование прошло без осложнений. В общем осложнения после эндоскопического исследования при панкреатогенном асците наблюдаются редко. Обычно через, несколько дней после исследования проводят плановую операцию. Хирургическая тактика заключается в образовании дренажа в соседний полый орган или резекции поджелудочной железы, если псевдокиста располагается в области хвоста. При разрыве протока создают анастомоз с петлей тощей кишки или резецируют диетальный отдел тела или хвоста поджелудочной железы в зависимости от локализации разрыва протока.
Смертность при хроническом панкреатическом асците составляет около 20%. Важное значение для успешного хирургического лечения, уменьшения послеоперационной смертности и профилактики рецидивирования асцита, после операции имеет проведение в предоперационном периоде ЭРХП или контрастирование протоков во время операции.
Питер А. Бенкс Панкреатит, 1982г.
источник
Поджелудочная железа является одним из самых важных органов в организме человека, отвечающим за расщепление пищеварительных ферментов.
При ее воспалении (панкреатите) процесс такого расщепления нарушается, что приводит к выбросу ферментов в желудок и кишечный тракт.
Они становятся очень активными и провоцируют повреждение сосудов железы и кишечника, проникают в кровь, разрушают ткани органов. В результате в брюшине больных может скапливаться жидкость, которая иногда имеет большой объем. Такая патология называется острый панкреатогенный асцит.
Надо отметить, что тяжелая форма заболевания встречается довольно редко и требует немедленной госпитализации. По сути, это внутренний свищ разных размеров, лечение которого проходит сложно, а диагностика порой затруднена.
Если он небольшой, жидкость накапливается медленно, и люди чувствуют дискомфорт, недомогание, но не придают этому особого значения. И обращаются за экстренной помощью только тогда, когда появляется невыносимая боль, живот становится очень большим, и ситуация превращается в критическую. Лучше не допускать этого и тщательно следить за тем, не появились ли признаки заболевания.
Симптомы асцита при панкреатите выражаются в таких явлениях, как:
- Вздутие живота;
- Одышка;
- Снижение веса;
- Побледнение кожных покровов;
- Нарушение свертываемости крови;
- Диабет;
- Боль в животе.
Больным показана операция, но если они не могут перенести хирургическое вмешательство, врачами определяется способ консервативной терапии. Оно подразумевает назначение препаратов, подавляющих секреторную активность поджелудочной железы и восстанавливающих водно-солевой баланс, и парентеральный или энтеральный метод ввода питательных веществ. Если появляется острая дыхательная недостаточность, проводят эндоскопию.
В целом, при асците экссудат через протоки попадает в забрюшинную полость и скапливается в ней в небольших количествах. В этом случае он обычно достаточно быстро рассасывается после того, как проходит воспаление поджелудочной железы, и представляет большой опасности.

Жидкость постоянно собирается, однако процесс часто заканчивается образованием флегмоны либо псевдокисты.
Если у людей, страдающих панкреатогенным асцитом, в крови наблюдается повышенный уровень амилазы, разрывы протоков случаются редко и могут обнаруживаться только при хирургическом вмешательстве.
Что касается вялотекущего панкреатита, то при нем концентрация амилазы значительно снижается, жидкость накапливается и удаляется путем повторения пунктирования брюшной полости.
Прогноз после него в большинстве случаев бывает хорошим, и в дальнейшем асцит не появляется.
Присутствие у пациентов панкреатогенного асцита определяется по ряду исследований. К ним относятся:
- Сбор анамнеза, основывающийся на жалобах больного и наличия у него каких-то болезней;
- Рентген и УЗИ поджелудочной железы;
- Осмотр пациента.
Обследования помогают выяснить объем скопившейся жидкости и установить причину сложившейся ситуации. Также при них при местном обезболивании проводится лапароцентез.
Специальным инструментом прокалывают брюшную стенку больного и забирают часть жидкости. Ее отправляют в лабораторию, где определяется процент лейкоцитов, нейтрофилов, уровень белка, глюкозы, определенных ферментов. Кроме того, жидкость подвергается исследованию на наличие микроорганизмов, опухолевых клеток, туберкулезной палочки.
Лапароцентез проводится быстро и значительно облегчает состояние людей, страдающих асцитом.
Самыми частыми причинами возникновения асцита поджелудочной железы являются:
- Наличие кисты поджелудочной железы;
- Блокировка лимфатических узлов, расположенных в забрюшинной полости;
- Гипертензия грудных лимфатических протоков;
- Белковая недостаточность.
При втором типе клиника выражена не так явно. Жидкость собирается постепенно и образуется на фоне деструктивных процессов, протекающих на небольшом участке кисты. Заболевание выявляется при рентгенологическом обследовании и после проведения лапароцентеза.
Объем экссудата, выходящего в брюшную полость при асците, может достигать десяти литров. Лапароцентез в данном случае помогает удалить жидкость, но стойкого эффекта не имеет. Через короткое время она вновь накапливается, а каждое последующее проведение лапароцентеза приводит к существенной потере белка. Поэтому врачи отдают преимущество хирургическому вмешательству, которое происходит после двух недель терапии фармакологическими средствами. Лечение асцита подразумевает соблюдение насыщенной белками диеты с низким содержанием соли.
Медики назначают мочегонные препараты, антибиотики, средства, снижающие давление в воротной вене (если оно повышено).
Осложнения асцита бывают различными. Он может стать причиной развития перитонита, дыхательной недостаточности, нарушения работы внутренних органов и прочих патологий, вызванных увеличением объема жидкости в брюшине и сдавливанием диафрагмы, печени, желудка. При частом проведении лапароцентезе нередко появляются спайки, мешающие полноценно функционировать кровеносной системе.
Все это является причиной несвоевременного или неверно проводимого лечения. Асцит нуждается в срочных медицинских мерах, иначе он будет прогрессировать и приведет к нежелательным последствиям. Поэтому при первых подозрениях на возникновение болезни следует немедленно обращаться за помощью к специалистам.
Для исключения заболевания важно регулярно проходить профилактическое обследование и своевременно приступать к лечению воспаления поджелудочной железы. Из рациона питания необходимо исключить жареную, соленую, жирную пищу, ограничить потребление кофе, газированных сладких напитков, крепкого чая. Следует полностью отказаться от вредных привычек, как можно больше времени проводить на свежем воздухе и постараться не нервничать по любому поводу. При панкреатите и асците противопоказаны чрезмерные физические нагрузки, поэтому тем, кто занимается спортом, придется довольствоваться легкой зарядкой.
Что такое асцит рассказано в видео в этой статье.
источник
Выпот в полости брюшины при ОП появляется часто, однако панкреатические асциты — достаточно редкое патологическое явление. В некоторых случаях развитие выпотного процесса в брюшной полости не оканчивается благоприятно, реактивный выпот после ОП стабилизируется с тенденцией к медленному накоплению. Причиной его, как отмечено выше, может быть сдавление и тромбоз в системе воротной вены. Наиболее часто это наблюдают при ОП или тяжёлой атаке ХП у больного с циррозом печени — панкреатический выпот на фоне декомпенсации цирроза и нарастающих явлений портальной гипертензии реализуется в настоящий асцит.
Значительно чаще панкреатический асцит возникает постепенно у больных с панкреатическими кистами, дренирующимися в свободную брюшную полость. Способствуют развитию панкреатического асцита следующие факторы: блок забрюшинных лимфатических узлов (парапанкреатит) с гипертензией в грудном лимфатическом протоке, выраженная белково-энергетическая недостаточность по типу квашиоркора.
Выделяют два варианта клинического течения панкреатического асцита. При первом варианте вслед за возникновением острого болевого криза происходит быстрое накопление жидкости в брюшной полости, что обусловлено развитием очагового панкреонекроза с захватом части протоковой системы ПЖ с последующим формированием псевдокисты, сообщающейся с брюшной полостью. Второй вариант характеризуется постепенным накоплением жидкости на фоне субклинического течения ХП, что чаще наблюдают при деструкции небольшого участка хронической кисты ПЖ.
Диагностика не вызывает затруднений. Асцит определяют физикально, подтверждают дополнительными исследованиями (УЗИ, рентгенологические методы). Асциту часто сопутствует плевральный и перикардиальный выпот, особенно у больных с комбинированным генезом асцита (портальная гипертензия, квашиоркор, гипертензия грудного лимфатического протока).
Окончательно диагноз верифицируют при лапароцентезе. Объем жидкости в брюшной полости нередко значителен и может достигать 10—15 л. Получаемая при лапароцентезе жидкость имеет светло-жёлтый цвет, содержание белка не более 30 г/л, при цитологическом исследовании преобладают лимфоциты. Реже асцит имеет хилёзный характер. Активность панкреатических ферментов в асцитической жидкости повышена.
Лапароцентез с максимальной эвакуацией внутрибрюшинной жидкости оказывает временный эффект, выпот в брюшной полости снова быстро накапливается. Повторно проводить лапароцентез не следует, поскольку это лишь симптоматическое лечение, хотя временно оно и улучшает качество жизни пациента. Повторные лапароцентезы усугубляют трофологическую недостаточность и могут провоцировать появление симптомов квашиоркора за счёт массивной потери белка с асцитической жидкостью.
При панкреатическом асците рекомендована фармакотерапии октреотидом (сандостатин) в обычных дозах в течение 2—3 нед, затем проводят хирургическое вмешательство.
Поскольку панкреатический асцит обусловлен преимущественно кистами ПЖ, единственной адекватной мерой можно считать оперативное лечение, причём наиболее безопасное вмешательство — внутреннее дренирование кист. В качестве дополнительного лечении следует использовать медикаментозные воздействия, направленные на лечение алкогольного цирроза, нутритивную поддержку и коррекцию гипопротеинемии, а также мочегонные препараты (спиронолактон).
Плевральный выпот при панкреатитах нередко сопровождает панкреатический асцит и возникает чаще при наличии кисты ПЖ, тесно примыкающей к диафрагме, особенно при её нагноении, а также при образовании панкреатического свища, открывающегося в плевральную полость. Перфорация нагноившейся кисты в плевральную полость приводит к развитию гнойного плеврита.
Диагностика плевритов затруднена лишь при незначительном выпоте, когда физикальное обследование не всегда выявляет патогномоничные плевритические симптомы. Диагноз окончательно устанавливают при помощи рентгенологического исследования органов грудной клетки. Важное диагностическое значение имеет плевральная пункция, позволяющая уточнить характер выпота и определить тактику дальнейшего лечения. Кроме того, при массивном выпоте, особенно гнойном, пункцию плевральной полости можно применять и с лечебной целью (эвакуация экссудата, ликвидация компрессионного ателектаза, введение в плевральную полость антибиотиков и др.).
Панкреатогенную природу выпота подтверждают определением активности в нём панкреатических ферментов. При подозрении на кистозно-плевральную коммуникацию после пункции выполняют контрастное исследование (плеврография с водорастворимым контрастом) с целью выявления такого сообщения или внутреннего панкреатического свища.
Если установлено, что причина плеврального выпота — киста ПЖ, необходимо оперативное вмешательство на самой кисте (внутреннее или наружное дренирование, цистэктомия, левосторонняя резекция ПЖ и др.). В качестве консервативного лечения используют октреотид (сандостатин) в дозе 200 мкг подкожно 3 раза в день в течение нескольких недель, что значительно уменьшает продукцию содержимого кисты.
Негепатогенное варикозное расширение вен пищевода и желудка возникает при сдавлении воротной вены и её ветвей увеличенной головкой ПЖ или панкреатической кистой, либо вследствие их тромбоза. Наиболее опасно профузное кровотечение из варикозно изменённых вен, основные симптомы которого: кровавая рвота или рвота по типу «кофейной гущи», мелена, острая постгеморрагическая анемия, гиповолемия вплоть до геморрагического шока.
Консервативное лечение этого осложнения заключается в адекватной инфузионно-трансфузионной терапии, введении этамзилата и больших доз аскорбиновой кислоты. Для достижения местного гемостаза эффективно использование зонда Блэкмора, которым на несколько часов (до суток) сдавливают кровоточащие варикозно расширенные вены пищевода и кардии. Если таким образом устойчиво остановить желудочное кровотечение не удаётся, прибегают к оперативному вмешательству.
Применяют минимально травматичную операцию — гастротомия и прошивание изнутри кровоточащих вен в области желудочно-пищеводного перехода с предварительной перевязкой левой желудочной и селезёночной артерии. При варикозном расширении вен, вызванном сдавлением воротной вены или её ветвей кистой ПЖ, дренирование или удаление кисты приводит не только к остановке кровотечения, но и к исчезновению варикоза.
Синдром Маллори-Вейсса клинически выявляют менее чем у 3% больных, когда воспалительный или деструктивный процесс в ПЖ проявляется частой или неукротимой рвотой. Морфологическую основу синдрома составляют разрывы слизистой оболочки и подслизистого слоя стенки желудка в области пишеводно-желудочного перехода, преимущественно со стороны малой кривизны. Для возникновения разрывов необходим своеобразный структурный фон в виде дистрофического изменения подслизистого слоя с варикозным расширением сосудов, периваскулярной инфильтрацией и микронекрозами в кардиальном отделе желудка. Не исключено значение субклинических форм портальной гипертензии.
Провоцируют развитие синдрома Маллори—Вейсса те же факторы, которые способствуют атаке панкреатита — приём алкоголя и переедание. В патогенезе основное значение отводят дискорреляции замыкательной функции кардиального и привратникового жомов, на фоне которой провоцирующее действие оказывает внезапное повышение внутрижелудочного давления при рвотном акте. Определённое значение имеет пролапс слизистой оболочки желудка в просвет пищевода, а также наличие небольшой скользящей грыжи пищеводного отверстия диафрагмы.
Клинические проявления синдрома Маллори—Вейсса складываются из классических признаков желудочного кровотечения и симптомов кровопотери. Следует учитывать, что у молодых лиц при отёчных панкреатитах, несмотря на кровотечение, может долто сохраняться высокое АД, не соответствующее величине кровопотери.
Диагностика синдрома Маллори—Вейсса основана на данных экстренной ЭГДС, позволяющей не только установить причину кровотечения и определить глубину разрыва, но осуществить местный гемостаз. При выполнении ЭГДС необходим тотальный осмотр пищевода, желудка и ДПК, поскольку у больных с ОП и обострением ХП нередко можно выявить острые эрозии и язвы.
Лечение синдрома Маллори—Вейсса включает введение противорвотных препаратов: метоклопрамид (церукал) внутримышечно или домперидон (мотилиум) сублингвально в суточной дозе 40 мг. Параллельно проводят гемостатическую и инфузионно-трансфузионную терапию. Консервативное хирургическое лечение состоит во введении зонда Блэкмора (на 12 ч) как основы гемостатической терапии. В современных условиях альтернативным методом считают эндоскопическую диатермическую (биполярную) или лазерную коагуляцию разрывов слизистой оболочки. Обязательно назначение ИПН (омепразол, лансопразол, рабепразол), препятствующих протеолизу сформированного тромба в просвете желудка за счёт выраженного угнетения активности пепсина,
Факторы риска развития острых эрозий и язв у больных панкреатитами:
• пожилой возраст;
• печёночная недостаточность с энцефалопатией;
• дыхательная недостаточность с тяжёлой гипоксемией;
• гиповолемия и связанная с ней гемодинамическая нестабильность;
• гепаторенальный синдром;
• панкреатитогенный перитонит, гнойно-септические процессы в ПЖ и парапанкреатической клетчатке;
• травматичное вмешательство по поводу некротического панкреатита или другого заболевания ПЖ.
Острые эрозивно-язвенные поражения эзофагогастродуоденальной зоны можно обнаружить при систематическом эндоскопическом обследовании у 2/3 больных ОП. Наиболее часто эрозии и язвы локализованы в области дна и тела желудка, реже в ДПК. Острые язвы чаще бывают множественными.
В развитии геморрагического осложнения имеет значение фактор времени — кровотечения наблюдают в сроки от 3 до 20 сут после развития панкреатической деструкции.
В патогенезе острых язв, прогрессирования ранних язвенно-некротических изменений в слизистой оболочке и возникновения вследствие этого острых кровотечений лежат следующие факторы: нарушение микроциркуляции в различных зонах пищеварительного тракта, избыточная стимуляция желудочной секреции на фоне снижения ощелачиваюшей способности панкреатического секрета, дуоденогастральный рефлюкс.
Сочетанное действие ишемии, жёлчных кислот и лизолецитина, гиперсекреции соляной кислоты и возросшей активности пепсина закономерно сдвигает существовавшее ранее равновесие слизистой оболочки в сторону факторов агрессии. Местные нарушения гемостаза нередко сочетаются с дефицитом факторов свёртывания крови из-за нарушения синтетической функции печени у больных алкогольным ХП и ХП, осложнённым подпечёночной портальной гипертензией, гепатопривным синдромом, печёночной недостаточностью.
У большинства больных панкреатитами острые эрозивно-язвенные поражения протекают бессимптомно, крайне редко манифестируют клиникой массивного кровотечения, рвотой «кофейной гущей» и геморрагическим шоком, чаще проявляются меленой, возникающей нередко только через сутки после кровотечения. Ведущее место в диагностике принадлежит эндоскопическому исследованию, хотя заподозрить кровотечение можно и у больных с назогастральными или двухпросветными назоинтестинальными зондами для энтерального питания.
Лечение комплексное, включает местную (при помощи ЭГДС) и системную гемостатичсскую терапию, применение блокаторов желудочной секреции, цитопротекторов и антиоксидантов с последующим введением препаратов, улучшающих микроциркуляцию и репарацию.
Частые ошибки в хирургических стационарах — полная отмена терапии после остановки кровотечения, применение в качестве блокаторов секреции атропина, пирензепина, ранитидина в стандартных дозах или антацидов, что в «эпоху» ИПН совершенно не рационально. Препараты выбора в этой ситуации — омепразол и лансопразол для парентерального введения. При интенсивных кровотечениях эффективно использование октреотида — синтетического аналога соматостатина.
Оперативное лечение острых язв показано при продолжительном или рецидивирующем кровотечении, несмотря на доступные данному учреждению меры системного, местного или эндоскопического гемостаза.
Свищи ПЖ — одна из малоизученных проблем панкреатологии. Это объясняется, прежде всего, относительной редкостью данного осложнения (хотя в последнее время отмечено увеличение числа больных с панкреатическими свищами). Панкреатические свищи всегда связаны с протоковой системой ПЖ, могут локализоваться в головке, теле или хвосте ПЖ.
Панкреатические свищи делят на:
• травматические, постнекротические и послеоперационные;
• полные (терминальные) и неполные (боковые);
• наружные (открываются на кожу или имеют сформированный ход в рану брюшной стенки или прилежащую гнойную полость) и внутренние (открываются в полость кисты ПЖ, соседние органы или другие полости — например, плевральную).
Для диагностики наружного панкреатического свища необходимо определение панкреатических ферментов в свищевом отделяемом и фистулография.
В лечении свищей ПЖ наиболее рационально сочетание консервативного и хирургического способов. Неполные и неосложнённые свищи лечат консервативно по стандартной программе терапии ХП с дополнительной санацией свищевого хода и полостей, ликвидацией мацерации вокруг свищевого хода. Консервативное лечение панкреатических свищей стало значительно более успешным в последнее время в связи с внедрением в панкреатологию октреотида (сандостатина). При использовании данного препарата отмечают снижение количества отделяемого из свищевого хода в 10 раз и более, что позволяет компенсировать водно-электролитные нарушения, адекватно санировать свищевой ход и ликвидировать мацерацию кожи. Существуют данные, что октреотид в суточной дозе 100—300 мкг способствует закрытию свищей более чем у 70% пациентов в течение 6 сут.
Длительное существование панкреатических свищей приводит к различным осложнениям: мальабсорбция за счёт экзогенной потери ферментов; трофологическая недостаточность на фоне мальабсорбции и длительной потери белка, жидкости и микроэлементов с отделяемым из свищевого хода; гнойные осложнения (нагноение свища, абсцессы сальниковой сумки, флегмоны забрюшинного пространства); различные поражения кожи вокруг свищевого хода (язвенный дерматит, экзема) ; аррозивное кровотечение.
Для определения показаний к хирургическому лечению, особенно при длительной (4—6 нед) и неэффективной консервативной терапии, необходимо выполнить фистулографию, при которой можно выявить связь свищевого хода с ГПП, наличие затёков, кистозных образований. Увеличение срока консервативной терапии у больных с панкреатическими свищами ухудшает ближайшие результаты хирургического вмешательства. При полных или терминальных наружных панкреатических свищах, резистентных к фармакотерапии, альтернативой хирургическому вмешательству может быть окклюзиононая терапия — «пломбировка» свища и части протоковой системы ПЖ полимерными материалами.
Гелатопривный синдром — осложнение острых, тяжело протекающих заболеваний ПЖ. Причины гепатопривного синдрома:
• прямое поражение печени при панкреатическом, геморрагическом или травматическом шоке, сочетающемся с травмой ПЖ (так называемая шоковая печень);
• тяжёлый деструктивный панкреатит, протекающий с предельно выраженным эндотоксикозом при неадекватном лечении (так называемая панкрсато-печёночная недостаточность);
• микробная интоксикация при высокоинвазивной или генерализованной инфекции в стадии гнойных осложнений ОП (так называемая инфекционно-токсическая печёночная недостаточность, или септическая печень);
• тромбоз воротной вены;
• оперативное вмешательство на ПЖ (неотложное или плановое) при значительной травматичности и неадекватности анестезиологической защиты, особенно на фоне значительных нарушений функций печени до операции;
• предельно выраженный и длительный холестаз, особенно на фоне гипоксического и токсического поражения печени в связи с хирургической операцией, ОП, абстинентным синдромом, передозировкой гепатотоксичных препаратов и др.
Тяжесть гепатопривного синдрома характеризуется различными по глубине изменениями белоксинтезируюшей функции печени, прежде всего, изменением содержания сывороточных белков (альбумина, трансферрина, сывороточной холинэстеразы), появлением маркёров цитолиза и холсстаза.
Лечение комплексное — этиотропное, патогенетическое и симптоматическое. Этиологические подходы различны и направлены на коррекцию непосредственной причины синдрома. Патогенетически оправдано применение гепатопротекторов (гептрал, урсофальк, эссенциале форте), антиоксидантов (аскорбиновая кислота, олигогая-Se, унитиол и др.), глюкокортикоидов (преднизолон, метилпреднизолон), дезинтоксикационной терапии и нутритивной поддержки. Дезинтоксикация включает не только инфузионную терапию, но и экстракорпоральные методы гемокоррекции (плазмаферез, гемосорбция). Эффективен и пероральный приём энтеросорбентов (энтеросгель, полифан), высокоэффективен приём лактулозы (дюфалак).
Гепатоцеллюлярная недостаточность — крайняя степень гепатопривного синдрома, которая может сопровождать тяжёлые формы ОП, длительный холестаз на фоне блока интрапанкреатического отдела холедоха, билиарнозависимый ХП с длительным блоком общего жёлчного протока конкрементом. Развитие гепатопеллюлярной недостаточности у больных панкреатитами редко бывает молниеносным, как при фульминантном вирусном или лекарственном гепатите; чаще она протекает по затяжному типу, что обусловлено определённым гепатостабилизирующим действием некоторых компонентов интенсивной терапии.
Основное клиническое проявление гепатоцеллюлярной недостаточности — печёночная энцефалопатия. Под термином печёночная энцефалопатия понимают весь комплекс церебральных нарушений, развивающихся вследствие острого или хронического поражения печени. Потенциально обратимые неврологические и психические нарушения варьируют по интенсивности и могут наблюдаться в разных комбинациях, что позволяет выделить стадии (степени тяжести) печёночной энцефалопатии.
Лечение печёночной энцефалопатии остаётся сложной задачей, поскольку элиминация этиологического фактора заболевания далеко не всегда возможна, а используемые в настоящее время терапевтические подходы многокомпонентны и не стандартизированы. Большинство гастроэнтерологов рекомендуют применение низкобелкового питания, использование слабительных средств и различных методов механической очистки кишечника, использование антибиотиков с целью деконтаминации кишечника, промежуточных метаболитов цикла мочевины, аминокислот с разветвлённой цепью, антагонистов бензодиазепиновых рецепторов и друтих средств.
С целью уменьшения образования аммиака в кишечнике применяют лактулозу (дюфалак) — синтетический дисахарид, расщепляющийся в толстой кишке на молочную и уксусную кислоты, снижающие рН в просвете кишки, подавляющие жизнедеятельность аммониетенных бактерий, уменьшающие абсорбцию аммиака. Дозу препарата подбирают индивидуально (от 30 до 120мл/сут). При невозможности применения приёма внутрь препарат назначают в клизме (300 мл сиропа на 700 мл воды 2 раза в день).
Доминирующее значение гипераммониемии в патогенезе печёночной энцефалопатии — основание для назначения препаратов, усиливающих обезвреживание аммиака в печени. Наибольшее распространение получил L-орнитин-L-аспартат.
Возможен дебют гепатоцеллюлярной недостаточности с геморрагического синдрома — возникают носовые и маточные кровотечения, кровоизлияния в местах инъекций и канюлирования вен, подкожные геморрагии на голенях, на местах, подвергавшихся давлению, возрастает вероятность желудочно-кишечных кровотечений.
Лабораторные критерии гепатоцеллюлярной недостаточности при исходном холестазе характеризуются гипербилирубинемией, при этом происходит «смена лидера» — возрастает доля неконъюгированного билирубина. При шоковом поражении печени, послеоперационном гепаторенальном синдроме с исходом в энцефалопатию гипербилирубинемия может быть умеренной. Исчезает гиперхолестеринемия, концентрация общего холестерина в сыворотке крови приближается к нижней границе нормы (3,5 ммоль/л), особенно значительно уменьшается содержание неэстерифицированного компонента холестерина. Резко снижается абсолютное количество альбумина (до 20 г/л), несмотря на стихание стрессорного катаболизма, неотчётливые изменения уровня мочевины и достаточное пластическое обеспечение с помощью искусственного питания.
Предельная гипоальбуминемия нередко сочетается с гиперазотемией. Существенную долю азотистых шлаков составляет азот полипептидов, не усвояемых печенью. Резко снижается активность сывороточной псевдохолинэстеразы и концентрация церулоплазмина, трансферрина, что свидетельствует о глубоких расстройствах белоксинтезирующей функции печени. Для затяжной формы гепатоцеллюлярной недостаточности характерно развитие отёчного синдрома, вплоть асцита, важную роль в развитии которого играет не только прогрессирующая гипопротеинемия и нарастание портального венозного давления, но и снижение дезактивации печенью альдостерона.
Для гепатоцеллюлярной недостаточности характерны значительные сдвиги в коагулограмме: прогрессирующее снижение протромбинового индекса (до 60% и ниже), проконвертина (ниже 40%), умеренное снижение концентрации фибриногена, несмотря на наличие у некоторых больных активного гнойно-воспалительного процесса, который обычно способствует гиперкоагуляции. Одновременно возрастает активность фибринолиза и протеолиза.
Цитолитический лабораторный синдром у таких больных характеризуется признаками неблагоприятного повышения аспартиламинотрансферазы и ложной нормализацией коэффициента de Ritis. Сохраняется высокая активность у-глутамилтранспептидазы, однако в наиболее тяжёлых случаях она снижается. Учитывая существенное уменьшение активности естественных факторов антиоксидантной защиты, даже умеренное повышение ПОЛ (определяют по концентрации малонового диальдегида и диеновых конъюгатов) оказывает неблагоприятное влияние на организм больного с гепатопривным синдромом и может стать причиной нарастания гепатоцеллюлярной недостаточности.
Успешное лечение гепатоцеллюлярной недостаточности возможно только на стадии прекомы. Заместительная трансфузия, которая позволяет поддерживать энергетическое обеспечение и уровень прокоагулянтов (нативпая плазма с большими дозами викасола), не даёт устойчивого эффекта. При использовании энергетических субстратов (глюкоза) следует помнить о снижении толерантности к экзогенному инсулину с возможностью гипогликсмического состояния.
Инфузионное восполнение дефицита альбумина с применением салуретиков (при малоповреждённых почках) позволяет уменьшить выраженность отёчно-асцитического синдрома. Для подавления избыточного бактериального роста показан приём внутрь нерезорбируемых антибиотиков типа канамицина (до 4 г/сут), тобрамицина, полимиксинаи др.
Используют прямые антиоксиданты (витамин Е до 600—800 мг/сут внутримышечно, дибунол внутрь), а также препараты, стабилизирующие эндогенные системы антиоксидантной защиты (унитиол по 5 мл 2—3 раза в сут). Применение гепатопротекторов (гептрал, эссенциале форте и др.) может оказаться неэффективным при сохранении патологических факторов, приведших к гепатоцеллюлярной недостаточности.
Уменьшение выраженности гипербилирубинемии при возрастании концентрации прокоагулянтов и снижении фибринолитической активности крови, стойкая нормализация содержания сывороточного альбумина, церулоплазмина (а позже и активности сывороточной холинэстеразы), снижение экспрессии продуктов ПОЛ в крови при стойком восстановлении сознания больного доказывают высокую эффективность проводимой интенсивной терапии.
источник
Асцит – это вторичное состояние, характеризующееся накоплением экссудата или транссудата в свободной брюшной полости. Клинически проявляется увеличением объема живота, тяжестью, чувством распирания и болями в брюшной полости, одышкой. Диагностика асцита включает проведение УЗИ, КТ, УЗДГ, диагностической лапароскопии с исследованием асцитической жидкости. Для патогенетического лечения необходимо установить причину, вызвавшую скопление жидкости; к симптоматическим мероприятиям при асците относятся назначение мочегонных средств, пункционное удаление жидкости из брюшной полости.
Асцит или брюшная водянка может сопровождать течение самого широкого круга заболеваний в гастроэнтерологии, гинекологии, онкологии, урологии, кардиологии, эндокринологии, ревматологии, лимфологии. Накопление перитонеальной жидкости при асците сопровождается повышением внутрибрюшного давления, оттеснением купола диафрагмы в грудную полость. При этом значительно ограничивается дыхательная экскурсия легких, нарушается сердечная деятельность, кровообращение и функционирование органов брюшной полости. Массивный асцит может сопровождаться значительной потерей белка и электролитными нарушениями. Таким образом, при асците может развиваться дыхательная и сердечная недостаточность, выраженные обменные нарушения, что ухудшает прогноз основного заболевания.
Асцит у новорожденных часто встречается при гемолитической болезни плода; у детей раннего возраста – при гипотрофии, экссудативных энтеропатиях, врожденном нефротическом синдроме. Развитие асцита может сопровождать различные поражения брюшины: разлитой перитонит неспецифической, туберкулезной, грибковой, паразитарной этиологии; мезотелиому брюшины, псевдомиксому, перитонеальный карциноз вследствие рака желудка, толстого кишечника, молочной железы, яичников, эндометрия.
Асцит может служить проявлением полисерозита (одновременного перикардита, плеврита и водянки брюшной полости), который встречается при ревматизме, системной красной волчанке, ревматоидном артрите, уремии, а также синдрома Мейгса (включает фиброму яичника, асцит и гидроторакс).
Частыми причинами асцита выступают заболевания, протекающие с портальной гипертензией – повышением давления в портальной системе печени (воротной вене и ее притоках). Портальная гипертензия и асцит могут развиваться вследствие цирроза печени, саркоидоза, гепатоза, алкогольного гепатита; тромбоза печеночных вен, вызванного раком печени, гипернефромой, заболеваниями крови, распространенным тромбофлебитом и т. д.; стеноза (тромбоза) воротной или нижней полой вены; венозного застоя при правожелудочковой недостаточности.
К развитию асцита предрасполагает белковая недостаточность, заболевания почек (нефротический синдром, хронический гломерулонефрит), сердечная недостаточность, микседема, болезни ЖКТ (панкреатит, болезнь Крона, хроническая диарея), лимфостаз, связанный со сдавлением грудного лимфатического протока, лимфоангиоэктазиями и затруднением лимфооттока из брюшной полости.
В норме серозный покров брюшной полости – брюшина продуцирует незначительное количество жидкости, необходимое для свободного движения петель кишечника и предупреждения склеивания органов. Этот экссудат всасывается обратно самой же брюшиной. При целом ряде заболеваний секреторная, резорбтивная и барьерная функции брюшины нарушаются, что приводит к возникновению асцита.
Таким образом, в основе патогенеза асцита может лежать сложный комплекс воспалительных, гемодинамических, гидростатических, водно-электролитных, метаболических нарушений, вследствие чего происходит пропотевание интерстициальной жидкости и ее скопление в брюшной полости.
В зависимости от причин патология может развиваться внезапно или постепенно, нарастая на протяжении нескольких месяцев. Обычно пациент обращает внимание на изменение размера одежды и невозможность застегнуть пояс, увеличение веса. Клинические проявления асцита характеризуются ощущениями распирания в животе, тяжестью, абдоминальными болями, метеоризмом, изжогой и отрыжкой, тошнотой.
По мере нарастания количества жидкости живот увеличивается в объеме, пупок выпячивается. При этом в положении стоя живот выглядит отвисшим, а в положении лежа становится распластанным, выбухающим в боковых отделах («лягушачий живот»). При большом объеме перитонеального выпота появляется одышка, отеки на ногах, затрудняются движения, особенно повороты и наклоны туловища. Значительное повышение внутрибрюшного давления при асците может приводить к развитию пупочной или бедренной грыж, варикоцеле, геморрою, выпадению прямой кишки.
Асцит при туберкулезном перитоните вызван вторичным инфицированием брюшины вследствие генитального туберкулеза или туберкулеза кишечника. Для асцита туберкулезной этиологии также характерны похудание, лихорадка, явления общей интоксикации. В брюшной полости, кроме асцитической жидкости, определяются увеличенные лимфоузлы вдоль брыжейки кишечника. Экссудат, полученный при туберкулезном асците, имеет плотность >1016, содержание белка 40-60 г/л, положительную реакцию Ривальта, осадок, состоящий из лимфоцитов, эритроцитов, эндотелиальных клеток, содержит микобактерии туберкулеза.
Асцит, сопровождающий перитонеальный карциноз, протекает с множественными увеличенными лимфоузлами, которые пальпируются через переднюю брюшную стенку. Ведущие жалобы при данной форме асцита определяются локализацией первичной опухоли. Перитонеальный выпот практически всегда имеет геморрагический характер, иногда в осадке обнаруживаются атипичные клетки.
При синдроме Мейгса у пациенток выявляется фиброма яичника (иногда злокачественные опухоли яичника), асцит и гидроторакс. Характерны боли в животе, выраженная одышка. Правожелудочковая сердечная недостаточность, протекающая с асцитом, проявляется акроцианозом, отеками голеней и стоп, гепатомегалией, болезненностью в правом подреберье, гидротораксом. При почечной недостаточности асцит сочетается с диффузным отеком кожи и подкожной клетчатки – анасаркой.
Асцит, развивающийся на фоне тромбоза воротной вены, носит упорный характер, сопровождается выраженным болевым синдромом, спленомегалией, незначительной гепатомегалией. Вследствие развития коллатерального кровообращения нередко возникают массивные кровотечения из геморроидальных узлов или варикозно увеличенных вен пищевода. В периферической крови выявляется анемия, лейкопения, тромбоцитопения.
Асцит, сопровождающий внутрипеченочную портальную гипертензию, протекает с мышечной дистрофией, умеренной гепатомегалией. На коже живота при этом хорошо заметно расширение венозной сети в виде «головы медузы». При постпеченочной портальной гипертензии стойкий асцит сочетается с желтухой, выраженной гепатомегалией, тошнотой и рвотой.
Асцит при белковой недостаточности, как правило, небольшой; отмечаются периферические отеки, плевральный выпот. Полисерозиты при ревматических заболеваниях проявляются специфическими кожными симптомами, асцитом, наличием жидкости в полости перикарда и плевры, гломерулопатией, артралгиями. При нарушениях лимфооттока (хилезном асците) живот быстро увеличивается в размерах. Асцитическая жидкость имеет молочный цвет, пастообразную консистенцию; при лабораторном исследовании в ней выявляются жиры и липоиды. Количество жидкости в брюшинной полости при асците может достигать 5-10, а иногда и 20 литров.
В ходе осмотра гастроэнтеролога исключаются другие возможные причины увеличения объема живота – ожирение, киста яичника, беременность, опухоли брюшной полости и т. д. Для диагностики асцита и его причин проводится перкуссия и пальпация живота, УЗИ брюшной полости, УЗДГ венозных и лимфатических сосудов, МСКТ брюшной полости, сцинтиграфия печени, диагностическая лапароскопия, исследование асцитической жидкости.
Перкуссия живота при асците характеризуется притуплением звука, смещением границы тупости при изменениях положения тела. Прикладывание ладони к боковой поверхности живота позволяет ощутить толчки (симптом флюктуации) при постукивании пальцами по противоположной стенке живота. Обзорная рентгенография брюшной полости позволяет идентифицировать асцит при объеме свободной жидкости более 0,5 л.
Из лабораторный тестов при асците проводится исследование коагулограммы, биохимических проб печени, уровней IgA, IgM, IgG, общего анализа мочи. У пациентов с портальной гипертензией показано выполнение ЭГДС с целью обнаружения варикозно измененных вен пищевода или желудка. При рентгеноскопии грудной клетки может выявляться жидкость в плевральных полостях, высокое стояние дна диафрагмы, ограничение дыхательной экскурсии легких.
В ходе УЗИ органов брюшной полости при асците изучаются размеры, состояние тканей печени и селезенки, исключаются опухолевые процессы и поражения брюшины. Допплерография позволяет оценить кровоток в сосудах портальной системы. Гепатосцинтиграфия проводится для определения поглотительно-экскреторной функции печени, ее размеров и структуры, оценки выраженности цирротических изменений. С целью оценки состояния спленопортального русла проводится селективная ангиография – портография (спленопортография).
Всем пациентам с асцитом, выявленным впервые, выполняется диагностический лапароцентез для забора и исследования характера асцитической жидкости: определения плотности, клеточного состава, количества белка и бактериологического посева. При сложно дифференцируемых случаях асцита показано проведение диагностической лапароскопии или лапаротомии с прицельной биопсией брюшины.
Патогенетическое лечение требует устранения причины скопления жидкости, т. е. первичной патологии. Для уменьшения проявлений асцита назначаются бессолевая диета, ограничение приема жидкости, мочегонные препараты (спиронолактон, фуросемид под прикрытием препаратов калия), проводится коррекция нарушений водно-электролитного обмена и снижение портальной гипертензии с помощью антагонистов рецепторов ангиотензина II и ингибиторов АПФ. Одновременно показано применение гепатопротекторов, внутривенное введение белковых препаратов (нативной плазмы, раствора альбумина).
При асците, резистентном к проводимой медикаментозной терапии, прибегают к абдоминальному парацентезу (лапароцентезу) – пункционному удалению жидкости из брюшной полости. За одну пункцию рекомендуется эвакуировать не более 4-6 л асцитической жидкости ввиду опасности развития коллапса. Частые повторные пункции создают условия для воспаления брюшины, образования спаек и повышают вероятность осложнений последующих сеансов лапароцентеза. Поэтому при массивных асцитах для длительной эвакуации жидкости производят установку постоянного перитонеального катетера.
К вмешательствам, обеспечивающим условия для путей прямого оттока перитонеальной жидкости, относятся перитонеовенозный шунт и частичная деперитонизация стенок брюшной полости. К косвенным вмешательствам при асците относятся операции, снижающие давление в портальной системе. В их число входят вмешательства с наложением различных портокавальных анастомозов (портокавальное шунтирование, трансъюгулярное внутрипеченочное портосистемное шунтирование, редукция селезеночного кровотока), лимфовенозное соустье. В некоторых случаях при рефрактерном асците производится спленэктомия. При резистентном асците может быть показана трансплантация печени.
Наличие асцита существенно утяжеляет течение основного заболевания и ухудшает его прогноз. Осложнениями самого асцита могут стать спонтанный бактериальный перитонит, печеночная энцефалопатия, гепаторенальный синдром, кровотечения. К неблагоприятным прогностическим факторам у пациентов с асцитом относят возраст старше 60 лет, гипотонию (ниже 80 мм рт. ст), почечную недостаточность, гепатоцеллюлярную карциному, сахарный диабет, цирроз печени, печеночноклеточную недостаточность и др. По данным специалистов в сфере клинической гастроэнтерологии, двухлетняя выживаемость при асците составляет около 50%.
источник