Цирроз печени характеризуется замещением печеночных клеток на клетки соединительной ткани. При этом происходит разрушение кровеносных сосудов печени. Орган становится неспособным к тому, чтобы пропустить через себя такой же большой объем крови для очищения, как в нормальном состоянии. При этом происходит повышение давления в сосудах системы воротной вены – возникает так называемая портальная гипертензия.
Жидкие компоненты крови пропотевают сквозь стенки сосудов и оказываются внутри брюшной полости. В дальнейшем объем этой жидкости только увеличивается. Кроме того, цирроз печени осложняется поражением лимфатической системы. Это ведет к тому, что лимфа также просачивается через стенки лимфатических сосудов внутрь брюшной полости. Возникает асцит – скопление жидкости внутри брюшной полости. В норме между листками брюшины содержится около 200 мл жидкости. При асците этот объем может увеличиваться до нескольких литров.
По тяжести состояния и количеству скопившейся в животе жидкости асцит делят на следующие виды:
- Малый, при котором объем жидкости не превышает трех литров. При этом внешне патология не видна. Наличие асцита можно диагностировать по результатам УЗИ или при лапароскопии.
- Средний – объем жидкости составляет более трех, но менее 10 литров. Форма живота изменяется, но мышцы брюшной стенки не растягиваются, и уровень диафрагмы остается прежним. Печеночная недостаточность прогрессирует, присоединяются необратимые изменения в деятельности мозга (возникает печеночная энцефалопатия).
- Большой – объем жидкости достигает 10 – 20 литров. Живот видоизменен, растянут, диафрагма приподнимается увеличенной брюшной полостью. Происходит нарушение дыхания (постоянная одышка), затрудняется работа сердечнососудистой системы, отмечаются значительные отеки по всему телу.
В зависимости от того как асцит поддается лечению, заболевание делится на 3 разновидности:
- Транзиторный, или преходящий асцит. При адекватном лечении симптомов заболевания не наблюдается.
- Стационарный асцит. Организм не откликается на консервативное лечение, требуется госпитализация и хирургическое вмешательство.
- Напряженный, или прогрессирующий асцит. Все лечебные мероприятия не дают результата. Заболевание прогрессирует, объем жидкости увеличивается.
Асцит при циррозе печени характеризуется постепенным увеличением размеров живота, изменением его формы и отвисанием. Еще при малом асците в верхней части живота могут появиться сосудистые звездочки на коже. Позднее, при большом асците, вокруг пупка проявляется характерный венозный рисунок (симптом «Головы Медузы»).
Мышцы пупочного кольца растягиваются, пупок оказывается «вывернутым». Позже вены выступают на поверхность по всему животу. Часто возникают грыжи – пупочная, паховая. При простукивании (перкуссии) живота отмечается тупой звук, который в норме должен быть звонким. При диагностических «толчках» пальцами по животу наблюдается явление флюктуации – «расхождения волн». Отмечается напряжение мышц брюшной стенки при пальпации (ощупывании).
Общие принципы лечения направлены на улучшение качества жизни пациента. В первую очередь – на терапию против цирроза. В некоторых случаях при малом и среднем асците состояние больного стабилизируется по мере восстановления функций печени после проведенного специфического лечения.
Консервативная терапия состоит из медикаментозных и немедикаментозных методов. Немедикаментозный – это назначение постельного режима и специальной диеты с ограничением потребления поваренной соли до минимума. Такой метод бывает эффективным на ранних стадиях асцита и всего в десяти процентах случаев. Медикаментозное лечение проводится препаратами:
- мочегонными, или диуретиками (Спиронолактоном, Фуросемидом);
- препаратами, влияющими на метаболические процессы (Гептралом, Карсилом, Эссенциале);
- разжижающими желчь средствами (Урсофальком, Урсосаном);
- витаминно-минеральными комплексами (Альтивилом, Мультитабсом с бета-каротином).
При назначении мочегонных средств обязателен контроль суточного диуреза – ведется подсчет выпитой и выделенной жидкости. Результаты сообщаются лечащему врачу.
При асците с компенсированным циррозом рекомендуется включать в рацион молочную и кисломолочную продукцию, телятину и постную говядину, нежирную рыбу, блюда из яичных белков, гречневой и пшенной круп, соевой муки. Такое питание обусловлено способностью больного организма перерабатывать белки в достаточных количествах.
Стадия декомпенсации цирроза характеризуется резким снижением способности организма к переработке белков. Поэтому диета в данном случае должна быть бессолевой, суточное потребление белка ограничивается до 20 – 25 граммов. При развитии печеночной комы белок исключается полностью, после выхода из комы белок вводится постепенно и крайне осторожно. Блюда должны быть богаты витаминами A, C, группы B, а также микроэлементами – калием, кальцием, фосфором и цинком.
Наиболее соответствующие потребностям больного с асцитом и циррозом печени диеты – это столы № 5 (применяются при заболеваниях печени) и № 10 (для больных с сердечно-сосудистой патологией, где резко снижено количество соли).
При отсутствии эффекта от консервативного лечения проводится пунктирование передней брюшной стенки специальной иглой (троакаром) и удаление скопившейся жидкости (не более 6 литров за сеанс). Чаще всего метод дает временный эффект. Жидкость накапливается снова, приходится делать повторный лапароцентез.
Радикальным методом лечения является устранение причины заболевания. В стадии декомпенсации такое возможно только путем пересадки печени. Однако шанс на трансплантацию органа выпадает очень малому количеству больных.
При малом асците и ответственном отношении пациента к лечению и образу жизни можно прожить от 8 до 10 лет. Организованный режим дня, отказ от вредных привычек, диетическое питание, адекватная физическая нагрузка, наблюдение у врача и своевременное лечение увеличивают шансы.
При среднем асците и декомпенсированной форме цирроза около 20% больных людей живут 5 и более лет. При неподдающемся лечению асците более 50% больных умирают в течение 1 года от начала декомпенсации. Наиболее частый прогноз при асците с циррозом печени – неблагоприятный. Половина больных с таким диагнозом живут не больше 2 лет.
источник
Трансплантация печени (ТП) является наиболее эффективным и единственным радикальным в отношении длительного выживания больных методом лечения хронических болезней печени в терминальной стадии, острой печеночной недостаточности фульминантного течения и некоторых злокачественных опухолей печени. Увеличивающееся с каждым годом количество выполняемых операций (ежегодно до 30 тысяч во всем мире) служит свидетельством признания ТП методом выбора. отнесенная по праву к категории самых сложных трансплантационных хирургических вмешательств за последние два десятилетия эта операция стала рутинной процедурой во многих центрах мира, в том числе и в России [1]. Ее высокая эффективность демонстрируется показателями годичной выживаемости реципиентов — 88%, а пятилетней — 75% [2]. Результаты разнятся в зависимости от нозологической формы заболевания, послужившего показанием к трансплантации, и тяжести исходного состояния больного: при нехолестатических циррозах печени (вирусный, алкогольный) однолетняя выживаемость составляет 86,6%, пятилетняя — 71,4%; при холестатических циррозах — 90,8% и 81,2%; при билиарной атрезии у детей — 90,9% и 82,9%; при фульминантной печеночной недостаточности — 79,9% и 68,9%; при врожденных нарушениях метаболизма — 90% и 79,5%, соответственно. При злокачественных опухолях печени пятилетняя выживаемость больных составляет 50–70% в зависимости от характера опухоли и стадии заболевания.
Потребность в трансплантации печени возникает ежегодно не менее чем у 20–40 человек на 1 миллион населения. При сохраняющейся тенденции к ежегодному медленному росту количества трансплантаций печени в России с использованием ресурсов как прижизненного, так и посмертного донорства, в 2015 году силами 17 центров было выполнено 325 трансплантаций (2,2 на млн населения) [3].
Возрастающий дефицит донорских органов привел к успешному клиническому внедрению альтернативных стандартной ТП технологий: , трансплантации фрагментов печени от живого донора [4], использование органов от субоптимальных посмертных доноров [5].
- Фульминантная печеночная недостаточность. Ее причиной у 30–80% больных служат вирусные гепатиты, 30–50% — химические реагенты и лекарства, 5% — яды, 5% — ишемия и гипоксия печени, 5–10% — метаболические нарушения. Летальность при фульминантной печеночной недостаточности достигает 50–90%. Трансплантация печени должна быть выполнена в течение 2–3 дней до развития необратимых неврологических нарушений (смерть мозга).
- Нехолестатические циррозы печени. Трансплантацию печени у взрослых пациентов проводят по поводу алкогольного цирроза печени в 21,6% случаев, цирроза печени в исходе гепатита С (HCV) — 19,5%, гепатита В (HBV) — 6,1%, криптогенного цирроза печени — 12%, аутоиммунного гепатита (АИГ) — 5%.
- Холестатические циррозы печени. Трансплантацию печени у взрослых пациентов проводят по поводу первичного билиарного цирроза (ПБЦ) в 10,9% случаев, первичного склерозирующего холангита (ПСХ) — 9,9%. Трансплантацию печени у детей выполняют по поводу врожденной билиарной атрезии в 55% случаев.
- Врожденные дефекты метаболизма печени: недостаточность α, болезнь , наследственный гемохроматоз, тирозинемия, первичная гипероксалурия, гликогенозы I и II типа, семейная гиперхолестеринемия.
- Злокачественные опухоли печени: гепатоцеллюлярная карцинома (ГЦК), холангиоцеллюлярный рак (редко), гепатобластома, эпителиоидная гемангиоэндотелиома. Лучшие отдаленные результаты отмечены при фиброламеллярном варианте ГЦК, гепатобластоме, а также метастазах нейроэндокринных опухолей.
Трансплантация по поводу ГЦК обычно ограничивается так называемыми Миланскими критериями (один опухолевый узел не более 5 см в диаметре или 2–3 узла, каждый из которых не более 3 см в диаметре, отсутствие признаков сосудистой инвазии и отдаленных метастазов) [6]. Соблюдение этих критериев позволяет рассчитывать на удовлетворительные отдаленные результаты — 50–70% пятилетнюю выживаемость, менее 10–20% рецидивов. Для уменьшения размеров опухоли (down staging) до операции могут применяться трансартериальная химиоэмболизация, радиочастотная абляция или алкоголизация опухоли [7–9].
Заболевания, служащие редкими показаниями для трансплантации печени: кистозный фиброз печени (муковисцидоз); болезнь/синдром , неалкогольный стеатогепатит; неонатальный гепатит; семейный холестаз или болезнь Байлера, болезнь Аладжила, болезнь Кароли у детей; поликистоз печени; семейная амилоидная полинейропатия (), альвеококкоз.
Противопоказания к ТП Абсолютные:
- развернутая стадия ;
- внепеченочное распространение злокачественных опухолей;
- активная внепеченочная инфекция;
- тяжелое заболевание;
- активный алкоголизм;
- психическое заболевание;
- возраст более 70 лет;
- метастатическое поражение печени.
- высокий кардиологический или анестезиологический риск;
- тромбоз системы воротной вены;
- ранее перенесенные вмешательства на печени;
- возраст более 65 лет;
- некомплаентность больного.
Оценка кандидатов и постановка в лист ожидания
При наличии показаний пациенты проходят детальное обследование по протоколу центра трансплантации и вносятся в лист ожидания. У больных с терминальными поражениями печени в первую очередь исключают противопоказания к операции. При наличии осложнений цирроза печени показана соответствующая патогенетическая терапия для стабилизации состояния больного в период ожидания, чтобы уменьшить риск кровотечения из варикозных вен пищевода, усугубления энцефалопатии и инфицирования асцита, прогрессирования почечной недостаточности при гепаторенальном синдроме. При угрозе кровотечения показано эндоскопическое лигирование вен пищевода.
Степень срочности операции зависит от риска смерти больного в период ожидания, который в свою очередь определяется показателем MELD в баллах (Model for Liver Desease). Последний рассчитывается по уровням билирубина, креатинина и МНО по формуле [10]. Количество баллов может варьировать от 6 до 40, что прогнозирует трехмесячную выживаемость от 100% до 7%, соответственно. Повторные эпизоды кровотечения из варикозных вен пищевода, декомпенсация энцефалопатии, диуретикорезистентный асцит и спонтанный бактериальный перитонит, прогрессирующий гепаторенальный синдром, ГЦК требуют ускорения проведения операции. Больным циррозом печени с MELD менее 15 трансплантация печени не рекомендуется и постановка в лист ожидания может быть отложена. При MELD более 15 риск смерти в листе ожидания превышает операционный.
Операция ТП выполняется с использованием органа или его части от посмертного донора, либо с использованием фрагмента печени, полученного от живого родственного донора. Повторные трансплантации печени (ретрансплантации) составляют до 10% всех операций. После ТП могут возникать разнообразные хирургические, иммунологические и инфекционные осложнения. Периоперационная летальность (до 90 дней) в специализированных центрах, располагающих достаточным опытом, не превышает 5%.
Осложнения в ближайшем послеоперационном периоде:
- Внутрибрюшное кровотечение (10%)ю
- Первичное отсутствие функции трансплантата наблюдается у 2–5% больных в результате ишемического\реперфузионного повреждения донорской печени. Клинические проявления отсутствия функции печени: прогрессирующая энцефалопатия, недостаточность, коагулопатия глубокий метаболический ацидоз, полиорганная недостаточность. Без ургентной ретрансплантации печени в течение 2–3 дней наступает летальный исход.
- Острая почечная недостаточность (до 25%).
- Несостоятельность билиобилиарного или билиодигестивного анастомозов.
- Тромбоз или стеноз печеночной артерии (2–5%) [11].
- Тромбоз воротной вены.
- Стриктуры желчных протоков.
- Острая реакция отторжения в течение первого года может развиться у 25% больных.
- Инфекционные осложнения в раннем послеоперационном периоде развиваются у 65% больных и представлены (35%), бактериальными (16%), вирусными (8%) и грибковыми (6%). На фоне угнетенного иммунитета инфекционные заболевания протекают наиболее тяжело и сопровождаются высокой смертностью. Так, летальность при внутрибрюшной инфекции достигает 20–90%, пневмонии — 30–50%, а при развитии сепсиса — 30–80%.
Медикаментозная иммуносупрессия назначается сразу после операции и продолжается пожизненно. Современные протоколы являются многокомпонентными и могут варьировать в зависимости от особенностей больного, первичного заболевания печени, почечной функции и развившихся осложнений, побочных эффектов [12].
Не существует универсального протокола иммуносупрессии для всех пациентов. На этапе индукции коротким курсом могут применяться гуманизированные моноклональные антитела (базиликсимаб). В дальнейшем иммуносупрессия поддерживается индивидуальной комбинацией из следующих препаратов:
- ингибиторы кальциневрина (циклоспорин или такролимус);
- глюкокортикоиды (метилпреднизолон или преднизолон);
- микофенолаты (микофеноловая кислота или микофенолата мофетил);
- ингибиторы пролиферативного сигнала (сиролимус, эверолимус).
Выбор препарата или нескольких и их доз определяется по совокупности клинических, лабораторных, гистологических данных. Дозирование ингибиторов кальциневрина осуществляется под контролем концентрации препарата в крови. Целевой уровень такролимуса через три месяца после трансплантации — 5–10 нг/мл, циклоспорина — 100–150 нг/мл, эверолимуса — 3–8 нг/мл. С течением времени риск отторжения трансплантата уменьшается. Уже к 90 дню после ОТП потребность в иммуносупрессии существенно снижается. Длительная иммуносупрессия может сопровождаться развитием побочных эффектов. Развивающиеся артериальная гипертензия, посттрансплантационный сахарный диабет, гиперлипидемия, ожирение, подагра и почечная дисфункция могут потребовать изменения схемы иммуносупрессии и назначения соответствующей терапии.
Даже современная длительная иммуносупрессия чревата известными негативными последствиями, такими как увеличение риска бактериальной, вирусной и грибковой инфекции, новообразования, в том числе пострансплантационные лимфопролиферативные заболевания. В больщинстве случаев с течением времени после ТП возможна ее минимизация. При выписке из стационара 90% больных получают такролимус, 10% — циклоспорин, 60% — микофенолаты, только 20% — глюкокортикоиды [13]. Через год после операции большинство больных получают иммуносупрессию в виде монотерапии такролимусом. Больным с аутоиммунными заболеваниями целесообразно продолжать прием преднизолона в дозе 5 мг/сутки.
Динамика клинических проявлений цирроза печени после трансплантации
Чаще всего проявления недостаточности и портальной гипертензии разрешаются полностью при нормальной функции трансплантата. Исключением может быть резидуальная спленомегалия. Явления печеночной энцефалопатии в отдаленном послеоперационном периоде могут развиваться при дисфункции трансплантата или наличии персистирующего шунта. Сохраняющиеся отеки или асцит могут быть проявлением стеноза нижней полой или воротной вены. Персистирующий асцит, особенно у пациентов с возвратным гепатитом С, — плохой прогностический признак.
Ведение больных после успешной трансплантации печени
Наибольшее количество летальных исходов или ретрансплантаций приходится на первый год после трансплантации. По истечении 12 месяцев на первое место среди причин смерти выходят заболевания и злокачественные опухоли. С увеличением срока после трансплантации в структуре причин нарушения или утраты функции трансплантата возрастает значение возврата исходного заболевания, особенно ГЦК, гепатита С, аутоиммунного заболевания.
заболевания и почечная недостаточность являются ведущими внепеченочными причинами заболеваемости и смертности реципиентов печени. Возврат исходного заболевания: гепатита С, первичного билиарного цирроза, первичного склерозирующего холангита, аутоиммунного гепатита, ГЦК также увеличивает заболеваемость и смертность. Стремление к минимизации иммуносупрессии, сохранение почечной функции, предупреждение и лечение возврата основного заболевания, контроль метаболических и осложнений, онкологический скрининг — необходимые условия для превращения хирургического успеха в продолжительную здоровую жизнь реципиента с пересаженной печенью.
Причины дисфункции трансплантата
Дисфункция пересаженной печени, проявляющаяся клинически (асцит, желтуха, гепатомегалия, кожный зуд, лихорадка) или только биохимическими отклонениями, может развиваться на любых сроках в результате причин, основные из которых приведенных ниже.
Паренхиматозное повреждение трансплантата:
- Иммунное: острое или хроническое отторжение.
- Возврат заболевания: HCV, HBV, ПБЦ, ПСХ, АИГ и др.
- Лекарственная токсичность (включая иммуносупрессанты).
- Алкоголь и другие токсины.
- Инфекция de novo (включая HBV и HCV).
- Рецидив ГЦК.
- Лимфопролиферативное заболевание.
- De novo или возвратный стеатогепатит.
Повреждение желчевыводящих протоков:
- Стриктуры (анастомотические или внутрпеченочные).
- Желчные конкременты/.
- Возврат ПСХ.
- Холангит.
- Тромбоз или стеноз печеночной артерии.
- Тромбоз воротной или печеночных вен.
Отторжение, развивающееся по истечении 90 дней после ОТП, определяется как позднее. Отторжение трансплантата как острое, так и хроническое, становится все более редкой причиной смерти или ретрансплантации.
Выделяют две формы позднего отторжения: клеточное и гуморальное (дуктопеническое -синдром исчезающих желчных протоков), которые могут проявляться лишь биохимическими изменениями. Для установления диагноза выполненяется биопсия трансплантата. Развитию позднего отторжения способствуют следующие факторы:
- уменьшение супрессии (ятрогенное или в результате несоблюдения рекомендаций больным);
- аутоиммунное заболевание печени;
- противовирусная терапия гепатита С интерфероном;
- рецидивирующее или неподдающееся лечению клеточное отторжение;
Лечение отторжения, доказанного биопсией, начинают с метилпреднизолоном, которая оказывается эффективной более чем в 90% случаев.
Заболевания почек Через пять лет после трансплантации печени 4 стадия хронической болезни почек (ХБП) отмечается у 18%, через 10 лет — у 25% больных. Терминальная почечная недостаточность развивается в 5–8% случаев в течение первых 10 лет после трансплантации печени [14].
Факторы риска ХБП включают в себя как распространенные в обычной популяции (артериальная гипертензия, сахарный диабет, ожирение, атеросклероз, гиперлипидемия), так и специфические для реципиентов печени (токсичность ингибиторов кальциневрина, хроническая , предшествующие болезни почек при циррозе печени и периоперационное повреждение почек). Для своевременной коррекции факторов риска необходим постоянный мониторинг почечной функции.
В основе профилактики и лечения лежит тщательный контроль артериальной гипертензии и применение блокаторов системы. Распространенной тактикой при прогрессировании почечной дисфункции является уменьшение дозы или полная отмена ингибиторов кальциневрина через несколько месяцев или лет после трансплантации печени. В этом случае основным иммуносупрессантом может быть сиролимус или эверолимус, часто в комбинации с микофенолатами.
На фоне иммуносупрессии возрастает частота развития оппортунистических бактериальных и рецидивирующих вирусных инфекций. В различные сроки после трансплантации печени у 50–70% пациентов может манифестировать цитомегаловирусная (ЦМВ) инфекция, обусловленная инфицированием после операции либо реактивацией вируса. В большинстве случаев после трансплантации печени необходимо проводить профилактику цитомегаловирусной инфекции валганцикловиром длительно (100–200 дней).
Наиболее опасным в отношении инфекционных осложнений является период до шести месяцев после ОТП. При сроках более трех месяцев наиболее часто инфекционный процесс локализуется в брюшной полости, легких и вызывается внебольничными возбудителями ( возбудители кишечных инфекций, S. pneumonia, респираторные вирусы).
Частота возникновения рака de novo у реципиентов печени выше, чем в общей популяции. Кумулятивная частота составляет 3–5% к трем годам и 11–20% к десяти годам после операции. Реципиентам печени рекомендуется минимизировать факторы риска онкологических заболеваний: исключить инсоляцию, курение, а также проходить стандартный скрининг наиболее распространенных новообразований чаще, чем представителям общей популяции. Больным ПСХ рекомендуется проводить колоноскопию с биопсией для раннего выявления колоректального рака.
При трансплантации печени по поводу ГЦК частота рецидивов зависит от размеров опухоли: к четырем годам после ОТП рецидив отмечается у 10% реципиентов, подходивших под миланские критерии, и у 40–60% реципиентов, выходивших за них [15]. В качестве скрининга рекомендуется проведение компьютерной томографии органов брюшной полости каждые шесть месяцев в течение трех лет после трансплантации печени по поводу ГЦК.
Учитывая проонкогенный эффект ингибиторов кальциневрина, целесообразно включение в схему иммуносупрессии ингибиторов пролиферативного сигнала, обладающих противоопухолевым действием [16]. Улучшения результатов операций по поводу ГЦК можно ожидать при более строгом отборе кандидатов, проведении неоадъювантного локорегионального лечения [9], сокращении сроков ожидания операции, учете клиникопатологических и молекулярных особенностей (биомаркеров) опухоли [7, 8].
Современные схемы профилактики позволяют избежать рецидива в трансплантате у более чем 90% реципиентов. Для снижения риска рецидива заболевания во время и после трансплантации печени назначают высокие дозы специфического иммуноглобулина в сочетании с аналогами нуклеозидов/нуклеотидов. В случае низкой вирусной нагрузки или авиремии до трансплантации и при отсутствии факторов риска рецидива гепатита В иммунопрофилактика может не проводиться, но противовирусная терапия должна быть продолжена длительно.
Возврат в трансплантате неизбежен при наличии виремии до трансплантации. У большинства реципиентов развивается вирусный гепатит С трансплантата в течение первого года, что подтверждается при морфологическом исследовании биоптата. Хотя скорость прогрессирования фиброза без противовирусной терапии варьирует, в среднем цирроз трансплантата развивается в течение 8–10 лет. К пяти годам после ОТП цирроз развивается у 30% пациентов. В течение первого года после верификации цирроза риск декомпенсации составляет 15–30%. Цирроз трансплантата в исходе хронического гепатита С — наиболее частая причина потери трансплантата. пятилетняя выживаемость HCV — инфицированных реципиентов печени на 10% ниже, чем . Комбинированная противовирусная терапия пегилированными интерферонами с рибавирином после трансплантации печени может быть начата при морфологически доказанном прогрессировании заболевания: средняя и тяжелая степень некроза и инфильтрации (3 и выше) либо начальная или средняя стадия фиброза (2 и выше); либо при холестатическом гепатите. Целью противовирусной терапии, как и при гепатите С до трансплантации, является достижение устойчивого вирусологического ответа, который улучшает прогноз пациентов. Что касается тройной терапии, боцепревир и телапревир не могут быть рекомендованы пациентам, получающим ингибиторы кальциневрина и ролиферативного сигнала в силу лекарственного взаимодействия. В последнее время появились новые, весьма многообещающие, особенно в области трансплантации, препараты прямого противовирусного действия для безинтерфероновой терапии гепатита С. В ходе проведенных и текущих многоцентровых исследований получены впечатляющие, можно сказать, революционные результаты применения подобных препаратов с достижением ранее невозможной доли устойчивого вирусологического ответа (более 90%), в том числе в сложных случаях: при 1 генотипе вируса, развитии цирроза трансплантата, неудачной терапии с интерфероном, при фиброзирующем холестатическом гепатите у больных после трансплантации. Перспективным представляется применение безинтерфероновой терапии до ТП, поскольку позволит добиться элиминации вируса, снизить риск ГЦК и, возможно, избежать трансплантации. Прямые противовирусные агенты — оптимальное решение для больных после трансплантации, позволяющее вылечить хронический гепатит C без риска отторжения и инфекций (17–19].
Первичный билиарный цирроз
Трансплантация печени по поводу ПБЦ характеризуется наилучшими показателями выживаемости по сравнению с другими нозологиями, несмотря на сохраняющееся системное заболевание. После пересадки сохраняются иммунологические отклонения, такие как повышение уровня иммуноглобулинов и аутоантител. Кроме того актуальными остаются проблемы остеопороза, заболеваний щитовидной железы, которые требуют контроля. Возможно развитие возвратного ПБЦ трансплантата, диагноз которого устанавливается морфологически и не коррелирует с наличием биохимических отклонений или антимитохондриальных антител. Возврат ПБЦ оказывает минимальное влияние на функцию трансплантата и выживаемость. Цирроз трансплантата развивается менее чем в 5% случаев.
Первичный склерозирующий холангит
Пациенты с ПСХ также имеют хорошие перспективы после трансплантации печени, несмотря на известные риски. Так, при формировании билиодигестивного анастомоза увеличивается вероятность рецидивирующего холангита, при сохранении собственного желчного протока возможно развитие холангикарциномы, при наличии язвенного колита отмечается высокая частота развития полипов и колоректального рака. Течение язвенного колита может как ухудшиться, так и улучшиться после трансплантации. В любом случае, всем реципиентам с ПСХ рекомендуется проведение колоноскопии с биопсией как минимум раз в год. Возврат ПСХ в трансплантате наблюдается у половины пациентов в течение пяти лет после ОТП, в 25% случаев возврата происходит потеря функции трансплантата. Диагноз устанавливается на основе результатов биохимических, лучевых, гистологических методов диагностики при исключении инфекции или ишемии в результате тромбоза печеночной артерии. Факторами риска возврата ПСХ являются мужской пол, анамнез рецидивирующего или отторжения, активный язвенный колит после операции, применение антилимфоцитарных агентов для лечения клеточного отторжения, несовпадение пола донора и реципиента, и некоторые , например DRB1*08. Колэктомия у реципиентов с язвенным колитом не оказывает влияния на частоту рецидивов ПСХ.
Результаты трансплантации печени при аутоиммунном гепатите считаются хорошими. Может обсуждаться проведение протокольных биопсий каждые пять лет после операции. Прогнозы выживаемости при возврате аутоиммунного гепатита достаточно разнообразны. Хотя большинство пациентов хорошо отвечает на увеличение иммуносупрессии как клинически, так и биохимически и гистологически, редко развивается цирроз трансплантата, требующий ретрансплантации. Несмотря на то что нет достаточных доказательств, логичным можно считать назначение низких доз кортикостероидов на длительный срок в дополнение к стандартной иммуносупрессии с контролем побочных эффектов глюкокортикоидов.
Неалкогольная жировая болезнь печени (НАЖБП)
НАЖБП после ТП как возвратная, так и de novo наблюдается довольно часто, что обусловлено длительной иммуносупрессией в сочетании с несоблюдением рекомендаций по поводу диеты и образа жизни. Так, среди реципиентов с исходным циррозом в исходе жировой болезни или циррозом неясного генеза 50–70% набирают лишний вес в течение первого года. Факторы риска НАЖБП после ТП те же, что и при метаболическом синдроме: высокий индекс массы тела, сахарный диабет, артериальная гипертензия, гиперлипидемия и стеатоз при биопсии трансплантата. Иммуносупрессанты потенцируют метаболические нарушения: кортикостероиды и такролимус провоцируют развитие сахарного диабета, сиролимус и эверолимус вызывают дислипидемию, циклоспорин и такролимус способствуют развитию артериальной гипертензии [20].
Готье С. В. , Мойсюк Я. Г. , Попцов В. Н. и др. Отдаленные результаты трансплантации трупной печени. Вестник трансплантологии и искусственных органов. Том XVI. № 3–2014, с. 4 -53.
Health Resources Services Administration, of Health & Human Services: Organ Procurement and Transplantation Network. http://optn.transplant.hrsa.gov.
Готье С. В., Хомяков и трансплантация органов в Российской Федерации в 2015 году. VIII сообщение регистра Российского трансплантологического общества. Вестник трансплантологии и искусственных органов. Том XVIII. № 2–2016, с. 6–26.
Lee SG: A complete treatment of adult living donor liver transplantation: A review of surgical technique and current challenges to expand indication of patients. Am J Transplant 15: 17–38, 2015.
Feng S, Goodrich NP, JL, et al: Characteristics associated with liver graft failure: The concept of a donor risk index. Am J Transplant 6: 783–790, 2006.
Mazzaferro V, Regalia E, Doci R, et al: Liver transplantation for the treatment of small hepatocellular carcinomas in patients with cirrhosis. N Engl J Med 334: 693–699, 1996.
Silva MF, Sherman M: Criteria for liver transplantation for HCC: What should the limits be? J Hepatol 55: 1137–1147, 2011.
Kakodkar R, Soin AS: Liver transplantation for HCC: A review. Indian J Surg 74: 100–117, 2012.
Raza A, Sood GK: Hepatocellular carcinoma review: Current treatment, and medicine. World J Gastroenterol 20: 4115–4127, 2014.
Yao FY, Mehta N, Flemming JA, et al: Downstaging of hepatocellular cancer before liver transplant: outcome compared to tumors within Milan Criteria. Hepatology 61: 1968–1977, 2015.
Kamath PS, Wiesner RH, Malinchoc M, et al: A model to predict survival in patients with liver disease. Hepatology 33: 464–470, 2001.
Stewart ZA, Locke JE, Segev DL, et al: Increased risk of graft loss from hepatic artery thrombosis after liver transplantation with older donors. Liver Transpl 15: 1688–1695, 2009.
Pillai AA, Levitsky J: Overview of immunosuppression in liver transplantation. World J Gastroenterol 15: 4225–4233, 2009.
Sgourakis G, Radtke A, Fouzas I, et al: immunosuppression in liver transplantation: A and of outcomes. Transpl Int 22: 892–905, 2009.
Ojo A. O., Held P. J., Ph. D., Port F. K. et al. Chronic Renal Failure after Transplantation of a Nonrenal Organ N Engl J Med 2003; 349: 931–940.
Marsh JW, Schmidt C: The Milan criteria: No room on the metro for the king? Liver Transpl 16:252–255, 2010.
Klintmalm GB, Nashan B: The role of mTOR inhibitors in liver transplantation: Reviewing the evidence. J Transplant 2014: 845438, 2014.
Meissner EG, Nelson A, Marti M, et al: Sustained virologic response for chronic hepatitis C infection after 27 days of treatment with sofosbuvir and ribavirin. Open Forum Infect Dis 1: 013, 2014.
JF, Charlton M: Treatment of HCV prior to liver transplantation to prevent HCV or wasteful? Liver Int 35: 9–11, 2015.
Kutala BK, Guedy J, Asselah T, et al: Impact of treatment against hepatitis C virus on overall survival of naive patients with advanced liver disease. Antimicrob Agents Chemother 59: 803–810, 2015.
Lucey M. R., Terrault N., Ojo L. [et al.] management of the successful adult liver transplant: 2012 practice guideline by the American Association for the Study of Liver Diseases and the American Society of Transplantation // Liver Transplantation. — 2013. — 1: Vol. 19. p. 3–26.
источник
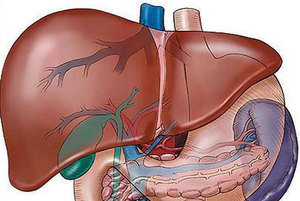
С этого и начинает своё развитие цирроз, что значительно укорачивает продолжительность жизни человека, не говоря уже об ухудшении качества жизни. При повышении давления и застое цирроза может развиться одно из самых опасных осложнений — асцит.
При проявлении симптомов асцита, — сильное вздутие живота, кровотечение из носа или вен пищевода, — можно констатировать факт запущенности цирроза. Асцит проявляется в результате повышения давления и накопления жидкости в брюшной полости. Если в обычном состоянии брюшная полость содержит в себе небольшое количество жидкости (примерно 200 мл), то при асците может накопиться до нескольких литров.
Асцит может быть нескольких типов. Типы дифференцируются при определении количества жидкости, находящейся в брюшной полости. Таким образом, можно выделить следующие три типа:
- Жидкости содержится до трёх литров, и прогноз на выздоровление самый оптимистичный;
- Больше трёх литров жидкости, наблюдаются признаки печёночной энцефалопатии;
- Жидкости накапливается больше двадцати литров, наблюдаются проблемы с передвижением и затруднения с дыханием.
Разные типы асциты при циррозе печени лечатся по-разному. Если первые два типа поддаются лечению и довольно уязвимы к медицинскому воздействию, то третий тип может вызвать сложности с его лечением. Следует следить за своим здоровьем, что избежать накапливания такого огромного количества жидкости в брюшной полости. Но, сколько жидкости ни накопилось, следует прибегнуть к лечению немедленно, чтобы не вызвать осложнений и фатальных последствий.
Итак, при назначении диеты, запрещается употребление всех солёных и острых блюд. Соль, вообще, должна употребляться в очень ограниченном количестве — не более пяти грамм. Также запрещается употребление блюд с содержанием пищевой соды. Таким образом, нельзя есть выпечку и пить минеральную воду. Особенно строго при асците регулируется количество потребляемой жидкости (до 1-1,5 литра в сутки).
Также при осуществлении лечебных мероприятий следует упомянуть о рекомендации врачей соблюдать постельный режим, так как именно в этом положении почки лучше фильтруют жидкость, что положительно влияет на процесс выздоровления хоть и не радикально, но всё же.
Самым идеальным и безупречным (если не учитывать материальный фактор) вариантом излечения цирроза печени является пересадка печени. При соблюдении дополнительного лечения вкупе с пересадкой это может существенно продлить человеку жизнь. Но трудности возникают с тем, что сама трансплантация является очень сложной и дорогой операцией. К тому же органов хватает далеко не всем пациентам, страдающим от данного недуга. Поэтому такое решение проблемы с асцитом и циррозом печени доступно, к сожалению, не всем.
Для того чтобы всё-таки побороть асцит, следует незамедлительно начать его лечение. Нельзя не упомянуть о том, что на современном этапе развития медицины, полное и безоговорочное избавление от цирроза печени невозможно. Но, если соблюдать все предписания врача, то можно улучшить прогноз и общее состояние больного. Жить с циррозом трудно, сложно, но эффективных препаратов, которые точно смогут побороть этот недуг, увы, нет.
Врачи выписывают препараты, которые влияют на смягчение или устранение симптомов цирроза печени. Лечение асцита направлено на уменьшение количества жидкости, скопившейся в брюшной полости. В основном против асцита при циррозе печени выписываются препараты мочегонного действия для уменьшения общего количества жидкости в организме, что влияет на количество скопившейся жидкости непосредственно в брюшной полости.
К сожалению, медики констатируют тот факт, что лечение посредством мочегонных препаратов не ведёт к каким-то значительным последствиям в плане выздоровления.
Для избавления от асцита врачи рекомендуют прибегнуть к проведению специальной процедуры, называемой пункцией. Её цель состоит в том, чтобы избавить пациента от накопившейся жидкости. После применения местного наркоза хирург прокалывает толстой иглой вздувшуюся брюшную полость пониже пупка, затем производит выкачивание лишней жидкости. За один сеанс пункции возможно удалить лишь до шести литров жидкости. В противном случае возникает риск резкого повышения артериального давления, что может повлечь за собой серьёзные последствия.
Если пациент прибег к пункции, страдая от асцита первого или малого асцита, то прогноз весьма и весьма благоприятен. Данная процедура вкупе со строгой диетой и постоянным медикаментозным лечением может продлить пациенту жизнь на восемь или даже на десять лет. При других, более тяжёлых типах асцита, пункция ведёт лишь к облегчению участи больного, уменьшая его страдания.
На данный момент ведётся активная деятельность по исследованию данного заболевания для обнаружения новых методов излечения асцита и цирроза печени в целом. Медицина на современном этапе активно развивается, и есть надежда, что уже в недалёком будущем будут найдены решения для излечения больных циррозом печени.
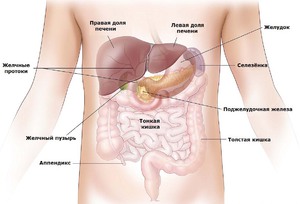
При циррозе печени ни один человек, ни один врач, не может с уверенностью сказать больному, сколько ему осталось. Но медицина позволяет относительно точно спрогнозировать развитие недуга и будущее состояние человека после диагноза и назначения лечение.
Чтобы ответить на вопрос насчёт продолжительности жизни больного циррозом печени и страдающего от асцита, следует отследить медицинскую дифференциацию типов асцита по «поведению» скопившейся жидкости в брюшной полости. По данному критерию различают пять типов, каждый из которых будет рассмотрен ниже.
-
Первый тип — Транзиторный. Этот тип поддаётся лечению и считается самым лёгким. Его можно вылечить при осуществлении постоянного лечения и при проведении процедуры пункции. Особых проблем с жидкостью не возникает. Асцит протекает не тяжело.
- Второй тип — Стационарный. При этом типе уже возникают трудности. Обычный темп лечения и консервативные методы не помогут. Жидкость просто не будет выходить в тех объёмах, в каких хотелось бы. Можно вылечить только в результате осуществления нескольких сеансов пункции.
- Третий тип — Напряжённый. Этот типа уже может считаться опасным и трудноизлечимым. При напряжённом асците количество жидкости в брюшной полости не убавляется, несмотря на все усилия медиков. В худшем случае жидкость может даже прибывать. Поможет лишь операционный метод решения проблемы.
- Четвёртый тип — Рефракторный. Лечение данного типа асцита вполне может помочь. В этом случае врачи выдают довольно оптимистичные прогнозы насчёт избавления от асцита. Болезнь поддаётся лечению и осложнений обычно не предвидится.
- Пятый тип. Нерефракторный. Данный тип асцита при циррозе печени уже не поддаётся лечению. В этом случае уже ни лечение, ни хирургическое вмешательство не поможет с проблемой. К сожалению, но факт остаётся фактом. Нерефракторный тип асцита самый сложный и трудноизлечимый тип этого недуга Жить с ним долго практически невозможно.
Чтобы всё-таки спрогнозировать продолжительность жизни человека, страдающего от асцита при циррозе печени, нужно знать стадию развитию болезни. После определения стадии заболевания, можно примерно определить сколько человеку дано ещё прожить. К сожалению, асцит укорачивает жизнь и в некоторых случаях намного.
Асцит образуется в течение десяти лет после непосредственного диагностирования этой проблемы.
- Первая и вторая стадии асцита позволит больному прожить ещё семь лет после обнаружения заболевания.
- Третья и четвёртая стадии уже не поддаются лечению, в таком состоянии больной может прожить не более трёх лет.
Но при резком прогрессировании асцита этот срок может быть укорочен ещё на два года. Из этого следует, что при двух последних стадиях, в условиях прогрессирования недуга, больной проживёт лишь год.
На начальных стадиях развития недуга ещё остаётся надежда на выздоровление и на избавление от мучений, которые приносит с собой развитие этого тяжёлого симптома. На более поздних стадиях развития уже ничего невозможно сделать, поэтому лучше не допускать запущения проблемы, чтобы не укорачивать себе жизнь намного.
Разочаровывает тот факт, что современная медицина не может однозначно избавлять страдающих от цирроза печени от этой страшной болезни. Препараты и хирургическое вмешательство лишь избавляет от страданий, а трансплантация печени доступна далеко не всем пациентам. Остаётся только надеяться, что в самое ближайшее время данная проблема будет решена, и тогда огромное количество людей получат надежду на полное выздоровление и на здоровую жизнь без цирроза печени и его тяжёлых симптомов.
источник
Сайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна!
Печень является одним из жизненно важных органов. Современные врачи уже научились пересаживать большинство органов. Самой дорогой является пересадка печени.
Первая трансплантация печени была осуществлена в 1963 году в Денвере. Донором был умерший человек. Особый статус операция имеет, в том числе, и потому, что ткани печени очень легко повреждаются. Поэтому сохранить и пересадить орган в целостности очень сложно. Еще одной проблемой была работа иммунной системы больного, которая всеми силами отторгала чужеродные ткани. И только к 80-м годам проблема была решена – были созданы лекарства, предупреждающие разрушение пересаженного органа иммунитетом реципиента (получателя).
Больше всего пересадок осуществляется ежегодно в США, Японии и Европейских странах. Сегодня количество пересаженных органов исчисляется тысячами в год. Но даже при таких количествах операций далеко не все нуждающиеся до них доживают. Пересадку осуществляют, в основном, в специальных центрах.
В конце 80-х годов в трансплантации печени произошел значительный сдвиг. То, что ткани печени способны к регенерации, врачам было известно давно. И именно этот факт натолкнул ученых на идею о трансплантации части печени. Методика такой пересадки была разработана в Соединенных Штатах Америки. Для трансплантации изымали из организма кровного родственника левую часть печени. Ее и пересаживали больному.
Подобное решение вопроса очень выгодно с нескольких точек зрения:
1. Орган обычно достаточно хорошего качества.
2. В некоторых странах религия не разрешает брать органы у трупов.
3. То, что орган уже есть и его не нужно искать, дает врачам возможность тщательно подготовиться.
Дать часть своего органа может лишь кровный родственник, которому уже исполнилось 18 лет. Группы крови, в лучшем случае, должны быть одинаковыми, в крайнем случае — совместимыми.
Если пересаживают от взрослого ребенку, нужна лишь одна половина левой доли.
Современные российские ученые разработали методику пересадки правой доли. До нее легче добраться, она быстрее приживается, так как имеет большие размеры. Причем это не ухудшает состояния донора.
- Гепатиты вирусные (кроме А),
- Врожденные аномалии развития,
- Гепатиты аутоиммунной природы: склерозирующий холангит, билиарный цирроз печени в первичной форме,
- Болезнь Вильсона,
- Поликистоз печени,
- Гемохроматоз,
- Онкологические заболевания печени (не всегда),
- Муковисцидоз,
- Нарушение метаболизма альфа-1-антитрипсина,
- Печеночная недостаточность в острой форме, вызванная отравлением.
Перечисленные заболевания вызывают увеличение количества соединительных волокон в тканях печени. Постепенно их становится так много, что печень перестает выполнять свою функцию. Печень является незаменимым органом, так как она обеспечивает выведение ядовитых веществ из организма, терморегуляцию, метаболизм, переработку пищи.
На окончательной стадии разрушения органа у пациента появляются асцит, кровотечения в органах пищеварения, желтуха, ухудшается сон, увеличивается диаметр пищеводных вен. На такой стадии болезни пациенту грозит печеночная кома и летальный исход.
Если больным, например, с почечной недостаточностью, можно проводить гемодиализ, то работу печени никакими приборами пока заменить невозможно. И единственным шансом к спасению жизни является пересадка печени.
Временным решением проблемы неработающей печени является альбуминовый гемодиализ. Но эта процедура может помочь на считанные часы. Чаще всего ее назначают уже после трансплантации, до тех пор пока уже пересаженный орган не начнет свою работу.
Существует всего два источника донорской печени:
1. От погибшего человека, у которого совершенно здоровая печень,
2. От живого человека. Изымается лишь часть печени. Процедура безопасна для донора, ведь даже после изъятия части печени уже через некоторое время ее объем достигает 85% прежнего.
В связи с тем, что найти целую здоровую печень от умершего донора очень сложно, в мире все больше используют часть органа, изъятую у здорового и живого родственника пациента.
В операции участвуют гепатолог, хирург, координатор. Иногда подключают кардиолога и пульмонолога.
На животе больного делается надрез в форме буквы L. Для того чтобы откачать из печени кровь и жидкость, применяется специальный прибор. В брюшную полость вводятся дренажные трубки и оставляются там, иногда, на несколько дней.
В желчный проток больному вставляют трубку для отвода желчи. Для врачей очень важен как объем выделившейся желчи, так и ее цвет. Она может быть желтой или зеленой. Трубку иногда оставляют в уже приживленном органе на несколько месяцев.
Кровеносные сосуды перерезаются и пораженный орган изымается. Все это время насос качает кровь от ног к сердцу. Далее орган или его часть переносятся в тело больного, сшиваются кровеносные сосуды и желчные протоки. Желчный пузырь в организм больного не пересаживается.
Первое время вместо пока еще не «запущенной» в ход печени ее работу выполняет аппарат «искусственная печень».
В период восстановления очень важным является супрессия иммунитета, который будет пытаться отторгнуть чужеродные ткани. Наиболее вероятным отторжение является первые полгода после трансплантации.
Азиатские страны стали пионерами в этой области потому, что их религия и культура не позволяет использовать части тела умерших людей для пересадки. Именно эти страны добились наилучших показателей по выживаемости после трансплантации печени. Сегодня в Японии 99% всех трансплантаций печени осуществляется именно от живого донора, в Соединенных Штатах Америки — 80%.
Такая практика в первую очередь позволяет обеспечить практически всех нуждающихся. В Америке, например, среди ожидающих трансплантации умирают лишь 10%, а в России 50% (здесь не так развита практика пересадки от живого донора).
Печень от живого донора лучше приживляется. Причем, лучше всего осуществляются пересадки детям. Здесь выживаемость у 92% пациентов (если печень взята у родственника). После пересадки органа, изъятого из трупа, этот показатель составляет 85%. Даже среди пациентов с новообразованиями выживаемость достаточно высока – 80%.
Чем этот метод лучше, чем пересадка от трупа?
1. Не нужно ожидать появления «подходящего трупа»,
2. Орган лучше приживляется,
3. Можно пить меньше иммуноподавляющих препаратов,
4. Период холодовой ишемии печени донора уменьшается (особая подготовительная процедура),
5. Ускоряется процесс подготовки органа.
Есть и недостатки метода:
1. Существует вероятность осложнения у донора,
2. Техника операции более тонкая. Доктор должен иметь не только практику сосудистого хирурга, но и опыт по хирургии печени,
3. В связи с тем, что пересаживается лишь небольшая часть, ее следует правильно «подогнать» под организм пациента,
4. Вероятность возврата первичного заболевания у реципиента увеличивается.
Сегодня можно сказать, что данная процедура только отрабатывается хирургами всех стран мира. Одним из важнейших моментов в вопросе о пересадке от живого донора является показатель смертности. К сожалению, погибают не только реципиенты, но и доноры. Так, после разглашения данных о нескольких смертях доноров количество пересадок от родственников уменьшилось на 15 часть в год.
Японские ученые утверждают, что осложнения у доноров развиваются приблизительно в 12% случаев. Причем чаще страдают доноры, у которых изымают правую долю органа. Наиболее частым осложнением является тромбоз воротной вены, послеоперационные грыжи и истечение желчи. Уже через год после операции почти все доноры могут продолжать привычный образ жизни.
2. Иммунологические проблемы. Печень занимает особое отношение к иммунной системе. Она менее уязвима, чем другие органы. Но, несмотря на это, у многих пациентов присутствуют признаки отторжения в большей или меньшей степени. Отторжение может быть острым (с ним можно успешно бороться) и хроническим (такая форма не поддается контролю). При пересадке части органа от живого родственника отторжение, практически, не наблюдается.
3. Кровотечение – наблюдается в среднем в 7,5% случаев.
4. Сосудистые осложнения: стеноз печеночной артерии, тромбоз, синдром обкрадывания. Наблюдаются в среднем в 3,5% случаев. Осложнения этой категории очень опасны и нередко приводят к необходимости повторной пересадки. Развиваются такие осложнения по вине хирурга. Если осложнение обнаруживается на ранней стадии и срочно приняты меры, положение может быть спасено.
5. Тромбоз либо стеноз воротной вены. При пересадке от живого донора наблюдается в среднем в 1,3% случаев. Обнаруживается по определенным признакам и с помощью УЗИ. Принятые срочно меры могут спасти исход операции.
6. Обструкция печеночных вен. Встречается редко и чаще всего по ошибке хирурга. Чаще наблюдается при пересадке части органа.
7. Билиарные стриктуры и желчеистечение. Наблюдаются достаточно часто в 25% случаев независимо от возраста пациента.
8. Синдром малого размера трансплантата (только при пересадке от живого донора) наблюдается, если врачи неправильно вычислили размер пересаживаемой части. Если признаки не исчезают в течение двух суток, необходимо делать повторную трансплантацию.
9. Инфицирование. У многих пациентов инфицирование протекает без клинических проявлений. У некоторых же возможно развитие воспаления легких и даже летальный исход. Для предупреждения инфицирования, пациент должен принимать антибиотики, до тех пор пока не будут удалены все дренажи и катетеры.
Чтобы процесс приживления органа шел успешно, пациенту ни в коем случае нельзя приостанавливать прием препаратов по собственному желанию.
Кроме этого, прием любых других лекарств тоже должен осуществляться только после консультации гепатолога. Иммуносупрессоры придется пить до конца жизни, но подавляющее большинство больных привыкают и не испытывают никаких неудобств в связи с этим.
Время от времени нужно сдавать анализы мочи, крови на присутствие вирусов, а также на уровень иммуносупрессоров, УЗИ печени, почек, сердца, поджелудочной, электрокардиограмму. Иногда доктор прописывает дополнительные диагностические методы.
Если пациент до трансплантации был заражен вирусом гепатита В или С, после операции существует вероятность активизации вируса. Это может спровоцировать отторжение печени. Более опасен в этом смысле вирус гепатита В, а при дельта-вирусе отторжение бывает очень редко.
После операции, желательно, нахождение в специальном реабилитационном центре под наблюдением специалистов.
Очень важно соблюдать режим питания. Пища не должна осложнять работу печени. Пациент должен получать домашнюю еду, включающую достаточное количество калорий. Уменьшить в рационе жареное, жирное, копченое. Питаться дробно по 4 раза в день. Основную долю пищи должны составлять овощи и фрукты. Категорически запрещены спиртные напитки. Следует меньше пить кофе, отказаться от никотина (по крайней мере, на некоторое время после операции).
В связи с тем, что иммунитет пациента подавляется с помощью специальных препаратов, он очень уязвим для инфекций. Поэтому лучше не бывать в людных местах и, ни в коем случае, не посещать друзей и родных, больных ОРВИ, гриппом или другими подобными заболеваниями.
Многие больные после трансплантации возвращаются к своей работе (85%). Но на этот показатель влияет и возраст пациента. Важно хорошо отдыхать и высыпаться. Конечно, если до операции работа больного была связана с большими физическими нагрузками, ее следует сменить. Кроме этого, теперь противопоказаны и многие виды спорта.
Существуют данные о женщинах, которые после трансплантации печени успешно беременели и воспроизводили на свет совершенно здоровых деток.
Психологические проблемы у пациентов после подобной операции наблюдаются крайне редко, поэтому они хорошо адаптируются в обществе.
Через определенный период времени у пациентов с пересаженной печенью могут появиться некоторые проблемы со здоровьем. Самые распространенные: инфекционные заболевания, нарушение работы желчного протока и сосудов.
Нарушения выявляются на периодических приемах у различных специалистов. Сужение желчного протока из-за появления шрамов устраняется с помощью стентов, вводимых эндоскопически. Чаще всего все основные осложнения проявляются в первые 6 месяцев после операции.
Прием иммуносупрессоров может привести к увеличению массы тела, нарушению обменных процессов, сахарному диабету и изменению метаболизма липидов. Поэтому такие пациенты более подвержены инсультам, инфарктам.
Если трансплантацию проводили пациенту с алкогольным циррозом, новообразованиями или гепатитом, ему необходимы периодические проверки, так как заболевание может рецидивировать.
На прогноз выживаемости очень большое влияние оказывает предоперационное состояние больного. Так, если он на время трансплантации был в работоспособном состоянии, его шанс выжить на протяжении года составляет 85%. Если перед трансплантацией больной долго лежал в больнице, его шанс составляет 70%, если же он находился в отделении интенсивной терапии, то шанс уменьшается до 50%. Таким образом, чем раньше проведена трансплантация, тем выше вероятность благоприятного исхода.
Еще один параметр, влияющий на выживаемость – это то, по какому диагнозу попадает на пересадку больной. Так, в группе высокого риска люди с гепатитом В, раком печени, молниеносным гепатитом, с тромбозом воротной вены, с осложнением в виде почечной недостаточности, те, которым нужно делать искусственную вентиляцию легких и те, которые много раз до этого оперировались по другим поводам. Кроме этого, к группе высокого риска относятся и больные старше 65 лет.
Пациенты, не относящиеся к вышеперечисленным категориям, включаются в группу низкого риска.
Выживаемость на протяжении года в первой группе составляет 60%, на протяжении 5 лет – 35%.
Выживаемость на протяжении года во второй группе составляет 85%, на протяжении 5 лет – 80%.
Если пациенту второй раз пересаживают печень, вероятность выжить у него составляет 50%. Причина неудачной операции при этом не имеет значения.
Многие пациенты, перенесшие пересадку печени, выживают на протяжении десяти – пятнадцати и даже двадцати пяти лет. Не следует забывать, что на пересадку идут лишь те люди, у которых нет других возможностей для выживания. Кроме этого, технологии пересадки каждый год развиваются, и показатели выживаемости улучшаются.
Показания:
- Нарушения обменных процессов,
- Холестатические нарушения,
- Цирроз печени,
- Острая печеночная недостаточность,
- Врожденный порок формирования желчных протоков (билиарная атрезия).
Наиболее предпочтительным является, в таком случае, метод пересадки от живого донора, являющегося кровным родственником.
В период подготовки проводится резонансная томография, позволяющая обследовать мелкие кровеносные сосуды и желчные протоки. Чаще всего используют боковую часть левой доли печени. Это связано с тем, что расположение сосудов в ней наиболее подходящее для детского организма.
Хотя прогноз лучше для детей с большей массой тела и старшим возрастом, этот фактор ни в коем случае не должен быть определяющим при выборе времени операции. Так как неработающая печень тормозит развитие детского организма.
Родителям детей, которым показана трансплантация печени, не следует впадать в панику. Сегодня подобная операция уже достаточно хорошо отработана и успешно проводится. Так, например, в Минске была проведена операция полуторагодовалой девочке, отравившейся поганками. Печень ребенка полностью перестала работать. Операцию нужно было сделать настолько быстро, что даже не было времени обследовать родителей в качестве потенциальных доноров. Поэтому девочке пересадили орган от умершего восьмимесячного малыша.
При отравлении бледной поганкой печень тут же перестает функционировать и восстановить ее работу не представляется возможным.
Процедура длилась 10 часов. Операция прошла достаточно успешно. Девочка чувствует себя хорошо. Времени, правда, прошло не так много (всего, около года), но данный факт дает надежду на то, что в будущем подобные операции станут вполне нормальным явлением.
Если в сутки женщина будет выпивать по 20 гр. чистого алкоголя, а мужчина 40 гр., у них начинает поражаться печень.
Еще одним фактором, приводящим к циррозу и необходимости пересадки, является аутоиммунный гепатит. Достаточно длительное время это заболевание можно контролировать с помощью гормональных противовоспалительных препаратов и других лекарств.
Кроме этого, пожилые представительницы слабого пола страдают первичным билиарным циррозом, при котором также единственным методом спасения жизни является пересадка.
Молодые мужчины нередко страдают склерозирующим холангитом, также приводящим к пересадке печени. У таких пациентов желчные протоки становятся непроходимыми.
Пересадку назначают в том случае, если цирроз поразил большую часть органа, при частых кровотечениях из вен пищевода, асците, печеночной коме, а также при явно слабой работе органа.
На фоне вирусных заболеваний печени или цирроза значительно увеличивается развитие рака печени – гепатоцеллюлярной карциномы.
Если размер опухоли невелик, пересадка может дать очень хорошие результаты. Операция по удалению опухоли чаще всего не очень эффективна, так как после нее часто развивается рецидив. Лишь в том случае, если рак не сочетается с циррозом, операция может быть действенной. Используется трансплантация и при других видах новообразований, например, при эндокринных опухолях.
Если раком поражены желчные протоки, существует высокий риск того, что даже после пересадки печени опять разовьется опухоль. Лишь если новообразование очень мало и перед пересадкой больной прошел химиотерапию и местную радиотерапию, существует шанс излечиться с помощью пересадки.
Если печень поражена метастазами, пересадка бесполезна, так как это означает, что метастазы присутствуют уже и в других органах.
Если при гепатите С осуществляют трансплантацию печени, то повторное заражение органа после пересадки наблюдается почти у ста процентов больных. Перерождение клеток в уже прижившемся органе под действием употребления иммунодепрессантов происходит скорее. У трети больных через пять лет после пересадки опять наблюдается цирроз и им опять нужно делать пересадку.
Гепатит С прогрессирует быстрее у:
- Людей старше 40 лет,
- При наличии цитомегаловируса,
- При употреблении кортикостероидов,
- При длительной холодовой ишемии органа перед пересадкой,
- При пульс-терапии мощными дозами кортикостероидов на фоне отторжения приживленного органа.
Применение противовирусных препаратов до операции и после нее уменьшает интенсивность повторного развития болезни после пересадки. Около 40% пациентов могут быть подвергнуты противовирусной терапии.
В Америке трансплантация стоит около 500 тыс. долларов.
В Европе операция по трансплантации печени стоит от 230 до 400 тысяч евро.
В Сингапуре за программу по пересадке, включающую 30 суток в больнице для пациента и неделю для донора придется выложить 120 тыс. евро.
В Москве пересадка обойдется в 2,5 – 3 млн. рублей.
В Украине от родственного донора можно пересадить часть органа за 100 тыс. гривен.
Автор: Пашков М.К. Координатор проекта по контенту.
источник



 Первый тип — Транзиторный. Этот тип поддаётся лечению и считается самым лёгким. Его можно вылечить при осуществлении постоянного лечения и при проведении процедуры пункции. Особых проблем с жидкостью не возникает. Асцит протекает не тяжело.
Первый тип — Транзиторный. Этот тип поддаётся лечению и считается самым лёгким. Его можно вылечить при осуществлении постоянного лечения и при проведении процедуры пункции. Особых проблем с жидкостью не возникает. Асцит протекает не тяжело.