Аневризма брюшной аорты (АБА) представляет собой выпячивание и истончение стенок брюшного отдела одной из главных артерий человеческого тела, которая несет кровь от сердца ко всем органам и тканям брюшной полости.
Аневризма брюшной аорты – очень коварное заболевание, которое до поры до времени может не беспокоить человека.
Ее главное осложнение – расслоение аорты – в 70-95% случаев приводит к скорой смерти больного.
В зависимости от размеров аневризмы, темпов ее роста, а также состояния здоровья самого больного, зарубежные врачи рекомендуют разные стратегии – от наблюдения до немедленного хирургического вмешательства.
Если вы столкнулись с аневризмой БА, врач будет регулярно вас обследовать, чтобы при необходимости запланировать хирургическую операцию и избежать непоправимого.
В случае разрыва аневризмы даже срочное лечение имеет немного шансов на успех.
Аневризма брюшной аорты является болезнью преимущественно пожилых людей, причем мужчины страдают АБА в 4 раза чаще женщин.
Аневризмы диаметром >4 см встречаются у 1% мужчин 55-64 лет, после чего каждые 10 лет эта цифра возрастает на 2-4%. По приблизительным оценкам, 4-9% мужчин старше 60 лет имеют клинически значимые аневризмы БА.
Курильщики страдают аневризмой брюшной аорты в 8 раз чаще некурящих, а наличие в семье родственников первой степени родства с аневризмой БА повышает риск этого заболевания в 2-4 раза.
Хотя точная причина возникновения аневризмы остается загадкой для науки, врачи выделяют множество факторов риска АБА:
• Употребление табака: сигареты, равно как и жевательный табак, увеличивают риск возникновения аневризмы брюшной аорты в 8 раз. Скорее всего, за счет длительного повреждения и ослабления стенок аорты. Более 90% больных курят или курили в прошлом.
• Атеросклероз: заболевание, которое характеризуется нарушением липидного обмена и отложением жиров на внутренней стенке (интиме) артерий, предрасполагает к возникновению аневризм. Правда, связь атеросклероза и аневризмы брюшной аорты некоторыми ставится под вопрос.
• Повышенное артериальное давление: у гипертоников, особенно не контролирующих свое давление, риск аневризмы БА значительно увеличивается. Вероятно, это также происходит за счет повреждения и ослабления стенок сосудов.
• Наличие других аневризм: имеющиеся аневризмы в других артериях повышают вероятность поражения брюшной аорты в будущем.
• Воспаление: аневризмы брюшной аорты могут быть вызваны заболеваниями, которые сопровождаются воспалением артерий.
• Инфекции: бактериальные или грибковые инфекции в редких случаях становятся причиной аневризмы (сифилис, сальмонеллез).
• Травма: предшествовавшая травма живота увеличивает вероятность развития АБА в будущем.
• Наследственность: в некоторых случаях аневризмы БА носят наследственный характер.
• Мужской пол: среди больных аневризмой брюшной аорты соотношение мужчин и женщин составляет 4:1.
• Возраст: риск аневризмы резко возрастает после 60 лет.
Помимо этого, аневризму брюшной аорты связывают с редкими генетическими заболеваниями:
• Синдром Марфана
• Синдром Элерса-Данло
• Дефицит альфа-1-антитрипсина
В 75% случаев аневризма БА никак не проявляет себя, обнаруживаясь случайно на УЗИ или томографии.
Одни остаются мелкими, другие растут по нескольку миллиметров в год – предсказать это совершенно невозможно.
При крупных аневризмах брюшной аорты могут беспокоить боли в животе или в спине, пульсирующее ощущение в области пупка. Если вы отмечаете у себя подобное, следует как можно скорее обратиться к специалисту!
Самым опасным осложнением аневризмы является расслоение аорты – нарушение целостности слоев стенки аорты с последующим разрывом и быстрой, массивной кровопотерей.
Это происходит из-за повышенного давления на стенки аорты наряду с накапливающимися в стенке сосуда гистопатологическими изменениями (кристаллы холестерина, «пенные» клетки и ферменты металлопротеиназы).
В целом, чем больше диаметр аневризмы и чем быстрее она растет, тем выше риск разрыва. Эксперты Клиники Мэйо в Рочестере (США) отмечают, что риск такого исхода значительно выше у больных, которые продолжают курить, а также у тех, кто плохо контролирует артериальное давление.
Как зависит вероятность разрыва аневризмы брюшной аорты от ее размеров?
Зарубежные наблюдения показывают, что в течение 5 лет разрывается 25-40% аневризм диаметром >5 см, 1-7% аневризм диаметром 4-5 см, а также менее 0,5% аневризм диаметром 5 см и только 29% АБА диаметром 3-4 см. Следовательно, нужны высокотехнологичные методы.
Согласно современным американским клиническим руководствам, больным с аневризмой диаметром 4-5,4 см нужно проходить компьютерную томографию или ультразвуковое исследование каждые 6-12 месяцев, при диаметре 5 см.
Поэтому в ведущих западных клиниках рекомендуется плановое хирургическое лечение, когда размер АБА достигает 1,9-2,2 дюйма (5-5,5 см). Также операция рекомендуется в тех случаях, когда аневризма меньшего размера, однако слишком быстро растет или вызывает боль и дискомфорт.
Самый старый метод лечения аневризмы, который отличается высокой надежностью и до сих пор называется «золотым стандартом».
Выполняется через длинный разрез на брюшной стенке.
При этом хирург удаляет пораженный участок аорты и заменяет его синтетической трубкой (графтом). Как и любая другая «открытая» хирургическая операция, требует длительного пребывания в больнице. На полное восстановление уходит не менее 1 месяца.
Если операция плановая и жизни больного в данный момент ничего не угрожает, то врачи будут учитывать не только размер аневризмы, но и состояние здоровья. При высоком хирургическом риске плановая операция не делается, однако в экстренных случаях противопоказаний нет.
Это современная, менее инвазивная процедура, которая занимает минимум времени, не требует лапаротомического разреза, не оставляет рубца на животе.
При эндопротезировании графт из специальной ткани в свернутом виде вводится через бедренную артерию и устанавливается на месте аневризмы, как бы изолируя ее.
Эта быстрая и почти бескровная процедура проводится под рентгеновским контролем. Выписка после процедуры максимально быстрая, однако после эндопротезирования аневризмы брюшной аорты больные до конца жизни нуждаются в периодическом обследовании (КТ, УЗИ).
источник
Первые патолого-анатомические наблюдения и клинические описания аневризмы брюшной аорты относятся к XVI веку (Фер-нелиус, 1542 г.; Везалиус, 1557 г.; Амбруаз Паре, 1561 г.— цит. по А. А. Шалимову и др., 1979 г.). В 1817 г. Astley Cooper первым произвел перевязку брюшной аорты по поводу ее аневризмы.
Первое сообщение об успешной резекции аневризмы брюшной аорты с протезированием гомотрансплантатом сделали С. Dubost и соавт. (1951 г.). 29 марта 1951 г. они первыми осуществили резекцию аневризмы брюшной аорты, заменив пораженный участок длиной 14 см сегментом грудной аорты, забранным у молодого человека, погибшего в автокатастрофе. Больной благополучно перенес операцию и умер через 8 лет от повторного инфаркта миокарда.
Первую успешную операцию при разрыве аневризмы брюшной аорты выполнили М. De Bakey и соавт. (1954 г.). Общепринятую в настоящее время резекцию аневризмы с внутримешковым протезированием первыми произвели Н. Javid и соавт. (1962 г.).
В бывшем СССР первые операции осуществили В. А. Жмур (1959 г.), Б. В. Петровский (1959 г.). Затем появились сообщения Ю. Е. Березова (1961 г.), Г. Л. Ратнера (1965 г.), Ф. Г.Углова (1970 г.) и других.
Публикуемые по вопросам артериальных аневризм материалы из-за отсутствия точных, общепринятых определений и критериев часто служат предметом научных споров и ошибочной интерпретации. Существующие различия в терминологии обусловливают сложности при обсуждении и сравнивании результатов хирургического лечения больных с подобной патологией.
Аневризма (от лат. aneuryno — расширяю) — расширение сосуда или выбухание его стенки кнаружи, возникающее вследствие разнообразных поражений, понижающих прочность и эластичность сосудистой стенки.
Несмотря на длительную историю выявления и лечения аневризм, единого мнения по вопросу, что считать «аневризмой брюшной аорты», до сих пор не существует. Общепринятой можно считать лишь первую часть определения: АБА является ненормальное локальное или диффузное расширение указанного сосуда. По второй части определения — какой диаметр аорты однозначно нужно считать аневризмой — разногласия среди клиницистов носят существенный характер.
Если ранее, в эпоху пальпаторной и ангиографической диагностики аневризмы брюшной аорты, большинство авторов склонялись к мнению, что под этим термином следует подразумевать локальное или диффузное расширение ее диаметра более 3 см (Спиридонов А. А., 1989 г.) или любое увеличение диаметра аорты вдвое более нормального (Покровский А. В., 1979 г.), то в настоящее время этот вопрос приобрел практически важное значение, во-первых, в связи с более точными диагностическими признаками изменения формы и диаметра брюшной аорты, выявляемыми с помощью эхосканирования, и, во-вторых, благодаря выбору хирургической тактики по отношению к каждому больному с определенными размерами брюшной аорты.
Тем не менее по сегодняшний день вопрос остается открытым. Одни авторы считают аневризмой полуторократное увеличение инфраренального диаметра в сравнении с интерреналь-ным (Sterpetti А. V. et al., 1987 г.; Cronennwett J. L. et al., 1990 г.) или двукратное превышение диаметра аорты в сравнении с невовлеченной аортой (Lederie F. А. et al., 1988 г.), или расширение всей аорты более чем в два раза по сравнению с нормой (Покровский А. В., 1992 г.). Вторая группа авторов за основу берут абсолютные критерии и определяют АБА как превышение поперечного размера более 3,0—3,5 см (Scott R. F. Р. et al., 1986 г.;
Никитаев Н. С., Тодуа Ф. И., 1992 г.) или увеличение диаметра более 4,0 см, или если диаметр аорты увеличивается более чем на 0,5 см в сравнении с диаметром, измеренным между устьями верхней брыжеечной и левой почечной артерий (Collin J., 1990 г.).
В 1991 г. отдел артериальных аневризм при Американском комитете стандартизации (Ad Hoc Commitee) по заданию руководства Североамериканского общества сердечно-сосудистых хирургов и общества сосудистых хирургов провело исследование (Johnston К. et al., 1991 г.), целью которого явилось разработать критерии и дать определение артериальных аневризм, а также согласовать стандарты, которые могут быть использованы как базовые критерии при изучении причин, факторов риска и других характеристик, отражаемые при публикации материалов по артериальным аневризмам. Согласно данному исследованию можно считать принятым следующее определение артериальных аневризм — стойкое, локальное расширение просвета артерии, превышающее нормальный диаметр сосуда более чем на 50%. Хотя вышеприведенная работа позволила более четко классифицировать артериальные аневризмы и определила оптимальные критерии для публикаций по данному вопросу, осталось много терминологических разночтений, не позволяющих расставить все точки над i в этом вопросе.
При ранее проводимых исследованиях нормальный диаметр аорты с помощью эхосканирования, но без учета ее конусовидной формы, считался равным 15-32 мм. Следовательно, само определение увеличения диаметра брюшной аорты до 3 см как «аневризма» явно несовершенно.
Проведенные нами скрининговые исследования нормальных параметров аорты методом эхосканирования показали, что у лиц с нормальным артериальным давлением нормальный диаметр аорты под диафрагмой (то есть в супраренальной ее части) равен 16-28 мм (в 91,5% случаев — 18-26 мм). Вследствие конусовидной формы аорты ее диаметр в области бифуркации, естественно, уже — 14-25 мм (в 84% случаев — 15-23 мм). Следует помнить, что у женщин аорта уже, чем у мужчин. Абсолютно нижней границы диаметра брюшного отдела аорты, который можно было бы определить как аневризму, практически не существует.
Современные исследования показали, что диаметр нормальной аорты варьирует в достаточно широких пределах и зависит от множества факторов. Большинство исследователей полагают, что нормальный инфраренальный диаметр аорты (ИДА) имеет тенденцию к увеличению с возрастом (Dixon A. et al., 1988 г.;
Horejs D. et al., 1988 г.; Pedersen О. М. et al., 1993 г.; Pears W. et al., 1993 г.). Однако отдельные авторы не обнаружили тесной корреляции между возрастом и инфраренальным диаметром аорты. В частности, А. В. Wilmink и соавт. (1998 г.) только у 25% мужчин и 15% женщин старших возрастных групп выявили увеличение нормального инфраренального диаметра аорты. Основываясь на результатах своих ультразвуковых исследований, они показали, что если нормальным ИДА считать диаметр аорты, соответствующий медиане (т.е. наиболее частой величине из кривой распределения) для данного возраста, то он величина постоянная. Однако работы В. Sonnesson и соавт. (1993 г., 1994 г.) опровергли это мнение и показали, что рост диаметра аорты медленно происходит и после 25 лет в пределах 20—25% от исходного уровня(рис.1).
Отмечая неодинаковый диаметр аорты у мужчин и женщин, многие исследователи считают, что нормальный инфрареналь ный диаметр аорты у мужчин достоверно выше, чем у женщин, и связывают это не с половыми различиями, а с особенностями комплекции мужчин, которые имеют больший рост и массу тела. Основная корреляция нормального ИДА была отмечена с анатомическими параметрами человеческого тела, в частности с площадью поверхности тела.
Изменение диаметра аорты с возрастом (по Sonesson В. etal., 1994г.)
Исходя из представленных данных, можно сделать вывод, что нормальный инфраренальный диаметр аорты — величина достаточно постоянная и в норме на протяжении всей жизни имеет тенденцию к увеличению. Эту тенденцию связывают с возрастными дегенеративными изменениями в стенке сосуда и возрастным увеличением цифр АД (Toda Т. et al., 1980 г.).
Увеличение нормального ИДА выше определенного уровня можно расценивать как патологическое состояние, требующее проведения соответствующих лечебных и профилактических мероприятий. Таким образом, дальнейшее уточнение понятий «расширение аорты», «аневризма брюшной аорты», «нормальный диаметр аорты» и разработка соответствующего алгоритма диагностических и лечебных мероприятий при различных степенях расширения аорты позволят избежать непоправимых тактических и диагностических ошибок и улучшить результаты лечения данной категории больных.
Литературные данные, собственные наблюдения позволяют нам считать аневризмой брюшной аорты следующее:
— любое расширение диаметра инфраренального отдела брюшной аорты на 50% по сравнению с супраренальным;
— любое локальное веретенообразное расширение аорты диаметром на 0,5 см больше, чем диаметр нормальной аорты;
— любое мешковидное выпячивание стенки аорты (как явный признак патологического процесса).
источник
Под аневризмой брюшной аорты (АБА) понимают превышение нормального диаметра аорты на 50% и более.
У мужчин диаметр аорты ниже почек в норме составляет 2,0 см. Диагноз АБА ставится в тех случаях, когда диаметр аорты равен или превышает 3 см.
Аневризма брюшной аорты (АБА) случайно выявляется у 3,2% взрослого населения во время ультразвукового исследования (УЗИ); у 5% больных с ишемической болезнью сердца (ИБС), и у 10% больных с заболеванием периферических сосудов.
Существуют многочисленные сообщения о семейных случаях аневризмы брюшной аорты (АБА). Поэтому рекомендуется обследовать ближайших родственников больного старше 50 лет. В двух проспективных исследованиях было продемонстрировано, что приблизительно 30% ближайших родственников больных с АБА сами страдают АБА. Предполагается, что генетическая причина аневризмы брюшной аорты (АБА) связана с патологическим коллагеном III типа.
Да. У 40% больных с аневризмой подколенной артерии и у 75% больных с аневризмой бедренной артерии также имеется аневризма брюшной аорты (АБА). При аневризме грудного отдела аорты в 20% случаев одновременно наблюдается аневризма брюшной аорты (АБА). Через 5 или более лет после пластики подпочечной аневризмы брюшной аорты (АБА) у 5% больных развивается аневризма аорты проксимальнее протеза.
Нет. Аорта разветвляется на уровне пупка. Таким образом, пульсирующее образование находится в эпигастрии. При объективном осмотре можно выявить только достаточно большие аневризмы брюшной аорты (АБА) у худых больных.
Рентгенография живота или поясничного отдела позвоночника в прямой проекции позволяет диагностировать около 20% скрытых аневризм брюшной аорты (АБА). Тонкий ободок кальцификации является диагностическим признаком аневризмы. Большинство аневризм брюшной аорты (АБА) содержат слишком мало кальция, и поэтому не визуализируются на рентгенограммах.
Ультразвуковое исследование (УЗИ) брюшной полости позволяет определить поперечные и продольные размеры аневризмы с точностью до 0,3 см.
Это компьютерная томография (КТ) с контрастным усилением, позволяющая определить диаметр аорты с точностью до 0,2 см. При КТ хорошо визуализируются венозные аномалии (расположение левой почечной вены позади или вокруг аорты, удвоение или левостороннее положение нижней полой вены), которые значительно влияют па тактику хирургического лечения.
Хотя КТ является идеальным методом диагностики разрыва аневризмы (чувствительность 92% и специфичность 100%), она менее информативна для диагностики распространения аневризмы на надпочечную часть аорты (чувствительность 83% и специфичность 90% с положительной прогностической ценностью).
До разрыва диагностируется менее трети аневризм. Неожиданный приступ боли в животе является наиболее частым симптомом (82%) разорвавшейся апвризмы. Пожилой больной с артериальной гипотензией и остро возникшей болью в нижней части спины должен расцениваться как больной с разрывом аневризмы, пока не доказано обратное.
Больным с нестабильной гемодинамикой и пульсирующим образованием в животе следует записать электрокардиограмму для исключения инфаркта миокарда непосредственно перед срочной диагностической лапароскопией. Время терять нельзя.
Больные в глубоком шоке и/или с остановившимся на момент обследования сердцем имеют мало шансов на выживание. Преклонный возраст, старческое слабоумие, метастазы рака и другие тяжелые заболевания в терминальной стадии должны заставить вас задуматься о целесообразности операции.
Около половины больных с разрывом аневризмы брюшной аорты (АБА) умирают па догоспитальном этапе. Четверть больных, поступивших в клинику, не доживают до операционного стола.
Из-за опасности критического падения артериального давления во время вводного наркоза анестезию начинают только при полной готовности к разрезу, когда операционное поле обработано и обложено салфетками. Ключом к успешному исходу операции при разрыве аневризмы брюшной аорты (АБА) является быстрое пережатие центральной части аорты.
Пережатие аорты осуществляется па уровне диафрагмы (внутрибрюшное кровотечение с нестабильной гемодинамикой или забрюшинная гематома, распространяющаяся проксимальнее левой почечной вены) или ниже почечных артерий (при низко расположенной забрюшинной гематоме и стабильной гемодинамике). Внутрипросветная окклюзия аорты баллонным катетером осуществляется при открытом внутрибрюшном кровотечении.
После остановки кровотечения и стабилизации гемодинамики зажимы перекладываются в более стандартное положение ниже почечных артерий. Чтобы предотвратить повреждение подвздошной вены, кровотечение из дистальной аорты останавливается баллонным катетером или тампонами.
Симптоматичные аневризмы брюшной аорты (АБА) быстро расширяются и имеют высокий риск разрыва. Поэтому большинство сосудистых хирургов сходятся во мнении, что такие аневризмы брюшной аорты (АБА) следует как можно быстрее оперировать.
При высоком риске разрыва симптоматичных аневризм брюшной аорты (АБА) или при разрыве аорты с образованием пульсирующей гематомы успешно применяются эндоваскулярные синтетические протезы, которые устанавливаются как в аорту, гак и в подвздошные артерии.
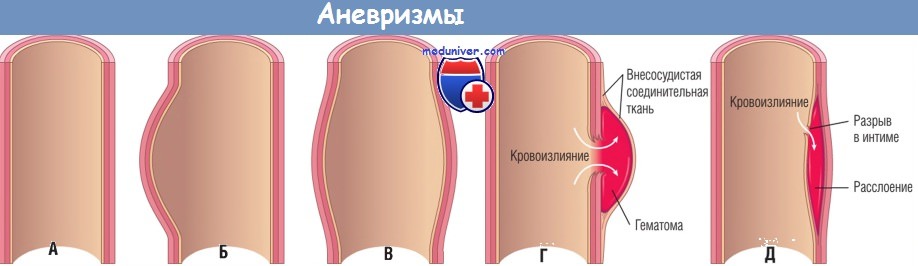
(А) Нормальный сосуд.
(Б) Истинная аневризма, мешковидный тип: стенка локально выпячивается наружу и может быть истонченной.
(В) Истинная аневризма, веретенообразный тип: тотальное расширение сосуда без разрыва.
(Г) Ложная аневризма: разрыв стенки и скопление крови (гематома), ограниченное снаружи прилегающей внесосудистой соединительной тканью.
(Д) Расслоение: кровь, проникая в стенку сосуда, расслаивает ее.
На рисунке видно, что кровь проникает из просвета через разрыв в интиме, однако расслоение также может произойти в результате разрыва vasa vasorum в медии.
Риск разрыва аневризмы брюшной аорты (АБА) диаметром 5 см в течение года составляет 4%. Этот риск возрастает с увеличением размера аневризмы (при АБА диаметром 7 см риск разрыва в течение года составляет 20%).
Средняя скорость расширения аневризмы брюшной аорты (АБА) составляет 0,4 см/год. Тем не менее 20% всех АБА с течением времени не увеличиваются. И наоборот, 20% аневризм увеличиваются со скоростью больше 0,5 см/год. Быстрое расширение аневризмы (0,5 см за 6 месяцев) является прогностическим фактором разрыва и служит показанием к операции.
18. Необходимо ли при аневризме брюшной аорты (АБА) проводить полномасштабное кардиологическое обследование?
Этот вопрос неясен. Частота сопутствующей ИБС у больных с аневризмой брюшной аорты (АБА) превышает 50%, а основной причиной периоперационной и отдаленной летальности является инфаркт миокарда.
Традиционно ангиография показана для определения размера проксимальной шейки аневризмы, выявления сопутствующей облитерации висцеральных сосудов, заболеваний почечных артерий, аневризм или облитерирующего заболевания периферических артерий и визуализации висцерального кровообращения после колэктомии.
Спиральная КТ дает трехмерное изображение контуров и аневризмы и висцеральных артерий. Основным недостатком метода является его высокая стоимость, а основным достоинством — получение потенциально полезной информации при планировании и проведении эндоваскулярного протезирования аорты. Для визуализации висцеральных сосудов, аорты и подвздошных артерий также применяется магнитно-резонансная ангиография. Основным недостатком метода является необходимость задержки больным дыхания для устранения респираторных артефактов.
Протезирование брюшной аорты может равно успешно выполняться как трансабдоминальиым, так и экстраперитонеальным доступами. Трансабдоминальный доступ обеспечивает лучший обзор сосудов таза, тогда как при экстраперитонеальном доступе лучше визуализируется аорта выше почечных артерий и сокращается количество послеоперационных легочных осложнений.

(а) Вид снаружи: крупная аневризма аорты с разрывом (стрелка).
(б) Вид изнутри: стенка аневризмы крайне тонкая, просвет заполнен крупным слоистым, но в основном неорганизованным тромбом; место разрыва показано зондом.
Эндоваскулярные протезы представляют собой большие стенты с покрытием, которые проводятся через бедренную артерию под рентгенологическим контролем и выключают аневризму из кровообращения. При этом пет необходимости в разрезе живота и пережатии аорты. Результаты эндоваскулярного выключения АБА противоречивы. Широкое исследование, посвященное эндоваскулярному протезированию, продемонстрировало успешную имплантацию стентов в 85% случаев и отсутствие интраоперационной летальности. Однако в 44% случаев отмечалось подтекание крови в пространство вокруг протеза. За время дальнейшего наблюдения половина таких стентов затромбировались.
Хирургическое лечение показано, когда аневризма брюшной аорты (АБА) достигает 5 см в диаметре. Единственной целью пластики асимптоматичных аневризм брюшной аорты (АБА) является предотвращение их последующего разрыва и смерти. Таким образом, прогнозируемая продолжительность жизни всех кандидатов на операцию должна составлять не менее 5 лет.
Двумя наиболее важными моментами являются: (1) расположение артериальных зажимов и (2) тип протеза. В большинстве случаев зажимы на аорту накладываются ниже почечных артерий. Такое положение зажимов позволяет избежать длительной ишемии почек. Аневризма вскрывается после пережатия проксимального и дистального участков аорты. Устья поясничных артерий ушиваются для предотвращения кровотечения из коллатералей. Нижняя брыжеечная артерия часто уже облитерирована, по если она проходима и в ней нет ретроградного кровотечения, может потребоваться ее реплантация.
Почечная недостаточность (повышение уровня креатинина) и ишемия кишечника (кровавый понос).
— Вернуться в оглавление раздела «Хирургия»
источник
Публикуемые по вопросам артериальных аневризм материалы из-за отсутствия точных, общепринятых определений и критериев часто служат предметом научных споров и ошибочной интерпретации. Существующие различия в терминологии обусловливают сложности при обсуждении и сравнивании результатов хирургического лечения больных с подобной патологией.
Аневризма(от лат. aneuryno — расширяю) — расширение сосуда или выбухание его стенки кнаружи, возникающее вследствие разнообразных поражений, понижающих прочность и эластичность сосудистой стенки.
Несмотря на длительную историю выявления и лечения аневризм, единого мнения по вопросу, что считать «аневризмой брюшной аорты», до сих пор не существует. Общепринятой можно считать лишь первую часть определения: АБА является ненормальное локальное или диффузное расширение указанного сосуда. По второй части определения — какой диаметр аорты однозначно нужно считать аневризмой — разногласия среди клиницистов носят существенный характер.
Если ранее, в эпоху пальпаторной и ангиографической диагностики аневризмы брюшной аорты, большинство авторов склонялись к мнению, что под этим термином следует подразумевать локальное или диффузное расширение ее диаметра более 3 см или любое увеличение диаметра аорты вдвое более нормального, то в настоящее время этот вопрос приобрел практически важное значение, во-первых, в связи с более точными диагностическими признаками изменения формы и диаметра брюшной аорты, выявляемыми с помощью эхосканирования, и, во-вторых, благодаря выбору хирургической тактики по отношению к каждому больному с определенными размерами брюшной аорты.
Тем не менее по сегодняшний день вопрос остается открытым. Одни авторы считают аневризмой полуторократное увеличение инфраренального диаметра в сравнении с интерреналь-ным или двукратное превышение диаметра аорты в сравнении с невовлеченной аортой, или расширение всей аорты более чем в два раза по сравнению с нормой. Вторая группа авторов за основу берут абсолютные критерии и определяют АБА как превышение поперечного размера более 3,0-3,5 см или увеличение диаметра более 4,0 см, или если диаметр аорты увеличивается более чем на0,5 см в сравнении с диаметром, измеренным между устьями верхней брыжеечной и левой почечной артерий.
В 1991 г. отдел артериальных аневризм при Американском комитете стандартизации (Ad Hoc Commitee) по заданию руководства Североамериканского общества сердечно-сосудистых хирургов и общества сосудистых хирургов провело исследование, целью которого явилось разработать критерии и дать определение артериальных аневризм, а также согласовать стандарты, которые могут быть использованы как базовые критерии при изучении причин, факторов риска и других характеристик, отражаемые при публикации материалов по артериальным аневризмам. Согласно данному исследованию можно считать принятым следующее определение артериальных аневризм — стойкое, локальное расширение просвета артерии, превышающее нормальный диаметр сосуда более чем на 50%. Хотя вышеприведенная работа позволила более четко классифицировать артериальные аневризмы и определила оптимальные критерии для публикаций по данному вопросу, осталось много терминологических разночтений, не позволяющих расставить все точки над i в этом вопросе.
При ранее проводимых исследованиях нормальный диаметр аорты с помощью эхосканирования, но без учета ее конусовидной формы, считался равным 15-32 мм. Следовательно, само определение увеличения диаметра брюшной аорты до 3 см как «аневризма» явно несовершенно.
Проведенные нами скрининговые исследования нормальных параметров аорты методом эхосканирования показали, что у лиц с нормальным артериальным давлением нормальный диаметр аорты под диафрагмой (то есть в супраренальной ее части) равен 16-28 мм (в 91,5% случаев — 18-26 мм). Вследствие конусовидной формы аорты ее диаметр в области бифуркации, естественно, уже — 14-25 мм (в 84% случаев — 15-23 мм). Следует помнить, что у женщин аорта уже, чем у мужчин. Абсолютно нижней границы диаметра брюшного отдела аорты, который можно было бы определить как аневризму, практически не существует.
Современные исследования показали, что диаметр нормальной аорты варьирует в достаточно широких пределах и зависит от множества факторов. Большинство исследователей полагают, что нормальный инфраренальный диаметр аорты (ИДА) имеет тенденцию к увеличению с возрастом. Однако отдельные авторы не обнаружили тесной корреляции между возрастом и инфраренальным диаметром аорты. В частности, А. В. Wilmink и соавт. только у 25% мужчин и 15% женщин старших возрастных групп выявили увеличение нормального инфраренального диаметра аорты. Основываясь на результатах своих ультразвуковых исследований, они показали, что если нормальным ИДА считать диаметр аорты, соответствующий медиане (т.е. наиболее частой величине из кривой распределения) для данного возраста, то он величина постоянная. Однако работы В. Sonnesson и соавт. опровергли это мнение и показали, что рост диаметра аорты медленно происходит и после 25 лет в пределах 20-25% от исходного уровня.
Отмечая неодинаковый диаметр аорты у мужчин и женщин, многие исследователи считают, что нормальный инфраренальный диаметр аорты у мужчин достоверно выше, чем у женщин, и связывают это не с половыми различиями, а с особенностями комплекции мужчин, которые имеют больший рост и массу тела. Основная корреляция нормального ИДА была отмечена с анатомическими параметрами человеческого тела, в частности с площадью поверхности тела.
Исходя из представленных данных, можно сделать вывод, что нормальный инфраренальный диаметр аорты — величина достаточно постоянная и в норме на протяжении всей жизни имеет тенденцию к увеличению. Эту тенденцию связывают с возрастными дегенеративными изменениями в стенке сосуда и возрастным увеличением цифр АД.
Увеличение нормального ИДА выше определенного уровня можно расценивать как патологическое состояние, требующее проведения соответствующих лечебных и профилактических мероприятий. Таким образом, дальнейшее уточнение понятий «расширение аорты», «аневризма брюшной аорты», «нормальный диаметр аорты» и разработка соответствующего алгоритма диагностических и лечебных мероприятий при различных степенях расширения аорты позволят избежать непоправимых тактических и диагностических ошибок и улучшить результаты лечения данной категории больных.
Литературные данные, собственные наблюдения позволяют нам считать аневризмой брюшной аорты следующее:
- любое расширение диаметра инфраренального отдела брюшной аорты на 50% по сравнению с супраренальным;
- любое локальное веретенообразное расширение аорты диаметром на 0,5 см больше, чем диаметр нормальной аорты;
- любое мешковидное выпячивание стенки аорты (как явный признак патологического процесса).
Заболевание в основном носит приобретенный характер: атеросклероз (73% поданным В. Л. Леменева, 1976 г.), неспецифический аортоартериит, специфические артерииты (сифилис, туберкулез, ревматизм, сальмонеллез), травматические аневризмы, ятрогенные аневризмы после реконструктивных операций на аорте, ангиографии, баллонной дилатации; среди причин врожденного характера — фиброзно-мышечная дисплазия.
Основным этиологическим фактором АБА, по данным отечественной и зарубежной литературы, в настоящее время, безусловно, является атеросклероз. Причем, если в период 1945-1954 гг. в бывшем СССР он составлял всего 40% от всех АБА, то уже в 1965-1972 гг. — 73%, а сейчас, по данным большинства авторов, — 80-90%. Однако это не исключает возможности развития АБА другого, более редкого происхождения (как приобретенного, так и врожденного).
Врожденная неполноценность аортальной стенки, служащая предпосылкой развития АБА, может быть обусловлена синдромом Марфана, а также фибромускулярной дисплазией стенки аорты.
В период бурного разития ангиологии и ангиохирургии диагностировали значительное количество ятрогенных аневризм в результате ангиографических исследований, ангиопластики после реконструктивных операций (эндартерэктомии, протезирования — анастомотические аневризмы). Однако эти аневризмы носят обычно ложный характер.
Достаточно редко встречаются аневризмы, связанные с воспалительным процессом — неспецифическим аортоартериитом, специфическими артериитами (сифилис, туберкулез, ревматизм, сальмонеллез). Следует сказать, что если, несмотря на рост заболеваемости сифилисом, АБА данной этиологии стала казуистически редкой патологией, то «микотические аневризмы» имеют тенденцию к увеличению.
Правомочность термина «микотические аневризмы» достаточно спорна. Роль микоплазмоза в развитии воспалительно-дегенеративных изменений аортальной стенки можно считать доказанной, однако на практике ни гистологически, ни серологически отличить аневризму микоплазматической этиологии от аневризмы другого инфекционного происхождения очень трудно.
Именно поэтому и предлагается объединить в общую группу как аневризмы, которые связаны с инфекционно-воспалительными изменениями в стенке аорты, так и те, которые возникли вследствие перехода воспалительного процесса из парааортальной клетчатки (как средостения, так и забрюшинного пространства). Этот механизм поражения стенки аорты более вероятен, поскольку лимфотропность таких инфекционных болезней, как сальмонеллез, иерсениоз, аденовирусные заболевания, увеличивает возможность поражения лимфоузлов парааортальной клетчатки.
Впервые термин «воспалительные аневризмы брюшной аорты» ввели г. D. Walker и соавт. Воспалительные аневризмы отличает триада симптомов:
- утолщение стенки аневризматического мешка;
- интенсивный перианевризматический и ретроперитонеальный фиброз;
- частое спаяние и вовлечение окружающих аневризму органов.
Пациенты с воспалительными АБА чаще являются симптомными по сравнению с больными с невоспалительными аневризмами. Симптоматика воспалительной АБА связана с клинической картиной воспаления и расширения брюшной аорты: снижение веса, боли в животе или поясничной области, изменение картины крови. Необходимо также отметить трехкратное увеличение летальности при плановых резекциях воспалительных АБА в сравнении с невоспалительными.
На основании анализа гистологической картины A. G. Roset и D. M. Dent впервые высказали мнение о том, что так называемые воспалительные и невоспалительные АБА, по-видимому, мало чем отличаются по патогенетическим механизмам, поскольку воспалительные изменения в стенке аорты в той или иной степени присутствуют при любых формах аневризм. Более того, они предположили, что воспалительные аневризмы являются терминальной стадией развития тех воспалительных процессов, которые возникают как при воспалительных, так и невоспалительных АБА. Последующие исследования других авторов показали, что хронические воспалительные инфильтраты обнаруживаются как в воспалительных, так и атеросклеротических АБА. Pennell R. С. и соавт. подчеркнули, что единственное различие воспалительных и невоспалительных АБА — «степень интенсивности и распространенности воспалительного процесса, что предполагает идентичность обеих форм заболевания, отличающихся только прогрессированием воспаления». Сходное заключение сделали позднее А. V. Sterpetti и соавт.
Современные теории патогенеза АБА предполагают, что воспалительная реакция возникает в ответ на фиксацию неизвестного антигена в стенке аорты. Этот ответ характеризуется инфильтрацией аортальной стенки макрофагами, Т- и В-лимфоцитами и активацией протеолитической активности через продукцию цитокинов. Повышение протеиназной активности приводит к дезинтеграции белков матрикса, что, в свою очередь, приводит к развитию АБА. Воспалительный процесс возникает только у некоторых субъектов при наличии экзогенных факторов (например курение) или генетической предрасположенности. Быстрое развитие воспалительного процесса в стенке аорты, который заканчивается образованием воспалительных аневризм, чаще возникает у пациентов более молодого возраста.
Поиск агента, который вызывает иммунный ответ в стенке аорты, сосредоточился на исследовании экзогенных и эндогенных факторов. В качестве таких эндогенных факторов называют продукты деградации эластина и/или эритроцитов, окисленные липопротеины низкой плотности. Ряд авторов считают наиболее вероятным источником аутоиммунной реакции при воспалительных АБА фибриллсвязанные гликопротеиды. Исследования S. Tanaka и соавт. свидетельствуют о роли вирусов в развитии воспалительных АБА. Они доказали, что вирус простого герпеса, или цитомегаловирус, встречается значительно чаще в стенке аневризм, чем в нормальной стенке аорты. Более того, эти вирусы чаще встречаются в воспалительных и реже в невоспалительных аневризмах. О роли других внутриклеточных патогенных микробов (например Chlamidia pneumoniae) в развитии АБА мы уже сообщали. Последние иммуномолекулярные исследования выдвигают еще одну гипотезу развития воспалительных аневризм. Так, Т. E. Rasmussen и соавт. выявили у больных с воспалительными аневризмами генетически обусловленный дефект в системе HLA, в частности в молекуле HLA-DR, что, по их мнению, может формировать неадекватный аутоиммунный ответ на различные антигены. Одним из возможных таких мощных антигенов, с их точки зрения, являются вещества, вдыхаемые при курении. Вот почему количество курильщиков среди больных с воспалительными аневризмами значительно выше, чем среди пациентов с невоспалительными АБА.
Таким образом, несмотря на многолетние исследования воспалительных аневризм, этиология и патогенез их развития до конца не изучены. Современные представления базируются на внешних (антигенных), эндотелиальных и генетических факторах, которые, воздействуя на стенку аорты, являются причиной образования АБА. У некоторых индивидуумов эти факторы могут привести к развитию воспалительных АБА.
Удельный вес неатеросклеротических аневризм брюшного отдела аорты, по данным Ф. В. Баллюзека, составляет не более 10%. Однако этот показатель не вполне демонстративен, поскольку зависит от концентрации больных с «микотическими аневризмами» в определенные периоды времени, совпадающие с неблагоприятными изменениями эпидемиологической обстановки в отдельных клиниках, особенно в отношении сальмонеллеза.
Авторы, имеющие опыт диагностики «микотических аневризм аорты», достаточно четко определяют критерии этого вида аневризм и их отличия от атеросклеротических аневризм. Средний возраст этих аневризм — 3,9-7 лет, преобладают лица женского пола, отсутствуют признаки системного атеросклероза, ишемической болезни сердца. Достаточно специфичен анамнез (перенесенная лихорадка, диспепсические жалобы, эпидемиологическая ситуация), а также клинические анализы крови, мочи, биохимические и иммунологические сдвиги в крови. Мнение о том, что аневризмы относятся к одним из наиболее частых проявлений атеросклероза как системного заболевания, в последнее время вызывает сомнение в результате некоторых клинических и лабораторных исследований. Выяснилось, что у части больных с аневризмами брюшной аорты отсутствуют клинические и лабораторные данные об окклюзионных поражениях других артериальных бассейнов. Кроме того, средний возраст этих больных на 10 лет больше, чем возраст больных с симптомами окклюзионных поражений различных сегментов аорты и магистральных и периферических артерий .
Достаточно существенна и такая особенность АБА, как их сочетание с аневризмами других локализаций у одного и того же больного, а также тенденция к генерализованной артериомега-лии. Кроме того, экспериментально вызванный атеросклероз у животных чаще ведет не к окклюзии, а к ди-латации артерий и аорты.
Механизмы формирования аневризм брюшной аорты
Несмотря на интенсивные исследования, особенно в последнее десятилетие, механизмы развития АБА до конца остаются неясными. В течение многих лет основной причиной АБА считают дегенеративные атеросклеротические изменения в стенке аорты. Это мнение безоговорочно принималось большинством клиницистов и основывалось на нескольких очевидных фактах:
- по данным гистологических исследований, в стенке АБА выявляются типичные атеросклеротические бляшки;
- у больных АБА часто имеются окклюзирующие поражения в других артериальных бассейнах, т. е. имеется системный атеросклеротический процесс;
- атеросклеротические изменения в стенке аорты нарастают с возрастом, и с возрастом же увеличивается частота АБА, что свидетельствует о взаимосвязи этих патологических состояний;
- факторы риска АБА и атеросклероза (курение, артериальная гипертензия, гиперхолестеринемия) во многом совпадают.
В то же время ряд существенных различий между атеросклерозом и АБА ставит под сомнение простое патогенетическое их тождество. Во-первых, несмотря на совпадение факторов риска развития заболевания, между АБА и атеросклерозом есть важные эпидемиологические различия. Во-вторых, атеросклероз первично локализуется в интимальном слое аорты, а при АБА процесс характеризуется воспалительными изменениями в среднем и адвентициальном слое сосуда с обширной дегенерацией медии и уменьшением количества эластических белков и гладко-мышечных клеток. В-третьих, для формирования аневризмы аорты, по всей видимости, необходимо вовлечение в процесс или, по крайней мере, ослабление (воспаление, дистрофия, склероз) средней оболочки, так как именно в ней находится эластокол-лагеновый каркас, определяющий эластичность и прочность стенки аорты. Все эти факты привели к пониманию того, что патогенетические механизмы развития АБА несравненно сложнее, чем простое естественное течение атеросклеротического процесса, и к тому, что механизмы развития АБА стали углубленно изучать.
Выявлено, что главную роль в формировании аневризм играет структура белков аортальной стенки. Содержание эластина в стенке аневризмы аорты, как правило, уменьшено, активность эластазы увеличена и сочетается обычно с нарастанием уровня предвестника эластина. Активность коллагеназы также может быть увеличена.
Генетическая предрасположенность подтверждается фактами семейного образования АБА. Недавно была обнаружена определенная мутация в III типе проколлагена, что считается причиной развития АБА, особенно у лиц более молодого возраста.
Таким образом, механистическая теория формирования и прогрессирования аортальных аневризм получила как бы новое освещение, касающееся естественной истории развития данного заболевания.
В настоящее время разрабатывают три основных направления в изучении этиологии формирования и развития аневризм брюшной аорты:
- генетическую теорию;
- теорию протеолитических энзимов;
- теорию роли редких металлов.
Для понимания основных патогенетических механизмов заболевания необходимо кратко остановиться на современных данных о структуре стенки брюшной аорты. В стенке аорты принято выделять три оболочки: внутреннюю, среднюю и наружную. Внутренняя оболочка (интима) представлена слоем эндотелия, покрытого гликокаликсом, расположенным на базальной мембране, и подэндотелиальным слоем, в котором ряд авторов выделяют соединитель-нотканный, эластический, гиперпластический и мышечно-эластический слои. Снаружи интима ограничена внутренней эластической мембраной. Средняя оболочка составляет основную массу стенки аорты. В нее входят 40-50 концентрически расположенных эластических окончатых мембран, связанных между собой эластическими волокнами и образующих единый эластический каркас вместе с другими оболочками. Между мембранами залегают гладкомышечные клетки, имеющие косое по отношению к ним направление, и небольшое количество фибробластов. Schlatmann Т. J. выделяет единицу строения средней оболочки аорты — пластинчатое соединение, которое состоит из двух параллельных эластических мембран с гладкомышечны-ми клетками, коллагеновыми волокнами и основным веществом между ними. Тонкие эластические волокна расположены поперечно и соединяют две основные эластические пластины. Этот тип строения прослеживается по всей длине аорты, но вместе с тем существуют определенные количественные и качественные различия в строении разных частей аорты. Основным компонентом медии брюшной части аорты являются гладкомышечные клетки, а грудной — поддерживающие структуры, такие как коллаген и эластин. Вторым отличием является соотношение содержания коллагена и эластина. В грудной аорте больше эластина, а в брюшной — коллагена. В некоторых работах отмечена и неоднородность строения средней оболочки. Субинтимальный слой, занимающий примерно 1/4-1/5 часть медии, по строению не похож на остальную часть средней оболочки. Отличительным признаком этого слоя является более рыхлое размещение гладкомышечных клеток и волокон, а также отсутствие их правильной ориентации. В нижней трети грудного и брюшном отделе аорты субинтимальный слой выражен сильнее. По наружной границе средней оболочки лежит наружная эластическая мембрана. Наружная оболочка аорты построена из рыхлой волокнистой соединительной ткани с большим количеством толстых эластических и коллаге-новых волокон, имеющих главным образом продольное направление.
Аортальный эластин включается в экстрацеллюлярный матрикс первично на ранних стадиях эмбрионального развития. Эластические волокна состоят из поперечно-соединенных тропоэластино-вых мономеров и микрофибриллярных протеинов, таких как фибриллин-1, которые организованы в тонкую эластическую мембрану, характеризующую архитектонику аортальной медии. Эластин является одним из самых стабильных структурных компонентов экстрацеллюлярного матрикса, и период его биологического полураспада достигает десятилетий, что делает упругость и эластичность основным свойством нормальной стенки аорты. И напротив, разрушение эластина средней оболочки аорты — наиболее частое морфологическое изменение при АБА.
Sterpetti A. V. и соавт. предложили различать два типа АБА: в сочетании с окклюзирующими поражениями других сегментов артериального русла и без подобных поражений. По их наблюдениям, среди 526 больных, оперированных по поводу АБА, 25% не болели атеросклерозом. Причем они отметили, что именно в группе неатеросклеротических АБА было значительно большее количество разрывов по сравнению с группой атеро-склеротических АБА.
«Семейные» АБА также наблюдались чаще в группе неатеросклеротических АБА.
Следующим отличием этих двух групп была определенная генерализованная слабость аортальной стенки у больных с неатеросклеротическими АБА, чем и объясняется более высокий риск разрывов, кровотечения и частого развития ложных аневризм анастомозов после реконструктивных операций.
Обнаружены определенные генетические вариации в хромосоме у 16 больных с АБА, что имеет отношение к повышению активности альфа-2-гаптаглобулина, ведущего к увеличению гидролиза нитей эластина эластазой.
Другое направление исследований свидетельствует о структурных изменениях стенок аорты вследствие протеолизиса. Так, R. W. Bussuti и соавт. доказали высокую активность коллагеназ в стенке аорты у больных с АБА, причем у больных с разрывом она была значительно выше.
Cannon D. J. и соавт. провели контрольные исследования у курящих больных с аневризмой дуги аорты (АДА) и синдромом Лериша для определения влияния курения на процесс протеолизиса. Было выявлено увеличение протеолитических эн-зимов в плазме курильщиков с АБА и отсутствие этих изменений у курильщиков с синдромом Лериша. Это. позволяет предположить протеазно-антипротеазный дисбаланс вследствие курения именно у больных с АБА и тем самым считать данный фактор одним из компонентов влияния на формирование АБА.
Теория редких металлов основана на экспериментальных исследованиях, свидетельствующих о том, что у мышей развитие аневризм обусловлено дефектом Х-связанной хромосомы, которая ведет к ненормальному метаболизму меди. У больных с АДА М. D. Tilson, G. Davis выявили дефект меди в печени и в коже при биопсии. Дефицит медной лизил-оксидазы может вызвать дефицит коллагена и эластина в стенке аорты, ослабление ее матрицы и формирование аневризм.
АБА структурно характеризуется деградацией экстрацеллю-лярного матрикса средней оболочки аортальной стенки с увеличением содержания коллагена и снижением эластина. Эти изменения сопровождаются повышением активности металлопротеиназ. Биохимический дисбаланс синтеза фибриллярных белков экстрацеллюлярного матрикса, по мнению исследователей, приводит к дезинтеграции структуры аортальной стенки. Существуют исследования, которые доказывают, что с ростом диаметра АБА содержание эластина в стенке аорты снижается, а содержание коллагена увеличивается. Синтетическая активность гладкомышечных клеток медии, которые ответственны за формирование экстрацеллюлярного матрикса, тоже снижается, что, вероятно, также ведет к снижению механических свойств аорты. Плотность гладкомышечных клеток в медии достоверно снижается. Было продемонстрировано, что снижение количества гладкомышечных клеток сопровождает увеличение активности так называемого фактора р53, который является медиатором торможения цикла клеточного развития и программирует клетку на гибель. Другая характерная особенность АБА — изменение клеточного состава в наружных слоях стенки аорты, сопровождающееся массивной инфильтрацией медии и адвентиции макрофагами и лимфоцитами. Макрофаги в стенке аневризмы выделяют различные цитокины и продукты воспаления, подобные фактору альфа опухолевого некроза и интерлейкину-8. Цитокины, продуцируемые макрофагами, в свою очередь стимулируют активность металлопротеиназ, и, что особенно важно, макрофаги сами по себе стимулируют активность металлопротеиназы-9 и-металлопротеиназы-3. Таким образом, макрофаги, скорее всего, являются основным источником повышенной протеазной активности в стенке брюшной аневризмы. По мнению некоторых исследователей, именно протеазы матрикса, запуская механизмы хронического воспаления стенки аорты, могут приводить к образованию АБА. Доказательство роли протеаз в развитии АБА привело к предложениям использовать ингибиторы протеаз в профилактике и предотвращении дальнейшего роста аневризм.
Как уже указывалось, в противоположность атеросклеротическим бляшкам, которые локализуются преимущественно в интимальном слое, АБА характеризуются образованием воспалительных инфильтратов, преимущественно в медии и адвентиции. Еще одной особенностью АБА является наличие в адвентициальных инфильтратах большого количества как В-, так и Т-лимфоцитов, тогда как для окклюзирующего атеросклероза характерно выявление только Т-клеток. В последних исследованиях сообщается о перманентном выявлении в стенке АБА так называемых сосудистых дендритных клеток, сходных с клетками Лангерганса. Это свидетельствует о наличии сложных иммунных реакций в тканях аневризматической стенки. В клетках тканевых культур, выделенных из стенок аневризм, уровень секреции простагландина Е2 превышал в 50 раз таковой в тканевых культурах из стенок нормальных аорт, что привело к возникновению гипотезы о том, что простагландин Е2 является стержневым воспалительным медиатором в аневризматической стенке. Эта гипотеза породила появление экспериментальных работ, в которых делаются попытки нестероидными противовоспалительными средствами (например индометацин) прервать порочный круг воспаления в аортальной стенке и таким образом препятствовать росту аневризмы. В литературе есть указания и на другой биохимический механизм не повышения активности протеаз, а, напротив, снижения активности их ингибиторов. В частности, у ряда пациентов с АБА отмечено снижение уровня альфа-1-антитрипсина — основного ингибитора эластазы. Исходя из этого, появилось предположение о том, что в развитии АБА может также играть роль дисбаланс между эластазой и альфа-1-антитрипсином.
Cohen J. R. и соавт. обнаружили генетическую предрасположенность больных с АБА к MZ-фенотипу альфа-1-антитрипсина. Этот факт сближает энзимную теорию образования АБА с генетической.
Семейные случаи формирования АБА вполне доказаны. В частности, Darling и соавт. сравнили в этом отношении две группы: 542 больных с АБА и 500 — без АБА. В 1-й группе у ближайших родственников 15,1% больных обнаружена АБА, во 2-й контрольной группе лишь у 1,8%. У сестер относительный риск формирования АБА был значительно выше, чем у братьев (22,9 и 9,9 соответственно).
Наследственные корни заболевания были подтверждены разносторонними генетическими исследованиями АБА с применением методов молекулярной биологии. В частности, Webster М. W. и соавт. выявили, что 25% пациентов, у которых при скрининговом ультразвуковом исследовании была выявлена АБА, являются детьми от одних родителей. Сходную частоту АБА (29%) выявили среди братьев Н. Bengtsson и соавт. Наконец, по сообщению F. A. Lederle и соавт., которые изучали распространенность АБА среди 73 451 американских ветеранов в возрасте 50-79 лет, семейная история аневризм была выявлена у 5,1% пациентов. Изучение механизмов наследования показало, что оно происходит в аутосомно-доми-нантной форме и может быть связано с одним геном. Kuivaniemi Н. и соавт. эти и собственные данные позволили сделать заключение о том, что семейная история АБА может быть обусловлена генетическим дефектом. Молекулярно-биологические исследования частично подтвердили это мнение и выявили, что у части больных с АБА имеются дефекты в синтезе важных фибриллярных белков — коллагена или эластина, составляющих каркасную структуру стенки аорты. Это, в свою очередь, может являться причиной генетически наследуемой АБА. Предположительно, эти генные дефекты могут быть выявлены в локусе генетического кода COL3A1, ответственного за синтез коллагена третьего типа, или локусе COL5A2, ответственного за синтез коллагена пятого типа (белок, определяющий диаметр белковых фибрилл и влияющий на упругую растяжимость экстрацеллюлярного матрикса). Однако генетические факторы развития АБА не нашли пока окончательного подтверждения и требуют дальнейшего изучения.
Первопричины запуска механизмов воспаления неизвестны. Однако в последнее время в качестве возможных агентов называют многие микроорганизмы, в том числе и условно-патогенные, например Pseudomonas aeruginosa. Особую роль отводят Chlamidia pneumoniae — одному из внутриклеточных патогенов, с которым связывают развитие заболеваний сосудов, в том числе ИБС, цереброваскулярной патологии. Исследования J. Juvonen и соавт., Е. Petersen и соавт. выявили ДНК Chlamidia pneumoniae в стенке аневризмы более чем в половине случаев АБА. В то же время прямых причинных связей с развитием АБА вновь безусловно выявлено не было.
Суммируя все данные, современные представления о патогенезе развития АБА можно свести к следующим механизмам:
- Атеросклеротические изменения стенки аорты.
- Изменения в матриксе аортальной стенки.
- Активация протеолиза в стенке брюшной аорты.
- Воспалительные изменения в стенке аорты.
- Генетические дефекты в синтезе фибриллярных белков брюшной аорты.
Поскольку причины этих нарушений до настоящего времени однозначно неизвестны, не существует и надежных медикаментозных или терапевтических средств, предотвращающих дегенеративные изменения в стенке аорты и дальнейший рост аневризмы с исходом в разрыв. Следовательно, единственным эффективным способом лечения АБА на сегодняшний день остается резекция аневризмы с замещением ее протезом. Возможно, дальнейший прогресс в изучении патогенеза АБА приведет к появлению эффективных терапевтических средств профилактики возникновения и прогрессирования аневризм указанной локализации.
Клинический материал Института сердечно-сосудистой хирургии проанализированс момента стабилизации исследований и хирургического опыта по разделу оперативного лечения АБА. За этот период хирургическое лечение проведено у 324 больных. Из них мужчин с болевой формой было 147, женщин — 25, с безболевой — соответственно 140 и 12. В возрасте до 30 лет с болевой формой было 8 больных; 31-40 лет — 12; 41-50 лет — 13; 51-60 лет — 61; 61-70 лет — 42; 80 лет — 7; с безболевой формой — соответственно 11, 12, 28, 64, 47 и 19 больных.
Таким образом, наши данные о соотношении мужчин и женщин с АБА (7,7 : 1) соответствуют литературным. Не противоречивы они и по возрасту оперированных больных: среди 324 больных самую большую группу (66%) составляют пациенты в возрасте 51-70 лет. Отсутствуют в этих группах существенные различия по клиническому течению, а также в распределении больных по этиологии заболевания. Атеросклеротическая природа заболевания выявлена нами у 301 больных (92,8%), редкие этиологические формы АБА — у 7,2% (неспецифический аортоартериит — у 16, фибромускулярная дисплазия — у 4 и медионекроз — у 3).
Патогенез аневризм брюшной аорты
Механизм развития аневризм брюшной аорты до настоящего времени не совсем ясен. Большинство авторов предполагают первичное поражение стенки аорты атеросклеротическим или воспалительным процессом. Склонность именно к инфраренальной локализации объясняется следующими причинами:
- внезапное уменьшение кровотока в брюшной аорте дистальнее почечных артерий, так как большая часть сердечного выброса направлена в покое в органы желудочно-кишечного тракта (23% от минимального объема — МО) и в почки (22% от МО);
- нарушение кровотока по vasa vasorum, вызывающее дегенеративные и некротические изменения в стенке аорты с замещением ее рубцовой тканью;
- постоянная травматизация бифуркации аорты о жесткие близлежащие образования (promontorium);
- близкое расположение бифуркации — практически первого непосредственного препятствия на пути кровотока. Здесь впервые возникает отраженная волна. Этот гемодинамический удар в развилку аорты, а также повышенное периферическое сопротивление в артериях нижних конечностей и приводят к увеличению бокового давления в терминальной аорте. Клинически хорошо известны факты дистального смещения бифуркации брюшной аорты, возникающей в связи с этим девиации подвздошных артерий и развития аневризм «типа лягушки».
Все эти факторы приводят к дегенерации и фрагментации эластического каркаса стенки аорты и атрофии ее средней оболочки. Основную роль каркаса начинает выполнять адвентиция, которая не может адекватно предотвратить постепенное расширение просвета аорты. Отмечено также, что стенка аневризмы содержит меньше коллагена и эластина, чем нормальная стенка аорты. Выявляется значительная фрагментация эластина. Summer D. S. показал, что передняя стенка аневризмы вообще имеет больше коллагеновых и эластических волокон, что обусловливает ее большую прочность. Задняя и боковые стенки содержат меньше эластических структур, поэтому менее прочны, и разрывы аневризм происходят в основном в забрю-шинное пространство. Напряжение стенки зависит, по закону Лапласа, от радиуса сосуда, ввиду чего возможность разрыва у аневризмы, имеющей большие размеры, естественно выше.
Патологическая анатомия
Форма аневризмы — мешотчатая или диффузная веретенообразная — зависит от степени и распространенности изменений стенки аорты. Мешотчатые аневризмы возникают при локализованном изменении одной из стенок аорты. При этом образуется добавочная полость — мешок, стенки которого составляют измененные стенки аорты. Веретенообразная аневризма — это диффузное расширение всего периметра брюшной аорты, связанное с более обширным циркулярным поражением сегмента аорты. Мешотчатые аневризмы более характерны для сифилитического процесса, диффузные — для атеросклероза, неспецифического аортита.
источник
