а) Предоперационная подготовка при аневризме сосуда головного мозга. Перед операцией хирург должен оценить имеющиеся изображения, чтобы определить:
• Ширину шейки аневризмы и конфигурацию окружающих сосудов;
• Оптимальные пути подхода;
• Возможность проксимального контроля;
• Потенциальную необходимость наложения обходного анастомозга.
Цифровая 3D-ротация или КТА являются идеальными методами предоперационной оценки шейки аневризмы. Можно оценить предполагаемое клипирование, предпочтительно в плоскости дистального сосуда, чтобы предотвратить или минимизировать перегибы, и принять меры для оптимального достижения этой цели. К аневризмам переднего соединительного комплекса можно подойти с любой стороны, иногда передним межполушарным доступом. Следует принимать во внимание не только конфигурацию сосудов, но и сторону доминантного заполнения (для проксимального контроля) или повреждение гематомой прямой извилины с одной стороны (тогда эта сторона предпочтительнее для доступа).
Аневризмы, возникающие в устье глазной артерии, часто ориентированы в медиальном направлении и подход с латеральной стороны может обеспечить беспрепятственный путь к шейке аневризм.
б) Общие принципы оперативного вмешательства:
1. Диссекция. При диссекции по возможности необходимо сначала выявить проксимальный отдел сосуда, а затем двигаться в направлении шейки аневризмы. Следует использовать только острое рассечение для любых ригидных тканей поблизости от аневризмы.
2. Прямое клипирование. Прямое клипирование должно быть направлено на полную окклюзию мешка аневризмы. При возможности следует пунктировать купол аневризматического мешка, чтобы обеспечить полное пережатие шейки аневризмы. Послеоперационная ангиография показывает, что в 2-10% случаях остаточная шейка располагается за пределами клипса.
3. Окутывание аневризмы. Окутывание дна аневризмы с мышцей обеспечивает некоторую защиту, но не исключает риск рецидива кровоизлияния. Использовать эту технику можно только в том случае, если прямое клипирование и эндоваскулярные методы недоступны.
4. Треппинг/экстра-интракраниальный анастомоз. Треппинг аневризмы в сочетании с наложением экстра-интракраниального микроанастомозга (ЭИКМА) сводит к минимуму риск ишемических осложнений в тех случаях, когда размер и форма аневризмы (например, веретенообразная) препятствуют применению клипирования или эндоваскулярной окклюзии.
5. Временное клипирование. Временное клипирование проксимального отдела несущего сосуда может способствовать выделению шейки аневризмы и затем окклюзии ее мешка. При использовании данной методики сосуд должен быть перекрыт в течение не более 3-5 минут, после чего необходима аналогичная по продолжительности реперфузия перед повторным применением временных клипсов. В случае, если доступ к проксимальному отделу сосуда неосуществим или сложен (например, низкая бифуркация базилярной артерии или аневризма супраклиноидного отдела внутренней сонной артерии), временная окклюзия может быть достигнута с помощью внутрисосудистого баллона.
6. Интраоперационная микродопплерография. Допплеровский микродатчик в дистальном отделе несущего сосуда может помочь убедиться в том, что поток крови дистальнее клипированной аневризмы сохраняется.
7. Дренирование ликвора. Примерно у 50% пациентов после САК возникают препятствия для оттока ликвора. Почти половине из них требуется выведение спинномозговой жидкости с помощью наружного вентрикулярного дренирования или при помощи поясничного дренажа в случае, если сгустки крови не тампонируют третий или четвертый желудочки. Люмбальный дренаж при любых оперативных вмешательствах помогает улучшить доступ и минимизирует тракцию мозга. Вскрытие терминальной пластинки во время операции может снизить потребность в постоянном дренировании ликвора.
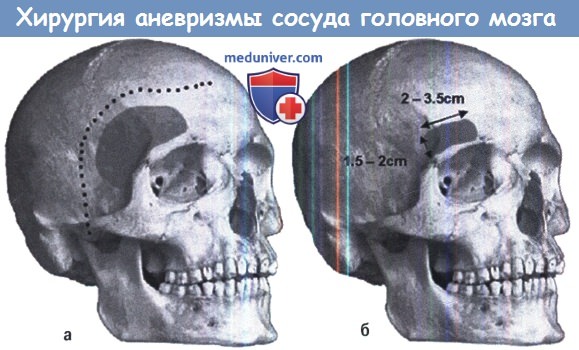
Б. Супраорбитальный доступ — область резекции кости. 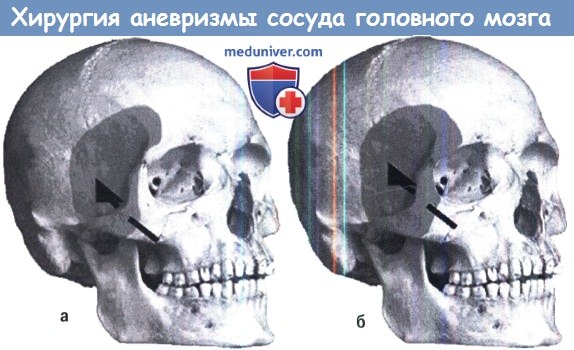
Б. Орбито-зигоматический доступ.
в) Аневризмы передней циркуляции — оперативная техника — птериональный доступ. Птериональный доступ остается стандартным подходом к аневризмам передней циркуляции. Голова пациента несколько приподнята, скуловая кость находится в самой высокой точке, поворот головы в сторону на 45° (больше или меньше в зависимости от предполагаемого направления доступа). На рисунке ниже показана линия разреза скальпа (пунктирная линия). Необходимо получить доступ к углу между скуловой костью и лобной костью. Затененная область показывает объем удаления кости.
Супраорбитальный разрез в сочетании с костным лоскутом размером 2×3,5 см («замочная скважина») может обеспечить доступ к большинству аневризм через стандартный птериональный доступ, но небольшой размер лоскута ограничивает угол подхода и неясно, оправдано ли повышение косметического дефекта за счет ограниченного доступа. Супраорбитальная линия доступа дает хороший обзор виллизиева круга, и мы всегда советуем расширять костный дефект в этом направлении, а не ограничиваться для трепанации черепа лобно-скуловым углом. Наружные отделы крыла клиновидной кости удаляются либо кусачками, либо дрелью заподлицо с основанием передней черепной ямки. При супраклиноидных аневризмах некоторые хирурги предпочитают удалять передний наклоненный отросток экстрадурально, чтобы получить доступ к кавернозному синусу, в то время как другие предпочитают удалять его интрадурально. Когда хирургу требуется доступ с низкой траекторией, удаление скуловой дуги с удалением или без удаления верхнего орбитального края может улучшить доступ и свести к минимуму тракцию мозга, хотя эти методы редко необходимы.
1. Аневризмы внутренней сонной артерии. Для аневризм, возникающих в области устья задней соединительной артерии, положение головы должно определяться направлением дна мешка. При направленной кзади аневризме положение головы на боку. Когда аневризма направлена латерально, поворот головы примерно на 45°. Паутинная оболочка рассекается над сонной артерией без ретракции височной доли, ретракция может привести к разрыву мешка аневризмы, если дно ее направлено в сторону доступа и аневризма может быть припаяна. Удаление переднего наклоненного отростка может помочь доступу к низко расположенным аневризмам. Перед клипированием необходимо идентифицировать заднюю соединительную и переднюю хориоидальную артерии. Окклюзии или стенозирования задней соединительной артерии лучше избегать, хотя это не должно принести вреда при условии нормально функционирующей задней мозговой артерии, но окклюзия передней хориоидальной артерии приведет к капсулярному инфаркту. Для передних хориоидальных и аневризм развилки внутренней сонной артерии важно обеспечить, чтобы перфорантные сосуды не попали между браншами клипса.
Параклиноидные аневризмы (включая офтальмические, верхние гипофизарные и задние параклиноидные аневризмы) требуют широкого удаления переднего наклоненного отростка, обеспечивая доступ к кавернозному синусу и позволяя применять проксимальный контроль. Транскавернозный доступ, описанный Dolenc, обеспечивает удобный доступ к интракавернозному сегменту внутренней сонной артерии. Кроме того, сонная артерия может быть обнажена на шее.
2. Аневризма передней мозговой/передней соединительной артерии. Идентифицируется бифуркация внутренней сонной артерии и отходящая кпереди передняя мозговая артерия. Необходимо аккуратность при ретракции лобной доли—аневризма передней соединительной артерии, будучи ориентированной вперед и вниз, может быть припаяна к основанию черепа. Удаление прямой извилины медиальнее от обонятельного нерва поможет улучшению доступа к комплексу передней соединительной артерии, в частности, для аневризм, дно которых направлено кзади и кверху между дистальными сосудами.
Нужно убедиться, что не повреждена возвратная артерии Гюбнера, в противном случае в послеоперационном периоде у пациента разовьется капсулярный инфаркт. Далее необходимо определить проксимальные и дистальные сосуды с каждой стороны до клипирования и остерегаться включения гипоталамических перфорантов в клипс. Перфорация терминальной пластинки поможет избежать необходимости шунтирующей операции в дальнейшем. Для некоторых аневризм комплекса передней соединительной артерии хирург может выбрать межполушарный подход, но при данном доступе существует вероятность выйти на купол аневризмы прежде, чем будут доступны условия для осуществления проксимального контроля. К аневризмам, возникающим в начале перикаллезной артерии, всегда требуется передний межполушарный доступ.
3. Аневризмы средней мозговой артерии. Для аневризмы, имеющей сложное строение, или при отсутствии достаточного опыта у нейрохирурга разумно начать вскрытие в проксимальных отделах сильвиевой щели перед тем, как начинать работать более дистально. Необходимо соблюдать осторожность, чтобы не повредить лентикулостриарные перфоранты на верхней поверхности средней мозговой артерии. В качестве альтернативы возможно раскрытие сильвиевой щели более латерально, также возможна инъекция физиологического раствора через небольшое отверстие в латеральную щель мозга. Иногда щель не разводится и, чтобы получить доступ к средней мозговой артерии, необходимо войти через верхнюю височную извилину.
В идеале при клипировании любой аневризмы клипс должен располагаться в плоскости дистального сосуда, чтобы минимизировать риск перегибов и препятствия току крови. Для аневризм средней мозговой артерии, как правило, необходимо выделение всего аневризматического мешка, так как он спаян с тканью головного мозга. Для более крупных аневризм применение временных клипсов должно сократить напряженность внутри аневризматического мешка и облегчить клипирование. Некоторые хирурги используют временное клипирование во время диссекции аневризмы, но это ограничено сроком около пяти минут, за которым требуется аналогичная по времени реперфузия. Нужно убедиться, что временный клипс не включает перфорантных сосудов, связанных с невидимыми глазом поверхностями средней мозговой артерии.
г) Аневризмы задней циркуляции — оперативная техника. Подход к аневризмам задней циркуляции зависит от того, где аневризма расположена на артериальном дереве.
I. Верхняя базилярная/верхняя мозжечковая/задняя мозговая артерии:
1. Аневризмы развилки основной артерии. Опасности оперативного лечения аневризм данной локализации связаны в первую очередь с риском повреждения перфорантов среднего мозга и таламуса. Они исходят из Р1, в нескольких миллиметрах от бифуркации, но некоторые из них могут отходить непосредственно от основной артерии и прилежать к задней поверхности мешка аневризмы. Субтемпоральный подход обычно применим для ориентированных кзади и низко расположенных аневризм базилярной бифуркации. Линейной или дугообразный разрез начинается от соединения скуловой кости с височной костью. Это дает ориентир проекции базилярной бифуркации. Люмбальный дренаж и маннитол помогают ретракции височной доли, но требуется осторожность, чтобы не повредить мостиковые вены, в частности, вену Лаббе.
Рассечение края намета (сохраняя четвертый нерв) перед открытием паутинной оболочки межножковой ямки, улучшает обзор. Важно попытаться определить левую заднюю мозговую артерию до клипирования и отделить любые перфоранты от задней поверхности шейки и дна аневризмы. Ориентированные кпереди аневризмы, как правило, лежат свободно от перфорантов и дают наименьший риск во время клипирования. Кверху и кзади ориентированные аневризмы обычно требуют фенестрированных клипсов, окружающих правую заднюю мозговую артерию, а иногда и III нерв. Бранши клипса должны доходить только до дистального края шейки, в противном случае клипс может перекрыть перфоранты, связанные с левым Р1.
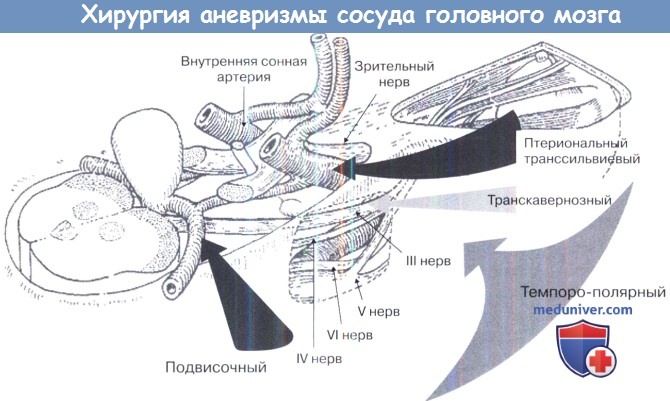
Транссильвиев птериональный доступ впервые был описан Yasergil. Широко открывается сильвиева щель, лобная доля, внутренняя сонная артерия и средняя мозговая артерия отводятся в медиальном направлении, а височная доля — в латеральном. Следуя по задней соединительной артерии, базилярная артерия и ее бифуркация оказываются в переднелатеральном положении. Диссекция продолжается либо сбоку от задней соединительной артерии, либо медиально между ветвями ее перфорантов. Рассечение задней соединительной артерии между наложенными клипсами может улучшить доступ, однако это невозможно при условии, что этот сосуд является основным источником заполнения правой задней мозговой артерии.
Транссильвиев птериональный доступ обеспечивает хороший обзор обеих задних мозговых артерий, но его недостатком является недостаточная прямая визуализация перфорантов, расположенных за мешком аневризмы. Этот подход требует меньшей ретракции височной доли, чем субтемпоральный доступ, однако доступ сложен для аневризм более 10 мм выше заднего наклоненного отростка. Для таких случаев более выгоден орбитозигоматический доступ, так как он допускает более короткую траекторию с меньшей ретракцией. Аневризмы, лежащие ниже уровня заднего наклоненного отростка, исключают применение транссильвиевого птерионального доступа, если только он не сочетается с транскавернозным доступом, описанным Dolenc.
Темпорополярный доступ дает сочетание маршрутов. При изменении направления ретракции височной доли хирург по мере необходимости может подойти к аневризме ориентированной кпереди или латерально. Ориентированные кзади аневризмы имеют больший риск осложнений из-за прямой связи с перфорантными сосудами; при этих аневризмах идентификация таких сосудов должна обеспечить наиболее безопасный подход при субтемпоральном доступе.
Аневризмы бифуркации основной артерии, лежащие ниже на 10 мм заднего наклоненного отростка и более, требуют одного из доступов, описанных в следующем разделе.
2. Аневризмы верхней мозжечковой артерии. Субтемпоральный доступ требует подхода со стороны аневризмы, а птериональный доступ позволяет клипировать аневризмы с обеих сторон. При этих аневризмах меньше вероятность связи перфорантов с шейкой или дном аневризмы; часто бывает припаян III нерв, который должен быть освобожден до клипирования.
3. Аневризмы задней мозговой артерии. К аневризмам, возникающим кпереди от среднего мозга (либо Р1, либо Р2) можно подойти через субтемпоральный, птериональный транссильвиев или темпорополярный доступ. Аневризмы, лежащие в обводной цистерне, исходящие из Р2 сегмента, требуют применения субтемпорального доступа, аневризмы в дистальных отделах Р3 сегмента можно достигнуть с помощью затылочного межполушарного подхода. Окклюзии дистальных отделов задней мозговой артерии дистальнее отхождения перфорантов среднего мозга или задней хориоидальной артерии редко вызывают значимый неврологический дефицит.

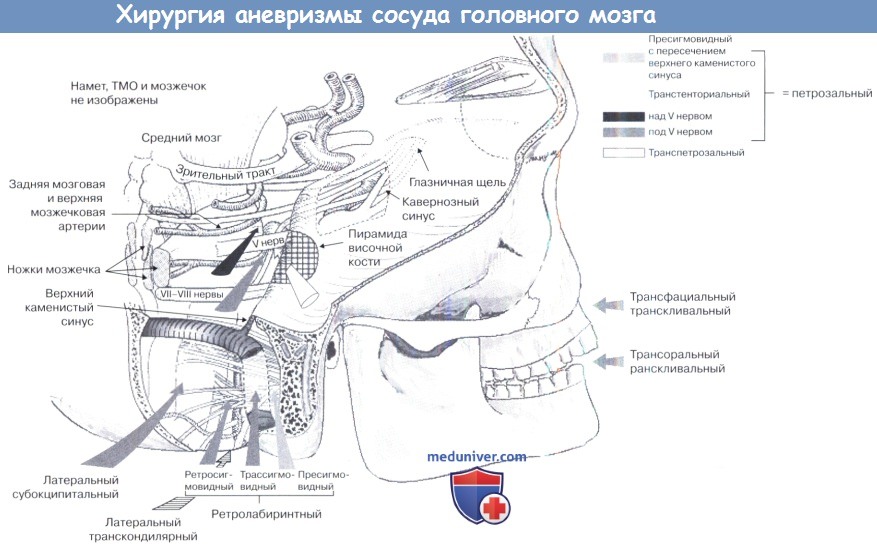
II. Аневризмы ствола основной артерии/вертебро-базилярного сочленения/низко расположенной базилярной бифуркации. Субтемпоральный транстенториальный доступ обеспечивает подход к аневризмам до 18 мм ниже уровня спинки турецкого седла (т. е. до уровня внутреннего слухового прохода). Темпоральная краниотомия производится более кзади, с центром над сосцевидным отростком. Во время ретракции требуется особая осторожность, чтобы не повредить нижнюю анастомотическую вену. Намет мозжечка рассекается позади точки выхода нерва IV, и расширяется к поперечному синусу. При перемещении кзади вдоль тенториального края, хирург видит медиальную стенку каменистой части височной кости. Аневризмы могут располагаться медиальнее или латеральнее тройничного нерва (черная и серая стрелки). Kawase et al. описали экстрадуральный транспетрозальный доступ, при котором каменистый отдел высверливается между внутренним слуховым проходом книзу, улиткой сзади и тройничным ганглием кпереди, однако операционное поле ограничено узкими костными отверстиями (белая стрелка). Данная методика может быть применена при интрадуральном транстенториальном доступе, если требуется более передний подход.
Кроме того, к аневризмам вертебро-бази-лярного сочленения и ствола основной артерии можно подойти ниже. Стандартный боковой субокципитальный доступ редко дает достаточный обзор, но может быть улучшен с помощью различных методов. Расширение области включает ограниченную мастоидэктомию с обнажением сигмовидного синуса. Открытие твердой мозговой оболочки синуса и ретракция синуса кпереди (ретросигмовидный доступ), или даже перевязка и ретракция синуса кпереди (транссигмовидный доступ) улучшают обзор как препонтинного пространства, так и мостомозжечковой цистерны, сокращая расстояние до средней линии. Кроме того, применение супраинфратенториального доступа обеспечивает широкий обзор ствола основной артерии и вертебро-базилярного перехода. Al-Mefty et al. описали транспетрозальный подход, при котором мастоидэктомия, помимо большой височно-затылочной трепанации, обеспечивает пресигмовидный ретролабиринтный путь к задней черепной ямке.
Разделение верхнего каменистого синуса и намета мозжечка, а также ретракция поперечного и сигмовидного синусов в медиальном направлении дает широкий обзор, обеспечивает кратчайший путь к аневризме, и сводит к минимуму тракцию моста и мозжечка. При всех вышеупомянутых инфратенториальных подходах, VII—XII черепные нервы лежат между хирургом и сосудом, поэтому они находятся под угрозой повреждения. Транскливальный подход, осуществляемый либо через трансфациальный, либо трансоральный доступ избегает тракции ствола головного мозга и черепно-мозговых нервов. Однако такие методы представляют значительную опасность: оперативный коридор длинный и узкий и пространство для действий обычно составляет только 5 мм от средней линии. Ориентированные кпереди аневризмы могут разорваться при рассечении твердой мозговой оболочки, при этом также имеется риск послеоперационной ликвореи, несмотря на применение современных тканевых клеев.
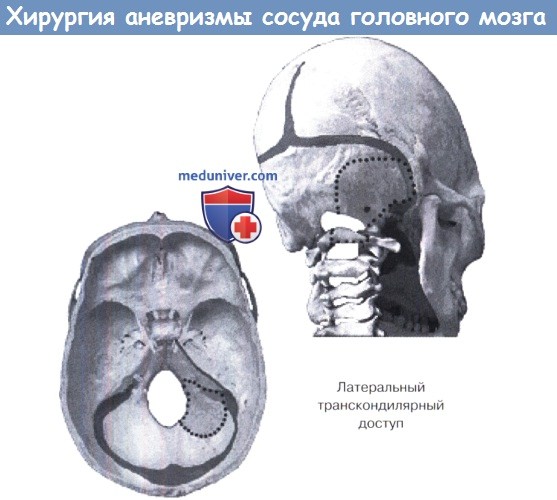
III. Аневризмы позвоночной артерии. Большинство аневризм позвоночной артерии возникает в области устья задней нижней мозжечковой артерии (ЗИМА), однако это происходит не всегда, аневризмы позвоночной артерии могут встречаться, начиная от уровня большого затылочного отверстия. Редко аневризмы лежат экстракраниально, возникая либо в месте отхождения передней спинномозговой артерии или в месте очень низкого отхождения ЗИМА. Стандартный латеральный субокципитальный доступ, как правило, обеспечивает достаточный обзор для большинства этих аневризм. Краниоэктомия проходит от средней линии до края поперечного/сигмовид-ного синуса и включает задний край большого затылочного отверстия. Для низко расположенных аневризм проксимальный контроль может обеспечиваться выделением позвоночной артерии экстракраниально в месте пересечения ею дуги С1 до входа артерии в твердую мозговую оболочку.
При боковом чрезмыщелковом доступе удаляется треть или даже половина затылочного мыщелка, что позволяет получить доступ к подъязычной и яремной областям и обеспечивает более каудально-ростральную траекторию и сокращенный путь к средней линии. Таким образом, чем больше размер аневризмы и чем она ближе к средней линии, тем больше необходимость резекции кости в латеральном направлении. В случае обоих указанных доступов часто необходимо работать между ветвями каудальной группы черепно-мозговых нервов для достижения шейки аневризмы, и избежать повреждения нервов можно только при соблюдении крайней осторожности.
источник
Аневризмы представляют собой выпячивание артериальной стенки и располагаются в области развилки сосуда или устья крупных ветвей, отходящих от артерии . Именно в этой части проксимальных сегментов артерий чаще возникают участки гемодинамического удара. Вследствие гипоплазии или аплазии одного из сегментов артерии (как вариантах строения артериального круга большого мозга) гемодинамический эффект развития аневризм особенно нагляден — происходит перераспределение кровотока с его увеличением на одном из участков артерий (чаще в проекции отхождения ветвей или развилки артерии).
В возникновении аневризм имеют значение и дегенеративные, атеросклеротические изменения стенки артерии, также обычно возникающие в области их деления на ветви. В проекции шейки аневризм часто обнаруживаются атеросклеротические бляшки.
Дистальные аневризмы образуются вследствие микотического поражения артерий.
Мешотчатая аневризма состоит из трех частей:
1 — шейки (сохраняет трехслойное строение стенки артерии – эндотелий, мышечный слой и адвентицию)
2 — тела (представлено соединительной тканью и фрагментами миофиломентов)
3 — купола (имеет только один внутренний слой)
Разрыв аневризмы возникает в области самого слабого участка аневризмы – купола.
Существуют веретенообразные аневризмы, располагающиеся в области базилярной артерии в проекции блюменбахова ската или внутренней сонной артерии в кавернозной ее части.Веретенообразные аневризмы возникают в результате дегенеративного поражения стенок на протяжении всего сегмента артерии.
Аневризмы могут быть также в виде воронкообразного расширения в области устья ветви, отходящей от основного артериального ствола (обычно в области внутренней сонной артерии).
Аневризмы чаще бывают мешотчатыми и редко – веретенообразными, соотношение их составляет 50:1.
На ангиограммах мешотчатая аневризма выглядит в виде депо контраста.
По величине аневризмы делят на:
1. милиарные (3 мм в диаметре)
2. обычного размера (4–15 мм)
3. большие (16–25 мм)
4. гигантские (>25 мм)
Аневризма чаще представлена одной камерой, но может быть и многокамерной.
Аневризмы обычно бывают одиночными, но могут быть и множественными (в 15%), располагаясь на различных артериях.
В подавляющем числе наблюдений (97%) аневризмы располагаются в переднем отделе артериального круга большого мозга (виллизиев круг) и только 3% аневризм локализуются в вертебробазилярном сосудистом бассейне.
Чаще аневризмы располагаются в области:
•передней мозговой (ПМА) и передней соединительной артерий (ПСА) – в 47%,
•внутренней сонной артерии (ВСА) – в 26%,
•средней мозговой артерии (СМА) – в 21%,
•дистальных ветвей ПМА – в 3%
В области развилки базилярной артерии или устья задней нижней мозжечковой артерий аневризмы встречаются только в 3%.
При множественных аневризмах несколько иная картина – чаще аневризмы бывают в области СМА и ВСА – в 35 и 34% соответственно, и реже в области ПМА–ПСА – в 22%.
Одиночные аневризмы диагностируют у 91%, множественные – у 9% больных.
ЭПИДЕМИОЛОГИЯ
Аневризмы сосудов головного мозга чаще встречаются у женщин .
Между локализацией аневризм, возрастом и полом пациентов существуют закономерности. Отмечено, что у детей соотношение аневризм у мальчиков и девочек равно 3:2, у людей молодого возраста – 1:1, а у взрослых аневризмы реже наблюдаются у мужчин, чем у женщин, и соотношение равно 2:3.
•У женщин аневризмы (разорвавшиеся и без разрыва) чаще встречаются в области супраклиноидной части внутренней сонной артерии.
•У мужчин среди разорвавшихся аневризм чаще бывает аневризма передней мозговой артерии–передней соединительной артерии, а среди неразорвавшихся – в супраклиноидной части внутренней сонной артерии.
Аневризма может стать причиной внутричерепного кровоизлияния в любой период жизни человека, но чаще в возрасте от 40 до 60 лет. Встречаемость разрыва аневризм возрастает с 3 на 100 000 населения среди лиц до 30 лет до 30 на 100 000 населения среди лиц старше 60 лет.
Факторами риска разрыва аневризм являются артериальная гипертензия, курение и возраст.
Летальность в течение первых 2–3 недель после разрыва аневризмы колеблется от 20 до 30%, инвалидами становятся около 20% пациентов.
Повторное кровоизлияние из аневризмы является основной причиной высокой летальности и инвалидности.
Риск повторного разрыва аневризмы в течение первых 2 недели заболевания достигает 20%, в течение 1-го месяца – 33% и в течение 6 мес – 50%. Далее риск повторного разрыва аневризм значительно уменьшается и составляет примерно 3% в год.Летальность от повторного разрыва аневризм очень высокая и достигает 40–50%. От первичных разрушений мозга, обусловленных кровоизлиянием, умирает каждый третий больной – 25–35%. Некоторые исследователи полагают, что существуют клинические предшественники разрыва аневризм.
КЛИНИЧЕСКАЯ КАРТИНА
Ведущий симптом разрыва аневризмы — выраженная головная боль, которая быстро распространяется. Одновременно возникают тошнота, многократная рвота. На различное время может утрачиваться сознание. Затем быстро присоединяется менингеальный синдром, могут отмечаться эпилептиформные припадки. В остром периоде возможно повышение температуры, в крови отмечается немного повышенное содержание лейкоцитов, в спинно-мозговой жидкости — примесь крови.
По клиническому течению артериальные аневризмы разделяют на три группы:
•разорвавшиеся (сопровождаются внутричерепным кровоизлиянием)
•неразорвавшиеся (проявляются поражением головного мозга и черепных нервов)
•бессимптомные (обнаруживаются случайно при ангиографии)
В клиническом проявлении разрыва аневризм принципиально выделяют два периода:
•острый (первые 14 дней после разрыва аневризмы)
•холодный – спустя 2 недели от начала заболевания
Выделение двух периодов обусловлено особенностями течения заболевания в течение первых 2 недель – эффектом кровоизлияния (субарахноидальное, паренхиматозное или вентрикулярное) и развитием изменений вследствие кровоизлияния (сосудистый спазм и ишемия мозга, окклюзионная гидроцефалия, дислокационный синдром). В остром периоде наиболее высок риск повторного разрыва аневризмы, что также отягощает течение заболевания.
Спустя 2 недели у части больных наступает регресс патологической реакции на кровоизлияние и состояние пациентов стабилизируется.
Как правило, первым проявлением аневризмы является субарахноидальное кровоизлияние (САК). В остром периоде кровоизлияния нередко возникает психомоторное возбуждение, гипертермия, тахикардия, повышение артериального давления.
Почти у каждого третьего больного с разрывом аневризмы наблюдается атипичная клиническая картина САК. Варианты клинического проявления разрыва аневризм в зависимости от ведущего клинического синдрома:
•мигренеподобный (7%)
•ложновоспалительный (6%)
•ложногипертонический (9%)
•ложнорадикулярный (2%)
•ложнопсихотический (2%)
•ложнотоксический (2%)
Наряду с описанными вариантами течения заболевания клиническе признаки САК могут определяться и локализацией аневризм.
Аневризма внутренней сонной артерии
Аневризмы внутренней сонной артерии подразделяются на следующие группы:
•аневризмы в кавернозном синусе (инфраклиноидные — расположенные ниже клиновидных отростков турецкого седла)
•аневризмы супраклиноидной части артерии
•аневризмы вблизи бифуркации сонной артерии
1. При локализации аневризмы в области устья глазничной артерии головная боль может локализоваться в параорбитальной областии на ипсилатеральной стороне и сопровождаться зрительными нарушениями в виде снижения остроты зрения или (и) выпадения полей зрения.
2. При локализации аневризмы в области устья задней соединительной артерии обычно развивается:
•парез глазодвигательного нерва,
•возможна очаговая полушарная симптоматика в виде контралатерального гемипареза.
•иногда появляются парестезии в области I и II ветвей тригеминального нерва, а также
•иногда признаки поражения IV и VI пар черепно-мозговых нервов.
3. При локализации аневризмы у устья верхней хориоидальной артерии часто наблюдается:
•парез глазодвигательного нерва
•при формировании внутримозговой гематомы может развиться гемипарез или гемиплегия.
4. При разрыве аневризм развилки внутренней сонной артерии:
•головная боль чаще локализуется в ипсилатеральной лобной области
•может развиться контралатеральный гемипарез или гемиплегия
Аневризмы бифуркации сонной артерии нередко вызывают нарушения зрения из-за их расположения в наружном углу хиазмы.
В зависимости от различной локализации аневризмы в пределах кавернозного синуса выделяют три синдрома кавернозного синуса:
•задний — для которого характерно поражение всех ветвей тройничного нерва в сочетании с глазодвигательными нарушениями
•средний — поражение первой и второй ветвей тройничного нерва и глазодвигательные расстройства
•передний синдром — боли и нарушение чувствительности в зоне иннервации I ветви тройничного нерва и паралич III, IV и VI нервов.
Большие и длительно существующие аневризмы сонной артерии в кавернозном синусе могут вызывать деструктивные изменения костей черепа, видимые на рентгенограмме. При разрыве аневризм в кавернозном синусе не бывает кровоизлияния в полость черепа вследствие экстрадурального их расположения.
Аневризма передней мозговой артерии–передней соединительной артерии
Клиническая картина разрыва аневризм этой локализации определяется поражением близлежащих анатомических структур, включая гипоталамус.
Характерными являются психические изменения, которые включают:
•эмоциональную лабильность
•изменения личности
•психомоторное и интеллектуальное снижение
•нарушение памяти
•расстройства концентрации внимания
•акинетический мутизм
•часто наблюдается конфабуляторно-амнестический синдром Корсакова
При разрыве аневризм этой локализации наиболее часто развиваются электролитные нарушения и сахарный диабет. При развитии гемипареза часто он более выражен в ноге.
Аневризма средней мозговой артерии
Кроме признаков САК, которые бывают при разрыве аневризм другой локализации, при разрыве аневризмы СМА наиболее часто развиваются:
•гемипарез (более выраженный в руке) или гемиплегия
•гемигипестезия
•моторная, сенсорная или тотальная афазия при поражении доминантного полушария
•гомонимная гемианопсия
Аневризмы основной артерии
Выделяют верхние и нижние симптомы аневризм основной артерии.
Симптомы аневризм верхнего сегмента основной артерии:
•одно- или двусторонний парез глазодвигательного нерва
•симптом Парино
•вертикальный или ротаторный нистагм
•офтальмоплегия
При разрыве аневризмы основной артерии возможны ишемические нарушения в бассейне задней мозговой артерии в виде гомонимной гемианопсии или корковой слепоты.
Ишемия отдельных структур ствола мозга проявляется соответствующими альтернирующими синдромами.
Классической, но редко встречающейся клинической картиной разрыва аневризмы основной артерии является:
•развитие комы
•нарушение дыхания
•отсутствие реакции на раздражение
•широкие, без фотореакции зрачки
Аневризма позвоночной артерии и ее ветвей
Основные признаками разрыва аневризм этой локализации:
•дисфагия
•дизартрия
•гемиатрофия языка
•нарушение или утрата вибрационной чувствительности
•снижение болевой и температурной чувствительности
•дизэстезия в ногах
При массивном кровоизлиянии развивается кома с нарушением дыхания.
Описанная неврологическая симптоматика, которая развивается при разрывах аневризм той или иной локализации, бывает обусловлена не только эффектом самого субарахноидального или паренхиматозного кровоизлияния, но и ишемическими изменениями в мозговой ткани вследствие сосудистого спазма, тогда клиническая картина заболевания определяется бассейном спазмированных артерий, степенью сужения артерий и особенностями коллатерального кровообращения.
При оценке клинических проявлений необходимо учитывать и сроки заболевания, каждый этап которого характеризуется:
•определенной частотой возникновения
•формой течения осложнений (повторные кровотечения из аневризмы, внутримозговая гематома, кровоизлияние в желудочки, гидроцефалия, спазм артерий и ишемия мозга, электролитные и эндокринные нарушения, кардиоваскулярные и легочные осложнения и др.)
При всем многообразии клинической картины в практике неврологии и нейрохирургии используют классификации тяжести состояния .
Наиболее распространенной из них является классификация, предложенная Hunt – Hess (1968 г.):
I степень тяжсти — Отсутствие выраженной неврологической симптоматики (легкая головная боль, незначительная оболочечная симптоматика).
II степень тяжести — Выраженная головная боль и оболочечная симптоматика без очаговых неврологических симптомов.
III степень тяжести — Поверхностные нарушения сознания (сомнолентность, спутанность) при минимальной очаговой неврологической симптоматике.
IV степень тяжести — Глубокое оглушение, умеренная или выраженная очаговая неврологическая симптоматика.
V степень тяжести — Глубокая кома, децеребрационная симптоматика.
Кроме того, при определении степени угнетения сознания используется и шкала комы Глазго.
Степень тяжести состояния по классификации Hunt – Hess сопоставима с показателями шкалы комы Глазго. Так, I степень тяжести состояния по классификации Hunt – Hess соответствует 15 баллам по шкале комы Глазго, II–III степень тяжести – 14–13 баллам, IV степень тяжести – 12–7 баллам и V степень тяжести – 6–3 баллам.
Всемирной ассоциацией нейрохирургов (WFNS) была предложена универсальная шкала тяжести состояния при САК, которая основана на классификации Hunt – Hess, шкале комы Глазго и наличии или отсутствии двигательных нарушений.
Создание подобной шкалы было обусловлено необходимостью стандартизации данных по изучению результатов обследования, консервативного и оперативного лечения больных с аневризмами, прогноза исхода заболевания и проведения других медицинских программ по проблемам САК.
После выявления у больного САК необходимо вызвать на консультацию нейрохирурга и перевести пациента в специализированный нейрохирургический стационар, в котором имеются:
•нейрохирургическое отделение и специалисты с опытом микрохирургии аневризм;
•отделение лучевой диагностики, оснащенное сериографом для проведения церебральной ангиографии, рентгеновской компьютерной (КТ) и(или) магнитно-резонансной (МРТ) томографии
•операционная, оснащенная оборудованием для хирургии аневризм головного мозга (операционные микроскоп, микрохирургический инструментарий для выполнения операций на аневризмах)
•отделение нейрореанимации
•отделение функциональной диагностики (для проведения электроэнцефалографии – ЭЭГ – и регистрации вызванных потенциалов)
ОБСЛЕДОВАНИЕ в нейрохирургическом стационаре
После поступления больного в специализированный нейрохирургический стационар при наличии клинических признаков САК и подозрении на разрыв аневризмы помимо общеклинического и неврологического исследований проводят :
1) оценку тяжести состояния пациента по шкалам Hunt – Hess
2) КТ головного мозга для определения анатомической формы кровоизлияния по шкале C.Fisher
3) церебральную ангиографию для определения причины кровоизлияния, установления локализации, формы и размеров аневризмы
4) МРТ головного мозга целесообразно проводить спустя 4–7 дней после САК (лучше через 2–3 недели и у больных с множественными аневризмами для определения разорвавшейся, а также для обнаружения признаков давнего кровоизлияния у пациентов поступающих для обследования в отдаленном периоде САК)
5) ЭЭГ с оценкой типа изменений ЭЭГ, имеющих прогностическое значение (появление на ЭЭГ волн тета-, дельта-диапазона при отсутствии альфа-ритма является неблагоприятным и характеризует функциональное поражение ствола мозга чаще вследствие сосудистого спазма и ишемии)
6) транскраниальную допплерографию и определение индекса Линденгаарда (отношение линейной средней скорости кровотока в СМА и во ВСА той же стороны в норме менее 3, при наличии сосудистого спазма равно 3–6 и более)
Рентгеновская КТ
С помощью КТ головного мозга при разрыве аневризм определяют тип кровоизлияния в зависимости от его анатомической формы.
Данные КТ (количество и распространенность излившейся крови) коррелируют с тяжестью состояния и прогнозом заболевания. Так, при I типе кровоизлияния сосудистый спазм обычно не развивается, а при III типе сосудистый спазм вследствие кровоизлияния развивается в 100% и бывает выраженным и распространенным. Соответственно частоте и распространенности спазма возрастает и частота ишемических осложнений: при отсутствии признаков САК ишемические изменения не развиваются, при I типе кровоизлияния ишемические осложнения вследствие спазма развиваются в 25%, при II типе – до 96% и при III типе – не более чем в 40% (табл. 3).
В первые 2 недели после разрыва аневризм с помощью КТ различные изменения удается выявить более чем у 80% больных:
•базальное кровоизлияние – у 74%
•внутримозговые гематомы – у 22%
•внутрижелудочковые кровоизлияния – у 14%
•гидроцефалию – у 22%
•ишемические изменения мозговой ткани – у 64%.
У 20% больных, перенесших разрыв аневризмы, изменений на КТ не определяется.
По характеру кровоизлияния на КТ можно предположить и локализацию аневризмы:
•При аневризмах передней соединительной артерии кровь располагается в межполушарной щели и проекции конечной пластинки, а гематома – в медиобазальных отделах лобной доли.
•При аневризмах ВСА кровоизлияние распространяется в соответствующую опоясывающую цистерну, часто проникая в боковой желудочек, а гематома распространяется на стыке лобной и височной долей.
•Для аневризм СМА характерно наличие крови в латеральной щели, а гематомы – в височной доле.
•При аневризмах развилки базилярной артерии кровь заполняет межножковую цистерну.
•При аневризмах задней нижней мозжечковой артерии распространяется в задней черепной ямке и проникает в IV желудочек.
КТ позволяет выявить аневризму у 39% обследованных больных, которая выглядит как очаг овальной формы повышенной плотности (от +46 до +78 ед. Н). Чем больше аневризма в диаметре, тем легче ее обнаружить при КТ-исследовании.
Дигитальная субтракционная ангиография
Исследование выполняют как можно раньше после госпитализации больного в нейрохирургический стационар. Учитывая высокую частоту множественных аневризм, ангиография должна охватывать два каротидных и два вертебральных бассейна.
Ангиографию выполняют в прямой и боковой проекциях, а при необходимости – в косой и других, атипичных проекциях. На основании ангиографического исследования определяют выраженность и распространенность сосудистого спазма.
Первичная выявляемость аневризм составляет 49–51% от всех случаев нетравматических САК.
При наличии у пациента типичной клинической картины аневризматического САК, ангиографических признаков сосудистого спазма и отсутствии на ангиограммах аневризмы целесообразно через 3–4 нед после кровоизлияния провести повторное ангиографическое исследование, что позволяет выявить ранее не контрастированные аневризмы приблизительно еще у 3% больных. Выполнение третьего ангиографического исследования через 5–6 мес после кровоизлияния позволяет дополнительно верифицировать аневризмы менее чем у 1% больных.
Магнитно-резонансная ангиография
Чувствительность магнитно-резонансной ангиографии (МРА) в определении аневризм головного мозга достигает 74–100%, а специфичность – 76–100% в сравнении с дигитальной субтракционной ангиографией.
С помощью МРА выявляемость аневризм диаметром более 3 мм составляет 86%, что сопоставимо с результатами дигитальной субтракционной ангиографии.
В настоящее время МРА обычно проводят после скрининга пациентов с высоким риском наличия церебрального ангиоспазма и лиц, перенесших САК.
Компьютерно-томографическая ангиография
Чувствительность трехмерной КТ-ангиографии (КТА) при аневризмах не менее 2 мм в диаметре достигает 88–97%, а специфичность – 95–100%. КTА особенно важно проводить в нейрохирургической клинике, это позволяет получать трехмерное изображение и определять взаиморасположение артерий и аневризмы с близлежащими костными структурами, что необходимо для планирования доступа к аневризме.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ больных с разрывами аневризм головного мозга
В большинстве клиник, занимающихся проблемой хирургии аневризм головного мозга, выбор метода лечения – хирургического или эндоваскулярного – чаще определяют на основании оценки тяжести состояния больного, имеющихся неврологических расстройств, количества, локализации и анатомических особенностей аневризмы, а также технических возможностей отделения выполнить ту или иную операцию.
Показания к хирургическому лечению аневризм головного мозга
Риск повторного кровотечение из аневризмы
В первые 2 недели после разрыва аневризмы повторные кровотечения происходят у 15–20% больных. В первые 6 месяцев после разрыва аневризмы повторные кровотечения развиваются у 50% больных с летальностью до 60%. С этого времени риск повторного кровотечения составляет 3% в год с летальностью 2% в год.
Внутрижелудочковое кровоизлияние (ВЖК) и острая гидроцефалия
ВЖК встречаются в 13–28% всех случаев разорвавшихся аневризм в сериях клинических наблюдений. Наличие у пациента дилатации желудочков и их гемотампонада являются наиболее важными прогностическими факторами неблагоприятного исхода.
Внутримозговые гематомы (ВМГ)
ВМГ встречаются в 20–40% и объемом более 30 см3 вызывают эффект компрессии и дислокации мозга, поэтому требуют проведения экстренного вмешательства.
Сосудистый спазм
Сосудистый спазм развивается у всех пациентов с разрывом аневризм, клинически он проявляется симптомами ишемии полушарий и ствола головного мозга у 20–30%, в 17% случаев являясь причиной смерти. Симптомы ишемии развиваются обычно на 6–8-е сутки после САК. Поэтому необходимо стремиться к выполнению операции на аневризме до развития ишемии мозга.
Операции в остром периоде производят при:
1) I–II степени тяжести по Нunt–Hess независимо от анатомической формы кровоизлияния
2) III степени тяжести по Нunt–Hess при систолической скорости кровотока в М1 менее 200 см/с, невыраженном и нераспространенном спазме, по данным ангиографии
3) IV степени тяжести по Нunt–Hess, обусловленной внутримозговой гематомой с развитием дислокационного синдрома или ВЖК и острой гидроцефалией
Объем операции в остром периоде предполагает: клипирование аневризмы, удаление сгустков крови из базальных цистерн, перфорацию конечной пластинки, удаление ВМU (при ее наличии), установку наружного вентрикулярного дренажа при внутрижелудочкового гровоизлияния и острой гидроцефалии.
Операции по поводу разрыва аневризм откладываются до холодного периода при:
1) III–IV степени тяжести по Нunt–Hess при систолической скорости кровотока в М1 более 200 см/с, выраженном и распространенном спазме, по данным ЦА, III–IV типах изменений ЭЭГ
2) V степени тяжести по Нunt–Hess, если тяжесть состояния не определяется внутримозговой гематомой или внутрижелудочковым кровоизлиянием и острой гидроцефалией
Объем операции в холодном периоде предполагает:
•клипирование аневризмы
•наложение вентрикулоперитонеального дренажа при развитии арезорбтивной гидроцефалии
Эндоваскулярное лечение аневризм имеет приоритет при:
1) аневризмах труднодоступной для прямого вмешательства локализации, прежде всего вертебробазилярного бассейна
2) при фузиформных аневризмах
3) у лиц пожилого возраста (старше 75 лет)
Неразорвавшиеся аневризмы
Риск кровоизлияния из неразорвавшейся аневризмы составляет около 1% в год, поэтому при обнаружении неразорвавшейся аневризмы всегда возникает вопрос о целесообразности операции и методе выключения ее из кровотока.
Операция показана при факторах риска разрыва аневризмы:
•гипертонической болезни
•молодом возрасте
•наличии сведений о перенесенном внутричерепном кровоизлиянии среди родственников
•размерах аневризмы более 10 мм в диаметре
Женский пол и курение также относят к факторам риска разрыва аневризмы.
Главное правило при определении показаний к операции при неразорвавшейся аневризме – чтобы риск операции не превышал риска ее разрыва.
Операции на неразорвавшейся аневризме можно производить только в специализированных клиниках, постоянно занимающихся микрохирургией аневризм. Предпочтение эндоваскулярному вмешательству отдается при локализации неразорвавшейся аневризмы в вертебробазилярном бассейне.
2 Комментариев · 61327 683″>
Рейтинг доступен только для пользователей.
Пожалуйста, залогиньтесь или зарегистрируйтесь для голосования.
источник
Церебральные аневризмы являются одной из основных причин нетравматического субарахноидального кровоизлияния (САК). Чаще других носителем церебральных аневризм оказывается средняя мозговая артерия (СМА) [4; 6]. Согласно данным разных исследователей, частота встречаемости аневризм СМА (АСМА) колеблется в диапазоне 18-43% от всех внутричерепных аневризм [13], а по данным аутопсий, достигает 32%.
Важную роль в формировании аневризм играет гемодинамический удар, возникающий при повышении артериального давления [2]. Согласно данным Забродской Ю.М. (1996), большую значимость в патогенезе аневризматической болезни приобретают микроскопические изменения сосудистой стенки – происходит гибель гладкомышечных элементов в области развилки сосуда, а затем фиброз средней оболочки сосуда, при этом изменения располагаются не только в области самой развилки, но также распространяются на устья исходящих из бифуркации сосудов [1], что позволяет объяснить преимущественное расположение аневризм (80-90%) в области развилки основного ствола СМА, а также нередко встречающиеся т.н. фузиформноподобные аневризмы данной локализации, т.е. аневризмы с вовлечением артериальных ветвей в шейку и пришеечную область [6].
У больных с аневризмами СМА более отчётлива зависимость от наследственного фактора, поэтому у их родственников следует ожидать более высокий риск кровоизлияния.
В настоящий момент в лечении больных с аневризмами церебральных сосудов применяют два основных метода: микрохирургический, то есть выделение и наложение металлического клипса на шейку аневризмы, и эндоваскулярный – пункция бедренной артерии, катетеризация аневризмы и внутрисосудистое выключение аневризмы из кровотока. Давно ведется спор между приверженцами обоих методов. Сторонники клипирования указывают на большую радикальность выключения аневризмы из кровотока и возможность выполнения реконструктивного клипирования при сложной геометрии аневризматического мешка; приверженцы эндоваскулярного метода указывают на малую инвазивность процедуры, возможность окклюзии аневризмы у больных, находящихся в тяжелом состоянии (H&H IV –V) и другие факторы.
Аневризмы СМА традиционно считаются более подходящими для открытой операции вследствие анатомических особенностей (сравнительно поверхностная топография СМА, благоприятная для внутричерепного доступа, отсутствие выраженных коллатералей, повышающее эффективность временного клипирования), а также частой неблагоприятной геометрии аневризм данной локализации: широкая шейка, вовлечение в состав мешка аневризмы одного или более М2 сегментов. Эти обстоятельства препятствуют тотальной эмболизации и обусловливают высокий риск ишемических осложнений [7]. По мнению Rodriguez-Hernandez A. (2013), J.M.C. Van Dijk (2011) и многих др. исследователей, микрохирургическое вмешательство продолжает оставаться операцией выбора и на современном этапе [5; 14].
Следует отметить, что некоторая неудовлетворённость в достижении радикальной внутрисосудистой окклюзии аневризм СМА имела место на этапе развития и отработки методики эмболизации спиралями. C 2003 года стали доступны интракраниальные саморасширяющиеся стенты, которые открывали новые возможности для более эффективного и безопасного лечения «сложных» церебральных аневризм, однако предпочтение отдавалось другим локализациям. Напротив, в последних публикациях возрастает интерес к использованию стент-ассистенции в лечении аневризм СМА. Согласно данным разных авторов применение стентов позволяет добиться радикальности, сопоставимой с микрохирургическим клипированием, при этом укорачивается послеоперационный период и уменьшаются сроки пребывания пациента в стационаре [11]. Стент-ассистенция все чаще применяется в геморрагическом периоде (JohnsonA.K. et al., 2013), однако данная методика имеет ряд ограничений в связи с необходимостью применения двойной дезагрегантной терапии, которая повышает риск развития осложнений [8].
Таким образом, представленные литературные данные указывают, что в повышении эффективности лечения АСМА стоят задачи, общие для всех аневризм, однако на их решение существенно влияет и данная локализация. Относительно поверхностное расположение СМА, слабый коллатеральный кровоток, всё же не устраняют недостатки открытого оперативного вмешательства. «Фузиформноподобный» характер и другие морфологические особенности затрудняют радикальную эмболизацию АСМА, однако использование наиболее современного внутрисосудистого инструментария, ассистирующих методик могло бы повысить радикальность малоинвазивной внутрисосудистой операции и способствовать лучшему функциональному результату.
Материал и методы. В настоящее исследование были включены 163 больных с 210 аневризмами, из них 174 аневризмы средней мозговой артерии, оперированных в ФГБУ «Российский научно-исследовательский нейрохирургический институт им. проф. А.Л. Поленова» с января 2010 по март 2014 г. включительно. Средний возраст больных составил 48,8±0,9 года, соотношение мужчин и женщин – 1:2. Заболевание проявило себя кровоизлиянием у 90 (55,2%) пациентов, другими неврологическими симптомами – у 24 (14,8%). С множественными аневризмами было 38 (23,3%) пациентов. Из них у 31 выявлено 2 аневризмы, у 5 — 3; 4 аневризмы встретились в 2 случаях. У 8 пациентов аневризмы располагались на СМА с одной стороны, зеркальные аневризмы СМА были у 3 пациентов, сочетание аневризмы СМА с аневризмой другой локализации у 27 пациентов.
На основании дооперационной ангиографической картины, анализа геометрии аневризм мы разделили их на мешотчатые, фузиформные (веретенообразные) и «фузиформноподобные» аневризмы (рис. 1).
Рис. 1. Виды аневризм: А — мешотчатая, Б — фузиформная, В — фузиформноподобная
К фузиформноподобным мы отнесли те случаи, когда ветви СМА были вовлечены в структуру шейки или отходили непосредственно от мешка аневризмы, что снижало радикальность операции и повышало риски развития как интра-, так и послеоперационных осложнений (рис. 2).
Рис. 2. Распределение аневризм по типу строения
В геморрагическом периоде оперировано 11 (6,7%) больных, в постгеморрагическом – 152 (93,3%). Поздние операции были обусловлены, вероятно, несвоевременным направлением больных в клинику института.
Для проведения сравнительного анализа все пациенты были разделены на две группы: в первую группу вошли пациенты, перенесшие микрохирургическое вмешательство – 71 пациент, во вторую – эндоваскулярное – 92 пациента. Эмболизация аневризм осуществлялась при помощи отделяемых микроспиралей, а в ряде случаев с помощью ассистирующих и потокперенаправляющих стентов. По степени радикальности выделяли тотально-субтотальную эмболизацию – 95-100%, частичную — 90%) микро-, небольших и больших аневризм достигали чаще, чем гигантских (р=0,02), тогда как попытка клипирования или окутывание аневризмы мышцей (радикальность=0) встречалась чаще при гигантском размере аневризмы. Достоверной зависимости степени радикальности от возраста больного, типа строения аневризмы выявлено не было.
Интраоперационные геморрагические осложнения имели место у 2 (2,8%) больных. Осложнения протекали бессимптомно, неврологическая симптоматика в послеоперационном периоде не наросла, оба больных выписаны с хорошим (OGS V) результатом. Ишемических осложнений отмечено не было. Ретракционная травма была заподозрена, по данным КТ, у 10 (14%) больных. Убедительных неврологических проявлений ретракционной травмы в наших наблюдениях отмечено не было. Послеоперационные эпи- и субдуральные гематомы были выявлены у 2 (2,8%) больных в результате контрольного КТ-исследования. Оба больных были реоперированы, в одном случае пациент умер (OGS I), во втором в последующем произошел частичный регресс неврологической симптоматики (OGS III). Послеоперационные менингиты выявлены у 2 (3%) больных. Послеоперационная летальность в группе составила 1,4%.
Внутрисосудистым методом были оперированы 92 пациента, которым было выполнено 96 внутрисосудистых операций. Хороший исход лечения (OGS 5–4) к моменту выписки имели 79,3% больных. Удовлетворительный (OGS 3) результат лечения был достигнут у 11% больных. Неудовлетворительный результат (OGS1–2) отмечен у 9,7% больных с летальностью 5,4% (рис. 4).
Рис. 4. Функциональный исход внутрисосудистых операций
Нами была выявлена определённая зависимость между функциональным исходом лечения и типом строения мешка аневризм. Неудовлетворительный функциональный исход встречался достоверно чаще после операций на аневризмах с фузиформноподобным типом строения — частота неблагоприятных исходов (OGS I-II) (21%) была выше, чем при операциях на мешотчатых и фузиформных аневризмах (p 90% оказался сопоставим для групп микрохирургического и эндоваскулярного вмешательства (86,7% и 84,2% соответственно)
Отдаленные результаты отслеживались у больных в сроки 6-12 месяцев при помощи селективной церебральной ангиографии. Катамнез был отслежен у 69 пациентов (42,3%), из которых 27 пациентов перенесли микрохирургическое вмешательство, 42 — эндоваскулярное. Особое внимание уделялось реканализации и/или росту аневризмы. Так, из 27 пациентов, перенесших микрохирургическую операцию, у 25 (92,6%) реканализации и роста отмечено не было, в двух случаях (7,4%) был отмечен рост аневризмы. Среди пациентов, перенесших внутрисосудистую операцию, реканализация аневризмы была отмечена у 2 пациентов (4,8%), тогда как дальнейший рост аневризмы был выявлен у 5 пациентов (11,9%). Нами была выявлена зависимость частоты роста или реканализации аневризмы от типа строения аневризматического мешка. Так, наиболее часто реканализация и/или рост аневризмы отмечались у пациентов с т.н. фузиформноподобным типом строения аневризмы (55,5%).
Повторные операции по поводу роста и/или реканализации были выполнены 4 (5,9%) пациентам, из них повторная эмболизация микроспиралями была выполнена в 1 случае (25%), в трех случаях (75%) использована реконструкция области развилки СМА с помощью ассистирующих стентов с последующей тотальной эмболизацией заполняющейся части микроспиралями с хорошим функциональным исходом.
Обсуждение. Согласно данным Kim B.M. (2010), расположение устьев ветвей основного ствола СМА в области шейки имеет место у 40,5%, т.е. практически у половины пациентов аневризмы СМА имеют т.н. фузиформноподобное строение, что усложняет операцию и повышает риски развития осложнений, однако хороший клинический результат (OGS 4–5) после внутрисосудистых операций на СМА удается получить у 74-92,5% больных, что сопоставимо с соответствующим показателем для микрохирургических операций (69–95%) [9; 10; 12; 15]. Согласно данным Brinjikji W. с соавт (2011), у больных, оперированных микрохирургически по поводу аневризм СМА, была отмечена более высокая смертность в сравнении с пациентами, прооперированными внутрисосудистым методом [3]. В нашей серии частота неблагоприятных исходов после эндоваскулярных вмешательств превышала таковую для прямого клипирования аневризмы, что мы объясняем относительно частым фузиформноподобным строением аневризм СМА, т.к. это препятствует адекватному расположению микроспиралей в аневризме и повышает риски развития осложнений. Радикальность для микрохирургической и внутрисосудистой операции была сопоставима и соответствовала данным ведущих исследователей [8].
Применение стентов позволило нам значительно повысить радикальность лечения наиболее сложных аневризм (100%), при этом хороший функциональный исход в эндоваскулярной группе удалось получить у 79,3% пациентов, что было сопоставимо с исходами в микрохирургической группе и данными литературы [3].
1. Селективное применение внутрисосудистой и внутричерепной операции повышает эффективность лечения больных с аневризмами средней мозговой артерии; применение эндоваскулярных операций после ранее проведенного внутрисосудистого или микрохирургического вмешательства повышает радикальность, не ухудшая функциональный результат.
2. Микрохирургическая операция может выполняться на большинстве аневризм СМА, не ухудшая функциональный исход и имея высокую радикальность в отдаленном периоде.
3. Селективный отбор больных на эмболизацию или микрохирургическое клипирование полностью не предупреждает развитие интра- и послеоперационных осложнений, при этом повышая радикальность. При внутрисосудистых вмешательствах преобладают тромбозы и тромбоэмболические осложнения, при внутричерепных операциях – геморрагические и инфекционные осложнения.
4. Фузиформноподобное строение аневризмы, т.е. вовлечение артериальных ветвей в шейку аневризмы, препятствует радикальности, а также повышает риск интра- и постоперационных осложнений.
5. Применение стент-ассистенции позволяет повысить эффективность лечения у больных с фузиформноподобными аневризмами средней мозговой артерии.
источник
Артериальная аневризма головного мозга — ограниченное или диффузное расширение просвета артерии или выпячивание её стенки. Типичная мешотчатая аневризма обычно бывает небольшого размера (до 1 см в диаметре). В ней можно довольно чётко выделить шейку, тело и дно (рис. 19-10). Аневризмы могут достигать гигантских размеров (>2,5 см в диаметре) . Гигантские аневризмы обычно не имеют шейки, в их стенке отмечают отложения солей кальция, а полость аневризмы в большинстве случаев частично тромбирована (рис. 19-11).
Основное клиническое проявление аневризм — внутричерепные кровоизлияния вследствие разрыва стенки аневризмы. Кровоизлияния имеют тенденцию к рецидивированию и в 60-70% случаев приводят к смерти больного в течение года после первого проявления болезни.
Частота клинически проявившихся аневризм составляет приблизительно 10-15 случаев на 100 000 человек в год. Наиболее часто заболевание проявляется в возрасте 30-50 лет (около 60%) . Дети составляют около 3% больных, а люди пожилого возраста — около 8%. В последние годы неуклонно увеличивается количество больных с аневризмами, не проявившимися клинически и выявленными при обследовании по поводу какого-либо другого заболевания » случайные» , «инсидентальные » аневризмы).
Рис. 19-10 . Виды артериальных аневризм: а — мешотчатая; б — фузиформная.
Рис. 19-11 . Гигантская аневризма супраклиноидного отдела правой внутренней сонной артерии (субтракционная дигитальная ангиография, 3D-реконструкция, прямая (а) и боковая (б) проекции).
Аневризмы Классифицируют по этиологии, размеру и расположению. В подавляющем Большинствеe случаев аневризмы формируются в области деления и анастомозирования крупных артерий на основании мозга (рис. 19-12). Наиболее часто выявляют аневризмы передней мозговой и передней соединительной артерии (37-47%), затем следуют аневризмы супраклиноидного отдела внутренней сонной (28-36%) и аневризмы средней мозговой артерии (17-22%). Аневризмы артерий вертебробазиля:рной системы составляют приблизительно 5-15% . Множественные аневризмы обваруживают в 20-30% случаев.
Аневризмы могут проявляться спонтанными внутричерепными кровоизлияниями (наиболее частая форма), а также симптомами. типичными для объёмного процесса (псевдотуморозная форма). Последняя, как правило, характерна для крупных и гигантских аневризм и по клиническому течению напоминает доброкачественные базальные опухоли, разрыв аневризмы практически всегда сопровождается субарахноидальным кровоизлиянием. У 20-40% больных наряду с субарахноидальным происходит кровоизлияние в мозг с формированием внутримозговых гематом различного объёма (субарахноидально-парехиматозное кровоизлияние) (рис. 19- 13).
В редких случаях геморрагия может быть только паренхиматозной. В 15-25% случаев субарахноидальное кровоизлияние сопровождается прорывом крови в желудочковую систему (субарахноидальновентрикулярное кровоизлияние).
Рис. 19-12 . Типичная локализация аневризм.
Рис. 19-13. Массивное субарахноидально-вентрикулярно-паренхиматозное кровоизлияние (компьютерная томограмма)
Клиническая картина субарахноидального кровоизлияния, в том числе вследствие разрыва артериальной аневризмы, описана в соответствующем разделе главы «Сосудистые заболевания головного мозга» . Помимо симптомов, общих для субарахноидального кровоизлияния различной этиологии, разрыв аневризмы может сопровождаться поражением ЧН и симптомами очагового поражения мозга.
Для аневризм супраклиноидного отдела внутренней сонной артерии типично изолированное поражение глазодвигательного нерва. Этот симптом может также развиться при аневризмах развилки основной артерии. Кровоизлияния из аневризм внутренней сонной и передней соединительной артерии около зрительных нервов и хиазмы могут сопровождаться снижением зрения. При прорыве крови в желудочковую систему кровоизлияния протекают тяжело, сопровождаются длительным угнетением сознания, горметонией, стволовыми симптомами.
Диагностика аневризм зависит прежде всего от правильной и своевременной диагностики субарахноидального кровоизлияния (см. раздел «Субарахноидальное кровоизлияние» в главе «Сосудистые заболевания головного мозга»), основанной на результатах люмбальной пункции, КТ или МРТ. Факт субарахноидального кровоизлияния обосновывает показания к церебральной ангиографии с целью выявить источник кровотечения. В настоящее время существуют инвазивные (прямая селективная ангиография) и неинвазивные (МРТ-ангиография и КТ-ангиография) методы исследования церебральных сосудов. Точность неинвазивных методов постоянно возрастает, и они постепенно становятся главными в диагностике сосудистой патологии.
Помимо диагностики аневризмы, большое значение в остром периоде болезни имеет оценка выраженности сопутствующего субарахноидальному кровоизлиянию артериального спазма. Ангиоспазм хорошо виден при прямом ангиографическом исследовании (рис. 19-14) , однако это однократное исследование, не позволяющее контролировать динамику ангиоспазма.
Рис. 19-14. ангиоспазм (дигитальная субтракционная ангиография; стрелками указаны спазм супраклиноидного отдела внутренней сонной артерии, отрезков д1 передней и М 1 средней мозговой артерии).
Общепризнанный метод динамического неинвазивного контроля ангиоспазма — ТКДГ. Основным параметром исследования служит линейная скорость кровотока (систолическая, диастолическая, средняя) в различных участках магистральных артерий мозга, измеряемая в СМ/С (рис. 19-15).
Рис. 19-15. Диагностика ангиоспазма при ТКДГ: систолическая скорость кровотока в отрезке МI средней мозговой артерии составляет 150 см/с.
С помощью этого метода начальные признаки ангиоспазма у больных с первичным кровоизлиянием регистрируют на 2-е-3-и сут после субарахноидального кровоизлияния, к 8- 12-м сут они достигают максимального развития, а с 10-14-х сут — постепенно регрессируют. Наиболее быстрый рост скорости кровотока регистрируют на 4-6-е сут. У больных с симптоматическим спазмом быстрый рост скорости кровотока отмечают за 2-3 сут до развития очаговой симптоматики.
Хирургическое вмешательство — единственный эффективный метод лечения артериальных аневризм головного мозга.
Цель операции — выключение аневризмы и з кровотока для предотвращения повторных кровоизлияний.
В настоящее время существуют прямые и эндовазальные методы выключения аневризмы.
Выбор способа операции зависит от ряда условий: размеров и анатомических особенностей аневризмы, состояния коллатерального кровотока, периода, прошедшего после кровоизлияния, состояния больного и др. Несмотря на то что эндоваскулярный метод постоянно совершенствуется и его результаты улучшаются, наиболее надёжным методом выключения аневризмы до настоящего времени остаётся прямое хирургическое вмешательство.
Метод выбора при прямых хирургических вмешательствах — клипирование аневризмы.
Клипирование аневризмы — операция. в ходе которой аневризму выключают из кровотока. накладывая на её шейку или тело одну или нескольких специально изготовленных клипс.
Другие варианты прямых операций (треппинг, укрепление стенок аневризмы хирургической марлей, выключение несущей артерии) выполняют, если невозможно клипировать аневризму.
В холодном периоде после кровоизлияния из аневризмы операцию следует выполнять безотлагательно по завершении необходимых обследований. противопоказаниями к операции могут быть только тяжёлые соматические заболевания или состояния.
В остром периоде показания к операции зависят от различных факторов. Основными считают состояние пациента. выраженность спазма сосудов мозга и массивность кровоизлияния.
Для оценки клинического состояния больного с разорвавшейся аневризмой в настоящее время наиболее широко используют шкалу Hunt и Hess (1968) и шкалу Всемирной федерации нейрохирургических обществ (WFNS SAH Scale. 1988) (табл. 19-1. 19-2).
Таблица 1 9 — 1 . Классификация Hunt и Hess ( 1 968)
| Стадия | Описание |
| I | Нет симптоматики или лёгкая головная боль, лёгкие менингеальные симптомы |
| II | Головная боль от умеренной до сильной, выраженные менингеальные симптомы. Нет очаговых симптомов, за исключением поражения ЧН ( III пара) |
| III | Вялость, сонливость или лёгкая очаговая симптоматика |
| IV | Глубокое оглушение, умеренный или выраженный гемипарез, начальные признаки децере· брации, вегетативные нарушения |
| V | Децеребрационная ригидность, кома |
Примечание: серьёзные системные заболевания и/или ангиоспазм, видимый на ангиограммах, больного переводят в следующую стадию.
Таблица 19-2. Шкала WFNS SAH Scale ( 1988)
| Стадия | GCS score* | Двигательный/речевой дефицит |
| I | 15 | Нет |
| II | 14-13 | Нет |
| III | 14-13 | Есть |
| IV | 12-7 | Есть или нет |
| V | 6-3 | Есть или нет |
*GCS score — количество баллов по шкале комы Глазго.
Эти шкалы имеют довольно тесную корреляцию.
В настоящее время приняты следующие критерии отбора больных на операцию в острой стадии разрыва аневризмы.
• В I-П стадии по Нuпt и Hess операция показана независимо от срока, прошедшего после кровоизлияния.
• В ПI-IV стадии по Нuпt и Hess основным критерием в определении показаний к операции становится показатель динамики ангиоспазма: больных с умеренным или регрессирующим спазмом можно оперировать с весьма благоприятным исходом. Целесообразно воздержаться от операции больных в
IV стадии с признаками нарастающего или выраженного ангиоспазма, так как риск жизненно опасных осложнений у них выше, чем риск повторного кровоизлияния.
Наиболее сложно определение показаний к операции у больных III стадии при наличии признаков нарастающего или выраженного ангиоспазма.
Активная хирургическая тактика у этих больных представляется более целесообразной, но вопрос о показаниях к операции следует решать с учётом всех факторов в каждом конкретном случае.
• В V стадии по Нuпt и Hess хирургическое вмешательство показано только больным с большими внутримозговыми гематомами, вызывающими дислокацию мозга. Операцию проводят по жизненным показаниям, и можно ограничиться только удалением гематомы.
При массивном внутрижелудочковом кровотечении показано наложение наружного вентрикулярного дренажа.
При крупных и гигантских аневризмах с псевдотуморозным течением показания к операции зависят от клинической картины заболевания, локализации и анатомических особенностей аневризмы. Определённое значение имеют также возраст больного и наличие сопутствующих соматических заболеваний.
При случайных аневризмах до настоящего времени нет чёткого мнения об обоснованности хирургических вмешательств. Считают, что необходимо оперировать больных с аневризмами размером более 7 мм. Показания к операции становятся более определёнными при увеличении аневризмы по мере наблюдения и при семейной предрасположенности к кровоизлиянию (случаи кровоизлияния из аневризмы у близких родственников).
Принципы консервативного лечения больных с артериальными аневризмами в предоперационном периоде
В холодном периоде заболевания специальной терапии перед операцией не требуется.
В остром периоде кровоизлияния перед операцией необходимы строгий постельный режим, контроль АД, электролитного состава крови, ежедневная ТКДГ. Медикаментозное лечение заключается в применении седативных, аналгезирующих препаратов, при необходимости — гипотензивной и мягкой диуретической терапии. Назначать антифибринолитики не рекомендуется, так как они не предотвращают повторного кровоизлияния, но усугубляют ишемию мозга и способствуют развитию арезорбтивной гидроцефалии. Лечение больных в III -V стадии по Нuпt и Hess нужно проводить в палатах интенсивной терапии или в условиях реанимационного отделения. Необходимы катетеризация центральной вены, мониторинг АД (систолическое давление должно быть не выше 1 20-150 мм рт.ст.), сердечного ритма, водно-электролитного баланса, осмолярности крови, оксигенации крови со своевременной коррекцией возникающих нарушений. При неадекватном дыхании пациента следует перевести на ИБЛ. В ряде клиник больным в тяжёлом состоянии про изводят установку вентрикулярного или субдурального датчика для контроля внутричерепного давления и адекватного про ведения дегидратационной терапии (маннитол) . Для предотвращения ангиоспазма назначают блокаторы кальциевых каналов (нимодипин) в виде непрерывной инфузии или таблеток. Препараты более эффективны, если применять их начали до развития спазма сосудов. При уже развившемся спазме блокаторы кальциевых каналов не устраняют его, тем не менее исход заболевания несколько лучше, что может быть связано с их нейропротективным эффектом. При назначении блокаторов кальция следует учитывать, что они могут приводить К существенному снижению АД, особенно при внутривенном введении.
Прямые хирургические вмешательства по поводу аневризм проводят в условиях общей анестезии.
При оценке больного перед операцией особое внимание следует обращать на состояние водно-электролитного обмена, уровень и стабильность АД объём циркулирующей крови, гипертермию, уровень внутричерепного давления и наличие спазма базальных артерий мозга.
Гиповолемию в острой стадии субарахноидального кровоизлияния отмечают почти в 50% наблюдений, наиболее часто — у больных в IV -V стадии по шкале Hunt и Hess. Уменьшение объёма циркулирующей крови способствует развитию или усугублению ишемии мозга. Восполнение объёма циркулирующей крови проводят кристаллоидными и коллоидными растворами. Критерии приемлемого объёма циркулирующей крови — центральное венозное давление не менее 6-7 см и гематокрит 30%.
У 50-100% больных в острой стадии разрыва аневризмы обнаруживают изменения на ЭКГ (чаще всего отрицательный зубец T и депрессия сегмента ST . Это следствие выброса катехоламинов в остром периоде субарахноидального кровоизлияния. Изменения на ЭКГ не сопряжены с повышением риска интраоперационных осложнений, их не считают поводом к отмене операции.
Артериальная гипертензия — показание к медикаментозной коррекции при АД выше 150- 160 мм рт. ст., так как высокое АД может провоцировать повторное кровоизлияние из аневризмы. Снижать АД следует в ограниченных пределах, так как резкое снижение может усугубить церебральную ишемию, особенно в условиях внутричерепной гипертензии и ангиоспазма. Гипотензивную терапию можно начинать только при нормализации объёма циркулирующей крови. Следует избегать применения диуретиков и препаратов длительного действия.
Из распространённых в России методик анестезии наиболее оптимальным для операций при артериальных аневризмах считают сочетание пропофола и фентанила.
Возможно также про ведение операции в условиях нейролептаналгезии.
Основные задачи анестезиолога в ходе операции таковы.
• Контроль и необходимая коррекция АД — предупреждение его подъёма в момент интубации, временное снижение, если необходимо, при выделении аневризмы или возникшем кровотечении.
• Создание благоприятных условий для проведения операции (обеспечение релаксации мозга в доступных пределах) .
• Защита мозга от ишемии, особенно в тех случаях, когда приходится прибегать к временному клипированию артерий или управляемой артериальной гипотензии.
Обязательное условие выполнения этих задач — мониторинг основных функций организма и состояния головного мозга: пульс-оксиметрия, ЭКГ в 3 отведениях, неинвазивное и инвазивное измерение АД капнография, почасовая регистрация диуреза, измерение центральной температуры тела.
Для предотвращения резкого подъёма АД при ларингоскопии и интубации трахеи после выключения сознания и за 3 мин до интубации вводят высокие дозы опиоидов (например, фентанил 5-10 мкг/кг) либо применяют меньшую дозу фентанила (4 мкг/кг) в сочетании с инфузией нитроглицерина (это сочетание можно использовать только при отсутствии внутричерепной гипертензии).
ДЛЯ обеспечения адекватной перфузии мозга АД поддерживают на верхней границе нормы. Если АД исходно повышено до умеренно высоких значений (систолическое АД 150-160 мм рт.ст.), то снижать его не следует. В ходе операции может возникнуть необходимость резко снизить или повысить АД. Для снижения АД применяют нитропруссид натрия или нитроглицерин в виде внутривенной инфузии, а также прибегают к болюсному введению анестетиков короткого действия (например, пропофола).
Чаще всего управляемая артериальная гипотензия показана при интраоперационном разрыве аневризмы, когда может возникнуть необходимость в кратковременном снижении среднего АД дО 50 мм рт.ст. И даже ниже. Для повышения АД применяют фенилэфрин, эфедрин и допамин. Эти пре· параты используют также для усиления коллатерального кровотока при времен· ном клипировании сосудов (в последнем случае систолическое АД увеличивают на 20-25 мм рт.ст.).
Для уменьшения ретракционной травмы и обеспечения доступа к аневризме в условиях отёка мозга и внутричерепной гипертензии необходимо обеспечить релаксацию мозга. Этого достигают путём дренирования ликвора и введения маннитола. Во время люмбальной пункции и установки дренажа нельзя допускать одномоментное выведение большого объёма ликвора, так как это может спрово· цировать снижение внутричерепного давления и разрыв аневризмы. Установка люмбального дренажа противопоказана при внутримозговой гематоме большого объёма. Дренаж не открывают до вскрытия твёрдой мозговой оболочки. Для снижения внутричерепного давления можно использовать 20% раствор манни· тола в дозе 0,5-2 г/кг, его вводят в течение 30 мин за 1 ч до вскрытия твёрдой мозговой оболочки, чтобы не вызывать значительных колебаний внутричереп· ного давления. Применение маннитола противопоказано при осмолярности выше 320 мосмоль/л.
Методы интраоперационной защиты мозга от ишемии включают умеренную гипотермию (33,5-34 0 С), применение барбитуратов, поддержание АД на верхней границе нормы и повышение его на 20-30 мм рт.ст. сверх исходного в момент временного клипирования артерии, несущей аневризму.
По окончании операции больного быстро пробуждают. Пациентов с исходно тяжёлым состоянием (IV-V стадия по Hunt и Hess), а также с осложнениями в ходе операции оставляют на ИВЛ и переводят в отделение интенсивной терапии.
Достуnы при аневризмах передних отделов вuллизиева круга
Наибольшее распространение получил птериональный доступ, применительно к аневризмам тщательно разработанный М. Yasargil. При доступе, как правило, широко раскрывают сильвиеву щель, что значительно уменьшает необходимость тракции мозга.
Для доступа к аневризмам передней соединительной артерии были предложены бифронтальный доступ О. Pool) и передний межгемисферный подход О. Suzuki).
При аневризмах каротидно-офтальмического сегмента птериональный доступ дополняют резекцией костных структур основания черепа — переднего наклонённого отростка и крыши канала зрительного нерва. В части случаев возникают показания к орбитозигоматическому доступу.
Достуnы при аневризмах задних отделов вuллизиева круга и вертебробазuлярной системы
Для подхода к аневризмам задних отделов виллизиева круга и верхней трети базилярной артерии наряду с птериональным используют подвисочный доступ с рассечением тенториального намёта, описанный С h . Drake в 1961 г.
При аневризмах средней и проксимальной третей базилярной артерии используют передний и задний транспирамидные доступы с экстрадуральной резекцией соответствующих участков пирамиды височной кости.
Аневризмы вертебральных артерий и их ветви обнажают посредством парамедианного или так называемого крайнего латерального (jar lateral) доступа.
Для успешного выключения аневризмы необходимо выполнение следующих важных условий.
- Выделение на протяжении артерии, на которой расположена аневризма. Это позволяет при необходимости временно прекратить кровоток в ней путём наложения съёмных клипс.
- Выделение аневризмы следует начинать с её пришеечной части, где стенка аневризмы прочнее. В большинстве случаев этого бывает достаточно, чтобы выключить аневризму с помощью клипсы, наложенной на её шейку.
- При препаровке аневризм окружающие сращения необходимо рассекать острым путём, чтобы предупредить тракцию и разрыв аневризмы.
- При выделении аневризм, погружённых в мозговое вещество (аневризмы передней соединительной и средней мозговой артерии), целесообразно резецировать прилежащее к аневризме мозговое вещество, сохранив на ней пиальную оболочку, — это способствует предупреждению разрыва аневризмы.
- При выделении аневризм с широкой шейкой или при сложной конфигурации, чтобы уменьшить риск разрыва, целесообразно прибегнуть к временному клипированию несущей артерии.
В ходе операций на аневризм ах можно применить временное клипирование сосудов. Это наиболее эффективная мера предупреждения разрыва аневризмы на разных этапах её выделения и при остановке кровотечения из разорвавшейся аневризмы. Для временного клипирования при меняют специальные мягкие пружинные клипсы, практически не повреждающие стенку артерии, при необходимости их можно накладывать на неё многократно (рис. 19-16).
Рис. 19-16 . Этапы клипирования аневризмы с использованием временного клипирования: а — временная клипса на внутренней сонной артерии; б — тоннельная клипса на шейке аневризмы, временная клипса на внутренней сонной артерии; в — временная клипса снята.
Применение этого метода возможно только при мониторинге функционального состояния мозга с помощью регистрации электрической активности. При появлении признаков ишемии в зоне, кровоснабжаемой клипированным сосудом, временную клипсу необходимо снять и восстановить кровоток по сосуду. Длительность допустимого выключения кровотока зависит от состояния коллатерального кровотока. Безопасным считают выключение артерии на срок не более 5 мин.
Для клипирования аневризмы предложено большое количество клипс и инструментов для их наложения (клипсодержателей): клипсы Язергиля, Судзуки, Дрейка и пр. (рис. 19-17).
Рис. 19-17 . Хирургические инструменты, применяемые для клипирования аневризм: а — пистолетный клипсодержатель; б — клипсы ДЛЯ временного клипирования несущих сосудов; в — постоянные «туннельные» клипсы; г — постоянные клипсы различной конфигурации; д — постоянные микроклипсы; е — пинцетный клипсодержатель.
В основном это пружинные клипсы, сделанные из ненамагничивающихся металлов, что позволяет использовать МРТ в послеоперационном периоде. Клипсы различаются размерами, степенью кривизны, усилием сжатия. В каждом конкретном случае подбирают наиболее подходящую для выключения аневризмы клипсу.
Оптимальным считают выключение аневризмы с помощью клипсы, наложенной на шейку непосредственно у несущей артерии.
При аневризмах с широкой шейкой иногда приходится использовать несколько клипс (рис. 19-18).
Рис. 19-18. Три клипсы (указаны стрелками) на теле и шейке крупной аневризмы внутренней сонной артерии.
Размеры шейки можно уменьшить с помощью биполярной коагуляции. в отдельных случаях прекратить кровоток в аневризме можно наложением клипсы на её тело.
После клипирования аневризмы целесообразно пропунктировать её стенку и аспирировать кровь из её полости. При спавшейся аневризме легче оценить эффективность клипирования и убедиться в том, что при этом были сохранены все прилежащие к аневризме сосуды. При необходимости положение клипсы можно изменить.
При тромбировании полости аневризмы невозможно осуществить эффективное клипирование до удаления тромбов. Чтобы достичь этого, временно выключают кровоток в несущей артерии, накладывая на неё клипсы проксимальнее и дистальнее аневризмы. Полость аневризмы вскрывают, извлекают тромб и про изводят клипирование спавшейся аневризмы.
Некоторые аневризмы, например аневризмы, представляющие собой диффуз’ ное расширение артерии, не удаётся выключить из кровообращения путём кли’ пирования. В этих случаях для предупреждения их разрыва можно использовать следующие методы .
- Укрепление стенок аневризмы. Обычно с этой целью используют кусочек хирургической марли, в которую заворачивают аневризму. Марля провоци’ рует развитие вокруг аневризмы прочной соединительнотканной капсулы. Серьёзный недостаток этого метода — реальная опасность кровотечения из аневризмы в течение первых послеоперационных дней .
- Выключение несущей аневризму артерии. Прекращения кровотока в сосуде можно достичь путём проксимального клипирования артерии или клипирования её по обе стороны от аневризмы (операция «ловушки» — треппинг) . Такие операции можно выполнять только при условии развитого коллатерального кровотока, обеспечивающего полноценную перфузию мозга в зоне васкуляризации выключенной артерии.
Иногда, чтобы улучшить условия коллатерального кровообращения, делают дополнительные операции — создают анастомозы между сосудами мозга (ветви средней мозговой артерии) и ветвями наружной сонной артерии. Современная микрохирургическая техника позволяет также создавать анастомозы между моз· говыми сосудами, например между передними мозговыми артериями.
При аневризмах сонной артерии и её ветвей лучшим признан птериональный доступ.
Наиболее часто обнаруживают аневризмы внутренней сонной артерии в месте отхождения задней соединительной артерии. Они в большинстве случаев имеют выраженную шейку, что упрощает их выключение. При наложении клипсы особое внимание необходимо обратить на то, чтобы вместе с аневризмой не выключить расположенную рядом переднюю ворсинчатую артерию.
Определённые трудности представляет выключение аневризм сонной артерии в месте отхождения глазничной артерии, поскольку они могут быть при крыты распластанным на аневризме зрительным нервом. В этих случаях для лучшего обнажения артерии и аневризмы целесообразно про извести резекцию переднего наклонённого отростка и резецировать стенки канала зрительного нерва.
При аневризмах средней мозговой артерии, чаще расположенных в месте деления артерии на основные ветви, операцию, как правило, начинают с препаровки начальных отделов сильвиевой щели и последовательного выделения сначала сонной, затем начальных отделов средней мозговой артерии.
Такая последовательность важна, поскольку она позволяет при разрыве аневризмы прибегнуть к временному клипированию приводящей артерии. Разрывы аневризм средней мозговой артерии часто сопровождаются формированием внутримозговых гематом. Опорожнение гематомы может способствовать обнаружению и выключению аневризмы.
Аневризмы передней соединительной артерии отличаются большим разнообразием вариантов в зависимости от отношения аневризмы к передней соединительной артерии, симметричности развития передних отделов виллизиева круга, направленности аневризмы.
Для планирования доступа (в том числе и его стороны) крайне важно изучить все эти детали с использованием возможностей как классической ангиографии, так и МРТ-, КТ-ангиографии. При клипировании аневризмы нужно обращать особое внимание на сохранность возвратной артерии Гюбнера.
Аневризмы перикаллёзных артерий относят к группе сравнительно редко встречающихся аневризм. Их особенность — частота формирования внутримозговых гематом и в сравнении с аневризмами другой локализации — редкое развитие стойкого спазма базальных артерий. При аневризмах этой локализации наиболее обоснован интергемисферный доступ с обнажением на начальных этапах приводящего сегмента артерии
Операции, направленные на выключение аневризм этой локализации, относят к категории технически наиболее сложных.
Основную группу составляют аневризмы развилки базилярной артерии. Для доступа к аневризмам этой локализации используют 2 основных подхода — птериональный и субвисочный транстенториальный.
При птериональном доступе на начальном этапе осуществляют препаровку 6азальных отделов сильвиевой щели с выделением супраклиноидного сегмента внутренней сонной артерии. Дальнейшее продвижение к области развилки базилярной артерии хирург осуществляет, следуя по ходу задней соединительной артерии и глазодвигательного нерва (последний на выходе из ствола мозга располагается между начальными участками задней мозговой и верхней мозжечковой артерии).
При низком расположении бифуркации основной артерии может возникнуть необходимость в резекции заднего наклонённого отростка
Наиболее ответственный момент операции — выделение шейки аневризмы и наложение клипсы. Крайне важно, чтобы вместе с аневризмой не были клипированы перфорирующие артерии, отходящие от задней вентральной поверхности начальных участков задних мозговых артерий. Самая крупная из перфорирующих артерий — стриоталамическая, её повреждение может привести к жизненно опасным осложнениям.
Перфорирующие артерии могут плотно прилежать и даже срастаться со стенкой аневризмы. В сложных случаях, чтобы создать условия для более тщательной препаровки, оправдано временное клипирование ствола основной артерии.
Канадский нейрохирург Ч. Дрейк, имевший наибольший опыт лечения аневризм вертебробазилярной системы, для обнажения аневризм развилки и верхней трети основной артерии в деталях разработал субтенториальный подход с рассечением тенториального намёта. В последние годы был предложен ряд базальных доступов с резекцией отдельных участков пирамиды височной кости, которые существенно расширили возможности обнажения аневризм базилярной, позвоночных артерий и их ветвей.
Аневризмы позвоночной артерии чаще всего локализуются в месте отхождения задней нижней мозжечковой артерии, значительно реже — в месте слияния позвоночных артерий.
Положение аневризм устья задненижней мозжечковой артерии крайне изменчиво, что соответствует вариабельности отхождения сосуда от позвоночной артерии.
Основная задача при выключении аневризм этой локализации — сохранить кровоток по задней нижней мозжечковой артерии, так как её выключение приводит к тяжёлым нарушениям кровообращения в стволе мозга.
Для доступа к аневризмам позвоночной артерии используют, как правило, парамедианный доступ с частичной резекцией дужки атланта.
Если невозможно клипировать шейку аневризмы, выполняют операцию ПРОК’ симального клипирования позвоночной артерии ниже отхождения задненижней мозжечковой артерии.
Выключение крупных (> 1 см в диаметре) и особенно гигантских (>2,5 см) аневризм сопряжено с особыми трудностями, что обусловлено частым отсутствием шейки, отхождением от аневризмы функционально важных сосудов, частым тромбированием их полости. Всё это делает клипирование таких аневризм сложным и нередко невозможным.
Наиболее распространённая локализация таких аневризм — инфраклиноидная и офтальмическая части внутренней сонной артерии. Для выключения крупных и гигантских аневризм нередко приходится прибегать к выключению приводящей артерии, если существуют надёжные признаки адекватного коллатерального кровообращения.
Эффективное клипирование таких аневризм зачастую невозможно без вскрытия полости аневризмы и удаления тромбов. Чтобы сохранить кровоток по несущей артерии, иногда приходится с помощью специальных туннельных клипс формировать просвет сосуда. При гигантских аневризмах внутренней сонной артерии в ряде случаев с успехом можно использовать методику клипирования аневризмы в условиях аспирации крови как из самой аневризмы, так и из сонной артерии. Для этого во внутреннюю сонную артерию со стороны шеи вводят двухпросветный катетер, через один канал которого в сонную артерию помещают баллон для временной окклюзии её просвета, а через другой — производят аспирацию крови.
Более простое решение проблемы — выключение баллоном внутренней сонной артерии проксимальнее аневризмы. При недостаточности коллатерального кровообращения предварительно создают анастомоз между поверхностной височной артерией и одной из ветвей средней мозговой артерии.
В некоторых клиниках для выключения гигантских и некоторых труднодоступных аневризм операции проводят на «сухом мозге» в условиях глубокой гипотермии и кардиоплегии.
Рис. 19-19. Множественные аневризмы сосудов мозга (указаны стрелками): параклиноидная аневризма внутренней сонной артерии справа, супраклиноидная аневризма внутренней сонной артерии справа, две аневризмы средней мозговой артерии слева (дигитальная субтракционная ангиограмма, прямая проекция).
Множественные аневризмы обнаруживают приблизительно в 30% случаев (рис. 19-19). Основная задача — выявить аневризму, ставшую причиной кровоизлияния.
Именно её нужно выключить из кровотока в первую очередь.
Возможности современной хирургии позволяют одновременно выключать из одного доступа несколько аневризм, если они имеют одностороннее расположение.
Более того, при использовании птерионального доступа возможно выключение и некоторых контралатерально расположенных аневризм.
Если состояние больного позволяет, желательно выключить все аневризмы одновременно (из одного или нескольких Доступов).
Интраоперационный разрыв аневризмы особенно опасен на начальных этапах операции, когда хирург лишён возможности обнажить приводящую артерию для её временного клипирования. Это осложнение может сделать невозможным успешное завершение операции. Профилактика разрыва — полноценное анестезиологическое обеспечение и технически полноценное выполнение всех этапов операции. Один из главных приёмов, позволяющих предотвратить это наиболее опасное осложнение, — использовать в момент выделения аневризмы временное клипирование приводящей артерии или временное снижение АД.
Выключение важных для кровоснабжения мозга сосудов. Это может произойти в результате пережатия клипсой приводящей артерии или её ветвей (В том числе и перфорирующих артерий). Наиболее опасно вынужденное выключение артерий при невозможности остановить кровотечение из разорвавшейся аневризмы. Для интраоперационного контроля за проходимостью прилежащих к аневризме артерий можно использовать интраоперационную допплерографию.
При попадании артерии в клипсу последнюю следует, если возможно, снять и наложить заново (рис. 19-20).
Рис. 19-20. Клипирование шейки параклиноидной аневризмы правой внутренней сонной артерии (веА) а — по данным интраоперационной ТКДГ, бранши клипса пережимают переднюю ворсинчатую артерию (ПВА (указано стрелкой); б — после перестановки клипсы хорошо видно месте отхождения передней ворсинчатой артерии (указано стрелками).
В раннем послеоперационном периоде основные осложнения связаны с нарастанием ангиоспазма, ишемии и отёка мозга у больных, оперированных в остром периоде кровоизлияния (рис. 19-21), а также с развитием ишемии при длительном временном клипировании артерий или их выключении в ходе операции.
Рис. 19-21 . Множественные очаги ишемии в бассейнах обеих передних и средних мозговых артерий вследствие выраженного диффузного ангиоспазма.
Надёжных методов предотвращения и устранения развившегося ангиоспазма в настоящее время не существует. После операции продолжают введение нимодипина до 10- 14-го дня после субарахноидального кровоизлияния. в условиях выключенной аневризмы можно начинать проведение «3H-терапии» , включающей создание артериальной гипертензии, гиперволемии и гемодилюции. Для её проведения используют вазопрессоры, кристаллоидные и коллоидные растворы.
При проведении «3Н-терапии» или её элементов следует придерживаться следующих принципов.
- Терапию про водят в условиях мониторинга основных физиологических показателей и показателей состояния цереброваскулярной системы. Желательно установить катетер в лёгочную артерию, чтобы определить давление в ней для профилактики отёка лёгких.
- «3Н -терапия» не рекомендуется больным с выраженным отёком мозга.
- АД следует повышать постепенно, максимум систолического АД не должен превышать 240 мм рт.ст., а центрального венозного давления — 8-12 см вод.СТ.
- При гемодилюции необходимо поддерживать гематокрит не ниже 30-35%.
- Если по данным ТКДГ появляются признаки разрешения ангиоспазма, терапию следует постепенно прекращать.
Для лечения симптоматического ангиоспазма можно внутриартериально вводить папаверин в сочетании с баллонной ангиопластикой. Количество больных, у которых может быть применён этот метод, составляет около 10% оперированных.
Для лечения отёка мозга используют главным образом маннитол, желательно под контролем внутричерепного давления с помощью датчика.
Чтобы предотвратить и уменьшить последствия ишемии мозга, рекомендуется применять антиоксиданты и нейропротекторы.
Ухудшение состояния больных может быть связано с отсроченным развитием гидроцефалии (рис. 19-22). В таких случаях необходимо решать вопрос о проведении шунтирующей операции на ликворной системе.
Рис. 19-22. Постгеморрагическая гидроцефалия.
Эндоваскулярное лечение аневризм первоначально осуществляли, заполняя полость аневризмы введённым в неё баллоном. в последние годы широкое распространение получила методика окклюзии аневризмы с помощью отделяемых микроспиралей. В некоторых случаях при гигантских аневризмах применяют метод проксимальной окклюзии баллоном несущего сосуда с предварительным исследованием коллатерального кровотока.
Микроспирали состоят из вольфрамовой или платиновой проволоки. Они имеют различные диаметр и длину, которые подбирают в зависимости от размера аневризмы. Спираль, соединённую с толкателем, доставляют в аневризму через предварительно введённый микрокатетер, положение которого контролируют при помощью ангиографии. Существуют 2 системы отделения спирали — электролитическая и механическая.
• В электролитической системе спираль прочно прикреплена к толкателю и отделяется от него после установки спирали в аневризме электролитическим путём. В этой системе до отделения микроспирали можно изменить её положение или заменить её на спираль другого размера .
• В механической системе спираль соединяется с толкателем посредством специального захватывающего устройства и сама отделяется в аневризме сразу после выхода из микрокатетера.
Операцию в большинстве случаев проводят под местным обезболиванием и нейролептаналгезией. Общую анестезию используют у больных с психомоторным возбуждением.
Первой вводят микроспираль наибольшего размера для формирования иитрааневризматического каркаса. Более короткие микроспирали вводят, чтобы заполнить центральную часть аневризматического мешка внутри каркаса, сформированного первой микроспиралью. Когда аневризма заполнена, процедуру заканчивают (рис. 19- 23).
Рис. 19-23. Выключение аневризмы бифуркации основной артерии спиралями: а — левосторонняя вертебральная ангиография в прямой проекции; б — контрольная левосторонняя вертебральная ангиография в прямой проекции (стрелкой обозначены микроспирали в полости аневризмы).
Микрокатетер медленно удаляют из аневризмы. Контрольную ангиографию, позволяющую определить полноту выключения аневризмы, выполняют непосредственно после операции и через 3-12 мес.
Основное условие для применения микроспиралей, особенно механической системы, — наличие узкой шейки, когда соотношение размеров шейки и дна аневризмы составляет 1 :2. В оптимальном варианте размер шейки не превышает 4 мм.
Применение спиралей не рекомендуется при маленьких и гигантских аневризмах, а также аневризм ах с широкой шейкой. Эндовазальная окклюзия аневризмы бывает затруднена при выраженном ангиоспазме, особенно при аневризмах в области передней соединительной артерии.
Эндоваскулярные операции с использованием микроспиралей наиболее целесообразны при аневризмах, представляющих большую сложность для прямого хирургического вмешательства, особенно при аневризмах основной артерии, у пожилых больных с отягощённым соматическим статусом, у больных в остром периоде субарахноидального кровоизлияния, состояние которых не позволяет провести прямое вмешательство (IV-V стадия по Hunt и Hess).
Полной окклюзии полости аневризмы спиралями (100%) удаётся достичь примерно у 40% больных. Приблизительно в 15% случаев полнота выключения аневризмы составляет менее 95% её объёма.
Интраоперационные осложнения связаны с разрывом аневризмы в ходе операции, перфорацией стенки аневризмы спиралью, тромбоэмболиями ветвей церебральных артерий из полости аневризмы, частичной или полной окклюзией несущего сосуда спиралью с развитием ишемии мозга.
Послеоперационные осложнения непосредственно после операции связаны с нарастанием ангиоспазма и ишемии мозга при операциях в остром периоде субарахноидального кровоизлияния и с ишемией мозга в результате интраоперационных осложнений.
В отдалённом периоде после операции существует риск повторного кровоизлияния при неполном выключении аневризмы. В связи с этим всем больным рекомендуют контрольное ангиографическое обследование через 6 мес после операции, а при необходимости — повторное вмешательство.
В целом частота осложнений при выключении аневризмы спиралями составляет около 10-15%.
Исход лечения больных с артериальными аневризмами зависит прежде всего от стадии развития заболевания.
При прямых операциях в холодном периоде летальность практически отсутствует.
Смертельные исходы и тяжёлые осложнения, ведущие к инвалидности, регистрируют главным образом у больных с крупными и гигантскими аневризмами, а также аневризмами вертебробазилярного бассейна.
При лечении больных в остром периоде послеоперационная летальность в лучших клиниках колеблется в пределах 10%, а общая смертность с учётом больных, которым операцию не проводили в связи с высоким риском, составляет около 20%. Тем не менее последний показатель значительно меньше, чем ожидаемая смертность при отсутствии хирургического вмешательства.
Среди выживших пациентов около 7% остаются инвалидами, нуждающимися в постоянном уходе. В то же время до 80% больных после операции могут вести независимый образ жизни, а около 40% — возвращаются к трудовой деятельности.
Послеоперационная летальность при прямых и эндоваскулярных операциях в острой стадии примерно одинакова, а уровень инвалидизации несколько ниже при эндоваскулярных вмешательствах.
источник