Боль в груди — одна из самых частых причин обращения за врачебной помощью. Причина боли в груди может быть ясной, но часто бывает атипичной. Случаи, когда пациенты жалуются на боль в груди, представляют наибольшие трудности для диагностики.
Дифференциально-диагностический ряд в таких случаях чрезвычайно широк и включает, в том числе, заболевания, представляющие непосредственную угрозу жизни, такие как инфаркт миокарда с подъемом и без подъема сегмента ST, нестабильную стенокардию, тромбоэмболию легочной артерии и расслаивающую аневризму аорты.
Расслаивающая аневризма аорты (РАА) представляет достаточно сложную проблему в плане первичной диагностики. Причиной этого является как низкая частота данной патологии, так и большая вариабельность клинических проявлений.
Без применения кардиохирургических методов в ранние сроки заболевания прогноз крайне неблагоприятен, а двухнедельная выживаемость не превышает 20 % , поэтому своевременная диагностика РАА является важнейшей задачей.
Под термином «расслаивающая аневризма аорты» подразумевают внезапное образование вследствие различных причин дефекта интимы аорты с последующим проникновением крови через этот дефект в дегенеративно измененную срединную оболочку, образованием гематомы и продольным расслоением стенки аорты.
Расслоение (диссекция) происходит преимущественно в дистальном, реже в проксимальном отделе. Гематома может развиваться по ходу аорты и закупоривать одну из ее ветвей, начиная от ветвей дуги аорты и заканчивая кишечными артериями.
Ретроградная диссекция может поражать коронарные артерии. Чаще вовлекается правая коронарная артерия. Ретроградное расслоение может привести к нарушению прочности одной или нескольких створок аортального клапана и его недостаточности.
Ложный канал располагается в наружной половине средней оболочки аорты. Наружная его стенка составляет всего четверть первоначальной толщины стенки аорты. Это является причиной частых разрывов аорты у больных с расслаивающей аневризмой.
Разрыв аневризмы дуги аорты происходит чаще всего в полость средостения, разрыв нисходящей аорты — в левую плевральную полость, брюшной аорты — в забрюшинную клетчатку. Так как париетальный перикард прикрепляется к восходящей части аорты, непосредственно проксимальнее места отхождения плечеголовного ствола, разрыв любого отдела восходящей части аорты может привести к тампонаде перикарда.
Классификации расслаивающих аневризм аорты обычно основаны на локализации проксимального разрыва внутренней оболочки аорты и протяженности расслоения стенки аорты. Поскольку разрыв внутренней оболочки аорты может теоретически произойти в любом сегменте и быть множественным, варианты расслоения аорты весьма разнообразны.
Однако на практике разрыв внутренней оболочки чаще всего происходит в передней стенке восходящей части аорты на границе проксимальной и средней трети, а также в начальном сегменте нисходящей части аорты дистальнее русла левой подключичной артерии.
Именно на этом принципе основана простая и широко распространенная Стэндфордская классификация, согласно которой выделяют несколько типов расслоения:
- тип А — разрыв интимы находится в восходящей аорте с поражением дуги или нисходящей аорты, или без них;
- тип В — надрыв находится в нисходящей аорте, при этом расслоение распространяется проксимально и дистально.
Для определения прогноза болезни и выработки консервативной и оперативной тактики в клинике применяется модификация классификации М. DeBakey:
- тип I — разрыв внутренней оболочки локализуется в восходящей части аорты, а расслоение ее стенок распространяется до брюшной части аорты;
- тип II — разрыв внутренней оболочки локализуется в восходящей части аорты, расслоение заканчивается слепым мешком проксимальнее плечеголовного ствола;
- тип III — разрыв внутренней оболочки аорты локализуется в начальном отделе нисходящей части грудной аорты дистальнее устья левой подключичной артерии.
Классификация расслаивающей аневризмы аорты
Согласно другой классификации, выделяют пять классов диссекции аорты.
- К 1-му классу относят классическое расслоение аорты с формированием ложного и истинного ходов без образования сообщения между ними,
- к 2-му— интрамуральную гематому или кровоизлияние,
- к 3-му — пенетрирующее изъявление атеросклеротической бляшки стенки аорты вследствие надрыва ее капсулы,
- к 4-му — небольшие ограниченные или частичные диссекции аорты с образованием выпячивания ее стенки
- к 5-му — ятрогенные или посттравматические диссекции аорты (например, расслоение аорты проведенным в нее для катетеризации сердца катетером).
Классификация диссекций аорты по L. G. Svensson и соавт.
Разрыв интимы, являющийся началом расслаивающей аневризмы, обнаруживается в восходящей части аорты примерно в 70 % случаев. В 10 % случаев его находят в дуге, в 20 % — в нисходящей части грудной аорты. В редких случаях наблюдается надрыв интимы брюшной аорты.
Диссекция (расслоение) аорты может быть острой (до 2 недель) и хронической (более 2 недель).
Распространенность РАА оценивается в среднем как 1 на 10 000 госпитализированных (однако значительная часть больных погибает на догоспитальном этапе). Данная патология является причиной 1,1 % случаев внезапной смерти и 3-4 % случаев всех внезапных смертей от сердечно-сосудистых заболеваний; выявляется в 1 случае на 400 аутопсий.
К предрасполагающим факторам расслоений аорты относятся заболевания и состояния, сопровождающиеся кистозной дегенерацией медии:
- длительно существующая артериальная гипертензия,
- врожденные дефекты соединительной ткани (синдромы Марфана, Элерса — Данлоса, Тернера),
- поликистозная болезнь почек,
- пожилой возраст (60-70 лет);
- врожденные пороки сердца (коарктация аорты, бикуспидальный или одностворчатый клапан);
- атеросклероз аорты;
- беременность;
- травма грудной клетки,
- сильное физическое и эмоциональное напряжение;
- системные васкулиты (особенно часто гранулематозный, гигантоклеточный артериит);
- химические и токсические воздействия (наркотики, например, кокаин);
- ятрогенные причины.
Наиболее частыми симптомами при РАА являются внезапное начало боли с молниеносным достижением максимальной интенсивности, локализация боли в грудной клетке, боль в спине. Боль описывается пациентами как очень интенсивная или нестерпимая, самая сильная боль, которую они когда-либо испытывали, боль острая или рвущая.
У значительной части пациентов могут наблюдаться те или иные изменения сегмента ST или зубца Т.
При проксимальном типе расслоения может выслушиваться шум аортальной регургитации.
Как при проксимальном, так и при дистальном типе расслоения может определяться асимметрия пульса (снижение его наполнения или отсутствие) и артериального давления на верхних или нижних конечностях.
У части пациентов могут выявляться те или иные неврологические нарушения.
Относительно редко встречается вторичный (чаще всего задненижний) инфаркт миокарда, связанный с распространением расслоения на устье коронарной артерии.
К заболеваниям, имеющим сходную с РАА клиническую картину, относятся:
- острый коронарный синдром;
- аортальная недостаточность без диссекции (расслоения);
- аневризма аорты без диссекции (расслоения);
- костно-мышечные;
- перикардит;
- опухоль средостения;
- плеврит;
- тромбоэмболия легочной артерии;
- холецистит.
Наличие РАА можно подозревать, если у пациента имеется боль; боль в сочетании с обмороком (синкопе); боль в сочетании с симптомами сердечной недостаточности; боль в сочетании с симптомами поражения ЦНС (инсульт); сердечная недостаточность без болевого синдрома; симптомы поражения ЦНС (инсульт) без болевого синдрома; изменения на рентгенограмме органов грудной клетки без болевого синдрома; отсутствие пульса без болевого синдрома.
Согласно рекомендациям рабочей группы Европейского общества кардиологов, для подтверждения диагноза, уточнения типа расслоения (локализация, протяженность), диагностики и уточнения тяжести аортальной недостаточности и диагностики экстравазации (периаортальная или медиастинальная гематома, плевральный или перикардиальный выпот) предпочтение следует отдавать трансторакальной ЭхоКГ с последующей трансэзофагеальной ЭхоКГ и внутрисосудистым УЗИ, мультиспиральной компьютерной томографии или магнитно-резонансной томографии.
Ангиография может проводиться для определения анатомического субстрата при планируемом чрескожном вмешательстве у гемодинамически стабильных и нестабильных пациентов, но не рутинно. Рентгенография грудной клетки не дает дополнительной информации.
Ниже представлены начальные лечебно-диагностические мероприятия, которые следует проводить при подозрении на РАА в соответствии с рекомендациями группы экспертов Европейского общества кардиологов.
- Сбор детального анамнеза и полный осмотр (при возможности).
- Обеспечение венозного доступа, анализы крови (ОАК, КФК, тропонин I (Т), Д-димер, гематокрит, липиды).
- Мониторирование артериального давления и ЭКГ.
- Снижение систолического артериального давления, предпочтительно β-адреноблокаторы (пропранолол, метопролол, эсмолол), при противопоказаниях — антагонисты кальция.
- При тяжелой артериальной гипертензии дополнительно вазодилататоры.
- Трансторакальная (трансэзофагеальная) ЭхоКГ.
Всем пациентам с расслаивающей аневризмой аорты показано хирургическое лечение.
Представляем клинический пример прижизненной диагностики РАА на основании особенностей течения заболевания и клинической картины.
Пациентка А., 59 лет. Жалоб в момент поступления нет. Ранее сердечно-сосудистых заболеваний не переносила.
Впервые за 3 дня до обращения в стационар возникла колющая, пронизывающая боль умеренной интенсивности в области сердца и между лопатками без связи с физической нагрузкой и движением, усиливавшаяся при пальпации, сохранялась несколько часов после самостоятельного приема анальгетиков. Повторный подобный приступ развился накануне поступления в стационар.
Консультирована неврологом, высказано предположение о вертеброгенной торакалгии. Проведена ЭКГ, выявлены изменения (отрицательные зубцы Т в отведениях III и aVF), по поводу которых пациентка направлена в стационар с диагнозом: «ИБС. Заднедиафрагмальный инфаркт миокарда».
При объективном обследовании обращал на себя внимание умеренно интенсивный диастолический шум, выслушивавшийся над аортой и по правому краю грудины.
С учетом острого характера и длительности боли в грудной клетке в сочетании с выявленными признаками аортальной недостаточности, предположительно остро развившейся (не было сведений о существовавшем ранее пороке сердца, границы сердца в пределах нормы, отсутствовали признаки хронической сердечной недостаточности) было высказано предположение о наличии РАА восходящего отдела аорты.
Пациентка была госпитализирована в ОРИТ, где планировалось начать инфузию эсмолола, провести трансторакальную и, при необходимости, трансэзофагеальную ЭхоКГ.
Через 10 мин после поступления больная внезапно потеряла сознание, диагностировано прекращение кровообращения (электромеханическая диссоциация). Реанимационные мероприятия безуспешны.
Диагноз: «Расслаивающая аневризма восходящей аорты. Гемоперикард. Тампонада сердца».
При патологоанатомическом исследовании было обнаружено непротяженное расслоение восходящей аорты с надклапанным разрывом и кровоизлиянием в полость перикарда.
П. В. Долотовская, И. В. Грайфер, С. В. Ефремов, Н. В. Фурман
источник
Опубликовано в журнале:
Визуализация в клинике »» N13, Декабрь 1998 Ultrasound imaging in the diagnosis of aortic dissecting aneurism
О.Ю. Атьков, Д.М. Атауллаханова, В.Е. Синицын, С.К. Терновой, Т.В. Балахонова
Atkov O.Yu., Ataullakhanova D.M., Sinitsyn V.E., Ternovoy S.K., Balahonova T.V.
Институт клинической кардиологии им А.Л. Мясникова Российского кардиологического научно-производственного комплекса МЗ РФ, Москва
Cardiology Research Complex, Ministry of Health of the Russian Federation, Moscow
Анализируется случай расслаивающей аневризмы аорты. Ддя уточнения диагноза и определения начала и протяженности отслойки интимы использовался комплекс современных визуализирующих методов — трансторакальная и чреспищеводная ЭхоКГ, а также электронно-лучевая томография. Продемонстрирована высокая диагностическая значимость примененных методов.
Analyzed is the case of aortic dissecting aneurism. Improvement of the diagnosis and determination of the origin and expanse of intima detachment were performed with a set of present-day imaging techniques including transthoracic and transesophageal echocardiography and electron-beam CT. A high diagnostic virtue of these techniques was demonstrated. («Визуализация в клинике», 1998, 13: 51-54)
Ключевые слова: ультразвуковая диагностика, расслаивающая аневризма аорты, эхокардиография, чреспищеводная ЭхоКГ, электронно-лучевая томография.
Key words: ultrasound imaging, aortic dissection, echocardiography, transesophageal echocardiography, electron-beam CT.
Расслаивание аневризмы аорты — самое частое из неотложных состояний, связанных с заболеванием аорты, которое заканчивается летальным исходом у половины больных уже в первые 48 часов. Многообразие клинических проявлений расслаивания аневризмы аорты (РАА) ведет к диагностическим ошибкам. По данным большинства исследователей, правильный диагноз ставится лишь в 50% случаев. Уменьшение летальности в последнее десятилетие связано со значительным улучшением диагностики и совершенствованием хирургических методов лечения.
Различают три типа РАА по классификации De Bakey в зависимости от места расположения отслоившейся интимы [4]:
тип I — восходящая аорта, дуга и нисходящий отдел аорты,
тип II — восходящая аорта,
тип III — нисходящая аорта.
Золотым стандартом среди диагностических методов считался и все еще считается метод контрастной аортографии. В то же время это довольно дорогой инвазивный метод, опасный своими осложнениями. Именно поэтому клиницисты не всегда используют его при подозрении на РАА, особенно при отсутствии клинических проявлений или при атипичной симптоматике.
Этим объясняется большой интерес к разработке неинвазивных методов диагностики РАА. Весьма привлекательна и удобна для этой цели эхокардиография. По имеющимся в литературе сообщениям, трансторакальная эхокардиография (ТЭхоКГ) позволяет выявлять 80% РАА со специфичностью 95% [1]. В настоящее время особую роль в диагностике РАА отводят чреспищеводной эхокардиографии (ЧПЭхоКГ), которую считают одним из наиболее информативных и точных методов [2, 3]. Так, по данным многоцентрового исследования [5], охватывающего 164 пациента с предполагаемым РАА, диагностическая чувствительность и специфичность ЧПЭхоКГ составили соответственно 94% и 98%, что не уступает аналогичным показателям компьютерной томографии (83% и 100% соответственно) и аортографии (88% и 94% соответственно). Кроме того, метод ЧПЭхоКГ является относительно недорогим, полуинвазивным, не сопровождается облучением пациента и не требует введения контраста. ЧПЭхоКГ можно проводить непосредственно у постели больного, при необходимости даже интраоперационно, или осуществлять с ее помощью мониторирование хирургических операций, причем длительно. Возможно повторное наблюдение.
В данном сообщении мы описываем случай применения ультразвуковых методов для установления диагноза PAA и точной локализации места его расположения.
12 декабря 1997 г. у больного У., 40 лет, впервые в жизни без провоцирующих факторов развился интенсивный приступ болей за грудиной. Вызванная бригада скорой помощи на основании данных ЭКГ не выявила ишемических изменений в миокарде. От госпитализации больной отказался. Боль продолжалась четверо суток, В последующем с помощью ЭхоКГ была обнаружена аневризма восходящего отдела аорты. Боль в грудной клетке больше не возникала. Со слов больного, несколько лет назад он перенес травму грудной клетки (удар).
2 марта 1998 г. больной поступил в НИИ кардиологии им А.Л. Мясникова. При поступлении состояние больного было удовлетворительным, жалоб не предъявлял. Аускультативно над всей поверхностью сердца выслушивался систолический шум, над аортой — грубый систоло-диастолический шум. Пульс на a. radialis слева хорошего наполнения, справа — резко ослаблен, ЧСС 60-70 ударов в мин. Отмечалась асимметрия артериального давления: на левой руке 120/80 мм рт. ст., на правой руке — 80/60 мм рт. ст.).
С целью уточнения диагноза больному проведено ультразвуковое исследование сердца и сосудов, ЧПЭхоКГ и электронно-лучевая томография (ЭЛТ).
При проведении трансторакальной ЭхоКГ из парастернальной позиции по длинной оси выявлено, что левый желудочек (ЛЖ) расширен: КДР — 6.6 см, КСР — 4.4 см (норма 5.5 см и 3.5 см соответственно). Сократительная способность миокарда ЛЖ удовлетворительная. Аорта в области аортального кольца не расширена, диаметр ее равен 3.5 см (норма до 3.7 см). Восходящий отдел аорты выше места прикрепления створок аортального клапана расширен до 6.0 см (аневризма). По задней стенке аорты определяется двойной контур, что позволило предположить наличие PAA (рис. 1). При допплеровском исследовании сердца из верхушечной позиции (пятикамерный срез) в выходном тракте ЛЖ зарегистрирован регургитирующий поток 2-й степени. Из-за плохого ультразвукового окна цветовое допплеровское картирование сердца затруднено.
Таким образом, по данным ТЭхоКГ, у пациента обнаружены расслаивающая аневризма восходящего отдела аорты с развитием относительной недостаточности аортального клапана 2-й ст. и расширение ЛЖ.
Для уточнения состояния аортального клапана, выявления границ отслоившейся интимы и определения объема и особенностей предстоящего оперативного вмешательства, в том числе на клапане, была проведена ЧП ЭхоКГ.
Под местной анестезией 10%-ным раствором лидокаина после внутривенного введения 2 мл раствора реланиума выполнена ЧП ЭхоКГ. Створки аортального клапана оказались неизмененными, аорта в области клапана не расширена, диаметр ее здесь равен 3.5 см. В 2 см от места прикрепления створок аортального клапана визуализируется отслоившаяся интима (рис. 2) с формированием ложной аневризмы в области задней стенки. Диаметр аорты в этой области составляет 6.2 см. При цветовом допплеровском картировании в нижней части отслоившейся интимы обнаружено отверстие размером 2.4 см (рис. 3) Отслойка интимы распространяется до дистального отдела дуги аорты, диаметр которой не превышает 3.5 см. Нисходящий отдел аорты не изменен и не расширен (2.6 см).
Таким образом, по данным ЧПЭхоКГ, диагностирована РАА в восходящем отделе с распространением и на дистальный отдел дуги.
При исследовании экстракраниального отдела брахиоцефальных артерий методом дуплексного сканирования и цветового допплеровского картирования потока выявлено расслоение брахиоцефального ствола с формированием двух каналов (рис. 4). Первый из них диаметром 10 мм переходит в правую сонную артерию, кровоток в которой не изменен. Второй канал диаметром 2.3 мм переходит в подключичную артерию, где определяется кровоток с повышенной скоростью и элементами турбулентности. Направление кровотока по правой позвоночной артерии ретроградное, что является признаком развития постоянной формы синдрома позвоночно-подключичного обкрадывания (рис. 5).
Таким образом, отслоение интимы аорты у данного больного распространялось на брахиоцефальный ствол, что, по-видимому, и привело к ослаблению пульса на a. radialis и снижению артериального давления справа.
Для уточнения данных, полученных с помощью ультразвуковых методов исследования, была проведена электронно-лучевая томография (ЭЛТ) на аппарате «Imatron», модель С-150 (США ) с синхронизацией по ЭКГ. Время выполнения одного среза составляло 100 мс. Все исследование было осуществлено в течение одной тридцатисекундной задержки дыхания. Толщина срезов и расстояние между их центрами равнялось 3 мм. ЭЛТ выполняли до и после внутривенного болюсного введения 120 мл неионного рентгеноконтрастного препарата Омнипак, содержащего 350 мг йода/мл, фирмы Никомед (Норвегия) со скоростью 3.5 мл/сек.
Рис. 1. Трансторакальная ЭхоКГ. Парастернальная позиция. Одномерное исследование аорты. Аорта расширена, по задней стенке определяется двойной контур (отслоившаяся интима).
Fig. 1. Transthoracic echocardiography: parasternal position, one-dimensional investigation. The enlarged aorta has a double contour along the posterior wall (detached intima).
Рис. 2. Чреспищеводная ЭхоКГ. Двухмерное изображение аорты по длинной оси. Стрелками показана отслоившаяся интима.
Fig. 2. Transesophageal echocardiography: two-dimensional image of the aorta along the long axis. Arrows point at the detached intima.
Рис. 3. Чреспищеводная ЭхоКГ. Двухмерное изображение аорты по длинной оси. Цветовое допплеровское картирование. Видно (желтый цвет) движение крови по каналу, образованному отслоившейся интимой.
Fig. 3. Transesophageal echocardiography: two-dimensional image of the aorta along the long axis. Color Doppler. Yellow is a blood flow along the channel formed by the detached intima.
Рис. 4. Исследование брахиоцефального ствола в цветовом допплеровском режиме. Отчетливо видно существование двух потоков.
Fig. 4. Investigation of the brachycephal column. Color Doppler. Two flows are easily observable.
Рис. 5. Правая общая сонная и позвоночная артерии в цветовом допплеровском режиме. Кровоток в общей сонной артерии направлен к мозгу, в позвоночной артерии — от мозга.
Fig. 5. The right common carotid and vertebral arteries in color Doppler. Blood is running toward the brain in the common carotid artery and in the opposite direction in the vertebral artery.
На основании серии поперечных срезов на рабочей станции выполнялись многоплоскостные и объемные реконструкции. По данным ЭЛТ, сразу за кольцом аортального клапана, диаметр которого составлял 3.0 см, начинается аневризматическое расширение восходящей аорты, достигающее 6.3 см в диаметре на границе между проксимальной и средней ее третями. Диаметр дуги аорты 3.5 см, нисходящей аорты — 3.3 см. Начиная от уровня синусов Вальсальвы, видна отслоившаяся интима, имеющая извитой ход и формирующая ложный канал вдоль задне-левой стенки аорты (рис. 6 а, b, с). Расслоение переходит на дугу аорты и заканчивается в ее дистальной трети. В нижней части отслоившейся интимы видна фенестрация размером около 2.5 см; в дистальном отделе дуги имеется второй разрыв интимы диаметром около 2.0 см. Тромботические массы в просвете ложного канала отсутствуют. При анализе состояния сосудов, отходящих от дуги аорты, обнаружен переход расслоения на устье брахиоцефального ствола.
Таким образом, данные ЭЛТ также свидетельствуют о наличии аневризмы восходящей аорты и ее расслоении (II тип) с вовлечением устья брахиоцефального ствола.
На основании клинических и инструментальных исследований был поставлен диагноз: расслаивающая аневризма восходящего отдела аорты (II тип по De Bakey) с распространением на брахиоцефальный ствол. Недостаточность аортального клапана 2-й степени.
Особенностью представленного наблюдения является распространение расслоения интимы на брахиоцефальный ствол с образованием двух каналов. Кроме того, несмотря на столь значительные изменения, больной не только остался жив, но и пребывал в удовлетворительном состоянии в течение нескольких месяцев после возникновения расслоения аневризмы.
Заключая, можно подчеркнуть, что ультразвуковые методы исследования позволили диагностировать расслаивающую аневризму аорты, определить место начала отслойки интимы, ее распространенность, что было подтверждено ЭЛТ. Это дает возможность рекомендовать использование ультразвуковых методов для диагностики РАА.
Рис. 6. Электронно-лучевая томография.
а — срез в поперечной плоскости. В просвете аорты, заполненном контрастным препаратом, видна отслоившаяся интима,
b — реконструкция в сагиттальной плоскости. Визуализируется проксимальный разрыв отслоившейся интимы,
с — трехмерная реконструкция.
Fig. 6. Electron-beam СТ.
а — cross section. The detached intima can be observed in the aortic lumen filled with a contrast agent,
b — reconstruction in the sagittal plane. Proximal rupture of the detached intima can be visualized,
с — three-dimensional reconstruction.
источник
Под расслаивающей аневризмой аорты (расслоение аорты) понимают образование дефекта (разрыва) внутренней оболочки стенки аорты с последующим поступлением крови в дегенеративно измененный средний слой, образованием внутристеночной гематомы и продольным расслоением стенки аорты на внутренний и наружный слои с формированием дополнительного внутрисосудистого канала (ложного просвета). Расслоение чаще происходит в дистальном (антеградном) направлении, реже — в проксимальном (ретроградном). Аневризма (расширение аорты) может формироваться в случае значительного расширения ложного просвета, однако, само по себе расширение аорты в ряде случаев носит умеренный характер или отсутствует.Клиническая картина заболевания определяется 3 патологоанатомическими факторами, лежащими в основе расслоения: расслоением стенки аорты, развитием обширной внутристеночной гематомы и сдавлением или отрывом ветвей аорты, снабжающих жизненно важные органы (сердце, головной и спинной мозг, почки), с последующей их ишемией. Само по себе внезапное расслоение аорты вызывает боль.
Образование внутристеночной гематомы в области восходящей аорты приводит к сдавлению коронарных артерий, сужению выходного отдела ЛЖ, острой недостаточности кровообращения, проксимальной коарктации. Обширная внутристеночная гематома, вмещающая большое количество крови, создает своеобразный «олигемический синдром».
Симптомы расслоения аорты могут быть разнообразны, т.к. расслоение — процесс динамичный и начальная картина заболевания может отличаться от финальной. Они могут имитировать практически все сердечно-сосудистые, неврологические, хирургические и урологические заболевания.
Ведущим и самым частым (в 90-96% случаев) синдромом расслоения аорты является боль (кроме больных с нарушением сознания). Боль отличается необычайной интенсивностью, возникает внезапно, с максимальной выраженностью в начале расслоения, в отличие от инфаркта миокарда (ИМ), где она постепенно нарастает. В некоторых случаях боль может становиться невыносимой. Боль имеет раздирающий, разрывающий, простреливающий характер, может быть мигрирующей от места возникновения по направлению расслоения, может в начале сопровождаться вагусными проявлениями, тошнотой, рвотой, повышением АД. Локализация боли при РА определяется местом начала расслоения. Боль за грудиной, спереди грудной клетки, имитирующая ИМ, характерна для проксимального расслоения (более 90% случаев), особенно если оно распространяется на корень и вызывает сдавление коронарных артерий. При дальнейшем расслоении (1тип) боль перемещается в межлопаточное пространство, затем смещается вдоль позвоночника. Мигрирующая боль по пути распространения расслаивающей гематомы отмечается у 17-70% больных. Боль в шее, глотке, челюсти, лице, зубах указывает на вовлечение восходящей аорты и дуги. Боль в грудной клетке сзади, спине, нижних конечностях характерна для дистального расслоения, при этом она первоначально локализуется в межлопаточном пространстве. Отсутствие боли в межлопаточном пространстве достаточное свидетельство против дистального расслоения. При распространении расслоения аорты I и II типов на брюшную аорту боль локализуется в эпигастрии, гипогастрии, пояснице, имитируя острые заболевания желудочно-кишечного тракта, урологические заболевания.
Асимптомное (безболевое) течение (кроме больных с нарушением сознания) может быть у больных с хроническим расслоением.
Менее частыми первоначальными признаками расслоения аорты (в связи или без связи с болью) могут быть:
— симптомы ишемии головного или спинного мозга, периферическая нейропатия, синкопэ без локальной неврологической симптоматики (в 4-5%), которые чаще связаны с разрывом расслоенной аорты в перикард или плевральную полость;
— аортальная недостаточность и острая недостаточность кровообращения;
— ишемия органов пищеварения;
— остановка сердца и внезапная смерть.
Данные объективного осмотра при расслоении аорты вариабельны и, в той или иной степени, связаны с локализацией аорты и степенью вовлечения сердечно-сосудистой системы. В других случаях, даже при наличии обширного расслоения, объективные данные могут быть невыраженными или вообще отсутствовать.
1) АГ в начале заболевания (при возможной клинической картине шока) наблюдается чаще при дистальном расслоении (в 80-90% случаев), реже — при проксимальном. Артериальная гипотензия — чаще при проксимальном расслоении. Причинами ее чаще является тампонада сердца, либо внутриплевральный или внутриперитониальный разрыв аорты.
2) Асимметрия пульса (снижение его наполнения или отсутствие) и АД на верхних или нижних конечностях наблюдается у половины больных с проксимальным и у 15% — с дистальным РА (при вовлечении бедренной или подключичной артерий). Сужение обусловлено либо распространением расслоения аорты на ту или иную артерию, с уменьшением истинного просвета, либо проксимальной обструкцией интимальным лоскутом лежащего выше устья вовлеченной артерии. Хотя наличие асимметрии пульса у больного с острой болью предполагает РА, возможны ошибочные трактовки.
3) Аортальная регургитация с диастолическим шумом аортальной недостаточности — важный признак проксимального расслоения — встречается у 50-75% больных. Шум может иметь музыкальный оттенок, лучше выслушивается вдоль правого края грудины. Он может быть нарастающим, убывающим, различной интенсивности, в зависимости от величины АД. При тяжелой аортальной недостаточности могут быть периферические признаки: быстрый, скачущий и высокий пульс и большое пульсовое давление. В некоторых случаях при развитии застойной сердечной недостаточности, вследствие остро развившейся аортальной недостаточности, диастолический шум может быть едва уловим или отсутствовать.
4) Неврологические нарушения встречаются в 6-19% всех расслоений аорты и включают в себя цереброваскулярные нарушения, периферическую нейропатию, нарушения сознания, параплегии. Цереброваскулярные нарушения встречаются в 3-6% случаев, вследствие вовлечения безымянной или левой общей сонной артерии. Реже могут быть нарушения сознания или даже кома.
При вовлечении спинальных артерий (чаще при дистальном расслоении) могут быть параплегии или парапарезы вследствие ишемии спинного мозга.
5) Более редкими проявлениями расслоений аорты могут быть: ИМ, инфаркт почек и др. В 1-2% случаев проксимального расслоения могут вовлекаться устья коронарных артерий и развиваться вторичный ИМ (чаще — задний/нижний, вследствие более частого поражения правой коронарной артерии). Из-за наличия симптомов расслоений аорты инфаркт миокарда может клинически не проявляться. С другой стороны, при ЭКГ острого ИМ может быть не распознано расслоение аорты, а применение тромболизиса может привести к фатальным последствиям. Поэтому при заднем/нижнем инфаркте миокарда следует не забывать о возможности РА и до проведения тромболизиса некоторые авторы считают необходимым провести рентгенологическое исследование для исключения расслоения аорты.
Распространение расслоения на брюшную аорту может вызвать различные сосудистые нарушения: ишемию и инфаркты почек, приводя к тяжелой АГ и острой почечной недостаточности мезентериальную ишемию и инфаркты соответствующей области (в 3-5% расслоений аорты); острую ишемию нижних конечностей (при распространении расслоения на подвздошные артерии).
6) Клиническим проявлением расслоения аорты могут быть плевральные выпоты, чаще слева, вследствие либо вторичной экссудативной реакции вокруг пораженной аорты, либо в результате разрыва или просачивания крови в плевральную полость.
7) Очень редкими проявлениями расслоений аорты могут быть:
— пульсация грудинно-ключичного сочленения
— сдавление трахеи и бронхов с явлениями стридора или бронхоспазма
— кровохарканье при разрыве в трахеобронхиальное дерево
— рвота кровью при разрыве в пищевод
— синдром верхней полой вены
— атриовентрикулярная блокада (при вовлечении перегородки)
— лихорадка неясного генеза, обусловленная воздействием пирогенных субстанций из гематомы или связанного с ней выпота
— шумы, обусловленные разрывом расслоенной аорты в полости предсердий или правого желудочка с развитием сердечной недостаточности.
При подозрении на расслоение аорты важно быстро и точно верифицировать диагноз.
Рентгенография органов грудной клетки, не являясь методом верификации диагноза, тем не менее, может первой выявить признаки, подозрительные на расслоение аорты. Данные рентгенологического обследования не являются специфичными, но могут дать основание для проведения других методов исследования. Основными рентгенологическими признаками, указывающими на возможность РА, являются:
I. Расширение тени аорты (в 81 -90% случаев, по нашим данным), лучше выявляемое в левой косой проекции (иногда локальное выпячивание в области расслоения, реже — расширение верхнего средостения). Расширение тени аорты было выявлено у 50% больных с расслоением I типа (- и у 10% — III типа. Отмечалась неровность контуров нисходящей аорты, деформация ее тени.
2. Сепарация (отделение) кальцинированной интимы в области выпячивания от адвентиция более, чем на 1 см (в норме — до 0,5 см) — предположительный, но также не диагностический признак.
3. Изменение тени контуров аорты или средостения при сравнении с данными предыдущего исследования.
4. Отклонение трахеи или плевральный выпот (чаще левосторонний).
5. Резкое снижение или отсутствие пульсации ненормально широкой аорты. Хотя большинство больных с РА имеет один или более рентгенологических признаков, у 12% пациентов имеется неизмененная рентгенограмма. Отсутствие изменений при ренгенографии не позволяет исключить диагноз расслоения аорты.
Электрокардиография в 12 стандартных отведениях выявляет неспецифические для РА признаки гипертрофии левого желудочка и связанные с ней изменения (депрессия сегмента ST, отрицательный зубец Т). У 1/3 пациентов ЭКГ остается нормальной. Тем не менее, снятие ЭКГ важно по двум причинам:
— отсутствие изменений на ЭКГ у больного с выраженным болевым синдромом в грудной клетке является опорным дифференциально-диагностическим критерием РА с ИМ;
— наличие на ЭКГ признаков ОИМ (чаще нижней локализации) при сопоставлении с данными рентгенографии позволяет не только предположить у больного расслоение аорты, но и указывает на вовлечение коронарных артерий.
Лабораторные признаки не очень показательны в диагностике расслоений аорты:
а. анемия — при значительной секвестрации крови в ложном канале или разрыве в полости;
б. небольшой (умеренный) нейтрофильный лейкоцитоз (до 12-14 тыс./мм3);
в. повышение ЛДГ и билирубина (из-за гемолиза крови в ложном канале);
г. нормальный уровень КФК и трансаминаз;
д. изредка возможно развитие ДВС-синдрома.
По данным объективных и рутинных методов обследования, диагноз расслоения аорты может быть поставлен только у 62% пациентов. Остальные в начале заболевания имеют признаки ишемии миокарда, застойной недостаточности кровообращения, нерасслаивающей аневризмы грудной или брюшной аорты, симптомы аортального стеноза, ТЭЛА и др. Среди этих больных с первоначально недиагносцированным расслоением аорты, у 2/3 расслоений аорты было диагносцировано другими методами исследования, использованными для решения прочих клинических вопросов. У 1/3 диагноз быть поставлен только на аутопсии.
Основными методами диагностики расслоений аорты в настоящее время считают методы, позволяющие визуализировать аорту:
— контрасгно-усиливающая компьютерная томография (КТ)
— ядерно-магнитный резонанс (ЯМР)
— трансторакальная и трансэзофагеальная эхокардиография.
Каждая методика имеет свои преимущества и недостатки. Выбор метода зависит от возможности и опыта.
Аортография долгое время рассматривалась как стандартный и единственно точный высокочувствительный метод диагностики расслоений аорты. Прямыми признаками расслоения аорты при аортографии являются: визуализация двух просветов (истинного и ложного), интимального лоскута, а непрямыми — деформация просвета аорты, расширение и деформация ее стенки, ненормальное отхождение сосудистых ветвей, наличие аортальной регургитации. Аортография позволяет:
1. определить протяженность расслоения
2. выявить вовлеченность ветвей аорты
3. определить место начального разрыва и точное место проксимальной фенестрации
4. наличие или отсутствие дистальной фенестрации
5. оценить степень состоятельности аортального клапана и коронарных артерий.
Однако, ложный просвет, чаще выявляющийся в нисходящей аорте, в 10-15% случаев тромбируется; истинный просвет при этом сужен. При трансфеморальном доступе катетер может не попасть в истинный просвет аорты. Выявить наличие интимального лоскута (т.е. отслоенную внутреннюю оболочку между истинным и ложным просветом) удается у 1/3 больных.
Недостатком аортографии является возможность получения ложно-отрицательных результатов, что случается при слабой контрастированности ложного просвета (из-за его возможного тромбоза), одинаково равномерном контрастировании обоих каналов, малом и локальном расслоении.
К сложностям применения данного метода следует отнести риск инвазивной процедуры и введения контрастного вещества (его непереносимость), невозможность выполнения аортографии у нестабильных (нетранспортабельных) больных. Кроме того, введение альтернативных диагностических методик показало, что чувствительность и специфичность аортографии составляет 77-88% и 95%, соответственно. Так, ложный ход визуализируется у 87% больных, интимальный лоскут — у 70% и место начального разрыва интимы — лишь у 50% пациентов с расслоениями аорты.
Эхокардиография является доступным и неинвазивным методом диагностики РА. По литературным данным трансторакальная эхокардиография позволяет выявить 80% расслоений аорты. В настоящее время особую роль в диагностике расслоений аорты отводят чреспищеводной ЭхоКГ (чувствительность метода составляет 95%, а специфичность-75%), являющейся методикой выбора при нестабильном состоянии больного, т.к. может быть быстро выполнена у постели больного, в операционной, непосредственно перед оперативным вмешательством, не требует прекращения мониторного наблюдения и проводимых терапевтических мероприятий. Эхокардиография позволяет визуализировать расширение луковицы аорты, увеличение толщины стенок аорты, функцию аортального клапана, определить подвижный лоскут в просвете аорты, а также дает дополнительную информацию о сердечных структурах и функции.
При отсутствии возможности проведения чреспищеводной ЭхоКГ, методом выбора является компьютерная томография с введением контраста. При контрастно-усиленной КТ расслоение аорты определяется по наличию двух различных просветов, видимо разделенных интимальным лоскутом, либо по различной скорости (степени) контрастного затемнения. Метод обладает чувствительностью 83-94% и специфичностью 87-100%.
Преимуществами КТ являются: неинвазивность, хотя и требуется в/в введение контраста; доступность; возможность установить диагноз расслоения аорты в случае тромбоза ложного просвета; возможность устанавливать наличие перикардиального выпота.
Основные недостатки КТ: относительно невысокая чувствительность в отношении диагностики расслоений аорты; невозможность в 1/3 случаев выявить интимальный лоскут; редкость установления места начального разрыва; невозможность выявить наличие аортальной регургитации и вовлечение сосудистых ветвей.
ЯМР является неинвазивной методикой, не требующей в/в введения контраста, при этом дающей высококачественное изображение в нескольких плоскостях. ЯМР облегчает распознавание РА, позволяет выявить вовлеченность ветвей, а также диагностировать расслоение аорты у пациентов с предшествующими заболеваниями аорты. Чувствительность и специфичность метода — около 98%, при этом, чувствительность составляет 88% для установки места интимального разрыва и аортальной регургитации, 98% — для диагностики наличия тромбоза и 100% — для выявления перикардиального выпота. Необычайно высокая точность делает ЯМР современным «золотым стандартом» в диагностике РА, особенно у стабильных больных и с хроническим расслоением.
Однако, у метода все же есть ряд недостатков: ЯМР противопоказан больным с пейсмейкером, при наличии определенного типа сосудистых скрепок, некоторыми старыми типами протезирования металлическими искусственными клапанами; не является широко доступным методом. Некоторые авторы считают относительным противопоказанием к проведению ЯМР нестабильное состояние больного, требующее в/в назначения гипотензивных препаратов и мониторинга АД.
Лечение при расслоении аорты направлено на остановку прогрессирования расслаивающей гематомы.
Боль должна быть купирована в/в введением морфина.
Для уменьшения сердечного выброса и снижения скорости изгнания ЛЖ, применяют b-блокаторы в возрастающих дозах до снижения ЧСС 60-80 в мин.
При наличии противопоказаний к применению b-блокаторов (брадикардия, АВ-блокада, бронхоспазм), сейчас все чаще применяются антагонисты кальциевых каналов. Нифедипин сублингвалыю может быть применим немедленно, пока будут приготовлены к введению другие препараты. Недостатком нифедипина является слабое отрицательное инотропное и хронотропное действия, в связи с чем могут быть применены дилтиазем и верапамил.
При неэффективности бета-блокаторов может быть применен нитропруссид натрия в дозе 0,5-10 мг/кг*мин в/в.
При рефракторной гипертензии, в результате вовлечения почечных артерий, наиболее эффективно применение ингибиторов АПФ (эналаприл — 0,625 мг внутривенно каждые 4-6 ч. с постепенным увеличением дозы).
При гипотензии следует думать о возможности тампонады сердца, разрыве аорты, что, по возможности, требует быстрого восстановления ОЦК. При рефракторной гипотензии предпочтительно использовать норадреналин, мезатон. Допамин используется для улучшения функции почек и только в малых дозах.
При стабилизации состояния больного немедленно проводятся диагностические исследования для верификации диагноза. При нестабильном состоянии больного предпочтительно выполнение ТЭЭ, на фоне непрерывающегося мониторинга и терапевтических мероприятий.
Дальнейшая тактика определяется типом расслоения.
источник
Сайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна!
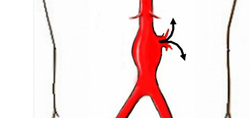
При отсутствии своевременного лечения у больных с аневризмой аорты могут появиться следующие осложнения:
- Образование тромбов. В полости аневризмы, будь она веретенообразной или мешковидной, нарушается нормальный ток крови. В нем образуются завихрения, что может привести к образованию тромбов. Тромб в данном случае будет представлять собой склеившиеся тромбоциты. Находясь в полости аневризмы, тромб не особенно мешает току крови. Однако, покинув аневризму, тромб может застрять в сосудах меньшего диаметра. Предсказать, где именно произойдет тромбоз, практически невозможно. Блокированной может оказаться мозговая артерия (с картиной ишемического инсульта), артерии почки, печени, конечностей. Тромбоз останавливает поступление артериальной крови в соответствующий орган, что ведет к быстрой гибели тканей. Нередко тромбоз заканчивается смертью пациента. Проблема заключается в том, что аневризма может никак себя не проявлять, и пациент не подозревает о наличии у него заболевания. В то же время, нарушения кровотока уже существуют, и инсульт, например, станет первым (и зачастую последним) проявлением болезни.
- Пневмония.Пневмония может быть следствием аневризмы грудной аорты, если последняя пережимает бронхи или давит на трахею. В норме эпителий воздуховодных путей выделяет определенной количество слизи, которая очищает бронхи и увлажняет воздух. Сдавление же приводит к тому, что слизь скапливается в определенном отделе легкого. Здесь создаются благоприятные условия для развития инфекции. Если она попадает, то развивается пневмония.
- Пережатие желчевыводящих протоков. Аневризмы в верхней части брюшной аорты соседствуют с множеством различных органов. Крупная аневризма может, например, пережать желчевыводящие протоки, который идут от желчного пузыря к двенадцатиперстной кишке. При этом, во-первых, нарушается отток желчи из желчного пузыря, и, во-вторых, ухудшается процесс пищеварения. Возрастает риск холецистита, панкреатита, а больной может страдать от диареи, запоров, метеоризма.
- Риск заболеваний сердца. Аневризма грудной аорты значительных размеров может сдавливать нервные сплетения, регулирующие работу сердца. Из-за этого у больных иногда наблюдаются стойкая брадикардия или тахикардия. Кроме того, в самой грудной аорте давление зачастую возрастает, из-за чего создается дополнительная нагрузка на левый желудочек. В результате могут произойти необратимые изменения в аортальном клапане сердца или в сердечной мышце. Даже после удаления аневризмы и нормализации давления нарушения в работе сердца могут остаться.
- Ишемия нижних конечностей. Ишемией называется кислородное голодание тканей. В нижние конечности артериальная кровь может попадать в меньших количествах из-за инфраренальной аневризмы аорты (расположенной ниже места отхождения почечных артерий). Недостаток же кислорода ведет к ухудшению восстановления клеток. Повышается риск обморожений, трофических язв (из-за недостатка питания) и других повреждений мягких тканей. Аневризма в данном случае будет играть роль провоцирующего фактора.
Разрыв аневризмы, безусловно, является самым опасным из осложнений. Именно риск разрыва объясняет необходимость хирургического решения проблемы при первой возможности. Поскольку стенки аневризмы тоньше и менее эластичны, чем на других участках сосуда, даже незначительное повышение артериального давления или травмы могут вызвать разрыв. Последствия же разрыва почти всегда ведут к смертельному исходу. Аорта имеет большой диаметр, и за короткий отрезок времени через нее проходит значительный объем крови. Через дефект, образовавшийся при разрыве аневризмы, кровь начинает попадать в свободную грудную или брюшную полость (в зависимости от расположения аневризмы). Массивное внутреннее кровотечение зачастую не дает врачам времени даже довезти больного до операционной.
Разрыв существующей аневризмы аорты могут спровоцировать следующие факторы:
- физическая нагрузка;
- травмы и падения;
- прием некоторых медикаментов (особенно повышающих давление);
- психоэмоциональный стресс.
Чаще и быстрее всего разрываются расслаивающие аневризмы аорты, так как их стенка обладает меньшей прочностью. Однако даже такие образования редко разрываются в состоянии покоя.
При разрыве аневризмы аорты у пациента могут появиться следующие симптомы:
- внезапная слабость;
- потеря сознания;
- шум в ушах;
- внезапная боль;
- быстрое побледнение кожи;
- появление темного пятна на коже живота (при скоплении большого количества крови в брюшной или забрюшинной полости).
Пациенту с разрывом аневризмы аорты необходимо срочное хирургическое вмешательство для устранения кровотечения и реанимационные мероприятия для поддержания жизненно важных процессов.
Заподозрив аневризму аорты, необходимо обратиться к семейному врачу-терапевту или кардиологу. Именно они могут квалифицированно провести первичное обследование и назначить дальнейшие анализы и обследования. Целенаправленный поиск аневризмы грудной или брюшной аорты в большинстве случаев оказывается успешным. Врачам удается обнаружить само образование, а также собрать все необходимые данные (форма, тип, размеры и др.).
Целью осмотра пациента является сбор информации без привлечения дополнительных методов обследования. Врач пытается выявить видимые нарушения и отклонения от нормы. Данное обследование иногда позволяет с высокой долей вероятности поставить правильный диагноз даже без привлечения дополнительных средств.
При физикальном осмотре используют следующие методы исследования:
- Визуальный осмотр. Визуально при аневризмах аорты удается получить очень мало информации. Какие-либо изменения в форме грудной клетки наблюдаются крайне редко и только в тех случаях, когда пациент прожил с крупной аневризмой грудной аорты хотя бы несколько лет. При аневризме же брюшной аорты крупных размеров иногда можно наблюдать пульсацию, которая передается на переднюю брюшную стенку. Кроме того, при разрыве аневризмы на брюшной стенке иногда можно наблюдать фиолетовые пятна – признак массивного внутреннего кровотечения. Однако данный симптом почти никогда не появляется на передней брюшной стенке (обычно на боку), так как аорта расположена забрюшинно (отделена от кишечника, желудка и других органов задним листком брюшины), и кровоизлияние происходит, в первую очередь, в забрюшинное пространство.
- Перкуссия. Перкуссия заключается в выстукивании полостей тела для определения границ разных органов на слух. При аневризме брюшной аорты можно таким способом определить приблизительные размеры и расположение образования. Часто область притупления перкуторного звука совпадает с зоной «сосудистого пучка». Тогда, по данным перкуссии, эта зона будет расширена. Кроме того, при крупной аневризме грудной аорты могут быть несколько сдвинуты границы сердца или средостения. При аневризме брюшной аорты перкуссия менее информативна, так как сосуд проходит по задней стенке брюшной полости. Пальпация в этом случае будет информативнее.
- Пальпация. Прощупывание грудной полости практически невозможно из-за реберного каркаса, поэтому в диагностике аневризмы грудной аорты пальпация почти не используется. При аневризме же брюшной полости часто можно обнаружить пульсирующее в такт сердцу образование. Это красноречиво говорит именно о наличии аневризмы, так как при других заболеваниях такие образования не встречаются. Кроме того, к пальпации можно отнести обнаружение пульса. Если частота или наполнение пульса различно на разных руках или на сонных артериях, это может говорить о наличии аневризмы дуги аорты. Ослабленная или отсутствующая пульсация на бедренных артериях (или разная частота на разных ногах) может указывать на инфраренальную аневризму.
- Аускультация. Выслушивание с помощью стетофонендоскопа (слушалки) является весьма распространенным и ценным методом диагностики. При аневризме брюшной аорты, приложив стетоскоп к месту проекции аневризмы, можно услышать усиленный шум тока крови. При аневризме же грудной аорты патологические изменения могут быть различными — металлический акцент второго тона над аортой, систолический шум в точке Боткина и др.
- Измерение давления. Чаще всего у пациентов с аневризмой обнаруживают гипертонию (повышение давления). При аневризмах дуги аорты больших размеров давление на разных руках может быть различным (разница более 10 мм рт. ст.).
При обнаружении характерных симптомов во время физикального обследования врач назначает другие диагностические мероприятия для подтверждения диагноза.
Рентгенография является наиболее распространенным методом визуализации органов брюшной или грудной полости. Рентгеновские лучи, проходя сквозь ткани, по-разному задерживаются ими. Так появляются границы на снимке. Они говорят об участках (органах, тканях, образованиях) с различной плотностью. При аневризме грудной аорты часто можно видеть либо один из краев полости аневризмы (например, выбухание дуги аорты), либо все расширение сосуда. Зависит это от качества снимка и расположения аневризмы.
Также с помощью рентгеновского излучения возможно исследование с контрастом (аортография). При этом в аорту вводят особое вещество, которое интенсивно окрашивает сосуд на снимке. Таким образом, врач получает четкие границы сосуда и его основных ветвей. Хорошо определяется форма и размер аневризмы, ее расположение. На практике, однако, контрастное исследование применяют редко. Во-первых, это инвазивная (травматичная) процедура, так как необходимо введение в аорту специального катетера через бедренную артерию. Из-за этого существует риск кровотечения, занесения инфекции и др. Во-вторых, при наличии аневризмы (особенно расслаивающей) высок риск спровоцировать разрыв во время проведения исследования. Поэтому данная процедура проводится только по особым показаниям.
Ультразвуковое исследование основано на прохождении через ткани звуковых волн. Отражаясь, эти волны улавливаются особым датчиком, а компьютер на основе полученной информации строит изображение, понятное для врача. В медицинской практике при аневризмах аорты УЗИ является одной из самых распространенных диагностических процедур. Это объясняется тем, что в режиме допплер аппарат УЗИ может также измерять скорость кровотока. Данная информация очень важна именно в случае аневризм, так как при них появляются завихрения в потоке, а в некоторые сосуды не поступает достаточное количество крови.
УЗИ для пациентов с аневризмой аорты имеет следующие преимущества:
- относительно низкая стоимость;
- безболезненное и безопасное для пациента исследование;
- немедленное получение результата;
- длительность исследования всего 10 – 15 минут;
- возможность определения формы и размеров аневризмы;
- возможность обнаружения некоторых осложнений аневризмы;
- возможность оценки кровотока в аорте и ее ветвях;
- возможность обнаружения формирующихся тромбов.
В целом УЗИ более распространено в диагностике аневризмы брюшной аорты. Брюшная стенка тоньше, и картинка, которую получает врач, точнее. При исследовании же аневризмы грудной аорты можно обнаружить также ряд патологий сердца и легких, что тоже важно для лечения. Метод исследования органов грудной полости с помощью ультразвуковых волн называется эхокардиографией (ЭхоКГ).
Магнитно-резонансная томография и компьютерная томография являются различными по принципу действия диагностическими методами, но в целом у них много общего. Обе процедуры являются весьма информативными, но и дорогостоящими, поэтому назначают их не всем пациентам. Часто к данным методам исследования прибегают перед плановой операцией по удалению аневризмы аорты. В этом случае необходимо собрать как можно больше информации об образовании.
При проведении МРТ используется особое свойство ядерно-магнитного резонанса. Изображение получается путем помещения пациента в мощное электромагнитное поле, в котором компьютер улавливает движения ядер водорода. Формируется высокоточное изображение, на котором видна не только объемная форма аневризмы, но даже толщина ее стенок. Все это является очень важным при составлении прогноза для пациента и для решения о хирургическом лечении. Исследование длится примерно 15 – 20 минут, в течение которых пациенту нельзя двигаться.
МРТ имеет следующие противопоказания:
- ушные импланты и встроенные слуховые аппараты;
- наличие металлических штифтов или пластин после перенесенных операций;
- наличие кардиостимулятора;
- некоторые виды протезов клапанов сердца.
Важным плюсом МРТ является то, что данная процедура позволяет оценить также кровоток в отдельных сосудах, а не только получить изображение самой аневризмы. Врачи получают возможность оценить расстройства кровообращения и заподозрить ряд сопутствующих нарушений.
При компьютерной томографии способ получения изображения несколько иной. Как и в случае рентгенографии, речь идет о различии в поглощении рентгеновского излучения у разных тканей тела. В современных томографах источник излучения вращается вокруг пациента, выполняя целый ряд снимков. Затем компьютер моделирует результат. В итоге получается серия высокоточных снимков-срезов. Опытный врач по результатам компьютерной томографии может не только обнаружить изменения в строении аорты, но и определить их размер, положение и другие особенности. Еще более информативной КТ делает возможность использования контраста. Введение контрастного вещества в сосуд позволяет получить компьютерную модель сосудов пациента в формате 3D. Интенсивность же рентгеновского излучения за процедуру остается маленькой, несмотря на выполненную серию снимков. Абсолютным противопоказанием для проведения данной процедуры является беременность (есть риск для плода).
Электрокардиография является недорогим и безболезненным методом исследования, который направлен на оценку электрической активности сердца. При подозрении на аневризму грудной или брюшной аорты рекомендуется снимать электрокардиограмму сразу по нескольким причинам. Во-первых, у пациентов с болями в грудной клетке это поможет дифференцировать аорталгию от ангинозных болей (ишемическая болезнь сердца), которые можно легко спутать. Во-вторых, атеросклероз, который является наиболее частой причиной аневризмы аорты, часто поражает и коронарные сосуды, повышая риск инфаркта. Желательно выявить данные нарушения с помощью ЭКГ до начала лечения. В-третьих, иногда на ЭКГ можно заметить и специфические изменения, характерные именно для аневризмы аорты. Также с помощью данного исследования иногда обнаруживают изменения в работе сердца, которые являются осложнениями аневризмы. Перед проведением операции для удаления аневризмы и во время нее ЭКГ снимается постоянно.
Основными преимуществами ЭКГ является скорость проведения исследования (стандартная процедура длится около 10 минут), безопасность для пациента (процедура не имеет абсолютных противопоказаний) и немедленное получение результата. Полученную запись должен внимательно изучить врач-кардиолог, который по ней может получить самую разную информацию о работе сердца.
В большинстве случаев анализ крови или анализ мочи у пациентов с аневризмой аорты не будет иметь специфических изменений. Стандартный общий и биохимический анализ крови назначают скорее с целью выявить возможную причину образования аневризмы уже после того как сама аневризма обнаружена.
У пациентов с аневризмой аорты могут быть выявлены следующие изменения в лабораторных анализах:
- Изменение уровня лейкоцитов. Может наблюдаться при некоторых инфекциях, которые, в свою очередь, являются причиной развития аневризмы. Уровень лейкоцитов обычно повышается при острых инфекционных процессах и снижается – при хронических. При хронических также растет доля несегментированных нейтрофилов в лейкоцитарной формуле.
- Изменения свертываемости крови. Исследование уровня тромбоцитов, факторов свертывания и ряда других показателей часто изменяется, если в полости аневризмы формируются тромбы.
- Повышенный уровень холестерина. Гиперхолестеринемией называется повышение уровня холестерина в крови до 5 ммоль/л и более. Чаще всего это указывает на атеросклеротическое поражение аорты. Косвенно об этом также говорит повышенный уровень триглицеридов или липопротеинов низкой плотности (даже если общий холестерин в норме).
- В анализе мочи в редких случаях могут обнаруживаться примеси крови (микрогематурия), которые обнаруживают при специфическом анализе.
Однако все эти изменения являются не обязательными, обнаруживаются не на всех стадиях болезни и далеко не у всех пациентов.
Важной частью лечения является профилактика разрыва аневризмы. Она включает изменение образа жизни, питания, некоторых привычек пациента. Соблюдение профилактических мер позволит пациенту лучше подготовиться к операционному лечению (оно будет не срочным по поводу расслоения или разрыва, а плановым).
Профилактика образования и разрыва аневризмы включает следующие рекомендации:
- прекращение курения является, пожалуй, наиболее важной мерой как для профилактики развития аневризмы, так и для задержки увеличения диаметра уже существующей аневризмы грудной аорты;
- нормализация артериального давления (в том числе с помощью медикаментозных средств);
- нормализация массы тела, при необходимости с помощью диетолога;
- соблюдение диеты с низким содержанием холестерина для профилактики атеросклероза;
- отказ от серьезных физических нагрузок;
- профилактика психоэмоционального стресса (вплоть до приема седативных препаратов).
Учитывая, что причины образования аневризмы аорты могут быть различными, могут потребоваться и другие профилактические меры. Их определяет и объясняет пациенту лечащий врач после обследования.
Естественное течение такого заболевания как аневризма аорты — это неуклонное и прогрессирующее увеличение аневризмы в диаметре, с последующим ее разрывом. На данный момент в медицине не существует достаточно надежных медикаментозных средств, которые могли бы предотвратить развитие дегенеративных процессов в стенке аорты и дальнейший рост аневризмы. Соответственно адекватным лечением может быть только хирургическое вмешательство с резекцией (удалением) пораженного участка и его замещением.
Но в следующих случаях необходимо прибегать к медикаментозным препаратам, для того чтобы максимально надолго задержать рост аневризмы и облегчить симптомы заболевания:
- При небольшом диаметре патологического участка в аорте (до 5 см) в период динамического наблюдения за пациентом с аневризмой грудной аорты.
- При тяжелых сопутствующих заболеваниях, когда риск от проведения операции превышает риск разрыва самой аневризмы. К этим состояниям относятся острые расстройства коронарного кровообращения, острые расстройства мозгового кровообращения, сердечная недостаточность II – III степени.
- В период подготовки к оперативному вмешательству.
Для каждого пациента лечащий врач подбирает собственную схему лечения в зависимости от типа и размеров образования, а также в зависимости от симптомов и жалоб больного. Однако существует несколько групп препаратов, которые назначают наиболее часто.
При аневризмах грудной или брюшной аорты могут быть назначены лекарства со следующим эффектом:
- препараты, уменьшающие ЧСС (частоту сердечных сокращений);
- препараты для снижения артериального давления;
- препараты, снижающие уровень холестерина.
Для уменьшения ЧСС чаще всего используются бета-адреноблокаторы, влияющие на иннервацию сердца. При противопоказаниях к применению бета-блокаторов может назначаться верапамил из группы блокаторов кальциевых каналов. Необходимо замедлять ЧСС до 50 — 60 ударов в минуту. Это существенно снижает нагрузку на стенки аорты и уменьшает вероятность осложнений.
Препараты для снижения ЧСС у пациентов с аневризмой аорты
Артериальное давление тоже необходимо снижать для уменьшения напряжения в стенке аорты. В этих целях используются блокаторы кальциевых каналов, ингибиторы АПФ (ингибиторы ангиотензинпревращающего фермента). Для каждого пациента лечащий врач подбирает препараты той группы, которая лучше всего подходит именно ему. В некоторых случаях возможна комбинация препаратов. Зависит назначение от причин, которые вызывают гипертонию.
Препараты для снижения артериального давления у пациентов с аневризмой аорты
Атеросклероз является фактором риска быстрого роста аневризмы, способствуя ослаблению стенки сосуда. Своевременное лечение может надолго задержать прогрессирование процесса. Используются препараты из группы статинов, фибраты, секвестранты желчных кислот. Препарат для лечения конкретного пациента выбирает врач, ориентируясь по результатам анализов.
Препараты для снижения уровня холестерина у пациентов с аневризмой аорты
При различных осложнениях аневризмы аорты или сопутствующих нарушениях у пациента могут потребоваться и другие препараты. Например, если аневризма аорты появилась на фоне системной инфекции, необходим курс лечения антибиотиками, которые эффективны против микроба-возбудителя. Также могут назначаться различные витаминные комплексы, препараты для укрепления сосудистой стенки, лекарства против образования тромбов. Однако единых стандартов лечения нет. Специалист ориентируется по ситуации, исходя из нарушений, обнаруженных у пациента. Самолечение вышеперечисленными препаратами без консультации врача очень опасно. Неправильный подбор дозы может ускорить разрыв аневризмы или дать избыточную нагрузку на другие внутренние органы.
В настоящее время выделяют следующие противопоказания к хирургическому лечению аневризмы аорты:
- острые расстройства кровообращения в сосудах сердца;
- недостаточность кровообращения II или III степени;
- серьезные проблемы с кровообращением в сосудах головного мозга (при наличии соответствующих неврологических проблем);
- невозможность адекватной реваскуляризации как минимум глубоких артерий бедра (после операции будет недостаточное кровообращение).
Перенесенный инфаркт миокарда при стабильной электрокардиограмме в течение трех месяцев или перенесенный инсульт шесть недель назад (при отсутствии неврологических нарушений) не относятся к противопоказаниям. Таким пациентам может быть проведено хирургическое удаление аневризмы.
В целом же в каждом отдельном случае возможность хирургического лечения и его план рассматривается отдельно. На длительность операции и ее сложность влияет вид аневризмы, ее расположение, наличие осложнений.
Для обнаружения противопоказаний и полноценного предоперационного обследования пациента назначают следующие процедуры:
- детальное обследование состояния дыхательной системы (спирография);
- оценка состояния почек, с целью исключения скрытой почечной недостаточности;
- обязательной является оценка состояния кровеносных сосудов нижних конечностей, а также коронарных артерий и артерий малого круга кровообращения;
- определение чувствительности к антибиотикам, назначаемым в отношении стафилококков и кишечной палочки (эти микроорганизмы чаще всего вызывают послеоперационные осложнения).
Независимо от вида аневризм антибиотикотерапия назначается заранее (обычно за 24 часа до операции) в качестве профилактики послеоперационных осложнений. За сутки в крови появляется достаточная концентрация антибиотика, чтобы не допустить размножения патогенных (болезнетворных) бактерий.
В настоящее время существует несколько вариантов хирургического лечения аневризмы аорты:
- Классическое хирургическое вмешательство. Под классическим вмешательством понимают масштабную полостную операцию с общим наркозом и широким рассечением тканей. Целью является удаление участка аорты с аневризмой и ее замены (обычно протезом). В результате кровоток по аорте восстанавливается полностью. Большим минусом такой операции является ее травматичность. Высок риск осложнений во время и после операции. Даже при отсутствии осложнений пациент, как правило, долго восстанавливается и надолго теряет трудоспособность.
- Эндоваскулярная хирургия. Под эндоваскулярной хирургией понимают совокупность методов, при которых не происходит масштабного рассечения тканей. Все необходимые инструменты подводятся к аневризме по другим сосудам (часто через бедренную артерию). В зависимости от типа и размеров аневризмы существует несколько вариантов вмешательства. Иногда в просвет сосуда устанавливают особую укрепляющую сетку, которая предотвращает рост или расслоение образования. При мешотчатых аневризмах небольших размеров порой прибегают к «пломбированию» устья. В настоящее время существует довольно широкий спектр манипуляций через эндоваскулярный доступ. Однако все они выполняются, как правило, при небольших мешотчатых аневризмах, когда нет серьезной угрозы разрыва.
Если речь идет о расслоении аневризмы, разрыве или других осложнениях, либо риск разрыва, по мнению врачей, очень высок, выполняется только обычное хирургическое вмешательство. Оно дает более обширный доступ к аорте, позволяет надежнее устранить проблему и хорошо осмотреть другие слабые участки сосуда, если таковые имеются. Также классическая хирургия является единственным вариантом лечения при больших и гигантских веретенообразных аневризмах.
Поскольку основным методом лечения аневризмы является хирургическое вмешательство, ни одно народное средство не может полностью излечить данный недуг. Их использование возможно только в качестве профилактического симптоматического лечения. Например, некоторые народные средства обладают хорошим успокаивающим эффектом (важно для профилактики стресса), другие – понижают артериальное давление. Однако в большинстве случаев имеются более эффективные фармацевтические аналоги, обладающие более выраженным и быстрым действием. К народным средствам разумно обращаться при наличии противопоказаний или при непереносимости лекарств.
В качестве альтернативы медикаментозному лечению иногда используют следующие народные средства:
- Настой зелени укропа. Одну столовую ложку мелко нарезанного укропа настоять в 400 мл кипятка. Эту порцию разделить на 3 части и выпить в течение суток.
- Настой боярышника. Плоды красного боярышника хорошо высушить и измельчить. Для приготовления настоя необходимо две ложки из полученного порошка. Залить порошок 300 мл кипящей воды и настаивать в течение получаса. Разделить на три части и употреблять за 30 минут до принятия пищи.
- Настой левкойного желтушника. Этот настой готовится из двух столовых ложек желтушника. Заливается 150 мл закипевшей воды. Выпивать по 15 мл 5 раз в день. Можно добавить сахар в приготовленный настой для улучшения вкуса.
- Отвар бузины. Для приготовления этого отвара необходим корень сибирской бузины. Вскипятить 200 мл воды, добавить измельченный корень бузины, дать прокипеть на маленьком огне в течение 15 минут. Снять с огня и настаивать еще 30 минут. Полученный отвар процедить, перелить в стеклянную посуду. Выпивать по одной столовой ложке 3 раза в день.
Необходимо понимать, что ни одно из рекомендованных выше средств не окажет наиболее важного эффекта — замедления роста аневризмы. При применении средств народной медицины возможно лишь временное облегчение симптомов заболевания, таких как одышка или отеки. Поэтому полагаться на фиторецепты совершенно недопустимо. Полное излечение может гарантировать только своевременное обращение к врачам и проведение хирургического лечения.
Прогноз для пациентов с аневризмой аорты зависит от целого ряда различных факторов. Их стараются выявить при поступлении пациента, чтобы понять, насколько срочно необходимо лечение. Определяют как можно более точно тип и размер аневризмы. После этого лечащий врач (обычно хирург) составляет приблизительный план дальнейших исследований и лечения.
На прогноз при аневризме аорты влияют следующие факторы и показатели:
- Форма аневризмы. Как правило, наиболее опасны расслаивающие аневризмы. Наилучший прогноз чаще всего для веретенообразных истинных аневризм, стенки которых более прочные.
- Причина образования. Аневризмы, появившиеся на фоне атеросклероза, растут медленнее. При сифилисе прогноз хуже, так как болезнь, добравшаяся до стенки аорты, уже на поздней стадии, и могут быть поражены другие органы. При врожденных заболеваниях соединительной ткани прогноз в целом плохой, так как не существует эффективного лечения.
- Размер аневризмы. Аневризмы большего размера чаще всего вызывают больше симптомов и имеют склонность к разрыву. Прогноз для них будет хуже.
- Возраст пациента. Атеросклеротические аневризмы обычно образуются у людей старше 40 лет. При этом у них могут быть различные сопутствующие заболевания — ишемическая болезнь сердца, проблемы с почками или печенью и др. Все это может стать относительным или даже абсолютным противопоказанием к хирургическому лечению. Прогноз, разумеется, ухудшается.
- Стадия болезни. Свежие аневризмы, образовавшиеся в течение последних недель, имеют худший прогноз, потому что врачам труднее оценить угрозу разрыва. Подострые аневризмы имеют лучший прогноз.
- Расположение аневризмы. Трудно сказать, какие аневризмы опаснее — грудной или брюшной аорты. В обоих случаях разрыв чаще всего приводит к смерти пациента. Важным фактором является то, какие ветви аорты затронуты аневризмой. Это во многом предопределяет объем и сложность хирургического вмешательства (особенно, если речь идет о протезировании). Наихудший прогноз будет для множественных аневризм аорты, расположенных и в грудной, и в брюшной полости.
В целом аневризма аорты без операционного лечения считается заболеванием с плохим прогнозом. Само наличие аневризмы указывает на возможность ее разрыва с летальным внутренним кровотечением. Возможности же профилактических методов и медикаментозной терапии не безграничны. Если же пациенту было успешно проведено хирургическое лечение, то прогноз благоприятный. Повторное образование аневризмы или другие осложнения после операции возможны, но они не представляют уже такой серьезной опасности. В этом случае прогноз будет больше зависеть от самого пациента (будет ли он добросовестно следовать предписаниям врачей).
Группу инвалидности присваивает медико-социальная экспертиза, состоящая из специалистов нескольких направлений. В принципе, каждый случай рассматривается индивидуально. Основным критерием для получения группы является трудоспособность – возможность выполнять различную нагрузку без серьезного вреда для здоровья и возможность самообслуживания в быту. Если пациент не может работать или ухаживать за собой, врачи оценивают серьезность ситуации и определяют группу инвалидности.
При аневризме грудной или брюшной аорты поначалу речь об инвалидности не идет. Сначала необходимо пройти полноценный курс лечения, который включает и хирургическую коррекцию данной патологии. Другими словами, пока у врачей есть варианты лечения, пациента на медико-социальную экспертизу не направляют.
После хирургического лечения должно пройти определенное время — обычно от полугода до 1 – 2 лет. В этот период пациент посещает реабилитационные центры, которые делают все возможное, чтобы восстановить здоровье. При отсутствии осложнений или серьезных последствий болезни (или операции) пациента признают здоровым. Разумеется, снова не встает вопрос о получении группы инвалидности.
Если же пациент после курса реабилитации не избавляется от серьезных последствий операции или болезни, его направляют на медико-социальную экспертизу. При аневризме брюшной или грудной аорты такими последствиями могут быть, например, нарушения работы сердца, ухудшение кровоснабжения отдельных органов. Иногда заболевания, приведшие к образованию аневризмы (синдром Марфана и ряд других врожденных заболеваний), прогрессируют, и пациент получает группу не столько из-за аневризмы, сколько по поводу основной патологии. При синдроме Марфана, например, отмечается слабость суставов, серьезное ухудшение зрения, пороки сердца. Медико-социальная экспертиза будет рассматривать эти проявления в совокупности.
Неоперированная аневризма аорты тоже может стать поводом для получения группы инвалидности. Например, если у пациента имеется аневризма, но есть серьезные противопоказания к операции (нарушения работы сердца, легких, почек, печени и другие сопутствующие патологии). Все это ставит врачей в тупик, так как решить проблему хирургическим путем становится невозможно. Риск от операции становится слишком высок. Поскольку пациенту приходится постоянно считаться с риском разрыва аневризмы и другими осложнениями, он вынужден часто посещать врачей и регулярно принимать различные лекарства. Это может стать поводом для его направления на медико-социальную экспертизу.
источник







