Постинфарктная аневризма – это патологическая деформация участка миокарда с частичной либо полной утратой сократительной способности, вызванная нарушениями работы сердечнососудистой системы и осложнением после перенесенного заболевания. Размер поврежденного участка зависит от обширности инфаркта и может занимать большую часть органа. Особую опасность представляет то, что рубцовая ткань, замещающая погибшую, почти всегда изнутри выстлана тромбами. Современные методы диагностики и лечения позволяют своевременно выявить заболевание и принять все меры для спасения жизни человека.
Инфаркт относится к заболеваниям, несвоевременное выявление которых в большинстве случаев приводит к тяжелым осложнениям либо летальному исходу. Согласно медицинской статистике, аневризма чаще своим появлением обязана инфаркту, но она также может быть врожденной, или стать результатом тяжелого травматического случая.
Формирование постинфарктной аневризмы в 8/10 случаев происходит в верхней области, а в остальных – на передней стенке левого желудочка. При этом деформированная ткань не сокращается и в результате левый желудочек разделяется аневризматическим проходом на 2 части, одна из них работает, а вторая – неподвижна.
Часть крови в систоле попадает в мешок несокращающегося сегмента, в результате чего появляется недостаточность кровообращения. До того момента, когда погибший участок миокарда полностью заменится соединительной тканью, существует опасность разрыва деформированной стенки и накопление крови в полости перикарда.
Кроме постинфарктной аневризмы сердца существует псевдоаневризма. Она появляется после:
- инфекционного эндокардита;
- ревматизма;
- сифилиса;
- туберкулеза;
- в результате травматического нарушения целостности стенки сосуда.
Представляет собой заполненную кровью полость между соединительной тканью и просветом артерии. Приводит к уменьшению сократительной способности сердца вследствие потери им двигательной активности.
Аневризматические нарушения не имеют четкой формы, определенной глубины и обширности поражения. Бывают:
В органе может быть несколько деформированных участков. Аневризмы делятся на:
- истинные, в которых нарушение охватывает 3 слоя;
- ложные, ограничены сращением перикарда;
- функциональные, образованы куском миокарда сохранившего свою деятельность, но имеющего низкую сократимость.
В органе образование располагается несколькими формами:
- плоской или диффузной, которая снаружи сердца выпячивания не имеет, а внутри находится чашеобразное углубление;
- мешковидной, с широким основанием и выпуклой закругленной стенкой;
- грибовидной: наблюдается узкий вход с последующим большим выпячиванием;
- аневризма внутри аневризмы обозначает, что в полости одного деформированного участка располагается другой.
Несмотря на то, что заболевание достаточно хорошо изучено, тем не менее, остается под вопросом, почему оно развивается только у 1/10 людей перенесших инфаркт миокарда.
В момент массивного инфаркта миокарда мышечные конструкции сердечной стенки гибнут, а внутрисердечное давление приводит к растяжению омертвевшей части органа. По моменту формирования заболевания в послеинфарктный период различается несколько типов
- Острый диагностируется в первые 2 недели. Представляет собой некротизированный, растянутый участок сердечной мышцы, выступающий внутрь или наружу органа.
- Подострый тип появляется в период от 3 до 8 недель. На месте погибших миокардиальных волокон начинает образовываться соединительная ткань. Внутренний слой оболочки органа утолщен, на нем скопления незрелых ретикулярных клеток, фибробласт, коллагеновые и эластические волокна.
- Хроническая постинфарктная аневризма левого желудочка развивается после 2 месяцев. Представляет собой фиброзный мешок с истощенной стенкой. Внутри разрастания часто расположены рыхлые пристеночные тромбы, размер которых варьируется и они могут занимать весь объем мешка.
Основными причинами возникновения любой формы постинфарктной аневризмы принято считать:
- нарушения работы сердечнососудистой системы в связи с возрастными изменениями;
- повышенное содержание холестерина в крови из-за неправильного питания;
- ожирение, гипертония, сахарный диабет и ряд других патологий являются провоцирующим фактором;
- повышение внутрижелудочкового давления и нарушения, вызванные уплотнением рубца;
- двигательная или другая форма физической активности в острой и подострой стадии инфаркта миокарда.
Мотивировать образование аневризмы может неконтролируемый прием алкогольных напитков, курение и употребление наркосодержащих веществ.
Симптоматика заболевания напрямую зависит от формы и длительности его протекания.
| Тип | Симптомы |
|---|---|
| Острая | Отек легких, слабость с отдышкой, усиленная потливость и длительная лихорадка, сбои сердечного ритма. |
| Подострая | При движении испарина, слабость, отдышка, учащенное сердцебиение с ощущением перебоев в работе органа. Прогрессирование симптомов, характерных для сердечной недостаточности. |
| Хроническая | Обморочные и полуобморочные состояния, стенокардия, отечность с набуханием вен на шее и одышкой, возникновение гидроторакса, патологическое увеличение печени, возможны перикардиты, спаечный процесс. |
Особую опасность представляет хроническая форма заболевания, так как она чревата развитием гангрены конечностей, инсультами, почечным инфарктом и рядом других патологий, представляющих угрозу для жизни пациента.
Основным признаком появления и развития постинфарктной аневризмы является усиливающаяся при каждом сокращении сердца прекордиальная пульсация, которую хорошо заметно на передней стенке грудной клетки. Диагностирование строится:
- на основании жалоб больного на боли в области сердца и за грудиной, перебои в ритме биения;
- при сборе анамнеза информация о перенесенном инфаркте и коронарной недостаточности указывают на необходимость проведения дополнительных исследований на предмет обнаружения постинфарктной аневризмы;
- ЭКГ при патологии дает стойкий подъем интервала S-T, а так же отрицательного зубца T и наличие QS;
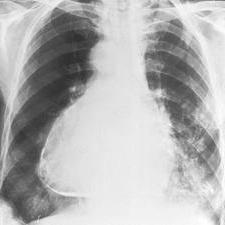
- на рентгенограмме становится явно видно выпячивание деформированной части органа.
Если в полости имеется тромб, то пульсация будет заметно понижена.
Сделать точные выводы, необходимые для выбора методов лечения, помогает КГР и вентрикулография:
- уточняется локализация измененных тканей;
- есть возможность дать оценку коронарного русла;
- устанавливаются точные размеры и формы аневризмы;
- оценивается сократительная способность уцелевшего миокарда левого желудочка.
Сбор данных важен, так как на основании их принимается решение о необходимости хирургического вмешательства.
Постинфарктная аневризма сердца показания к операции имеет при любой форме развития, так как после ее образования продолжительность жизни составляет не более 2-3 лет. Причиной прекращения работы сердца становится сердечная недостаточность, эмболия в артериальной системе или повторный инфаркт миокарда.
- Видоизмененная ткань при операции удаляется не полностью. Для сохранения полости левого желудочка она оставляется по 15 мм с каждой стороны.
- Аневризму межжелудочковой перегородки корректируют путем ее укорочения либо компенсацией с применением методов пластики.
- При развитии недостаточности левого предсердно-желудочкового клапана проводится его удаление и замена протезом.
Показанием к срочному вмешательству являются:
- опасность разрыва травмированной сердечной стенки;
- многочисленные тромбы, образовавшиеся внутри аневризмы;
- частично скрытое перфорирование аневризматического мешка;
- появление желудочковой тахикардии и других явных признаков прогрессирования нарушений сердечной деятельности.
При посттравматической и ложной форме заболевания выполняется ушивание сердечной мышцы с удалением места деформации.
Необходимо учитывать, что после иссечения и пластики аневризмы может произойти повторный инфаркт миокарда. Но при оставлении болезни без лечения шансы на выздоровление сводятся к нулю.
Без хирургического лечения прогнозировать дальнейшее течение заболевания и степень влияния его на здоровье пациента полностью бессмысленно.
Плоские неосложненные формы патологии позволяют проводить сопутствующее терапевтическое лечение. Так, применяя при постинфарктной аневризме Варфарин, можно:
- снизить риск повторного инфаркта;
- уменьшить развитие тромбоза;
- улучшить показатели работы сердца еще по ряду факторов.
Однако препарат имеет строгую дозировку и поэтому может применяться только по назначению лечащего врача.
Мешковидные и грибовидные постинфарктные аневризмы почти всегда осложнены образованием тромбов и поэтому не могут давать положительных прогностических данных.
Единственной приемлемой формой профилактики развития заболевания служит своевременное диагностирование, быстрая госпитализация и правильное лечение у больного инфаркта миокарда. Реабилитационный период должен включать постепенное наращивание двигательной активности, постоянный контроль за тромбообразованием в постинфарктный период, контроль ритма сердечных сокращений.
источник
Одно из тяжелых осложнений инфаркта – аневризматическое выпячивание стенки в зоне некроза. Признаками его развития являются: недостаточность кровообращения, тромбоэмболия, аритмия. Для лечения необходима операция, без нее больные погибают от сердечной декомпенсации или разрыва аневризмы.
У большинства пациентов предшествующим состоянием был обширный инфаркт миокарда с трансмуральным (все слои стенки) некрозом. При этом аневризма может возникнуть как в первую неделю, так и через несколько месяцев от начала болезни.
Самое частое место формирования – верхушка и передняя стенка левого желудочка. Разрушенная мышечная ткань обладает высокой растяжимостью и в период сокращения сердца выпячивается наружу или в просвет правого желудочка, если образование находится на перегородке.
К факторам, которые могут провоцировать развитие аневризмы после инфаркта, относятся:
- пожилой возраст пациентов, сахарный диабет, истощение (нарушается процесс рубцевания зоны инфаркта);
- ранняя физическая активность;
- тяжелая форма артериальной гипертензии;
- возникновение повторного инфаркта, особенно у больных с кардиомиопатией, дистрофией миокарда, кардиосклерозом;
- позднее начало лечения заболевания;
- атипичные, в том числе и безболевые формы;
- отсутствие коллатерального (обходного пути) кровотока при впервые возникшем тяжелом приступе стенокардии.
А здесь подробнее об осложнениях инфаркта миокарда.
При сокращении желудочка кровь частично переходит в аневризматический мешок, что снижает величину сердечного выброса и способствует проявлениям сердечной и сосудистой недостаточности:
- одышка,
- резкая слабость,
- головокружение,
- обморочные состояния,
- кашель,
- приступы удушья,
- отеки на ногах,
- увеличение печени.
Из-за турбулентного движения крови в полости аневризмы образуются сгустки крови – пристеночные тромбы. Они могут разрушаться, а их части передвигаются по артериальному руслу. Такие эмболы приводят к закупорке сосудов конечностей, головного мозга, легких, кишечника, почек, вызывая гангрену, инфаркты органов (в том числе и вторичный некроз миокарда), инсульт.
Если аневризма возникает в острый или подострый период болезни, то ее стенка содержит еще недостаточно сформированную рубцовую ткань, что может привести к разрыву сердца, кровоизлиянию в перикард, тампонаде и остановке сердечных сокращений.
Формирование выпячивания стенки сердца относится к неблагоприятному варианту течения инфаркта миокарда. Если вовремя не провести операцию, то в течение 2 — 3 лет от момента образования аневризмы больные погибают от острой коронарной или сердечной декомпенсации, тромбоза. К факторам, которые повышают вероятность летального исхода, относятся:
- прогрессирование недостаточности кровообращения;
- возобновление приступов стенокардии на фоне лечения;
- относительная недостаточность митрального клапана из-за расширения полости левого желудочка;
- тяжелые виды нарушения ритма;
- большой размер аневризмы, мешковидная или грибовидная форма.
Более доброкачественное течение у бессимптомных и небольших образований, сформированных после 2 месяцев от начала инфаркта.
Смотрите на видео об аневризме и опасности, которую она несет:
По месту расположения аневризмы могут быть:
- желудочковыми (преимущественно левого);
- септальными (межжелудочковая перегородка).
Встречаются опасные образования в форме мешка, гриба и многослойные (одна внутри другой), более прочными считаются плоские, имеющие изнутри конфигурацию чаши. Структурой стенки аневризмы бывает мышечные или соединительнотканные волокна, чаще они сочетаются в различных пропорциях.
Истинные аневризмы желудочка имеет в составе все три слоя миокарда, а ложные появляются при разрыве мышечной ткани, их ограничивает только эпикард и околосердечная сумка, вероятность разрыва в таком случае чрезвычайно высокая.
При инфаркте может появиться и функциональный вариант – жизнеспособные клетки находятся в спящем состоянии (зона гибернирующего сердца), они не сокращаются в фазу систолы, а выпячиваются под давлением крови. После восстановления притока крови в эту область аневризма исчезает.
К признакам, которые можно обнаружить при обследовании больного, относятся:
- осмотр и пальпация – асинхронная пульсация в 3 — 4 межреберном промежутке вне зоны верхушечного толчка (симптом коромысла);
- аускультация – шум на протяжении систолы при относительной митральной недостаточности;
- рентгенография – патологическое выпячивание дуги левого желудочка, расширение границ сердца, легочной застой;
- ЭКГ – «застывшие» симптомы инфаркта, нет улучшения (восстановления ST);
- ЭхоКГ – определяется аневризма, можно исследовать ее размеры, наличие сгустков крови, а также гемодинамические показатели – фракцию выброса, конечные объемы желудочка в систолу и диастолу;
- коронарография – закупорка венечной артерии и изменения кровотока за ней;
- вентрикулография и МРТ – помогают установить размер, форму, расположение, изменение сердечной мышцы вне аневризмы, тромбоз полости желудочка;
- ПЭТ сердца (позитронная эмиссионная томография) – нужна для определения «спящего» миокарда в смежных участках;
- ЭФИ (электрофизиологическое исследование) показано при наличии аритмии.
Медикаментозное лечение может быть назначено в исключительных случаях – при противопоказаниях к операции (опасность наркоза, погибшие клетки вокруг аневризмы, тяжелая митральная недостаточность), бессимптомной аневризме небольшого размера. Во всех остальных ситуациях показано хирургическое вмешательство.
Больного подключают к аппарату искусственного дыхания, после вскрытия мешка аневризмы ее очищают от тромбов, иссекают, оставляя около 2 см рубцовой ткани, затем сшивают линейным или кисетным швом. Для больших образований поверх швов накладывают заплату. Вместе с удалением аневризмы иногда проводится шунтирование коронарных артерий для восстановления кровотока в зоне инфаркта, операции на клапанах сердца.
Проведенная операция существенно снижает смертность больных. Но так как она проводится на открытом сердце, а объем желудочка после ушивания уменьшается, то в послеоперационном периоде возможны осложнения:
- сердечная и дыхательная недостаточность;
- низкий сердечный выброс (гипотония, обморок, коллапс);
- аритмия;
- кровотечение;
- инсульт;
- почечная недостаточность.
Пятилетняя выживаемость после резекции аневризмы составляет около 75%, а десятилетняя – примерно 35%. У большинства пациентов причиной смерти становится повторное острое нарушение коронарного кровообращения.
А здесь подробнее о повторном инфаркте миокарда.
Постинфарктная аневризма образуется при обширных и трансмуральных поражениях миокарда. Чаще всего бывает в левом желудочке. Приводит к сердечной недостаточности, тромбозу сосудов, нарушениям ритма. При появлении в острый и подострый период имеет непрочную стенку, что угрожает разрывом сердца.
Наиболее точный диагноз ставится при помощи ЭхоКГ, вентрикулографии и МРТ. Для лечения нужна операция – иссечение тканей с последующим восстановлением целостности стенок желудочка.
Если выявлена аневризма сердца, операция может стать единственным шансом на спасение, только с ней прогноз улучшается. Жить без операции в целом можно, но только в том случае, если аневризма, например, левого желудочка очень маленькая.
Если образовалась аневризма сердца, симптомы могут быть схожи с обычной сердечной недостаточностью. Причины — инфаркт, истощение стенок, изменения сосудов. Опасное последствие — разрыв. Чем раньше проведена диагностика, тем больше шансов.
Случиться повторный инфаркт миокарда может в течение месяца (тогда его называют рецидивирующий), а также 5 лет и более. Чтобы максимально предотвратить последствия, важно знать симптомы и проводить профилактику. Прогноз не самый оптимистичный для больных.
Констатируют трансмуральный инфаркт зачастую на ЭКГ. Причины острого, передней, нижней, задней стенки миокарда кроются в факторах риска. Лечение требуется начать незамедлительно, ведь чем оно позже предоставлено, тем хуже прогноз.
Возникает постинфарктный кардиосклероз довольно часто. Он может быть с аневризмой, ИБС. Распознание симптомов и своевременная диагностика помогут спасти жизнь, а ЭКГ признаки — установить правильный диагноз. Лечение длительное, требуется реабилитация, могут быть и осложнения, вплоть до инвалидности.
Если воспалилась аневризма аорты, операция может спасти жизнь. Пациенту стоит знать, какие проводят операции, важные показатели к хирургическому вмешательству, реабилитация и прогноз после, последствия вмешательства. А также об образе жизни и питании после. Какие есть виды замены аорты, протезирование аневризмы и осложнения после. Сколько идет эндоваскулярное протезирование.
Образоваться пристеночный тромб может в сердце (в верхушке, левом и правом желудочке), аорте. Опасность возникает в момент отрыва от постоянного места дислокации. Тяжелый случай — аневризма аорты с пристеночным тромбом. Лечение только хирургическое.
В зависимости от времени наступления, а также сложности различают такие осложнения инфаркта миокарда: ранние, поздние, острого периода, частые. Их лечение непростое. Чтобы их избежать, поможет профилактика осложнений.
Возникнуть аневризма сердца у детей (МПП, межжелудочковой перегородки) может по причине нарушений, интоксикаций во время беременности. Признаки могут быть выявлены при регулярном обследовании. Лечение может заключаться приеме лекарств или операции.
источник
Аневризма сердца – истончение и выбухание участка миокарда сердечной камеры. Аневризма сердца может проявляться одышкой, сердцебиением, ортопноэ, приступами сердечной астмы, тяжелыми нарушениями сердечного ритма, тромбоэмболическими осложнениями. Основными методами диагностики аневризмы сердца служат ЭКГ, ЭхоКГ, рентген грудной клетки, вентрикулография, КТ, МРТ. Лечение аневризмы сердца предусматривает иссечение аневризматического мешка с ушиванием дефекта сердечной мышцы.
Аневризма сердца – ограниченное выпячивание истонченной стенки миокарда, сопровождающееся резким снижением или полным исчезновением сократительной способности патологически измененного участка миокарда. В кардиологии аневризма сердца выявляется у 10-35% пациентов, перенесших инфаркт миокарда; 68% острых или хронических аневризм сердца диагностируется у мужчин в возрасте от 40 до 70 лет. Чаще всего аневризма сердца формируется в стенке левого желудочка, реже – в области межжелудочковой перегородки или правого желудочка. Величина аневризмы сердца колеблется от 1 до 18-20 см в диаметре. Нарушение сократительной способности миокарда в области аневризмы сердца включает акинезиею (отсутствие сократительной активности) и дискинезию (выбухание стенки аневризмы в систолу и ее западение — в диастолу).
В 95-97% случаев причиной аневризмы сердца служит обширный трансмуральный инфаркт миокарда, преимущественно левого желудочка. Подавляющее большинство аневризм локализуется в области передне-боковой стенки и верхушки левого желудочка сердца; около 1% — в области правого предсердия и желудочка, межжелудочковой перегородки и задней стенки левого желудочка.
Массивный инфаркт миокарда вызывает разрушение структур мышечной стенки сердца. Под действием силы внутрисердечного давления некротизированная стенка сердца растягивается и истончается. Существенная роль в формировании аневризмы принадлежит факторам, способствующим увеличению нагрузки на сердце и внутрижелудочкового давления – раннему вставанию, артериальной гипертензии, тахикардии, повторным инфарктам, прогрессирующей сердечной недостаточности. Развитие хронической аневризмы сердца этиологически и патогенетически связано с постинфарктым кардиосклерозом. В этом случае под действием давления крови происходит выпячивание стенки сердца в области соединительнотканного рубца.
Гораздо реже, чем постинфарктные аневризмы сердца, встречаются врожденные, травматические и инфекционные аневризмы. Травматические аневризмы возникают вследствие закрытых или открытых травм сердца. К этой же группе можно отнести послеоперационные аневризмы, часто возникающие после операций по коррекции врожденных пороков сердца (тетрады Фалло, стеноза легочного ствола и др.).
Аневризмы сердца, обусловленные инфекционными процессами (сифилисом, бактериальным эндокардитом, туберкулезом, ревматизмом), весьма редки.
По времени возникновения различают острую, подострую и хроническую аневризму сердца. Острая аневризма сердца формируется в период от 1 до 2-х недель от инфаркта миокарда, подострая – в течение 3-8 недель, хроническая – свыше 8 недель.
В остром периоде стенка аневризмы представлена некротизированным участком миокарда, который под действием внутрижелудочкового давления выбухает кнаружи или в полость желудочка (при локализации аневризмы в области межжелудочковой перегородки).
Стенка подострой аневризмы сердца образована утолщенным эндокардом со скоплением фибробластов и гистиоцитов, вновь образованных ретикулярных, коллагеновых и эластических волокон; на месте разрушенных миокардиальных волокон обнаруживаются соединительные элементы различной степени зрелости.
Хроническая аневризма сердца представляет собой фиброзный мешок, микроскопически состоящий из трех слоев: эндокардиального, интрамурального и эпикардиального. В эндокарде стенки хронической аневризмы сердца имеются разрастания фиброзной и гиалинизированной ткани. Стенка хронической аневризмы сердца истончена, иногда ее толщина не превышает 2 мм. В полости хронической аневризмы сердца часто обнаруживается пристеночный тромб различного размера, который может выстилать только внутреннюю поверхность аневризматического мешка или занимать почти весь его объем. Рыхлые пристеночные тромбы легко подвергаются фрагментации и являются потенциальным источником риска тромбоэмболических осложнений.
Встречаются аневризмы сердца трех видов: мышечные, фиброзные и фиброзно-мышечные. Обычно аневризма сердца является одиночной, хотя может обнаруживаться 2-3 аневризмы одновременно. Аневризмы сердца могут быть истинными (представлены тремя слоями), ложными (формируются в результате разрыва стенки миокарда и ограничены перикардиальными сращениями) и функциональными (образованы участком жизнеспособного миокарда с низкой сократимостью, выбухающего в систолу желудочков).
С учетом глубины и обширности поражения истинная аневризма сердца может быть плоской (диффузной), мешковидной, грибовидной и в виде «аневризмы в аневризме». У диффузной аневризмы контур наружного выпячивания плоский, пологий, а со стороны полости сердца определяется углубление в форме чаши. Мешковидная аневризма сердца имеет округлую выпуклую стенку и широкое основание. Грибовидную аневризму характеризует наличие большого выпячивания со сравнительно узкой шейкой. Понятием «аневризма в аневризме» обозначается дефект, состоящий из нескольких выпячиваний, заключенных одно в другое: такие аневризмы сердца имеют резко истонченные стенки и наиболее склонны к разрыву. При обследовании чаще выявляются диффузные аневризмы сердца, реже — мешковидные и еще реже — грибовидные и «аневризмы в аневризме».
Клинические проявления острой аневризмы сердца характеризуются слабостью, одышкой с эпизодами сердечной астмы и отека легких, длительной лихорадкой, повышенной потливостью, тахикардией, нарушениями сердечного ритма (брадикардией и тахикардией, экстрасистолией, фибрилляцией предсердий и желудочков, блокадами). При подострой аневризме сердца быстро прогрессируют симптомы недостаточности кровообращения.
Клинике хронической аневризмы сердца соответствуют ярко выраженные признаки сердечной недостаточности: одышка, синкопальные состояния, стенокардия покоя и напряжения, ощущение перебоев в работе сердца; в поздней стадии – набухание вен шеи, отеки, гидроторакс, гепатомегалия, асцит. При хронической аневризме сердца может развиваться фиброзный перикардит, обусловливающий развитие спаечного процесса в грудной полости.
Тромбоэмболический синдром при хронической аневризме сердца представлен острой окклюзией сосудов конечностей (чаще подвздошного и бедренно-подколенного сегментов), плечеголовного ствола, артерий мозга, почек, легких, кишечника. Потенциально опасными осложнениями хронической аневризмы сердца могут стать гангрена конечности, инсульт, инфаркт почки, ТЭЛА, окклюзия мезентериальных сосудов, повторный инфаркт миокарда.
Разрыв хронической аневризмы сердца происходит сравнительно редко. Разрыв острой аневризмы сердца обычно случается на 2-9 день после инфаркта миокарда и является фатальным. Клинически разрыв аневризмы сердца проявляется внезапным началом: резкой бледностью, которая быстро сменяется цианотичностью кожных покровов, холодным потом, переполнением вен шеи кровью (свидетельство тампонады сердца), утратой сознания, похолоданием конечностей. Дыхание становится шумным, хриплым, поверхностным, редким. Обычно смерть наступает мгновенно.
Патогномоничным признаком аневризмы сердца является патологическая прекордиальная пульсация, обнаруживаемая на передней стенки грудной клетки и усиливающаяся при каждом сердечном сокращении.
На ЭКГ при аневризме сердца регистрируются признаки трансмурального инфаркта миокарда, которые, однако, не изменяются стадийно, а сохраняют «застывший» характер на протяжении длительного времени. ЭхоКГ позволяет визуализировать полость аневризмы, измерить ее размеры, оценить конфигурацию и диагностировать тромбоз полости желудочка. С помощью стресс-ЭхоКГ и ПЭТ сердца выявляется жизнеспособность миокарда в зоне хронической аневризмы сердца.
Рентгенография органов грудной клетки обнаруживает кардиомегалию, явления застоя в малом круге кровообращения. Рентгеноконтрастная вентрикулография, МРТ и МСКТ сердца являются высокоспецифичными методами топической диагностики аневризмы, определения ее размеров, выявления тромбоза ее полости.
По показаниям больным с аневризмой сердца выполняется зондирование полостей сердца, коронарография, ЭФИ. Аневризму сердца необходимо дифференцировать от целомической кисты перикарда, митрального порока сердца, опухолей средостения.
В предоперационном периоде больным с аневризмой сердца назначаются сердечные гликозиды, антикоагулянты (гепарин подкожно), гипотензивные средства, кислородотерапия, оксигенобаротерапия. Хирургическое лечение острой и подострой аневризмы сердца показано в связи с быстрым прогрессированием сердечной недостаточности и угрозой разрыва аневризматического мешка. При хронической аневризме сердца операция производится для предотвращения риска тромбоэмболических осложнений и с целью реваскуляризации миокарда.
В качестве паллиативного вмешательства прибегают к укреплению стенки аневризмы с помощью полимерных материалов. К радикальным операциям относятся резекция аневризмы желудочка или предсердия (при необходимости – с последующей реконструкцией стенки миокарда заплатой), септопластика по Кули (при аневризме межжелудочковой перегородки).
При ложной или посттравматической аневризме сердца производится ушивание сердечной стенки. При необходимости дополнительного реваскуляризирующего вмешательства одномоментно выполняют резекцию аневризмы в сочетании с АКШ. После резекции и пластики аневризмы сердца возможно развитие синдрома малого выброса, повторного инфаркта миокарда, аритмий (пароксизмальной тахикардии, мерцательной аритмии), несостоятельности швов и кровотечения, дыхательной недостаточности, почечной недостаточности, тромбоэмболии сосудов головного мозга.
Без хирургического лечения течение аневризмы сердца неблагоприятное: большинство пациентов с постинфарктными аневризмами погибают в течение 2-3 лет после развития заболевания. Относительно доброкачественно протекают неосложненные плоские хронические аневризмы сердца; худший прогноз имеют мешковидные и грибовидные аневризмы, часто осложняющиеся внутрисердечным тромбозом. Присоединение сердечной недостаточности является неблагоприятным прогностическим признаком.
Профилактика аневризмы сердца и ее осложнений заключается в своевременной диагностике инфаркта миокарда, адекватном лечении и реабилитации больных, постепенном расширении двигательного режима, контроле за нарушением ритма и тромбообразованием.
источник
Боковая стенка левого желудочка истончена, плотная, белесоватая (рубец), выбухает (аневризма). В верхней части аневризмы тромб диаметром 3 см.
Мелкоочаговый кардиосклероз.
В толще разрезанного миокарда видны белесоватого цвета блестящие очаги.
Рубцы после инфаркта почки.
Под капсулой почки видны западающие очаги размерами от 0,5 до 2,5 см в диаметре.
Тромбоэмболия сосудов легкого с развитием геморрагического инфаркта.
На разрезе легкого в сосудах видны красные обтурационные тромбы. В нижней части легкого имеется очаг темно-красного цвета, тусклый, выходящий под плевру.
Творожистый некроз лимфоузлов брыжейки при туберкулезе.
Лимфоузлы брыжейки увеличены, с очагами некроза серовато-белого цвета.
Творожистый некроз в легком при туберкулезе.
Очаги творожистого (казеозного) некроза в легком при туберкулезе серовато-белого цвета. Очаги черного цвета в легком – антракоз — отложение угольной пыли.
Муляж. Влажная гангрена щеки — нома.
На коже щеки виден крупный очаг некроза черного цвета, с распадом мягких тканей и обнажением зубов.
Муляж. Рак-язва губы.
Изучить микропрепараты:
Кариолизис. Кариорексис. Кариопикноз.
В очагах творожистого некроза в легком при туберкулезе на фоне гомогенных участков видны отдельные клетки с измененными ядрами: кариорексис — разрыв ядра с освобождением хроматина в виде отдельных зерен; кариопикноз — сморщивание ядер в виде темных комочков хроматина различной формы: кариолизис — растворение ядра, клетка без ядра или с его “тенью”.
| Указать на рисунке: 1 — нормальную клетку, 2 — кариолизис, 3 — кариопикноз, 4 -кариорексис. |
Инфаркт миокарда с пристеночным тромбом.
В зоне инфаркта мышечные волокна лишены ядер — кариолизис. Между некротизированными мышечными волокнами и на границе с нормальной мышцей сердца видно скопление лейкоцитов — демаркационное воспаление. К эндокарду прилежит красный тромб.
| Указать на рисунке: 1 — некроз мышечных волокон, 2 — скопление лейкоцитов, 3 — неизмененные сердечные волокна, 4 — тромб. |
Некротический нефроз.
Эпителий некоторых извитых канальцев почки набухший, имеет вид гомогенных эозинофильных масс без ядер, в результате постепенного растворения их — кариолизис. Просветы канальцев заполнены детритом. Клубочки и прямые канальцы сохраняют свою структуру.
| Указать на рисунке: 1 — некроз эпителия извитых канальцев, 2 — клубочки, 3 — прямые канальцы. |
НАРУШЕНИЯ КРОВООБРАЩЕНИЯ
Нарушение кровообращения бывает двух типов:
I. Нарушения, связанные с изменением объема циркулирующей крови. Они включают: гиперемию, венозный застой, геморрагии и шок.
II. Нарушения, связанные с наличием препятствий для прохождения крови. К ним относятся: тромбоз, эмболия, ишемия и инфаркт.
I. НАРУШЕНИЯ, СВЯЗАННЫЕ С ИЗМЕНЕНИЕМ ОБЪЕМА ЦИРКУЛИРУЮЩЕЙ КРОВИ.
Гиперемия и венозный застой — термины, используемые для описания увеличения объема крови в пределах расширенного сосудистого русла, органа или ткани; увеличенный объем проходящей артериальной крови и расширение артериол, носит название –активной гиперемии, при нарушении венозного оттока аналогичный процесс называется пассивной гиперемией. Если это состояние развивается быстро, это называется острым, в то время как более длительный и постепенный процесс называется хроническим.
Активная гиперемия — расширение артерий, артериол и капилляров происходит за счет симпатический нервной системы или за счет выброса вазоактивных веществ. При этом ткань или орган становятся розового, или красного цвета, появляется — эритема.
Пассивная гиперемия при венозном застое — расширение вен и капилляров из-за повреждаемого венозного дренажа приводит к пассивной гиперемии или венозному застою. Венозный застой может быть острым и хроническим. При этом ткань или орган становятся цианотичными из-за накопления венозной крови (цианоз). Нарушения венозного оттока могу быть местными или системными.
Местный венозный застой наблюдается при наличии препятствия току крови для одного органа или его части. Пример: портальная венозная преграда при циррозе печени, при этом раскрываются кава — портальные анастомозы, и формируют несколько путей коллатеральной гиперемии:
1) порто-люмбальный путь приводит к раскрытию геморроидальных сосудов прямой кишки (кровь из воротной вены по нижней брыжеечной поступает в вены прямой кишки, оттуда в систему нижней полой вены);
2) порто-абдоминальный путь приводит к развитию «головы медузы» в области пупка из-за раскрытия здесь вен в условиях притока к ним крови по параумбиликальным венам далее по грудной и эпигастральной венам кровь поступает в системы верхней и нижней полых вен;
3) порто-эзофагальный путь приводит к полнокровию вен пищевода и возможному кровотечению из них.
Системный (общий) венозный застой — например, при патологии левых и правых отделов сердца, при болезнях легких, связанных с разрастанием в легких соединительной ткани или эмфиземой и т.д. Кровь накапливается до поврежденного отдела сердца. При патологии левых отделов сердца — за счет стеноза аортального отверстия или недостаточности левого желудочка — при инфаркте миокарда. Это приводит к застою крови в легких. При патологии правых отделов сердца — из-за стеноза отверстий или легочной гипертензии, отмечается системный венозный застой в большом круге кровообращения.
Последствия венозной гиперемии: индурация (уплотнение органов) от разрастания соединительной ткани, т.е. склероз, тромбоз вен, нарушение лимфообращения, отеки, развитие трофических язв.
Анасарка – общий отек, асцит – скопление не воспалительной жидкости (транссудата) в брюшной полости, гидроперикард — скопление транссудата в полости перикарда в количестве более 30 мл.
Морфология системного венозного застоя.
ЛЕГКИЕ. Хронический венозный застой в легких отмечается при патологии левых отделов сердца, особенно при митральном стенозе ревматического генеза, при этом повышается венозное давление в легких.
Макроскопически: вес легких увеличен, они имеют твердую консистенцию. На разрезе темно-коричневого цвета, этот процесс носит название — бурая индурация легких.
Бурая индурация легких происходит из-за отложения гемосидерина и фиброза.
ПЕЧЕНЬ. Хронический венозный застой в печени происходит при нарушении деятельности правых отделов сердца и из-за окклюзии нижней полой вены и печеночных вен.
Мускатная гиперемия и мускатный цирроз печени могут возникать при тромбофлебите печеночных вен, это характерно для болезни Бадда – Киари.
Макроскопически печень увеличена и капсула ее напряженна. На разрезе печень пестрого цвета и напоминает мускатный орех из-за красного и желтого цвета, соответственно, в переполненном центре дольки и отложения жира по ее периферии.
Микроскопические изменения. Центральные вены, как и смежные синусоидные капилляры, расширены и заполнены кровью. Расположенные центрально гепатоциты повреждаются, и, в конечном счете, отмечается центролобулярный геморрагический некроз. Хронический процесс является мускатным или сердечным циррозом.
СЕЛЕЗЕНКА. Орган переполнен кровью и цианотичен, на разрезе кровоточит.
Микроскопически, красная пульпа с застойными явлениями и расширением синусоидных капилляров, отмечаются области старых и свежих геморрагий. Эти геморрагии могут прорастать соединительной тканью и формировать Гамма-Ганди тела или сидерофиброзные узелки.
Хронический венозный застой в ПОЧКЕ. Макроскопически, почки слегка увеличены, переполнены кровью – цианотическая индурация почек.
Геморрагии — это кровотечение из кровеносного сосуда. Кровотечение может осуществляться во внешнюю среду или внутренние серозные полости (например, гемоторакс, гемоперитонеум, гемоперикардиум) или в полости внутренних органов. Проникновение крови в ткани с образованием полости носит название – гематома. Геморрагическая инфильтрация – равномерное пропитывание кровью ткани. Проникновение больших объемов крови в кожу и слизистые оболочки носит название экхимозы. Пурпурой называются небольших размеров кровоизлияния в коже и слизистые оболочки до 1 см в диаметре, петехии – это очень небольшие размером с булавочную головку геморрагии. Микроскопическое проникновение эритроцитов в ткани происходит после гиперемии или застоя и называется диапедезным.
Шок — определяется как клиническое состояние циркуляторного коллапса, характеризующегося как:
острое уменьшение объема реально циркулирующей крови; и наличия неадекватной перфузии клеток и тканей.
ЭТИОЛОГИЯ И КЛАССИФИКАЦИЯ
1. Гиповолемический шок. Уменьшение объема крови приводит к гиповолемическому шоку. Причинами гиповолемии являются следующие:
а) Сильное кровотечение (внешнее или внутреннее) например, при травме, хирургической операции.
б) Потере жидкости, например, при обширных ожогах, повреждениях, сопровождающихся размозжением тканей конечностей, постоянной диарей приводящей к дегидратации.
2. Септический шок. Сильное бактериальное инфицирование или септицемия приводит к септическому шоку.
3. Кардиогенный шок. Острые циркуляторные нарушения с резким падением сердечного выброса из-за острой сердечно сосудистой недостаточности или без реального уменьшения объема циркулирующей крови (нормоволемия) приводит к кардиогенному шоку.
МОРФОЛОГИЧЕСКИЕ ПРОЯВЛЕНИЯ ШОКА
Морфологические изменения при шоке происходят из-за гипоксии и приводят к обратимым и необратимым повреждениям — некрозам в различных органах. Основными органами при этом являются мозг, сердце, легкие и почки. Морфологические изменения также выявляются в надпочечниках, желудочно-кишечном тракте, печени и других органах.
1. Гипоксическая энцефалопатия. В областях мозга, получающих кровь от наиболее удаленных ветвей церебральных артерий, отмечается гибель нейронов и рост клеток глии.
2. Сердце при шоке. Отмечаются два типа морфологических изменений в сердечной мышце при всех типах шока:
а) Геморрагии и некроз. Под эпикардом и в субэндокардиальной области сердечной мышцы отмечаются зоны ишемии и инфаркты.
б) Зональные поражения кардиомиоцитов — представлены непрозрачными эозинофильными полосками сокращения в области вставочных дисков.
3. Легкое при шоке. В легких из-за двойного кровоснабжения не отмечается морфологических изменений при гипоповолемическом шоке, но при септическом шоке морфологические изменения в легких достаточно выражены и называются «шоковое легкое».
4. Шоковая почка. Почечная ишемия после системной гипотонии является причиной изменений почек при шоке, которая приводит к анурии и смерти. Юкстамедуллярный шунт в почках – это бледность (малокровие) коркового слоя и венозная гиперемия мозгового.
5. Надпочечники при шоке. При сильном шоковом состоянии в надпочечниках может происходить кровоизлияние.
6. Геморрагические поражения желудочно-кишечного тракта.
Стаз. Различают гемостаз и лимфостаз. Гемостазом называют остановку крови в капиллярах и венулах с расширением просвета, слипанием эритроцитов в гомогенные столбики (последнее отличает стаз от гиперемии).
Кратковременная остановка крови обратима, длительная приводит к стойкому стазу, образованию гиалиновых тромбов, повышению проницаемости капилляров и венул, отеку, кровотечениям.
Сладж – склеивание эритроцитов в сосудах различного калибра. Сладж называют также внутрисосудистой агрегацией эритроцитов. Макроскопически при этом в артериях и венах можно обнаружить «замазкообразную» густую кровь. В отличие от тромбов эта масса не содержит фибрина. Сладж наблюдается при различных инфекциях, интоксикациях, ведущих к изменению зарядов эритроцитов.
Лимфостазом называют застой лимфы, возникающий вследствие механической, резорбционной или динамической недостаточности лимфообращения.
Изучить макропрепараты:
Мускатная печень.
Печень несколько увеличена, плотная. Паренхима на разрезе пестрая, имеет вид мускатного ореха, с чередованием темно-красных и серо-желтых участков.
источник
Острая аневризма левого желудочка может вызвать тяжелую сердечную недостаточность и даже разрыв миокарда. Аневризмы чаще всего развиваются при инфарктах, распространяющихся на верхушку левого желудочка, особенно трансмуральных. Острые аневризмы во время систолы выбухают, и на это выбухание уходит работа сокращения непораженного миокарда. При этом эффективность работы желудочка снижается. Хронические аневризмы
Это аневризмы, сохраняющиеся более 6 нед. после инфаркта миокарда. Они менее податливы и обычно не выбухают в систолу. Хронические аневризмы развиваются у 10-30% больных после инфаркта миокарда, особенно переднего. Хронические аневризмы левого желудочка могут вызывать сердечную недостаточность, желудочковые аритмии и тромбоэмоблию артерий большого круга кровообращения, но часто протекают бессимптомно.
Постоянно сокращаясь, сердце перекачивает кровь, а в аневризме она застаивается и превращается в тромб. Это подвергает человека постоянному риску тромбоза сосудов головного мозга и нижних конечностей.
Наблюдается прогрессирующая недостаточность кровообращения по левожелудочковому типу (нарастающая одышка, цианоз, развитие застойных явлений в малом круге кровообращения, проявления приступов сердечной астмы, переходящих в отёк лёгких).Наличие аневризмы в сердце, замедляет процесс рубцевания (заживления) сердца и нарушает образование прочного рубца на месте инфаркта. Происходит дальнейшее развитие тотальной сердечной недостаточности с малой эффективностью лекарственного лечения. Развиваются аритмии (экстрасистолия, желудочковая тахикардия и др.). Наблюдается прекардиальная пульсация в Ⅲ-Ⅳ межреберье кнаружи от среднеключичной линии, имеющая разлитой, «сотрясающий» характер.
Осмотр- видимая пульсация грудной стенки и верхней части живота. Аневризма верхушки левого желудочка сердца может прощупываться в виде пульсации между 3 и 4 ребром слева от грудины
Аневризма сердца препятствует улучшению и кардиограмма имеет «застывший» вид и соответствует первой неделе инфаркта миокарда.. При рентгенографии грудной клетки можно обнаружить ограниченное выбухание контура сердца.
ЭхоКГ – лучший метод диагностики, позволяющий четко увидеть саму аневризму и уточнить ее локализацию.
Аневризму левого желудочка можно увидеть при МРТ.
• Назначение препаратов снижающих артериальное давление и препятствующих развитию аритмии.
1.Бета – адреноблокаторы При этом нужно следить за частотой пульса, чтобы он был не менее 55 – 60 ударов в минуту, если пульс будет меньше, необходимо уменьшить дозу препарата и проконсультироваться с врачом.Атенолол.Пропранолол.Соталол.
2. Противоаритмическая терапия
Амиодарон (кордарон) – наиболее часто используемый и хорошо зарекомендовавший себя препарат для лечения и профилактики практически всех видов аритмий. Он является препаратом выбора при аритмиях, у пациентов с инфарктом миокарда и сердечной недостаточностью.
Первые 2 недели после возникновения (или для профилактики) аритмии, кордарон применяют внутрь, для насыщения сердца, затем доза постепенно снижается и препарат отменяют.
Хирургическое лечение аневризмы сердца
• Прогрессирующий рост аневризмы сердца с развитием сердечной недостаточности.
• Развитие тяжелых нарушений ритма сердца (аритмий) плохо поддающихся медикаментозному лечению.
• Риск «выхода» тромба из аневризмы и угроза тромбоза.
• Повторные тромбоэмболии, если доказано, что их причиной является пристеночный тромб находящийся в области аневризмы сердца.
Оперативное лечение аневризмы сердца предусматривает иссечение (удаление) аневризмы с ушиванием (закрытием) дефекта сердечной мышцы.
Варфарин используют при пристеночном тромбозе. Начинают с в/в введения гепарина, поддерживая АЧТВ на уровне 50-65 с. Одновременно с этим дают варфарин и поддерживают МНО на уровне 2—3 в течение 3-6 мес.
Нужны ли антикоагулянты при больших аневризмах без пристеночного тромбоза, не ясно. Многие врачи назначают антикоагулянты в течение 6-12 нед. всем больным с большими передними инфарктами.
источник
Фрагмент брюшного отдела аорты, размерами 14*4см. серовато розового цвета. Интима сосуда деформирована. На поверхности имеются множественные атеросклеротические бляшки (различных размеров) в стадии липосклероза. На поверхности одной бляшки размерами 10*1см. имеются массивные тромботические наложения, плотной консистенции, шероховатой поверхности, плотно сращены со стенкой сосуда.
Причины: Повреждения аортальной стенки (после травмы), обменные: гиперлипидемия, холестеринемия, гемодинамические: артериальная гипертензия, гормональные: сахарный диабет, гипотиреоз, нервные нарушения, наследственные особенности, этническая предрасположенность.
Исходы: Атрофия внутренних органов с атрофией паренхимы: например почек, тромбов, тромбоэмболия с развитием инфаркта (например почек) и гангрены (кишечника и нижних конечностей). Образование аневризмы в месте изъязвления с возможностью артериального кровотечения при разъедании стенки, атрофия от сдавления окружающих тканей.
Аневризма (греч. anéurysma — расширение), ограниченное расширение кровеносного сосуда, выпячивание его стенки.
Данный макропрепарат — брюшная аорта. Форма органа сохранена, размеры не увеличены. Орган светло-серого цвета. На интимен видны образования темно-серого цвета диаметром 5 мм. с неровной поверхностью, а рядом с ним, образование такой же консистенции и цвета 3×1.5 см. Это образование расположено в месте разветвления аорты.
Описание патологических изменений.
Данные морфологические изменения могли развиться в резз’льтате нарушения жирового и белкового обмена, чему способствовали такие факторы как:
Нерегулируемый клеточный обмен холестерина приводит к образованию пенистых клеток и дальнейшему развитию атеросклеротических изменений, которые мы видим на интиме аорты: жировые пятна, фиброзные бляшки, образования тромботических наложений на месте изъязвления бляшки. В образовании тромботических наложений (образования темно-серого цвета плотной консистенции) принимают участки не только нарушения сосудистой стенки, но и с нарушением кровообращения, состава крови, сосудистой стенки, нарушение регуляции свертывающей, противосвертывающей и фибринолитической систем.
Особенно важным фактором в данном случае является нарушение кровообращения в виде завихрения тока крови у места бифуркации брюшной аорты. Это замедление тока крови и способствует наложению тромботических масс на изъязвленную интиму.
а) асептический аутолиз тромба;
б) организация; 2) неблагоприятный:
в) септическое расплавление;
г) обтурация просвета аорты.
Заключение: данные морфологические изменения свидетельствуют о дистрофических изменениях в интиме аорты, которые вместе с нарушением тока крови создали предпосылки для тромбоза.
Данный препарат — матка. Размеры и масса значительно увеличены за счет опухолевых узлов. Цвет белесовато-желтый. Видны два узла опухолевой ткани: первый расположен внутри миометрия тела матки (ближе к эндометрию), диаметр 2,5 см.; другой в области дна матки, прорастает наружу органа. Размеры данного узла 10-12 см., округлой формы, плотной консистенции. Очагов некроза и кровоизлияний не наблюдается.
Описание патологического процесса
Данный патологический процесс полиэтиологичен, но наиболее вероятной причиной являются дисгармональные нарушения. Обязательной стадией являются предопухопевые изменения, среди которых выделяют так называемые фоновые изменения, проявляющиеся дистрофией, атрофией, гиперплазией. Гиперплазия рассматривается как собственно предопухолевый процесс. Стадия развития опухоли: диффузная гиперплазия, очаговая гиперплазия, доброкачественная опухоль. Опухоль представлена в данном препарате гладкомышечными клетками. Так как строма опухоли хорошо развита — она называется фибромиомой. В матке в зависимости от локализации различают интрамуральные, субсерозные и подслизистые миомы.
Осложнения: развитие опухали под эндометрием часто становиться причиной малых маточных кровотечений, которые даже будучи сами не опасными для жизни через некоторое время приводят к развитию анемий (железодефицитной с соответствующими последствиями). Малигнизация.
Заключение: данные морфологические изменения свидетельствуют о развитии в матке дисгармональных элементов.
Фибринозный перикардит
Данный макропрепарат — сердце, заключенное в околосердечную сумку.
Форма органа сохранена, размеры .несколько увеличены. Эпикард тускло-серого цвета, Шероховатый, покрыта фибрином светло-коричневого цвета. Очагов кровоизлияния и некроза нет. Фибрин более выражен на передней стенке правого желудочка
Описания патологических изменений.
Данные патологические изменения могут развиться при ревматических болезнях с поражением сердца. В листках сердечной сорочки развивается дезорганизация соединительной ткани, поражения сосудов и иммуннопатологические процессы. Повышенная проницаемость сосудов в стадии экссудации приводит к «пропотеванию» фибриногена за их стенки и образованию «волосатого» сердца.
2) неблагоприятный: облитерация полости сердечной сорочки и обызвествление образовавшейся в ней соединительной ткани (панцирное сердце).
Заключение: данные морфологические изменения свидетельствуют о том, что в листках перикарда при ревматизме развились дистрофия и экссудативное фибринозное воспаление.
Диагноз: Фибринозный перикардит (волосатое сердце).
Крупозная пневмония
Макро: вся доля легкого (за исключением верхних сегментов) серо-желтого цвета, плотной консистенции, плевра – тусклая, мутная с наложениями фибрина.
Группа заболеваний – острые пневмонии.
Синонимы: долевая, лобарная, фибринозная, плевропневмония.
Коллоидный зоб
Узловой коллоидный зоб: щитовидная железа увеличена в размерах, поверхность ее бугристая, с узлами разной величины, консистенция плотная, капсула гладкая, сквозь нее просвечивают очаги кровоизлияний, склероза
Мускатная печень
Данный макропрепарат — печень. Масса и размеры уменьшены, форма сохранена. Цвет органа на разрезе пестрый, серо-желтый с красным крапом, причем пестрота увеличивается к периферии. Печень бугристая, бугристость увеличивается к периферии.
Описание патологических изменений.
Данные патологические изменения могли развиться в результате увеличения давления в венах печени, что возможно при общем (хроническая правожелудочная недостаточность) или местном венозном застое (воспаление печеночных вен, тромбоз их просветов). При этом центральные вены расширяются, что приводит к дистрофии и некрозу прилежащих гепатоцитов и расширению синусоидов. В них к центру располагаются форменные элементы, а на периферии -плазма (из-за увеличения давления в месте впадения артериального капилляра) > плазморрагия, диапедезное кровоизлияние. В следствие застоя венозной крови > гипоксия > синтез соединительной ткани клеток Купфера — формирование базальной мембраны и превращение синосоида в капилляр > гипоксия. В центральных отделах долек развивается жировая дистрофия (декомпозиция) вплоть до некроза. Из-за полной регенерации в местах гибели гепатоцитов разрастается соединительная ткань > склероз. Венозный застой > гипоксия > утолщение соединительной ткани печени (междольковой и по ходу триад). Оставшиеся периферические гепатоциты, окруженные соединительной тканью, начинают размножаться. Формируется ложная долька, кровоснабжение которой крайне плохое > гипоксия, дистрофия > некроз гепатоцитов.
1) благоприятный: хроническое течение заболевания; устранение причины венозного полнокровия;
2) неблагоприятный: смерть от печеночной недостаточности, рак, формирование склероза и портальной гипертензии, присоединение инфекции, желтуха и т д.
Заключение: данные морфологические изменения свидетельствуют о венозном полнокровии печени и развившейся на этой почве гипоксии, которая приводит к структурной перестройки органа.
Диагноз: Мускатный цирроз печени.
Подострый гломерулонефрит
^ Подострый гломерулонефрит — развивается в связи с поражением клубочков почек циркулирующими иммунными комплексами, а также антителами. Течение быстрое (быстропрогрессирующий гл-т): рано наступает почечная недостаточность — злокач.гл-т. Это обычно — экстракап.продукт.гл-т. появляются “полулуния” вследствие пролиферации нефротелия клубочков, подоцитов и макрофагов, “полулуния” сдавливают клубочек. Капиллярные петил — фибриноидный некроз, фибриновые тромбы в просвете. Склероз, гиалиноз клубочков, атрофия канальцев, фиброз стромы почек.
Макро- почки увеличены, дряблые, корковый слой широкий, набухший, желто-серый, тусклый, с красным крапом, хорошо отграничек от темно-красного мозгового вещества (большая пестрая почка) , либо корковый слой красный и сливается с полнокровными пирамидами (большая карсная почка).
Инфаркт миокарда
Сердце, размерами 8*8,3*2см. дряблой консистенции серовато-желтого цвета на разрезе, на поверхности желтого цвета. Перикард сохранен, но его целостность нарушена. На разрезе отмечается гипертрофия миокарда, толщина стенки левого желудочка приблизительно 2 см. гипертрофированы сосочковые мышцы и часть травекулярных мышц. Инфаркт локализуется субэпикардиально в стенке левого желудочка. Имеет диффузный характер, неправильную форму, белый с геморрагическим венчиком.
Причины: Атеросклеротические поражения сосудов (особенно коронарных), ишемическая болезнь сердца, гипертоническая болезнь, нервный фактор, спазм, тромбоз и эмболия коронарных артерий.
Исход: Необратим (так как инфаркт – вид некроза). Приводит к функциональной недостаточности органа, возможно образование хронической аневризмы сердца с тромбозом его полости, что может привести к инфаркту внутренних органов, хронической сердечной недостаточности. Возможна острая аневризма сердца, возникает разрыв сердца и гемоперикард. Возможны миомаляция поврежденного участка и разрыв сердца примерно на 5-6 день после инфаркта. Смерть может наступить вследствие фибрилляции желудочков, острой сердечной недостаточности, асистолии, кардиогенного шока, разрыва сердца. Однако область поражения может зарубцеваться, так как формируется соединительная ткань – кардиосклероз. Окружающая ткань в таком случае будет компенсаторно гипертрофироваться.
Последнее изменение этой страницы: 2016-08-01; Нарушение авторского права страницы
источник
В большинстве случаев в области аневризмы формируется пристеночный тромб, что может приводить к развитию тромбоэмболических осложнений
3. В большинстве случаев в области аневризмы формируется пристеночный тромб, что может приводить к развитию тромбоэмболических осложнений.
Наличие аневризмы способствует формированию повторного входа и патологической циркуляции волны возбуждения c развитием жизнеопасных желудочковых нарушений ритма (пароксизмальной ЖТ и ФЖ). В целом летальность больных траншуральным ИМ, осложненным аневризмой ЛЖ, в 4-5 раз выше, чем больных без аневризмы.
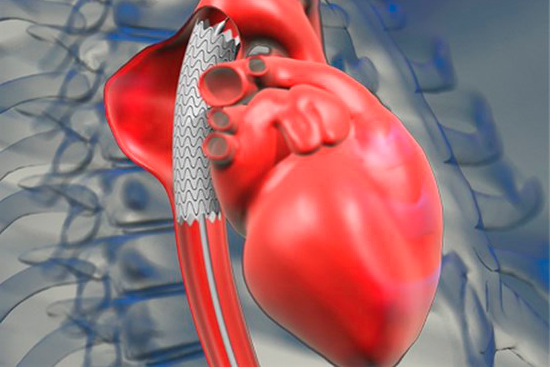
Различают острую и хроническую аневризму сердца.
Острая аневризма сердца развивается в остром периоде инфаркта миокарда,
когда омертвевший участок миокарда размягчается и под влиянием повышенного во время систолы давления крови в левом желудочке выбухает кнаружи или (при поражении межжелудочковой перегородки) в полость правого желудочка. В процессе рубцевания инфаркта миокарда острая аневризма может исчезнуть или сохраниться, превратившись в хроническую. Для острой и подострой АС характерны обширный трансмуральный инфаркт миокарда в анамнезе, дилатация сердца, формирование патологической прекордиальной пульсации (симптом Казем-Бека), прогрессирующая сердечная недостаточность, плохо поддающаяся консервативной терапии; иногда отмечаются длительная лихорадка, лейкоцитоз и увеличение СОЭ. Аускультативно обнаруживаются ослабление I тона сердца на верхушке, акцент II тона над легочной артерией, систолический шум на верхушке и в V точке, нередко разнообразного тембра, иногда определяется шум трения перикарда. На ЭКГ выявляется «застывшая» картина острого трансмурального инфаркта миокарда. При хронической АС клинические проявления зависят от ее размеров и локализации. При небольшой АС больные, не занимающиеся тяжелой физической работой, могут предъявлять жалобы на перебои в работе сердца, сердцебиение. В других случаях больных беспокоят одышка и боли в области сердца или за грудиной. На ЭКГ выявляются нарушения ритма (желудочковая экстрасистолия) и проводимости (блокада левой ножки пучка Гиса). Определяющим клиническим признаком АС является патологическая прекордиальная пульсация, наблюдающаяся примерно у 50% больных. Иногда она видна на глаз, но чаще определяется при пальпации: причем в положении больного на левом боку пульсация усиливается. Прослушиваемый иногда при АС систолический шум на верхушке вариабелен по тембру и редко бывает интенсивным.
Хроническая аневризма сердца в зависимости от обширности и глубины поражения миокарда может быть плоской (слегка выбухающей над поверхностью сердца), мешковидной и даже грибовидной. В полости аневризмы очень часто образуются тромбы, которые могут стать источником эмболии артерий большого круга кровообращения. Аневризма стенки левого желудочка сердца приводит к нарушению его сократительной функции, выраженность которого зависит от размеров аневризмы и толщины ее стенки. При аневризме межжелудочковой перегородки нарушается насосная функция и правого желудочка, полость которого частично заполняет выбухающая в нее аневризма.
Значительно реже встречаются врожденные, инфекционные, травматические,
послеоперационные АС. По форме АС могут быть диффузными
(плоскими), мешковидными грибовидными и в виде «аневризмы в аневризме».
Клинические проявления АС определяются ее размерами, локализацией и
связанными с наличием аневризмы осложнениями. Острая аневризма
межжелудочковой перегородки проявляется симптомами правожелудочковой
сердечной недостаточности (увеличение печени, отеки, гидроторакс, асцит).
Больные с хронической аневризмой сердца могут в течение многих лет не
предъявлять никаких жалоб. Однако нередко хроническая аневризма служит
причиной тяжелых нарушений сердечного ритма, в т. ч. желудочковой
тахикардии Жалобы больных с аневризмой левого желудочка сердца чаще всего соответствуют проявлениям его недостаточности: больные отмечают одышку и сердцебиение при физической нагрузке, а при большой АС также в покое; возможны ортопноэ, приступы сердечной астмы, которые могут сглаживаться при присоединении правожелудочковой недостаточности сердца. В ряде случаев преобладают жалобы, связанные с тромбоэмболиями артерий головного мозга, почек, селезенки, конечностей и др. Осмотр прилежащей к аневризме области грудной стенки при боковом освещении позволяет обнаружить при острой аневризме передней стенки левого желудочка патологическую пульсацию в межреберных промежутках. При аускультации выявляется систолический шум, нередко ритм галопа, размеры и строение АС можно определить с помощью эхокардиографии, а также рентгенологических методов исследования сердца, особенно при введении в полость пораженного желудочка рентгеноконтрастных веществ.
Радикальное лечение аневризмы ЛЖ — хирургическое иссечение аневризматического мешка — показано в следующих случаях:
— при быстром прогрессировании сердечной недостаточности;
— при возникновении тяжелых повторных желудочковых нарушений ритма,
рефрактерных к консервативной терапии;
— при повторных тромбоэмболиях, если доказано, что источником их является пристеночный тромб, располагающийся в области аневризмы.
Лечение больных с неосложненной плоской аневризмой сердца в исходе инфаркта миокарда предполагает в основном строгое ограничение физической активности. При появлении первых признаков сердечной недостаточности (тахикардия, одышка при ходьбе) ставится вопрос о необходимости и возможности хирургического лечения АС, так как консервативными методами лечения аневризма не устраняется. Если операцию не производят, осуществляют симптоматическое лечение осложнений АС. При АС, осложненной тяжелыми аритмиями или пристеночным тромбозом, а также при аневризме межжелудочковой перегородки хирургическое лечение может быть произведено по витальным показаниям. Оно заключается в иссечении АС в пределах здорового миокарда или плотного соединительнотканного края аневризмы с последующим ушиванием; пластике межжелудочковой перегородки (см. Пороки сердца).
Прогноз при острой аневризме сердца сомнителен, т. к. ее наличие существенно повышает опасность разрыва сердца на 2-10-й день заболевания. При хронической плоской аневризме сердца, протекающей без осложнений, прогноз относительно благоприятен; он резко ухудшается с появлением первых признаков сердечной недостаточности. Неблагоприятен прогноз при мешковидной и грибовидной аневризмах, особенно часто осложняющихся внутрисердечным тромбозом, тяжелыми нарушениями ритма сердца и сердечной недостаточностью.
сердца. У больных с развившимся острым инфарктом миокарда профилактика состоит в строгом соблюдении и контролируемом расширении двигательного режима в течение 2 мес. (период формирования прочного рубца).
Операцию проводят в условиях искусственного кровообращения. Чаще всего
выполняется резекция аневризмы, реже аневризморафия или пликация АС
Операция может дополняться тромбэктомией а также пластикой межжелудочковой перегородки при ее рубцовых изменениях или дефекте. При сопутствующем поражении венечных артерий вне зоны АС проводят аортокоронарное шунтирование. Послеоперационная летальность составляет 5—8%. Причинами смерти больных в отдаленном послеоперационном периоде являются прогрессирующая сердечная недостаточность вследствие тяжелого дооперационного поражения миокарда и повторные инфаркты миокарда как результат прогрессирования атеросклероза венечных артерий сердца. Без хирургического лечения прогноз при хронической АС неблагоприятный.
Сердечная недостаточность — патологическое состояние, обусловленное неспособностью сердца обеспечивать адекватное кровоснабжение органов и тканей при нагрузке, а в более тяжелых случаях и в покое. В классификации, принятой на XII съезде терапевтов (1935 г.), СН и сосудистая недостаточность выделены как две самостоятельные формы недостаточности кровообращения. По темпам развития и течению СН подразделяют на острую и хроническую, по преимущественному значению недостаточности какого-либо из желудочков сердца — на левожелудочковую, правожелудочковую и тотальную. Иногда выделяют также предсердную СН (при стенозах атриовентрикулярных отверстий). В течении недостаточности кровообращения при хронической СН выделяют 3 стадии: I стадия (начальная) проявляется одышкой, тахикардией, утомляемостью только при физической нагрузки; II стадия характеризуется застоем в малом и (или) большом круге кровообращения и нарушениями функций органов вначале мало выраженными, в основном при нагрузке (стадия ПА), а затем устойчивыми признаками значительных нарушений гемодинамики и водно-электролитного обмена, сохраняющимися в покое (стадия ПБ); III стадия, или дистрофическая, характеризуется тяжелыми нарушениями гемодинамики, обмена веществ и функций всех органов с развитием в них необратимых морфологических изменений.
Этиология и патогенез. В основе СН могут быть:
— ослабление функции сократимости миокарда при первичном его поражении (первично-миокардиальная СН) или в связи с перегрузкой сердца объемом крови либо давлением; ограничение растяжимости камер сердца в диастолу вследствие поражения других оболочек сердца (так называемая диастолическая, или рестриктивная, СН);
— поражения клапанов или дефекты перегородок сердца, снижающие эффективность деятельности сердца как насоса даже при усиленных сокращениях его камер. Последний механизм может иметь ведущее значение в патогенезе СН при врожденных и приобретенных пороках сердца, но при нихобычно ослабляется и сократительная функция миокарда вследствие его дистрофии от гиперфункции в связи с перегрузкой камер сердца объемом крови (при клапанной недостаточности и внутрисердечных шунтах) или давлением (при клапанных стенозах). Причиной диастолической СН обычно бывают приводящие к ригидности стенок сердца фибропластический эндокардит, выпотной и слипчивый перикардит, в сочетании со снижением сократительной функции миокарда диастолическая СН характера для амилоидоза сердца, гипертрофической кардиомиопатии. Снижение сократительной функции миокарда вследствие перегрузки давлением наблюдается кроме клапанных стенозов при артериальной гипертензии в большом круге кровообращения (перегрузка левого желудочка), что характерно для развития недостаточности кровообращения в поздних стадиях гипертонической болезни и при кардиальных гипертонических кризах, гипертензивных кризах при феохромоцитоме и др., либо в малом круге (перегрузка правого желудочка) при заболеваниях, сопровождающихся формированием легочного сердца. Причиной первично-миокардиальной СН являются миокардит, кардиомиопатии, миокардиодистрофия различной этиологии, дегенеративные изменения миокарда при амилоидозе, гемохроматозе, поражения миокарда при ишемической болезни сердца. Своеобразной формой является аритмогенная СН, при которой миокард, клапаны и состояние стенок сердца могут обеспечивать нормальное кровоснабжение тканей, но насосная функция сердца снижена из-за нарушения ритма или темпа его сокращений, обусловленного либо заболеванием самого сердца, либо экстракардиальной патологией. Такое происхождение может иметь СН при выраженной брадикардии, в т. ч. обусловленной блокадой сердца, пароксизмальной тахикардии, тахисистолической форме мерцательной аритмии.
Гемодинамически СН проявляется в одних случаях преимущественно снижением массы и скорости сердечного выброса (в сравнении с должными), что приводит к уменьшению объемной скорости кровотока в тканях, в других — преимущественно застоем крови и повышением давления в венах малого (при левожелудочковой СН) или большого (при правожелудочковой СН) круга кровообращения — так называемая застойная СН, при которой не только замедляется кровоток в тканях, особенно удаленных от сердца (что проявляется акроцианозом, похолоданием конечностей), но и нарушается режим фильтрационного обмена веществ, в т. ч. электролитов и воды, между тканями и кровью в капиллярах, приводя к формированию отеков. В большинстве случаев застойная СН и снижение сердечного выброса сочетаются. Следствием снижения кровотока в органах и тканях является их гипоксия, нарушающая функции клеточных мембран и порождающая дефицит энергетического обеспечения жизнедеятельности клеток. В результате в органах и тканях развиваются процессы дистрофии и склероза; функции органов существенно нарушаются.
На начальных этапах развития СН нарушение сократимости миокарда или перегрузка одной или нескольких сердечных камер приводят к мобилизации трех главных компенсаторных механизмов, позволяющих поддерживать насосную функцию сердца: согласно закону Франка — Старлинга, увеличение растяжения саркомеров сердца (при дополнительной нагрузке объемом) приводит к повышению сократимости; происходит увеличение выброса катехоламинов адренергическими сердечными нервами и надпочечниками, что усиливает сокращения миокарда и повышает темп сердечных сокращений при одновременной активации липолиза вследствие возбуждения β-адренорецепторов развивается компенсаторная гипертрофия миокарда. Кроме того, в компенсации СН принимают участие сосудистые реакции, направленные на централизацию кровообращения при снижении сердечного выброса и на перераспределение крови в венозных депо при повышении давления в правых отделах сердца.
Происхождение одного из ранних симптомов СН — тахикардии связано с рефлекторной активацией симпатоадреналовой системы с рецепторов правого предсердия и полых вен при повышении в них давления (рефлекс Бейнбриджа) или с барорецепторов каротидного синуса, реагирующих на снижение сердечного выброса. По мере истощения компенсаторных резервов и нарастания энергетического дефицита в миокарде уменьшаются запасы норадреналина, плотность β-адренорецепторов, активность миозиновой АТФ-азы, ухудшается доставка кальция в саркоплазматический ретикулум.
Активация альдостерона, приводящая к задержке соли и жидкости, способствует увеличению давления заполнения желудочков, но при декомпенсации сердечной деятельности становится одним из патогенетических механизмов стабилизации отеков. В развитии последних при сердечной недостаточности немалое значение имеют снижение кровотока в почках и гипоксия почечных канальцев, возникновение дис- и гипопротеинемии вследствие прогрессирующей при СН дистрофии всех органов, в т. ч. печени (особенно при застойных ее изменениях и формировании так называемого кардиогенного цирроза печени). Патогенез одышки — одного из характерных проявлений СН — зависит от характера гемодинамических нарушений. В одних случаях ведущее значение имеют нарушения центральной регуляции дыхания, в других — изменения гемодинамики в малом круге кровообращения, а при значительном асците у больных с правожелудочковой СН — нарушения механики дыхания из-за повышения внутрибрюшного давления.
Клиническая картина. Острая левожелудочковая СН проявляется сердечной астмой и отеком легких: острая правожелудочковая СН — болью в правом подреберье, резко выраженной тахикардией, набуханием шейных вен, похолоданием конечностей, акроцианозом. Основными симптомами хронической СН являются зависящие от нагрузки одышка, тахикардия, акроцианоз, а также отеки, нарушение функций различных органов. При недостаточности кровообращения I стадии тахикардия и одышка появляются при повышенной, но привычной для больного нагрузке. Больные жалуются на сердцебиение и ощущение нехватки воздуха при ускорении ходьбы, подъемах по лестнице, переноске небольших тяжестей; по окончании нагрузки теми сокращений сердца и дыхание нормализуются через несколько минут. Осмотр больного, пальпация и выслушивание органов позволяют определить признаки заболевания сердца (например, обнаружить клапанный порок), но признаки собственно СН при обследовании больного в покое не определяются. Объективным подтверждением ее наличия может быть появление видимой одышки (учащенное и углубленное дыхание) и тахикардии после выполнения больным 5—10 приседаний в среднем темпе. С переходом недостаточности кровообращения во П стадию толерантность
больных к физической нагрузке еще более снижается. Тахикардия и одышка
ограничивают ходьбу в нормальном или даже сниженном темпе, возникают
при нагрузке, связанной с самообслуживанием, а в последующем и в покое.
У больных с певожелудочковой СН в этой стадии нередко появляются
одышка в горизонтальном положении тела, исчезающая в положении сидя
или стоя — ортопноэ непродуктивный кашель (эквивалент одышки); при нагрузке, лихорадке, подъеме АД возможно возникновение сердечной астмы и отека легких. Больные с правожелудочковой СН в этой стадии нередко жалуются на ощущение тяжести в эпигастральной области, утомляемость, появление пастозности или отека стоп и голеней вначале к концу дня с исчезновением их к утру, а затем (в стадии ПБ) — на постоянные отеки. Появлению отеков предшествует никтурия, а по мере их нарастания стойко снижается суточный диурез. У больных с первично-левожелудочковой (или левопредсердной) СН в стадии ИБ, как правило, имеются и признаки правожелудочковой недостаточности, то есть СН становится тотальной. При обследовании больных с недостаточностью кровообращения II стадии всегда, независимо от этиологии СН, перкуторно определяется расширение границ относительной сердечной тупости вследствие дилатации камер сердца и в большинстве случаев обнаруживаются признаки гипертрофии левого (усиленный 1фиподнимающий верхушечный толчок) или правого (появление сердечного толчка, упругой пульсации под мечевидным отростком) желудочков. У больных с левожелудочковой СН в легких выслушивается жесткое дыхание, иногда влажные хрипы, локализация которых может изменяться через несколько минут после изменения положения тела больного (например, когда больной, лежащий на спине, поворачивается на правый бок); над легочным стволом во всех случаях отмечается усиление и акцент II тона сердца. Правожелудочковая СН в этой стадии объективно проявляется похолоданием кистей и стоп больного, наличием акроцианоза, набухлостью шейных и периферических вен, видимыми отеками стоп и голеней, увеличением печени, край которой при пальпации несколько утолщен и уплотнен. При надавливании на печень больного ладонью нередко отмечают дополнительное набухание шейных вен (гепатоюгулярный рефлюкс). V Периферические отеки становятся видимыми после задержки в организме более 4 л внеклеточной жидкости (скрытые отеки). Отеки обычно симметричны и расположены в нижних частях тела (голени, стопы), где венозное давление достигает наивысших значений. У лежачих больных отеки чаще формируются в области крестца.
В III стадии недостаточности кровообращения отмечается прогрессирование
гемодинамических нарушений и развивается склероз органов, подверженных
венозному застою. Наблюдается выраженное похудание больных, иногда
кахексия. Отеки носят генерализованный характер и распространяются на бедра, переднюю брюшную стенку, поясницу, половые органы. Длительно существующие отеки приводят к пигментации, покраснению и отвердению кожи нижних конечностей. Появляются асцит и нередко гидроторакс (скопление отечной жидкости в плевральной полости), чаще правосторонний. При значительном асците и гидротораксе одышка приобретает инспираторный характер. Нижние границы легких определяются на 2—3 межреберья выше, чем в норме; в нижних отделах выслушиваются влажные мелко- и среднепузырчатые хрипы трескучего тембра на фоне жесткого дыхания (над областью гидроторакса дыхание ослаблено); в ряде случаев — сухие жужжащие хрипы (признак застойного бронхита). У большинства больных (за исключением страдающих констриктивным перикардитом) выявляется кардиомегалия. Изменения тонов сердца и наличие шумов соответствуют имеющемуся клапанному пороку (его аускультативные признаки при выраженной СН могут ослабевать), а при отсутствии органических изменений клапанов I тон сердца обычно становится глухим, нередко определяется ритм галопа, появляется систолический шум относительной недостаточности митрального или трикуспидального клапанов. Часто возникают аритмии сердца; у многих больных в этой стадии СН определяется постоянная форма мерцательной аритмии. Длительная застойная СН приводит к нарушению функции желудочно-кишечного тракта, что проявляется снижением аппетита, тошнотой, метеоризмом. При пальпации живота возможна болезненность в эпигастральной области (застойный гастрит), определяется увеличенная печень с плотным краем, который обычно закруглен, но может быть заостренным, при выраженном, так называемом кардногенном, циррозе печени, что обычно сочетается с наличием признаков значительной портальной гипертензии. Больные выделяют мочу малыми порциями, концентрированную, при ее лабораторном исследовании обычно обнаруживают белок (застойная протеинурия).
Диагноз ХСН устанавливают на основании всей совокупности ее клинических проявлений, т.к. ни один из отдельных ее симптомов не является строго специфическим (тахикардия может быть следствием разных болезней, одышка — легочной, отеки — почечными и т.д.). Относительно специфичен для правожелудочковой СН акроцианоз, но и этот поздний симптом в ряде случаев приходится дифференцировать с особенностями проявления диффузного цианоза. В то же время каждый из основных симптомов имеет при СН специфические черты. Так, одышка в типичных случаях имеет характер полипноэ, не является экспираторной (как в большинстве случаев легочной одышки) и становится инспираторной только при выраженном асците или (и) наличии гидроторакса. При недостаточности кровообращения II стадии сердечное происхождение одышки подтверждается данными рентгенологического исследования легких, корни которых становятся расширенными, мало структурными, вены расширенными, появляются линии Керли. Ортопноэ — высокоспецифический симптом левожелудочковой СН Отеки при СН имеют характер гипостатических: в отличие от отека при флемотромбозе конечностей отеки при СН симметричны, носят распространенный характер, в отличие от почечных отеков они «мягкие» (на месте надавливания на кожу пальцем длительно сохраняется ямка) и всегда сочетаются с системным повышением венозного давления. Для диагноза СН в ранней стадии ее развития достаточно установить явную связь тахикардии и одышки с физической нагрузкой, а также наличие болезни сердца, исключив легочную патологию. Тахикардия, возникающая при нагрузке в ранней стадии СН, полностью исчезает после нескольких минут пребывания больного в покое (в отличие, например, от тахикардии при тиреотоксикозе). Для установления и уточнения характера болезни сердца применяют при необходимости специальные методы исследования его
морфологии и функции, в т.ч. обязательно электрокардиографию и
рентгенологическое исследования, а по показаниям также эхокардиографию,
реокардиографию, с помощью которых можно определить, в частности,
снижение сердечного выброса, методы радионуклидной диагностики,
ангиокардиографию.
Относительно ранними признаками правожелудочковой СН являются повышение венозного давления, измеряемого в локтевой вене, а также никтурия и появление скрытых стеков. Для выявления последних используют вариант строфантиновой пробы, предложенный Б.Е. Вотчалом: больного переводят на стандартную диету и взвешивают в течение 3 дней подряд, из которых 2 последние дня больному вводят внутривенно по 0,25 мг строфантина, не применяя мочегонных средств. Проба считается положительной, если в конце ее масса тела больного уменьшается не менее чем на 1,5 кг. Вспомогательное значение для ранней диагностики С. н. имеет фазовый анализ сердечного цикла.
Хроническая сердечная недостаточность (ХСН) — это синдром, возникающий при наличии у человека систолической и (или) диастолической дисфункции, сопровождающийся хронической гиперактивацией нейрогормональных систем, и клинически проявляющийся одышкой, слабостью, сердцебиением, ограничением физической активности, патологической задержкой жидкости в организме.
ХСН может развиться на фоне практически любого заболевания сердечнососудистой системы, однако основными тремя являются следующие наднозологические формы: ИБС, артериальные гипертензии и сердечные пороки. Первые две причины являются характерными как для России, так и для развитых стран, третья более характерна для нашей страны вследствие отсутствия полного охвата всего населения кардиохирургической помощью.
Вне зависимости от этиологии гипертензии происходит структурная перестройка миокарда, имеющая специфическое название — «гипертоническое сердце». Механизм ХСН в данном случае обусловлен развитием диастолической дисфункции ЛЖ.
Для России до настоящего времени характерно развитие ХСН вследствие приобретенных и некорригированньгх ревматических пороков. Несколько слов необходимо сказать о дилатационной кардиомиопатии (ДКМП) — заболевании достаточно редком, неуточненной этиологии, которое развивается в относительно молодом возрасте и быстро приводит к сердечной декомпенсации.
Этиология, патогенез и диагностика.
В настоящее время хроническая сердечная недостаточность (ХСН) является одной из главных проблем здравоохранения во многих странах мира, в том числе в России, США и экономически развитых странах Запада, так как ежегодные расходы на лечение больных очень велики, а смертность остается высокой. Точных данных о заболеваемости и распространенности ХСН в большинстве стран нет. По данным Фремингемского исследования, установлено, что заболеваемость ХСН увеличивается с возрастом, т.е. ХСН — чаще «спутник» людей пожилого и старческого возраста. ХСН ежегодно развивается у 1% лиц старше 60 лет и почти у 10% лиц старше 75 лет. Очевидно, что отчетливая тенденция к «постарению» жителей планеты в последние десятилетия вызовет еще большую распространенность ХСН, которой страдает в настоящее время 1-2 % населения в экономически развитых странах мира. Поэтому ХСН является одной из основных проблем современной геронтологии и гериатрии и имеет глобальный социально-экономический характер. ХСН чаще развивается в результате заболеваний сердечно-сосудистой системы, но может иметь первично и «внесердечную» этиологию. В большинстве экономически развитых стран мира наиболее частой причиной ХСН является ишемическая болезнь сердца в сочетании с артериальной гипертонией или без нее. На втором месте среди причин развития ХСН стоит артериальная гипертония и на третьем — приобретенные пороки сердца, чаще ревматического генеза. Другими причинами ХСН могут быть дилатационная кардиомиопатия, миокардиты, поражение миокарда вследствие хронической интоксикации алкоголем, кокаином и др., консгсриктивный перикардит, гипертрофическая и рестриктивная кардиомиопатии, инфекционный эндокардит, опухоли сердца, врожденные пороки сердца. Среди «внесердечных» причин, приводящих к появлению ХСН, необходимо отметить болезни органов дыхания с сопутствующей легочной гипертензией, тромбоэмболию легочной артерии, гипо- и гипертиреоз, диффузные болезни соединительной ткани, анемии, гемохроматоз, амилоидоз, саркоидоз, бери-бери, дефицит селена, карнитина, кардиотоксические эффекты лекарственных препаратов, лучевую терапию с вовлечением средостения, интоксикацию солями тяжелых металлов. У больных пожилого и старческого возраста нередко имеется несколько этиологических факторов, приведших к развитию ХСН (например, в случае наличия перенесенного в анамнезе инфаркта миокарда и сопутствующего хронического обструктивного бронхита и/или артериальной гипертонии). Именно больным старших возрастных групп свойственна полиморбидность, и СН в этом контингенте населения носит мультифакториальный характер. Также необходимо учитывать и возрастные изменения миокарда (гипертрофия, фиброз, формирующие «старческое сердце»), которые снижают его способность к расслаблению в диастолу, а «наслоение» заболеваний различных органов и систем (в основном сердечно-сосудистой системы) уменьшает сократительную способность миокарда. Отложение амилоида в тканях сердца лишь усугубляет этот процесс. Снижение функциональных резервов миокарда у пожилых делает их более уязвимыми к развитию СН (при наличии фоновой патологии миокарда или без нее) в различных клинических ситуациях (анемия, тяжелые инфекции, гипергидратация, наджелудочковая Ведущим звеном патогенеза ХСН в настоящее время считается активация важнейших нейрогормональных систем организма — ренин-ангиотензин-альдостероновой (РААС) и симпато-адреналовой (САС) — на фоне снижения сердечного выброса. В результате происходит образование биологически активного вещества — ангиотензина II, который является мощным вазоконстриктором, стимулирует выброс альдостерона, повышает активность САС (стимулирует выброс норадреналина). Норадреналин, в свою очередь, может активировать РААС (стимулирует синтез ренина). Также следует учитывать, что активируются и локальные гормональные системы (прежде всего РААС), которые существуют в различных органах и тканях организма. Активация тканевых РААС происходит параллельно плазменной (циркулирующей), но действие этих систем различается. Плазменная РААС активируется быстро, но оказывает кратковременные эффекты. Активность тканевых РААС сохраняется долговременно. Синтезирующийся в миокарде ангиотензин II стимулирует гипертрофию и фиброз мышечных волокон. Кроме того, он активирует локальный синтез норадреналина. Аналогичные изменения наблюдаются в гладкой мускулатуре периферических сосудов и приводят к ее гипертрофии. В конечном итоге повышение активности этих двух систем организма, вызывая мощную вазоконстрикцию, задержку натрия и воды, возрастание ЧСС, приводит к увеличению сердечного выброса, поддерживает функцию кровообращения на оптимальном уровне, сохраняет гомеостаз организма. В норме активации прессорных систем организма (РААС, САС) «противостоит» действие депрессорных систем (калликреин-кининовая система: ключевое звено брадикинин, натрийуретические пептиды, окись азота), вызывающих системную вазодилатацию, увеличение диуреза. Однако длительное снижение сердечного выброса вызывает практически постоянную активацию РААС и САС, нарушает баланс прессорных и депрессорных систем и формирует патологический процесс. «Срыв» компенсаторных реакций проявляется клиникой СН.
Тем не менее у некоторых пациентов с выраженной дисфункцией сердечной мышцы длительно не отмечаются симптомы ХСН. Одышка как самостоятельный симптом или в сочетании с признаками задержки жидкости и утомляемостью — самые частые клинические признаки ХСН. Однако они не патогномоничны, так как могут отмечаться, например, при ожирении, гипотиреозе, почечной недостаточности. Для правильной диагностики ХСН необходимо уточнение данных анамнеза (указание на перенесенный инфаркт миокарда, наличие артериальной гипертензии, стенокардии, порока сердца, аритмий и т.д.) и осмотра (наличие тахикардии, смещенного влево верхушечного толчка, расширение границ сердца по данным перкуссии, наличие патологического III тона сердца, сердечных шумов, набухание шейных вен, периферические отеки и др.), направленных прежде всего на выявление заболевания сердца и уточнение его природы.
Подтвердить предположение о наличии ХСН и выявить возможные
причинные факторы можно только с помощью инструментально-
лабораторных методов диагностики, и в первую очередь на основании
результатов эхокардиографии. У пациентов с ХСН нередко регистрируются
изменения на ЭКГ (признаки гипертрофии левого желудочка, перенесенного
инфаркта миокарда, блокада левой ножки пучка Гиса, трепетание-мерцание
предсердий, и др.). При рентгенологическом исследовании органов грудной клетки нередко выявляются кардиомегалия, застойные явления в легких, плевральный выпот. При острой или декомпенсированной ХСН на рентгенограммах может наблюдаться интерстициальный либо альвеолярный отек легких. Анализы крови и мочи позволяют исключить анемию, заболевания печени, почек и щитовидной железы.
В зависимости от выраженности клинических симптомов различают четыре функциональных класса ХСН (по классификации Нью-Йоркской ассоциации сердца — NYHA).
Диагноз ставится на основании осмотра врача-кардиолога и дополнительных методов обследования, таких как электрокардиограмма в различных вариациях: эхокардиограмма, суточное мониторирование ЭКГ и тредмилл-тест. Возможно проведение катетеризации сердца (вводится тонкая трубка через вену или артерию непосредственно в сердечную мышцу, данная процедура позволяет измерить давление в сердечных камерах и выявить место закупорки сосудов).
ПИЕЛОНЕФРИТ — неспецифическое инфекционное заболевание почек, поражающее почечную паренхиму, преимущественно интерстициальную ткань, лоханку и чашечки.
Классификация заболевания: (единой классификации нет)
I а) Первичный — без предшествующих нарушений со стороны почек и
I б) Вторичный — на основе органических или функциональных нарушений
(обструктивный), ему предшествуют урологические заболевания. Первичный
III. По пути распространения инфекции: гематогенные, чаще первичные, и уриногенные, чаще вторичные.
IV. По течению: быстро прогрессирующий, рецидивирующий и латентный.
источник