Боль в груди — одна из самых частых причин обращения за врачебной помощью. Причина боли в груди может быть ясной, но часто бывает атипичной. Случаи, когда пациенты жалуются на боль в груди, представляют наибольшие трудности для диагностики.
Дифференциально-диагностический ряд в таких случаях чрезвычайно широк и включает, в том числе, заболевания, представляющие непосредственную угрозу жизни, такие как инфаркт миокарда с подъемом и без подъема сегмента ST, нестабильную стенокардию, тромбоэмболию легочной артерии и расслаивающую аневризму аорты.
Расслаивающая аневризма аорты (РАА) представляет достаточно сложную проблему в плане первичной диагностики. Причиной этого является как низкая частота данной патологии, так и большая вариабельность клинических проявлений.
Без применения кардиохирургических методов в ранние сроки заболевания прогноз крайне неблагоприятен, а двухнедельная выживаемость не превышает 20 % , поэтому своевременная диагностика РАА является важнейшей задачей.
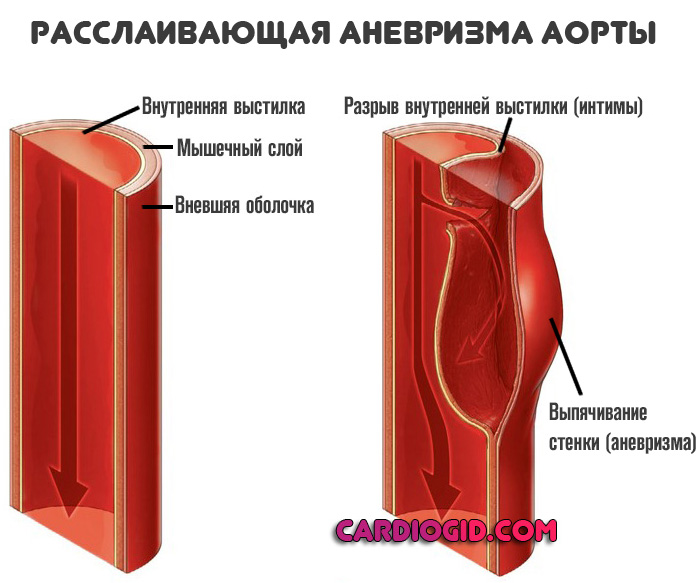
Под термином «расслаивающая аневризма аорты» подразумевают внезапное образование вследствие различных причин дефекта интимы аорты с последующим проникновением крови через этот дефект в дегенеративно измененную срединную оболочку, образованием гематомы и продольным расслоением стенки аорты.
Расслоение (диссекция) происходит преимущественно в дистальном, реже в проксимальном отделе. Гематома может развиваться по ходу аорты и закупоривать одну из ее ветвей, начиная от ветвей дуги аорты и заканчивая кишечными артериями.
Ретроградная диссекция может поражать коронарные артерии. Чаще вовлекается правая коронарная артерия. Ретроградное расслоение может привести к нарушению прочности одной или нескольких створок аортального клапана и его недостаточности.
Ложный канал располагается в наружной половине средней оболочки аорты. Наружная его стенка составляет всего четверть первоначальной толщины стенки аорты. Это является причиной частых разрывов аорты у больных с расслаивающей аневризмой.
Разрыв аневризмы дуги аорты происходит чаще всего в полость средостения, разрыв нисходящей аорты — в левую плевральную полость, брюшной аорты — в забрюшинную клетчатку. Так как париетальный перикард прикрепляется к восходящей части аорты, непосредственно проксимальнее места отхождения плечеголовного ствола, разрыв любого отдела восходящей части аорты может привести к тампонаде перикарда.
Классификации расслаивающих аневризм аорты обычно основаны на локализации проксимального разрыва внутренней оболочки аорты и протяженности расслоения стенки аорты. Поскольку разрыв внутренней оболочки аорты может теоретически произойти в любом сегменте и быть множественным, варианты расслоения аорты весьма разнообразны.
Однако на практике разрыв внутренней оболочки чаще всего происходит в передней стенке восходящей части аорты на границе проксимальной и средней трети, а также в начальном сегменте нисходящей части аорты дистальнее русла левой подключичной артерии.
Именно на этом принципе основана простая и широко распространенная Стэндфордская классификация, согласно которой выделяют несколько типов расслоения:
- тип А — разрыв интимы находится в восходящей аорте с поражением дуги или нисходящей аорты, или без них;
- тип В — надрыв находится в нисходящей аорте, при этом расслоение распространяется проксимально и дистально.
Для определения прогноза болезни и выработки консервативной и оперативной тактики в клинике применяется модификация классификации М. DeBakey:
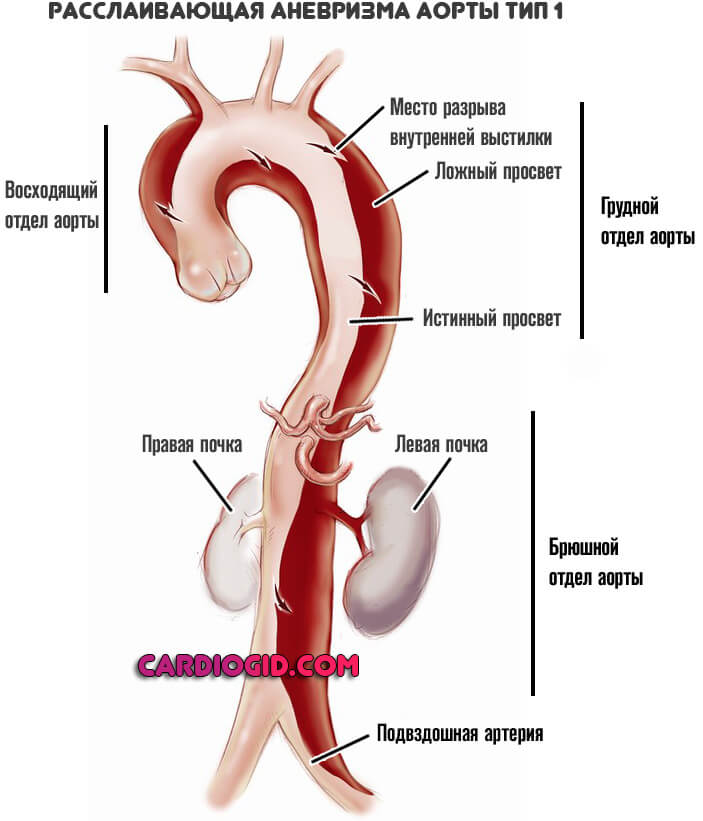
- тип I — разрыв внутренней оболочки локализуется в восходящей части аорты, а расслоение ее стенок распространяется до брюшной части аорты;
- тип II — разрыв внутренней оболочки локализуется в восходящей части аорты, расслоение заканчивается слепым мешком проксимальнее плечеголовного ствола;
- тип III — разрыв внутренней оболочки аорты локализуется в начальном отделе нисходящей части грудной аорты дистальнее устья левой подключичной артерии.
Классификация расслаивающей аневризмы аорты
Согласно другой классификации, выделяют пять классов диссекции аорты.
- К 1-му классу относят классическое расслоение аорты с формированием ложного и истинного ходов без образования сообщения между ними,
- к 2-му— интрамуральную гематому или кровоизлияние,
- к 3-му — пенетрирующее изъявление атеросклеротической бляшки стенки аорты вследствие надрыва ее капсулы,
- к 4-му — небольшие ограниченные или частичные диссекции аорты с образованием выпячивания ее стенки
- к 5-му — ятрогенные или посттравматические диссекции аорты (например, расслоение аорты проведенным в нее для катетеризации сердца катетером).
Классификация диссекций аорты по L. G. Svensson и соавт.
Разрыв интимы, являющийся началом расслаивающей аневризмы, обнаруживается в восходящей части аорты примерно в 70 % случаев. В 10 % случаев его находят в дуге, в 20 % — в нисходящей части грудной аорты. В редких случаях наблюдается надрыв интимы брюшной аорты.
Диссекция (расслоение) аорты может быть острой (до 2 недель) и хронической (более 2 недель).
Распространенность РАА оценивается в среднем как 1 на 10 000 госпитализированных (однако значительная часть больных погибает на догоспитальном этапе). Данная патология является причиной 1,1 % случаев внезапной смерти и 3-4 % случаев всех внезапных смертей от сердечно-сосудистых заболеваний; выявляется в 1 случае на 400 аутопсий.
К предрасполагающим факторам расслоений аорты относятся заболевания и состояния, сопровождающиеся кистозной дегенерацией медии:
- длительно существующая артериальная гипертензия,
- врожденные дефекты соединительной ткани (синдромы Марфана, Элерса — Данлоса, Тернера),
- поликистозная болезнь почек,
- пожилой возраст (60-70 лет);
- врожденные пороки сердца (коарктация аорты, бикуспидальный или одностворчатый клапан);
- атеросклероз аорты;
- беременность;
- травма грудной клетки,
- сильное физическое и эмоциональное напряжение;
- системные васкулиты (особенно часто гранулематозный, гигантоклеточный артериит);
- химические и токсические воздействия (наркотики, например, кокаин);
- ятрогенные причины.
Наиболее частыми симптомами при РАА являются внезапное начало боли с молниеносным достижением максимальной интенсивности, локализация боли в грудной клетке, боль в спине. Боль описывается пациентами как очень интенсивная или нестерпимая, самая сильная боль, которую они когда-либо испытывали, боль острая или рвущая.
У значительной части пациентов могут наблюдаться те или иные изменения сегмента ST или зубца Т.
При проксимальном типе расслоения может выслушиваться шум аортальной регургитации.
Как при проксимальном, так и при дистальном типе расслоения может определяться асимметрия пульса (снижение его наполнения или отсутствие) и артериального давления на верхних или нижних конечностях.
У части пациентов могут выявляться те или иные неврологические нарушения.
Относительно редко встречается вторичный (чаще всего задненижний) инфаркт миокарда, связанный с распространением расслоения на устье коронарной артерии.
К заболеваниям, имеющим сходную с РАА клиническую картину, относятся:
- острый коронарный синдром;
- аортальная недостаточность без диссекции (расслоения);
- аневризма аорты без диссекции (расслоения);
- костно-мышечные;
- перикардит;
- опухоль средостения;
- плеврит;
- тромбоэмболия легочной артерии;
- холецистит.
Наличие РАА можно подозревать, если у пациента имеется боль; боль в сочетании с обмороком (синкопе); боль в сочетании с симптомами сердечной недостаточности; боль в сочетании с симптомами поражения ЦНС (инсульт); сердечная недостаточность без болевого синдрома; симптомы поражения ЦНС (инсульт) без болевого синдрома; изменения на рентгенограмме органов грудной клетки без болевого синдрома; отсутствие пульса без болевого синдрома.
Согласно рекомендациям рабочей группы Европейского общества кардиологов, для подтверждения диагноза, уточнения типа расслоения (локализация, протяженность), диагностики и уточнения тяжести аортальной недостаточности и диагностики экстравазации (периаортальная или медиастинальная гематома, плевральный или перикардиальный выпот) предпочтение следует отдавать трансторакальной ЭхоКГ с последующей трансэзофагеальной ЭхоКГ и внутрисосудистым УЗИ, мультиспиральной компьютерной томографии или магнитно-резонансной томографии.
Ангиография может проводиться для определения анатомического субстрата при планируемом чрескожном вмешательстве у гемодинамически стабильных и нестабильных пациентов, но не рутинно. Рентгенография грудной клетки не дает дополнительной информации.
Ниже представлены начальные лечебно-диагностические мероприятия, которые следует проводить при подозрении на РАА в соответствии с рекомендациями группы экспертов Европейского общества кардиологов.
- Сбор детального анамнеза и полный осмотр (при возможности).
- Обеспечение венозного доступа, анализы крови (ОАК, КФК, тропонин I (Т), Д-димер, гематокрит, липиды).
- Мониторирование артериального давления и ЭКГ.
- Снижение систолического артериального давления, предпочтительно β-адреноблокаторы (пропранолол, метопролол, эсмолол), при противопоказаниях — антагонисты кальция.
- При тяжелой артериальной гипертензии дополнительно вазодилататоры.
- Трансторакальная (трансэзофагеальная) ЭхоКГ.
Всем пациентам с расслаивающей аневризмой аорты показано хирургическое лечение.
Представляем клинический пример прижизненной диагностики РАА на основании особенностей течения заболевания и клинической картины.
Пациентка А., 59 лет. Жалоб в момент поступления нет. Ранее сердечно-сосудистых заболеваний не переносила.
Впервые за 3 дня до обращения в стационар возникла колющая, пронизывающая боль умеренной интенсивности в области сердца и между лопатками без связи с физической нагрузкой и движением, усиливавшаяся при пальпации, сохранялась несколько часов после самостоятельного приема анальгетиков. Повторный подобный приступ развился накануне поступления в стационар.
Консультирована неврологом, высказано предположение о вертеброгенной торакалгии. Проведена ЭКГ, выявлены изменения (отрицательные зубцы Т в отведениях III и aVF), по поводу которых пациентка направлена в стационар с диагнозом: «ИБС. Заднедиафрагмальный инфаркт миокарда».
При объективном обследовании обращал на себя внимание умеренно интенсивный диастолический шум, выслушивавшийся над аортой и по правому краю грудины.
С учетом острого характера и длительности боли в грудной клетке в сочетании с выявленными признаками аортальной недостаточности, предположительно остро развившейся (не было сведений о существовавшем ранее пороке сердца, границы сердца в пределах нормы, отсутствовали признаки хронической сердечной недостаточности) было высказано предположение о наличии РАА восходящего отдела аорты.
Пациентка была госпитализирована в ОРИТ, где планировалось начать инфузию эсмолола, провести трансторакальную и, при необходимости, трансэзофагеальную ЭхоКГ.
Через 10 мин после поступления больная внезапно потеряла сознание, диагностировано прекращение кровообращения (электромеханическая диссоциация). Реанимационные мероприятия безуспешны.
Диагноз: «Расслаивающая аневризма восходящей аорты. Гемоперикард. Тампонада сердца».
При патологоанатомическом исследовании было обнаружено непротяженное расслоение восходящей аорты с надклапанным разрывом и кровоизлиянием в полость перикарда.
П. В. Долотовская, И. В. Грайфер, С. В. Ефремов, Н. В. Фурман
источник
Единой классификации, полностью отражающей суть артериальной аневризмы, не существует. Поэтому все классификации предлагается проводить с учетом: а) локализации; б) генеза
(происхождения); в) морфогистологических проявлений; г) клинических проявлений.
Патогенетическая классификация
- Истинные аневризмы.
- Ложные аневризмы.
- Расслаивающие аневризмы.
Морфологическая классификация
По форме:
- Мешковидная.
- Веретенообразная. По размерам:
- Малые аневризмы (D 3—5 см).
- Средние (D 5-7 см).
- Большие (D более 7 см).
- «Гигантские» (в 8-10 раз превышают диаметр инфраре-нального сегмента аорты).
Этиологическая классификация аневризм брюшной аорты
- «Врожденные».
- Травматические.
- Воспалительные (неинфекционные).
- Инфекционные — бактериальные, микотические, вирусные.
- Дегенеративные — диспластические (чаще вызванные атеросклерозом).
- Постартериотомические и анастомотические.
Классификация АБА по течению и клинике заболевания
- Асимптомное течение.
- Безболевое течение.
- Болевая стадия заболевания.
- Стадия осложнений:
- угрожающий разрыв;
- разрыв, прорыв;
- расслоение;
- некоронарогенная эмболизация в артерии. Поскольку наш клинический материал представлен неослож-
ненными формами АБА (324 операции), клиническое течение этих аневризм, наблюдаемое у наших больных, можно распределить следующим образом:
- асимптомное;
- безболевое;
- болевое.
В соответствующих разделах работы классификационные особенности аневризм брюшной аорты будут рассмотрены подробнее.
Разработанная и применяемая в НЦССХ хирургическая классификация (А. А. Спиридонов, 1992 г.) составлена с учетом двух основных критериев, определяющих оперативную тактику: проксимального уровня аневризмы и ее распространения на бифуркацию брюшной аорты (рис. 2). В связи с этим следует различать следующие аневризмы:
- Супраренальные:
- изолированные;
—диффузные, без вовлечения в процесс бифуркации брюшной
аорты;
- диффузные с вовлечением ее.
- Субренальные:
- изолированные, без вовлечения в процесс бифуркации брюшной аорты;
- диффузные с вовлечением ее.
- Инфраренальные:
- без вовлечения в процесс бифуркации брюшной аорты;
- с вовлечением ее.
Супраренальные изолированные аневризмы брюшной аорты, вовлекающие в процесс только проксимальные висцеральные ветви,
- чрезвычайно редкий вариант локализации процесса. Он чаще обусловлен неспецифическим аортитом, специфическими аортитами, а также может возникать в результате операции (эндартерэктомии) или ангиографического исследования. При этом оперативный доступ
- левосторонняя торакофренолюмбо-томия с укладкой больного на операционном столе на правый бок.
РУС. 2. Хирургическая классификация АБА по А. А. Спиридонову (1992 г.): а — супраренальные; 6 — субренальные; в —
инфрареналъные.
Супраренальные диффузные аневризмы без вовлечения в процесс бифуркации также чаще связаны с аортитом; при вовлечении бифуркации этиология их может быть как воспалительного, так и атеросклеротического характера. Инфраренальные аневризмы с выраженными атеросклеротическими бляшками (по данным Bergman, Yao, 1974 г.; Шалимова А. А. и др., 1979 г.) составляют 95-96%. Оперативный доступ — полная срединная ла-паротомия.
Учитывая, что наиболее распространенные на сегодняшний день хирургические классификации относят супраренальные аневризмы к аневризмам торакоабдоминального отдела аорты, хотелось бы подробнее остановиться на этом вопросе.
Общепринятой является классификация аневризм торакоабдоминального отдела аорты Е. S. Crawford (рис. 3), в основе которой лежит распространенность процесса и вовлечение магистральных ветвей аорты:
Классификация аневризм торакоабдоминального (ТАА) отдела аорты по Е. S. Crawford
- тип — от левой подключичной артерии до интерренального сегмента аорты;
- тип — от левой подключичной артерии до уровня бифуркации аорты;
- тип — от середины нисходящего отдела грудной аорты до бифуркации аорты;
- тип — от двенадцатого межреберья до бифуркации аорты.
Являясь в целом сторонниками классификации Е. S. Crawford, не можем не отметить имеющиеся в ней недостатки и противоречия:
- Относить ли истинные аневризмы грудной аорты с протяженностью поражения от перешейка до уровня диафрагмы к ТАА
- типа (если да, то каковы минимальные размеры этих поражений)?
Рис. 3. Классификация аневризм торакоабдоминального (ТАА) отдела аорты по Е. S. Crawford.
- К какой группе относить сегментарные поражения верхне-и среднегрудного отдела аорты?
- Подразумевает ли 1 тип возможность поражения дуги аорты и ее ветвей?
- Почему IV тип поражения, захватывая только брюшной отдел аорты, определяется как торакоабдоминальная аневризма и т. д.
Более логичной является классификация истинных аневризм грудной и брюшной аорты по локализации, которая считается общепризнанной. С учетом классификации Е. S. Crawford и нашими уточнениями современная классификация подобных поражений должна выглядеть следующим образом:
Классификация аневризм аорты по локализации
- Синуса Вальсальвы.
- Восходящей аорты.
- Дуги аорты.
- Перешейка аорты.
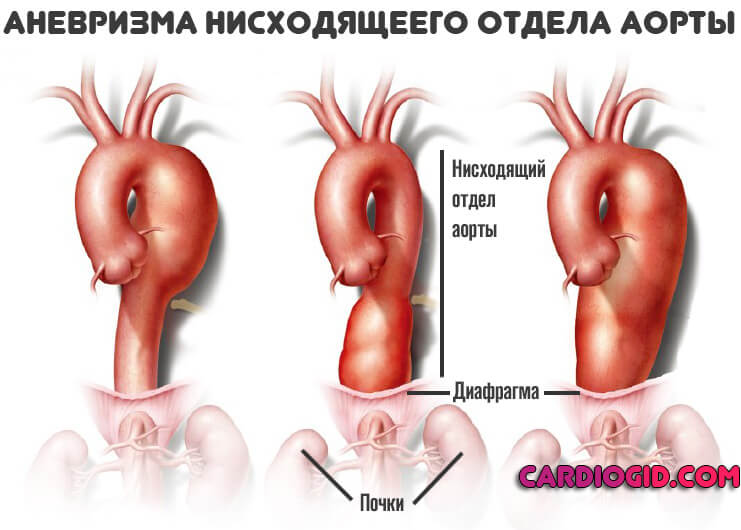
- Нисходящей грудной аорты.
- Торакоабдоминальной аорты:
- I тип — от левой подключичной артерии до интерренального сегмента аорты;
- II тип — от левой подключичной артерии до уровня бифуркации аорты;
- Ill тип — от середины нисходящего отдела грудной аорты до бифуркации аорты.
- Аневризмы брюшной аорты:
1)супраренальные:
- изолированные с вовлечением только висцеральных артерий;
- диффузные с вовлечением инфраренального сегмента аорты;
- диффузные с вовлечением бифуркации аорты и подвздошных артерий;
- субренальные (изолированные и диффузные);
- инфраренальные (изолированные, диффузные).
- Комбинированные аневризмы.
- Аневризмы анастомозов.
Принципиальным считаем выделение в отдельную группу субренальных аневризм в связи с высокой вероятностью поражения почечных артерий в этой группе, а также хирургической тактикой, требующей выполнения операции из торакофрено-люмботомии для ревизии почечных артерий и адекватной их пластики.
В заключение еще раз подчеркнем, что предложенные уточнения к существующим и признанным классификациям основаны на собственном клиническом материале более 1000 операций по поводу аневризм аорты и периферических артерий и обоснованы стремлением устранить существующий хаос в определении аневризм.
источник
Согласно общепринятым стандартам под аневризмой понимают локальное либо распространенное расширение артерии, превышающее более чем в 1,5 раза (на 2 см и более) его нормальный диаметр или близлежащий участок сосуда.
В зависимости от локализации выделяют следующие виды аневризм:
Восходящего отдела и дуги аорты.
По этиологии аневризмы делятся на:
а) невоспалительные (атеросклеротические; трaвматические, возникающие вследствие повреждения сосудистой стенки при колото-резаных либо пулевых ранениях);
б) воспалительные (развивающиеся при сифилисе, неспецифическом аортоартериите, а также микотические).
встречаются при коарктации аорты, синдроме Марфана, кистозном медионекрозе или болезни Эйдгеймера, синдроме Ehlers-Danlos.
В зависимости от формы аневризмы разделяют на:
По морфологии различают аневризмы:
1.Истинные (сохранены все слои сосудистой стенки).
Ложные (стенка сформирована соединительно-тканной капсулой, образованной вследствие выхода крови за пределы сосуда).
Расслаивающие (проникающие между слоями аорты).
В зависимости от клинического течения выделяют аневризмы:
По клиническим проявлениям аневризмы разделяют на:
Осложненные (расслоение стенки, разрыв).
Аневризмы грудной аорты (АГА) и торакоабдоминальной локализации представляют собой наиболее сложную в хирургическом плане и опасную по своим последствиям сосудистую патологию. Согласно данным литературы, 2-летняя выживаемость неоперированных больных с подобным заболеванием не превышает 25%, а 5-летняя — 13%, при этом более половины летальных исходов обусловлено разрывом аневризмы. Хотя достоверных данных о зависимости частоты разрыва АГА от ее размеров нет, достаточно точно установлено, что в сравнении с аневризмами брюшной аорты (АБА) риск этот значительно выше.
Основные причины развития АГА — дегенеративные процессы врожденного (синдром Марфана, коарктация аорты) либо приобретенного (артериальная гипертензия, атеросклероз) характера, изменяющие структуру и свойства мышечного, эластического и коллагенового компонентов стенки аорты. Возможны два варианта возникновения и прогрессирования АГА: с формированием аневризма-тического мешка веретенообразной или мешковидной формы; с расслоением (диссекцией) стенки аорты.
Большинство АГА протекают скрыто, поэтому первые симптомы появляются нередко достаточно поздно: при начавшемся расслоении стенки аорты либо разрыве аневризмы. Один из наиболее постоянных признаков этой патологии — боль, которая локализуется за грудиной, в области сердца, между лопаток, иррадиирует в шею. У отдельных лиц, страдающих данной патологией, отмечают одышку, сухой кашель, иногда охриплость голоса. Сосудистые шумы выявляют у 70% больных. Более чем у половины пациентов диагностируют артериальную гипертензию и ИБС. Неспецифичность всех перечисленных проявлений болезни делает проблематичным своевременное распознавание АГА на основе клинической симптоматики.
Традиционное рентгенологическое исследование органов грудной клетки позволяет у 30–48% больных заподозрить аневризму по следующим признакам: отклонение пищевода при контрастировании его Ba2SO4, расширение тени аорты и средостения, кальциноз стенки аневризмы.
Ультразвуковая диагностика АГА имеет меньшее в сравнении с распознаванием АБА значение. Более достоверную информацию дают ангиография, КТ и ЯМРТ. Они позволяют определить локализацию и размеры аневризмы, распространенность парааортальной гематомы, дифференцировать ложный и истинный просветы аорты при ее диссекции.
Наиболее информативным методом диагностики АГА считается чреспищеводная либо трансторакальная эхокардиография, чувствительность и специфичность этой неинвазивной процедуры достигает 88–98%.
Лечение АГА — хирургическое. Заключается оно в иссечении аневризмы и восстановлении кровотока путем реконструктивной операции или замещения аорты протезом. В связи с большим числом магистральных ветвей, отходящих от аорты к жизненно важным органам в этом отделе, и необходимостью сохранения данных ветвей и восстановления в них кровотока, вмешательства при аневризмах этой локализации считаются одними из самых травматичных.
Оперативные доступы. В зависимости от локализации патологического процесса применяют продольную (срединную) и поперечную (с двусторонней торакотомией) стернотомию, боковую торакотомию в четвертомпятом межреберье слева, торакофрено-люмботомию, тотальную срединную стернолапаротомию.
Операцию проводят в условиях искусственного кровообращения, умеренной фармакологической гипотонии либо временного обходного шунтирования.
источник
Версия: Справочник заболеваний MedElement
Под аневризмой брюшной аорты подразумевают :
- любое расширение диаметра инфраренального отдела брюшной аорты на 50% по сравнению с супраренальным;
- любое локальное веретенообразное расширение аорты диаметром на 0,5 см больше, чем диаметр нормальной аорты;
- любое мешковидное выпячивание стенки аорты (как явный признак патологического процесса).
- I тип — аневризма проксимального сегмента брюшной аорты с вовлечением висцеральных ветвей;
- II тип — аневризма инфраренального сегмента без вовлечения бифуркации;
- III тип — аневризма инфраренального сегмента с вовлечением бифуркации аорты и подвздошных артерий;
- IV тип — тотальное поражение брюшной аорты.
Этиология
К развитию аневризм приводят как врожденные заболевания (синдром Марфана, дефекты развития аортальной стенки, врожденная неполноценность эластики и др.), так и приобретенные (атеросклероз, сифилис, туберкулез, синдром Такаясу, ревматизм и др.), а также травмы живота. Аневризмы могут возникать и в области сосудистого шва после операций на аорте. Однако основной причиной образования аневризм брюшного отдела аорты в настоящее время является атеросклероз (80-95%). У 3% людей старше 50 лет, страдающих атеросклерозом, наблюдается аневризма брюшной аорты, а в возрасте старше 65 лет – у 6,5%.
Патогенез
Развитие аневризм брюшной части аорты, обусловлено в первую очередь дегенеративными или воспалительными изменениями стенки аорты.
Наиболее частое поражение инфраренального сегмента аорты зависит от следующих факторов:
— резкого уменьшения кровотока по брюшной части аорты дистальнее почечных артерий, поскольку около 23% от минутного объема крови поступает к внутренним органам, а 22%—к почкам;
— нарушение кровотока по vasa vasorum, вызывающего дегенеративные и некротические изменения в стенке аорты с замещением ее рубцовой тканью;
— постоянной травматизации области бифуркации брюшной части аорты о близлежащие костные образования (промонториум);
— бифуркация брюшной части аорты—практически первое непосредственное препятствие на пути кровотока, где впервые возникает «отраженная волна», что повышает гемодинамическую нагрузку на стенку аорты, и наряду с повышенным периферическим сопротивлением в артериях нижних конечностей приводит к увеличенному боковому давлению в инфраренальной части аорты.
Все эти факторы приводят к дегенерации и фрагментации эластического каркаса стенки аорты и атрофии ее средней оболочки. Основную роль каркаса аорты начинает выполнять наружная оболочка, которая не может адекватно предотвратить постепенное расширение просвета аорты. Отмечено также, что стенка аневризмы содержит меньше коллагена и эластина, нежели нормальная стенка аорты. Выявляется значительная фрагментация эластина. Передняя стенка аневризмы в норме содержит больше коллагеновых и эластических волокон, чем и обусловлена ее большая прочность. Задняя и боковые стенки аорты содержат меньше эластических структур и поэтому менее прочны. Разрывы аневризм брюшной части аорты в связи с этим происходят в основном в забрюшинное пространство. Напряжение стенки сосуда зависит, по закону Лапласа, от радиуса сосуда, поэтому возможность разрыва аневризмы большого диаметра увеличивается.
Признак распространенности: Крайне редко
Аневризма брюшной аорты обнаруживается, по данным различных авторов, в 0,16—1,06% всех вскрытий. Соотношение числа мужчин и женщин составляет 5:1. С увеличением возраста частота заболевания резко возрастает — для мужчин, умерших в возрасте до 50 лет, частота аневризм брюшной части аорты составляет 6%, свыше 60 лет—10%, свыше 70 лет—12%. Среди аневризм аорты аневризмы брюшной части аорты составляют большинство—80%. У 95-96% больных аневризмы, как правило, расположены ниже почечных артерий. Существует также прямая зависимость между размерами аневризм и их склонностью к разрывам. При малых аневризмах (диаметр аорты до 5 см.) выживаемость в течение 1 года составляет 75%, в течение 5 лет — 48%. Если диаметр аневризмы больше 6 см, то выживаемость в течение года — 50%, в течение 5 лет — лишь 6% .
- Возраст. Аневризма аорты чаще возникает у людей старше 60 лет.
- Табакокурение. Курение является одним из основных факторов риска формирования аневризмы грудной аорты. С увеличением стажа курения, повышается риск образования аневризмы.
- Артериальная гипертония. Повышенное артериальное давление повреждает кровеносные сосуды в организме и тем самым увеличивается риск развития аневризмы аорты.
- Атеросклероз. Повышение уровня холестерина и других веществ, которые могут повредить внутренний слой кровеносных сосудов, так же является важным фактором формирования аневризм.
- Пол. У мужчин аневризма аорты образуется чаще, чем у женщин. Однако женщины с аневризмой аорты имеют более высокий риск разрыва, чем мужчины.
- Раса. Аневризма аорты чаще возникает у белых людей, чем у людей других рас.
- Семейный анамнез. Если у кого-то в семье были случаи выявления аневризмы аорты, то его кровные родственники имеют повышенный риск развития аневризмы. У таких людей высока тенденция формирования аневризм в более молодом возрасте и выше риск ее разрыва.
Наиболее постоянным симптомом являются боли в животе. Они локализуются обычно в околопупочной области или в левой половине живота, могут быть непрерывными ноющими или приступообразными; иногда иррадиируют в поясничную или паховую область, у некоторых больных локализуются преимущественно в спине. Боли возникают вследствие давления аневризмы на нервные корешки спинного мозга и нервные сплетения забрюшинного пространства. Нередко больные жалуются на чувство усиленной пульсации в животе, ощущение тяжести и распирания в эпигастральной области, вздутие живота. Иногда снижается аппетит, появляются тошнота, рвота, отрыжка, запоры, похудание, что связано с компрессией желудочно-кишечного тракта либо с вовлечением в патологический процесс висцеральных ветвей брюшной аорты. Аневризма брюшной аорты может протекать бессимптомно. При осмотре больных в горизонтальном положении нередко выявляют усиленную пульсацию аневризмы. При пальпации в верхней половине живота, чаще слева от средней линии, определяют пульсирующее опухолевидное образование плотно-эластической консистенции, безболезненное или малоболезненное, чаще неподвижное. При аускультации над образованием выявляют систолический шум, проводящийся на бедренные артерии.
Ультразвуковое продольное и поперечное В-сканирование брюшной аорты, производится в трех стандартных позициях; под диафрагмой, на уровне висцеральных ветвей и над бифуркацией. В зависимости от эхографической картины предложено выделять три степени расширения диаметра брюшной аорты (В. А. Сандриков с соавт., 1996):
I степень — расширение брюшной аорты (диффузное или локальное): под диафрагмой и на уровне висцеральных ветвей — до 3 см; над бифуркацией — до 2,5 см;
II степень — формирующаяся аневризма брюшной аорты: под диафрагмой и на уровне висцеральных ветвей — до 4 см; над бифуркацией — до 3,5 см;
III степень — аневризма брюшной аорты: под диафрагмой и на уровне висцеральных ветвей — от 4 см; над бифуркацией — от 3,5 см (в том числе аневризма малых размеров — до 5 см).
При аневризме расширение брюшной аорты визуализируется как образование округлой формы, имеющее четкий наружный контур, анэхогенную центральную часть и гипоэхогенные пристеночные наложения с неровным нечетким контуром. Скорость кровотока в области аневризмы снижена, а поток крови носит турбулентный характер.
Для ангиографической диагностики аневризм брюшной аорты чаще применяется аортография по Сельдингеру в двух проекциях. Однако у больных с окклюзией подвздошных артерий или при наличии данных о расположении верхнего уровня аневризмы показано выполнение транслюмбальной аортографии. В выявлении супраренальных аневризм целесообразна катетеризация аорты через подмышечную артерию. Основным ангиографическим признаком аневризмы является расширение просвета определенного сегмента аорты по сравнению с выше- или нижележащим ее участком. Исходя из рентгенологической картины, аневризмы диаметром до 3 — 5 см считаются малыми, до 5 — 7 см — средними, До 7 — 16 см — большими, более 16 см — гигантскими. Вместе с тем истинная величина аневризмы может не соответствовать ее размерам на аортограмме из-за наличия пристеночного тромбоза. Кроме того, в случае полного тромбирования аневризмы контрастируете я лишь центральная часть аневризматической полости, создавая иллюзию неизмененной аорты. Перед началом аневризмы аорта изгибается влево. У большинства аневризм отсутствует контрастирование поясничных артерий.
На обзорной рентгенограмме органов брюшной полости при аневризме брюшной аорты выявляются тень аневризматического мешка и кальциноз стенки. В отличие от кальциноза аорты при атеросклерозе обызвествленная стенка аневризмы визуализируется наподобие выпуклой по отношению к позвоночнику дугообразной линии. Нередко видна узурация веретенообразная аневризма брюшного отдела аорты.
При рентгеноконтрастном исследовании органов, желудочно-кишечного тракта определяется смещение желудка, двенадцатиперстной кишки в сторону от центра брюшной полости. Внутривенная урография у больных с аневризмами дает сведения об отклонениях в положении мочеточников, их компрессии извне, пиелоэктазиях.
При КТ аневризма брюшной аорты имеет вид округлого образования с ровным контуром и тонкой стенкой, нередко с очагами кальциноза. Вдоль внутренней поверхности стенки находятся пристеночные тромбы в форме полулунного или плоского образования, изменяющего правильность сечения аорты.
МРТ также информирует о структуре аневризмы, состоянии ее контуров и висцеральных ветвей брюшной аорты, наличии тромботических масс, зон расслоения.
источник
А натомические дефекты сосудистых структур представляют колоссальную опасность для здоровья и жизни пациента. Включают в себя гетерогенную группу патологических процессов.
Проблема в том, что в большинстве своем указанные расстройства имеют латентное, вялое течение и не отличаются симптомами.
До определенного момента невозможно обнаружить проблему, если обращать внимание только на субъективные ощущения. Требуется качественная инструментальная диагностика.
Расслаивающая аневризма аорты — это нарушение целостности отдельных внутренних слоев сосуда, а затем тотальную деструкцию выстилки с развитием массивного кровотечения и гибелью больного в считанные секунды.
Частота или встречаемость процесса минимальна, в практике обнаруживается не более 1% пациентов с подобным страшным диагнозом.
Общая летальность близится к 40% даже при раннем выявлении патологии. Что связано с некоторыми трудностями оперативной коррекции (например, неудачная локализация дефекта или же множественное вовлечение участков).
Расслаивающаяся аневризма аорты имеет сложное происхождение. Речь не об одном факторе, а о целой группе нарушений органического плана.
Крайне редко это первичная патология. Много чаще говорят о вторичном типе, то есть таком, который обусловлен сторонними заболеваниями. Всего выделяют три механизма развития указанной проблемы.
Первый касается роста давления в системе. Изменение показателей АД вызывает стремительное изнашивание сосудов, снижается качество кровотока, начинаются дистрофические процессы.
Внутренняя выстилка и мышечный слой аорты истончаются, наружная оболочка не приспособлена для противодействия большим нагрузкам.
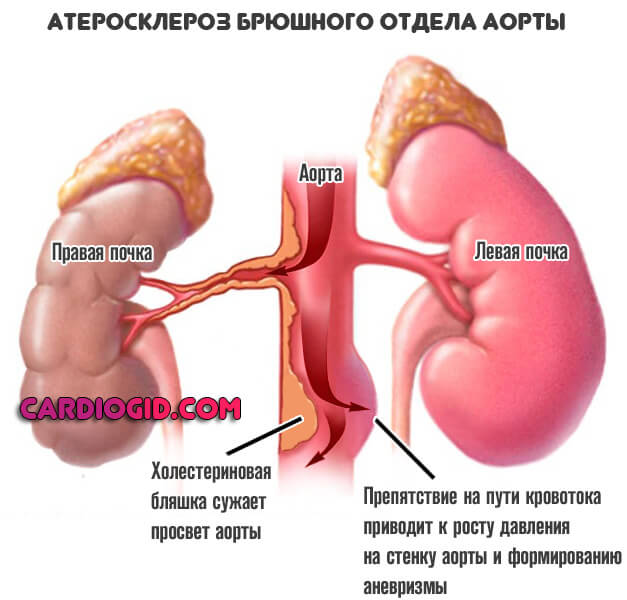
Второй весомый механизм — атеросклероз. Как правило, самостоятельного значения не имеет и идет в комплексе с ростом артериального давления, что объяснимо.
Закупорка просвета аорты холестериновой бляшкой или же стеноз (сужение) крупнейшей артерии приводит к невозможности нормального тока крови.
Организм отвечает на подобные препятствия усилением сердечной деятельности и ростом давления. Что и приводит уже по понятным причинам к дистрофии сосуда, деструкции стенок и повышает вероятность стеночного выпячивания.
Третий механизм имеет аутоиммунное происхождение. Возможны воспалительные процессы во внутреннем слое аорты, прямая деструкция стенок. Также встречается рубцевание просвета, образование фибриновых тяжей, препятствующих нормальному кровотоку.
Далее процесс идет по идентичной схеме. Рост давления в системе приводит к дистрофии (истончению стенки). Сосуд становится податливым, аномально пластичным.
Мышечный слой оказывается не способен поддерживать аорту в стабильном состоянии, противодействовать негативным факторам.
Потому происходит продавливание сосуда в одну из сторон или сразу по всему диаметру с развитием мешковидного или диффузного (веретенообразного) дефекта.
Уже на этом этапе возможен разрыв аневризмы и смерть от массивного кровотечения. Второй вариант — дальнейшая деструкция стенок.
Сначала жидкая соединительная ткань разрушает интиму (внутреннюю выстилку), затем просачивается в мышечный слой, потом в область наружной оболочки, пока не спровоцирует нарушения целостности и массивного кровотечения.
Полный «цикл» развития патологии, от старта до летального исхода составляет от 1 недели до 2 месяцев.
Известны случаи полугодового выживания, но это редкость и конец все равно идентичен. Без лечения спонтанного регресса не происходит, летального результата не избежать.
Как таковая типизация рассматриваемого дефекта не разработана, что связано с довольно малой распространенностью расслаивающей аневризмы аорты.
Основная классификация нарушения по локализации проводится по Де Бейки. Согласно ей выделяют три места расслоения:
- Первый тип. Порок расположен в восходящей части сосуда, может диффузно, экспансивно охватывать сразу группу участков (грудной и брюшной). Представляет собой наиболее встречаемый тип. При массивном поражении прогноз изначально хуже, потому как возрастает сложность предполагаемой операции.
- Второй тип. Отклонение локализуется строго изолированно, в восходящей части аорты. Также представляет трудности для хирурга, открытый доступ проблематичен, потому как мобилизовать сосуд непросто, слишком много тканей.
- Третий тип. Поражает нисходящий отдел аорты и брюшную часть включительно.
Существует упрощенная Стенфордская классификация. Согласно ей выделяют расслоение аневризмы, берущее начало в восходящем отделе аорты — тип (а) и в нисходящей части, тип (б).
Возможно подразделение расстройства также по симптомам (острое, хроническое), течению, размерам выпячивания (крайне запутанный критерий).
Универсальных методов подразделения нет. Врачей в первую очередь интересует диаметр патологического образования, скорость его прогрессирования и локализация.
Выяснение деталей позволяет снизить риски для пациента благодаря четкой, тщательной проработки оперативной стратегии.
Возможны два варианта течения расслаивающей аневризмы. Первый — острое. Представлено генерализовнанными признаками. Полная клиническая картина развивается в считанные секунды, отличается высокой тяжестью.
Продолжительность эпизода составляет несколько минут и менее, после чего наступает потеря сознания и гибель от массивного внутреннего кровотечения.
- Сильная, невыносимая боль. Располагается в области брюшины, спину, в грудной клетке. Зависит от локализации патологического процесса и его типа. Возникает внезапно, не купируется ничем. Вынуждает пациента принять положение лежа и не двигаться. Или же сесть.
- Потливость, бледность кожных покровов, выраженная одышка, слабость, тошнота, цианоз носогубного треугольника, спутанность сознания, предобморочное состояние. Так называемая коллаптоидная реакция. Объективно сопровождается падением уровня артериального давления.
- До становления описанного состояния возникает стремительный рост АД, на короткий промежуток времени.
Это типичные проявления. Прочие симптомы расслаивающей аневризмы аорты представлены ситуативными моментами, которые встречаются не у всех и не в каждом случае. Вероятность определяется в 1-15%.
- Боли в ногах, ощущение бегания мурашек, невозможность устоять, ходить.
- Почечная дисфункция. Сопровождается коликами в пояснице, задержкой мочи.
- Метеоризм, дискомфорт в животе. Причина кроется в нарушении соответствующего кровотока.
- Слабость мышц. Парезы, параличи. При снижении трофики нервных тканей спинного мозга.
- Боли в грудной клетке, отклонения ритма от нормального (по типу ускорения или урежения ЧСС), выраженная одышка.
- Потеря сознания. Сильная головная боль. При вовлечении в патологический процесс мозга, церебральных структур.
Расслаивающая аневризма грудного отдела аорты представлена наиболее полной клинической картиной.
Хроническая форма встречается примерно в 60% случаев. В то время как на долю острой приходится 20%. Остальные 20% определяются промежуточным типом.
- Боли в животе, запоры, диспепсические явления, артериальная гипертензия, которая не снимается препаратами и никак не реагирует на терапию. Встречается при поражении соответствующего одноименного отдела аорты.
- Дисфагия (невозможность глотать), нарушения голоса, процесса говорения, дыхания. По причине компрессии нервных тканей и самих систем, расположенных в грудной клетке. При значительных размерах аневризмы или же отклонения гемодинамики.
- Болевой синдром. Расположен в проекции сердца. Напоминает стенокардические или таковые при инфаркте. Однако это ложное впечатление.
- Отеки. В основном периферические. Страдают нижние и верхние конечности. Лицо.
- Посинение дермальных слоев. Возникает при компрессии вен, сопровождается ростом давления, одышкой.
- Нарушения зрения по типу потемнения, тумана в поле видимости.
- Наконец, обнаруживаются обмороки. Частые, пациента трудно вывести из подобного состояния.
Симптомы расслоения аневризмы, многообразны, но без должной подготовки и даже с таковой, но вне инструментальной диагностики определить, что стало причиной расстройства невозможно.
В некоторых клинических случаях, особенно сложных, патологический процесс маскируется столь хорошо, что даже по окончании обследования сказать что-либо конкретное не представляется возможным.
В основе развития расслаивающей аневризмы лежат врожденные и приобретенные патологии (соотношение — 30% против 70%).
Первые представлены соединительнотканными дефектами (синдром Морфана и прочие), анатомическими изменениями по типу стеноза аортального клапана, иных явлений. Они не обязательно провоцируют именно рассматриваемое расстройство. Вариантов множество.
Вторая группа отклонений многочисленна. Если ранжировать заболевания по встречаемости, обнаружится такая картина:
- Атеросклероз и гипертония. Также симптоматическое, стабильное повышение уровня давления в кровеносном русле. В сочетании они особенно опасны.
- Ятрогенный фактор. То есть врачебное вмешательство лечебного или диагностического плана. В основном — катетеризация аорты. Реже открытые или эндоваскулярные операции.
- Васкулиты вирусного, грибкового, бактериального, аутоиммунного (неинфекционного) рода. Сопровождаются воспалением сосудистых стенок, их деструкцией, рубцеванием.
- Перенесенные травмы грудной клетки. Особенно, если была вовлечена аорта.
Эндокринные факторы встречаются, но много реже. Обычно расслаивающая аневризма манифестирует в период беременности, на ранних сроках или в 3-й триместр. Настораживающим признаком оказывается тяжелый токсикоз.
В остальных случаях, если нет возможности определиться с фактором развития отклонения, говорят об идиопатической форме расстройства.
Выявить причину необходимо. Потому как даже после успешного хирургического вмешательства, полного восстановления, при самом благоприятном исходе ни один врач не даст гарантии отсутствии рецидива в будущем. Ведь патогенный фактор никуда не девается.
Среди редко встречающихся причин называют и сторонние инфекционные заболевания. Возможна транспортировка агентов в аорту, развитие воспаления и деструкции стенок.
Генетические врожденные синдромы генерализованного плана (например, Дауна) могут проявляться тем же неочевидным на первый взгляд образом.
Есть и предрасполагающие моменты, которые увеличивают риски развития расстройства: принадлежность к мужскому полу ( представители сильной половины человечества страдают рассматриваемым дефектом втрое чаще ), возраст от 55 лет и свыше (в связи с естественными процессами старения и воздействием накопленного груза заболеваний).
Выявление патологии ложится на плечи сосудистого хирурга. В основном. К кардиологу обратиться также можно, однако, это не профильный специалист. Обследование проводится в срочном порядке, времени на раздумья нет.
Примерный список мероприятий:
- Устный опрос больного. Направлен на выявление симптомов, выстраивание понятной клинической картины. Представляет собой основу.
- Сбор анамнеза. Перенесенные заболевания, образ жизни, семейная история (некоторые расстройства, особенно сопряженные с дефектами соединительной ткани передаются по наследству и повышают риски).
- Выслушивание сердечного звука. Аускультация. В 80% случаев обнаруживается синусовый шум над участочком локализации аневризмы.
- Рентгенография грудной клетке. Морально устаревшее исследование, дает минимум информации, но в рамках диагностики запущенных форм патологического процесса может оказаться полезным.
- Эхокардиография. УЗИ сердца и окружающих структур. Используется для визуализации грудного отдела аорты.
- Ультрасонография. Основная методика диагностики. Позволяет выявить дефект любой части крупнейшей артерии.
- МРТ-ангиография. Для визуализации тканей. Использовать контраст не имеет смысла, потому как кровь сама по себе хорошо усиливает рисунок. Компьютерная методика (КТ) применяется реже, она более предпочтительна в деле оценки состояния костных тканей.
После проведения тщательного обследования нужно начинать восстановление. Времени обычно не много.
Терапия строго хирургическая. Смысла в консервативных способах нет. Они не возымеют эффекта, зато время будет безвозвратно утрачено, а значит и шансы пациента на выживание и полное восстановление снизятся.
Открытым доступом. Суть заключается в иссечении аномальной, измененной области и ее ушивании. При необходимости проводится протезирование, либо эндоваскулярное вмешательство.
Хирургическое вмешательство представляет трудности, требует высокой квалификации врача. Порой дело осложняется «неудачной» локализацией дефекта.
Обязательное условие — лечение патологии, которая стала причиной расслаивающей аневризмы. Если речь о гипертонии — показаны специализированные средства (ингибиторы АПФ, бета-блокаторы, диуретики, лекарства центрального действия, антагонисты кальция).
При врожденных или приобретенных пороках проводится еще одна операция. Параллельно, как правило, несколько вмешательство не назначается, вопрос решается на усмотрение доктора.
Атеросклероз требует приема статинов, медикаментов, для растворения бляшек и выведения избытков холестерина.
Необходимо скорректировать образ жизни:
- Отказаться от курения, спиртного, психостимуляторов (наркотики), самовольного приема любых препаратов.
- Правильное питание (меньше животных жиров и соль до 7 граммов в сутки).
- Полноценный сон (не менее 7 часов за ночь).
- Адекватная, посильная физическая активность (оптимум — плавание или же прогулки неспешным шагом на свежем воздухе).
Соблюдение всех рекомендаций специалиста позволяет добиться максимального эффекта.
Лечение аневризмы проводится оперативными методами. Прочих вариантов не существует, потому терять время, надеяться на спонтанное самовосстановление не нужно.
Зависит от этапа, локализации дефекта, общего состояния здоровья пациента, первопричины аномалии и прочих факторов.
При раннем обнаружении и возможности «удобного» доступа к пороку — благоприятный. В остальных ситуациях — спорный.
Однозначно негативный только при разрыве образования. Шансы есть всегда. Опускать руки не стоит.
Общая летальность патологического процесса составляет порядка 40%, плюс-минус несколько процентов.
Без лечения смерть наступает в перспективе недели, максимум месяца. В исключительных ситуациях — полугода. Но это, скорее, казуистика, единичные случаи.
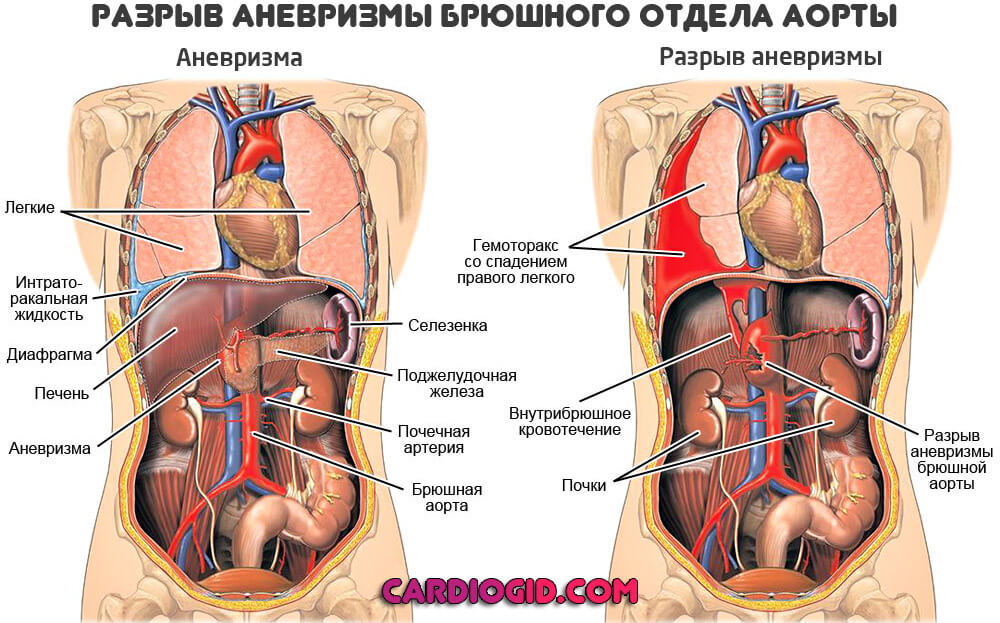
Основное и самое угрожающее последствие — разрыв аневризмы. С массивным кровотечением, гибелью человека. Тот же эффект наблюдается при прогрессирующем расслоении аорты в области мешотчатого или диффузного образования. Исход всегда один и тот же.
В процессе развития самого заболевания возможны грозные осложнения, спровоцированные сторонними явлениями.
Например, асфиксия вследствие компрессии дыхательных структур, инсульт, инфаркт на фоне недостаточного кровообращения в указанных тканях.
Расслаивающая аневризма аорты — смешанный патологический процесс. Сопровождается аномальным изменением крупнейшей артерии, деструкцией стенок.
Заканчивается смертью без лечения всегда . Единственный шанс на восстановление — своевременно провести операцию. Прогноз в такой ситуации благоприятный.
источник
По локализации:
а) грудного отдела: синуса Вальсальвы (А), восходящей части (В), дуги (С), нисходящей части (О), грудной и брюшной частей (Е), комбиниро
б) брюшного отдела: супраренальные (I тип)— аневризмы верхнего отдела брюшной аорты с вовлечением отходящих от нее ветвей, инфраренальные (II тип)— без вовлечения бифуркации аорты, инфраренальные (III тип)— с поражением бифуркации аорты и подвздошных артерий, тотальные аневризмы (IV тип);
По этиологии:
· невоспалительные (атеросклеротические, травматические);
· воспалительные (сифилитические, вследствие неспецифического аортоартериита, микотические и т. д.)
· идиопатические;
а) Мешотчатые – представляют собой локальное выпячивание стенки, занимающее не более половины диаметра аорты. Мешотчатые аневризмы брюшного отдела аорты подразделяются на
· боковые, распространяющиеся на подвздошные артерии (мешотчатые аорто-подвздошные аневризмы)
· спускающиеся в малый таз (аневризмы типа лягушки);
б) Веретенообразные — образуются вследствие равномерного расширения стенки аорты по всей или большей части окружности ее определенного сегмента;
По морфологическому признаку (строению аневризматического мешка):
а) Истинные аневризмы имеют строение, идентичное строению стенки аорты;
б) Ложные — стенка аневризмы образована рубцовой тканью;
- 1-й тип — аневризма проксимального сегмента брюшной аорты с вовлечением висцеральных ветвей;
- 2-й тип — аневризма инфраренального отдела без вовлечения бифуркации;
- 3-й тип — аневризма инфраренального отдела с вовлечением бифуркации аорты и подвздошных артерий;
- 4-й тип — тотальное поражение аорты.
*Инфраренальные составляют 89-96% локализованы инфраренально.
По размерам: малые – до 5 см, средние – 5-7 см, большие — более 7 см в диаметре.
По характеру клинического течения:
· осложненные (разрывом, расслоением, тромбозом, обызвествлением и т. д.)
Аневризма брюшного отдела аортыувеличение диаметра аорты более чем в 2 раза (в норме 18-20 мм). Частота 29-38% от всех локализаций.
Гемодинамические нарушения при аневризме БОА заключаются в замедлении и турбуленции потока крови, что ведет к увеличению бокового давления на ее стенки и росту аневризмы
Классификация аневризм по Алленбергу (Allenberg) в модификации Рейтеля (Raithel) выглядит следующим образом:
- Тип 1 — инфраренальная аневризма с адекватным проксимальным и дистальным перешейком.
- Тип 1а — изолированная инфраренальная аневризма.
- Тип 1в — инфраренальная аневризма с адекватным дистальным перешейком.
- Тип 2 — адекватный проксимальный перешеек.
- Тип 2а — аневризма, распространяющаяся до бифуркации аорты.
- Тип 2в — аневризма с вовлечением общих подвздошных артерий.
- Тип 2с — аневризма, распространяющаяся на подвздошные артерии, с вовлечением устий внутренних подвздошных артерий.
- Тип 3 — отсутствие адекватного проксимального перешейка.
| С хирургической точки важна локализация и протяженность поражения, что отображено в классификации Покровского |
Дата добавления: 2016-03-04 ; просмотров: 1011 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
источник
Первые описания аневризмы брюшной аорты относятся к XVI в. (Vesalius, 1557 г.; A. Pare, 1561 г.). Laennek впервые описал симптомы разрыва аневризмы брюшной аорты. Среди аневризм всех локализаций аневризмы брюшной аорты составляют 29-37,8%. Из всех патологических расширений аорты на долю брюшной ее части приходится 80%. Это тяжелое заболевание в клиническом и прогностическом плане и часто осложняется разрывом аневризмы. В последние годы отмечается рост числа больных этой патологией, что связывают с увеличением продолжительности жизни населения, распространенностью атеросклероза и совершенствованием диагностических методов. Частота аневризм брюшной аорты в России составляет 10-40 случаев на 100 тыс. населения. Около 80% больных старше 60 лет. Соотношение мужчин и женщин составляет примерно 10:1.
Причины развития аневризм брюшного отдела аорты разнообразны. Они указаны в ниже приведенной классификации. Основной причиной (80-85%) является атеросклероз. Современные представления (П.О. Казанчан, В.А. Попов, 2002) о патогенезе развития аневризмы брюшной аорты (АБА) можно свести к следующим механизмам :
1) атеросклеротические изменения стенки аорты;
2) изменения в матриксе аортальной стенки;
3) активация протеолиза в стенке брюшной аорты;
4) воспалительные изменения в стенке аорты;
5) генетические дефекты в синтезе фибриллярных белков брюшной аорты.
У 95-96% больных аневризмы расположены ниже почечных артерий, что связано, вероятно, с нарушением кровотока vasa vasorum этой области.
Наиболее рациональная классификация аневризм брюшной аорты, которой пользуется большинство авторов, предложена А.В. Покровским и Р.С. Ермолюк (1968 г.). Она построена с учетом этиологии, морфологического признака, локализации, клинического течения аневризмы.
- невоспалительные (атеросклеротические, травматические).
- воспалительные (специфические — сифилитические, инфекционные; неспецифические — при аортоартериите).
2. Врожденные (вследствие фибромускулярной дисплазии, кистозного медионекроза Эрдгейма, синдрома Марфана и др.).
II. По морфологическому признаку:
IV. По клиническому течению:
1-й тип — аневризма проксимального сегмента брюшной аорты с вовлечением висцеральных ветвей.
2-й тип — аневризма инфраренального отдела без вовлечения бифуркации.
3-й тип — аневризма инфраренального отдела с вовлечением бифуркации аорты и подвздошных артерий.
4-й тип — тотальное поражение брюшной аорты.
Важно отметить, что большинство аневризм (90-95%) локализуются в инфраренальном отделе.
Представленная ниже классификация аневризм по Алленбергу (Allenberg) в модификации Рейтеля (Reithel) учитывает только анатомическое положение аневризмы и ориентирует хирурга на выбор метода хирургической реконструкции.
Тип 1 — инфраренальная аневризма с адекватным проксимальным и дистальным перешейком.
Тип 1а — изолированная инфраренальная аневризма.
Тип 1в — инфраренальная аневризма с адекватным дистальным перешейком.
Тип 2 — адекватный проксимальный перешеек.
Тип 2а — аневризма, распространяющаяся до бифуркации аорты.
Тип 2в — аневризма с вовлечением общих подвздошных артерий.
Тип 2с — аневризма, распространяющаяся до подвздошных артерий, с вовлечением устий внутренних подвздошных артерий. Тип 3 — отсутствие адекватного проксимального перешейка.
Аневризмы до 4-7 см в диаметре не вызывают субъективных жалоб. Иногда аневризма аорты выявляется случайно. Асимптомное течение болезни может наблюдаться у 25-45% больных. При наличии симптомов больные отмечают тупые, ноющие боли в животе (в 90% случаев), наличие пульсирующего образования (60%). Над аневризматическим расширением выслушивается систолический шум (75%). Это основные симптомы аневризмы брюшной аорты (АБА). Почти у 1/4 больных имеет место отсутствие аппетита, похудание, отрыжка, рвота, неустойчивый стул или запоры, что может быть обусловлено компрессией двенадцатиперстной кишки или вовлечением в патологический процесс висцеральных ветвей аорты. Артериальная гипертензия выявляется у 60% больных. Может наблюдаться ишиорадикулярный синдром с чувствительными и двигательными расстройствами. Он вызван компрессией корешков спинного мозга в поясничном отделе. Симптомы ишемии нижних конечностей могут быть связаны с эмболией фрагментированными тромботическими массами из полости аневризмы и сопутствующими окклюзирующими поражениями магистральных и периферических артерий.
Тяжесть клинического состояния пациентов преимущественно пожилого возраста диктует необходимость правильной оценки состояния как самой аневризмы, так и сопутствующих заболеваний. В диагностическом алгоритме обследования больных, помимо общеклинических, применяются следующие методы исследования:
- обзорная рентгенография брюшной полости;
- рентгенологическое исследование органов грудной полости;
- ультразвуковое дуплексное сканирование брюшной аорты, артерий нижних конечностей и брахиоцефальных артерий;
- компьютерная томография брюшной аорты;
- ядерно-магнитно-резонансная томография брюшной аорты;
- рентгеноконтрастная ангиография;
- электрокардиография;
- эхокардиография;
- исследование функции почек (выделительная урография и изотопная ренография);
- исследование функции внешнего дыхания;
- исследования состояния желудочно-кишечного тракта;
У большинства больных диагноз аневризмы можно поставить без использования инвазивных методов исследования, но перед хирургическим вмешательством рентгеноконтрастная аортоартериография необходима для уточнения состояния магистральных и периферических артерий.
Дифференциальный диагноз проводится с забрюшинной липомой, пакетом увеличенных забрюшинных лимфатических узлов, лимфосаркомой, опухолями желудка, кишечника, поджелудочной железы. Ошибочный диагноз возможен при наличии опухоли или подковообразной почки, при опущенной, блуждающей почке, когда она прилежит к аорте и имеет передаточную пульсацию. Данные проведенного исследования уточняют клиническую картину.
Прогноз неблагоприятный. Только 10-36,4% больных живут свыше 5 лет после установления диагноза без оперативного вмешательства, 50-70% пациентов умирают от разрыва аневризмы и кровотечения.
Наблюдения за больными показали, что аневризмы диаметром менее 3 см увеличиваются за год в среднем на 0,21 см, диаметром 3-4,9 см — на 0,43 см и при диаметре 6 см — до 0,75 см в год. Более 80% аневризм прогрессивно увеличивается в размерах, 15 — 20% — не изменяется. Аневризмы диаметром 4 см и менее осложняются расслоением и разрывом в 9,5% случаев, диаметром 4 — 6 см — в 23,4% и диаметром 7 — 10 см — в 45,6% случаев. На этом строятся показания к хирургическому лечению. При увеличении диаметра аневризмы более 5 см в год показания к операции абсолютные. Возраст сам по себе не является противопоказанием к операции.
При определении риска операции следует выделить три уровня:
- первый — возраст больных старше 75-85 лет, легкой степени нестабильная стенокардия с фракцией выброса менее 50%, но выше 30%, креатининемия менее 2 мг%;
- второй — возраст 85-90 лет, стабильная стенокардия, инфаркт миокарда в анамнезе, фракция выброса менее 30%, но выше 20%, нарушение функции легких, креатининемия 2-3,5 мг%;
- третий — возраст старше 90 лет, стенокардия II-III классов.
Впервые в мире успешную резекцию аневризмы брюшной аорты с замещением ее гомотрансплантатом выполнил Шарль Дюбост (С. Dubost) в 1951 г. во Франции. Большой вклад в развитие хирургического лечения этой патологии внесли Де Беки, Е. Крауфорд и Кули (М. De Bakey, Е. Crawford, D. Cooley), применившие гофрированные синтетические протезы. В России аналогичное вмешательство при данной патологии впервые выполнено В.А. Жмуром в 1958 г.
Лечение аневризм только хирургическое и заключается в резекции аневризмы с замещением ее синтетическим протезом. Противопоказания к плановой операции: свежий инфаркт миокарда (менее 1 месяца.), острое расстройство мозгового кровообращения (до 6 недель), тяжелая легочная недостаточность, недостаточность кровообращения II Б-III степени, выраженное нарушение функции печени, почечная недостаточность, распространенная окклюзия подвздошных и бедренных артерий.
В профилактике различных послеоперационных осложнений большое значение имеет выбор оптимального оперативного доступа. При инфраренальных АБА наиболее рациональной является полная срединная лапаротомия. В некоторых случаях возможно применение и внебрюшинных доступов — левостороннего параректального и доступа по Робу.
Резекция аневризм надпочечной локализации — одна из наиболее сложных и продолжительных операций. Адекватный подход ко всему брюшному отделу аорты, к висцеральным и почечным артериям обеспечивает комбинированный торакоабдоминальный доступ: торакофренолюмботомия или торакофренолапаротомия. Для пластики висцеральных ветвей используют аллопротезирование их отдельными протезами, которые вшивают в аортальный протез, или производят реплантацию артерий в аортальный протез. При необходимости реваскуляризации нижних конечностей эти доступы дополняются бедренными разрезами.
Новым методом лечения АБА является дистанционное эндоваскулярное протезирование пораженного сегмента аорты трансплантатом, вводимым через разрез бедренной или чаще подвздошной артерий и фиксируемым в области шейки и дистально от аневризматического мешка с помощью каркасных конструкций-стентов. Существуют различные модификации этого метода. Подобные вмешательства позволяют свести до минимума риск у тяжелых больных и получить хорошие результаты.
Задачей ближайшего послеоперационного периода после резекции АБА является поддержание стабильной гемодинамики, адекватного внешнего дыхания и хорошей функции почек. Серьезным осложнением может быть кровотечение, которое является абсолютным показанием к повторной операции.
Летальность при плановых операциях в большинстве клиник составляет 3,5-5%. Осложнения, которые могут иметь место в отдаленные после операции сроки, следующие: аортокишечные свищи, ложные аневризмы, ишемия кишечника, инфицирование протеза.
Избранные лекции по ангиологии. Е.П. Кохан, И.К. Заварина
источник