Аневризмой называется остро возникшее или постепенно формирующееся мешкообразное выпячивание сердечной стенки, возникшее в силу патологических изменений нормальной мышечной ткани. Аневризма может быть локализована в стенке и предсердий, и правого желудочка, но в связи с анатомо-функциональными особенностями сердца, чаще всего формирование аневризмы происходит в стенке левого желудочка. По статистике, аневризма левого желудочка развивается у 5-20% пациентов, перенесших острый инфаркт миокарда, и чаще диагностируется у лиц мужского пола старше 50 лет.
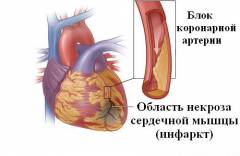
Аневризма левого желудочка представляет собой рубцовую ткань, которая формируется в том участке миокарда, в котором локализованы некротические или воспалительные процессы. Механизм развития аневризмы заключается в следующем. Нормальная мышечная ткань представлена гладко-мышечными волокнами, которые выполняют сократительную функцию. Для того, чтобы сокращаться в полную силу, волокнам необходима бесперебойная доставка кислорода с кровью, притекаемой по коронарным артериям. В случае закупорки артерии возникает острая нехватка кислорода в сердечной мышце (гипоксия) и развивается некроз, или отмирание сердечных клеток. Сердечная мышца в данном участке некроза превращается в “мягкую” ткань (процесс называется миомаляцией), и стенка сердца не способна выдержать высокое давление крови, нагнетаемой в желудочек из предсердной полости. Кроме этого, этот участок миокарда не способен нормально сокращаться в систолу и расслабляться в диастолу, и определенный кровяной объем так и остается в сформированном аневризматическом мешке. Такой механизм формирования аневризмы обусловлен острым инфарктом миокарда.
Формирование постинфактной аневризмы ЛЖ
Кроме острого инфаркта, аневризма левого желудочка может быть сформирована при развитии постинфарктного кардиосклероза. Кардиосклероз – это процесс развития соединительнотканных (рубцовых) волокон на месте погибших кардиомиоцитов. Другими словами, в сердце формируется рубец, которого в норме быть не должно. В том случае, если инфаркт миокарда был обширным, трансмуральным или циркулярным, рубцовой ткани в сердце становится слишком много, но она не может вынести тех нагрузок, которые испытывает мощная сердечная мышца. Под воздействием кровяного давления образуется постинфарктная аневризма. Таким образом, аневризма после инфаркта чаще развивается у тех пациентов, которые переносили обширный инфаркт, особенно повторно.
Не только некроз кардиомиоцитов может привести к образованию рубцовой ткани в сердце. Острые или хронические воспалительные процессы в сердечной мышце также приводят к истончению сердечной стенки за счет соединительной ткани. Такие процессы называются миокардитами, и вызваны они могут быть чем угодно. Чаще всего миокардит вызывается вирусами (грипп, ветрянка, брюшной тиф и др), бактериями (сифилис, стрептококки, стафилококки, пневмококки и др), грибками или обусловлен аутоиммунным воспалением в сердечной мышце, как, например, это бывает при системной красной волчанке или ревматизме.
Из провоцирующих факторов, способствующих развитию выпячивания в стенке сердца, следует отметить высокие цифры артериального давления и отсутствие строго постельного режима в первые недели после острого инфаркта или миокардита. Вот почему так важно лечить причинные заболевания в условиях стационара, контролировать гипертонию и строго следовать рекомендациям врача.
Клиническая картина аневризмы сердца не является строго специфичной. Другими словами, симптомов, по которым можно четко определить аневризму, не существует. Однако, быстрое прогрессирование сердечной недостаточности после обширного инфаркта миокарда, частая ее декомпенсация могут свидетельствовать о формировании выпячивания в стенке сердца.
Итак, симптомами, которые должны насторожить пациента и врача, являются следующие:
- Быстрое развитие (в течение нескольких недель и месяцев) левожелудочковой недостаточности, которая проявляется нарастанием одышки при физической активности и в покое, усиливающейся в положении лежа. У пациента снижается переносимость обычных бытовых нагрузок – пациент после инфаркта не может завязать шнурки, приготовить пищу, спокойно пройти в другую комнату без одышки.
- При инфаркте миокарда с аневризмой у пациента в остром периоде отмечаются частые приступы острой левожелудочковой недостаточности, проявляющиеся эпизодами сердечной астмы (сухой навязчивый кашель и учащение дыхания) и/или отека легких (влажный кашель с пенящейся мокротой, посинение кожи и другие признаки).
- Быстрое присоединение правожелудочковой недостаточности, которая проявляется отечностью нижних конечностей. У пациента буквально за несколько дней может увеличиться живот, что обусловлено застоем крови в печени и выпотом жидкости в брюшную полость (асцит). Отеки могут распространиться по всему телу (анасарка).
При появлении подобных признаков пациенту необходимо незамедлительно обратиться в поликлинику или в скорую помощь с целью дообследования и лечения.
Немаловажным в установке диагноза аневризмы является полноценный осмотр пациента. Так, в подавляющем числе случаев врач может увидеть патологическую прекардиальную пульсацию, которая определяется как периодическое выпячивание передней грудной стенки в 3-4 межреберьях слева от грудины, совпадающее с частотой сердечных сокращений. Этот феномен назван симптомом “перекатывающейся волны” или симптомом “коромысла”.
Кроме осмотра, при аускультации сердца можно выслушать систоло-диастолический шум, называемый “шумом писка”, но он выслушивается у незначительной части пациентов. Кроме этого, при выслушивании легких можно определить единичные или множественные, сухие или влажные хрипы в нижних отделах легких при сердечной недостаточности.
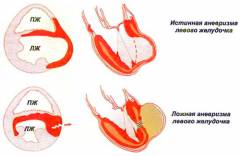
Также помимо истинной аневризмы левого желудочка, принято выделять ложную, обусловленную выпячиванием участка сердечной сумки – перикарда. Отличия – на рисунке ниже:
Если у врача возникло подозрение на формирование аневризмы сердца, он направляет пациента на обследование. Из методов диагностики информативными являются следующие:
- Электрокардиограмма. На ЭКГ аневризма, достигшая значительных размеров, характеризуется признаками острого повреждения миокарда и его некроза. В таком случае говорят о том, что ЭКГ имеет “застывший вид” острого инфаркта миокарда. Однако, отсутствие признаков инфаркта на ЭКГ еще не говорит о том, что у пациента нет аневризмы сердца.
- Рентгенография. Рентгенограмма органов грудной полости у пациентов с аневризмой, достигшей больших размеров, характеризуется увеличением тени сердца в поперечнике, а также выпячиванием сердечного контура. В том случае, когда аневризма имеет небольшие размеры, рентгено-диагностические методы оказываются малоинформативными.
- Эхокардиоскопия (эхо-кардиография, УЗИ сердца). Является информативным методом диагностики, так как позволяет не только уточнить форму, локализацию и размеры аневризмы, но еще и выявить наличие пристеночных тромбов, которые могут представлять значительную опасность для пациента.
- Компьютерная, магнитно-резонансная и мульти-спиральная компьютерная томография сердца (КТ, МРТ и МСКТ) являются самыми информативными методами выявления аневризмы и используются в качестве дополнения для УЗИ сердца в диагностически неясных случаях.
Консервативная терапия аневризмы неэффективна, поэтому медикаментозные препараты назначаются для лечения воспаления в остром периоде миокардита, для восстановления кровотока в миокарде при остром инфаркте, а также для профилактики или для лечения уже развивающейся хронической сердечной недостаточности.
Тактика лечения аневризмы может быть выжидательной или хирургической. В первом случае за пациентом осуществляется динамическое наблюдение – раз в полгода или раз в год ему необходимо посещать кардиолога с проведением ЭКГ, рентгенографии органов грудной клетки и УЗИ сердца. При увеличивающихся размерах аневризмы, или при появлении выраженных симптомов, значительно нарушающих качество жизни, пациенту может потребоваться кардиохирургическое вмешательство.
Средние (несколько сантиметров) и гигантские размеры аневризмы, когда выпячивание по объему сопоставимо с полостью самого левого желудочка, требуют проведения операции. При этом операция может быть выполнена как без разреза сердечной стенки, так и на открытом сердце с использованием аппарата искусственного кровообращения (АИК).
Методика операции заключается в ушивании аневризмы, в укреплении (пластике) аневризмы другими тканями, либо в резекции аневризмы.
- В первом случае выпячивание не вскрывается, а как бы погружается в стенку сердца с помощью швов, фиксирующих его к самому миокарду. Такая операция применяется при средних размерах аневризмы, которая не сильно выпячивается кнаружи и не сильно возвышается над поверхностью сердца. Оперативный доступ не требует вскрытия стенки сердца.
- Во втором случае аневризма не удаляется, а к стенке сердца подшивается лоскут из диафрагмы, питание которого осуществляется с помощью сосудистой ножки. Разреза стенки сердца не требуется, а операция применима при средних размерах аневризмы, которая диффузно охватывает миокард, и также не сильно возвышается над наружной поверхностью сердца. Оперативный доступ к диафрагме и к сердцу осуществляется посредством разреза грудной клетки в шестом межреберье слева с вскрытием плевральной и перикардиальной полостей.
- Резекция аневризмы является радикальным (то есть удаляющим аневризму насовсем) методом лечения – стенку аневризмы иссекают, удаляют ее часть и ушивают специальными швами. Операция проводится на открытом сердце, с применением АИК. После оперативного доступа и накладывания швов на аневризматический мешок важно как можно быстрее вскрыть купол аневризмы и наложить швы (обычно кардиохирург выполняет данную манипуляцию за 40-60 секунд). Оставшееся время занимает ушивание дефекта в стенке сердца и наложение диафрагмального лоскута.
После операции пациент несколько дней должен находиться в кардиохирургическом отделении с целью наблюдения и предупреждения постоперационных осложнений.
Аневризмы ЛЖ незначительных размеров обычно не представляют опасности для жизни пациента, хотя в редких случаях могут провоцировать тромбоэмболические осложнения вследствие формирования пристеночных тромбов в полости сердца, которые током крови разносятся по другим артериям и могут стать причиной инфаркта, инсульта, тробоэмболии легочной или брызжеечной артерий (ТЭЛА и мезентериального тромбоза).
Осложнения при аневризмах средних и гигантских размеров встречаются чаще, и заключаются в следующем:
- Тромбоэмболические осложнения,
- Прогрессирование хронической сердечной недостаточности, развитие острой сердечной недостаточности,
- Разрыв аневризмы, приводящий к быстрой гибели пациента.
Профилактикой осложнений является своевременное выявление роста аневризмы, регулярное обследование у врача, а также своевременное выявление показаний для оперативного лечения.
Осложнения после кардиохирургического вмешательства встречаются редко и заключаются в развитии тромбоэмболии, воспалительных процессов в постоперационной ране, а также в рецидиве аневризматического выпячивания при погружении или пластике аневризмы. Профилактикой является тщательное наблюдение за больным в раннем (в условиях стационара), а также в постоперационном периодах (в условиях поликлиники).
Прогноз при аневризме после инфаркта определяется, исходя из ее размеров и локализации. Так, аневризмы небольших размеров, диффузно локализующиеся на передней стенке ЛЖ или аневризмы верхушки левого желудочка, не требующие оперативного лечения, характеризуются благоприятным прогнозом для жизни и здоровья пациента.
Аневризмы средних и гигантских размеров часто являются причиной тяжелой сердечной недостаточности и тромбоэмболий, поэтому без лечения в данном случае прогноз неблагоприятный. После операции прогноз улучшается, так как у 90% пациентов качество жизни повышается, а пятилетняя выживаемость увеличивается.
источник
На ЭКГ определяются «застывший», без динамики в течение 2 недель (при хронической аневризме подъем сегмента ST сохраняется более 6 недель) монофазный подъем сегмента ST чаще в V2_4 (напоминающий острую стадию трансмурального ИМ), несмотря на реперфузию; отсутствие и замедление образования отрицательного зубца Т; рецидивирующая ЖТ. Рентгенологически выявляются увеличенные размеры сердца с неправильными его контурами (локальное выпячивание по контуру ЛЖ или участка в области верхушки сердца).
ЭхоКГ — метод выбора, позволяющий визуализировать аневризму (выпячивание миокарда, дискинезию и истончение стенки ЛЖ).
Лечение аневризмы левого желудочка. Сводится к терапии нарушений ритма, ОСН и назначению антикоагулянтов на 6 месяцев и более. При длительном существовании аневризмы прогрессирует ХСН, возникают повторные эмболии (в том числе и в мозг). У трети больных с аневризмой может быть ее самопроизвольный разрыв без появления предостерегающих симптомов. В целях снижения риска смерти показана хирургическая коррекция аневризмы как у больных с симптоматикой, так и без нее.
Обызвествленная аневризма левого желудочка (большая стрелка)
как последствие заднего инфаркта миокарда на неконтрастном изображении при МДКТ
(маленькая стрелка — электрод кардиостимулятора).
При острой аневризме, отягощенной ОСН, проводят лечение с помощью расширяющих сосуды ЛС; ИАПФ (уменьшающих расширение зоны некроза и ремоделирование миокарда), назначаемых после 24 ч от начала ИМ, если это позволяет уровень АД и ВАБК. У больных с наличием пристеночного тромба проводится антитромботическое лечение: внутривенно гепарин (в дозе, удлиняющей АЧТВ до 50-65 с) и оральные антикоагулянты непрямого действия (варфарин) в течение 3-6 месяцев (целевое MHO — 2,0—3,0).
Больным с хронической аневризмой на фоне нормальной функции ЛЖ, но с наличием желудочковой аритмии, резистентной к фармакологическому лечению, показана постановка кардиовертера-дефибриллятора.
В поздние сроки пациентам с утяжелением ХСН, стенокардией или наличием резистентной к терапии ХСН или желудочковой аритмии необходима резекция аневризматического мешка (с замещением дефекта) в целях сохранения соответствующей формы ЛЖ (если сохранена контрактильная способность оставшегося миокарда).
Для профилактики образования аневризмы сердца при ИМ рано назначают ИАПФ и проводят агрессивное лечение — тромболизис или коронарную ангиопластику, восстанавливающую проходимость инфарктсвязанной артерии и имеющую положительное влияние на ремоделирование ЛЖ (уменьшающую его дилатацию и зону некроза).
Аневризмой левого желудочка (ЛЖ) обычно называют участки стенки левого желудочка (ЛЖ) с парадоксальным (дискинетическим) расширением в фазу систолы. При хронической фиброзной аневризме эффективность работы желудочков снижена главным образом из-за потери сократительной ткани. Если аневризма состоит из комплекса рубцовой ткани и жизнеспособного миокарда или представляет собой истонченную рубцовую ткань, функция левого желудочка (ЛЖ) также нарушается из-за парадоксального расширения левого желудочка (ЛЖ) и уменьшения эффективности сокращения.
Ложные аневризмы (псевдоаневризмы) представляют собой локальные разрывы миокарда, кровотечение из которых ограничивается адгезией перикарда, при этом устье аневризмы намного меньше, чем максимальный размер полости. Истинные и ложные аневризмы могут сочетаться, хотя такая комбинация встречается чрезвычайно редко.
Частота выявления аневризмы левого желудочка (ЛЖ) зависит от случаев трансмурального ИМ и ХСН в исследуемой популяции больных. Благодаря широкому применению острой реперфузионной терапии при развивающемся ИМ частота аневризмы ЛЖ и потребность в аневризмэктомии за последние 5-10 лет значительно снизились.
Более 80% аневризм левого желудочка (ЛЖ) имеют переднебоковую локализацию рядом с верхушкой и часто ассоциируются с полной окклюзией ЛПНА и слабым коллатеральным кровотоком. От 5 до 10% аневризм имеют заднюю локализацию. 75% больных с аневризмой имеют многососудистую КБС.
Почти у 50% больных с аневризмой среднего и большого размера диагностируют СН, в т.ч. сопровождающуюся стенокардией, 33% имеют только тяжелую стенокардию и 15% — клинически выраженные желудочковые аритмии, носящие упорный и угрожающий характер. Почти у 50% больных с хронической аневризмой ЛЖ наблюдается пристеночный тромбоз, который может быть выявлен при ангиографии и двухмерной ЭхоКГ.
Системная эмболия у больных с тромбозом и аневризмой ЛЖ чаще возникает в раннем постинфарктном периоде. При хронической аневризме ЛЖ (установленной не ранее 1 мес после ИМ) риск последующей системной эмболии чрезвычайно низок (0,35 на 100 больных в год при отсутствии приема антикоагулянтов).
Диагностика аневризмы левого желудочка (ЛЖ). На аневризму указывают стойкая элевация сегмента ST на ЭКГ в покое (в отсутствие боли в груди) и характерное округлое выбухание контура левого желудочка на рентгенограмме. На силуэте ЛЖ может быть отчетливо видна кальцификация. Если эти признаки выявляются отчетливо, они достаточно специфичны, но имеют ограниченную чувствительность.
При радионуклидной вентрикулографии и двухмерной эхокардиографии аневризма ЛЖ выявляется значительно легче. ЭхоКГ позволяет также дифференцировать истинную аневризму от ложной, устье которой намного меньше размера полости. Цветовая визуализация кровотока при ЭхоКГ облегчает диагностику, т.к. позволяет выявлять ток крови «в и из» аневризмы, а также аномальный ток внутри аневризмы; последующая пульсовая допплерография помогает обнаружить динамику по типу «туда и сюда» с характерной респираторной вариабельностью на пике систолической скорости. КМРТ — наиболее информативный неинвазивный метод для дооперационной оценки формы желудочков, степени утончения стенки и резектабельности.
Сердце в фазу систолы и фазу диастолы при наличии истинной и ложной анатомической и функциональной аневризмы левого желудочка (ЛЖ) и зарубцевавшегося ИМ.
Для сравнения представлено нормальное сердце (на цветном фоне).
(А) Истинная анатомическая аневризма ЛЖ выбухает как во время систолы, так и во время диастолы; устье имеет такой же размер,
как максимальный диаметр аневризмы, или шире; измененная стенка ЛЖ состоит из фиброзной ткани с наличием или без остаточных миокардиальных волокон.
Истинная аневризма может содержать или не содержать тромб, а после рубцевания ИМ почти никогда не подвергается разрыву.
(Б) Ложная анатомическая аневризма ЛЖ. Ее устье значительно меньше максимального диаметра аневризмы и представляет собой зону разрыва миокарда,
имеет стенку, состоящую из париетального листка перикарда, почти всегда содержит тромб и часто разрывается.
(В) Функциональная аневризма ЛЖ выбухает только во время систолы, состоит из фиброзной ткани с наличием или без миокардиальных волокон.
Ао — аорта; ЛП — левое предсердие.
Операция при аневризме левого желудочка (ЛЖ). Истинные аневризмы ЛЖ не подвержены разрыву, их хирургическое иссечение проводят для уменьшения тяжести клинической симптоматики, чаще всего СН и иногда стенокардии, снижения угрозы эмболии и опасных для жизни тахиаритмий. Одновременно с аневризмэк-томией часто выполняют коронарную реваскуляризацию, особенно если СН сочетается со стенокардией.
Наличие большой аневризмы ЛЖ у больных с симптомами СН служит показанием к хирургическому лечению, особенно при сопутствующей стенокардии. Операционная смертность при аневризмэктомии ЛЖ составляет 8% (2-19%), в более поздних наблюдениях — не более 3%. ФР ранней смерти считают ослабление функции ЛЖ, трехсосудистое поражение, недавно перенесенный ИМ, митральную регургитацию и упорную желудочковую экстрасистолию.
Наличие в дооперационном периоде в качестве основного симптома стенокардии, а не одышки ассоциируется с более низкой операционной смертностью. Риск операции особенно высок, если при ЭхоКГ выявляют тяжелую СН, низкий СВ и акинезию МЖП. Акинезия и дискинезия заднебазальных отделов ЛЖ и значимый стеноз ПКА считаются дополнительными ФР.
К факторам, ухудшающим прогноз отдаленной смертности и выживаемости после операции, относят неполную реваскуляризацию, нарушенную систолическую функцию в базальных отделах ЛЖ и МЖП, не относящихся к аневризме, большие размеры аневризмы при малом объеме жизнеспособного миокарда и наличие тяжелой СН в качестве основного симптома.
Есть сведения об улучшении функции ЛЖ у больных, перенесших резекцию аневризмы ЛЖ. Реконструкция передней стенки Л Ж может привести к обратному ремоделированию сердца, переупорядочению контрактильных волокон и снижению напряжения стенки желудочка. В отдаленном периоде благодаря устранению в результате аневризмэктомии неправильной механической нагрузки происходило улучшение общей систолической функции ЛЖ, сократимости неишемизированного миокарда вне зоны аневризмы, а также улучшение показателей релаксации ЛЖ и кардиоваскулярных нейрорегуляторных механизмов.
Кроме того, может повышаться переносимость нагрузок и улучшаться клиническая симптоматика, особенно при достижении полной реваскуляризации. В одной серии наблюдений 285 больных после реконструкции желудочка улучшение симптоматики отмечалось у 67% больных, а выживаемость в течение 5 лет составила 82%.
Новые хирургические подходы к лечению аневризмы ЛЖ направлены на восстановление нормальной геометрии ЛЖ с помощью альтернативного метода закрытия эпикардом и/или наложения эндокардиального лоскута для отделения полости аневризмы от остальной полости ЛЖ. При применении этого метода 5-летняя выживаемость составляла от 73 до 87,5%, что сопровождалось положительными клиническим и гемодинамическим эффектами. Сообщается, что 88% больных, перенесших эндоаневризморафию (ушивание дефекта стенки аневризмы изнутри), на протяжении = 3,5 года наблюдения относили к I или II ФК NYHA.
Эффективность оперативного лечения пациентов с ишемической КМП, включающего хирургическую реконструкцию желудочка, в настоящее время проверяют в исследовании STICH.
Линейная техника пластики аневризмы левого желудочка (ЛЖ).
Стенки аневризмы закрывают по вертикальной линии между двумя полосками из тефлона.
Два ряда узлового горизонтального матрасного шва усилены двумя рядами непрерывного шва. ПЖ — правый желудочек.
Последнее обновление статьи: Апрель , 2019
Аневризма левого желудочка или аневризма сердца – это участок погибшей сердечной мышцы левого желудочка, которая утратила свою упругость и под действием высокого давления растянулась. Размеры и степени выпячивания аневризмы зависят от обширности инфаркта миокарда.
Выявить аневризму можно при УЗИ сердца. Если она достаточно большая, то образно ее можно представить в виде мешка, который во время сокращения сердца растягивается и набирает в себя кровь, предназначенную для выброса в общую систему. Таким образом весь остальной организм недополучает большую часть крови. Кроме этого, растягивая сердце, аневризма может приводить к повреждению клапанного аппарата, а также вовлечению в аневризму здоровых прилегающих участков. Все это непременно ведет к развитию сердечной недостаточности порой крайне выраженной.
В ряде случаев в аневризме создаются условия для образования тромбов, которые могут отрываться и приводить к инсультам. Кроме того, тромб – это хорошая среда для размножения бактерий и при определенном стечении обстоятельств может резвиться воспаление внутренней поверхности сердца в месте прикрепления тромба – бактериальный тромбэндокардит, который в свою очередь может привести к сепсису (заражение крови) и гибели пациента.
Что же необходимо делать если анавризма существует? Если она не большая, то требуется только динамическое наблюдение. Если же она клинически значимая, а это решает врач, то потребуется открытая операция – аневризмэктомия, суть которой заключается в удаление этой бесполезной ткани, в результате чего достигается невероятное улучшение состояния пациента, иногда сердечная недостаточность практически полностью исчезает. И хотя по классификации степень сердечной недостаточности не меняется в меньшую сторону, но в этом случае это можно было бы вполне сделать.
источник
Часто у пациентов с подозрением на заболевание левого желудочка при эхокардиографии обнаруживается патология правого желудочка (ПЖ), до того не распознанная. Например, больные первичной легочной гипертензией обычно обращаются к врачу по поводу прогрессирующей одышки. При эхокардиографии в этом случае, часто впервые, обнаруживается хроническое легочное сердце. При эмфиземе легких эхокардиография с допплеровским исследованием давления в легочной артерии дает больше для диагностики легочного сердца, чем все традиционные клинические методы (физикальное исследование, рентгенография грудной клетки и электрокардиограмма). В целом же эхокардиографические находки, связанные с патологией левого и правого желудочков почти одинаково часты.
Сократимость, объем и толщина стенок
В отличие от левого желудочка, имеющего форму эллипса и легко поддающегося измерениям, форма ПЖ затрудняет количественную оценку его функции и объемов. Стереометрической моделью ПЖ служит пирамида с треугольным основанием. Такая модель, однако, не учитывает поперечное расширение ПЖ и его выносящий тракт. Количественная двумерная эхокардиография ПЖ, имеющего очень сложные пространственные соотношения, весьма затруднена. Многие исследователи предпринимали попытки разработать надежный способ измерения объемов ПЖ, но ни один из методов не получил распространения [48, 53, 54]. В Лаборатории эхокардиографии UCSF используют два относительно простых количественных подхода к оценке размеров ПЖ. Если размер ПЖ при М-модальном парастернальном исследовании на уровне короткой оси левого желудочка превышает 2,5 см, должна быть заподозрена дилатация ПЖ (рис. 6.1B). Затем изучают два двумерных изображения ПЖ. В норме по короткой оси из парастернального доступа левый желудочек доминирует над правым, — последний занимает небольшое пространство кпереди от левого желудочка (рис. 2.9). Если ПЖ равен в этой позиции левому или больше него, то можно с уверенностью говорить о дилатации ПЖ (рис. 6.1A). При исследовании из апикальной четырехкамерной позиции верхушка сердца в норме занята левым желудочком. Если верхушка занята ПЖ хотя бы частично, то он дилатирован. При значительной дилатации ПЖ преобладает над левым в апикальной четырехкамерной позиции; в предельно выраженных случаях левый желудочек виден на изображении как узкая полоска (рис. 6.2). Если парастернальных и апикальных позиций недостаточно для суждения о размерах ПЖ, следует использовать субкостальный доступ. По нашим наблюдениям, в субкостальных позициях реже, чем в других, может возникнуть ложное впечатление о дилатации ПЖ.
Рисунок 6.1. Дилатация правого желудочка: парастернальная короткая ось левого желудочка, двумерное (А) и М-модальное исследование (В). Переднезадний размер правого желудочка составляет 45 мм. Парадоксальное движение межжелудочковой перегородки (стрелки). RV — правый желудочек, LV — левый желудочек, IVS — межжелудочковая перегородка, PE — выпот в полости перикарда.
Рисунок 6.2. Дилатация правых отделов сердца: апикальная четырехкамерная позиция, диастола. Правый желудочек значительно превышает в размерах левый и занимает верхушку сердца. Межжелудочковая перегородка обращена выпуклостью в сторону левого желудочка (признак объемной перегрузки правого желудочка). Межпредсердная перегородка обращена выпуклостью в сторону левого предсердия: это свидетельствует о том, что давление в правом предсердии превышает давление в левом. RV — правый желудочек, LV — левый желудочек, RA — правое предсердие, LA — левое предсердие, MB — модераторный пучок, PE — выпот в полости перикарда.
Сократимость ПЖ чаще всего оценивается визуально, без специальных измерений. Из-за того, что ПЖ имеет тонкие стенки, для изучения их толщины и движения требуется тщательная настройка усиления сигнала и, часто, — смена датчика. М-модальные изображения ПЖ, полученные из парастернального доступа, мало информативны для оценки сократимости, так как их срезы проходят через выносящий тракт ПЖ, сократимость которого может не соответствовать сократимости всего ПЖ. Напротив, М-модальное исследование из субкостального доступа — лучший способ оценки движения передней стенки ПЖ и ее толщины.
Выраженную дисфункцию ПЖ распознать всегда легко; гораздо сложнее оценить пограничные состояния, особенно при технически несовершенном исследовании. В таких ситуациях мы рекомендуем ориентироваться на движение правого атриовентрикулярного фиброзного кольца в месте прикрепления передней створки трехстворчатого клапана. Движение этой подвижной области отражает сокращение продольных мышечных волокон ПЖ и соответствует движению основания ПЖ в сторону верхушки. Оно может быть исследовано даже в отсутствие хорошей визуализации сердца. При выраженном снижении сократительной способности ПЖ амплитуда движения этой области резко снижается.
Исследовать толщину стенок ПЖ трудно. Главным препятствием являются трабекулы и модераторный пучок ПЖ, которые вносят неопределенность в измерения при М-модальном исследовании. Неясность в определении границы эндокарда ПЖ делает рутинное определение толщины его стенок невозможным, однако при наличии гипертрофии ПЖ измерения упрощаются. Мы даем заключение о гипертрофии ПЖ, если толщина его передней стенки превышает 0,5 см (рис. 6.3).
Рисунок 6.3. Гипертрофия и дилатация правого желудочка: парастернальная короткая ось левого желудочка. Гипертрофия правого желудочка высокой степени выраженности: толщина его стенки превышает толщину стенки левого желудочка. RV — правый желудочек, LV — левый желудочек.
Нарушения локальной сократимости
Наибольшее практическое значение имеют нарушения локальной сократимости ПЖ при инфаркте миокарда ПЖ. Почти всегда инфаркт ПЖ сопряжен с инфарктом миокарда левого желудочка задней локализации.
Тщательно проведенное эхокардиографическое исследование может выявить инфаркт миокарда ПЖ. С появлением множества работ, посвященных функции ПЖ при инфаркте миокарда левого желудочка задней локализации, оказалось, что инфаркт миокарда ПЖ не такая редкая патология, как считалось раньше [49]. Результаты некоторых работ свидетельствуют о том, что примерно в 40% случаев инфаркта миокарда задней локализации наблюдается разной степени выраженности дисфункция ПЖ. Существует, конечно, огромная разница между клинически слабо выраженным снижением сократимости ПЖ и тяжелой правожелудочковой недостаточностью. Обширный инфаркт миокарда ПЖ сопровождается низким сердечным выбросом; летальность при нем высокая.
Одним из основных признаков инфаркта миокарда ПЖ является расширение полости ПЖ при М-модальном исследовании. Поскольку парастернальное М-модальное исследование ПЖ проводят на уровне его выносящего тракта, судить при этом о сократимости ПЖ нельзя. При двумерном исследовании ПЖ выглядит расширенным, его передняя стенка акинетична или даже дискинетична (при формировании аневризмы ПЖ), иногда заметна граница, отделяющая нормальный миокард от некротизированного. Часто ПЖ преобладает над левым в апикальной четырехкамерной позиции. Первое подозрение на инфаркт миокарда ПЖ обычно возникает при двумерном исследовании парастернально по короткой оси ЛЖ, если обнаруживается акинезия задне-нижней стенки левого желудочка и граничащих с ней сегментов ПЖ.
Другими эхокардиографическими признаками инфаркта миокарда ПЖ являются: расширение нижней полой вены с неадекватным коллабированием (недостаточным спадением) после глубокого вдоха (признак повышенного давления в правом предсердии), уменьшенная амплитуда движения основания ПЖ (снижение глобальной сократимости ПЖ). По степени расширения ПЖ и степени коллабирования нижней полой вены можно судить о гемодинамической значимости поражения ПЖ. Эхокардиографическое исследование нижней полой вены — надежный эквивалент изучения пульсации яремных вен.
Поскольку у 20—30% людей имеется открытое овальное окно, увеличение давления в правых отделах сердца, сопутствующее инфаркту миокарда ПЖ, может привести к выраженному сбросу крови из правого предсердия в левое. Наличие такого шунта легко доказать контрастным исследованием — по попаданию пузырьков воздуха справа налево через среднюю часть межпредсердной перегородки.
Если инфаркт миокарда ПЖ заподозрен на основании клинических данных, эхокардиография позволяет быстро и надежно подтвердить этот диагноз и определить гемодинамическую значимость поражения ПЖ.
Другие заболевания, приводящие к нарушениям локальной сократимости ПЖ, — болезнь Чагаса и эндомиокардиальный фиброз, рассмотрены выше (гл. 5).
Опухоли ПЖ могут быть первичными или метастатическими, доброкачественными или злокачественными. Опухоли, которые поражают ПЖ, аналогичны по гистологии опухолям левого желудочка. Исследование эхо-структуры опухоли само по себе не позволяет судить о ее происхождении, но, сопоставив данные эхокардиографии с клиникой, почти всегда можно предсказать данные гистологического исследования. Имеет значение не только эхо-структура опухоли, но и ее подвижность и место прикрепления. Среди доброкачественных опухолей чаще всего встречаются миксомы, среди злокачественных — меланомы и лимфосаркомы. Возможно также прорастание опухоли в ПЖ через нижнюю полую вену и правое предсердие. Такие опухоли чаще всего оказываются гепатомами, но опухоли почек и надпочечников могут аналогичным образом прорастать в правые отделы сердца. Злокачественные тимомы прорастают в полость правого желудочка через верхнюю полую вену и иногда создают препятствие для кровотока.
Среди образований, попадающих в ПЖ через нижнюю полую вену, наибольшее клиническое значение имеют тромбы, образующиеся в венах нижних конечностей. Подробно исследованы пути миграции тромбоэмболов [67, 68, 77]. Попав в ПЖ, они иногда прилежат к его стенке и выглядят как подвижные опухолеподобные образования. Их эхо-плотность ниже, чем у опухолей. Миновав трехстворчатый клапан, тромбы могут пройти через клапан легочной артерии и закончить свой путь в легочной артерии. Тромбы из правого предсердия могут попасть через открытое овальное в левые отделы сердца и стать причиной «парадоксальной» тромбоэмболии [67, 71, 78]. Во всех случаях обнаружения тромбоза правых отделов сердца и в большинстве случаев тромбоэмболий легочной артерии мы рекомендуем во время эхокардиографии введение контрастного вещества. Попадание пузырьков воздуха в левые отделы сердца указывает на открытое овальное окно и, следовательно, на возможность парадоксальной тромбоэмболии. Независимо от путей тромбоэмболии, все они угрожают жизни больного и требуют активного медикаментозного или хирургического лечения.
Правый желудочек при кардиомиопатиях
Первичные заболевания миокарда, поражающие только ПЖ, встречаются редко и еще реже распознаются с помощью эхокардиографии. При заболеваниях миокарда левого желудочка правый часто вовлекается в патологический процесс. Однако у некоторых пациентов необъяснимым образом ПЖ остается интактным. Пациенты, у которых к поражению левого желудочка присоединяется патология правого, имеют худший прогноз заболевания. При дилатации ПЖ и нарушении его сократимости эхокардиографическое исследование не позволяет определить, первично ли поражение ПЖ или оно является следствием легочной гипертензии.
Состояния, связанные с дилатацией правого желудочка
Дилатация ПЖ возникает под действием нескольких причин. Для того, чтобы выявить эти причины, обычно необходимы клинические сведения о больном. Однако в некоторых случаях можно обойтись и чисто эхокардиографическими данными. Так, объемная перегрузка ПЖ без легочной гипертензии возникает при дефектах межпредсердной перегородки, выраженной трикуспидальной недостаточности или недостаточности клапана легочной артерии. Во всех этих случаях может наблюдаться дилатация ПЖ с доминированием его в апикальной четырехкамерной позиции над нормальным левым желудочком (рис. 6.1, 6.2). Расширение коронарного синуса также является признаком объемной перегрузки правых отделов сердца (рис. 6.4). При этом сохранена сократимость ПЖ и стенки его не утолщены. Дефект межпредсердной перегородки отличается от клапанной патологии тем, что он приводит к расширению легочной артерии. В Лаборатории эхокардиографии UCSF принято измерять правую легочную артерию из супрастернального доступа. Если размеры правой легочной артерии оказываются в пределах нормы (т. е. меньше дуги аорты), наличие гемодинамически значимого сброса крови справа налево считается маловероятным.
Рисунок 6.4. Расширение коронарного синуса: признак объемной перегрузки правых отделов сердца. Позиция парастернальной длинной оси левого желудочка. RV — правый желудочек, LV — левый желудочек, LA — левое предсердие, CS — коронарный синус.
Дефект межпредсердной перегородки можно обнаружить с помощью контрастного исследования: при этом наблюдается «негативное контрастирование» — струя крови, не содержащая пузырьков воздуха, проникает из левого предсердия в правое (рис. 14.5). У пациентов с дефектом межпредсердной перегородки также может быть обнаружено небольшое по объему шунтирование крови справа налево. Непосредственная рассмотреть дефект трудно из-за большого количества артефактов, создаваемых межпредсердной перегородкой, но иногда он виден. Бывает затруднено и допплеровское обнаружение шунтирования крови через межпредсердную перегородку.
По нашему мнению, основной вклад допплеровского исследования в диагностику патологии ПЖ заключается в точном неинвазивном определении давления в легочной артерии [47, 51, 57, 58, 59]. Возможность измерить систолическое давление в легочной артерии существует даже при минимальной трикуспидальной регургитации, которая есть почти у всех пациентов с легочной гипертензией и у большинства здоровых людей. Определение максимальной скорости регургитирующего потока позволяет вычислить транстрикуспидальный градиент (рис. 6.5). Сумма транстрикуспидального градиента и давления в правом предсердии равна систолическому давлению в легочной артерии (если нет стеноза легочной артерии). Давление в правом предсердии принимают равным 5 мм рт. ст. при коллабировании нижней полой вены после глубокого вдоха более чем на 50% (рис. 6.6) [70, 75].
Рисунок 6.5. Постоянно-волновое допплеровское исследование струи незначительной трикуспидальной регургитации (после усиления допплеровского сигнала внутривенным контрастированием): пример расчета систолического давления в легочной артерии. Максимальная скорость струи — 3,6 м/с; это соответствует транстрикуспидальному градиенту давления 52 мм рт. ст. (по упрощенному уравнению Бернулли: 4 ? 3,6 2 = 52). Прибавив к этой величине давление в правом предсердии, получим систолическое давление в правом желудочке, равное (если нет стеноза легочной артерии) систолическому давлению в легочной артерии. Давление в правом предсердии было в данном случае принято равным 5 мм рт. ст., так как нижняя полая вена нормально реагировала на фазы дыхания. Таким образом, систолическое давление в легочной артерии составило 57 мм рт. ст.
Рисунок 6.6. Длинная ось нижней полой вены при спокойном дыхании (А) и после глубокого вдоха (В). После вдоха диаметр нижней полой вены уменьшился более чем на 50% — признак нормального давления в правом предсердии. Давление в правом предсердии принимают равным 5 мм рт. ст., если коллабирование нижней полой вены после глубокого вдоха превышает 50%. IVC — нижняя полая вена, L — печень.
Врожденное отсутствие перикарда также сопровождается эхокардиографическими признаками дилатации ПЖ (из-за ротации сердца). Нормальные размеры легочной артерии, нормальное давление в легочной артерии, отсутствие патологии при контрастном исследовании должно в этом случае заставить эхокардиографиста вспомнить о возможном врожденном отсутствии перикарда.
Дилатация ПЖ развивается также при выраженной трикуспидальной недостаточности и (реже) при недостаточности клапана легочной артерии. Наиболее частая причина гемодинамически значимой трикуспидальной недостаточности — дисфункция левого желудочка (посткапиллярная легочная гипертензия); другими причинами могут быть: ревматическое поражение трехстворчатого клапана, бактериальный эндокардит, высокая легочная гипертензия. Выраженная трикуспидальная регургитация отчетливо выявляется при цветном допплеровском сканировании (регургитирующая струя проникает глубоко в правое предсердие) и допплеровском исследовании в постоянно-волновом режиме (плотный спектр регургитирующего потока). Систолическая пульсация нижней полой вены, заброс в нее пузырьков воздуха при контрастном исследовании, ретроградный систолический кровоток в печеночных венах — дополнительные признаки, тяжелой трикуспидальной недостаточности. При этом, если клапанная недостаточность не является следствием легочной гипертензии (первичной или посткапиллярной), давление в легочной артерии должно быть нормальным. В случаях комбинированной перегрузки ПЖ давлением и объемом очень трудно выделить доминирующую причину дилатации ПЖ.
При хронических заболеваниях легких причиной правожелудочковой недостаточности служит повышение сосудистого сопротивления в малом круге кровообращения. Этот синдром, известный как легочное сердце, при эхокардиографическом исследовании проявляется дилатированным ПЖ, занимающим верхушку сердца [51, 60]. Степень гипертрофии ПЖ при легочном сердце может быть различной, но обычно это гипертрофия легкой или средней степени выраженности. Без лечения, по мере прогрессирования правожелудочковой недостаточности происходит расширение нижней полой вены и она перестает адекватно реагировать на фазы дыхания; расширяется легочная артерия. Если у пациента нет открытого овального окна, то контрастное исследование дает отрицательный результат. Если же пациент относится к числу 20—30% популяции, у кого есть открытое овальное окно, то при контрастном исследовании пузырьки воздуха попадут в левые отделы сердца и может создаться ложное впечатление о наличии дефекта межпредсердной перегородки. Отсутствие эффекта «негативного контрастирования», выбухание межпредсердной перегородки в сторону левого предсердия, полнокровие нижней полой вены и признаки нарушения сократимости ПЖ должны помочь дифференциальной диагностике. Наконец, на легочную патологию укажут клинические данные. Чаще всего причина легочного сердца — хронические обструктивные заболевания легких, но легочное сердце может развиться и при хронической тромбоэмболии легочной артерии, муковисцидозе, приобретенных заболеваниях соединительной ткани, саркоидозе, ожирении.
При первичной легочной гипертензии изменения в правых отделах сердца аналогичны описанным. Разница состоит в том, что более высокое давление в легочной артерии приводит при первичной легочной гипертензии к более выраженной гипертрофии ПЖ. На ранних стадиях первичной легочной гипертензии выраженность гипертрофии и дилатации ПЖ существенно заметнее, чем расширение нижней полой вены.
Легочная гипертензия при врожденных пороках сердца также имеет проявления, пересекающиеся с признаками поражения ПЖ другой этиологии. При врожденных пороках сердца, сопровождающихся легочной гипертензией, сильно выражена гипертрофия ПЖ — обычно при минимальных проявлениях правожелудочковой недостаточности. Разумеется, в этих случаях обычно нетрудно диагностировать и сам врожденный порок сердца, например, большой дефект межжелудочковой перегородки.
Изолированная дилатация ПЖ, не сопровождающаяся гипертрофией, легочной гипертензией или правожелудочковой недостаточностью, характерна для так называемой аритмогенной дисплазии правого желудочка [46, 55, 56]. При этом заболевании стенка ПЖ исключительно тонка («пергаментный желудочек» или болезнь Ула), нередки аневризмы ПЖ; у пациента и его больных родственников отмечаются пароксизмы желудочковой тахикардии, происходящей из ПЖ. В некоторых случаях при аритмогенной дисплазии ПЖ мы отмечали гиперплазию модераторного пучка ПЖ с множественными его прикреплениями к межжелудочковой перегородке и свободной стенке ПЖ (рис. 6.7).
Рисунок 6.7. Чреспищеводное эхокардиографическое исследование: дилатация правого желудочка, множественные прикрепления модераторного пучка к свободной стенке правого желудочка у пациента с аритмогенной дисплазией правого желудочка. Стрелки — модераторный пучок, RV — правый желудочек, RA — правое предсердие, LA — левое предсердие.
источник
В настоящее время возможность проведения данного обследования предоставляют очень многие медицинские учреждения, поскольку исследование сердца – услуга достаточно востребованная и актуальная, с учетом большого количества сердечно-сосудистых заболеваний среди населения.
В данной статье мы рассмотрим основные заболевания, которые может выявить врач УЗИ на основании данных ЭХОКГ. Необходимо понимать, что далеко не все симптомы связаны со структурной патологией сердца и будут видны на УЗИ. Например, некоторые виды аритмии могут сопровождаться изменениями только на электрокардиограмме и на ЭХОКГ сердце будет выглядеть абсолютно нормальным.
Итак, что может найти врач при эхокардиографии?
Коронарные артерии, кровоснабжающие стенки сердца, при ЭХОКГ, как правило, не видны. Как же тогда врач может судить о наличии ИБС? Дело в том, что при проведении ЭХОКГ может быть видно нарушение сократимости одной или нескольких стенок левого желудочка. Иногда несмотря на изменения на ЭКГ и наличия симптомов на ЭХОКГ изменений сократимости стенок не будет. Это связано с тем, что затруднения в движении целой стенки сердца происходят только при существенном нарушении ее кровоснабжения, поэтому нормальные результаты УЗИ не исключают наличие даже инфаркта миокарда. Для диагностики инфаркта миокарда используют в первую очередь данные ЭКГ, а также берут кровь на сердечные маркеры. В настоящее время, в связи с необходимостью экстренной диагностики инфаркта миокарда, существуют так называемые экспресс-тесты на тропонин, которые выдают результат в считанные минуты.
Однако, даже выявление затрудненной сократимости стенок сердца не всегда означает наличие инфаркта, это может быть и при кардиомиопатии, миокардите и других заболеваниях. Именно поэтому не следует требовать от врача УЗИ окончательного диагноза, поскольку только кардиолог, имея на руках результаты ЭКГ, анализов крови, данные осмотра и истории болезни и др. может поставить окончательный достоверный диагноз ишемической болезни сердца.
При инфаркте миокарда эхокардиография направлена на выявление:
- локализации и распространенности нарушений сократимости стенок, функции и объема левого и правого желудочков,
- возможного наличия недостаточности на клапанах сердца,
- возможного наличия тромбов,
- возможного наличия осложнений инфаркта миокарда.
Косвенный эхокардиографический признак артериальной гипертензии – увеличение массы миокарда левого желудочка, или его гипертрофия. Это происходит из-за того, что стенкам сердца приходится качать кровь против более высокого давления, поэтому, чтобы справляться с этой функцией, мышечные стенки сердца утолщаются. Кроме того, длительная стойкая артериальная гипертония обычно сопровождается дегенеративными изменениями аортального клапана, кальцинозом митрального клапана, расширением левого предсердия и атеросклерозом аорты.
Существует несколько типов кардиомиопатий (от слов «кардио» — сердце и «патия» — патология), их коварность заключается в том, что поначалу они протекают без каких-либо симптомов, а когда появляются первые признаки сердечной недостаточности (одышка, отеки, боли в сердце), обследование выявляет уже сильно запущенный процесс.
Например, функция сердца при ЭХОКГ оценивается преимущественно на основании данных фракции выброса. Фракция выброса — это расчётная величина, измеряется как отношение ударного объема, выброшенного в аорту за одно сокращение, к диастолическому объему левого желудочка, то есть к общему объему левого желудочка в заключительный момент его наполнения. В норме данная величина составляет, по разным данным, от 55% и выше. При наличии кардиомиопатии, имеющей название дилатационная кардиомиопатия, камеры сердца со временем сильно расширяются, и фракция выброса снижается. Но сердце имеет компенсаторные механизмы, которые при наличии данного заболевания достаточно долго способствуют нормальному внешнему самочувствию человека.
Поэтому, при малейших симптомах каких-либо нарушений, например, при снижении возможностей переносить ранее вполне нормальную физическую нагрузку, включая появление затруднений при подъёме по лестнице или длительной спокойной ходьбе из-за одышки или ощущения нехватки воздуха, не лишним будет проконсультироваться у кардиолога и выполнить ЭХОКГ.
Гипертрофическая кардиомиопатия — другой важный тип кардиомиопатии, который связан с аномальным утолщением стенки левого желудочка. При этой патологии симптомы чаще возникают при развитии осложнения данной патологии, а именно при появлении обструкции, или препятствию нормальному потоку крови из левого желудочка в аорту.
Рестриктивная кардиомиопатия чаще встречается при амилоидозе сердца и характеризуется диффузным утолщением стенок и повышением общей эхоплотности миокарда (при УЗИ он выглядит более ярким, чем в норме), а также расширением предсердий.
Достаточно редкий тип кардиомиопатии – некомпактный миокард, связан с нарушениями при закладке сердца во внутриутробном периоде.
Миокардит сложно диагностировать по данным ЭХОКГ, без биопсии миокарда, но иногда могут выявляться диффузные или региональные нарушения сократимости стенок. Для диагностики миокардита важным методом визуализации является проведение МРТ.
Подводя итог, необходимо отметить, что, если ишемическая болезнь сердца — это удел, как правило пожилых пациентов, курильщиков, лиц с повышенным холестерином, то кардиомиопатия может поражать людей молодого и среднего возраста.
Всем больным с сердечной недостаточностью показано проведение ЭХОКГ.
Помимо основного предназначения – установления причины сердечной недостаточности, ЭХОКГ играет важную роль в отборе пациентов на следующие вмешательства:
- имплантацию кардиовертера-дефибриллятора (при фракции выброса менее 35%)
- выявление гибернирующего миокарда, имеющего потенциальную возможность улучшения функции после проведения реваскуляризации
- РСТ (ресинхронизирующая терапия) – при наличии значительной диссинхронии миокарда.
Лечением сердечной недостаточности должен заниматься специалист-кардиолог, поскольку предотвратить развитие декоменсации и появление симптомов острой сердечной недостаточности довольно долгое время возможно при проведении медикаментозной терапии. Разумеется, назначение такой терапии — процесс достаточно трудоемкий, врачу необходимо время для подбора подходящей именно определенному пациенту терапии, с учетом всех его особенностей и сопутствующих заболеваний. Не в каждом лечебном учреждении у врача хватит времени, отведенного на один прием пациента, для тщательного выбора наиболее правильной тактики лечения.
Кардиогенная эмболия – это появление в камерах сердца дополнительных включений, чаще тромбов или фрагментов ткани другого происхождения, например, образований сердца с их отрывом и поступлением в кровоток, что приводит к закупорке просвета сосуда, в который он попадает. В первую очередь при ЭХОКГ исследуются следующие возможные источники эмболов:
- предсердия, особенно ушки предсердий, для этого при наличии фибрилляции предсердий проводится чреспищеводная ЭХОКГ
- клапаны, как места возможного расположения бактериальных вегетаций
- обширные участки выраженного нарушения сократимости (тромб при наличии инфаркта миокарда)
- опухоли, например, миксома
- дефект межпредсердной перегородки, как возможный путь перемещения эмболов из правого предсердия в левое
- аорта, при ее поражении.
В заключение стоит отметить, что здесь перечислены далеко не все заболевания, которые выявляет ЭХОКГ. Например, можно визуализировать также врожденные и приобретенные пороки сердца, включая стенозы и недостаточности клапанов, аневризму восходящей аорты и другие. Здесь мы рассмотрели лишь основные заболевания, при подозрении на которые необходимо выполнение УЗИ сердца, или эхокардиографии.
источник
Данная проблема относится к распространенным осложнениям инфаркта. Аневризмы формируются у 5 – 15% пациентов, перенесших некроз сердечной мышцы. По статистике чаще всего болеют мужчины в возрасте после 40 лет. Это совпадает с распространенностью инфаркта миокарда. У детей и взрослых моложе 40 лет как инфаркт, так и аневризмы сердца встречаются очень редко.
В кардиологии данная проблема является весьма актуальной, так как образовавшаяся аневризма всегда угрожает разрывом. С одной стороны, это постоянный риск серьезнейшего кровотечения, которое часто заканчивается летальным исходом. Существует и ряд других серьезных осложнений. В связи с этим аневризмы сердца считаются весьма опасными образованиями, угрожающими жизни и здоровью пациента. С другой стороны, возможности эффективного лечения аневризм достаточно ограничены. Возможно хирургическое лечение, однако оно тоже сопряжено с определенным риском для пациента.

В организме человека сердце располагается в грудной клетке. Большая часть органа находится левее грудины (примерно 2/3) и лишь 1/3 – справа. Сердце граничит с левым легким, диафрагмой (плоской мышцей, разделяющей брюшную и грудную полость) и некоторыми органами средостения (пространство между двумя легкими за грудиной). В сердце различают основание – широкую верхнюю часть, из которой выходят крупные сосуды, и верхушку, которая направлена вниз. В грудной клетке сердце расположено под наклоном. При этом его передне-верхняя стенка соприкасается с легким, а задняя стенка прилегает к диафрагме. Верхушка сердца расположена очень близко к передней грудной стенке. Точка ее прилегания расположена левее грудины в пятом межреберье. В этом месте легче всего нащупать пульсацию.
С точки зрения анатомии в сердце выделяют следующие отделы:
- камеры сердца;
- клапаны сердца;
- стенки сердца;
- сосуды сердца;
- сердечная сумка (перикард).
У человека сердце содержит четыре камеры, которые разделены продольной перегородкой. При этом левые отделы сердца полностью отделены от правых, и смешения крови не происходит. По правым отделам течет венозная кровь. Она поступает в сердце через две крупные вены – верхнюю и нижнюю полые вены. Отсюда кровь нагнетается в легочные артерии (правую и левую), которые несут венозную кровь к легким. Возвращается кровь уже обогащенная кислородом по четырем легочным венам в левые отделы сердца. Отсюда она разносится по организму через аорту.
Сердце содержит следующие внутренние камеры:
- Правое предсердие. Принимает венозную кровь и направляет ее в правый желудочек.
- Правый желудочек. Нагнетает венозную кровь в легочные артерии и перекачивает ее по малому кругу кровообращения.
- Левое предсердие. Принимает артериальную крови и направляет ее в левый желудочек.
- Левый желудочек. Нагнетает артериальную кровь под большим давлением в аорту. Оттуда она расходится по большому кругу кровообращения ко всем органам и тканям организма.
Клапаны сердца – это тонкие мембраны из соединительной ткани, которые препятствуют обратному току крови. Благодаря им кровь не может вернуться из желудочков в предсердия, а из артерий – в желудочки. Каждый клапан состоит из фиброзного кольца, который сращен со стенкой органа, створок клапана, закрывающих просвет, и уздечки, которая не дает клапанам «вывернуться» наружу.
Всего в сердце содержится четыре клапана:
- Трехстворчатый (трикуспидальный) клапан. Разделяет правое предсердие и правый желудочек. Содержит три створки. Открывается при сокращении предсердия, чтобы пропустить кровь в желудочек, но закрывается при сокращении желудочка.
- Пульмональный клапан (клапан легочного ствола). Располагается на границе между правым желудочком и началом легочной артерии. Также содержит три створки. Они открываются при сокращении сердца и закрываются при его расслаблении.
- Двустворчатый (митральный) клапан. Разделяет левое предсердие и левый желудочек. Створки открываются в полость желудочка в момент сокращения предсердия. Когда стенки желудочка сокращаются, створки смыкаются, и кровь не попадает обратно в предсердие.
- Аортальный клапан. Располагается на границе левого желудочка и аорты. Состоит из трех створок, которые смыкаются при расслаблении камеры. Благодаря этому кровь не затягивается обратно из аорты, а поступает новая порция из предсердия.
Слаженная работа клапанов очень важна для регуляции давления внутри сердечных камер. Если какой-либо клапан работает плохо, кровь может медленнее покидать камеру. При этом сильно возрастает давление внутри нее. Например, при стенозе (сужении) аортального клапана кровь не может полностью покинуть левый желудочек в момент его сокращения. Из-за этого резко возрастает давление, и в слабом месте (если таковое имеется) может образоваться аневризма. Таким образом, сбои в работе клапанов или изменения в их структуре могут повышать вероятность развития аневризм.
Стенки сердца состоят из трех слоев, каждый из которых играет определенную роль. В них также содержатся особые волокна так называемой проводящей системы. Эта система отвечает за распространение импульса по всей стенке. Благодаря этому происходит одновременное сокращение предсердий, а затем с небольшой задержкой и сокращение желудочков. Проводящая система представлена отдельными волокнами и узлами и является лишь небольшой составной частью стенок.
Стенки сердца состоят из следующих слоев:
- Эндокард. Является внутренним слоем стенки. Его толщина составляет всего несколько миллиметров, и он как бы выстилает камеры. Эндокард обладает некоторой эластичностью, благодаря чему растягивается при сокращениях сердца. В нем нет прочных волокон коллагена, поэтому он не особенно способствует укреплению стенки. Основной задачей клеток этого слоя является предотвращение завихрений крови и образования тромбов. Эндокард имеет приблизительно равную толщину во всех отделах сердца.
- Миокард. Представляет собой наиболее толстый и массивный слой стенки. Он состоит из особых клеток – кардиомиоцитов. С одной стороны, кардиомиоциты обладают способностью к сокращениям, как и любая другая мышечная ткань. С другой стороны, эти клетки имеют особые соединения между собой. Благодаря им происходит равномерное сокращение всей стенки, а не отдельных ее участков. Миокард имеет различную толщину в различных отделах сердца. Наиболее тонок он в предсердиях, так как здесь нет такой большой нагрузки. В правом желудочке кровь необходимо проталкивать в малый круг кровообращения. Давление здесь выше, а стенки – толще. Примерно такая же толщина обычно и в межжелудочковой перегородке. Наибольшая толщина миокарда в стенках левого желудочка. Отсюда кровь выбрасывается в аорту под большим давлением. В момент сокращения желудочка это давление должно быть достаточным, чтобы протолкнуть кровь по всему большому кругу кровообращения. Миокард обладает также механической прочностью. При отсутствии его повреждений аневризма образоваться практически не может.
- Эпикард. Является наиболее поверхностным слоем сердечной стенки. Он плотно сращен с миокардом и перикардом (сердечной сумкой), который, по сути, является его продолжением. Эпикард не содержит прочных волокон и не способствует укреплению сердечной стенки.
Перикард представлен серозным листком, который оборачивает сердце в своеобразную сумку, отделяя его от других органов грудной клетки. Перикард является прямым продолжением эпикарда. Эти два листка сращиваются, образуя особую полость вокруг сердца (перикардиальная полость). Она представляет собой щель шириной в несколько миллиметров. Таким образом, выбухающая аневризма на сердечной стенке поначалу локализуется в полости перикарда. При разрыве аневризмы (наиболее серьезном и опасном осложнении) кровь также попадает в эту полость и скапливается там.
Физиологический процесс сердечных сокращений регулируется нервной системой. В работе сердца различают две фазы — систолу (сокращение) и диастолу (расслабление). Как уже говорилось выше, систола предсердий происходит раньше, чем систола желудочков. За счет этого успевают раскрыться и закрыться створки клапанов. При наличии аневризмы давление внутри желудочка повышается именно в период систолы. Чем сильнее сокращается сердечная мышца, тем выше вероятность разрыва растянутой стенки. В диастолу из полости аневризмы также выбрасывается часть крови, но полость все равно не опорожняется полностью. К тому же, даже при падении давления во время расслабления дефект уже не принимает прежний вид. Ткани попросту не успевают восстановиться, так как диастола слишком коротка, а новая систола вновь наполнит мешок аневризмы кровью и растянет ее стенки.
Сама аневризма как патологическое образование также имеет собственное строение. В частности, морфологически (структурно) различаются слои стенки сердца и аневризмы. Как правило, стенка аневризмы состоит из эндокарда, эпикарда и сильно растянутого миокарда. Последний вследствие каких-либо заболеваний может содержать повышенное количество соединительной ткани. Из-за малого числа нормальных кардиомиоцитов стенка аневризмы не сокращается в такт с другими участками, а прочность и эластичность тканей падают. При сердечных сокращениях в полость аневризмы попадает часть крови. Однако эта полость является мертвым пространством, поэтому кровь не может быстро ее покинуть.
Для диагностики аневризмы имеют значение следующие показатели работы сердца (приведена норма):
- Частота сердечных сокращений – 60 – 100 ударов в минуту. Может меняться из-за того, что аневризма мешает нормальному охвату миокарда возбуждением.
- Фракция выброса – 55 – 60%. Это процент крови, который покидает желудочек за одно сокращение. При аневризме идет застой и во время систолы выбрасывается меньше крови.
- Ударный объем – 60 – 100 мл. Это количество крови, которое перекачивает сердце за одно сокращение. При аневризме измеряется ударный объем левого желудочка.
- Масса миокарда левого желудочка – 95 – 183 г. Может уменьшаться из-за смерти кардиомиоцитов во время инфаркта.
- Давление в левом желудочке – от 65 – 75 мм рт. ст. (миллиметры ртутного столба) до 115 – 125 мм рт. ст. Измеряется отдельно в фазу систолы и диастолы. Этот показатель имеет значение для правильного прогнозирования осложнений.
Давление в желудочках значительно выше, чем в предсердиях. Поэтому чаще всего аневризмы обнаруживают именно там (особенно на стенке левого желудочка). Сам процесс образования патологического выпячивания занимает некоторое время. Обычно гибель клеток в тканях сердечной стенки происходит постепенно. Давление же сильно возрастает, например, при физической нагрузке, когда сердце вынуждено перекачивать большой объем крови.
Вышеописанное несоответствие между прочностью сердечной стенки и внутренним давлением в желудочках может встречаться при различных патологиях. Как правило, это заболевания, повреждающие непосредственно ткани сердца либо (редко) проводящую систему органа. В связи с этим аневризмы почти всегда классифицируются не как самостоятельные заболевания, а как осложнения других патологических процессов.
Появление аневризм сердца может иметь следующие причины:
- перенесенный инфаркт миокарда;
- инфекционные заболевания;
- врожденные аневризмы сердца;
- операции на сердце;
- травмы;
- токсические миокардиты;
- системные воспалительные заболевания;
- идиопатический кардиосклероз;
- ионизирующие излучения.
Инфаркт миокарда считается наиболее распространенной и частой причиной аневризм сердца. По некоторым данным эта причина встречается более чем в 90% случаев. Инфаркт представляет собой острую нехватку кислорода, которую испытывает сердечная мышца. Это ведет к быстрой смерти нормальных кардиомиоцитов. Проблема заключается в том, что эти клетки практически не восстанавливаются. На их месте через некоторое время образуется соединительная (рубцовая) ткань. По своей структуре и свойствам она сильно отличается от нормальной сердечной стенки. Несмотря на механическую прочность, соединительная ткань не обладает ни эластичностью, ни сократительной активностью, которые присущи миокарду.
Аневризмы возникают в связи с тем, что даже после инфаркта в сердце все равно сохраняется высокое внутреннее давление. Соединительная ткань же начинает образовываться лишь через несколько дней, а окончательно набирает прочность через несколько недель (а иногда и месяцев) после инфаркта. За этот период, когда рубец еще свежий, происходит выбухание поврежденного участка с образованием аневризмы.
Постинфарктные аневризмы имеют следующие особенности:
- располагаются в стенке левого желудочка (в области наибольшего давления);
- могут достигать больших размеров (более 5 – 7 см в диаметре);
- образуются в первые недели после перенесенного инфаркта;
- характерны как осложнение после трансмуральных инфарктов (когда зона некроза охватывает все слои сердечной стенки);
- часто склонны к быстрому росту и разрыву.
Инфекционные заболевания не могут напрямую повлиять на образование аневризмы, но часто с них начинается патологический процесс. Происходит это следующим образом. Вирусная или бактериальная инфекция попадает (обычно с кровью) в сердце. Здесь она поражает сердечную мышцу, вызывая ее воспаление (миокардит). Как правило, этот процесс сопровождается гибелью части кардиомиоцитов. После стихания воспалительного процесса, когда инфекция уже излечена, на месте погибших клеток начинает образовываться соединительная ткань. В определенных условиях и в зависимости от воздействия различных факторов это дает толчок к диффузному кардиосклерозу. Чем интенсивнее протекал воспалительный процесс, тем выше вероятность такого осложнения.
Вызвать миокардит с последующим кардиосклерозом могут следующие инфекции:
- вирус Коксаки;
- вирус гриппа;
- стрептококковая инфекция;
- грибковые инфекции (кандидоз);
- вирус Эпштейна-Барр.
Также подобное осложнение может встречаться при дифтерии. Сама дифтерийная палочка не может попасть в сердце, однако сильный токсин, который она выделяет, вполне может стать причиной миокардита. На фоне последующего кардиосклероза, через месяцы (а иногда и годы) после перенесенного заболевания у больных может развиться аневризма сердца. Как минимум, у них появляется предрасположенность к этой патологии, так как прочность сердечной стенки уже снижена.
Врожденные аневризмы сердца могут появляться в первые дни или недели после рождения ребенка. Это объясняется пороками развития сердца во внутриутробном периоде. Порой еще до рождения клетки в определенном участке сердца перестают правильно делиться. Тогда образуются истончения или своеобразные вкрапления в миокард других тканей. Во внутриутробном периоде в сердце нет такого высокого давления крови, потому что легкие еще не раскрылись, и плод дышит с помощью матери. Однако с первым вдохом кровь начинает циркулировать нормально, по обоим кругам. Давление в сердце поднимается, и в слабых местах могут образовываться аневризмы.
Появление врожденных аневризм иногда связывают с воздействием во время беременности на материнский организм следующих факторов:
- курение;
- алкоголизм;
- производственные токсины;
- некоторые инфекции (корь, краснуха и др.);
- прием некоторых медикаментов.
В ряде случаев аневризмы развиваются как послеоперационные осложнения после хирургических вмешательств на сердце. Чаще всего это встречается у пожилых людей и детей, прооперированных по поводу врожденных пороков сердца. Как и любая другая операция, операция на сердце заканчивается наложением специальных швов на ткани. Однако в процессе работы сердца ткани могут плохо срастись. В итоге образуются более крупные и грубые рубцы, которые, по сути, мало отличаются от очагового кардиосклероза. Особенно часто аневризмы в послеоперационном периоде возникают у пациентов, перенесших операции на левом желудочке.
В некоторых случаях операция на сердце не является непосредственной причиной появления аневризмы, но способствует ее появлению. Дело в том, что в послеоперационном периоде может расти давление в желудочках, резко повышаться число сердечных сокращений. Если при этом в сердце имеются слабые места, в них может образоваться аневризма. Таким образом, осложнение может появиться даже при том, что операция прошла хорошо.
Травматическое поражение сердца может вызвать образование аневризмы через несколько механизмов. Во-первых, прямое повреждение сердечной стенки (например, острым предметом при колющем ранении) вызывает образование рубца. По сути, это вариант очагового кардиосклероза, который часто ведет к появлению аневризмы. Во-вторых, тупая травма ведет к частичному выходу жидкости из просвета сосудов в ткани. Тогда может возникнуть миокардит с последующим кардиосклерозом. Третьим вариантом является появление ложной аневризмы сердца. Она возникает, если в стенке имеется небольшой открытый дефект, через который кровь в небольших количествах попадает в полость перикарда. Там данный участок может изолироваться образованием спаек. Это приведет к формированию небольшой полости, заполненной кровью.
Как правило, аневризмы сердца образуются в первые дни или недели после травмы. Они имеют тенденцию к быстрому росту и разрыву. В связи с этим такие аневризмы рекомендуется лечить хирургически в срочном порядке.
Токсический миокардит – это воспаление сердечной мышцы, вызванное попаданием в кровь пациента определенных химических соединений. Они вызывают повреждение клеток эндокарда и миокарда, а в тяжелых случаях могут привести и к возникновению очагов некроза либо к диффузному разрастанию соединительной ткани (диффузный кардиосклероз). В обоих случаях сердечная стенка ослабевает и возникает риск появления аневризмы. В медицинской практике аневризмы после токсического миокардита встречаются крайне редко.
Токсический миокардит может быть вызван следующими веществами:
- алкоголь;
- повышенная концентрация тироксина (тиреотоксикоз);
- повышенное содержание мочевой кислоты в крови – уремия (встречается при заболеваниях почек);
- отравление некоторыми химическими соединениями.
Практически с такой же частотой встречаются аллергические миокардиты. В этих случаях речь идет не о прямом воздействии токсина на клетки сердечной мышцы, а на чрезмерно сильную реакцию иммунной системы. Чаще всего такая реакция является индивидуальной особенностью организма пациента. Аллергический миокардит может развиться после применения некоторых медикаментов (ряд антибиотиков, новокаин, метилдопа и др.), введения вакцины и сыворотки, крайне редко – после употребления определенных продуктов питания или укусов ядовитых животных.
Все вышеописанные процессы в определенной степени повреждают клетки миокарда и вызывают кардиосклероз. Как правило, аневризмы, образующиеся в этих случаях, не имеют такой тенденции к разрыву, как, например, после перенесенного инфаркта. Стенка сохраняет все свои слои и значительную часть мышечных клеток.
Ионизирующие излучения (или радиация) являются очень редкой причиной развития кардиосклероза. В данном случае речь идет о попадании на проекцию сердца очень мощного потока мельчайших частиц. Эти частицы как бы бомбардируют клетки миокарда, нарушая нормальные биохимические процессы и молекулярные связи внутри них. В итоге затормаживается деление клеток, и постепенно развивается кардиосклероз, который и ведет к появлению аневризмы.
Дозу радиации, достаточную для такого серьезного патологического процесса, нельзя получить ни при повторных рентгенографических снимках, ни при долгой работе на рентгеновском аппарате. Она может стать результатом радиотерапии (облучения) опухолей средостения. При этом мощное излучение направляется непосредственно в область разрастания опухоли, чтобы уничтожить новообразование. Если сердце оказывается на пути лучей, может развиться кардиосклероз. Болезнь в этом случае прогрессирует достаточно медленно, и со дня облучения до образования аневризмы сердца может пройти не один год.
Определение причины, которая вызвала появление аневризмы сердца, очень важно для начала правильного лечения. Дело в том, что, имея полную информацию о патологическом процессе, врачи смогут точнее спрогнозировать течение болезни. Это позволит улучшить качество жизни пациента. Как уже было сказано выше, в некоторых случаях аневризмы имеют тенденцию к увеличению. Тогда необходимо назначить такое лечение, которое затормозило бы этот процесс и снизило бы риск разрыва.
Аневризмы сердца можно классифицировать по следующим критериям:
- по времени появления;
- по месту расположения;
- по размерам;
- по форме;
- по структуре стенки;
- по механизму образования.
Данный критерий является, пожалуй, наиболее важным, так как он помогает понять, какие процессы происходят в тканях в данный момент времени. Эта классификация применяется обычно только по отношению к постинфарктным аневризмам. Точкой отсчета считают момент некроза мышцы (собственно, инфаркта миокарда).
По времени появления различают следующие аневризмы сердца:
- Острые. Острыми называются аневризмы, появляющиеся в первые 2 недели после инфаркта. Небольшое выбухание стенки на протяжении первой недели может исчезнуть само по мере образования соединительной ткани. Она будет уплотняться и может не допустить образование аневризмы. Если же у пациента обнаруживают мешковидное выбухание в месте инфаркта в промежутке между 1 и 2 неделями, то речь идет именно об острой аневризме. Такие образования плохо поддаются различным прогнозам. В стенке аневризмы только начинают образовываться плотные коллагеновые волокна. Она очень чувствительна к повышению внутреннего давления, может быстро увеличиваться либо разорваться. Со временем острые аневризмы переходят в подострые. При этом их изначальная форма может меняться.
- Подострые. Подострыми называются аневризмы на 3 – 8 неделе постинфарктного периода. В этот промежуток времени соединительная ткань набирает прочность. Риск разрыва или быстрого роста аневризмы снижается. На поверхности эндокарда в полости аневризмы могут формироваться тромбы.
- Хронические. Хроническими называются аневризмы после 8 недель с момента инфаркта миокарда. В их стенках уже сформировалась плотная соединительная ткань. Под действием внутреннего давления сердца она тоже может постепенно растягиваться, приводя к увеличению полости аневризмы. Однако рост образования будет значительно более медленным. Иногда толщина стенки хронической аневризмы не превышает 2 – 3 мм (по сравнению с 10 – 15 мм у нормального миокарда левого желудочка). Однако разрывы встречаются относительно редко. Зато такие осложнения как тромбы или нарушения ритма беспокоят пациента чаще.
В подавляющем большинстве случаев аневризмы сердца локализуются на стенке левого желудочка. Это объясняется наибольшей частотой инфарктов в этой области (из-за высоких потребностей в кислороде). Кроме того, в левом желудочке наиболее высокое внутреннее давление. Оно и вызывает выбухание стенки после инфаркта. Аневризмы правого желудочка встречаются гораздо реже, а предсердий – практически не встречаются.
Аневризмы сердца могут располагаться в следующих местах:
- передняя стенка сердца;
- верхушка сердца;
- задняя стенка сердца (редко);
- межжелудочковая перегородка.
В последнем случае речь идет об инфаркте, при котором часть очага некроза перешла на перегородку, разделяющую желудочки. В ней также содержится небольшое количество мышечных клеток, но их сокращение не так важно для работы сердца в целом. Аневризма в данном случае довольно условна. Это не мешковидное образование, а просто смещение перегородки в сторону правого желудочка (так как там давление меньше). Такие случаи встречаются очень редко, но могут вызвать серьезные нарушения. Смещение перегородки уменьшает объем правого желудочка, одновременно увеличивая объем левого. Это ведет к выраженной сердечной недостаточности и ставит под угрозу жизнь пациента.
Под формой аневризмы понимают контуры и очертания образования на ЭхоКГ или во время операции, когда аневризму можно увидеть невооруженным глазом. Форма аневризмы часто говорит о скорости ее роста и дает возможность сделать правильный прогноз для пациента.
По форме выделяют следующие виды аневризм сердца:
- Диффузные. Такие аневризмы имеют сравнительно небольшой объем. Они образуются после обширных инфарктов, обычно на передней стенке левого желудочка. Их основание (собственно, место некроза) достаточно большое, а дно выпячивания находится примерно на одном уровне с остальным миокардом. Такие аневризмы редко разрываются и не так способствуют образованию тромбов. Однако из-за того, что большая площадь миокарда не участвует в сердечных сокращениях, развивается левосторонняя сердечная недостаточность. Также не исключен рост дальнейшего роста аневризмы с постепенным изменением формы. Характерны выраженные нарушения ритма сердца.
- Мешковидные. У мешковидных аневризм также широкое основание, но они сильнее выпячиваются, и их полость больше, чем у диффузных. Здесь чаще застаивается кровь, и формируются тромбы. Кроме того, стенка мешковидных аневризм растянута сильнее, и вероятность разрыва в таких случаях повышается.
- Грибовидные. Грибовидные аневризмы могут сформироваться из небольших некротизированных или зарубцевавшихся участков. При этом «шейка» (устье) аневризмы остается достаточно узкой, а сама полость под давлением крови расширяется. По форме она напоминает перевернутый кувшин. Стенки такой аневризмы растягиваются и истончаются еще сильнее, чем у мешковидного образования. Высока вероятность разрыва и образования тромбов.
- «Аневризма в аневризме». Данный тип является наиболее опасным. При нем формируется диффузное или мешковидное углубление, а уже на его стенке появляется дополнительное выпячивание. Это говорит о серьезном повреждении слоев сердца в этом месте. Вероятность разрыва при таких аневризмах наиболее высока.
В медицинской практике преобладают диффузные и мешковидные образования, в то время как грибовидные и «аневризма в аневризме» встречаются сравнительно редко.
Данная классификация не имеет широкого практического применения. Она основывается на том, какая ткань преобладает в стенке аневризмы. Во многом эта классификация совпадает с классификацией по времени образования. Многое зависит также от причины образования аневризмы. Например, в стенках постинфарктных аневризм преобладает соединительная ткань, образовавшаяся на месте некроза. При инфекционном поражении миокарда или воспалении другого происхождения часть мышечных волокон сохраняется. Это в значительной мере влияет на прогноз для конкретного пациента.
По данному критерию выделяют следующие виды аневризм:
- Мышечные. В стенке аневризмы преобладает мышечная ткань. Ее слабость может быть вызвана генетическим дефектом мышечных волокон, нарушением иннервации или кровоснабжения этой зоны. Из-за того, что кардиомиоциты в месте аневризмы не сокращаются одновременно с остальными клетками, они подвергаются более сильному воздействию внутреннего давления. Нарушения сократимости попросту не позволяют этому давлению противостоять. В результате формируется полость, в стенках которой почти нет соединительной ткани. Такие аневризмы зачастую не проявляются какими-либо симптомами.
- Фиброзные. Содержат большое количество соединительной ткани. Формируются через несколько недель после инфаркта миокарда, когда значительный участок мышцы погиб. Такие участки уже не способны сокращаться под действием возбуждающего импульса. Они постепенно растягиваются и истончаются.
- Фиброзно-мышечные. Содержат как мышечную, так и соединительную ткань. Могут формироваться после пристеночного инфаркта, когда зона некроза не охватывает всю толщу сердечной стенки.
Разные аневризмы, как уже упоминалось выше, имеют различное происхождение. Чаще всего в медицинской практике образовываются истинные аневризмы. Они состоят из тех же слоев, что и сердечная стенка, но содержат большое количество соединительной ткани. Другим вариантом, встречающимся намного реже, является так называемая функциональная аневризма. При ней происходит выбухание почти не измененного миокарда, который по каким-либо причинам не сокращается. Этот тип соответствует мышечным аневризмам, описанным выше.
Другим вариантом аневризм являются ложные аневризмы, которые ограничиваются листками перикарда и фиброзными спайками. По сути, это не выбухание сердечной стенки с ее растяжением, а небольшой сквозной дефект, через который кровь из сердца попадает в патологическую полость.
Часто у врачей нет возможности в процессе диагностики и лечения классифицировать аневризму по всем пунктам, чтобы получить наиболее полную информацию о болезни. Например, структуру стенки обычно не определяют, так как для точного ее определения требуется биопсия (процедура по забору кусочка ткани). Это не только технически сложно, но и опасно для пациента.

При аневризме сердца у пациентов могут наблюдаться следующие симптомы и жалобы:
- боли в груди;
- слабость;
- нарушения ритма;
- одышка;
- бледность кожи;
- кашель;
- ощущение биения сердца.
Боли в груди не являются обязательным симптомом аневризмы сердца. Они могут возникать при проблемах с кровообращением в коронарных сосудах любого происхождения. Сама аневризма чаще всего содержит соединительную ткань, которая лишена нервных окончаний. Поэтому аневризма сама по себе болеть не может. Болит здоровая мышечная ткань вокруг постинфарктного рубца.
У болей в груди при аневризме сердца могут быть следующие причины:
- Зарастание сосудов. В растянутой стенке аневризмы тоже содержится некоторое количество небольших сосудов. Это ветви коронарных артерий, которые поставляют кровь к отдельным областям миокарда. По мере формирования рубца эти сосуды зарастают, и поставка кислорода к определенным мышечным клеткам ухудшается. В принципе, это может создать угрозу повторного инфаркта. Но так как нехватка кислорода развивается постепенно, успевают образоваться новые сосуды (коллатеральные), которые будут снабжать кровью пострадавший миокард.
- Нарушения ритма. Об этом симптоме далее будет рассказано более подробно. Из-за перебоев в работе сердца кровь хуже перекачивается, и к тканям поступает меньше кислорода. Живые кардиомиоциты очень чувствительны к его нехватке, и в таких случаях возникают болевые ощущения.
- Перегрузка миокарда. В полости аневризмы при сокращении сердца остается небольшой объем крови, который не выбрасывается в аорту. При поступлении новой порции крови из предсердия возникает перегрузка левого желудочка жидкостью. Его стенки растягиваются, а клетки хуже сокращаются. Это также может стать причиной периодических болей в области сердца.
- Сдавливание тканей и органов. Боли такого характера наблюдаются крайне редко, при гигантских аневризмах. Они могут быть самого разного характера и объясняются большими размерами самой аневризмы.
В целом боли при аневризме сердца локализуются обычно за грудиной или немного левее. Они появляются в виде приступов, которые могут быть спровоцированы физической нагрузкой, алкоголем, курением и другими внешними факторами.
Слабость возникает из-за застойной сердечной недостаточности. Как уже говорилось выше, при сокращении левого желудочка с аневризмой в его полости остается часть крови. Она называется конечно-систолическим объемом. В норме она составляет 50 – 60 мл или 40 – 50% от всего объема крови в желудочке. Проблема заключается в том, что у пациентов с аневризмой этот показатель увеличивается. Из всего объема крови в фазе сокращения выбрасывается лишь 30 – 40%, а большая часть остается внутри. Кроме того, сердце не может увеличить объем перекачиваемой крови в случае необходимости. Например, при физической нагрузке здоровые кардиомиоциты начинают сокращаться быстрее и сильнее. Но это лишь приводит к увеличению давления и нагнетанию крови в полость аорты. Ее объем увеличивается, надуваясь, подобно воздушному шарику, и в системный кровоток все равно не попадает нужное количество крови.
Таким образом, слабость возникает оттого, что скелетные мышцы и нервная система не получают нужного объема кислорода. Они не могут работать на полную мощность, пока сердце не перекачивает необходимый объем крови. Данный симптом наблюдается не у всех пациентов. На повышенную утомляемость и постоянную слабость жалуются только пациенты с развившейся застойной сердечной недостаточностью. Как правило, она появляется при аневризмах большого размера.
Нарушения ритма являются одним из самых частых симптомов у пациентов с аневризмой сердца. Как правило, они появляются периодически и быстро проходят. В случае более выраженных или длительных приступов такие нарушения расценивают уже не как симптом, а как тяжелое осложнение – пароксизмальную тахикардию.
Нарушения ритма могут носить следующий характер:
- перебои с короткими остановками сердца;
- тахикардия (учащение сердцебиения более 100 ударов в минуту);
- брадикардия (замедление сердцебиения менее 60 ударов в минуту).
Бледность кожи является распространенным симптомом, который типичен для пациентов с заболеваниями сердца. Кожные покровы бледнеют из-за того, что к ним не поступает необходимый объем крови. При аневризме сердца застойная сердечная недостаточность не дает перекачивать кровь в нормальном количестве. Поступающий же объем организм перераспределяет сообразно своим собственным нуждам. В первую очередь, кровь необходима мозгу и другим внутренним органам. Сосуды же кожи не являются жизненно важными. В условиях нехватки кислорода они сокращаются и «экономят» энергию.
В первую очередь, бледнеет кожа лица, конечностей. Параллельно пациенты могут жаловаться на быстро замерзающие пальцы рук и ног, периодическое онемение или снижение чувствительности кожи.
Кашель является достаточно редким симптомом у пациентов с аневризмой сердца. При небольших образованиях он, как правило, отсутствует. Если же речь идет о крупной аневризме, происходит сдавливание части легкого. Поскольку плевра, которой покрыто легкое, очень чувствительная, происходит ее механическое раздражение, и у больного начинается приступ кашля. Он может быть спровоцирован глубоким вдохом, при котором легкое растягивается и аневризма сдавливает его еще больше. В этих случаях кашель сухой, возникает редко и не сопровождается повышением температуры или другими симптомами, характерными для инфекционного заболевания. Такой кашель не сопровождается хрипами в легких или отделением мокроты.
Также возможно появление кашля как симптом застоя крови в малом круге кровообращения (при левосторонней сердечной недостаточности). Механизм появления такого кашля такой же, как и при одышке. Он может быть влажным и при прослушивании (аускультации) сопровождаться хрипами.
Здоровый человек в состоянии покоя не чувствует, как бьется его собственное сердце. Ощущение усиленного сердцебиения может быть вызвано нарушениями ритма либо усиленными сокращениями. При аневризме сердца объем левого желудочка увеличивается, и его передняя стенка более плотно прилегает к ребрам изнутри. Из-за этого пульсация передается отчетливее, и у человека возникает ощущение усиленного биения собственного сердца.
Существует также ряд объективных симптомов и проявлений аневризмы, которые обнаруживаются врачом при осмотре. Они имеют большое значение, так как присутствуют у большинства пациентов, в отличие от вышеперечисленных жалоб более общего характера. О симптомах, выявляемых на приеме у врача, будет подробнее рассказано в разделе «диагностика аневризм сердца».
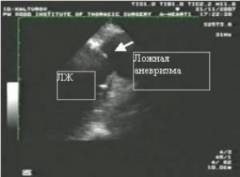
В связи с этим диагностику аневризмы аорты можно разделить на два этапа. На первом врач проводит так называемый физикальный осмотр. Он не прибегает к сложным и дорогостоящим методам обследования, стараясь найти малейшие признаки патологии самостоятельно. Если у него возникает подозрение на аневризму сердца, либо пациент сразу приходит с характерными жалобами, начинается второй этап диагностики. Он включает подробное обследование сердца и сбор информации о патологии. Это помогает правильно классифицировать аневризму и подобрать оптимальную тактику лечения.
В диагностике аневризмы сердца используют следующие методы:
- физикальное обследование;
- электрокардиография (ЭКГ);
- эхокардиография;
- сцинтиграфия миокарда;
- рентгенография.
Как уже говорилось выше, физикальное обследование делается самим врачом-кардиологом без использования какой-либо дорогостоящей аппаратуры. Оно включает набор стандартных методов осмотра пациента, с которыми каждый знаком с детства. На деле опытный врач с помощью этих методов может собрать много полезной информации о работе сердца и других органов.
Физикальное обследование включает следующие методы:
- Пальпация. В отличие от многих других заболеваний сердца, именно при аневризме пальпация может быть очень полезной. Поскольку аневризмы чаще всего располагаются на передней стенке сердца или в области его верхушки, их пульсация хорошо передается на переднюю грудную стенку. В частности, верхушечный толчок при крупных образованиях может быть увеличен до 3 – 5 см в диаметре. Если толчок не ощущался ранее, то при формировании аневризмы он может появиться (что тоже расценивается как симптом). Наиболее специфичен так называемый симптом «коромысла». Так как пульсация аневризмы и остального участка миокарда не совпадает, при пальпации можно ощутить эту разницу в биении сердца. Верхушечный толчок будет отражать нормальный ритм, а аневризма будет отставать. Также пальпаторно можно нащупать пульс на лучевой артерии (в области запястья). У пациентов с аневризмой сердца он часто бывает ослаблен.
- Перкуссия. Перкуссия подразумевает простукивание передней стенки грудной клетки пальцем с целью определить границы органов. Для определения границ сердца используется так называемая тишайшая перкуссия. Аневризма средних и больших размеров сдвигает левую границу сердца влево. Звук при перкуссии будет притупленным, так как полость аневризмы наполнена кровью, а расположенное рядом легкое – воздухом.
- Аускультация. Аускультация также является очень информативным методом при аневризмах сердца. Этот метод заключается в выслушивании работы органа с помощью стетоскопа. При наличии аневризмы могут наблюдаться изменения в работе клапанов и завихрения в токе крови. Это приводит к появлению патологических шумов. Во-первых, выслушивается акцент второго тона над легочной артерией (из-за растущего давления в малом круге). Во-вторых, часто появляется пансистолический шум (шум на протяжении всего периода систолы) и ритм галопа, при котором невозможно различить отдельные тоны. В-третьих, часто ослабевает первый тон митрального клапана. Это происходит из-за растяжения стенок левого желудочка. Другим специфическим признаком является шум Казем-Бека («машинный» шум), который появляется при прохождении крови через устье аневризмы.
- Измерение давления. Пациенты с аневризмой сердца часто страдают от повышенного артериального давления (более чем 140/90). Этот показатель играет важную роль в прогнозировании течения болезни.
Если, применяя вышеперечисленные методы, врач обнаруживает какие-либо признаки аневризмы сердца, он назначает дальнейшее инструментальное обследование.
ЭКГ в наши дни является рутинным методом исследования, который, однако, уже много лет не теряет своей диагностической ценности. Принцип основывается на создании электромагнитного поля вокруг сердца. С помощью специально установленных электродов аппарат регистрирует направление, в котором движется биоэлектрический импульс по миокарду. В результате путем сложения векторов относительно различных осей можно оценить, какая часть сердечной мышцы хуже проводит импульс.
Опытный кардиолог по результатам ЭКГ не только с высокой вероятностью определит аневризму, но и уточнит место ее расположения. Метод является безболезненным, безвредным и недорогим, что позволяет прибегать к нему регулярно (например, в предоперационном периоде, чтобы оценить аневризму в динамике).
Основными признаками аневризмы сердца на ЭКГ являются:
- Отсутствие нормальной динамики. У инфаркта миокарда в каждом из его этапов течения есть свои особенности на ЭКГ. Если имеет место формирование аневризмы, то эта динамика отсутствует. ЭКГ как бы «застывает» на одном из этапов и дальше не меняется.
- Подъем сегментаST. На «застывшей» ЭКГ определяется подъем сегмента ST, что напоминает острую стадию инфаркта. Чаще всего этот признак определяется в грудных отведениях V2 – V4.
- Рецидивирующие приступы тахикардии. Учащение сердцебиения на ЭКГ легко определяется по количеству сердечных комплексов на отрезке ленты.
- Отсутствие отрицательного зубца Т. Встречается далеко не у всех пациентов. Этот зубец является последним в нормальном сердечном комплексе. При наличии аневризмы он может формироваться медленнее либо отсутствовать вовсе.
Если эти признаки определяются на кардиограмме в течение 2 – 3 недель с момента инфаркта, это можно считать предварительным подтверждением диагноза. Если характерные изменения сохраняются более 6 недель, речь, видимо, идет о хронической аневризме сердца.
ЭхоКГ, или УЗИ (ультразвуковое исследование) сердца, является основным методом диагностики. Она позволят со стопроцентной точностью подтвердить диагноз, а также предоставляет много другой полезной информации. Суть метода заключается в применении ультразвуковых волн. Их посылают к сердцу сквозь переднюю стенку грудной клетки. Отражаясь от структур различной плотности, волны возвращаются к чувствительному датчику. На экране аппарата в результате формируется картинка. Наиболее современные устройства считывают информацию одновременно с двух датчиков, что позволяет получить объемную картинку. Кроме того, при ЭхоКГ врач получает картину движущегося сердца. Это тоже немаловажно для оценки его работы.
ЭхоКГ позволяет выявить следующие признаки и особенности строения аневризмы сердца:
- локальное выпячивание стенки сердца;
- истончение стенки аневризмы по сравнению с миокардом в соседних областях (из-за растяжения);
- дискинезия миокарда (стенка аневризмы не принимает участия в сокращениях сердца либо сильно отстает в ритме);
- разделение аневризм на систолические (меньшие по размерам, которые видны в систолу, но исчезают в диастолу) и диастолические (которые видны в любой фазе);
- определение ширины перешейка (важно для выявления ложных аневризм);
- обнаружение тромбов, формирующихся в полости аневризмы или левого желудочка;
- обнаружение крови в полости перикарда;
- оценка работы клапанов;
- измерение диаметра и объема камер сердца (важно для выявления причин сердечной недостаточности);
- оценка направления и скорости кровотока в камерах сердца (важно для прогнозирования тромбоза).
Таким образом, именно ЭхоКГ дает наиболее полную информацию о болезни. На основании этого исследования аневризма классифицируется по форме, размерам и другим критериям. Делается прогноз для конкретного пациента и намечается оптимальная тактика при лечении.
Является довольно дорогостоящим и сложным исследованием. При нем в кровоток вводится особое вещество – изотоп таллия 201 Tl. Это вещество улавливается жизнеспособными кардиомиоцитами. Таким образом, через некоторое время после его введения таллий скапливается в тех областях сердечной мышцы, куда поступает кровь. Чем интенсивнее накопление изотопа, тем лучше кровоснабжение. В стенке постинфарктных аневризм таллий, как правило, не накапливается. Это создает контраст при сканировании сердца, и врачи легко обнаруживают аневризму.
Существуют следующие варианты данного теста:
- С применением вазодилататоров. Данные вещества расширяют коронарные сосуды и улучшают кровоснабжение. Врачи могут сделать заключение, помогают ли препараты данной группы конкретному пациенту, или нужно искать более эффективные аналоги.
- С нагрузкой. При нагрузке, как уже говорилось выше, сердце потребляет больше кислорода. Могут обнаруживаться определенные дефекты в накоплении изотопа. Тогда врачам будет ясно, какая нагрузка для пациента является предельно допустимой.
Кроме сцинтиграфии с таллием можно прибегнуть к аналогичному тесту с изотопом технеция – 99m Tc. Это вещество, наоборот, накапливается в погибших кардиомиоцитах, за счет чего стенка аневризмы как бы «подсвечивается» при сканировании. Данные исследования могут помочь хирургам лучше подготовиться к операции, а также позволят дать более точный прогноз для конкретного пациента.
Рентгенография в диагностике аневризмы сердца применяется сравнительно редко, обычно в тех случаях, когда нет возможности применить другие методы. Суть рентгенографии состоит в прохождении рентгеновского излучения через тело человека. Часть его поглощается тканями. Чем плотнее ткань, тем меньше частиц попадает на кассету с чувствительной черной пленкой. Таким образом, на снимке более плотные места выглядят светлее (почти белые), а легкие, например, в которых много воздуха, будут темными. Метод хорош простотой выполнения, безболезненностью и низкой стоимостью. Однако он не дает исчерпывающей информации о заболевании, а пациент, к тому же, получает небольшую дозу радиации. Однако для здорового человека данная доза полностью безопасна с медицинской точки зрения.
С помощью рентгенографии можно обнаружить только большие аневризмы, расположенные на передне-левой стенке и на верхушке органа. На снимке будет видно увеличение границ сердца. По неправильному (иногда даже двойному) контуру можно предположить правильный диагноз. Однако для однозначного подтверждения рентгенографии недостаточно.
Помимо вышеперечисленных методов диагностики могут быть назначены и другие исследования, которые косвенно указывают на причину появления аневризмы. Например, анализ крови на маркеры некроза подтверждает, что пациент недавно перенес инфаркт миокарда, и его необходимо наблюдать в течение некоторого времени, так как есть шанс появления аневризмы. В редких случаях повышенная СОЭ (скорость оседания эритроцитов) или лейкоцитоз (повышенный уровень лейкоцитов) говорят о воспалительном повреждении миокарда другой природы. Анализ мочи назначается скорее для выявления других сопутствующих заболеваний. Непосредственно аневризма сердца не вызывает в нем каких-либо серьезных изменений.
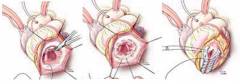
Непосредственно после обнаружения аневризмы больного могут госпитализировать для более подробного обследования. Если нет непосредственной угрозы разрыва или серьезной сердечной недостаточности, хирургическое лечение можно отложить. В этом случае медикаментозное лечение пациента проводится в домашних условиях. Однако все равно необходимы регулярные посещения врача-кардиолога. Если больной может не перенести операцию либо добровольно и сознательно отказывается от нее, медикаментозное профилактическое лечение может длиться всю жизнь.
Показаниями к хирургическому лечению аневризмы являются:
- Быстро нарастающая сердечная недостаточность. При этом начинают появляться новые объективные симптомы, а старые усугубляются, несмотря на назначенное лечение.
- Тяжелые нарушения ритма. В данном случае речь идет об аритмии или выраженной тахикардии, которые плохо поддаются медикаментозному лечению.
- Повторные тромбоэмболии. Как уже говорилось выше, в полости аневризмы нередко образуются тромбы, которые могут отрываться и приводить к закупорке сосудов. Если у пациента имело место такое осложнение, и при ЭхоКГ был обнаружен тромб, следует назначить хирургическое иссечение (удаление) аневризмы.
- Ложные аневризмы сердца. Как уже говорилось выше, ложная аневризма является скорее неполным разрывом. В любой момент она может привести к сильнейшему кровотечению. Вследствие этого при обнаружении таких аневризм следует проводить срочное хирургическое лечение с устранением дефекта.
- Разрыв аневризмы. Является наиболее опасным осложнением. Сопровождается тяжелым кровотечением, кровь перестает нагнетаться в аорту, и организм может быстро погибнуть от нехватки кислорода.
Во всех этих случаях существует серьезный риск осложнений. Аневризма сильно снижает качество жизни пациента, вызывает множество различных сбоев и нарушений в работе сердца. Статистически такие образования приводят к летальному исходу в 5 – 7 раз чаще, чем бессимптомные аневризмы.
В целом существует два основных варианта лечения аневризмы сердца:
- хирургическое лечение;
- медикаментозное лечение.
Является основным способом устранения аневризм сердца. В данном случае речь идет о весьма серьезной и масштабной операции, в ходе которой врач вскроет грудную клетку, чтобы обеспечить широкий доступ к органу. После этого будет остановлен ток крови через камеры сердца. Насосную функцию временно будет выполнять специальный аппарат, который соединяют с основными сосудами. Когда через сердце уже не перекачивается кровь, хирург начинает, собственно, удаление аневризмы. Оно включает иссечение мешка с удалением деформированных участков соединительной ткани. Также удаляются тромбы внутри желудочков, если они имеются. После этого стенка сердца прочно ушивается. Иногда для ее укрепления и поддержания нормальной формы органа применяют и синтетические материалы.
Параллельно обращается внимание на кровоток через коронарные артерии. Часто одновременно с иссечением аневризмы приходится делать шунтирование сосудов, чтобы восстановить нормальный кровоток. Это снижает вероятность инфарктов в послеоперационном периоде и устраняет ангинозные боли.
Наиболее распространенными проблемами после иссечения аневризмы сердца являются:
- скопление крови в перикарде;
- снижение фракции выброса левого желудочка (левосторонняя сердечная недостаточность);
- нарушения ритма;
- образование тромбов.
Однако со всеми этими проблемами становится легче бороться соответствующими медикаментами. Практически исчезает риск разрыва аневризмы или повторных инфарктов (если параллельно было сделано шунтирование).
При ложных аневризмах операция заключается в ушивании дефекта стенки, рассечении спаек между листками перикарда и удалении крови из полости перикарда. При аневризме межжелудочковой перегородки проводится ее укрепление по специальной методике.
Операция проходит под общим наркозом и длится несколько часов. Значительная часть времени уходит на вскрытие грудной клетки и подключение аппарата для перекачивания крови. Даже хорошо выполненная операция заканчивается летальным исходом в 3 – 8% случаев. Послеоперационный период длится несколько недель, в течение которых пациент находится в больнице под присмотром специалистов и получает профилактическое медикаментозное лечение.
Медикаментозное лечение аневризмы чаще всего сводится к снижению нагрузки на левый желудочек и профилактике образования тромбов. Если по результатам ЭхоКГ аневризма не увеличивается в размерах, а в полости желудочка не образуются тромбы, пациент может обходиться без операции длительное время. Многим пациентам в возрасте, которые могут не перенести наркоз, рекомендуется именно такое симптоматическое лечение. Операция назначается лишь тогда, когда врачи подозревают, что есть опасность разрыва, либо симптомы и проявления болезни не поддаются медикаментозной терапии.
Для консервативного лечения аневризмы сердца можно применять следующие группы препаратов:
- Бета-адреноблокаторы. Данная группа препаратов ослабляет сердечные сокращения, стабилизирует ритм. Лекарственное вещество блокирует рецепторы на кардиомиоцитах, из-за чего они становятся не так восприимчивы к импульсам возбуждения.
- Тромболитики. Данная группа назначается для профилактики образования тромбов. Ее действие сводится к снижению слипания тромбоцитов и разжижению крови.
- Диуретики (мочегонные препараты). Назначаются гипертоникам (пациентам с гипертонической болезнью) для снижения артериального давления. Чем ниже давление, тем меньше вероятность разрыва аневризмы.
- Нитраты. Применяются для расширения коронарных сосудов. Поступление крови к сердечной мышце улучшается, и ангинозные боли проходят.
Конкретные препараты и их дозировки в данном случае может определить только лечащий врач исходя из симптомов у конкретного пациента. Единых стандартов медикаментозного лечения пациентов с аневризмой сердца не существует. Дозы подбираются в зависимости от симптомов, данных ЭКГ и ЭхоКГ, анализов крови. Самолечение вышеуказанными группами препаратов может привести к серьезнейшим осложнениям (разрыв аневризмы, остановка сердца или дыхания).

Профилактика разрыва аневризмы сердца включает следующие пункты:
- Отказ от курения. Никотин, содержащийся в сигаретах, может влиять на скорость сердечных сокращений. При наличии аневризмы это часто вызывает приступы аритмии и стенокардии (из-за спазма коронарных сосудов). Кроме того, курение является важным фактором, влияющим на развитие атеросклероза. При данном заболевании в просвете артерий откладываются холестериновые бляшки, мешающие нормальному току крови. Это ухудшает прогноз для пациента.
- Отказ от алкоголя. Алкоголь не только вызывает опьянение, которое, в принципе, не представляет опасности для сердца, но и приводит к расширению периферических сосудов. Из-за этого происходит перераспределение жидкости в организме, и нагрузка на сердце увеличивается. В результате повышается риск разрыва и других осложнений болезни.
- Снижение физической активности. Любая физическая нагрузка (в том числе быстрая ходьба, бег, подъем по ступенькам и др.) сопровождается учащением дыхания и сердцебиения. Чем старше или слабее организм, тем быстрее включаются данные механизмы. В норме они призваны ускорить кровоток и увеличить поступление кислорода к мышцам. Однако все это представляет собой значительную нагрузку на сердце. Приток крови и учащение ритма могут спровоцировать разрыв аневризмы и привести к летальному исходу.
- Соблюдение диеты. Больным с аневризмой сердца обычно назначают лечебную диету №10 по Певзнеру. Она направлена на борьбу с симптомами сердечной недостаточности, которые часто наблюдаются у больных. Необходимо исключить соленую и острую пищу, свежий хлеб, жирные сорта мяса и рыбы. Также не рекомендуется употребление кофе, крепкого чая или шоколада. Основу составляют вегетарианские супы, овощи и фрукты (без грубой клетчатки), молочные продукты. Такая диета снижает риск развития атеросклероза, улучшает кровообращение и разгружает сердце.
На практике все эти меры часто помогаю избежать разрыва в первые 2 – 3 недели после инфаркта. После этого угроза именно разрыва сильно снижается. Однако соблюдение профилактического режима поможет снизить частоту приступов стенокардии (болей в груди) или нарушений сердечного ритма. Больным желательно придерживаться вышеописанных правил до конца жизни либо до момента операции, когда причина болезни будет устранена. При наличии других хронических заболеваний лечащий врач может уточнить диету либо дополнить список другими профилактическими мерами.
В случае аневризмы сердца важно воспринимать данные предписания всерьез. Медикаментозное лечение не даст никакого эффекта без их соблюдения. Однако и соблюдение режима малоэффективно без лекарств. В профилактике аневризмы эти методы идут параллельно и имеют примерно равное значение для прогноза на будущее.
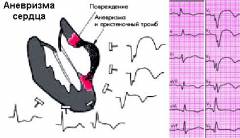
Однако следует учитывать, что такая серьезная операция всегда представляет определенный риск. Пожилые люди могут не перенести наркоз, а в периоде восстановления возможны свои осложнения, не связанные непосредственно с аневризмой. Поэтому часть пациентов не соглашаются на операцию осознанно. Некоторым больным операция противопоказана из-за сопутствующих хронических заболеваний.
Плохой прогноз для пациентов, не согласившихся на хирургическое лечение аневризмы сердца, объясняется следующим образом:
- Риск осложнений. Формирование аневризмы после инфаркта сопряжено с определенной опасностью в будущем. Аневризма сильно влияет на работу этого жизненно важного органа в целом. В определенных условиях она может привести к таким серьезным осложнениям как фибрилляция желудочков, разрыв аневризмы, формирование и отрыв тромба с закупоркой других сосудов. Все эти осложнения часто заканчиваются летальным исходом. Риск их появления и объясняет плохой изначальный прогноз.
- Рост аневризмы. Аневризма сердца представляет собой растянутый участок стенки органа. Растягивается он из-за снижения прочности миокарда (сердечной мышцы) или функциональных нарушений. Даже нормальная работа сердца сопровождается периодическим повышением давления в полости левого желудочка. Это приводит к тому, что стенка аневризмы растягивается еще больше, а опасность разрыва постепенно повышается. Так как стенка состоит в основном из соединительной ткани, а не из нормального миокарда, ее эластичность снижена. Растянувшись, она уже не может вернуть прежний вид. Единственным выходом является операция, которая и улучшит прогноз.
- Снижение качества жизни. Даже без осложнений, угрожающих пациенту смертью, качество его жизни снизится. Альтернативой хирургическому лечению является профилактический прием медикаментов. Это не устраняет саму аневризму, а просто снижает риск осложнений. В то же время пациенту приходится постоянно ограничивать физическую нагрузку, соблюдать диету, мириться с периодическими болями, сердцебиением и другими неприятными симптомами.
При обращении конкретного пациента к врачу-кардиологу, для определения правильного прогноза нужно пройти ряд обследований. Наиболее важными являются электрокардиография (ЭКГ) и эхокардиография (ЭхоКГ). Они позволяют собрать информацию об аневризме и правильно ее классифицировать, что важно для определения тактики лечения.
На прогноз при аневризме сердца влияют следующие факторы:
- Размеры аневризмы. Чем больше образование, тем выше риск разрыва и других осложнений.
- Форма аневризмы. Диффузные или мешковидные образования менее опасны, чем грибовидные или вариант «аневризма в аневризме». В последнем случае стенка растянута сильнее, и поражен больший участок миокарда.
- Срок с момента образования. Острые аневризмы (до 2 недель) чаще приводят к разрыву, так как соединительная ткань после инфаркта еще не успела набрать прочность, и стенка наиболее слаба. Хронические аневризмы (более 6 недель) в этом отношении более стабильны.
- Локализация аневризмы. Аневризмы левого желудочка считаются наиболее опасными, так как в этой камере сердца наиболее высокое внутреннее давление. Это способствует росту аневризмы и повышает риск разрыва. Аневризмы же правого желудочка или межжелудочковой перегородки в этом плане менее опасны (однако и встречаются они гораздо реже).
- Степень нарушения работы сердца. Аневризма левого желудочка может приводить к возникновению левосторонней сердечной недостаточности. При этом из сердца выбрасывается пониженный объем крови, которого не хватает для нормального питания организма. Чем меньше фракция выброса (объем крови, который выбрасывает левый желудочек за одно сокращение), тем хуже прогноз для пациента.
- Возраст. Как уже говорилось выше, возраст может стать помехой для проведения операции. Кроме того, мышца сердца у пожилых людей уже не так сильна. Повышен риск разрыва или других осложнений.
- Сопутствующие заболевания. Инфаркт миокарда является весьма распространенным заболеванием. Иногда возникают ситуации, когда постинфарктные аневризмы формируются у людей с сахарным диабетом, почечной недостаточностью и другими хроническими патологиями. Это ухудшает прогноз, так как обострение имеющихся заболеваний может резко ухудшить работу сердца и повышает риск осложнений.
Однако аневризмы сердца у детей все же встречаются, хоть и очень редко. В этих случаях они являются не постинфарктными, а вызваны другими причинами. Как правило, это различные заболевания детского возраста, сопровождающиеся осложнениями на сердце.
Наиболее распространенными заболеваниями сердца у детей являются:
- Врожденные пороки сердца. Данная причина может привести к аневризмам у новорожденных. Под врожденными пороками понимают аномалии развития сердца во внутриутробном периоде, до момента рождения. Аневризмы могут быть вызваны какими-либо генетическими дефектами, когда клетки просто неправильно делятся, либо воздействием каких-либо внешних факторов. Обычно это токсины (в том числе алкоголь, наркотики или курение) в период беременности, некоторые заболевания (герпес, корь, краснуха, грипп), травмы. Иногда на фоне врожденных пороков сердца аневризма образуется в первые недели или месяцы жизни ребенка. Например, порок клапанов может вызвать резкие скачки давления в сердечных камерах, что способствует образованию аневризм. Недоразвитие проводящей системы может «выключить» из работы определенный участком миокарда, и он не будет вовремя сокращаться. Такие аневризмы называют еще функциональными, поскольку нет прямого повреждения тканей сердца.
- Инфекционные заболевания. Существует достаточно много детских заболеваний, которые могут дать осложнения на сердце. Это приведет к развитию воспалительного процесса (эндокардита или миокардита), который ослабит сердечную мышцу. Инфекции могут быть вирусного (вирус Коксаки В) или бактериального происхождения (поражение дифтерийным токсином). Однако при этих заболеваниях серьезный воспалительный процесс, который заканчивается появлением аневризмы, встречается в медицинской практике достаточно редко.
- Токсическое поражение миокарда. Сюда относят воздействие на сердечную мышцу определенных токсичных веществ, с которыми вступает в контакт ребенок. Часть этих веществ сами по себе вызывают воспалительный процесс в миокарде, часть – через иммунный ответ (тогда это точнее отнести к аллергическим миокардитам). Однако такие процессы тоже крайне редко приводят к появлению аневризмы, так как поражение миокарда не так масштабно.
Во всех вышеперечисленных случаях не идет речь о смерти такого большого количества кардиомиоцитов (клеток миокарда), как это бывает при инфаркте миокарда. Чаще всего в аневризмах сердца у детей достаточно много мышечной ткани (а не только рубцовая). Это объясняет достаточно благоприятный прогноз. Стенка аневризмы не потеряла полностью свою эластичность и прочность. Поэтому разрывы таких аневризм и другие осложнения встречаются крайне редко. Чаще всего аневризмы сердца у детей протекают без каких-либо выраженных симптомов или проявлений.
Однако если у ребенка обнаруживается аневризма сердца, нельзя недооценивать риск для здоровья. Проводится полноценное обследование у врача-кардиолога. Затем в течение некоторого времени ребенок регулярно наблюдается. Проводится эхокардиография (ЭхоКГ), чтобы определить, есть ли динамика роста у данного образования. Таким детям запрещают заниматься спортом из-за высокого риска осложнений. Впоследствии обычно выбирают удобный момент, когда организм лучше всего готов, и проводится операция по удалению аневризмы. В противном случае по мере взросления аневризма может начинать создавать проблемы, и риск различных осложнений увеличивается.

На получение группы инвалидности влияют следующие особенности течения болезни:
- Срок с момента образования. Медико-социальная экспертиза (МСЭ), устанавливающая группу инвалидности, рассматривает обычно хронические аневризмы, то есть те, которые сформировались через 4 – 6 недель после инфаркта.
- Наличие сердечной недостаточности. Данный пункт является наиболее важным. Сердечная недостаточность возникает из-за застоя крови в полости аневризмы. Кровь начинает хуже перекачиваться по организму, и от этого страдают различные органы. Степень сердечной недостаточности определяется на основании присутствующих симптомов, а также результатов инструментальных исследований (электрокардиография, эхокардиография, вентрикулография и др.). При выраженной сердечной недостаточности пациент не способен к самообслуживанию и зависит от других людей. Это является достаточным поводом для получения первой группы инвалидности.
- Наличие сопутствующих заболеваний. Если инфаркт с образованием аневризмы произошел у людей с тяжелыми хроническими заболеваниями (сахарный диабет и др.), то это повышает шансы на получение группы инвалидности. Дело в том, что эти болезни могут помешать провести хирургическое лечение. А это значит, что у больного не временная, а постоянная потеря трудоспособности. Значение имеет также тип и частота обострений хронического заболевания.
Существуют и другие условия и факторы, которые могут повлиять на решение МСЭ. Так, например, будет рассматриваться возраст пациента, его профессия (сопряжена ли она с факторами риска, которые могут привести к осложнениям), есть ли возможность профессиональной переподготовки (переквалификации) на другие, более безопасные рабочие места. Если пациент в возрасте и его специальность сопряжена с серьезными нагрузками, это является весомым аргументом в пользу группы инвалидности.
Важным фактором также является возможность хирургического лечения аневризмы. Дело в том, что без операции всегда существует риск тяжелых осложнений, угрожающих смертью пациента. После операции пациент постепенно восстанавливается, и к нему в определенной степени возвращается трудоспособность. Удаление аневризмы повышает качество его жизни, устраняет или облегчает сердечную недостаточность. При прохождении комиссии учитывается и эта возможность. Не исключено получение более высокой группы инвалидности (например, первой или второй) с последующим пересмотром и понижением (до третьей группы) после операции.
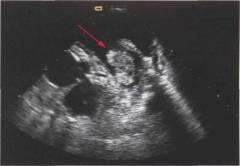
При аневризмах сердца у пациентов чаще всего встречаются следующие осложнения:
- Разрыв аневризмы. Данное осложнение встречается не так уж часто, но почти всегда заканчивается летальным исходом. Собственно, аневризма представляет собой сильно растянутую стенку сердца, которая образует патологическую полость. Внутри сердца (особенно в полости левого желудочка) всегда поддерживается высокое давление, которое необходимо, чтобы перекачивать кровь по сосудам. Это давление постоянно действует на стенки аневризмы, растягивая их еще сильнее. В определенных условиях давление может резко повыситься (чаще всего при нагрузке, сильном стрессе). Тогда ослабленная и растянутая стенка сердца попросту разрывается. Через открывшийся дефект за короткое время огромное количество крови выходит из сосудистого русла, приводя к смерти пациента. Наиболее подвержены разрывам аневризмы больших размеров в первые недели после их формирования. Однако даже условно благоприятные аневризмы (хронические, небольших размеров) могут в определенных условиях разорваться.
- Нарушения проводимости. Нарушения проводимости возникают из-за того, что биоэлектрический импульс, вырабатываемый в синусовом узле сердца, не распространяется нормально по миокарду. Здоровая мышца проводит его с определенной скоростью и сокращается под его воздействием. Аневризма же состоит их соединительной ткани, которая этот импульс проводит плохо, а сокращаться не способна вовсе. В итоге возникают так называемые нарушения ритма, которые можно условно разделить на три группы — брадикардии (замедление ритма), тахикардии (учащение ритма) и аритмии (рваный ритм с разными интервалами между сокращениями). При аневризмах чаще всего возникают так называемые пароксизмальные тахикардии. В момент приступа кровь хуже перекачивается сердцем. Пациент может почувствовать головокружение, боли в груди или даже потерять сознание. Частые приступы у пациентов с аритмией говорят о плохом прогнозе. Летальность среди таких пациентов (даже без разрыва) возрастает в 4 – 6 раз.
- Сердечная недостаточность. Так как аневризма в подавляющем большинстве случаев образуется в стенке левого желудочка, пациенты обычно страдают от так называемой левосторонней (или левожелудочковой) недостаточности. Она возникает отчасти из-за нарушений ритма, отчасти из-за расширения полости левого желудочка. Дело в том, что в полости аневризмы постоянно находится определенный объем крови. Ее стенки не сокращаются, поэтому эта кровь практически «выключается» из системного кровотока. Кроме того, сам левый желудочек не сокращается достаточно сильно. В результате он выбрасывает в аорту меньше крови, чем обычно. Часть крови застаивается в самом желудочке, в левом предсердии, в сосудах легких. Такие пациенты часто жалуются на слабость, головокружение, бледность, боязнь холода. При выраженном застое крови в легких могут также появляться хрипы и кашель, сердечные отеки. Без хирургического и медикаментозного лечения со временем развивается и правосторонняя сердечная недостаточность (при аневризме перегородки сердца она наступает быстрее).
- Тромбоэмболия. Тромбоэмболией называется ситуация, когда тромб, сформировавшийся в каком-либо сосуде кровеносной системы, отрывается и закупоривает другой, меньший по диаметру сосуд. У многих пациентов с аневризмой сердца тромбы формируются как раз в левом желудочке. Патологическая полость способствует застою крови. Активируется свертывающая система, и клетки крови начинают слипаться, образуя тромб. Во время приступа аритмии или при резком скачке давления (а иногда и просто от резкого движения или сотрясения) тромб отрывается и попадает в аорту. Отсюда он может быть занесен практически в любую артерию организма. Чаще всего регистрируется закупорка сосудов мозга (ишемический инсульт), коронарных сосудов сердца (повторный инфаркт миокарда), ветвей мезентериальной артерии (некроз кишечника), почечных артерий. Во всех этих случаях речь идет о развитии тяжелейшего состояния с отказом какого-либо жизненно важного органа.
Таким образом, сама аневризма сердца может проявляться какими-либо неприятными симптомами, но наибольшую опасность для жизни представляют осложнения этой патологии. Если операцию провести невозможно, рекомендуется регулярно приходить на осмотр к врачу-кардиологу, проходить необходимые обследования (например, ЭхоКГ для своевременного обнаружения растущих тромбов), а также проводить профилактическое медикаментозное лечение.
источник

