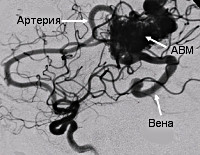
Артериовенозная мальформация (АВМ) головного мозга – это локальный дефект архитектоники внутричерепных сосудов, при котором формируется беспорядочное соединение между артериями и венами с образованием извитого сосудистого клубка. Патология возникает вследствие ошибки морфогенеза, а потому в основном является врожденной. Может быть одиночной или распространенной.
При мозговой АВМ кровоток осуществляется аномально: кровь из артериального бассейна прямиком, обходя капиллярную сеть, перебрасывается в венозную магистраль. В зоне мальформации отсутствует нормальная промежуточная капиллярная сеть, а связующий узел представлен фистулами или шунтами в количестве 1 и более единиц. Стенки артерий дегенерированы и не имеют надлежащего мышечного слоя. Вены, как правило, расширены и истончены по причине нарушенной ауторегуляции мозгового кровотока.
АВМ головного мозга, как и аневризмы, опасны внезапным внутримозговым кровоизлиянием, которое возникает вследствие разрыва стенки патологического сосуда. Разорвавшаяся мальформация чревата ишемией мозга, отеком, гематомой, прогрессией неврологического дефицита, что не всегда для больного заканчивается благополучно.
Артериовенозная мальформация в структуре всех патологий с объемными образованиями в тканях головного мозга в среднем составляет 2,7%. В общей статистике острых нетравматических геморрагий в субарахноидальное пространство, 8,5%-9% случаев кровоизлияний происходят по причине мальформаций. Инсультов головного мозга – 1%.
Встречаемость заболевания происходит со следующей средней частотой в год: 4 случая на 100 тыс. населения. Некоторые зарубежные авторы указывают другую цифру – 15-18 случаев. Несмотря на врожденную природу развития, клинически проявляется только у 20%-30% детей. Причем возрастной пик обнаружения АВМ ГМ у детей приходится на младенчество (≈13,5%) и возраст 8-9 лет (столько же %). Считается, что у ребенка с таким диагностированным сосудистым нарушением риски разрыва гораздо выше.
По статистике, мальформации проявляют себя по большей мере в возрасте 30-40 лет, поэтому диагностируются чаще у людей именно этой возрастной группы. Заболевание обычно протекает скрыто в течение десятков лет, чем и объясняется такая тенденция его определения далеко не в детские годы. Половой закономерности в развитии церебральных АВМ у мужского и женского пола пациентов не обнаружено.При наличии мальформации ГМ вероятность разрыва составляет от 2% до 5% в год, с каждым последующим годом риски увеличиваются. Если кровоизлияние уже состоялось, риск его повторного рецидива существенно возрастает, вплоть до 18%.
Летальные исходы из-за внутричерепного кровоизлияния, которое часто является первым проявлением болезни (в 55%-75% случаев), случаются у 10%-25% пациентов. Смертность вследствие разрыва, согласно исследованиям, больший процент имеет у детей (23%-25%), чем у взрослых людей (10%-15%). Инвалидизация от последствий заболевания отмечается у 30%-50% больных. Примерно к 10%-20% пациентов возвращается полноценное или приближенное к норме качество жизни. Причина такой грозной тенденции заключается в поздней диагностике, несвоевременном получении квалифицированной медицинской помощи.
Распространенная локализация артериовенозной аномалии – это супратенториальное пространство (верхние отделы мозга), проходящее над палаткой мозжечка. Чтобы было понятнее, изъяснимся проще: сосудистый дефект примерно в 85% случаев обнаруживается в больших полушариях. Преобладают поражения сосудистых звеньев теменной, лобной, затылочной, височной долей больших полушарий.
В целом, АВМ могут располагаться в любом полюсе головного мозга, причем как в поверхностных частях, так и глубинных слоях (таламусе и др.). Достоверно определить точную локализацию очага возможно только после прохождения аппаратного исследования с возможностями визуализации мягких тканей. К базовым принципам диагностики относят МРТ и метод ангиографии. Эти методы позволяют качественно оценить порядок ветвления артерий и построение вен, их соединение между собой, калибр ядра АВМ, афференты артерий, дренирующие вены.
Заболевание является врожденным, поэтому анормальная закладка сосудов в определенных зонах мозга происходит в ходе внутриутробного периода. Достоверные причины развития патологии до текущего момента так и не установлены. Но, по словам специалистов, на аномальное строение сосудистой системы ГМ у плода предположительно могут способствовать негативные факторы в течение беременности:
- получение организмом матери высоких доз радиации;
- внутриутробные инфекции, передающиеся в дородовом периоде от матери к ребенку;
- хронические или острые интоксикации;
- курение и прием алкогольных напитков;
- наркотические средства, в том числе из ряда медикаментов;
- лекарственные препараты, обладающие тератогенным действием;
- хронические болезни у беременной в анамнезе (клубочковый нефрит, диабет, бронхиальная астма, пр.).
Специалисты также полагают, что в формировании порока может играть роль и генетический фактор. Наследственность до недавнего времени не воспринималась как причина патологии серьезно. Сегодня же все больше поступает сообщений о причастности и данного фактора. Так, в ряде случаев у кровных родственников больного определяются аналогичного типа сосудистые пороки. Предположительно их вызывает передающаяся по наследству генная мутация, затрагивающая хромосому 5q, локус СМС1 и RASA1.
Как было сказано ранее, для заболевания характерно продолжительное «немое» течение, которое может продолжаться десятилетиями. О диагнозе либо узнают случайно в момент диагностического обследования структур головного мозга, либо уже после случившегося разрыва мальформации. В немногочисленных вариантах болезнь может давать о себе знать до того как лопнет сосуд. Тогда клиника патологии чаще проявляется такими симптомами, как:
- шум в ушах (звон, гул, шипение и т.п.);
- частые головные боли;
- судорожный синдром, который схож с эпилептическими приступами;
- неврологические симптомы (парестезии, ощущения онемения, покалывания, вялость и апатия, пр.).
Клиническая картина при разрыве АВМ подобна всем типам внутричерепных кровоизлияний:
- резкое появление сильной головной боли, быстро прогрессирующей;
- головокружение, спутанность сознания;
- обмороки, вплоть до развития комы;
- тошнота, рвота;
- выпадение чувствительности половины тела;
- нарушение зрения, слуха;
- экспрессивная афазия, дизартрия (нарушения произношения);
- быстро нарастающий неврологический дефицит.
У детей заболевание зачастую проявляется отставанием в психическом развитии, задержкой речевых функций, эпиприступами, симптомами сердечной недостаточности, когнитивными нарушениями.
Патологические образования принято различать по топографо-анатомическому признаку, гемодинамической активности, размерам. Первый параметр характеризует место расположения мальформации в головном мозге, отсюда происходят их названия:
- поверхностные АВМ – сосредоточены в коре больших полушарий мозга (на поверхности мозга) и прилежащих структурах белого вещества;
- глубинные АВМ – локализуются в глубине мозговых извилин, базальных ганглиях, внутри желудочков, в структурах ствола ГМ.
По гемодинамической активности выделяют мальформации:
- активные – к ним причисляют смешанного вида АВМ ГМ (самая частая разновидность, при которой обнаруживается частичная деструкция капилляров) и фистулезного типа (артерия прямо переходит в вену, капиллярная сеть полностью разрушена);
- неактивные – капиллярные (телеангиоэктазии), венозные, артериовенозные кавернозные.
Поражение также оценивается по размерам, учитывается диаметр только клубка мальформации. При диагностике размеров используют следующие наименования АВМ:
- микромальформации – менее 10 мм;
- малые – от 10 мм до 20 мм;
- средние – 20-40 мм
- большие – 40-60 мм
- гигантские – более 6 см в диаметре.
Для предупреждения тяжелой геморрагии и связанных с ней необратимых осложнений крайне важно выявить и устранить очаг в ближайшее время, до разрыва. Почему? Объяснение куда более убедительное – при разрывах слишком большой процент людей погибает (до 75% пациентов) от обширного кровоизлияния, несопоставимого с жизнью.
Необходимо понимать, что сосуды АВМ слишком подвержены прорывам, так как они серьезно истощены на почве ненормального строения и нарушенного тока крови. Одновременно с этим, крупные порочные образования сдавливают и повреждают окружающие мозговые ткани, что несет дополнительную угрозу состоятельности функций ЦНС. Поэтому, если диагноз подтвержден клинически, оттягивать с лечением ни в коем случае нельзя.
Терапия заключается в полной резекции или полноценной облитерации сосудистого дефекта хирургическим путем. Существует 3 вида высокотехнологичных операций, которые применяются в этих целях: эндоваскулярное лечение, стереотаксическая радиохирургия, микрохирургическое вмешательство.
- Эндоваскулярная операция. Метод подходит для лечения глубоко расположенных и крупных образований. Вмешательство выполняется под рентгенологическим контролем, анестезиологическое обеспечение – наркоз общего типа. Эта малоинвазивная тактика нередко является начальным этапом лечения перед предстоящей открытой операцией.
- К патологической части головного мозга через бедренную артерию по сосудам подводят тонкую трубочку катетера.
- Через установленный проводник в область мальформации подается специальный клеевый биоматериал, похожий на монтажную пену.
- Нейрохирург пенным составом перекрывает участки поражения, то есть тромбирует аномально развитые сосуды при сохранении здоровых.
- Эмболизация позволяет «выключить» патологическое сплетение из общей системы мозгового кровообращения.
- После выполненной операции под стационарным наблюдением пациент обычно находится 1-5 суток.
- Стереотаксическая радиохирургия. Лечебная тактика хоть и относится к ангионейрохирургии, но не является травматичной. Это означает, что никаких разрезов, введения внутрисосудистых зондов вообще не будет. Подходит для лечения сосудистого порока небольших размеров (до 3,5 см) или в том случае, когда очаг расположен в неоперабельной секции мозга.
- Радиохирургия предполагает разрушение ангиом системами вида Кибер-нож или Гамма-нож.
- Аппараты работают по принципу прицеленного воздействия на аномалию радиоактивным облучением.
- Лучи испускаются с разных сторон и сходятся в одной точке только дефектной зоны, здоровые структуры не затрагиваются. В результате сосуды АВМ срастаются, очаг подавляется.
- На Кибер- или Гамма-ноже процедуры абсолютно безболезненные, во время лечения пациент находится в сознании. Аппараты, на кушетке которых нужно будет просто неподвижно лежать (от 30 минут до 1,5 часов), напоминают традиционные томографы.
- При лечении Гамма-ножом на голову надевается специальный шлем и жестко фиксируется. Чтобы пациент, которому ставят шлем, не испытывал чувства дискомфорта, делают поверхностное местное обезболивание отдельных участков головы. Операция на Кибер-ноже не требует анестезии и помещения головы в жесткую конструкцию.
- В госпитализации нет необходимости. Но возможно понадобится пройти не один сеанс радиохирургии, чтобы окончательно ликвидировать остаточные явления АВМ ГМ. Иногда процесс облитерации длится 2-4 года.
- Прямое микрохирургическое удаление. Микрохирургия при данном диагнозе – единственный метод, который дает максимально высокие шансы на радикальное излечение патологии, сведение до минимума рисков рецидива. Является «золотым стандартом» в лечении данного заболевания с поверхностной локализацией и компактными формами узла.
- Микрохирургическая операция не обходится без типичной краниотомии, обязательно выполняется экономное вскрытие черепа для проведения основных хирургических манипуляций на мозге.
- Вмешательство проходит под общей эндотрахеальной анестезией, под контролем сверхмощного интраоперационного микроскопа и ультразвукового оборудования.
- Для предотвращения кровяного сброса по питающему артериальному сосуду и вене применяется метод биполярной коагуляции, то есть осуществляется прижигание.
- Далее единым блоком через трепанационное окно производится одномоментное иссечение всего тела мальформации с минимальными кровопотерями.
- В конце операционного сеанса отверстие в черепе закрывается костным лоскутом, на кожные покровы накладывается шов.
- Выписка возможна ориентировочно через 14 суток после операции. Далее нужно продолжить послеоперационное восстановление в специализированном центре реабилитации. Продолжительность реабилитации устанавливается индивидуально.
Видео открытой операции можно посмотреть по ссылке: https://www.youtube.com/watch?v=WA2FTX1NK1Y
В определенных ситуациях невозможно сразу приступить к прямой микрохирургии ввиду высоких интраоперационных рисков, особенно при АВМ больших размеров. Или же другой вариант: ангиома после стереотаксии или катетерной эмболизации лишь частично компенсирована, что крайне плохо. Поэтому иногда целесообразно обращаться к поэтапному лечению, используя последовательную комбинацию нескольких ангионейрохирургических методов.
Грамотно спланированный алгоритм лечебных действий поможет полностью удалить сосудистый конгломерат не в ущерб жизненно важным тканям. Адекватность терапии с учетом принципа индивидуальности убережет от прогрессии неврологических отклонений, возможного раннего рецидива со всеми вытекающими последствиями.
Оперировать высший орган ЦНС, который отвечает за множество функций в организме (двигательные способности, память, мышление, речь, обоняние, зрение, слух и пр.), следует доверять мирового уровня нейрохирургам. Кроме того, медучреждение должно быть снаряжено широкой базой высокотехнологичного интраоперационного оборудования передового образца. Российские клиники нейрохирургии мозга, жаль, но значительно отстают по качеству технологического оснащения и профессионализму специалистов от зарубежных медцентров.
В зарубежных странах с высокоразвитой нейрохирургией услуги стоят дорого, зато там, что называется, возвращают пациентов к жизни. Среди популярных направлений, одинаково продвинутых в хирургии головного мозга, выделяют Чехию, Израиль и Германию. В чешских клиниках цены на медицинскую помощь по поводу артериовенозных мальформаций самые низкие. Невысокая стоимость, совершенная квалификация чешских врачей-нейрохирургов сделали Чехию самым востребованным направлением. Именно в это почетное государство стремятся попасть не только пациенты из России и Украины, но и Германии, Израиля, других стран высокого полета. И коротко о ценах.
Центральный военный госпиталь г.Прага.
| Метод хирургии | Россия (руб.) | Чехия (евро) | Германия, Израиль (евро) |
| Операция на CyberKnife или GammaKnife | от 200000 | 8000-12000 | от 20000 |
| Эндоваскулярное вмешательство | от 75000 | до 8000 | от 15000 и более |
| Микрохирургическая резекция | 150000-250000 | 7000-10000 | 13000-18000 |
https://cyberleninka.ru/article/v/endovaskulyarnoe-lechenie-arteriovenoznyh-malformatsiy-sosudov-golovnogo-mozga
https://cyberleninka.ru/article/v/arteriovenoznaya-malformatsii-nizhney-doli-levogo-legkogo-u-patsienta-rannego-vozrasta
https://cyberleninka.ru/article/v/arteriovenoznye-malformatsii-golovnogo-mozga-u-detey
источник
Наиболее распространенными сосудистыми патологиями головного мозга являются острые нарушения мозгового кровообращения – геморрагический инсульт, ишемический инсульт (инфаркт мозга), а также аневризмы сосудов, артериовенозные мальформации (АВМ) и каротидно-кавернозные (сонно-пещеристые) соустья. В нейрохирургической практике чаще всего приходится сталкиваться с такой сосудистой патологией головного мозга, как аневризмы и АВМ, т.к. наиболее эффективным (а часто и единственно возможным) методом их лечения является хирургическое вмешательство.
Аневризма представляет собой локальное выпячивание стенки артерии, имеющее вид тонкостенного мешочка (из-за этого их называют мешотчатыми аневризмами), в котором различают дно (купол), среднюю часть (тело) и шейку. Встречаются также веретенообразные (фузиформные) аневризмы – диффузное расширение артерии на значительном ее протяжении. Мышечный слой в стенке аневризмы отсутствует, а в области дна она заметно истончена, поэтому всегда присутствует риск ее разрыва. Большинство аневризм имеет размеры в несколько миллиметров (до 1 см), однако встречаются и достаточно большие – 2-3 см, а также гигантские аневризмы – 5-6 см в диаметре.
Чаще всего аневризмы возникают на передней мозговой и передней соединительной артериях, реже – на внутренней сонной и средней мозговой артериях, достаточно редко – на артериях вертебро-базилярной системы. Достаточно часто (до 20% случаев) встречаются множественные аневризмы – на двух и более артериях.
В основе возникновения аневризм лежит врожденная неполноценность стенки артерии, возникающий вследствие нарушения структуры коллагена и эластина, значительная роль принадлежит также дегенеративным изменениям сосудистой стенки, в т.ч. и возрастным. По мере развития возрастных изменений в стенке артерии такие изменения возникают и в аневризме – она истончается, увеличивается в размерах, возрастает риск ее разрыва. К факторам, оказывающим влияние на формирование аневризмы, относятся повышенное артериальное давление, атеросклероз, курение.
В большинстве случаев «носители» аневризм головного мозга даже не подозревают об их существовании и они выявляются «случайно» при детальном исследовании сосудов головного мозга. Гигантские аневризмы могут проявляться клинической симптоматикой опухоли базальных отделов мозга, вызывать сдавление черепномозговых нервов, диэнцефальных и стволовых отделов мозга. Основные клинические проявления артериальных аневризм связаны с их разрывом и спонтанным субарахноидальным кровоизлиянием.
Риск развития таких кровоизлияний относительно невысок (1-2% в год), однако он значительно возрастает при аневризмах большого размера (чем больше размеры аневризмы, тем больше риск ее разрыва). При размерах аневризмы до 5 мм риск ее разрыва составляет 2,5% в течение всей жизни, при размерах 6-10 мм аневризма разрывается в 41% случаев, если ее размер превышает 1 см, разрыв аневризмы происходит в 87% случаев. Следует также отметить, что очень высок риск повторных разрывов аневризмы, они возникают более чем у 50% пациентов, причем это может произойти как через несколько недель, так и через несколько лет: в первые 2 недели риск повторного разрыва аневризмы составляет 15-25%, в течение 6 месяцев – 50%.
Артериовенозная мальформация – это врожденная аномалия развития сосудов головного мозга, которая приводит к беспорядочному переплетению патологически измененных сосудов в виде клубков различной формы и размера. В АВМ чаще всего отсутствует капиллярная сеть, вследствие чего артериальная кровь сбрасывается из артериального бассейна в венозное русло, т.е. АВМ фактически представляет собой артериовенозный шунт.
Различают несколько типов сосудистых мальформаций:
- артериальная
- артериовенозная фистулезная
- артериовенозная рацемозная
- артериовенозная микромальформация
- артериовенозная кавернозная
- капиллярные телеангиоэктазия
- венозная
Поскольку в сосудистом конгломерате АВМ отсутствует капиллярная сеть, то часть крови, проходящая по этим сосудам, в тканевом обмене не участвует – происходит т.н. геморрагическое обкрадывание мозга, вызывающее стойку ишемию мозга. Это приводит к прогрессирующей атрофии мозга, развитию неврологического дефицита, психопатических расстройств, возникновению эпилептических припадков, кластерных головных болей. Однако наиболее характерной для АВМ клинической манифестацией являются кровоизлияния.
Риск возникновения кровоизлияний при АВМ составляет 1,5-3% в год, однако он увеличивается с возрастом. Повторные кровоизлияния возникают гораздо чаще: в течение жизни они случаются у 34% больных, а среди перенесших третье – у 36%. Кровотечения из АВМ являются причиной 23% всех внутричерепных кровоизлияний у беременных и 5-12% случаев материнской смертности.
В лечении АВМ специалистами нашего отделения применяются открытые операции, эндоваскулярное вмешательство, радиохирургические методы терапии. Открытые операции по иссечению АВМ мы проводим с использованием микрохирургической техники, позволяющей удалять даже глубоко располагающиеся (в т.ч. и функционально важных областях мозга) АВМ большого размера. Из эндоваскулярных операций мы используем эмболизацию в потоке, стационарную баллон-окклюзию артерий, комбинацию временной или постоянной баллон-окклюзии с эмболизацией в потоке, суперселективную эмболизацию (тромбирование АВМ).
Нейрохихургическая консультация
прием ведет Некрасов Михаил Алексеевич, к.м.н., врач высшей категории
По будням с 10:00 до 18:00 без обеда On-line запись
г.Москва , Ленинский пр-т, дом 10 (27-е нейрохирургическое отделение)
Карта сайта
источник

Образуется он еще на этапе внутриутробного развития и некоторое время может ничем себя не проявлять, но это ощущение здоровья призрачно и опасно для жизни. Большая часть мальформаций склонна к разрыву и кровоизлиянию в головной мозг. Выживаемость пациентов составляет 70 процентов, половина становится тяжелыми инвалидами.
Мальформация представляет собой неправильное срастание сосудов с образованием связей между венами и артериями, которых в норме быть не должно. Нарушенное строение сосудистого русла чревато проблемами с кровотоком, истончением сосудистых стенок и локальным повышением давления.
Заболевание имеет два типа течения:
- геморрагический (42-65%);
- негеморрагический (35-58%).
Геморрагические мальформации сопровождаются внезапными кровотечениями. Это небольшие глубокозалегающие очаги. При разрыве истончившейся стенки сосуда развивается кровоизлияние в головной мозг. Это состояние проявляется сильнейшей головной болью, спутанностью или потерей сознания, ощущением слабости в конечностях и нарушением чувствительности.
Негеморрагические мальформации — чаще всего крупные патологические очаги, расположенные поверхностно. Они сопровождаются сильной приступообразной головной болью (5-25%), приливами, тахикардией и судорожным синдромом (17-40%).
Среди других неврологических симптомов:
- головокружение;
- мышечная астения;
- проблемы со зрением;
- нарушение координации.
Симптоматика может проявляться в разном возрасте, и при диагностировании недуг нуждается в тщательном лечении.
Аневризма — сходный вид патологии. Это выбухание стенки сосуда, чреватое разрывом на фоне ее постепенного истончения. Заболевание является опасным для жизни и приводит к внезапному кровоизлиянию и, как следствие, тяжелой инвалидности или летальному исходу.
С каждым годом вероятность инсульта на фоне аневризмы и мальформации увеличивается, составляя к:
- 25 годам — 50 процентов;
- 40 годам — 80 процентов;
- 50 годам — 87 процентов.
Поэтому при обнаружении патологического очага в головном мозге нельзя оставлять его без внимания. Требуется хорошо спланированное лечение.
Лечение аневризм и мальформаций
Единственным надежным способом убрать патологический очаг является операция. Это сложное и травматичное нейрохирургическое вмешательство, подразумевающее вскрытие черепной коробки и удаление проблемной зоны. Операцию проводят под наркозом. Она сопровождается сложной и продолжительной реабилитацией.
Несмотря на применяемые методы микрохирургии, современную аппаратуру и другие новшества, процедура удаления мальформации или аневризмы может быть успешной далеко не всегда. При глубоком расположении патологического очага до него, не травмировав мозг, очень сложно добраться. Такие аневризмы и мальформации часто являются неоперабельными.
Чтобы визуализировать их расположение, применяется ангиография, нейронавигация, электрокортигография, КТ или МРТ. После операций пациенты долго остаются в реанимационном отделении и только после полной стабилизации долечиваются в отделении нейрохирургии.
Еще одним видом лечения при сосудистой патологии головного мозга является эмболизация. Лечение применяется только при крупных очагах и хорошем общем состоянии здоровья. Операция проводится под наркозом и иногда комбинируется с хирургическим удалением остаточного очага. Учитывая сложность проведения, подобное лечение востребовано далеко не всегда.
Лечение Гамма-ножом
Гамма-нож представляет собой современный радиохирургический метод оперативного лечения многих заболеваний бескровным и неинвазивным путем. При его применении эффект достигается за счет направленного радиоактивного излучения, в дозе, достаточной для уничтожения патологического очага и не нанесения ущерба окружающим здоровым тканям.
Эффект достигается за счет точного компьютерного планирования по результатам компьютерной томографии или магнитно-резонансного сканирования. По данным, полученным в ходе обследования, создается трехмерная модель проблемной зоны, определяется направление и сила радиоактивного воздействия.
Лечение при аневризмах и мальформациях сосудов проводится аккуратно и с минимальной травматизацией. И это выгодно отличает Гамма-нож от других вмешательств. Процедура спланирована заранее и соответствует особенностям каждого клинического случая.
Ее сущность заключается в прицельном облучении патологического очага. Доза подбирается индивидуально. Мальформации постепенно регрессируют в течение нескольких лет. Чаще всего подобному лечению подвергаются мелкие и глубоко расположенные очаги, к которым невозможно добраться другим способом.
Крупные артерио-венозные образования требуют высоких доз облучения, что небезопасно. Поэтому процедура проводится двумя путями:
- Фракционным. Многократным облучением патологической зоны. Подобное лечение оправдано при гигантских размерах патологического очага.
- Стажированным. При образованиях диаметром 6-8 сантиметров может использоваться большая доза облучения, подаваемая поэтапно в течение полугода.
Недостатком лечения является постепенный, с каждой процедурой, регресс образования. В это время риски, присущие таким заболеваниям, сокращаются постепенно. Но весомый плюс — неинвазивность вмешательства — делает его востребованным и оправданным во многих случаях.
Процедура лечения достаточно проста. Пациент находится в изолированной комнате, лежа на специальном столе. Под местным наркозом его голову закрепляют винтами к специальной рамке, дабы обездвижить на время проведения сеанса. Наркоз во время процедуры не применяется, так как радиохирургия безболезненна.
Побочных эффектов и осложнений после сеанса крайне мало. Некоторые пациенты жалуются на слабую головную боль, у других в месте закрепления винтов наблюдается местный отек. Необходимости в стационарном наблюдении нет. Лишь те, кто прошел перед лечением ангиографию, остаются в клинике на 2-3 часа.
Не рекомендуется в день процедуры водить машину и выполнять действия, требующие внимания и четкой координации. Врач может назначить щадящий режим и дополнительные обследования между повторными сеансами. Более подробно о рекомендациях и сущности процедуры можно узнать в нашей клинике. Будем рады помочь!
Наши консультанты ответят на все вопросы, а опытные онкологи определят необходиость лечения гамма-ножом.
источник
Существуют два принципиально различных подхода к хирургическому лечению аневризм:
- Традиционный интракраниальный доступ с выделением несущих артерий и выключением аневризмы из общего кровотока путем клипирования ее шейки либо вынужденной окклюзии несущей аневризму артерии (треппинг). В редких особо сложных случаях применяется окутывание аневризматического мешка мышцей либо специальными синтетическими материалами (surgigel, tachocomb).
- Эндоваскулярный метод, суть которого заключается в проведении всех манипуляций, направленных на выключение аневризмы, внутри сосуда под контролем рентген-изображений. Постоянная окклюзия аневризмы достигается введением либо отделяемого баллон-катетера, либо специальных микроспиралей (coils).
Интракраниальный метод выключения аневризмы технически более сложен и травматичен для больного, однако по степени надежности занимает ведущее место.
Операция заключается в проведении костнопластической трепанации черепа, широком раскрытии базальных цистерн с аспирацией ликвора, что позволяет уменьшить мозг в объеме и улучшить доступ к артериям основания мозга. Используя операционный микроскоп и микрохирургическую технику, выделяют вначале несущую артерию, затем выделяется одна или две отводящие артерии. Это делается с целью возможности в случае интраоперационного разрыва аневризмы наложения временных клипсов. Основной этап — выделение шейки аневризмы. Тело аневризмы, за исключением гигантских, как правило, не иссекается. Достаточно наложить на шейку аневризмы клипс, надежно выключающий ее из кровотока. Во всем мире используются самосжимающиеся съемные пружинные клипсы, разработанные в 70-х годах XX столетия С. Drake и M. Yasargil.
Интракраниальные операции могут быть реконструктивными и деконструктивными. Все хирурги стремятся к проведению реконструктивных операций, позволяющих выключить аневризму с сохранением всех приводящих и отводящих артерий. В случаях, когда из-за особенностей анатомического расположения и формы аневризматического мешка его невозможно выключить реконструктивно, производится треппинг, т.е. выключение аневризмы вместе с несущей артерией. Чаще всего такая операция заканчивается инфарктом мозга и развитием у больного грубого неврологического дефицита. Иногда нейрохирурги в подобных ситуациях предпочитают не выключать артерию, а окутать аневризму мышцей или специальными синтетическими материалами с целью укрепления стенки снаружи развивающимся фиброзом в ответ на инородное тело.
Эндоваскулярные операции выполняются введением отделяемого баллона-катетера в полость аневризмы через общую сонную артерию (аневризмы каротидного бассейна) либо через бедренную (аневризмы вертебро-базилярного бассейна). Для выключения аневризмы из кровотока используются специальные баллон-катетеры конструкции Ф.А. Сербиненко. Баллон заводится в полость аневризмы под рентгенконтролем, заполняется быстротвердеющей силиконовой массой. Объем вводимого силикона должен точно соответствовать объему внутренней полости аневризмы. Превышение этого объема может привести к разрыву аневризматического мешка. Введение меньшего объема не обеспечит надежную окклюзию аневризмы. В ряде случаев не удается выключить аневризму баллоном с сохранением проходимости артерий. В этих случаях приходится жертвовать несущей артерией, выключая ее вместе с аневризмой. Перед выключением аневризмы производится пробная окклюзия путем введения в баллон физиологического раствора. Если в течение 25-30 минут не углубляется неврологический дефицит, баллон заполняется силиконом и навсегда оставляется в полости несущей артерии, выключая ее вместе с аневризмой. В последнее десятилетие на смену баллонам в большинстве клиник приходят отделяемые микроспирали. Наиболее прогрессивным продуктом новых технологий стали электролитически разделяемые платиновые микроспирали. К августу 2000 года во всем мире таким методом было прооперировано более 60000 пациентов. Вероятность проведения реконструктивной операции с применением спирали значительно выше, а вероятность интраоперационного разрыва аневризмы ниже, чем с применением баллона.
Оценивая оба метода, необходимо отметить, что до настоящего времени ведущее место занимает интракраниальный. И этим методом, как более надежным и управляемым, следует проводить большинство операций. Эндоваскулярным операциям должны подвергаться лишь те аневризмы, прямое выключение которых сопряжено со значительной травматизацией мозга.
Экстирпация, или удаление артериовенозной мальформации относится к наиболее сложным операциям в нейрохирургии. Она требует не только высокой оперативной техники хирурга и хорошего технического оснащения операционной (микроскоп, микроинструментарий), но и знания особенностей экстерпации. К АВМ нельзя относиться как к опухоли, ее нельзя удалять по частям, нужно точно отличать приводящие артериальные сосуды от дренирующих вен, уметь их последовательно выделить, коагулировать и пересечь. Кровотечение, возникающее в ходе операции из сосудов АВМ, неподготовленного хирурга может привести в замешательство, а любая паника при такой операции чревата серьезными последствиями, вплоть до летального исхода. Поэтому хирургу, идущему на такую сложную операцию, нужно знать о всех ее особенностях, возможных осложнениях и методах борьбы с ними.
Первое условие — нельзя идти на операцию, не имея полного представления о размерах мальформации, ее локализации и всех источниках кровоснабжения. Ошибка может привести к тому, что хирург во время операции неизбежно наталкивается на стенки АВМ и повреждает их. Недостаточное по размерам трепанационное окно резко затрудняет действия хирурга и позволяет атравматично провести операцию. Трепанационное окно должно быть в 1,5-2 раза больше максимального размера АВМ.
Твердая мозговая оболочка вскрывается дугообразным разрезом, окаймляющим со всех сторон АВМ и превышающим его размеры на 1,5-2 см. При конвекситальном расположении АВМ очень важно не повредить дренирующие вены, которые чаще контурируют и просвечиваются через истонченную оболочку. Отворачивание твердой мозговой оболочки — также важный и ответственный момент. С одной стороны, оболочка может быть припаяна к дренирующим венам и сосудам АВМ, а с другой — сосуды оболочки могут участвовать в кровоснабжении АВМ. Этап этот следует выполнить с использованием оптики и, если не удается легко отделить оболочку от сосудов АВМ, ее следует окаймляющим разрезом отсечь и оставить.
Важно правильно оценить границы мальформации и над предполагаемой границей по периметру коагулируется и рассекается арахноидальная и мягкая оболочки. Дренирующие вены сохраняются. Основные питающие артерии расположены в субарахноидальных цистернах или в глубине борозд, поэтому их можно выделить с минимальной травматичностью.
Определяя источники кровоснабжения, нужно выделить из них главные и второстепенные. Начинать выделение артериовенозной мальформации следует вблизи основных источников кровоснабжения, но при этом нельзя повреждать и выключать дренирующие вены. В АВМ существует определенный баланс между притекающей и оттекающей кровью, малейшее затруднение оттока крови неизбежно приводит к резкому увеличению объема АВМ, перерастяжению ее венозных сосудов и одновременному разрыву нескольких из них. Если повреждаются не поверхностные сосуды, а внутримозговые, то кровь устремляется в мозг и субарахноидальные пространства, вызывая резкое пролабирование мозга. Во избежание этого следует знать следующие правила:
- Выделяется АВМ и приводящие артерии на отдалении от основных дренирующих вен.
- Если приводящие артерии и дренирующие вены расположены близко, используя микротехнику, выделяется дренирующая вена и отгораживается ватными полосками.
- Если во время выделения повреждается стенка вены и возникает сильное кровотечение, нельзя клинировать или коагулировать ее. Нужно приложить к месту разрыва ватную полоску, смоченную перекисью водорода и прижать шпателем так, чтобы кровотечение уменьшилось, но кровоток по вене сохранился.
- Коагуляция или клипирование вены приведет к уменьшению оттока крови и к уже описанным осложнениям, поэтому лучше дольше подождать и добиться полного гемостаза без выключения вены. Даже если первое время кровь просачивается мимо ватника, не следует торопиться. Через 5-10 минут кровотечение, как правило, останавливается. Еще лучше гемостаз осуществлять гемостатической губкой типа “Спонгостан”.
- Перед коагуляцией приводящей артерии нужно убедиться в том, что это не вена, т.к. и по вене течет алая кровь. Но поскольку венозная стенка тоньше артериальной, то и по цвету она бывает более красного цвета, чем артерия. Иногда в микроскоп виден турбулентный поток крови по ней. Артерии имеют более тусклый розовый цвет. При коагуляции слабым током венозная стенка легко сокращается, а крупная артерия плохо поддается коагуляции. Но этого бывает недостаточно, чтобы точно идентифицировать артерию и вену. В случае сомнения можно на предполагаемую артерию положить съемный сосудистый клипс. Если вслед за этим не последовало никакой реакции, значит это артериальный сосуд. Если же буквально на глазах АВМ начинает увеличиваться в объеме и усиливается пульсация, значит была клипирована вена, и клипс следует немедленно снять.
- Выделять мальформацию нужно со всех сторон, но прежде всего со стороны источников кровоснабжения. При этом тонким отсосом резецируется мозговая ткань, предлежащая к телу мальформации, но так, чтобы не травмировать ее сосуды. Все второстепенные артерии и вены, встречающиеся на пути, последовательно коагулируются и пересекаются. Таких сосудов может быть несколько десятков. При возникновении кровотечения не из тела мальформации, а из приводящих или отводящих сосудов до 1,5-2 мм в диаметре, их следует коагулировать биполярным пинцетом.
- По мере выключения основных питающих артерий объем мальформации может уменьшаться и цвет ее становится более темным. Однако не следует успокаиваться до полного удаления АВМ, т.к. еще не выключены второстепенные артерии, которые могут вызвать серьезное кровотечение при повреждении стенки мальформации.
- Удаляя АВМ, хирург может оставить незамеченным ее участки в мозговом веществе. Особенно это опасно, если артериальный приток к ним сохранен, а отток нарушен. В этих случаях сразу после удаления артериовенозной мальформации может начаться “вспучивание” мозга и кровотечение из стенок мозговой раны. Источников кровотечения может быть несколько. Кровоточащие участки нужно прикрыть ватными полосками, слегка прижать шпателем и быстро начинать последовательно, вокруг каждого источника кровотечения, резецировать отсосом мозговое вещество и, найдя приводящий артери-альный сосуд, коагулировать или клипировать его.
- Перед закрытием раны необходимо убедиться в надежности гемостаза, для чего анестезиолог искусственно создает умеренную артериальную гипертензию. Нельзя зашивать оболочку на фоне низкого артериального давления. Ряд авторов пытаются объяснить острое вспучивание мозга после удаления АВМ его острой гиперемией, вследствие устранения источника “обрадывания”. Особенно это опасно в тех случаях, когда основные приводящие артерии имеют длину более 8 см. Однако Яшаргил убежден, что острое “вспучивание” является лишь следствием нерадикальной экстирпации АВМ.
- Если, несмотря на все предосторожности, вы все же преждевременно выключили дренирующую вену и АВМ увеличилась в объеме, следует срочно снизить артериальное давление до 70-80 мм рт.ст. Это может предотвратить множественные разрывы ее сосудов и позволить вам найти питающие артерии и последовательно их выключить.
- Если все же множественные разрывы сосудов АВМ произошли, не спешите их коагулировать, это только усилит кровотечение. Прижмите их ватными полосками, смоченными перекисью водорода, и по возможности быстрее ищите питающие артерии и выключайте их. Только такая тактика позволит сохранить жизнь больного.
- Если хирург переоценил свои способности и в ходе операции осознал, что не сможет произвести радикальную экстирпацию, он может остановить операцию если:
- а) не нарушен отток от АВМ;
- б) уменьшен артериальный приток к ней;
- в) гемостаз идеальный даже на фоне искусственной артериальной гипертензии.
- Нельзя умышленно идти на частичное удаление артериовенозной мальформации.
- Идя на операцию, нужно всегда думать о возможной гемотрансфузии. Чем больше размер АВМ, тем большее количество крови потребуется в ходе операции.
- Кровопотеря до 1 литра может компенсироваться плазмозаменяющими растворами, однако большая кровопотеря нуждается в проведении гемотрансфузии. Мы рекомендуем до операции 1-2 раза производить забор крови по 200 мл у самого больного, и в ходе операции проводить реинфузию. Это позволяет в большинстве случаев обойтись без донорской крови.
- О радикальности экстирпации АВМ свидетельствует изменение окраски всех дренирующих вен: они становятся темно-вишневого цвета. Сохранение хоть одной ярко-красной вены говорит о нерадикальности операции.
Наряду с радикальной экстирпацией артериовенозной мальформации в последние годы внедряется эндоваскулярный метод окклюзии АВМ. С этой целью применяют введение в сосуды мальформации разнообразных тромбирующих веществ. Раньше это были композиции на основе клеевых соединений — цианокрилатов. Сейчас наиболее перспективным считается эмболин, представляющий собой 10% раствор низкомолекулярного линейного полиуретана в безводном диметилсульфоксиде. Эмболин во время контакта с кровью вызывает быстрое развитие тромба фибрилярно-эластической консистенции. В большинстве случаев АВМ удается выключить субтотально (90-95%), этого достаточно для предотвращения ее повторного разрыва. Эндоваскулярная окклюзия наиболее показана больным с АВМ подкорковых ганглиев и моста, а также при гигантских АВМ любой локализации. В ряде случаев эндоваскулярная эмболизация АВМ производится как первый этап перед ее радикальной экстирпацией. Этим достигается уменьшение кровопотери в ходе открытой операции.
Мальформации малого и среднего объема можно также коагулировать направленным протоновым пучком, однако применение этого метода возможное лишь в клиниках, которые оборудованные линейным ускорителем. В связи с этим метод пока не находит широкого применения.

источник
Артериовенозные мальформации головного мозга — врожденные аномалии церебральных сосудов, характеризующиеся образованием локального сосудистого конгломерата, в котором отсутствуют капиллярные сосуды, а артерии напрямую переходят в вены. Артериовенозные мальформации головного мозга проявляются упорными головными болями, эпилептическим синдромом, интракраниальным кровотечением при разрыве сосудов мальформации. Диагностика осуществляется при помощи КТ и МРТ сосудов головного мозга. Лечение хирургическое: транскраниальное иссечение, радиохирургическое вмешательство, эндоваскулярная эмболизация или комбинация этих методик.
Артериовенозные мальформации головного мозга (церебральные АВМ) — измененные участки церебральной сосудистой сети, на которых вместо капилляров имеются многочисленные разветвления извитых артерий и вен, формирующих единый сосудистый конгломерат, или клубок. АВМ относятся к сосудистым аномалиям развития головного мозга. Встречаются у 2 человек из 100 тыс. населения. В большинстве случаев клинически дебютируют в период от 20 до 40 лет, в отдельных случаях — у лиц старше 50 лет. Артерии, формирующие АВМ, имеют истонченные стенки с недоразвитым мышечным слоем. Это обуславливает главную опасность сосудистых мальформаций — возможность их разрыва.
При наличии АВМ головного мозга риск ее разрыва оценивается примерно 2-4% в год. Если кровоизлияние уже имело место, то вероятность его повтора составляет 6-18%. Смертность при внутричерепном кровоизлиянии из АВМ наблюдается в 10% случаев, а стойкая инвалидизация отмечается у половины пациентов. Из-за истончения артериальной стенки на участке АВМ может сформироваться выпячивание сосуда — аневризма. Летальность при разрыве аневризмы сосудов головного мозга намного выше, чем при АВМ, и составляет около 50%. Поскольку АВМ опасны внутричерепным кровоизлиянием в молодом возрасте с последующей летальностью или инвалидизацией, их своевременная диагностика и лечение являются актуальными проблемами современной нейрохирургии и неврологии.
Артериовенозные мальформации головного мозга возникают в результате внутриутробных локальных нарушений формирования церебральной сосудистой сети. Причинами таких нарушений являются различные вредоносные факторы, влияющие на плод в течение антенатального периода: повышенный радиоактивный фон, внутриутробные инфекции, заболевания беременной (сахарный диабет, хронический гломерулонефрит, бронхиальная астма и др.), интоксикации, вредные привычки беременной (наркомания, курение, алкоголизм), прием во время беременности фармпрепаратов, имеющих тератогенный эффект.
Церебральные артериовенозные мальформации могут располагаться в любом месте головного мозга: как на его поверхности, так и в глубине. В месте локализации АВМ отсутствует капиллярная сеть, циркулирование крови происходит из артерий в вены напрямую, что обуславливает повышенное давление и расширение вен. При этом сброс крови в обход капиллярной сети может повлечь за собой ухудшение кровоснабжения церебральных тканей в месте расположения АВМ, приводя к хронической локальной ишемии мозга.
По своему типу мальформации церебральных сосудов классифицируются на артериовенозные, артериальные и венозные. Артериовенозные мальформации состоят из приводящей артерии, дренирующей вены и расположенного между ними конгломерата измененных сосудов. Выделяют фистулезную АВМ, рацинозную АВМ и микромальформацию. Около 75% случаев занимают рацинозные АВМ. Изолированные артериальные или венозные мальформации, при которых наблюдается извитость соответственно только артерии или только вены, встречаются достаточно редко.
По размеру церебральные АВМ подразделяются на малые (диаметром менее 3 см), средние (от 3 до 6 см) и большие (свыше 6 см). По характеру дренирования АВМ классифицируют на имеющие и не имеющие глубокие дренирующие вены, т. е. вены, впадающие в прямой синус или систему большой церебральной вены. Различают также АВМ, локализующиеся в или за пределами функционально значимых областей. К последним относят сенсомоторную кору, мозговой ствол, таламус, глубинные зоны височной доли, сенсорную речевую область (зону Ве́рнике), центр Брока, затылочные доли.
В нейрохирургической практике для определения риска оперативного вмешательства по поводу церебральных сосудистых мальформаций используется градация АВМ в зависимости от совокупности баллов. Каждому из признаков (размер, тип дренирования и локализация по отношению к функциональным зонам) присуждается определенное количество баллов от 0 до 3. В зависимости от набранных балов АВМ классифицируется от имеющей незначительный операционный риск (1 балл) до связанной с высоким операционным риском из-за технической сложности ее ликвидации, большого риска смертельного исхода и инвалидности (5 баллов).
В клинике церебральных АВМ выделяют геморрагический и торпидный варианты течения. По различным сведениям, геморрагический вариант составляет от 50% до 70% случаев АВМ. Он типичен для АВМ небольшого размера, имеющих дренирующие вены, а также для АВМ, располагающихся в задней черепной ямки. Как правило, в таких случаях у пациентов наблюдается артериальная гипертензия. В зависимости от локализации АВМ возможно субарахноидальное кровоизлияние, которое занимает около 52% от всех случаев разрыва АВМ. Остальные 48% приходится на осложненные кровоизлияния: паренхиматозные с формированием внутримозговой гематомы, оболочечные с образованием субдуральной гематомы и смешанные. В ряде случаев осложненные кровоизлияния сопровождаются кровоизлиянием в желудочки головного мозга.
Клиника разрыва АВМ зависит от ее локализации и скорости истечения крови. В большинстве случаев наблюдается резкое ухудшение состояния, нарастающая головная боль, расстройство сознания (от спутанности до комы). Паренхиматозные и смешанные кровоизлияния наряду с этим проявляются очаговой неврологической симптоматикой: нарушениями слуха, зрительными расстройствами, парезами и параличами, выпадением чувствительности, моторной афазией или дизартрией.
Торпидный вариант течения более типичен для церебральных АВМ среднего и большого размера, располагающихся в мозговой коре. Для него характерны кластерные цефалгии — следующие друг за другом пароксизмы головной боли, длящиеся не дольше 3 часов. Цефалгия не носит такого интенсивного характера как при разрыве АВМ, но является регулярной. На фоне цефалгий у ряда пациентов возникают судорожные приступы, которые зачастую имеют генерализованный характер. В других случаях торпидная церебральная АВМ может имитировать симптомы внутримозговой опухоли или другого объемного образования. В таком случае наблюдается появление и постепенное нарастание очагового неврологического дефицита.
В детском возрасте встречается отдельный вид церебральной сосудистой мальформации — АВМ вены Галена. Патология является врожденной и заключается в наличии АВМ в области большой вены мозга. АВМ вены Галена занимают около трети всех случаев сосудистых церебральных мальформаций, встречающихся в педиатрии. Характеризуются высокой летальностью (до 90%). Наиболее эффективным считается хирургическое лечение, проведенное на первом году жизни.
Поводом для обращения к неврологу до разрыва АВМ могут быть упорные головные боли, впервые возникший эпиприступ, появление очаговой симптоматики. Пациенту проводится плановое обследование, включающее ЭЭГ, Эхо-ЭГ и РЭГ. При разрыве АВМ диагностика осуществляется в экстренном порядке. Наиболее информативны в диагностике сосудистых мальформаций томографические методы. Компьютерная томография и магнитно-резонансная томография могут быть использованы как для визуализации тканей мозга, так и для исследования сосудов. В случае разрыва АВМ МРТ головного мозга более информативно, чем КТ. Она дает возможность выявить локализацию и размер кровоизлияния, отдифференцировать его от других объемных интракраниальных образований (хронической гематомы, опухоли, абсцесса головного мозга, церебральной кисты).
При торпидном течении АВМ МРТ и КТ головного мозга могут оставаться в норме. Обнаружить сосудистую мальформацию в таких случаях позволяет лишь церебральная ангиография и ее современные аналоги — КТ сосудов и МР-ангиография. Исследования церебральных сосудов проводятся с использованием контрастных веществ. Диагностика осуществляется нейрохирургом, который также оценивает операционный риск и целесообразность хирургического лечения АВМ. При этом следует учитывать, что при разрыве, в связи с компрессией сосудов в условиях гематомы и отека мозга, томографический размер АВМ может быть существенно меньше реального.
Артериовенозные мальформации головного мозга при их разрыве или при опасности такого осложнения подлежат удалению. Предпочтительно плановое оперативное лечение АВМ. В случае разрыва оно проводится после ликвидации острого периода кровоизлияния и рассасывания гематомы. В остром периоде по показаниям возможно хирургическое удаление образовавшейся гематомы. Одновременная ликвидация и гематомы, и АВМ проводится лишь при лобарной локализации сосудистой мальформации и ее небольшом диаметре. При кровоизлиянии в желудочки в первую очередь показано наружное вентрикулярное дренирование.
Классическое хирургическое удаление АВМ осуществляется путем трепанации черепа. Производится коагуляция приводящих сосудов, выделение АВМ, перевязка отходящих от мальформации сосудов и иссечение АВМ. Такое радикальное транскраниальное удаление АВМ осуществимо при ее объеме не более 100 мл и расположении вне функционально значимых зон. При большом размере АВМ зачастую прибегают к комбинированному лечению.
Когда транскраниальное удаление АВМ затруднительно из-за ее расположения в функционально значимых областях мозга и глубинных структурах, проводится радиохирургическое удаление АВМ. Однако этот метод эффективен лишь для мальформаций размером не более 3 см. Если размер АВМ не превышает 1 см, то ее полная облитерация происходит в 90% случаев, а при размерах свыше 3 см — в 30%. К недостатком метода относится длительный период (от 1 до 3 лет), необходимый для полной облитерации АВМ. В ряде случаев требуется поэтапное облучение мальформации в течение ряда лет.
К способам ликвидации церебральных АВМ относится также рентгеноэндоваскулярная эмболизация приводящих к АВМ артерий. Ее проведение возможно, когда имеются доступные для катетеризации приводящие сосуды. Эмболизация проводится поэтапно, и ее объем зависит от сосудистого строения АВМ. Полной эмболизации удается достигнуть только у 30% пациентов. Субтотальная эмболизация получается еще у 30%. В остальных случаях эмболизация удается лишь частично.
Комбинированное этапное лечение АВМ заключается в стадийном использовании нескольких перечисленных выше методов. Например, при неполной эмболизации АВМ следующим этапом проводится транскраниальное иссечение ее оставшейся части. В случаях, когда не удается полное удаление АВМ, дополнительно применяется радиохирургическое лечение. Такой мультимодальный подход к лечению церебральных сосудистых мальформаций показал себя как наиболее эффективный и оправданный в отношении АВМ большого размера.
источник
I. Хирургическое лечение артерио-венозной мальформации (АВМ) головного мозга. Хотя существуют различные виды современной терапии при церебральных артерио-венозных мальформаций (АВМ), хирургическое лечение является наиболее известным вариантом и относится к первому выбору при наличии такой возможности. С развитием микрохирургических методов показатели эффективности полного удаления заметно улучшились.
Принятие решений при церебральных артерио-венозных мальформаций (АВМ) является одним из наиболее сложных аспектов нейрохирургической практики. Решение, следует ли рекомендовать операцию, должно быть основано на объективном сравнении долгосрочных рисков неоперированной артерио-венозной мальформации (АВМ) с риском оперативного лечения.
У молодых пациентов, особенно при наличии неврологических симптомов, попытки хирургического удаления связаны с хирургическим риском, хотя и высоким, но по-прежнему меньшим, чем при естественном течении. У пациентов средних лет и пожилых пациентов с минимальной симптоматикой консервативный подход кажется более разумным, так как риск лечения может быть не меньше, чем при естественном течении.
Наиболее популярная система для оценки риска операции — пятибалльная шкала, разработанная Spetzler и Martin. Она включает в себя три переменные:
• Размер артерио-венозной мальформации (АВМ)
• Характер венозного оттока
• Локализацию артерио-венозной мальформации (АВМ) (функционально значимая зона или нет).
Тип I — малые размеры, поверхностные и расположенные в функционально незначимой зоне мозга, в то время как тип поражения V — это большие, глубокие АВМ в функционально значимой зоне мозга. Размер и структуру венозного оттока из АВМ как хирургические факторы риска оценить довольно несложно, но гораздо сложнее определиться в отношении функционально значимых зон мозга. Повреждение извилин и перемещение функций в связи с реорганизацией коры у пациентов с АВМ может затруднять выявление функционально значимых зон.
Перед операцией полезно проведение функциональной МРТ или ПЭТ для определения функциональных областей мозга и для получения информации о местонахождении зон речи, сенсорной и зрительной коры. Во время операции, выявлению и сохранению важных областей мозговой ткани могут способствовать электрофизиологический мониторинг, системы картирования и корковой нейронавигации.
При хирургическом вмешательстве в принципе допустимы мелкие и средние повреждения конвекситальной поверхности мозга вне критических областей. По сравнению с радиохирургией или наблюдением только хирургическое иссечение является рентабельным и очень эффективным способом улучшения качества и продлении жизни.
По нашему опыту, примерно треть пациентов с АВМ может быть направлена только на хирургическое лечение, а в остальных случаях необходимы эмболизация и/или радиохирургия до, после или вместо хирургического вмешательства.
Лечение при больших АВМ, расположенных в критически важных областях с подкорковыми клинообразными расширениями, достигающими стенок бокового желудочка, представляет собой сложную задачу. Глубокая их часть обычно снабжается из хориоидальных артерий или мелких сосудов, обычно питающих базальные ганглии, внутреннюю капсулу и таламус. Кровотечение из этих сосудов во время операции может привести к гематоцефалии.
Кроме того, трудности контроля глубоких сосудов, таких как лентикулостриарные артерии, при использовании транскортикального или трансвентрикулярного подхода увеличивают риск хирургических осложнений. В этих случаях полезно проведение эндоваскулярной эмболизации до операции.
При больших высокопотоковых артерио-венозных мальформаций (АВМ) обычно требуется предоперационная эмболизация, а некоторые авторы рекомендуют несколько этапов резекции. Поэтапное лечение при больших АВМ может свести к минимуму риски синдрома гиперперфузии и кровоизлияния в мозг после хирургического лечения.
II. Эндоваскулярное лечение артерио-венозной мальформации (АВМ). Альтернативой хирургической резекции артерио-венозной мальформации (АВМ) является эндоваскулярная эмболизация. Принцип эмболизации заключается в окклюзии тела АВМ либо частицами, либо жидким веществом, которое быстро затвердевает при попадании в кровеносный сосуд. Так как частицы не приводят к достаточно надежной окклюзии, в настоящее время используют эмболизаты на основе NBCA (N-бутил-цианакрилат) и ONYX®. Оба агента в настоящее время достаточно изучены для оценки результатов после долгосрочного наблюдения.
Эмболизация обычно проводится под общим наркозом. После пункции бедренной артерии, катетер проводится в сонную артерию по методике Сельдингера. С помощью микрокатетера выполняется суперселективная катетеризация питающих сосудов АВМ, что позволяет получить точное изображение тела АВМ и выявить возможные факторы риска, такие как интранидальные аневризмы. Так как большинство артериальных афферентов не только питают очаг, но и снабжают нормальные ткани мозга (так называемые «транзитные» артерии), устанавливают кончик микрокатетера в положении, из которого снабжается только тело АВМ. В этом положении эмболизационный агент высвобождается и продвигается в тело.
Как правило, для достижения благоприятного результата необходимо проведение нескольких этапов эмболизации.
Хотя метод эндоваскулярной эмболизации достаточно изящен и привлекателен для пациента отказом от краниотомии, к его недостаткам относится возможность излечения лишь в 15% случаев, а неоднократная эмболизация ведет к кумуляции осложнений. Поэтому, эмболизация обычно применяется в составе комбинированной терапии вместе с хирургией или радиохирургией при АВМ степени 3 или выше по Spetzler. Эмболизация служит, например для того, чтобы уменьшить размеры патологического очага и, следовательно, улучшить результаты радиохирургического лечения, или эмболизировать глубокие сосуды, которые трудно контролировать при хирургической резекции АВМ.
В качестве заключения следует сказать, что, эндоваскулярная эмболизация является устоявшимся методом в лечении АВМ. Возможные риски следует соотнести с потенциальным эффектом в каждом конкретном случае. Таким образом, она заняла свое место, в основном, в комбинированном лечении.
III. Стереотаксическая радиохирургия в лечении артерио-венозной мальформации (АВМ):
а) Определение. Однофракционное высокофокусированное стереотаксически направленное излучение малого объема, применяемое для облучения внутричерепных объектов.
б) Синонимы. Радиохирургия, SRS, STRS, хирургия гамма-ножом.
в) История развития:
— 1951 г.: понятие введено Lars Leksell (1907-1986)
— Первое лечение было проведено в 1950 г. с применением рентгеновской трубки и стереотаксической дуги
— 1954 г.: в лаборатории Lawrence и Berkeley разработан перекрестный пучок протонов
— 1968 г.: проведено лечение гамма-ножом
— 1985 г.: Colombo разработал модифицированный линейный ускоритель
— 2000 г.: для гамма-ножа была разработана автоматическая система позиционирования (APS).
г) Принципы радиохирургии. Лечение обычно проводится под местной анестезией, у всех пациентов, кроме детей и лиц, страдающих клаустрофобией. Принцип действий:
• Формирование контуров патологического очага
• Планирование дозы
• Доставка дозы.
1. Формирование контуров патологического очага. Прежде всего, вокруг головы с помощью стереотаксической рамы устанавливается набор стандартных ориентиров или «нормирующих систем».
Контуры патологического очага формируются при помощи цифровой субтракционной ангиографии (DSA), дополненной МРТ и/или КТ в аксиальной проекции. В редких случаях, аксиальных изображений может быть достаточно. Затем вычерчивают контур мишени.
2. Планирование дозы. Цель заключается в максимально точном соответствии дозы лучистой энергии контурам очага поражения. Включение смежных нормальных тканей может привести к побочным эффектам и осложнениям, в то время как эффективность облучения патологического очага снижается. Помимо соответствия форме, внимание уделяется тому, чтобы избежать прохождения пучков излучения через важные структуры, прилегающие к очагу поражения или даже на расстоянии (например, хрусталик глаза). Это достигается путем подключения нескольких источников излучения в гамма-нож или выбором лечения при помощи линейного ускорителя.
3. Доставка дозы. Существуют две основные технологии для доставки дозы: гамма-нож и линейный ускоритель. С точки зрения количества пациентов и публикаций, гамма-нож доминирует над ускорителем и, следовательно, считается «золотым стандартом».
— Гамма-нож. Концентрический массив из 201 источника кобальт-60 обеспечивает выход гамма-лучей, сфокусированных на цели. Комбинация стационарных источников и коллиматоров позволяет достичь точности в 0,1 мм.
— Линейный ускоритель. Существует несколько методов лечения с помощью линейного ускорителя (LINAC — «linear accelerator»). Может быть использована модифицированная LINAC лучевая терапия с вторичной системой коллиматоров или выделенная LINAC лучевая терапия. Наиболее часто применяется многоуровневая однофокусная некомпланарная дуга и методы конформного блока. При первой технике источник излучения перемещается вдоль нескольких дуг, а вторая основана на высоковольтном трансформаторе, создающим высокое переменное напряжение, после чего пучок проходит в нужной фазе вблизи максимума электрического поля.
Коллиматор состоит из ряда индивидуально моторизованных листов вольфрама, которые устанавливаются автоматически и создают любую форму пучка. При технике модуляции интенсивности доза радиации различной интенсивности доставляется по периметру всего очага поражения. Коллиматор динамически открывается и закрывается под управлением компьютера для выбора экспозиции или частей мишени. Эта технология пока находится на раннем этапе развития, в стадии клинической оценки.
4. Лечение артерио-венозной мальформации (АВМ). Целью является тело АВМ. Тело определяется как сеть слабо дифференцированных и незрелых сосудов, в которой сходятся питающие артерии и выходят переполненные вены.
Механизмы действия:
— Преобладающий фактор: пролиферация эндотелиальных клеток и гиалинизация стенок сосудов.
— Вторичный фактор: развитие миофибробластов адвентициальной оболочки.
5. Критерии отбора пациентов. Лечение артерио-венозной мальформации (АВМ) является мультидисциплинарным. Критерии отбора представлены в таблице ниже.
6. Подходящие артерио-венозные мальформации (АВМ). Большинство артерио-венозных мальформаций (АВМ) поддается терапии. В идеальном случае АВМ небольших размеров ( 4 см.
7. Результаты. Результат зависит от размера очага и дозы. При небольших ( 3,5 см, периферическая доза > 25 Гр.
9. Варианты лечения при крупных артерио-венозных мальформациях (АВМ):
• Выжидательная тактика
• Стереотаксическая радиохирургия:
— Малая доза менее эффективна
— Стадирование (радиохирургия проводится с интервалом в несколько месяцев между процедурами)
• Уменьшение объема:
— Хирургия
— Эмболизация
III. Консервативное лечение артерио-венозной мальформации (АВМ) без операции. Сведения о долгосрочных спонтанных исходах у пациентов с АВМ в значительной степени основаны на данных Ondra et al. Частота массивных повторных кровоизлияний составила 4,0%, а смертность 1,0% в год, 23% пациентов погибли из-за кровоизлияния из АВМ. Совокупная частота тяжелых осложнений и смертность составили 2,7% в год. Эти ежегодные показатели практически не менялись в течение всего периода исследования. Риск лечения АВМ IV-V степени по Spetzler сопоставим с рисками естественного течения в течение 10 лет.
Таким образом, только в случае эпилепсии или головной боли консервативное лечение может быть оправдано с рекомендацией пересмотра в случае кровоизлияния.
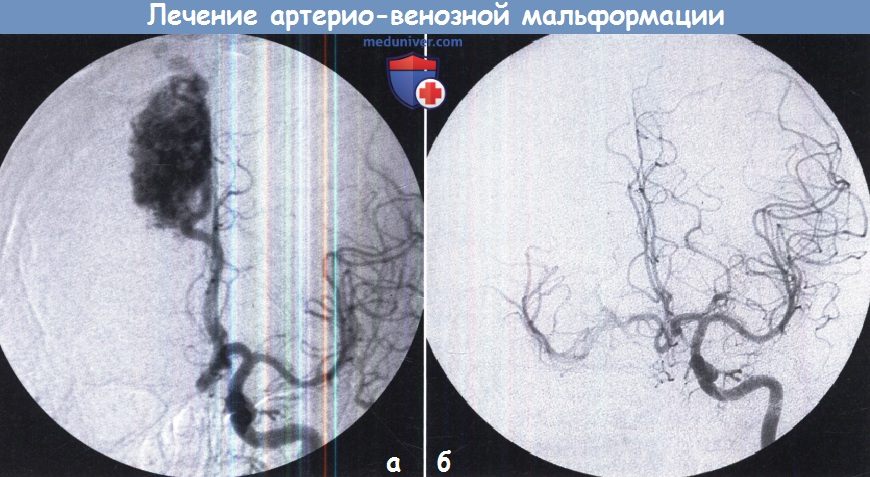
б — Спустя два года контрольная ангиография показывает полную облитерацию после радиохирургии. 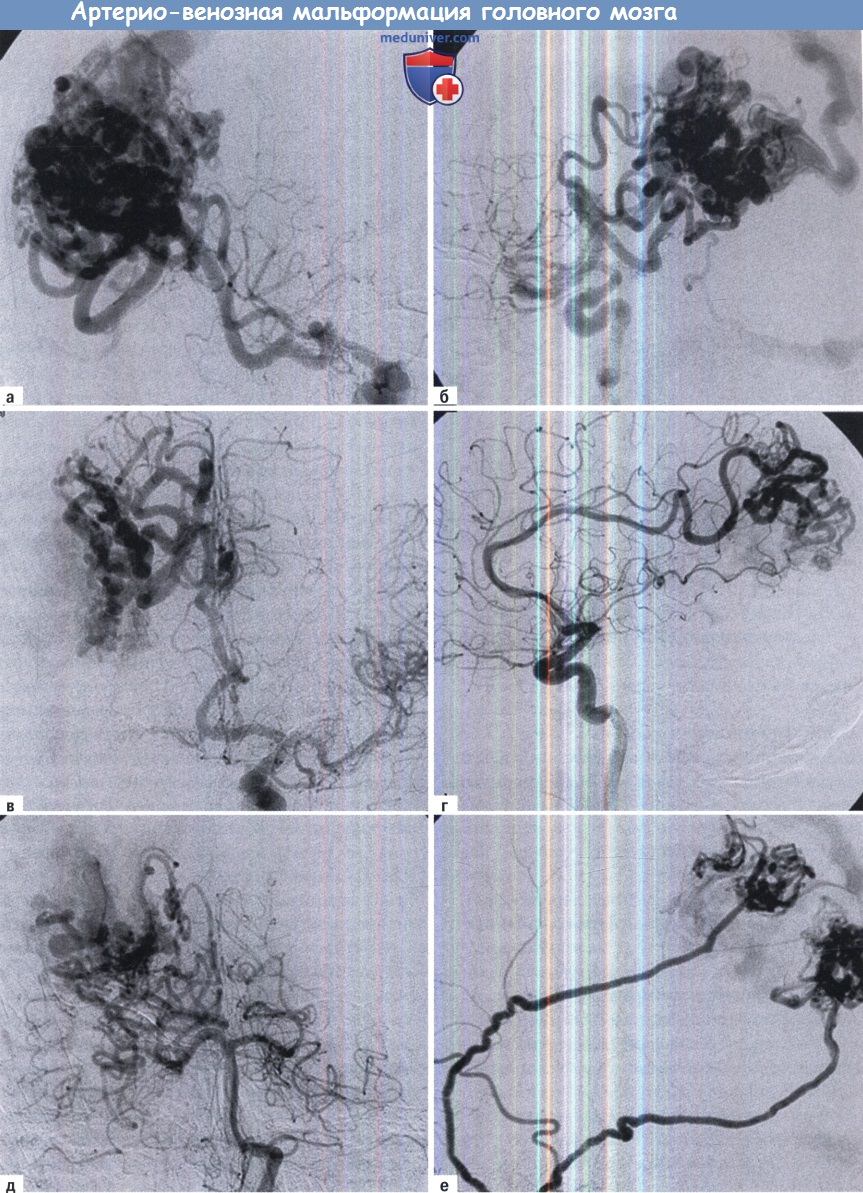
Данный пациент 63 лет поступил с кровоизлиянием. Венозный дренаж осуществляется через верхний сагиттальный синус.
Лечение состояло из совмещения эмболизации и микрохирургии.
источник