Операция резекции аневризмы брюшной аорты проводится для предупреждения ее осложнений, особенно разрыва с внутренним кровотечением. Операция при аневризме является достаточно травматичным вмешательством высокого риска, поэтому в настоящее время должна применяться только в случае невозможности выполнить эндоваскулярное протезирование. Смысл операции при аневризме заключается в выделении аневризматического мешка через разрез на животе или в поясничной области. Аневризма выделяется до нормальной аорты (шейки). После этого аневризматический мешок вскрывается, к нормальной аорте пришивается искусственный протез, который выводится на бедренные артерии. Тем самым ликвидируется кровоток по аневризме и устраняются риски ее разрыва. Операция может сопровождаться значительной кровопотерей и другими осложнениями. Риск неблагоприятного исхода выше у больных пожилого возраста с сопутствующими заболеваниями и составляет около 8%.
Сосудистые хирурги нашей клиники имеют значительный опыт открытых операций при аневризмах брюшной аорты. Ими выполнено более 150 операций при этой патологии с успехом у 95% пациентов. Подход нашей клиники состоит во всемерной подготовке пациента с аневризмой, для исключения патологии сердца и сонных артерий, которые могут влиять на исход операции. Для профилактики почечных осложнений мы используем продленную гемофильтрацию в послеоперационном периоде. С целью уменьшения кровопотери используется гемодилюция (разведение крови) и аппаратура для возврата крови. С целью предупреждения осложений в послеоперационном периоде мы практикуем раннее поднятие больных с постели, активную реабилитацию. В последние годы мы постепенно отходим от открытых операций при аневризмах в пользу менее травматичных эндоваскулярных операций эндопротезирования.
- Открытая операция на аорте используется для лечения пациентов с аневризмами аорты размерами более 5,5 см в диаметре.
- При разрывах аневризмы любого размера.
- При расслоении аорты в рамках острого аортального синдрома.
Открытая операция используется при аневризмах аорты ниже почечных артерий, надпочечных и почечных сегментов. До появления эндопротезирования (EVAR) данная методика была единственным методом хирургического пособия при аневризмах. Сейчас эндоваскулярные технологии постепенно оттесняют ее.
- Низкая ожидаемая продолжительность жизни по другим заболеваниям (онкология, тяжелая сердечная недостаточность, старческий возраст)
- Выраженная патология коронарных или сонных артерий. Операция возможна только после устранения нарушения кровообращения в этих бассейнах
- Выраженное ожирение, затрудняющее доступ к аорте.
Перед большой аортальной операцией пациент должен быть детально обследован, чтобы уменьшить риски осложений в других сосудистых бассейнах. В нашей клинике метод лечения аневризмы аорты определяется консилиумом врачей с учетом рисков предстоящего вмешательства.
В обязательном порядке выполняется электрокардиография, УЗИ сердца. Для исключения послеоперационного кровотечения из желудка обязательно выполняется эзофагогастроскопия (ЭГДС). Выполняется комплекс обследования сосудов сердца, сонных артерий и артерий конечностей.
Накануне операции выполняется подготовка кишечника. Пациент не ужинает и принимает специальные слабительные (фортранс). Этим достигается полное очищение кишечника и риск развития послеоперационного кишечного застоя. На ночь может быть назначена очищающая клизма.
Утром перед операцией тщательно выбривается живот, область лобка и бедер. Устанавливается катетер в мочевой пузырь, выполняется катетеризация подключичной вены. Пациенту проводится введение успокаивающих препаратов и он подается в операционную.
Операция может проводиться под общим наркозом, либо под перидуральной анестезией (укол в спину). Общий наркоз требуется при больших аневризмах, распространяющих до уровня почечных артерий, либо выше. Общий наркоз необходим при доступе методом широкой серединной лапаротомии. При забрюшинном доступе к аорте можно ограничиться эпидуральной анестезией. При операциях по поводу аневризмы обязательно проводится мониторинг сердечной деятельности и артериального давления с помощью специальной техники. Для проведения анестезии и интенсивной терапии обязательно устанавливается катетер в центральную вену (чаще всего подключичный). Функция почек оценивается по количеству мочи, для этого устанавливается катетер в мочевой пузырь. Во время анестезии контролируется уровень центрального венозного давления и вводятся препараты, регулирующие объем циркулирующей крови, электролитов. При необходимости проводится переливание крови и плазмы, для восполнения потерянных во время операции. Специальные дозаторы вводят препараты, регулирующие уровень артериального давления. При длительной операции может быть подключен аппарат для гемофильтрации, чтобы устранить возможную интоксикацию.
В целом анестезия при операциях на аорте имеет очень важное значение и от ее течения зависит удобство работы хирургов и непосредственные результаты хирургического вмешательства.
Во время предоперационного обследования принимается решение о хирургическом доступе. Чаще всего выполняется три доступа. Два из них в паховой области на бедре, для выделения общих бедренных артерий, один доступ — срединная лапартотомия (разрез по середине живота) или доступ на левом боку. При высоких аневризмах верхний доступ может быть продлен на грудную клетку. Это вмешательство — торакофренолюмботомия.

Открытая операция при аневризме заключается в замене расширенного участка аорты синтетическим сосудистым протезом. Последний вшивается в верхний участок аорты (выше аневризмы), затем ветви протеза проводятся на бедренные артерии и пришиваются к ним. После этого протез укрывается стенками аневризматического мешка. Основной проблемой является выделение аневризматического мешка и ветвей исходящих из него. Делать это надо достаточно быстро, если эти ветви проходимы, так как длительное пережатие может вызвать нарушение питания кишечника или спинного мозга.

После завершения сосудистого этапа операции в забрюшинное пространство и в область доступов на бедрах устанавливаются трубчатые дренажи, а раны послойно ушиваются.
Средняя продолжительность операции по поводу аневризмы аорты составляет 3 часа. Средний объем кровопотери около одного литра. Кровопотеря восполняется донорской кровью, плазмой и солевыми растворами.
Открытые операции по поводу аневризмы аорты имеют больший риск ранних послеоперационных осложнений и смертности, чем эндоваскулярная установка стент-графта в аорту. Летальность после открытых операций составляет около 5%, в то время как после эндопротезирования 0,5%.
- Острая почечная недостаточность
- Инсульт спинного мозга с параличом ног
- Высокая перемежающаяся хромота (боль в ягодицах при ходьбе) хромота
- Ишемия толстой кишки
- Эмболия нижних конечностей с острой ишемией
- Кровотечение из места операции и геморрагический шок
- Нагноение сосудитого протеза
Эти осложнения встречаются достаточно редко. В нашей клинике наблюдались единичные случаи подобных осложнений.
Ближайший послеоперационный период занимает обычно 10-14 дней и зависит от непосредственных результатов операции. В течение 1-3 дней пациенты нуждаются в интенсивной терапии, возможно проведение продленной искусственной вентиляции легких. Поднимать пациентов мы обычно начинаем на 3 сутки после вмешательства. Ходить разрешаем к 5 суткам. Если послеоперационный период протекает гладко, то пациент на 10 сутки выписывается домой.
После выписки необходимо ношение специального бандажа на животе в течение месяца. Через месяц выполняется контрольное ультразвуковое сканирование, для оценки проходимости искусственного протеза и состояния кровотока в ногах.
К обычной повседневной деятельности пациент после открытой операции на аорте возвращается через 3-6 месяцев. Проходимость сосудистых протезов сохраняется на уровне 93% в течение пятилетнего периода после операции. УЗИ контроль позволяет выявлять возможное развитие проблем и своевременно принять меры по их устранению.
Преимуществом открытой операции при аневризме перед эндоваскулярной является отсутствие необходимости в постоянном контроле за функцией сосудистого протеза. Если в ближайшие 3 месяца не развивается никаких осложнений, то можно рассчитывать на долгий срок работы сосудистого протеза. Периодический контроль с помощью УЗИ необходим только один раз в год.
источник
Операция при аневризме аорты направлена на удаление измененного участка и восстановление целостности сосуда посредством протезирования. Такое лечение проводится в плановом порядке или экстренно, под общим наркозом.
Аневризма аорты представляет собой локальное расширение просвета сосуда с изменениями его стенок и высоким риском разрыва. Опасность патологии состоит в том, что долгое время она может не давать никаких симптомов, а ее носитель не подозревает о наличии в организме смертельно опасного изменения.
Аневризматические расширения в сосудах чаще обнаруживают у пожилых людей, особенно – при наличии атеросклероза, артериальной гипертензии, сахарного диабета. Эта патология предрасполагает не только к структурным изменениям стенок аорты, их истончению и выпячиванию, но и нарушению целостности уже имеющейся аневризмы.
аневризма аорты при атеросклерозе (а – грудного, б – брюшного отдела)
Бессимптомная аневризма не влияет на кровоток, но тяжелые осложнения делают ее чрезвычайно опасной. Вне разрыва есть риск тромбоэмболий по причине тромбообразования в стенке и полости аневризмы, а разрыв вызывает массивное кровотечение и шок, когда больной умирает в очень короткий промежуток времени.
Учитывая тяжесть последствий аневризмы, все случаи, когда диагностирована данная патология, подлежат тщательному контролю. Пациента следует обследовать, определить степень риска осложнений и назначить срок проведения операции. При разрыве вмешательство проводится в экстренном порядке.
Единственным показанием к проведению аневризмы можно считать уже ее наличие, даже если патология протекает бессимптомно. Сроки лечения и способ зависят от расположения, размеров выпячивания, риска разрыва, возраста и общего состояния больного.

- Состоявшийся разрыв с кровотечением (экстренная операция);
- Стремительное увеличение размеров образования – более 4 мм в год;
- Диаметр аневризмы более 5 см;
- Высокий риск осложнений (тромбоз, эмболия, разрыв);
- Нарушение кровообращения в ногах;
- Расслоение стенки аорты в области аневризмы (сопровождается сильной болью в груди, животе, паху).
У пациентов пожилого возраста при наличии сопутствующих заболеваний проведение операции может быть опасным, поэтому хирург всегда четко взвешивает предполагаемую пользу и риски. Если аневризма стабильна, угроза ее разрыва минимальна, то можно на какое-то время отложить оперативное лечение и попытаться максимально улучшить состояние больного.
Плановая операция по удалению аневризмы аорты имеет свои противопоказания – тяжелая сердечная недостаточность, серьезные нарушения в работе печени и почек, острый инфаркт сердца и инсульт. У больных старше 75 лет, при низком гемоглобине крови и высоком показателе креатинина есть высокий риск неблагоприятного исхода прямо во время оперативного лечения, особенно, если произошел разрыв. В случае разрыва аневризмы противопоказаний, по сути, нет, так как без операции неминуема гибель больного.
Все вмешательства на аневризмах делят на радикальные и паллиативные. Радикальные производят наиболее часто, это основной вид лечения патологии. Паллиативные применимы лишь тогда, когда противопоказана открытая перация, но имеется большой риск разрыва выпячивания. К паллиативным процедурам можно отнести «укутывание» места аневризматического расширения синтетическим материалом, который будет препятствовать нарушению целостности стенки сосуда.
При экстренном хирургическом лечении разорвавшейся аневризмы времени на обследование и подготовку крайне мало, поэтому при поступлении в приемном покое делаются в срочном порядке анализы крови и мочи, коагулограмма, затем пациента отправляют на УЗИ, компьютерную томографию (если позволяет состояние, конечно), далее – в операционную.
При плановой операции по поводу аневризмы больного обследуют гораздо более тщательно. Проводят анализы крови и мочи, кардиографию, рентгенографию грудной клетки, УЗИ органов брюшной полости, а также КТ и МРТ, позволяющие очень точно локализовать выпячивание, уточнить его размеры и строение.
При беседе с лечащим врачом на этапе подготовки пациент обязательно должен сообщить обо всех принимаемых препаратах. Особенно это касается аспирина и антикоагулянтов (варфарин, клопидогрель), которые могут спровоцировать снижение свертываемости крови и кровотечение.
При поступлении в стационар больной уже имеет на руках большинство результатов исследований, кое-что может быть повторно проведено в клинике (те же анализы крови, свертываемость, группа и резус-фактор, анализы на ВИЧ, гепатиты, сифилис, УЗИ живота).
Накануне вечером происходит последний прием пищи не позднее 8 часов до операции, принимается душ, пациент переодевается в чистую одежду и ложится спать. При сильных переживаниях и бессоннице допускается прием успокоительных средств и снотворных.
Все открытые операции на аорте требуют общего наркоза, в ряде случаев – искусственного кровообращения или временного шунтирования. Эндоваскулярное лечение может быть проведено под местной анестезией. Открытое вмешательство длится в среднем 3-6 часов.
Аневризма аорты брюшной полости считается одной из наиболее частых локализаций патологии. Это неслучайно, ведь именно в этом месте от сосуда отходят магистрали к кишечнику, почкам, в устьях которых создаются «завихрения» кровотока, способствующие прогрессированию атеросклероза и микротравмированию внутренней стенки аорты.
В 9 случаях из 10 аневризматический мешок расположен ниже места ветвления почечных сосудов, поэтому кровоток в почках сохраняется на время операции. Дополнительные трудности по обеспечению кровообращения в почках возникают во время операции на аневризме, расположенной выше этого места. В таком случае даже кратковременное пережатие сосуда может вызвать острую недостаточность почек, поэтому время манипуляции на сосудах максимально сокращают.
Доступ к брюшной аорте – срединный, когда хирург делает длинный продольный разрез передней стенки живота от нижнего края грудины до лобкового симфиза. Такой разрез оставит после себя заметный косметический дефект, но иного выхода у хирурга нет, этого требует тяжесть патологии и глубокая локализация самой аорты позади органов живота.
После вскрытия брюшной полости, хирург отодвигает кишечные петли вправо, выделяет мочеточники, подвздошные и почечные сосуды, определяет верхний и нижний полюс аневризмы, пережимает сосуды, задействованные в патологическом процессе.
Основной тип операции на аневризму брюшной аорты – протезирование, при этом протез может быть в виде трубки, соединяющей оба конца аорты выше и ниже места выпячивания после его иссечения. В случае распространенного атеросклероза протез может соединять аорту с подвздошной или бедренной артерией – эти особенности определяются индивидуально для каждого пациента.
Если аневризма аорты сочетается с тяжелым атеросклерозом места ее деления на подвздошные артерии, то протез будет в форме развилки (бифуркационный), фиксирован к аорте и обеим подвздошным артериям, а место выпячивания и бифуркации аорты удаляется.
В процессе манипуляций важно очень аккуратно обращаться с сосудами, постараться сохранить внутреннюю подвздошную артерию для кровотока в малом тазу (предупреждение импотенции у мужчин). При очень близком расположении к аневризме яичниковой или яичковой артерии лучше их перевязать, чтобы предупредить возможное повреждение и кровотечение.
Когда на верхний и нижний концы аневризмы наложены зажимы, то в сосуды выше и ниже места их пережатия вводят гепарин для профилактики тромбообразования. Затем хирург рассекает стенку аневризматического мешка, удаляет из него тромботические массы, промывает полость гепарином и иссекает переднюю и боковые стенки.
Протез участка сосуда изготавливается из гибких синтетических материалов и подбирается индивидуально в соответствии с диаметром аорты и того сосуда, к которому будет наложен анастомоз. Сначала к верхнему концу аорты пришивают верхнюю часть протеза, накладывая швы кнаружи, затем производят фиксацию нижнего конца протеза к аорте, подвздошным или бедренным артериям.
После того, как протез установлен, снимаются зажимы с аорты, и происходит восстановление движения крови по ней. Операция проводится при использовании аппарата искусственного кровообращения или временного анастомоза, «перекачивающего» кровь, минуя зону хирургических манипуляций.
На завершающем этапе операции хирург убеждается в отсутствии кровоточивости и хорошей фиксации протеза швами, укладывает кишечник в нормальное положение и ушивает ткани. Для профилактики свищей от действия шовных нитей на кишечные петли, протез укрывается двумя слоями брюшины.
В послеоперационном периоде неизбежны проблемы с кишечником, его вздутие, поэтому шов на брюшной стенке дополнительно укрепляется проволокой или прочной нейлоновой нитью, чтобы предупредить его расхождение.
При аневризме восходящей аорты и ее дуги также производится протезирование пораженного участка сосуда, но не всегда возникает необходимость в налаживании искусственного кровотока. В некоторых случаях достаточно обходного шунтирования, обеспечивающего кровоснабжение тканей головы.

После того, как аневризма выделена, на нее накладываются зажимы, стенка пересекается, удаляются измененные фрагменты и устанавливается протез. Обычно в его качестве используют собственные сосуды больного или другие ткани (аллотрансплантат).
Если помимо аневризмы есть нарушения со стороны аортального клапана, то операция может быть дополнена его пластикой. После того, как все манипуляции завершены, хирург удостоверяется в надежности установки протеза, больного согревают до нормальной температуры тела, а аппарат искусственного кровотока отключают тогда, когда левый желудочек достаточно заполнится кровью для нормальной его сократимости.
Операцию заканчивают установкой дренажей в правую плевральную полость и сердечную сумку, ткани послойно ушивают, грудину фиксируют металлическими скобками или проволокой.
пример протезирования восходящей аорты
протезирование части дуги и нисходящего отдела аорты
Если аневризма восходящего отдела имеет узкую шейку, то кровообращение в теле пациента сохраняют в обычном состоянии. На участок аорты в основании выпячивания накладывается зажим, аневризма отсекается и удаляется полностью, а место ее отхождения тщательно ушивается.
При поражении аневризмой дуги аорты доступ производится через левую грудную полость, грудина пересекается в косом направлении и далее разрез распространяется направо во 2-3 межреберный промежуток. Операция проводится при искусственном кровообращении, а для снабжения кровью головы устанавливается шунт между нисходящей частью сосуда и сонными артериями.
Аневризма грудной аорты оперируется открытым способом и требует либо искусственного кровообращения, либо наложения шунта, осуществляющего циркуляцию крови между верхним и нижним участками сосуда. После того, как эти манипуляции завершены, хирург удаляет аневризму полностью. Восстановление целостности сосуда возможно с помощью прямого протеза, соединяющего оба конца грудной аорты. В части случаев аорта в зоне удаленной аневризмы зашивается полностью, а кровоток осуществляет временный анастомоз, который после операции становится постоянным.
Помимо открытых, разработаны и малоинвазивные операции, которые показаны в качестве планового лечения патологии. Эндоваскулярное вмешательство состоит во введении через разрез в бедренной артерии катетера, который доставляет к измененному участку сосуда стент-графт, обеспечивающий выключение аневризмы из кровотока.
Стент-графт представляет собой металлическую пружину, расправляющуюся в просвете аорты до нужного диаметра. Снаружи к стенту фиксирована тканевая основа из синтетического прочного материала. Такие устройства бывают прямые или бифуркационные, для установки в брюшном отделе аорты, месте ее деления на сосуды и в начальные отделы подвздошных артерий.
Стент-графт изготавливается индивидуально для каждого пациента вручную, из высококачественных материалов, что объясняет его высокую стоимость и, соответственно, низкую доступность для широкого круга больных.
Послеоперационный период при открытом вмешательстве занимает около двух недель, по истечении которых удаляются кожные швы. Все это время пациент находится под тщательнейшим контролем специалистов. Реабилитация при эндоваскулярных операциях существенно короче – уже через несколько дней можно покинуть клинику.
На первом году после хирургического лечения аневризмы требуется постоянное наблюдение, и пациент посещает врача раз в месяц, затем два раза в год и ежегодно после трех лет. Дома нужно регулярно измерять давление, не допуская его повышения.
После операции по удалению аневризмы возможны самые разные осложнения. Так, в раннем послеоперационном периоде опасность представляют:
- Кровотечение при негерметично установленных швах на аорте;
- Тромбоэмболический синдром;
- Отек легких;
- Нагноение послеоперационной раны;
- Тяжелые нарушения функции почек.
Среди отдаленных последствий отмечают инфицирование протеза, тромбозы, кишечные свищи при недостаточной изоляции кишечника от зоны протезирования, нарушения половой функции у мужчин.
Для профилактики осложнений пациентам после протезирования аорты назначаются антиагреганты, при любой манипуляции (у стоматолога, гинеколога и т. д.) с риском повреждения тканей показаны антибиотики. Для коррекции артериального давления и сердечной деятельности кардиолог или терапевт назначают прием гипотензивных препаратов, бета-блокаторы, диуретики и другие в соответствии с теми или иными заболеваниями.
Открытые операции при аневризмах аорты проводятся бесплатно в центрах сосудистой хирургии. Эндопротезирование относится к числу высокотехнологичных операций, требующих дорогостоящего оборудования и наличия квалифицированного хирурга, поэтому возможности такого бесплатного лечения ограничены, и их проводят лишь в части клиник по квотам.
Платное лечение тоже возможно. Стоимость резекции аневризмы начинается с 30 тысяч рублей, при использовании аппарата искусственного кровообращения достигает ста и более тысяч. Эндопротезирование предполагает еще и покупку стент-графта. Цена на стент-графт за границей приближается к 500 тысячам рублей, в то время как стоимость самого эндопротезирования – в пределах 20-40 тысяч рублей.
Прогноз при аневризме аорты очень серьезный, и если ее не лечить, то рано или поздно произойдет разрыв и гибель пациента. Без лечения при разрыве шансов выжить нет, и даже после хирургической операции смертность достигает 90% в первые месяцы после вмешательства. После планового лечения пять и более лет живут 70% больных, поэтому, как только аневризма будет обнаружена, сразу же будет поставлен вопрос о необходимости операции.
источник
ЛСДЛЯ АНЕСТЕЗИИ Бензодиазепины
ЛС для внутривенной анестезии
ЛС для ингаляционной анестезии
ВСПОМОГАТЕЛЬНЫЕ ЛС Антагонисты кальция
Нитропруссид натрия Антикоагулянты
Блокаторы Н^гистаминовых рецепторов
Кардиотонические и вазопрессорные ЛС
Предоперационная подготовка и оценка состояния пациента до операции
За последние годы значительно повысился возраст больных при операциях на крупных магистральных сосудах, в частности при операциях по поводу аневризмы брюшной аорты. Большая часть больных с данной патологией — больные преклонного возраста, с далеко зашедшим распространенным атеросклерозом и сопутствующим поражением коронарных, мозговых и почечных сосудов; один из трех больных страдает ГБ, два из трех — ИБС, нередко нарушением функции почек, что повышает риск оперативного вмешательства и способствует развитию осложнений как во время операции, так и в послеоперационном периоде. Особенности патофизиологии пожилых больных обсуждается в начале главы. Несмотря на улучшение хирургической техники и анестезиологического пособия, летальность среди этих больных колеблется от 1,5 до 8%.
Поэтому важную роль в благополучном исходе операции играет не только совершенствование хирургической техники и сокращение длительности операции, но и совершенствование анестезиологического пособия, направленного на поддержание стабильной гемодинамики и показателей гомеостаза и защиту функции органов и систем на различных этапах операции, включая вводный наркоз, пережатие аорты и пуск кровотока, и в послеоперационном периоде.
Второй особенностью операций по поводу аневризм брюшной аорты, отличающей их от одинаковых по тяжести операций на других органах, является прекращение кровотока по сосудам таза и нижних конечностей: восстановление кровотока приводит порой к значительным изменениям гемодинамики и КОС вследствие как кровопотери, так и депрессии миокарда в результате освобождения продуктов метаболизма из ишемизированных тканей после восстановления кровотока. Несмотря на то что операции по поводу аневризм брюшной аорты ниже почечных артерий сопровождаются менее выраженными изменениями гемодинамики, преклонный возраст этого контингента больных, серьезные сопутствующие заболевания (стенокардия, перенесенный ранее ИМ, ГБ, нарушение функции почек, сахарный диабет) значительно повышают риск анестезии и операции. Поэтому важное
значение у этого контингента больных имеет тщательное предоперационное обследование с целью выявления сопутствующей патологии и при необходимости предоперационной коррекции. Больным с признаками ГЧ в первую очередь назначают диуретик! дигоксин или другие инотропные ЛС до стабилизации функции миокарда. У б—20% этих больных может отмечаться недиагностированная ИБС, а во время операции — скрытая ишемия миокарда.
В операционной всем больным налаживается непрерывный мониторный контроль: ЭКГ, ЭЭГ, прямое измерение АД в лучевой артерии, ЦВД и периодическое исследование газов артериальной и венозной крови. Больному производят катетеризацию нескольких вен для обеспечения адекватной инфузионно-трансфузионной терапии. Несмотря на существующие разногласия в необходимости катетеризации легочной артерии катетером Свана—Ганца, считаем регистрацию ЦВД вполне достаточной для контроля за инфузионной терапией.
Накануне операции больным назначают снотворные, транквилизаторы и антигис- таминные ЛС.
За 1 ч до операции в/м вводят тримепе- ридин, дифенгидрамин и диазепам:
I Тримеперидин е/м 0,3 мг/кг, одно- I кратно за 1 ч до операции
I Дифенгидрамин е/м 0,25 мг/кг, одно- I кратно за 1 ч до операции
I Диазепам е/м 0,1—0,15 мг/кг, одно- I кратно за 1 ч до операции.
Основные методы анестезии
Какие-либо научно обоснованные данные в пользу той или иной методики анестезии при этих операциях отсутствуют. Основной принцип проведения индукции и анестезии у этого тяжелого контингента больных заключается в профилактике как гипотонии (опасность тромбозов, нарушений мозгового и коронарного кровообращения), так и выраженной гипертонии (ИМ, СН). Наиболее распространенной методикой анестезии остается методика анестезии динитрогеном оксидом с кислородом (1 : 1) с дополнением анальгетиков и галотана, энфлурана или изофлурана или только указанными анестетиками без использования динитрогена оксида в сочетании с инфузией небольших доз кетамина или пропофола, что ускоряет пробуждение и раннюю экстубацию больных, а также седацию в послеоперационном периоде.
Все перечисленные ЛС оказывают отрицательное инотропное действие на миокард. Однако сочетанное их применение с анальгетиками, кетамином позволяет значительно уменьшить используемую их концентрацию, при которой сохраняются их положительные свойства. Галотан в сочетании с анальгетиками лучше подавляет выброс катехоламинов и ренина и облегчает коррекцию АД при пережатии аорты, снижает потребление кислорода миокардом, что очень важно у таких больных. Некоторые авторы анестетиком выбора считают изофлуран, являющийся мощным вазодилататором и оказывающий небольшое отрицательное инотропное действие, несмотря на одинаковую частоту развития ишемии и ИМ.
I Кетамин е/е 1 мг/кг, однократно
I Фентанил е/е 0,008 мг/кг, однократно
I Панкурония бромид е/е 0,1 мг/кг,
I Динитроген оксид с кислородом
Галотан ингаляционно 0,2—1 об%, перед травматичными этапами вмешательства с целью коррекции АД или Изофлуран ингаляционно 0,2—1 об%, перед травматичными этапами вмешательства с целью коррекции АД
Нимодипин в/в 0,35—0,7 мкг/кг/мин, перед травматичными этапами вмешательства с целью коррекции АД
I Фентанил в/в дробно 0,005 мг, при не- I обходимости
Галотан ингаляционно 0,2—0,7 об%, перед травматичными этапами вмешательства с целью коррекции АД или
Изофлуран ингаляционно 0,2—0,5 об%, перед травматичными этапами вмешательства с целью коррекции АД
! Фентанил в/в дробно 0,005 мг, при не- ! обходимости
| Кетамин в/в 0,7—0,8 мг/кг/ч или 1 Пропофол в/в 50—200 мкг/кг/мин.
В последнее время при этих операциях все большее распространение получает регионарная анестезия. Регионарная анестезия обеспечивает нейроблокаду, предупреждает чрезмерную эндокринную/метаболическую реакцию на операцию, предупреждая повышение во время операции уровня сахара в крови, кортизола, катехоламинов, АДГ. Сочетание ЭА с поверхностной общей анестезией способствует более ранней экстубации и активизации больного, уменьшает продолжительность пребывания больного в стационаре. Введение в перидураль- ный катетер местных анестетиков или наркотических анальгетиков позволяет обеспечить достаточное обезболивание больного в послеоперационном периоде. По данным некоторых авторов, ЭА оказывает благоприятное действие на исход операции, включающее снижение послеоперационного катаболизма, частоту легочных осложнений, снижение кровопотери во время операции, профилактику тромбоэмболических осложнений, а также сохранение функции кишечника.
Однако не все авторы придерживаются этой точки зрения, считая, что эта методика не должна быть панацеей и сама по себе не приводит к снижению осложнений в послеоперационном периоде. К тому же эта методика представляет определенные технические трудности, особенно для начинающего анестезиолога при выполнении грудной эпидуральной блокады. Кроме того, определенные сложности могут возникать при коррекции показателей гемодинамики во время снятия зажима с аорты, особенно при длительном пережатии ее выше чревного ствола.
Важное значение в профилактике гипотонии и брадикардии, нередко наблюдающейся при использовании эпидуральной блокады, является дробное применение небольших доз 0,25% раствора бупивакаина. Подобная методика позволяет уменьшить двигательный блок в нижних конечностях. Стабильности показателей гемодинамики при использовании грудной эпидуральной анестезии можно добиться инфузией 0,125% раствора бупивакаина со скоростью 0,25 мл/кг/ч: Бупивакаин, 0,25% р-р, эпидурально
12— 15 мл, периодичность введения определяется клинической целесообразностью, или 0,125% р-р, эпидурально 0,25 мл/кг/ч.
С этой же целью можно использовать 0,2% раствора ропивакаина в дозе 40— 80 мг, периодичность введения также определяется клинической целесообразностью.
И все же во время этих операций необходимо тщательно оценить возможность развития порой выраженной гипотонии, вызываемой самой методикой ЭА. Исследования показали, что при использовании ЭА в сочетании с поверхностной общей анестезией у больных с высоким операционным риском почти в 90% случаев требовалось применение вазопрессоров во время операции. Гипотония, возникающая при ЭА, обусловлена главным образом вазодилатацией, приводящей к относительной гиповолемии. Поэтому не удивительно, что такую гипотонию не удается корригировать переливанием кристаллоидов, которые тотчас перемещаются в интерстициальное пространство. И, что удивительно, некоторые анестезиологи, несмотря на отсутствие эффекта, продолжают переливать все увеличивающееся количество кристаллоидов, что может привести к нарушению функции легких. Следует подчеркнуть, что пуск кровотока только по чревным сосудам во время общей анестезии без применения ЭА сопровождается порой выраженным падением АД, даже при адекватной инфузионной поддержке.
Наконец, анестезиологу всегда следует помнить о возможности развития эпидуральной гематомы, особенно у больных при аневризмах брюшной аорты с возможностью прерывания кровоснабжения спинного мозга, снижения перфузионного давления спинного мозга и интраопе- рационного применения гепарина. Точная частота этого осложнения остается неизвестной. По данным двух авторов, частота эпидуральной гематомы после спинальной и эпидуральной анестезии составляет менее 1 на 4000 анестезий. Дальнейшие сравнительные исследования, направленные на установление теоретических и практических преимуществ регионарной анестезии, будут способствовать увеличению ее безопасности и более широкому клиническому использованию.
Другими важными дестабилизирующими факторами, помимо вводного наркоза у больных во время операций по поводу аневризмы брюшной аорты, являются пережатие и снятие зажима с аорты. Пережатие аорты сопровождается прерыванием кровотока к тканям и органам, расположенным ниже уровня пережатия, вызывая развитие гипертонии выше уровня пережатия, перегрузки ЛЖ и СН, особенно у больных с высоким операционным риском. Изменения гемодинамики при пережатии аорты ниже почечных артерий являются значительно менее выраженными, чем при операциях на нисходящем отделе аорты и при пережатии ее выше чревного ствола, и даже больные с СН или ИБС могут переносить это вмешательство. Пережатие аорты вследствие внезапного увеличения постнагрузки сопровождается повышением артериального и конечно-диастолического давления ЛЖ, снижением СВ и ИУРЛЖ.
Применение галотана или изофлурана позволяет легко корригировать АД при пережатии аорты и избежать использования нитропруссида натрия или нитроглицерина, поскольку последний сам может вызывать депрессию миокарда, а после снятия зажима с аорты для поддержания стабильной гемодинамики требуется значительно больший объем переливаемой жидкости, что может привести к развитию гиперволемии и СН в послеоперационном периоде. Так, Б. ТЬо- трзоп и соавт. отмечали, что инфузия ва- зодилататоров приводит к выраженному снижению СВ даже при отсутствии изменений АД и давления в ЛП. Более того, 1кес1а и соавт. в эксперименте на собаках отметили существенное снижение почечного кровотока при использовании нитропруссида натрия и нитроглицерина с целью коррекции гипертонии во время пережатия аорты. Пережатие аорты в наших исследованиях не сопровождалось сколько-нибудь существенными изменениями гемодинамики (р > 0,05), повышением ОПСС и депрессией сократительной способности миокарда, которые отмечают многие авторы.
Для коррекции гипертонии с успехом можно использовать антагонисты каль
ция нифедипин или нимодипин в дозе
0, 35—0,7 мкг/кг/мин. Это вызывает быстрое снижение АД до желаемого уровня в зависимости от дозы ЛС. Наряду со снижением АД отмечается уменьшение ОПСС и увеличение СВ на 10—15%.
Из гипотензивных ЛС можно использовать аденозин (см. в предыдущем разделе), ингибиторы III фракции фосфодиэстеразы (амринон, эноксимон) — фермента, специфического для сердечной и сосудистой ткани. Традиционно амринон используется чаще в качестве ино- тропного ЛС при лечении СН, чем в качестве гипотензивного ЛС. Возможно, это обусловлено предположением, что амринон обладает длительным Т1/2. Однако период полураспределения ЛС составляет от 1,4 до 4,4 мин, т.е. приблизительно равен периоду полураспределения у нитропруссида натрия. Проведенные рядом авторов исследования показали, что амринон по эффективности гипотензивного действия является альтернативой нитропруссиду натрия и обеспечивает умеренное снижение АД без изменения других параметров гемодинамики.
В тканях ниже уровня пережатия (органы малого таза, нижние конечности) развивается метаболический ацидоз в результате перехода к анаэробному метаболизму и накопление молочной кислоты в тканях, ионов водорода и других вазоактивных продуктов анаэробного метаболизма, что сопровождается параличом сосудов и ишемической вазодилата- цией.
Снятие зажима с аорты и восстановление магистрального кровотока сопровождается гипотонией, хотя и менее выраженной, чем при операциях на нисходящем отделе аорты или ее пережатии выше чревного ствола. Некоторые авторы отмечают при этом значительное повышение К+ плазмы, что в ряде случаев являлось причиной фибрилляции желудочков. Причиной гипотонии считают гиповолемию в результате депонирования крови за счет реактивной гиперемии в реперфузируемых нижних конечностях и огромном массиве внутренних органов при пережатии аорты выше чревного ствола. Одновременное снижение СВ и ОПС может сопровождаться выраженной гипотонией. Для профилактики снижения АД после снятия зажима с аорты уменьшают уровень анестезии, одновременно увеличивая темп переливания жидкости и крови, добиваясь небольшого повышения ЦВД или ДЗЛА или поддержания их на близком к исходным цифрам. Снятие зажима производится постепенно, в течение 30 сек, а при «включении» подвздошных и бедренных артерий восстановление кровотока проводится поэтапно: сначала по одной бранше протеза, затем по другой. В наших исследованиях снятие зажима с аорты не сопровождалось существенными изменениями МОС, СИ, ИУРЛЖ (Р > 0,05).

источник
Под аневризмой брюшной аорты (АБА) понимают превышение нормального диаметра аорты на 50% и более.
У мужчин диаметр аорты ниже почек в норме составляет 2,0 см. Диагноз АБА ставится в тех случаях, когда диаметр аорты равен или превышает 3 см.
Аневризма брюшной аорты (АБА) случайно выявляется у 3,2% взрослого населения во время ультразвукового исследования (УЗИ); у 5% больных с ишемической болезнью сердца (ИБС), и у 10% больных с заболеванием периферических сосудов.
Существуют многочисленные сообщения о семейных случаях аневризмы брюшной аорты (АБА). Поэтому рекомендуется обследовать ближайших родственников больного старше 50 лет. В двух проспективных исследованиях было продемонстрировано, что приблизительно 30% ближайших родственников больных с АБА сами страдают АБА. Предполагается, что генетическая причина аневризмы брюшной аорты (АБА) связана с патологическим коллагеном III типа.
Да. У 40% больных с аневризмой подколенной артерии и у 75% больных с аневризмой бедренной артерии также имеется аневризма брюшной аорты (АБА). При аневризме грудного отдела аорты в 20% случаев одновременно наблюдается аневризма брюшной аорты (АБА). Через 5 или более лет после пластики подпочечной аневризмы брюшной аорты (АБА) у 5% больных развивается аневризма аорты проксимальнее протеза.
Нет. Аорта разветвляется на уровне пупка. Таким образом, пульсирующее образование находится в эпигастрии. При объективном осмотре можно выявить только достаточно большие аневризмы брюшной аорты (АБА) у худых больных.
Рентгенография живота или поясничного отдела позвоночника в прямой проекции позволяет диагностировать около 20% скрытых аневризм брюшной аорты (АБА). Тонкий ободок кальцификации является диагностическим признаком аневризмы. Большинство аневризм брюшной аорты (АБА) содержат слишком мало кальция, и поэтому не визуализируются на рентгенограммах.
Ультразвуковое исследование (УЗИ) брюшной полости позволяет определить поперечные и продольные размеры аневризмы с точностью до 0,3 см.
Это компьютерная томография (КТ) с контрастным усилением, позволяющая определить диаметр аорты с точностью до 0,2 см. При КТ хорошо визуализируются венозные аномалии (расположение левой почечной вены позади или вокруг аорты, удвоение или левостороннее положение нижней полой вены), которые значительно влияют па тактику хирургического лечения.
Хотя КТ является идеальным методом диагностики разрыва аневризмы (чувствительность 92% и специфичность 100%), она менее информативна для диагностики распространения аневризмы на надпочечную часть аорты (чувствительность 83% и специфичность 90% с положительной прогностической ценностью).
До разрыва диагностируется менее трети аневризм. Неожиданный приступ боли в животе является наиболее частым симптомом (82%) разорвавшейся апвризмы. Пожилой больной с артериальной гипотензией и остро возникшей болью в нижней части спины должен расцениваться как больной с разрывом аневризмы, пока не доказано обратное.
Больным с нестабильной гемодинамикой и пульсирующим образованием в животе следует записать электрокардиограмму для исключения инфаркта миокарда непосредственно перед срочной диагностической лапароскопией. Время терять нельзя.
Больные в глубоком шоке и/или с остановившимся на момент обследования сердцем имеют мало шансов на выживание. Преклонный возраст, старческое слабоумие, метастазы рака и другие тяжелые заболевания в терминальной стадии должны заставить вас задуматься о целесообразности операции.
Около половины больных с разрывом аневризмы брюшной аорты (АБА) умирают па догоспитальном этапе. Четверть больных, поступивших в клинику, не доживают до операционного стола.
Из-за опасности критического падения артериального давления во время вводного наркоза анестезию начинают только при полной готовности к разрезу, когда операционное поле обработано и обложено салфетками. Ключом к успешному исходу операции при разрыве аневризмы брюшной аорты (АБА) является быстрое пережатие центральной части аорты.
Пережатие аорты осуществляется па уровне диафрагмы (внутрибрюшное кровотечение с нестабильной гемодинамикой или забрюшинная гематома, распространяющаяся проксимальнее левой почечной вены) или ниже почечных артерий (при низко расположенной забрюшинной гематоме и стабильной гемодинамике). Внутрипросветная окклюзия аорты баллонным катетером осуществляется при открытом внутрибрюшном кровотечении.
После остановки кровотечения и стабилизации гемодинамики зажимы перекладываются в более стандартное положение ниже почечных артерий. Чтобы предотвратить повреждение подвздошной вены, кровотечение из дистальной аорты останавливается баллонным катетером или тампонами.
Симптоматичные аневризмы брюшной аорты (АБА) быстро расширяются и имеют высокий риск разрыва. Поэтому большинство сосудистых хирургов сходятся во мнении, что такие аневризмы брюшной аорты (АБА) следует как можно быстрее оперировать.
При высоком риске разрыва симптоматичных аневризм брюшной аорты (АБА) или при разрыве аорты с образованием пульсирующей гематомы успешно применяются эндоваскулярные синтетические протезы, которые устанавливаются как в аорту, гак и в подвздошные артерии.
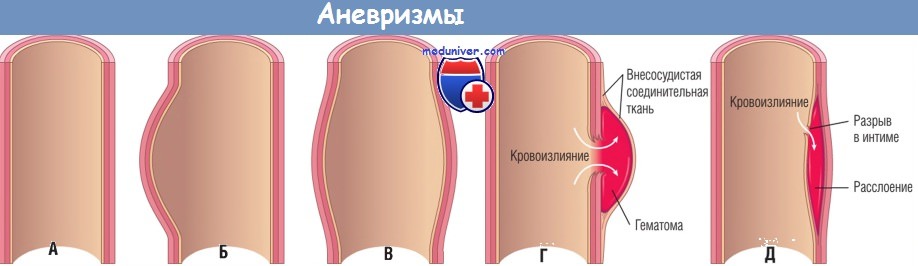
(А) Нормальный сосуд.
(Б) Истинная аневризма, мешковидный тип: стенка локально выпячивается наружу и может быть истонченной.
(В) Истинная аневризма, веретенообразный тип: тотальное расширение сосуда без разрыва.
(Г) Ложная аневризма: разрыв стенки и скопление крови (гематома), ограниченное снаружи прилегающей внесосудистой соединительной тканью.
(Д) Расслоение: кровь, проникая в стенку сосуда, расслаивает ее.
На рисунке видно, что кровь проникает из просвета через разрыв в интиме, однако расслоение также может произойти в результате разрыва vasa vasorum в медии.
Риск разрыва аневризмы брюшной аорты (АБА) диаметром 5 см в течение года составляет 4%. Этот риск возрастает с увеличением размера аневризмы (при АБА диаметром 7 см риск разрыва в течение года составляет 20%).
Средняя скорость расширения аневризмы брюшной аорты (АБА) составляет 0,4 см/год. Тем не менее 20% всех АБА с течением времени не увеличиваются. И наоборот, 20% аневризм увеличиваются со скоростью больше 0,5 см/год. Быстрое расширение аневризмы (0,5 см за 6 месяцев) является прогностическим фактором разрыва и служит показанием к операции.
18. Необходимо ли при аневризме брюшной аорты (АБА) проводить полномасштабное кардиологическое обследование?
Этот вопрос неясен. Частота сопутствующей ИБС у больных с аневризмой брюшной аорты (АБА) превышает 50%, а основной причиной периоперационной и отдаленной летальности является инфаркт миокарда.
Традиционно ангиография показана для определения размера проксимальной шейки аневризмы, выявления сопутствующей облитерации висцеральных сосудов, заболеваний почечных артерий, аневризм или облитерирующего заболевания периферических артерий и визуализации висцерального кровообращения после колэктомии.
Спиральная КТ дает трехмерное изображение контуров и аневризмы и висцеральных артерий. Основным недостатком метода является его высокая стоимость, а основным достоинством — получение потенциально полезной информации при планировании и проведении эндоваскулярного протезирования аорты. Для визуализации висцеральных сосудов, аорты и подвздошных артерий также применяется магнитно-резонансная ангиография. Основным недостатком метода является необходимость задержки больным дыхания для устранения респираторных артефактов.
Протезирование брюшной аорты может равно успешно выполняться как трансабдоминальиым, так и экстраперитонеальным доступами. Трансабдоминальный доступ обеспечивает лучший обзор сосудов таза, тогда как при экстраперитонеальном доступе лучше визуализируется аорта выше почечных артерий и сокращается количество послеоперационных легочных осложнений.

(а) Вид снаружи: крупная аневризма аорты с разрывом (стрелка).
(б) Вид изнутри: стенка аневризмы крайне тонкая, просвет заполнен крупным слоистым, но в основном неорганизованным тромбом; место разрыва показано зондом.
Эндоваскулярные протезы представляют собой большие стенты с покрытием, которые проводятся через бедренную артерию под рентгенологическим контролем и выключают аневризму из кровообращения. При этом пет необходимости в разрезе живота и пережатии аорты. Результаты эндоваскулярного выключения АБА противоречивы. Широкое исследование, посвященное эндоваскулярному протезированию, продемонстрировало успешную имплантацию стентов в 85% случаев и отсутствие интраоперационной летальности. Однако в 44% случаев отмечалось подтекание крови в пространство вокруг протеза. За время дальнейшего наблюдения половина таких стентов затромбировались.
Хирургическое лечение показано, когда аневризма брюшной аорты (АБА) достигает 5 см в диаметре. Единственной целью пластики асимптоматичных аневризм брюшной аорты (АБА) является предотвращение их последующего разрыва и смерти. Таким образом, прогнозируемая продолжительность жизни всех кандидатов на операцию должна составлять не менее 5 лет.
Двумя наиболее важными моментами являются: (1) расположение артериальных зажимов и (2) тип протеза. В большинстве случаев зажимы на аорту накладываются ниже почечных артерий. Такое положение зажимов позволяет избежать длительной ишемии почек. Аневризма вскрывается после пережатия проксимального и дистального участков аорты. Устья поясничных артерий ушиваются для предотвращения кровотечения из коллатералей. Нижняя брыжеечная артерия часто уже облитерирована, по если она проходима и в ней нет ретроградного кровотечения, может потребоваться ее реплантация.
Почечная недостаточность (повышение уровня креатинина) и ишемия кишечника (кровавый понос).
— Вернуться в оглавление раздела «Хирургия»
источник
Эпидуральная анестезия при хирургическом лечении разрывов аневризм брюшной аорты Ситкин С. И., Казаков Ю. И., Овечкин А. М
Цель работы
Материал и методы
Результаты исследования и их обсуждение.
| Эпидуральная анестезия при хирургическом лечении разрывов аневризм брюшной аорты Ситкин С.И., Казаков Ю.И., Овечкин А.М. * , Федерякин Д.В. Тверская государственная медицинская академия, Московская медицинская академия им. И.М. Сеченова * Лечение больных с разрывом аневризмы брюшной аорты – наиболее сложная и до конца не решенная проблема экстренной сосудистой хирургии. Разнообразие клинических проявлений, сложность диагностики, тяжесть состояния, экстренно оперируемых больных, объясняют высокую (до 85%) послеоперационную летальность (8). По данным Maryland Vascular Center (2004) в США ежегодно от разрывов аневризм брюшной аорты погибают более 15 тыс. человек. У подавляющего числа данных пациентов имеется сопутствующая сердечно-сосудистая патология. Ишемическая болезнь сердца диагностируется у 50 – 80% больных, гипертоническая болезнь – у 80 – 100%, что существенно повышает анестезиолого-операционный риск (9, 14). Помимо сопутствующей патологии, результаты операции определяются также тяжестью развившегося шока до операции, величиной кровопотери во время операции, длительностью ишемии почек, кишечника и нижних конечностей, возникающей при пережатии аорты. Подавляющее большинство разрывов аневризм брюшной аорты (95%) локализуется ниже отхождения почечных артерий. Среди разновидностей разрывов аневризмы брюшной аорты разрыв в забрюшинное пространство по частоте занимает первое место и встречается в 80 – 85 % случаев. При данном варианте кровотечение не бывает столь быстрым и массивным и всегда имеет место эффект тампонады и тромбоза отверстия, что на фоне гипотензии приводит к временной остановке кровотечения (11). В лечении разрывов аневризм брюшной аорты выделяют несколько аспектов: продление выживаемости больного до операции; анестезиологическое и реанимационное обеспечение; технику хирургического вмешательства; ведение послеоперационного периода (2). Техника самой операции мало отличается от техники операции при неосложненной аневризме брюшной аорты и достаточно хорошо отработана в сосудистой хирургии. Большое значение в успешном исходе хирургического лечения данной патологии отводится анестезиологическому пособию (4, 16). По данным. Бураковского В.И, Бокерия Л.А. (1996) для обеспечения положительного результата необходимо соблюдение стандарта предоперационной подготовки:
Создание умеренной гипотонии до момента пережатия аорты выше аневризмы способствует уменьшению кровопотери и является одной из главных задач анестезиолога на начальном этапе операции. Для этих целей некоторые авторы рекомендуют применение вазодилятаторов и ганглиоблокаторов (2). При проведении анестезии у пациентов с разрывами аневризм брюшной аорты анестезиологу приходится одновременно решать несколько задач:
Учитывая сопутствующую сердечно-сосудистую патологию, травматичность самой операции, использование грудной эпидуральной анестезии, на наш взгляд, во многом может способствовать решению поставленных перед анестезиологом задач (6, 10, 13, 15). И если использование эпидуральной анестезии в плановой хирургии брюшной аорты считается общепринятым (3, 12), то применение ее на фоне гиповолемии и кровопотери является относительным противопоказанием (1). ^ Цель работы . Провести сравнительное изучение результатов хирургического лечения больных с разрывами аневризм брюшной аорты, оперированных в условиях эпидуральной и общей анестезии. ^ Материал и методы . Анализу подвергнуты результаты лечения 15 больных, поступивших в экстренном порядке в областную клиническую больницу г. Твери с диагнозом: разрыв аневризмы брюшного отдела аорты, геморрагический шок. Пациенты были разделены на две группы: 1-я группа — 7 человек, оперированных под комбинированной эпидуральной и «облегченной» общей анестезией, 2-я группа — 8 человек, оперированных под общей анестезией. Средний возраст больных в группах составил 62±4 года. Все пациенты страдали гипертонической болезнью. Сопутствующая ИБС имела место у 5 больных в первой группе и у 4 – во второй. Время от разрыва аневризмы до оперативного вмешательства в среднем составило 48 ± 8 часов. При поступлении пациенты имели клинику геморрагического шока 1 степени. У всех больных диагностирована обширная забрюшинная гематома. Риск анестезии соответствовал IV-V степени по ASA. Средняя продолжительность операций колебалась от 5,5 до 7,5 часов. Объем интраоперационной кровопотери в группах был примерно одинаковым и равнялся в среднем 2100±250 мл. Инфузионно-трансфузионная терапия осуществлялась больным через 3 вены, из которых 1 или 2 были центральные. Во время операции всем больным производилась реинфузия крови в объеме от 400 до 600 мл и трансфузия эритроцитарной массы в объеме около 1000 мл. Пациентам 1 группы, в операционной, в положении на боку выполнялась катетеризация эпидурального пространства на уровне Th IX-VII. После введения тест дозы лидокаина (2% — 80 мг) и отсутствии признаков спинального блока, в эпидуральный катетер фракционно вводилось по 80 мг 2% лидокаина с интервалом в 10 минут до общей дозы не более 210 мг под тщательным контролем АД. После получения сенсорного блока в зоне предстоящей операции, осуществлялась индукция в наркоз (фентанил – 0,0012 мг/кг, пропофол – 2,5 мг/кг, кетамин – 0,35 мг/кг), вводился листенон (1,5 мг/кг) и больной переводился на ИВЛ. Поддержание анестезии: пропофол – 4 мг/кг/час, кетамин – 0,5 мг/кг/час, N2O — 50%. Миоплегия достигалась введением ардуна в дозе 0,3 мг/кг. Анальгетический компонент достигался эпидуральным введением 0,5% раствора маркаина в общей дозе до 100 мг. Действие эпидуральной блокады пролонгировалось на ранний послеоперационный период до трех суток. Во 2 группе больных использовалась комбинированная общая анестезия: фентанил 0,0026 мг/кг/ч, реланиум 0,07 мг/кг/ч, кетамин 0,9 мг/кг/ч, N2O — 50%, фторотан 0,5- 1 об/%. Миоплегия – ардуан 0,3 мг/кг. Для послеоперационного обезболивания использовались опиаты. Всем больным для контроля и поддержания АД, стимуляции диуреза во время операции отдельной инфузионной линией вводился допамин в дозах 1-3 мкг/кг/мин. Интраоперационный мониторинг включал измерение АД, ЦВД, ЧСС, ЭКГ, Sp O2, t 0 , Hb, Ht, диурез. Степень выраженности интра- и послеоперационного стресса оценивалась по изменению вегетативной регуляции сердечного ритма с помощью метода компьютерной ритмокардиографии (5). Изучались следующие показатели:
В раннем послеоперационном периоде проводилась оценка болевого синдрома по визуально-аналоговой шкале (ВАШ) боли. ^ Результаты исследования и их обсуждение. Данные, изменений параметров гемодинамики во время операции, представлены в таблице №1. Как видно из таблицы, грудная эпидуральная блокада у пациентов первой группы не вызвала существенного снижения артериального давления, более того в этой группе зафиксированы минимальные интраоперационные изменения АДс. Известно, что наиболее гемодинамически значимыми этапами операции в хирургии брюшной аорты являются наложение и снятие зажима с аорты (11, 17). В 1-ой группе при наложении зажима на аорту значения АДс были на 16,8% ниже, чем во 2-ой. При снятии зажима с аорты АДс в 1-ой группе снизилось на 15,2%, против 45% во 2 группе. Менее выраженная «гипотония снятия зажима» регистрируемая при эпидуральной анестезии, объясняется, на наш взгляд тем, что пациенты данной группы до рассматриваемого этапа операции получают в 1,5 — 2,0 раза больший объем инфузионной поддержки, чем в группе больных с общей анестезией. Данное обстоятельство позволяет не только существенно увеличить ОЦК, но значительно разбавить вымываемые из ранее ишемизированных участков нижних конечностей продукты метаболизма и тем самым снизить проявления синдрома реперфузии. Исходно низкие показатели ЦВД у пациентов 1 и 2 групп подтверждали наличие выраженной гиповолемии. Анализ ЧСС выявил, что во 2 группе у больных на протяжении всей операции отмечалась тенденция к тахикардии. У пациентов 1 группы, по мере развития грудной эпидуральной блокады, имеющаяся исходная тахикардия переходила в нормо- и даже в брадикардию, легко купируемую допамином. Параметры гемодинамики на этапах операции
По объему интраоперационной инфузионно-трансфузионной терапии анализируемые группы существенно отличались друг от друга. В 1 группе общий объем инфузии за операцию составил в среднем 8800±450 мл, при диурезе 120±10 мл/ч. Во 2 группе объем инфузии составил 6250±620 мл, при диурезе 60±12 мл/ч. Динамика показателей красной крови на этапах операции представлена в таблице №2. Исходные данные Hb и Ht в группах мало отличались друг от друга. На этапе доступа к аорте, за счет большего объема инфузионной терапии, в 1 группе отмечалась и большая степень гемодилюции, что привело к значительному снижению Hb и Ht по сравнению со 2 группой. Однако, благодаря этому, больные 1 группы на основном этапе оперативного вмешательства теряли более анемизированную кровь, чем пациенты 2 группы. В результате чего, после операции, показатели Hb и Ht в 1 группе были выше аналогичных показателей во 2 группе соответственно на 16,4% и 24,2% . Показатели красной крови в группах
Степень выраженности интра- и послеоперационного стресса, оцениваемая по данным изменений индекса напряжения (ИН) представлена в таблице №3. Как видно из таблицы, перед операцией у всех пациентов регистрировалось повышение активности симпатадренергического звена вегетативной нервной системы. Значения ИН превышали нормальные значения в 1,5 – 2 раза, что является следствием таких факторов как гиповолемический шок, болевой синдром, психоэмоциональный стресс. В дальнейшем, в первой группе, отмечалась нормализация показателей ИН. У данных пациентов даже во время травматичного этапа операции не наблюдалось усиления симпатических влияний на сердечный ритм. Значения ИН в 1 группе были в 4 раза ниже аналогичных данных во 2 группе. Динамика индекса напряжения (ИН) в группах
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||




