ЧТО ТАКОЕ АНЕМИЯ?
Анемия — состояние, характеризующееся снижением концентрации гемоглобина (менее 130 г/л у мужчин и 120 г/л у женщин) и гематокрита (менее 39% у мужчин и 36% у женщин). Обычно при этом также происходит и снижение количества красных кровяных телец (эритроцитов).
Различные виды анемий выявляются у 10-20% населения, в большинстве случаев у женщин. Наиболее часто встречаются анемии, связанные с дефицитом железа (около 90% всех анемий), реже анемии при хронических заболеваниях, еще реже анемии, связанные с дефицитом витамина В12 или фолиевой кислоты (мегалобластные), гемолитические и апластические. Необходимо помнить, что анемия может иметь сложное происхождение. Возможно сочетание железодефицитной и В12-дефицитной анемий.
КЛАССИФИКАЦИЯ АНЕМИЙ
В клинической практике наиболее распространена следующая классификация анемий:
- Анемии, обусловленные острой кровопотерей
- Анемии вследствие нарушения продукции эритроцитов
- Апластические
- Железодефицитные
- Мегалобластные
- Сидеробластные
- Хронических заболеваний
- Анемии вследствие повышенного разрушения эритроцитов
- Гемолитические
В зависимости от выраженности снижения уровня гемоглобина выделяют три степени тяжести анемии:
- Легкая — уровень гемоглобина выше 90 г/л;
- Средняя — гемоглобин в пределах 90-70 г/л;
- Тяжелая — уровень гемоглобина менее 70 г/л.
ОБЩИЕ СИМПТОМЫ АНЕМИЙ
- Слабость, повышенная утомляемость, снижение работоспособности, раздражительность, сонливость
- Головокружение, головные боли, шум в ушах, мелькание «мушек» перед глазами,
- Сердцебиение при небольшой физической нагрузке или в покое
- Одышка при небольшой физической нагрузке или в покое
Нередко первой жалобой у пожилых пациентов, страдающих ишемической болезнью сердца, является учащение приступов стенокардии, даже после небольшой физической нагрузки. Характер и выраженность жалоб при анемии разнообразны и зависят от вида, степени тяжести анемии, скорости ее развития и индивидуальных особенностей больного.
ДИАГНОСТИКА АНЕМИЙ
Для выявления анемии необходимы:
- Врачебный осмотр
- Общий клинический анализ крови с обязательным определением:
- Количества эритроцитов
- Количества ретикулоцитов
- Гемоглобина
- Гематокрита
- Среднего объема эритроцитов (MCV)
- Ширины распределения эритроцитов по объему (RDW)
- Среднего содержания гемоглобина в эритроците (MCH)
- Средней концентрации гемоглобина в эритроците (MCHC)
- Количества лейкоцитов
- Количества тромбоцитов
Дополнительные методы исследования используются для более детальной диагностики отдельных видов анемии.
ЖЕЛЕЗОДЕФИЦИТНАЯ АНЕМИЯ
ДИАГНОСТИКА
Для диагностики железодефицитной анемии необходимо проведение дополнительных исследований:
- Определение уровня железа сыворотки крови, ферритина и насыщенных трансферринов; общей железосвязывающей способности и ненасыщенных трансферринов.
- Аспирационная биопсия костного мозга не является обязательным исследованием для диагностики железодефицитной анемии и проводится лишь по особым показаниям.
ОСНОВНЫЕ ПРИНЦИПЫ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ
- Ликвидация причины, вызвавшей дефицит железа.
- Диета с высоким содержанием железа (мясо, печень и др.).
- Длительный прием препаратов железа (4-6 мес.).
- Парентеральные препараты железа (по показаниям).
- Переливания эритроцитарной массы при тяжелой анемии.
- Профилактический прием препаратов железа в группах риска.
В12-ДЕФИЦИТНАЯ АНЕМИЯ
ДИАГНОСТИКА
Для диагностики В12-дефицитной анемии необходимо проведение дополнительных исследований:
- Определение уровня витамина В12 в крови.
- Аспирационная биопсия костного мозга (при отсутствии возможности определения витамина В12 в крови, либо при отсутствии ответа на лечение в течение 5-8 дней).
ОСНОВНЫЕ ПРИНЦИПЫ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ
- Заместительная терапия.
- Сбалансированная диета.
ФОЛИЕВОДЕФИЦИТНАЯ АНЕМИЯ
ДИАГНОСТИКА
Для диагностики фолиеводефицитной анемии необходимо проведение дополнительных исследований:
- Определение уровня фолиевой кислоты в сыворотке и эритроцитах.
- Показания для проведения аспирационной биопсии костного мозга такие же, как и при В12-дефицитной анемии.
ОСНОВНЫЕ ПРИНЦИПЫ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ
- Профилактическое назначение фолиевой кислоты беременным; больным, принимающим противосудорожные препараты и некоторые другие медикаменты.
- Назначение лечебной дозы фолиевой кислоты при заместительной терапии
.
АНЕМИЯ ПРИ ХРОНИЧЕСКИХ ЗАБОЛЕВАНИЯХ
ДИАГНОСТИКА
Для диагностики анемии при хронических заболеваниях необходимо проведение дополнительных исследований:
- Определение уровня железа сыворотки крови, общей железосвязывающей способности и степени насыщения трансферрина, уровня ферритина сыворотки крови, уровня эритропоэтина в крови.
- Аспирационная биопсия костного мозга проводится по показаниям.
- Исследования, направленные на диагностику основного заболевания, вызвавшего анемию.
ОСНОВНЫЕ ПРИНЦИПЫ ЛЕЧЕНИЯ
- Лечение основного заболевания.
- Лечение рекомбинантным эритропоэтином
- Назначение фолиевой кислоты при ее дефиците.
ПРИОБРЕТЕННАЯ ГЕМОЛИТИЧЕСКАЯ АНЕМИЯ
ДИАГНОСТИКА
Для диагностики приобретенной гемолитической анемии необходимо проведение дополнительных исследований:
- Определение содержания свободного и связанного билирубина в сыворотке крови и моче.
- Определение осмотической стойкости эритроцитов.
- Проведение прямой пробы Кумбса.
ОСНОВНЫЕ ПРИНЦИПЫ ЛЕЧЕНИЯ
- Глюкокортикостероиды.
- Спленэктомия (удаление селезенки).
- Иммунодепрессанты.
- Антилимфоцитарный глобулин.
- Плазмаферез.
Как правило, перечисленные методы лечения приобретенной гемолитической анемии используются последовательно. Плазмаферез является дополнительным методом и может сопровождать любое медикаментозное или хирургическое лечение. При тяжелых формах заболевания, не отвечающих на вышеперечисленные методы лечения, может быть проведена высокодозная иммуносупрессивная терапия с последующим использованием колониестимулирующих факторов и/или кроветворных стволовых клеток.
АПЛАСТИЧЕСКАЯ АНЕМИЯ
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ
Клинические проявления при апластической анемии, особенно, при тяжелой и крайне тяжелой формах, помимо общих симптомов, характерных для всех анемий, во многом схожи с таковыми при острых лейкозах:
- Кровоточивость
- Склонность к инфекциям
ДИАГНОСТИКА
Для диагностики апластической анемии необходимо проведение дополнительных исследований:
- Аспирационная биопсия костного мозга (цитологическое исследование)
- Трепанобиопсия костного мозга (гистологическое исследование)
- Цитогенетическое исследование клеток костного мозга и периферической крови
ОСНОВНЫЕ ПРИНЦИПЫ ЛЕЧЕНИЯ:
Лечение больных тяжелой и крайне тяжелой апластической анемией начинают сразу после подтверждения диагноза. Терапия должна проводиться в специализированном гематологическом стационаре, имеющем необходимый опыт работы и соответствующее оснащение. Размещение должно проводиться в палатах не более чем на 2-х человек, с туалетом и душем. Важную роль играет вентиляция, обеспечивающая быстрое удаление из воздуха микробных тел, представляющих опасность для больных апластической анемией.
Основными методами лечения апластической анемии являются:
- Аллогенная трансплантация костного мозга — при наличии родственного донора.
- Комбинированная иммуносупрессивная терапия (антилимфоцитарный или антитимоцитарный глобулин, сандиммун)
- Заместительная терапия компонентами крови (эритроциты, тромбоциты),
- Профилактика и лечение инфекционных осложнений (антибактериальная, противогрибковая и противовирусная терапия)
источник
Отмечается эритропения, снижение содержания гемоглобина до 30-40 г/л, анизоцитоз, пойкилоцитоз, гипохромия, снижение ретикулоцитарного индекса, лейкопения за счет снижения количества нейтрофилов.
Патогномоничный признак железодефицита в костном мозге – резкое снижение местных запасов железа (снижается количество сидеробластов – клеток, содержащих гранулы железа). Отмечается умеренная гиперплазия эритроидного ростка. Гемоглобинизация клеток эритрона нарушена: увеличено количество базофильных и полихроматофильных форм, снижено количество оксифильных. По мере истощения запасов железа ферритин и гемосидерин исчезают и из костного мозга, и из других мест хранения.
Особую роль в диагностике играют биохимические показатели:
Уровень ферритина сыворотки снижен – менее 12 нг/мл.
Увеличена общая железосвязывающая способность.
Увеличена ненасыщенная, латентная железосвязывающая способность.
Резко снижено насыщение трансферрина.
Витамин В12 содержится в мясе, яйцах, сыре, молоке, почках, печени. Витамин В12 в продуктах связан с белком, от которого он освобождается в процессе кулинарной обработки и под воздействием протеолитических ферментов ЖКТ, после чего он связывается в желудке с внутренним фактором Кастла. Внутренний фактор – это гликопротеид, который образуется в фундальной части и в области тела желудка париетальными клетками. Комплекс «витамин В12 – фактор Кастла» связывается со специфическими рецепторами клеток подвздошной кишки. Витамин В12 всасывается медленно, за сутки может всосаться не более 6-9 мкг. Незначительная часть витамина В12 может всосаться без фактора Кастла.
Витамин В12 в плазме связывается с транскобаламинами. Известно три транскобаламина – I, II, III. Основное количество витамина переносится транскобаламином II. Этот белок синтезируется в печени.
Содержание витамина В12 в организме здорового человека составляет 2-5 мг, депо находится в печени. Запасы витамина В12 настолько велики, что их хватает на 3-6 лет.
Все клетки организма имеют рецепторы для комплекса «транскобаламин II – витамин В12».
У человека выявлены две метаболически активные формы витамина В12:
1. Метилкобаламин. Эта активная форма обеспечивает нормальное эритробластическое кроветворение и нормально протекающие метотические процессы в других клетках организма. В ходе реакции с метилкобаламином из уридинмонофосфата образуется тимидинмонофосфат, который включается в ДНК. Необходимым условием для течения этой реакции является участие активной коферментной формы фолиевой кислоты – 5, 10 – метилен-тетрагидрофолиевой кислоты.
Метилкобаламин участвует в метилировании гомоцистеина в метионин.
2. 5-дезоксиаденозилкобаламин. Этот метаболит необходим для нормального обмена жирных кислот. Так при распаде некоторых жирных кислот образуется пропионовая кислота. Распад пропионовой кислоты обеспечивается рядом ферментативных реакций, в ходе которых синтезируются производные янтарной кислоты, входящие в цикл Кребса. Одним из промежуточных продуктов является метилмалоновая кислота. Метилмалоновая кислота образуется также при распаде валина и метионина. 5-дезоксиаденозилкобаламин участвует в образовании янтарной кислоты из метилмалоновой. Предполагается участие аденозилкобаламина в биосинтезе миелина. При дефиците витамина В12 накапливается избыток пропионовой и метилмалоновой кислот. Они переходят в жирные кислоты с физиологическим нечетным числом атомов углерода в молекуле. Включаясь в липиды нейронов, они нарушают процессы миелинизации и вызывают жировую дистрофию клеток.
источник
Железодефицитные анемии (сидеропенические) – анемии, обусловленные дефицитом железа в сыворотке крови и костном мозге, что сопровождается нарушением синтеза гема, образования гемоглобина и эритроцитов, развитием трофических изменений в органах и тканях.
Железо участвует в транспорте кислорода, окислительно-восстановительных процессах, защитных реакциях. В организме взрослого человека содержится 3-5 г железа. Основная часть (70%) входит в состав гемоглобина, остальное количество содержится в клетках разных органов, входит в состав дыхательных ферментов.
Суточная потеря железа организмом незначительная – около 1 мг (с потом, мочой, волосами, слущенным эпителием кишечника, желчью). Женщины в период менструации теряют 5-15 мг железа.
Суточная потребность взрослого человека в железе, необходимая для поддержания нормального биосинтеза гемоглобина, составляет 15-30 мг. При этом большая часть железа поступает из печени – это, так называемое, эндогенное железо, освобождающееся при распаде эритроцитов в селезенке и поступающее по воротной вене в печень.
Основным источником восстановления утерянного железа является пища. Особенно богаты железом телятина и печень. В желудке под действием соляной кислоты трехвалентное железо переходит в двухвалентное, которое легко всасывается. Всасывание железа происходит в двенадцатиперстной кишке и в верхних отделах тощей кишки.
Железодефицитные анемии являются наиболее распространенными анемиями, составляя более 80% всех анемий. Встречаются преимущественно у детей младшего возраста, у девушек-подростков, женщин детородного возраста. Распространенность железодефицитных анемий составляет 12-20% среди всего населения, у подростков – до 50%, у женщин детородного возраста – до 30%.
Этиология железодефицитных анемий:
§ хронические кровопотери (острые кровопотери протекают без дефицита железа!);
§ пониженное всасывание железа;
§ перераспределенный дефицит железа при инфекциях;
§ недостаточное поступление железа в организм;
§ нарушение транспорта железа в костный мозг.
Стадии: латентная (дефицит железа без признаков анемии) и явная.
Имеет место общеанемический синдром.
Независимо от причин дефицита железа выделяют ряд трофических (сидеропенических) расстройств:
§ мышечная слабость, снижение мышечной силы, атрофия мышц;
§ ногти ломкие, мягкие, истончены, расслаиваются, с продольной и поперечной исчерченностью, часто плоские (платонихии), с приподнятыми или вогнутыми ложкообразными краями (койлонихии);
§ кожа бледная, сухая, особенно на лице и кистях рук, ангулярный стоматит (трещины углов рта, заеды, хейлоз);
§ волосы сухие, ломкие, выпадают, растут медленно, концы их секутся;
§ глоссит – язык ярко-красный, блестящий, отечный, болезненный, с гладкой поверхностью, сосочки сглажены или отсутствуют;
§ атрофический эзофагит (дисфагия, хрипота);
§ кариес зубов и их крошение, неправильный рост, стираемость эмали;
§ извращение вкуса и обоняния, пристрастие к несъедобным вещам (мел, зубной порошок, глина, древесный уголь, тесто, крупы, сырое мясо и др.), атрофические изменения слизистой оболочки желудка;
§ атрофия слизистой оболочки гениталий, сопровождающаяся гипер-, гипо- и аменореей;
§ императивные позывы на мочеиспускание, сфинктерные нарушения.
Синдром эндогенной метаболической интоксикации проявляется нарушением терморегуляции (длительный субфебрилитет), психоэмоциональными нарушениями, предрасположенностью к респираторным заболеваниям, хронизации инфекции.
Обращает внимание бледность кожных покровов и слизистых оболочек, появление желтоватого оттенка вокруг глаз, тахикардия, гипотония, функциональный систолический шум на верхушке из-за нарушения вязкости крови на фоне звучных тонов, возможно появление периферических отеков, «мешков» под глазами по утрам. При выраженной анемии может определяться «шум волчка» над шейными венами.
В общем анализе крови наблюдается гипохромная анемия, иногда ускорение СОЭ. Наблюдается микроцитоз эритроцитов, иногда анизоцитоз (изменения по диаметру), пойкилоцитоз (изменения по форме). В сыворотке крови снижено содержание железа (в норме 12,5-30,4 мкмоль/л). При железодефицитной анемии нарушается также обмен меди, кобальта и марганца.
Железодефицитная анемия может осложняться миокардиодистрофией с аритмиями и недостаточностью кровообращения.
Диагностические критерии: наличие анемического и сидеропенического синдромов, гипохромной анемии в ОАК, дефицита железа в сыворотке крови.
В отличие от железодефицитных встречаются и железонасыщенные анемии (сидероахрестические) – анемии с низким содержанием железа в эритроцитах (гипохромией) не вследствие его дефицита в организме, а в результате дефицита или отсутствия ферментов, участвующих в синтезе гема (порфиринов).
Нарушение синтеза порфиринов может быть наследственной природы (по рецессивному типу, сцеплено с полом, встречается преимущественно у мальчиков) и приобретенной (у лиц, имеющий производственный контакт со свинцом, кадмием, никелем, токсическими веществами). В общем анализе крови – гипохромная анемия, в биохимическом анализе – уровень сывороточного железа повышен.
3. Диагностика В12— и фолиеводефицитной анемии
B12-дефицитная анемия – заболевание, обусловленное нарушением кроветворения из-за недостатка в организме витамина B12. Особенно чувствительны к дефициту этого витамина костный мозг и ткани нервной системы.
В 1855 году английский врач Томас Аддисон, а затем в 1872 году более подробно немецкий врач Антон Бирмер описали болезнь, которую назвали злокачественной (пернициозной) анемией. Вскоре французский врач Арман Труссо предложил называть эти болезни аддисоновой анемией и болезнью Аддисона.
В 1926 году Дж. Уипл, Дж. Майнот и У.Мёрфи сообщили, что пернициозная анемия лечится введением в рацион питания сырой печени и что в основе заболевания лежит врожденная неспособность желудка секретировать вещество, необходимое для всасывания витамина В12 в кишечнике. За это открытие они в 1934 году получили Нобелевскую премию.
Витамин В12 и фолиевая кислота оказывают гемостимулирующее действие, широко распространены в природе. Основное депо витаминов в организме – печень. Суточные потери этих витаминов ничтожны. Всасывается витамин В12 в дистальных отделах тонкого кишечника. Всасыванию, проникновению витамина В12 через кишечный барьер способствует так называемый внутренний фактор Касла – гастромукопротеин, секретирующийся обкладочными клетками дна и тела желудка. Фолиеводефицитная кислота всасывается в подвздошной кишке.
Этиология. Основной причиной В12 –дефицитной анемии является дефицит цианкобаламина и/или фолиевой кислоты с развитием мегалобластного типа кроветворения. Причины этого:
1.1. Неадекватная выработка внутреннего фактора Касла. Основной причиной дефицита витамина В12 (у 90% больных) является атрофический гастрит, приводящий к нарушению выработки внутреннего фактора Касла. Реже заболевание развивается после гастрэктомии или резекции желудка.
1.2. Заболевания подвздошной кишки (спру, энтерит, резекция подвздошной кишки, дивертикулез и др.), являющейся основным местом всасывания витамина В12.
2. Конкурентное поглощение витамина В12 при инвазии широким лентецом, дисбактериозе.
3. Приём ряда медикаментов (колхицин, аминосалициловая кислота).
4. Неадекватное поступление витамина В12 с пищей.
5. Нарушение синтеза и структуры транскобаламинов.
Мегалобластные анемии характеризуются ослаблением синтеза ДНК, в результате чего нарушается деление всех быстропролиферирующих клеток (гемопоэтических клеток, клеток кожи, клеток ЖКТ, слизистых оболочек). Кроветворные клетки относятся к наиболее быстро размножающимся элементам, поэтому анемия (нередко нейтропения и тромбоцитопения) выходят на первый план в клинике.
У взрослых особенно часто распространена эндогенная В12-дефицитная анемия (анемия Аддисона-Бирмера, пернициозная (от лат. perniciosus – гибельный, опасный), мегалобластная, злокачественное малокро́вие). Болеют чаще женщины старше 40 лет. Болезнь развивается исподволь, медленно, приобретая хроническое рецидивирующее течение.
Клинические признаки анемии неспецифичны: слабость, быстрая утомляемость, одышка, головокружение, сердцебиение. Больные бледны, субиктеричны.
Характерным симптомом является глоссит – язык гладкий, блестящий (лакированный) вследствие атрофии сосочков. Желудочная секреция резко снижена. При фиброгастроскопии выявляется атрофия слизистой оболочки желудка, которая подтверждается и гистологически. Клинически больной отмечает снижение аппетита, чувство тяжести в эпигастрии после еды, отрыжку пищей или воздухом. Пальпация живота сопровождается умеренной болезненностью в эпигастрии, нередко увеличиваются печень и селезенка.
Наблюдаются симптомы поражения нервной системы (фуникулярный миелоз), которые не всегда коррелируют с выраженностью анемии. В основе неврологических проявлений лежит демиелинизация нервных волокон. Отмечаются: слабость в ногах, особенно при подъеме по лестнице, парестезии, онемение конечностей, шаткость походки, ощущение ваты под ногами при ходьбе, периферическая полинейропатия (покалывание, жжение и/или боли в стопах и кистях), расстройства чувствительности, повышение сухожильных рефлексов.
Таким образом, для В12-дефицитной анемии характерна триада:поражение крови; ЖКТ; нервной системы.
1. Клинический анализ крови:
• снижение количества эритроцитов;
• повышение цветового показателя (выше 1,05);
• макроцитоз (макроцитарная анемия);
• наличие в эритроцитах базофильной зернистости и патологических включений: телец Жолли и колец Кэбота;
Базофильная зернистость (пунктация) эритроцитов – гранулы сине-фиолетового или синего цвета, различного размера, располагаются чаще по периферии эритроцита или нормобласта, представляет собой остатки рибосом.
Тельца Жолли(тельца Хауэлла-Жолли) – мелкие круглые фиолетово-красные включения размером 1-2 мкм, встречаются по 1 (реже по 2-3) в одном эритроците. Представляют собой остаток ядра после удаления его РЭС.
Кольца Кебота – остатки оболочки ядра в виде восьмерки или кольца, окрашиваются в красный цвет.
2. В окрашенных мазках – типичная картина: наряду с характерными овальными макроцитами встречаются эритроциты нормального размера, пойкило- и анизоцитоз.
3. Уровень билирубина в сыворотке повышен за счет непрямой фракции
4. Обязательна пункция костного мозга, т.к. такая картина на периферии может быть при лейкозе, гемолитической анемии, апластических и гипопластических состояниях (однако, гиперхромия характерна именно для В12-дефицитной анемии). В костном мозге находят типичные мегалобласты – главный критерий постановки диагноза В12-дефицитной анемии.
Фолиеводефицитная анемия чаще встречается у детей раннего возраста и молодых женщин. Среди клинических симптомов преобладают симптомы основного заболевания, осложнившегося анемией. Отмечаются общие анемические признаки, явления диареи, стеатореи. Редко наблюдаются поражение нервной системы, ахилия. В общем анализе крови изменения сходны с изменениями при анемии Аддисона-Бирмера. Для дифференциальной диагностики мазки костного мозга окрашивают ализарином красным. При этом окрашиваются только В12-дефицитные мегалобласты и не окрашиваются мегалобласты при дефиците фолиевой кислоты.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Для студента самое главное не сдать экзамен, а вовремя вспомнить про него. 9657 — 

193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Автор: Аверина Олеся Валерьевна, к.м.н., врач-патолог, преподаватель кафедры паталогической анатомии и патологической физиологии
Анализы крови, какими бы развернутыми они не были, не всегда способны дать полный объем информации о состоянии костного мозга и его функционировании, ведь в кровотоке обычно присутствуют уже зрелые клетки. Проследить характер кроветворения и морфологические особенности клеток крови позволяет стернальная пункция, посредством которой специалист получает образец костного мозга для исследования.
Красный костный мозг является важнейшей тканью организма, обеспечивающей созревание всех без исключения клеток крови. Он содержит стволовые элементы и клетки всех стадий созревания, которые после полноценного формирования выходят в периферическую кровь для обеспечения иммунитета, газообмена, тромбообразования и т. д.
У новорожденных детей красный костный мозг заполняет все кости, но по мере роста объем его уменьшается и к пятилетнему возрасту начинает замещаться жировым (желтым) костным мозгом. У взрослых людей кроветворная ткань сконцентрирована в грудине, костях таза, телах позвонков, длинных трубчатых костях, ребрах, где она доступна для аспирации с целью диагностики различных патологических состояний.
Термин «стернальная» подразумевает, что костный мозг будет взят из грудины, хотя его также можно получить из подвздошных костей или пяточных (у маленьких детей). Прокол грудины представляется довольно простым и безопасным способом диагностики при условии соблюдения всех мер предосторожности и техники выполнения манипуляции.
Поводом к исследованию пунктата костного мозга, полученного из грудины, становятся подозрение в отношении гематологических заболеваний, планирующаяся пересадка костного мозга, некоторые инфекционные процессы, когда другие рутинные обследования не дают достаточного объема информации. Стернальная пункция проводится при:
- Анемиях — тяжелая железодефицитная, мегалобластные, апластические.
- Опухолях кроветворной ткани — лейкозы, парапротеинемические гемобластозы.
- Миелодиспластическом синдроме.
- Лейкемоидных реакциях, когда картина периферической крови не позволяет исключить опухолевый рост.
- Болезнях накопления наследственной природы, обменных нарушениях (болезнь Гоше, Нимана-Пика).
- Висцеральном лейшманиозе.
- Подозрении на наличие метастазов других злокачественных новообразований в кости (рак простаты, например).
- Оценке эффективности лечения и контроле состояния у пациентов гематологического профиля.
- Исследовании и заготовке полученных стволовых клеток для трансплантации донору либо самому пунктируемому пациенту после курсов химиотерапии или облучения.
- Внутрикостном введении лекарственных препаратов.
Установленный диагноз хронического лейкоза в стадии обострения, а также железодефицитная анемия, диагностированная посредством рутинных обследований, служат относительными показаниями к пункции костного мозга, то есть в этих случаях от процедуры вполне можно отказаться.
Противопоказания к стернальной пункции тоже имеются:
- Тяжелые нарушения свертываемости крови.
- Пожилой возраст в случаях, когда стернальная пункция не является единственно возможным способом диагностики.
- Острые воспалительные и инфекционные поражения в месте предполагаемого прокола кожи.
- Отказ пациента от исследования.
- Тяжелые сопутствующие заболевания в стадии декомпенсации (вопрос о целесообразности пункции решается индивидуально).
Стернальная пункция не относится к разряду сложных процедур, она безопасна, не требует наркоза и проводится как в стационаре, так и в амбулаторных условиях. Подготовка к аспирации костного мозга грудины предельно проста:
- Пациент проходит исследование свертываемости крови и общий анализ не более, чем за 5 дней до планируемой манипуляции;
- За два часа до пункции возможен последний прием пищи и воды;
- Перед процедурой опорожняется мочевой пузырь и кишечник;
- Отменяются все лекарственные препараты, кроме тех, которые жизненно необходимы;
- В день пункции не назначаются никакие другие процедуры.
Перед манипуляцией пациент обязательно сообщает врачу обо всех принимаемых им препаратах, особенно это касается антикоагулянтов и других кроверазжижающих средств, которые должны быть отменены ввиду многократно возрастающего риска кровотечения на фоне их приема.
Специалист, который будет проводить стернальную пункцию, выясняет информацию о наличии аллергии на лекарства, так как потребуется введение анестетиков. Пациенту подробно рассказывают о сути пункции, ее назначении и смысле предстоящей операции. Врач предупреждает о возможной болезненности прокола и последующих мерах предосторожности. В обязательном порядке берется письменное согласие обследуемого (или родителей при пункции ребенка) на проведение процедуры.
Техника проведения стернальной пункции включает несколько этапов:
-
Укладывание пациента на спину, под лопатки помещают валик.
- Обработка места прокола растворами антисептиков (йод, этанол), у мужчин сбривается волосяной покров.
- Для обезболивания используют местные анестетики (лидокаин, новокаин), вводимые в кожу, подкожную клетчатку и периостальное пространство, поскольку прокол — мероприятие довольно болезненное, особенно, в момент прохождения иглы через надкостницу.
- Пункцию производят на уровне крепления к грудине третьего или четвертого ребра, по средней линии, используя иглу Кассирского, которую быстрым вкручивающим движением вводят в кость. При попадании во вместилище костного мозга врач ощутит как бы провал, который свидетельствует о прохождении иглы через поверхность кости. В момент погружения иглы сквозь компактный костный слой и аспирации костного мозга пациент почувствует кратковременную боль.
- Когда игла находится в костномозговом канале грудины, к ней подсоединяется шприц, посредством которого врач аспирирует 0,3 мл содержимого кости.
- После получения необходимого объема кроветворной ткани игла извлекается, а на место прокола накладывается стерильная салфетка или пластырь.
Особые меры предосторожности следует соблюдать при пунктировании грудины у детей. Кость у них более мягкая и эластичная, поэтому неосторожными действиями ее можно проколоть насквозь. По возможности, ребенок должен быть обездвижен, чтобы его движения не нарушили процесс пункции грудины.
Особенности пункции грудины у детей:
- Стернальный прокол возможен только с двух лет;
- Используются специальные иглы меньшего, нежели для взрослых, диаметра;
- Возможна общая анестезия.
Пожилые люди, пациенты, длительно получающие кортикостероидные препараты, могут страдать остеопорозом, поэтому к ним также применимы меры предосторожности сквозного прокола, который возможен в связи с уменьшением плотности костной ткани.
Процедура пункции грудины в редких случаях проводится без анестезии — если без нее не обойтись, а у пациента есть абсолютные противопоказания к введению анестетиков. В такой ситуации больного предупреждают о болезненности манипуляции, возможно применение транквилизаторов перед процедурой и анальгетиков.
Полученный посредством прокола грудины костный мозг помещается на предметное стекло, далее изготавливается цитологический препарат, который оценивает специалист-цитолог. При диагностике гематологической патологии последний обращает внимание на строение клеток крови, их численность, степень зрелости, соотношение различных элементов в общем объеме пунктата.
Извлеченный из грудины костный мозг можно также подвергнуть цитохимическому, иммунологическому, гистологическому исследованию. Гистологическая оценка пунктата дает больше возможностей оценить соотношение жирового и активного костного мозга, состояние сосудистого компонента и клеточных элементов разной степени зрелости.
Результаты стернальной пункции могут быть получены в тот же день, если предполагается цитологическое исследование мазка костного мозга. При гистологическом анализе и других более технически сложных исследованиях диагностика растягивается на срок 7-10 дней.
Вышеописанный способ стернальной пункции был предложен в 1927 году Аринкиным М. И. и практикуется по сей день. Игла Кассирского успешно используется гематологами уже не один десяток лет. Она прочная, широкая, имееет удобную при введении съемную рукоятку, а также снабжена ограничителем, препятствующим движению иглы чрезмерно глубоко.
Процедура взятия костного мозга длится примерно 20 минут, после нее пациент находится под наблюдением около часа, контролируется общее самочувствие, пульс и артериальное давление. В тот же день можно покинуть лечебное учреждение, но крайне нежелательно садиться за руль, поскольку есть вероятность обморочных состояний.
Место прокола не требует никакой обработки в домашних условиях, однако первые трое суток рекомендуется исключить водные процедуры, чтобы не занести в пункционное отверстие инфекцию. Каких-либо ограничений в режиме и питании стернальная пункция не предполагает. При сильной болезненности в месте прокола пациент может принять обезболивающий препарат.
Соблюдение точной техники стернальной пункции, использование иглы Кассирского с ограничителем, обработка места прокола антисептиками практически исключают вероятность осложнений. В редких случаях возможны неблагоприятные последствия в виде:
- Сквозного прокола (у ребенка или больного с остеопорозом);
- Кровотечения из места пункции;
- Инфицирования места прокола (крайне редко);
- Обморочных состояний у эмоционально лабильных лиц, гипотоников, при недостаточно тщательной психологической подготовке пациента к манипуляции;
- Шока в случае тяжелой патологии сердечно-сосудистой системы, у лиц преклонного возраста.
В целом, процедура пункции грудины переносится легко и чрезвычайно редко сопровождается осложнениями. Отзывы пациентов в большинстве своем положительны, а самочувствие и отношение к манипуляции во многом зависят от качества подготовки и грамотной беседы врача с больным. Кто-то отмечает выраженную болезненность и в момент прокола и взятия материала из грудины, и в последующие 2-3 дня, другие ощущают лишь небольшой дискомфорт.
Анализ костного мозга, полученного посредством стернальной пункции, показывает количество в нем клеточных элементов, их соотношение и степень зрелости. Миелограмма характеризует качественные и количественные показатели белого ростка кроветворения:
- Миелокариоциты (общее число клеток крови, содержащих ядра) составляют 50-250х10 9 в пересчете на литр крови;
- Мегакариоциты (предшественники тромбоцитов) — 0,054-0,074х10 6 в литре;
- Ретикулоциты (предшественники эритроцитов) составляют 20-30% и увеличиваются при кровопотерях и гемолитических анемиях;
- Бластные клетки — 0,1-1,1%, миелобласты — 0,2-1,7%, промиелоциты — 0,5-8,0% от всех элементов белого ростка костного мозга, лимфоциты — 1,2-1,5%, моноциты — 0,25-2,0%, плазмоциты — не более 1%.
Уменьшение числа миелокарио- и мегакариоцитов возможно при погрешностях в выполнении пункции, когда костный мозг разбавляется жидкой кровью.
Специалист, изучающий пунктат костного мозга, отражает в заключении тип кроветворения, клеточность, индексы костного мозга, присутствие и количество нехарактерных клеток (например, Ходжкина при лимфогранулематозе). Отдельно анализируется каждый из ростков.
Для оценки количественного содержания каждой разновидности костномозговых клеток подсчитывают их соотношение в 500 клетках. Важным показателем является костномозговой индекс созревания нейтрофилов, который вычисляют путем деления общего числа клеток-предшественниц белого ростка на суммарное число палочкоядерных и сегментоядерных нейтрофилов. В норме показатель равен 0,6-0,8.

После вычисления количества гранулоцитов и общего числа клеток красного ростка, содержащих ядра, высчитывают их соотношение, которое в норме составляет 3-4:1 — лейко-эритробластическое соотношение.
Индексы костного мозга позволяют объективизировать данные об абсолютных цифрах и процентном содержании конкретных клеточных популяций. Так, увеличение лейко-эритробластического индекса характерно для гиперплазии белого ростка кроветворения, что наблюдается при хронических лимфо- и миелобластных лейкозах, инфекционных заболеваниях, интоксикациях, а также оно может говорить о гипопластической анемии при общем обеднении костномозговой ткани.
Уменьшение лейко-эритробластического индекса показательно для гемолитических, постгеморрагических и мегалобластных анемий (при нормальной клеточности костного мозга), а в случае обеднения костного мозга свидетельствует об агранулоцитозе (снижение лейкоцитарного ряда).
Нормальное значение указанного соотношения может говорить либо о полном здоровье, либо об аплазии и гипоплазии костномозговой ткани, когда наблюдается более или менее равномерное снижение числа клеток и белого, и красного ростка, поэтому так важно не проводить изолированных оценок только миелограммы во избежание диагностических ошибок.
Индекс созревания нейтрофилов при достаточной клеточности пунктата повышается при опухолях кроветворной ткани (лейкозы), отравлениях лекарствами, а снижение его обычно характеризует разведение костного мозга вследствие погрешностей при выполнении пункции.
Описанные критерии миелограммы позволяют оценить гемопоэз в целом, но заключение специалиста не должно быть категоричным. Важно соотнести результаты исследования стернального пунктата с особенностями клинической картины и данными анализа периферической крови.
Особенно следует предостеречь пациентов и их родственников от самостоятельной оценки результатов, которые могут попасть им в руки. Подобная самодеятельность обычно влечет ошибочные выводы, которые могут только навредить пациенту. Анализ показателей костномозгового пунктата — сложный процесс, требующий предельного внимания исключительно со стороны специалиста в этой области, который точно сможет указать, есть ли изменения и стоит ли беспокоиться.
источник

Железодефицитная анемия является самой распространенной патологией системы крови и самой часто встречаемой анемией. По данным ВОЗ (всемирной организации здравоохранения), более 2 миллиардов людей на планете имеют дефицит железа в организме. Несколько чаще данным недугом страдают женщины, что связано с беременностью, кормлением грудью, а также периодической кровопотерей во время менструаций.
Интересные факты
- Первое задокументированное упоминание о железодефицитной анемии датируется 1554 годом. В те времена данным недугом страдали преимущественно девушки 14 – 17 лет, в связи с чем заболевание называлось «de morbo virgineo», что в переводе означает «болезнь девственниц».
- Первые попытки лечения заболевания препаратами железа были предприняты в 1700 году.
- Латентный (скрытый) дефицит железа может отмечаться у детей в период интенсивного роста.
- Потребность в железе у беременной женщины в два раза больше, чем у двух здоровых взрослых мужчин.
- За время беременности и родов женщина теряет более 1 грамма железа. При обычном питании данные потери восстановятся лишь через 3 – 4 года.
Размер зрелого эритроцита колеблется в пределах от 7,5 до 8,3 микрометров (мкм). Он имеет форму двояковогнутого диска, которая поддерживается благодаря наличию в клеточной мембране эритроцита особого структурного белка – спектрина. Такая форма обеспечивает максимально эффективный процесс газообмена в организме, а наличие спектрина позволяет эритроцитам видоизменяться при прохождении через мельчайшие кровеносные сосуды (капилляры) и после этого восстанавливать свою первоначальную форму.
Более 95% внутриклеточного пространства эритроцита заполнено гемоглобином – веществом, состоящим из белка глобина и небелкового компонента – гема. Молекула гемоглобина состоит из четырех глобиновых цепей, в центре каждой из которых находится гем. Каждый эритроцит содержит более 300 миллионов молекул гемоглобина.
За транспортировку кислорода в организме отвечает небелковая часть гемоглобина, а именно атом железа, входящего в состав гема. Обогащение крови кислородом (оксигенация) происходит в легочных капиллярах, при прохождении через которые каждый атом железа присоединяет к себе 4 молекулы кислорода (формируется оксигемоглобин). Оксигенированная кровь разносится по артериям ко всем тканям организма, где происходит переход кислорода к клеткам органов. Взамен из клеток выделяется углекислый газ (побочный продукт клеточного дыхания), который присоединяется к гемоглобину (формируется карбгемоглобин) и по венам транспортируется к легким, где выделяется в окружающую среду вместе с выдыхаемым воздухом.
Помимо переноса дыхательных газов, дополнительными функциями эритроцитов являются:
- Антигенная функция. Эритроциты обладают собственными антигенами, которые определяют принадлежность к одной из четырех основных групп крови (по системе АВ0).
- Транспортная функция. К наружной поверхности мембраны эритроцитов могут прикрепляться антигены микроорганизмов, различные антитела и некоторые медикаменты, которые разносятся с током крови по всему организму.
- Буферная функция. Гемоглобин принимает участие в поддержании кислотно-щелочного равновесия в организме.
- Остановка кровотечений. Эритроциты включаются в состав тромба, формирующегося при повреждении сосудов.
В организме человека эритроциты формируются из так называемых стволовых клеток. Эти уникальные клетки образуются на стадии эмбрионального развития. Они содержат ядро, в котором находится генетический аппарат (ДНК – дезоксирибонуклеиновая кислота), а также множество других органелл, обеспечивающий процессы их жизнедеятельности и размножения. Стволовые клетки дают начало всем клеточным элементам крови.
Для нормального процесса эритропоэза необходимы:
- Железо. Данный микроэлемент входит в состав гема (небелковой части молекулы гемоглобина) и обладает способностью обратимо связывать кислород и углекислый газ, что и определяет транспортную функцию эритроцитов.
- Витамины (В2, В6, В9 и B12). Регулируют образование ДНК в кроветворных клетках красного костного мозга, а также процессы дифференцировки (созревания) эритроцитов.
- Эритропоэтин. Гормональное вещество, вырабатываемое почками, которое стимулирует процесс образования эритроцитов в красном костном мозге. При уменьшении концентрации красных кровяных телец в крови развивается гипоксия (недостаток кислорода), что является основным стимулятором выработки эритропоэтина.
Образование эритроцитов (эритропоэз) начинается в конце 3 недели эмбрионального развития. На ранних этапах внутриутробного развития красные клетки крови образуются, в основном, в печени и селезенке. Примерно на 4 месяце беременности происходит миграция стволовых клеток из печени в полости костей таза, черепа, позвонков, ребер и других, в результате чего в них формируется красный костный мозг, который также принимает активное участие в процессе кроветворения. После рождения ребенка кроветворная функция печени и селезенки угнетается, и костный мозг остается единственным органом, обеспечивающим поддержание клеточного состава крови.
В процессе превращения в эритроцит, стволовая клетка претерпевает целый ряд изменений. Она уменьшается в размерах, постепенно теряет ядро и практически все органеллы (в результате чего дальнейшее ее деление становится невозможным), а также накапливает гемоглобин. Конечным этапом эритропоэза в красном костном мозге является ретикулоцит (незрелый эритроцит). Он вымывается из костей в периферический кровоток, и в течение суток происходит его созревание до стадии нормального эритроцита, способного в полной мере выполнять свои функции.
Средняя продолжительность жизни красных клеток крови составляет 90 – 120 дней. По истечении этого периода их клеточная мембрана становится менее пластичной, в результате чего теряет способность обратимо деформироваться при прохождении через капилляры. «Старые» эритроциты захватываются и разрушаются особыми клетками иммунной системы – макрофагами. Данный процесс происходит, в основном, в селезенке, а также (в значительно меньшей степени) в печени и красном костном мозге. Незначительно малая доля эритроцитов разрушается непосредственно в сосудистом русле.
При разрушении эритроцита из него выделяется гемоглобин, который быстро распадается на белковую и небелковую части. Глобин подвергается ряду превращений, в результате чего формируется пигментный комплекс желтого цвета – билирубин (несвязанная форма). Он нерастворим в воде и весьма токсичен (способен проникать в клетки организма, нарушая процессы их жизнедеятельности). Билирубин быстро транспортируется в печень, где связывается с глюкуроновой кислотой и выводится вместе с желчью.
Небелковая часть гемоглобина (гем) также подвергается разрушению, в результате чего происходит выделение свободного железа. Оно токсично для организма, поэтому быстро связывается с трансферрином (транспортным белком крови). Большая часть железа, выделяющегося при разрушении эритроцитов, транспортируется в красный костный мозг, где повторно используется для синтеза эритроцитов.
В организме взрослого человека содержится около 4 грамм железа. Эта цифра варьирует в зависимости от пола и возраста.
Концентрация железа в организме составляет:
- у новорожденных – 75 мг на 1 килограмм массы тела (мг/кг);
- у мужчин – более 50 мг/кг;
- у женщин – 35 мг/кг (что связано с ежемесячной потерей крови).
Основными местами содержания железа в организме являются:
- гемоглобин эритроцитов – 57%;
- мышцы – 27%;
- печень – 7 – 8%.
Кроме того, железо входит в состав целого ряда других белковых ферментов (цитохромов, каталазы, редуктазы). Они участвуют в окислительно-восстановительных процессах в организме, в процессах клеточного деления и регуляции многих других реакций. Дефицит железа может привести к недостатку данных ферментов и появлению соответствующих нарушений в организме.
Всасывание железа в организме человека происходит преимущественно в двенадцатиперстной кишке, при этом все железо, поступающее в организм, принято разделять на гемовое (двухвалентное, Fe +2 ), содержащееся в мясе животных и птиц, в рыбе, и негемовое (трехвалентное, Fe +3 ), основным источником которого являются молочные продукты и овощи. Важным условием, необходимым для нормального всасывания железа, является достаточное количество соляной кислоты, входящей в состав желудочного сока. При уменьшении ее количества всасывание железа значительно замедляется.
Всосавшееся железо связывается с трансферрином и транспортируется в красный костный мозг, где используется для синтеза эритроцитов, а также к органам-депо. Запасы железа в организме представлены, в основном, ферритином – комплексом, состоящим из белка апоферритина и атомов железа. Каждая молекула ферритина содержит в среднем 3 – 4 тысячи атомов железа. При снижении концентрации данного микроэлемента в крови, происходит выделение его из ферритина и использование для нужд организма.
Скорость всасывания железа в кишечнике строго ограничена и не может превышать 2,5 мг в сутки. Этого количества достаточно лишь для того, чтобы восстанавливать ежедневные потери данного микроэлемента, которые в норме составляют около 1 мг у мужчин и 2 мг у женщин. Следовательно, при различных патологических состояниях, сопровождающихся нарушением всасывания железа либо повышенными его потерями, может развиться дефицит данного микроэлемента. При снижении концентрации железа в плазме уменьшается количество синтезируемого гемоглобина, в результате чего образующиеся эритроциты будут иметь меньшие размеры. Кроме того, нарушаются процессы роста эритроцитов, что приводит к уменьшению их количества.
Причиной дефицита железа в организме может быть:
- недостаточное поступление железа с пищей;
- повышение потребности организма в железе;
- врожденный недостаток железа в организме;
- нарушение всасывания железа;
- нарушение синтеза трансферрина;
- повышенная кровопотеря;
- алкоголизм;
- применение лекарственных препаратов.
Нарушение питания может привести к развитию железодефицитной анемии как у детей, так и у взрослых.
Основными причинами недостаточного поступления железа в организм являются:
- длительное голодание;
- вегетарианство;
- однообразная диета с малым содержанием животных продуктов.
У новорожденных и детей грудного возраста потребности в железе полностью покрываются при кормлении грудным молоком (при условии, что мать не страдает железодефицитным состоянием). Если же слишком рано переводить ребенка на искусственное вскармливание, у него также могут появиться симптомы дефицита железа в организме.
В нормальных, физиологических условиях может возникать повышенная потребность в железе. Это характерно для женщин во время беременности и в период кормления грудью.
Несмотря на то, что определенная часть железа в период беременности сохраняется (ввиду отсутствия менструальных кровотечений), потребность в нем увеличивается в несколько раз.
| Причина | Примерное количество расходуемого железа |
| Увеличение объема циркулирующей крови и количества эритроцитов | 500 мг |
| Железо, передаваемое плоду | 300 мг |
| Железо, входящее в состав плаценты | 200 мг |
| Кровопотеря во время родов и в послеродовом периоде | 50 – 150 мг |
| Железо, теряемое с грудным молоком за весь период кормления | 400 – 500 мг |
Организм ребенка получает от матери все необходимые питательные вещества, в том числе и железо. Однако при наличии определенных заболеваний у матери или плода, возможно рождение ребенка с дефицитом железа.
Причиной врожденного дефицита железа в организме может быть:
- тяжелая железодефицитная анемия у матери;
- многоплодная беременность;
- недоношенность.
В любом из вышеперечисленных случаев концентрация железа в крови новорожденного значительно ниже нормы, и симптомы железодефицитной анемии могут проявляться уже с первых недель жизни.
Всасывание железа в двенадцатиперстной кишке возможно лишь при нормальном функциональном состоянии слизистой оболочки данного отдела кишечника. Различные заболевания желудочно-кишечного тракта могу повреждать слизистую оболочку и значительно снижать скорость поступления железа в организм.
К уменьшению всасывания железа в двенадцатиперстной кишке может привести:
- Энтерит – воспаление слизистой оболочки тонкого кишечника.
- Целиакия – наследственное заболевание, характеризующееся непереносимостью белка глютена и связанным с этим нарушением всасывания в тонком кишечнике.
- Helicobacter Pylori – инфекционный агент, поражающий слизистую оболочку желудка, что, в конечном итоге, приводит к уменьшению секреции соляной кислоты и нарушению всасывания железа.
- Атрофический гастрит – заболевание, связанное с атрофией (уменьшением размеров и функции) слизистой оболочки желудка.
- Аутоиммунный гастрит – заболевание, вызванное нарушением работы иммунной системы и выработкой антител к собственным клеткам слизистой оболочки желудка с последующим их разрушением.
- Удаление желудка и/или тонкой кишки – при этом уменьшается как количество образуемой соляной кислоты, так и функциональная площадь двенадцатиперстной кишки, где происходит всасывание железа.
- Болезнь Крона – аутоиммунное заболевание, проявляющееся воспалительным поражением слизистой оболочки всех отделов кишечника и, возможно, желудка.
- Муковисцидоз – наследственное заболевание, проявляющееся нарушением секреции всех желез организма, в том числе слизистой оболочки желудка.
- Рак желудка или двенадцатиперстной кишки.
Нарушение образования данного транспортного белка может быть связано с различными наследственными заболеваниями. Симптомов дефицита железа у новорожденного не будет, так как он получал данный микроэлемент из организма матери. После рождения основным способом поступления железа в организм ребенка является всасывание в кишечнике, однако из-за недостатка трансферрина всосавшееся железо не может быть доставлено к органам-депо и к красному костному мозгу и не может использоваться в синтезе эритроцитов.
Так как трансферрин синтезируется только в клетках печени, различные ее поражения (цирроз, гепатиты и другие) также могут привести к уменьшению концентрации данного белка в плазме и развитию симптомов железодефицитной анемии.
Одноразовая потеря большого количества крови обычно не приводит к развитию железодефицитной анемии, так как запасов железа в организме достаточно, чтобы возместить потери. В то же время при хронических, длительных, часто незаметных внутренних кровотечениях организм человека может терять по несколько миллиграмм железа ежедневно, на протяжении нескольких недель или даже месяцев.
Причиной хронической кровопотери может быть:
- язва желудка или двенадцатиперстной кишки;
- геморрой;
- неспецифический язвенный колит (воспаление слизистой толстого кишечника);
- болезнь Крона;
- полипоз кишечника;
- распадающиеся опухоли желудочно-кишечного тракта (и другой локализации);
- грыжа пищеводного отверстия диафрагмы;
- эндометриоз (разрастание клеток внутреннего слоя стенки матки);
- системная красная волчанка;
- системный васкулит (воспаление кровеносных сосудов различной локализации);
- сдача крови донорами более 4 раз в год (300 мл донорской крови содержат около 150 мг железа).
Если причина кровопотери не будет своевременно выявлена и устранена, высока вероятность развития железодефицитной анемии у больного, так как всасывающееся в кишечнике железо способно лишь покрывать физиологические потребности в данном микроэлементе.
Прием некоторых лекарственных препаратов может нарушать процессы всасывания и утилизации железа в организме. Обычно это происходит при длительном приеме больших доз медикаментов.
Препаратами, которые могут вызвать дефицит железа в организме, являются:
- Нестероидные противовоспалительные средства (аспирин и другие). Механизм действия данных препаратов связан с улучшением текучести крови, что может привести к появлению хронических внутренних кровотечений. Кроме того, они способствуют развитию язвы желудка.
- Антациды (Ренни, Алмагель). Данная группа препаратов нейтрализует или уменьшает скорость выделения желудочного сока, содержащего соляную кислоту, необходимую для нормального всасывания железа.
- Железосвязывающие препараты (Десферал, Эксиджад). Данные препараты обладают способностью связывать и выводить из организма железо, причем как свободное, так и входящее в состав трансферрина и ферритина. В случае передозировки возможно развитие железодефицитного состояния.
Во избежание развития железодефицитной анемии принимать данные препараты следует только по назначению врача, строго соблюдая дозировку и длительность использования.
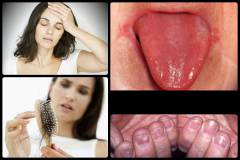
Проявлениями железодефицитной анемии являются:
- мышечная слабость;
- повышенная утомляемость;
- одышка;
- учащенное сердцебиение;
- изменения кожи и ее придатков (волос, ногтей);
- поражение слизистых оболочек;
- поражение языка;
- нарушение вкуса и обоняния;
- склонность к инфекционным заболеваниям;
- нарушения интеллектуального развития.
Как говорилось ранее, железо входит в состав множества ферментов, участвующих в процессах клеточного дыхания и деления. Дефицит данного микроэлемента приводит к повреждению кожи — она становится сухой, менее эластичной, шелушится и трескается. Кроме того, привычный красный или розоватый оттенок слизистым оболочками и коже придают эритроциты, которые находятся в капиллярах данных органов и содержат оксигенированный гемоглобин. При снижении его концентрации в крови, а также в результате уменьшения образования эритроцитов, может отмечаться бледность кожных покровов.
Волосы истончаются, теряют привычный блеск, становятся менее прочными, легко ломаются и выпадают. Рано появляется седина.
Поражение ногтей является весьма специфичным проявлением железодефицитной анемии. Они истончаются, приобретают матовый оттенок, расслаиваются и легко ломаются. Характерной является поперечная исчерченность ногтей. При выраженном дефиците железа может развиться койлонихия – края ногтей приподымаются и изгибаются в обратную сторону, приобретая ложкообразную форму.
Слизистые оболочки относятся к тканям, в которых процессы клеточного деления происходят максимально интенсивно. Вот почему их поражение является одним из первых проявлений дефицита железа в организме.
При железодефицитной анемии поражается:
- Слизистая оболочка полости рта. Она становится сухой, бледной, появляются участки атрофии. Затрудняется процесс пережевывания и проглатывания пищи. Также характерно наличие трещин на губах, образование заед в углах рта (хейлоз). В тяжелых случаях изменяется цвет и снижается прочность зубной эмали.
- Слизистая оболочка желудка и кишечника. В нормальных условиях слизистая оболочка данных органов играет важную роль в процессе всасывания пищи, а также содержит в себе множество желез, вырабатывающих желудочный сок, слизь и другие вещества. При ее атрофии (вызванной дефицитом железа) нарушается пищеварение, что может проявляться диареей или запорами, болями в животе, а также нарушением всасывания различных питательных веществ.
- Слизистая оболочка дыхательных путей. Поражение гортани и трахеи может проявляться першением, чувством наличия инородного тела в горле, что будет сопровождаться непродуктивным (сухим, без мокроты) кашлем. Кроме того, слизистая оболочка дыхательных путей в норме выполняет защитную функцию, предотвращая попадание чужеродных микроорганизмов и химических веществ в легкие. При ее атрофии повышается риск развития бронхита, пневмонии и других инфекционных заболеваний органов дыхания.
- Слизистая оболочка мочеполовой системы. Нарушение ее функции может проявляться болями при мочеиспускании и во время полового акта, недержанием мочи (чаще у детей), а также частыми инфекционными заболеваниями в пораженной области.
Как уже говорилось, слизистая оболочка языка богата вкусовыми рецепторами, расположенными преимущественно в сосочках. При их атрофии могут появляться различные вкусовые нарушения, начиная со снижения аппетита и непереносимости некоторых видов продуктов (обычно кислой и соленой пищи), и заканчивая извращением вкуса, пристрастием к поеданию земли, глины, сырого мяса и других несъедобных вещей.
Нарушения обоняния могут проявляться обонятельными галлюцинациями (ощущением запахов, которых на самом деле нет) либо пристрастием к непривычным запахам (лака, краски, бензина и другим).
Склонность к инфекционным заболеваниям
При дефиците железа нарушается образование не только эритроцитов, но и лейкоцитов – клеточных элементов крови, обеспечивающих защиту организма от чужеродных микроорганизмов. Недостаток данных клеток в периферической крови повышает риск развития различных бактериальных и вирусных инфекций, который еще больше возрастает при развитии анемии и нарушении микроциркуляции крови в коже и других органах.
Важно отметить, что лечение железодефицитной анемии будет неэффективным, если не выявить и не устранить причину ее возникновения.
В диагностике железодефицитной анемии применяется:
- опрос и осмотр пациента;
- общий анализ крови;
- биохимический анализ крови;
- пункция костного мозга.
Первое, что должен сделать врач при подозрении на железодефицитную анемию – это тщательно опросить и обследовать пациента.
Врач может задать следующий вопросы:
- Когда и в какой последовательности начали появляться симптомы заболевания?
- Как быстро они развивались?
- Имеются ли схожие симптомы у членов семьи или ближайших родственников?
- Как питается пациент?
- Страдает ли пациент какими-либо хроническими заболеваниями?
- Каково отношение к алкоголю?
- Принимал ли пациент какие-либо медикаменты в течение последних месяцев?
- Если больна беременная женщина – уточняется срок беременности, наличие и исход предыдущих беременностей, принимает ли она препараты железа.
- Если болен ребенок – уточняется его масса при рождении, родился ли он доношенным, принимала ли мать препараты железа во время беременности.
Во время обследования врач оценивает:
- Характер питания – по степени выраженности подкожно-жировой клетчатки.
- Цвет кожи и видимых слизистых оболочек – особое внимание уделяется слизистой полости рта и языку.
- Придатки кожи – волосы, ногти.
- Мышечную силу – врач просит пациента сжать свою руку или использует специальный прибор (динамометр).
- Артериальное давление – оно может быть снижено.
- Вкус и обоняние.
Это первый анализ, назначаемый всем пациентам при подозрении на анемию. Он позволяет подтвердить или опровергнуть наличие анемии, а также дает косвенную информацию о состоянии кроветворения в красном костном мозге.
Кровь для общего анализа может браться из пальца или из вены. Первый вариант более подходит в том случае, если общий анализ является единственным лабораторным исследованием, назначенным пациенту (когда достаточно небольшого количества крови). Перед взятием крови кожу пальца всегда обрабатывают ватой, смоченной в 70% спирте, чтобы избежать занесения инфекции. Прокол производится специальной одноразовой иглой (скарификатором) на глубину 2 – 3 мм. Кровотечение в данном случае несильное и полностью останавливается практически сразу после взятия крови.
В том случае, если планируется выполнять сразу несколько исследований (например, общий и биохимический анализ) – берут венозную кровь, так как ее легче получить в больших количествах. Перед забором крови на среднюю треть плеча накладывается резиновый жгут, что приводит к наполнению вен кровью и облегчает определение их местоположения под кожей. Место прокола также должно быть обработано спиртовым раствором, после чего медсестра одноразовым шприцем прокалывает вену и набирает кровь для анализа.
Полученную одним из описанных методов кровь направляют в лабораторию, где она исследуется в гематологическом анализаторе – современном высокоточном приборе, имеющемся в большинстве лабораторий мира. Часть полученной крови окрашивают специальными красителями и исследуют в световом микроскопе, что позволяет визуально оценить форму эритроцитов, их строение, а при отсутствии или неисправности гематологического анализатора – произвести подсчет всех клеточных элементов крови.
При железодефицитной анемии мазок периферической крови характеризуется:
- Пойкилоцитозом – наличием в мазке эритроцитов различных форм.
- Микроцитозом – преобладанием эритроцитов, размер которых меньше нормы (могут встречаться и нормальные эритроциты).
- Гипохромией – цвет эритроцитов изменяется с ярко-красного на бледно-розовый.
| Исследуемый показатель | Что обозначает? | Норма | Возможные изменения при железодефицитной анемии |
| Концентрация эритроцитов (RBC) | При истощении запасов железа в организме нарушается эритропоэз в красном костном мозге, ввиду чего общая концентрация эритроцитов в крови будет снижена. | Мужчины (М): 4,0 – 5,0 х 10 12 /л. | Менее 4,0 х 10 12 /л. |
| Женщины (Ж): 3,5 – 4,7 х 10 12 /л. | Менее 3,5 х 10 12 /л. | ||
| Средний объем эритроцита (MCV) | При дефиците железа нарушаются процессы образования гемоглобина, в результате чего уменьшается размер самих эритроцитов. Гематологический анализатор позволяет максимально точно определить данный показатель. | 75 – 100 кубических микрометров (мкм 3 ). | Менее 70 мкм 3 . |
| Концентрация тромбоцитов (PLT) | Тромбоциты – клеточные элементы крови, отвечающие за остановку кровотечений. Изменение их концентрации может наблюдаться в том случае, если дефицит железа вызван хронической кровопотерей, что приведет к компенсаторному увеличению их образования в костном мозге. | 180 – 320 х 10 9 /л. | В норме или увеличена. |
| Концентрация лейкоцитов (WBC) | При развитии инфекционных осложнений концентрация лейкоцитов может значительно повышаться. | 4,0 – 9,0 х 10 9 /л. | В норме или увеличена. |
| Концентрация ретикулоцитов (RET) | В нормальных условиях естественным ответом организма на анемию является увеличение скорости образования эритроцитов в красном костном мозге. Однако при дефиците железа развитие данной компенсаторной реакции невозможно, ввиду чего снижается количество ретикулоцитов в крови. | М: 0,24 – 1,7%. | Уменьшена либо находится на нижней границе нормы. |
| Ж: 0,12 – 2,05%. | |||
| Общий уровень гемоглобина (HGB) | Как уже говорилось, дефицит железа приводит к нарушению образования гемоглобина. Чем дольше длится заболевание, тем ниже будет данный показатель. | М: 130 – 170 г/л. | Менее 120 г/л. |
| Ж: 120 – 150 г/л. | Менее 110 г/л. | ||
| Среднее содержание гемоглобина в одном эритроците (MCH) | Данный показатель более точно характеризует нарушение образования гемоглобина. | 27 – 33 пикограмм (пг). | Менее 24 пг. |
| Гематокрит (Hct) | Данный показатель отображает количество клеточных элементов по отношению к объему плазмы. Так как основное большинство клеток крови представлено эритроцитами, уменьшение их количества приведет к снижению гематокрита. | М: 42 – 50%. | Менее 40%. |
| Ж: 38 – 47%. | Менее 35%. | ||
| Цветовой показатель (ЦП) | Цветовой показатель определяется путем пропускания через взвесь эритроцитов световой волны определенной длины, которая поглощается исключительно гемоглобином. Чем меньше будет концентрация данного комплекса в крови, тем ниже будет значение цветового показателя. | 0,85 – 1,05. | Менее 0,8. |
| Скорость оседания эритроцитов (СОЭ) | Все клетки крови, а также эндотелий (внутренняя поверхность) сосудов, имеют отрицательный заряд. Они отталкиваются друг от друга, что способствует поддержанию эритроцитов во взвешенном состоянии. При уменьшении концентрации эритроцитов расстояние между ними увеличивается, и сила отталкивания уменьшается, в результате чего они будут оседать на дно пробирки быстрее, чем в нормальных условиях. | М: 3 – 10 мм/час. | Более 15 мм/час. |
| Ж: 5 – 15 мм/час. | Более 20 мм/час. |
В ходе данного исследования удается установить концентрацию различных химических веществ, находящихся в крови. Это дает информацию о состоянии внутренних органов (печени, почек, костного мозга и других), а также позволяет выявить множество заболеваний.
Существует несколько десятков биохимических показателей, определяемых в крови. В данном разделе будут описаны только те из них, которые имеют значение в диагностике железодефицитной анемии.
| Исследуемый показатель | Что обозначает? | Норма | Возможные изменения при железодефицитной анемии |
| Концентрация сывороточного железа | Вначале данный показатель может быть в норме, так как дефицит железа будет компенсироваться выделением его из депо. Только при длительном течении заболевания концентрация железа в крови начнет снижаться. | М: 17,9 – 22,5 мкмоль/л. | В норме или снижена. |
| Ж: 14,3 – 17,9 мкмоль/л. | |||
| Уровень ферритина в крови | Как говорилось ранее, ферритин является одним из основных видов депонирования железа. При недостатке данного элемента начинается мобилизация его из органов-депо, ввиду чего уменьшение концентрации ферритина в плазме является одним из первых признаков железодефицитного состояния. | Дети: 7 – 140 нанограмм в 1 миллилитре крови (нг/мл). | Чем дольше длится дефицит железа, тем меньше уровень ферритина. |
| М: 15 – 200 нг/мл. | |||
| Ж: 12 – 150 нг/мл. | |||
| Общая железосвязывающая способность сыворотки | Данный анализ основан на способности трансферрина, находящегося в крови, связывать железо. В нормальных условиях, каждая молекула трансферрина только на 1/3 связана с железом. При дефиците данного микроэлемента печень начинает синтезировать больше трансферрина. Концентрация его в крови повышается, однако количество железа, приходящегося на каждую молекулу, снижается. Определив, какая доля молекул трансферрина находится в несвязанном с железом состоянии, можно сделать выводы о выраженности дефицита железа в организме. | 45 – 77 мкмоль/л. | Значительно выше нормы. |
| Концентрация эритропоэтина | Как было упомянуто ранее, эритропоэтин выделяется почками, если ткани организма испытывают недостаток в кислороде. В норме данный гормон стимулирует эритропоэз в костном мозге, однако при дефиците железа данная компенсаторная реакция малоэффективна. | 10 – 30 международных миллиединиц в 1 миллилитре (мМЕ/мл). | Значительно выше нормы. |
Данное исследование заключается в прокалывании одной из костей организма (обычно грудины) специальной полой иглой и заборе нескольких миллилитров вещества костного мозга, которое потом исследуется под микроскопом. Это позволяет напрямую оценить выраженность изменения структуры и функции органа.
В начале заболевания никаких изменений в пунктате костного мозга не будет. При развитии анемии может отмечаться разрастание эритроидного ростка кроветворения (увеличения количества клеток-предшественниц эритроцитов).
Для выявления причины железодефицитной анемии применяется:
- анализ кала на наличие скрытой крови;
- рентгенологическое исследование;
- компьютерная томография;
- эндоскопические исследования;
- консультация других специалистов.
Причиной появления крови в кале (мелены) может стать кровотечение из язвы, распад опухоли, болезнь Крона, неспецифический язвенный колит и другие заболевания. Обильные кровотечения легко определяются визуально по изменению цвета каловых масс на ярко-красный (при кровотечении из нижних отелов кишечника) или черный (при кровотечении из сосудов пищевода, желудка и верхнего отдела кишечника).
Массивные однократные кровотечения практически не приводит к развитию железодефицитной анемии, так как быстро диагностируются и устраняются. Опасность в этом плане представляют длительные, небольшие по объему кровопотери, возникающие при повреждении (или изъязвлении) мелких сосудов желудочно-кишечного трата. В таком случае выявить кровь в кале возможно только с помощью специального исследования, которое назначается во всех случаях анемии неясного генеза.
С целью выявления опухолей или язв желудка и кишечника, которые могли стать причиной хронического кровотечения, применяется рентген с контрастом. В роли контраста используется вещество, которое не поглощает рентгеновские лучи. Обычно это взвесь бария в воде, которую пациент должен выпить непосредственно перед началом исследования. Барий покрывает слизистые оболочки пищевода, желудка и кишечника, в результате чего на рентгеновском снимке становится четко различима их форма, контур и различные деформации.
Перед проведением исследования необходимо исключить прием пищи в течение последних 8 часов, а при исследовании нижних отделов кишечника назначаются очистительные клизмы.
В данную группу включен ряд исследований, суть которых заключается во введении в полости организма специального аппарата с видеокамерой на одном конце, подсоединенной к монитору. Этот метод позволяет визуально исследовать слизистые оболочки внутренних органов, оценить их строение и функцию, а также выявить опухоль или кровотечение.
С целью установления причины железодефицитной анемии используется:
- Фиброэзофагогастродуоденоскопия (ФЭГДС) – введение эндоскопа через рот и исследование слизистой оболочки пищевода, желудка и верхних отделов кишечника.
- Ректороманоскопия – исследование прямой и нижнего отдела сигмовидной кишки.
- Колоноскопия – исследование слизистой оболочки толстого кишечника.
- Лапароскопия – прокалывание кожи передней стенки живота и введение эндоскопа в брюшную полость.
- Кольпоскопия – исследование влагалищной части шейки матки.
При выявлении заболевания различных систем и органов гематолог может привлекать специалистов из других областей медицины с целью постановки более точного диагноза и назначения адекватного лечения.
Для выявления причины железодефицитной анемии может понадобиться консультация:
- Диетолога – при выявлении нарушения питания.
- Гастролога – при подозрении на наличие язвы или других заболеваний желудочно-кишечного тракта.
- Хирурга – при наличии кровотечения из желудочно-кишечного тракта или другой локализации.
- Онколога – при подозрении на опухоль желудка или кишечника.
- Акушера-гинеколога – при наличии признаков беременности.
| Название продукта | Содержание железа в 100 г продукта |
| Продукты животного происхождения | |
| Печень свиная | 20 мг |
| Печень куриная | 15 мг |
| Печень говяжья | 11 мг |
| Яичный желток | 7 мг |
| Мясо кролика | 4,5 – 5 мг |
| Баранина, говядина | 3 мг |
| Куриное мясо | 2,5 мг |
| Творог | 0,5 мг |
| Коровье молоко | 0,1 – 0,2 мг |
| Продукты растительного происхождения | |
| Плоды шиповника | 20 мг |
| Морская капуста | 16 мг |
| Чернослив | 13 мг |
| Гречка | 8 мг |
| Семена подсолнечника | 6 мг |
| Смородина черная | 5,2 мг |
| Миндаль | 4,5 мг |
| Персик | 4 мг |
| Яблоки | 2,5 мг |
Основным направлением в терапии данного заболевания является использование препаратов железа. Диетотерапия, хотя и является важным этапом лечения, не в состоянии самостоятельно восполнить дефицит железа в организме.
Методом выбора являются таблетированные формы препаратов. Парентеральное (внутривенное или внутримышечное) введение железа назначается в случае, если невозможно полноценное всасывание данного микроэлемента в кишечнике (например, после удаления части двенадцатиперстной кишки), необходимо быстро восполнить запасы железа (при массивной кровопотере) либо при развитии побочных реакций от применения пероральных форм препарата.
| Название препарата | Механизм лечебного действия | Способ применения и дозы | Контроль эффективности лечения |
| Гемофер пролонгатум | Препарат сульфата железа, восполняющий запасы данного микроэлемента в организме. | Принимать внутрь, за 60 минут до или через 2 часа после еды, запивая стаканом воды. |
Рекомендуемые дозы:
- детям – 3 миллиграмма на килограмм массы тела в сутки (мг/кг/сут);
- взрослым – 100 – 200 мг/сут.
Перерыв между двумя последующими приемами железа должен составлять не менее 6 часов, так как в этот период клетки кишечника невосприимчивы к новым дозам препарата.
Длительность лечения – 4 – 6 месяцев. После нормализации уровня гемоглобина переходят на поддерживающую дозу (30 – 50 мг/сутки) еще на 2 – 3 месяца.
- Повышение количества ретикулоцитов в анализе периферической крови на 5 – 10 день после начала приема препаратов железа.
- Повышение уровня гемоглобина (обычно отмечается через 3 – 4 недели лечения).
- Нормализация уровня гемоглобина и количества эритроцитов на 9 – 10 неделе лечения.
- Нормализация лабораторных показателей – уровня сывороточного железа, ферритина крови, общей железосвязывающей способности сыворотки.
- Постепенное исчезновение симптомов дефицита железа отмечается на протяжении нескольких недель или месяцев.
Данные критерии используются для контроля эффективности лечения всеми препаратами железа.
Рекомендуемые дозы:
- взрослым для лечения анемии – 2 таблетки 2 раза в день;
- женщинам при анемии во время беременности – 1 – 2 таблетки 1 раз в сутки.
После нормализации уровня гемоглобина переходят на поддерживающую терапию (20 – 50 мг 1 раз в сутки).
- сульфат железа;
- фолиевую кислоту;
- витамин В12.
Данный препарат назначается женщинам во время беременности (когда повышается риск развития дефицита железа, фолиевой кислоты и витаминов), а также при различных заболеваниях желудочно-кишечного тракта, когда нарушается всасывание не только железа, но и многих других веществ.
При внутривенном введении железа высок риск передозировки, поэтому данная процедура должна выполняться только в условиях стационара под контролем специалиста.
Важно помнить, что некоторые лекарственные средства (и другие вещества) могут в значительной степени ускорять либо замедлять скорость всасывания железа в кишечнике. Применять их совместно с препаратами железа стоит осторожно, так как это может привести к передозировке последних, или, наоборот, к отсутствию лечебного эффекта.
| Медикаменты, способствующие всасыванию железа | Вещества, препятствующие всасыванию железа |
|
|
При неосложненном течении и правильно проводимом лечении необходимости в данной процедуре нет.
Показаниями к переливанию эритроцитов являются:
- массивная кровопотеря;
- снижение концентрации гемоглобина менее 70 г/л;
- стойкое снижение систолического артериального давления (ниже 70 миллиметров ртутного столба);
- предстоящее хирургическое вмешательство;
- предстоящие роды.
Эритроциты следует переливать максимально короткий промежуток времени, пока не будет устранена угроза жизни пациента. Данная процедура может осложниться различными аллергическими реакциями, поэтому перед ее началом необходимо провести целый ряд тестов на определение совместимости крови донора и реципиента.

Причиной затруднений в лечении железодефицитной анемии может быть:
- неправильно выставленный диагноз;
- неустановленная причина дефицита железа;
- поздно начатое лечение;
- прием недостаточных доз препаратов железа;
- нарушение режима приема медикаментов или диеты.
При нарушениях в диагностике и лечении заболевания возможно развитие различных осложнений, некоторые из которых могут представлять опасность для здоровья и жизни человека.
Осложнениями железодефицитной анемии могут быть:
- Отставание в росте и развитии. Данное осложнение характерно для детей. Оно обусловлено ишемией и связанными с ней изменениями в различных органах, в том числе в ткани головного мозга. Отмечается как задержка физического развития, так и нарушение интеллектуальных способностей ребенка, которые при длительном течении заболевания могут оказаться необратимыми.
- Анемическая кома. Развитие комы обусловлено критическим снижением доставки кислорода к головному мозгу. Внешне это проявляется потерей сознания, отсутствием реакции на речь и болевые раздражители. Кома является опасным для жизни состоянием, требующим срочной медицинской помощи.
- Развитие недостаточности внутренних органов. При длительном дефиците железа и наличии анемии могут поражаться практически все органы человека. Наиболее характерным является развитие сердечной недостаточности, почечной недостаточности и печеночной недостаточности.
- Инфекционные осложнения. Часто рецидивирующие инфекции могут сопровождаться поражением внутренних органов и развитием сепсиса (попадания гноеродных бактерий в кровоток и ткани организма), что особенно опасно у детей и людей пожилого возраста.
источник

 Укладывание пациента на спину, под лопатки помещают валик.
Укладывание пациента на спину, под лопатки помещают валик.