Согласно рекомендациям ВОЗ, критерием анемии является снижение концентрации гемоглобина до уровня 120 г/л для женщин (во время беременности – менее 110 г/л), для мужчин – менее 130 г/л. По степени тяжести различают анемию легкую (уровень гемоглобина крови 90-110 г/л), средней тяжести (гемоглобин – 70-89 г/л) и тяжелую (гемоглобин менее 70 г/л).
В лабораторной диагностике железодефицитной анемии основное практическое значение имеют три показателя: сывороточные концентрации железа, ферритина и общая железосвязывающая способность сыворотки (ОЖСС). ОЖСС – это общее количество железа, которое может связаться с трансферином. В норме сывороточная концентрация железа составляет 12-30 мкМоль/л (50-150мкг%), а ОЖСС – 30-85 мкМоль/л (300-360 мкг%).
Важное значение в лечении железодефицитной анемии имеет место устранение причин ее развития (оперативное лечение опухоли желудка, кишечника, лечение энтерита, коррекция алиментарной недостаточности и др.), а также возмещение дефицита железа в крови и тканях и достижение полной клинико-гематологической ремиссии. В ряде случаев радикальное устранение причины железодефицитной анемии невозможно, и тогда основное значение приобретает патогенетическая терапия железосодержащими лекарственными препаратами.
В качестве заместительной терапии при железодефицитной анемии используют препараты железа.
Терапия железодефицитной анемии при заболеваниях желудочно-кишечного тракта проводится преимущественно препаратами железа для перорального приема, за исключением случаев тяжелой мальабсорбции и состояний после резекции тонкой кишки.
Рекомендуемая ВОЗ оптимальная доза составляет 120 мг элементарного железа в сутки. Более высокие дозы не увеличивают эффективность, однако могут вызвать диспепсические явления вследствие раздражения желудочно-кишечного тракта. Лечение препаратами железа должно быть длительным.
Суточная доза для профилактики анемии и лечения легкой формы заболевания составляет 50-60 мг Fe 2+ , а для лечения выраженной анемии – 100-120 мг Fe 2+ .
При выборе препаратов железа необходимо учитывать и их состав.
В настоящее время существуют препараты двухвалентного и трехвалентного железа. По мнению специалистов, наибольшей биодоступностью обладает двухвалентная форма железа, именно поэтому старт терапии начинают с препаратов этой группы. Согласно проведенным клиническим исследованиям, терапия препаратами двухвалентного железа позволяет за более короткий временной интервал нормализовать показатели красной крови.
Таким образом, анемический синдром достаточно часто является «маской» многих распространенных и тяжелых заболеваний желудочно-кишечного тракта. Ключевыми моментами диагностики являются определение вида и причины развития анемии, а залогом успешного лечения служат своевременная терапия основного заболевания и правильная патогенетическая терапия с восполнением дефицита железа.
Железодефицитная анемия — частое осложнение хронического энтерита. Как воспалительные заболевания тонкой кишки, так и атрофия слизистой оболочки приводят к нарушению всасывания железа наряду с всасыванием других веществ и развитие прежде всего железодефицитной анемии. Дефицит железа характерен для глютеновой энтеропатии — заболевание, при котором наблюдается стеаторея, связанная с непереносимостью глютена — склеивающей белковой части ряда злаковых растений (пшеница, рожь, овес, ячмень). Глютеновая энтеропатия встречается как у детей, так и у взрослых [Ташев Г. и др., 1964].
Для хронического энтерита характерно чувство давления, тяжести, распирания в животе, часто наблюдается урчание, булькание. Сильный болевой синдром наблюдается редко. Стул чаще всего учащенный кашицеобразный с кусочками непереваренной пищи, но без слизи. Акт дефекации безболезнен. Стул от 2—3 до 10—15раз в сутки. Иногда при энтеритах поносы могут отсутствовать, наблюдаются запоры.
Для хронического энтерита характерна непереносимость молока, нередко после его употребления появляются боли в животе, усиливается понос. Вначале при энтеритах обнаруживаются лишь симптомы, характеризующие изменения в системе пищеварения: обложен язык, живот вздут и болезнен в мезогастральной области (по данным А. Я. Губергрица и В. Н. Шмакова, в 94%случаев). Характерно громкое урчание и плеск в слепой кишке, болезненность в зоне слева и выше пупка, в области подвздошной кишки.
Постепенно больные худеют, появляются признаки обезвоживания, интоксикации, появляются трофические расстройства. У некоторых больных обнаруживаются признаки демпинг-синдрома, витаминной недостаточности, понижается тургор кожи, появляются боли в мышцах, суставах, костях, иногда неприятные ощущения в области сердца. Характерны ангулярный стоматит, своеобразный дерматит кожи лица, признаки эндокринной недостаточности. Хронические энтериты гематологически чаще всего проявляются дефицитом железа. Мегалобластная анемия бывает реже. Запасы витамина Bisв организме очень велики. Нарушение всасывания витаминаBigпроявляется лишь на3—4-й год болезни. Дефицит фолиевой кислоты может проявиться раньше.
Стул у больных обильный, неоформленный, нередко светло-желтый. В кале обнаруживается непереваренная пища и слизь. Для энтеритов характерно увеличение количества жира в кале.
Рентгенологически при хроническом энтерите обнаруживаются признаки нарушения тонуса тонкой кишки, изменение рельефа слизистой оболочки кишки. Нередко обнаруживаются, утолщенные, грубые, отечные складки. Иногда при хронических энтеритах обнаруживается низкий уровень жидкости, что бывает связано с усилением брожения, нарушением всасывания в тонкой кишке и значительной экссудацией.
Больные поступают в гематологическую клинику с диагнозом: анемия неясного генеза. Обнаруживается гипохромия эритроцитов, низкое содержание железа. При помощи 51 Сг кровопотери обычно выявить не удается. Помогает в диагностике исследование всасывания радиоактивного железа. При постгеморрагических железодефицитных анемиях всасывание железа, как правило, резко возрастает. При хроническом энтерите кишечное всасывание железа резко снижается.
Больная П., 45 лет, с 1971 г. жалуется на боли в животе, метеоризм, тошноту, поносы, чередующиеся с запорами. С 1976 г. отмечается умеренная железодефицитная анемия. В 1978 г. было обморочное состояние. Содержание гемоглобина снизилось до 85 г/л (8,5 г%), цветовой показатель 0,7. Лечилась длительно препаратами железа для внутреннего приема без эффекта. При поступлении в клинику в марте 1979 г. состояние больной удовлетворительное. Жалобы на боли в животе, иногда поносы. Живот умеренно вздут, болезнен в эпигастральной области, в области пупка и по ходу толстой кишки. Печень и селезенка не пальпируются. При гастроскопии выявлена картина гастродуоденита. Обнаружена небольшая грыжа пищеводного отверстия диафрагмы.
Гинекологической патологии не выявлено. Менструации по 3 дня через 28 дней. необильные. Анализ крови: Нb 85 г/л (8,5 г%), эр. 4•10 12 /л, цв. показатель 0,63, СОЭ 36 мм/ч, ретикулоц. 2%, тромбоц. 300•10 9 /л, л. 4,2•10 9 /л, п. 8%, с. 52%, э. 2%, лимф. 30%, мон. 8%. Железо сыворотки 9 мкмоль/л (50 мкг%).
Кровопотери из желудочно-кишечного тракта (при помощи 51 Сг) не выявлено. При исследовании всасывания железа было установлено, что у больной всосалось 6,3% от принятой дозы, что значительно ниже нормы.
При рентгенологическом исследовании пищевода, желудка и тонкой кишки установлено следующее: пищевод свободно проходим и не изменен, желудочный пузырь прозрачен, складки слизистой оболочки прослеживаются на всем протяжении. Форма, размеры и положение желудка в пределах нормы; привратник раскрывается своевременно. Луковица двенадцатиперстной кишки обычных размеров, складки слизистой оболочки широкие; просвет двенадцатиперстной кишки шире обычного. Тощая кишка в области П. duodeno-jejunalis раздута газом. Проксимальные отделы тощей кишки кое-где расширены, образуя резервуары контрастного вещества, кое-где сужены. Нормального рельефа слизистой оболочки тощей кишки проследить не удается. Нижележащие отделы тощей кишки тоже значительно расширены, и в этих отделах длительно задерживается бариевая взвесь. Прохождение бария в тощей кишке своевременное. Остатков бария в тонкой кишке нет. Толстая кишка на всем протяжении заполнена барием. Заключение: рентгенологическая картина хронического энтерита.
Назначены соответствующая диета и препараты железа для парентерального введения. Содержание гемоглобина повысилось до 120 г/л (12 г%). Состояние больной удовлетворительное.
Нарушение всасывания железа наблюдается при тропических энтеритах типа спру. Описано нарушение кишечного всасывания железа при некоторых эндокринных заболеваниях, в частности при синдроме Турнера [Mialeetal., 1978]. При этом у больных нередко выявляется снижение содержания сывороточного железа, повышение общей железосвязывающей способности и гипохромная анемия.
Следует иметь в виду, что нарушение кишечного всасывания — сравнительно редкая причина дефицита железа и что железодефицитная анемия не развивается в результате ахилического гастрита.
«ФАРМАТЕКА»; Актуальные обзоры; № 13; 2012; стр. 9-14.
Обсуждается проблема железодефицитной анемии (ЖДА), развивающейся в т. ч. при заболеваниях желудочно-кишечного тракта. Представлены сведения, касающиеся причин возникновения ЖДА, патогенеза, симптоматики, диагностики и лечения данной патологии. Особое внимание уделено препарату Феринжект (железа карбоксимальтозат), который применяется в комплексной терапии пациентов с ЖДА, обусловленной воспалительными заболеваниями кишечника.
Ключевые слова: железодефицитная анемия, дефицит железа, ферротерапия, железа карбоксимальтозат
The article discusses the problem of iron deficiency anemia (IDA), which develops against the background of many diseases, including gastrointestinal diseases. The data on the causes of IDA, pathogenesis, symptoms, diagnosis and treatment of this disease are presented. Particular attention is paid to the drug Ferinject (ferric carboxymaltosate) used for the treatment of IDA in patients with inflammatory bowel diseases.
Key words: iron deficiency anemia, iron deficiency, ferrotherapy, ferric carboxymaltosate
Наиболее частая в популяции причина анемии — дефицит железа в организме. По данным отчета Всемирной организации здравоохранения (ВОЗ) о состоянии здоровья за 2002 г., железодефицитная анемия (ЖДА) входит в десятку глобальных факторов риска развития нетрудоспособности. Так, показано, что ЖДА встречается среди 30 % населения планеты [1]. В США ЖДА наблюдается среди 5-12 % небеременных женщин и 1-5 % мужчин [2].
Баланс железа в организме поддерживается соответствием количества поступающего железа его потерям. В пище железо присутствует в составе гема или как негемовое железо. Ежедневно с пищей (стандартный пищевой рацион) в организм человека поступает 10—20 мг железа, из которого в норме в кишечнике всасывается около 10 % (от 3 до 15 %), что компенсирует суточные потери железа, главным образом при слущивании эпителиальных клеток. Организм обеспечивает баланс железа в организме, регулируя процесс его всасывания в кишечнике. В случае развития дефицита железа организм увеличивает процент всасываемого железа (может достигать 25 %), при избытке — уменьшает [3]. В этом процессе ключевое значение придают гепсидину — белку, который синтезируется в печени. Поступление с пищей или выведение железа, как правило, вне контроля организма.
Около 25—30 мг железа ежедневно реутилизируется после разрушения (вследствие старения) эритроцитов в селезенке и поступает снова в костный мозг для синтеза новых эритроцитов. Железо, которое всасывается в кишечнике, предварительно на поверхности энтероцита восстанавливается с участием ферроредуктаз из трехвалентного (Fe 3+ ) в двухвалентнтное (Fe 2+ ), затем с помощью специфического переносчика — транспортера двухвалентных металлов (DMT1) поступает в цитоплазму [4]. Железо в составе гема (содержится в мясе, рыбе) всасывается напрямую. В дальнейшем двухвалентное железо с помощью другого переносчика, ферропортина (также мобилизует железо из ферритина), секретируется в кровь, где снова окисляется до трехвалентного (при участии белка гефестина) и связывается с плазменным белком трансферрином [5]. Трансферрин осуществляет транспорт железа в костный мозг, где оно утилизируется для синтеза эритроцитов, или преимущественно в печень, где железо депонируется в составе ферритина (рис. 1) [6].
При снижении запасов железа, гипоксии, анемии, усиленном эритропоэзе в печени снижается синтез гепсидина, что усиливает всасывание железа в кишечнике, при хроническом воспалении синтез гепсидина в печени увеличивается и, соответственно, всасывание железа в кишечнике снижается.
Ферритин — ключевой белок, отражающий запасы железа в организме. Он депонирует железо в нетоксической форме, которое при необходимости мобилизуется. В среднем одна молекула ферритина содержит до 4500 атомов железа. Главным образом железо депонируется в печени, костном мозге и селезенке. Снижение уровня ферритина в сыворотке крови является достаточно надежным показателем дефицита железа в организме, его увеличение, как правило, указывает на перегрузку организма железом. В то же время необходимо помнить, что ферритин относится к белкам острой фазы воспаления, поэтому увеличение его содержания в крови может быть следствием активного воспалительного процесса, а не телько избытка железа. В ряде случаев некоторые злокачественные опухоли обладают способностью синтезировать и секретировать в кровь большое количество ферритина (в рамках паранеопластического синдрома). В норме содержание ферритина в сыворотке крови составляет 30-300 нг/мл.
1. Недостаточное поступление с пищей или повышенная потребность.
2. Нарушение всасывания железа в кишечнике.
3. Хронические потери крови.
В популяции наиболее частой причиной ЖДА является недостаточное поступление с пищей: по данным ВОЗ, от четверти до трети населения в мире хронически голодают из-за нехватки продуктов питания, особенно мясной пищи. Однако в клинической практике среди основных причин ЖДА выделяют хронические потери крови, прежде всего из желудочно-кишечного тракта.
извращение вкуса (желание есть крахмал, мел, глину и др.). Диагностика
Лабораторная диагностика ЖДА основана на изучении обмена железа и выявлении его дефицита. Выделяют ряд признаков, указывающих на железодефицитный характер анемии (табл. 1).
Лабораторные признаки дефицита железа и ЖДА
Анемия – это патологическое состояние, характеризующееся снижением уровня гемоглобина и (или) уменьшением числа эритроцитов в единице объема крови.
Из всех форм анемий железодефицитная (ЖДА) встречается чаще всего. Этот гематологический синдром развивается в результате нарушения синтеза гемоглобина из-за дефицита железа. Самые уязвимые категории населения — дети до 1 года (70-80%), девочки в период полового созревания (14%), беременные женщины (30-80%). Дефицит железа был и остается актуальной медицинской проблемой.
К общим симптомам анемии относятся головокружение, слабость и вялость, ощущение сердцебиения, склонность к обморокам. При прогрессировании могут присоединяться изменения со стороны сердечно-сосудистой системы (шумы и т.д.).
Для синдрома ЖДА характерны мышечная слабость, утомляемость. Кожа бледная, сухая, на ней появляются трещины. Наблюдается легкая желтизна рук и носогубного треугольника вследствие нарушения обмена каротина при дефиците железа. Ногти уплощаются, становятся вогнутыми и ломкими. Волосы сухие и ломкие, сильно выпадают. Наблюдается ангулярный стоматит, трещины, заеды, пародонтоз, кариес. При сидоропеническом синдроме (греч. sidēros — железо) иногда возникает симптом «синих склер», когда сквозь утонченную склеру просвечивают сосудистые сплетения. Очень часто особенно у подростков при длительно существующем дефиците железа возникает пристрастие к необычным запахам и извращение вкуса. Нередко наблюдается субфебрилитет (слегка, до 37,1-37,3, повышенная температура). Очень часто при смехе, кашле, чихании у ребенка возникает императивный позыв на мочеиспускание (недержание мочи). Также часто у детей наблюдается дистрофия внутренних органов, атрофический гастрит, энтерит, мальабсорбция (нарушение всасывания в тонкой кишке одного или нескольких питательных веществ). Но, главным образом, страдают функции иммунной системы, в связи с чем снижается мозговая деятельность (ребенок становится рассеянным, начинает хуже учиться в школе забывчивым, у него снижается скорость решения задач).
У детей раннего возраста признаки ЖДА таковы:
- впечатляющая бледность кожи при еще нормальном уровне эритроцитов и гемоглобина;
- «беспричинная» потеря аппетита;
- частые или резко участившиеся ОРВИ;
- «беспричинная» приостановка в прибавлении веса.
Анемия появляется вследствие:
- нарушенного кровообразования;
- кровопотерь (постгеморрагические);
- повышенного кроворазрушения (гемолитические).
Причины дефицита железа у детей:
- недостаток неонатальных (с рождения) запасов железа;
- недостаточное усвоение и всасывание железа;
- повышенные потребности;
- повышенные потери (у детей дошкольного и школьного возраста).
Недостаток неонатальных запасов железа возникает у детей, рожденных от матерей, у которых имелись нарушения маточно-плацентарного кровообращения, при синдроме фетальной трансфузии, при недоношенности, при многоплодной беременности, при глубоком и длительном дефиците железа в организме беременных.
Нарушение всасывания железа может происходить при недостаточном поступлении витаминов С, D, группы В, микроэлементов Cu, Co, Mg, Zn, аминокислот (глютамина, серина, гистидина, аспарагина), янтарной, лимонной кислоты, пепсина. Все эти вещества улучшают всасывание железа.
Подавляют всасывание железа:
- соли Са, Р, фитин;
- большой объем пищи;
- расстройства пищеварения;
- интоксикация;
- терапия антибиотиками, сульфаниламидами.
В пубертатном возрасте (период полового созревания) возникновению железодефицитных состояний максимально способствуют:
- быстрые темпы роста подростков;
- формирование вторичных половых признаков и становление овариально-менструального цикла;
- дисбаланс половых стероидов (андрогены усиливают, а эстрогены угнетают эритропоэз — процесс образования эритроцитов);
- хронические заболевания щитовидной железы, надпочечников, ЖКТ;
- усиленные занятия спортом, требующие больших расходов железа на мышечную массу.
Нарушение усвоения железа происходит при врожденном дефиците ферментов (гемосинтетазы), витаминов (В1, В2, В6, В12, фолиевой кислоты), микроэлементов (Сu), а также при частых инфекциях и интоксикациях.
У детей старшего возраста и взрослых основной причиной железодефицитного состояния может являться повышенное выведение железа, которое чаще всего наблюдается при острых и хронических кровопотерях (в первую очередь, из желудочно-кишечного тракта – трещины, полипы, эрозии, скользящая диафрагмальная грыжа и т.д.). Реже причинами повышенного выведения железа являются белковые энтеропатии, кишечные заболевания, паразиты, нефропатии с гематуриями (наличие крови в моче).
Существует три стадии развития железодефицитных состояний. Первая стадия – прелатентный дефицит железа — характеризуется снижением запасов железа в организме. Клинические проявления отсутствуют. Выявляется с помощью определения ферритина сыворотки, десфералового теста (определение запасов железа), стернальной пункции (пункция грудины). Но, как правило, на этом этапе диагноз не ставится.
Вторая стадия — латентный дефицит железа — характеризуется:
- снижением уровня сывороточного железа (менее 14 мкмоль/л);
- повышением общей железосвязывающей способности сыворотки (N – 45-75 мкмоль/л);
- снижением коэффициента насыщения трансферрина железом (N – 25-40%).
Это состояние тоже, как правило, пропускается специалистами.
Третья стадия железодефицитных состояний — железодефицитная анемия — возникает при снижении гемоглобинового фонда железа. Специалисты должны руководствоваться максимальными нормативами уровня гемоглобина, в соответствии с которыми у детей до 1 года нижней границей является 110 г/л, от 1 до 6 лет –120 г/л. Для женщин нормой содержания гемоглобина в крови является 120 г/л, для мужчин-130 г/л и выше.
Для ЖДА характерно не только снижение гемоглобина. Важными показателями также являются гипохромия эритроцитов, то есть низкое насыщение эритроцитов гемоглобином (ЦП 69 мкмоль/л.
Показатель анемии гемоглобин (Hb). От количества гемоглобина зависит констатация степени ЖДА. При легкой степени Hb 110-90 г/л, при среднетяжелой — Hb 90-70 г/л и при тяжелой Hb менее 70г/л. Тяжелая степень очень опасна.
Мужчины; женщины в период менопаузы 0,5-1,0;
Женщины детородного возраста 0,7- 2,0;
Мальчики и девочки в пубертатном периоде – 1,0-2,0;
Влияние ЖДА на будущую мать огромно. Анемия осложняет течение беременности и родов: возможны такие осложнения, как гестоз, преждевременные роды, гипотония и слабость родовой деятельности, кровотечения в родах. Даже при латентной форме ЖДА у 59% женщин отмечено неблагоприятное течение беременности в виде угрозы ее прерывания и гестоза. У матерей с анемией лактация продолжается 3,5 месяца против 6,8 месяцев у здоровых, а среднесуточный объем молока в первые 3 месяца равен 60 мл против 110 мл у здоровых.
На плод и новорожденного ЖДА влияет следующим образом. Развивается хроническая гипоксия плода, наблюдается задержка внутриутробного развития, нарушение иммунного статуса новорожденного, потеря массы тела, длительное течение физиологической желтухи. Чаще развиваются гнойно-септические осложнения.
Анемии являются довольно частым вторичным синдромом при гастроэнтерологических заболеваниях. Основными видами анемий, выявляемых у гастроэнтерологических больных, являются: железодефицитная анемия (ЖДА), анемия хронических заболеваний (АХЗ), гемолитическа
Анемии являются довольно частым вторичным синдромом при гастроэнтерологических заболеваниях. Основными видами анемий, выявляемых у гастроэнтерологических больных, являются: железодефицитная анемия (ЖДА), анемия хронических заболеваний (АХЗ), гемолитическая анемия, В12— и фолиеводефицитная анемия, гипо-, апластические анемии.
ЖДА — наиболее частая форма анемий в гастроэнтерологии, и причиной ее развития являются кровотечения, нарушения всасывания железа, диетические ограничения. Второй по распространенности после ЖДА в детской гастроэнтерологии является АХЗ, которая отличается достаточными запасами железа в организме, но снижением насыщения им трансферрина, сниженным или нормальным уровнем сывороточного железа. Причина развития АХЗ заключается в действии провоспалительных цитокинов (интерлейкина 1-альфа и интерлейкина 1-бета, фактора некроза опухоли альфа, гамма-интерферона и др.).
Воспалительные заболевания кишечника
Воспалительные заболевания кишечника (ВЗК), прежде всего, неспецифический язвенный колит (НЯК) и болезнь Крона (БК), часто сопровождаются развитием анемии. Частота анемии при ВЗК, по данным литературы, достаточно вариабельна и колеблется от 6% до 74% [17]. В большинстве исследований это значение составляет 35–50% [9, 12, 13, 19, 25, 27]. С несколько большей частотой анемия выявляется у больных НЯК. Так, S.?Schreiber и соавт. [26] сообщили о наличии анемии у 25% больных с БК и 37% больных с НЯК.
В развитии анемии при ВЗК всегда играют роль несколько механизмов. Условно можно выделить следующие группы причин возникновения анемии при ВЗК [2, 4, 7, 13, 17, 18, 20]:
Наиболее часто у больных ВЗК комбинируются АХЗ и железодефицитная анемия [1, 4, 17, 18], однако роль других факторов тоже велика и выраженность анемии может усиливаться вследствие повторных эпизодов кровотечения, дефицита витаминов и нутриентов, влияния лекарственных препаратов.
Анемия хронических заболеваний была впервые описана Maxwell Wintrobe и George Cartwright в 1949 году. Основными критериями ее диагностики являются снижение уровня сывороточного железа и насыщения трансферрина железом при сохранных запасах железа в ретикулоэндотелиальной ткани (нормальный уровень ферритина).
Успехи в расшифровке основных механизмов АХЗ привели к повышенному вниманию к этому виду анемии, в том числе и в педиатрии. Установлено, что на долю АХЗ приходится около 10–20% всех анемий.
На сегодняшний день главным звеном в патогенезе АХЗ считается гиперпродукция провоспалительных цитокинов. Они приводят к угнетению синтеза эритропоэтина и значительно снижают его эффекты, направленные на усиление пролиферации и созревания эритроидных предшественников [1–4, 13].
Нарушение метаболизма железа при АХЗ во многом опосредовано экспрессией гепсидина. Гепсидин — это белок острой фазы воспаления, который синтезируется печенью в ответ на воздействие липополисахаридов бактерий и интерлейкина 6. Гепсидин снижает всасывание железа в двенадцатиперстной кишке, блокирует высвобождение железа из макрофагов и снижает способность красного костного мозга его усваивать. Недостаточное поступление железа в эритроидные клетки приводит к нарушению их созревания и снижению синтеза гема [3, 14].
Участие провоспалительных цитокинов в генезе АХЗ при ВЗК обусловлено как прямым их ингибирующим действием (в первую очередь, гамма-интерферона) на созревание эритроидных клеток и усилением процессов апоптоза, так и опосредованными эффектами: подавлением синтеза эритропоэтина, снижением чувствительности к нему эритроидных клеток, активацией синтеза гепсидина и нарушением утилизации железа, а также усилением свободно-радикальных реакций [5, 10, 14].
В течение последних двадцати лет в отделении гастроэнтерологии Российской детской клинической больницы (РДКБ) наблюдалось 155 пациентов с НЯК и 61 пациент с БК. Анемия выявлялась у 35% детей с НЯК и имела железодефицитный характер, обусловленный преимущественно хронической кровопотерей. В 69% случаев анемия была легкой степени, в 27% — среднетяжелой, а в 4% — тяжелой. Тяжесть анемии в значительной степени зависела от обширности поражения толстой кишки и выраженности язвенного процесса.
Снижение уровня гемоглобина (110 г/л ≤ Hb
А. В. Малкоч*, кандидат медицинских наук
С. В. Бельмер*, доктор медицинских наук, профессор
Н. А. Анастасевич*
Е. В. Семенова*
Л. М. Карпина**
Н. Е. Щиголева**
И. А. Матина**
А. П. Пономарева**
*РГМУ, **Российская детская клиническая больница, Москва
Автореферат и диссертация по медицине (14.01.04) на тему: Клинико-патогенетические особенности анемии у больных с воспалительными заболеваниями кишечника
Автореферат диссертации по медицине на тему Клинико-патогенетические особенности анемии у больных с воспалительными заболеваниями кишечника
ЛИЩИНСКАЯ Альбина Александровна
Клинико-патогенетические особенности анемии у больных с воспалительными заболеваниями кишечника.
14.01.04 — внутренние болезни 14.01.28- гастроэнтерология
АВТОРЕФЕРАТ диссертации на соискание ученой степени кандидата медицинских наук
Работа выполнена в Центральном научно-исследовательском институте гастроэнтерологии Департамента здравоохранения г. Москвы (директор — доктор медицинских наук, профессор Л.Б. Лазебник)
Доктор медицинских наук, профессор
Доктор медицинских наук, профессор
Доктор медицинских наук, профессор
Ведущая организация: ГОУ ВПО «Российский государственный медицинский университет» Федерального агентства по здравоохранению и социальному развитию
Защита состоится « 27 » января 2012г. в 13 ч. на заседании диссертационного совета Д.850.002.01 Центрального научно — исследовательского института гастроэнтерологии по адресу: 111123, г. Москва, ул. Шоссе Энтузиастов, 86.
С диссертацией можно ознакомиться в библиотеке Центрального научно-исследовательского института гастроэнтерологии. Автореферат разослан «24»декабря 2011 г. Ученый секретарь диссертационного совета
доктор медицинских наук, профессор
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Проблеме анемии при воспалительных заболеваниях кишечника (ВЗК) многие годы уделялось мало внимания, она считалась неизбежным проявлением основного заболевания. Между тем, патогенез и лечение ВЗК-ассоциированной анемии имеют ряд особенностей [Kulnigg S и соавт., 2006; de la Morena Fu соавт.,2008; Pizzi LT и соавт., 2006]. Степень выраженности и продолжительность ее значительно влияют на качество жизни больного [Wells CW и соавт., 2006; Cucino С и соавт.,2001], а в некоторых случаях, приобретают ведущую роль в летальном исходе [Wilson А и соавт., 2004; Bambach CP и соавт.,1986]. Исходя из этого, анемию можно рассматривать, как самостоятельное мультифакторное заболевание, сопутствующее болезни Крона (БК) и язвенному колиту (ЯК). Известно, что анемия — самый частый спутник ВЗК. Частота этого осложнения по разным источникам составляем 9-70% среди больных ВЗК. Установлено, что этиология анемии при ВЗК связана с различными факторами патогенеза, такими, как хроническая кровопотеря, нарушение всасывания железа и витамина В12 в тонкой кишке и снижение уровня фолиевой кислоты при поражении тонкой кишки при болезни Крона. Наряду с этими факторами выделяют также анемию хронических заболеваний, этиология которой связана с повышением уровня провоспалительных цитокинов, которые ответственны за подавление продукции эритропоэтина, что влечет за собой подавление эритропоэза. Однако в настоящее время влияние совокупности этих факторов на развитие анемии изучено не достаточно. Существуют различные мнения в отношении ВЗК-ассоциированной анемии: является ли она осложнением ВЗК или самостоятельной нозологической формой? Мультифакторный характер ВЗК-ассоциированной анемии позволяет выделить различные клини-ко-морфологические и клинико-патогенетические варианты анемии, чтобы более четко оценить их клинико-прогностическую значимость.
Разработать критерии диагностики и терапевтической коррекции различных патогенетических вариантов анемии.
1. Установить частоту анемии у больных с различными клиническими вариантами течения язвенного колита и болезни Крона
2. Исследовать взаимосвязь между клинико-морфологическими особенностями анемии и характером нарушений обмена железа, фолиевой кислоты, витамина В)2 и уровнем эритропоэтина.
3. Определить влияние показателей системного воспаления: СРБ, а-ФНО, геп-сидина на частоту и клинико-морфологические варианты анемии.
4. Выделить клинико-патогенетические варианты анемии у больных ВЗК.
5. Оценить взаимосвязь между базисной противовоспалительной терапией и риском развития анемии у больных ВЗК, и влияние биологической терапии (инфликсимаб, мезенхимальные стромальные клетки) на факторы патогенеза анемии у больных ВЗК.
Впервые проведено комплексное исследование факторов патогенеза анемии при ВЗК: показатели обмена железа, воспалительной активности, уровень гепсидина, содержание эритропоэтина, концентрация В]2 и фолиевой кислоты в крови у больных язвенным колитом и болезнью Крона.
Установлена многофакторность развития анемии у больных с воспалительными заболеваниями кишечника.
Выделены диагностически значимые маркеры воспаления: СРБ, а-ФНО и гепсидин, как факторы риска развития анемии хронических заболеваний у больных ВЗК.
Впервые предложена классификация патогенетических вариантов анемии на основе состояния обмена железа, показателей воспалительной активности и уровня В и и фолиевой кислоты.
Проведена оценка влияния современных методов биологической терапии инфликсимабом или мезенхимальными стромальными клетками на факторы патогенеза анемического синдрома у больных ВЗК.
• Выделены критические значения уровня СРБ, а-ФНО и гепсидина, повышающие относительный риск развития анемии у больных ВЗК.
• Определены дополнительные критерии оценки эффективности терапии ВЗК, исходя из клинико-патогенетических вариантов анемии.
• Предложены дополнительные показания к назначению биологической терапии, исходя из клинико-патогенетического варианта анемии.
Апробация работы Результаты исследования опубликованы в 5 печатных работах, в том числе 3 журналах, рекомендованных ВАК, и доложены на XX и XI съездах Научного общества гастроэнтерологов России в 2010 и 2011гг., г. Москва; на 18th United European Gastroenterology Week 2010, г. Барселона, Испания.
Апробация работы проведена 12.10.2011г.
Объем и структура работы Диссертация изложена на 100 страницах машинописного текста, состоит из введения, 4 глав, которые содержат обзор литературы, сведения о больных и методы исследования, результаты проведенных исследований и обсуждение полученного материала, выводы, практические рекомендации и список литературы. Работа иллюстрирована таблицами и рисунками. Библиографический указатель включает 107 работ, из них на русском языке 8 источников и 99 работ на английском языке.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ Клиническая часть исследования Для решения поставленных задач было обследовано 274 больных язвенным колитом и болезнью Крона, мужчин и женщин средний возраст 41,16 ± 16,49 лет, находившихся на лечении в отделении патологии кишечника ЦНИИГ в период с 2008 по 2010 годы. Из них у 206 больных диагностирован ЯК и у 68
больных БК. Среди них был 131- мужчина, средний возраст 36,69+15,42 лет и 143 женщины, средний возраст 45,25 ± 16,44 лет с длительностью заболевания от нескольких месяцев до 30 и более лет. Критерии включения в исследование.
Больные считались подходящими для включения в исследование, если они соответствовали всем указанным критериям:
• Имели достоверный диагноз ЯК или БК различной протяженности поражения и степени тяжести, подтвержденный с помощью колоноскопии, ирригоскопии, рентгенологического исследования тонкой кишки, гистологического исследования.
• Способность понять цели исследования и возможные риски, подписать и заверить датой форму информированного согласия.
Критерии исключения из исследования
Больные исключались из исследования, если они соответствовали любому их приведенных критериев:
• Сердечная недостаточность стадий ПА, ПВ, Ш (по классификации Васи-ленко-Стражеско);
• Стенокардия напряжения любого функционального класса, предполагающая прием коротко и/или длительно-действующих нитратов.
• Тяжелая дыхательная недостаточность (степени П-Ш).
• Хроническая почечная недостаточность (повышение уровня креатинина сыворотки >140 мкм оль/л);
• Хроническая печеночная недостаточность класса А-С по СЫИ-РияЬ;
• Острые или обострение хронических воспалительных заболеваний внутренних органов;
• Наличие в анамнезе лимфопролиферативных заболеваний или злокачественных опухолей.
• Острые или хронические кровопотери, не связанные с ВЗК.
В соответствии с классификационно-клиническими критериями все больные были разделены на следующие группы: по распространенности, тяжести, активности заболевания.
У больных ЯК тотальное поражение толстой кишки встречалась у 95 (46,1%) больных, левосторонняя локализация воспалительного процесса и дис-тальное поражение наблюдалась одинаково часто, примерно по 1\3 больных — у 55 (26,7%) и у 56 (27,2%) соответственно. Чаще заболевание имело хроническое рецидивирующее течение — у 140 (68%) больных, реже — непрерывное течение -у 13 (6,3%) больных. И у 53 (25,7%) больных зафиксирована первая атака ЯК. Для оценки степени тяжести атаки использовались критерии Тгие1оуе&\У1И5 (1955г), больные распределились следующим образом: среднетяжелая форма заболевания встречалась у 96 (46,6%) больных, легкое течение болезни зарегистрировано у 49 (23,8%) больных и тяжелое течение заболевания встречалось у 61(29,6%) больного.
В исследование также включено 68 больных БК — 36 женщин и 32 мужчины от 16 до 76 лет, средний возраст 36,5+15,2 лет. По распространенности воспалительного процесса (как известно, при БК локализация воспалительного процесса возможна изолированно в толстой кишке (колит) или в тонкой кишке (илеит), либо в тонкой и толстой одновременно (илеоколит), наши больных разделились следующим образом: у 22 (32,4%) больных имелось на момент обследования изолированное поражение толстой кишки (колит), у 23 (33,8%) -изолированное поражение тонкой кишки (илеит), у 23 (33,8%) — сочетанное поражение как тонкой, так и толстой кишки (илеоколит). По тяжести атаки заболевания, ориентируясь на индекс Беста, 30 (44,1 %) больных имели тяжелую атаку заболевания и 38 (55,9 %) больных — нетяжелую атаку заболевания.
Анализ сопутствующей патологии показал, что 106(51,6%) больных ЯК и 31(45,6%) больных БК имели сопутствующие заболевания, что составило половину (50%) от общей выборки.
Соответственно задачам исследования всем больным воспалительными заболеваниями кишечника проводилось клиническое обследование, включаю-
щее осмотр больного, определение индексов клинико-эндоскопической активности по Мейо для язвенного колита и по Бесту для болезни Крона. Диагноз был подтвержден инструментальными методами обследования, проводилась, ректороманоскопия с биопсией слизистой оболочки толстой кишки, колоно-скопия с илеоскопией и посегментарной биопсией слизистой оболочки подвздошной и ободочной кишки и рентгенологическое исследование тонкой кишки (при болезни Крона).
Из лабораторных показателей, помимо развернутого клинического анализа крови, определяли показатели обмена железа ( железо сыворотки, ферритин, трансферрин, общую железосвязывающую способность сыворотки, латентную железосвязывающую способность сыворотки, насыщение трансферрином железа, растворимый рецептор трансферрина, а также уровень эритропоэтина, витамина В12, фолиевой кислоты, гепсидина,СРБ и а- ФНО.
Всем больным выполнялся антиглобулиновый тест для исключения гемолитической анемии, ни в одном случае тест не был положительным.
Всем больным определяли антитела к внутреннему фактору, ни в одном случае повышения уровня антител выявлено не было.
Всем больным определяли антитела к париетальным клеткам желудка. Повышений уровень антител выявлен у 2 больных, у одного из них он сопровождался наличием латентного железодефицита, а у второго железодефицитной анемией легкой степени тяжести.
Всем больным проводилась фиброэзофагогастродуоденоскопия с проведением уреазного теста для определения наличия Helicobacter pylori (Нр). Из 274 больных ВЗК положительный уреазный тест зафиксирован у 56 (20,4%) больных. Среди 96 больных ВЗК с наличием анемии, Нр выявлен у 22 (22,9%), а в группе больных ВЗК без анемии — у 34 (19,1%) больных. Таким образом, достоверной разницы влияния хеликобактерной инфекции на частоту ВЗК-ассоциированной анемии выявлено не было ( р > 0,05).
Обследовано 274 больных с установленным диагнозом Ж и БК, находившихся на лечении в отделении патологии кишечника ЦНИИГ с 2008г по
2010г, с наличием анемии и без нее. После проведенного обследования сформированы две группы больных ВЗК с анемией — 96 человек и без анемии — 50 человек с примерно одинаковыми тендерными характеристиками. В этих группах:
• изучено состояние обмена железа, витамина В12, фолиевой кислоты, уровня
эритропоэтина, гепсидина и показателей воспалительной активности;
• на основании полученных данных были рассчитаны относительные риски
развития анемии при повышении этих показателей;
• изучено влияние проводимой терапии на риск развития анемии;
• выделены клинико-патогенетические варианты анемии.
Статистическую обработку результатов исследования проводили при помощи пакета статистических программ -¡^аивйка 6.0» и «Вю$1аЬ>. Рассчитывали среднее значение, стандартное квадратичное отклонение, медиану, 95% доверительный интервал среднего значения. Достоверность разницы определяли по критерию Стьюдента при нормальном распределении и по критерию Манна-Уитни при отсутствии нормального распределения полученных результатов. Достоверность разницы непараметрических показателей определяли по критерию %2 или критерию Фишера в зависимости от численности сравниваемых групп, корреляционный анализ проводили по методу Пирсона.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ Согласно критериям ВОЗ анемия определяется, как состояние, при котором уровень гемоглобина снижается 40 пкг/мл до 3,71(1,2-6,0;95%ДИ), а при повышении гепсидина более 800 пкг/мл до 5,1(2,1-17,6).
5. У больных ВЗК выделены следующие клинико-патогенетические варианты анемии : железодефицитная анемия 6,2% (3,3 -9,1; 95%ДИ), железодефицитная анемия в сочетании с анемией хронических заболеваний -12% (8,1-15,9;95%ДИ), анемия хронических заболеваний 3,6% (1,4-5,8;95%ДИ), Вп и/или фолиеводефицитная анемия — 3,6% (1,4-5,8;95%ДИ), а у 10,2% (6,7-13,7;95%ДИ) больных анемия обусловлена сочетанием 3-х и более патогенетических факторов.
6. Неэффективная базисная противовоспалительная терапия у 41,5% больных сопровождается развитием анемии, при положительном эффекте лечения анемия встречается у 18,4% больных (х2=6,9,р=0,009).
7. Применение биологической терапии инфликсимабом или мезенхимальными стромальными клетками приводит к достоверному снижению уровня гепсидина, СРБ, а- ФНО и способствует восстановлению гемоглобина чаще, чем традиционная терапия глюкокортикостероидами и иммуносупрессорами-(77,4% уя. 43% больных; %2=6,66,р=0,036) на 21 день терапии.
1. У больных ВЗК в план обследования необходимо включать комплекс исследований по выявлению факторов патогенеза анемии: обмен железа, содержание В12 и фолиевой кислоты в крови, маркеры активности воспаления (СРБ, а- ФИО, гепсидин).
2. При наличии у больных ВЗК в анализах крови повышения СРБ выше 30 мкг/мл и/или а-ФНО более 40 пкг\мл и/или гепсидина выше 800 пкг/мл необходимо рассматривать анемию, как анемию хронических заболеваний, или сочетающую другие варианты анемии с анемией хронических заболеваний.
3. При сохранении анемии, лечение больного с ВЗК нельзя считать адекватным.
4. При наличии у больного ВЗК анемии хронических заболеваний, рефрактерной к проводимой базисной противовоспалительной терапии, рекомендуется традиционное лечение дополнять биологической терапией.
Работы, опубликованные по теме диссертации:
1. Носкова К.К.Риск развития и клинико-патогенетические особенности анемии на фоне базисной терапии воспалительных заболеваний кишечника. Носкова К.К., Лищинская A.A., Парфенов А.И., Князев О.В., Варванина Г.Г., Дроздов
B.Н. Экспериментальная и клиническая гастроэнтерология, 2011;10: С.12-17
2. Дроздов В.Н. Клинико-диагностическое значение уровня гепсидина в регуляции обмена железа у больных воспалительными заболеваниями кишечника. Дроздов В.Н., Парфенов А.И., Лищинская A.A., Носкова К.К., Ткаченко Е.В., Варванина Г.Г. Экспериментальная и клиническая гастроэнтерология, 2011; 10:
3. Носкова К.К. Частота анемии у больных гастроэнтерологического стационара. Носкова К.К., Лищинская A.A., Мелькина Е. С., Дроздов В.Н.Экспериментальная и клиническая гастроэнтерология, 2011; 10: С.9-11
4. Лищинская A.A. Гепсидин, как один из основных факторов патогенеза у больных ВЗК. Лищинская A.A., Дроздов В.Н., Парфенов А.И., Носкова К.К., Барышников E.H. Тезисы XI Съезда научного общества гастроэнтерологов России, 2011,Москва, El 66: 141-142.
5. Lishchinskaja A.A. Hepcidin in patients with inflammatory bowel diseases accompanied by anemia. Lishchinskaja A.A., Drozdov V.N, Parfenov A.I., Noskova K.K., Baryshnicov E.N. UEGW BARCELONA 2010, 18th United European Gastroenterology Week, October 23 — 27,2010. Тезисы и постерный доклад.
ВЗК воспалительные заболевания кишечника
ОЖСС общая железосвязывающая способность сыворотки
ЛЖСС латентная железосвязывающая способность сыворотки
Анемия – это состояние организма человека, характеризующееся пониженной концентрацией гемоглобина в единице объема крови, и, как правило, коррелирующее с одновременным снижением количества эритроцитов. Состояние анемии вторично и является симптомом различных заболеваний. Многочисленные болезни, от заболеваний инфекционной и паразитарной этиологии и до предраковых состояний и наличия опухолей сопровождаются анемией. Однако и анемия как состояние, вызывая нарушения в газообмене организма, вызывает хроническую усталость, повышенную сонливость, головокружения, упадок сил, повышает раздражительность. В тяжелых случаях анемия может приводить к шоковым состояниям, выраженной гипотонии, коронарной, легочной недостаточности, геморрагическому шоку. При обнаружении анемии лечение направлено на устранение сопутствующих симптомов и на терапию основного заболевания, вызвавшего состояние анемии.
Анемия считается одним из самых распространенных патологических состояний среди населения планеты. Среди разновидностей анемий выделяют несколько основных состояний, классифицируя их по причинам возникновения анемии:
- железодефицитная анемия;
- гемолитическая анемия;
- апластическая анемия;
- сидеробластная разновидность анемии;
- B12-дефицитная, возникающая вследствие недостаточности витамина B12;
- постгеморрагическая анемия;
- серповидноклеточная анемия и другие формы.
Примерно каждый четвертый человек на планете, в соответствии с исследованиями специалистов, страдает от железодефицитной формы анемии вследствие снижения концентрации железа. Опасность этого состояния – в стертой клинической картине железодефицитной анемии. Симптомы становятся выраженными, когда уровень железа и, соответственно, гемоглобина, снижается до критической отметки.
К группам риска развития анемии среди взрослых относятся следующие категории населения:
- последователи вегетарианских принципов питания;
- люди, страдающие от кровопотери вследствие физиологических причин (обильные менструации у женщин), заболеваний (внутренние кровотечения, выраженные стадии геморроя и т. п.), а также доноры, сдающие кровь и плазму на регулярной основе;
- беременные и кормящие женщины;
- профессиональные спортсмены;
- пациенты с хроническими или острыми формами некоторых заболеваний;
- категории населения, испытывающие недостаток в питании или ограниченный рацион питания.
Самая распространенная железодефицитная форма анемии является следствием недостатка железа, что, в свою очередь, может быть спровоцировано одним из следующих факторов:
- недостаточностью поступления железа с пищей;
- повышенной потребностью в железе в виду ситуативных или индивидуальных особенностей (патологий развития, дисфункций, заболеваний, физиологических состояний беременности, лактации, профессиональной деятельности и т. д.);
- усиленной потерей железа.
Легкие формы анемии, как правило, поддаются излечению при помощи коррекции рациона питания, назначения витаминно-минеральных комплексов, железосодержащих препаратов. Средняя и тяжелая форма анемии требует вмешательства специалиста и курса соответствующей терапии.
Диагностическим критерием анемии у мужчин является снижение концентрации гемоглобина в крови до уровня ниже 130 г/л. Статистически анемия у мужчин диагностируется реже, чем у представителей женского пола в связи с особенностями физиологии: отсутствия менструаций, приводящих к ежемесячной потере крови, гестации, лактации, нередко сопровождающихся дефицитами необходимых микроэлементов.
Однако анемия среди мужской части населения также диагностируется нередко, и, как правило, является следствием наличия хронического заболевания и нарушений в работе различных систем организма.
Так, к хронической железодефицитной анемии у мужчин чаще всего приводят скрытые желудочно-кишечные кровотечения при эрозиях кишечника, язвенной болезни, геморрое. В этиологии анемий у мужчин могут быть также паразитарные заболевания, доброкачественные и злокачественные новообразования. Разнообразие факторов, вызывающих анемию, требует диагностики причины возникновения состояния и соответствующей терапии.
Анемия у женщин диагностируется при показателях гемоглобина ниже 120 г/л (или 110 г/л во время вынашивания ребенка). Физиологически женщины более склонны к возникновению анемии.
При ежемесячных менструальных кровотечениях женский организм теряет эритроциты. Средний объем ежемесячной кровопотери составляет 40-50 мл крови, однако при обильных менструациях количество выделений может доходить до 100 и более мл за период в 5-7 дней. Несколько месяцев подобной регулярной кровопотери способно привести к развитию анемии.
Еще одна форма скрытой анемии, распространенная среди женского населения с высокой частотой (20% женщин), спровоцирована снижением концентрации ферритина, белка, выполняющего функцию накопления железа в крови и высвобождающим его, когда уровень гемоглобина снижается.
Анемии беременных возникают под воздействием различных факторов. Растущий плод изымает из материнского кровотока вещества, необходимые для развития, в том числе железо, витамин В12, фолиевую кислоту, необходимых для синтеза гемоглобина. При недостаточном поступлении витаминов и минералов с пищей, нарушениях ее обработки, хронических заболеваниях (гепатиты, пиелонефриты), выраженном токсикозе первого триместра, а также при многоплодной беременности у будущей матери развивается анемия.
К физиологической анемии беременных относят гидремию, «разжижение» крови: во второй половине гестационного периода объем жидкой части крови возрастает, что приводит к естественному снижению концентрации эритроцитов и транспортируемого ими железа. Данное состояние нормально и не является признаком патологический анемии, если уровень гемоглобина не опускается ниже показателя в 110 г/л или восстанавливается самостоятельно в сжатые сроки, а также отсутствуют признаки дефицита витаминов и микроэлементов.
Тяжелая анемия беременных угрожает невынашиванием плода, преждевременными родами, токсикозом третьего триместра (гестозом, преэклампсией), осложнениями процесса родоразрешения, а также анемией у новорожденного.
К симптомам анемии у беременных относят общую клиническую картину анемии (усталость, сонливость, раздражительность, тошнота, головокружения, сухость кожи, ломкость волос), а также извращения обоняния и вкуса (желание есть мел, штукатурку, глину, необработанное мясо, нюхать вещества с резким запахом среди бытовой химии, строительных материалов и т. п.).
Незначительная анемия беременных и кормящих восстанавливается после родов и окончания периода лактации. Однако при малом промежутке между повторными родами процесс восстановления организма не успевает завершиться, что приводит к усилению признаков анемии, особенно выраженных при промежутке между родами менее 2-х лет. Оптимальный срок восстановления женского организма составляет 3-4 года.
Согласно исследованиям специалистов, лактационная анемия чаще всего диагностируется на достаточно выраженном этапе заболевания. Развитие анемии связано с кровопотерей в процессе родоразрешения и лактацией на фоне гипоаллергенной диеты кормящих. Сама по себе выработка грудного молока не способствует развитию анемии, однако при исключении из рациона питания некоторых важных групп продуктов, например, бобовых (из-за риска повышенного газообразования у ребенка), молочных и мясных продуктов (из-за аллергических реакций у грудного ребенка) вероятность развития анемии значительно возрастает.
Причиной поздней диагностики послеродовых анемий считается смещение фокуса внимания с состояния матери на ребенка прежде всего у самой молодой матери. Особенности здоровья малыша волнуют ее больше своего самочувствия, а симптомокомплекс анемии – головокружения, усталость, сонливость, снижение концентрации внимания, бледность кожных покровов – чаще всего воспринимаются как следствие переутомления, связанного с уходом за новорожденным.
Еще одна причина распространенности железодефицитной анемии кормящих связана с неверным мнением о влиянии препаратов железа, проникающих в грудное молоко, на работу желудочно-кишечного тракта младенца. Это мнение не подтверждается специалистами, и, при диагностике железодефицитной анемии назначенные специалистом медикаменты и витаминно-минеральные комплексы обязательны к приему.
Анемия во время женского климакса – достаточно распространенное явление. Гормональная перестройка, последствия периода менструаций, гестации, родов, различные дисфункциональные состояния и хирургические вмешательства становятся причиной хронической анемии, усиливающейся на фоне климактерических изменений организма.
Провокативную роль играет и ограничение в питании, несбалансированные диеты, к которым прибегают женщины, стремящиеся снизить скорость набора веса, обусловленную колебаниями гормонального баланса в предклимактерический период и непосредственно во время климакса.
К возрасту наступления климакса отмечается также снижение запасов ферритина в организме, что является дополнительным фактором развития анемии.
Колебания самочувствия, усталость, раздражительность, головокружения нередко воспринимаются как симптомы наступившего климакса, что приводит к поздней диагностике анемии.
По исследованиям Всемирной Организации Здравоохранения (ВОЗ) 82% детей страдают от анемии различной степени выраженности. Низкий уровень гемоглобина и железодефицитные состояния различной этиологии приводят к нарушениям умственного и физического развития ребенка. К основным причинам возникновения анемии в детском возраста относят:
- отсутствие полноценного, сбалансированного питания;
- нарушения всасываемости железа в желудочно-кишечном тракте;
- дисфункции регуляции витаминного обмена;
- паразитарные болезни;
- дисбактериоз, гастрит, гастродуоденит и иные заболевания ЖКТ;
- гормональные дисбалансы;
- экологические факторы: отравление тяжелыми металлами, загазованность воздуха, загрязнение воды, пищевых продуктов и т. п.
Потребность в железе различается у детей в зависимости от возраста, а по достижении периода пубертата коррелирует с половой принадлежностью. Терапия дефицитных анемий у детей при помощи сбалансированной диеты не всегда эффективна, поэтому специалисты предпочитают регуляцию при помощи медикаментов, гарантирующих поступление необходимой дозы микроэлементов в организм ребенка.
Новорожденный ребенок появляется на свет с определенным запасом железа, полученным из организма матери в период внутриутробного развития. Сочетание несовершенства собственного кроветворения и быстрого физического роста приводят к физиологическому снижению уровня гемоглобина в крови у здоровых детей, родившихся в положенный срок, к 4-5 месяцу жизни, у недоношенных – к возрасту в 3 месяца.
Искусственное и смешанное вскармливание считаются факторами риска, повышающими вероятность развития анемии. Особенно стремительно развивается гемоглобиновая недостаточность при замене грудного молока и/или искусственных смесей коровьим, козьим молоком, кашами и прочими продуктами в период до 9-12 месяцев.
К симптомам анемии детей до года относят:
- бледность кожи, так как кожные покровы еще очень тонкие, наблюдается повышенная «прозрачность», «синюшность» кожи;
- беспокойство, беспричинный плач;
- нарушения сна;
- снижение аппетита;
- выпадение волос вне физиологических рамок смены волосяного покрова;
- частые срыгивания;
- низкая прибавка массы тела;
- отставание сначала в физическом, потом и в психоэмоциональном развитии, снижение интереса, невыраженность комплекса оживления и т. п.
Особенность детей этого возраста – способность к высокому (до 70%) усвоению железа из пищи, поэтому не во всех случаях анемии педиатры видят необходимость в назначении препаратов, ограничиваясь коррекцией рациона ребенка, переводом на полное грудное вскармливание, подбором соответствующей потребностям смеси-заменителя. При выраженной степени анемии назначаются препараты железа в возрастной дозировке, например, Феррум Лек или Мальтофер в виде сиропа капель.
При диагностировании выраженной степени анемии причины могут быть не в рационе питания, а в болезнях, патологиях и дисфункциях организма ребенка. Анемия может быть вызвана и наследственными заболеваниями, некоторые наследственные нарушения развития и заболевания характеризуются снижением концентрации железа, зритроцитопенией, недостаточностью системы кроветворения и т. п. При стойких низких показателях уровня гемоглобина необходимо обязательное обследование детей и коррекция первичного заболевания.
Фото: crystal ligh/ Shutterstock.com
Проведенное в 2010 году масштабное исследование выявило высокую частоту наличия железодефицитного типа анемии у дошкольников: каждый второй ребенок страдает от недостатка гемоглобина из-за пониженного уровня железа. В этиологии этого явления могут находиться различные факторы, однако наиболее распространенный – последствия нескорректированной анемии первого года жизни.
Второй фактор, провоцирующий анемию у дошкольников, часто сочетается с первым. Недостаточно сбалансированный рацион питания, нехватка белка (мясных продуктов) и витаминов (овощей) нередко объясняется нежеланием ребенка есть мясо и овощи, отдавая предпочтение полуфабрикатам и сладостям. Это исключительно вопрос воспитания и внимания родителей к здоровому рациону без предоставления альтернативных продуктов с раннего возраста, что также требует перевода членов семьи на рационально составленную диету.
В случае, когда питание соответствует возрастным нормам, а ребенок проявляет признаки анемии (бледность, сухость кожных покровов, быстрая утомляемость, сниженный аппетит, повышенная ломкость ногтевых пластин и т. п.), необходимо обследование у специалиста. Несмотря на то, что у 9 из 10 дошкольников с диагностированной анемией она обусловлена дефицитом железа, в 10% анемий причина находится в заболеваниях и патологиях (целиакия, лейкемия и т. д.).
Нормы содержания гемоглобина в крови у детей 7-11 лет – 130 г/л. Проявления анемии в этом возрастном периоде нарастают постепенно. К признакам развивающегося малокровия относят, помимо симптомов анемии у дошкольников, снижение концентрации внимания, частые острые респираторно-вирусные и бактериальные заболевания, повышенную утомляемость, что может сказываться на результатах учебной деятельности.
Немаловажный фактор развития анемии у детей, посещающих общеобразовательные учреждения, – отсутствие возможности контроля за рационом питания. В данном возрастном периоде еще сохраняется достаточный уровень усвоения железа из поступающей в организм пищи (до 10%, снижаясь к возрасту взрослого до 3%), поэтому профилактикой и коррекцией железодефицитного типа анемии служит правильно организованный прием пищи с богатыми витаминами и микроэлементами блюдами в его основе.
Гиподинамия, ограниченность пребывания на свежем воздухе, предпочтение играм в доме, особенно с планшетами, смартфонами и т. п., диктующими длительное пребывание в статичном положении, также провоцируют анемию.
Подростковый период опасен развитием анемии прежде всего у девушек с началом менструаций, характеризующихся периодическим уменьшением гемоглобина с потерей крови. Второй фактор, провоцирующий начало анемичности у девочек-подростков, связан с концентрацией на собственной внешности, стремлению к соблюдению различных диет и уменьшению ежедневного рациона питания, исключения необходимых для здоровья продуктов.
Быстрые темпы роста, интенсивные занятия спортом, неправильное питание и анемии предыдущего периода также влияют на подростков обоего пола. К симптомам анемии подросткового периода относят голубой оттенок склеры глаз, изменение формы ногтей (чашеобразная форма ногтевой пластины), дисфункции пищеварительной системы, нарушения вкуса, обоняния.
Выраженные формы заболевания в подростковом периоде требуют терапии медикаментами. Изменение формулы крови отмечается, как правило, не ранее 10-12 дня после начала курса лечения, признаки клинического выздоровления при условии соблюдения назначений специалиста наблюдаются через 6-8 недель.
Анемия характеризуется снижением концентрации гемоглобина и эритроцитов в единице крови. Основное назначение эритроцитов – участие в газообмене, транспорт кислорода и углекислого газа, а также питательных веществ и продуктов метаболизма к клетками и тканям для дальнейшей переработки.
Эритроцит наполнен гемоглобином, белком, придающим эритроциту и крови красный цвет. В состав гемоглобина входит железо, в связи с чем его нехватка в организме обуславливает высокую частоту железодефицитной разновидности анемии среди всех разновидностей данного состояния.
Выделяют три основных фактора развития анемии:
- острая или хроническая кровопотеря;
- гемолиз, разрушение эритроцитов;
- снижение продуцирования эритроцитов костным мозгом.
По разновидности факторов и причин выделяют следующие виды анемии:
- пищевую, связанную с недостаточностью рациона или общей нехваткой пищи;
- физическую (травмы, оперативные вмешательства, родоразрешение, обморожения, ожоги и т. п.);
- генетической этиологии;
- инфекционную, вторичную анемию при таких заболеваниях, как вирусный гепатит, цирроз, туберкулез печени, гломерулонефрит, болезни желудочно-кишечного тракта (язвенная болезнь ЖКТ, колит, гастрит, болезнь Крона), ревматоидный артрит, системная волчанка, доброкачественные и злокачественные новообразования различной локализации;
- инфекционную (при вирусных, бактериальных, паразитарных и протозойных заболеваниях);
- отравления ядовитыми веществами и медикаментами, в том числе при длительном, особенно неконтролируемом курсе терапии (антибиотикотерапия, прием цитостатиков, нестероидных противовоспалительных препаратов, средств антитиреоидного, противоэпилептического действия);
- воздействие радиоактивных волн.
Классификация анемичного состояния базируется на различных признаках, описывающих этиологию, механизмы развития заболевания, стадию анемии, диагностическим показателям.
Степень тяжести анемии основывается на показателях анализа крови и зависит от возрастной, половой принадлежности и физиологического периода.
В норме у здорового взрослого мужчины показатели гемоглобина составляют 130-160 г/л крови, у женщины – от 120 до 140 г/л, в период гестации от 110 до 130 г/л.
Легкая степень диагностируется при снижении уровня концентрации гемоглобина до 90 г/л у обоих полов, при средней показатель соответствует диапазону от 70 до 90 г/л, тяжелая степень анемии характеризуется уменьшением уровня гемоглобина ниже границы в 70 г/л.
В патогенезе анемии наблюдаются три фактора, которые могут воздействовать по отдельности или вместе:
- кровопотеря острого или хронического характера;
- нарушения системы кроветворения, продуцирования эритроцитов костным мозгом (железодефицитная, ренальная, апластическая анемия, дефицитные анемии при недостатке витамина В12 и/или фолиевой кислоты);
- усиленное разрушение эритроцитов до окончания срока функционирования (120 дней) вследствие генетических факторов, аутоиммунных заболеваний.
Цветовой показатель служит индикатором насыщенности эритроцитов гемоглобином и рассчитывается по особой формуле в процесс анализа крови.
Гипохромную форму с ослабленной окраской эритроцитов диагностируют при цветовом показателе ниже 0,80.
Нормохромная форма, с цветовым показателем в пределах нормы, определяется диапазоном 0,80-1,05.
Гиперхромной форме, с чрезмерным насыщением гемоглобином, соответствует цветовой показатель выше 1,05.
Размер эритроцитов – важный показатель при диагностике причины развития анемии. Различные размеры эритроцитов могут указывать на этиологию и патогенез состояния. В норме эритроциты продуцируются с диаметром от 7 до 8,2 микрометра. Выделяют следующие разновидности на базе определения размера превалирующего количества эритроцитов в крови:
- микроцитарная, диаметр эритроцитов менее 7 мкм, указывает на высокую вероятность дефицита железа;
- нормоцитарная разновидность, размер красных кровяных телец от 7 до 8,2 мкм. Нормоцитоз – признак постгеммарогической формы;
- макроцитарная, с размером эритроцитов более 8,2 и менее 11 мкм, как правило, указывает на дефицит витамина В12 (пернициозная форма) или фолиевой кислоты;
- мегалоцитоз, мегалоцитарная (мегалобластная) форма, при которой диаметр эритроцитов более 11 мкм, соответствует тяжелым стадиям некоторых форм, нарушениям в формировании красных кровяных телец и т. п.
Степень эритропоэза, способности красного костного мозга в формированию эритроцитов, оценивается по количественному показателю ретикулоцитов, клеток-предшественников или «незрелых» эритроцитов, что считается основным критерием при оценке способности тканей костного мозга к регенерации и является важным фактором для прогнозирования состояния пациента и выбора методов терапии. Нормальной концентрацией ретикулоцитов является показатель в 0,5-1,2% от общего количества эритроцитов на единицу крови.
В зависимости от уровня ретикулоцитов выделяют следующие формы:
- регенераторная, указывающая на нормальную способность костного мозга к восстановлению. Уровень ретикулоцитов 0,5-1,2%;
- гипорегенераторная, с концентрацией незрелых эритроцитов ниже 0,5%, что свидетельствует о пониженной способности костного мозга к самостоятельному восстановлению;
- гиперрегенераторная, показатель ретикулоцитов более 2%;
- апластическая анемия диагностируется при снижении концентрации незрелых эритроцитов менее 0,2% среди массы всех красных кровяных телец и является признаком резкого подавления способности к регенерации.
Железодефицитная форма составляет до 90% всех разновидностей анемичных состояний. Согласно исследованиям Всемирной Организации Здравоохранения, данной формой страдают один из 6 мужчин и каждая третья женщина в мире.
Гемоглобин – это сложное белковое соединение, имеющее в составе железо, способное к обратимой связи с молекулами кислорода, что является базой процесса транспортировки кислорода из легких в ткани организма.
Железодефицитная форма – это анемия гипохромная, с признаками микроцитоза, наличия в формуле крови эритроцитов с диаметром меньше нормального, что связано с недостаточностью железа, базового элемента для формирования гемоглобина, наполняющего полость эритроцита и придающего ему красный цвет.
Железо является жизненно важным микроэлементом, участвующим во многих процессах метаболизма, обмене питательных веществ, газообмене организма. В течение суток взрослый человек расходует 20-25 мг железа, при этом общий запас данного элемента в организме составляет около 4 г.
К причинам развития данной формы состояния относят факторы различной этиологии.
Нарушения поступления железа:
- несбалансированный рацион питания, строгое вегетарианство без компенсации железосодержащих продуктов, голодание, диеты, прием медикаментов, наркотических и иных веществ, подавляющих чувство голода, нарушения аппетита в связи с заболеваниями физической или психоэмоциональной этиологии;
- социально-экономические причины недоедания, нехватки пищи.
Нарушения процесса всасывания, усвоения железа:
- заболевания желудочно-кишечного тракта (гастриты, колиты, язвенная болезнь желудка, резекция данного органа).
Дисбаланс расхода и поступления железа вследствие повышенной потребности организма:
- беременность, период лактации;
- возраст пубертатных скачков физического роста;
- хронические заболевания, провоцирующие гипоксию (бронхит, обструктивная болезнь легких, пороки сердца и прочие болезни сердечно-сосудистой системы и органов дыхания);
- заболевания, сопровождающиеся гнойно-некротическими процессами: сепсис, абсцессы тканей, бронхоэктатическая болезнь и т. д.
Потеря железа организмом, острая или хроническая посгемморагическая:
- при легочных кровотечениях (туберкулез, опухолевые образования в легких);
- при желудочно-кишечных кровотечениях, сопровождающих язвенную болезнь желудка, двенадцатиперстной кишки, раковые образования желудка и кишечника, выраженную эрозию слизистой ЖКТ, варикозы вен пищевода, прямой кишки, геморрой, глистная инвазия кишечника, неспецифический язвенный колит и другие;
- при маточных кровотечениях (обильные менструации, рак матки, шейки матки, миома, отслойка плаценты в гестационном периоде или в родах, внематочная беременность в период изгнания, родовые травмы матки и шейки);
- кровотечения с локализацией в почках (опухолевые образования в почках, туберкулезные изменения в почках);
- кровотечения, в том числе внутренние и скрытые, вследствие травм, потеря крови при ожогах, обморожениях, при плановых и экстренных хирургических вмешательствах и т. п.
Клиническую картину железодефицитной формы составляют анемический и сидеропенический синдром, вызванные в первую очередь недостаточным газообменом в тканях организма.
К симптомам анемического синдрома относят:
- общее недомогание, хроническую усталость;
- слабость, неспособность переносить длительные физические и умственные нагрузки;
- синдром дефицита внимания, сложности с концентрацией, ригидность;
- раздражительность;
- головные боли;
- головокружения, иногда обмороки;
- сонливость и нарушения сна;
- одышка, учащенный темп сердцебиения как при физических и/или психоэмоциональных нагрузках, так и в состоянии покоя;
- черный цвет стула (при кровотечениях желудочно-кишечного тракта).
Сидеропенический синдром характеризуется следующими проявлениями:
- извращение вкусовых пристрастий, тяга к поеданию мела, глины, сырого мяса и т. п.;
- искажения обоняния, желание нюхать краску, бытовую химию, вещества с резким запахом (ацетон, бензин, стиральный порошок и т. п.);
- ломкость, сухость волосяного покрова, отсутствие блеска;
- белые пятна на ногтевых пластинах рук;
- сухая кожа, шелушение;
- бледность кожных покровов, иногда – голубизна склер;
- наличие хейлитов (трещин, «заед») в уголках губ.
На тяжелых стадиях ЖДА отмечаются неврологические симптомы: ощущения «мурашек», онемение конечностей, затруднение при глотании, ослабление контроля над мочевым пузырем и т. д.
Диагноз «железодефицитная анемия» основывается на данных внешнего осмотра, оценке результатов лабораторных анализов крови и инструментального обследования пациента.
При внешнем медицинском осмотре и сборе анамнеза обращают внимание на состояние кожных покровов, слизистых поверхностей рта, уголков губ, а также оценивают размер селезенки при пальпации.
Общий анализ крови при классической клинической картине ЖДА показывает снижение концентрации эритроцитов и гемоглобина относительно возрастных и половых норм, наличие эритроцитов разного размера (пойкилоцитоза), выявляет микроцитоз, присутствие, в тяжелых формах – преобладание красных кровяных телец с диаметром менее 7,2 мкм, гипохромную, слабо выраженную окраску эритроцитов, низкий цветовой показатель.
Результаты биохимического исследования крови при ЖДА имеют следующие показатели:
- пониженная относительно границ нормы концентрация ферритина, белка, выполняющего функцию депо железа в организме;
- низкий уровень сывороточного железа;
- повышенная железосвязывающая способность сыворотки крови.
Диагностика ЖДА не ограничивается выявлением дефицита железа. Для эффективной коррекции состояния после сбора анамнеза специалист при необходимости назначает инструментальные исследования с целью уточнения патогенеза заболевания. К инструментальным исследованиям в данном случае относят:
- фиброгастродуоденоскопию, исследование состояния слизистой пищевода, стенок желудка, двенадцатиперстной кишки;
- ультразвуковое исследование печени, почек, женских репродуктивных органов;
- колоноскопию, исследование стенок толстого кишечника;
- методы компьютерной томографии;
- рентгенологическое исследование легких.
В зависимости от стадии и патогенеза ЖДА выбирают терапию при помощи коррекции рациона питания, медикаментозный курс лечения, хирургическое вмешательство для устранения причин кровопотери или комбинацию методов.
Железо, поступающее в организм с пищей, подразделяют на гемовое, животного происхождения, и негемовое железо растительного происхождения. Гемовая разновидность усваивается значительно лучше и ее недостаток в питании, например, у вегетарианцев, приводит к развитию ЖДА.
К продуктам, рекомендованным для коррекции дефицита железа, относят следующие:
- гемовая группа в порядке убывания количества железа: говяжья печень, говяжий язык, крольчатина, индюшатина, гусиное мясо, говядина, некоторые сорта рыбы;
- негемовая группа: сушеные грибы, горох свежий, гречневая крупа, геркулес и овес, свежие грибы, абрикосы, груши, яблоки, сливы, черешня, свекла и т. д.
Несмотря на кажущееся высоким при изучении состава содержание железа в овощах, фруктах, продуктах растительного происхождения, усвояемость железа из них незначительна, 1-3% от общего объема, особенно сравнении с продуктами животного происхождения. Так, при употреблении говядины организм способен усвоить до 12% содержащегося в мясе необходимого элемента.
При коррекции ЖДА при помощи диеты следует увеличить содержание в рационе блюд, богатых витамином С и белком (мясным) и снизить употребление яиц, поваренной соли, напитков с кофеином и продуктов, богатых кальцием из-за влияния на процесс усвоения пищевого железа.
При средней и тяжелой форме лечебная диета комбинируется с назначением лекарственных препаратов-поставщиков железа в легкоусвояемой форме. Медикаменты различаются по типу соединения, дозировке, форме выпуска: таблетки, драже, сиропы, капли, капсулы, растворы для инъекций.
Препараты для перорального применения принимают за час до еды или через два часа после из-за особенностей всасывания железа, при этом в качестве жидкости, облегчающей проглатывание, не рекомендуется использовать кофеинсодержащие напитки (чай, кофе), так как это ухудшает усвоение элемента. Интервал между приемом доз препаратов должен составлять не менее 4-х часов. Самостоятельное назначение медикаментов может вызвать как побочные последствия от неправильно подобранной формы или дозировки, так и отравление железом.
Дозировку препаратов и форму выпуска определяет специалист, ориентируясь на возраст, стадию заболевания, причины состояния, общую клиническую картину и индивидуальные особенности пациента. Дозы могут быть скорректированы в процессе курса лечения по результатам промежуточных или контрольных анализов крови и/или самочувствия пациента.
Препараты железа в курсе лечения принимают от 3-4 недель до нескольких месяцев с периодическим контролем уровня гемоглобина.
Среди препаратов-поставщиков железа, принимаемых перорально, выделяют медикаменты с двух- и трехвалентной формой железа. На данный момент, согласно исследованиям, двухвалентное железо считается более предпочтительной формой для приема внутрь из-за более высокой способности усваиваться в организме и щадящего воздействия на желудок.
Для детей выпускают железосодержащие средства в виде капель и сиропов, что обуславливается как возрастными особенностями приема препаратов, так и более коротким курсом терапии, чем у взрослых, из-за повышенной усваиваемости железа, поступающего с пищей. При возможности приема капсул, драже и таблеток, а также при длительных курсах следует отдавать предпочтение твердым формам лекарственных средств, содержащих железо, так как жидкие при пролонгированном употреблении могут оказывать негативное воздействие на зубную эмаль и вызывать ее потемнение.
К наиболее популярным таблетированным формам относят следующие медикаменты: Ферроплекс, Сорбифер, Актиферрин, Тотема (двухвалентная форма железа) и Мальтофер, Ферростат, Феррум Лек с трехвалентным железом.
Пероральные формы комбинируют с приемом витамина С (аскорбиновой кислоты) в дозировке, назначаемой врачом, для лучшего всасывания.
Внутримышечные и внутривенные инъекции препаратов железа назначаются в ограниченных ситуациях, таких, как:
- тяжелая стадия анемии;
- неэффективность курса приема пероральных форм препаратов;
- наличие специфических заболеваний желудочно-кишечного тракта, при которых прием пероральных форм может ухудшить состояние пациента (при острых гастритах, язвенной болезни желудка, двенадцатиперстной кишки, неспецифическом язвенном колите, болезни Крона и т. п.);
- при индивидуальной непереносимости пероральных форм железосодержащих препаратов;
- в ситуациях необходимости экстренного насыщения организма железом, например, при значительной кровопотере вследствие травмы или перед хирургическим вмешательством.
Введение препаратов железа внутривенно и внутримышечно может повлечь реакцию непереносимости, ввиду чего подобный курс терапии проводится исключительно под контролем специалиста в стационарных или клинических условиях. К побочным негативным последствиям внутримышечного введения железосодержащих жидкостей относят отложение гемосидерина подкожно в месте инъекции. Темные пятна на кожных покровах в местах введения препаратов могут сохраняться от полутора до 5 лет.
Железодефицитная анемия хорошо поддается медикаментозной терапии при условии соблюдении назначенной дозы и продолжительности курса лечения. Однако если в этиологии состояния лежат выявлены первичные серьезные заболевания и нарушения, терапия будет носить симптоматический характер и иметь кратковременный эффект.
Для устранения таких причин, как внутренние кровотечения, при геморрагической форме железодефицитную анемию лечат хирургическими методами. Оперативное вмешательство позволяет устранить основной фактор острого или хронического кровотечения, остановить кровопотерю. При внутренних кровотечениях желудочно-кишечного тракта применяют фиброгастродуоденоскопические методы или колоноскопию для выявления области кровотечения и мер по его прекращению, например, отсечения полипа, коагуляции язвы.
При внутренних кровотечениях органов брюшины и репродуктивных органов у женщин используют лапароскопический метод вмешательства.
К методам экстренного лечения относят переливание донорской эритроцитарной массы для быстрого восстановления уровня концентрации эритроцитов и гемоглобина на единицу крови.
Профилактикой железодефицитной формы считается сбалансированный рацион питания и своевременные диагностические и лечебные мероприятия для сохранения здоровья.
Дефицитарные формы не ограничиваются железодефицитной анемией. Пернициозная анемия – это состояние, возникающее на фоне нарушения всасывания витамина В12, его недостаточного поступления, повышенного расхода, отклонений в синтезе защитного белка или патологий печени, препятствующих накоплению и хранению кобаламина. В птогенезе данной формы отмечают также частую комбинацию с дефицитом фолиевой кислоты.
Среди причин данной дефицитной формы выделяют следующие:
- недостаточность витамина В12 в пище. В норме печень содержит запасы кобаламина, способные обеспечить потребности организма в нем в течение 2-4 лет. Для пищевого фактора дефицит витамина В12 должен быть выраженным и длительным (голодание, однообразная диета);
- нарушения синтеза внутреннего фактора Касла или гастромукопротеида, белка, защищающего кобаламин от негативного воздействия кишечной флоры и участвующего в процессе всасывания витамина стенками кишечника. Данное отклонение может наблюдаться при заболеваниях желудочно-кишечного тракта (атрофический гастрит, резекция желудка, опухолевые образования желудка и кишечника);
- нарушения функционирования кишечника вследствие выраженного дисбактериоза, паразитозов, глистных инвазий, кишечных инфекционных заболеваний;
- повышенная потребность организма в кобаламине: период гестации, особенно при многоплодной беременности, этап быстрого роста (младенчество, пубертат), чрезмерные занятия спортом без коррекции питания под потребности организма;
- снижение депонирующей функции печени вследствие заболеваний, нарушающих структуру ее тканей, например, цирроза.
В клиническую картину дефицита витамина В12 и фолиевой кислоты входят анемический, желудочно-кишечный и невралгический синдромы.
В особенности анемического симптомокомплекса при данном типе дефицитов входят такие специфические симптомы, как желтушность кожных покровов и склер и повышение артериального давления. Остальные проявления характерны в том числе для ЖДА: слабость, утомляемость, головокружения, одышка, ускоренное сердцебиение (ситуативно), тахикардия и т. д.
В проявления, связанные с функционированием желудочно-кишечного тракта, включают следующие симптомы атрофии слизистых ЖКТ и ротовой полости:
- красный, «глянцевый» язык, нередко с жалобами на ощущение жжения его поверхности;
- явления афтозного стоматита, изъязвления слизистой поверхности ротовой полости;
- нарушения аппетита: снижение вплоть до полного отсутствия;
- чувство тяжести в желудке после приема пищи;
- снижение массы тела пациента в ближайшем анамнезе;
- нарушения, затруднения в процессе дефекации, запоры, боль в прямой кишке;
- гепатомегалия, увеличение печени в размерах.
Невралгический синдром при дефиците витамина В12 состоит из следующих проявлений:
- ощущение слабости в нижних конечностях при выраженной физической нагрузке;
- онемение, покалывание, «мурашки» на поверхности рук и ног;
- снижение периферической чувствительности;
- атрофия мышечной ткани ног;
- судорожные проявления, мышечные спазмы и т. д.
Диагностические мероприятия включают общий медицинский осмотр пациента, сбор анамнеза, лабораторные исследования крови и, при необходимости, инструментальные методы обследования.
При общем анализе крови отмечают следующие изменения:
- пониженный относительно границ возрастной нормы уровень содержания эритроцитов и гемоглобина;
- гиперхромию, повышение цветового показателя окраски эритроцитов;
- макроцитоз эритроцитов, превышение их размеров в диаметре более 8,0 мкм;
- пойкилоцитоз, наличие эритроцитов разного размера;
- лейкопению, недостаточную концентрацию лейкоцитов;
- лимфоцитоз, превышение границ норм уровня лимфоцитов в крови;
- тромбоцитопению, недостаточное количество тромбоцитов на единицу крови.
Исследования образцов крови методом биохимии выявляют гипербилирубинемию и недостаточность витамина В12.
Для диагностики наличия и степени выраженности атрофии слизистых оболочек желудка и кишечника, а также для выявления возможных первичных заболеваний используют инструментальные методы обследования пациентов:
- фиброгастродуоденоскопическое исследование;
- анализ биопсийного материала;
- колоноскопия;
- ирригоскопия;
- УЗИ печени.
В большинстве случаев В12-дефицитная анемия требует госпитализации или лечения в условиях стационара. Для терапии в первую очередь назначают рацион питания с продуктами, насыщенными кобаламином и фолиевой кислотой (печень, говядина, скумбрия, сардины, треска, сыр и т. п.), во вторую используют медикаментозную поддержку.
При наличии неврологической симптоматики назначаются инъекции Цианкобаламина внутримышечно в повышенной дозе: 1000 мкг ежедневно до исчезновения неврологических признаков дефицита. В дальнейшем дозировка снижается, однако, при диагнозе вторичной этиологии, прием препаратов чаще всего назначается на пожизненной основе.
После выписки из лечебного учреждения пациент обязан проходить регулярные профилактические осмотры у терапевта, гематолога и гастролога.
Апластическая анемия может быть как врожденным, так и приобретенным заболеванием, развивающимся под воздействием внутренних и внешних факторов. Само состояние возникает вследствие гипоплазии костного мозга, снижения способности продуцировать клетки крови (эритроциты, лейкоциты, тромбоциты, лимфоциты).
При апластической, гипопластической формах анемии причины возникновения подобного состояния могут быть следующие:
- дефект стволовых клеток;
- подавление процесса гемопоэза (кроветворения);
- недостаточность факторов стимуляции гемопоэза;
- иммунные, аутоиммунные реакции;
- недостаточность железа, витамина В12 или их исключение из процесса гемопоэза вследствие нарушений функций кроветворных тканей и органов.
К развитиям нарушений, провоцирующих апластическую или гипопластическую форму, относят следующие факторы:
- наследственные заболевания и генетические патологии;
- прием некоторых медикаментов из групп антибиотиков, цитостатитков, нестероидных противовоспалительных препаратов;
- отравление химическими веществами (бензолы, мышьяк и т. п.);
- инфекционные заболевания вирусной этиологии (парвовирус, вирус иммунодефицита человека);
- аутоиммунные нарушения (системная красная волчанка, ревматоидный артрит);
- выраженные дефициты кобаламина и фолиевой кислоты в рационе питания.
Несмотря на обширный список причин заболевания, в 50% случаев патогенез апластической формы остается невыявленным.
Выраженность панцитопении, снижения количества базовых видов клеток крови, определяет степень тяжести проявления симптомов. К клинической картине апластической формы относят следующие признаки:
- тахикардию, учащенное сердцебиение;
- бледность кожи, слизистых;
- головные боли;
- повышенную усталость, сонливость;
- одышку;
- отеки нижних конечностей;
- кровоточивость десен;
- петехиальную сыпь в виде небольших красных пятен на кожных покровах, склонность к легкому образованию синяков;
- частые острые инфекции, хронические заболевания как следствие снижения общего иммунитета и лейкоцитарной недостаточности;
- эрозии, язвы на внутренней поверхности полости рта;
- желтушность кожи, склер глаз как признак начавшегося поражения печени.
Для установления диагноза используют лабораторные методы исследования различных биологических жидкостей и тканей и инструментальное обследование.
При общем анализе крови отмечается пониженное количество эритроцитов, гемоглобина, ретикулоцитов, лейкоцитов, тромбоцитов при соответствии норме цветовому показателю и содержанию гемоглобина в эритроцитах. В результатах биохимического исследования отмечаются повышение сывороточного железа, билирубина, лактатдегидрогеназы, насыщение трансферрина железом на 100% от возможного.
Для уточнения диагноза проводят гистологическое исследование материала, изымаемого из костного мозга при пункции. Как правило, по результатам исследования отмечается недоразвитие всех ростков и замещение костного мозга жировым.
Анемия данной разновидности не подлежит лечению при помощи коррекции рациона. В первую очередь больному апластической анемией назначают выборочный или комбинированный прием препаратов следующих групп:
- иммунодепрессанты;
- глюкокортикостероиды;
- иммуноглобулины антилимфоцитарного и антитромбоцитарного действия;
- антриметаболические препараты;
- стимуляторы продукции эритроцитов стволовыми клетками.
При неэффективности терапии лекарственными препаратами назначаются немедикаментозные методики лечения:
- трансплантация костного мозга;
- переливание эритроцитной, тромбоцитной массы;
- плазмафорез.
Апластическая анемия сопровождается снижением общего иммунитета вследствие недостаточности лейкоцитов, поэтому в дополнение к общей терапии рекомендовано асептическое окружение, антисептическая обработка поверхностей, отсутствие контакта с носителями инфекционных заболеваний.
При недостаточности перечисленных методов лечения больному назначают операцию спленэктомии, удаление селезенки. Так как именно в данном органе происходит распад эритроцитов, его удаление позволяет улучшить общее состояние пациента и замедлить развитие заболевания.
Наиболее распространенная форма заболевания – железодефицитная анемия – подлежит профилактике при помощи сбалансированного питания с увеличением количества железосодержащих продуктов в критические периоды. Важным фактором является также наличие в продуктах питания витамина С, кобаламина (витамина В12), фолиевой кислоты.
При нахождении в группе риска развития данной формы анемии (вегетарианство, возрастные периоды роста, беременность, лактация, недоношенность у младенцев, обильные менструальные кровотечения, хронические и острые заболевания) рекомендовано регулярное медицинское обследование, анализ крови на количественные и качественные показатели гемоглобина, эритроцитов и дополнительный прием препаратов в соответствии с назначением специалистов.
источник
Понравилась статья? Поделись с друзьями!
32


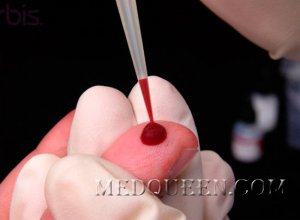 Анемия В практике гастроэнтеролога анемический синдром встречается достаточно часто. При этом основными видами анемий у пациентов с патологией органов пищеварения являются железодефицитная и В12-фолиеводефицитная анемии. В патогенезе анемий при заболеваниях желудочно-кишечного тракта ведущими механизмами выступают хроническая кровопотеря и нарушение всасывания гемопоэтических факторов.
Анемия В практике гастроэнтеролога анемический синдром встречается достаточно часто. При этом основными видами анемий у пациентов с патологией органов пищеварения являются железодефицитная и В12-фолиеводефицитная анемии. В патогенезе анемий при заболеваниях желудочно-кишечного тракта ведущими механизмами выступают хроническая кровопотеря и нарушение всасывания гемопоэтических факторов.