Многие годы безуспешно боретесь с ГИПЕРТОНИЕЙ?
Глава Института: «Вы будете поражены, насколько просто можно вылечить гипертонию принимая каждый день.
Болезни крови часто очень серьезны и требуют экстренного лечения. Одно из таких заболеваний — апластическая анемия. Болезнь признается одной из разновидностей нарушения деятельности костного мозга, проявляется тяжелой клиникой — слабостью, потерей сознания, кровотечениями.
- Общая информация
- Причины патологии
- Классификация заболевания
- Клиническая картина при гипопластической анемии
- Диагностика заболевания
- Лечение при гипопластической анемии
- Трансфузии крови
- Трансплантация костного мозга
- Спленэктомия
- Осложнения заболевания
- Профилактика гипопластической анемии
Терапия заболевания сложная и включает не только введение специальных препаратов, но и переливания крови, пересадку костного мозга.
Для лечения гипертонии наши читатели успешно используют ReCardio. Видя, такую популярность этого средства мы решили предложить его и вашему вниманию.
Подробнее здесь…
Апластическая или гипопластическая анемия — патология крови и костного мозга, для которой характерно тяжелое расстройство нескольких или всех звеньев гемопоэза с угнетением ростка кровяных телец.
Проще говоря, при возникновении данной патологии резко снижается производство новых лейкоцитов, тромбоцитов и эритроцитов, что означает развитие анемического, геморрагического синдрома и присоединение инфекционных осложнений. Еще одно название гипопластической анемии — панмиелофтиз.
Патология довольно редкая — показатель заболеваемости не превышает 2 – 5 случаев на 1 миллион населения за год. В странах Восточной Азии цифра выше среднемировых в 3 раза, что специалисты связывают с высокой частотой вирусных инфекций в данном регионе.
Примерно у половины больных причины, вызывающие анемию, установить не удается. В основе патогенеза лежит дефицит кроветворной стволовой клетки, который вызывает нарушение продукции клеток крови.
Причиной может стать как подавление процесса выработки кровяных клеток, так и разрушение уже готовых эритроцитов, лейкоцитов, тромбоцитов собственными антигенами.
Причины врожденных форм патологии — наследственность и хромосомные мутации. Пример мутирования — появление аномальной стволовой клетки, в результате чего нарушается синтез основных элементов в костном мозге, развиваются апластические и гемолитические анемии.
Что касается наследственной передачи заболевания, то при наличии апластических форм анемии у родителей в 50 случаев будущий ребенок будет иметь их признаки.
Происхождение приобретенных анемий может остаться неустановленным. Если указать причину патологии не удается, болезнь признается идиопатической апластической анемией.
Первичная анемия обусловлена угнетением миелопоэза на фоне появления в красном костном мозге цитотоксичных Т-лимфоцитов. Производимые ими вещества подавляют ростки кроветворения.
Аналогичные процессы способны запустить различные внешние и внутренние факторы:
- воздействие радиации, облучения;
- отравление химическими веществами — бензолом, толуолом;
- работа с гербицидами без защитных приспособлений;
- перенесенный гепатит С или гепатит В;
- инфекции — вирус Эпштейна-Барра, ВИЧ, грипп, цитомегаловирус, туберкулез;
- прием цитотоксичных препаратов — противомалярийных, препаратов золота, антибиотиков, антидепрессантов, противовоспалительных средств;
- перенесенные лейкозы, лимфома;
- проживание в условиях плохой экологии;
- работа на вредном производстве;
- хронический алкоголизм, наркомания;
- снижение функции щитовидной железы, яичников;
- болезни вилочковой железы.
Гипопластическая анемия способна сопровождать ряд системных аутоиммунных заболеваний — эозинофильный фасциит, системную красную волчанку. Очень редко старт развития патологии приходится на беременность без воздействия других провоцирующих факторов.
По длительности течения анемия бывает следующей:
- Острая. Развивается не более месяца, часто оканчивается летальным исходом к концу указанного срока. Протекает бурно, начинается с кровотечений, инфекционного заболевания с высокой температурой.
- Подострая. Протекает 1 – 6 месяцев. Геморрагии менее выражены, критические проблемы в системе кроветворения наступают через 3 месяца.
- Хроническая. Продолжительность болезни более 6 месяцев, прогрессирование медленное. Типичные симптомы — непродолжительные кровотечения, бледность, головокружения. Болезнь можно остановить, добившись длительной ремиссии.
По типу поражения костномозговых ростков выявляются такие типы анемии:
- Одноростковая — угнетается развитие одного вида элементов крови (лейкоцитов, эритроцитов, тромбоцитов).
- Двухростковая — нарушается развитие двух любых типов клеток.
- Трехростковая — угнетен рост всех трех кроветворных ростков.
Чаще всего диагностируется третий вид патологии, но в разные ее фазы может быть более выраженным угнетение только одного из ростков гемопоэза. Трехростковую анемию обычно называют истинной. Если же у человека развивается малокровие на фоне нарушения производства исключительно эритроцитов, заболевание именуют парциальной (красноклеточной) анемией апластического типа.
Классификация выделяет три степени тяжести гипопластической анемии, при этом учитывается выраженность снижения количества тромбоцитов и гранулоцитов (зернистых лейкоцитов — нейтрофилов, базофилов, эозинофилов):
- Средней тяжести, или умеренная — гранулоцитов в периферической крови — более 0,5/109/л, тромбоцитов — более 20*109/л.
- Тяжелая — показатели ниже, чем 0,5*109/л и 20*109/л.
- Сверхтяжелая — кроме серьезного снижения выработки тромбоцитов и гранулоцитов, присоединяется резкое падение функции костного мозга (ниже 30 % от нормы).
По этиологии выделяют такие формы гипопластической анемии:
- конституциональная, в том числе наследственная;
- медикаментозная;
- спровоцированная внешними факторами;
- идиопатическая;
- неуточненная.
Гипопластическая анемия бывает приобретенной и врожденной (наследственной). Если для первого типа есть ряд характерных причин и факторов риска, действующих в течение жизни, то второй тип анемий развивается у ребенка сразу после рождения или в течение нескольких месяцев или лет.
Выделяют такие виды наследственной анемии:
- Анемия Фанкони. Выявляется в 3 – 10 лет, развивается из-за генных мутаций. Протекает в виде ремиссий и обострений. Приводит к высокому риску развития лейкозов и других злокачественных процессов, имеет неблагоприятный прогноз.
- Анемия Даймонда-Блекфена. Связана с низкой врожденной чувствительностью клеток мозга к эритропоэтину, что приводит к угнетению эритроцитарного ростка в костном мозге (лейкоциты и тромбоциты остаются в норме). Чаще всего эта болезнь передается по наследству.
Выраженность симптомов апластической анемии сильно зависит от формы — острой, подострой или хронической. Последняя дает яркую клинику только во время обострения.
Общие признаки, отражающими снижение гемоглобина в крови:
- одышка;
- слабость;
- резкое падение работоспособности;
- головокружения;
- обмороки;
- бледность, серость кожи;
- шум в ушах;
- невозможность перенесения физических нагрузок;
- тошнота;
- аритмии;
- сердечные шумы;
- потемнение в глазах;
- снижение давления крови;
- синюшность губ;
- увеличение печени.
Параллельно начинают проявляться симптомы снижения тромбоцитов в крови. Отличительный признак — различные кровотечения. На коже можно отметить как мелкие и крупные синяки, так и ярко красную мелкоточечную сыпь. Отмечается повышенная рыхлость десен, беспокоят частые носовые кровотечения. Месячные у женщин идут дольше положенного срока. Тяжелые случаи анемии сопровождаются внутримозговыми кровоизлияниями.
Из-за снижения уровня лейкоцитов происходит резкое падение защитной функции организма. Часто развиваются ангина, бронхит, трахеит и прочие инфекционные заболевания. Ранения, травмы сопровождаются нагноением тканей, появляется гнойный стоматит, язвенно-некротический тонзиллит. При тяжелых формах патологии развивается сепсис.
Анемия Фанкони сочетается с такими признаками:
- Волчья пасть, отсутствие раковин ушей, нарушение строения носа, тяжелый сколиоз, добавочные позвонки, отсутствие лопаток.
- Парезы и параличи, слепота, глухота, грыжи позвоночника, уменьшение головного мозга, умственная отсталость.
- Отсутствие почки, аномалии строения почек, мочеточников, двурогая матка, отсутствие матки, выворот половых органов.
- Различные пороки сердца, стеноз аорты.
- Аневризмы кишечника, дивертикулы кишечника, свищи желудка и пищевода.
Большинство детей с тяжелыми формами наследственной анемии не доживают до 7 – 8 лет, в ряде случаев удается продлить жизнь до 20 лет.
Важный метод исследования, позволяющий предположить диагноз, — общий анализ крови. Критериями типичной трехростковой гипопластической анемии являются падение гемоглобина менее 100 г/л, нейтропения менее 1,5*10*9/л, тромбоцитопения менее 100*10*9/л.
После получения указанных результатов анализа периферической крови обязательно дается рекомендация на проведение стернальной пункции — взятия на анализ костного мозга. Пункцию делают под местным или общим наркозом.
В миелограмме при панмиелофтизе количество всех клеточных элементов сильно снижено, имеется умеренный лимфоцитоз. Иногда из-за компенсаторной реакции костного мозга появляются очаги повышенного количества клеток крови, что может стать причиной ложноотрицательного результата миелограммы.
Чтобы наверняка установить диагноз, многим больным показано выполнение трепанобиопсии. Часть костного мозга забирают из крыла подвздошной кости. Полное сохранение структуры биоптата и большое его количество позволяют детально изучить строение и функцию костного мозга.
Для постановки дифференциального диагноза и поиска сопутствующих аномалий и заболеваний могут быть рекомендованы такие виды исследований:
- биохимический анализ крови;
- иммунологические анализы;
- исследования на присутствие вирусов;
- рентгенография легких, носа и т. д.;
- МРТ брюшной полости.
Дифференцировать гипопластическую анемию нужно с пароксизмальной ночной гемоглобинурией (ПНГ) — болезнью, при которой появляются ПНГ-клоны — стволовые клетки с аномальной структурой. Отличать анемию нужно от лейкозов, агранулоцитоза, В12-дефицитной анемии, миелодиспластического синдрома.
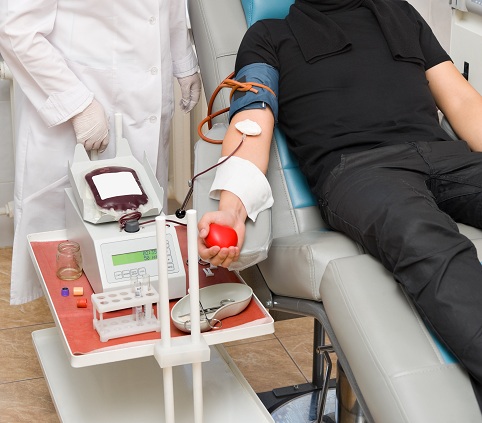
Лечение проводится в отделении гематологии. Основные методики — переливание крови, эритроцитарной и тромбоцитарной массы, трансплантация костного мозга, введение ряда препаратов. Никакие народные средства вылечить это тяжелое заболевание не способны.
Легкие случаи и самые начальные этапы болезни успешно лечат при помощи глюкокортикостероидов (Преднизолон), путем введения цитостатиков (Циклоспорин, Метотрексат, Циклофосфан), которые резко снижают реактивность организма. При септических осложнениях срочно вводят антибиотики из групп цефалоспоринов и макролидов.
Применяются стимуляторы гемопоэза — Лейкомакс, Филграстим, активирующие выработку гранулоцитов. Иммуносупрессивное лечение в качестве монотерапии не помогает на запущенной стадии болезни. При излишней кровоточивости вводят препараты аминокапроновой кислоты, кровоостанавливающие средства.
Для лечения гипертонии наши читатели успешно используют ReCardio. Видя, такую популярность этого средства мы решили предложить его и вашему вниманию.
Подробнее здесь…
При снижении гемоглобина менее 80 г/л показано переливание крови. У большинства больных оно проводится регулярно. Как правило, переливают эритроцитарную массу (отмытые эритроциты), которую готовят на Станциях переливания крови. Этот метод помогает восполнить недостающие эритроциты, замедлив прогрессирование осложнений. Терапевтического эффекта на костный мозг трансфузии не оказывают.
Радикальным методом лечения остается пересадка костного мозга. Материал забирают у донора, пересаживая его реципиенту. Донор должен быть совместим с реципиентом по 3 – 6 антигенам в зависимости от показаний.
Операцию делают под общей анестезией. При помощи толстой иглы забирают материал из подвздошной кости в объеме 700 – 1000 мл. Далее костный мозг переливают донору, после чего проводят иммуносупрессивную терапию, лучевую терапию для профилактики отторжения трансплантата.
Удаление селезенки, или спленэктомия, дает положительные результаты в лечении у 75 % больных. Обычно операция назначается при отсутствии эффекта от гемотрансфузий и других консервативных методик. После операции прекращается воздействие собственных антител на организм, и анемия останавливает свое развитие.
Патология может осложниться тяжелыми септическими заболеваниями — абсцессами, флегмонами, заражением крови, от которых пациент погибает в сжатые сроки.
У части больных возникает острый лейкоз, наблюдаются серьезные, смертельно опасные кровотечения. Критерий плохого прогноза — сочетание инфекционных осложнений с геморрагическим синдромом и быстрым прогрессированием дисфункции костного мозга. После трансплантации нового костного мозга выздоравливает 75 – 90 % людей.
Меры предупреждения наследственных и первичных форм патологии не разработаны. Профилактика вторичной анемии апластического типа включает недопущение работы на вредных производствах, предотвращение интоксикаций, химический отравлений, прием мер защиты от инфекционных заболеваний.
– оставляя комментарий, вы принимаете Пользовательское соглашение
- Аритмия
- Атеросклероз
- Варикоз
- Варикоцеле
- Вены
- Геморрой
- Гипертония
- Гипотония
- Диагностика
- Дистония
- Инсульт
- Инфаркт
- Ишемия
- Кровь
- Операции
- Сердце
- Сосуды
- Стенокардия
- Тахикардия
- Тромбоз и тромбофлебит
- Сердечный чай
- Гипертониум
- Браслет от давления
- Normalife
- Аллапинин
- Аспаркам
- Детралекс
источник
Эритроцитарная масса (ЭМ) представляет собой основной компонент крови, содержащий более 65 % эритроцитов. Ее получают из заготовленной донорской крови путем удаления большей части плазмы при отстаивании, центрифугировании и аппаратном фракционировании клеток крови. Она может содержать примесь лейкоцитов, тромбоцитов или оставшейся плазмы.
В клинической практике трансфузии эритроцитарной массы используются по строгим показаниям. Среди них выделяют два основных:
- Острая анемия, которая возникает в связи с большой кровопотерей (около трети всего объема крови) и сопровождается циркуляторными расстройствами при гематокрите ниже 25 % и уровне гемоглобина менее 80 г/л.
- Тяжелые формы хронической анемии с такими же требованиями к показателям гемоглобина и гематокрита (когда их коррекция другими методами невозможна).
Следует учитывать, что при острой анемии в первые часы после кровопотери тяжесть состояния больного обусловлена не снижением гемоглобина, а резким уменьшением объема крови в кровеносном русле. Целью инфузионной терапии является не увеличение количества эритроцитов в крови, а восполнение внутрисосудистого объема для обеспечения достаточного кровоснабжения внутренних органов. Поэтому в таких случаях в первую очередь вводятся коллоидные и солевые растворы с последующим переливанием эритроцитарной массы.
Причинами хронических анемий могут быть:
- тяжелые дефицитные анемии у пожилых (недостаток железа, витамина В₁₂, фолиевой кислоты);
- апластические анемии;
- падение уровня гемоглобина при острых или хронических лейкозах;
- анемии, сопровождающие заболевания пищеварительной системы (желудка, кишечника) и др.
Назначая трансфузии эритроцитарной массы таким больным, необходимо определить клинические признаки заболевания, которые могут быть критерием эффективности данной процедуры. При этом нельзя ориентироваться только на цифры гемоглобина. Они могут колебаться в зависимости от объема вливаемых растворов и диуреза.
При сочетании анемии и сердечной недостаточности у пожилых трансфузию нужно осуществлять осторожно с возможным применением мочегонных средств, так как существует опасность гиперволемии (перегрузки кровеносного русла объемом жидкости).
При наличии тяжелой анемии абсолютных противопоказаний к переливанию эритроцитарной массы нет. К относительным противопоказаниям относятся следующие патологические состояния:
На этапе планирования переливания эритроцитарной массы определяются и фиксируются в медицинской документации показания к данной процедуре.
- Обязательно проводится контрольная проверка групповой принадлежности крови пациента по системе АВ0.
- Затем выполняются индивидуальные пробы на совместимость.
- Только после этого осуществляется собственно трансфузия гемокомпонента.
После окончания процедуры переливания больному рекомендуется в течение первых 2 часов соблюдать постельный режим. Этот период времени он находится под постоянным медицинским наблюдением. Каждый час ему измеряют артериальное давление, пульс и температуру тела, что также фиксируется документально. Обязательно контролируют цвет мочи и почасовой диурез. Через сутки после трансфузии выполняется исследование крови и мочи.
Согласно классификации препаратов крови эритроцитарную массу относят к группе переносчиков газов крови. Для восполнения нормального состава крови используют несколько ее видов:
- Нативная ЭМ с гематокритом 0,65-0,8 (получают в результате удаления из цельной крови плазмы путем отстаивания и центрифугирования).
- Эритроконцентрат с гематокритом не более 0,7 и гемоглобином не менее 43 г на одну дозу (для его приготовления кровь центрифугируют, после чего удаляют плазму и подлежащий лейкотромбослой; к оставшейся ЭМ добавляют взвешивающий раствор для улучшения ее реологических свойств).
- Эритроцитарная взвесь с ресуспендирующим раствором с показателями гемоглобина не менее 45 г в одной дозе и гематокрита – от 0,5 до 0,7 (представляет собой трансфузионную среду, полученную после удаления плазмы и добавления специального ресуспендирующего раствора или стерильного раствора 0,9 % натрия хлорида).
- ЭМ, обедненная эритроцитами и тромбоцитами (получают путем 3-5-кратного отмывания эритроцитов в физиологическом растворе; содержит около 70 % эритроцитов, 30 % лейкоцитов и 10 % тромбоцитов от исходного содержания в дозе крови; используется в качестве трансфузионной среды со сниженной реактогенностью у больных с сенсибилизацией к белкам крови, лейкоцитам, тромбоцитам и тканевым антигенам).
- Размороженная и отмытая ЭМ (взвесь эритроцитов, которая хранится определенное время в замороженном состоянии вместе с раствором-криопротектором, который отмывается после размораживания; обычно в качестве последнего используют глицерин; после отмывания ЭМ взвешивается в ресуспендирующем растворе; такая трансфузионная среда содержит минимальные количества других компонентов крови и применяется у пациентов со склонностью к сенсибилизации, осложненным трансфузиологическим анамнезом или у лиц с редкими группами крови).
- ЭМ, полученная методом цитафереза с гематокритом 0,65-0,7, гемоглобином не менее 45 г в одной дозе, примесью лейкоцитов не более 1×10⁶/л (препарат крови заготавливается с помощью специального оборудования – автоматических фракционаторов клеток крови; позволяет сократить антигенную нагрузку на организм человека и снижает риск осложнений после процедуры).
Получение отдельных гемокомпонентов позволяет избежать трансфузий цельной крови, так как это считается нецелесообразным и имеет много осложнений. При этом в организм больного вводится только недостающая составляющая часть крови. Современные методики очистки и заготовки препаратов эритроцитарной массы дают возможность уменьшить антигенную нагрузку на организм и применять их у пациентов с сенсибилизацией к сывороточным белкам и тканевым антигенам.
источник
Переливание крови (гемотрансфузия) — процедура, которая формально приравнивается к хирургическим вмешательствам. Ее проводят с помощью иглы, введенной непосредственно в вену пациента, или заранее установленного венозного катетера. Несмотря на кажущуюся простоту переливания крови, оно должно проводиться с учетом целого ряда факторов, особенно если речь идет о раковых больных.
Необходимость хотя бы в разовом переливании крови у ракового больного возникнет с большой долей вероятности: по данным Всемирной организации здравоохранения, анемия тяжелой степени наблюдается у 30% пациентов на ранних стадиях онкозаболеваний и у 60% пациентов после химиотерапии. Что же следует знать об этой процедуре?
Грамотно назначенное и организованное переливание крови помогает нормализовать состояние онкологического больного и предотвратить осложнения заболевания. Современная медицина накопила достаточную статистику по выживаемости онкобольных, подвергавшихся процедурам гемотрансфузии. Выяснилось, что переливание цельной крови может усилить процессы метастазирования и ухудшить сопротивляемость организма патологическим процессам. Поэтому при раке переливают только отдельные компоненты крови, причем подбор препарата должен быть индивидуальным и учитывать не только группу крови больного и диагноз, но и его состояние. В тяжелых случаях (поздние стадии рака, послеоперационный период) могут потребоваться повторные переливания крови. Остальным больным после первой процедуры требуется динамический контроль показателей крови, иногда — назначение индивидуального курса гемотрансфузии. Эффект от правильного переливания крови заметен практически сразу после процедуры: самочувствие больного улучшается, чувство слабости отступает. Длительность эффекта — вопрос индивидуальный.
Опросы онкологических больных показывают, что лишь 34% ставят на первое место обезболивающие процедуры. 41% в первую очередь высказывается за избавление от постоянной усталости, вызванной в основном анемией.
Когда же требуется переливать кровь? Некоторые виды онкологических заболеваний, например злокачественные опухоли ЖКТ и женских половых органов, часто вызывают внутренние кровотечения. Длительное течение рака приводит к различным нарушениям жизненно важных функций, вызывающим так называемую анемию хронического заболевания. При поражении красного костного мозга (как вследствие самого заболевания, так и в результате химиотерапии), селезенки, почек снижаются функции кроветворения. И наконец, при раке могут потребоваться сложные хирургические операции, сопровождающиеся большой кровопотерей. Все эти состояния требуют поддержки организма с помощью препаратов донорской крови.
Переливать кровь нельзя при аллергиях, заболеваниях сердца, гипертонии 3-й степени, нарушениях мозгового кровообращения, отеке легких, тромбоэмболической болезни, тяжелой почечной недостаточности, остром гломерулонефрите, бронхиальной астме, геморрагическом васкулите, нарушениях со стороны центральной нервной системы. При тяжелых анемиях и острых кровопотерях переливание проводится всем больным без исключения, но с учетом и профилактикой возможных осложнений.
Переливание крови будет в наименьшей степени сопряжено со стрессом для организма, если использовать собственную кровь пациента. Поэтому в некоторых случаях (например, перед курсом химиотерапии) пациент ее сдает заранее, она хранится в банке крови, и ее используют по мере необходимости. Также собственная кровь пациента может быть собрана во время операции и перелита обратно. Если нет возможности использовать собственную кровь, из банка крови берется донорская.
В зависимости от показаний переливают либо очищенную плазму, либо плазму с высоким содержанием тех или иных кровяных телец.
Плазму переливают при повышенной кровоточивости и тромбообразовании. Ее хранят в замороженном виде, чтобы при необходимости разморозить и провести переливание. Срок хранения замороженной плазмы — 1 год. Существует методика отстаивания размороженной плазмы для получения криопреципитата — концентрированного раствора факторов свертывания крови. Он переливается при повышенной кровоточивости.
Эритроцитарная масса переливается при хронической анемии и острых кровопотерях. В первом случае есть время понаблюдать за пациентом, во втором требуются экстренные меры. Если запланирована сложная хирургическая операция, предполагающая большую потерю крови, переливание эритроцитарной массы может быть проведено заранее.
Тромбоцитарная масса в основном требуется для восстановления показателей крови после химиотерапии. Также ее могут переливать при повышенной кровоточивости и кровопотерях в результате хирургического вмешательства.
Лейкоцитарная масса помогает повысить иммунитет, но в настоящее время ее переливают крайне редко. Вместо этого пациенту вводят колониестимулирующие препараты, активизирующие выработку организмом собственных лейкоцитов.
Несмотря на то, что в современной медицине устоялась тенденция назначать переливания крови только в самых крайних случаях, раковых больных она касается в последнюю очередь.
Процедуру предваряет изучение анамнеза и информирование пациента об особенностях переливания крови. Требуется также измерить артериальное давление пациента, частоту пульса, температуру, взять на исследование кровь и мочу. Потребуются данные о предыдущих переливаниях крови и их осложнениях, если таковые были.
У каждого пациента должны быть определены группа крови, резус-фактор и Kell-антиген. Пациентам с отрицательным Kell-антигеном можно переливать только Kell-отрицательную донорскую кровь. Также у донора и реципиента должны быть совместимы группа и резус-фактор. Однако правильный подбор по этим параметрам не исключает негативной реакции организма на чужую кровь и на качество препарата, поэтому делается биопроба: вводится сначала 15 мл донорской крови. Если в последующие 10 минут нет никаких тревожных симптомов, переливание можно продолжать.
На одну процедуру может потребоваться от 30–40 минут до 3–4 часов. Переливание тромбоцитарной массы занимает меньше времени, чем переливание эритроцитарной. Используются одноразовые капельницы, к которым подсоединяют флаконы или гемаконы с препаратами крови. По окончании процедуры пациент должен оставаться в лежачем положении как минимум 2–3 часа.
При назначении курса длительность и частота процедур переливания определяется показателями анализов, самочувствием больного и тем, что за одну процедуру больному можно перелить не более двух стандартных доз препарата крови (одна доза — 400 мл). Разнообразие онкологических заболеваний и особенностей их течения, а также индивидуальная переносимость процедур не позволяют говорить о каких-либо универсальных схемах. Например, больным с лейкемией могут требоваться ежедневные процедуры с варьированием объема и состава препаратов крови. Курс проводится под постоянным контролем всех параметров самочувствия больного и при первой возможности прекращается.
Несмотря на все меры предосторожности, примерно в 1% случаев гемотрансфузия может вызывать негативную реакцию организма. Чаще всего это проявляется в виде лихорадки, озноба и сыпи. Иногда могут наблюдаться повышение температуры, покраснение лица, проблемы с дыханием, слабость, появление крови в моче, боль в пояснице, тошнота или рвота. При своевременном выявлении этих признаков и обращении к врачу опасности для жизни больного нет.
Переливание крови онкологическим больным надежнее всего проводить в специализированном стационаре, где они будут находиться под круглосуточным наблюдением медперсонала. Однако в некоторых случаях оно проводится амбулаторно. По возвращении домой после процедуры необходимо следить за состоянием и при его ухудшении вызвать неотложную помощь.
источник
Рекомендации по переливанию эритроцитарной массы у пациентов младше 4 мес:
1. Гематокрит менее 20% с маленьким количеством ретикулоцитов и симптомами анемии 1 .
2. Гематокрит менее 30% у новорожденных:
а. Оксигенотерапия более 35%.
б. Оксигенотерапия через носовые катетеры.
в. Постоянное положительное давление в дыхательных путях и/или периодическая принудительная ИВЛ со средним давлением в дыхательных путях менее 6 см вод.ст.
г. Выраженное апноэ или брадикардия 2 .
д. Выраженная тахикардия или тахипноэ 3 .
е. Медленная прибавка массы тела 4 .
3. Гематокрит менее 35% у новорожденных:
а. Оксигенотерапия более 35%.
б. Постоянное положительное давление в дыхательных путях/периодическая принудительная ИВЛ со средним давлением в дыхательных путях более 6 см.вод.ст.
4. Гематокрит меньше 45% у новорожденных:
а. Экстракорпоральная мембранная оксигенация.
б. Врожденный «синий» порок сердца.
* 1 Тахикардия, тахипноэ, плохо питающиеся.
2 Более шести эпизодов в течение 12 ч или два эпизода за 24 ч, требующих вентиляции мешком через маску, в то время как пациент получает терапевтические дозы метилксантинов.
3 ЧСС более 180 в минуту, ЧДД более 80 в минуту в течение 24 ч.
4 Набор менее 10 г/день, наблюдаемый в течение 4 дней, при одновременном получении более 100 ккал/кг в день.
1. Определение общего количества крови, которую необходимо перелить:
а. Расчет объема крови для трансфузии. Большинству новорожденных переливают 10-15 мл/кг ЭМ, которая увеличивает гемоглобин на 3 г/дл.
б. Расчет требуемого объема ЭМ: [ПОК х (Ht желаемый — Ht наблюдаемый)] х Ht-единицы ЭМ,
где ПОК — предполагаемый объем крови (примерно 80-85 мл/кг массы тела у доношенных новорожденных и 100-120 мл/кг массы тела у недоношенных); Ht — гематокрит.
2. Учитывают объем крови, необходимый для заполнения мертвого пространства трубок, фильтра, механизма насоса (варьирует в зависимости от систем, может достигать 30 мл).
3. Получают препарат крови:
а. В нескольких исследованиях зафиксирована информация о безопасности использования ЭМ, с добавлением антикоагулянта.
б. Не следует хранить ЭМ с добавлением дополнительных растворов для массивных трансфузий, за исключением удаления добавки путем центрифугирования (предполагается риск гиперосмолярности, гипергликемии, гипернатриемии, гиперкалиемии, гиперфосфатемии).
в. У новорожденных, получающих 10-15 мл ЭМ, количество ионов калия, получаемых при переливании, оценивается только в 0,15 ммоль/кг и не предполагает существенного риска для большинства новорожденных.
г. Снижается риск возможных отрицательных эффектов от донорской крови путем деления одной дозы на несколько более мелких для одного ребенка и их использования до истечения срока годности.
4. На этикетки выносится информация о необходимости перекрестных проб.
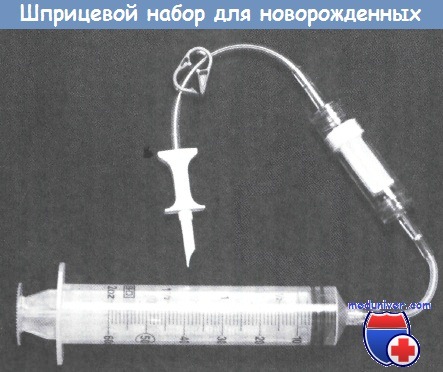
Эта система, при условии использования со стерильной методикой соединения, обеспечивает закрытый способ введения, который поддерживает постепенное опорожнение крови.
Шприц, заполненный компонентом крови (ЭМ, плазмой) должен быть введен пациенту в течение 24 ч, а шприц, заполненный разведенными тромбоцитами, — в течение 4 ч.
5. Подтверждают, что ограничения применены к препаратам крови и помечены на трансфузионной бирке:
а. ЦМВ: проверялось/не проверялось.
б. Облучение: да/нет.
в. Прямой (семейный) донор: да/нет.
г. Антиэритроцитарные антитела отрицательны: да/нет.
д. Серповидноклеточный тест отрицателен: да/нет.
е. Другие ограничения: да/нет.
6. Проверяют соответствие выбранной крови путем сравнения препарата крови, полученной от пациента, и информации на этикетке на пакете с донорским препаратом.
Рекомендуют применение устройства для чтения штрихкода:
а. Информация о группе крови на этикетке и результатами исследования этой крови.
б. Номер пациента в госпитале или истории болезни.
в. Идентификация пациента с помощью браслета на руке или ноге.
г. Группа и Rh-фактор крови у донора и реципиента.
д. Срок годности и срок заготовки.
е. Ограничения, как предписано врачом или указаниями лечебного учреждения.
7. Согревание ЭМ (эритроцитарной массы):
а. Нет необходимости в согревании небольших объемов разведенной ЭМ, особенно если трансфузия будет проведена в течение 2-3 ч.
б. ЭМ масса может быть согрета путем помещения шприца в инкубатор с обогреваемым воздухом на 30 мин перед трансфузией.
в. Нельзя согревать кровь путем воздействия на нее нагревательных ламп или фототерапевтического света, так как это может вызвать гемолиз.
8. Строго соблюдают стерильность во время всей процедуры.
9. Если банком крови предоставлена заранее профильтрованная ЭМ в шприце, присоединяют трубку прямо к нему.
10. Если ЭМ предоставлена в мешке, используют иглу с крупным просветом (18-го размера или более) для забора объема в шприц. Фильтр следует расположить между мешком и шприцем.
11. Заполняют трубку кровью. Освобождают шприц и трубку от пузырьков и монтируют в инфузионное устройство.

а — единица эритроцитов для переливания у взрослых показана вместе с педиатрическим транспортным пакетом.
Его можно присоединить путем прокола пакета, из-за чего ЭМ следует использовать в течение 24 ч; или транспортный пакет может быть соединен с помощью стерильного соединительного устройства;
а, б — отдельные трубочки помещаются в держатели. Крышку закрывают;
в — сварочная пластина нагревается до 260 °С, расплавляя трубки. Благодаря держателю трубок они спаиваются вместе;
г — теперь из пакета можно извлекать столько препарата крови, сколько нужно. Поскольку поддерживается замкнутая система, срок использования крови не изменяется.
12. Проверяют проходимость сосудистого доступа.
13. Промывают катетер физиологическим раствором.
14. Записывают и следят за жизненно важными признаками.
15. Определяют гематокрит. Повторяют каждый час, если необходимо.
16. Начинают переливание при установленной скорости 5 мл/кг в час.
17. Осторожно переворачивают контейнер с кровью каждые 15-30 минут для уменьшения осаждения.
18. Останавливают переливание при появлении любых побочных изменений в состоянии пациента.
19. В конце инфузии промывают катетер физиологическим раствором.
20. Проверяют концентрацию гемоглобина и гематокрит у пациента, если необходимо, не ранее чем через 2 ч после трансфузии.
21. Если после трансфузии гематокрит/гемоглобин не поднялся до ожидаемого уровня, рассматривают следующие варианты:
а. Низкий гематокрит в пакете с эритроцитарной массой (ЭМ).
б. Неправильный расчет требуемой инфузии.
в. Продолжающаяся кровопотеря.
г. Трансфузионная реакция.
д. Гемолиз из-за несовместимости по системе AB0 или другой:
(1) Новорожденный имеет циркулирующие анти-А-, анти-В- и анти-АВ-антитела, которые связываются с А- или В-антигенами при трансфузии эритроцитов.
(2) Прямой антиглобулиновый тест (ПАТ) первоначально отрицательный стал положительным.
(3) Неожиданное повышение уровня билирубина.
(4) Новорожденный имеет эритроцитарные антитела другой системы, кроме AB0.
(5) Гемолиз вследствие механического повреждения эритроцитов или заболевания донора, сопровождающегося гемолизом.
источник
В своей практике врачам нередко приходится назначать переливание крови в тяжелых случаях, когда не остается других эффективных способов быстро нормализовать состояние больного.
Цельную кровь переливают не всегда, поскольку, например, у раковых пациентов она может стимулировать метастазирование. Негативное свойство цельной крови заключается в большом разнообразии антигенных раздражителей, которые в ней содержатся.
После получения ее от донора и хранения в течение определенного времени часть клеток разрушается и теряет свои функциональные свойства, а кроме того, появление значительного количества таких «обломков» чревато большой нагрузкой на почки и иммунную систему реципиента.
По этой причине обычно используют отдельные фракции крови строго по показаниям. В них спектр возможных антигенов намного меньше, и они не содержат клеток и компонентов, в которых нет необходимости.
В Европейской клинике хирургии и онкологии нередко приходится прибегать к переливанию крови и ее компонентов, так как здесь проводится лечение пациентов с тяжелой раковой и соматической патологией.
Благодаря многолетнему опыту работы и высокому уровню подготовки врачей, количество осложнений от переливания крови и ее фракций сведено к минимуму.
Четкое следование предписанным протоколам и постоянный мониторинг состояния пациентов позволяет вовремя диагностировать и предотвращать любые негативные побочные эффекты проводимой терапии.
+7(925)191-50-55
г. Москва, Духовской переулок, 22б
Если целью лечения данного конкретного пациента является устранение анемии, то нет необходимости переливать цельную кровь, поскольку перечень осложнений для такой процедуры гораздо обширней, чем, например, при переливании эритромассы.
Существует много способов ее заготовки, но основной смысл заключается в отстаивании и центрифугировании крови, удалении плазмы и аппаратном фракционировании форменных элементов. При этом иногда эритроциты отмывают в растворе, что позволяет снизить антигенную нагрузку.
В ряде случаев их погружают в крио-протекторный раствор, который дает возможность осуществлять замораживание без разрушения клеток. Также готовят эритроцитарную взвесь, в которой помимо отмытых (от остатков плазмы и других форменных элементов) эритроцитов содержится физиологический раствор.
Такая взвесь не содержит антигенов, ассоциированных с лейкоцитами, тромбоцитами, и сывороточных белков. Отмытую эритроцитарную взвесь используют для тех больных, у которых в анамнезе были аллергические реакции при трансфузии крови и ее компонентов.
Общим показанием к переливанию эритроцитарной массы является падение гемоглобина ниже 70 г/л и гематокрита ниже 25%. Такая ситуация может быть при острых кровотечениях, когда человек потерял треть объема циркулирующей крови.
Хронические кровопотери также могут быть показанием для переливания крови. При заболеваниях желудочно-кишечного тракта происходит нарушение всасывания железа и витаминов, в частности В12 и фолиевой кислоты, что приводит к развитию анемии.
При онкологической патологии из-за синдрома интоксикации подавляется красный росток кроветворения, что приводит к развитию апластической анемии.
При лейкозах и лимфомах избыточное производство лейкоцитов приводит к инфильтрации костного мозга раковыми клетками, в результате чего активность кроветворной системы, не имеющей отношение к производству пула мутировавших клеток, сильно снижается и развивается анемия.
Различные болезни пищеварительной системы, которые сопровождаются образованием эрозий и язв, часто приводят к хронической кровоточивости и возникновению выраженной анемии, которая нуждается в соответствующей терапии.
У женщин патология репродуктивной системы нередко провоцирует анемию: это могут быть не только новообразования, но и предраковые состояния, а также полипы полости и шейки матки, которые в результате механической травматизации кровоточат, приводя к потере гемоглобина.
Противопоказания к переливанию крови при тяжелых кровопотерях и анемиях носят относительный характер и не могут быть препятствием для этой процедуры.
В случае выраженной сердечной недостаточности введение в кровеносное русло избыточного объема жидкости может вызвать дополнительную нагрузку на сердечную мышцу и тогда приходится вводить пациенту мочегонные и вазодилататоры.
Следует также проявлять осторожность при выраженной почечной недостаточности.
Эритромасса содержит некоторое количество разрушенных клеток и свободного гемоглобина, которые могут засорять почечные канальцы и усиливать дисфункцию.
Кроме того, возможно разрушение части эритроцитов из-за возможного присутствия антиэритроцитарных антител и развитие гемолиза.
Процедуры переливания стараются избегать при острых инсультах, печеночной недостаточности, эндокардите, который сопровождается уменьшением сердечного выброса.
Эритроциты необходимо человеку, поскольку основная их функция – это перенос кислорода в молекулах гемоглобина. При их снижении организм испытывает кислородное голодание, что проявляется в общей слабости, бледности, снижении умственной и физической выносливости.
Критическая потеря крови с форменными элементами приводит к гиповолемическому шоку и смерти. По этой причине необходимо замещать как утраченный объем, так и клетки крови для быстрого улучшения состояния пациента.
Перед переливанием донорский материал тестируют на антигены системы AB0, резус-фактор и Келл-антигены. Это позволяет минимизировать риски иммунного конфликта между кровью донора и реципиента.
Кроме того, после того, как эритромасса доставлена в отделение проводят пробу на совместимость. Для этого берут две капли сыворотки крови пациента в пробирке, добавляют одну каплю эритромассы и две капли полиглюкина – все тщательно перемешивают.
Затем доливают 3 мл физиологического раствора. Если материал пациента и донорских эритроцитов не совместимы, то образуются мелкие агглютинаты, которые выглядят, как мелкий красный песок в растворе и на стенках пробирки.
В этом случае переливать такой материал нельзя и подыскивают другую эритромассу. Если испытание на совместимость пройдено благополучно, то проводят биологическую пробу.
Для этого в вену пациента вводят 10 мл эритромассы и выжидают 3-5 минут: при отсутствии неблагоприятных симптомов, испытание повторяют еще два раза. Если пациент хорошо отреагировал на биологическую пробу, то вводят основной объем эритромассы.
Вводимый раствор предварительно прогревают до 38ºС. Соблюдение всех необходимых правил позволяет максимально сократить риски осложнений.
Перед самой трансфузией врач осматривает пациента и заносит в историю болезни данные о его текущем состоянии. В процессе непосредственно переливания производится мониторинг самочувствия больного, измеряется пульс, давление.
После процедуры документально оформляется протокол переливания крови. Весь процесс введения эритромассы занимает 30-40 минут и происходит со скоростью 40-60 капель в минуту.
Чаще всего осложнением от такой манипуляции бывает кожная сыпь, вызванная освобождением гистамина, лихорадка, озноб.
После окончания переливания эритромассы человек проводит в постели 2-3 часа, и медсестра отслеживает его состояние: измеряет температуру, пульс и давление.
На следующий день собирают анализ мочи и крови для мониторинга функции почек и общей реакции организма.
Как правило, при соблюдении всех установленных протоколов побочных эффектов почти не бывает, зато самочувствие пациента быстро улучшается за счет устранения кислородного голодания и активации метаболизма.
+7(925)191-50-55
г. Москва, Духовской переулок, 22б
| Показания к гемотрансфузии |
| Переливание плазмы |
| Переливание эритроцитарной массы |
| Переливание тромбоцитарной массы |
| Переливание лейкоцитарной массы |
+7(925)191-50-55 — европейские протоколы лечения в Москве
центр современной онкологии и хирургии. Это одно из самых лучших медицинских учреждений, где ежегодно проходят лечение и профилактические процедуры тысячи людей из разных стран мира. Подробнее
HIPEC (Гипертермическая интраперитонеальная химиотерапия) — новейший метод лечения канцероматоза уже применяют в Европейской клинике. Подробнее
Ведущие специалисты Клиники и высококлассное оборудование всегда помогут вам и вашим близким людям в ранней диагностике рака. Подробнее
Европейская клиника имеет большой опыт по установке подкожных порт-систем для длительного внутривенного впрыскивания лечебных препаратов, забора крови для переливания или анализа е компонентов. Использование инфузионных порт-систем в онкологии – это обязательная часть «золотого стандарта» лечения. Подробнее
Стационарное отделение имеет все возможности для оказания медицинской помощи онкобольным, а также пациентам с тяжелой формой соматической патологии. . Подробнее
Эмболизация микросферами DC Bead — современный подход химиотерапии. Использование нагруженных лекарством микросфер DC Bead, обеспечивает эффективную, устойчивую и контролируемую доставку лекарства только к опухолевой ткани . . Подробнее
Лечение рака молочной железы — самые современные методы борьбы с онкологическими заболеваниями в Европейской клинике. . Подробнее
Лечение рака шейки матки, использование самых эффективных методов в Европейской клинике в Москве. . Подробнее
источник
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Эритроцитарная масса (ЭМ) — компонент крови, который состоит из эритроцитов (70-80%) и плазмы (20-30%) с примесью лейкоцитов и тромбоцитов (гематокрит — 65- 80%). По содержанию эритроцитов одна доза эритроцитарной массы (270 ± 20 мл) эквивалентна одной дозе (510 мл) крови.
Выделяют 6 видов эритроцитарной массы (эритроцитарная масса, фильтрованная; эритроцитарная масса, гамма-облученная; эритроцитарная масса, обедненная лейкоцитами и тромбоцитами; эритроцитарная масса с удаленным лейкотромбослоем; эритроцитарная масса с удаленным лейкотромбослоем, фильтрованная; эритроцитарная масса с удаленным лейкотромбослоем, гамма-облученная) и несколько видов ауто эритроцитарная масса (ауто-ЭМ; аутоЭМ, фильтрованная; аутоЭМ, гамма-облученная, и др).
Эритроцитарная взвесь (ЭВ) представляет собой эритроцитарную массу, ресуспендированную в специальном растворе натрия хлорида и гемоконсерванта, содержащего препараты желатина, и некоторые другие компоненты. Как правило, соотношение эритроцитарной взвеси и раствора составляет 1 : 1. Эритроцитарная взвесь, приобретая более высокую текучесть и соответственно более высокие реологические свойства, одновременно имеет более низкое гематокритное число (40-50%).
Выделяют 5 видов эритроцитарной взвеси (эритроцитарная взвесь с физиологическим раствором, эритроцитарная взвесь с ресуспендирующим раствором, эритроцитарная взвесь с ресуспендирующим раствором, фильтрованная, эритроцитарная взвесь с ресуспендирующим раствором, гамма-облученная, эритроцитарная взвесь, размороженная и отмытая).
Эритроцитарная масса, обедненная лейкоцитами и тромбоцитами (отмытые эритроциты — (ОЭ) представляет собой эритроцитарную массу, лишенную плазмы, а также лейкоцитов и тромбоцитов путем 1-5-кратного повторного добавления физиологического раствора и удаления надосадочной жидкости после центрифугирования. Отмытые эритроцитарные массы сохраняются до использования во взвеси 100-150 мл физиологического раствора с гематокритом 0,7-0,8 (70-80%).
Для удаления лейкоцитов из цельной консервированной крови или эритроцитарной массы активно используют специальные фильтры, которые позволяют удалять более 99% лейкоцитов, что позволяет резко уменьшить число посттрансфузионных реакций негемолитического типа и тем самым повысить эффект лечебных процедур.
Эритроцитарная взвесь, размороженная и отмытая,- метод замораживания и хранения эритроцитов при низких температурах (до 10 лет) позволяет получить после размораживания и отмывания от криопротектора (глицерола) функционально полноценные эритроциты. В замороженном состоянии эритроциты могут находиться до 10 лет.
Так же, как и с донорской кровью, более целесообразно как с медицинской, так и с экономической точек зрения заготавливать вместо цельной консервированной аутокрови ее компоненты — аутологичные (аутогенные) гемокомпоненты: эритроцитарную массу, свежезамороженную плазму (СЗП), в отдельных случаях тромбоконцентрат. При адекватной медикаментозной подготовке пациента (препараты железа, витаминотерапия, эритропоэтин) за 2-3 недели до операции можно заготовить от 600-700 до 1500-18 000 мл аутоСЗП, 400-500 мл аутоЭМ.
В ряде случаев из аутоЭМ получают аутоЭВ с физиологическим раствором или при дополнительной фильтрации — аутоЭВ с ресуспендирующим раствором, фильтрованную.

Эритроцитарная масса назначается с целью купирования анемии для усиления оксигенирующей функции крови. В отличие от консервированной крови, применение ЭМ значительно снижает вероятность иммунизации больного белками плазмы, лейкоцитами и тромбоцитами донорской крови.
У больных с нормальными исходными показателями гемоглобина, гематокрита и белков плазмы при кровопотере в пределах 10-15% ОЦК нет необходимости применения ЭМ. Поддерживать стабильную гемодинамику и возместить кровопотерю достаточно кровезаменителями.
При кровопотере более 15-20% ОЦК, как правило, наблюдаются первые признаки нарушения кислородтранспортной функции крови, что требует адекватного восполнения дефицита эритроцитов, т.е. применения ЭМ. Трансфузии ЭМ, ЭВ могут производиться капельно или струйно.
Установить какие-либо абсолютные лабораторные критерии для назначения ЭМ не представляется возможным и вряд ли целесообразно. Прежде всего, необходимо учитывать клиническое состояние пациента, сопутствующую патологию, степень и место травмы, причину анемизации, время кровотечения и многие другие факторы. Так, известно, что больные с хронической анемией более адаптированы к низкому уровню гемоглобина. В то же время больные артериальной гипотензией, с выраженной сердечно-легочной недостаточностью, при инфекционных заболеваниях и др. требуют переливания ЭМ и при более высоких значениях показателей красной крови.
При хронических кровопотерях или при недостаточности кроветворения основанием для вливания эритроцитов в большинстве случаев является падение уровня гемоглобина крови ниже 80 г/л и гематокрита ниже 25% (0,25 л/л). Для улучшения реологических свойств ЭМ (или ЭК) непосредственно перед трансфузией возможно добавление в контейнер 50-100 мл 0,9% раствора натрия хлорида, что фактически превращает ее в ЭВ с физиологическим раствором. Показания к переливанию ЭВ, ОЭ, размороженных ОЭ аналогичны назначениям эритроцитарной массы:
- травматический и операционный шок, осложненный кровопотерей;
- анемическая гипоксия при нормо-гиповолемических состояниях;
- постгеморрагические анемии;
- в период подготовки больных с критически низкими показателями гемограммы к обширным хирургическим вмешательствам;
- посттермические (при ожоговой болезни) анемии.
Отмытая эритроцитарная масса применяется у пациентов, сенсибилизированных предыдущими гемотрансфузиями к плазменным факторам или антигенам лейкоцитов и тромбоцитов. Причиной большинства трансфузионных реакций негемолитического типа у больных, имевших в анамнезе множественные трансфузии компонентов крови, а также женщин, имевших беременности, являются изоантитела к антигенам лейкоцитов (в частности, HLA), которые, несомненно, снижают эффект не только перелитого компонента, но и всей лечебной процедуры. Отмывание эритроцитарной массы практически полностью устраняет плазму и элементы разрушенных клеток периферической крови, тромбоциты и резко снижает содержание лейкоцитов ( 200 мг%) является противопоказанием для гемотрансфузии. Такая эритроцитарная масса перед гемотрансфузией отмывается.

При соблюдении правил заготовки, переработки, хранения и адекватного клиническому состоянию пациента применения донорских эритроцитов риск реакций и осложнений сводится к минимуму.
Согревание компонентов крови снижает риск гипотермии при массивных переливаниях охлажденных компонентов крови. Минимальная рекомендуемая температура переливаемой крови и ее компонентов — +35° С. При гемотрансфузии неподогретой крови или ее компонентов иногда можно наблюдать желудочковые аритмии (обычно не развиваются до снижения температуры тела ниже +28° С).
Различают пирогенные, аллергические, анафилактические, фебрильные (негемолитические) виды гемотрансфузионных реакций.
Посттрансфузионные реакции, как правило, не сопровождаются серьезными и длительными нарушениями функции органов и систем и не представляют непосредственной опасности для жизни больного. Они манифестируют, как правило, через 10-25 мин после начала гемотрансфузии, в отдельных случаях отмечаются после окончания гемотрансфузии и в зависимости от степени тяжести могут продолжаться от нескольких минут до нескольких часов.
Пирогенные реакции (гипертермия) возникают как следствие инфузии в кровеносное русло реципиента пирогенов вместе с консервированной кровью или ее компонентами. Пирогены — неспецифические протеины, продукты жизнедеятельности микроорганизмов. Посттрансфузионные пирогенные реакции могут возникать также у изосенсибилизирован-ных повторными гемотрансфузиями больных или у женщин, имевших в анамнезе неоднократную беременность при наличии антилейкоцитарных, антитромбоцитарных или антибелковых антител. Фильтрация крови через лейкофильтры и отмывание позволяет резко снизить риск изосенсибилизации пациентов при множественных гемотрансфузиях.
При возникновении пирогенных реакций появляется озноб, температура повышается до +39 или 40° С обычно через 1-2 ч после переливания крови, реже во время него. Лихорадка сопровождается головной болью, миалгией, дискомфортом в грудной клетке, болями в поясничной области. Клиническая картина может иметь различную степень выраженности. Гемотрансфузии достаточно часто протекают с субфебрильной температурой, которая обычно скоро проходит. Прогноз при пирогенных реакциях благоприятный. Клинические признаки исчезают через несколько часов.
Аллергические реакции различной степени выраженности отмечаются в 3-5% случаев гемотрансфузии. Как правило, они регистрируются у больных, сенсибилизированных предшествующими гемотрансфузиями или имевших в анамнезе повторные беременности с антителами к антигенам плазменных белков, лейкоцитов, тромбоцитов и даже Ig. У части больных аллергические реакции наблюдаются уже при первом переливании гемокомпонентов и не связаны с предшествующей изосенсибилизацией. Полагают, что в таких случаях эти реакции обусловлены наличием «спонтанных» антител к Ig и ответом IgE тучных клеток реципиента на перелитый специфический антиген донора, который часто ассоциирован с тромбоцитами или плазменными белками.
Аллергические реакции могут возникать как во время переливания крови или ее компонентов, так и отсрочено, спустя 1-2 ч после окончания процедуры. Характерный признак аллергической посттрансфузионной реакции — аллергическая сыпь, нередко в сопровождении зуда. При более тяжелом течении реакции — озноб, головные боли, лихорадка, боли в суставах, диарея. Следует иметь в виду, что аллергическая реакция может протекать с симптомами анафилактического характера — нарушением дыхания, цианозом, иногда — с быстрым развитием отека легких. Одним из самых грозных осложнений гемотрансфузии является анафилактическая реакция, иногда молниеносно развивающаяся до анафилактического шока.
По тяжести клинического течения (температуры тела и длительности проявления) выделяют три степени посттрансфузионных реакций: легкие, средние, тяжелые.
Легкие реакции характеризуются незначительным повышением температуры, головной болью, небольшим ознобом и недомоганием, болями в мышцах конечностей. Эти явления, как правило, кратковременны — 20-30 мин. Обычно для их купирования не требуется каких-либо специальных лечебных мероприятий.
Среднетяжелые реакции — отмечаются учащение пульса и дыхания, повышение температуры на 1,5-2° С, нарастающий озноб, иногда проявляется крапивница. В большинстве случаев медикаментозная терапия не требуется.
Тяжелые реакции — цианоз губ, рвота, сильная головная боль, боль в пояснице и костях, одышка, крапивница или отеки (типа Квинке), температура тела повышается более чем на 2° С, наблюдается потрясающий озноб, лейкоцитоз. Необходимо как можно скорее приступать к медикаментозной коррекции гемотрансфузионного осложнения.
Поскольку аутокомпоненты иммуноидентичны крови пациентов, реакции и осложнения, ассоциированные с переливанием компонентов донорской крови, при условии соблюдения всех правил гемотрансфузии отсутствуют.
источник
Когда приходится выбирать между жизнью и смертью, врачи используют переливание крови при низком гемоглобине.
Процедура способствует быстрой нормализации состояния больного, но таит в себе опасности. Узнайте из статьи, как может помочь переливание при низком гемоглобине и почему врачи неохотно используют этот способ лечения.
В последние десятилетия в трансфузиологии произошли изменения революционного характера. Особенно они затронули клиническую гематологию.
Если в середине XX века при низком уровне гемоглобина у пациентов с раком крови, анемиями и другими заболеваниями крови использовали «теплую» (цельную) кровь и эритроцитную массу, то сейчас применяют трансфузию кровяных компонентов, в том числе красных телец.
В современной медицине «теплую» кровь переливают только в экстренных случаях: в хирургии, травматологии и акушерстве. Гематологи используют для лечения клеточные составляющие плазмы и ее препараты.
Насколько оправдан отказ от цельной законсервированной крови? Практика показала, что компоненты имеют не меньшее терапевтическое действие.
Сейчас для повышения низкого гемоглобина во всем мире используется эритроцитная масса в виде взвеси, восстановленная, отмытая или замороженная. В последнее время в гематологии стали чаще применять аутологичную эритроцитную массу.
Показания для применения эритроцитной массы — крайне низкий уровень гемоглобина, возникший из-за объемной кровопотери или в результате лучевой терапии.
Эритроцитную массу переливают пациентам с выраженным анемическим симптомокомплексом. Целью переливания является поддержание уровня гемоглобина не меньше 90 г/л.
Уровень Hb в крови может варьироваться в зависимости от возраста и пола пациента, вида заболевания и сопутствующих недугов, поэтому показания к введению эритроцитной массы всегда строго индивидуальны.
Основанием для вливания эритроцитной массы будут быстрое ухудшение здоровья, одышка, сердцебиение, бледность слизистых и кожи.
Сколько можно влить трансфузионного материала за один раз? В некоторых случаях требуется вливать внушительные объемы эритроцитов, но большие дозы (более 0,5 л в сутки) опасны для состояния больного, так как увеличивается риск послетрансфузионных осложнений.
При определении достаточного объема гемотрансфузии в среднем придерживаются следующего соотношения: при потере больным более 1 литра крови на каждый литр кровопотери переливают по одной-две дозы эритроцитарной массы и плазмы и до полутора литра солевых растворов.
Больные с заболеваниями крови должны проходить адекватную химическую терапию, при необходимости используется пересадка стволовых клеток.
Кроме того, применяется поддерживающая терапия, главным образом состоящая из трансфузионного гемакомпонентного лечения.
Гематологическим больным эритроцитарную массу переливают только при тяжелых формах железодефицитной анемии.
Особенно показано переливание крови при низком гемоглобине пожилым больным или перед срочным хирургическим вмешательством с большой кровопотерей.
При остром лейкозе переливание эритроцитарной массы (ЭМ) показано при низком гемоглобине (меньше чем 90 грамм на литр).
Поддерживать данный уровень во время химиотерапии помогает переливание 1 – 1,5 литра эритроцитарной массы.
При гемобластозах трансфузию эритроцитов обязательно проводят еще на стадии подготовки к химиолечению, так как при низком гемоглобине в крови химиотерапия не показывает нужных результатов и переносится гораздо тяжелее.
Переливание эритроцитарной массы отличаются от обычного переливания крови прежде всего скоростью процедуры. Компоненты гуще натуральной крови.
Если нужно перелить их быстрее, то врач разводит эритроцитарную массу изотоническим раствором хлорида натрия. Для смешивания двух жидкостей в капельницу вставляют Y-образные трубки.
Массу переливают только в слегка подогретом виде, ее температура должна быть 35 – 37 градусов. Перед процедурой врач еще раз определяет у пациента группу и резус-фактор и выбирает соответствующую ЭМ.
За несколько минут до начала трансфузии делают пробы на совместимость, смешивая на предметном стекле каплю крови пациента, две капли ЭМ и 5 капель физраствора.
За смесью внимательно наблюдают. Если через 3 минуты в ней не появились признаки сворачивания, то трансфузионный материал совместим с кровью больного.
Кроме главных, существует второстепенные группы крови. Для окончательной проверки совместимости проводят биологическую пробу — пациенту вливают небольшое количество (20 – 25 мл) трансфузионного материала, перекрывают капельницу и наблюдают.
Процедуру можно продолжать, если после теста у больного не наблюдаются покраснение лица, беспокойство, одышка, не повышается пульс.
Пациенты с низким гемоглобином, которым делали много переливаний, приобретают зависимость от гемотрансфузии.
У таких пациентов развивается гемосидероз, что ограничивает возможность переливания крови. Пациентам с гемосидерозом поддерживают уровень гемоглобина не менее 80 грамм на литр.
Главными правилами терапии с использованием компонентов крови являются:
- принцип достаточности;
- индивидуальный подход.
Если пониженный или низкий гемоглобин — следствие хронических заболеваний негематологического характера, отравлений, ожогов, воспалительных инфекций, то переливание должно быть строго ограниченным, только для поддержки естественного эритроцитообразования.
При сильной анемии нет абсолютных противопоказаний к вливанию эритроцитной массы. Можно приступать к переливанию крови, если уровень гемоглобина упал ниже 70 г/л, пациент страдает от одышки или при наличии сердечно-сосудистых осложнений.
В таких случаях предпочтение отдают размороженной, отмытой или фильтрованной эритроцитарной массе.
Относительными противопоказаниями к переливанию являются:
- затяжная почечная или печеночная недостаточность;
- остропротекающее воспаление эндокарда;
- сердечные заболевания с недостаточным кровообращением;
- гипертония 3 степени;
- сужение просвета сосудов мозга;
- серьезные патологии кровообращения в мозгу;
- туберкулез;
- остропротекающий ревматизм;
- легочные отеки.
Существуют побочные эффекты от переливания эритроцитарной массы в виде аллергического ответа организма больного.
Посттрансфузионные реакции начинается через 10 – 20 минут после начала переливания и продолжаются до нескольких часов.
К их числу относятся: покраснение кожи, небольшой озноб, повышение температуры тела, дискомфорт в грудной клетке, боль в пояснице.
Клиника имеет разную степень выраженности. Побочные эффекты должны полностью исчезнуть через три-четыре часа после окончания процедуры.
Переливание показано при многих заболеваниях, но при этом оно остается опасной процедурой со множеством противопоказаний.
Низкий гемоглобин не является абсолютным показанием для трансфузии. Если можно обойтись менее опасными и дорогостоящими методами, чем переливание ЭМ, то лучше воспользоваться ими.
источник