Сущность Biz-дефицитной анемии (В12ДА) состоит в нарушении образования дезоксирибонуклеиновой кислоты (ДНК) в связи с нехваткой в организме витамина Bi2 (цианокобаламина), что приводит к нарушению кроветворения, появлению в костном мозге мегалобластов, внутри-костномозговому разрушению эритрокариоцитов, снижению количества эритроцитов и гемоглобина, лейкопении, нейтропении и тромбоцитопении, а также к изменению ряда органов и систем (пищеварительный тракт, ЦНС).
Этиология.В12ДА встречается значительно реже, чем ЖДА, и может быть вызвана следующими причинами:
1) нарушением секреции гастромукопротеина («внутренний фактор»)
при наследственно обусловленной атрофии желез желудка (пернициозная
анемия, или болезнь Аддисона — Бирмера), при органических заболева
ниях желудка (полипоз, рак), после гастрэктомии;
2) повышением расхода витамина Bi2 (инвазия широкого лентеца, ак
тивация кишечной микрофлоры при дивертикулезах тонкой кишки);
3) нарушением всасывания витамина Bi2 (органические заболевания
кишечника — спру, илеит, рак, состояние после резекции кишки, наслед
ственное нарушение всасывания — болезнь Имерслунд—Гресбека);
4) нарушением транспорта витамина Вп (дефицит транскобаламина);
5) образованием антител к «внутреннему фактору» или комплексу
«внутренний фактор» + витамин В12-
Сходную с В12ДА гиперхромную анемию вызывает дефицит фолиевой кислоты, который возникает при: 1) повышенном расходе (беременность); 2) вскармливании детей козьим молоком; 3) нарушении всасывания (органические заболевания кишечника, алкоголизм); 4) приеме некоторых лекарственных препаратов (противосудорожные, противотуберкулезные препараты, фенобарбитал, контрацептивы и др.).
Патогенез.Витамин В(2 состоит из двух коферментов — метилкоба-ламина и дезоксиаденозилкобаламина. Дефицит первого кофермента обусловливает нарушение синтеза ДНК, вследствие чего деление и созревание клеток красного ряда нарушаются, они избыточно растут, не утрачивая ядра. Большие клетки, содержащие ядра, называются мегалобласта-ми, они не созревают до мегалоцитов (гигантские эритроциты без ядер), легко гемолизируются, еще находясь в костном мозге. Дефицит витамина В(2 вызывает нарушение роста клеток лейкоцитарного и тромбоцитарного рядов, но это не так заметно сказывается на морфологии и количестве клеток, как нарушения эритропоэза.
При недостатке второго кофермента нарушается обмен жирных кислот, вследствие чего в организме происходит накопление токсичных продуктов пропионовой и метилмалоновой кислот: развивается поражение заднебоко-вых канатиков спинного мозга — фуникулярный миелоз (схема 26).
Клиническая картина.Проявления В^ДА, как это вытекает из схемы патогенеза, складываются из следующих синдромов: 1) циркуляторно-ги-поксического (при достаточной выраженности анемии и кислородного голодания тканей); 2) гастроэнтерологического; 3) неврологического; 4) гематологического (анемия гиперхромного типа).
Кроме этих синдромов, клиническая картина будет определяться также заболеванием, на основе которого развилась В^ДА.
На I этапе диагностического поиска при достаточно выраженной анемии могут наблюдаться симптомы, обусловленные циркуляторно-ги-поксическим синдромом (слабость, повышенная утомляемость, одышка при физической нагрузке, болевые ощущения в области сердца, сердцебиения). В случае нерезкого кислородного голодания тканей эти жалобы могут отсутствовать. Снижение аппетита, отвращение к мясу, боли в кончике языка и жжение, чувство тяжести в эпигастрии после еды, чередование поносов и запоров обусловлены поражением пищеварительного тракта и, в частности, выраженной секреторной недостаточностью желудка. При поражении ЦНС больные жалуются на головную боль, неустойчивую походку, зябкость, чувство онемения в конечностях, ощущение «ползания
| Схема 26. Патогенез В12-дефицитной анемии |
мурашек». Выраженность этих жалоб не всегда соответствует степени анемии, в период ремиссии заболевания жалобы могут отсутствовать. Весьма существенно, если все перечисленные жалобы предъявляет немолодой человек, в этих случаях вероятность В12ДА повышается.
В семейном анамнезе у больных с предполагаемой В12ДА могут быть больные с данным заболеванием. Злоупотребление алкоголем может быть одной из причин развития анемии.
Данные анамнеза могут помочь в предположении патогенетического варианта анемии. Развитие анемии после пребывания больного возле больших водоемов и употребления в пищу сырой или недостаточно обработанной рыбы заставляет предположить в качестве возможной причины дифилло-ботриоз. Если заболевание возникло у пожилого человека, страдающего хроническим гастритом, и развивается медленно, то можно думать о В12ДА. В случае, если симптомы со стороны пищеварительного тракта сочетаются со снижением массы тела и быстро прогрессируют, следует предположить в качестве причины заболевания злокачественное новообразование.
Наконец, сведения об успешном лечении больного витамином Bf2 позволяют с большой уверенностью рассматривать имеющуюся симптоматику как проявление В^ДА.
На II этапе диагностического поиска симптомы могут быть обусловлены поражением пищеварительного тракта и ЦНС. Кроме того, ряд неспецифических признаков повышает вероятность предположения о наличии у больного В12ДА. Так, бледность кожных покровов в сочетании с небольшой иктеричностью склер и одутловатостью лица наблюдается при В12ДА. Масса тела таких больных, как правило, нормальная или повышенная. Однако снижение массы тела может указывать на злокачествен-
ную опухоль как возможную причину ВпДА. Аналогичное значение имеет обнаружение увеличенного плотного лимфатического узла (метастаз опухоли?). Циркуляторно-гипоксический синдром проявляется так же, как и при ЖДА (расширение границ сердца влево, тахикардия, систолический шум, шум «волчка» на яремных венах).
Несомненное диагностическое значение имеет обнаружение при исследовании пищеварительного тракта признаков глоссита: сглаженные сосочки вплоть до полной их атрофии («полированный» язык). Печень несколько увеличена, может прощупываться селезенка. Однако все эти симптомы не являются обязательными для В12ДА. Отмечаются нарушения глубокой чувствительности, нижний спастический парапарез (картина псевдотабеса). Следует заметить, что изменения нервной системы наблюдаются далеко не во всех случаях, так что их отсутствие не исключает диагноза В12ДА.
Таким образом, данные II этапа в сочетании с анамнестическими данными и жалобами больного, хотя и выявляют ряд основных симптомов В12ДА, но дают основание лишь заподозрить эту форму болезни. Окончательный диагноз ставят после проведения серии лабораторных исследований.
На III этапе диагностического поиска при исследовании периферической крови выявляют следующие признаки: снижение количества эритроцитов (менее 310 12 /л), повышение цветового показателя (более 1,1), среднего содержания гемоглобина в эритроците (более 34 пг) и среднего объема эритроцита (более 120 мкм 3 ). Эритроцитометрическая кривая сдвинута вправо — увеличено количество макроцитов, появляются мега-лоциты — эритроциты диаметром более 12 мкм. Форма эритроцитов изменена — пойкилоцитоз. Встречаются единичные мегалобласты.
Дополнительный признак — появление нейтрофилов с гиперсегмен-тированными ядрами.
Если в картине периферической крови не обнаруживают характерных признаков, то производят стерналъную пункцию. Последняя позволяет выявить в костном мозге мегалобластический тип кроветворения.
Важным является определение содержания сывороточного железа: при ВпДА оно может быть в норме или повышено в связи с усиленным гемолизом эритроцитов. В этих случаях увеличено содержание непрямого билирубина. При исследовании желудочного сока часто выявляется гиста-миноустойчивая ахилия (характерный признак анемии Аддисона — Бирме-ра), эндоскопически — атрофия слизистой оболочки желудка.
Другие инструментальные методы исследования помогают обнаружить признаки миокардиодистрофии (развивается на фоне выраженной анемии), а также уточнить этиологию заболевания.
Диагностика. В диагностике В12ДА выделяют два этапа: 1) доказательство дефицита витамина Вп как причины анемии; 2) выявление причин дефицита витамина Bi2.
Критериями ВпДА являются: 1) снижение содержания эритроцитов (менее 3,0-10 12 /л); 2) повышение цветового показателя (более 1,1); 3) повышение содержания гемоглобина в эритроцитах (более 34 пг); 4) увеличение среднего объема эритроцита (более 120 мкм 3 ); 5) сдвиг эритроцитомет-рической кривой вправо (увеличение количества макроцитов, появление ме-галоцитов — эритроцитов диаметром более 12 мкм); 6) появление в мазках пунктата костного мозга элементов мегалобластного кроветворения; 7) по-
вышение содержания сывороточного железа (более 30,4 мкмоль/л); 8) снижение радиоактивности мочи после приема витамина Bi2, меченного радиоактивным кобальтом.
Для выявления причины анемии следует проводить рентгенологическое и эндоскопическое исследование пищеварительного тракта (опухоль желудка, дивертикулез тонкой кишки), гельминтологическое исследование (инвазия широким лентецом), функциональное исследование печени с биопсией (хронический гепатит, цирроз), исследование нейтрального жира в кишечнике (спру).
В12ДА следует дифференцировать от фолиеводефицитной анемии. При дефиците фолиевой кислоты наблюдается макроцитарная гиперхром-ная анемия, а в костном мозге могут обнаруживаться мегалобласты. Следует отметить, что дефицит фолиевой кислоты встречается значительно реже. В отличие от В12ДА при фолиеводефицитной анемии содержание фолиевой кислоты в сыворотке, а также в эритроцитах снижено. Кроме того, при окраске препарата костного мозга ализарином красным окрашиваются только мегалобласты, связанные с дефицитом В^, и не окрашиваются мегалобласты, связанные с дефицитом фолиевой кислоты.
Течение. Заболевание может резко обостриться. В таких случаях развивается коматозное состояние: потеря сознания, снижение температуры тела и АД, одышка, рвота, арефлексия, непроизвольное мочеиспускание. Между развитием коматозного состояния и падением уровня гемоглобина нет четких коррелятивных отношений (у больных с резко сниженным содержанием гемоглобина не наблюдается комы). Главную роль в патогенезе комы играют быстрый темп и степень снижения гемоглобина, резкая ишемия и гипоксия ЦНС.
Формулировка развернутого клинического диагнозаучитывает: 1) этиологию В12ДА (отдельно следует выделять такую форму анемии, как болезнь Аддисона — Бирмера); 2) стадию процесса (рецидив — ремиссия); 3) выраженность отдельных синдромов (обычно при наличии неврологических расстройств, обусловленных фуникулярным миелозом).
Лечение.Комплекс лечебных мероприятий при В12ДА следует проводить с учетом этиологии, выраженности анемии и наличия неврологических нарушений. При лечении следует ориентироваться на следующие положения:
• Непременным условием лечения В12ДА при глистной инвазии явля
ется дегельминтизация (для изгнания широкого лентеца назначают
фенасал по определенной схеме или экстракт мужского папоротни
ка).
• При органических заболеваниях кишечника и поносах следует при
менять ферментные препараты (панзинорм, фестал, панкреатин), а
также закрепляющие средства (карбонат кальция в сочетании с дер-
матолом).
• Нормализация кишечной флоры достигается приемом ферментных
препаратов (панзинорм, фестал, панкреатин), а также подбором
диеты, способствующей ликвидации синдромов гнилостной или
бродильной диспепсии.
• Сбалансированное питание с достаточным содержанием витаминов
белка, безусловным запрещением алкоголя — непременное условие
лечения Bir и фолиеводефицитной анемии.
• Патогенетическая терапия осуществляется с помощью парентерального введения витамина Bi2 (ликвидация его дефицита), а также нормализации измененных показателей центральной гемодинамики и нейтрализации антител к гастромукопротеину («внутреннему фактору») или комплексу гастромукопротеин + витамин В^ (корти-костероидная терапия). Цианкобаламин (витамин Вп) вводят ежедневно внутримышечно в дозе 200 — 500 мкг 1 раз в день в течение 4 — 6 нед до наступления гематологической ремиссии. Критериями гематологической реакции являются резкое увеличение количества ретикулоцитов в периферической крови — ретикулоцитарный криз, трансформации мегалобластического кроветворения в нормобласти-ческое. Появление ретикулоцитарного криза на 5 —б-й день лечения является ранним критерием эффективности его. В процессе лечения цианкобаламином количество эритроцитов нарастает быстрее, чем содержание гемоглобина, в связи с этим цветовой показатель обычно снижается. После нормализации костномозгового кроветворения и состава крови (обычно через 1,5 — 2 мес) витамин вводят 1 раз в неделю в течение 2 — 3 мес, затем в течение полугода 2 раза в месяц в тех же дозах, что и в начале курса). В дальнейшем больных ставят на диспансерный учет; профилактически им вводят витамин Bi2 1 — 2 раза в год короткими курсами по 5 — 6 инъекций или ежемесячно по 200 — 500 мкг (пожизненно).
При симптомах фуникулярного миелоза витамин Вп вводят в значительных дозах — 500 — 1000 мкг ежедневно в течение 10 дней, а затем 1—3 раза в неделю до исчезновения неврологической симптоматики.
Гемотрансфузии проводят лишь при значительном снижении гемоглобина и проявлении симптомов коматозного состояния. Рекомендуется вводить эритроцитную массу по 250 — 300 мл (5 — 6 трансфузий).
Преднизолон (20 — 30 мг/сут) рекомендуется при аутоиммунной природе заболевания.
Прогноз.В настоящее время применение витамина Bt2 сделало прогноз В12ДА благоприятным. При адекватной терапии больные живут длительное время.
Профилактика.Мер первичной профилактики не существует. У лиц, имеющих перечисленные ранее этиологические факторы, следует периодически исследовать кровь для своевременного выявления анемии.
Дата добавления: 2014-11-20 ; Просмотров: 527 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
Кандидат медицинских наук, доцент В.А. Ткачев
В12-дефицитная анемия – это тяжелая прогрессирующая анемия, возникающая при нарушении усвоения витамина В12, поступающего с пищей, вследствие пониженной (или при отсутствии) секреции внутреннего желудочного фактора.
Номенклатура названия этого заболевания разная, и оно нередко обозначается в литературе как пернициозная анемия (perniciosa – гибельная), злокачественная болезнь Аддисона–Бирмера (по фамилии авторов), а также мегалобластная анемия (по типу кроветворения).
Болеют лица старше 40 лет. Женщины подвержены этому заболеванию в два раза чаще, чем мужчины и, прежде всего, в возрасте старше 50–60 лет. Известны случаи В12-дефицитной анемии у детей, вскармливаемых козьим молоком или сухими молочными смесями. Заболеваемость составляет от 20 до 60 случаев на 10 000 населения.
Историческая справка. Первое описание этого заболевания сделал Кумбс в 1822 г. и назвал его тяжелым первичным малокровием. В 1855 г. врач Аддисон описал это страдание под названием «идиопатическая анемия». В 1872 г. Бирмер опубликовал результаты наблюдения за группой больных, страдавших прогрессирующей пернициозной анемией. Однако возможность излечения этого заболевания появилась только в 1926 г., когда Майнот и Мерфи обнаружили выраженный лечебный эффект от назначения сырой печени.
Через три года американский физиолог Кастл показал, что сырое мясо, печень, дрожжи, обработанные желудочным соком здорового человека, обладают свойством вызывать ремиссию у больного пернициозной анемией. Исследования Кастла легли в основу концепции, согласно которой в результате взаимодействия двух факторов – внешнего, содержащегося в сыром мясе, сырой печени, дрожжах, и внутреннего, вырабатываемого слизистой оболочкой желудка, создается антианемическое соединение, которое обеспечивает физиологическое вызревание костномозговых клеток.
Природа внешнего фактора была установлена – им является цианкобаламин (витамин В12). Витамин В12 по потребности организма используется не только для гемопоэза в костном мозге, но и для нормального функционирования нервной ткани и органов пищеварения.
Комплексное соединение, состоящее из пептидов (появляющихся в процессе превращения пепсиногена в пепсин) и мукоидов (выделяемых добавочными клетками слизистой оболочки желудка) было названо гастромукопротеидом или внутренним фактором Кастла. Роль внутреннего фактора (гастромукопротеида) заключается в образовании с витамином В12 комплекса, обеспечивающего транспорт цианкобаламина по кишечнику и препятствующего его распаду и инактивации. Резорбция (всасывание) витамина В12 происходит в подвздошной кишке. Дальнейшее поступление его в портальный кровоток осуществляется при помощи белковых переносчиков: транскобаламина-1 (-глобулина) и транскобаламина-2 (-глобулина), которые образуют белково-В12-витаминный комплекс, способный депонироваться в печени.
Этиология. Ведущим фактором в этиологии заболевания является эндогеннная недостаточность витамина В12, возникающая вследствие нарушения его всасывания из-за прекращения секреции внутреннего фактора (гастромукопротеида).
Нарушение всасывания В12 может возникнуть в результате поражения желудочно-кишечного тракта воспалительным или злокачественным процессом, после субтотального или тотального удаления желудка, после обширной резекции части тонкого кишечника. В редких случаях пернициозная анемия развивается при нормальной секреции внутреннего желудочного фактора и обусловлена врожденным отсутствием транскобаламина-2, с которым витамин В12 связывается и доставляется в печень, либо в результате отсутствия в кишечнике белкового акцептора (воспринимающего) витамина В12, необходимого для поступления цианкобаламина из кишечника в кровеносное русло. В отдельных случаях имеет место генетический фактор развития В12-дефицитной анемии вследствие врожденного нарушения выработки желудочного фактора или наличия антител против париетальных клеток.
К возникновению В12-дефицитной анемии могут привести и следующие факторы:
нарушение всасывания В12 в тонком кишечнике в результате хронического энтерита или глютеновой энтеропатии;
конкурентное поглощение витамина В12 в тонком кишечнике широким лентецом или микроорганизмами;
полное исключение пищи животного происхождения;
длительное снижение внешнесекреторной активности поджелудочной железы, следствием чего является нарушение расщепления протеина R, без которого витамин В12 не может связаться с мукополисахаридом;
длительное назначение некоторых лекарственных препаратов: метотрексат, сульфасалазин, триамтерен, 6-меркаптопурин, азатиоприн, ацикловир, фторурацил, цитозар, фенобарбитал и др.
Патогенез. Нарушение кроветворения при В12-дефицитной анемии характеризуется мегалобластическим типом для всех трех ростков крови: эритроидного, гранулоцитарного и мегакариоцитарного. Отмечается неэффективность красного кроветворения: нарушение дифференцировки эритроидных клеток и появление аномальных клеток типа промегалобластов, мегалобластов (большого размера клеток с базофильной цитоплазмой и ядром, содержащим ядрышки).
В результате дефектного метаболизма фолиевой кислоты (из-за дефицита В12), которая участвует в образовании ДНК, нарушается клеточное деление. Следствием этого является выраженная интрамедуллярная гибель эритроидных элементов и снижение количества эритроцитов на периферии.
Из-за несостоятельности клеточных элементов крови усилен гемолиз, который проявляется гипербилирубинемией, уробилинурией, увеличением стеркобилина в кале.
Патологоанатомические изменения характеризуются общим малокровием, желтушностью кожи и слизистых, жировой дистрофией миокарда, печени, почек. Костный мозг сочный, малинового цвета из-за гиперплазии.
Со стороны органов пищеварения выявляются атрофические изменения сосочков языка (их сглаженность), воспалительные его изменения (глоссит), афтозные высыпания, трещины (Гунтеровский глоссит), а также атрофия слизистой оболочки щек, неба, глотки, пищевода. Наибольшая атрофия регистрируется в желудке, которая характеризуется истончением его стенок, формированием полипов. Слизистая оболочка кишечника также атрофирована. Селезенка, как правило, нормальных размеров или увеличена.
Гепатомегалия невыраженная. Выявляется гемосидероз в печени, селезенке, почках (ржавый оттенок на разрезе) в результате гемолиза эритроцитов.
В нервных волокнах языка (нервных сплетениях Мейснера и Ауэрбаха), а также в задних столбах спинного мозга (очаговое набухание с распадом миелиновых нервных волокон) отмечаются дистрофические изменения.
Клинические проявления В12-дефицитной анемии чаще развиваются постепенно: нарастает слабость, недомогание, головокружение, диспепсические расстройства, шум в ушах, склонность к ожирению. Редко заболевание начинается остро, с подъема температуры тела до 38 С, выраженной слабости.
Анемический синдром характеризуется вялостью, бледностью кожных покровов с лимонно-желтым оттенком, иногда (у 12% больных) субиктеричностью склер. В периферической крови регистрируется анемия, чаще (58%) тяжелая, с увеличением цветного показателя до 1,4, снижением ретикулоцитов до 0,5 – 1,0% (у трети больных – ретикулоцитоз), пойкилоцитозом и наличием телец Жолли и колец Кэбота в эритроцитах. Часто выявляется лейкопения, лимфоцитоз, но тромбоцитопения.
В костном мозге определяются признаки мегалобластического типа кроветворения.
Синдром желудочной диспепсии (37,% наблюдений) проявляется отрыжкой, тошнотой, потерей вкусовых ощущений, снижением аппетита вплоть до отвращения к пище, тяжестью в эпигастрии, иногда дисфагией, чувством жжения языка, слизистой оболочки рта. На ЭГДС выявляются атрофические изменения в слизистой оболочки пищевода и желудка.
Синдром кишечной диспепсии характеризуется неустойчивым стулом, похуданием.
Глоссит проявляется наличием «ошпаренного» (красного) или «лакированного» с трещинами языка. Боли в языке отмечаются у 30% больных с В12-дефицитной анемией.
Синдром желтухи бывает у 50% больных и проявляется субиктеричностью склер и гипербилирубинемией.
Синдром фуникулярного миелоза (сенсорная атаксия – нарушение координации движений) отмечается у больных с В12-дефицитной анемией в 11% случаев и развивается в результате нарушения проприорецептивной чувствительности из-за атрофических процессов в задних рогах спинного мозга. Могут быть и другие симптомы поражения нервной системы: парестезии, расстройства функции тазовых органов, снижение рефлексов.
Синдром межреберной невралгии встречается существенно чаще (до 30% случаев), чем признаки фуникулярного миелоза, проявляется невралгическими болями по ходу межреберий и также обусловлен функциональной недостаточностью нервной ткани проводников.
У части больных отмечается поражение черепномозговых нервов (зрительного, слухового, обонятельного), наличие симптомов спинального паралича (спастический парапарез с повышенными рефлексами и клонусами) Может обнаруживаться центральная скотома (дефект поля зрения) с потерей зрения.
Изменения со стороны центральной нервной системы могут проявляться синдромом психомоторного возбуждения (маниакальное состояние с эйфорией или синдромом депрессии с нарушением памяти и критики — мегалобластное слабоумие).
Кардиальный синдром (в 15–20% наблюдений) характеризуется одышкой, сердцебиением, болями в области сердца, миокардиодистрофией. При аускультации сердца выслушивается функциональный анемический шум. На ЭКГ определяется снижение ST, расширение желудочкового комплекса.
Отечный синдром встречается при В12-дефицитной анемии в 80% случаев и проявляется периферическими отеками, могущими достигать степени анасарки, как результат недостаточности кровообращения.
Увеличение печени (синдром гепатомегалии) встречается у 22% больных, увеличение селезенки (синдром спленомегалии) в 10% случаях.
При нелеченной В12-дефицитной анемии может развиться синдром пернициозной комы, проявляющийся ишемией головного мозга, потерей сознания, арефлексией, падением температуры тела, снижением АД, рвотой, непроизвольным мочеиспусканием.
С целью диагностики заболевания проводится тщательное гематологическое исследование, включающее изучение картины периферической крови, стернального пунктата и сывороточных факторов, участвующих в гемопоэзе. Точный диагноз очень важен, т.к. эти больные в ряде случаев нуждаются в пожизненном лечении.
Гиперсегментация нейтрофилов (более пяти ядерных долей) периферической крови является первой гематологической патологией при мегалобластном статусе. У здорового человека могут циркулировать в крови до 2% гиперсегментированных нейтрофилов. У больных мегалобластной анемией количество гиперсегментированных нейтрофилов превышает 5%.
Для костномозгового кроветворения характерен мегалобластический тип, для которого типично раздражение красного ростка и появление мегалобластов. Костный мозг гиперклеточный за счет увеличения количества ядросодержащих клеток красного ряда. В результате нарушения клеточного деления эритроидные клетки становятся очень крупными (мегалобласты). Они характеризуются большой величиной, нежной структурой и необычным расположением хроматина в ядре, асинхронной дифференцировкой ядра и цитоплазмы.
В сыворотке крови у больных с В12-дефицитной анемией повышена концентрация билирубина, железа, ферритина (железосодержащий белок печени). Активность сывороточной лактатдегидрогеназы (ЛДГ) значительно повышена и увеличивается по мере прогрессирования заболевания. Уровень сывороточного цианкобаламина обычно низкий, но может быть нормальным.
Дифференциальная диагностика проводится с фолиево-дефицитной анемией. Дефицит фолиевой кислоты наблюдается обычно в более молодом возрасте, не сопровождается атрофическими изменениями слизистой оболочки желудка и неврологической симптоматикой.
Для исключения фолиево-дефицитной анемии проводится тест Шиллинга: вводят витамин В12 парентерально, который определяется в моче в минимальных количествах при В12-дефицитной анемии и в больших количествах — при фолиево-дефицитной. Важно учитывать, что назначение больным с В12-дефицитной анемией фолиевой кислоты быстро способствует развитию фуникулярного миелоза.
Следует помнить, что симптоматическую мегалобластную анемию вызывают опухоли желудка, тонкой и слепой кишки, а также глистная инвазия (глистная В12-дефицитная анемия), что необходимо исключить при верификации диагноза.
Дифференцировать следует и с эритромиелозами (начальные формы проявления лейкоза), которые сопровождаются анемией, протекающей с повышенным содержанием в крови витамина В12 и резистентной к лечению цианкобаламином.
При проведении дифференциальной диагностики В12-дефицитной анемии необходимо установить ее причины.
Лечение В12-дефицитной анемии включает парентеральное введение витамина В12 или гидрооксикобаламина (метаболит цианкобаламина) в дозах, обеспечивающих удовлетворение дневной потребности и удвоение запасов депо. Витамин В12 вводят по 1000 мкг внутримышечно ежедневно в течение двух недель, затем один раз в неделю до нормализации уровня гемоглобина, после чего переходят на введение 1 раз в месяц в течение всей жизни.
Оксикобаламин по фармакологическим свойствам близок к цианкобаламину, но сравнительно с последним быстрее превращается в организме в активную коферментную форму и дольше сохраняется в крови. Вводится оксикобаламин в дозе 500–1000 мкг через день или ежедневно. При наличии неврологической симптоматики необходимо введение препарата в дозе 1000 мкг каждые две недели в течение шести месяцев.
При фуникулярном миелозе назначаются массивные дозы цианкобаламина по 1000 мкг ежедневно в течение 7–10 дней, далее два раза в неделю до исчезновения неврологических признаков.
Начало терапии кобаламином быстро улучшает самочувствие больных. Костномозговой эритропоэз превращается из мегалобластного в нормобластный уже через 12 часов после введения витамина В12. Поэтому назначение витамина В12 при коматозном состоянии относится к неотложным мероприятиям. Ретикулоцитоз появляется на 3–5 день, пик его (ретикулоцитарный криз) наиболее выражен на 4–10 день. Концентрация гемоглобина нормализуется через 1–2 месяца. Гиперсегментация нейтрофилов сохраняется до 10–14 дней.
Трансфузии эритроцитарной массы показаны для срочной ликвидации симптомов гипоксии.
После терапии кобаламином может развиться тяжелая гипокалиемия. Поэтому в процессе лечения витамином В12 необходимо тщательно контролировать содержание калия в крови и при необходимости проводить заместительную терапию.
Лечение кобаламином следует назначать всем больным после тотальной гастрэктомии. Для предупреждения обострения витамин В12 вводится один раз в две недели по 100 – 200 мкг.
Диспансеризация. Больные В12-дефицитной анемией подлежат диспансерному наблюдению, в ходе которого проводится мониторинг состояния периферической крови 1-2 раза в год, а также лечение заболеваний и состояний, приведших к развитию данного вида анемии.
Существуют разные схемы поддерживающей терапии кобаламинами. При назначении цианкобаламина рекомендуются пожизненно ежегодные профилактические трехнедельные курсы по 400-500 мкг через день либо ежемесячное введение 500-1000 мкг препарата. Гидроксикобаламин рекомендуется ежегодными профилактическими курсами по одной инъекции в неделю (1 мг) в течение 2-х месяцев.
источник
. или: Пернициозная анемия (от латинского слова «гибельный, опасный»), мегалобластная анемия, болезнь Аддисона-Бирмера, злокачественное малокровие (устаревшее название)
В12-дефицитная анемия — это заболевание, обусловленное нарушением кроветворения (образования клеток крови) вследствие дефицита в организме витамина В12.
Анемия может развиться через 4-5 месяцев полного прекращения поступления витамина В12 в организм.
Все симптомы В12 -дефицитной анемии объединены в три синдрома (устойчивая совокупность симптомов, объединенных единым развитием).
- Анемический (то есть со стороны системы крови):
- слабость, снижение работоспособности;
- головокружение;
- обморочные состояния;
- шум в ушах;
- мелькание « мушек» перед глазами;
- одышка (учащенное дыхание) и сердцебиение при незначительной физической нагрузке;
- колющие боли в грудной клетке.
- Гастроэнтерологический (то есть со стороны системы органов пищеварения) синдром:
- снижение массы тела;
- тошнота и рвота;
- запоры;
- снижение аппетита;
- ощущение жжения в языке – проявление гюнтеровского глоссита (изменения структуры языка вследствие дефицита витамина В12). Язык становится ярко-красным или малиновым, « лакированным» (со сглаженной поверхностью).
- Неврологический синдром (то есть со стороны нервной системы). Для В12 -дефицита характерно поражение периферической нервной системы (то есть нервы, соединяющие головной и спинной мозг со всеми органами).
- Онемение и неприятные ощущения в конечностях.
- Скованность ног.
- Неустойчивость походки.
- Мышечная слабость.
- При длительном дефиците витамина В12 может развиваться поражение спинного и головного мозга, имеющее свои симптомы:
- утрачивается вибрационная чувствительность (то есть чувствительность к воздействиям колебаний на кожу) в ногах;
- появляются эпизоды резкого сокращения мышц (судороги).
По степени тяжести, в зависимости от содержания гемоглобина (особого вещества, содержащегося в эритроцитах, переносящего кислород) в крови, различают:
- легкую анемию (гемоглобин от 90 до 110 г/л, то есть граммов гемоглобина на 1 л крови);
- анемию средней тяжести (гемоглобин от 90 до 70 г/л);
- тяжелую анемию (гемоглобин менее 70 г/л).
В норме у мужчин содержание гемоглобина в крови 130/160 г/л. Ситуации, при которых гемоглобин крови составляет от 110 до 130 г/л, являются промежуточными между нормой и анемией.
Врач гематолог поможет при лечении заболевания
- Анализ анамнеза заболевания и жалоб (когда (как давно) появились общая слабость, нарушения походки, снижение аппетита, тошнота, одышка и другие симптомы, с чем пациент связывает их возникновение).
- Анализ анамнеза жизни (есть ли у пациента какие-либо хронические заболевания, были ли в семье случаи глистной инвазии (внедрение в организм человека круглых или плоских червей), отмечаются ли наследственные заболевания (например, гастрит – воспаление слизистой оболочки желудка и др.), имеет ли пациент вредные привычки, принимал ли длительно какие-нибудь препараты, выявлялись ли у него опухоли, контактировал ли он с токсическими (отравляющими) веществами).
- Физикальный осмотр. Определяется цвет кожных покровов (для В12 дефицитной анемии характерна бледность кожных покровов), осматривается язык (характерен малиновый язык с гладкой поверхностью), пульс может быть учащенным, артериальное давление — сниженным.
- Анализ крови. При В12 дефицитной анемии определяется снижение количества эритроцитов (красных клеток крови) и ретикулоцитов (клеток-предшественников эритроцитов) с увеличением их размера, уменьшение уровня гемоглобина (особого соединения внутри эритроцитов, переносящего кислород), снижение количества тромбоцитов (кровяных пластинок) с увеличением их размера. Цветной показатель (отношение уровня гемоглобина, умноженного на 3, к первым трем цифрам количества эритроцитов) изменяется в сторону увеличения: в норме этот показатель 0,86-1,05, при В12 -дефицитной анемии – выше, чем 1,05.
- Анализ мочи. Проводится для выявления сопутствующих заболеваний.
- Биохимический анализ крови. Определяется уровень холестерина (жироподобное вещество), глюкозы (простого углевода), креатинина (продукт распада белка), мочевой кислоты (продукт распада веществ из ядра клетки), электролитов (калий, натрий, кальций) для выявления сопутствующего поражения органов. Для В12-дефицитной анемии характерно повышение уровня билирубина (вещества, появляющегося в крови при распаде эритроцитов), лактат-дегидрогеназы (особого фермента (вещества, ускоряющего химические реакции) печени), железа (в связи с уменьшением его использования для образования новых эритроцитов).
- Содержание в крови витамина В12 (при данном заболевании оно снижается).
- Исследование костного мозга, полученного при помощи пункции (прокалывания с извлечением внутреннего содержимого) кости, чаще всего грудины (центральной кости передней поверхности грудной клетки, к которой крепятся ребра). В костном мозге при В12-дефицитной анемии определяются усиленное образование эритроцитов и мегалобластический тип кроветворения – то есть крупные эритроциты с остатками ядер (в норме у созревших эритроцитов ядер нет).
- Электрокардиография (ЭКГ). Определяется увеличение частоты сердечных сокращений, нарушение питания мышцы сердца, реже – нарушения ритма сердца.
- Возможна также консультация терапевта.
- Воздействие на причину В12 -дефицитной анемии – избавление от глистов (внедрившихся в организм плоских или круглых червей), удаление опухоли, нормализация питания.
- Восполнение дефицита витамина В12. Введение витамина В12 внутримышечно в дозе 200-500 мкг в сутки. При достижении стабильного улучшения следует вводить (в виде внутримышечных инъекций) поддерживающие дозы – 100-200 мкг 1 раз в месяц в течение нескольких лет. При повреждении нервной системы дозу витамина В12 повышают до 1000 мкг в сутки на 3 дня, затем действует обычная схема.
- Быстрое восполнение количества эритроцитов (красных клеток крови) – переливание эритроцитарной массы (эритроцитов, выделенных из донорской крови) по жизненным показаниям (то есть при угрозе для жизни пациента). Угрозой для жизни пациенту с В12-дефицитной анемией являются два состояния:
- анемическая кома (утрата сознания с отсутствием реакции на внешние раздражители вследствие недостаточного поступления кислорода к головному мозгу в результате значительного или быстро развившегося снижения количества эритроцитов);
- тяжелая степень анемии (уровень гемоглобина крови ниже 70 г/л, то есть граммов гемоглобина на 1 л крови).
Осложнения В12 -дефицитной анемии.
- Фуникулярный миелоз – поражение спинного мозга и периферических нервов (то есть нервов, соединяющих головной и спинной мозг со всеми органами), проявляющееся онемением и неприятными ощущениями в конечностях, мышечной слабостью, иногда – отсутствием чувствительности и движений в ногах, недержанием мочи и кала.
- Пернициозная (то есть злокачественная) кома – утрата сознания с отсутствием реакции на внешние раздражители вследствие недостаточного поступления кислорода к головному мозгу в результате значительного или быстро развившегося снижения количества эритроцитов.
- Ухудшение состояния внутренних органов, особенно при наличии хронических заболеваний (например, сердца, почек и др.).
Последствия В12-дефицитной анемии могут отсутствовать при своевременно начатом полноценном лечении.
При позднем начале лечения имеющиеся нарушения со стороны нервной системы становятся необратимыми.
источник
Данный вид анемии обусловлен нарушением формирования эритроцитов в красном костном мозге из-за недостаточности витамина В$12$ (цианокобаламин), необходимого для синтеза ДНК. В следствие нарушения синтеза ДНК нарушаются и процессы деления и дифференцировки клеток, в том числе клеток крови. В результате вместо формирования эритроцитов процесс дифференцировки останавливается на стадии мегалобластов – больших по размеру ($10-20$ мкм) клеток, содержащих остатки разрушенного ядра и избыток гемоглобина. Мегалобласты не способны переносить кислород, они разрушаются в костном мозге либо выходят в кровоток и при первом попадании в селезенку, погибают в ней.
В связи с тем, что синтез ДНК страдает не только в эритроцитах, снижается также уровень лейкоцитов и тромбоцитов, но в меньшей степени.
Развитие дефицита витамина В$12$ может происходить как на этапе поступления его в организм, так и на этапе использования.
- Недостаточное поступление кобаламина с пищей при вегетарианской диете или нерациональном питании может быть критическим в развитии анемии, так как организм человека не способен самостоятельно его синтезировать. Кроме того, кобаламин не поступает в достаточном количестве у лиц, страдающих хроническим алкоголизмом, так как этанол препятствует взаимодействию кобаламина с фактором Касла в желудке и, таким образом, предотвращает его всасывание.
- Нарушение всасывания кобаламина в кишечнике может быть вызвано несколькими причинами:
- Нарушением образования внутреннего фактора Касла в стенке желудка, который является необходимой субстанцией для всасывания кобаламина в кровь. Недостаток фактора Касла наблюдается при различных заболеваниях желудка: атрофический и аутоиммунный гастрит, рак желудка, резекция желудка, наконец врожденный дефицит.
- Нарушением непосредственно всасывания витамина через стенку тощей кишки в следствие ее поражения при энтеритах, опухолевых заболеваниях, после резекции.
- Паразитарными заболеваниями кишечника.
- Повышенное использование витамина при беременности, гипертиреозе, злокачественных опухолях.
- Нарушение обмена В$12$ в следствие таких наследственных патологий, как синдром Имерслунд-Гресбека, наследственный дефицит транскобаламина II и пр.
Попробуй обратиться за помощью к преподавателям
Как правило, развитие болезни происходит медленно, и первые симптомы могут быть неспецифичными, например, слабость, повышенная утомляемость.
Со временем проявляется картина кислородного голодания тканей, вызванного снижением количества эритроцитов в крови: бледность и желтушность (из-за разрушения гемоглобина мегалобластов в селезенке до билирубина) кожных покровов и слизистых оболочек, тахикардия, кардиалгии, одышка при физической нагрузке, головокружение и синкопальные состояния, «мушки» перед глазами.
Из-за накопления в селезенке мегалобластов происходит ее увеличение.
Так как нарушается синтез ДНК не только эритроцитов, то можно отметить изменения в слизистых оболочках органов – в тканях, где деление клеток и дифференцировка в норме происходит наиболее быстро. Так, возникают признаки мальдигестии: метеоризм, изжога, констипация или диарея, недостаточность микроэлементов, снижение массы тела. Атрофия слизистой оболочки языка приводит к тому, что он становится гладким и ярко-малиновым, а вкусовым ощущения притупляются. Часто сопутствуют инфекции ротовой полости, боль и жжение в полости рта.
Задай вопрос специалистам и получи
ответ уже через 15 минут!
Важнейшей функцией кобаламина является также участие в образование миелиновых оболочек. При нарушении формирования миелина возникают нарушения со стороны нервной системы. Они могут проявляться нарушением чувствительности в различных участках тела, атаксией, снижением мышечной силы, а позднее нарушениями процессов мочеиспускания и дефекации и даже психических процессов.
В общем анализе крови у больных В$12$-дефицитной анемией отмечается пойкилоцитоз, анизоцитоз, макроцитоз, гиперхромия, увеличение СОЭ и др. При этом уровень гемоглобина может сохраняться, что отличает данный вид анемии от железодефицитной, а количество ретикулоцитов снижается.
Биохимический анализ крови поможет выявить причину анемии. Снижение содержания кобаламина в крови говорит о проблемах с его поступлением в организм. Если при наличии клиники В12-дефицитной анемии, кобаламин в крови содержится в достаточном количестве стоит думать о нарушении его обмена.
В некоторых случаях выполняется пункция костного мозга для подтверждения диагноза.
Для поиска причины выполняются также ЭГДС с биопсией слизистой оболочки желудка и кишечника, анализ кала на яйца гельминтов, анализ крови на антитела к фактору Касла.
Терапия В12-дефицитной анемии основана на внутримышечном введении препаратов цианокобаламина в дозировке от $500$ до $1000$ мкг один раз в сутки в течение шести недель. Далее назначается поддерживающая доза $200 – 400$ мкг $2-4$ раза в месяц.
При тяжелых анемиях и анемической коме показано переливание крови.
Немаловажна в лечении анемии диета пациента, особенно при беременности или заболеваниях печени. Следует употреблять больше печени и мяса животных и птицы, морской рыбы.
Так и не нашли ответ
на свой вопрос?
Просто напиши с чем тебе
нужна помощь
источник
В12-дефицитная анемия — довольно опасное заболевание, которое связано с нарушением нормальных процессов кроветворения, возникающих на фоне дефицита кобаламина в организме.
Современной медицине известно достаточно много причин, которые провоцируют развитие патологического состояния, но все они сводятся к недостатку витамина Б12 в организме человека. Поэтому причины В12 дефицитной анемии должны рассматриваться именно вкупе с причинами недостатка витамина.
Главными причинами развития заболевания являются:
Недостаточное поступление витамина B12 с пищей. Организм человека не в состоянии самостоятельно синтезировать данный витамин, он поступает только с пищей. Растения не содержат витамин B12, его источником служат только мясо, рыба, кисломолочные продукты. Как правило, эти продукты входят в рацион питания каждого человека, но в случае развития хронического алкоголизма или голодания, развитие В12 дефицитной анемии практически неминуемо.
Нарушение всасывания витамина В12 в кишечнике. Факторами, приводящими к нарушенной работе кишечника, являются:
- гастрит аутоиммунный или атрофический;
- рак желудка;
- врожденный дефицит внутреннего фактора Касла;
- воспалительные заболевания тонкого кишечника (энтериты);
- опухоли кишечника;
- паразитарные инфекции.
Повышенное использование организмом витамина B12. Взрослому человеку, для нормальной деятельности организма, требуется в сутки 3-5 мкг витамина. Но при определенных условиях потребность организма в витамине B12 значительно повышается, а произойти это может при:
- беременности – в плоде стремительно протекают процессы роста и деления клеток, что и требует большего количества витамина В12;
- гипертиреозе – в кровоток поступает большое количество гормонов щитовидной железы, обменные процессы усиливаются и организм требует большего количества рассматриваемого витамина;
- злокачественные опухоли – витамин Б12 активно потребляется такими новообразованиями и остальным отделам организма ничего не достается.
Наследственные заболевания, которые сопровождаются нарушением обмена витамина В12. К этому фактору можно отнести достаточно большую группу патологий, но мы выделим только несколько из них:
- синдром Имерслунд-Гресбека;
- дефицит транскобаламина II;
- нарушение использования витамина В12 в клетках.
Часто B12 дефицитная анемия развивается у веганов, не употребляющих животную пищу. Дело в том, что в пище растительного происхождения данный витамин не содержится, поэтому веганам следует употреблять продукты, искусственно обогащенные B12, а также специальные витаминные комплексы.
Запасы витамина B12 в организме человека достаточно большие, поэтому клинических проявлений анемии может и не быть длительное время. Заболевание развивается очень медленно и на начальных стадиях характеризуется слабостью, повышенной утомляемостью и сонливостью – абсолютно неспецифическими симптомами.
К основным клиническим проявлениям B12 дефицитной анемии относятся:
- головокружениями и частыми обмороками;
- бледностью кожных покровов;
- желтушностью слизистых оболочек;
- непереносимостью физических нагрузок;
- болями в области сердца;
- учащенным сердцебиением;
- появлением «мушек» перед глазами ;
- увеличением селезенки.
В принципе, при появлении только одного из вышеперечисленных проявлений, человек должен обратиться за квалифицированной помощью, ведь совсем необязательно, что одновременно будет присутствовать комплекс симптомов нарушения образования клеток крови.
Именно этот симптом является самым ранним признаком B 12 дефицитной анемии, а проявляться он будет:
- нарушением пищеварения;
- снижением аппетита;
- болью и жжением в полости рта;
- нарушением вкуса;
- боль в эпигастральной области после приема пищи;
- часто возникающими инфекциями в ротовой полости.
Обычно симптомы проявляются только в случае запущенной формы В12 дефицитной анемии и представляют собой:
- нарушения чувствительности в пальцах рук и запястьях;
- парестезии – онемения, «покалывания» в определенных местах тела;
- снижения мышечных сил;
- проблемы с мочеиспусканием и дефекацией.
Обратите внимание: все симптомы рассматриваемого заболевания являются неспецифичными, то есть могут свидетельствовать и о развитии других заболеваний. Поэтому врачи всегда их рассматривают только в комплексе с другими диагностическими данными.
Только лишь жалобы пациента на имеющиеся симптомы, которые описаны выше, не являются поводом диагностировать заболевание. Процесс диагностики Б12 дефицитной анемии достаточно сложный, так как понадобится провести следующие мероприятия:
- исследовать кровь путем проведения общего клинического и биохимического анализа в лабораторных условиях;
- сделать пункцию костного мозга.
А еще больного с подозрением или уже установленной В12 дефицитной анемией обязательно полностью обследуют, так как понадобится выяснить причину патологии.
Лечение проводится только комплексно, потому что перед врачами стоит задача максимально быстро восстановить нормальное функционирование кроветворной, пищеварительной и нервной систем.
Суть этого типа терапии заключается в введении витамина В 12 извне. Показаниями к назначению такого лечения являются подтвержденный диагноз Б12 дефицитной анемии и выраженная клиническая картина заболевания.
Чаще всего препарат витамина В12 вводится внутримышечно, но допускается и прием его внутрь в виде таблеток в случае точного установления факта недостаточного поступления витамина B12 с пищей.
Лечение заболевания начинают с внутримышечного введения 500-1000 мкг витамина В12 один раз в сутки. Продолжительность медикаментозного лечения составляет не менее 6 недель, затем врачи переводят пациента на поддерживающую терапию – дозировка в этом случае будет составлять 200-400 мкг препарата 2-4 раза в месяц. В некоторых случаях такая поддерживающая терапия проводится на протяжении всей жизни больного.
В период медикаментозного лечения B12 дефицитной анемии пациенту обязательно должен проводиться контроль эффективности терапии – 2-3 раза в неделю производят забор крови для лабораторного исследования. Как правило, уже через 1 месяц происходит полная нормализация показателей периферической крови, ослабление неврологических проявлений, восстанавливается работа пищеварительной системы. Как только пациент переводится на поддерживающую терапию, забор крови для анализа осуществляется один раз в месяц.

- тяжелая анемия, когда у пациента уровень гемоглобина составляет менее 70 г/л;
- анемическая кома, проявляющаяся потерей сознания.
Так как переливание крови назначается только при подтвержденном диагнозе, то одновременно с этой процедурой назначают и внутримышечное введение препарата витамина Б12. Но переливание крови или эритроцитарной массы прекращают сразу же, как только устранено угрожающее жизни состояние.
Часто В12 дефицитная анемия лечится диетой, но такое возможно только при своевременной диагностике заболевания. В меню больного должны быть включены продукты, богатые витамином B12 и важные для лечения анемии:
- сок сливы;
- зеленые овощи, зелень, салаты и зерновые завтраки;
- мясо, сливки и масло;
- свекла, морковь, кукуруза, помидоры;
- субпродукты – говяжья и куриная печень, сердце;
- треска, карп, скумбрия;
- крольчатина.
Важно питаться полноценно и разнообразно. Вот примерное меню на день для больных с диагностированной В12 дефицитной анемией:
- 1 завтрак – салат из свежей капусты с добавлением яблок и сметаны, омлет, каша овсяная молочная с молоком;
- 2 завтрак – чай и 100 грамм сыра (максимальное количество);
- обед – борщ на мясном бульоне со сметаной, курица жареная с отварным рисом и компот;
- полдник – отвар шиповника;
- ужин – зразы мясные с луком и яйцом, морковное пюре, запеканка из гречневой крупы с творогом, некрепкий чай;
- на ночь – кефир.
Если рассматриваемое заболевание было диагностировано на ранней стадии своего развития, сразу же было назначено и проводится лечение, а нормализация показателей периферической крови произошла уже через месяц — полтора, то прогнозы будут исключительно благоприятными. Как только будет проведена основная терапия, состояние здоровья восстанавливается и пациент возвращается к привычному ритму жизни. Но если есть:
- позднее начало лечения;
- симптомы поражения центральной нервной системы;
- отсутствие эффекта от проводимого лечения;
- наследственная форма В12 дефицитной анемии.
То прогнозы будут неблагоприятными. Скорее всего, больной вынужден будет проходить лечение всю жизнь, нередко тяжелая форма В12 дефицитной анемии заканчивается комой и летальным исходом.
B12 дефицитная анемия – состояние, не опасное для жизни, но весьма коварное. Если человек обращает внимание на самые ранние признаки болезни, то врач сможет быстро и установить причину развития заболевания, и провести эффективное лечение.
Анемия. Виды анемий: железодефицитная, гемолитическая, В12 дефицитная, апластическая. Причины, диагностика, степени анемии.
Анемия или пониженное количество гемоглобина в крови, а в просторечии – «малокровие». Практически каждый человек хотя бы один раз сталкивался с такой формулировкой, особенно женщины. Что же означает этот пугающий термин? Почему возникает данное состояние организма? Чем опасна анемия? Как вовремя распознать её на начальных этапах?
Анемия – это патологическое состояние организма, при котором наблюдается снижение количества гемоглобина и эритроцитов ниже нижних границ нормы. Причем уменьшение содержания гемоглобина является обязательным признаком анемии, в отличие от снижения количества эритроцитов. То есть снижение концентрации гемоглобина при анемии есть всегда, а снижение количества эритроцитов может и не быть. Однако в некоторых случаях при анемии выявляются патологические формы эритроцитов (не двояко – вогнутые).
Анемия – это не самостоятельное заболевание, а следствие основной патологии, потому, выявление сниженного уровня эритроцитов и гемоглобина, требует проведения тщательной диагностики для выявления причины!
Гидремия – разжижение крови.
Такое состояние возможно при поступлении в кровоток тканевой жидкости при схождении отека, обильном питье. Гидремия – это псевдоанемия.
Сгущение крови
Сгущение крови может происходить вследствие потери жидкой части крови, что происходит при сильном обезвоживании. Обезвоживание наблюдается в результате сильной рвоты, поноса, обильного потения. Однако в этом случае за счет сгущения крови количество гемоглобина и эритроцитов может быть в пределах нормальных значений. В таких ситуациях говорят о наличии скрытой анемии.
Специфические и неспецифические признаки анемии – что относится к ним?
В первую очередь рассмотрим, как же проявляется анемия. Существуют неспецифические проявления и специфические. Неспецифические проявления называются так, потому что эти признаки общие для всех видов анемий. Специфические же проявления строго индивидуальны и характерны только для каждого конкретного вида анемии.Сейчас мы рассмотрим только неспецифические проявления, а специфические укажем при рассмотрении видов анемий.
Итак, к неспецифическим признакам анемий, относят следующие симптомы:
- бледность кожи и слизистых оболочек
- слабость
- головокружение
- шум в ушах
- головные боли
- быстрая утомляемость
- сонливость
- одышка
- анорексия (патологическая потеря аппетита или отвращение к пище)
- нарушение сна
- нарушения менструального цикла вплоть до полного прекращения менструаций (аменореи)
- импотенция
- тахикардия (увеличение частоты сердечных сокращений)
- шумы в сердце (усиление сердечного толчка, систолический шум на верхушке сердца)
- сердечная недостаточность
- при снижении количества гемоглобина менее 50 г/л возможно развитие ацидоза (закисление крови)
- снижение содержания гемоглобина ниже нормальных показателей
- снижение содержания эритроцитов ниже нормы
- изменение цветного показателя
- изменение содержания лейкоцитов и тромбоцитов
Виды анемий – постгеморрагическая, гемолитическая, дефицитная и гипопластическая
Анемии могут вызываться совершенно разными причинами, поэтому принято все анемии делить по различным признакам, в том числе по причинам, их вызывающим. Согласно причинам (патогенезу) выделяют три вида анемии: постгеморрагические, гемолитические и связанные с нарушением кровообразования (дефицитные и гипопластические). Что это значит? Разберем подробнее.
Постгеморрагические анемии связаны с острой или хронической кровопотерей (кровотечение, ранение).
Гемолитические – развиваются в связи с усиленным разрушением эритроцитов.
Дефицитные анемии вызваны недостатком витаминов, железа или других микроэлементов, которые необходимы для кроветворения.
Гипопластические анемии – это самый тяжелый вид анемий и связан он с нарушением кроветворения в костном мозгу.
- По степени тяжести. Существует три степени тяжести анемии – легкая, средняя и тяжелая в зависимости от содержания гемоглобина и эритроцитов в крови:
| Степень тяжести | Гемоглобин, г/л | Эритроциты, Т/л | ||||||||||||||||||||||
| Легкая | > 100 г/л | > 3 Т/л | ||||||||||||||||||||||
| Средняя | 100 – 66 г/л | 3 – 2 Т/л | ||||||||||||||||||||||
| Тяжелая | 1,05) и гипохромные (ЦП 8,0 микрон) и мегалобластные (СДЭ > 9,5 микрон). Нормоцитарные анемии характеризуются нормальным диаметром эритроцитов, микроцитарные – уменьшенным диаметром эритроцитов, а макроцитарные и мегалобластные связаны с увеличением диаметра эритроцитов. К нормоцитарным анемиям относят – острую постгеморрагическую и большинство гемолитических анемий; к микроцитарным – железодефицитную анемию, микросфероцитоз и хроническую постгеморрагическую анемию. Макроцитарные анемии – это гемолитическая болезнь новорожденных, фолиево дефицитная анемии. Мегалоцитарная – В12 дефицитнаяанемия.
Мы рассмотрели, на какие типы, и по каким признакам классифицируют анемии. Перейдем к рассмотрению, как проявляются отдельные виды анемий, какие изменения при этом наблюдаются в крови и в организме человека в целом.
Симптомы острой постгеморрагической анемии, картина крови Симптомами острой постгеморрагической анемии являются такие признаки: бледность, резкое головокружение, обмороки, частый пульс, холодный пот, снижение температуры тела, иногда рвота. Потеря крови более 30% от исходного уровня является критической и опасна для жизни. Диагностика постгеморрагической острой анемии В крови увеличивается количество ретикулоцитов более 11%, также появляются «незрелые» эритроциты и эритроциты с измененной формой клетки. Со стороны лейкоцитов наблюдается увеличение их общего количества выше 12 Г/л, а в лейкоцитарной формуле идет сдвиг влево. В последующие два месяца после острой кровопотери происходит восстановление показателей эритроцитов и гемоглобина. Однако восстановление количества эритроцитов и содержания гемоглобина связано с расходованием фонда железа в организме и может повлечь за собой развитие железодефицита. Поэтому в период восстановления после кровопотери необходимо соответствующее питание, то есть в рационе должны быть продукты с высоким содержанием железа (например, гранаты, гречка, печень и т.д.). Принципы лечения острой постгеморрагической анемии Лечение острой постгеморрагической анемии должно проводиться в условиях стационара и быть направлено на восстановление количества циркулирующей крови, количества форменных элементов крови и поддержание этих показателей. В первую очередь необходимо остановить кровотечение. Затем в зависимости от количества кровопотери применяют переливание крови, эритроцитарной массы и кровезаменителей. Симптомы хронической постгеморрагической анемии Симптомы хронической постгеморрагической анемии такие же, как при железодефицитной анемии. Какие же это симптомы? Итак, признаками хронической постгеморрагической анемии являются: кожа «алебастрового» оттенка (очень белая, бледная), извращение обоняния (непереносимость запахов или, наоборот, тяга к каким-либо запахам), изменение вкуса, одутловатость лица, пастозность голеней, ломкость волос и ногтей, сухость, шершавость кожи. Также возможно образование койлонехий – истонченных и уплощенных ногтей. Помимо этих внешних признаков возможно появление одышки, тошноты, головокружения, учащения пульса, слабости, утомляемости, субфебрильной температуры (до 37° С) и прочее. Из-за дефицита железа могут проявляться нарушения со стороны желудочно-кишечного тракта – кариес, глоссит, сниженная кислотность желудочного сока, а также непроизвольное мочеиспускание при смехе, потливость. Диагностика хронической постгеморрагической анемии В крови при хронической постгеморрагической анемии появляются слабо окрашенные эритроциты маленького размера, овальные эритроциты, снижено общее количество лейкоцитов, а в лейкоцитарной формуле наблюдается незначительный лимфоцитоз. В сыворотке крови концентрация железа ниже нормы – 9,0 мкмоль/л, также ниже нормального содержание меди, кальция, витаминов А, В, С, но, однако, повышена концентрация цинка, марганца и никеля в крови. Причины хронической постгеморрагической анемии Почему же возникает такое состояние – хроническая постгеморрагическая анемия? Причины этого явления следующие:
Лечение хронической постгеморрагической анемии Именно в силу причин, приводящих к развитию хронической постгеморрагической анемии, при лечении этого состояния, прежде всего, необходимо устранить причину хронической кровопотери.Затем необходимо сбалансированное питание, содержащее продукты с высоким содержанием железа, фолиевой кислоты и витаминов. В случае тяжелой анемии необходимо принимать препараты железа (сорбифер, феррум-лек) в виде таблеток или инъекций, препараты фолиевой кислоты, витамин В12 в виде таблеток или в виде инъекций. Наиболее эффективными препаратами для восстановления уровня железа в организме являются таблетированные препараты, которые выпускаются различными фирмами. В силу этого в аптеках представлен широкий выбор препаратов железа. При выборе препарата необходимо обращать внимание на содержание железа в одной таблетке и биологическую доступность данного препарата. Препараты железа необходимо принимать совместно с аскорбиновой кислотой и фолиевой кислотой, поскольку в такой комбинации происходит наилучшее усвоение железа. Однако при выборе препарата и дозы необходимо обязательно проконсультироваться с врачом. Гемолитические анемии – это группа анемий, при которых процессы разрушения эритроцитов преобладают над процессами их производства. Иными словами разрушение эритроцитов происходит быстрее, чем образуются новые клетки, взамен разрушенных. Гемолитические анемии могут быть наследственными и приобретенными. Наследственные гемолитические анемии это:
Симптомы гемолитических анемий Общим признаком всех гемолитических анемий является желтуха. Желтуха появляется вследствие того, что при разрушении эритроцитов выделяется в кровь большое количество билирубина, который и приводит к данному симптому. Помимо желтухи имеются следующие признаки, общие для всех гемолитических анемий – увеличение печени и селезенки, увеличение концентрации билирубина в крови, темный цвет мочи и кала, лихорадка, ознобы, боли, моча цвета «мясных помоев». В связи с тем, что наиболее широкое распространение среди наследственных гемолитических анемий имеют серповидно – клеточная анемия и талассемия, более подробно рассмотрим именно их.
Серповидно – клеточная анемия вызвана тем, что синтезируется молекула гемоглобина с дефектом. Такие дефектные молекулы гемоглобина собираются в веретенообразные кристаллы (тактоиды), которые растягивают эритроцит, придавая ему серповидную форму. Такие серповидные эритроциты мало пластичны, повышают вязкость крови и закупоривают мелкие кровеносные сосуды. Кроме этого своими острыми концами такие эритроциты протыкают друг друга и разрушаются. Симптомы серповидно–клеточной анемии Серповидно – клеточная анемия внешне проявляется следующими признаками:
Диагностика серповидно–клеточной анемии В анализе крови сниженное количество гемоглобина (50 – 80 г/л) и эритроцитов (1 – 2 Т/л), увеличение ретикулоцитов до 30% и более. В мазке крови видны серповидные эритроциты и эритроциты с тельцами Жолли и кольцами Кабо. Лечение серповидно-клеточной анемии Основной принцип лечения данного вида анемии –это недопущение гемолитических кризов. Данный эффект достигается тем, что человек избегает гипоксических состояний – присутствия в разреженном воздухе, в местах с низким содержанием кислорода и прочее. Используют переливание эритроцитарной массы или кровезаменителей.
Талассемия возникает вследствие нарушения скорости образования гемоглобина. Такой незрелый гемоглобин не стабилен, в результате чего он выпадает в эритроцитах в виде включений – телец, а весь эритроцит приобретает внешний вид мишеневидной клетки. Талассемия – это тяжелое наследственное заболевание, которое невозможно вылечить, а можно лишь облегчить ее проявления. Симптомы талассемии
Диагностика талассемии В крови обнаруживаются мишеневидные эритроциты, увеличенное количество ретикулоцитов, снижение концентрации гемоглобина до 20 г/л, а эритроцитов до 1 Т/л. Также наблюдаются уменьшение количества лейкоцитов и тромбоцитов. Итак, мы рассмотрели основные виды наследственных гемолитических анемий, которые передаются от родителей к детям. Перейдем к рассмотрению приобретенных гемолитических анемий, которые возникают вследствие наличия провоцирующего фактора. Приобретенные гемолитические анемии, иммунные и не иммунные анемии Прежде всего, необходимо отметить, что приобретенные гемолитические анемии могут развиваться при участии иммунной системы (иммунные) или без ее участия (не иммунные). К анемиям, развивающимся при участии иммунной системы, относятся вирусная, сифилитическая анемия и гемолитическая болезнь новорожденных. Не иммунные гемолитические анемии – это болезнь Маркиафавы – Микелли, а также анемии, возникшие вследствие длительной маршевой ходьбы, отравления алкоголем, кислотами, солями тяжелых металлов, ядами змей, насекомых и грибов. При ожогах, составляющих более 20% поверхности тела, недостатке витамина Е и малярии, также развивается не иммунная гемолитическая анемия.
Лечение этих видов анемии, как правило, не требуется. Гемолитическая болезнь новорожденного, причины развития, симптомы заболевания, степени тяжести.
В настоящее время проводится профилактика гемолитической болезни новорожденных путем отслеживания наличия антител у матери. Если у матери выявляются антитела, то лечение проводят в стационаре. При этом производят вливание антирезусных иммуноглобулинов. Признаки не иммунных гемолитических анемий, лабораторные симптомы Не иммунные гемолитические анемии имеют следующие признаки – желтуха,увеличенные печень и селезенка,повышенная концентрация билирубина в крови, темный цвет мочи и кала, лихорадка, ознобы, боли, моча цвета «мясных помоев».В картине крови отмечается наличие эритроцитов различной формы и размеров, ретикулоцитоз до 30% и выше, сниженное количество лейкоцитов и тромбоцитов. Такие анемии сами по себе не требуют отдельного и особенного лечения, так как в первую очередь необходимо убрать фактор, вызывающий эту анемию (яды змей, соли тяжелых металлов и т.д.). Анемии, вызванные нарушением кровообразования, делятся на две большие группы – дефицитные анемии и гипопластические. Дефицитные анемии связаны с дефицитом необходимых для кроветворения элементов. К дефицитным анемиям относят – железодефицитную анемию, железорефрактерную анемию, В12 – дефицитную и фолиево дефицитную. Гипопластические анемии вызваны гибелью клеток – предшественниц в костном мозгу. Гипопластические анемии могут быть наследственными (анемия Фанкони, анемия Эстрена – Дамешика, анемия Блекфэрна — Даймонда) и приобретенными. Приобретенные гипопластические анемии развиваются либо сами по себе вследствие неизвестной причины, либо на фоне имеющегося заболевания — лучевой болезни, инфекций, повреждений иммунитета. Для большинства людей больший интерес представляют дефицитные анемии, которые могут возникнуть практически у каждого человека. Поэтому наиболее подробно остановимся именно на этом виде анемий.
Причины железодефицитной анемии Железодефицитная анемия возникает в следующих случаях:
Симптомы железодефицитной анемии Клинически железодефицитная анемия проявляется тремя основными синдромами – гипоксическим, сидеропеническим и анемическим. Что это за синдромы? Чем характеризуется каждый из них?Синдром – это устойчивая совокупность симптомов. Итак, гипоксический синдром характеризуется одышкой, головными болями, шумом в ушах, быстрой утомляемостью, сонливостью и тахикардией; анемический синдром выражается в уменьшении содержания количества эритроцитов и гемоглобина. Сидеропенический синдром напрямую связан с уменьшением количества железа в организме и проявляется так: нарушение питания кожи, ногтей, волос – кожа «алебастрового» оттенка, сухость и шершавость кожи, ломкие волосы и ногти. Затем присоединяетсяизвращение вкуса и обоняния (желание есть мел, вдыхать запах мытых бетонных полов и т.д.). Возможно появление осложнений со стороны желудочно-кишечного тракта – кариеса, дисфагии, снижения кислотности желудочного сока, непроизвольного мочеиспускания (в тяжелых случаях), потливости. Диагностика железодефицитной анемии В крови наблюдается снижение содержания гемоглобина до 60 – 70 г/л, эритроцитов до 1,5 – 2 Т/л, также снижено количество или вовсе отсутствуют ретикулоциты. Появляются эритроциты различных форм и размеров. Концентрация сывороточного железа ниже нормы. Лечение железодефицитной анемии В основе лечения железодефицитной анемии лежат принципы устранения причины ее возникновения – лечение заболеваний желудочно – кишечного тракта, а также введение сбалансированного пищевого рациона. В диете должны присутствовать продукты с высоким содержанием железа (печень, мясо, молоко, сыр, яйца, злаки и т.д.). Однако главным средством восстановления количества железа в организме на начальном этапе являются лекарственные препараты железа. В большинстве случаев такие лекарства назначают в виде таблеток. В тяжелых случаях прибегают к внутримышечным или внутривенным инъекциям. В лечении данной анемии используют, например, такие препараты: сорбифер, феррум-лек, тардиферон, тотема и другие. Выбор различных лекарственных средств, в том числе комбинированных, очень широк. При выборе необходимо консультироваться с врачом. Обычно, суточная доза для профилактики и лечения анемии легкой степени составляет 50-60 мг железа, для лечения анемии средней тяжести – 100-120 мг железа в сутки. Лечение анемии тяжелой степени проводят в стационаре и применяют препараты железа в виде инъекций. Затем переходят на таблетированные формы. Препараты железа вызывают потемнение стула, однако в данной ситуации это нормально.Если препарат железа вызывает неприятные ощущения в желудке, то его необходимо заменить.
Железорефрактерную анемию также называют сидеробластной или сидероахристической. Железорефрактерная анемия развивается на фоне нормального содержания железа в сыворотке крови и недостатка ферментов, которые участвуют в синтезе гемоглобина. То есть основная причина железорефрактерной анемии – нарушение процессов «усвоения» железа. Симптомы железорефрактерной анемии, что такое гемосидероз? Проявляется железорефрактерная анемия одышкой, головными болями, головокружением, шумом в ушах, быстрой утомляемостью, сонливостью, нарушениями сна и тахикардией. Из-за высокого содержания железа в крови тканях наблюдается гемосидероз.Гемосидероз – это отложение железа в органах и тканях вследствие его избытка. При гемосидерозе развивается недостаточность сердечно – сосудистой системы вследствие отложения железа в сердечной мышце, сахарный диабет, поражение легких и увеличиваются размеры печени и селезенки. Кожа приобретает землянистый оттенок. Диагностика железорефрактерной анемии, что такое сидеробласты? Цветной показатель крови снижен до 0,6 – 0,4, присутствуют эритроциты различных форм и размеров, количество гемоглобина и эритроцитов ниже нормы. Имеются изменения и в костном мозгу – появляются клетки – сидеробласты. Сидеробласты – это клетки, имеющие вокруг ядра венчик из железа. В норме таких клеток в костном мозгу 2,0 – 4,6%, а при железорефрактерной анемии их количество может доходить до 70%. Лечение железорефрактерной анемии Лечения, которое смогло бы устранить ее совсем, на сегодняшний день нет. Возможно применение заместительной терапии – вливание эритроцитарной массы и кровезаменителей.
Во-первых, что такое В12? В12 – это витамин, который имеет также название цианкобаламин. Цианкобаламин содержится в основном в продуктах животного происхождения – мясо, печень, почки, молоко, яйца, сыр. Уровень витамина В12 необходимо постоянно поддерживать употреблением соответствующих продуктов, поскольку происходят его естественные физиологические потери с калом и желчью. Причины В12 дефицитной анемии Итак, В12 – дефицитная анемия – это анемия, возникающая вследствие недостаточности витамина В12. Недостаток витамина В12 может быть вызван недостаточным его поступлением с пищей или нарушением его усвоения в желудочно-кишечном тракте. Недостаточное поступление цианкобаламина с пищей возможно у строгих вегетарианцев. Также недостаток В12 может проявиться при повышении потребности в нем у беременных женщин, кормящих матерей, раковых больных. Неусвоение витамина В12, поступающего с пищей в достаточном количестве, происходит при заболеваниях желудка, тонкого кишечника (дивертикулы, глисты) и лечении противосудорожными средствами или оральными контрацептивами. Симптомы В12 дефицитной анемии Симптомы проявления В12 – дефицитной анемии характеризуются нарушениями в центральной нервной системе и желудочно-кишечном тракте. Итак, рассмотрим эти две большие группы симптомов:
Диагностика В12 дефицитной анемии В системе крови происходит переход на мегалобластический тип кроветворения. Это означает, что в крови появляются гигантские эритроциты с укороченным сроком жизни, ярко окрашенные эритроциты без просветления в центре, грушевидные и овальные эритроциты с тельцами Жолли и кольцами Кабо. Также появляются гигантские нейтрофилы, уменьшается количество эозинофилов (вплоть до полного отсутствия), базофилов и общего количества лейкоцитов. В крови повышена концентрация билирубина, в связи с чем, может наблюдаться легкая желтушность кожи и склер глаз. Лечение В12 дефицитной анемии В первую очередь необходимо вылечить заболевания желудочно-кишечного тракта и наладить сбалансированное питание, с достаточным содержанием витамина В12. Применение курса инъекций витамина В12 быстро нормализует кроветворение в костном мозгу, а далее необходимо постоянное, регулярное поступление с пищей достаточного количества витамина В12.
Симптомы фолиеводефицитной анемии При фолиево дефицитной анемии страдает желудочно-кишечный тракт, поэтому и проявления данной анемии связаны с нарушениями работы желудочно-кишечного тракта. Наблюдается появление повышенной чувствительности к кислой пище, глоссита, трудностей глотания, атрофии слизистой желудка, увеличения размеров печени и селезенки. Лечение фолиеводефицитной анемии Для лечения данного вида анемии применяют таблетки фолиевой кислоты и нормализуют рацион питания, в котором должны быть продукты, содержащие достаточное количество фолиевой кислоты.
Симптомы гипопластических анемий Гипопластические анемии могут быть наследственными или приобретенными, однако все подвиды данного типа анемий характеризуются одинаковыми проявлениями. Рассмотрим эти симптомы:
Причины, вызывающие развитие гипопластической анемии Какие же причины способны вызывать подобное поражение костного мозга? Наследственные анемии, соответственно, передаются по наследству, а вот приобретенные? Все факторы, способные приводить к развитию гипопластической анемии, делятся на экзогенные (внешние) и эндогенные (внутренние). В таблице приведены основные экзогенные и эндогенные причины, способные вызвать развитие гипопластической анемии.
Принципы лечения гипопластических анемий Лечение гипопластических анемий находится строго в компетенции врача – гематолога. Могут применяться различные методы стимулирования кроветворения, или пересадка костного мозга. Итак, мы рассмотрели все основные виды анемий. Конечно, их гораздо больше, однако мы не можем объять необъятное. При появлении каких-либо признаков анемии необходимо своевременно обратиться к врачу. И регулярно сдавать анализ крови на содержание гемоглобина. источник |






 Постгеморрагические анемии могут быть острыми и хроническими. Острая постгеморрагическая анемия развивается в ответ на скоротечную и большую кровопотерю, а хроническая – развивается в ответ на длительную кровопотерю в небольших количествах.
Постгеморрагические анемии могут быть острыми и хроническими. Острая постгеморрагическая анемия развивается в ответ на скоротечную и большую кровопотерю, а хроническая – развивается в ответ на длительную кровопотерю в небольших количествах.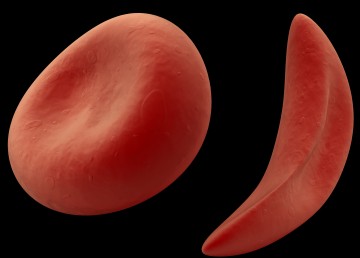 Причины серповидно–клеточной анемии
Причины серповидно–клеточной анемии Талассемия – причины заболевания
Талассемия – причины заболевания Сифилитическая и вирусная иммунные гемолитические анемии проявляются одинаково. Эти виды анемии являются вторичными, то есть возникают на фоне уже имеющегося заболевания – сифилиса или вирусной инфекции.У этих людей наблюдается лихорадка, ознобы, боли в спине, слабость, одышка, кровь в моче, увеличение печени и селезенки. В крови увеличивается концентрация билирубина и количество ретикулоцитов, а вот содержание гемоглобина может быть в норме или немного снижено, появляются эритроциты круглой формы.
Сифилитическая и вирусная иммунные гемолитические анемии проявляются одинаково. Эти виды анемии являются вторичными, то есть возникают на фоне уже имеющегося заболевания – сифилиса или вирусной инфекции.У этих людей наблюдается лихорадка, ознобы, боли в спине, слабость, одышка, кровь в моче, увеличение печени и селезенки. В крови увеличивается концентрация билирубина и количество ретикулоцитов, а вот содержание гемоглобина может быть в норме или немного снижено, появляются эритроциты круглой формы. Гемолитическая болезнь новорожденных – это заболевание, которое возникает в результате конфликта эритроцитов матери и ребенка, которые имеют несовместимые антигены группы крови или резус – фактора. В таком случае антитела матери проникают к плоду через плаценту и вызывают разрушение эритроцитов у ребенка. Тяжесть гемолитической болезни новорожденных зависит от количества антител матери, которые проникают через плаценту к плоду. Поэтому беременные женщины с отрицательным резус – фактором крови регулярно сдают анализ крови на наличие именно таких антител. Если антитела обнаруживаются, значит необходимо соответствующее лечение. Ребенок с гемолитической болезнью новорожденных рождается с отеками, асцитом, имеет высокий тон крика и высокое содержание незрелых эритроцитов (эритробластов, нормоцитов и ретикулоцитов). Гемолитическая болезнь новорожденных классифицируется по степени тяжести на легкую, среднюю и тяжелую согласно количеству гемоглобина и билирубина в крови.
Гемолитическая болезнь новорожденных – это заболевание, которое возникает в результате конфликта эритроцитов матери и ребенка, которые имеют несовместимые антигены группы крови или резус – фактора. В таком случае антитела матери проникают к плоду через плаценту и вызывают разрушение эритроцитов у ребенка. Тяжесть гемолитической болезни новорожденных зависит от количества антител матери, которые проникают через плаценту к плоду. Поэтому беременные женщины с отрицательным резус – фактором крови регулярно сдают анализ крови на наличие именно таких антител. Если антитела обнаруживаются, значит необходимо соответствующее лечение. Ребенок с гемолитической болезнью новорожденных рождается с отеками, асцитом, имеет высокий тон крика и высокое содержание незрелых эритроцитов (эритробластов, нормоцитов и ретикулоцитов). Гемолитическая болезнь новорожденных классифицируется по степени тяжести на легкую, среднюю и тяжелую согласно количеству гемоглобина и билирубина в крови.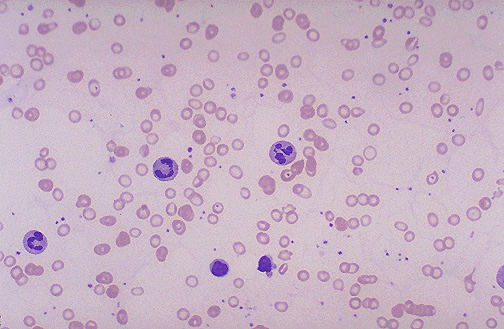 Содержание железа в организме человека – 4 – 5 г или 0,000065% от массы тела. Из них 58% железа входит в состав гемоглобина. Железо может депонироваться (откладываться в запас) в печени, селезенке и костном мозгу. В то же самое время происходят физиологические потери железа с калом, мочой, потом, с менструацией и во время кормления грудью, поэтому необходимо включать в рацион питания железосодержащие продукты.
Содержание железа в организме человека – 4 – 5 г или 0,000065% от массы тела. Из них 58% железа входит в состав гемоглобина. Железо может депонироваться (откладываться в запас) в печени, селезенке и костном мозгу. В то же самое время происходят физиологические потери железа с калом, мочой, потом, с менструацией и во время кормления грудью, поэтому необходимо включать в рацион питания железосодержащие продукты. Причина железорефрактерной анемии
Причина железорефрактерной анемии Что такое В12? Где содержится этот витамин?
Что такое В12? Где содержится этот витамин? Витамин В9 –фолиевая кислота. В организм поступает с пищей – печень говяжья и куриная, салат, шпинат, спаржа, томаты, дрожжи, молоко, мясо. Витамин В9 способен накапливаться в печени. Таким образом, В9 – дефицитная анемия возникает вследствие недостатка фолиевой кислоты в организме человека. Недостаток фолиевой кислоты возможен при вскармливании детей козьим молоком, при длительной термической обработке пищи, у вегетарианцев, при недостаточном или несбалансированном питании. Также дефицит фолиевой кислоты наблюдается при повышенной потребности в ней у беременных, кормящих, недоношенных детей, подростков, раковых больных. К Вс – дефицитной анемии приводит наличие таких заболеваний как хроническая почечная недостаточность, заболевания печени. Возникновение дефицита фолиевой кислоты возможно и при нарушении всасывания данного витамина, что происходит при алкоголизме, приеме оральных контрацептивов и недостатке В12.
Витамин В9 –фолиевая кислота. В организм поступает с пищей – печень говяжья и куриная, салат, шпинат, спаржа, томаты, дрожжи, молоко, мясо. Витамин В9 способен накапливаться в печени. Таким образом, В9 – дефицитная анемия возникает вследствие недостатка фолиевой кислоты в организме человека. Недостаток фолиевой кислоты возможен при вскармливании детей козьим молоком, при длительной термической обработке пищи, у вегетарианцев, при недостаточном или несбалансированном питании. Также дефицит фолиевой кислоты наблюдается при повышенной потребности в ней у беременных, кормящих, недоношенных детей, подростков, раковых больных. К Вс – дефицитной анемии приводит наличие таких заболеваний как хроническая почечная недостаточность, заболевания печени. Возникновение дефицита фолиевой кислоты возможно и при нарушении всасывания данного витамина, что происходит при алкоголизме, приеме оральных контрацептивов и недостатке В12. Гипопластические анемии характеризуются уменьшением содержания в крови всех клеток (панцитопенией). Панцитопения связана с гибелью клеток – предшественниц в костном мозгу.
Гипопластические анемии характеризуются уменьшением содержания в крови всех клеток (панцитопенией). Панцитопения связана с гибелью клеток – предшественниц в костном мозгу.