Анемия или малокровие — состояние, характеризующееся уменьшением гемоглобина, числа эритроцитов в единице объема крови, что приводит к снижению доставки кислорода к тканям. Различают: заболевания, связанные с нарушением гемоглобинообразования или продукции эритроцитов, и заболевания, обусловленные повышенным разрушением эритроцитов.
Анемии могут быть отдельными заболеваниями или проявлениями какого-либо другого заболевания. Организм испытывает кислородное голодание, характеризующееся следующими симптомами анемии: слабость, головокружение, могут быть обмороки, шум или звон в ушах, мелькание точек в глазах (кислородное голодание мозга); учащенное сердцебиение (сердце вынуждено быстрее «гонять» кровь, чтобы компенсировать нехватку кислорода);
одышка (учащенное дыхание — тоже попытка компенсации кислородного голодания); бледность кожи (особенно хорошо заметна, если оттянуть нижнее веко или посмотреть на кончики пальцев — «бледные ногти»).
При биохимическом исследовании крови важными показателями для врача и пациента являются:
- анализ железа в сыворотке крови
- железосвязывающая способность сыворотки крови (ЖСС)
- трансферрин
- анализ на ферритин.
Совокупность показателей этих анализов наиболее полно отражает при диагностике анемии ее наличие или отсутствие, характер анемии.
| Наименование услуги | Стоимость |
|---|---|
| Жидкостная цитология | 2 180 руб. |
| Соскоб на грибы (демодекс) | 560 руб. |
| Анализ мочи общий | 550 руб. |
| Анализ мочи (2-х стаканная проба) | 910 руб. |
| Анализ кала общий (копрограмма) | 430 руб. |
| Смотреть весь прайс-лист | |
Трансферрин — белок в плазме крови, основной переносчик железа.
Насыщение трансферрина происходит благодаря его синтезу в печени и зависит от содержания железа в организме. С помощью анализа трансферрина можно оценить функциональное состояние печени.
Норма трансферрина в сыворотке крови — 2,0–4,0 г/л. Содержание трансферрина у женщин на 10% выше, уровень трансферрина увеличивается при беременности и снижается у пожилых людей.
Повышенный трансферрин — симптом дефицита железа (предшествует развитию железодефицитной анемии в течение нескольких дней или месяцев). Повышение трансферрина происходит вследствие приема эстрогенов и оральных контрацептивов.
Пониженный трансферрин в сыворотке крови — повод для врача поставить следующий диагноз:
- хронические воспалительные процессы
- гемохроматоз
- цирроз печени
- ожоги
- злокачественные опухоли
- избыток железа.
Повышение трансферрина в крови происходит также в результате приема андрогенов и глюкокортикоидов.
Железосвязываюшая способность сыворотки крови (ЖСС) — показатель, характеризующий способность сыворотки крови к связыванию железа.
Железо в организме человека находится в комплексе с белком — трансферрином. ЖСС показывает концентрацию трансферрина в сыворотке крови. Железосвязывающая способность сыворотки крови изменяется при нарушении обмена, распада и транспорта железа в организме.
Для диагностики анемии используют определение латентной железосвязывающей способности сыворотки крови (ЛЖСС) — это ЖСС без сывороточного железа. Норма латентной ЖСС — 20–62 мкмоль/л.
Повышение уровня ЛЖСС происходит при дефиците железа, железодефицитной анемии, остром гепатите, на поздних сроках беременности.
Понижение ЛЖСС происходит при уменьшении количества белков в плазме (при нефрозе, голодании, опухолях), при хронических инфекциях, циррозе, гемахроматозе, талассемии.
источник
Анализ крови на ферритин — когда назначают, подготовка и проведения, показатели нормы у детей и взрослых
Нетоксичная и биологически полезная форма железа в организме человека содержится в ферритине. Это особый белок, который присутствует во всех клетках организма, особенно в селезенке, печени, головном мозге. Входит он и в состав крови. Железо очень важно для организма, поскольку отвечает за транспорт кислорода, поддерживает иммунитет, регулирует процессы кроветворения. Ферритин выполняет функцию депонирования (запаса) этого микроэлемента.
Молекула ферритина состоит из кристаллического ядра (фосфата и гидроксида железа) и белковой полой оболочки (апоферритина). Синтез его осуществляется клетками печени, почек, костного мозга, селезенки, тонкого кишечника. На 1/5 ферритин состоит из железа – оно находится в нем в физиологически доступном, нетоксичном, водорастворимом виде. Количество этого микроэлемента может достигать 3000 атомов. По происхождению ферритин делят на два вида:
- тканевый – попадает в кровь при разрушении клеток тканей, содержащих этот белок;
- плазменный – проникает в кровь при разрушении клеток плазмы.
Поскольку ферритин является депо железа на случай непредвиденных обстоятельств, анализ на этот белок точно показывает объем запасов данного микроэлемента. Точное количество определяют по сыворотке крови. По этой причине ферритин называется сывороточным. Результаты анализа показывают его объем в микрограммах (мкг) или нанограммах (нг) на 1 л крови. Такое исследование важно, поскольку ферритин выполняет в организме важные функции:
- Является белком острой фазы, которая необходима для обеспечения неспецифической защиты организма до развития иммунной реакции. Это состояние сопровождается лихорадкой (жаром и ознобом), снижающей резистентность патогенных микроорганизмов к действию внешних факторов.
- Используется для синтеза ферментов – белков, ускоряющих химические реакции.
- Способствует превращению токсичной двухвалентной формы железа в безвредную нетоксичную.
- Контролирует присоединение атомов железа к трансферрину и его транспорт от матери к плоду.
Основная цель проведения анализа – диагностика избытка или недостатка железа в организме. Такой лабораторный тест, по сравнению с другими методами оценки запасов феррума, позволяет выявить недостаток этого микроэлемента при разных заболеваниях. Затем патологию можно дифференцировать. Анализ на ферритин отличает абсолютный дефицит (при хронической кровопотере) от относительного, который связан с нарушением перехода феррума в депо. Исходя из этого, такой анализ имеет следующие показания:
- подозрению на анемию;
- контроль лечения злокачественных опухолей;
- дифференциальная диагностика истинной железодефицитной анемии от анемий, сопровождающих инфекции, опухолевые процессы, ревматизм;
- наблюдение за анемией у лиц с риском ее развития – детей, доноров крови, беременных;
- выявление латентного (скрытого) дефицита железа до момента, как появится симптоматика снижение уровня гемоглобина;
- оценка эффективности лечения железосодержащими препаратами;
- обнаружение воспалительных процессов и некрозов в организме.
На понижение или повышение уровня ферритина указывают определенные симптомы, при которых врач тоже может назначить анализ на этот белок. К таким признакам относятся:
- снижение иммунитета;
- выпадение волос;
- тошнота, рвота, изжога;
- бледность кожных покровов;
- ломкость и отслаивание ногтей;
- учащенное сердцебиение;
- повышенная утомляемость;
- отечность и болезненность суставов;
- хронические кровотечения (носовые, кровоточивость десен);
- серо-коричневый оттенок кожи и слизистых оболочек;
- болезненность мышц без физической нагрузки;
- раздражительность.
Чтобы анализ крови на ферритин дал достоверные результаты, необходимо правильно к нему подготовиться. На концентрацию железа влияют многие факторы. Общие требования по подготовке к исследованию:
- не есть на протяжении 12 ч. до проведения теста, не употреблять кофе и крепкий чай;
- исключить эмоциональные и физические перегрузки за полчаса до анализа;
- за неделю до процедуры исключить железосодержащие препараты;
- уведомить врача о принимаемых лекарствах;
- за день до анализа отказаться от алкоголя, курения.
С утра перед забором крови на голодный желудок допускается употребление только негазированной чистой воды. Кроме железосодержащих препаратов, на уровень железа влияют и некоторые другие лекарства. Об их приеме нужно обязательно уведомить лечащего врача. К таким препаратам относятся:
- антибиотики – Цефотаксим, Хлорамфеникол;
- оральные контрацептивы;
- противоопухолевые – Метотрексат, Аспарагиназа;
- нестероидные противовоспалительные средства – Ацетилсалициловая кислота (Аспирин);
- глюкокортикоидные гормоны – Кортизол;
- лекарства на основе тестостерона;
- гиполипидемические средства – Холестирамин, Метформин;
- лекарства, снижающие концентрацию мочевой кислоты – Аллопуринол.
Анализ проводится в утренние часы натощак. Кровь для исследования берут только из вены. Пациенту нужно прийти в поликлинику на 8–10 ч. утра. Венозная кровь забирается из локтевой вены при помощи одноразового шприца. Предварительно врач дезинфицирует место прокола медицинским спиртом. Затем шприцем берут кровь – весь процесс длится около 1,5 мин. Боль и дискомфорт во время процедуры минимальны. Для анализа врачу требуется сыворотка крови, поэтому взятый материал переливают в пробирку, которая ни разу не использовалась.
Показатели нормы этого белка отличаются в зависимости от пола и возраста. Более низкий уровень характерен для женщин, поскольку у них от природы меньше эритроцитов, железа и ниже гемоглобин. У ребенка первых дней жизни, наоборот, повышенный ферритин. Это объясняется тем, что у них высокий гемоглобин и больше эритроцитов. Такие условия необходимы ребенку для приспособления к новым условиям в осуществлении всех физиологических процессов, включая кроветворение, без помощи материнского организма.
В дальнейшем эритроциты у ребенка начинают распадаться, а гемоглобин заменяется красным пигментом взрослых. Так система кроветворения перестраивается для работы в автономном режиме. На фоне этого показатели крови постепенно снижаются. Норма ферритина в крови у женщин, мужчин и детей:
источник
Здоровье человека – это достаточно хрупкая вещь, которая зависит от различных факторов. Поддерживать хорошее самочувствие и крепкое здоровье важно всегда, и не только витаминами или правильным питанием. Очень важно время от времени следить за показателями крови, которые могут максимально достоверно отобразить здоровье организма и его состояние. Иногда человек может и не догадываться о наличии патологических процессов, которые у него прогрессирует, однако лабораторное исследование крови поможет выявить заболевания на ранней стадии развития.
Показатель ферритина выступает маркером запасов железа в организме человека. Диагностическое направление обследования уровня ферритина необходимо для определения функционального состояния организма. Для того, чтобы понять, какая взаимосвязь существует между ферритином и сывороточным железом, стоит для начала определиться с понятием ферритина и его основными функциями.
Что же из себя представляет ферритин? Это особый белок, который является наиболее распространенной формой депонирования железа. Проще говоря является так называемым «складом» железа. Каждая из молекул этого специального белка содержит в себе от одной до трех тысяч атомов железа. Наибольшее содержание ферритина отмечается в печени, селезенке, костном мозге, эритроцитах, а также в сыворотке крови. Если уровень железа находится в нормальном соотношении, тогда можно наблюдать своеобразное равновесие в содержании ферритина в плазме и депо.
Стоит заметить, что в период протекания острого воспалительного процесса возможно значительное повышение уровня сывороточного ферритина, однако это никак не связано с уровнем железа и не отображает количество металла в организме.
Однако в том случае, когда у человека существует переизбыток железа или хроническое заболевание, ферритин в сыворотке не способен достоверно показать запасы железа, доступного для обмена. Само по себе железо имеет свойство накапливаться в макрофагах в виде этого особого белка ферритина. Если перенос его от ферритина к трансферрину каким либо образом нарушается, это приводит к тому, что уровень сывороточного железа начинает активно понижаться. В таком случае возможно ошибочное постановление диагноза железодефицитного состояния.
Если уровень гемоглобина в норме, а ферритин низкий, тогда это может свидетельствовать о том, что существует латентная стадия развития малокровия (анемии). И если не заняться устранение подобного состояния, вполне возможно развитие заболевания. Но бывает и другая ситуация — низкий ферритин при нормальном гемоглобине. Некоторые пациенты имеют неправильное представление и считают, что при нормальном гемоглобине не бывает железодефицитного состояния.
Однако дефицит железа обязательно присутствует, если сывороточное железо и ферритин низкий. Однако уровень гемоглобина падает в последнюю очередь, когда профилактические меры уже не будут иметь никакого эффекта. Низкий ферритин при нормальном гемоглобине – это состояние, при котором возможна наиболее быстрая коррекция малокровия. А вот пониженный ферритин при пониженном гемоглобине – это уже явно выраженное железодефицитное состояние, которое обязательно требует помощи специалиста.
Также можно наблюдать и другую ситуацию, когда в крови пониженный ферритин при нормальном гемоглобине. Почему так происходит? Низкий уровень ферритина и нормальный гемоглобин бывает у людей, которым свойственна привычка сидеть на «жестких» диетах. А еще ситуация, когда ферритин понижен, а гемоглобин в норме встречается у людей с пристрастием к вредным привычкам. Если в случае с низким ферритином при пониженном гемоглобине обязательно требуется прием лекарств, то в этом случае достаточно будет внести корректировки в образ жизни.
Низкий уровень ферритина при нормальном гемоглобине встречается довольно часто в период беременности. Пациенткам назначаются препараты железа и дозировку устанавливает только лечащий врач. Многие задаются вопросом: «Гемоглобин и ферритин – одно и то же?». Конечно же, нет. Белок ферритин отвечает за депонированное железо, в то время как гемоглобин отвечает за кислородное обогащение тканей.
Ферритин — это «пристанище» для резервного железа. Небольшая часть этого белка находится в плазме крови, а его концентрация и содержание достоверно отображает количественные запасы железа. Каково основное назначение трансферрина? Это транспортный белок, основная задача которого транспортировка железа, которое усвоилось в кишечнике, в депо (селезенку, печень). Железо с свободном состоянии представляет угрозу для человека, оно токсично и ядовито без переносчика, который может его обезвредить. Трансферрин связывается с железом только на некоторое время — транспорт железа из печени ко всем тканям организма.
Иногда можно услышать такой вопрос «Ферритин и железо: в чем разница?». Ответить на это можно довольно просто: железо – это минеральное вещество, а ферритин – специальный белок. По сути ферритин можно спутать с железом, однако выполняет он совершенно другую функцию.
источник
Однако, для точной диагностики причины развития анемии необходимо провести ряд уточняющих анализов. Подтвердить возможную причину развития анемии позволяют пять лабораторных анализов крови:
- Сывороточное железо
- Общая железосвязывающая способность сыворотки
- Сывороточный ферритин
- Витамин B12 (Цианокобаламин)
- Витамин B9 (Фолиевая кислота)
Дефицит железа – самая распространенная причина развития анемии. По данным ВОЗ (Всемирной организации здравоохранения) анемией страдает примерно 25% населения во всем мире, при этом около 50% случаев анемии вызвано именно дефицитом железа. В развитых странах железодефицитная анемия обнаруживается у 2-5% взрослого населения. Среди беременных анемия встречается чаще.
Анализ крови на содержание железа, общей железосвязывающей способности сыворотки и ферритина дает возможность установить диагноз железодефицитной анемии. Определение уровня фолиевой кислоты (фолата) и цианокобаламина в крови, а также уровень фолата в эритроцитах позволяет установить диагноз «мегабластная анемия», которая возникает при дефиците витаминов B9 и B12. Причиной отклонения от нормы упомянутых выше показателей является не только анемия, но и другие состояния (рассмотрены ниже).
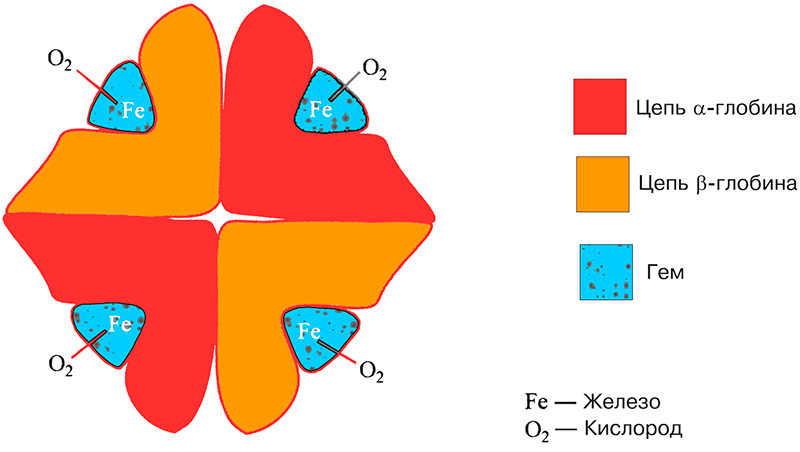
Способность гемоглобина, содержащегося в эритроцитах, транспортировать кислород зависит от содержания железа в молекуле гема (см рисунок 1), где кислород вступает в слабую взаимосвязь с атомом железа. Для образования и функционирования гемоглобина необходимо железо. Отметим, что железо также содержится в миоглобине (мышечном белке) и некоторых ферментах.
Рисунок 1. Молекула гемоглобина
В организме взрослого человека содержится около 5 г железа, из которого примерно 70% находится в эритроцитах циркулирующей крови (см рисунок 2). Большая часть остального количества содержащегося в организме железа депонируется в тканях (в основном в костном мозге, печени и селезенке). В этих «депо» железо входит в состав белка ферритина и гемосидерина.
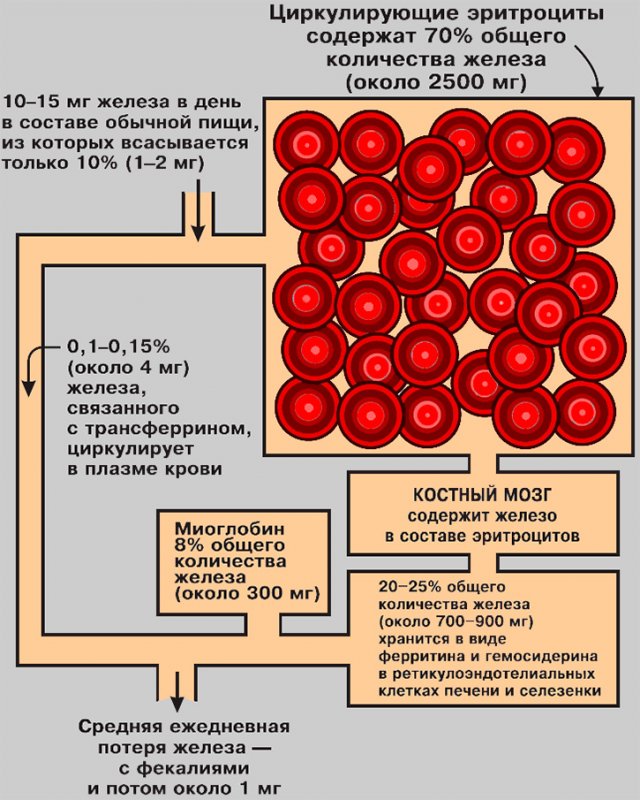
Рисунок 2. Распределение железа в организме: суточное поступление и потери
Определенная часть ферритина находится в крови. Именно концентрация ферритина в крови является точным индикатором состояния запасов железа в организме. Содержание железа в циркулирующей крови составляет примерно 3-4 мг (0,1% от общего содержания железа в организме); это железо связано с трансферрином (транспортным белком). Анализ на содержание железа в крови основан на определении именно трансферриносвязанной фракции.
Организм человека хорошо сохраняет железо. Эритроциты жизнеспособны примерно 100-120 дней, после их гибели (эритропоэза) высвобождается железо, которое возвращается в резерв костного мозга, чтобы участвовать в образовании новых эритроцитов. Железо имеет связь с белком – это не позволяет ему проникать через почечный фильтр, поэтому выделение его с мочой очень ограничено. Единственная значительная потеря железа происходит с эпителиальными клетками, которые постоянно слущиваются с поверхности кожи (таким образом организм теряет до 1 мг железа в сутки). В эритроцитах содержится основная часть железа, поэтому кровотечение представляет потенциальную опасность истощения его запасов. Так, при нормальном менструальном кровотечении организм ежемесячно теряет примерно 15 мг железа, поэтому здоровая женщина в период месячных теряет в среднем 1,5-2 мг железа в сутки.
Для компенсации потерь и для поддержания необходимых запасов железа в организме, дети, мужчины и женщины (в межменструальный период) должны получать минимум 1 мг железа с пищей, а женщины в период менструации – не менее 2 мг железа в сутки. Сбалансированное питание позволяет обеспечить поступление в среднем 10-15 мг железа в день. Среди продуктов питания основными источниками железа являются мясо, рыба, свежие фрукты и овощи, зелень, крупы. Усвоению железа способствует витамин C. В норме организм усваивает из пищи примерно 10% железа – это количество компенсирует суточные потери. Усвоение железа происходит в верхней части тонкой кишки. Важно отметить, что избыток железа опасен для организма не меньше, чем его дефицит. Поскольку в организме отсутствуют механизмы, регулирующие потери железа, контроль за его запасами зависит в основном от механизмов его усвоения. Так, усвоение железа с пищей регулируется потребностями организма в конкретный промежуток времени. Неусвоенное в кишечнике железо выводится с фекалиями.
К витаминам относится группа жизненно важных органических компонентов, имеющих разное химическое строение, которые необходимы организму в очень малых количествах. Организм человека не способен самостоятельно синтезировать витамины, поэтому единственным их источником является пища. Основная часть витаминов группы B, в том числе витамин B9 (фолиевая кислота, или фолат) и B12 (цианокобаламин) выполняют функцию коферментов в ферментативных реакциях клеточного метаболизма.
Фолиевая кислота и цианокобаламин обеспечивают функцию ключевых ферментов в процессе синтеза ДНК (ДНК необходимо для деления клеток). Особенно зависят от полноценного синтеза ДНК и, следовательно, от витаминов B9 и B12 ткани, в которых происходит постоянное деление клеток и быстрое клеточное обновление. Одна из этих тканей – костный мозг. В костном мозге непрерывно на протяжение всей жизни организма происходит продукция клеток, и для обеспечения этой функции требуется адекватное поступление витаминов B9 и B12. Фолиевая кислота и цианокобаламин участвуют в разных ферментативных реакциях, но для нормального процесса кроветворения они необходимы в первую очередь, что определяет их клиническое значение.
Витамины B9 и B12 синтезируются бактериями, а в организм человека они попадают с животной и растительной пищей, содержащей эти бактерии. Основной источник цианокобаламина – мясные продукты (особенно много витамина B12 содержится в печени животных), рыба и молочные продукты. Растительная пища (овощи, фрукты, зелень), как правило, не содержит этот витамин. Основным источником фолиевой кислоты является печень животных, зелень. Многие крупы содержат фолиевую кислоту и цианокобаламин. Минимальная суточная потребность взрослого человека в фолиевой кислоте составляет 150 мкг, в цианокобаламине – 1-2 мг. При условии соблюдения рекомендаций по здоровому питанию, дневной рацион позволяет покрыть необходимую суточную потребность организма в этих витаминах.
Для успешного высвобождения витамина B12 из поступающей пищи и дальнейшего его усвоения в кишечнике огромное значение имеет кислая среда желудка. То есть, чтобы цианокобаламин успешно усвоился в тонкой кишке, он должен вступить в связь с белком, синтезируемом в эпителиальных клетках желудка – внутренним фактором (см рисунок 3). После усвоения в кишечнике транскобаламин (транспортный белок) переносит с кровотоком витамин B12 в разные ткани (в том числе и костный мозг).
Рисунок 3. Усвоение витамина B12
Витамин B12 способен накапливаться в достаточных количествах в печени, что позволяет организму компенсировать его дефицит при отсутствии цианокобаламина в пище на протяжение длительного периода времени (в течение нескольких лет).
Процесс усвоения фолиевой кислоты в организме человека проходит гораздо проще, по сравнению с цианокобаламином. Фолат усваивается в верхних отделах тонкой кишки и с током крови транспортируется в свободной форме или в связи с альбумином к тканям организма (включая костный мозг).
Как и цианокобаламин, фолиевая кислота способна накапливаться в организме (в основном в печени). Но запасов витамина B9 организму хватает всего лишь на несколько месяцев (в случае отсутствия этого компонента в пище).
Итак, рассмотрев кратко физиологию процесса кроветворения, можно сделать вывод, что образование клеток крови зависит от следующих факторов:
- Адекватного поступления в организм с пищей витаминов B9 и B12
- Нормального синтеза желудком соляной кислоты и внутреннего фактора, необходимых для полноценного усвоения витамина B12 в кишечнике
- Функционирования желудочно-кишечного тракта, то есть от нормального усвоения в подвздошной кишке
- Продукции транскобаламина (транспортного белка)
Рассматриваемые анализы, за редким исключением, назначают пациентам, у которых была обнаружена анемия на общем анализе крови (см статью «Анализ крови: Эритроциты, Гемоглобин, Индексы эритроцитов» ). Основываясь на показателе среднего объема эритроцитов можно определить, какой из нижеперечисленных анализов лучше всего назначать. То есть, сниженный объем эритроцитов указывает на вероятность того, что у пациента железодефицитная анемия – в этом случае необходимо исследовать уровень железа и ферритина в крови; если средний объем эритроцитов увеличен, необходимо назначить анализ крови на уровень витаминов B9 и B12.
Уровень железа в плазме (сыворотке) крови – определение концентрации железа в плазме (не включает определение содержания железа в эритроцитах и ферритине).
Общая железосвязывающая способность – определение уровня трансферрина в крови (трансферрин – белок, который связывает железо в плазме крови).
Сывороточный ферритин – определение уровня ферритина в крови (ферритин – белок, в составе которого железо находится в тканях организма). Уровень ферритина в крови является индикатором запаса железа в организме.
Витамин B12 и фолиевая кислота в крови – определение уровня цианокобаламина и фолиевой кислоты в крови. Низкий показатель указывает на дефицит этих витаминов.
Фолат эритроцитов – определение концентрации фолиевой кислоты в эритроцитах. Низкий показатель указывает на дефицит витамина B9.
Для проведения этих анализов пациент не нуждается в какой-либо специальной подготовке.
Забор крови для проведения анализа можно проводить в любое время. Рекомендуется брать кровь в удобное для транспортировки в лабораторию время.
Для проведения анализа на содержание железа в крови, железосвязывающей способности и определения уровня ферритина необходимо 5 мл венозной крови. Для исследования как правило используют сыворотку (при этом кровь собирают в обыкновенную пробирку без антикоагулянта).
Для проведения анализа на содержание фолата в эритроцитах кровь собирают в пробирку с антикоагулянтом (ЭДТА).
Для проведения анализа на содержание фолиевой кислоты и цианокобаламина необходимо 5 мл венозной крови, которую собирают в обычную пробирку (без каких-либо добавок).
Железо: 10-30 мкмоль/л
Общая железосвязывающая способность: 40-75 мкмоль/л
Ферритин: 10-300 мкмоль/л
Витамин B12: 150-1000 нг/л
Фолиевая кислота: 150-700 мкмоль/л
Лаборатории используют разные методики исследования, поэтому референсные значения могут быть другими (их предоставляет лаборатория, проводившая анализ). Также при интерпретации результатов анализа необходимо учитывать половые различия пациентов.
Отклонения от нормы уровня железа в крови, общей железосвязывающей способности и ферритина связаны со следующими состояниями:
- Железодефицитная анемия
- Инфекционные заболевания (АХЗ – анемия при хронических заболеваниях) и хронические воспаления (болезнь Крона и др)
- Избыток железа
Железодефицитная анемия часто носит многофакторный характер, то есть, у пациента может быть сразу несколько причин развития этого состояния. Наиболее вероятными причинами развития железодефицитной анемии являются:
- Недостаток железа в пище
- Повышенные потери железа организмом
- Нарушения процесса усвоения железа в кишечнике
- Повышенная потребность организма в железе
Недостаток железа в пище среди населения, проживающего в экономически развитых странах – редкая причина развития анемии (конечно, бывают случаи, когда дефицит железа оказывает влияние). Тем не менее, в депрессивных регионах плохое питание – основная причина дефицита железа в организме. Патологии желудочно-кишечного тракта (например, дизентерия, тропическое спру и др) нарушают процесс усвоения железа, однако это довольно редкие причины дефицита этого элемента.
Самая распространенная причина развития железодефицитной анемии у взрослого населения развитых стран – хроническая кровопотеря. Так как основной пул железа (примерно 70%) содержится в эритроцитах, кровопотери способны вызвать дефицит железа. Отметим, что организм накапливает железо в тканях, поэтому единичные случаи кровотечения (даже тяжелой кровопотери) не вызовет дефицит железа. Но хроническая кровопотеря (регулярная и/или продолижительная потеря небольших объемов крови) в течение долгого периода времени, постепенно истощает запасы железа. Частая причина развития дефицита железа среди женщин детородного возраста – меноррагия (очень обильные менструации).
Хронические кровопотери часто связаны с распространенными, но тяжелыми патологиями желудочно-кишечного тракта (язва желудка или двенадцатиперстной кишки, язвенный колит, рак и др). В этом случае кровотечения могут оставаться незамеченными на протяжение многих месяцев и даже лет, поскольку кровь незаметно выводится с фекальными массами. Причиной возникновения кровотечения может быть прием некоторых лекарственных препаратов, вызывающих раздражение слизистой оболочки желудка (например, аспирин и другие нестероидные противовоспалительные средства). Поэтому риск развития железодефицитной анемии повышается при длительной терапии аспирином. Исследования показали, что самой частой причиной развития железодефицитной анемии в взрослых мужчин и женщин в период постменопаузы являются кровотечения в желудочно-кишечном тракте.
При некоторых патологиях пищеварительной системы происходят нарушения процесса усвоения железа в кишечнике, что также способствует развитию железодефицитной анемии. Прежде всего – это целиакия (мультифакториальная патология, характеризующаяся нарушением процесса пищеварения, при котором нарушается чувствительность к некоторым белкам). Исследования показывают, что распространенность целиакии среди населения гораздо выше, чем предполагалось ранее (сегодня целиакия считается относительно распространенной причиной дефицита железа). Хронические воспалительные заболевания кишечника (язвенный колит, болезнь Крона) также характеризуются нарушением усвоения железа и последующим развитием его дефицита. Такие же последствия возникают после гастрэктомии (хирургического удаления желудка).
У здоровых людей желудок колонизирован бактериями Helicobacter pylori. При определенных факторах эти микробы могут стать причиной развития гастрита, язвы или железодефицитной анемии. Механизм развития этой патологии полностью не изучен, но ученые предполагают, что он связан с нарушением усвоения железа. В этом случае терапия антибактериальными препаратами, целью которой является эрадикация Helicobacter pylori, эффективная и в отношении железодефицитной анемии.
Беременность сопровождается рядом физиологических изменений, в том числе повышенной продукцией эритроцитов. При адаптации к таким изменениям потребность организма в железе увеличивается в 2-3 раза. Если запасы железа при этом не восполняются, возникает дефицит этого элемента. Развитие железодефицитной анемии наблюдается у многих женщин на поздних сроках беременности. У детей в период интенсивного роста повышается потребность в железе, что также может быть причиной развития железодефицитной анемии, особенно при плохом питании.
Любые случаи железодефицитной анемии требуют обязательного поиска причины ее возникновения. Это состояние может быть симптомом серьезных патологий пищеварительной системы или гинекологических заболеваний. Многие последние рекомендации для пациентов с железодефицитной анемией неясного генеза в независимости от степени тяжести указывают на необходимость проведения диагностики на предмет обнаружения целиакии (для этого назначают анализ крови на антитела к тканевой трансглутаминазе (IgA-tTG). Также необходимо провести анализ мочи на предмет обнаружения гематурии (одного из симптомов рака мочевого пузыря). Кроме этого, все взрослые мужчины и женщины старше 50 лет (период постменопаузы) должны пройти обследование желудочно-кишечного тракта (эндоскопия, ренгенография с барием и др).
Помимо основных признаков анемии, описанных в статье «Анализ крови: Эритроциты, Гемоглобин, Индексы эритроцитов» , у больных железодефицитной анемией могут возникать некоторые специфические симптомы:
- Глоссит (воспаление языка)
- Ангулярный стоматит (заеды)
- Изменения ногтей (изменение формы: вогнутые или гребневидные; ломкость и т.д.)
Уровень ферритина в крови – точный показатель состояния запасов железа в организме. Снижение концентрации ферритина происходит в период прогрессивного истощения запасов железа, до момента возникновения первых симптомов анемии. Когда запасы железа в организме полностью истощаются, возникают признаки его дефицита (при этом уровень ферритина в крови очень низкий или он вообще не определяется). Уровень железа в крови часто снижен, однако может оставаться на нижней границе нормы. Железосвязывающая способность крови всегда высокая.
При железодефицитной анемии типичным результатом анализа крови является:
- Уровень железа: 5-10 мкмоль/л (может быть на нижней границе нормы)
- Железосвязывающая способность сыворотки: выше 75 мкмоль/л (всегда повышена)
- Ферритин:«Анализ крови: Эритроциты, Гемоглобин, Индексы эритроцитов»
- Желтуха (незначительная)
- Заеды (ангулярный стоматит)
- Воспаление зыка (глоссит)
При значительном дефиците фолиевой кислоты и цианокобаламина у пациентов может возникать нейропатия. При этом развиваются следующие неврологические симптомы:
- Повышенная раздражительность
- Неспособность сосредоточиться
- Нарушения памяти
- Парестезии (аномальная чувствительность, например, покалывание, жжения или «мурашки» в руках и ногах)
- Расстройства моторики, например, атаксия (проявляется затруднениями при ходьбе)
- Нарушения психики (редко)
Отметим, что при дефиците цианокобаламина неврологические симптомы могут возникать даже при отсутствии других признаков анемии.
При пернициозной анемии, как и в других случаях мегалобластной анемии, а также при нейропатии (вызванной дефицитом витамина B12) уровень цианокобаламина в крови как правило низкий. Бывают случаи, когда уровень витамина B12 в крови находится на нижней границе нормы, что приводит к трудностям в постановке диагноза. Уровень фолиевой кислоты в крови при этом в основном остается в пределах нормы (может быть незначительно повышен). Отметим, что при дефиците цианокобаламина концентрация фолиевой кислоты в эритроцитах остается в пределах нормы или понижается.
Если мегалобластная анемия вызвана дефицитом фолиевой кислоты, уровень цианокобаламина в крови остается в пределах нормы (при этом концентрация фолиевой кислоты в эритроцитах и крови снижена). Отметим, что содержание фолиевой кислоты в эритроцитах является более надежным маркером, поскольку при некоторых патологиях (например, тяжелые заболевания почек или печени) уровень фолиевой кислоты в крови может быть низким несмотря на достаточное количество этого витамина в организме.
источник
Автор: Андреев Г. И., магистр техники и технологии, выпускник (2003 г.) СПбГПУ, факультет медицинской физики и биоинженерии, кафедра физико-химических основ медицины.
Железодефицитной анемией (ЖДА) и скрытыми формами дефицита железа страдает 50-80% населения России. Определение концентрации ферритина в сыворотке крови позволяет эффективно дифференцировать ЖДА от других типов анемий. Кроме того, высокие концентрации ферритина характерны для воспалительных и инфекционных процессов, некоторых онкологических заболеваний.
В статье описаны структура и функции ферритина, его роль в метаболизме железа, характерные для разных состояний изменения его концентрации в крови, дан сравнительный анализ характеристик ИФА-наборов зарубежных производителей и первой российской тест-системы.
Ионы железа выполняют в организме человека очень важную функцию. Они входят в состав белков, осуществляющих перенос кислорода, цитохромов и железосеропротеинов, железосодержащих ферментов. Поэтому недостаток железа в организме приводит ко многим негативным последствиям. Одним из них является развитие железодефицитной анемии (ЖДА). Согласно данным ВОЗ, от скрытого дефицита железа и ЖДА страдает около одной трети населения планеты. В некоторых регионах России этот показатель достигает 70-80%. Проявления данного заболевания разнообразны и иногда приводят к тяжелым последствиям.
Избыточное содержание железа в организме также опасно. Оно приводит к развитию токсикозов, патологическому повышению уровня активных форм кислорода.
Вследствие этого важно иметь интегральный показатель оценки содержания железа в организме. Высокоинформативным маркером, характеризующим метаболизм железа, является ферритин.
Для определения содержания ферритина в сыворотке крови используются иммунометрические методы. В связи с поливалентностью данного антигена можно создать специфические и высокочувствительные системы определения его концентрации. В России в настоящее время определение ферритина в лабораторной практике распространено очень слабо. Это объясняется недостаточной информированностью населения и медицинского персонала о диагностической значимости данного показателя, а также сравнительно высокой стоимостью проведения анализа при помощи наборов реагентов зарубежных производителей. Первая в нашей стране иммуноферментная система для определения концентрации ферритина в сыворотке крови человека, основанная на применении моноклональных антител, разработана в аналитической лаборатории компании «Алкор Био» . Для успешного применения в лабораторной практике создаваемый продукт должен удовлетворять всем требованиям к его качеству, не уступать по аналитическим характеристикам зарубежным аналогам, а также обладать стоимостью, обеспечивающей возможность проведения регулярных скрининговых обследований.
Ферритин — растворимый в воде комплекс гидроксифосфата железа с белком апоферритином. Наибольшее его количество находится в клетках печени, селезенки, костного мозга и ретикулоцитах, где наиболее интенсивно проходят процессы синтеза, созревания и деградации эритроцитов и ферритин активно участвует в метаболизме и перераспределении железа в организме.
У позвоночных защита от токсического эффекта железа и активных форм кислорода осуществляется двумя железосвязывающими белками: внеклеточными трансферринами и внутриклеточными ферритинами. Оба сохраняют железо в безопасной окисленной форме Fe(III), которая не катализирует продукцию свободных радикалов. Ферритин содержит 15-20% общего количества железа в организме.
Концентрация ферритина в сыворотке крови позволяет оценить общие запасы железа в организме [1]. У здоровых людей содержание ферритина в плазме крови составляет 20-350 нг/мл. Падение концентрации ниже 10 нг/мл свидетельствует о развитии железодефицитной анемии, в то время как при избыточном накоплении железа концентрация ферритина может возрастать до нескольких тысяч нг/мл.
Железодефицитная анемия является самым распространенным анемическим синдромом и составляет приблизительно 80% заболеваемости всеми видами анемий. Ее распространенность определяется физиологическими, патологическими, экологическими и социальными факторами. Предполагают, что в мире страдает железодефицитной анемией около 1,8 миллиарда человек (ВОЗ, 1998). Согласно данным ВОЗ (1992), дефицит железа определяется как минимум у 20-25 % всех младенцев, у 43 % детей в возрасте до 4 лет и 37 % детей от 5 до 12 лет. Даже в развитых странах эти цифры не ниже 12 % у детей до 4 лет и 7 % детей в возрасте от 5 до 12 лет [2].
Из-за физиологических ежемесячных кровопотерь и вынашивания детей более чем у 51 % женщин детородного возраста во всем мире обнаруживается нехватка железа вплоть до отсутствия его запасов. Дефицит железа в III триместре беременности обнаруживается почти у 90% женщин и сохраняется после родов и лактации у 55% из них [2].
В России частота железодефицитной анемии приближается к показателю стран третьего мира. В некоторых регионах России (Север, Восточная Сибирь, Северный Кавказ) скрытый дефицит железа выявляется у 70-80% жителей. Это связано и с неблагоприятной экологической обстановкой, и с нерациональным питанием, вызванным снижением уровня жизни.
Негативные проявления данного заболевания разнообразны и тяжело переносимы. Это синдром хронической усталости, внезапная потеря сознания, нарушения менструального цикла, дизурические расстройства, извращение вкусовых ощущений, нарушения психики. ЖДА является отягощающим фактором при заболеваниях сердечно-сосудистой и пищеварительной систем. У детей анемии часто являются причиной замедления умственного и физического развития, снижения успеваемости. Взрослые страдают от мышечной слабости, длительной ремиссии после перенесенных инфекций, что приводит к экономическим потерям. Кажущаяся странность, несерьезность симптомов (сонливость, быстрая утомляемость) заставляют людей долгое время не обращаться к врачу с четкими жалобами, а приспосабливаться к болезни. Патология же прогрессирует и в итоге может привести к серьезным, порой необратимым нарушениям функций организма. Так, анемии являются частой причиной внутриутробной смерти плода, низкого веса новорожденных, они обуславливают до 20% материнских смертей [3].
В настоящее время общепринято, что диагноз железодефицитных состояний надо ставить до развития полной картины заболевания, т.е. до возникновения гипохромной анемии. При дефиците железа страдает весь организм, а гипохромная анемия — это поздняя стадия болезни.
В 1983 г. П. М. Альперин и Ю. Г. Митерев предложили новую классификацию форм железодефицитной анемии, которая в полной мере отражает все основные этиологические факторы, приводящие ее к развитию. Они выделяют:
- постгеморрагические анемии;
- нутритивные (алиментарные) анемии;
- анемии при повышенном расходе железа в организме (например, при беременности, лактации, росте и созревании);
- железодефицитные анемии при исходно недостаточном уровне железа;
- железодефицитные анемии при его недостаточной резорбции (например, постгастрорезекционные, агастральные, анэнтеральные);
- при перераспределении железа в результате инфекции, при воспалительных и опухолевых процессах;
- при нарушении транспорта железа (например, гипотрансферринемические и атрансферринемические).
Регулярное определение ферритина используется для отслеживания быстрого истощения запасов железа во время беременности, у доноров крови и у пациентов, регулярно подвергающихся гемодиализу. Оно также имеет ценность для диагностики гемохроматозов, при мониторинге пациентов, которые регулярно подвергаются переливанию крови или железозаместительной терапии и составляют группу риска по аккумулированию избыточных запасов железа. Концентрация ферритина может повышаться при некоторых острых и хронических заболеваниях печени, при голодании и истощении, наличии воспалительных процессов, инфаркте миокарда. Можно использовать определение ферритина для диагностики и мониторинга онкологических заболеваний.
Показатели обмена железа в норме и при различных видах анемий (Авцын А. П., 1990).
| Показатели метаболизма железа | Норма | Железодефицитная анемия | Инфекционная, опухолевая анемия | Нарушение синтеза гема и глобина |
| Железо сыворотки, мкг/дл: | ||||
| — мужчины | 50-160 | 180 | ||
| — женщины | 40-150 | 170 | ||
| ОЖСС, мкг/дл | 250-400 | >400 | 180 | 200 |
| Коэффициент насыщения трансферрина, % | 15-54 | 60 | ||
| Ферритин, нг/мл | 20-350 | 350 | 360-1000 |
К современным методам ранней диагностики железодефицитных состояний (гипосидероза) относятся определение концентрации железа в сыворотке, общей железосвязывающей способности сыворотки (ОЖСС), трансферрина и ферритина в сыворотке. Показатели метаболизма железа при различных видах анемий представлены в Таблице 1.
Избыточное содержание железа в организме называют сидерозом или гиперсидерозом. В 1971 г. Dagg e. a. предложили клиническую классификацию гиперсидерозов. Различают следующие формы гиперсидероза:
- паренхиматозные формы (с преимущественным отложением железа в клетках паренхимы печени). К ним относятся: первичный наследственный гемохроматоз, сидероз при некоторых видах цирроза печени, вторичный сидероз при портокавальном анастомозе, сидероз при врожденной атрансферринемии;
- «ретикулоэндотелиальные» формы, к которым относятся: генерализованные отложения железа при хронических рефрактерных (к специфическому лечению) анемиях, гемолитических анемиях, многократных гемотрансфузиях, при избыточном парентеральном введении железа, сидерозе банту;
- локальные формы: идиопатический гемосидероз легких, легочно-почечный синдром Гудпасчера и гемосидероз почечного происхождения при ночной пароксизмальной гемоглобинурии.
При этих патологических состояниях концентрация ферритина в плазме крови повышена вследствие нарушения баланса обмена железа.
В то время как истощение запасов железа в организме является единственной причиной снижения уровня сывороточного ферритина, повышение уровня ферритина наблюдается не только при избытке запасов железа, но также в некоторых других ситуациях.
Определение ферритина можно использовать для диагностики и мониторинга ряда онкологических заболеваний. Ценность определения ферритина как онкомаркера подтверждают многие исследования [4] , [5].
Высокие концентрации ферритина обнаруживаются в сыворотке пациентов с карциномой поджелудочной железы, раком легких, гепатомой и нейробластомой, острым миелобластным и лимфобластным лейкозами, лимфогранулематозом (болезни Ходжкина). Концентрация сывороточного ферритина обычно повышена при метастазирующем раке молочной железы. При онкологических заболеваниях концентрация ферритина в крови повышена как вследствие его активной секреции, так и за счет повышенного распада клеток и высвобождения цитоплазматического ферритина, например, при химиотерапии. После успешного лечения концентрация ферритина в сыворотке крови снижается.
Концентрация ферритина может также повышаться при некоторых острых и хронических заболеваниях печени (например, алкогольное поражение, гепатит), при голодании и истощении, воспалительных заболеваниях (легочные инфекции, остеомиелит, хронические инфекции мочевых путей, ревматоидный артрит, системная красная волчанка, ожоговая болезнь), инфаркте миокарда [5, [6]. В этих случаях основной причиной увеличения содержания ферритина в крови является некроз клеток и высвобождение внутриклеточной фракции.
Определение ферритина в клинической практике позволяет улучшить диагностику нарушений метаболизма железа. Несомненными достоинствами метода являются также малая инвазивность и простота выполнения. Однако правильная интерпретация результатов требует ясного понимания как процессов метаболизма железа, так и учета других влияющих на уровень сывороточного ферритина факторов, например поражения печени или воспалительных процессов.
В настоящее время многие зарубежные производители предлагают наборы реагентов для иммуноферментного определения содержания ферритина в сыворотке, однако они очень мало распространены в России вследствие высокой стоимости и недостаточной информированности как медиков, так и населения о диагностической значимости данного показателя. Таким образом, необходимость разработки отечественной тест-системы для определения концентрации ферритина в крови человека очевидна.
Молекула ферритина образована Н- и L- типами субъединиц (Н — heavy и L — light), У человека аминокислотные последовательности Н и L идентичны на 54%. Полипептидная цепь Н-типа человека состоит из 183 аминокислотных остатков, ее молекулярная масса 21 кДа. Молекулярная масса L-субъединицы, состоящей из 175 аминокислот, около 19 кДа.
Каждая молекула апоферритина собрана из 24 структурно равнозначных субъединиц, вносящих одинаковый вклад в формирование четвертичной структуры. В 24-мерах смешанного состава (гетрополимерах) Н- и L- субъединицы имеют одинаковую конформацию, предоставляя возможность формирования гетерополимеров с любой из возможных композицией субъединиц.
Субъединицы организованы таким образом, чтобы образовать полую, симметричную глобулу с наружным и внутренним диаметрами 125 и 80 ангстрем соответственно [7] , [8] (Рисунок 1).
Рисунок 1. Четвертичная структура молекулы ферритина.
Ближайшие к зрителю субъединицы изображены толстыми лентами, внутри глобулы в центре видно железосодержащее ядро.
Молекулы ферритина могут образовывать суперолигомеры — димеры и тетрамеры [9].
Субъединицы плотно упакованы, за исключением того, что в местах контакта трех субъединиц есть узкие каналы диаметром около 1 нм, пронизывающие глобулу. Эти каналы, проходящие вдоль осей третичной симметрии, являются главным входным путем для железа и сайтами окисления Fe(II) [10].
Все молекулы ферритинов имеют полость для хранения железа. Полагают, что главным фактором, определяющим формирование ядра, является распределение зарядов на внутренней поверхности.
Ферритины, изолированные из тканей млекопитающих, состоят из смеси изоферритинов с широким спектром состава субъединиц и содержания железа [11] , [12]. Возможны 25 изоферритинов с соотношением субъединиц: Н24L, H23L1, H22L2… HL24, но в основном спектр распределения субъединиц в изоферритинах заключен в пределах H22L2— Н2L22. Обычно ферритины с преобладанием L-субъединиц характерны для органов, запасающих железо (печень и селезенка), и эти ферритины обычно имеют относительно высокий средний уровень содержания железа (более 1500 атомов Fe на молекулу). Богатые Н-субъединицами ферритины, характерные для сердца и мозга, имеют низкое содержание железа (менее 1000 атомов Fe на молекулу).
Вследствие различий по составу субъединиц молекулярная масса изоферритинов колеблется от 440 кДа у легких фракций изоферритинов селезенки до 500 кДа у тяжелых мышечных ферритинов. Общая молекулярная масса ферритина может удваиваться за счет включения кластера железа и достигать 900 кДа [13]. Однако ферритины обычно не полностью насыщены железом и обладают молекулярной массой, промежуточной между апоферритином и полностью заполненным холоферритином.
Субъединицы ферритинов содержат небольшое число углеводородов. Состав и количество сахаров сильно варьируют в зависимости от тканевой принадлежности, и составляет 2,4% массы апоферритинов печени и селезенки и около 5% у сердечных изоформ [14].
Ферритин выполняет в организме двойственную функцию. Он запасает в клетках растворимое железо, которое при необходимости может быть легко задействовано для синтеза различных веществ. В то же время ферритин защищает организм от токсического действия ионов металлов. Помимо железа ферритин способен связывать и другие ионы, некоторые из которых токсичны (алюминий, бериллий).
Известно, что связывание железа трансферрином и ферритином требует предварительного изменения степени окисления металла от +2 до +3, а его высвобождение из этих молекул сопровождается обратным процессом восстановления. Важнейшую роль в этих процессах играют также низкомолекулярные хелатирующие соединения. Они являются необходимым промежуточным звеном в переносе железа от транспортных и депонирующих белков к местам утилизации железа.
Первое прямое свидетельство присутствия ферритина в сыворотке крови получили Reissman и Dietrich в 1956 г [15]. Первоначально ферритин был найден в сыворотке пациентов с некрозом печени и перегрузкой железом, однако после развития чувствительного иммунорадиометрического анализа его удалось обнаружить и в нормальной сыворотке [16].
Внеклеточные ферритины, найденные в сыворотке и биологических жидкостях, составляют меньшую часть от общего ферритина. Плазматический ферритин имеет низкое содержание железа (0,02-0,07 мкг Fe на мкг белка в сравнении с более 0,7 мкг Fe на мкг белка в печени и селезенке).
Источник и механизм продукции плазматического ферритина до сих пор во многом неясен. Часть циркулирующего ферритина выделяется из разрушающихся тканей, например при циррозе печени, инфаркте миокарда. Однако наличие в молекуле специфически гликозилированных субъединиц и тонкая регуляция количества ферритина в крови в соответствии с уровнем железа в норме и при различных патологических процессах показывает, что главным источником плазматического ферритина является его активная секреция. В частности, секреция выполняется фагоцитами, осуществляющими деградацию гемоглобина. При этом ферритин выполняет функцию транспорта железа от клеток ретикулоэндотелиальной системы к гепатоцитам, синтезирующим гемоглобин de novo.
Места синтеза ферритина, подлежащего секреции, и тканевого ферритина также различны. Показано, что секреторный белок синтезируется на полирибосомах, связанных с мембранами эндоплазматического ретикулума, где осуществляется дальнейший процессинг молекулы, включая гликозилирование. Синтез ферритинов, секреция которых не предусмотрена, протекает на свободных цитоплазматических рибосомах [17].
Предположение, что секретируемые ферритины функционально активны, основано на идентификации специфических рецепторов на различных клеточных мембранах. Такие рецепторы были описаны на клетках печени, лимфоцитах и эритробластах человека. До настоящего времени неясно, сколько типов рецепторов существует, но главное очевидное различие найдено между ними на клетках печени и других типах клеток. Рецепторы печени обладают специфичностью с учетом соотношения Н- и L-субъединиц, в то время как лимфоцитарные рецепторы специфичны к Н-цепи.
Хотя многие тканевые изоферритины могут высвобождаться в плазму, обнаружены четкие различия в динамике циркуляции тканевого и плазматического ферритинов. Так, скорость удаления из плазмы тканевых ферритинов очень высока (период полувыведения Т1/2составляет примерно 9 мин), в то время как количество инъецированного меченого плазматического ферритина уменьшалось на 50% лишь спустя 30 часов. В норме в плазме способны накапливаться изоформы L24и гликозилированные молекулы, богатые L-субъединицами, но содержащие мало железа [18].
Значительное увеличение содержания характерных для опухолевых клеток фракций ферритинов с повышенным количеством Н-субъединиц может быть следствием нескольких причин:
- интенсивного некроза опухолевой ткани из-за недостаточности трофики быстро растущей опухоли;
- эффективной противораковой терапии, приводящей к прямому высвобождению цитозольного ферритина;
- активного синтеза и секреции специфических опухолевых форм ферритинов;
- патологического перераспределения железа с его накоплением в клетках ретикулоэндотелиальной системы;
- изменений функционирования печени, приводящих к нарушению циркуляции ферритина.
Взаимосвязь плазматического ферритина со многими физиологическим процессами в организме позволяет отнести его к белкам острой фазы и к опухолевым маркерам.
Таблица 2. Содержание ферритина в сыворотке крови в норме.
| Возраст | Содержание ферритина, нг/мл (мкг/л) |
| Новорожденные | 25-200 |
| 1 месяц | 200-600 |
| 6 месяцев — 15 лет | 30-140 |
| Взрослые: | |
| Мужчины | 20-350 |
| Женщины | 10-150 |
| Беременность: | |
| Первый триместр | 56 |
| Второй триместр | 27 |
| Третий триместр | 10 |
В первый месяц после рождения концентрация ферритина повышена в связи переходом от фетальной формы гемоглобина к взрослой.
Содержание ферритина в плазме у женщин репродуктивного возраста значительно меньше, чем у мужчин. Это связано с ежемесячными физиологическими кровопотерями, а также с деторождением. За весь период беременности дополнительно расходуется около 1 г железа, что явно прослеживается в прогрессивном снижении ферритина в крови. В третьем триместре беременности концентрация ферритина минимальна и граничит со значениями, характерными для ЖДА. Лактация также сопровождается повышенным расходом железа, так как молочная железа продуцирует белок с подобными трансферрину свойствами — лактоферрин.
В постменопаузальный период содержание железа и концентрация ферритина в организме женщин возрастают, приближаясь к показателям у мужчин [19].
В случае перегрузки организма железом концентрация ферритина превышает 400-500 нг/мл, а при ярко выраженном гемохроматозе может достигать 10 000 нг/мл и более.
Несмотря на низкое содержание железа в плазматическом ферритине, концентрация ферритина в плазме коррелирует как с резервными запасами железа в организме, так и его общим количеством. Определяя в сыворотке крови содержание ферритина, на самом деле мы определяем концентрацию белковой части комплекса, апоферритина. Концентрация апоферритина в крови соответствует общему уровню ферритина в тканях и, следовательно, содержанию запасов железа.
Данное утверждение подтверждается многочисленными опытами [20] , [21]. Для здоровых лиц был предложен фактор эквивалентности (коэффициент пересчета): 1 нг ферритина в 1 мл сыворотки соответствует 8 мг (143 мкмоль) железа, хранимого в депо.
Таким образом, диагностическая ценность измерения сывороточного ферритина неоспорима.
В настоящее время для измерения концентрации ферритина в сыворотке крови используются иммунологические методы анализа. Для правильного определения исследуемого антигена необходимо использовать высокоспецифичные к анализируемому веществу антитела. Правильный выбор антител можно сделать, зная особенности антигенного строения ферритина.
Ферритин представляет собой сложный белок с выраженной четвертичной структурой (см. раздел 3.). Вследствие этого большинство антигенных детерминант на его поверхности являются конформационно зависимыми. В литературе описаны специфичность и аффинность широкого круга как поликлональных, так и моноклональных антител к ферритину. Показано, что антитела обладают специфичностью в межтканевом отношении. Так, в зависимости от относительного содержания в молекуле Н- и L-субъединиц антитела проявляют различное сродство к ферритину. Например, в работе [22] при использовании в качестве иммуногена ферритина из печени человека перекрестная реактивность полученных моноклональных антител с селезеночным ферритином составляла 74%, а с сердечным ферритином — всего 13%.
Белковая оболочка, лишенная кластера железа, проявляет большую иммунологическую активность по сравнению с ферритином, нагруженным железом. Вероятно, это вызвано повышением конформационной лабильности молекулы, что способствует вовлечению во взаимодействие с антителами участков, не доступных или малодоступных в нативной молекуле. Адсорбция апоферритина на полистироле приводила к практически полной утрате иммунологической реактивности, что также указывает на конформационный характер эпитопов молекулы [23].
Антитела к одиночным субъединицам ферритина выявили существенные отличия в их антигенном строении. Антигенные детерминанты Н- и L-субъединиц ферритина отличаются друг от друга.
Из общего числа кластеров эпитопов, максимальное количество которых ограничено числом субъединиц ферритина (24) только 3-4 доступны для одновременного связывания антител. Данный вывод о максимальной валентности ферритина сделан в работе [24] на основании геометрических расчетов по известному внешнему диаметру сферической глобулы ферритина (12-13 нм) и минимальному расстоянию между центрами двух молекул антител, способными расположиться на антигенной поверхности без стерических затруднений (12-14 нм).
Определение концентрации ферритина в сыворотке крови первоначально осуществлялось радиоиммунологическими методами, основанными на конкуренции за связывание с антителами антигена из сыворотки крови и его радиоактивно меченого аналога [25]. Несколько позднее стал применяться неконкурентный иммунорадиометрический метод, использующий возможность одновременного связывания с молекулой ферритина двух молекул антител [26].
Особенностью ферритина является наличие нескольких сайтов связывания антител, некоторые из них повторяются. Как было сказано выше, в целом глобула обладает размерами, достаточными для одновременного связывания с четырьмя молекулами антител. Поэтому для выявления ферритина в основном используют неконкурентный метод анализа. Данный выбор связан не только со сложностью конъюгирования ферритина с меткой и возможностью нарушения при этом его антигенной структуры, но и с необходимостью обеспечения высокой чувствительности анализа для выявления ЖДА, недостижимой при конкурентной схеме.
Применение моноклональных антител с различной эпитопной направленностью для связывания и детекции антигена делает возможным проведение иммунологической реакции в одну стадию, при этом отсутствует конкуренция между «верхними» и «нижними» антителами за связывание с общими эпитопами, искажающая результаты анализа. Проведение анализа в одну стадию позволяет снизить расход реагентов и стоимость анализа, уменьшить занятость лабораторного оборудования и значительно сэкономить рабочее время.
В настоящее время практически все предлагаемые тест-системы основаны на неконкурентном методе определения ферритина. Однако используемые разными производителями антитела, поверхность твердой фазы, способы детекции сигнала и другие параметры разнятся очень значительно.
Результаты сравнения аналитических характеристик тест-систем производства различных фирм приведены в Таблице 3.
Таблица 3. Аналитические характеристики наборов для определения ферритина различных производителей.
| Производитель | Особенности методики | Используемые антитела | Первая и последняя КП, нг/мл; аттестация | Чувствитель ность, нг/мл | Эффект высоких концент раций, нг/мл |
| DPC «Immulite» | Одностадийный «сэндвич», инкубация 30мин, объем сыворотки 10 мкл, регистрация хемилюминесценции. | Иммобилизованные — мышиные моноклональные, конъюгат — козьи поликлональные со щелочной фосфатазой. | 10; 1500 IS 80/578 | 1.5 | 73 000 |
| Roche «Cobas Core» | Одностадийный «сэндвич». В качестве «твердой фазы» используются полистирольные шары. Инкубация 15мин/37°С, объем сыворотки 20 мкл. Субстрат — ТМБ. | Мышиные моноклональные к 2-м эпитопам для иммобилизации и конъюгирования с ПХ. | 75; 1200 IS 80/602 | 2 | 300 000 |
| Delfia | Двухстадийный «сэндвич», обе инкубации по 1 часу при комнатной Т, объем сыворотки 20 мкл. Регистрация флуоресценции (Eu метка). | Мышиные моноклональные. | 2; 1000 IS 80/578 | 0.5 | 120 000 |
| IBL | Одностадийный «сэндвич», инкубация 45 мин при комнатной Т, объем сыворотки 20 мкл. | Иммобилизованные — кроличьи, для конъюгирования с ПХ — моноклональные мышиные. | 15; 1000 IS 80/602 | 5 | 12 000 |
| Randox | Турбидиметрический метод измерения | Антисыворотка на латексных частицах. | 5; 450 | 5 | 2 000 |
| DSL | Двухстадийный «сэндвич», инкубации 30 и 60 мин при комнатной температуре, объем сыворотки 50 мкл. | Поликлональные козьи против селезеночного ферритина человека, метка — I125 | 8; 1000 IS 80/602 | 3.6 | 10 000 |
| Beckman Coulter | Одностадийный «сэндвич», инкубация 20 мин при 36,5°С, объем сыворотки 10 мкл. | Парамагнитные частицы, покрытые козьими АТ против иммуноглобулинов мыши, связывающие мышиные моноклональные АТ к ферритину; конъюгат — козьи АТ со щелочной фосфатазой | 10; 1500 | 0.2 | |
| Roche «Elecsys» | Одностадийный «сэндвич». Общее время проведения анализа — 18 мин. Объем сыворотки 15 мкл. Регистрация электрохемилюминесценции. | Мышиные моноклональные к 2-м эпитопам для иммобилизации и конъюгирования с ПХ | 0,5; 2000 | 0.5 | 200 000 |
| Алкор Био | Одностадийный «сэндвич», инкубация 30мин/37°С или 45 мин при комнатной Т, объем сыворотки 20 мкл. | Мышиные моноклональные к 2-м эпитопам для иммобилизации и конъюгирования с ПХ | 10; 1000 IS 80/578 | 5 | 10 000 |
В Таблице. 4 приведена ориентировочная стоимость реагентов, необходимых для выполнения одного анализа наборами реагентов разных производителей. Стоимость рассчитана по ценам производителя или его официального дистрибьютора в России (при условии проведения анализа в соответствии с инструкцией производителя).
Таблица 4. Стоимость определения ферритина наборами различных производителей.
| Производитель | Цена, $ |
| VedaLab | 4.17 |
| IBL | 3.66 |
| OrgenTec | 3.63 |
| Sigma | 3.05 |
| DRG | 2.66 |
| Roche «Elecsys» | 2.16 |
| Roche «Cobas Core» | 2.04 |
| Алкор Био | 1.52 |
| DPC «Immulite» | 1.22 |
Разработанный компанией «Алкор Био» набор «ИФА-ферритин» представляет собой гетерогенную иммуноферментную систему для количественного определения ферритина в сыворотке крови человека. Основными компонентами такой системы является твердая фаза, конъюгат антитела с меткой и калибровочные пробы.
Из Таблиц 3 и 4 видно, что «ИФА-ферритин» по своим характеристикам превосходит многие из зарубежных аналогов. Стоимость единичного определения ферритина набором DPC «Immulite» немного ниже, однако следует учитывать, что стоимость необходимого для этого автоматического анализатора примерно в 5 раз выше, чем стоимость оборудования, на котором проводится определение ферритина набором «ИФА-ферритин».
[1] . Bezwoda WR et al. The relationship between marrow iron stores, plasma ferritin concentrations and iron absorption, Scand J Haematol. 1979; 22: 113-20. [2] . Complementary Feeding And The Control Of Iron Deficiency Anemia In The Newly Independent States Presentation By WHO At A WHO/Unicef Consultation Geneva, Switzerland 4 February ( http://www.cdc.gov/mmwr/distrnds.html ). [3] . 1999 Report of the UNICEF/WHO Regional Consultation Prevention and Control of Iron Deficiency Anemia in Women and Children. 3-5 February 1999, Geneva, Switzerland ( http://www.who.int/nut/ida.htm ). [4] . Grail A, Hancock BW, Harrison P. Serum ferritin in normal individuals and in patients with malignant lymphoma and chronic renal failure measured with seven different commercial immunoassay techniques. J Clin Pathol 1982; 35: 1204-1212. [5] . Milman N, Pedersen L. The serum ferritin concentration is a significant prognostic indicator of survival in primary lung cancer. Oncology reports, 2002; 9: 193-198. [6] .Назаренко ГИ, Кишкун АА. Клиническая оценка результатов лабораторных исследований. М., Медицина, 2000, 544с. [7] . Harrison PM, Arosio P. The ferritins: molecular properties, iron storage function and cellular regulation. Biochimica et Biophysica Acta. 1996; 1275: 161-203. [8] . Munro HN, Linder MC. Ferritin structure, biosynthesis, and function. Physiological Reviews. 1978; 58: 317-396. [9] . Gerl M, Jaenicke R. Self-assembly of apoferritin from horse spleen after reversible chemical modification with 2,3-dimethylmaleic anhydride. Biochemistry. 1988; 27: 4089-4097. [10] . Harrison PM, Treffry A, Lilley TH. Ferritin as an iron-storage protein: mechanisms of iron uptake. J. Inorg. Biochemistry. 1986; 27: 287 — 293. [11] . Arosio P, Adelman TG, Drysdale JW. On ferritin heterogeneity. Further evidence for heteropolymers. J. Biol. Chemistry. 1978; 253: 4451-4458. [12] . Ruggieri G, Iacobello C, Albertini A, Brocchi E, Levi S, Gabri E, Arosio P. in Ferritins and Isoferritins as Biochemical Markers (Albertini A, Arosio P, Drysdale JW, eds). 1984; pp. 67-78, Elsevier, Amsterdam. [13] . Stefanini S, Chiancone E, Arosio P, Antonini E. Structural heterogeneity and subunit composition of horse ferritin. Biochemistry. 1982; 21: 2293-2299. [14] . Shinjyo S, Abe H, and Masuda M. Carbohydrate composition of horse spleen ferritin. Biochim Biophys Acta, Nov 1975; 411: 165-167. [15] . Reissman KR, Dietrich MR. On the presence of ferritin in the peripheral blood of patients with hepatocellular disease. J. of clinical investigation. 1956; 35: 588-595. [16] . Addison GM, Beamish MR, Hales CN, Llewellyn P. An immunoradiometric assay for ferritin in the serum of normal subjects and patients with iron deficiency and iron overload. J. of Clin. Pathol. 1972; 25: 326-329. [17] . White K, Munro HN. Induction of ferritin subunit synthesis by iron is regulated at both the transcriptional and translational levels. J. Biol.Chem. 1988; 263: 8938-8942. [18] . Cragg SJ, Covell AM, Burch A, Worwood M. Turnover of 131 I-human spleen ferritin in plasma. British J. of Haematology. 1983; 55: 83-92. [19] . Yamashita N, Oba K, Nakano H, and Metori S. Age-related changes in concentrations of ferritin, glycosylated ferritin, and non-glycosylated ferritin. Nippon Ronen Igakkai Zasshi. 1996; 33: 754-760. [20] . Lipschitz DA, Cook JD, Finch CA, A clinical evaluation of serum ferritin as an index of iron stores. The New Engl J of Medicine, 1974, 290, 22, 1213-1216. [21] . Jacobs A, Miller F, Worwood M, et al. Ferritin in serum of normal subjects and patients with iron deficiency and iron overload. Br Med J. 1972; 4: 206-208. [22] . Cavanna F, Ruggeri G, Iacobell C, Albertini A, Arosio P. Development of a monoclonal antibody against human heart ferritin and its application in an immunoradiometric assay. Clinica Chimica Acta. 1983; 134: 347-356. [23] . Лунев ВЕ, Мельникова ЯИ, Кошкин СА, Лунева НМ. Моноклональные антитела к ферритину селезенки человека. Получение и исследование взаимодействия с ферритином и апоферритином. Биохимия, 1993, том 58, вып. 5, 745-757. [24] . Мельникова ЯИ, Лунев ВЕ, Прейгерзон ВА, Родионов МА. Моноклональные антитела к ферритину селезенки человека. Локализация эпитопов и количественные параметры связывания. Биохимия, 1993, том 58, вып. 5, 759-771. [25] .Luxton AW, Walker WH, Gauldie J, Ali AM, and Pelletier C. A radioimmunoassay for serum ferritin. Clin. Chem., 1977; 23: 683-689. [26] . Miles LE, Lipschitz DA, Bieber CP and Cook JD. Measurement of serum ferritin by a 2-site immunoradiometric assay. Analyt Biochem 1974, 61: 209-224.источник