Автор: Аверина Олеся Валерьевна, к.м.н., врач-патолог, преподаватель кафедры паталогической анатомии и патологической физиологии
Исследование костного мозга представляет собой чрезвычайно важный этап диагностики многих гематологических заболеваний, когда ни анализ периферической крови, ни стернальная пункция не дали необходимого объема информации.
Процедуру забора костномозговой ткани называют трепанобиопсией. Полученный материал в виде столбика исследуется под микроскопом, что дает возможность определить клеточный состав, степень зрелости элементов всех ростков кроветворения, состояние стромы, которые отражают наличие или отсутствие конкретного заболевания.

Сложный цикл созревания клеточной массы невозможен без стромального компонента — соединительнотканных волокон, фибробластов, сосудов, которые выполняют поддерживающую роль, обеспечивают трофику кроветворного органа, дают возможность полноценным клеткам покинуть место своего образования.
У маленьких детей красный костный мозг можно добыть почти из всех костей, но с возрастом он сменяется жировым, а у взрослых в достаточном количестве присутствует лишь в крупных трубчатых костях — бедренные, подвздошные, грудина, ребра. Самой «удобной» для трепанобиопсии костного мозга у взрослых людей считается подвздошная кость, к которой довольно легко «подступиться» и которая богата кроветворным органом.
Зачастую оценка лишь периферической части форменных элементов не дает полной картины о характере нарушений кроветворения и их причинах, поэтому врачи идут на трепанобиопсию для получения достаточного объема костного мозга вместе с клетками и элементами стромы, которые подвергаются микроскопическому анализу после соответствующей подготовки и окраски.
Трепанобиопсия костного мозга проводится повсеместно, не представляет никаких трудностей для опытного специалиста, хорошо переносится и не несет вреда пациенту при правильной оценке показаний и противопоказаний к исследованию.
Трепанобиопсия широко используется в практике врачей-гематологов в качестве одного из основных методов диагностики заболеваний кроветворной ткани. Она показана при:
- Тяжелой анемии, не отвечающей на стандартные протоколы лечения;
- Подозрении на полицитемию, эритремию, когда в общем анализе число красных клеток (эритроцитов) стремительно растет;
- Изменении числа клеток белого ростка кроветворения в периферической крови, подозрительном в отношении опухоли;
- Наличии симптомов гематологического заболевания (лихорадка, потливость, похудание, рецидивирующие инфекции, необъяснимая лимфаденопатия и др.) при неубедительной картине периферической крови;
- Проведении химиотерапии — до и после лечения для контроля его эффективности;
- Диагностике болезней накопления — наследственных синдромов с дефицитом ферментов и нарушением кроветворения;
- Гистиоцитозе;
- Признаках иммунодефицитного состояния;
- Наличии злокачественных опухолей с возможным метастазированием в костный мозг;
- Снижение числа форменных элементов при невозможности диагностики посредством пункции грудины или аспирационной биопсии подвздошной кости.
Кроме того, трепанобиопсия костного мозга проводится при дифференциальной диагностике первичного опухолевого процесса в кроветворной ткани и вторичного поражения костного мозга при патологии печени, почек, эндокринной системы, инфекциях, метастазах рака другой локализации и т. д.
Препятствия к проведению трепанобиопсии возникают не так уж часто, их считают относительными, то есть при соответствующей подготовке пациента процедуру можно будет провести. В числе противопоказаний:
- Пожилой и старческий возраст;
- Ситуация, когда заключение по костному мозгу не повлияет на схему лечения и не продлит жизнь больному;
- Воспалительные, гнойничковые процессы, экзема в зоне предполагаемого прокола кожи;
- Выраженное нарушение свертываемости крови (тяжелая тромбоцитопения);
- Острая общая инфекционная патология (грипп, например) — до момента полного выздоровления;
- Тяжелая сопутствующая патология — декомпенсированная недостаточность сердца, сахарный диабет, не поддающийся коррекции, недостаточность печени, почек;
- Невозможность уложить обследуемого на живот по причине сильного ожирения или патологии позвоночника (предпочтительнее трепанобиопсия в положении сидя);
- Аллергия на местные анестетики;
- Нежелание и отказ пациента от проведения исследования.
Преимуществами трепанобиопсии костного мозга подвздошной кости считаются относительная простота проведения исследования, его безопасность, безболезненность и хорошая переносимость при высокой информативности. Кроме того, забор костного мозга не предполагает длительной и сложной подготовки, может быть проведен амбулаторно, не требует наличия дорогостоящего оборудования, поэтому доступен каждому нуждающемуся в нем пациенту. Трепанобиопсия занимает мало времени и не ограничивает жизнедеятельности в последующем, госпитализации также не требуется.
В отличие от пункции грудины, при которой тоже можно получить образцы кроветворных клеток, трепанобиопсия дает возможность комплексно исследовать структуру кроветворной ткани, оценить соотношение и количество ее составляющих, изучить характер и изменения стромального и сосудистого компонента, что чрезвычайно важно при диагностике онкогематологической патологии.
По сути, недостатков у трепанобиопсии нет. Конечно, обследуемому придется побороть свои страхи, справиться с волнением перед процедурой, испытать вполне терпимую болезненность, но все это кажется несущественным по сравнению с той пользой, которую принесет исследование.
Перед тем, как врач назначит дату трепанобиопсии, пациенту предстоит пройти некоторые подготовительные мероприятия — сдать общий анализ крови, сделать коагулограмму, пройти флюорографию, ЭКГ (по показаниям), проконсультироваться у узких специалистов при наличии сопутствующих заболеваний. Возможно, понадобится рентгенография костей таза и позвоночника, УЗИ органов малого таза, лимфоузлов и др.
Лечащий врач обязан знать обо всех принимаемых препаратах, особенно — антикоагулянтах и антиагрегантах, используемых постоянно. Кроверазжижающие средства отменяются за 10-14 дней до процедуры во избежание кровотечений.
Поскольку трепанобиопсия требует местного обезболивания, врач выясняет, нет ли аллергии на местные анестетики, были ли в прошлом неблагоприятные последствия или какие-либо реакции на введение анестезирующих средств.
В случае остеопороза, перенесенных ранее операций или травм тазовых костей и позвоночника, врач обязательно ставится об этом в известность, чтобы при необходимости изменить место прокола кости или вовсе его отменить из-за риска осложнений.
Утром за несколько часов до исследования рекомендуется позавтракать, чтобы чувство голода и дурноты не потревожило во время манипуляции, и пациент не потерял сознание из-за необоснованного отказа от еды. Пить же много жидкости перед пункцией не советуют, так как переполненный мочевой пузырь может потребовать опорожнения в неподходящий момент.
Эмоционально лабильным пациентам, а также тем, кто чрезмерно волнуется или боится исследования, за полчаса до прокола могут быть введены успокоительные препараты.
Перед трепанобиопсией пациент в обязательном порядке информируется о возможных осложнениях, целях и ходе процедуры, после чего дает свое письменное согласие на исследование. В назначенный день он приходит в клинику самостоятельно, без предварительной госпитализации.
Трепанобиопсия подвздошной кости может быть проведена в положении пациента лежа на животе (предпочтительнее) или на боку. При невозможности такой позы обследуемого усаживают.
Трепанобиопсия костного мозга проводится специальной иглой с мандреном и ограничителем, который предупреждает чрезмерно глубокое проникновение в костную ткань. Игла имеет резьбу, с помощью которой она как бы ввинчивается в костную ткань, вырезая ее столбиком. После прокола она попадает в костномозговой канал, после чего аспирируется необходимый объем ткани, отправляющейся после процедуры на гистологическое исследование.
техника трепанобиопсии костного мозга
Трепанобиопсия подвздошной кости занимает не более получаса и может быть проведена амбулаторно. Перед пункцией пациенту проводится местное обезболивание, в редких случаях — общий наркоз, который более предпочтителен в педиатрической практике. В случае наличия волосяного покрова в месте предполагаемого прокола (у мужчин) волосы удаляются.
Пациент укладывается на живот, бок, спину или садится, после чего место пунктирования обрабатывают антисептическим средством, а в мягкие ткани и под надкостницу вводят анестезирующий препарат. Через несколько минут, по мере пропитывания кожи и подкожного слоя анестетиком, пациент теряет чувствительность, а врач аккуратно вводит иглу, слегка надавливая и вращая ее.
Место пункции — гребень подвздошной кости на 2-3 см отступя кзади от передне-верхней ости или задняя ость в том месте, где подвздошная кость расположена ближе всего к коже.
Надавливая на иглу и одновременно вращая ее по оси, врач прокалывает кость, игла вводится на глубину до 3-4 см, после чего нужно совершить осторожные колебательные движения в сторону для отделения ткани в троакаре от стенок кости. Такими же вращательными движениями, но в противоположном направлении, игла вынимается, а костный мозг выталкивается наружу при помощи мандрена.
Трепанобиопсию всегда делает врач, средний медицинский персонал помогает во время процедуры, заполняет документацию, стерилизует инструментарий, осуществляет обработку кожи пациента антисептиками и наложение стерильных салфеток после манипуляции.
Когда необходимый объем ткани набран, а для гистологии достаточно 1-2 мл, игла извлекается, костный мозг отправляется в емкость с формалином для фиксации, флакон маркируется, медсестра заполняет направление на исследование с указанием паспортных данных и диагноза пациента.
Если планируется цитологическое исследование костномозговой ткани, врач сразу же после получения материала наносит его на чистые предметные стекла, получая мазки. Перед иммунологическим и цитогенетическим анализами кроветворная ткань находится в пробирках с антикоагулянтами.
Место прокола кости закрывается стерильной салфеткой, а пациента нужно уложить таким образом, чтобы обеспечить прижатие пункционного отверстия в течение 10-15 минут. Это позволяет снизить риск кровотечения.
После тепанобиопсии не требуется госпитализации, и уже спустя час пациент может покинуть клинику, если его заболевание не предполагает стационарного лечения. Место прокола не рекомендуется мочить в течение 3 суток, поэтому посещение бассейна, принятие ванн лучше отложить до полного заживления пункционного отверстия.
Ввиду возможных реакций на анестезирующие вещества, врачи не советуют после трепанобиопсии садиться за руль или мчаться на работу, требующую повышенного внимания. Лучше, если добраться домой помогут родственники или друзья, а после процедуры полезнее будет отдохнуть.
Осложнения после трепанобиопсии подвздошной кости случаются редко, но полностью исключить их вероятность нельзя. Во время манипуляции игла может сломаться или отделиться от удерживающей ее ручки. При недостаточном опыте хирурга или нарушении техники манипуляции, правил асептики и антисептики, возможно развитие кровотечения, гнойных процессов в месте прокола, повреждение в процессе пункции крупных сосудов и нервных стволов.
Отдельного внимания заслуживают аллергические реакции на средства для обезболивания, поэтому врач заранее выясняет, если ли или случались ли раньше неблагоприятные эффекты от анестезии, а в операционной всегда имеется набор необходимых медикаментов для купирования тяжелой аллергической реакции.
Многие пациенты боятся, что при трепанобиопсии им будет больно. На самом деле, процедура переносится хорошо, а местные анестетики позволяют сделать ее комфортной и безболезненной. Неприятные ощущения возможны лишь при проколе кожи и введении анестезирующего средства, но они под действием препарата быстро проходят.
После трепанобиопсии возможна небольшая болезненность в области подвздошной кости, которая проходит самостоятельно и не нарушает привычной жизни обследуемого. В случае сильной боли есть риск травмирования крупного нерва, поэтому врач должен знать о таком последствии процедуры.
Эмоционально лабильные пациенты, излишне чувствительные и мнительные люди могут испытать на себе весь спектр вегетативных реакций во время трепанобиопсии — тахикардия, потливость, головокружение и даже обморок. Для предупреждения этих явлений показаны седативные средства.
Результаты трепанобиопсии подвздошной кости могут быть готовы в разные сроки в зависимости от вида исследования костного мозга. Цитологическое заключение пациент может получить даже в день исследования, а гистологический ответ придется подождать не менее недели, а то и больше. При сложных исследованиях, в трудных для диагностики случаях, при необходимости получения консультативного заключения из специализированных отделений онкоморфологии и т. д. ожидание ответа может занять до месяца.
Костномозговой пунктат при гистологическом анализе дает большой объем информации для установления правильного диагноза. Подсчет численности клеток разных ростков кроветворения может указывать на гиперплазию костного мозга или гипо- и аплазию при тяжелых опухолях кроветворной ткани, а также вследствие проводимой химиотерапии.
Анализ стромального компонента позволяет установить степень миелофиброза, то есть разрастания соединительной ткани, что характерно для многих опухолевых поражений костного мозга. Этот показатель также важен для прогноза течения заболевания и контроля эффективности его лечения.
Отзывы пациентов, перенесших трепанобиопсию, чаще положительны. Короткий период реабилитации и возможность амбулаторного обследования позволяют пройти этот диагностический этап без изменения привычного образа жизни и с сохранением трудоспособности. Применение местных анестетиков делает процедуру забора костного мозга практически безболезненной и вполне комфортной.
Таким образом, трепанобиопсия костного мозга — важнейший этап диагностики многих гематологических заболеваний, дающий огромный объем информации касательно особенностей кроветворения у конкретного пациента. Вместе с тем, процедура довольно проста в исполнении, что дает возможность проводить ее широкому кругу нуждающихся на бесплатной основе в государственных лечебных учреждениях.
Бояться трепанобиопсии не стоит, ведь необходимость обследования, даже такого специфического, не всегда указывает на злокачественную опухоль или другое неизлечимое заболевание. Перед пункцией следует успокоиться и набраться надежды на благоприятный результат исследования.
источник
Одним из самых редких, но тяжелых заболеваний системы кровообращения считается апластическая анемия, симптомы, причины, методы лечения этого вида малокровия бывают различны. Все зависит от формы, вида и степени тяжести данной патологии.
Люди, далекие от медицины, зачастую не имеют представления о том, что такое апластическая анемия. Так называется расстройство кроветворной функции костного мозга, ведущее к снижению выработки кровяных клеток. Это приводит к серьезным патологическим изменениям во всех системах человеческого организма. Очень часто заболевание заканчивается летально.
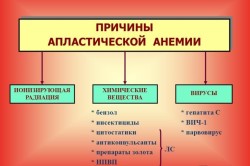
Этиология апластической анемии до сих пор досконально не изучена. Поэтому окончательный список причин данного заболевания все еще полностью не составлен. На данный момент основными причинами апластического малокровия считаются:
- плохая экология в регионе проживания;
- ионизирующая радиация;
- постоянные контакты с опасными химическими веществами в течение долгого времени;
- отдельные инфекционные заболевания: гепатит, цитомегаловирус;
- разрушение костного мозга под воздействием некоторых медикаментозных средств при их длительном приеме в высоких дозах, особенно левомицетина, мышьяка, бензола, химических препаратов, противоопухолевых средств, антибиотиков;
- генетическая предрасположенность;
- беременность;
- патологии костного мозга;
- злоупотребление алкоголем.
Возникновение апластической анемии у детей сразу после рождения может быть спровоцировано такими причинами, как:
- врожденный сифилис;
- токсоплазмоз;
- генерализованный мегалоцитоз.
Часто у детей диагностируется идиопатическая апластическая анемия. В этом случае определить точную причину возникновения патологии не представляется сегодня возможным.
При гипопластической анемии наблюдается еще более серьезное расстройство кроветворной функции костного мозга. В целом гипопластические и апластические анемии вызывают сходные патологии органов и систем организма, имеют похожую симптоматику и лечатся примерно одинаково.
Костный мозг образуется губчатой структурой и располагается в глубине трубчатых костей. Посредством его структуры происходит выработка различных клеток крови: лейкоцитов, тромбоцитов, эритроцитов.
При апластической анемии, прежде всего, нарушается эритрогенез. Стимулировать этот процесс медикаментозными средствами невозможно. В этом случае может помочь только пересадка донорского костного мозга.
Помимо этого, апластичная анемия развивается на фоне уменьшения количества и изменения функций стволовых клеток.
Причиной этого становится нарушение микроокружения, клеточное или гуморальное воздействие иммунного характера, препятствующее нормальному функционированию стволовых клеток.
Апластическая анемия, симптомы которой часто незаметны, является серьезной патологией. В отдельных случаях недуг начинается в острой форме с быстрым нарастанием симптоматических проявлений. Развитие болезни может быстро прогрессировать, приводя к летальному исходу. Возможно также хроническое с периодическими ремиссиями и рецидивами протекание анемии.
Апластическая анемия симптомы имеет следующие: анемический, геморрагический и лейкоцитопенический синдромы. Для каждого из них характерны определенные признаки.
Анемический синдром (снижение уровня гемоглобина) возникает при нарушении формирования эритроцитов и сопровождается такими симптомами, как:
- общая слабость;
- сонливость;
- бессонница;
- раздражительность;
- одышка;
- шум в ушах;
- тахикардия;
- бледность кожных покровов;
- быстрая утомляемость.
Геморрагический синдром (повышение кровоточивости) вызван понижением уровня тромбоцитов в крови. Его сопровождают такие симптомы, как:
- петехии, т. е. точечные кровоизлияния на коже и слизистых оболочках и гематомы;
- плохая свертываемость крови;
- десневые и носовые кровотечения;
- появление крови в моче;
- обильные менструальные выделения у женщин.

Он сопровождается следующими симптомами:
- появление хронических очагов инфекции в различных органах и на поверхности кожи больного;
- учащение инфекционных заболеваний, протекающих длительно и со многими осложнениями;
- стоматит;
- внезапная гипертермия без видимых причин.
По форме апластическая и гипопластическая анемия может быть как врожденной, так и приобретенной.
После проведения анамнестической беседы врач проводит общий осмотр пациента. При этом обязательно применяются такие методы, как:
- выслушивание (аускультация) сердечных шумов;
- простукивание (перкуссия) живота, показывающая увеличение таких органов, как печень и селезенка;
- прощупывание (пальпация) для уточнения результатов перкуссии.
Для получения дополнительных сведений больному назначается:
- общий анализ крови;
- биохимический анализ крови;
- клинический анализ крови — гемограмма;
- забор мазка — биопсия, костного мозга;
- анализ мазка костного мозга, на основании которого составляется миелограмма.
При необходимости больному проводятся специальное тестирование, помогающее уточнить причину заболевания.
На основании всех полученных данных составляется точная клиническая картина заболевания, необходимая для определения курса лечения.
Когда больному диагностируется апластическая анемия, лечение проводится по 3 направлениям: этиологическому, симптоматическому и патогенетическому. Если известна точная причина возникновения заболевания, ее необходимо ликвидировать: прекратить контакт с токсинами, сменить лекарственные препараты, используемые для лечения других заболеваний и т. д.
Восстановлению кроветворного функционирования костного мозга помогают следующие препараты:
- кортикостероиды;
- андрогены;
- цитоксины;
- иммуносупрессоры.
Помимо медикаментозной терапии лечение апластической анемии проводится при помощи таких процедур, как переливание крови и ТКМ. Посредством переливания донорской крови организм больного частично обеспечивается недостающими кровяными клетками.
В особых случаях больным проводится трансплантация костного мозга. Костный мозг донора должен максимально соответствовать костному мозгу реципиента. Поэтому этот метод особенно эффективен, если у больного есть однояйцевый близнец. Процент выживаемости после трансплантации костного мозга выше у реципиентов более молодого возраста.

Основными факторами, влияющими на получение положительных эффектов, являются:
- Степень тяжести заболевания.
- Правильный выбор и хорошая переносимость лечения.
- Возраст больного. Легкая апластическая анемия у детей и молодых людей, не достигших 30-летнего возраста, полностью вылечивается чаще, чем у людей среднего и старшего возраста. При тяжелых формах болезни прогнозы не столь благоприятные.
Основным условием ремиссии и значительного продления жизненного срока является хорошая переносимость патогенетической терапии и успешное проведение трансплантации костного мозга.
Профилактика анемии различного вида может быть первичной или вторичной. Первичная профилактика предполагает исключение возможности развития данной патологии у относительно здорового человека. Этого можно добиться при помощи таких способов, как:
- ведение здорового образа жизни;
- правильное питание;
- постоянное укрепление иммунной системы;
- исключение или сведение к минимуму контакта с ионизирующими излучателями и токсичными веществами, вызывающими патологии костного мозга;
- контролированный прием лекарственных препаратов во время лечения других заболеваний;
- периодические визиты к терапевту и гематологу;
- полный отказ от употребления алкоголя и никотина.
Вторичная профилактика анемии проводится для замедления развития заболевания, избегания его осложнения сопутствующими патологиями. Для этого необходимо:
- аккуратное проведение лечения;
- постоянный контроль специалистов — гематолога и терапевта;
- тщательное контролирование больным своего состояния, немедленное посещение врача при появлении новых симптомов;
- постоянный прием поддерживающих препаратов в течение долгого времени.
Апластическая анемия — опасная патология, которую лечат годами. Только под наблюдением специалиста можно добиться стойкой ремиссии патологии. Самолечение в этом случае неприемлемо и может привести к плачевным последствиям.
источник
Ретроспективными исследованиями установлено, что средний интервал от воздействия этиологического агента до возникновения панцитопении составляет 6-8 нед.
Симптомы апластических анемий напрямую связаны со степенью снижения 3 важнейших показателей периферической крови — гемоглобина, тромбоцитов и нейтрофилов. Подавляющее большинство больных апластическими анемиями обращаются к врачу по поводу кровоточивости, причём угрожающие жизни кровотечения в качестве первого клинического проявления болезни встречаются очень редко. В типичных случаях речь идёт о петехиальной сыпи, кровоточивости дёсен и легко возникающих экхимозах. Серьёзные висцеральные кровотечения — желудочно-кишечные, почечные и внутричерепные — возникают позже. Анемический синдром проявляется лёгкой утомляемостью, шумом в ушах, ощущением пульсации в голове, усталостью и другими классическими симптомами анемии. Как правило, дети хорошо переносят даже очень тяжёлую анемию. По данным литературы, тяжёлые инфекции редко выступают первыми симптомами болезни, однако, по нашим данным, это не совсем так. Нехарактерны для апластических анемий снижение массы, спленомегалия, лимфаденопатия и боли. Появление этих симптомов заставляет искать другую причину панцитопении.
Помимо внимательного клинического осмотра минимальный спектр необходимых диагностических исследований при подозрении на апластическую анемию включает:
- гемограмму с определением ретикулоцитов и ручным подсчётом лейкоцитарной формулы;
- миелограмму из 2-3 анатомически различных точек;
- трепанобиопсию костного мозга;
- пробу на ломкость хромосом с диэпоксибутаном или митомицином (митомицин С);
- биохимический анализ крови.
Для апластических анемий типично конкордатное снижение показателей производных всех 3 главных ростков костномозгового кроветворения (эритроцитов, гранулоцитов и тромбоцитов), несмотря на различную кинетику зрелых элементов крови. У большинства пациентов число лимфоцитов и моноцитов также снижено. Абсолютное число ретикулоцитов неадекватно тяжести анемии. Повышение фетального гемоглобина наряду с макроцитозом типично для апластических анемий. Повышение активности сывороточных трансаминаз, за исключением случаев гепатит-ассоциированных апластических анемий нехарактерно. Относительно высокий ретикулоцитоз, повышение билирубина и лактатдегидрогеназы говорит о сопутствующем синдроме — пароксизмальной ночной гемоглобинурии.
Состояние костного мозга при апластических анемиях должно быть оценено как по данным аспирата из нескольких точек, так и по данным трепанобиопсии. По данным исследования пунктата оценивают морфологию резидентных элементов эритро-, грануло- и мегакариоцитопоэза. Дизэритропоэз — весьма частая характеристика при апластических анемиях, типично также выявление «мегалобластоидности» эритроидных элементов, асинхронии созревания ядра и цитоплазмы эритробластов — эти признаки очень трудно дифференцировать от дисплазии эритроидного ряда, выявляемой при миелодиспластических синдромах. Зачастую в пунктате выявляется повышение количества плазматических клеток и макрофагов с явлениями фагоцитоза эритроцитов. Выявление лейкемических бластов в аспирате заставляет пересмотреть диагноз.
В 1976 и 1979 гг. Брюсом Камиттой и соавт. была выделена группа простейших показателей периферической крови и костного мозга, определяющих тяжесть течения заболевания и прогноз больных апластической анемией.
Критерии тяжёлой формы апластической анемии
Клеточность костного мозга, по данным трепанобиопсии, менее 25% (или 9 /л). Тромбоцитопения по мере прогрессирования заболевания достигает значительной степени (до единичных тромбоцитов в мазке). СОЭ, как правило, увеличена.
При анемии Фанкони имеется стресс-эритропоэз, который характеризуется макроцитозом, высоким уровнем Hb F, высоким уровнем эритропоэтина в сыворотке и наличием i-антигена.
Стернальный пунктат на ранних стадиях заболевания нормо- или гипоклеточный. Количество бластов в пределах нормы. Содержание клеток эритроидного ростка увеличено с задержкой их созревания и морфологическими нарушениями в виде анизоцитоза, базофильной пунктации в нормобластах, иногда отмечается появление мегалобластов. Гранулоцитарный росток «сужен», возможна задержка созревания на стадии неитрофильных миелоцитов и метамиелоцитов. Мегакариоцитарный росток значительно «сужен» уже на ранних стадиях заболевания. По мере прогрессирования заболевания отмечается выраженная гипоклеточность костного мозга с угнетением всех ростков и разрастанием жировой ткани. В костном мозге увеличено число ретикулярных, плазматических и тучных клеток. Гипоплазия костного мозга подтверждается результатами трепанобиопсии.
Из биохимических показателей для апластической анемии характерно повышение уровня фетального гемоглобина до 15 % (при норме 2 %) еще до развития цитопении, по мере прогрессирования аплазии фетальный гемоглобин достигает 45 %.
Установлено, что клетки больных с анемией Фанкони не способны репарировать поперечные сшивки ДНК, вызываемые так называемыми кластогенами — диэпоксибутаном, митомицином С и др. На этом феномене основана современная диагностика анемии Фанкони и у всех больных с подозрением на анемию Фанкони должен проводиться тест с диэпоксибутаном.
Течение анемии Фанкони характеризуется наличием периодов обострения и ремиссии. Без лечения через 2 года после диагностики панцитопении умирают 80 % больных, а через 4 года — около 100 %. Причиной смерти, наряду с тяжелой анемией, являются наиболее серьезные проявления геморрагического синдрома — желудочно-кишечные кровотечения, внутричерепные кровоизлияния и присоединение различных инфекций.
У больных анемией Фанкони имеется высокий риск трансформации в миелодиспластический синдром, острый лейкоз (особенно миелобластный или монобластный), злокачественные опухоли ЖКТ.
Наследственная апластическая анемия с общим поражением гемопоэза без врожденных аномалий развития (анемия Эстрена-Дамешека)
Является тотальной формой наследственной апластической анемии, наследуется аутосомно-рецессивно, протекает с панцитопенией, не сопровождается врожденными пороками развития. Заболевание встречается крайне редко, гематологические нарушения отмечаются в раннем детском возрасте. Прогноз неблагоприятный.
Врожденный дискератоз (синдром Цинссера-Коула-Энгмана)
Синдром характеризуется признаками эктодермальной дисплазии (патологическое ороговение отдельные клеток шиповатого слоя эпидермиса кожи и слизистых оболочек) в сочетании с гематологическими изменениями (примерно у 50 % больных развивается апластическая анемия). В 75 % случаев синдром наследуется рецессивно сцепленно с Х-хромосомой и, соответственно, встречается у мальчиков; у 25 % детей больных наследуется по аутосомно-доминантному типу (описано примерно одинаковое количество больных). Поражаются кожа и ее дериваты, слизистые оболочки. Наблюдаются множественный рассеянный гиперкератоз с преимущественной локализацией на лице, шее, спине, груди; атрофия кожи ладоней и ступней, ладонно-подошвенный гипергидроз; нарушение роста и дистрофия ногтей; гипотрихоз ресниц; закупорка слезных канальцев и слезотечение; лейкоплакия слизистых полости рта, в основном языка и десен; поражение эндокринных желез (нанизм, недоразвитие вторичных половых признаков). Гематологические изменения разнообразны: панцитопения, изолированная анемия, тромбоцитопения, нейтропения. Возраст дебюта апластической анемии при данном синдроме может быть весьма вариабелен, средний возраст дебюта АА составляет 15 лет.
В отличие от больных с анемией Фанкони клетки больных с врожденным дискератозом не обладают повышенной чувствительностью к антигенам, вызывающим поперечные сшивки, поэтому эти иногда фенотипически похожие синдромы могут быть дифференцированы на основании теста с диэпоксибутаном.
Характеризуется экзокринной недостаточностью поджелудочной железы, карликовостью, метафизарной хондродис-плазией, нейтропенией, иногда анемией, тромбоцитопенией. Наследуется аутосомно-доминантно.
Заболевание клинически проявляется в раннем возрасте и характеризуется признаками поражения ЖКТ и гематологическими изменениями. Отмечаются диарея, стеаторея, замедление весовых прибавок, гипотрофия. Характерны изменения костной системы в виде хондроднсплазии метафиза и формирование ортопедической патологии, задержка роста. У части больных возможна галактоземия, что приводит к гепатоспленомегалии, задержке психомоторного развития. Характерны рецидивирующие респираторные заболевания, отиты, абсцессы, остеомиелит. У некоторых детей наблюдается задержка наступления пубертатного периода.
В анализах крови с раннего возраста отмечается абсолютная нейтропения, число нейтрофилов менее 1 х 10 9 /л. Для зрелых нейтрофилов характерна гипосегментация ядер, отмечается снижение хемотаксиса нейтрофилов. Наряду с нейтропенией приблизительно у 50 % больных отмечается анемия с ретикулоцитопенией, у 60-70 % детей — тромбоцитопения, примерно у 25% больных развивается апластическая анемия. В стернальном пунктате число миелокариоцитов может быть нормальным, сниженным или повышенным; отмечается задержка созревания нейтрофилов на стадии метамиелоцита. Прогноз наиболее неблагоприятный в раннем детском возрасте, когда около 25% детей погибают от инфекционных осложнений; летальный исход возможен и от кровоизлияний в жизненно важные органы.
Наследственная апластическая анемия с избирательным поражением эритропоэза (анемия Блекфена-Даймонда)
Частота данного заболевания составляет 1 : 1 000 000 живых новорожденных; 5 — 7 : 1 000 000 во Франции, 10:1 000 000 в Скандинавии, встречается во всех этнических группах, мальчики и девочки заболевают одинаково часто. Подавляющее большинство (75 %) составляют спорадические случаи заболевания; в некоторых случаях возможно аутосомно-доминантное наследование, аутосомно-рецессивное или сцепленное с Х-хромосомой.
Первые признаки болезни выявляются в первые месяцы или на протяжении первого года жизни — у 35 % больных анемией при рождении, у 65 % в первые 6 месяцев жизни и в 90 % случаев заболевание диагностируется до года. Диагноз анемии Блекфена — Даймонда у детей старше 2 лет маловероятен. Дети, как правило, рождаются доношенными с нормальной массой тела и ростом, психомоторное развитие нормальное. Бледность кожи и слизистых отмечается с первых дней жизни, но явные клинические признаки гипоксии: вялость или возбуждение, беспокойство, сонливость, отказ от еды, диспепсические явления — появляются при снижении гемоглобина до 60-30 г/л. Врожденные пороки развития встречаются реже (в 25 % случаев), чем при анемии Фанкони. Некоторые больные имеют характерные фенотипические особенности: волосы цвета пакли, курносый нос, большая верхняя губа, гипертелоризм. По мере прогрессирования заболевания кожа приобретает восковидный, а к 5-6 годам, в связи с развитием гемосидероза, — сероватый оттенок, особенно в области шейных, подмышечных, паховых складок, половых органов. Геморрагический синдром отсутствует. Наблюдаются гепатомегалия, спленомегалия, в динамике заболевания селезенка сокращается, а печень прогрессивно увеличивается. Костный возраст отстает от паспортного на 4-5 лет, темпы окостенения изменены. Смена молочных зубов запаздывает, часто выявляется кариес.
В периферической крови нормохромная макроцитарная гипо- или арегенераторная анемия (ретикулоциты 0-0,1 %), как правило, тяжелой степени. Число лейкоцитов и тромбоцитов остается на нормальном уровне в течение первых лет жизни; иногда отмечается тенденция к тромбоцитозу. При длительном течении заболевания может развиваться умеренная тромбоцитопения. После первого десятилетия жизни может также появиться умеренная нейтропения, вероятно, из-за снижения клональной эффективности предшественников гранулоцитов.
Биохимически отмечается высокий уровень активности эритроцитарной аденозиндезаминазы; уровень фетального гемоглобина нормальный или умеренно повышен; повышено содержание i-антигена в эритроцитах; увеличено содержание эритропоэтина в сыворотке.
В стернальном пунктате костный мозг нормоклеточный, по мере прогрессирования заболевания отмечается гипоклеточность. Эритроидный росток резко сужен; диагностическим критерием является отсутствие или малое количество эритробластов (менее 5 % ядросодержащих клеток) в костном мозге. Миелоидный и мегакариоцитарный ростки не изменены. Число ретикулярных клеток и лимфоцитов увеличено, плазматических клеток не изменено.
Анемия Блекфена-Даймонда протекает хронически, у 80 % больных получают ремиссию при использовании кортикостероидов; у 20 % больных описана спонтанная ремиссия. «Постоянная гипоксия, нарушение утилизации железа, необходимость по жизненным показаниям трансфузии эритроцитарной массы неуклонно ведут к гемосидерозу, который в дальнейшем является «убийцей» больного ребенка». Возможна трансформация в миелодиспластический синдром, острый лейкоз (лимфобластный, миелобластный, промиелоцитарный, мегакариоцитарный), солидные опухоли (гепатобластому, рстеосаркому, злокачественную фиброзную гистиоцитому), лимфогранулематоз.
Дифференциальный диагноз при анемии Блекфена-Даймонда проводится с другими видами анемий, при которых в периферической крови уменьшается количество ретикулоцитов.
Анемия в период выздоровления после гемолитической болезни новорожденных.
Иногда может сочетаться со снижением интенсивности эритропоэза. Апластические кризы, характеризующиеся ретикулоцитопенией и уменьшением числа предшественников эритроцитов, могут осложнять разные типы гемолитической болезни. Подобные эпизоды являются транзиторными, кроме того, обычно выявляются признаки предшествующей гемолитической болезни. Развитие апластических кризов связывают с В19-парвовирусной инфекцией. Тактика ведения больных, как правило, выжидательная: при значительном снижении уровня гемоглобина проводятся гемотрансфузии.
Транзиторная эритробластопения детского возраста
Одна из наиболее частых форм аплазии эритроидного ростка. Этиология заболевания не известна. У здоровых ранее детей в возрасте 5 мес — 6 лет, чаще всего в возрасте 2 лет, медленно развивается тяжелая арегенераторная анемия, обусловленная резким снижением эритроцитов в костном мозге.
Развитию анемии за 1 — 2 мес может предшествовать вирусная инфекция, хотя связь заболевания с определенным возбудителем не доказана, нередко им является парвовирус В19. Анамнез и физикальное исследование неинформативны, обращает на себя внимание лишь выраженная бледность кожных покровов и слизистых. В периферической крови уровень Нb снижен до 30-80 г/л, ретикулоциты отсутствуют, количество лейкоцитов и тромбоцитов обычно нормальное, однако у 10 % больных имеется нейтропения ( 9 /л) и у 5 % — тромбоцитопения ( 9 /л). Лабораторно выявляют нормальные уровни активности эритроцитарнои аденозиндезаминазы и фетального гемоглобина; по ферментативным характеристикам эритроциты относят к стареющей популяции. Уровень железа в сыворотке повышен. В пользу транзиторной эритробластопении также свидетельствуют нормальные результаты клинического анализа крови до болезни. В стернальном пунктате отмечается резкое сужение эритроидного ростка, отсутствуют предшественники, за исключением нормоцитов, эритроцитов. Культуральными исследованиями костного мозга выявлено несколько патогенетических механизмов: присутствие в сыворотке ингибиторов стволовых клеток или аномалии последних, выражающиеся либо в их численности, либо в способности к реакции на эритропоэтин. Возможен аутоиммунный генез заболевания с поражением первичных эритроидных предшественников, а не зрелых эритроцитов. Через несколько месяцев после старта заболевания наступает спонтанная ремиссия. До наступления выздоровления могут потребоваться гемотрансфузии, кортикостероиды не используются.
Вторичные (приобретенные) аплазии эритроидного ростка
Также проявляются анемией, сопровождающейся ретикулоцитопенией и уменьшением количества предшественников эритроцитов в костном мозге. Вторичная аплазия эритроидного ростка может быть вызвана вирусными инфекциями (паротит, вирус Эпштейна-Барр, парвовирус В19), а т и — пичными пневмониями и бактериальным сепсисом; лекарственными средствами (хлорамфеникол, пенициллин, фенобарбитал, дифенилгидантоин); антиэритроцитарными антителами; иммунодефицитом; тимомой; злокачественными опухолями.
Эпизоды острой недостаточности эритропоэза могут сопровождать целый ряд вирусных инфекций. При этом значительно снижается количество циркулирующих ретикулоцитов (менее 0,1 %) и повышается уровень железа в сыворотке. В костном мозге уменьшено число предшественников эритроцитов. Эти эпизоды, как правило, купируются и не оставляют каких-либо последствий. Наиболее часто вторичная аплазия эритроидного ростка вызывается парвовирусом В19.
У всех больных грудного возраста при диагностике эритробластопении необходимы следующие исследования:
- Содержание сывороточных антител IgM и IgG (мать и ребенок).
- Вирусной ДНК в сыворотке крови.
- Вирусной ДНК в костном мозге.
Эти исследования могут помочь в дифференциации эритробластопении при инфицировании парвовирусом В19 и эритробластопении другого генеза.
В терапии вторичных эритробластопении важно устранение причины, вызвавшей заболевание — отмена препарата, лечение основного заболевания или тимэктомия. При обнаружении антиэритроидных антител показаны кортикостероиды, при их неэффективности — иммунодепрессанты (циклофосфан или азатиоприн). При иммунодефиците парвовирусная инфекция может быть хронической, тогда применяют иммуноглобулин внутривенно.
Приобретенные апластические анемии
Клиника приобретенных апластических анемий отличается в зависимости от тотального или избирательного поражения гемопоэза. У больных приобретенными апластическими анемиями в отличие от наследственных форм отсутствуют врожденные аномалии развития, физическое и психическое развитие детей не изменено, костный возраст соответствует паспортному.
Для тотальных форм апластических анемий характерно сочетание геморрагического, анемического и инфекционно-септического синдромов. Геморрагический синдром, обусловленный тромбоцитопенией, выражен резко: множественные экхимозы и петехии на коже и слизистых оболочках, конъюнктивах, рецидивирующие носовые, десневые, маточные, желудочно-кишечные и почечные кровотечения, кровоизлияния в местах инъекций. Непосредственной причиной смерти у таких больных являются чаще всего кровоизлияния в жизненно важные органы. Поражение эритроидного ростка приводит к развитию анемического синдрома, при котором у больного отмечается общая слабость, снижение аппетита, головокружение, повышенная утомляемость, бледность кожи и слизистых оболочек, ногтевых фаланг, изменения со стороны сердечно-сосудистой системы: расширение границ сердца, приглушенность тонов, тахикардия, систолический шум различной интенсивности, возможна экстрасистолия, одышка. Наличие лейкогранулоцитопении обусловливает возникновение инфекционно-септического синдрома: легкое присоединение инфекций любой локализации, язвенно-некротическое поражение кожи, слизистых оболочек. Характерно тяжелое течение инфекций, вызванных не только патогенной флорой, но и условно-патогенными и грибковыми возбудителями. Лимфатические узлы, печень, селезенка не увеличены. При избирательном поражении эритроидного ростка имеются проявления лишь анемического синдрома.
Все симптомы болезни могут проявляться и нарастать более или менее остро.
Гематологические изменения при апластической анемии складываются из нейтропении (абсолютное число нейтрофилов менее 1,5 х 10 9 /л), анемии (Нb 9 /л) и ретикулоцитопении, не соответствующей тяжести анемии. В миелограмме отмечается резкое снижение клеточности, редукция миелоидного и эритроидного ростков, вариабельный лимфоцитоз и отсутствие мегакариоцитов. У больных с медленным развитием аплазии длительно могут сохраняться участки активного кроветворения — «горячие карманы». В трепанобиоптате обнаруживается резкое снижение плацдарма кроветворения — доминирует жировой костный мозг, гемопоэтические элементы представлены резидуальными очагами эритро- и миелопоэза, мегакариоциты практически не обнаруживаются.
По тяжести приобретенные апластические анемии делятся в зависимости от глубины цитопении, ретикулоцитоза и остаточной клеточности костного мозга по данным трепанобиопсии. Используются критерии тяжести апластической анемии, разработанные международной группой изучения апластической анемии — «критерии Камитты»:
- число гранулоцитов менее 500 в 1 мкл;
- число тромбоцитов менее 20 000 в 1 мкл;
- число ретикулоцитов менее 40 000 в 1 мкл (или менее 1 % после коррекции на нормальный гематокрит).
Апластическая анемия считается тяжелой, если присутствуют любые два указанных выше показателя крови в сочетании со сниженной клеточностью. Если гематологический синдром соответствует критериям тяжелой апластической анемии, но число гранулоцитов менее 200 в 1 мкл — сверхтяжелая апластическая анемия. Все остальные случаи характеризуются как нетяжелая апластическая анемия.
Дифференциальный диагноз при приобретенных апластических анемий проводится преимущественно с острым лейкозом, мегалобластными анемиями, синдромом гиперспленизма, метастазами опухолей в костный мозг.

источник
Из гистологических методов исследования в гематологии наиболее часто используются трепанобиопсия костного мозга и биопсия лимфатических узлов.
Основные показания к трепанобиопсии:
1) диагностика хронических миелопролиферативных заболеваний (истинная полицитемия, сублейкемический миелоз, эссенциальная тромбоцитемия), кроме хронического миелолейкоза;
2) диагностика апластической анемии;
3) определение стадии лимфогранулематоза и неходжкинских лимфом (поражение костного мозга — признак IV стадии);
4) спленомегалия неясного генеза (для исключения хронических миелопролиферативных заболеваний).
По показаниям трепанобиопсия может использоваться и в других случаях (определение полноты ремиссии острого лейкоза, диагностика множественной миеломы, выявление характера поражения костного мозга при хроническом лимфолейкозе и др.).
Трепанобиопсия проводится с помощью игл (трепанов) Jamshidi. Биопсию проводят в области задневерхнего бугра правой и/или левой подвздошных костей. Размеры биоптата должны позволить получить гистологические срезы площадью не менее 40 мм2 (2×20 или 3×15 мм). Для гистологического заключения необходим просмотр не менее 5 неповрежденных костномозговых ячеек.
Если большую часть препарата занимает надкостница, кортикальная пластинка губчатой кости и субкортикальные костномозговые ячейки, трепанобиопсию необходимо повторить.
Лучшие результаты обеспечивает фиксация столбика ткани в фиксаторах, содержащих сулему (ценкерформол, В5). Для декальцинации костной ткани применяют насыщенный раствор хелатирующего соединения или кислоты. Возможно использование заливки недекальцинированных трепанобиоптатов в полимеризующиеся смолы.
Обязательна окраска срезов гематоксилин-эозином, азур II-эозином, по Перлсу; для дифференциальной диагностики хронических миелопролиферативных заболеваний необходимо выявление ретикулиновых волокон с помощью импрегнации срезов серебром (по Футу, Гордону-Свиту и др.).
Результаты гистологического исследования костного мозга (трепанобиоптата) должны характеризовать:
1) клеточность;
2) соотношение миелоидного и эритроидного ростков;
3) созревание клеток миелоидного ряда;
4) созревание клеток эритроидного ряда;
5) состояние эозинофильных гранулоцитов и наличие тучных клеток;
6) состояние мегакариоцитарного ростка;
7) присутствие других клеток (лимфоцитов, плазмоцитов, гистиоцитов);
8) стромальные реакции (гранулемы, фиброз, некроз, серозная атрофия жира, отек);
9) наличие и количество гемосидерина;
10) сосудистые нарушения (амилоидоз и др.);
11) изменения костной ткани (остеопороз, болезнь Педжета и др.);
12) наличие метастазов.
Биопсия. Для биопсии пригодны практически все органы и ткани. Проведение операционной биопсии лимфатического узла показано при любой лимфоаденопатии (кроме типичных случаев реактивного лимфаденита). В ряде случаев необходимо проведение пункции внутренних органов (обычно печени, значительно реже — селезенки), которая чаще всего проводится в условиях хирургического стационара.
При диффузном процессе возможна неприцельная биопсия, при очаговом поражении целесообразно ее проведение под контролем УЗИ или компьютерной томографии. В некоторых случаях (изолированное увеличение висцеральных лимфатических узлов, очаговое поражение ребер, позвоночника и др.) получение материала, необходимого для морфологического исследования, возможно только при хирургическом вмешательстве.
Наиболее часто применяется биопсия лимфатических узлов с последующим цитологическим и гистологическим исследованием. Аспирационная биопсия позволяет получить материал, необходимый для диагностики инфекционных поражений лимфатических узлов (методами классической бактериологии) и обнаружения метастазов солидных опухолей.
Для диагностики лимфопролиферативных заболеваний необходима операционная биопсия лимфатического узла с последующим гистологическим и иммуногистохимическим исследованием. Частичное иссечение лимфатического узла (инцизионная биопсия) используется в ситуациях, когда у пациента имеется конгломерат лимфатических узлов. Во всех остальных случаях иссекают лимфатический узел целиком (эксцизионная биопсия).
Биопсию лимфатических узлов головы и шеи при отсутствии противопоказаний проводят под общей анестезией. При генерализованной лимфоаденопатии используют биопсию шейных, надключичных, подмышечных лимфатических узлов. Биопсия паховых лимфатических узлов нежелательна (они нередко несут следы массивной антигенной стимуляции, что затрудняет интерпретацию гистологических изменений).
Для иссечения выбирают наиболее измененный, крупный, глубоко лежащий лимфоузел. Во время операции стараются браншами пинцета захватывать лимфатический узел только за капсулу.
До погружения лимфоузла в фиксирующую жидкость его необходимо острым лезвием рассечь на две части через ворота по малому диаметру. Со свежей поверхности среза каждой части делают мазки-отпечатки для цитологического исследования. Для проводки и заливки кусочки вырезают после того, как рассеченный лимфатический узел профиксируется в течение нескольких часов. Плохая фиксация сильно влияет на размеры ядер клеток и строение гетерохроматина (ядра клеток имеют большие размеры).
Обязательна окраска срезов гематоксилин-эозином, азур II-эозином и применение иммуногистохимических реакций.
источник
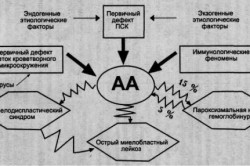
Апластическая анемия – разнородная группа гематологических заболеваний, морфологическим признаком которых является панцитопения в периферической крови и глубокая гипоплазия или аплазия миелоидной ткани. Развитие апластической анемии обусловлено большим числом эндогенных и экзогенных факторов, вызывающих качественные и количественные изменениями со стороны стволовой клетки и ее микроокружения.
Апластическая анемия — достаточно редкое заболевание: его средняя частота в Европе и США составляет 4-6 случаев на 1 миллион жителей в год. Чаще всего апластическая анемия развивается у лиц до 20 и старше 65 лет, что может быть связано с преобладанием этиологической роли вирусов у лиц молодого возраста и химических веществ — у пожилых людей. Свое подтверждение эта гипотеза находит в исследованиях, проведенных в Китае и Юго-Восточной Азии. Эти регионы, где частота апластической анемии в 3-4 раза выше среднемировой, характеризуются широким распространением вирусных заболеваний (в особенности гепатита) и использованием в сельском хозяйстве ядохимикалиев без адекватной защиты.
Причину апластической анемии удается выявить менее, чем у 50% больных. В зависимости от этиологических факторов выделяют: врожденные (наследственные) и приобретенные формы заболевания.
К врожденным формам относятся анемия Фанкони, амегакариоцитарная аплазия и апластическая анемия, развивающаяся у больных с негаматологической патологией (синдром Дауна). В группу приобретенных входят первичная (этиологический фактор неизвестен) и вторичная апластическая анемия, которая может возникать при воздействии ионизирующей радиации, химических веществ (бензин, толуол), при вирусных инфекциях (гепатиты В и С, ВИЧ-инфекция, вирус Эпштейна-Барр, парвовирусы), иммунных заболеваниях (системная красная волчанка, эозинофильный фасциит), тимоме и др.
В основе патогенеза апластической анемии лежит внутренний дефект кроветворной стволовой клетки, приводящий к нарушению ее пролиферации и дифференцировки. В реализации факторов, приводящих к изменению в стволовой клетке, имеют значение состояние кроветворного микроокружения (стромы костного мозга), а также иммунопатологические воздействия, обусловленные внешними и/или внутренними факторами.
Течение апластической анемии различно: в одних случаях заболевание возникает внезапно и быстро приводит к летальному исходу, в других протекает более латентно, особенно у лиц пожилого возраста.
Наиболее распространенной является приобретенная первичная апластическая анемия. При этой форме чаще страдают мужчины в возрасте 18-20 лет. Длительность заболевания до первичного обращения за врачебной помощью составляет в среднем от 1 до 3 месяцев. При отсутствии своевременной диагностики апластическая анемия характеризуется неуклонным прогрессированием.
Клинические проявления заболевания тесно связаны с выраженностью изменений в периферической крови (анемия, лейко- и нейтропения, тромбоцитопения) и включают 3 синдрома: анемический, геморрагический и инфекционных осложнений. Как правило, первые симптомы обусловлены анемией. Часто одновременно развивается геморрагический синдром различной степени выраженности (кровоизлияния на коже по петехиально-пятнистому типу, носовые, десневые, в более тяжелых случаях — маточные и желудочно-кишечные кровотечения, кровоизлияния в сетчатку и головной мозг). Иногда геморрагический синдром в начале заболевания настолько выражен, что дает повод к ошибочному диагнозу (это более характерно для редкой формы апластической анемии — амегакариоцитарной аплазии). Синдром инфекционных осложнений в начале заболевания возникает редко (при клинически раритетной форме апластической анемии, характеризующейся преимущественным угнетением нейтропоэза). При прогрессировании заболевания инфекционные осложнения (язвенно-некротическое поражение полости рта, миндалин, пневмония, сепсис и др.) доминируют в клинической картине и, наряду с геморрагическим синдромом, являются одной из основных причин летальных исходов.
В некоторых случаях апластическая анемия проявляется одноростковой цитопенией с соответствующей клинической симптоматикой (чаще — парциальная красноклеточная аплазия, реже — амегакариоцитарная аплазия или угнетение нейтропоэза).
При объективном исследовании больных обращает внимание мраморная бледность кожи и видимых слизистых оболочек. Увеличения селезенки, печени и лимфатических узлов не отмечается; более того, наличие органомегалии и лимфоаденопатии исключает апластическую анемию).
Диагностика апластической анемии основывается на лабораторных показателях (анализ периферической крови) и результатах морфологического исследования костного мозга.
Клинический анализ крови. У 80% больных выявляется трехростковая цитопения: гемоглобин ниже 100 г/л, нейтрофилов менее 1,5х10 9 /л, тромбоцитов менее 100,0х10 9 /л. Анемия, как правило, носит нормо- или гиперхромный характер с выраженным анизоцитозом. Важным является показатель абсолютного количества ретикулоцитов: при апластической анемии у 2/3 больных отмечается ретикулоцитопения.
Исследование миелограммы. Апластическая анемия является абсолютным показанием для стернальной пункции. Чаще всего в аспирате костного мозга выявляется снижение клеточности (уменьшение содержания миелокариоцитов) с угнетением всех ростков гемопоэза, относительный лимфоцитоз, умеренная плазмоцитарная реакция. В связи с тем, что поражение костного мозга развивается неравномерно, зоны аплазии чередуются с участками кроветворного костного мозга. В этой связи для окончательного подтверждения диагноза необходимо проведение трепанобиопсии.
Трепанобиопсия костного мозга — основной метод, позволяющий поставить подтвердить диагноз апластической анемии. При тяжелой АА в трепанобиоптате практически весь объем межбалочных пространств заполнен жировой тканью, среди клеток которой встречаются рассеянные лимфоциты, плазматические клетки, единичные тучные клетки и макрофаги с цитоплазмой, содержащей гемосидерин. При гипоплазии миелоидной ткани, которая может быть начальной фазой заболевания, на фоне жировой ткани сохраняются небольшие скопления клеток эритроидного и гранулоцитарного ростков. Мегакариоциты обычно не обнаруживаются, даже если другие ростки кроветворной ткани более или менее сохранены.
Биохимические исследования. Выполнение этих тестов не связано с диагностикой апластической анемии, но необходимо для проведения дифференциального диагноза с другими анемиями (исследование содержания сывороточного железа, свободного билирубина, свободного гемоглобина плазмы), оценки функции печени (если имеются анамнестические данные о гепатите) и почек (для контроля их функцией на фоне лечения).
Иммунологические исследования. Необходимо определение группы крови и резус-фактора, а также совместимости с донором по системе HLA для подбора компонентов крови и костного мозга (при подготовке к миелотрансплантации).
Вирусологические исследования. Обязательным является определение наличия или отсутствия антител к цитомегаловирусу (CMV). Это связано с тем, что больные, не имеющие антител к CMV, должны получать CMV-отрицательные компоненты крови. Кроме того, необходимо проведение исследований на вирусы гепатита A, B, C и ВИЧ-инфекцию.
Рентгенологические исследования. Рентгенография грудной клетки и придаточных пазух необходимы для определения очагов возможной инфекции, а также для динамического контроля при ее возникновении. У больных молодого возраста необходимо проведение рентгенологических исследований костей предплечий и кистей рук для исключения анемии Фанкони.
Ультразвуковая томография. Ультразвуковое исследование органов брюшной полости в первую очередь показано детям и больным молодого возраста для выявления аномалий развития почек, которые характерны для анемии Фанкони. Выявление при ультразвуковом исследовании увеличения селезенки и печени противоречит диагнозу апластической анемии.
Цитогенетические исследования. Цитогенетические исследования необходимы для исключения анемии Фанкони, миелодиспластического синдрома и острого лейкоза, которые характеризуются цитогенетическими аномалиями.
В соответствии с показателями периферической крови и данными трепанобиопсии выделяют следующие формы апластической анемии.
Тяжелая апластическая анемия.
Периферическая кровь (сочетание не менее двух из трех критериев): а)нейтрофилы 0,5-0,2х10 9 /л; б)тромбоциты 9 /л; в)ретикулоциты 9 /л.
Апластическая анемия средней степени тяжести: те же данные трепанобиопсии при уровне нейтрофилов более 0,5х10 9 /л, тромбоцитов более 20,0х10 9 /л и ретикулоцитов — более 1% (не менее двух из трех критериев).
При наиболее часто встречающейся приобретенной апластической анемии необходимо проводить дифференциальную диагностику с острым лейкозом, миелодиспластическим синдромом, В12–дефицитной анемией и анемией Фанкони.
Острый лейкоз в некоторых случаях проявляется различными вариантами цитопений (моно-, би- или панцитопения) без бластоза периферической крови. Поставить диагноз острого лейкоза помогают клинические данные (частая органомегалия), результаты стернальной пункции, трепанобиопсии, а также наличие цитогенетических аномалий.
Миелодиспластический синдром. Наблюдающееся у некоторых больных апластической анемией сочетание панцитопении, макроцитоза и гиперплазии эритроидного ростка в миелограмме может вызвать подозрение на миелодиспластический синдром. Постановке диагноза миелодиспластического синдрома способствуют данные трепанобиопсии (отсутствие аплазии костного мозга) и результаты цитогенетического исследования (наличие различных хромосомных аномалия).
В12 – дефицитная анемия. Во многих случаях это заболевание сопровождается развитием умеренно выраженной панцитопении в периферической крови, однако клинические (отсутствие геморрагического синдрома и инфекционных осложнений, нередкое поражение желудочно-кишечного тракта и нервной системы) и лабораторно-инструментальные данные (в периферической крови — макро- и мегалоцитоз, гигантские гиперсегментированные нейтрофилы; в миелограмме — мегалобластический тип кроветворения; результаты трепанобиопсии) позволяют верифицировать диагноз В12 – дефицитной анемии.
Анемию Фанкони необходимо исключать у детей в возрасте от 5 до 12 лет. Первый ее тип (классический тип Фанкони) характеризуется наличием грубых пороков развития скелета и внутренних органов (аномалии почек, мочеточников, половых органов, пороки сердца). Второй тип заболевания проявляется малыми аномалиями развития скелета, участками гиперпигментации кожи, задержкой роста больных. Гематологические признаки заболевания проявляются анемией и тромбоцитопенией с развитием геморрагического синдрома. Одновременно с этим развивается повышенная наклонность к инфекциям. В миелограмме количество миелокариоцитов нормальное за счет увеличения содержания клеток эритроидного ряда, выявляется повышенный уровень тучных клеток. Типично значительное увеличение содержания фетального гемоглобина. У половины больных в моче отмечается повышение уровня аминокислот, особенно пролина.
При апластической анемии терапия должна начинаться немедленно после постановки диагноза. Выделяют 4 группы методов: 1)направленные на восстановление костного мозга; 2)заместительная терапия компонентами крови; 3)профилактика и лечение инфекционных осложнений; 4)дополнительные методы лечения.
I Лечение, направленное на восстановление костного мозга включает иммуносупрессивную терапию и миелотрансплантацию.
А. Иммуносупрессивная терапия проводится одним из следующих препаратов.
1.Антилимфоцитарный (АЛГ) или антитимоцитарный глобулин (АТГ) — наиболее распространенный метод лечения больных апластической анемией при невозможности проведения трансплантации костного мозга. Оба препарата относятся к классу иммуносупрессантов. АЛГ назначается в дозе 15 мг/кг/сут в виде 8-12 часовой внутривенной инфузии ежедневно в течение 8 -10 дней; АТГ — в дозе 0,75 мг/кг/сутки, 4-5 часовой внутривенной инфузией, ежедневно в течение 8 -10 дней.
2. Циклоспорин А (сандиммун) относится к иммунодепрессантам. Механизм действия связан со специфическим и обратимым влиянием на геном стволовой клетки и торможением апоптоза. Показан при тяжелой апластической анемии, рефрактерной к терапии АЛГ или АТГ (как самостоятельный метод или в сочетании с АЛГ), а также при повышенной чувствительности к АЛГ. Препарат применяется в дозе 5-10 мг/кг/сутки в два приема. Продолжительность курса должна составлять не менее 3 месяцев (в среднем 6-12 месяцев).
3. Высокие дозы метилпреднизолона — альтернативный метод иммуносупрессивной терапии при тяжелой апластической анемии. Препарат вводится внутривенно болюсом в дозе 0,5- 1,0 г/сутки в течение 5 дней. Результаты терапии сопоставимы с терапией AЛГ/АТГ, однако высокая частота трудно контролируемого тяжелого сахарного диабета, артериальная гипертензия и инфекционные осложнения не всегда дают возможность использовать этот метод лечения.
Б. Трансплантация аллогенного костного мозга — единственный радикальный метод лечения тяжелой и очень тяжелой апластической анемии. При наличии гистосовместимого донора и отсутствии противопоказаний аллогенная миелотрансплантация должна быть проведена как можно раньше, а гемотрансфузии исключены или сведены к минимуму с целью снижения риска передачи цитомегаловирусной инфекции, гепатита В и С, а также аллосенсибилизации.
II. Заместительная терапия компонентами крови.
Показанием для переливания эритроцитов является снижение гемоглобина ниже 80 г/л и гематокрита 30%, а у лиц пожилого возраста и при наличии заболеваний сердечно-сосудистой системы — концентрация гемоглобина менее 90 г/л. С целью уменьшения аллоиммунизации предпочтительнее переливать отмытые эритроциты.
Трансфузии тромбоцитов проводятся при наличии признаков кровотечения (мелена, гематурия, кровохарканье) или кровоизлиянии в жизненно важные органы и сетчатку глаза при их уровне менее 50 х 10 9 /л. При количестве тромбоцитов ниже 20 х 10 9 /л необходимы профилактические трансфузии тромбоконцентрата 2 — 3 раза в неделю.
Несмотря на гранулоцитопению, переливания гранулоцитарной массы при апластической анемии не показаны. Это обусловлено как неэффективностью данной процедуры (после трансфузии гранулоциты находятся в циркуляции не более нескольких часов), так и высокой вероятностью развития тяжелых посттрансфузионных осложнений и аллосенсибилизации.
III. Профилактика и лечение инфекционных осложнений.
У больных апластической анемией имеется повышенный риск развития инфекционных осложнений. Вероятность развития системной или местной инфекции определяется уровнем гранулоцитов, в связи с чем выделяют группы пациентов с высоким (гранулоцитов менее 0,2х10 9 /л), умеренным (гранулоцитов от 0,2х10 9 /л до 0,5х10 9 /л) и низким риском (гранулоцитов более 0,5х10 9 /л). Больные с низким риском возникновения инфекционных осложнений не нуждаются в специальном режиме и терапии. При умеренном и высоком риске инфекции пациенты переводятся в асептические палаты, им проводится обработка кожи и полости рта дезинфицирующими растворами (хлоргексидин) и деконтаминация кишечника (неабсорбируемые антибиотики и противогрибковые препараты per os). Из пищи должны быть исключены продукты, не подвергшиеся термической обработке, а внутримышечные и подкожные инъекции — сведены к минимуму для уменьшения риска подкожных кровоизлияний и местных воспалительных процессов. Такие же мероприятия должны проводиться и у всех пациентов получающих иммуносупрессивную терапию.
Возбудителями инфекционных осложнений у больных без центральных катетеров и дренажей чаще всего является грамположительная флора, а при наличии центрального катетера — грамотрицательная.
При возникновении лихорадки у больного апластической анемией и агранулоцитозом (гранулоцитов менее 0,5х10 9 /л) показано проведение эмпирической антибактериальной терапии препаратами широкого спектра. Стандартной является комбинация аминогликозидов и цефалоспоринов III-IV поколения. Если лихорадка не купируется в течение 48 часов, даже при отсутствие микробиологического подтверждения, назначаются антистафилококковые антибиотики (ванкомицин). После купирования выявленных инфекционных осложнений и нормализации температуры антибиотики отменяются не ранее, чем через 5-7 дней. Если лихорадка возобновляется после отмены антибиотиков, высока вероятность грибковой инфекции (чаще всего вызванная грибами родов Candida и Aspergillus), в связи с чем необходимо назначение противогрибковых препаратов (амфотерицин В). Лечение грибковой инфекции проводится в течение длительного времени, а полное ее купирование даже при адекватной терапии происходит только после восстановления уровня гранулоцитов.
IV. Дополнительные методы лечения.
Андрогенные стероиды используют для стимуляции эритропоэза у пациентов, нуждающихся в постоянных трансфузиях эритроцитарной массы. Обычно применяются анаболические стероиды (оксиметанолон в дозе 200-300 мг/сутки в течение 2-3 месяцев).
Колониестимулирующие факторы (гранулоцитарный, гранулоцитарно-макрофагальный) могут назначаться с целью повышения уровня гранулоцитов у пациентов, имеющих резерв миелоидной ткани (уровень нейтрофилов более 0,5х10 9 /л). Среди других факторов роста перспективно использование интерлейкина-3, который повышает уровень нейтрофилов, а в ряде случаев также число ретикулоцитов и тромбоцитов.
Спленэктомия является дополнительным методом лечения и используется при отсутствии длительного эффекта от гемотрансфузионной терапии, в особенности при сохраняющейся тромбоцитопении.
Оценка эффективности лечения.
Полная ремиссия: гемоглобин выше 100 г/л, нейтрофилы выше 1,0х10 9 /л, тромбоциты выше 100,0х10 9 /л; больные не нуждаются в гемотрансфузиях.
Частичная ремиссия: гемоглобин более 80 г/л, нейтрофилы более 0,5х10 9 /л, тромбоциты более 20,0х10 9 /л; больные не нуждаются в гемотрансфузиях.
Клинико-гематологическое улучшение: улучшение гематологических показателей и уменьшение потребности в заместительной гемотрансфузионной терапии более чем на 2 месяца.
Отсутствие эффекта на терапию: отсутствие улучшения гематологических показателей, сохранение зависимости от гемотрансфузионной терапии.
После трансплантации аллогенного костного мозга полная ремиссия достигается у 50-80%, при иммуносупрессивной терапии — у 40-50% больных с тяжелой апластической анемией. После иммуносупрессивной терапии восстановление функции костного мозга происходит медленно, у ряда пациентов в различные сроки после лечения развивается рецидив заболевания.
Апластическая анемия (АА) – разнородная группа гематологических заболеваний, морфологическим признаком которых является панцитопения в периферической крови и глубокая гипоплазия или аплазия миелоидной ткани.
-анемический синдром(одышка при физических нагрузках, сердцебиения);
-геморрагический синдром – кожные и слизистые геморрагии, носовые, десневые, маточные кровотечения;
-синдром инфекционных осложнений – частые и тяжелые инфекции (язвенное поражение слизистых оболочек полости рта, миндалин, пневмонии, сепсис);
— отсутствуют увеличение лимфатических узлов, печени и селезегки.
-периферическая кровь – панцитопения (анемия, лейкопения, тромбоцитопения) и ретикулоцитопения;
-миелограмма — снижение общего количества миелокариоцитов, сужение всех ростков гемопоэза;
-трепанобиопсия – гипоплазия или аплазия миелоидной ткани;
-цитогенетические исследования –отсутствие цитогенетических аномалий;
Лечение: иммуносупрессивная терапия (антилимфоцитарный/антитимоцитарный глобулин, сандиммун, высокие дозы метилпреднизолона), аллогенная трансплантация костного мозга, поддерживающая терапия компонентами крови (эритроциты, тромбоциты), антибактериальная терапия.
источник