Заболевания человека для качественного лечения должны быть правильно диагностированы. Современные технологии позволяют сделать это довольно быстро, а методики – избежать ненужных затрат времени и ресурсов. Например, диф. диагностика анемий использует метод исключения для выяснения причины проблемы, чтобы уточнить ее и конкретизировать при помощи специальных анализов и исследований.
О связи «гемоглобин – железо» все узнают еще на уроках анатомии в средних классах школы. Именно она, одна из основ эритроцитов, являющихся компонентом крови – жидкой соединительной ткани организма человека. Кровь циркулирует по замкнутой системе сосудов начиная от крупных аорт и вен до мельчайших капилляров, пронизывающих практических все органы и ткани. Структура самой крови не так уж и сложна. В жидкой плазме находятся взвешенные компоненты:
Именно в эритроцитах находится гемоглобин, придающий крови красный цвет за счет содержания в своем составе атома железа.
Терапевтический анализ – диф. диагностика железодефицитной анемии – помогает специалисту установить причину, по которой снижается уровень гемоглобина. От верно проведенного анализа зависит адекватность диагноза и направление лечения. Одно из патологических состояний состава крови – анемия.
Анемия имеет народное название, точно отражающее суть этого симптома многих заболеваний и состояний – малокровие. Причем подразумевается под ним не количественный показатель объема самой жидкости, а уровень гемоглобина. Анемия не является самостоятельным заболеванием, так как она симптом определенного вида патологии. Причем проблема может быть как в самой системе образования и транспорта крови, так и в работе, скажем так, сторонних органов. Здесь возникает одна серьезная проблема: классическая нозология для анемии – неподходящий способ определения. Но для видов анемий характерен один важный признак – уменьшение количества гемоглобина, связанного чаще всего с сокращением числа эритроцитов. Здесь ярко прослеживается зависимость гемоглобин–железо, так как в некоторых случаях анемия выявляется именно как железодефицитная. В других же случаях гемоглобин падает не только из-за сокращения железа в крови, об этом подробнее расскажем ниже.
Итак: дифференциальная диагностика анемий у детей и взрослых ставит своей целью выявить причину такой проблемы со здоровьем, как анемия.
Художественные произведения знакомят читателей, зрителей, слушателей со всеми сторонами жизнедеятельности человека, подчас очень далекими и малопонятными. Например, один из популярных сериалов «Доктор Хаус» интересно и ярко поясняет работу врача-диагноста. Причем метод дифференциальной диагностики у героев фильма – основной принцип работы.
Постановка верного диагноза – залог максимально качественного лечения в каждой конкретной ситуации. Для этого специалистами используется множество способов, методов и методик. Патологические состояния, такие, к примеру, как недостаточность гемоглобина, также остро нуждается в адекватной установке этиологии. Одним из качественных способов в этом случае является диф. диагностика анемий. Гипотеза, выдвигаемая специалистом, оценивается на рациональность, подтверждается или отвергается наблюдениями и анализами, что позволяет качественно вычислить причину патологического состояния пациента.
Сама методика отделения (дифференцирование) – действенная для диагностики многих патологических состояний, когда один симптом или симптомокомплекс может быть свидетелем большого количества проблем со здоровьем пациента. Например, дифференциальная диагностика железодефицитных анемий позволяет максимально точно исключить какие-либо другие виды недостаточности гемоглобина, что помогает в кратчайшие сроки назначить необходимые обследования для конкретизации заболевания и назначения качественной терапии.
Диф. диагностика анемий – не единственный метод поиска причины патологии. Любое заболевание при исследовании у конкретного пациента проходит несколько ступеней. Для недостаточности гемоглобина крови врач должен провести следующие этапы:
- диагностика синдрома, которая позволит определить патогенетический вариант;
- диагностика нозологии патологии, необходимая для выявления основы проблемы в виде заболевания или патологического процесса какого-либо органа или системы.
На этом этапе используется клинический анализ крови, который служит источником выявления самой проблемы анемии и ее уровня. На этом же этапе проводится исследование состава крови по ее компонентам – железа, трансферринов и ферритина. При необходимости при помощи трепанобиопсии или стернальной пункции – современных методов забора исследуемого биоматериала – берется на анализ костный мозг. При помощи таких исследований проводится диф. диагностика железодефицитной анемии и В12-анемии, позволяющая конкретизировать проблему для качественного поиска ее решения.
Специалистами выработаны определенные современные методики качественной диагностики проблемы состояния здоровья у каждого пациента. Суть дифференциальной диагностики анемий состоит в последовательном исключении неподходящих вариантов проблемы, приводящее таким образом, к конкретному и правильному решению, а, значит, к подбору адекватной случаю терапии.
Какие же лабораторные исследования помогают установить диагноз? Следует сразу же сказать, что для проведения анализов используются современные аппараты и методы, что позволяет получить максимально точный результат.
- гематокрит (H tc);
- гемоглобин (Hb);
- группу крови и резус-фактор;
- лейкоциты (Le);
- количество эритроцитов (Er);
- средний объем эритроцитов (MCV);
- среднюю концентрацию гемоглобина (Hb) в эритроцитах (MCHC);
- среднее содержание гемоглобина (Hb) в одном эритроците (MCH);
- ретикулоциты (Rtc);
- скорость оседания эритроцитов (СОЭ);
- тромбоциты (Tr);
- цветовой показатель (ЦП).
Мазки крови, рассматриваемые под микроскопом, дают возможность определить есть ли в исследуемом образце клетки крови аномальных форм.
При исследовании таких компонентов крови, как плазма и сыворотка, определяются:
- билирубин;
- белки крови;
- концентрация железа;
- креатинин;
- лактатдегидрогеназа;
- мочевина;
- общая железосвязывающая способность сывортки (ОЖСС);
- трансаминазы;
- ферритин;
- щелочная фосфатаза.
Также для постановки диагноза пациенту назначается:
- анализ мочи, определяющий цвет, уровень кислотности рН, прозрачность, удельный вес, наличие белка, уробилина, эритроцитов, состав осадка;
- анализ кала на яйца глист, цвет, консистенцию, оккультные кровотечения.
Исследования костного мозга проводятся двумя методами:
- стернальная пункция проводится для определения цитоза, соотношения эритроидных и миелоидных клеток, морфологического исследования клеток;
- трепанобиопсия показывает клеточность костного мозга, морфологическое строение клеток.
Дифференциальная диагностика гипохромных анемий, впрочем, так же, как и абсолютного большинства других проблем, связанных с составом крови, использует не только выше перечисленные, но и другие, более подробные и узконаправленные обследования.
Алгоритм дифференциальной диагностики анемий разработан для качественной и быстрой диагностики вида патологии крови, имеющегося у пациента. На первой стадии определяется тип анемии в соответствии с уровнем среднего объема эритроцитов:
- микроцитарная (+\- гипохромная; MCV 100 fl).
Аббревиатура fl обозначает фемтолитр, равный мкм 2 . Этот показатель довольно условен для характеристики анемии и лишь подсказывает диагносту, в какую сторону следует идти далее в поиске источника болезни.
Следующий этап – вычленение особенностей конкретного типа анемии. Они будут таковы.
Для микроцитарной анемии характерен дефицит железа или из-за сокращения его запасов, или как увеличение количества потребляемого элемента. Здесь уже специалист будет искать показатели таких состояний, как:
- хроническая железодефицитная анемия;
- анемия хронических заболеваний;
- талассемия – наследственное заболевание, характеризующееся снижением выработки одного из компонентов гемоглобина – полипептидных цепей;
- другие микроцитарные гипохромные анемии.
Нормоцитарную анемию далее дифференцируют по активности эритропоэза – увеличен он или снижен. В зависимости от полученного результата вычленяются:
- при пониженном эритропоэзе – гемолиз, что говорит о гемолитической форме анемии, и кровопотеря, требующая поиска источника кровотечения;
- повышенный эритропоэз служит свидетельством или болезни самого костного мозга или же заболевания какого-либо органа, участвующего в системе кровообращения – печень, почки, эндокринные патологии.
При установлении макроцитарной анемии следующий этап – различение по мегалобластам:
- наличие этих образований подразумевает мегалобластную анемию, которая может быть активирована недостатком фолиевой кислоты или витамина В12, а также действием токсинов, лекарственных препаратов, оказывающих воздействие на синтез ДНК;
- если в анализе мегалобласты не обнаружены, то речь идет о немегалобластной анемии, которая может быть вызвана алкоголизмом, болезнями печени, гипотиреозом, хронической обструктивной болезнью легких (ХОБЛ) или же миелодиспластическим синдромом.
Диф. диагностика анемий в таблице будет выглядеть вот так:
Диф. диагностика анемий у детей и взрослых начинается с определения ее наличия как таковой. Ведь недостаточность гемоглобина – симптом многих патологических состояний организма и может быть вызван комплексом проблем. Одной из наиболее распространенных форм патологий крови является недостаток железа. Диф. диагностика железодефицитной анемии позволяет выяснить причину, по которой в красных кровяных тельцах нарушен синтез гема – железосодержащего пигмента. Ими могут являться:
- хронические кровопотери – желудочно-кишечные, маточные кровотечения, онкологические опухоли органов желудочно-кишечного тракта и мочевыводящей системы, гемосидероз легкого, геморрагический диатез различной этиологии, пароксизмальная ночная гемоглобинурия;
- повышенная потребность в железе, наблюдающаяся во время беременности, периода лактации, в младенческом возрасте, а также при ювенильном хлорозе;
- недостаток железа, поступаемого с пищей, что происходит при гастродуодените, гастрэктомии, инфекционных поражениях кишечника, а также может наблюдаться при определенных системах питания – вегетарианстве, голодании;
- нарушение транспорта железа, характеризующимся малым количеством или низкой функциональной активностью трансферрина.
Для проведения качественной диагностики метод дифференцирования является одним из наиболее эффективных и качественных. При постановке диагноза, касающегося железодефицитной анемии, специалист в первую очередь учитывает, что именно такой вид анемии является гипохромным в любом случае, но в то же время выявленная изначально гипохромная анемия может и не быть железодефицитной. И поэтому именно для такого диагноза, как гиперхромная анемия, диагностика требует тщательного различения, то есть дифференцирования. В этих целях используется мазок крови, рассматриваемый под микроскопом, и определение свободного эритроцитарного протопорфирина (норма 2,7-9,0 мкмоль/л). Мазок крови на стекле позволяет наблюдать базофильную пунктацию в эритроцитах. При железодефицитной анемии зернистость будет выглядеть мягкой, а вот при отравлении свинцом, к примеру, она более крупная и четкая.
Талассемия, являясь наследственной, также относится к гипохромной гемолитической анемии, проявляется она нарушением синтеза гемоглобина. В этом случае дифференцированию помогают семейный анамнез, определение фракций гемоглобина и признаки гемолиза. Отделить талассемию от железодефицитной анемии помогает и определение показателя RDW (показатель анизоцитоза эритроцитов). В случае если у пациента талассемия, то он будет нормальным, если человек страдает от железодефицитной формы малокровия то этот уровень будет повышенным.
Дифференциальная диагностика некоторых дефицитных анемий использует анализ на определение уровня рецепторов сывороточного трансферрина и уровня ферритина. Если он нормален на фоне недостатка гема, то речь идет об анемиях хронических заболеваний.
Еще один тип анемий – так называемая В12-дефицитная анемия. Этот тип проблемы входит в группу мегалобластных анемий, основанных на нарушении синтеза ДНК и РНК. Основа развития этой анемии – дефицит кобаламина (витамина В12). Его определением занимается дифференциальная диагностика анемий. Причины появления данной проблемы следующие:
- атрофический гастрит при отсутствии внутреннего фактора и с нарушением всасывания В12;
- вегетарианство с недостаточным поступлением В12 с пищей;
- гастрэктомия или резекция тонкой кишки;
- гельминтозы (широкий лентец);
- злокачественная опухоль фундального отдела желудка;
- множественный дивертикулез с чрезмерным развитием микрофлоры кишечника;
- энтериты с нарушением всасывания.
В данном случае диф, диагностика анемий основной целью преследует отделение от заболеваний, при которых характерен мегалобластный тип кроветворения, а также от анемий с синдромами панцитопении и гемолиза. Она проводится с использованием следующих клинически значимых анализов:
- анализ крови общий для определения количества эритроцитов, их диаметра и объема, цветового показателя, уровня гемоглобина, количества лейкоцитов, ретикулоцитов, тромбоцитов, лейкоцитарной формулы, а также скорости оседания эритроцитов;
- анализ мочи общий;
- анализ крови биохимический, который определяет содержание общего белка и белковых фракций, аминотрансфераз и билирубина;
- содержания в крови витамина В12 и фолиевой кислоты;
- ультразвуковая диагностика внутренних органов – печени, почек, поджелудочной железы, селезенки, желчного пузыря, почек;
- фиброгастродуоденоскопия;
- фиброколоноскопия.
Для уточнения диагноза В12-дефицитная анемия пациенту назначается стернальная пункция.
Дифференциальная диагностика железодефицитных анемий позволяет провести очень подробное определение состояния здоровья организма человека в целом. Довольно часто помимо непосредственно недостаточности железа в крови человека, выявляются и другие формы анемии. К примеру, фолиеводефицитная анемия, характерным признаком которой является дефицит фолатов. Это заболевание относится к группе мегалобластных анемий, и болеют им в основном люди молодого и среднего возраста. Как ясно из названия проблемы, недостаток фолиевой кислоты в пище, недостаточное продуцирование этого элемента в самом организме человека, является основой столь серьезной проблемы. Специалистами отмечено, что диф. диагностика анемий, вызванных недостаточностью витамина В12 и фолиевой кислоты, имеет одинаковые алгоритмы проведения. Основной методики определения количества именно фолатов в крови, позволяющей поставить верный диагноз, на данный момент нет. Но эти два вида проблемы крови зачастую идут вместе. Это так называемая сочетанная анемия, имеющая много общих проявлений и путей лечения.
В особую группу врачи выделяют заболевания, связанные с врожденной или приобретенной патологией крови, выражающейся усиленным распадом эритроцитов, а также их более короткой жизнью. Диф. диагностика анемий начинает анализ с общего состояния больного, так как его самочувствие напрямую зависит от снижения кислородсвязывающей способности крови, а также присутствием в организме продуктов распада эритроцитов. Поэтому человек постоянно ощущает слабость, головокружение, сердцебиение, озноб, лихорадку. Из-за того, что в плазме может находиться довольно большое количество свободного гемоглобина, то моча может окрашиваться в красный цвет – от светло-розового до почти черного – так как развивается гемоглобинурия.
Абсолютным показателем данного типа анемий при дифференцированной диагностике служит сокращенный период жизни эритроцитов, определяемый в результате проведения радиоизотопного исследования. К сожалению, данная методика относится к дорогостоящим обследованиям и применяется в редких случаях. Дифференцированная диагностика использует более доступный комплекс следующих наблюдений и исследований:
- гаптоглобин в сыворотке крови присутствует в недостаточном количестве из-за связывания со свободным гемоглобином;
- гемосидеринурия – как свидетельство превышения порога фильтрации через почечные клубочки свободного гемоглобина плазмы;
- гемоглобинурия;
- желтуха, как проявление повышенного количества свободного или «непрямого» билирубина в сыворотке крови;
- наличие антиэритроцитарных антител в результате серологической диагностики – как важного этапа установления нозологического диагноза (также этот анализ является основой дифференциального диагностирования приобретенных аутоиммунных гемолитических анемий (АИГА);
- повышенный уровень эритрокариоцитов в костном мозге (более 20-24%) –эритроидная гиперплазия костного мозга;
- ретикулов (незрелых эритроцитов) обнаруживается больше 2%;
- установленное клинически понижение уровня гемоглобина.
Анемии – серьезный симптом нарушений в работе тех или иных органов или систем организма человека. И чтобы правильно выяснить причину развития малокровия необходимо провести тщательное обследование. Метод дифференциальной диагностики позволяет довольно быстро, но в тоже время правильно установить причину, по которой появилась данная проблема. Это позволяет получить адекватное ситуации лечение.
источник
Н.И. Стуклов, Е.Н. Семенова
ФГБОУ ВПО Российский университет дружбы народов, Москва
Рассмотрен современный взгляд на проблему железодефицитной анемии (ЖДА) с точки зрения эпидемиологии, этиологии, патогенеза. Описаны известные в настоящее время механизмы регуляции обмена железа, приведены наиболее важные данные литературы и результаты собственных исследований. Основываясь на рекомендациях по лечению больных ЖДА, авторы представляют описанный в литературе и собственный клинический опыт использования железосодержащих препаратов и рассматривают полученные результаты. В рамках статьи авторы объясняют механизмы низкой эффективности лечения при ЖДА и предлагают способы решения проблемы с учетом опубликованных в литературе последних научных исследований.
Ключевые слова: анемия; обмен железа; сидеропенический синдром; лечение железодефицитной анемии.
N.I. Stuklov, E.N. Semenova
Russian University of People’s Friendship, Moscow, Russia
Modern views of epidemiology, etiology and pathogenesis of iron deficiency anemia are considered. Mechanisms of iron metabolism regulation are described based on the most important literature data and the results of the authors ’ research. The authors present their own and literature clinical experience of using iron-containing drugs with reference to the existing recommendations on the treatment of iron deficiency anemia. Causes of low treatment efficiency are discussed and the ways to address this problem are proposed based on the published results of clinical research.
Key words: anemia; iron metabolism; sideropenic syndrome; treatment of iron deficiency anemia.
Анемии (греч. αναιμια — бескровие) определяются как ряд клинических состояний, связанных со снижением уровня гемоглобина менее 120 г/л у женщин и менее 130 г/л у мужчин; (ВОЗ, 2001) и (или) гематокрита ( менее 36,4% соответственно), что обусловлено уменьшением количества эритроцитов или содержания гемоглобина в них [1]. В настоящее время железодефицитная анемия (ЖДА) является самым распространенным состоянием, связанным со снижением уровня гемоглобина, поэтому ее признают государственной проблемой более чем в 100 странах мира, где разрабатываются программы, направленные на профилактику и снижение заболеваемости. ЖДА чаще выявляется у представителей наиболее социально значимых и незащищенных слоев населения — у женщин детородного возраста и детей. Количество больных анемией в указанных группах, по данным ВОЗ (2001), превышает 1 млрд [2]. В итоге ЖДА является причиной роста материнской и детской смертности [3].
Регуляция обмена железа.
Ежедневно организму для нормальной жизнедеятельности требуется 20—25 мг железа, причем экзогенного железа необходимо только 1— 2 мг: женщинам — 2 мг (из-за физиологической кровопотери), а мужчинам — 1—1,5 мг. Около 20 мг железа поступает из «старых» разрушенных эритроцитов, столько же расходуется на синтез нового гемоглобина.
Железо накапливается в органах ретикулоэндотелиальной системы (до 500 мг), остальные запасы железа на 70% сосредоточены в гемоглобине, что и обусловливает развитие ЖДА при хронической кровопотере (рис. 1).
Рис. 1. Схема обмена железа.
Всасывание железа происходит в верхних отделах тонкой кишки, причем этот процесс требует участия множества белков. В основном до 70—80% железа усваивается в двухвалентном состоянии (гемовое железо, содержащееся в основном в мясе, меньше — в печени и рыбе). При поступлении в кишечник растительного трехвалентного железа с помощью медьзависимой ферроредуктазы на апикальной мембране энтероцитов или под действием витамина С оно восстанавливается до двухвалентного. Двухвалентное железо через марганецзависимые белки — транспортеры двухвалентных металлов (ДМТ — двухвалентный металлотранспортер) поступает в энтероцит, а затем через белок ферропортин на базальной мембране — в кровь, где с помощью медьзависимых феррооксидаз (гефестина, расположенного на базальной мембране и связанного с ферропортином, и церулоплазмина, находящегося в плазме) окисляется до трехвалентного состояния, чтобы связаться с транспортным белком — трансферрином (рис. 2). Только очень незначительная часть железа, образуя комплекс с муцином, может поступить в энтероциты путем пиноцитоза [4, 5].
Рис. 2. Схема регуляции обмена железа.
Универсальным регулятором метаболизма железа является гепцидин [6—9], который блокирует транспорт железа, причем этот механизм реализуется с помощью регуляции активности белка ферропортина, т.е. путем воздействия на высвобождение железа из клеток кишечника и макрофагов ретикулоэндотелиальной системы [10—13]. Увеличение количества железа в организме ведет к стимуляции синтеза гепцидина, что уменьшает абсорбцию железа в кишечнике и его транспорт в циркуляцию. В свою очередь уменьшение абсорбции железа в кишечнике ведет к угнетению синтеза гепцидина в печени и по обратной связи — к восстановлению захвата железа из пищи и кишечника (см. рис. 2) [14—18]. Помимо железорегуляторной функции, гепцидин оказывает выраженное бактерицидное действие, является белком воспаления, его уровень повышается при инфекционных, воспалительных, опухолевых заболеваниях, блокируя выход железа в кровь [6]. Такой эффект гепцидина отрицательно влияет на рост бактерий, опухолей, блокирует избыточный воспалительный процесс. В работе, проведенной в 2011 г. [19], доказана роль гепцидина как основного фактора развития ЖДА у женщин с гинекологическими заболеваниями без патологической кровопотери. Показатели гепцидина в указанной группе составили 108,75 ± 40,08 нг/л (референсные значения 60— 85 нг/л), что обусловило резкое уменьшение содержания ферропортина — 0,43 ± 0,21 нг/л (референсные значения 3,1 ± 0,2 нг/л) и привело к нарушению поступления железа из кишечника в кровь [19].
Железо, которое остается внутри клеток, депонируется в виде ферритина, количество которого в крови прямо пропорционально содержанию железа в депо [20].
Клиническая картина и диагностические критерии.
Дефицит железа приводит к нарушению синтеза гемоглобина в эритрокариоцитах костного мозга, уменьшению содержания миоглобина в мышцах, активности цитохромов и каталаз в митохондриях клеток, миелопероксидазы в нейтрофилах [21—23].
В настоящее время выделяют несколько этапов развития дефицита железа [5, 24].
1. Предрасположенность к развитию дефицита железа (вегетарианство, подростковый возраст в сочетании с нарушением менструального цикла у девочек, частые роды, наличие хронических болезней желудочно-кишечного тракта — ЖКТ, заболеваний женской репродуктивной системы, связанных с кровопотерей).
2. Предлатентный дефицит железа. На этой стадии нет никаких лабораторных критериев дефицита железа, однако можно определить повышение абсорбции трехвалентного железа в ЖКТ, которое может превышать 50% (в норме 10—15%).
3. Латентный дефицит железа характеризуется развитием сидеропенического синдрома и уменьшением запасов железа в организме (по данным лабораторных исследований).
4. ЖДА. Диагноз устанавливается при уровне гомоглобина менее 120 г/л у женщин и 130 г/л у мужчин. Выделяют следующие стадии ЖДА:
В основе патологии эритропоэза при дефиците железа лежит нарушение синтеза гема, в результате которого уменьшается количество гемоглобина в эритрокариоцитах костного мозга, что проявляется на первом этапе гипохромией эритроцитов, а в дальнейшем — развитием гипохромной микроцитарной анемии.
Клинические проявления ЖДА связаны с развитием как сидеропенического синдрома, для которого характерны выраженная мышечная слабость, нарушение целостности слизистых оболочек, кожи, ее придатков (ломкость и расслаивание ногтей, выпадение волос), снижение иммунитета, так и непосредственно симптомов анемии (головокружение, мелькание «мушек» перед глазами, сонливость, снижение работоспособности).
Наиболее характерным лабораторным признаком ЖДА являются гипохромия, микроцитоз эритроцитов, анизоцитоз. О гипохромии эритроцитов свидетельствуют цветовой показатель менее 0,8, среднее содержание гемоглобина в эритроците менее 28 пг, средняя концентрация гемоглобина в эритроците менее 290 г/л. О микроцитозе говорят, когда средний диаметр эритроцита менее 7 мкм, а средний объем эритроцита — менее 80 фл [21, 22, 24].
Параметры обмена железа широко используются в клинической практике, но в связи с отсутствием четко определенных значений, доказывающих наличие ЖДА, высокой стоимостью исследования и большим количеством больных их применение не всегда оправдано. Так, показатель ферритина сыворотки (ФС) как единственный маркер, отражающий запасы железа в организме и используемый для верификации и дифференциальной диагностики ЖДА, по мнению разных исследователей [5, 20], варьирует от 15 до 100 мкг/л. Известно, что показатель ФС является положительным маркером воспаления, а количество его определяется белково-синтетической функцией печени. В настоящее время для установления диагноза ЖДА принято считать достоверным показатель ФС менее 30 мкг/л [25]. Уровень такого транспортного белка, как трансферрин, как правило, повышен при недостатке железа, однако при наличии инфекции его содержание уменьшается и не может использоваться в диагностике ЖДА [26]. Тем более изменчивы такие параметры обмена железа, как железосвязывающая способность (общая и латентная) и коэффициент насыщения трансферрина железом, так как они рассчитываются исходя из содержания трансферрина и сывороточного железа, а последний показатель вообще не имеет связи с содержанием железа в организме и зависит от времени, в которое проведено исследование, и приема пищи [21]. Значения коэффициента насыщения трансферрина железом у больных ЖДА, по опубликованным данным, могут составлять от 15 до 20%. Наиболее точным методом диагностики ЖДА в настоящее время считается подсчет растворимых рецепторов для трансферрина, однако этот метод не используется в качестве рутинного из-за отсутствия единого способа детекции, высокой стоимости исследования, невозможности интерпретировать результат при наличии любых пролиферативных процессов [26].
Наиболее частыми причинами ЖДА являются как физиологические, так и патологические состояния. В группу риска развития ЖДА входят недоношенные дети, так как у них не успевает сформироваться депо железа, и подростки, которым требуется больше железа в связи с быстрым ростом организма [27]. Наиболее часто ЖДА развивается при беременности. В период беременности, родов и лактации в среднем расходуется до 1000 мг железа, что в 2 раза больше его запасов в депо [28]. Репродуктивный возраст у женщин связан с повышенной потерей железа при менструациях; этот недостаток компенсируется увеличением всасывания железа в ЖКТ, что в настоящее время объясняется изменением влияния гепцидина. При наличии гиперполименореи, однако, такой баланс нарушается в связи с увеличением кровопотери [29, 30], при сопутствующих заболеваниях ЖКТ нарушается всасывание железа и развивается ЖДА [6, 19]. Часто у женщин меноррагии имеют органические причины: полипы, эндометрит, миома матки, аденомиоз, открывающийся в полость матки; мало того, такие заболевания, как миома матки и дисплазия шейки матки, оказывают влияние на развитие анемии и без патологической кровопотери [5, 19, 30]. Указанный механизм связан с увеличением содержания гепцидина в крови и снижением активности эритропоэза, доказанным синдромом неадекватной выработки эритропоэтина. В настоящее время продукцию эритропоэтина принято считать неадекватной при отношении определяемого эритропоэтина к предполагаемому (О/П log эритропоэтина менее 0,9) [28, 31]. Так, В.А. Бурлевым и Е.Н. Коноводовой [32] при обследовании женщин с миомой матки выявлено отношение О/П log эритропоэтина менее 0,8, а при обследовании гинекологических больных с анемией без нарушения менструальной функции в 2011 г. отношение О/П log эритропоэтина составило 0,89 (рис. 3). Для всех женщин с диагностированной ЖДА необходимо обязательное обследование у гинеколога. В случае обнаружении ЖДА у мужчин, наоборот, показано исключение заболеваний ЖКТ.
Рис. 3. Зависимость между уровнем гемоглобина и сывороточного эритропоэтина (логарифмическая шкала и экспоненциальные кривые) у больных с постгеморрагической ЖДА при заболеваниях ЖКТ (предполагаемый эритропоэтин) и анемии при гинекологических заболеваниях (определяемый эритропоэтин) [5].
Помимо повышенной потребности в железе и хронической кровопотери, патологическими состояниями, способными вызывать развитие ЖДА, являются различные нарушения всасывания железа и поступления его с пищей (в том числе и обусловленные вегетарианством), нарушения транспорта железа (гипотрансферринемии при заболеваниях печени и наследственные атрансферринемии) [21].
Таким образом, гипохромная микроцитарная анемия, особенно при наличии характерной для сидеропенического синдрома клинической картины, даже без исследования обмена железа может определяться как ЖДА при условии полноценного клинического и инструментального обследования больного и установления причины ее развития [5].
Лечение.
Современная тактика лечения при ЖДА в настоящее время направлена на устранение этиологического фактора и восполнение запасов железа в организме [4, 5]. Наиболее оправдано более физиологическое пероральное применение препаратов железа; парентерально препараты можно использовать только при доказанном дефиците железа. Перорально следует назначать препараты железа в высоких дозах (от 200 до 300 мг/сут), что, однако, может приводить к возникновению диспепсических явлений, поэтому (особенно в детской и акушерской практике) рекомендуется постепенное повышение дозы до терапевтической, а при достижении нормальных значений уровня гемоглобина — ее снижение [20].
Степень абсорбции двухвалентных солей железа в несколько раз выше, чем трехвалентных, так как они пассивно диффундируют через каналы ДМТ-белков [33], поэтому препараты, содержащие двухвалентное железо, дают быстрый эффект и нормализуют уровень гемоглобина в среднем через 1—2 мес, а нормализация депо железа происходит уже через 3—4 мес от начала лечения в зависимости от степени тяжести анемии и дозы препарата. Препараты, содержащие железо в трехвалентном состоянии, требуют более длительного применения, а в случае дефицита меди в организме будут неэффективны. Нормализация уровня гемоглобина при лечении препаратом трехвалентного железа наступит только через 2—4 мес, а нормализация показателей депо железа — через 5—7 мес от начала терапии [5, 19, 33]. Степень абсорбции отражается и на частоте развития побочных эффектов. Уменьшить нежелательное влияние таблетированных препаратов железа на ЖКТ можно, принимая их во время еды, но при этом уменьшается всасывание железа. Лучше (но также с потерей эффективности) использовать формы с замедленным высвобождением, так как часть препарата будет высвобождаться в нижних отделах ЖКТ, где железо практически не всасывается [34]. Несмотря на рекомендации ВОЗ по применению для лечения ЖДА препаратов двухвалентного железа как более эффективных, препараты с низкой биодоступностью на основе трехвалентного железа активно применяются благодаря их лучшей переносимости.
В современной клинической практике используются различные варианты сочетаний двухвалентного железа с витаминами С, В9, В12, что позволяет минимизировать побочные эффекты и одновременно повысить эффективность терапии, однако переносимость такого лечения до настоящего времени была основным лимитирующим фактором [20, 33]. Анализ переносимости различных препаратов железа более чем у тысячи пациентов показал, что современная жидкая форма двухвалентного железа (препарат тотема, лаборатория Иннотек Интернасиональ, Франция) по количеству побочных эффектов не превышает таковые у трехвалентного (рис. 4) [4]. Такой эффект достигается равномерным распределением препарата по слизистой оболочке желудка и его высокой биодоступностью. Двухвалентное железо равномерно и максимально эффективно проникает в энтероциты и, не накапливаясь в них, поступает в кровь. Это обусловлено наличием в составе препарата меди и марганца, которые входят в состав ДМТ-белков и гефестина, окисляющего железо, что способствует наилучшему его метаболизму (см. рис. 2) [33]. Помимо этого, указанные металлы участвуют в работе системы антиоксидантов, наиболее важными составляющими которой являются Cu, Zn-супероксиддисмутаза, Mn-супероксиддисмутаза (в митохондриях), каталаза, глутатионпероксидаза и глутатион. При уменьшении антиоксидантной защиты происходит сдвиг в сторону избыточного накопления свободных радикалов, что обусловливает их повреждающее действие на клетки. Следует понимать, что процесс активации перекисного окисления липидов запускается ионами двухвалентного железа, что проявляется частым развитием побочных эффектов при лечении препаратами железа. Наличие меди и марганца в составе тотемы уменьшает образование свободных радикалов, что улучшает переносимость препаратов железа [37].
Пациентам с заболеваниями ЖКТ назначать препараты железа перорально следует с осторожностью, причем острые заболевания, такие как язва желудка и двенадцатиперстной кишки, эрозивный гастрит, являются противопоказаниями; также не следует использовать указанный метод лечения у больных с заболеваниями тонкой кишки (болезнь Крона, целиакия, мальабсорбция) или отсутствием ее части.
Рис. 4. Сравнение результатов исследований безопасности применения различных железосодержащих препаратов.
При лечении больных ЖДА остро стоит вопрос оценки эффективности терапии, так как часто ЖДА диагностируется у соматически тяжелых больных с крайне низким уровнем гемоглобина. Попытки ранней диагностики, как правило, связаны с исследованием количества ретикулоцитов [38], однако в настоящее время такой подход не является доказательным, так как часто ретикулоцитоз возникает компенсаторно при наличии кровотечения. В работе [5, 9] показано, что наиболее достоверными показателями, указывающими на хороший эффект препаратов железа, служат появление молодых форм ретикулоцитов и увеличение дельты гемоглобина (разницы между средним содержанием гемоглобина в ретикулоците и эритроците) уже через 1 нед после начала лечения (рис. 5).
Рис. 5. Динамика гемоглобина эритроцитов (RBC), количества ретикулоцитов (Ret), фракции незрелых ретикулоцитов (IRF-) среднего содержания гемоглобина в эритроците (RBC-Hb), среднего содержания гемоглобина в ретикулоците (Ret-Hb), дельты гемоглобина (D-Hb) при лечении ЖДА в течение 1 мес.
Основным критерием положительного ответа на терапию ЖДА является прирост уровня гемоглобина через 1 мес после начала применения препаратов железа, однако рекомендации разных организаций по этому вопросу не согласуются друг с другом. Минимальным приростом уровня гемоглобина в периферической крови для признания терапии эффективной является его увеличение более чем на 10 г/л за 1 мес (Центр по контролю и профилактике заболеваний в США) [39]. В нашем исследовании, проведенном при лечении 61 пациентки с гинекологической патологией и заболеваниями ЖКТ, у которых лечение привело к полному восстановлению показателей гемоглобина и обмена железа, прирост уровня гемоглобина в течение первого месяца составил от 10 до 50 г/л с медианой прироста 30 г/л [19]. Поэтому с учетом большого количества сопутствующих заболеваний у больных ЖДА и доказанной роли гепцидина в нарушении метаболизма железа за оптимальный критерий оценки эффективности терапии лучше принять прирост уровня гемоглобина более 10 г/л за 1 мес [5].
При отсутствии прироста уровня гемоглобина, согласно указанным критериям, необходимо обязательно исследовать обмен железа, провести диагностический поиск, исключить другой механизм развития анемии. При подтверждении абсолютного дефицита железа и отсутствии злокачественной опухоли следует перейти на парентеральное применение препаратов железа со строго рассчитанной терапевтической дозой. При назначении препаратов парентерально предпочтение следует отдавать внутривенному пути введения. Наиболее часто в настоящее время используются венофер (100 мг в 5 мл), космофер, феринъект (50 мг в 1 мл). За один раз, как правило, вводят 100—200 мг, но, используя феринъект, это количество можно увеличить до 1000 мг. Эти препараты должны применяться только при наличии показаний, доказанном абсолютном дефиците железа и невозможности перорального применения. Существенным недостатком парентерального применения является то, что необходимо использовать строго рассчитанное количество препарата, врач может назначать препараты только в условиях стационара, применение препаратов ограничено из-за наличия большого количества тяжелых побочных реакций (анафилактический шок, аллергические реакции, передозировка железа, системный гемосидероз, локальный гемосидероз тканей). Кроме того, как правило, есть ограничения парентерального применения препаратов при беременности, особенно в ранние сроки.
В случае отсутствия гипоферритинемии есть основания проводить лечение анемии с использованием препаратов рекомбинантного человеческого эритропоэтина, эффективность которого доказана при терапии ЖДА в поздние сроки беременности [28] и у больных с миомой матки [40, 41]. Такую тактику необходимо выбирать у больных с доказанными хроническими воспалительными или инфекционными заболеваниями, доброкачественными опухолями при наличии синдрома неадекватной степени тяжести анемии выработки эритропоэтина [5, 19, 28].
Таким образом, оптимальным у больных с наличием гипохромной микроцитарной анемии является выявление причины развития дефицита железа, после чего следует начинать лечение. Если есть сомнения в железодефицитном характере анемии, лучше проверить обмен железа, подтвердив диагноз ЖДА низкими показателями ФС и насыщения трансферрина железом. Далее следует устранить хроническое заболевание, остановить кровотечение, убрать погрешности в диете и начать пероральный прием препаратов железа (с обязательным учетом противопоказаний). Лечение следует начинать с двухвалентных препаратов железа. При наличии хронических воспалительных, пролиферативных, инфекционных заболеваний лучше использовать жидкую лекарственную форму (препарат тотема), содержащую в своем составе глюконат двухвалентного железа, медь и марганец. Через 1 мес следует определить прирост уровня гемоглобина и если он выше 10 г/л в месяц — продолжить лечение, если нет — пересмотреть диагноз (рис. 6).
Рис. 6. Схема лечения ЖДА.
При использовании препаратов железа необходимо ориентироваться на показатель ФС, целевое значение которого должно составлять около 100 мкг/л, после чего можно остановить лечение (поздние критерии эффективности терапии [39]). При пероральном приеме препаратов достаточно подтвердить нормализацию содержания ФС через 3 мес терапии, при назначении препаратов железа внутривенно этот показатель необходимо проверять каждую неделю. Лечение препаратами рекомбинантного человеческого эритропоэтина опасно из-за возможности развития эритроцитоза и тромботических осложнений, поэтому ориентироваться прежде всего необходимо на уровень гемоглобина, целевая концентрация которого не должна превышать 120 г/л [42].
Таким образом, ЖДА представляет собой важную социально значимую проблему, а ее диагностика и лечение до сих пор являются трудной задачей. Только выполнение современных рекомендаций позволит существенно повысить качество и эффективность оказания медицинской помощи больным ЖДА.
Сведения об авторах:
Российский университет дружбы народов, Москва
Кафедра госпитальной терапии с курсом клинической лабораторной диагностики Стуклов Николай Игоревич — д-р мед. наук, проф. кафедры; руководитель курса гематологии;
Семенова Елена Николаевна — учебный мастер кафедры.
источник
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
В соответствии с рекомендациями ВОЗ, стандартизованы следующие критерии диагностики железодефицитных анемий у детей:
- снижение уровня СЖ менее 12 мкмоль/л;
- повышение ОЖСС более 69 мкмоль/л;
- насыщение трансферрина железом менее 17%;
- содержание гемоглобина ниже 110 г/л в возрасте до 6 лет и ниже 120 г/л — в возрасте старше 6 лет.
Таким образом, ВОЗ рекомендует достаточно точные критерии для диагностики железодефицитной анемии, однако методы диагностики требуют забора крови из вены и проведения достаточно дорогих биохимических исследований, что не всегда возможно в украинских лечебных учреждениях. Имеются попытки минимизации критериев диагностики железо-дефицитной анемии.
Федеральная служба по заболеваемости, эпидемиологии и образованию (United States Federal Government Centers for Disease Control — CDC) со штаб-квартирой в Атланте (Джорджия, США) рекомендует использовать для диагностики железо-дефицитной анемии 2 доступных критерия: снижение концентрации гемоглобина и гематокрита (Ht) при отсутствии у больного других заболеваний. Устанавливают предположительный диагноз железодефицитной анемии и назначают лечение препаратами железа на 4 нед из расчёта 3 мг элементарного железа на 1 кг массы тела больного в сутки. Достоинство данных рекомендаций — регистрация ответа на терапию препаратами железа по строго фиксированным критериям. К концу 4-й нед лечения концентрация гемоглобина должна повыситься на 10 г/л по отношению к исходной, a Ht — на 3%. Такой ответ подтверждает диагноз «железодефицитная анемия», и лечение продолжают в течение нескольких месяцев. Если ответ не получен, рекомендуют остановить лечение препаратами железа и пересмотреть данный случай с точки зрения диагностики процесса. Перегрузка железом организма за 4 нед при приёме препаратов железа внутрь маловероятна.

Лабораторную диагностику железодефицитной анемии осуществляют с помощью:
- общего анализа крови, выполненного «ручным» методом;
- анализа крови, выполненного на автоматическом анализаторе крови;
- биохимических исследований.
При диагностике любой анемии обязательно выполнение общего анализа крови с определением количества ретикулоцитов. Врач ориентируется на гипохромный и микроцитарный характер анемии. В общем анализе крови, выполненном «ручным» методом, выявляют:
- снижение концентрации гемоглобина ( 12 /л) количество эритроцитов;
- снижение цветового показателя ( 12-16 мм/ч);
- анизоцитоз (характерны микроциты) и пойкилоцитоз эритроцитов.
Ошибка определения параметров может достигать 5% и более. Стоимость одного общего анализа крови составляет около 5 долларов США.
Точным и удобным методом диагностики и дифференциальной диагностики служит метод определения эритроцитарных показателей на автоматических анализаторах крови. Исследование проводят как в венозной, так и в капиллярной крови. Ошибка в определении параметров значительно ниже, чем при «ручном» методе, и составляет менее 1%. При развитии дефицита железараньше всего повышается показатель выраженности анизоцитоза эритроцитов — RDW (норма
Портал iLive не предоставляет медицинские консультации, диагностику или лечение.
Информация, опубликованная на портале, предназначена только для ознакомления и не должна использоваться без консультации со специалистом.
Внимательно ознакомьтесь с правилами и политикой сайта. Вы также можете связаться с нами!
Copyright © 2011 — 2019 iLive. Все права защищены.
источник
Периферическая кровь при железодефицитной анемии. Свойственные крови морфологические изменения заключаются в микроцитозе и гипохромии. Однако эти признаки отражают длительную недостаточность железа, сочетающуюся с тяжелой анемией. Исходно, когда в процессе гемоглобиногенеза отмечается отрицательное влияние недостаточного подвоза железа в костный мозг, кроветворение начинает приспосабливаться к новым условиям. По началу сокращается объем эритроцитов.
Микроцитоз и нормохромия обычное явление у женщин при показателе гемоглобина от 9 до 10 г на 100 мл. Гипохромия развивается, когда показатель уровня гемоглобина падает до меньших значений, причем вначале она умеренная, а затем становится все более выраженной. При тяжелой форме анемии эритроциты имеют кольчатый аспект (аннулоциты) или обретают вид клеток-мишень. Пойкилоцитоз наблюдается лишь при тяжелых формах анемии (Дачие и сотр.).
Показатели эритроцитов свидетельствуют о небольшом объеме (менее 80 мкг3), о количестве гемоглобина менее 27 пг и о средней концентрации гемоглобина на каждый эритроцит (менее 30 г/100/мл.). В принципе число ретикулоцитов в норме или немного больше; лишь е редких случаях их число занижено. Число эритроцитов обычно нормальное или немного меньшее нормы. Вот почему определение не дает точную справку о тяжести анемии. В отдельных случаях, особенно у детей, число эритроцитов превышает 5 млн/мм3. Следует отметить, что, при железодефицитной анемии увеличивается устойчивость эритроцитов к гипотонии.
Наиболее часто число лейкоцитов укладывается в норму. При длительной недостаточности железа развивается умеренная гранулоцитопения. В некоторых случаях выявляются гиперсегментированные нейтрофилы. Их появление при недостатке железа можно объяснить развитием вторичной недостаточности фолиевокислых солей или витамина В12 (Брукнер и сотр.).
В большинстве случаев показатель численности тромбоцитов высокий, однако еше не разработано четкое объяснение этому явлению. Высказана мысль о возможности появления тромбоцитоза в результате активной кровоточивости. В случаях тяжелой или длительной анемии отмечена умеренная тромбоцитопения, обратимая после проведения железотерапии.
У страдающих железодефицитной анемией количество клеточной массы в костном мозге выше нормы. Рост показателя костномозговых клеток объясняется увеличением числа эритробластов. Последние, в частности полихроматофильные и оксифильные меньших размеров, чем нормальные эритробласты в связи с сокращением количества цитоплазмы. Исследование мазка в условиях железодефицитной анемии выявляет не только малые размеры эритробластов, но также их нерегулярный, «изорванный» контур. В таких клетках были описаны аспекты дисэритропоэза и кариорексиса, почкования ядер, в некоторых случаях многоядерность и ядерные фрагменты.
Непосредственное исследование, без окраски, размозженных на стекле зерен костного мозга не выявляет наличие аггрегатов мелких, нерегулярных, золотистых, характерных гемосидерину частиц. Окраска по Перлсу выявляет отсутствие запасного железа в макрофагах и наличие менее 10% сидеробластов (Дачие и сотр.). В целях определения заболевания железодефицитной анемией этот тест представляет наибольшее диагностическое значение.
Сывороточное железо при железодефицитной анемии. Концентрация железа в сыворотке всегда меньше 50 мкг/100 мл., причем в отдельных случаях она не больше 10 мкг/100 мл. Общая связывающая способность железа (ОССЖ), отражающая количество находящегося в кровотоке трансферина, чаще завышена и лишь в редких случаях укладывается в норму или занижена. У больных с заниженной ОССЖ возможно вмешательство и других факторов, например гипопротеинемии (McGibbon и Mollin5). Насыщение трансферином (железо сыворотки/ОССЖ х 100) в любом случае меньше 16%, однако встречаются и случаи 1%-ой насыщенности.
Следует обратить особое внимание на интерпретацию насыщения трансферином у женщин на последнем квартале беременности. У последних насыщение трансферином менее 16% не всегда указывает на наличие недостатка железа. Объяснение такому явлению следует искать в повышении количества трансферина, что характерно беременным независимо от возможного дефицита железа.
Показатель свободного протопорфирина эритроцитов (СПЭ) в принципе характеризуется высокими значениями — более 70 мкг/100 мл. а в отдельных случаях даже больше 300 мкг/мл. При этом следует обратить внимание на тот факт, что на повышение уровня СПЭ влияет больше продолжительность железо дефицита, чем его интенсивность (Dameshek).
Показатель феритина в сыворотке — растворимой формы находящегося в запасе железа—составляет менее 12 мкг/л. у женщин и детей раннего возраста и менее 35 мкг/л. у мужчин. Существует четкая взаимосвясь сывороточного феритина и количеством железа выявляемого в костном мозге и печени путем окраски по Перлсу.
Кинетика железа. В процессе выявления недостатка железа кинетика последнего не применяется как текущий метод. При использовании этого метода обнаруживается весьма быстрый клиренс железа плазмы, перенос железа в костный мозг и его расход нормальными или увеличенными эритроцитами, при этом интенсивность и скорость метаболизма железа эритроцитов больше нормы. Эти данные свидетельствуют о наличии неэффективного кроветворения в условиях недостатка железа:
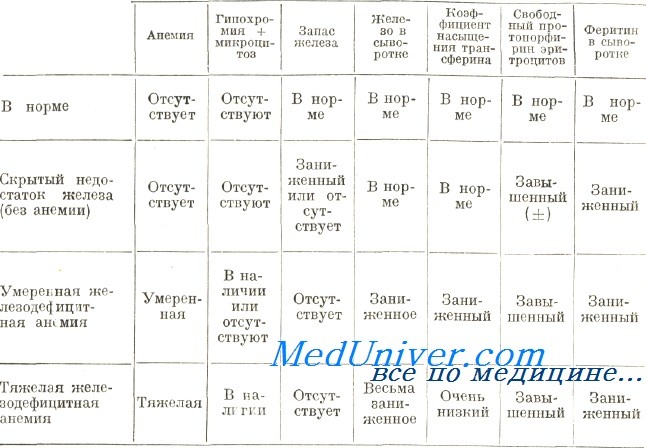
Диагностирование тяжелой железодефицитной анемии по клиническим и лабораторным данным дело несложное, при этом сделанное определение подтверждается терапевтическим испытанием. Осложнения появляются при мало выраженной форме анемии и нечетких клинических и лабораторных признаках. Ниже в таблице приведены морфологические, биохимические и цитохимические данные, на основе которых дифференцируются этапы недостатка железа.
Элементы лабораторного диагноза стадий железной недостаточности
Железодефицитную анемию следует отличать от остальных видов гипохромной анемии. Среди последних, на втором месте по частоте после железодефицитной анемии, находится бета-талассемия (по данным приема для страдающих болезнями крови при Центре гематологии). Учитывая тяжесть заболевания, ранный возраст страдающего и характерную клиническую картину тяжелая бета-талассемия (анемия Кули) распознается без затруднений.
В противоположность этому легкая форма бета-талассемии в отдельных случаях не различима от железодефицитной анемии по клиническим признакам и результатам морфологического исследования крови. Возможные кровоточивость в анамнезе, наблюдаемые в слизистых оболочках и роговых образованиях изменения, равно как и бледность сыворотки подсказывают диагноз железодефицитной анемии. Гипохромия и микроцитоз общее, для обеих групп явление, однако при талассемии они выделяются более ярко.
Отмечаем, что, при талассемии, более характерной чертой микроцитоза это не сокращенный диаметр эритроцитов, а их значительно уменьшенная толщина (микроплатициты). Вот почему выраженная гипохромия с показателем гемоглобина примерно 10 г/100 мл или более подсказывает диагноз талассемии. Также, при железодефицитной анемии с более 8 г/100 мл гемоглобина пойкилоцитоз единичное явление, в то время как при талассемии наблюдается часто. В условиях талассемии выраженный микроцитоз отражается ростом численности эритроцитов, по сравнению с железодефицитной анемией.
Что касается остальных лабораторных данных следует не забывать, что при талассемии чаще наблюдаются такие признаки, как повышенное число ретикулоцитов, полихроматофильных эритроцитов и наличие точечно-базофильных красных кровяных клеток, к тому же осмотическая устойчивость последних больше.
В связи со сказанным для различения этих двух заболеваний наибольшую ценность представляют тесты метаболизма железа. В принципе, при талассемии показатель железа в крови характеризуется нормальными или завышенными значениями. Редко, у больных с хронической кровоточивостью развивается гипосидеремия. В таких случаях ОССТЖ, показатель которой при талассемии отличается низкими значениями (обычно менее 250 мкг/100 мл), увеличивается до нормы и даже более.
За исключением случаев, осложненных недостатком железа, костномозговые запасы железа при талассемии укладываются в норму или несколько больше. В отдельных случаях количество железа в митохондриях нормобластов очень велико, что создает аспект кольчатых сидеробластов.
Анемия с многонедельным течением, развивающаяся при инфекциях и хронических воспалениях, в принципе носит нормоцитный и нормохромный характер, причем эта характеристика действительна и в отношение анемий, наблюдаемых при свежих новообразованиях. Но после длительного течения в условиях этих заболеваний анемия становится микроцитной и гииохромной. В подобном случае различение этой анемии от железодефицитной возможна путем выявления первичного заболевания, в частности посредством лабораторных исследований. Морфологическое исследование крови не представляет данные, способствующие дифференциальному диагнозу.
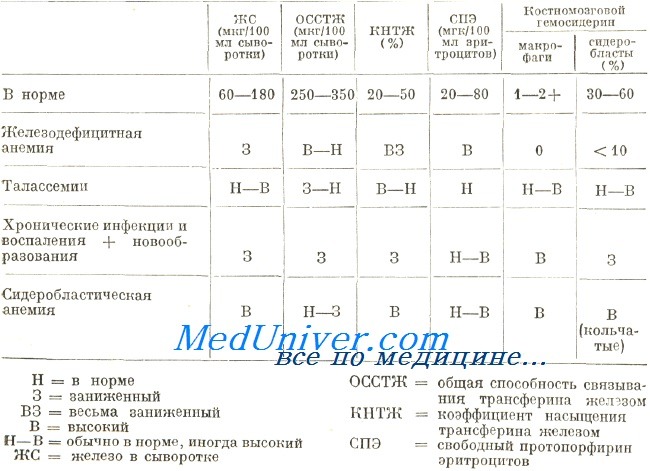
Элементы дифференциальной диагностики при гипохромной анемии
Концентрация железа в сыворотке невелика в обеих группах заболеваний, в то время как показатель ОССТЖ в принципе высокий при железодефицитной анемии и низкий при хронических воспалениях и новообразованиях. По этой причине коэффициент насыщенности трансферина меньше у страдающих железодефицитной анемией. Обследование дополняется определением гемосидерина на костномозговом мазке. В костном мозге страдающих хроническим воспалением и новообразованием содержатся макрофаги, загруженные гемосидерином, который всегда отсутствует в условиях железодефицитной анемии. При обоих заболеваниях сидеробласты обнаруживаются в малом количестве или совсем отсутствуют.
В процессе, диагностирования возникают затруднения и в случае сидеробластической анемии. Тем не менее, в условиях сидеробластической анемии, эритроциты отличаются частным видом. На мазге различаются две популяции эритроцитов, из них одна микроцитная и гипохромная) другая — макроцитная и нормохромная («частичная гипохромия»). Дифференциальная диагностика основывается на определении метаболизма железа, который, при сидеробластической анемии, отражает нормальную или завышенную сидеремию, нормальную или низкую ОССТЖ и высокий показатель гемосидерина в костном мозге с наличием кольчатых сидеробластов.
Из гемолитических анемий наличие гипохромии отмечается при гемоглобинопатиях К, КС, Е, Кёлн. В отдельных случаях наблюдаются клетки мишень. Высокие показатели сидеремии и гемосидерина в костном мозге исключают возможность наличия железодефицитной анемии. Гемолитическая анемия с хроническим внутрисосудистым гемолизом, в частности ночной пароксизмальной гемоглобинурией сочетается с характерной для железодефицитной анемии картиной. Дифференциация возможна по признакам гемолиза и данным лабораторных анализов специфических ночной пароксизмальной гемоглобинурии.
После проведения курса лечения витамином В12 или фолиевой кислотой сидеремия и запасы железа быстро сокращаются под влиянием ускоренного эритропоэза. Это сокращение четко выражено у женщины с небольшим запасом железа. Дифференциальная диагностика представляет трудности, поскольку признаки мегалобластоза в костном мозге исчезают после проведения специфической терапии. В таком случае наиболее важным представляется исследование мазка крови, выявляющее наличие макроцитоза с нормохромией и гиперсегментирование нейтрофилов.
Нередко исследование мазка крови страдающего недостатком железа указывает на наличие нормохромии. Вот почему представляется важной постановка дифференциального диагноза по сравнению с группой нормохромных анемий. Отсутствие костномозгового гемосидерина характеризует железодефицитную анемию, даже при ее умеренной форме.
Необходимо отметить, что в условиях истинной полицитемии, эритроциты нередко гипохромные уже при первом обследовании врача, до вскрытия вен. К тому же обнаруживается невысокая сидеремия и отсутствие костномозгового запаса железа. Тем не менее истинная полицитемия отличается характерной клинической и лабораторной симптоматологией.
источник
Выдыборец С.В., д.м.н., профессор кафедры гематологии и трансфузиологии
Национальная медицинская академия последипломного образования им. П.Л. Шупика МЗ Украины
Показатели метаболизма железа при ЖДА характеризуются уменьшением содержания железа в сыворотке (в норме у мужчин и женщин соответственно 13-30 и 12-25 мкмоль/л), увеличением общей железосвязывающей способности сыворотки крови (в норме 30-85 мкмоль/л). Разница между показателями общей железосвязывающей способности сыворотки крови и сывороточного железа отражает латентную железосвязывающую способность сыворотки (в норме менее 47 мкмоль/л). При ЖДА этот показатель повышен. Соотношение показателя железа сыворотки и общей железосвязывающей способности выражает насыщение трансферрина железом (норма 16-50%). При ЖДА этот показатель снижается. ЖДА характеризуется уменьшением содержания ферритина в сыворотке крови (норма 15-150 мкг/л). Оценка запасов железа в организме, кроме определения показателя ферритина, может быть осуществлена по десфераловому тесту. Суть последнего состоит в том, что после внутривенного введения 500 мг десферала у здорового человека с мочой выделяется от 0,8 до 1,2 мг железа, в то время, как у больных ЖДА этот показатель снижен. Следует помнить, что показанием для назначения данного теста может быть только невозможность доказать другими методами предполагаемый дефицит железа в организме больного [5, 6]. Определение протопорфиринов в эритроцитах больных ЖДА показывает их увеличение (норма 18-89 мкмоль) [15, 18]. По данным радиологических исследований выявляют увеличение клиренса железа плазмы [19, 20]. На сегодняшний день наиболее точными методами количественного определения железа в биологических жидкостях и тканях являются методы: спектрального анализа, нейтронно-активационный, атомно-абсорбционный, рентген-флюоресцентный [4, 15, 18]. Таким образом, ЖДА характеризуется нарушениями метаболизма железа в сыворотке, изменениями транспортного и депонированного фондов железа в организме.
Считают, что для диагностики ЖДА морфологическое исследование костного мозга малоинформативно [1, 9, 16, 20]. Однако, значимость его существенно возрастет, если применить цитохимическое исследование с окрашиванием мазков на железо. Существуют три классические метода выявления неорганического железа: 1) метод Perisс берлинской лазурью; 2) с турбуленовым синим; 3) реакции с образованием сульфидов железа. В гематологии, чаще всего, используют метод окраски с берлинской лазурью, что базируется на образовании ферриферрицианида при взаимодействии ионов трехвалентного железа с ферроцианидом в кислой среде [10]. Реакция проявляется в виде образования синего или сине-зеленого осадка ферриферрицианида.
Определение содержания железа в костном мозге при помощи реакции с берлинской лазурью дает ценную информацию для оценки адекватности накопления железа в организме. Большие зерна или конгломераты окрашенного в синий цвет железа в норме наблюдают в макрофагальных клетках костного мозга или свободно лежащими между клеток. Более мелкие гранулы могут наблюдаться в молодых красных клетках мазков костного мозга после соответствующей обработки, а также в клетках системы фагоцитирующих макрофагов. В макрофагальных элементах железо просматривается в виде неплотных агрегатов и предполагают, что оно не идентично гранулам, которые наблюдаются в созревающих красных клетках. Такое железо рассматривают как форму накопления, которая используется на синтез гемоглобина. Истощение отложений железа наблюдают при ЖДА, а избыточное накопление при гемохроматозе, хронических гемолитических анемиях, талассемии, рефрактерных анемиях [10, 18].
Критерии лабораторной диагностики ЖДА приведены в табл. 3.
Таким образом, лабораторными критериями ЖДА является гипохромная анемия, которая сопровождается морфологическими изменениями эритроцитов, уменьшением содержания сывороточного железа, увеличением общей железосвязывающей способности сыворотки крови, уменьшением насыщения трансферрина железом и снижением концентрации ферритина в сыворотке крови.
Во избежание ошибок при интерпретации результатов исследований, необходимо помнить следующее. Полученные результаты исследований могут не отражать истинное содержание железа в сыворотке, если больной перед исследованием, даже кратеовременно принимал препараты железа. Для определения железа следует использовать пластиковые или стеклянные пробирки, промытые перед исследованием соляной кислотой и дважды – дистиллированной водой, поскольку обычное промывание не гарантирует защиту от внесения незначительных количеств железа. При центрифугировании пробирки следует закрывать пробками из пластмассы, поскольку в них может попасть железная пыль из центрифуги. Кровь для исследований следует брать натощак утром, поскольку существуют суточные биоритмы колебания концентрации железа в сыворотке. Показатели сывороточного железа могут изменяться в зависимости от фаз менструального цикла.
Учет вышеизложенных фактов позволит избежать неточностей в исследованиях и ошибок в диагностике ЖДА.
Критерии лабораторной диагностики ЖДА
Лабораторный показатель
Изменения при ЖДА
источник