Симптомы анемии часто не замечаются в первое время. Периодическая головная боль, слабость, сонливость списывают на усталость или трудоголизм. А ведь именно об анемии эти неприятные признаки как раз и могут свидетельствовать. Поговорим, как проявляется такая патология, в чем суть изменений в организме и есть ли способы избежать вреда.
Синонимом анемии в народе является малокровие. Несмотря на то, что это название страшно звучит, по факту ничего смертельного в нем нет. Анемия развивается, когда в крови снижается уровень гемоглобина и объем кровяных телец. Клетки крови, то есть эритроциты, переносят кислород и утилизируют продукты распада. Если кровяных телец мало, эти процессы затрудняются. Итог: развивается кислородное голодание, в тканях накапливается диоксид углерода.
Важнейший компонент в составе гемоглобина – железо. Да, далеко не всегда анемия развивается на фоне дефицита железа. Но, как показывает статистика, именно на железодефицитную анемию приходится примерно 90–95% всех случаев патологии. Остальные вызваны редкими заболеваниями, нехваткой витамина B12 или, что характерно для женщин, частыми интенсивными кровопотерями.
В связи с тем, что при железодефицитной анемии развивается кислородное голодание, ее признаки повторяют симптомы недостатка кислорода. Определить анемию можно по следующей симптоматике.
- Проблемы с дыханием. Вариантов множество. По большей части, это одышка, учащение дыхания или затрудненный вдох.
- Перебои в ритме сердца. Сердце – орган, которому нужен особенно большой объем кислорода. Если в крови его недостаточно, сердечный ритм нарушается. Опять же, он может как ускоряться, так и замедляться. Иногда ускорение и замедление чередуются.
- Нарушения мышления. Еще больше, чем сердце, от поставок кислорода зависит работа мозга. При железодефицитной анемии затрудняется мышление, ухудшается память, быстрее наступает утомление при умственной работе.
- Бледность кожных покровов. Кожа при анемии становится белой, подушечки пальцев бывают практически белоснежными. Холодные кисти и стопы – еще один характерный симптом.
Если наблюдаются сразу все эти признаки, с большой вероятностью мы имеем дело именно с железодефицитной анемией. Если патология развивается ситуативно, из-за неправильного питания или образа жизни, можно обойтись без серьезного вмешательства врачей. Но придется пересмотреть свой взгляд на жизнь в целом. Что же можно сделать?
Самый большой удар по здоровью человеку наносит курение. В сигаретном дыме содержатся компоненты, которые замещают кислород в гемоглобине. Регулярно курящие люди по определению страдают от дефицита кислорода. Анемия у них развивается гораздо чаще, чем у некурящих. Вывод один: нужно навсегда избавиться от сигареты.
Основу борьбы с анемией и профилактики железодефицитной анемии составляет питание. Никакие витамины и аптечные лекарственные препараты не заменят полноценного рациона, богатого железом и другими компонентами, способствующими выработке гемоглобина. Тем не менее, не нужно злоупотреблять железосодержащими продуктами. Намного важнее, чтобы рацион был сбалансированным и правильным. Какие продукты включать в меню?
- Мясо без жира. В первую очередь это говядина. В день нужно съедать порцию красного мяса весом примерно 180 граммов. Здесь требуется уточнение. Чтобы железо, содержащееся в мясе, хорошо усваивалась, продукты нужно совмещать только с овощами. Это базовый принцип раздельного питания.
- Бобовые. Бобы, хотя и содержат много углеводов, богаты еще и железом. Фасоль – замечательное дополнение к тому же мясу. Хотя это уже не раздельное питание. И все равно время от времени нужно баловать себя блюдами из мяса и фасоли, пусть даже и консервированной.
- Мед. Полезнейший продукт, который можно употреблять в качестве десерта. Полезно пить чай с лимоном и медом. Только не сразу после основного приема пищи, а примерно через полчаса после него.
- Орехи. Время от времени балуйте себя кедровыми орешками, миндалем. Только не нужно их солить. Максимум – поджарить. Оптимальный вариант – есть в свежем, то есть в сыром виде.
- Некоторые овощи и фрукты. В овощах и фруктах содержатся не только железо, но и очень полезный витамин C. Он необходим и при профилактике, и при лечении железодефицитной анемии. Витамин C улучшает усвоение компонента. Сделайте основной акцент на яблоки, помидоры, морковь, ананас, кабачки и зелень.
- Меньше черного чая и кофе. Если с черным чаем еще можно более-менее и смириться, особенно добавив мед и лимон, то кофе из рациона желательно исключить. Кофе содержит танин, который не дает железу усваиваться. Если вы не можете отказаться от кофе, хотя бы употребляйте его по прошествии часа с употребления пищи.
- Качественная минеральная вода. В настоящей минеральной воде, полученной из хорошего источника, много железа. Перед покупкой обязательно почитайте состав конкретной воды. Чем больше в ней железа, тем лучше.
Как еще стимулировать образование красных кровяных телец и восполнить недостаток кислорода? Ответ простой: чаще бывать на природе и больше двигаться. По возможности добавите в распорядок дня прогулки, пробежки, катание на лыжах и коньках. Только не на крытой ледовой арене, а на свежем воздухе.
Предложим еще несколько средств, помогающих защититься от анемии или компенсировать ее при необходимости. Здесь пойдет речь не только о как таковых народных препаратах, но и просто о хитростях, позволяющих защититься от патологии.
- Травяные настои. Надо сделать акцент на травах и растениях, богатых витамином C. Это боярышник, шиповник, рябина, листья черной смородины, тысячелистник, одуванчик, крапива. Настой любого из этих продуктов поможет справиться с железодефицитной анемией. Из ягод получается и отличный сироп.
- Мумие. Хотя средство известно у нас уже очень давно, все равно его принимают не так часто. А ведь мумие – прекрасный препарат против анемии. Главное, чтобы сам продукт был максимально качественным.
- Красное вино. Если с желудком все в порядке, для профилактики анемии можно выпивать по рюмке красного вина в обед. Только не переборщите с этим, а то могут быть и неприятные последствия.
Железодефицитная анемия – основной тип анемии, который встречается в подавляющем большинстве случаев. Выявить ее можно по симптомам, характерным для кислородного голодания. Чтобы справиться с заболеванием и обеспечить его профилактику, надо добавить в рацион железосодержащие продукты, избавиться от вредных привычек, вести активный образ жизни.
источник
| Дата | 03.05.2016 |
| Размер | 132.5 Kb. |
- Навигация по данной странице:
- ЖЕЛЕЗОДЕФИЦИТНАЯ АНЕМИЯ 2014 Содержание Список сокращений
- Список литературы Таблицы Список сокращений
- 1. Определение. Железодефицитная анемия (ЖДА)
- 2. Коды по МКБ-10
- 4. Факторы и группы риска.
- Пример формулировки диагноза
- Дифференциальный диагноз.
- 8. Критерии ранней диагностики.
- 9. Общие принципы терапии в амбулаторных условиях
- Критерии эффективности лечения пероральными или парентеральными препаратами железа
- 10. Показания к гемотрансфузии.
- 11. Показания к консультации гематолога.
- 12. Показания к госпитализации больного.
- 14. Прогноз.
| Беременные женщины, имеющие 3-ю и более беременность Женщины детородного возраста, имеющие обильные менструации Отсутствие в рационе красного мяса более 6-ти месяцев. | Продолжительная ахлоргидрия Резекция желудка или тонкого кишечника Хроническая кровопотеря (геморрой, диафрагмальная грыжа, дивертикулез, опухоли, язвенный колит, пептические язвы) Для скрининга ЖДА могут быть использованы клинические данные: наличие сидеропенического синдрома (извращение вкуса, изменение придатков кожи и т.д.) в сочетании с данными о факторах риска (см.выше) и данными общего анализа крови (ОАК). К данным ОАК, свидетельствующим о возможном наличии железодефицитной анемии, относятся низкий цветовой показатель (цп менее 0,86) и низкий средний корпускулярный объем эритроцита (MCV менее 80 фл). При подозрении на ЖДА следует провести исследование показателей обмена железа. Железодефицитная анемия – не самостоятельная нозологическая форма, а синдром, который может развиться при многих заболеваниях, сопровождающихся хронической кровопотерей или нарушением всасывания железа; и при вегетарианстве. ЖДА является результатом длительного отрицательного баланса железа. Выделяют три стадии развития железодефицитной анемии:
Критерии этих стадий представлены в таблице 2. Знание стадий развития хронической железодефицитной анемии позволяет проводить ее своевременную диагностику. Стадии развития дефицита железа
В зависимости от лабораторных показателей выделяют три степени тяжести железодефицитной анемии: легкую – уровень гемоглобина (НВ) более 90г/л, среднюю – гемоглобин от 70 до 90г/л тяжелую – уровень НВ менее 70г/л. Пример: Железодефицитная анемия тяжелой степени тяжести. 7. Принципы диагностики заболевания у взрослых в амбулаторных условиях. В большинстве случаев диагностика железодефицитной анемии не вызывает затруднений. Для этого достаточно клинических данных (наличие вероятного источника кровопотери и сидеропенического синдрома), исследования периферической крови с определением цветового показателя (характерно его снижение) и/или эритроцитарных индексов (MCV, MCH, MCHC – характерно их снижение), снижения уровня сывороточного железа, а также увеличения общей железосвязывающей способности сыворотки крови (ОЖСС) и снижения уровня ферритина сыворотки. У женщин фертильного возраста наиболее вероятным источником кровопотери являются менструальные кровопотери. Кровопотеря превышает физиологическую (300 мл), если имеет место хотя бы один из следующих признаков: длительность менструации превышает пять суток; в выделениях отмечается наличие сгустков; за одну менструацию используется более 10 прокладок/тампонов. У мужчин наиболее вероятным является наличие скрытой кровопотери из желудочно-кишечного тракта (ЖКТ). К источникам таковой может быть отнесен, прежде всего, хронический геморрой. При этом кровопотеря может быть минимальной, не привлекающей внимания пациента, но ее многомесячная длительность приводит к постепенному формированию отрицательного баланса железа и развитию железодефицитной анемии. К другим источникам кровопотери из ЖКТ относятся дивертикулы, полипы, грыжа пищеводного отверстия диафрагмы, язвы желудка и двенадцатиперстной кишки, неспецифический язвенный колит, болезнь Крона и т.д. Сидеропенический синдром развивается при дефиците железа в тканях. Его основными клиническими признаками являются извращение вкуса (пристрастие к глюконату кальция и др.), пристрастие к резким запахам, деформация, истончение и расслаивание ногтей, выпадение волос, дисфагия, недержание мочи у женщин. Важнейшее значение для дифференциальной диагностики анемий и определения плана дальнейшего обследования имеет определение цветового показателя и эритроцитарных индексов. Цветовой показатель отражает относительное содержание гемоглобина в одном эритроците в условных единицах. Его вычисляют при делении концентрации гемоглобина на количество эритроцитов в крови по формуле: Цп=3*НВ (г/л)/ три первые цифры количества эритроцитов Например, гемоглобин 140г/л, эритроциты-4,2*10/12/л. Цп=(3*140)/420=1,0. В норме цветовой показатель находится в пределах 0,86-1,05. В зависимости от величины цп выделяют гипохромные (цп менее 0,85), нормохромные (цп 0,86-1,05) и гиперхромные (цп более 1,05) анемии. Железодефицитная анемия относится к гипохромным анемиям. Средний корпускулярный объем эритроцитов (размер эритроцитов) (MCV- mean ctll volume) – наиболее ценный показатель для дифференциальной диагностики анемий. Вычисляют MCV по следующей формуле: MCV= гематокрит (%)*10 / количество эритроцитов в миллионах в 1 мм3 Например, гематокрит 40%, эритроциты 4,7*10/9. Следовательно, MCV составит (40*10):4,7=85 мкм3. В норме MCV составляет 80-95 фл. На основании MCV анемии разделяются на нормоцитарные (MCV в пределах 80-95фл), микроцитарные (MCV менее 75 фл) и макроцитарные (MCV более 95 фл). Железодефицитная анемия относится к микроцитарным анемиям. В практической работе необходимо дифференцировать железодефицитную анемию с другими микроцитарными гипохромными анемиями, к которым относятся анемия хронических заболеваний, сидеробластные анемии и гетерозиготные талассемии. Это необходимо помнить, так как препараты железа оказывают положительный эффект только при железодефицитных анемиях. При других микроцитарных гипохромных анемиях использование препаратов железа бесполезно, а при длительном применении в больших дозах (особенно при парентеральном введении) даже вредно, так как это может приводить к развитию вторичного гемосидероза. Анемия хронических заболеваний (АХЗ) нередко развивается при хронических воспалительных, аутоиммунных, инфекционных заболеваниях, злокачественных новообразованиях. У большинства пациентов наблюдается нормохромная нормоцитарная анемия, однако в ряде случаев возможны умеренный микроцитоз и гипохромия. При анемии хронических заболеваний ведущим в клинической картине являются проявления основной патологии (инфекционного эндокардита, ревматоидного артрита и т.д.), отсутствует сидеропенический синдром, анемия выражена умеренно (гемоглобин обычно в пределах 90-100г/л). Содержание сывороточного железа при АХЗ может быть незначительно снижено, однако, в отличие от железодефицитной анемии, отмечается также снижение уровня общих и ненасыщенных трансферринов при нормальном содержании ферритина. Сидеробластная анемия характеризуется отсутствием сидеропенического синдрома, качественными нарушениями эритропоэза, лейкопоэза и мегакариоцитопоэза, повышением количества сидеробластов в костном мозге и появлением их кольцевидных форм, увеличением содержания железа и ферритина в сыворотке крови. Выделяют врожденные и приобретенные формы сидеробластной анемии. В последнем случае она может быть самостоятельной нозологической формой (вариант миелодиспластического синдрома), либо ассоциироваться с другими заболеваниями (солидные опухоли, лейкозы), алкоголизмом, дефицитом меди, лечением некоторыми медикаментами (левомицетин, изониазид). Гетерозиготная бета-талассемия относится к наследственным гемолитическим анемиям. В России это заболевание чаще возникает у коренных жителей Северного Кавказа, однако встречается и у лиц других национальностей. Основными критериями диагностики является повышение уровня гемоглобина А2 и F при электрофорезе гемоглобина. В периферической крови отмечаются выраженный микроцитоз, увеличение количества мишеневидных эритроцитов, сывороточного железа, общих и ненасыщенных трансферринов и ферритина. Выявление пациентов с железодефицитом на ранней стадии, то есть на стадии латентного дефицита железа связано с рядом сложностей. На этой стадии пациенты часто не обращаются за медицинской помощью в связи с отсутствием ограничения переносимости физической нагрузки. В этом случае у пациентов отсутствует анемия, а есть лишь сидеропенические жалобы (извращение вкуса, изменение придатков кожи и т.д.), которые необходимо активно выявлять при наличии факторы риска. При выявлении латентного дефицита железа, его необходимо лечить, поскольку в противном случае он трансформируется в железодефицитную анемию. Для терапии используют диету, богатую красным мясом и те же препараты, что и для лечения ЖДА, но доза их уменьшается вдвое (до 1 таблетки в сутки). Для успешного лечения железодефицитной анемии необходимо установить и по возможности устранить ее причину (уменьшить объем менструальных кровопотерь, удалить геморроидальные узлы и др.). Диета должна содержать достаточное количество железа, то есть 100-200мг красного мяса в сутки. Необходимо пояснить пациенту, что к красному мясо не относятся колбасные изделия, курица, бульоны и т.п. полноценная диета препятствует прогрессированию дефицита железа, но не может устранить уже имеющуюся анемию. Для лечения ЖДА необходимо назначение медикаментозных препаратов. Пероральные препараты железа – эффективные и хорошо переносимые средства для лечения больных железодефицитной анемией. Обычно назначают препараты железа в виде сульфата или фумарата. Наиболее известными препаратами являются сорбифер (сульфат железа, содержащий 100мг железа и аскорбиновую килоту), фенюльс (сульфат железа (45мг) с аскорбиновой кислотой и рибофлавином), мальтофер (железо-полимальтозный комплекс) и феррум–лек (железо-полимальтозный комплекс). Внимания заслуживает препарат ферроплекс, поскольку он содержит всего 10мг железа и для достижения терапевтического эффекта необходимо принять 8-10 драже в сутки. Взрослым необходимо назначать 200мг железа в сутки. Прием разовой дозы более 150мг и суточной дозы более 450мг не приводит к увеличению его поступления в организм. Сульфат железа (сорбифер, фенюльс) следует принимать натощак, за полчаса до еды, так как продукты питания снижают абсорбцию железа на 40-50%. Препараты железо-полимальтозного комплекса можно принимать независимо от приема пищи. При приеме данных препаратов диспепсический синдром в качестве побочного эффекта практически не встречается. Стартовая доза 1 таблетка 2 раза в день в течение месяца. Состояние больных на фоне лечения препаратами железа часто улучшается уже к концу первой недели, однако отчетливое повышение уровней НВ и эритроцитов начинается обычно через 2,5-3 недели, поэтому контроль ОАК ранее чем через 4 недели от начала лечения не имеет смысла. Нормализация гематологических показателей происходит через 4-6, а при тяжелой анемии и через 8 недель. Через месяц после начала приема препаратов железа пациент приходит на контрольную явку с общим анализом крови. Терапия считается адекватной если к концу третьей недели лечения уровень НВ поднимается до отметки, являющейся серединой между начальным и нормальным уровнями. При наличии положительной динамики в ОАК через 1 месяц необходимо продолжить прием препаратов железа в лечебной дозе (1т*2 раза в сутки) с контролем ОАК ежемесячно до подъема уровня НВ более 120г/л. На это уходит обычно от 2 до 4 месяцев. Типичной ошибкой является прекращение приема препаратов железа до нормализации уровня НВ, поскольку самочувствие пациента нормализуется очень быстро. Однако это приводит к рецидиву анемии. После нормализации уровня НВ препараты железа не отменяются, но лишь уменьшается их доза до 1 таблетки в сутки. В такой дозе пациент принимает препараты железа еще 2-4 месяца, в зависимости от исходной глубины анемии, с целью восполнения депо. Если источник кровопотери при этом ликвидировать не удается (например, полименоррею), то рекомендован постоянный ежемесячный прием препаратов железа в дни менструального цикла. В ряде случаев лечение пероральными препаратами железа неэффективно, что может быть обусловлено: — неправильным приемом или неадекватной дозой препарата -неправильным диагнозом (анемия хронических заболеваний, талассемия, сидеробластная анемия). — комбинированным дефицитом (чаще всего – железа и витамина В12) — нарушением всасывания железа. Парентеральные препараты железа более эффективные, чем пероральные, однако, чаще сопровождаются развитием побочных реакций, иногда опасных для жизни. Показания к назначению парентеральных препаратов железа: — непереносимость пероральных препаратов железа — Необходимость быстрого восполнения запасов железа (тяжелая ЖДА, послеоперационный период, последние недели беременности, повторные кровотечения при геморрагических заболеваниях) — заболевания ЖКТ (НЯК, болезнь Крона) — нарушения всасывания железа Парентеральные препараты железа предпочтительнее вводить внутривенно, так как внутримышечное введение менее эффективно (часть железа откладывается в мышцах в виде гемосидерина) и может осложняться развитием постинъекционных инфильтратов. Начинают лечение с пробной дозы препаратов (1/ 2 ампулы), которую вводят очень медленно. К наиболее распространенным парентеральным препаратам железа относятся феррум-лек и венофер. Внутривенная форма препаратов содержит 5,0мл лекарственного вещества, внутримышечная форма феррум-лека – 2,0мл. Парентерально препараты железа назначаются по 1 инъекции через день (в амбулаторных условиях – понедельник, среда, пятница). Побочные эффекты при лечении препаратами железа развиваются у 10-20% пациентов (при лечении венофером реже, чем при лечении феррум-леком). Наиболее часто встречаются: — повышение температуры тела — боли и инфильтраты в местах инъекций (при внутримышечном введении) — аллергические реакции (вплоть до анафилактического шока). Критерии эффективности лечения пероральными или парентеральными препаратами железа: — улучшение общего состояния больного к концу первой недели лечения — увеличение количества ретикулоцитов до 30-50%% через 5-10 дней — повышение гемоглобина (обычно начинается через 2-3 недели), уровень гемоглобина нормализуется через 4-5 недель. — улучшение качественного состава эритроцитов (исчезает микроцитоз и гипохромия) — постепенная регрессия эпителиальных изменений. 10. Показания к гемотрансфузии. Трансфузии эритроцитарной массы проводятся только по жизненным показаниям. При уровне НВ менее 70г/л гемотрансфузия проводится ТОЛЬКО в том случае, если анемия сопровождается клиническими признаками тканевой гипоксии (выраженная тахикардия, тахипноэ) или перед операцией. У пожилых пациентов показания к трансфузиям эритроцитарной массы (т.е. признаки гипоксии) могут возникнуть и при более высоком уровне гемоглобина. При удовлетворительном самочувствии, отсутствии признаков гипоксии, нарушений со стороны кардиореспираторной системы и благоприятном прогноза (хроническая железодефицитная анемия при отсутствии признаков продолжающейся кровопотери) патогенетическое и симптоматическое лечение без трансфузий эр.массы может проводиться и при анемии тяжелой степени. Частота гемотрансфузий определяется в зависимости от клинических и лабораторных показателей. 11. Показания к консультации гематолога. Показаниями к консультации гематолога являются сложные случаи, когда трудно в амбулаторных условиях провести дифференциальную диагностику с такими заболеваниями, как талассемия, сидеробластная анемия. Показаниями к направлению на консультацию к гематологу также может является отсутствие положительной динамики через месяц ферротерапии, при условии, что пациенту до начала лечения проведено исследование показателей обмена железа. Неудовлетворительной можно считать тактику лечения «вслепую», когда пациенту без дообследования, на основании одного лишь общего анализа крови, «автоматически» назначаются препараты железа, которые через месяц приема оказываются неэффективными. В этом случае дальнейший их прием бессмысленен, бессмысленно также назначение дополнительно витамина В12 или фолиевой кислоты без подтвержденного диагноза. Данная тактика затрудняет диагностический поиск, удлиняет диагностический период, приводит к потере времени и средств. В случае, если пациент принимает несколько препаратов без эффекта, необходимо прекратить лечение и повторить обследование пациента не ранее, чем через 7 дней. 12. Показания к госпитализации больного. Выраженные признаки тканевой гипоксии (необходимость гемотрансфузии) Пациентам, относящимся к группам риска, а также пациентам, вылечившимся от ЖДА, рекомендована диета, богатая красным мясом: 100-200мг красного мяса не менее 5 раз в неделю. При сохраняющемся источнике кровопотери (полименоррея) обоснован прием препаратов железа ежемесячно в течение 5-7 дней. При правильном лечении, ликвидации источника кровопотери прогноз благоприятный.
Таблица 1. Факторы риска развития железодефицитной анемии. Таблица 2. Стадии развития дефицита железа. источник В тех случаях, когда распространенность железодефицитных состояний в том или ином регионе превышает 40 %, в целях массовой профилактики анемии у взрослых и детей рекомендуется проведение ряда мероприятий, направленных на своевременное выявление, устранение и предотвращение развития этой патологии. Фортификация. Данная процедура предусматривает обогащение железом массово употребляемых населением продуктов. Обычно в этой роли выступают хлеб или макаронные изделия. Для успешной профилактики анемии необходимо, чтобы процент населения, употребляющего этот продукт, составлял не менее 65 %. Однако активное внедрение фортификации затрудняет ряд обстоятельств. Главным из них является отсутствие пищевого продукта, оптимально переносящего соединения железа и способствующего его хорошей всасываемости. Поэтому в настоящее время эффективность массовой профилактики не превышает 50 % среди охваченного населения. Саплиментация. Более эффективной считается направленная профилактика анемии у лиц, входящих в группы риска, при помощи профилактических доз ферропрепаратов. Саплиментация проводится в частности у женщин во 2-м и 3-м триместрах беременности и в течение первых трех месяцев лактации. В настоящее время статистика свидетельствует, что при охвате от 50 до 95 % будущих матерей эффективную дозу получает только 67 % из них. Поскольку развитие дефицита железа – это зачастую проблема питания, первичная профилактика анемии у взрослых и детей подразумевает правильное питание. Употребление продуктов животного происхождения. Главными источниками железа являются говядина, печень, баранина. В меньшей степени к ним относят также творог, рыбу и курятину. Они богаты гемовым железом, легко усваиваемым организмом и отличающимся высокой биодоступностью. Употребление продуктов растительного происхождения. Овощи и фрукты также могут содержать большое количество железа, но из-за того, что в них оно находится в так называемой негемовой форме, этот элемент усваивается менее хорошо (в сравнении с животными продуктами). Использование профилактических биодобавок. Для дополнительного обогащения рациона железом используются и специальные биодобавки, в том числе гематоген. Этот продукт изготавливают из альбумина – переработанной крови крупного рогатого скота. Выбирая гематоген, следует отдавать предпочтение продуктам, изготовленным по традиционной рецептуре – без шоколада, орехов, меда и прочих кондитерских добавок. Эти ингредиенты не только повышают калорийность гематогена, нарушают процессы всасывания железа, но и могут привести к аллергии. К гематогенам, не содержащим посторонних добавок, относят «ФЕРРОГЕМАТОГЕН®-ФАРМСТАНДАРТ». В его состав помимо альбумина входят компоненты, оптимизирующие всасывание железа и стимулирующие синтез гемоглобина: медь, витамин В6, аскорбиновая и фолиевая кислота. Под вторичной профилактикой подразумевается ранняя диагностика латентного дефицита железа. Диагностику рекомендуется проводить при каждом обращении пациентов к врачам, а также при медицинских осмотрах, диспансеризациях и др., особенно у людей, входящих в группы риска. При вторичной профилактике, при необходимости, врачом назначаются железосодержащие препараты. В дополнение к ним может быть использован гематоген.
Также в группы риска входят дети:
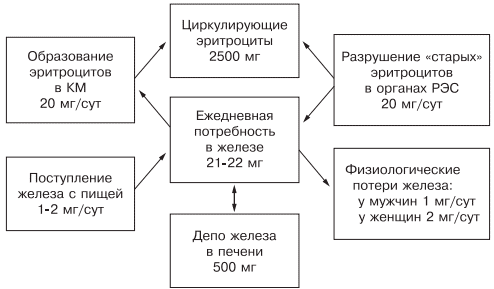
источник Анемии — группа заболеваний, характеризующихся уменьшением гемоглобина и (или) количества циркулирующих эритроцитов в единице объема крови ниже нормального для данного возраста и пола. Диагностика анемии основывается главным образом на данных лабораторных исследований, в первую очередь на результатах клинического исследования крови с определением концентрации гемоглобина. Согласно рекомендациям ВОЗ, критерием анемии для детей является снижение концентрации гемоглобина до уровня менее 110 г/л, для женщин – менее 120 г/л (во время беременности – менее 110 г/л), для мужчин – менее 130 г/л. По степени тяжести различают анемию легкую (уровень гемоглобина крови выше 90 г/л), средней тяжести (гемоглобин – 70–89 г/л) и тяжелую (гемоглобин менее 70 г/л). Наиболее часто (80–95 % всех анемий) в терапевтической практике встречается хроническая железодефицитная анемия (ЖДА) — болезненное состояние, обусловленное нарушением синтеза гемоглобина вследствие дефицита железа. По статистике ВОЗ, в мире около 2 млрд человек страдают в той или иной форме дефицитом железа, большинство из них женщины и дети. Частота ЖДА у беременных в мире колеблется от 25 до 50%, в развивающихся странах – от 35 до 75%, а в развитых составляет 18–20%. В МКБ-10 соответствует рубрике D50 — железодефицитная анемия. У мужчин с пищей поступает около 18 мг Fe в сутки, всасывается 1,0–1,5 мг, теряется Fe с мочой, калом, потом, эпителием кожи и кишечника. У женщин с пищей поступает 12–15 мг Fe в сутки, всасывается 1,0–1,3 мг, теряется Fe с мочой, калом, потом, эпителием кожи и кишечника, волосами, ногтями, во время менструального цикла, беременности и лактации. Во время менструального периода потери составляют 20–30 мг, при беременности, родах и лактации до 700–800 мг. При повышении потребности организма в железе из пищи может всосаться не более 2,0–2,5 мг. Если потеря организмом Fe составляет более 2 мг/сут., после того как истощаются депо, развивается железодефицитная анемия. Недостаточное поступление железа с пищей, в основном за счет нехватки мясных продуктов (например, при голодании, вегетарианстве), не позволяет восполнить его потери, возникающие вследствие разрушения эритроцитов.
Развивается у пациентов с энтеритами различного генеза, синдромом мальабсорбции, послеоперационными состояниями (резекция желудка с выключением двенадцатиперстной кишки, резекция тонкой кишки), а также связано с приемом лекарственных препаратов, угнетающих всасывание железа.
Как правило, обусловлена беременностью, лактацией, интенсивным ростом в пубертатный период, возникает в предклимактерический период и при лечении макроцитарной (В12-дефицитной) анемии витамином В12.
Хроническая кровопотеря обусловлена желудочно-кишечными (при рефлюкс-эзофагите, эрозивно-язвенных заболеваниях желудка, опухолях желудка и толстой кишки, болезни Крона, неспецифическом язвенном колите, дивертикулитах, кровоточащем геморрое), маточными (включая обильные менструации), носовыми, почечными (при гломерулонефрите, мочекаменной болезни, опухолях), десневыми, в замкнутые полости и ткани (изолированный легочный гемосидероз, внематочный эндометриоз) кровотечениями. Наиболее распространена постгеморрагическая железодефицитная анемия при кровопотерях из ЖКТ. Эти кровопотери – самая частая причина дефицита железа у мужчин и вторая по частоте у женщин.
Основным патогенетическим механизмом развития ЖДА является недостаток в организме железа – основного строительного материала для построения молекул гемоглобина, в частности его железосодержащей части – гема. Клинические проявления дефицита Fe манифестируют после длительного латентного периода, соответствующего истощению запасов Fe в организме. Выраженность симптомов может быть различна и зависит от причины, скорости кровопотери, пола и возраста пациента. Тяжесть состояния обусловлена снижением кислородсвязывающей емкости крови и тканевым дефицитом железа. Анемический синдром обусловлен тканевой гипоксией, его проявления универсальны для всех видов анемий:
Сидеропенический синдром обусловлен тканевым дефицитом Fe и свойственен только ЖДА. Основные проявления:
Синдром вторичного иммунодефицита — склонность к частым рецидивам и хронизации инфекционно-воспалительных заболеваний. Висцеральный синдром включает:
Кожа у пациентов с ЖДА бледная, не желтушная; печень, селезенка и периферические лимфатические узлы не увеличены. При ювенильном хлорозе склеры, а иногда и кожа приобретают голубоватый оттенок. Такие пациенты плохо загорают на солнце; девушки нередко инфантильны, у них часто наблюдаются расстройства менструального цикла – от аменореи до обильных менструаций. Основными лабораторными критериями ЖДА являются:
После установления наличия анемии и степени ее выраженности необходимо выяснить причину и источник кровотечения. Для этого необходимо провести целый ряд исследований. К основным исследованиям относятся:
При отсутствии данных, свидетельствующих о явном эрозивно-язвенном процессе, следует провести онкологический поиск. Целями лечения ЖДА являются:
Устранить ЖДА только с помощью диеты невозможно, поскольку всасывание Fe из продуктов питания составляет не более 2,5 мг/сутки, в то время как из лекарственных препаратов его всасывается в 15–20 раз больше. Тем не менее пациентам с ЖДА рекомендуются продукты, содержащие достаточное количество хорошо всасываемого белка и Fe. В мясных продуктах содержится Fe, входящее в состав гема (гемовое Fe), которое всасывается на 25–30 %. Входящее в состав гемосидерина и ферритина Fe (печень, яйца, рыба) всасывается на 10–15 %, а в состав продуктов растительного происхождения (бобовые, соя, шпинат, укроп, салат, абрикосы, чернослив, хлеб, рис) Fe – на 3–5 %. Прием большого количества яблок, гранатов, моркови, свеклы, гречневой крупы не является оправданным с точки зрения ограниченного всасывания из них ионов Fe. Люди, употребляющие в пищу мясо, получают больше железа гема (в составе миоглобина), чем вегетарианцы. У строгих вегетарианцев со временем может развиться дефицит железа, поскольку овощи и злаки содержат вещества, препятствующие всасыванию железа, в частности фосфаты. Следует учитывать, что полноценная и сбалансированная по основным ингредиентам диета позволяет лишь «покрыть» физиологическую потребность организма в железе, но не устранить его дефицит, и должна рассматриваться как один из вспомогательных компонентов терапии. Гемотрансфузии проводятся пациентам только по жизненным показаниям, причем показанием является не уровень Hb, а общее состояние пациента и гемодинамики. Чаще всего прибегают к гемотрансфузиям (трансфузиям эритроцитарной массы) при падении Hb ниже 40–50 г/л. Проводится только препаратами Fe, в основном пероральными, реже парентеральными, длительно, под контролем развернутого анализа крови. Скорость восстановления показателей красной крови не зависит от пути введения. К основным принципам лечения железодефицитной анемии препаратами Fe для перорального приема относятся:
Критерий эффективности лечения препаратами железа — прирост ретикулоцитов (ретикулоцитарный криз) в 3–5 раз на 7–10-й день от начала терапии (при однократном контроле регистрируют не всегда). Препараты Fe классифицируют на: ионные ферропрепараты, представляющие собой солевые или полисахаридные соединения Fe 2+ , и неионные соединения, состоящие из гидроксидполимальтозного комплекса трехвалентного Fe 3+ . Сульфат Fe, входящий в монокомпонентные и комбинированные ферропрепараты, хорошо всасывается (до 10%) и переносится больными. Хлоридные соединения Fe всасываются хуже (до 4%) и имеют больше нежелательных эффектов: металлический привкус во рту, потемнение зубов и десен, диспепсия. В настоящее время предпочтение отдают препаратам, содержащим двухвалентное железо (лучше абсорбируются в кишечнике по сравнению с препаратами трехвалентного железа), суточная доза которого составляет 100–300 мг. Назначать более 300 мг Fe 2+ в сутки не следует, т.к. его всасывание при этом не увеличивается. Следует учитывать, что содержащийся в пищевых продуктах целый ряд веществ – фосфорная кислота, соли, кальций, фитин, танин (поэтому не рекомендуется запивать препараты железа чаем, кофе, кока-колой) – ингибирует всасывание железа. Такой же эффект отмечается при одновременном приеме двухвалентного железа некоторых лекарственных препаратов, таких как алмагель, соли магния. Показания для парентерального введения препаратов Fe:
При парентеральном введении в случае неправильно установленного диагноза возможно развитие гемосидероза с полиорганной недостаточностью. Не следует вводить парентерально более 100 мг/сутки. Профилактика ЖДА должна проводиться при наличии скрытых признаков дефицита Fe либо факторов риска для ее развития. Исследование Hb, сывороточного Fe должны выполняться не реже 1 раза в год, а при наличии клинических проявлений по мере необходимости у следующих категорий пациентов:
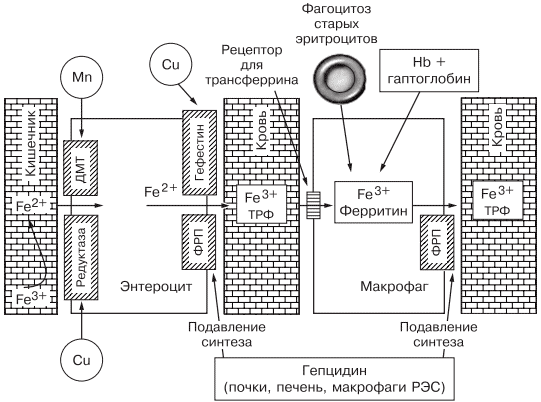
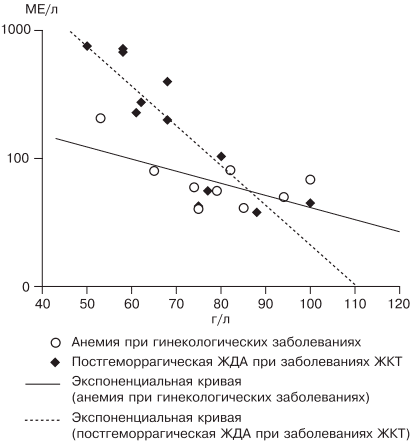
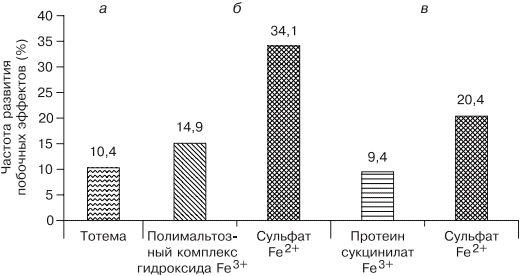
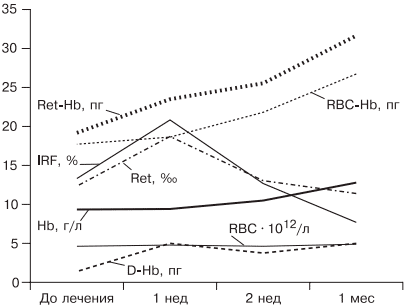
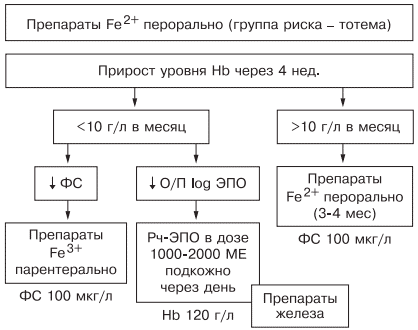
источник Н.И. Стуклов, Е.Н. Семенова Рассмотрен современный взгляд на проблему железодефицитной анемии (ЖДА) с точки зрения эпидемиологии, этиологии, патогенеза. Описаны известные в настоящее время механизмы регуляции обмена железа, приведены наиболее важные данные литературы и результаты собственных исследований. Основываясь на рекомендациях по лечению больных ЖДА, авторы представляют описанный в литературе и собственный клинический опыт использования железосодержащих препаратов и рассматривают полученные результаты. В рамках статьи авторы объясняют механизмы низкой эффективности лечения при ЖДА и предлагают способы решения проблемы с учетом опубликованных в литературе последних научных исследований. N.I. Stuklov, E.N. Semenova Modern views of epidemiology, etiology and pathogenesis of iron deficiency anemia are considered. Mechanisms of iron metabolism regulation are described based on the most important literature data and the results of the authors ’ research. The authors present their own and literature clinical experience of using iron-containing drugs with reference to the existing recommendations on the treatment of iron deficiency anemia. Causes of low treatment efficiency are discussed and the ways to address this problem are proposed based on the published results of clinical research. Анемии (греч. αναιμια — бескровие) определяются как ряд клинических состояний, связанных со снижением уровня гемоглобина менее 120 г/л у женщин и менее 130 г/л у мужчин; (ВОЗ, 2001) и (или) гематокрита ( менее 36,4% соответственно), что обусловлено уменьшением количества эритроцитов или содержания гемоглобина в них [1]. В настоящее время железодефицитная анемия (ЖДА) является самым распространенным состоянием, связанным со снижением уровня гемоглобина, поэтому ее признают государственной проблемой более чем в 100 странах мира, где разрабатываются программы, направленные на профилактику и снижение заболеваемости. ЖДА чаще выявляется у представителей наиболее социально значимых и незащищенных слоев населения — у женщин детородного возраста и детей. Количество больных анемией в указанных группах, по данным ВОЗ (2001), превышает 1 млрд [2]. В итоге ЖДА является причиной роста материнской и детской смертности [3]. Регуляция обмена железа. Железо накапливается в органах ретикулоэндотелиальной системы (до 500 мг), остальные запасы железа на 70% сосредоточены в гемоглобине, что и обусловливает развитие ЖДА при хронической кровопотере (рис. 1). Рис. 1. Схема обмена железа. Всасывание железа происходит в верхних отделах тонкой кишки, причем этот процесс требует участия множества белков. В основном до 70—80% железа усваивается в двухвалентном состоянии (гемовое железо, содержащееся в основном в мясе, меньше — в печени и рыбе). При поступлении в кишечник растительного трехвалентного железа с помощью медьзависимой ферроредуктазы на апикальной мембране энтероцитов или под действием витамина С оно восстанавливается до двухвалентного. Двухвалентное железо через марганецзависимые белки — транспортеры двухвалентных металлов (ДМТ — двухвалентный металлотранспортер) поступает в энтероцит, а затем через белок ферропортин на базальной мембране — в кровь, где с помощью медьзависимых феррооксидаз (гефестина, расположенного на базальной мембране и связанного с ферропортином, и церулоплазмина, находящегося в плазме) окисляется до трехвалентного состояния, чтобы связаться с транспортным белком — трансферрином (рис. 2). Только очень незначительная часть железа, образуя комплекс с муцином, может поступить в энтероциты путем пиноцитоза [4, 5]. Рис. 2. Схема регуляции обмена железа. Универсальным регулятором метаболизма железа является гепцидин [6—9], который блокирует транспорт железа, причем этот механизм реализуется с помощью регуляции активности белка ферропортина, т.е. путем воздействия на высвобождение железа из клеток кишечника и макрофагов ретикулоэндотелиальной системы [10—13]. Увеличение количества железа в организме ведет к стимуляции синтеза гепцидина, что уменьшает абсорбцию железа в кишечнике и его транспорт в циркуляцию. В свою очередь уменьшение абсорбции железа в кишечнике ведет к угнетению синтеза гепцидина в печени и по обратной связи — к восстановлению захвата железа из пищи и кишечника (см. рис. 2) [14—18]. Помимо железорегуляторной функции, гепцидин оказывает выраженное бактерицидное действие, является белком воспаления, его уровень повышается при инфекционных, воспалительных, опухолевых заболеваниях, блокируя выход железа в кровь [6]. Такой эффект гепцидина отрицательно влияет на рост бактерий, опухолей, блокирует избыточный воспалительный процесс. В работе, проведенной в 2011 г. [19], доказана роль гепцидина как основного фактора развития ЖДА у женщин с гинекологическими заболеваниями без патологической кровопотери. Показатели гепцидина в указанной группе составили 108,75 ± 40,08 нг/л (референсные значения 60— 85 нг/л), что обусловило резкое уменьшение содержания ферропортина — 0,43 ± 0,21 нг/л (референсные значения 3,1 ± 0,2 нг/л) и привело к нарушению поступления железа из кишечника в кровь [19]. Железо, которое остается внутри клеток, депонируется в виде ферритина, количество которого в крови прямо пропорционально содержанию железа в депо [20]. Клиническая картина и диагностические критерии. В настоящее время выделяют несколько этапов развития дефицита железа [5, 24]. 1. Предрасположенность к развитию дефицита железа (вегетарианство, подростковый возраст в сочетании с нарушением менструального цикла у девочек, частые роды, наличие хронических болезней желудочно-кишечного тракта — ЖКТ, заболеваний женской репродуктивной системы, связанных с кровопотерей). В основе патологии эритропоэза при дефиците железа лежит нарушение синтеза гема, в результате которого уменьшается количество гемоглобина в эритрокариоцитах костного мозга, что проявляется на первом этапе гипохромией эритроцитов, а в дальнейшем — развитием гипохромной микроцитарной анемии. Клинические проявления ЖДА связаны с развитием как сидеропенического синдрома, для которого характерны выраженная мышечная слабость, нарушение целостности слизистых оболочек, кожи, ее придатков (ломкость и расслаивание ногтей, выпадение волос), снижение иммунитета, так и непосредственно симптомов анемии (головокружение, мелькание «мушек» перед глазами, сонливость, снижение работоспособности). Наиболее характерным лабораторным признаком ЖДА являются гипохромия, микроцитоз эритроцитов, анизоцитоз. О гипохромии эритроцитов свидетельствуют цветовой показатель менее 0,8, среднее содержание гемоглобина в эритроците менее 28 пг, средняя концентрация гемоглобина в эритроците менее 290 г/л. О микроцитозе говорят, когда средний диаметр эритроцита менее 7 мкм, а средний объем эритроцита — менее 80 фл [21, 22, 24]. Параметры обмена железа широко используются в клинической практике, но в связи с отсутствием четко определенных значений, доказывающих наличие ЖДА, высокой стоимостью исследования и большим количеством больных их применение не всегда оправдано. Так, показатель ферритина сыворотки (ФС) как единственный маркер, отражающий запасы железа в организме и используемый для верификации и дифференциальной диагностики ЖДА, по мнению разных исследователей [5, 20], варьирует от 15 до 100 мкг/л. Известно, что показатель ФС является положительным маркером воспаления, а количество его определяется белково-синтетической функцией печени. В настоящее время для установления диагноза ЖДА принято считать достоверным показатель ФС менее 30 мкг/л [25]. Уровень такого транспортного белка, как трансферрин, как правило, повышен при недостатке железа, однако при наличии инфекции его содержание уменьшается и не может использоваться в диагностике ЖДА [26]. Тем более изменчивы такие параметры обмена железа, как железосвязывающая способность (общая и латентная) и коэффициент насыщения трансферрина железом, так как они рассчитываются исходя из содержания трансферрина и сывороточного железа, а последний показатель вообще не имеет связи с содержанием железа в организме и зависит от времени, в которое проведено исследование, и приема пищи [21]. Значения коэффициента насыщения трансферрина железом у больных ЖДА, по опубликованным данным, могут составлять от 15 до 20%. Наиболее точным методом диагностики ЖДА в настоящее время считается подсчет растворимых рецепторов для трансферрина, однако этот метод не используется в качестве рутинного из-за отсутствия единого способа детекции, высокой стоимости исследования, невозможности интерпретировать результат при наличии любых пролиферативных процессов [26]. Наиболее частыми причинами ЖДА являются как физиологические, так и патологические состояния. В группу риска развития ЖДА входят недоношенные дети, так как у них не успевает сформироваться депо железа, и подростки, которым требуется больше железа в связи с быстрым ростом организма [27]. Наиболее часто ЖДА развивается при беременности. В период беременности, родов и лактации в среднем расходуется до 1000 мг железа, что в 2 раза больше его запасов в депо [28]. Репродуктивный возраст у женщин связан с повышенной потерей железа при менструациях; этот недостаток компенсируется увеличением всасывания железа в ЖКТ, что в настоящее время объясняется изменением влияния гепцидина. При наличии гиперполименореи, однако, такой баланс нарушается в связи с увеличением кровопотери [29, 30], при сопутствующих заболеваниях ЖКТ нарушается всасывание железа и развивается ЖДА [6, 19]. Часто у женщин меноррагии имеют органические причины: полипы, эндометрит, миома матки, аденомиоз, открывающийся в полость матки; мало того, такие заболевания, как миома матки и дисплазия шейки матки, оказывают влияние на развитие анемии и без патологической кровопотери [5, 19, 30]. Указанный механизм связан с увеличением содержания гепцидина в крови и снижением активности эритропоэза, доказанным синдромом неадекватной выработки эритропоэтина. В настоящее время продукцию эритропоэтина принято считать неадекватной при отношении определяемого эритропоэтина к предполагаемому (О/П log эритропоэтина менее 0,9) [28, 31]. Так, В.А. Бурлевым и Е.Н. Коноводовой [32] при обследовании женщин с миомой матки выявлено отношение О/П log эритропоэтина менее 0,8, а при обследовании гинекологических больных с анемией без нарушения менструальной функции в 2011 г. отношение О/П log эритропоэтина составило 0,89 (рис. 3). Для всех женщин с диагностированной ЖДА необходимо обязательное обследование у гинеколога. В случае обнаружении ЖДА у мужчин, наоборот, показано исключение заболеваний ЖКТ. Рис. 3. Зависимость между уровнем гемоглобина и сывороточного эритропоэтина (логарифмическая шкала и экспоненциальные кривые) у больных с постгеморрагической ЖДА при заболеваниях ЖКТ (предполагаемый эритропоэтин) и анемии при гинекологических заболеваниях (определяемый эритропоэтин) [5]. Помимо повышенной потребности в железе и хронической кровопотери, патологическими состояниями, способными вызывать развитие ЖДА, являются различные нарушения всасывания железа и поступления его с пищей (в том числе и обусловленные вегетарианством), нарушения транспорта железа (гипотрансферринемии при заболеваниях печени и наследственные атрансферринемии) [21]. Таким образом, гипохромная микроцитарная анемия, особенно при наличии характерной для сидеропенического синдрома клинической картины, даже без исследования обмена железа может определяться как ЖДА при условии полноценного клинического и инструментального обследования больного и установления причины ее развития [5]. Лечение. Степень абсорбции двухвалентных солей железа в несколько раз выше, чем трехвалентных, так как они пассивно диффундируют через каналы ДМТ-белков [33], поэтому препараты, содержащие двухвалентное железо, дают быстрый эффект и нормализуют уровень гемоглобина в среднем через 1—2 мес, а нормализация депо железа происходит уже через 3—4 мес от начала лечения в зависимости от степени тяжести анемии и дозы препарата. Препараты, содержащие железо в трехвалентном состоянии, требуют более длительного применения, а в случае дефицита меди в организме будут неэффективны. Нормализация уровня гемоглобина при лечении препаратом трехвалентного железа наступит только через 2—4 мес, а нормализация показателей депо железа — через 5—7 мес от начала терапии [5, 19, 33]. Степень абсорбции отражается и на частоте развития побочных эффектов. Уменьшить нежелательное влияние таблетированных препаратов железа на ЖКТ можно, принимая их во время еды, но при этом уменьшается всасывание железа. Лучше (но также с потерей эффективности) использовать формы с замедленным высвобождением, так как часть препарата будет высвобождаться в нижних отделах ЖКТ, где железо практически не всасывается [34]. Несмотря на рекомендации ВОЗ по применению для лечения ЖДА препаратов двухвалентного железа как более эффективных, препараты с низкой биодоступностью на основе трехвалентного железа активно применяются благодаря их лучшей переносимости. В современной клинической практике используются различные варианты сочетаний двухвалентного железа с витаминами С, В9, В12, что позволяет минимизировать побочные эффекты и одновременно повысить эффективность терапии, однако переносимость такого лечения до настоящего времени была основным лимитирующим фактором [20, 33]. Анализ переносимости различных препаратов железа более чем у тысячи пациентов показал, что современная жидкая форма двухвалентного железа (препарат тотема, лаборатория Иннотек Интернасиональ, Франция) по количеству побочных эффектов не превышает таковые у трехвалентного (рис. 4) [4]. Такой эффект достигается равномерным распределением препарата по слизистой оболочке желудка и его высокой биодоступностью. Двухвалентное железо равномерно и максимально эффективно проникает в энтероциты и, не накапливаясь в них, поступает в кровь. Это обусловлено наличием в составе препарата меди и марганца, которые входят в состав ДМТ-белков и гефестина, окисляющего железо, что способствует наилучшему его метаболизму (см. рис. 2) [33]. Помимо этого, указанные металлы участвуют в работе системы антиоксидантов, наиболее важными составляющими которой являются Cu, Zn-супероксиддисмутаза, Mn-супероксиддисмутаза (в митохондриях), каталаза, глутатионпероксидаза и глутатион. При уменьшении антиоксидантной защиты происходит сдвиг в сторону избыточного накопления свободных радикалов, что обусловливает их повреждающее действие на клетки. Следует понимать, что процесс активации перекисного окисления липидов запускается ионами двухвалентного железа, что проявляется частым развитием побочных эффектов при лечении препаратами железа. Наличие меди и марганца в составе тотемы уменьшает образование свободных радикалов, что улучшает переносимость препаратов железа [37]. Пациентам с заболеваниями ЖКТ назначать препараты железа перорально следует с осторожностью, причем острые заболевания, такие как язва желудка и двенадцатиперстной кишки, эрозивный гастрит, являются противопоказаниями; также не следует использовать указанный метод лечения у больных с заболеваниями тонкой кишки (болезнь Крона, целиакия, мальабсорбция) или отсутствием ее части. Рис. 4. Сравнение результатов исследований безопасности применения различных железосодержащих препаратов. При лечении больных ЖДА остро стоит вопрос оценки эффективности терапии, так как часто ЖДА диагностируется у соматически тяжелых больных с крайне низким уровнем гемоглобина. Попытки ранней диагностики, как правило, связаны с исследованием количества ретикулоцитов [38], однако в настоящее время такой подход не является доказательным, так как часто ретикулоцитоз возникает компенсаторно при наличии кровотечения. В работе [5, 9] показано, что наиболее достоверными показателями, указывающими на хороший эффект препаратов железа, служат появление молодых форм ретикулоцитов и увеличение дельты гемоглобина (разницы между средним содержанием гемоглобина в ретикулоците и эритроците) уже через 1 нед после начала лечения (рис. 5). Рис. 5. Динамика гемоглобина эритроцитов (RBC), количества ретикулоцитов (Ret), фракции незрелых ретикулоцитов (IRF-) среднего содержания гемоглобина в эритроците (RBC-Hb), среднего содержания гемоглобина в ретикулоците (Ret-Hb), дельты гемоглобина (D-Hb) при лечении ЖДА в течение 1 мес. Основным критерием положительного ответа на терапию ЖДА является прирост уровня гемоглобина через 1 мес после начала применения препаратов железа, однако рекомендации разных организаций по этому вопросу не согласуются друг с другом. Минимальным приростом уровня гемоглобина в периферической крови для признания терапии эффективной является его увеличение более чем на 10 г/л за 1 мес (Центр по контролю и профилактике заболеваний в США) [39]. В нашем исследовании, проведенном при лечении 61 пациентки с гинекологической патологией и заболеваниями ЖКТ, у которых лечение привело к полному восстановлению показателей гемоглобина и обмена железа, прирост уровня гемоглобина в течение первого месяца составил от 10 до 50 г/л с медианой прироста 30 г/л [19]. Поэтому с учетом большого количества сопутствующих заболеваний у больных ЖДА и доказанной роли гепцидина в нарушении метаболизма железа за оптимальный критерий оценки эффективности терапии лучше принять прирост уровня гемоглобина более 10 г/л за 1 мес [5]. При отсутствии прироста уровня гемоглобина, согласно указанным критериям, необходимо обязательно исследовать обмен железа, провести диагностический поиск, исключить другой механизм развития анемии. При подтверждении абсолютного дефицита железа и отсутствии злокачественной опухоли следует перейти на парентеральное применение препаратов железа со строго рассчитанной терапевтической дозой. При назначении препаратов парентерально предпочтение следует отдавать внутривенному пути введения. Наиболее часто в настоящее время используются венофер (100 мг в 5 мл), космофер, феринъект (50 мг в 1 мл). За один раз, как правило, вводят 100—200 мг, но, используя феринъект, это количество можно увеличить до 1000 мг. Эти препараты должны применяться только при наличии показаний, доказанном абсолютном дефиците железа и невозможности перорального применения. Существенным недостатком парентерального применения является то, что необходимо использовать строго рассчитанное количество препарата, врач может назначать препараты только в условиях стационара, применение препаратов ограничено из-за наличия большого количества тяжелых побочных реакций (анафилактический шок, аллергические реакции, передозировка железа, системный гемосидероз, локальный гемосидероз тканей). Кроме того, как правило, есть ограничения парентерального применения препаратов при беременности, особенно в ранние сроки. В случае отсутствия гипоферритинемии есть основания проводить лечение анемии с использованием препаратов рекомбинантного человеческого эритропоэтина, эффективность которого доказана при терапии ЖДА в поздние сроки беременности [28] и у больных с миомой матки [40, 41]. Такую тактику необходимо выбирать у больных с доказанными хроническими воспалительными или инфекционными заболеваниями, доброкачественными опухолями при наличии синдрома неадекватной степени тяжести анемии выработки эритропоэтина [5, 19, 28]. Таким образом, оптимальным у больных с наличием гипохромной микроцитарной анемии является выявление причины развития дефицита железа, после чего следует начинать лечение. Если есть сомнения в железодефицитном характере анемии, лучше проверить обмен железа, подтвердив диагноз ЖДА низкими показателями ФС и насыщения трансферрина железом. Далее следует устранить хроническое заболевание, остановить кровотечение, убрать погрешности в диете и начать пероральный прием препаратов железа (с обязательным учетом противопоказаний). Лечение следует начинать с двухвалентных препаратов железа. При наличии хронических воспалительных, пролиферативных, инфекционных заболеваний лучше использовать жидкую лекарственную форму (препарат тотема), содержащую в своем составе глюконат двухвалентного железа, медь и марганец. Через 1 мес следует определить прирост уровня гемоглобина и если он выше 10 г/л в месяц — продолжить лечение, если нет — пересмотреть диагноз (рис. 6). Рис. 6. Схема лечения ЖДА. При использовании препаратов железа необходимо ориентироваться на показатель ФС, целевое значение которого должно составлять около 100 мкг/л, после чего можно остановить лечение (поздние критерии эффективности терапии [39]). При пероральном приеме препаратов достаточно подтвердить нормализацию содержания ФС через 3 мес терапии, при назначении препаратов железа внутривенно этот показатель необходимо проверять каждую неделю. Лечение препаратами рекомбинантного человеческого эритропоэтина опасно из-за возможности развития эритроцитоза и тромботических осложнений, поэтому ориентироваться прежде всего необходимо на уровень гемоглобина, целевая концентрация которого не должна превышать 120 г/л [42]. Таким образом, ЖДА представляет собой важную социально значимую проблему, а ее диагностика и лечение до сих пор являются трудной задачей. Только выполнение современных рекомендаций позволит существенно повысить качество и эффективность оказания медицинской помощи больным ЖДА. Сведения об авторах: источник |