Анемия – обширное заболевание с недостаточностью железа. Апластическая анемия – малокровие, которое развивается вследствие заболевания костного мозга. А именно – прекращения функционирования костного мозга.
Причина кроется в поражении систем организма различного происхождения. Сюда входит:
Какова же симптоматика апластической анемии? Симптомы разнообразны. В основном клиника напоминает любую другую анемию. К симптомам можно отнести:
— бледность слизистых оболочек;
В конечной стадии наблюдаются некрозы и сепсис.
Для более подробной информации зайдите на сайт: bolit.info
В любом случае проконсультируйтесь с врачом!
Апластическую анемию можно предупредить. Профилактика будет заключаться в постоянном медицинском наблюдении. Если вас беспокоят симптомы, напоминающие анемию. Срочно обратитесь к специалисту!
Проходите чаще лабораторные методы исследования крови! Анализ крови наиболее подробно покажет присутствующую патологию. Это поможет вовремя сменить профессию. Если условия труда неблагоприятны для работы.
Неспецифическая профилактика будет заключаться в изоляции с очага облучения. Как известно данный очаг неблагоприятно сказывается на здоровье организма. Особенно, если это касается костного мозга.
Прежде всего, врач должен обратить внимание на жалобы пациента. Диагностика будет заключаться на основе субъективных и объективных данных. Осмотр специалиста включает в себя образования на коже. А именно – кровоизлияния.
Затем собирается анамнез. То есть наследственные данные. Были ли случаи заболевания среди родственников. Также как давно пациента беспокоят данные симптомы. Есть ли вредные привычки.
Важным компонентом диагностики будет исследование крови. Лабораторные анализы покажут нам пониженное количество эритроцитов и снижение уровня гемоглобина.
Анализ мочи будет свидетельствовать о воспалительном процессе и кровоточивости. Можно отнести еще исследование костного мозга. В данном случае проводится пункция кости.
Апластическая анемия – явление достаточно редкое. У взрослых данное заболевание развивается остро с рецидивами и осложнениями. Апластической анемии подвержены одинаково, и женщины, и мужчины. Чаще молодого возраста.
Если своевременно начать лечение, то шансы есть. В чем же заключается лечение данного заболевания? Лечение будет заключаться в гемотрансфузии. То есть переливание крови и ее компонентов. А именно – эритроцитарная масса.
Хлористый кальций тоже используется в лечении. Витамин А, фолиевая кислота. Антибиотики – пенициллин и стрептомицин. Длительный курс лечения гормонами. К ним относят преднизалон и кортикозон.
Апластическая анемия у детей протекает не так тяжело, как у взрослых. С чем это может быть связано. Чаще у детей данное заболевание возникает как следствие вируса. А именно – дети, перенесшие вирусную инфекцию. Наследственные факторы тоже имеют место при заболевании. По статистике, вирусная инфекция – гепатит становится причиной апластической анемии. У детей осложнения наблюдаются реже. Диагностика будет заключаться в исследовании мочи и крови. А также анамнез и осмотр.
Лечение данного заболевания будет заключаться в приеме антибиотиков по возрастным показаниям. Симптоматическое лечение показано в любом возрасте. Конечной точкой будет пересадка костного мозга, но при условии необратимых осложнений.
Прогноз будет зависеть от своевременности лечения. Чем раньше начали лечение, тем лучше прогноз! Известно, что почти 90% больных погибают от апластической анемии. Данный факт опирается на своевременность лечения.
Если проведено трансплантация костного мозга, то шансов выжить гораздо больше. Все зависит от конкретного человека. Ну и, конечно же, от грамотного специалиста. Правильной диагностики данного заболевания.
Если прогноз неблагоприятный, то рассчитывать на хороший исход не придется. Все чаще не леченные вовремя болезни приводят к летальному исходу. Апластическая анемия – не исключение!
Если вы хотите сохранить жизнь себе и близким, то обращайтесь к врачу. Осложнения, которые вызваны данным заболеваниям все чаще приводят к смерти.
Инсульт, кома, хронические заболевания – неблагоприятный исход апластической анемии. Известно, что эти болезни не приведут к счастливой и долгой жизни!
У людей вовремя не вылеченных от данной болезни продолжительность жизни резко сокращается! По статистике в течение одно года погибает большее количество больных.
При трансплантации костного мозга выживаемость значительно возрастает. На четыре года больше. Примерно у 10 из 11 больных.
Если человеку вовремя провели лечебный курс, то выживаемость повышается. Больной может прожить и семь, и восемь лет. Поэтому не откладывайте визит к врачу! Будьте более внимательными к своему здоровью!
источник

Можно даже сказать, что это целая группа патологических состояний, которые представляют собой самостоятельную форму заболевания. При апластической анемии костный мозг перестает производить клетки крови в необходимом количестве: лейкоциты, тромбоциты и эритроциты. Различные виды болезни протекают по-разному, некоторые из них дают о себе знать сразу, а остальные проявляются только через время.
Тяжелая апластическая анемия требует обязательной госпитализации, так как она угрожает жизни больного. Критерии тяжелой формы заболевания заключаются в резком понижении уровня тромбоцитов в крови (менее 500/мкл), при этом также отмечается снижение нейтрофилов. Сверхтяжелая форма апластической анемии характеризуется критическим понижением нейтрофилов до 200/мкл.
Апластическая анемия у детей развивается в нескольких формах, которые характеризуются развитием определенных признаков. Самой тяжелой из них считается анемия Фанкони, при которой присутствуют врожденные дефекты развития костей, пороки сердца и почек.
Впервые это заболевание было описано Паулем Эрлихом в 1888 году у 21-летней женщины.
Термин «апластическая анемия» был предложен Чауфордом в 1904 году. Апластическая анемия — одно из самых тяжёлых расстройств гемопоэза. Без лечения больные тяжёлыми формами апластической анемии погибают в течение нескольких месяцев. При своевременном адекватном лечении прогноз достаточно хороший. Длительный период времени апластическая (гипопластическая) анемия рассматривалась как синдром, объединяющий патологические состояния костного мозга протекающие с выраженной гипоплазией кроветворения.
В настоящее время заболевание с названием «апластическая анемия» выделяют как самостоятельную нозологическую единицу — и чётко разграничивают его от синдрома гипоплазии кроветворения, являющегося проявлением ряда известных самостоятельных заболеваний костного мозга.
Многих интересует вопрос, что такое апластическая анемия и почему она появляется? К сожалению, современная медицина не может назвать очевидные причины развития апластической анемии у человека. Но известно, что болезнь бывает приобретённая и наследственная.
Существует теория, что развитие патологии связано с особенностями функционирования организма каждого индивида. Тем не менее отмечаются некоторые факторы, которые могут спровоцировать появление болезни. В частности, самым ясным из факторов является воздействие на человека ионизирующей радиации, которая подавляет функции костного мозга и приводит к снижению выработки им эритроцитов, тромбоцитов и лейкоцитов. Также к предрасполагающим факторам можно отнести следующие:
- плохая экологическая ситуация в регионе;
- регулярные контакты человека с вредными химическими веществами;
- некоторые инфекционные патологии, в частности, гепатит, цитомегаловирусная инфекция;
- проблемы с костным мозгом;
- приём некоторых медикаментов, в том числе обычных жаропонижающих и обезболивающих средств типа аспирина;
- частый приём антибиотиков, особенно левомицетина.
Обнаружено, что болезнь наблюдают у пациентов с чрезмерной тягой к алкоголю. Не последнюю роль в развитии болезни играет и генетическая предрасположенность. Апластическая анемия у детей часто развивается вследствие наследственных патологий, в том числе этом может быть анемия Фанкони. Необходимо отметить, что зачастую у детей диагностируется идиопатическая апластическая анемия – то есть патология с неясной этиологией.
Что касается такой патологии, как гипопластическая апластическая анемия – то это ещё более тяжёлая патология, вызывающая серьёзные нарушения в работе всех внутренних органов и приводящая к нарушению работоспособности систем организма.
Также следует сказать, что апластическая анемия бывает трёх форм тяжести:
- очень тяжелая (тромбоцитов менее 20,0х109/л; гранулоцитов менее 0,2х109/л)
- тяжелая (тромбоцитов менее 20,0х109/л; гранулоцитов менее 0,5х109/л), по данным трепанобиопсии – низкая клеточность костного мозга (менее 30% от нормы)
- умеренная (тромбоцитов более 20,0х109/л; гранулоцитов более 0,5х109/л)
Апластическую анемию, протекающую с избирательным угнетением эритропоэза, называют парциальной красноклеточной аплазией.
Все симптомы апластической анемии объединяются в 3 основных группы синдромов: анемический синдром, геморрагический синдром, синдром инфекционных осложнений.
Анемический синдром характеризуется:
- выраженной общей слабостью;
- быстрой утомляемостью;
- непереносимостью привычных физических нагрузок;
- одышкой и тахикардией при умеренных нагрузках, в тяжелых случаях – в покое, при перемене положения тела;
- головными болями, головокружением, эпизодами обморока;
- шумом, звоном в ушах;
- чувством «несвежей головы»;
- мельканием «мушек», пятен, цветных полос перед глазами;
- болями колющего характера в области сердца;
- снижением концентрации;
- нарушением режима «сон – бодрствование» (сонливость днем, бессонница ночью).
Объективно при обследовании пациентов устанавливаются бледность кожных покровов и видимых слизистых оболочек, приглушенность тонов сердца, учащение пульса, снижение артериального давления.
Выделяют два пика заболеваемости: в 10–25 лет и после 60 лет. Чаще болеют женщины.
Геморрагический синдром проявляется:
- гематомами (синяками) разного размера и точечными кровоизлияниями, возникающими на коже и слизистых оболочках после незначительного воздействия или спонтанно, без причин;
- кровоточивостью десен;
- кровотечением из носа;
- у женщин – маточными межменструальными кровотечениями, длительными обильными менструациями;
- розовым окрашиванием мочи;
- определением следов крови в испражнениях;
- возможными массивными желудочно-кишечными кровотечениями;
- кровоизлияниями в склеру и глазное дно;
- кровоизлияниями в головной мозг и его оболочки;
- легочными кровотечениями.
Объективное подтверждение геморрагического синдрома – точечные кровоизлияния и кровоподтеки на коже и слизистых, множественные гематомы на разных стадиях (от пурпурно-фиолетовых до желтых).
Инфекционные осложнения представлены развивающимися пневмониями, пиелонефритами, фурункулезами, постинъекционными абсцессами или инфильтратами, в тяжелых случаях – сепсисом.
В детском возрасте чаще наблюдается врожденная патология, передаваемая от родителей либо приобретенная в период внутриутробного развития. Некоторые признаки такой патологии можно определить даже у новорожденного, другие могут проявиться только через несколько лет. К числу тяжелых симптомов анемии у новорожденных относятся:
- аномалии строения лица (треугольное лицо, маленькие глаза, курносый нос и др.);
- аномалии конечностей (отсутствие большого пальца на руках, отсутствие лучевой кости, шестипалость и др.);
- низкорослость;
- особенности пигментации кожи – это скопления множественных пятен светло-коричневого цвета;
- аномалии внутренних органов, чаще мочеполовой системы;
- деформация и разрушение ногтей;
- отставание в умственном развитии;
Апластическая анемия у детей старше 1 года первоначально определяется по внешнему виду, поведению. Больные дети отличаются от сверстников бледностью кожных покровов и слизистых оболочек, у них наблюдается увеличение размеров лимфатических узлов, случаются частые кровотечения из носа, десен, по утрам появляется кровь в моче. Их поведение характеризуется частой сменой настроения, раздражительностью, они быстро утомляются, теряют аппетит.
Гематологическое обследование включает внимательный клинический осмотр и проведение специальных диагностических исследований: общего и биохимического анализа крови, стернальной пункции, трепанобиопсии. При физикальном обследовании выявляется выраженная бледность или желтушность кожи, артериальная гипотония, тахикардия.
Для гемограммы при апластической анемии типичны эритро-, лейкоцито- и тромбоцитопения, нейтропения и относительный лимфоцитоз. Исследование пунктата костного мозга показывает уменьшение количества миелокариоцитов и мегакариоцитов, снижение клеточности; в трепанобиоптате обнаруживается замещение красного костного мозга жировым (желтым). В рамках диагностического поиска апластическую анемию необходимо дифференцировать с мегабластными (В12-дефицитными, фолиеводефицитными) анемиями, идиопатической тромбоцитопенической пурпурой, пароксизмальной ночной гемоглобинурией, острым лейкозом.
Апластическая анемия может осложняться:
- тяжелыми жизнеугрожающими кровотечениями;
- бактериальным эндокардитом;
- сепсисом;
- сердечной недостаточностью;
- почечной недостаточностью;
- реакцией отторжения при трансплантации костного мозга.
При диагнозе апластическая анемия, лечение подбирается с учетом потенциальной причины, которая могла спровоцировать болезнь. Как только патология выявлена, больного нужно госпитализировать, только в больнице можно провести диагностику, подобрать и провести комплексное лечение, определить дозировку препаратов и курс терапии. Есть три способа лечения болезни:
- трансплантация;
- трансфузия;
- лечение с помощью медикаментов.
Трансплантацию считают одним из успешных способов помощи пациентам при апластической анемии. Суть процедуры заключается в пересадке костного мозга от донора. Прогноз после проведенной в больнице операции зависит от возраста пациента – чем он моложе, тем больше шансы на успех. В качестве донора может выступать близкий родственник пациента, у которого такая же группа крови.
До назначения пересадки, необходимо провести исследование, которое покажет, насколько совместимы будут клетки донора и реципиента. Перед трансплантацией проводится серьезная подготовка пациента, риск отторжения чужеродных тканей высокий. Перед трансплантацией костного мозга переливание крови не делают, проводят облучение, затем назначают химиотерапию.
Такая подготовка нужна, чтобы снизить иммунитет больного, чтобы он не атаковал чужеродные клетки на первых порах. Нужно учесть, что трансплантация мозга – затратная процедура, которая проводится в специализированных медицинских учреждениях.
Трансфузия – процедура, при которой больному переливают кровь. Для переливания используют препараты крови, подготовленные из крови доноров на станциях переливания. Методика дает лишь временный эффект, переливание частично восполняет дефицит клеток крови больного, но патология не лечится, костный мозг также остается неспособным производить собственные кровяные тельца. Недостатком трансфузионной терапии является невозможность проведения у пациентов с аутоиммунной формой патологии. Если трансфузия будет проводится часто, в печени и селезенке скапливается железо, врачи назначают пациентам медикаменты, способствующие его выведению из организма.
Лечение с помощью медикаментов проводится комплексно, пациенту назначают препараты из разных групп:
- иммунодепрессанты (специфические антиглобулины, Циклоспорин и пр.). Такие медикаменты нужны, если нет возможности пересадить костный мозг. Назначают иммуносупрессоры параллельно с гормонами, чтобы исключить анафилактическую реакцию;
- лекарства для стимуляции кроветворения (Филгастрим, Лейкомакс). Медикаменты этой группы активизируют в организме продуцирование лейкоцитов, поэтому целесообразно их назначать только при диагностировании лейкопении;
- андрогеносодержащие медикаменты (Тестостерона пропионат, Сустанон) назначаются мужчинам для подавления апластической анемии;
- гемостатики (аминокапроновая кислота и пр.) назначаются при выраженном геморрагическом синдроме;
- Десферал и его аналоги назначаются в случае необходимости избавиться от излишков железа в организме.
Другим методом лечения апластической анемии является спленэктомия (операция по удалению селезенки). Цель оперативного вмешательства – остановить происходящие в организме аутоиммунные процессы, из-за которых вырабатываются антитела к клеткам собственного костного мозга. У такой методики есть противопоказание – наличие инфекционных осложнений.
Ремиссию удаётся получить примерно у половины больных. Прогноз несколько лучше у детей, чем у взрослых.
Наличие большого количества жира в костном мозге не говорит о необратимости процесса. Бывают случаи, когда и у таких больных наступает полная ремиссия и полная репарация костномозгового кроветворения. Прогноз лучше, когда увеличено содержание ретикулоцитов, когда в костном мозге имеется более полиморфная картина, когда имеется небольшое увеличение размеров селезёнки и хотя бы небольшой, но чёткий эффект от кортикостероидных гормонов.
В этих случаях спленэктомия оказывает чаще хороший эффект вплоть до полного выздоровления. У части больных апластический синдром является началом острого лейкоза. Иногда признаки гемобластоза выявляются лишь через несколько лет от начала болезни.
источник
Апластическая анемия – тяжёлое гематологическое заболевание, сопровождающиеся малокровием, резким снижением иммунитета, а также нарушениями процессов свертывания крови. Она возникает вследствие подавления кроветворной функции костного мозг (или аплазии костного мозга).
Болезнь впервые описана известным немецким врачом и ученым Паулем Эрлихом, в 1888 году. Неизвестная ранее патология, обнаруженная у молодой беременной женщины, сопровождалась тяжёлой анемией, снижением числа лейкоцитов, лихорадкой, кровоточивостью и быстро привела к смерти больной. Проведенное патологоанатомическое исследование обнаружило замещение красного костного мозга жировой тканью. Позднее, в 1907 году, Анатоль Шоффар, французский врач, предложил назвать это заболевание апластической анемией.
Апластическая анемия – достаточно редкое заболевание. Средняя заболеваемость – 3-5 на 1 млн. всего населения за год. Большинство больных – дети и молодые люди.
Различают наследственную (генетически обусловленную) и приобретенную апластическую анемию.
80% случаев заболевания обусловлены приобретенной формой патологии, 20% вызваны генетическими факторами.
Медики пользуются классификацией патологии по МКБ-10 (Международная Классификация Болезней 10 пересмотра). Различают следующие виды апластических анемий:
D61.0 Конституциональная апластическая анемия
D61.1 Медикаментозная апластическая анемия
D61.2 Апластическая анемия, вызванная другими внешними агентами
D61.3 Идиопатическая апластическая анемия
D61.8 Другие уточненные апластические анемии
D61.9 Апластическая анемия неуточненная
У детей в большинстве случаев заболевание носит приобретенный характер. Частота встречаемости составляет 2-3 случая на 1 млн. детей (пик заболеваемости приходится на подростковый возраст). В 70% случаев непосредственную причину болезни установить не удаётся, принято считать, что наибольшее значение имеют вирусные инфекции, химикаты и лекарственные препараты.
Чаще всего диагноз устанавливают случайно, при общем анализе крови. При правильном лечении и своевременной диагностике прогноз благоприятный. Апластическая анемия у детей хорошо лечится. Результаты применения трансплантации костного мозга и иммуносупрессивной терапии примерно одинаковы по эффективности, однако следует отдавать предпочтение пересадке костного мозга от подходящего (в идеале брат или сестра) донора. Современные методы лечения апластической анемии в детском возрасте позволяют сохранить здоровье и не влияют на способность иметь детей в будущем.
Генетически обусловленные нарушения кроветворной функции отмечают при некоторых наследственных патологиях, таких как семейная анемия Фанкони, синдром Швахмана-Даймонда, истинная эритроцитарная аплазия, врождённый дискератоз.
Мутации в критически важных генах, отвечающих за регуляцию клеточного цикла, синтез белков, защиту и восстановление повреждений ДНК, ведут к образованию дефектных стволовых (гемопоэтических) клеток. Ошибки в генетическом коде инициируют запуск апоптоза – механизма запрограммированной клеточной смерти. При этом пул стволовых клеток сокращается гораздо быстрее, чем у здоровых людей.
Приобретенная форма патологии возникает в результате прямого токсического воздействия на гемопоэтические клетки. К таким факторам относят:
· Воздействие ионизирующей радиации. От апластической анемии погибла Мария Склодовская-Кюри — физик, дважды лауреат Нобелевской премии, полученной за работы в области исследования радиоактивности и за открытие новых радиоактивных элементов;
· Пестициды, инсектициды, производные бензола, соли тяжёлых металлов, мышьяк обладают прямым токсическим эффектом на костный мозг, угнетают продукцию форменных элементов крови и приводят к гибели стволовых клеток;
· Схожим эффектом обладают некоторые лекарства. Нестероидные противовоспалительные средства, противоопухолевые препараты, анальгин, левомицетин (вызывает наиболее тяжёлую форму заболевания, которая по статистике возникает в 1 из 30 тыс. курсов лечения левомицетином), мерказолил, карбамазепин, хинин способны вызвать апластическую анемию у некоторых людей;
· Пусковым фактором для болезни могут быть вирусы. Вирусные гепатиты, некоторые виды парвовирусов, ЦМВ, вирус Эпштейна-Барр и ВИЧ обладают способностью вызывать сбой в иммунной системе, вследствие чего она начинает атаковать собственные ткани организма. Например, у 2% пациентов с острым вирусным гепатитом — выявляют апластическую анемию;
· Аутоиммунные заболевания (ревматоидный артрит, СКВ) также может сопровождать аплазия костного мозга;
· Апластическая анемия при беременности, предположительно, также возникает из-за нарушений в иммунной системе.
В более 50% случаев непосредственную причину заболевания не находят, тогда говорят об идиопатической апластической анемии.
Красный костный мозг – основной и самый важный кроветворный орган, в котором происходит образование и созревание элементов крови. Стволовые гемопоэтические клетки в нем дают начало эритроцитам (отвечают за перенос О 2 и СО 2 ), лейкоцитам (обеспечивают иммунитет) и тромбоцитам (участвуют в процессах свёртывания крови). Количество гемопоэтических клеток ограничено и постепенно уменьшается на протяжении всей жизни человека.
При апластической анемии происходит массовая гибель стволовых клеток костного мозга, и, как результат, — резкое снижение содержания эритроцитов, тромбоцитов и лейкоцитов в кровеносном русле больного. Недостаток эритроцитов приводит к малокровию, уменьшение количества лейкоцитов вызывает резкое угнетение иммунной системы, уменьшение числа тромбоцитов — причина кровоточивости и, как следствие, повышенного риска неконтролируемого кровотечения.
Результаты последних исследования дают основание полагать, что приобретенная форма заболевания почти всегда — аутоиммунная патология. Ключевой момент в развитии аплазии красного костного мозга – прямое цитотоксическое действие Т-лимфоцитов. Однако причина, по которой Т-лимфоциты начинают распознавать гемопоэтические стволовые клетки как цели для атаки, до сих пор неизвестна. Пусковым фактором могут служить точечные мутации в генах, кодирующих человеческие лейкоцитарные антигены (HLA система), и объясняющий искажённый иммунный ответ (как и при других аутоиммунных патологиях).
Также полагают, что для развития патологии необходима комбинация нескольких факторов – как внутренних (неизвестные дефекты в ДНК стволовых клеток, мутации генов системы HLA, иммунные нарушения), так и внешних (лекарственные препараты, вирусные инфекции, экзотоксины и антигены).
Симптомы, характерные для заболевания:
· Необъяснимая слабость, утомляемость, сонливость;
· Одышка, возникающая даже при легком физическом напряжении;
· Головокружение, головные боли;
· Перебои в сердце, сердцебиение, тахикардия;
· Удлинение времени свертывания крови, кровоизлияния в мягкие ткани, головной мозг, образование синяков и кровоподтёков при незначительном воздействии, кровотечение из носа, затяжные изнуряющие менструации у женщин;
· Мелкоточечные кровоизлияния в кожу и слизистые оболочки, кровоточивость десен;
· Частые инфекции (дыхательных путей, кожи, слизистых оболочек, мочевыводящих путей), сопровождающиеся лихорадкой;
· Безболезненные язвы на слизистой рта;
· Потеря массы тела, похудание.
Течение болезни может быть постепенным или молниеносным (с быстрым развитием крайне тяжелой анемии, иммунодефицита, нарушениям процессов свертывания крови с соответствующими осложнениями).
Для диагностики используют развернутый анализ крови и гистологическое исследование материала, добытого из костного мозга.
Лабораторные признаки патологии, обнаруживаемые в периферической крови:
· Снижение концентрации эритроцитов и гемоглобина в крови без дефицита железа;
· Снижение концентрации лейкоцитов всех видов в крови больного;
· Низкое количество ретикулоцитов – незрелых форм эритроцитов;
· Увеличение скорости оседания эритроцитов (до 40-60 мм/ч).
В очень тяжелых случаях концентрация гемоглобина падает ниже 20-30 гр/л. Цветовой показатель, уровни сывороточного железа, эритропоэтина обычно в норме или повышены. Количество тромбоцитов ниже нормы, в тяжёлых случаях они полностью отсутствуют.
Диагноз подтверждается с помощью биопсии костного мозга. Гистология пунктата показывает большое содержание жира на фоне снижения количества гемопоэтических клеток. Клеточность (общее содержание гемопоэтических стволовых клеток) – ниже 30%, могут отсутствовать мегакариоциты – клетки-предшественники тромбоцитов.
По результатам биопсии различают апластическую анемию лёгкой, тяжёлой и крайне тяжелой степени.
Тяжёлая форма болезни: клеточность – ниже 25%; в периферической крови: нейтрофилов – 9 /л, тромбоцитов – 9 /л, ретикулоцитов – 9 /л.
Крайне тяжелая форма болезни: клеточность – ниже 25; в периферической крови: нейтрофилов – 9 /л, тромбоцитов – 9 /л, ретикулоцитов – 9 /л.
Легкая форма патологии отклонения от нормы не достигают таких критических показателей.
Тактика лечения зависит от нескольких факторов: от степени тяжести, возраста больного, возможности провести пересадку костного мозга от подходящего донора (в идеале – близкие единокровные родственники больного).
Оптимальным методом лечения тяжелой и крайне тяжелой формы патологии принято считать трансплантацию костного мозга от подходящего донора. Максимальный эффект наблюдается у пациентов молодого возраста. При пересадке костного мозга от подходящего донора 10-летняя выживаемость может достигать 85-90%.
При наличии противопоказаний к трансплантации костного мозга или отсутствии возможности провести её (отсутствие подходящего донора) используется иммуносупрессивная терапия.
Основные препараты, использующиеся для консервативной терапии – антитимоцитарный иммуноглобулин (АТГ) и циклоспорин А.
АТГ – это сыворотка, содержащая антитела против человеческих Т-лимфоцитов, полученная из лошадиной крови. Введение приводит к сокращению популяции Т-лимфоцитов в организме больного, в результате снижается цитотоксическое воздействие на стволовые клетки, улучшается кроветворная функция.
Циклоспорин А – селективный иммунодепрессант, избирательно блокирующий активацию Т-лимфоцитов и высвобождение интерлейкинов, включая интерлейкин-2. В результате блокируется аутоиммунный процесс, разрушающий стволовые клетки, улучшается кроветворная функция. Циклоспорин А не подавляет кроветворную функцию костного мозга и не приводит к тотальной иммуносупрессии.
Показания к назначению глюкокортикостероидов при апластической анемии ограничены профилактикой осложнений при терапии АТГ. Во всех остальных случаях стероидные гормоны имеют посредственную эффективность и являются причиной целого ряда осложнений.
Несмотря на высокую эффективность иммуносупрессивной терапии наиболее радикальное лечение — это пересадка костного мозга. Применение АТГ и циклоспорина А увеличивает риск развития миелодиспластического синдрома и лейкозов, не гарантирует отсутствие рецидивов заболевания.
При неэффективности иммуносупрессивной терапии проводится пересадка костного мозга от донора, не состоящего в родстве с больным. Результаты операции могут быть разными. В 28-94% случаев отмечают 5-летняя выживаемость, в 10-40% случаев происходит отторжение трансплантата.
Пациенты с тяжёлой апластической анемией получают препараты крови в качестве экстренной медицинской помощи. Переливание эритроцитарной массы позволяет быстро компенсировать анемию, а переливание тромбоцитарной массы предупреждает угрожающие жизни кровотечения.
Даже при стойкой ремиссии необходимо проходить периодические обследования (прежде всего, сдавать анализы крови) и по возможности — избегать воздействия негативных факторов.
В период лечения следует помнить, что больные с апластической анемией имеют слабую иммунную систему. Необходимо избегать посещения мест массового скопления людей, регулярно мыть руки, не есть приготовленную в сомнительных местах еду (из-за риска инфекции). Своевременная вакцинация может предупредить некоторые заболевания (в том числе гриппа).
Высокий риск кровотечения или кровоизлияния ограничивает занятия спортом, особенно травмоопасными видами. Несмотря на это, активный образ жизни с регулярными дозированными физическими нагрузками положительно влияют на самочувствие и психоэмоциональное состояние больных.
Сбалансированное питание, богатое витаминами, минералами и белками способствует быстрому восстановлению кроветворения. Не следует употреблять скоропортящиеся продукты (из-за риска возникновения пищевых токсикоинфекций). При лечении циклоспорином А следует ограничить потребление соли.
Оппортунистические инфекции (вирусные, грибковые, бактериальные), обусловленные иммунодефицитом;
Кровотечения, кровоизлияния, нарушения свертывания крови (обусловленные низким числом тромбоцитов);
Осложнения, обусловленные побочными эффектами лекарственных средств для лечения апластической анемии (вторичный гемохроматоз, сывороточная болезнь);
Трансформация болезни в миелодиспластический синдром, лейкемию и другие гематологические заболевания.
До выяснения причин и механизмов развития патологии смертность от апластической анемии достигала 90%. За последние 20-30 лет удалось значительно снизить летальность заболевания. Современные методы лечения значительно улучшили прогноз – 85% пациентов достигают 5-летнего порога выживаемости.
У детей и молодых людей при адекватном лечении прогноз благоприятный и пятилетняя выживаемость достигает 90% (для больных старше 40 лет — 75%).
Эффективные меры профилактики генетически обусловленной апластической анемии отсутствуют в настоящее время.
Профилактика приобретенной апластической анемии заключается в адекватной защите от воздействия токсических веществ, пестицидов и ионизирующего излучения. Следует избегать самостоятельного приема лекарственных средств, особенно длительного и в высоких дозах.
источник
Новые медикаменты и пересадка костного мозга помогут людям с апластической анемией жить полноценной жизнью гораздо дольше.
Кровь — это жизнь. Но редкая болезнь под названием апластическая анемия лишает организм жизни, лишая организм крови. (23.03.2008 — HealthDay Новости). Кровь пациентов с апластической анемией становится обедненной клетками крови, так как костный мозг замедляет их производство. Симптомы заболевания могут варьироваться в зависимости от того, какого типа клеток крови больше всего не хватает. Это может быть хроническая усталость, болезни сердца, бесконечные инфекций, понижение свертываемости крови.
Но есть надежда. Не смотря на то, что как два десятилетия назад, так и как в последнее время, болезнь часто оканчивается смертельным исходом, в настоящее время апластическая анемия становится гораздо более управляемым заболеванием. Достижения в области медикаментозной терапии и успехи в области трансплантации позволили сократить число летальных исходов, что позволяет пациентам жить полноценной жизнью гораздо дольше.
«Мы совершенствуем методы лечение апластической анемии — либо полностью вылечиваем заболевание, либо лечим ее симптомы», говорит д-р Ярослав П. Мациежевский (Dr. Jaroslaw P. Maciejewski, Cleveland Clinic’s Department of Hematologic Oncology and Blood Disorders). И эти успехи помогают врачам лучше понять другие, имеющие более широкое распространение заболевания, такие как болезни сердца и лейкемия.
По данным Национальных институтов здравоохранения ежегодно в США регистрируется 50 тысяч случаев апластической анемии и 20-30 тысяч случаев миелодиспластического синдрома (миелодиспластический синдром или МДС — это подобное апластической анемии заболевание крови, которое возникает тогда, когда костный мозг начинает производить плохо функционирующие или незрелые клетки крови).
Важно отметить, что многие симптомы апластической анемии, такие как усталость и инфекции, также могут быть вызваны другими заболеваниями, говорит д-р Роналд Пакетт (Dr. Ronald Paquette, a blood disease researcher with the University of California, Los Angeles’ Jonsson Comprehensive Cancer Center) специалист по заболеваниям крови в Калифорнийском университете.
Костный мозг — это губчатый материал внутри кости, который производит стволовые клетки, которые в свою очередь превращаются в три типа клеток крови — эритроциты, лейкоциты и тромбоциты. «По существу, костный мозг – это завод крови», — говорит Мациежевский. У больных с апластической анемией, стволовые клетки повреждаются, вследствие чего происходит замедление или остановка производства всех клеток крови.
Причина повреждения стволовых клеток остается неизвестной в более чем половине случаев заболеваний апластической анемией. Согласно научным исследованиям Национального института здоровья есть предположение, что стволовые клетки повреждаются, когда иммунная система человека атакует свои собственные клетки организма по ошибке.
Некоторые случаи апластической анемии были связаны с воздействием токсинов, таких как пестициды, мышьяк и бензол. Инфекционные заболевания также могут привести к нарушениям приводящим к апластической анемии. Это инфекционные заболевания как гепатит, вирус Эпштейна-Барра, цитомегаловирус, парвовирус B19, ВИЧ, а также аутоиммунные заболевания, такие как системная красная волчанка и ревматоидный артрит. Наконец, некоторые генетические нарушения могут привести к апластической анемии.
Симптомы апластической анемии зависят от типа клеток крови, которых больше всего не хватает в организме:
— Недостаток эритроцитов может привести к нехватке кислорода в организме. Люди, у которых низкий уровень эритроцитов нередко чувствуют себя усталыми. Из-за того, что сердце должно работать быстрее и напряженнее, чтобы снабдить органы и ткани кислородом, со временем могут развиться сердечно-сосудистые заболевания.
— Недостаток лейкоцитов может ослабить иммунитет человека. Человек может чаще болеть инфекционными заболеваниями, и обычные болезни могут проходить в тяжелой форме.
— Недостаток тромбоцитов, снижает способность крови свертываться. Пациенты с низким уровнем тромбоцитов могут иметь большое количество синяков и гематом. Возможны кровотечения, которые трудно остановить.
«После того, как человеку поставлен диагноз апластическая анемия необходимо сразу начать лечение», — говорит д-р Пакетт. «Очень важно, чтобы лечение было в специализированном центре, так как это очень редкое заболевание» — сказал он. «Самое главное заключается в том, чтобы вас наблюдал специалист с большим опытом лечения заболеваний на ранней стадии».
Для пациентов моложе 30 лет трансплантация стволовых клеток является предпочтительным методом лечения. Для тех, у кого есть родственный донор (подходящие брат или сестра), проводят трансплантацию стволовых клеток, здоровые стволовые клетки донора заменяет дефектные клетки костного мозга больного человека. По данным Международного фонда апластической анемии и МДС более 80% процентов пациентов полностью выздоравливают (Aplastic Anemia & MDS International Foundation Inc.)
По мнению д-ра Пакетта достижения в области исследования стволовых клеток и препаратов против отторжения донорских клеток привели к тому, что трансплантации от неродственных доноров также становятся все более успешными.
Одним из перспективных направлений лечения является трансплантация стволовых клеток пуповинной крови. «Стволовые клетки пуповинной крови новорожденных младенцев можно замораживать и сохранять в банке клеток, чтобы позже использовать как донорские клетки, как для новорожденного (в случае возникновения у него тяжелых заболеваний), так и для неродственной трансплантации», говорит д-р Пакетт. — «Это очень обнадеживает».
Для пациентов с апластической анемией важно начать лечение как можно скорее. «Как показывают исследования, чем раньше была сделана пересадка костного мозга с момента постановки диагноза, тем лучше результат» — считает Пакетт.
Больные, у которых нет донора, или те, для которых трансплантация невозможна по медицинским показаниям, часто получают иммуносупрессивную терапию такими препаратами как антитимоцитарный глобулин и циклоспорин. По данным Международного фонда апластической анемии и МДС положительная динамика в результате иммуносупрессивной терапии наблюдается в 70-80% случаев.
Переливание крови от подходящего донора также помогает поддержать показатели крови на высоком уровне. Это помогает облегчить симптомы заболевания, хотя этот метод не является эффективными при длительном лечении.
«Так или иначе, вылечиваем ли мы болезнь или нет, в любом случае состояние пациента можно улучшить «, говорит д-р Ярослав П. Мациежевский. — «Теперь мы можем сохранить жизнь людям с апластической анемией или продлить им жизнь на долгие годы».
источник
Апластическая анемия – угнетение функции кроветворения красного костного мозга (эритроцитопоэза, лейкопоэза и тромбоцитопоэза), приводящее к пангемоцитопении. К основным клиническим проявлениям гематологического синдрома принадлежат головокружение, слабость, обмороки, одышка, покалывание в груди, кожные геморрагии, кровотечения, склонность к развитию инфекционно-воспалительных и гнойных процессов. Заболевание диагностируется на основании характерных изменений гемограммы, миелограммы и гистологического исследования трепанобиоптата. Лечение патологии включает проведение гемотрансфузий, иммуносупрессивной терапии, миелотрансплантации.
Апластическая (гипопластическая) анемия – тяжелое расстройство гемопоэза (чаще всех его звеньев), сопровождающееся развитием анемического, геморрагического синдромов и инфекционных осложнений. Развивается в среднем у 2 человек на 1 млн. населения в год. Приблизительно с одинаковой частотой патология поражает мужчин и женщин. Возрастные пики заболеваемости приходятся на возраст 10–25 и старше 50 лет. При данной патологии в костном мозге чаще нарушается образование всех трех типов клеточных элементов крови (эритроцитов, лейкоцитов и тромбоцитов), иногда — только одних эритроцитов; в зависимости от этого различают истинную и парциальную апластическую анемию. В гематологии данный вид анемии относится к числу потенциально фатальных заболеваний, приводящих к гибели 2/3 заболевших.
По происхождению апластическая анемия может быть врожденной (связанной с хромосомными аберрациями) и приобретенной (развившейся в течение жизни). Принято считать, что угнетение миелопоэза связано с появлением в красном костном мозге и крови цитотоксических T-лимфоцитов, производящих фактор некроза опухолей и γ-интерферон, которые в свою очередь подавляют ростки кроветворения. Запускать этот механизм могут различные внешнесредовые (химические соединения, физические явления, лекарственные вещества), а также эндогенные факторы (вирусы, аутоиммунные реакции). К числу наиболее значимых причин относят:
- Прием миелотоксических препаратов. Достоверно установлена связь анемии с приемом некоторых противоопухолевых, противосудорожных, антибактериальных, антитиреоидных, противомалярийных препаратов, транквилизаторов, препаратов золота и др., обладающих потенциальным миелотоксическим эффектом. Лекарственные вещества могут вызывать как прямое повреждение стволовых кроветворных клеток, так и опосредованное — через аутоиммунные реакции. Анемии, связанные с таким механизмом развития, называются лекарственными.
- Контакт с химическими и физическими агентами. Супрессию костного мозга может вызывать взаимодействие с органическими растворителями, соединениями мышьяка, бензольными соединениями, пестицидами, облучение всего тела. В некоторых случаях недостаточность гемопоэза является временной и обратимой — главными факторами здесь являются концентрация/доза вещества и время контакта. супрессию костного мозга.
- Вирусные инфекции. Из вирусных агентов наибольшее значение уделяется возбудителям гепатитов В, С и D. В этом случае гипопластическая анемия обычно развивается в течение полугода после перенесенного вирусного гепатита. При изучении патогенеза было замечено, что репликация вируса происходит в мононуклеарах крови и костного мозга, а также в иммунных клетках. Предполагается, что подавление миелопоэза в этом случае является своеобразным иммунным ответом, возникающим против клеток, несущих на своей поверхности вирусные антигены. Такой вид анемии выделяется в отдельную форму – постгепатитную. Среди других вирусных инфекций называются ЦМВ, инфекционный мононуклеоз, грипп.
Также описаны случаи панцитопении, вызванные инфицированием туберкулезом, интоксикацией, лучевой болезнью, лимфопролиферативными заболеваниями (тимомой, лимфомой, хроническим лимфобластным лейкозом), беременностью. Почти в половине наблюдений причину анемии выявить не удается — такие случаи относят к идиопатической форме.
В основе апластической анемии может лежать либо первичное повреждение гемопоэтических стволовых клеток, либо нарушение их эффективной дифференцировки. При наследственных анемиях недостаточность гемопоэза опосредована кариотипическими аберрациями, приводящими к нарушению репарации ДНК и невозможности репликации стволовых клеток костного мозга. В случае приобретенной анемии под влиянием этиофакторов наблюдается активация Т-клеток, которые начинают продуцировать цитокины (интерферон-гамма, ФНО), поражающие клетки-предшественники гемопоэза. В стволовых клетках костного мозга повышается экспрессия генов, отвечающих за апоптоз и активизацию клеточной гибели. Основные клинические проявления обусловлены пангемоцитопенией – снижением в составе крови всех ее форменных элементов (эритроцитов, лейкоцитов, тромбоцитов).
Кроме различных этиологических вариантов (лекарственного, постгепатитного, идиопатического), различают острую (до 1 мес. течения), подострую (от 1 до 6 мес.) и хроническую (более 6 мес.) форму заболевания. Анемию, протекающую с избирательным угнетением эритропоэза, называют парциальной красноклеточной аплазией. На основании выраженности тромбо- и гранулоцитопении данная форма анемии подразделяется на 3 степени тяжести:
- очень тяжелую (тромбоцитов менее 20,0х109/л; гранулоцитов менее 0,2х109/л)
- тяжелую (тромбоцитов менее 20,0х109/л; гранулоцитов менее 0,5х109/л), по данным трепанобиопсии – низкая клеточность костного мозга (менее 30% от нормы)
- умеренную (тромбоцитов более 20,0х109/л; гранулоцитов более 0,5х109/л)
Поражение трех гемопоэтических ростков (эритро-, тромбоцито- и лейкопоэза) обусловливает развитие анемического и геморрагического синдромов, инфекционных осложнений. Дебют апластической анемии обычно происходит остро. Анемический синдром сопровождается общей слабостью и утомляемостью, бледностью кожи и видимых слизистых, шумом в ушах, головокружением, покалыванием в груди, одышкой при нагрузке.
Основным проявлением тромбоцитопении выступает геморрагический синдром. Больные отмечают появление петехий и экхимозов на коже, повышенную кровоточивость десен, спонтанные носовые кровотечения, меноррагии. Возможно возникновение гематурии, маточных и желудочно-кишечных кровотечений. Следствием лейкопении и агранулоцитоза служит частое развитие инфекционных процессов – стоматитов, пневмоний, инфекций кожи и мочевыводящих путей. Для апластической анемий нехарактерны похудание, лимфаденопатия, гепато- и спленомегалия – при этих признаках следует искать другую причину пангемоцитопении.
Врожденная апластическая анемия (синдром Фанкони) обычно развивается у детей в возрасте до 10 лет и кроме аплазии костного мозга характеризуется другими нарушениями: микроцефалией, гипоплазией почек, низкорослостью, аномалиями развития верхних конечностей (гипоплазией первой пястной и лучевой кости), гипоспадией, гиперпигментацией кожи, крайней степенью тугоухости и др. При наследственной анемии Эстрена-Дамешека отмечается тотальное поражение кроветворения и панцитопения при отсутствии врожденных аномалий развития. Для анемии Даймонда-Блекфена или парциальной красноклеточной аплазии характерно только снижение количества эритроцитов.
Летальный исход может быть обусловлен кровоизлияниями во внутренние органы, массивными кровотечениями, инфекционными осложнениями, анемической комой. Наиболее грозное из геморрагических осложнений – кровоизлияние в головной мозг (геморрагический инсульт). Больные склонны к частым и тяжело протекающим вирусным и бактериальным инфекциям респираторного тракта. Значительное или стремительное снижение уровня красных кровяных телец может привести к анемической коме. При молниеносной форме крайне быстро развиваются тяжелейшая анемия, иммунодефицит, коагулопатии, имеющие фатальные последствия.
Оценка гематологического статуса включает внимательный клинический осмотр и проведение тщательной лабораторной диагностики. При физикальном обследовании выявляется выраженная бледность или желтушность кожи, артериальная гипотония, тахикардия. Основу диагностического алгоритма составляет проведение общего и биохимического анализа крови, стернальной пункции, трепанобиопсии:
- Исследования крови. Для гемограммы при гипопластической анемии типичны эритро-, лейкоцито- и тромбоцитопения, нейтропения и относительный лимфоцитоз. Оценка биохимических показателей (печеночных проб, нефрологического комплекса, сывороточного железа, билирубина) информативна для исключения других анемий.
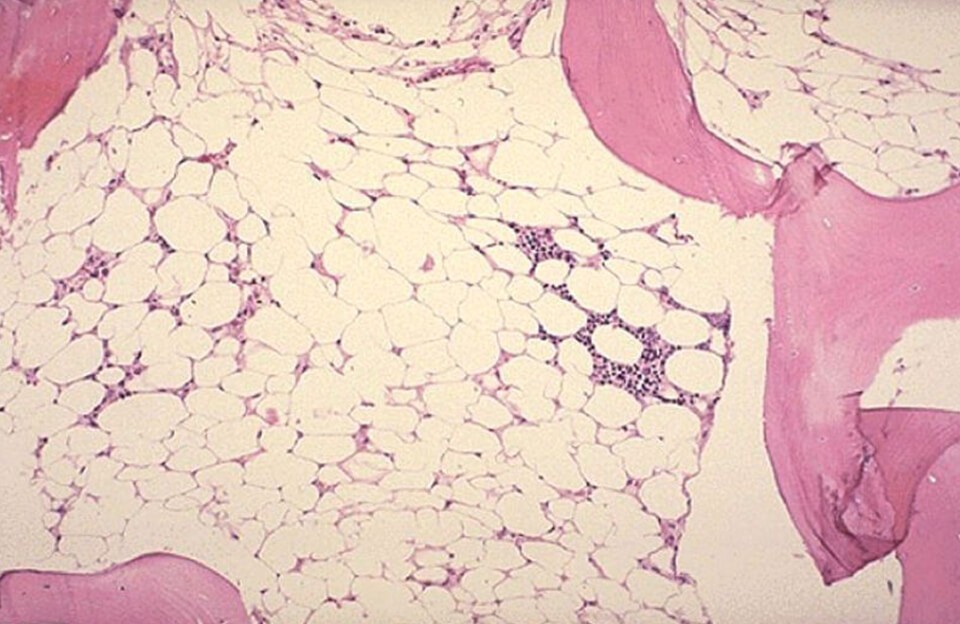
- Исследованиепунктата костного мозга. В миелограмме обнаруживается уменьшение количества миелокариоцитов и мегакариоцитов, снижение клеточности. В трепанобиоптате определяется замещение красного костного мозга жировым (желтым).
В рамках диагностического поиска апластическую анемию необходимо дифференцировать с мегабластными (В12-дефицитными, фолиеводефицитными) анемиями, идиопатической тромбоцитопенической пурпурой, пароксизмальной ночной гемоглобинурией, острым лейкозом.
Больные с апластической анемией госпитализируются в специализированные отделения. Им обеспечиваются полная изоляция и асептические условия для предупреждения возможных инфекционных осложнений. Проведение эффективного лечения является сложной проблемой практической гематологии. В зависимости от уровня цитопении используются следующие лечебные подходы:
- Иммуносупрессиная терапия. При умеренной цитопении назначается фармакотерапия, включающая комбинацию антитимоцитарного иммуноглобулина и циклоспорина А. Поддерживающая терапия проводится анаболическими стероидами или их сочетанием с циклоспоринами.
- Гемотрансфузии. В комплексе с курсом иммуносупрессивной терапии при низких показателях красной крови показано проведение заместительной гемотрансфузионной терапии (переливание тромбоцитов и эритроцитарной массы), плазмафереза. Данная мера не оказывает воздействия на патогенетическое звено заболевания, но позволяет восполнить дефицит кровяных телец, не вырабатываемых костным мозгом.
- Трансплантация КМ и СК. Наиболее благоприятные прогнозы на долгосрочную выживаемость оказывает выполнение аллогенной трансплантации костного мозга. Однако ввиду сложности подбора иммунологически совместимого донора процедура используется ограниченно. В качестве экспериментальных подходов рассматриваются аутологичные трансплантации, пересадка стволовых клеток периферической крови. Больным с нетяжелой формой анемии может быть показано проведение спленэктомии, эндоваскулярной окклюзии селезеночной артерии.
Прогноз определяется этиологической формой, тяжестью и остротой течения анемии. Критериями неблагоприятного исхода служат быстрое прогрессирование заболевания, тяжелый геморрагический синдром и инфекционные осложнения. После трансплантации костного мозга ремиссии удается достичь у 75–90% пациентов. Первичная профилактика данной разновидности анемии предполагает исключение влияния неблагоприятных внешнесредовых факторов, необоснованного применения лекарственных препаратов, предупреждение инфекционной заболеваемости и др. Пациентам с уже развившимся заболеванием требуется диспансерное наблюдение гематолога, систематическое обследование и длительная поддерживающая терапия.
источник
Апластической анемией (АА) называют заболевание, при котором костный мозг больного перестает производить достаточные количества всех основных видов клеток крови – эритроцитов, лейкоцитов и тромбоцитов. Отсюда и название болезни: она сочетает в себе анемию (недостаточное число эритроцитов, низкий уровень гемоглобина) и аплазию кроветворения (угнетение выработки всех клеток крови).
Апластическая анемия – редкая болезнь: ее частота составляет порядка 2-6 случаев на миллион жителей в год. АА может возникнуть как у детей, так и у взрослых; считается, что пики заболеваемости наблюдаются в молодом возрасте (15-30 лет) и затем в пожилом (свыше 60 лет). Мужчины и женщины заболевают одинаково часто.
В подавляющем большинстве случаев причина заболевания неизвестна – в этом случае говорят об идиопатической АА. Но иногда развитие болезни связано с некоторыми врожденными патологиями или с внешними факторами: использованием определенных лекарств (хинин, хлорамфеникол и др.), работой с токсичными веществами (гербициды, инсектициды, некоторые растворители, включая бензол), облучением или перенесенными инфекциями (инфицирование вирусами гепатитов, вирусом Эпштейна-Барр, ВИЧ; возможно, также цитомегаловирусом).
Считается, что идиопатическая АА обычно имеет аутоиммунную природу, то есть возникает тогда, когда иммунная система организма по какой-то причине начинает бороться против его собственных клеток костного мозга.
Проявления апластической анемии связаны с панцитопенией – дефицитом всех разновидностей клеток крови.
- Недостаток эритроцитов – бледность, слабость, одышка, учащенное сердцебиение, головокружения, головные боли.
- Недостаток тромбоцитов – кровотечения, в том числе из носа и десен; появление синяков и петехий (мелких подкожных кровоизлияний).
- Недостаток лейкоцитов – слабая сопротивляемость инфекциям. Могут возникнуть инфекционные заболевания, плохо поддающиеся терапии или часто повторяющиеся.
Апластическая анемия бывает разной степени тяжести: различают легкую, средней тяжести, тяжелую и сверхтяжелую формы АА.
Заподозрить АА можно при появлении у ребенка перечисленных жалоб и симптомов, а подтвердить – на основании результатов клинического анализа крови, где резко снижены количества эритроцитов, лейкоцитов и тромбоцитов. Производятся также другие клинические и лабораторные исследования, но окончательный диагноз ставится только по результатам анализа образца костного мозга, полученного с помощью пункции и/или трепанобиопсии. Исследование костного мозга необходимо для того, чтобы исключить другие возможные причины дефицита клеток крови, такие как лейкоз, миелодиспластические синдромы, миелофиброз и др.
При апластической анемии исследование костного мозга указывает на аплазию или гипоплазию кроветворения – то есть костный мозг практически не производит клетки крови или же производит их, но существенно меньше нужного. Таким образом специалисты могут сделать вывод, что дефицит клеток крови связан именно с их недостаточным образованием в костном мозге, а не, например, с их ускоренным разрушением в крови.
В ходе диагностических исследований необходимо также надежно отличать АА от врожденной анемии Фанкони, так как лечение этих болезней (включая протоколы трансплантации костного мозга) заметно различается. Для подтверждения или исключения анемии Фанкони могут использоваться цитогенетические исследования.
Лечение тяжелой и сверхтяжелой АА должно быть начато сразу после постановки диагноза, так как состояние серьезного дефицита всех клеток крови опасно для жизни. Если развитие АА вызвано определенной внешней причиной (лекарства, радиация), то в первую очередь надо убрать эту причину. Однако, как уже говорилось, какой-то внешний фактор развития болезни удается установить лишь в очень небольшом числе случаев.
Так как АА предположительно имеет аутоиммунную природу, то для ее лечения широко применяется иммуносупрессивная терапия – то есть терапия, которая направлена на подавление иммунной системы, «атакующей» клетки костного мозга. Обычно такая терапия включает в себя антитимоцитарный глобулин (АТГ) или антилимфоцитарный глобулин (АЛГ) в сочетании с циклоспорином; для профилактики побочных действий АТГ могут использоваться стероидные гормоны, такие как метилпреднизолон. Ответ на эту терапию, как правило, возникает медленно: в случае успеха костный мозг постепенно восстанавливается через несколько недель или месяцев после введения лекарств и начинает производить здоровые клетки.
Для проведения курса иммуносупрессивной терапии АА обычно необходима госпитализация. Основные осложнения в ходе лечения – это инфекции и кровотечения. Если нет ответа на первый курс терапии, могут быть проведены повторные курсы. Иммуносупрессивная терапия эффективна приблизительно в 70% случаев. К сожалению, у части больных после нее возникают рецидивы болезни.
Аллогенная трансплантация костного мозга в случае успеха приводит к полному излечению. Трансплантация особенно предпочтительна в случаях, когда больной молод и у него есть полностью совместимый родственный донор (брат или сестра). В отсутствие родственного донора допустимо использование совместимого неродственного донора, хотя результаты при этом в среднем хуже. Аллогенная трансплантация связана с серьезными рисками, включая возможное отторжение трансплантата или реакцию «трансплантат против хозяина».
В ходе лечения АА нужна интенсивная заместительная терапия компонентами крови (переливания донорских тромбоцитов, эритроцитов, в случае тяжелых инфекций – иногда и гранулоцитов). Однако если планируется трансплантация костного мозга, то нужно помнить, что множественные переливания перед трансплантацией повышают вероятность отторжения трансплантата.
Очень важны профилактика и лечение бактериальных, вирусных и грибковых инфекций, которые представляют большую опасность для больных АА. Для лечения применяют сочетания эффективных антибиотиков и противогрибковых препаратов, иногда на протяжении долгого времени.
В качестве дополнительной терапии используются также факторы роста – препараты, помогающие костному мозгу производить нужные клетки. Среди них можно назвать гранулоцитарный колониестимулирующий фактор (нейпоген, лейкостим, граноцит), который стимулирует выработку лейкоцитов, и эритропоэтин, стимулирующий выработку эритроцитов.
Без лечения больные тяжелыми формами апластической анемии погибают в течение нескольких месяцев. Однако при современном адекватном лечении прогноз достаточно хороший.
Как уже говорилось, во многих случаях эффективна иммуносупрессивная терапия. Больные после такой терапии могут продолжительное время чувствовать себя хорошо, однако у некоторых из них возникает рецидив (возвращение) болезни. Для своевременного обнаружения рецидива необходимы регулярные проверки, в первую очередь анализы крови.
Среди детей и молодых взрослых, получивших трансплантацию костного мозга от полностью совместимых родственных доноров, полностью излечиваются более 80%. При использовании неродственных доноров вероятность успеха в среднем ниже и зависит от многих факторов. Однако следует отметить, что в последние годы результаты неродственных трансплантаций при АА улучшились.
источник
Апластическая анемия — лечение, симптомы, причины, диагностика и прогноз. Клинические рекомендации, которые помогут остановить тяжелое заболевание
Апластическая анемия ― патология крови, которая связана с угнетением кроветворения (гемопоэза), в результате чего в костном мозге нарушается образованием эритроцитов, тромбоцитов и лейкоцитов.
Заболевание относится к одной из самых тяжелых видов анемии. Встречается преимущественно в молодом (5-25 лет) и пожилом (после 50 лет) возрасте. Радикальным методом терапии является пересадка костного мозга. При невозможности проведения операции, в большинстве случаев, прогноз для жизни неблагоприятный. Впервые описал заболевание иммунолог Пауль Эрлих в конце 19 века.
Существует 3 теории развития апластической анемии, каждая из которых получила научное подтверждение. Воздействие нескольких неблагоприятных факторов утяжеляет течение болезни и затрудняет терапию. По статистике, анемия с угнетением кроветворения встречается редко ― в среднем у 2 человек на миллион населения.
Костный мозг состоит из «скелета» — стромы, в котором находятся предшественники кровяных клеток. Здесь синтезируются факторы роста, которые стимулируют образование молодых клеток крови. Нарушение строения и функций костного мозга и его «скелета» возникает под действием генетических (мутаций хромосом) и приобретенных факторов. В результате развивается угнетение всех ростков гемопоэза: красного (эритроциты, тромбоциты) и белого (лейкоциты).
При некоторых условиях организм воспринимает собственные клетки костного мозга, как чужеродные, и вырабатывает защитные антитела. Это приводит к разрушению предшественников эритроцитов, тромбоцитов, лейкоцитов и, соответственно, уменьшению количества форменных элементов в крови.
Аутоиммунный конфликт возникает вследствие генетических мутаций. Это приводит к нарушению синтеза особых белков, при помощи которых организм распознает свои и чужие клетки. Сбой в работе иммунитета угнетает гемопоэз.
В организме существует защитная система удаления поврежденных, мутированных и опухолеподобных клеток. Этот процесс называется апоптоз. Таким образом поддерживается нормальный клеточный состав тканей и осуществляется защита от онкологических заболеваний.
Под действием генетических факторов нарушается синтез белков, которые являются маркерами дефектных клеток. В результате апоптоз происходит в здоровом костном мозге. Это вызывает преждевременное разрушение молодых эритроцитов, тромбоцитов и лейкоцитов.
В МКБ-10 апластической анемии присвоен код D61. Классификация включает причины (этиологию), вид угнетенного ростка гемопоэза, тяжесть течения заболевания.
По происхождению анемия бывает:
p, blockquote 12,0,0,0,0 —>
- врожденная (конституциональная) ― возникает вследствие генетических мутаций;
- приобретенная ― развивается при воздействии неблагоприятных факторов внешней среды;
- идиопатическая (первичная) ― происходит без видимой причины;
- неуточненная ― если при проведении диагностики этиологию не удалось установить.
По угнетенному ростку кроветворения выделяют анемии:
p, blockquote 13,0,0,0,0 —>
- истинные ― снижается образование всех клеток костного мозга (панцитопения);
- парциальные ― происходит угнетение только одного ростка кроветворения, чаще эритроцитарного.
Анемии по тяжести течения бывают:
p, blockquote 14,0,0,0,0 —>
- тяжелые ― нейтрофилы (вид лейкоцитов) 0,2-0,5х10*9/л, ретикулоциты (молодые формы эритроцитов) менее 1%, тромбоциты не более 20х10*9/л, при трепанобиопсии (пункция костного мозга для анализа) количество клеток составляет 50% от нормы;
- средней тяжести ― нейтрофилы более 0,5х10*9/л, ретикулоциты больше 1%, тромбоциты не менее 20х10*9/л, показатели трепанобиопсии ― 30%;
- сверхтяжелая ― нейтрофилов менее 0,2х10*9, анализ пунктата костного мозга ― менее 30%.
Апластической анемии легкой степени не существует . Заболевание всегда имеет тяжелое течение и сопряжено с риском развития осложнений.
Выделяют 2 основных фактора, которые приводят к возникновению апластической анемии. Это мутации хромосом и негативное влияние внешней среды (приобретенные формы болезни).
Мутации в хромосомах вызывают врожденные анемии, которые обычно имеют тяжелое течение и сопряжены с пороками развития скелета и внутренних органов. Сюда относят анемию Фанкони, Даймонда-Блекфена, изменение крови при синдроме Дауна. Угнетение костного мозга происходит с самого рождения, поэтому заболевание трудно поддается консервативному лечению. Пересадка костного мозга (трансплантация) в большинстве случаев малоэффективна.
Приобретенные анемии развиваются под действием негативного влияния внешней среды. При своевременном выявлении болезни и предотвращения пагубного воздействия патологический процесс можно остановить и нормализовать работу костного мозга. Приобретенные анемии имеют более благоприятный прогноз, хорошо отвечают на проводимую терапию и трансплантацию костного мозга.
Угнетение гемопоэза вызывают токсические продукты. Степень нарушения работы костного мозга зависит от длительности негативного влияния и дозы химического вещества. Высокой токсичностью обладают органические растворители, бензол, соединения мышьяка, пестициды. Отравление чаще происходит во время профессиональной деятельности, которая связана с контактом химических веществ, реже в быту. Влияние радиации (ионизирующего излучения) приводит к быстрому разрушению клеток крови и вызывает тяжелые формы апластической анемии.
Длительный прием медикаментов, токсичных для костного мозга, вызывает угнетение гемопоэза. Препараты оказывают прямое разрушающее влияние на клетки и опосредованное действие ― способствуют сбою в работе иммунной системы и выработке антител против предшественников форменных элементов крови. К токсичным для костного мозга относят некоторые транквилизаторы, антибиотики, противосудорожные, противомалярийные и антитиреоидные (применяют при повышенной функции щитовидной железы) средства, препараты золота, противоопухолевые лекарства.
Вирусные заболевания оказывают опосредованное действие на костный мозг путем развития аутоиммунных реакций против клеток-предшественников. Апластическая анемия в таких случаях развивается в течение полугода после перенесенного заболевания. Опасными для костного мозга являются вирусы гепатита В, С, D, ЦМВ (цитомегаловирус), Эпштейн-Барр, гриппа, папилломы человека.
В 50% случаев причину заболевания выявить не удается, анемию считают идиопатической или неуточненной .
Клинические признаки апластической анемии развиваются остро или могут возникать постепенно. Это зависит от причины заболевания и интенсивности воздействия на организм повреждающих факторов. При наследственных формах характерно медленное развитие патологии, в случае токсического воздействия химических веществ, радиации, медикаментов симптомы нарастают стремительно.
В начале заболевания возникает гипопластическая форма анемии, при которой ростки кроветворения угнетаются частично. Костный мозг сохраняет способность к образованию клеток, но в гораздо меньшем объеме. Апластический процесс подразумевает полное угнетение гемопоэза, что приводит к критическому снижению концентрации эритроцитов, тромбоцитов, лейкоцитов в крови.
Клиническая картина складывается из 3 синдромов: анемического, геморрагического, инфекционного. Синдром ― это совокупность симптомов, которые характерны для заболевания. Анемические и геморрагические проявления возникают первыми, затем присоединяются инфекционные осложнения. Степень тяжести клинических признаков зависит от причины болезни.
Возникает вследствие угнетения красного ростка гемопоэза. Снижается содержание эритроцитов, которые переносят кислород органам и тканям. При этом концентрация гемоглобина в клетках соответствует норме, так как в организме достаточно веществ для его синтеза. Вследствие низкого содержания эритроцитов развивается гипоксия (кислородное голодание тканей). Нормальная работа органов нарушается. Развивается хроническая недостаточность сердца, почек и печени. Страдает функция головного мозга.
Анемический синдром проявляется быстрой утомляемостью, слабостью, сонливостью. Возникает головокружение, частые головные боли, снижение остроты зрения и слуха, мелькание «мушек» перед глазами. Характерны перебои в работе сердца, которые сопровождаются тахикардией, неустойчивостью артериального давления, аритмиями, появлением шумов при выслушивании (аускультации) сердца.
Кожа становится сухая и бледная. Вследствие частых гемотрансфузий (переливаний крови) приобретает желтушный оттенок, что связано с гемолизом (разрушением) эритроцитов. Ухудшение обмена веществ из-за гипоксии приводит к расслоению ногтей, выпадению волос, разрушению зубной эмали. На голенях формируются долго незаживающие язвы.
Появляется вследствие нарушения образования предшественников тромбоцитов в красном ростке гемопоэза. Эти клетки отвечают за формирование сосудистых сгустков для остановки и предупреждения кровотечений. Чаще геморрагический синдром возникает сразу с анемическим или несколько позже. При редком заболевании ― амегакариоцитарной аплазии, угнетение образования тромбоцитов выходит на первый план, что может привести к ошибочному диагнозу.
Синдром характеризуется кровотечениями различной степени тяжести. Появляются мелкие и крупные кровоизлияния в коже ― геморрагическая сыпь. Склонность к возникновению синяков и гематом приводит к присоединению вторичной инфекции и нагноению. Характерны частые кровотечения из носа и десен, обильные менструации, увеличивается время остановки кровотечения. Кожа приобретает пятнистую окраску вследствие многочисленных синяков.
Прогрессирование болезни приводит к массивным кровотечениям из легких, желудка и кишечника. Кровоизлияние в головной мозг вызывает геморрагический инсульт и сопряжено с высоким риском смертельного исхода.
Угнетение белого ростка кроветворения приводит к нарушению образования лейкоцитов. Снижается количество сегментоядерных клеток (при рассмотрении под микроскопом в ядре заметны включения). К ним относят нейтрофилы (см. «Нейтропения»), базофилы (см. «Базопения») и эозинофилы (см. «Эозинопения»). Другие клетки лейкоцитарной формулы (моноциты, лимфоциты) обычно находятся на уровне нормальных показателей, а если рассматривать относительно сегментоядерных лейкоцитов, то их концентрация в крови повышается.
Так как белый росток кроветворения формирует иммунную защиту организма, в результате нарушается способность противостоять бактериальным и вирусным инфекциям, заражению гельминтами, образованию опухолей. Характерно тяжелое течение респираторных заболеваний, воспаление мочеполового тракта, легких. Часто возникают инфекции кожных покровов, долго не заживают царапины и раны. Повреждения кожи склонны к нагноению. Высокий риск развития сепсиса (заражения крови) ухудшает течение болезни.
Наиболее известные врожденные виды заболевания ― анемия Фанкони и Даймонда-Блекфена. Патологию выявляют в детском возрасте, чаще в 5-10 лет. При тяжелом угнетении кроветворения заболевание диагностируют в первые годы жизни.
Наследуется по аутосомно-рецессивному типу. Это означает, что генная мутация должна присутствовать у обоих родителей — только в этом случае патология проявится у детей. Но при этом вероятность рождения больного ребенка составляет 25%. Анемия Фанкони связана с нарушением синтеза белка в составе ДНК. В результате угнетается образование всех клеток крови в костном мозге.
Анемия сочетается с другими врожденными нарушениями. Характерна деформация черепа и скелета: маленький размер головы, укорочение больших пальцев рук, косолапость, низкорослость. Возникают пороки развития внутренних органов: почек (подковообразная форма, удвоение, образование множественных кист), половых органов (недоразвитие, отсутствие одного или обоих яичек), сердца (незаращение боталлова протока, деформация клапанов).
Часто встречается глухота, недоразвитие глаз, опущение века. Страдает умственное развитие. В зрелом возрасте анемия принимает злокачественное течение и трансформируется в рак крови (острый миелоидный лейкоз), который трудно поддается противоопухолевой терапии и сопряжен с высоким риском смерти.
Редкая форма заболевания, при которой происходит угнетение только эритроцитарного ростка гемопоэза. Наследуется по аутосомно-доминантному типу — для развития анемии достаточно мутации генов у одного из родителей. Вероятность появления болезни достигает 50%. Причина развития ― нарушение синтеза рибосомальных белков в хромосомах и нечувствительность костного мозга к эритропоэтину (веществу почек, которое стимулирует гемопоэз).
Анемию Даймонда-Блекфена диагностируют в первые годы жизни. В клинической картине преобладает анемический синдром: бледность кожи, слабость, головокружение, одышка, перебои в области сердца, низкая устойчивость к умеренным физическим нагрузкам.
У новорожденных могут выявлять пороки внутриутробного развития: незаращение верхней губы («заячья» губа), твердого неба («волчья» пасть), недоразвитие черепа и костей скелета, нарушение зрения (катаракта, слепота), пороки развития внутренних органов.
Для выявления апластической анемии назначают лабораторные и инструментальные методы обследования. В постановке диагноза учитывают клинические признаки, наследственность, факт влияния токсических веществ на организм. Стандарт диагностики ― лабораторные исследования крови и костного мозга. Анализы позволяют выявить угнетение гемопоэза и оценить тяжесть течения заболевания.
Таблица ― Лабораторная диагностика апластической анемии
Молодые нейтрофилы (палочкоядерные)
Ниже 2% (обычный показатель 6%)
Увеличение уровня микроэлемента вследствие частых гемотрансфузий
Положительные после перенесенной инфекции
* Антитела к цитомегаловирусу определяют перед проведением гемотрансфузий. Если человек не заражен вирусом, ему переливают CMV-отрицательную кровь.
Стернальная пункция и трепанобиопсия являются обязательными методами обследования при апластической анемии. Только по анализам крови нельзя поставить точный диагноз. Стернальная пункция проводится путем прокола грудины на уровне 2-4 ребра полой иглой для забора небольшого количества костного мозга. Из полученного материала готовят 10-15 мазков на предметных стеклах для микроскопического исследования (изучения под микроскопом). В результате выявляют дефицит клеток в костном мозге.
Трепанобиопсию проводят путем прокола подвздошной кости (одной из костей таза). Методика позволяет взять больший объем костного мозга, провести не только цитологическое (изучение клеток), но и гистологическое исследование (оценку особенностей тканей). Кроме того, этот метод более надежный для диагностики на первых этапах развития болезни, когда остались островки нормального кроветворения. Если при стернальной пункции прокол попал на такой участок, то диагноз может быть ложно опровергнут. Обе процедуры делают под анестезией в условиях операционной.
Дополнительно назначают инструментальные методы обследования:
p, blockquote 49,1,0,0,0 —>
- УЗИ (ультразвуковое исследование) внутренних органов ― выявляет нарушение функции и врожденные пороки развития.
- ЭКГ (электрокардиограмма) ― исследование работы сердца, нарушения ритма и проводимости.
- КТ/МРТ (компьютерная и магнитно-резонансная томография) ― определяет нарушения в строении органов и новообразования.
- Рентгенография рук ― позволяет подтвердить врожденное недоразвитие костей.
- Генетические исследования ― оценивают риск развития анемии Фанкони и Даймонда-Блекфена.
Диагностику проводят в амбулаторных условиях. При тяжелом состоянии пациента и назначении пункции костного мозга дают направление на госпитализацию в гематологию.
В клинической практике чаще встречается приобретенная форма заболевания. Ее необходимо дифференцировать (отличать) от анемии Фанкони, лейкоза, В12-дефицитной анемии, миелодиспластического синдрома.
Таблица ― Дифференциальная диагностика
p, blockquote 52,0,0,0,0 —>
| Заболевание | Отличительные симптомы | Результаты обследования |
| Апластическая анемия приобретенная | Анемический синдром Частые и тяжелые инфекции Печень и селезенка не увеличены | Снижение в крови эритроцитов, лейкоцитов, тромбоцитов (панцитопения) Уменьшение клеток-предшественников в костном мозге |
| Анемия Фанкони | Пороки развития скелета и внутренних органов Пигментация (потемнение) кожи Детский возраст (5-12 лет) | Такие же, как при наследственной форме Фетальный гемоглобин в крови (характерный для внутриутробного развития) |
| Острый лейкоз (рак крови) | Увеличение печени и селезенки | Чаще угнетение одного ростка кроветворения (редко панцитопения) При проведении стернальной пункции ― опухолевые клетки |
| В12-дефицитная анемия | Нет геморрагического и инфекционного синдрома Поражение пищеварительного тракта и нервной системы | Макроцитоз в крови (большие размеры эритроцитов) В результатах стернальной пункции ― мегалобласты |
| Миелодиспластический синдром | Симптомы как при апластической анемии | В костном мозге нет дефицита клеток Генетические исследования выявляют характерные изменения хромосом |
Важный клинический признак заболевания ― отсутствие увеличения печени, селезенки и лимфатических узлов.
В терапии апластической анемии применяют консервативные (медикаментозные) и оперативные методы. Лекарственные средства снижают агрессию иммунной системы против клеток костного мозга, устраняют воспаление, предупреждают развитие инфекций. Переливание крови временно восполняет недостаток клеток и улучшают общее самочувствие.
Единственным радикальным методом терапии, который может остановить развитие анемии, считают операцию по пересадке костного мозга от подходящего донора. Хирургическое лечение сопряжено с риском отторжения трансплантата и другими осложнениями, но дает шанс на выздоровление.
Клинические рекомендации при апластической анемии включают иммуносупрессивные, заместительные и профилактические средства. Терапия направлена на поддержание кроветворения и улучшение общего самочувствия.
Таблица ― Лекарственные препараты при апластической анемии
p, blockquote 57,0,0,0,0 —>
| Цель терапии | Название препаратов | Способ применения |
| Иммунодепрессанты | ||
| Снижение аутоиммунной реакции в организме | Антилимфоцитарный глобулин (АЛГ) | 15 мг/кг в сутки в виде внутривенных инфузий (капельниц) для медленного введения Курс лечения ― 7-10 дней |
| Антитимоцитарный глобулин (АТГ) ― Атгам | 0,75 мг/кг в сутки внутривенно капельно медленно Курс терапии ― 7-10 дней | |
| Торможение апоптоза (преждевременного разрушения клеток) | Циклоспорин А (Сандиммун) | 5-10 мг/кг дважды в сутки Продолжительность лечения ― 3-12 месяцев |
| Глюкокортикоиды | ||
| Угнетение аутоиммунной и воспалительной реакции | Метилпреднизолон | Применяют высокие дозировки: 0,5-1 г в сутки в течение 5 дней |
| Заместительные средства* | ||
| Предупреждение кислородного голодания тканей | Переливание эритроцитарной массы | При уровне гемоглобина крови ниже 80 г/л |
| Профилактика кровотечений | Инфузии тромбоцитарной массы | При содержании клеток менее 50х10*9/л |
| Профилактические средства (антибиотики)** | ||
| Предупреждение инфекций и нагноения | Цефалоспорины (Цефазолин, Цефотаксим, Цефтриаксон) Макролиды (Эритромицин, Азитромицин, Спирамицин) Фторхинолоны (Ципрофлоксацин, Офлоксацин, Пефлоксацин) | Назначают в максимальных дозах в зависимости от тяжести течения инфекции |
| Профилактика грибковых заболеваний | Противогрибковые средства (Амфотерицин В, Бифоназол, Интраконазол, Миконазол) | Дозировки подбирают индивидуально |
| Дополнительные препараты | ||
| Стимуляция образования эритроцитов | Анаболические стероиды (Оксиметолон) | 200-300 мг в сутки в течение 1-3 месяцев |
| Активация белого ростка кроветворения (лейкоцитов) | Колониестимулирующий фактор (гранулоцитарный) | При уровне нейтрофилов не менее 0,5х10*9/л |
* Переливание лейкоцитов не проводят. Белые клетки крови быстро разрушаются и часто вызывают аллергические реакции.
** При высоком риске инфекции (гранулоциты менее 0,5х10*9/л) пациентов переводят в палаты с соблюдение стерильности. Ежедневно кожу обрабатывают антисептическими растворами, в рацион включают только термически обработанную пищу. Минимизируют количество инъекций для предупреждения нагноения кровоподтеков от укола иглой.
Для проведения операции необходимо подобрать подходящего донора, клетки которого способны прижиться в организме пациента. Для этого кровь больного (реципиента) и донора исследуют на совпадение по антигенному составу (особенностям строения белков форменных элементов крови).
Максимально совместимый костный мозг другого человека приживается в 70-80% случаев. Частичное совпадение по антигенам дает эффективность на 40-50%. После операции пациенту назначают длительный прием иммунодепрессантов для предупреждения отторжения пересаженного костного мозга.
Прорывом в гематологии стала возможность использования собственные клетки крови. Забор биологического материала проводят до начала болезни. В таких случаях приживаемость костного мозга составляет 98%, нет опасности отторжения трансплантата и необходимости принимать иммунодепрессанты.
Таблица ― Оценка эффективности терапии
p, blockquote 64,0,0,0,0 —>
| Степень | Показатели крови |
| Полная ремиссия (восстановление функции костного мозга) | Нейтрофилы более 1х10*9/л Тромбоциты более 100х10*9/л |
| Частичная ремиссия | Нейтрофилы 0,5-1,0х10*9/л Тромбоциты 20-100х10*9/л |
| Отсутствие эффекта | Нет значимых изменений в клеточном составе крови Необходимость в регулярных гемотрансфузиях |
В зависимости от особенностей операции выделяют несколько видов трансплантации: аллогенную и аутологичную. В первом случае пересадку биологического материала проводят от донора. Во втором ― применяют собственные ткани пациента.
Донором клеток может стать родственник больного. По статистике, только в 30% случаев удается найти подходящего по всем показателям человека в близком окружении пациента. Пол и возраст не имеют значения. Забор костного мозга можно делать даже у грудного ребенка. Если не удалось найти донора среди родственников, совместимый костный мозг ищут в банке органов. Поиск может занять месяцы и годы.
По сути, операцию проводят только донору, у которого извлекают костный мозг. Для этого под наркозом делают трепанобиопсию. После забора костного мозга (700-1000 мл) клетки переливают реципиенту посредством внутривенных инфузий.
Забор костного мозга при помощи трепанобиопсии можно заменить менее травматичной методикой. Клетки-предшественники (стволовые клетки) получают путем взятия крови у донора. Затем биологический материал обрабатывают в специальных аппаратах и переливают реципиенту.
Получение клеток-предшественников из крови, а не из костного мозга имеет ряд преимуществ. После операции посредством трепанобиопсии восстановление кроветворения донора длится в течение года. Полученные клетки путем обработки крови не вызывают тяжелых иммунных реакций у реципиента, а реабилитация донора сокращается до 3-4 недель.
После рождения ребенка делают забор крови из пуповины (соединительного канала между плацентой и плодом). Биологический материал консервируют и помещают в специальные хранилища. При необходимости пуповинную кровь можно использовать, если человек затем заболевает апластической анемией или онкологическими заболеваниями.
Методика эффективно используется последние десятилетия. Собственные стволовые клетки не отторгаются и не вызывают иммунный конфликт. Единственный недостаток ― высокая стоимость хранения крови в банке донорских органов.
В период стойкой ремиссии и восстановления функции гемопоэза больному проводят трепанобиопсию или получают стволовые клетки из крови. При возникновении обострения биологический материал можно использовать для эффективного и безопасного лечения.
В организме близнецов, которые развивались из одной яйцеклетки, антигены клеток крови максимально похожи. Пересадка костного мозга в таких случаях приравнивается к использованию собственных тканей.
После пересадки костного мозга могут возникать инфекционные, трансплантационные и функциональные нежелательные последствия. Нагноение операционной раны и остеомиелит (гнойное воспаление кости) встречаются редко, так как во время операции соблюдаются стерильные условия.
Гораздо чаще возникает отторжение трансплантата. Иммунная система воспринимает пересаженный костный мозг, как чужеродное вещество, и синтезирует против него антитела. Чем меньше антигенных совпадений между кровью донора и реципиента, тем выше риск развития осложнений.
Операция по пересадке костного мозга становится серьезным испытанием для организма. Если работа функциональных систем уже была нарушена до вмешательства, то риск нарушения их работы повышается в десятки раз. Усугубляет ситуацию прием высоких доз иммунодепрессантов, которые направлены на профилактику отторжения трансплантата. Лекарственные средства обладают токсичностью и ухудшают функцию органов. Развивается почечная и печеночная недостаточность.
Новаторским методом терапии апластической анемии является применение колониестимулирующих средств ― ростовых факторов. Это синтетические препараты, которые способны активировать кроветворение. Ростовые факторы улучшают функцию стромы костного мозга, нормализуя рост и созревание клеток-предшественников крови.
Самым популярным и хорошо изученным считают гранулоцитарный колониестимулирующий фактор. Он активирует белый росток гемопоэза. В результате в крови увеличивается количество лейкоцитов, снижается риск возникновения тяжелых инфекций и гнойных осложнений. Препараты, содержащие гранулоцитарный фактор: Лейкостим, Граноцит, Нейпоген.
Такое лечение помогает пациентам нормализовать состав крови и общее состояние, улучшить качество жизни до пересадки костного мозга. Терапия обладает высокой эффективностью, редко вызывает тяжелые побочные явления. Относительный недостаток препаратов ― высокая цена, если учитывать, что лечение может продлиться долгие месяцы и даже годы.
Предупреждение развития анемии направлено на устранение неблагоприятных факторов внешней среды (профессиональных и бытовых вредностей, радиации), необоснованного назначения токсичных для костного мозга препаратов. Это первичная профилактика болезни. Сюда же входит предупреждение и своевременное лечение инфекций.
Вторичная профилактика проводится при уже возникшем заболевании. Пациенты нуждаются в диспансерном наблюдении гематолога, регулярном обследовании и получении поддерживающего лечения.
Продолжительность и качество жизни зависит от причины анемии, тяжести течения, возникновения осложнений, сроков пересадки костного мозга. После проведения операции прогноз благоприятный в 40-98% случаев. Выздоровление наиболее вероятно после пересадки собственных стволовых клеток.
Неблагоприятный прогноз чаще возникает при наследственных формах, остром течении и быстром прогрессировании болезни. Смертельный исход наступает вследствие массивных кровотечений и тяжелых инфекций, которые плохо поддаются антибактериальной терапии.
Вопрос: Можно ли вылечить апластическую анемию?
Ответ: Единственным радикальным способом терапии является пересадка костного мозга или стволовых клеток. Эффективность операции выше, если биологический материал берут у самого больного. В таких случаях вероятность выздоровления высокая. Если пересаживают донорский костный мозг, то эффективность операции снижается за счет высокого риска отторжения клеток и необходимости длительного приема токсических иммунодепрессивных препаратов.
Вопрос: Апластическая анемия ― это рак крови или нет?
Ответ: Онкологические заболевания возникают вследствие появления в организме атипичных клеток, которые быстро растут и разрушают нормальные ткани. Рак крови вызывает формирование таких клеток в костном мозге. При апластической анемии происходит обеднение кроветворения. В костном мозге находятся нормальные клетки, но в критически малом количестве. Апластическая анемия ― тяжелое заболевание, но это не рак.
Вопрос: Какую диету лучше использовать?
Ответ: В питание включают повышенное содержание белков и углеводов, ограничивают поступление жиров. Рекомендуют диетическое мясо (индюшатина, телятина, курятина), рыбу (пеленгас, карп, хек, минтай), морепродукты. Каши, фрукты и овощи поставляют в организм сложные углеводы, которые медленно всасываются и пополняют энергетические запасы организма. Из рациона исключают маргарин, сало, свинину, баранину, колбасные изделия, копчености, полуфабрикаты, фастфуд. Для улучшения аппетита в пищу добавляют специи.
Вопрос: Можно лечить заболевание народными средствами?
Ответ: Апластическая анемия относится к тяжелой патологии крови, которая трудно поддается терапии лекарственными препаратами. Зачастую помочь больному может только пересадка костного мозга. Народные средства неэффективны в борьбе с болезнью.
Вопрос: Когда используется и какая эффективность препарата Атгам?
Это иммунодепрессивный препарат, который устраняет разрушающее действие иммунитета на собственные клетки костного мозга. Представляет собой антилимфоцитарный глобулин, приготовленный из крови лошади.
Предназначен для внутривенного введения. Назначается одновременно с другими иммунодепрессантами ― глюкокортикоидами и циклоспорином. Атгам эффективен при отсутствии показаний к пересадке костного мозга, нормализует кроветворение, улучшает общее состояние, увеличивает продолжительность жизни.
Апластическая анемия связана с угнетением всех ростков кроветворения, что приводит к критическому снижению содержания эритроцитов, тромбоцитов и лейкоцитов. Это одна из самых серьезных форм малокровия, по тяжести сопоставимая с онкологическими заболеваниями.
p, blockquote 98,0,0,0,0 —>
- Анемия бывает наследственная и приобретенная. Своевременное устранение негативных факторов может остановить развитие патологии. При наследственной форме болезни это сделать невозможно, поэтому врожденные анемии обычно протекают тяжело с неблагоприятным прогнозом.
- Клинические проявления тяжелые, связаны с нарушением функции органов, кровотечениями, затяжными инфекциями. Это приводит к развитию осложнений с высоким риском смертельного исхода.
- Для диагностики недостаточно проведения анализа крови, обязательно назначают пункцию костного мозга. Изучение миелограммы выявляет панцитопению (уменьшение количества клеток всех ростком кроветворения).
- Лечение проводят иммунодепрессивными средствами, что сопряжено с развитием побочных эффектов. Выздоровление обычно наступает после пересадки костного мозга.
- Пациенты должны находиться на диспансерном учете у гематолога. Это предупреждает быстрое прогрессирование болезни.
p, blockquote 99,0,0,0,1 —>
Тяжесть течения заболевания и прогноз зависят от своевременной диагностики и терапии. Чем раньше начато лечение, тем больше шансов остановить опасную для жизни патологию.
источник