«ФАРМАТЕКА»; Актуальные обзоры; № 13; 2012; стр. 9-14.
Д.Т. Абдурахманов
Кафедра терапии и профболезней ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова» Минздравсоцразвития РФ, Москва
Обсуждается проблема железодефицитной анемии (ЖДА), развивающейся в т. ч. при заболеваниях желудочно-кишечного тракта. Представлены сведения, касающиеся причин возникновения ЖДА, патогенеза, симптоматики, диагностики и лечения данной патологии. Особое внимание уделено препарату Феринжект (железа карбоксимальтозат), который применяется в комплексной терапии пациентов с ЖДА, обусловленной воспалительными заболеваниями кишечника.
Ключевые слова: железодефицитная анемия, дефицит железа, ферротерапия, железа карбоксимальтозат
The article discusses the problem of iron deficiency anemia (IDA), which develops against the background of many diseases, including gastrointestinal diseases. The data on the causes of IDA, pathogenesis, symptoms, diagnosis and treatment of this disease are presented. Particular attention is paid to the drug Ferinject (ferric carboxymaltosate) used for the treatment of IDA in patients with inflammatory bowel diseases.
Key words: iron deficiency anemia, iron deficiency, ferrotherapy, ferric carboxymaltosate
Наиболее частая в популяции причина анемии — дефицит железа в организме. По данным отчета Всемирной организации здравоохранения (ВОЗ) о состоянии здоровья за 2002 г., железодефицитная анемия (ЖДА) входит в десятку глобальных факторов риска развития нетрудоспособности. Так, показано, что ЖДА встречается среди 30 % населения планеты [1]. В США ЖДА наблюдается среди 5-12 % небеременных женщин и 1-5 % мужчин [2].
Метаболизм железа в организме
Общее количество железа в организме взрослого человека составляет около 3,5-4,0 г, в среднем 50 и 40 мг/кг у мужчин и женщин соответственно. Основная часть железа входит в состав гемоглобина эритроцитов (около 2,5 г), значительная часть железа (около 0,5—1,0 г) депонируется в составе ферритина или входит в состав гемсодержащих и других ферментов (миоглобина, каталазы, цитохромов) организма (около 0,4 г) и небольшая часть железа (0,003—0,007 г) находится в связанном с трансферрином состоянии в крови.
Баланс железа в организме поддерживается соответствием количества поступающего железа его потерям. В пище железо присутствует в составе гема или как негемовое железо. Ежедневно с пищей (стандартный пищевой рацион) в организм человека поступает 10—20 мг железа, из которого в норме в кишечнике всасывается около 10 % (от 3 до 15 %), что компенсирует суточные потери железа, главным образом при слущивании эпителиальных клеток. Организм обеспечивает баланс железа в организме, регулируя процесс его всасывания в кишечнике. В случае развития дефицита железа организм увеличивает процент всасываемого железа (может достигать 25 %), при избытке — уменьшает [3]. В этом процессе ключевое значение придают гепсидину — белку, который синтезируется в печени. Поступление с пищей или выведение железа, как правило, вне контроля организма.
Около 25—30 мг железа ежедневно реутилизируется после разрушения (вследствие старения) эритроцитов в селезенке и поступает снова в костный мозг для синтеза новых эритроцитов. Железо, которое всасывается в кишечнике, предварительно на поверхности энтероцита восстанавливается с участием ферроредуктаз из трехвалентного (Fe 3+ ) в двухвалентнтное (Fe 2+ ), затем с помощью специфического переносчика — транспортера двухвалентных металлов (DMT1) поступает в цитоплазму [4]. Железо в составе гема (содержится в мясе, рыбе) всасывается напрямую. В дальнейшем двухвалентное железо с помощью другого переносчика, ферропортина (также мобилизует железо из ферритина), секретируется в кровь, где снова окисляется до трехвалентного (при участии белка гефестина) и связывается с плазменным белком трансферрином [5]. Трансферрин осуществляет транспорт железа в костный мозг, где оно утилизируется для синтеза эритроцитов, или преимущественно в печень, где железо депонируется в составе ферритина (рис. 1) [6].
При снижении запасов железа, гипоксии, анемии, усиленном эритропоэзе в печени снижается синтез гепсидина, что усиливает всасывание железа в кишечнике, при хроническом воспалении синтез гепсидина в печени увеличивается и, соответственно, всасывание железа в кишечнике снижается.
Рис 1. Регуляция всасывания железа в кишечнике [Guidi G.C., Santonastaso C.L., 2010]
Ферритин — ключевой белок, отражающий запасы железа в организме. Он депонирует железо в нетоксической форме, которое при необходимости мобилизуется. В среднем одна молекула ферритина содержит до 4500 атомов железа. Главным образом железо депонируется в печени, костном мозге и селезенке. Снижение уровня ферритина в сыворотке крови является достаточно надежным показателем дефицита железа в организме, его увеличение, как правило, указывает на перегрузку организма железом. В то же время необходимо помнить, что ферритин относится к белкам острой фазы воспаления, поэтому увеличение его содержания в крови может быть следствием активного воспалительного процесса, а не телько избытка железа. В ряде случаев некоторые злокачественные опухоли обладают способностью синтезировать и секретировать в кровь большое количество ферритина (в рамках паранеопластического синдрома). В норме содержание ферритина в сыворотке крови составляет 30-300 нг/мл.
Причины железодефицитной анемии
Выделяют три глобальные причины развития дефицита железа в организме (рис. 2):
1. Недостаточное поступление с пищей или повышенная потребность.
2. Нарушение всасывания железа в кишечнике.
3. Хронические потери крови.
Рис 2. Основные причины железодефицитной анемии
В популяции наиболее частой причиной ЖДА является недостаточное поступление с пищей: по данным ВОЗ, от четверти до трети населения в мире хронически голодают из-за нехватки продуктов питания, особенно мясной пищи. Однако в клинической практике среди основных причин ЖДА выделяют хронические потери крови, прежде всего из желудочно-кишечного тракта.
Клиническая картина
При ЖДА наблюдаются общие для всех анемий проявления циркуляторно-гипоксического синдрома:
Кроме того могут встречаться специфические признаки тканевого дефицита железа:
Диагностика
Лабораторная диагностика ЖДА основана на изучении обмена железа и выявлении его дефицита. Выделяют ряд признаков, указывающих на железодефицитный характер анемии (табл. 1).
Лабораторные признаки дефицита железа и ЖДА
| Параметры | Значения при ЖДА | Норма | |||
| Железо сыворотки, мкг/дл | 3 | 5 | Примечание. НПВС — нестероидные противовоспалительные средства. Среди причин ЖДА (почти 30-50 % всех случаев) прежде всего рассматривают острые или хронические кровопотери из ЖКТ. Основной причиной ЖДА у женщин до менопаузы являются беременность и менструации, у женщин после менопаузы и у мужчин — хронические (латентные) потери крови из ЖКТ. Анализ кала на скрытую кровь — основной скрининговый метод выявления скрытого желудочно-кишечного кровотечения (тест положительный при выделении не менее 10 мл крови в сутки). При потере не менее 30 мл крови в сутки тест на скрытую кровь бывает положительным в 93 % случаев [8]. Наиболее часто при хронической ЖДА и особенно в случаях положительного результата кала на скрытую кровь выполняют эзофагогастродуодено- (ЭФГДС) и колоноскопию. В 5-10 % случаев анемий, связанных с заболеваниями ЖКТ, при ЭФГДС и колоноскопии не удается выявить очага поражения [9]. В 25 % случаев это обусловлено небольшим размером пораженного участка, который обнаруживается при повторном осмотре, в остальных случаях необходимо обследование тонкой кишки. В последние годы наиболее часто для выявления источника кровотечения из тонкой кишки используется беспроводная капсульная эндоскопия. В 10-17 % случаев причиной ЖДА у мужчин и женщин старше 40 лет являются онкологические заболевания ЖКТ; прежде всего колоректальный рак. ЖДА в течение длительного времени может быть единственным проявлением рака толстой кишки правосторонней локализации, при этом размер опухоли обычно превышает 3 см. Другая наиболее частая причина ЖДА -язвенная болезнь желудка и двенадцатиперстной кишки. При скрытых кровопотерях, обусловленных поражением тонкой кишки, наиболее часто в возрасте до 40 лет выявляют опухоли (лимфому, карциноид, аденокарциному, полипоз), ангиоэктазию артерий (Dieulafoy’s поражение), целиакию и болезнь Крона, в возрасте старше 40 лет -патологию сосудов различной природы и прием НПВС. У трети больных воспалительными заболеваниями кишечника (болезнь Крона, язвенный колит) выявляется анемия, имеющая сложный генез (сочетание ЖДА и анемии хронических заболеваний). При этом дефицит железа становится следствием нескольких причин: Лечение Суточная терапевтическая доза элементарного железа при лечении ЖДА для взрослых составляет в среднем 100— 200 мг в 2—3 приема. Поливитаминные комплексы, содержащие железо, не рекомендуют в качестве лечения ЖДА, т. к. они содержат недостаточное количество железа либо оно плохо всасывается в кишечнике. При адекватном лечении уже в течение первых 3 суток наблюдается увеличение числа ретикулоцитов в крови, на 7—10-й день отмечается ретикулоцитарный криз (пик ретикулоцитоза). К 3—4-й неделе лечения имеет место увеличение уровня гемоглобина на 20 г/л. Прием препаратов железа необходимо продолжать еще в течение 3—6 месяцев после нормализации уровня гемоглобина — пока насыщение трансферрина железом не превысит 30 % и концентрация ферритина не достигнет 50 нг/мл (показатель восстановления тканевых запасов железа). Среди 20—30 % пациентов в результате приема препаратов железа отмечаются различные диспептические расстройства (тошнота, дискомфорт в эпигастрии, диарея или запор). Риск развития желудочно-кишечных расстройств можно снизить, принимая препарат во время еды или на ночь, а также при постепенном увеличении дозы. Среди причин неэффективности пероральных форм железа рассматривают целый ряд факторов [10]: недостаточное поступление железа; Нарушение всасывания железа: Продолжающиеся потери крови или повышенная потребность в железе: Сопутствующие заболевания или состояния: Неправильный диагноз или наличие других причин анемии: Выделяют следующие показания к парентеральному введению, преимущественно внутривенному, препаратов железа: Основная опасность при парентеральном введении железа — развитие тяжелых аллергических реакций, включая анафилактических шок с летальным исходом, которые наблюдаются в 0,6—1,0 % случаев. Данные реакции, в основном, характерны для препаратов железа, содержащих декстран. Среди парентеральных препаратов железа широкое распространение, особенно в комплексной терапии воспалительных заболеваний кишечника, получили сахарат железа и железа карбоксимальтозат (Феринжект), которые в отличие от декстрана железа ассоциируются с минимальным риском развития анафилактических и других аллергических реакций [11—13]. Так, в 2011 г. были опубликованы результаты рандомизированного контролируемого исследования применения железа карбоксимальтозата пациентами с железодефицитной анемией, обусловленной воспалительными заболеваниями кишечника (FERGIcor — a Randomized Controlled Trial on Ferric Carboxymaltose for Iron Deficiency Anemia in Inflammatory Bowel Disease) [14]. В исследовании сравнивали эффективность и безопасность нового режима фиксированной дозы железа карбоксимальтозата (Феринжекта) и индивидуально рассчитываемых доз сахарата железа (СЖ) для пациентов с воспалительными заболеваниями кишечника и ЖДА. В исследование были включены 485 пациентов с ЖДА (уровень ферритина ЛИТЕРАТУРА источник Сайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна!
Эритроциты формируются в красном костном мозге из белковых фракций и небелковых компонентов под воздействием эритропоэтина (синтезируется почками). Эритроциты в течение трех дней обеспечивают транспорт, главным образом, кислорода и углекислого газа, а также питательных веществ и продуктов метаболизма от клеток и тканей. Срок жизни эритроцита сто двадцать дней, после чего он разрушается. Старые эритроциты накапливаются в селезенке, где утилизируются небелковые фракции, а белковые поступают в красный костный мозг, участвуя в синтезе новых эритроцитов. Вся полость эритроцита наполнена белком, гемоглобином, в состав которого входит железо. Гемоглобин придает эритроциту красную окраску, а также помогает ему переносить кислород и углекислый газ. Его работа начинается в легких, куда эритроциты поступают с током крови. Молекулы гемоглобина захватывают кислород, после чего обогащенные кислородом эритроциты направляются сначала по крупным сосудам, а затем и по мелким капиллярам к каждому органу, отдавая клеткам и тканям необходимый для жизни и нормальной деятельности кислород. Анемия ослабляет способность организма к газовому обмену, за счет сокращения числа эритроцитов нарушается транспортировка кислорода и углекислого газа. Вследствие этого у человека могут наблюдаться такие признаки анемии как чувство постоянной усталости, упадок сил, сонливость, а также повышенная раздражительность. Анемия является проявлением основного заболевания и не является самостоятельным диагнозом. Многие болезни, включая инфекционные заболевания, доброкачественные или злокачественные опухоли могут быть связаны с анемией. Именно поэтому анемия является важным признаком, который требует проведения необходимых исследований для выявления основной причины, которая привела к ее развитию. Тяжелые формы анемии вследствие тканевой гипоксии могут привести к серьезным осложнениям, таким как шоковые состояния (например, геморрагический шок), гипотония, коронарная или легочная недостаточность.
Также следует заметить, что в зависимости от вида анемии причины ее возникновения могут отличаться. Факторы, влияющие на развитие анемии |
| |
| |||||
| |||||
| |||||
|
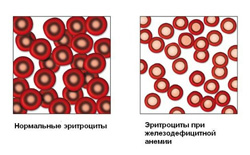
Для железодефицитной анемии характерно снижение эритроцитов, гемоглобина и цветового показателя.
Железо — это жизненно важный элемент, участвующий во многих метаболических процессах организма. У человека с весом семьдесят килограмм запас железа в организме составляет примерно четыре грамма. Данное количество поддерживается благодаря сохранению баланса между регулярными потерями железа из организма и его поступлением. Для поддержания равновесия суточная потребность железа составляет 20 – 25 мг. Большая часть поступающего железа в организм затрачивается на его нужды, остальное депонируется в виде ферритина или гемосидерина и при необходимости расходуется.
Нарушение поступления железа в организм
- вегетарианство вследствие неупотребления белков животного происхождения (мясо, рыба, яйца, молочные продукты);
- социально-экономическая составляющая (например, недостаточно денег для полноценного питания).
Нарушение усвоения железа
Всасывание железа происходит на уровне слизистых желудка, поэтому такие заболевания желудка как гастриты, язвенная болезнь или резекция желудка приводят к нарушению всасывания железа.
Повышенная потребность организма в железе
- беременность, в том числе многоплодная беременность;
- период лактации;
- подростковый возраст (за счет быстрого роста);
- хронические заболевания, сопровождающиеся гипоксией (например, хронический бронхит, пороки сердца);
- хронические нагноительные заболевания (например, хронические абсцессы, бронхоэктатическая болезнь, сепсис).
Потери железа из организма
- легочные кровотечения (например, при раке легких, туберкулезе);
- желудочно-кишечные кровотечения (например, язва желудка и двенадцатиперстной кишки, рак желудка, рак кишечника, варикозное расширение вен пищевода и прямой кишки, неспецифический язвенный колит, глистные инвазии);
- маточные кровотечения (например, преждевременная отслойка плаценты, разрыв матки, рак матки или шейки матки, прервавшаяся внематочная беременность, миома матки);
- почечные кровотечения (например, рак почек, туберкулез почек).
Питание при анемии
В питании железо делится на:
- гемовое, которое поступает в организм с продуктами животного происхождения;
- негемовое, которое поступает в организм с продуктами растительного происхождения.
Следует заметить, что гемовое железо усваивается в организме значительно лучше, нежели негемовое.
Количество железа на сто миллиграмм
Продукты питания
животного
происхождения
- печень;
- язык говяжий;
- мясо кролика;
- индюшатина;
- гусиное мясо;
- говядина;
- рыба.
- 9 мг;
- 5 мг;
- 4,4 мг;
- 4 мг;
- 3 мг;
- 2,8 мг;
- 2,3 мг.
Продукты питания растительного происхождения
- сушеные грибы;
- свежий горох;
- гречка;
- геркулес;
- свежие грибы;
- абрикосы;
- груша;
- яблоки;
- сливы;
- черешня;
- свекла.
- 35 мг;
- 11,5 мг;
- 7,8 мг;
- 7,8 мг;
- 5,2 мг;
- 4,1 мг;
- 2,3 мг;
- 2,2 мг;
- 2,1 мг;
- 1,8 мг;
- 1,4 мг.
При соблюдении диеты также следует увеличить потребление продуктов, содержащих витамин C, а также белок мяса (они повышают усвояемость железа в организме) и снизить потребление яиц, соли, кофеина и кальция (они уменьшают всасываемость железа).
Медикаментозное лечение
При лечении железодефицитной анемии больному параллельно с диетой назначается прием препаратов железа. Данные лекарственные средства предназначены для восполнения дефицита железа в организме. Они выпускаются в виде капсул, драже, инъекций, сиропов и таблеток.
Доза и длительность лечения подбирается индивидуально в зависимости от следующих показателей:
- возраста пациента;
- степени тяжести заболевания;
- причины, вызвавшей железодефицитную анемию;
- на основе результатов анализов.
Препараты железа принимаются за один час до еды или через два часа после приема пищи. Данные лекарственные средства нельзя запивать чаем или кофе, так как снижается всасываемость железа, поэтому их рекомендуется запивать водой или соком.
Принимать внутрь по одному грамму три – четыре раза в сутки.
Принимать по одной таблетке в день, с утра за тридцать минут до приема пищи.
Принимать по одной таблетке один – два раза в день.
Данные препараты рекомендуется назначать совместно с витамином C (по одной таблетке один раз в день), так как последний увеличивает всасываемость железа.
Препараты железа в виде инъекций (внутримышечных или внутривенных) применяются в следующих случаях:
- при тяжелой степени анемии;
- если анемия прогрессирует, несмотря на принимаемые дозы железа в виде таблеток, капсул или сиропа;
- если у больного имеются заболевания желудочно-кишечного тракта (например, язва желудка и двенадцатиперстной кишки, неспецифический язвенный колит, болезнь Крона), так как принимаемый препарат железа может усугубить имеющееся заболевание;
- перед оперативными вмешательствами с целью ускоренного насыщения организма железом;
- если у пациента имеется непереносимость препаратов железа при их приеме внутрь.
Хирургическое лечение
Хирургическое вмешательство производится при наличии у больного острого или хронического кровотечения. Так, например, при желудочно-кишечном кровотечении может применяться фиброгастродуоденоскопия или колоноскопия с выявлением области кровотечения и последующей его остановкой (например, удаляется кровоточащий полип, коагулируется язва желудка и двенадцатиперстной кишки). При маточных кровотечениях, а также при кровотечениях в органах, находящихся в брюшной полости, может применяться лапароскопия.
При необходимости больному может быть назначено переливание эритроцитарной массы для восполнения объема циркулирующей крови.

В норме витамин В12 поступает в организм с пищевыми продуктами. На уровне желудка В12 связывается с продуцируемым в нем белком, гастромукопротеидом (внутренний фактор Касла). Данный белок защищает поступивший в организм витамин от негативного воздействия микрофлоры кишечника, а также способствует его усвоению.
Комплекс гастромукопротеид и витамин В12 доходит до дистального отдела (нижний отдел) тонкого кишечника, где происходит распад этого комплекса, всасывание витамина В12 в слизистый слой кишечника и дальнейшее поступление его в кровь.
Из кровяного русла данный витамин поступает:
- в красный костный мозг для участия в синтезе эритроцитов;
- в печень, где происходит его депонирование;
- в центральную нервную систему для синтеза миелиновой оболочки (покрывает аксоны нейронов).
Клиническая картина В12 и фолиево-дефицитной анемии основывается на развитии у больного следующих синдромов:
- анемический синдром;
- желудочно-кишечный синдром;
- невралгический синдром.
| |
Данные симптомы развиваются вследствие атрофических изменений слизистого слоя ротовой полости, желудка и кишечника. |
|
- снижение уровня эритроцитов и гемоглобина;
- гиперхромия (выраженная окраска эритроцитов);
- макроцитоз (увеличенный размер эритроцитов);
- пойкилоцитоз (различная форма эритроцитов);
- при микроскопии эритроцитов выявляются кольца Кебота и тельца Жолли;
- ретикулоциты снижены или в норме;
- снижение уровня лейкоцитов (лейкопения);
- повышение уровня лимфоцитов (лимфоцитоз);
- снижение уровня тромбоцитов (тромбоцитопения).
В биохимическом анализе крови наблюдается гипербилирубинемия, а также снижение уровня витамина В12.
При пункции красного костного мозга выявляется повышение мегалобластов.
Больному могут быть назначены следующие инструментальные исследования:
- исследование желудка (фиброгастродуоденоскопия, биопсия);
- исследование кишечника (колоноскопия, ирригоскопия);
- ультразвуковое исследование печени.
Данные исследования помогают выявить атрофические изменения слизистой оболочки желудка и кишечника, а также обнаружить заболевания, которые привели к развитию В12-дефицитной анемии (например, злокачественные образования, цирроз печени).
Все больные госпитализируются в отделение гематологии, где проходят соответствующее лечение.
Питание при В12-дефицитной анемии
Назначается диетотерапия, при которой увеличивается потребление продуктов, богатых витамином В12.
Суточная норма витамина В12 составляет три микрограмма.
Количество витамина В12 на сто миллиграмм
Медикаментозное лечение
Медикаментозное лечение назначается больному по следующей схеме:
- В течение двух недель больной ежедневно получает по 1000 мкг Цианокобаламина внутримышечно. За две недели у пациента исчезает неврологическая симптоматика.
- В течение последующих четырех – восьми недель больной получает по 500 мкг ежедневно внутримышечно для насыщения депо витамина В12 в организме.
- Впоследствии больной пожизненно получает внутримышечные инъекции один раз в неделю по 500 мкг.
Во время лечения одновременно с Цианокобаламином больному могут назначить прием фолиевой кислоты.
Больной В12-дефицитной анемией должен пожизненно наблюдаться у гематолога, гастролога и семейного врача.
Фолиевая кислота (витамин B9) является водорастворимым витамином, который отчасти продуцируется клетками кишечника, но в основном должен поступать извне для восполнения необходимой для организма нормы. Суточная норма фолиевой кислоты составляет прием 200 – 400 мкг.
В пищевых продуктах, а также в клетках организма фолиевая кислота находится в форме фолатов (полиглутаматы).
Фолиевая кислота играет большую роль в организме человека:
- участвует в развитии организма во внутриутробном периоде (способствует формированию нервной проводимости тканей, кровеносной системы плода, предупреждает развитие некоторых пороков развития);
- участвует в росте ребенка (например, в первый год жизни, в период полового созревания);
- влияет на процессы кроветворения;
- совместно с витамином В12 участвует в синтезе ДНК;
- препятствует образованию тромбов в организме;
- улучшает процессы регенерации органов и тканей;
- участвует в обновлении тканей (например, кожи).
Абсорбция (всасывание) фолатов в организме осуществляется в двенадцатиперстной кишке и в верхнем отделе тонкого кишечника.
При фолиеводефицитной анемии у больного наблюдается анемический синдром (такие симптомы как повышенная утомляемость, сердцебиение, бледность кожных покровов, снижение работоспособности). Неврологический синдром, а также атрофические изменения слизистой оболочки ротовой полости, желудка и кишечника при данном виде анемии отсутствуют.
Также у больного может наблюдаться увеличение размеров селезенки.
При общем анализе крови наблюдаются следующие изменения:
- гиперхромия;
- снижение уровня эритроцитов и гемоглобина;
- макроцитоз;
- лейкопения;
- тромбоцитопения.
В результатах биохимического анализа крови наблюдается снижение уровня фолиевой кислоты (менее 3 мг/мл), а также повышение непрямого билирубина.
При проведении миелограммы выявляется повышенное содержание мегалобластов и гиперсегментированных нейтрофилов.
Питание при фолиеводефицитной анемии играет большую роль, больному необходимо ежедневно потреблять продукты, богатые фолиевой кислотой.
Следует заметить, что при любой кулинарной обработке продуктов фолаты разрушаются приблизительно на пятьдесят процентов и более. Поэтому для обеспечения организма необходимой суточной нормой продукты рекомендуется употреблять в свежем виде (овощи и фрукты).
| Продукты питания | Наименование продуктов | Количество железа на сто миллиграмм |
| Продукты питания животного происхождения |
|
|
| Продукты питания растительного происхождения |
|
|
Медикаментозное лечение фолиеводефицитной анемии включает прием фолиевой кислоты в количестве от пяти до пятнадцати миллиграмм в сутки. Необходимую дозировку устанавливает лечащий врач в зависимости от возраста пациента, тяжести течения анемии и результатов исследований.
Профилактическая доза включает прием одного – пяти миллиграмм витамина в сутки.
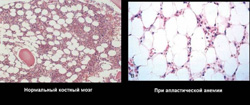
Апластическая анемия может быть врожденной или приобретенной.
Клинические проявления апластической анемии зависят от степени выраженности панцитопении.
При апластической анемии у больного наблюдаются следующие симптомы:
- бледность кожных покровов и слизистых;
- головная боль;
- учащенное сердцебиение;
- одышка;
- повышенная усталость;
- отеки на ногах;
- десневые кровотечения (вследствие снижения уровня тромбоцитов в крови);
- петехиальная сыпь (красные пятна на коже маленьких размеров), синяки на коже;
- острые или хронические инфекции (вследствие снижения уровня лейкоцитов в крови);
- изъязвления орофарингеальной зоны (поражается слизистая полости рта, язык, щеки, десна и глотка);
- желтушность кожных покровов (симптом поражения печени).
При биохимическом анализе крови наблюдается:
- повышение сывороточного железа;
- насыщение трансферрина (белок, переносящий железо) железом на 100%;
- повышение билирубина;
- повышение лактатдегидрогеназы.
При пункции красного мозга и последующем гистологическом исследовании выявляются:
- недоразвитие всех ростков (эритроцитарный, гранулоцитарный, лимфоцитарный, моноцитарный и макрофагальный);
- замещение костного мозга жировым (желтый костный мозг).
Среди инструментальных методов исследований больному может быть назначено:
- ультразвуковое исследование паренхиматозных органов;
- электрокардиография (ЭКГ) и эхокардиография;
- фиброгастродуоденоскопия;
- колоноскопия;
- компьютерная томография.
При правильно подобранном поддерживающем лечении состояние пациентов с апластической анемией существенно улучшается.
При лечении апластической анемии больному назначаются:
- иммунодепрессивные препараты (например, Циклоспорин, Метотрексат);
- глюкокортикостероиды (например, Метилпреднизолон);
- антилимфоцитарный и антитромбоцитарный иммуноглобулины;
- антиметаболиты (например, Флударабин);
- эритропоэтин (стимулирует образование эритроцитов и стволовых клеток).
Немедикаментозное лечение включает:
- трансплантацию костного мозга (от совместимого донора);
- переливание компонентов крови (эритроциты, тромбоциты);
- плазмаферез (механическое очищение крови);
- соблюдение правил асептики и антисептики с целью предотвращения развития инфекции.
Также при тяжелом течении апластической анемии больному может понадобиться хирургическое лечение, при котором производится удаление селезенки (спленэктомия).
В зависимости от эффективности проводимого лечения у больного при апластической анемии может наблюдаться:
- полная ремиссия (затухание или полное исчезновение симптомов);
- частичная ремиссия;
- клиническое улучшение;
- отсутствие эффекта от лечения.
|
|
|
|

Гемолитическая анемия может развиться вследствие наследственных или приобретенных заболеваний.
По локализации гемолиз может быть:
- внутриклеточным (например, аутоиммунная гемолитическая анемия);
- внутрисосудистым (например, переливание несовместимой крови, диссеминированное внутрисосудистое свертывание).
У пациентов с легкой степенью гемолиза уровень гемоглобина может быть нормальным, если производство эритроцитов соответствует темпу их разрушения.
Преждевременное разрушение эритроцита может быть связано со следующими причинами:
- внутренними мембранными дефектами эритроцитов;
- дефектами структуры и синтеза белка гемоглобина;
- ферментативными дефектами в эритроците;
- гиперспленомегалией (увеличение размеров печени и селезенки).
Наследственные заболевания могут вызвать гемолиз в результате отклонений мембраны эритроцита, ферментативных дефектов и отклонений гемоглобина.
Существуют следующие наследственные гемолитические анемии:
- энзимопатии (анемии, при которых наблюдается недостаток фермента, дефицит глюкозо-6-фосфатдегидрогеназы);
- наследственный сфероцитоз или болезнь Минковского-Шоффара (эритроциты неправильной шарообразной формы);
- талассемия (нарушение синтеза полипептидных цепей, входящих в строение нормального гемоглобина);
- серповидно-клеточная анемия (изменение строения гемоглобина приводит к тому, что эритроциты принимают серпообразную форму).
Приобретенные причины гемолитической анемии включают иммунные и не иммунные нарушения.
Иммунные нарушения характеризуются аутоиммунной гемолитической анемией.
Не иммунные нарушения могут быть вызваны:
- ядохимикатами (например, пестициды, бензол);
- лекарственными средствами (например, противовирусные препараты, антибиотики);
- физическим повреждением;
- инфекциями (например, малярия).
Гемолитическая микроангиопатическая анемия приводит к производству фрагментированных эритроцитов и может быть вызвана:
- дефектным искусственным сердечным клапаном;
- диссеминированным внутрисосудистым свертыванием;
- гемолитическим уремическим синдромом;
- тромбоцитопенической пурпурой.
Симптомы и проявления гемолитической анемии разнообразны и зависят от вида анемии, степени компенсации, а также от того, какое лечение получал больной.
Следует заметить, что гемолитическая анемия может протекать бессимптомно, а гемолиз выявляться случайно во время обычного лабораторного тестирования.
При гемолитической анемии могут наблюдаться следующие симптомы:
- бледность кожи и слизистых;
- ломкость ногтей;
- тахикардия;
- учащение дыхательных движений;
- снижение артериального давления;
- желтушность кожных покровов (из-за увеличения уровня билирубина);
- на ногах могут наблюдаться язвы;
- гиперпигментация кожи;
- желудочно-кишечные проявления (например, боль в животе, нарушение стула, тошнота).
Следует заметить, что при внутрисосудистом гемолизе у больного наблюдается дефицит железа из-за хронической гемоглобинурии (наличие гемоглобина в моче). Вследствие кислородного голодания нарушается сердечная функция, что приводит к развитию у пациента таких симптомов как слабость, тахикардия, одышка и стенокардия (при тяжелой форме анемии). Из-за гемоглобинурии у больного также наблюдается потемнение мочи.
Длительный гемолиз может привести к развитию желчных камней вследствие нарушения обмена билирубина. При этом пациенты могут жаловаться на боль в животе и бронзовый цвет кожи.
В общем анализе крови наблюдается:
- снижение уровня гемоглобина;
- снижение уровня эритроцитов;
- увеличение ретикулоцитов.
При микроскопии эритроцитов выявляется их серпообразная форма, а также кольца Кебота и тельца Жолли.
В биохимическом анализе крови наблюдается повышение уровня билирубина, а также гемоглобинемия (увеличение свободного гемоглобина в плазме крови).
Также необходимо сдать анализ мочи на выявление наличия гемоглобинурии.
При пункции костного мозга наблюдается выраженная гиперплазия эритроцитарного ростка.
Существует много видов гемолитической анемии, поэтому лечение может отличаться в зависимости от причины, вызвавшей анемию, а также от типа гемолиза.
При лечении гемолитической анемии больному могут назначаться следующие препараты:
- Фолиевая кислота. Профилактическая доза фолиевой кислоты назначается, потому что активный гемолиз может потреблять фолат и впоследствии привести к развитию мегалобластоза.
- Глюкокортикостероиды (например, Преднизолон) и иммунодепрессанты (например, Циклофосфан). Данные группы препаратов назначаются при аутоиммунной гемолитической анемии.
- Переливание эритроцитарной массы. Больному индивидуально подбираются отмытые эритроциты, так как существует высокий риск разрушения перелитой крови.
Спленэктомия
Спленэктомия может быть первоначальным вариантом в лечении некоторых типов гемолитической анемии, таких как, например, наследственный сфероцитоз. В других случаях, например, при аутоиммунной гемолитической анемии, спленэктомия рекомендуется тогда, когда другие методы лечения потерпели неудачу.
Терапия препаратами железа
При гемолитической анемии применение препаратов железа в большинстве случаев противопоказано. Это связано с тем, что уровень железа при данной анемии не снижается. Однако если у больного наблюдается постоянная гемоглобинурия, то происходит существенная потеря железа из организма. Поэтому при выявлении дефицита железа пациенту может быть назначено соответствующее лечение.
Проявления анемии будут зависеть от следующих факторов:
- какое количество крови было потеряно;
- с какой скоростью происходит кровопотеря.
Симптомами постгеморрагической анемии являются:
- слабость;
- головокружение;
- бледность кожных покровов;
- сердцебиение;
- одышка;
- тошнота, рвота;
- сечение волос и ломкость ногтей;
- шум в ушах;
- мелькание мушек перед глазами;
- жажда.
При острой кровопотере у больного может развиться геморрагический шок.
Выделяют четыре степени геморрагического шока.
источник
Железодефицитная анемия – синдром, обусловленный недостаточностью железа и приводящий к нарушению гемоглобинопоэза и тканевой гипоксии. Клинические проявления представлены общей слабостью, сонливостью, пониженной умственной работоспособностью и физической выносливостью, шумом в ушах, головокружениями, обморочными состояниями, одышкой при нагрузке, сердцебиением, бледностью. Гипохромная анемия подтверждается лабораторными данными: исследованием клинического анализа крови, показателей сывороточного железа, ОЖСС и ферритина. Терапия включает лечебную диету, прием препаратов железа, в некоторых случаях – трансфузию эритроцитарной массы.
Железодефицитная (микроцитарная, гипохромная) анемия – анемия, обусловленная нехваткой железа, необходимого для нормального синтеза гемоглобина. Её распространенность в популяции зависит от половозрастных и климатогеографических факторов. По обобщенным сведениям, гипохромной анемией страдает около 50% детей раннего возраста, 15% женщин репродуктивного возраста и около 2% мужчин. Скрытый тканевой железодефицит выявляется практически у каждого третьего жителя планеты. На долю микроцитарной анемии в гематологии приходится 80–90% всех анемий. Поскольку железодефицит может развиваться при самых различных патологических состояниях, данная проблема актуальна для многих клинических дисциплин: педиатрии, гинекологии, гастроэнтерологии и др.
Ежесуточно с потом, калом, мочой, слущенными клетками кожи теряется около 1 мг железа и примерно столько же (2-2,5 мг) поступает в организм с пищей. Дисбаланс между потребностями организма в железе и его поступлением извне или потерями способствует развитию железодефицитной анемии. Железодефицит может возникать как при физиологических условиях, так и в результате ряда патологических состояний и быть обусловлен как эндогенными механизмами, так и внешними воздействиями:
Чаще всего анемия вызывается хронической потерей крови: обильными менструациями, дисфункциональными маточными кровотечениями; желудочно-кишечными кровотечениями из эрозий слизистой желудка и кишечника, гастродуоденальных язв, геморроидальных узлов, анальных трещин и др. Скрытая, но регулярная кровопотеря отмечается при гельминтозах, гемосидерозе легких, экссудативном диатезе у детей и др.
Особую группу составляют лица с болезнями крови — геморрагическими диатезами (гемофилией, болезнью Виллебранда), гемоглобинурией. Возможно развитие постгеморрагической анемии, вызванной одномоментным, но массивным кровотечением при травмах и операциях. Гипохромная анемия может возникать вследствие ятрогенных причин — у доноров, часто сдающих кровь; пациентов с ХПН, находящихся на гемодиализе.
К факторам алиментарного порядка относятся анорексия, вегетарианство и следование диетам с ограничением мясных продуктов, плохое питание; у детей — искусственное вскармливание, позднее введение прикорма. Снижение абсорбции железа характерно для кишечных инфекций, гипоацидного гастрита, хронического энтерита, синдрома мальабсорбции, состояния после резекции желудка или тонкой кишки, гастрэктомии. Значительно реже железодефицитная анемия развивается вследствие нарушения транспортировки железа из депо при недостаточной белково-синтетической функции печени – гипотрансферринемиях и гипопротеинемиях (гепатитах, циррозе печени).
Ежедневная потребность в микроэлементе зависит от пола и возраста. Наиболее высока необходимость в железе у недоношенных, детей раннего возраста и подростков (в связи с высокими темпами развития и роста), женщин репродуктивного периода (в связи с ежемесячными менструальными потерями), беременных (в связи с формированием и ростом плода), кормящих мам (в связи с расходом в составе молока). Именно эти категории являются наиболее уязвимыми в отношении развития железодефицитной анемии. Кроме того, повышение потребности и расхода железа в организме наблюдается при инфекционных и опухолевых заболеваниях.
По своей роли в обеспечении нормального функционирования всех биологических систем железо является важнейшим элементом. От уровня железа зависит поступление кислорода к клеткам, протекание окислительно-восстановительных процессов, антиоксидантная защита, функционирование иммунной и нервной систем и пр. В среднем содержание железа в организме находится на уровне 3-4 г. Более 60% железа (>2 г) входит в состав гемоглобина, 9% — в состав миоглобина, 1% — в состав ферментов (гемовых и негемовых). Остальное железо в виде ферритина и гемосидерина находится в тканевом депо – главным образом, в печени, мышцах, костном мозге, селезенке, почках, легких, сердце. Примерно 30 мг железа непрерывно циркулирует в плазме, будучи частично связанным основным железосвязывающим белком плазмы – трансферрином.
При развитии отрицательного баланса железа мобилизуются и расходуются запасы микроэлемента, содержащиеся в тканевых депо. На первых порах этого бывает достаточно для поддержания адекватного уровня Hb, Ht, сывороточного железа. По мере истощения тканевых резервов компенсаторно увеличивается эритроидная активность костного мозга. При полном истощении эндогенного тканевого железа его концентрация начинает снижаться в крови, нарушается морфология эритроцитов, уменьшается синтез гема в гемоглобине и железосодержащих ферментов. Страдает кислородтранспортная функция крови, что сопровождается тканевой гипоксией и дистрофическими процессами во внутренних органах (атрофический гастрит, миокардиодистрофия и др.).
Железодефицитная анемия возникает не сразу. Вначале развивается предлатентный железодефицит, характеризующийся истощением только запасов депонированного железа при сохранности транспортного и гемоглобинового пула. На этапе латентного дефицита отмечается уменьшение транспортного железа, содержащегося в плазме крови. Собственно гипохромная анемия развивается при уменьшении всех уровней метаболических запасов железа – депонированного, транспортного и эритроцитарного. В соответствии с этиологией различают анемии: постгеморрагические, алиментарные, связанные с повышенным расходом, исходным дефицитом, недостаточностью резорбции и нарушением транспорта железа. По степени выраженности железодефицитные анемии подразделяются на:
- Легкие (Нb 120-90 г/л). Протекают без клинических проявлений или с их минимальной выраженностью.
- Среднетяжелые (Нb 90-70 г/л). Сопровождаются циркуляторно-гипоксическим, сидеропеническим, гематологическим синдромами умеренной степени выраженности.
- Тяжелые (Нb
Циркуляторно-гипоксический синдром обусловлен нарушением синтеза гемоглобина, транспорта кислорода и развитием гипоксии в тканях. Это находит свое выражение в ощущении постоянной слабости, повышенной утомляемости, сонливости. Пациентов преследует шум в ушах, мелькание «мушек» перед глазами, головокружения, переходящие в обмороки. Характерны жалобы на сердцебиение, одышку, возникающую при физической нагрузке, повышенную чувствительность к низким температурам. Циркуляторно-гипоксические нарушения могут усугублять течение сопутствующей ИБС, хронической сердечной недостаточности.
Развитие сидеропенического синдрома связано с недостаточностью тканевых железосодержащих ферментов (каталазы, пероксидазы, цитохромов и др.). Этим объясняется возникновение трофических изменений кожных покровов и слизистых оболочек. Чаще всего они проявляются сухостью кожи; исчерченностью, ломкостью и деформацией ногтей; повышенным выпадением волос. Со стороны слизистых оболочек типичны атрофические изменения, что сопровождается явлениями глоссита, ангулярного стоматита, дисфагии, атрофического гастрита. Может возникать пристрастие к резким запахам (бензина, ацетона), искажение вкуса (желание есть глину, мел, зубной порошок и пр.). Признаками сидеропении также служат парестезии, мышечная слабость, диспепсические и дизурические расстройства. Астеновегетативные нарушения проявляются раздражительностью, эмоциональной неустойчивостью, снижением умственной работоспособности и памяти.
Поскольку в условиях железодефицита IgA теряет свою активность, больные становятся подвержены частой заболеваемости ОРВИ, кишечными инфекциями. Пациентов преследует хроническая усталость, упадок сил, снижение памяти и концентрации внимания. Длительное течение железодефицитной анемии может привести к развитию миокардиодистрофии, распознаваемой по инверсии зубцов Т на ЭКГ. При крайне тяжелом железодефиците развивается анемическая прекома (сонливость, одышка, резкая бледность кожи с цианотичным оттенком, тахикардия, галлюцинации), а затем – кома с потерей сознания и отсутствием рефлексов. При массивной стремительной кровопотере возникает гиповолемический шок.
На наличие железодефицитной анемии может указывать внешний вид больного: бледная, с алебастровым оттенком кожа, пастозность лица, голеней и стоп, отечные «мешки» под глазами. При аускультации сердца обнаруживается тахикардия, глухость тонов, негромкий систолический шум, иногда – аритмия. С целью подтверждения анемии и определения ее причин проводится лабораторное обследование.
- Лабораторные тесты. В пользу железодефицитного характера анемии свидетельствует снижение гемоглобина, гипохромия, микро- и пойкилоцитоз в общем анализе крови. При оценке биохимических показателей отмечается снижение уровня сывороточного железа и концентрации ферритина (60 мкмоль/л), уменьшение насыщения трансферрина железом (
- Инструментальные методики. Для установления причины хронической кровопотери должно быть проведено эндоскопическое обследование ЖКТ (ЭГДС, колоноскопия,), рентгенодиагностика (ирригоскопия, рентгенография желудка). Обследование органов репродуктивной системы у женщин включает УЗИ малого таза, осмотр на кресле, по показаниям — гистероскопию с РДВ.
- Исследование пунктата костного мозга. Микроскопия мазка (миелограмма) показывает значительное снижение количества сидеробластов, характерное для гипохромной анемии. Дифференциальная диагностика направлена на исключение других видов железодефицитных состояний — сидеробластной анемии, талассемии.
К основным принципам терапии железодефицитной анемии относятся устранение этиологических факторов, коррекция рациона питания, восполнение железодефицита в организме. Этиотропное лечение назначается и проводится специалистами гастроэнтерологами, гинекологами, проктологами и др.; патогенетическое – гематологами. При железодефицитных состояниях показано полноценное питание с обязательным включением в рацион продуктов, содержащих гемовое железо (телятины, говядины, баранины, мяса кролика, печени, языка). Следует помнить, что усилению ферросорбции в ЖКТ способствуют аскорбиновая, лимонная, янтарная кислота. Ингибируют всасывание железа оксалаты и полифенолы (кофе, чай, соевый протеин, молоко, шоколад), кальций, пищевые волокна и др. вещества.
Вместе с тем, даже сбалансированная диета не в состоянии устранить уже развившийся недостаток железа, поэтому больным с гипохромной анемией показана заместительная терапия ферропрепаратами. Препараты железа назначаются курсом не менее 1,5-2-х месяцев, а после нормализации уровня Hb проводится поддерживающая терапия в течение 4-6 недель половинной дозой препарата. Для фармакологической коррекции анемии используются препараты двухвалентного и трехвалентного железа. При наличии витальных показаний прибегают к гемотрансфузионной терапии.
В большинстве случаев гипохромная анемия подается успешной коррекции. Однако при неустраненной причине железодефицит может рецидивировать и прогрессировать. Железодефицитная анемия у детей раннего и младшего возраста может вызывать задержку психомоторного и интеллектуального развития (ЗПР). В целях профилактики железодефицита необходим ежегодный контроль параметров клинического анализа крови, полноценное питание с достаточным содержанием железа, своевременная ликвидация источников кровопотери в организме. Следует учитывать, что лучше всего усваивается железо, содержащееся в мясе и печени в форме гема; негемовое железо из растительной пищи практически не усваивается – в этом случае оно сначала должно восстановиться до гемового при участии аскорбиновой кислоты. Лицам групп риска может быть показан профилактический прием железосодержащих препаратов по назначению специалиста.
источник


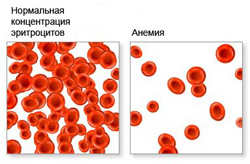 Анемия — это патологическое состояние организма, которое характеризуется уменьшением количества эритроцитов и гемоглобина в единице крови.
Анемия — это патологическое состояние организма, которое характеризуется уменьшением количества эритроцитов и гемоглобина в единице крови. Анемии классифицируются:
Анемии классифицируются: Существуют три основные причины, приводящие к развитию анемии:
Существуют три основные причины, приводящие к развитию анемии: