При апластической анемии анализ крови может многое рассказать, как и при любой другой форме этого заболевания. Чаще всего встречается дефицит железа, из-за чего анемия именуется железодефицитной. В целом под ней понимается заболевание, которое провоцирует дефицит железа или неправильный процесс его переработки внутри организма.
Железодефицитной анемии диагностика подтверждает, что первичным заболеванием она считаться не может. Присутствует дополнительное патологическое влияние. Дефицит железа в организме становится причиной неправильного кроветворения. Из-за железодефицита происходит неправильный гемоглобиновый синтез на базе эритроцитов. В результате количество их становится меньше, как и функциональные способности.
Диагностика анемии демонстрирует, что именно железодефицитный вариант является наиболее распространенным в мире. Чаще всего сталкиваются с ЖДА женщины, в том числе из-за беременности и кормления грудью. Кроме этого, они периодически теряют кровь, что снижает количество железа.
Анализ крови при анемии является обязательным исследованием. При этом предлагается три варианта:
- общий кровяной анализ;
- биохимия;
- анализ кала на скрытую кровь.
Рекомендации врачей говорят о том, что лучше пройти все обследования, а не выбирать какое-то одно. Говоря об общем анализе крови, показатели, определяемые при нем, помогают понять, в каком состоянии находятся все кровяные клетки. ОАК демонстрирует соотношение их объемного показателя к жидкой кровяной части. Кроме этого, определяются гемоглобиновые показатели, формула по лейкоцитам.
Биохимия – это лабораторная диагностика, помогающая понять, в каком состоянии находятся системы и внутренние органы. Такое исследование помогает определить и недостаток железа в организме, причем не только выраженный, но и скрытый, за счет определения уровня ферритина и трасферрина. Первый компонент демонстрирует, сколько в организме осталось железистых запасов. Кроме этого, демонстрируются другие показатели, сдвиги которых могут объясняться нехваткой железа.
В рамках сдачи кала на скрытую кровь можно проанализировать присутствует ли в желудке и кишечнике кровотечение. Важно отметить, что такая лабораторная диагностика предполагает особую подготовку. Речь идет об исключении из рациона за три дня до сдачи продуктов с высоким содержанием железа и медикаментов, которые предназначены для восполнения этого недостатка.
Стоит сразу отметить, что большинство анемий поддаются корректировке, особенно, если выявляются на ранней стадии. Чтобы анализы при анемии продемонстрировали правильные цифры, важно подготовиться к ним правильно. Об особенностях подготовки к сдаче калатуже упоминалось выше.
Если говорить про анализ крови при железодефицитной анемии, то здесь все несколько проще. За сутки до сдачи исключается прием любого напитка, содержащего алкоголь. Сдача крови выполняется в утренние часы после предварительного восьмичасового голодания. В этот период запрещено употреблять любую пищу или напитки, кроме негазированной воды. По согласованию с врачом исключаются любые лекарственные препараты, кроме жизненно необходимых. Препараты, в которых содержится железо, должны быть исключены за трое суток до анализа. Курение исключается за полчаса до сдачи. Важно исключить перенапряжение с физической и эмоциональной точки зрения.
Выше уже отмечалось, что анализы на анемию бывают разные, так как существуют разные типы заболевания. В большинстве случаев выполняется постановка диагноза железодефицитная анемия. В организме присутствует дефицит железа. Это может быть результатом недостаточного поступления его вместе с пищей, или результатом неправильной переработки его в организме или длительное кровотечение. Анализу и предстоит определить причину, в соответствии с которой подбирается лечение. Часто такая картина крови наблюдается у беременных или кормящих матерей, в такие моменты железо потребляется организмом в большом количестве, поэтому до анемического состояния дойти не сложно.
Чтобы дифференцировать такое состояние, обратите внимание на гемоглобин, он в таком случае демонстрируется недостаточный, сокращается эритроцитный показатель и уровень железа в сыворотке. Лечение ЖДА, называющейся также малокровием, предполагает прием железа по длительной схеме.
Встречается и гемолитическая анемия. В таком случае болезнь развивается на фоне гемолиза – эритроцитного разрушения в крови. Способствовать этому могут различные факторы. Как пример, отравление ядами, сильные нагрузки стрессового характера, болезни, передающиеся по наследству.
Для такого диагноза выполняется расшифровка анализа мочи, в которой обнаруживается гемоглобин. В крови растет показатель билирубина. Иногда присутствуют эритроциты измененной формы и другие признаки. На основе гемограммы выясняется первопричина, которую и нужно лечить.
В12 дефицитная анемия или по-другому пернициозная анемия встречается в том случае, когда фиксируется недостаток витамина В 12. Без этого витамина невозможен рост и созревание эритроцитов в костном мозге. Кроме этого, без него невозможна правильная работа системы нервной направленности.
Пернициозная анемия часто проявляет себя как покалывание и онемение, присутствующее в пальцах, походка становится шаткой. В анализах пернициозная анемия проявляет себя как повышенное количество эритроцитов с увеличенной формой. Пернициозная анемия часто встречается у пожилых людей. Можно встретить и еще одно ее название – мегалобластная анемия. Недостаточное количество В12 фиксируется при заболеваниях пищеварительного тракта, при присутствии в организме таких паразитов, как ленточные черви. Все это провоцирует диагноз мегалобластная анемия.
Встречается и так называемая злокачественная анемия, именуется которая апластической. Под такими формами анемии понимается особая группа заболеваний крови, в результате чего количество всех клеток крови снижается, а признаки опухолевого процесса отсутствуют. Это не слишком распространенное заболевание, однако поражать оно может представителей всех полов и возрастов, но чаще встречается у старшей возрастной группы. Пробелам апластической анемии заключается в том, что как минимум две трети заболевших не выживают.
Еще одна необычная форма – это серповидноклеточная анемия. Она становится следствием наследственного заболевания кровяной системы. Речь идет о дефекте, работающем на уровне генетики, в результате которого происходит нарушение формирования нормальных гемоглобиновых цепей в рамках эритроцитов. Гемоглобин, который образуется при этом, является аномальным, есть у него отличия и по свойствам электрофизиологического типа, если сравнивать с нормальным здоровым гемоглобином. В результате этого процесса фиксируют изменения самих эритроцитов, которые становятся вытянутыми в длину. Среди наследственных гемоглобинопатий СКА считается наиболее тяжелой формой. Дело в том, что эритроциты с таким изменением подвергаются быстрому разрушению в организме, часто вызывают осложнения тяжелого течения и смерть.
Гипохромная анемия – это общее название для целой группы заболеваний, на фоне которых недостаточность гемоглобина приводит к формированию другого цветового показателя крови. Расшифровка анализа в таком случае демонстрирует цифру менее 0,8, а концентрация гемоглобина в одном эритроците не дотягивает до 330 г/л. Чаще всего гипохромная анемия формируется вслед за ЖДА. Кроме этого, привести к такому диагнозу может отравление свинцом хронического порядка, недостаток витамина В6. Столкнуться с ней можно после некоторых воспалений инфекционной и неинфекционной природы, которые приводят к нарушению железистого обмена.
Если при дифференциальной диагностике железодефицитной анемии был подтвержден диагноз, важно выявить причину патологии. Выше уже отмечалось, что провоцировать ЖДА может как недостаток железа с пищей, так и неправильная его переработка организмом.
Кроме этого, нельзя исключать повышенные в количестве железа потребности организма, врожденный его недостаток, нарушение процессов всасывания или синтеза трансферрина. Влияют негативно массивные кровопотери, алкоголизм, прием ряда медикаментов.
Если говорить о недостатке железа, поступающего с пищей, то чаще всего наблюдается такая проблема при длительном голодании, у вегетарианцев, при однообразных диетах, не предполагающих большое количество животных продуктов.
Повышенная в железе необходимость является нормальным признаком, если речь идет о беременных или кормящих матерях. В такие периоды количество его с пищей должно увеличиваться. При этом если речь идет о многоплодной беременности, то цифры потребления железа должны увеличиваться еще в несколько раз.
Дети, страдающие от врожденного железистого дефицита, рождаются у матерей с тяжелой железодефицитной анемией, при многоплодной беременности или недоношенности. В таком случае с симптомами ЖДА ребенок сталкивается уже на первых неделях жизни.
Когда речь идет о неправильном всасывании железа, подразумевается работа двенадцатиперстной кишки, а именно проблемы со слизистой этого кишечного отдела. Самые разные заболевания ЖКТ становятся причиной поврежденной слизистой, что влияет на скорость, с которой железо всасывается.
Это и ряд наследственных заболеваний, в том числе целиакия, которая подразумевает непереносимость глютена. Это может быть воспаление слизистой, которая покрывает тонкий кишечник, инфекционные проблемы, гастрит атрофического типа, в результате которого сокращаются размеры слизистой, что снижает функционал.
Нельзя исключать и гастрит аутоимунного типа. Заболевание провоцируется нарушением иммунной работы и антительным производством. Атакуют они при этом собственные организменные клетки, в частности, клетки, которые покрывают слизистую желудка, на фоне чего они разрушаются. Такой диагноз может быть поставлен и людям, перенесшим удаление желудка или части тонкого кишечника. Нельзя исключать болезнь Крона, муковисцидоз и раковые проблемы.
Когда речь идет о неправильном синтезе трансферрина, то в большинстве случаев такие проблемы провоцируются разного рода наследственными заболеваниями. Трансферрин отвечает за перенос железа к различным органам, в результате страдает и красный костный мозг, так как синтезироваться эритроциты не могут. За синтез трансферрина отвечают печеночные клетки, поэтому их разнообразные поражения, могут стать причиной сокращенного количества трансферрина, что спровоцирует симптоматику ЖДА.
Повышенная потеря крови тоже может приводить к недостатку железа. При этом чаще всего подразумеваются именно хронические небольшие кровопотери. Дело в том, что одноразовые, даже массированные потери крови, такой проблемы не вызывают, поскольку в организме железо присутствует в виде запасов, которые и предназначены для возмещения таких потерь. Когда же речь идет о хронических кровотечениях внутри, которые незаметны сразу, длятся которые долго, человек может терять по миллиграмму железа каждый день и так на протяжении долгого времени.
Хроническая кровопотеря может формироваться на фоне язвенной болезни желудка или двенадцатиперстной кишки, геморрой, неспецифического язвенного колита, болезни Крона, кишечного полипоза. Влияют таким же образом опухоли ЖКТ, эндометриоз, системная красная волчанка. С таким диагнозом могут столкнуться и слишком активные доноры, которые в год сдают кровь более четырех раз. Важно обнаружить непосредственную причину кровопотери, в противном случае ЖДА для больного неизбежна.
Алкоголизм тоже не лучший друг железа. При длительном и частом употреблении алкогольных напитков повреждается слизистая желудка. Кроме этого, этиловым спиртом угнетаются процессы кроветворения, которые проходят в красном костном мозге, что усиливает анемичные проявления.
Нельзя в качестве причин появления ЖДА исключать и прием определенных медикаментов. Дело в том, что у некоторых лекарственных препаратов, нарушение процессов всасывания и железистой утилизации является побочным эффектом. Чаще всего столкнуться с такой проблемой можно при длительном курсе лечения с большими дозами препарата.
Повлиять на уровень железа могут такие популярные препараты, как противовоспалительные нестероидные средства. Дело в том, что такие препараты как бы разжижают кровь, что чревато образованием хронических внутренних кровотечений. Кроме этого, опасен их бесконтрольный прием язвенной болезнью желудка.
В группу опасных, с этой точки зрения, препаратов входят и антациды, которые сокращают или нейтрализуют скорость выделения желудочного сока. В составе его присутствует соляная кислота, которая требуется для нормального всасывания железа.
Препараты железосвязывающего характера помогают в связке и выводе железа из организма. При этом речь идет не только о свободном железе, но и о запасах организма. Говоря о симптоматике анемии, связанной с дефицитом железа, чаще всего врачами обращается внимание на бледность кожи и губ, слабость, утомляемость. На фоне недостаточности кислорода в крови повышается пульс, который превышает показатель в 90 ударов в минуту. Признаки могут варьироваться, в зависимости от вида анемии, которая вас настигла.
источник
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Ретроспективными исследованиями установлено, что средний интервал от воздействия этиологического агента до возникновения панцитопении составляет 6-8 нед.
Симптомы апластических анемий напрямую связаны со степенью снижения 3 важнейших показателей периферической крови — гемоглобина, тромбоцитов и нейтрофилов. Подавляющее большинство больных апластическими анемиями обращаются к врачу по поводу кровоточивости, причём угрожающие жизни кровотечения в качестве первого клинического проявления болезни встречаются очень редко. В типичных случаях речь идёт о петехиальной сыпи, кровоточивости дёсен и легко возникающих экхимозах. Серьёзные висцеральные кровотечения — желудочно-кишечные, почечные и внутричерепные — возникают позже. Анемический синдром проявляется лёгкой утомляемостью, шумом в ушах, ощущением пульсации в голове, усталостью и другими классическими симптомами анемии. Как правило, дети хорошо переносят даже очень тяжёлую анемию. По данным литературы, тяжёлые инфекции редко выступают первыми симптомами болезни, однако, по нашим данным, это не совсем так. Нехарактерны для апластических анемий снижение массы, спленомегалия, лимфаденопатия и боли. Появление этих симптомов заставляет искать другую причину панцитопении.
Помимо внимательного клинического осмотра минимальный спектр необходимых диагностических исследований при подозрении на апластическую анемию включает:
- гемограмму с определением ретикулоцитов и ручным подсчётом лейкоцитарной формулы;
- миелограмму из 2-3 анатомически различных точек;
- трепанобиопсию костного мозга;
- пробу на ломкость хромосом с диэпоксибутаном или митомицином (митомицин С);
- биохимический анализ крови.
Для апластических анемий типично конкордатное снижение показателей производных всех 3 главных ростков костномозгового кроветворения (эритроцитов, гранулоцитов и тромбоцитов), несмотря на различную кинетику зрелых элементов крови. У большинства пациентов число лимфоцитов и моноцитов также снижено. Абсолютное число ретикулоцитов неадекватно тяжести анемии. Повышение фетального гемоглобина наряду с макроцитозом типично для апластических анемий. Повышение активности сывороточных трансаминаз, за исключением случаев гепатит-ассоциированных апластических анемий нехарактерно. Относительно высокий ретикулоцитоз, повышение билирубина и лактатдегидрогеназы говорит о сопутствующем синдроме — пароксизмальной ночной гемоглобинурии.
Состояние костного мозга при апластических анемиях должно быть оценено как по данным аспирата из нескольких точек, так и по данным трепанобиопсии. По данным исследования пунктата оценивают морфологию резидентных элементов эритро-, грануло- и мегакариоцитопоэза. Дизэритропоэз — весьма частая характеристика при апластических анемиях, типично также выявление «мегалобластоидности» эритроидных элементов, асинхронии созревания ядра и цитоплазмы эритробластов — эти признаки очень трудно дифференцировать от дисплазии эритроидного ряда, выявляемой при миелодиспластических синдромах. Зачастую в пунктате выявляется повышение количества плазматических клеток и макрофагов с явлениями фагоцитоза эритроцитов. Выявление лейкемических бластов в аспирате заставляет пересмотреть диагноз.
В 1976 и 1979 гг. Брюсом Камиттой и соавт. была выделена группа простейших показателей периферической крови и костного мозга, определяющих тяжесть течения заболевания и прогноз больных апластической анемией.
Критерии тяжёлой формы апластической анемии
Клеточность костного мозга, по данным трепанобиопсии, менее 25% (или 9 /л). Тромбоцитопения по мере прогрессирования заболевания достигает значительной степени (до единичных тромбоцитов в мазке). СОЭ, как правило, увеличена.
При анемии Фанкони имеется стресс-эритропоэз, который характеризуется макроцитозом, высоким уровнем Hb F, высоким уровнем эритропоэтина в сыворотке и наличием i-антигена.
Стернальный пунктат на ранних стадиях заболевания нормо- или гипоклеточный. Количество бластов в пределах нормы. Содержание клеток эритроидного ростка увеличено с задержкой их созревания и морфологическими нарушениями в виде анизоцитоза, базофильной пунктации в нормобластах, иногда отмечается появление мегалобластов. Гранулоцитарный росток «сужен», возможна задержка созревания на стадии неитрофильных миелоцитов и метамиелоцитов. Мегакариоцитарный росток значительно «сужен» уже на ранних стадиях заболевания. По мере прогрессирования заболевания отмечается выраженная гипоклеточность костного мозга с угнетением всех ростков и разрастанием жировой ткани. В костном мозге увеличено число ретикулярных, плазматических и тучных клеток. Гипоплазия костного мозга подтверждается результатами трепанобиопсии.
Из биохимических показателей для апластической анемии характерно повышение уровня фетального гемоглобина до 15 % (при норме 2 %) еще до развития цитопении, по мере прогрессирования аплазии фетальный гемоглобин достигает 45 %.
Установлено, что клетки больных с анемией Фанкони не способны репарировать поперечные сшивки ДНК, вызываемые так называемыми кластогенами — диэпоксибутаном, митомицином С и др. На этом феномене основана современная диагностика анемии Фанкони и у всех больных с подозрением на анемию Фанкони должен проводиться тест с диэпоксибутаном.
Течение анемии Фанкони характеризуется наличием периодов обострения и ремиссии. Без лечения через 2 года после диагностики панцитопении умирают 80 % больных, а через 4 года — около 100 %. Причиной смерти, наряду с тяжелой анемией, являются наиболее серьезные проявления геморрагического синдрома — желудочно-кишечные кровотечения, внутричерепные кровоизлияния и присоединение различных инфекций.
У больных анемией Фанкони имеется высокий риск трансформации в миелодиспластический синдром, острый лейкоз (особенно миелобластный или монобластный), злокачественные опухоли ЖКТ.
Наследственная апластическая анемия с общим поражением гемопоэза без врожденных аномалий развития (анемия Эстрена-Дамешека)
Является тотальной формой наследственной апластической анемии, наследуется аутосомно-рецессивно, протекает с панцитопенией, не сопровождается врожденными пороками развития. Заболевание встречается крайне редко, гематологические нарушения отмечаются в раннем детском возрасте. Прогноз неблагоприятный.
Врожденный дискератоз (синдром Цинссера-Коула-Энгмана)
Синдром характеризуется признаками эктодермальной дисплазии (патологическое ороговение отдельные клеток шиповатого слоя эпидермиса кожи и слизистых оболочек) в сочетании с гематологическими изменениями (примерно у 50 % больных развивается апластическая анемия). В 75 % случаев синдром наследуется рецессивно сцепленно с Х-хромосомой и, соответственно, встречается у мальчиков; у 25 % детей больных наследуется по аутосомно-доминантному типу (описано примерно одинаковое количество больных). Поражаются кожа и ее дериваты, слизистые оболочки. Наблюдаются множественный рассеянный гиперкератоз с преимущественной локализацией на лице, шее, спине, груди; атрофия кожи ладоней и ступней, ладонно-подошвенный гипергидроз; нарушение роста и дистрофия ногтей; гипотрихоз ресниц; закупорка слезных канальцев и слезотечение; лейкоплакия слизистых полости рта, в основном языка и десен; поражение эндокринных желез (нанизм, недоразвитие вторичных половых признаков). Гематологические изменения разнообразны: панцитопения, изолированная анемия, тромбоцитопения, нейтропения. Возраст дебюта апластической анемии при данном синдроме может быть весьма вариабелен, средний возраст дебюта АА составляет 15 лет.
В отличие от больных с анемией Фанкони клетки больных с врожденным дискератозом не обладают повышенной чувствительностью к антигенам, вызывающим поперечные сшивки, поэтому эти иногда фенотипически похожие синдромы могут быть дифференцированы на основании теста с диэпоксибутаном.
Характеризуется экзокринной недостаточностью поджелудочной железы, карликовостью, метафизарной хондродис-плазией, нейтропенией, иногда анемией, тромбоцитопенией. Наследуется аутосомно-доминантно.
Заболевание клинически проявляется в раннем возрасте и характеризуется признаками поражения ЖКТ и гематологическими изменениями. Отмечаются диарея, стеаторея, замедление весовых прибавок, гипотрофия. Характерны изменения костной системы в виде хондроднсплазии метафиза и формирование ортопедической патологии, задержка роста. У части больных возможна галактоземия, что приводит к гепатоспленомегалии, задержке психомоторного развития. Характерны рецидивирующие респираторные заболевания, отиты, абсцессы, остеомиелит. У некоторых детей наблюдается задержка наступления пубертатного периода.
В анализах крови с раннего возраста отмечается абсолютная нейтропения, число нейтрофилов менее 1 х 10 9 /л. Для зрелых нейтрофилов характерна гипосегментация ядер, отмечается снижение хемотаксиса нейтрофилов. Наряду с нейтропенией приблизительно у 50 % больных отмечается анемия с ретикулоцитопенией, у 60-70 % детей — тромбоцитопения, примерно у 25% больных развивается апластическая анемия. В стернальном пунктате число миелокариоцитов может быть нормальным, сниженным или повышенным; отмечается задержка созревания нейтрофилов на стадии метамиелоцита. Прогноз наиболее неблагоприятный в раннем детском возрасте, когда около 25% детей погибают от инфекционных осложнений; летальный исход возможен и от кровоизлияний в жизненно важные органы.
Наследственная апластическая анемия с избирательным поражением эритропоэза (анемия Блекфена-Даймонда)
Частота данного заболевания составляет 1 : 1 000 000 живых новорожденных; 5 — 7 : 1 000 000 во Франции, 10:1 000 000 в Скандинавии, встречается во всех этнических группах, мальчики и девочки заболевают одинаково часто. Подавляющее большинство (75 %) составляют спорадические случаи заболевания; в некоторых случаях возможно аутосомно-доминантное наследование, аутосомно-рецессивное или сцепленное с Х-хромосомой.
Первые признаки болезни выявляются в первые месяцы или на протяжении первого года жизни — у 35 % больных анемией при рождении, у 65 % в первые 6 месяцев жизни и в 90 % случаев заболевание диагностируется до года. Диагноз анемии Блекфена — Даймонда у детей старше 2 лет маловероятен. Дети, как правило, рождаются доношенными с нормальной массой тела и ростом, психомоторное развитие нормальное. Бледность кожи и слизистых отмечается с первых дней жизни, но явные клинические признаки гипоксии: вялость или возбуждение, беспокойство, сонливость, отказ от еды, диспепсические явления — появляются при снижении гемоглобина до 60-30 г/л. Врожденные пороки развития встречаются реже (в 25 % случаев), чем при анемии Фанкони. Некоторые больные имеют характерные фенотипические особенности: волосы цвета пакли, курносый нос, большая верхняя губа, гипертелоризм. По мере прогрессирования заболевания кожа приобретает восковидный, а к 5-6 годам, в связи с развитием гемосидероза, — сероватый оттенок, особенно в области шейных, подмышечных, паховых складок, половых органов. Геморрагический синдром отсутствует. Наблюдаются гепатомегалия, спленомегалия, в динамике заболевания селезенка сокращается, а печень прогрессивно увеличивается. Костный возраст отстает от паспортного на 4-5 лет, темпы окостенения изменены. Смена молочных зубов запаздывает, часто выявляется кариес.
В периферической крови нормохромная макроцитарная гипо- или арегенераторная анемия (ретикулоциты 0-0,1 %), как правило, тяжелой степени. Число лейкоцитов и тромбоцитов остается на нормальном уровне в течение первых лет жизни; иногда отмечается тенденция к тромбоцитозу. При длительном течении заболевания может развиваться умеренная тромбоцитопения. После первого десятилетия жизни может также появиться умеренная нейтропения, вероятно, из-за снижения клональной эффективности предшественников гранулоцитов.
Биохимически отмечается высокий уровень активности эритроцитарной аденозиндезаминазы; уровень фетального гемоглобина нормальный или умеренно повышен; повышено содержание i-антигена в эритроцитах; увеличено содержание эритропоэтина в сыворотке.
В стернальном пунктате костный мозг нормоклеточный, по мере прогрессирования заболевания отмечается гипоклеточность. Эритроидный росток резко сужен; диагностическим критерием является отсутствие или малое количество эритробластов (менее 5 % ядросодержащих клеток) в костном мозге. Миелоидный и мегакариоцитарный ростки не изменены. Число ретикулярных клеток и лимфоцитов увеличено, плазматических клеток не изменено.
Анемия Блекфена-Даймонда протекает хронически, у 80 % больных получают ремиссию при использовании кортикостероидов; у 20 % больных описана спонтанная ремиссия. «Постоянная гипоксия, нарушение утилизации железа, необходимость по жизненным показаниям трансфузии эритроцитарной массы неуклонно ведут к гемосидерозу, который в дальнейшем является «убийцей» больного ребенка». Возможна трансформация в миелодиспластический синдром, острый лейкоз (лимфобластный, миелобластный, промиелоцитарный, мегакариоцитарный), солидные опухоли (гепатобластому, рстеосаркому, злокачественную фиброзную гистиоцитому), лимфогранулематоз.
Дифференциальный диагноз при анемии Блекфена-Даймонда проводится с другими видами анемий, при которых в периферической крови уменьшается количество ретикулоцитов.
Анемия в период выздоровления после гемолитической болезни новорожденных.
Иногда может сочетаться со снижением интенсивности эритропоэза. Апластические кризы, характеризующиеся ретикулоцитопенией и уменьшением числа предшественников эритроцитов, могут осложнять разные типы гемолитической болезни. Подобные эпизоды являются транзиторными, кроме того, обычно выявляются признаки предшествующей гемолитической болезни. Развитие апластических кризов связывают с В19-парвовирусной инфекцией. Тактика ведения больных, как правило, выжидательная: при значительном снижении уровня гемоглобина проводятся гемотрансфузии.
Транзиторная эритробластопения детского возраста
Одна из наиболее частых форм аплазии эритроидного ростка. Этиология заболевания не известна. У здоровых ранее детей в возрасте 5 мес — 6 лет, чаще всего в возрасте 2 лет, медленно развивается тяжелая арегенераторная анемия, обусловленная резким снижением эритроцитов в костном мозге.
Развитию анемии за 1 — 2 мес может предшествовать вирусная инфекция, хотя связь заболевания с определенным возбудителем не доказана, нередко им является парвовирус В19. Анамнез и физикальное исследование неинформативны, обращает на себя внимание лишь выраженная бледность кожных покровов и слизистых. В периферической крови уровень Нb снижен до 30-80 г/л, ретикулоциты отсутствуют, количество лейкоцитов и тромбоцитов обычно нормальное, однако у 10 % больных имеется нейтропения ( 9 /л) и у 5 % — тромбоцитопения ( 9 /л). Лабораторно выявляют нормальные уровни активности эритроцитарнои аденозиндезаминазы и фетального гемоглобина; по ферментативным характеристикам эритроциты относят к стареющей популяции. Уровень железа в сыворотке повышен. В пользу транзиторной эритробластопении также свидетельствуют нормальные результаты клинического анализа крови до болезни. В стернальном пунктате отмечается резкое сужение эритроидного ростка, отсутствуют предшественники, за исключением нормоцитов, эритроцитов. Культуральными исследованиями костного мозга выявлено несколько патогенетических механизмов: присутствие в сыворотке ингибиторов стволовых клеток или аномалии последних, выражающиеся либо в их численности, либо в способности к реакции на эритропоэтин. Возможен аутоиммунный генез заболевания с поражением первичных эритроидных предшественников, а не зрелых эритроцитов. Через несколько месяцев после старта заболевания наступает спонтанная ремиссия. До наступления выздоровления могут потребоваться гемотрансфузии, кортикостероиды не используются.
Вторичные (приобретенные) аплазии эритроидного ростка
Также проявляются анемией, сопровождающейся ретикулоцитопенией и уменьшением количества предшественников эритроцитов в костном мозге. Вторичная аплазия эритроидного ростка может быть вызвана вирусными инфекциями (паротит, вирус Эпштейна-Барр, парвовирус В19), а т и — пичными пневмониями и бактериальным сепсисом; лекарственными средствами (хлорамфеникол, пенициллин, фенобарбитал, дифенилгидантоин); антиэритроцитарными антителами; иммунодефицитом; тимомой; злокачественными опухолями.
Эпизоды острой недостаточности эритропоэза могут сопровождать целый ряд вирусных инфекций. При этом значительно снижается количество циркулирующих ретикулоцитов (менее 0,1 %) и повышается уровень железа в сыворотке. В костном мозге уменьшено число предшественников эритроцитов. Эти эпизоды, как правило, купируются и не оставляют каких-либо последствий. Наиболее часто вторичная аплазия эритроидного ростка вызывается парвовирусом В19.
У всех больных грудного возраста при диагностике эритробластопении необходимы следующие исследования:
- Содержание сывороточных антител IgM и IgG (мать и ребенок).
- Вирусной ДНК в сыворотке крови.
- Вирусной ДНК в костном мозге.
Эти исследования могут помочь в дифференциации эритробластопении при инфицировании парвовирусом В19 и эритробластопении другого генеза.
В терапии вторичных эритробластопении важно устранение причины, вызвавшей заболевание — отмена препарата, лечение основного заболевания или тимэктомия. При обнаружении антиэритроидных антител показаны кортикостероиды, при их неэффективности — иммунодепрессанты (циклофосфан или азатиоприн). При иммунодефиците парвовирусная инфекция может быть хронической, тогда применяют иммуноглобулин внутривенно.
Приобретенные апластические анемии
Клиника приобретенных апластических анемий отличается в зависимости от тотального или избирательного поражения гемопоэза. У больных приобретенными апластическими анемиями в отличие от наследственных форм отсутствуют врожденные аномалии развития, физическое и психическое развитие детей не изменено, костный возраст соответствует паспортному.
Для тотальных форм апластических анемий характерно сочетание геморрагического, анемического и инфекционно-септического синдромов. Геморрагический синдром, обусловленный тромбоцитопенией, выражен резко: множественные экхимозы и петехии на коже и слизистых оболочках, конъюнктивах, рецидивирующие носовые, десневые, маточные, желудочно-кишечные и почечные кровотечения, кровоизлияния в местах инъекций. Непосредственной причиной смерти у таких больных являются чаще всего кровоизлияния в жизненно важные органы. Поражение эритроидного ростка приводит к развитию анемического синдрома, при котором у больного отмечается общая слабость, снижение аппетита, головокружение, повышенная утомляемость, бледность кожи и слизистых оболочек, ногтевых фаланг, изменения со стороны сердечно-сосудистой системы: расширение границ сердца, приглушенность тонов, тахикардия, систолический шум различной интенсивности, возможна экстрасистолия, одышка. Наличие лейкогранулоцитопении обусловливает возникновение инфекционно-септического синдрома: легкое присоединение инфекций любой локализации, язвенно-некротическое поражение кожи, слизистых оболочек. Характерно тяжелое течение инфекций, вызванных не только патогенной флорой, но и условно-патогенными и грибковыми возбудителями. Лимфатические узлы, печень, селезенка не увеличены. При избирательном поражении эритроидного ростка имеются проявления лишь анемического синдрома.
Все симптомы болезни могут проявляться и нарастать более или менее остро.
Гематологические изменения при апластической анемии складываются из нейтропении (абсолютное число нейтрофилов менее 1,5 х 10 9 /л), анемии (Нb 9 /л) и ретикулоцитопении, не соответствующей тяжести анемии. В миелограмме отмечается резкое снижение клеточности, редукция миелоидного и эритроидного ростков, вариабельный лимфоцитоз и отсутствие мегакариоцитов. У больных с медленным развитием аплазии длительно могут сохраняться участки активного кроветворения — «горячие карманы». В трепанобиоптате обнаруживается резкое снижение плацдарма кроветворения — доминирует жировой костный мозг, гемопоэтические элементы представлены резидуальными очагами эритро- и миелопоэза, мегакариоциты практически не обнаруживаются.
По тяжести приобретенные апластические анемии делятся в зависимости от глубины цитопении, ретикулоцитоза и остаточной клеточности костного мозга по данным трепанобиопсии. Используются критерии тяжести апластической анемии, разработанные международной группой изучения апластической анемии — «критерии Камитты»:
- число гранулоцитов менее 500 в 1 мкл;
- число тромбоцитов менее 20 000 в 1 мкл;
- число ретикулоцитов менее 40 000 в 1 мкл (или менее 1 % после коррекции на нормальный гематокрит).
Апластическая анемия считается тяжелой, если присутствуют любые два указанных выше показателя крови в сочетании со сниженной клеточностью. Если гематологический синдром соответствует критериям тяжелой апластической анемии, но число гранулоцитов менее 200 в 1 мкл — сверхтяжелая апластическая анемия. Все остальные случаи характеризуются как нетяжелая апластическая анемия.
Дифференциальный диагноз при приобретенных апластических анемий проводится преимущественно с острым лейкозом, мегалобластными анемиями, синдромом гиперспленизма, метастазами опухолей в костный мозг.

источник
Исследование периферической крови указывает на наличие панцитопении. Анемия носит нормоцитный характер, однако, в отдельных случаях, может быть умеренно макроцитной (например, при отравлении химическими веществами, такими как бензол). Число ретикулоцитов меньше нормы; в некоторых случаях эти клетки крупных размеров и незрелые, возможно по причине краткосрочности их пребывания в костном мозге.
Гранулоцитопения носит абсолютный характер, при этом, когда их количественный показатель менее 200/мм3, создаются брагоприятные условия для развития весьма тяжелых инфекций. Определение запаса гранулоцитов в костном мозге с помощью эндотоксина, этиохоланолона или пирифера лучше отражает фактическое состояние гранулоцитопении.
Хотя на первый взгляд образование лимфоцитов и моноцитов не нарушается при этом заболевании, тем не менее, когда, например, количественный показатель лейкоцитов достигает 1000/мм3 отмечается наличие абсолютной лимфоцитопении. Но при определенных обстоятельствах, таких как апластическая анемия у ребенка под воздействием облучения, по иммунологической причине (волчанка) и пр., наблюдается поражение и лимфатической ткани (Мунтяну).
В любом случае отмечается наличие тромбоцитопении различной интенсивности с соответствующими проявлениями в клиническом плане. Следует отметить, что в уже проявившейся анемии тромбоцитопоэтическая функция восстанавливается наиболее поздно или никогда. Показатель времени кровоточивости увеличен, пробы на ломкость капилляров — положительные, ретракция сгустка — измененная, причем все это отражает присутствие уменьшенного числа кровяных пластинок.
Эритроферокинетические исследования определяют количественный недостаток эритропоэза, при этом выявляемые аномалии отражают, по существу, не только сокращение, но и функциональное поражение ткани красных кровяных клеток (Bryon). Так, показатель железа в сыворотке увеличен, скрытая способность восстановления железа — заниженна, временной показатель клиренса радиоактивного железа завышен, а включение железа в эритроциты сосудистой крови — ниже нормы.
Все это свидетельствует о значительном сокращении эритропоэтической ткани. Однако интенсивность и скорость метаболизма железа плазмы в норме (24—30 мг/сутки), что может показаться лишенным логики в отношении не включающего железо костного мозга. Объяснение этого факта следует искать в том, что железо, как свидетельствует сцинтиграфическое исследование, направляется в другие органы — в том числе печень или селезенка.
Исследование продолжительности жизни красных кровяных клеток привели к укладывающимся в норму результатам.
Эритропоэтин выделяется в избытке с мочой, видимо по причине неиспользования в процессе эритропоэза.
Плодный гемоглобин может увеличиваться до более 1%, особенно у детей, однако в нашей казуистике повышение его показателя обнаруживалось и v взрослых. Собственно наличие подсказывает хороший прогноз (Williams).
В принципе макроскопический аспект костного мозга жирный, это обнаруживается при размозжении зерен для мазков, дающих результаты большей точности.
Общий аспект костного мозга напоминает «цвет бузины» с перемежающимися участками жирного преобразования и различной целлюлярности.
В менее тяжелых случаях клеточная масса слагается из всех кроветворных рядов со всеми ступенями созревания, но, естественно, в меньшем количестве. В отдельных случаях наблюдаются качественные изменения даже среди имеющихся в наличии рядов, в основном — эритроидном. К таковым относятся наличие макробластов или мегалобластов, угнетение созревания ряда гранулоцитов с процентным ростом незрелых элементов (миелоцитов, промиелоцитов).
При всех обстоятельствах показатель железа в постном мозге значительно увеличен, в то время как численность сидеробластов превышает норму. Нередко зерна железа располагаются кольцом (при отравлениях, предлейкемическом состоянии) (Мунтяну).
В тяжелых случаях клеточная масса костного мозга сводится к редким элементам лимфоидного, плазмоцитного или моноцитного видов. Наиболее точное определение состояния гипо-или аплазии костного мозга достигается проведением биоптического исследования костного мозга различных участков (Duhamel). Гистопатологическое исследование костного мозга представляет исключительную ценность при апластической анемии. Этим способом:
1) определяется распространенность процесса аплазии костного мозга;
2) выявляются исходные костномозговые поражения, касающиеся микроциркуляции и медуллярной стромы, что не достигается отсасывающей пункцией (отек, геморрагия, некроз и пр.);
3) уточняется вид поражения продуктивного характера в остове костного мозга — реактивного полиморфного или мономорфного, или неопластического типов;
4) вскрываются — даже при панцитопении с гиперпластическим костным мозгом — поражения реактивного вида грануломатозного (воспалительного) характера, возможные поражения сосудов, стромы (ретикулиновое утолщение, фибробластическая реакция и пр.) или очаги (зоны) атипичного разрастания, которые не выявляются при обычной пункции (Мунтяну).
источник
Железодефицитная анемия (малокровие) обычно рассматривают скорее в качестве симптома другого заболевания или в виде состояния, возникающего при недостаточной концентрации в организме железа.
Причины и факторы, способствующие развитию анемического синдрома:
- Развивается болезнь у маленьких детей и взрослых, соблюдающих строгую диету, если они не получают необходимого количества железа с едой.
- На фоне нарушений в пищеварительной системе. Известно, что всасывание микроэлементов происходит в тонкой кишке (верхние отделы) и в желудке. А тем более, после удаления части желудка, способность пищеварительной системы к абсорбции нарушается.
- Анемический синдром может развиться из-за больших потерь крови. Это является основной причиной железодефицитных состояний. Часто синдром возникает у женщин из-за больших потерь крови во время обильной менструации и у тех, кто страдает от язвы пищеварительного тракта, рака желудка, геморроя, новообразований в толстой кишке.
- Сокращение времени жизни эритроцитов в крови или быстрое их разрушение. В норме срок жизни эритроцита – 4 месяца. В некоторых случаях причиной гемолиза является патология селезенки. Развивается гемолитическая или серповидно-клеточная анемия. При таком заболевании организмом вырабатывается аномальный гемоглобин.
При подозрении на анемию, важно оперативно обратится за помощью к специалисту. Врач поможет выявить причины и способы лечения болезни. Синдром приводит к снижению иммунитета, к упадку сил, ограничению работоспособности. Также анемия может стать важным сигналом о развитии других патологий и серьезных проблем в работе отдельных органов и их систем.
Диагноз ставят по анализу крови, а лечение, как правило, заключается в восстановлении количества железа с помощью лек. препаратов. Лекарства используют внутрь или вводят с помощью инъекций.
| Пол, возраст | Порог Нb (Г/Л) | Порог Нb (Г/%) |
| Дети от 3 месяцев до 5 лет | 110 | 11,0 |
| Дети от 5 до 12 лет | 115 | 11,5 |
| Дети от 12 до 15 лет | 120 | 12,0 |
| Мужчины от 15 лет | 130 — 160 | 13,0 — 16,0 |
| Женщины от 15 лет | 120 — 140 | 12,0 — 14,0 |
| Беременные женщины | 110 | 11,0 |
Можно выделить 3 основных механизма развития анемии:
- Вследствие нарушения процесса образования эритроцитов и образования гемоглобина. Такого рода механизм можно проследить при недостаточном поступлении железа, фолиевой кислоты и витамина В12, при заболеваниях костного мозга. Иногда дефицитное состояние может возникнуть из-за приема сверхбольших доз витамина С. При приеме сверх доз аскорбиновой к-ты происходит блокировка витамина В12 и нарушение процессов кроветворения.
- Острая потеря эритроцитов. Обычно – это последствия острых кровотечений, операций и травм. При хронических кровотечениях в небольших объемах причиной анемии выступает не просто потеря эритроцитов, но и недостаток железа на фоне хронической утраты крови.
- Анемический синдром — последствия от ускоренного разрушения эритроцитов крови. При нормальной работе костного мозга и иных органов кроветворения эритроциты живут порядка 4 месяцев, а затем разрушаются. При гемолитической анемии, гемоглобинопатии и так далее скорость разрушения эритроцитов выше, чем их производства. Иногда процесс протекает под влиянием внешних стимулов, химических веществ (уксус).
Рассмотрим различные виды у взрослых. Анемия является симптомом, а не отдельным заболеванием и может возникать при ряде болезней. Они, как правило, связаны с первичным поражением кроветворной системы или не зависят от нее. Невозможно провести четкую нозологическую классификацию анемий. Для этого используют принцип практической целесообразности. И в результате заболевание делят по единому классификационному признаку – по цветовому показателю.
Падение уровня гемоглобина в крови чаще всего наблюдают при одновременном снижении количества и качества эритроцитов. Любой вид анемии непременно приводит к снижению эффективности дыхательной функции крови, возникновению кислородного голодания тканей. Обычно это видно по бледности кожных покровов, слабости, высокой утомляемости, головным болям, головокружении, одышке, учащенному ритму сердца и т.д.
Врач назначает рутинное исследование мазка крови, в процессе анализа морфолог обязан указать на отклонения размера эритроцитов. Уменьшение может быть, как в меньшую (микроцитарная анемия), так и большую сторону (макроцитарная). Однако, если необходимую оценку производят без специальных микрометров, то она является весьма субъективной.
Анемии, которые могут развиться при болезнях почек, гипопластические, АХЗ и острую постгеморрагическую относят к нормоцитарным. Макроцитарные анемии бывают нормо- и гиперхромными, а микроцитарные – гипохромными.
Намного информативнее автоматический анализ крови, при котором соблюдается четкая стандартизация важных показателей. Учитывают средний корпускулярный объем (СКО), который можно измерить в фемтолитрах (fl, фл). Нормальное значение СКО составляет 80-90 фл и называется нормоцитозом. Если показатель повышен до 95 и более – то фиксируют развитие макроцитоза. При снижении менее 80 фл ставят диагноз микроцитоз. Есть у автоматического метода и свои недостатки: достаточно дорогое и чуткое оборудование, которому необходимо соответствующее обслуживание.
При замене цветового показателя на СКО не нарушается привычная классификация анемий по цветовому показателю. Анемии подразделяют на группы по различным признакам. Классификацию, как правило, основывают на удобстве и практической значимости для постановки диагноза.
Цветовой показатель покажет степень насыщения эритроцита гемоглобином. У здорового человека ЦП колеблется 0,86 до 1,1. В зависимости от него различают такие анемии:
- Гипохромная анемия, если ЦП меньше 0,86 (по некоторым классификациям ниже 0,8). При таких анализах ставят диагноз талассемия или железодефицитная анемия.
- При нормохромной анемии ЦП колеблется в пределах 0,86 — 1,1. В таком случае у пациента наблюдается постгеморрагическая анемии, гемолитические анемии, апластические анемии, неопластические заболевания костного мозга, внекостномозговые опухоли, анемия из-за снижения темпов выработки и количества эритропоэтина.
- Гиперхромная анемия – при ЦП более 1,1. Такие показатели характерны для фолиеводефицитной анемии, а также витамин B12-дефицитной анемии, для миелодиспластического синдрома.
Проводится в зависимости от выраженности снижения уровня гемоглобина в крови. Классификация по степени тяжести предполагает:
- легкую степень (когда уровень гемоглобина ниже нормы, но остается на уровне более 90 грамм на литр);
- среднюю степень тяжести (когда гемоглобин 70-90 г/л);
- тяжелую степень (когда уровень гемоглобина остается меньше 70 грамм на литр).
Разделение степени анемии по уровню гемоглобина достаточно распространено. Чаще всего именно по гемоглобину подтверждают диагноз, а потом уже проводят более детальную диагностику.
Характеризуется незначительным падением количества гемоглобина в крови. Обычно проявляются следующие симптомы:
- усталость;
- апатия;
- общее недомогание;
- часто развивается у беременных.
Как уже упоминалось выше, анемия 1 степени фиксируется, если уровень микроэлементов в крови ниже нормы, но выше 90 г на л.
Также первая степень заболевания часто поражает маленьких детей, появившихся на свет при многоплодной беременности или недоношенными. У детей постарше – это паразитические заболевания или погрешности в питании. Анемия легкой степени тяжести проще поддается лечению. Обычно рекомендуют соблюдать диету и усиленно питаться. При легкой степени анемии в рацион необходимо включать различные микроэлементы и витамины, в первую очередь – железо и витамин В12.
Анемия 2 степени или средней степени тяжести возникает не только при снижении уровня гемоглобина до 70 г/л. Возникает головокружение и головные боли, одышка, частое сердцебиение, трудности с дыханием. Дети часто болеют, у них наблюдается бледность губ и кожи. При 2 степени анемии может возникнуть кислородное голодание плода, снижается сократительная способность миокарда. Лечение медикаментозное + диета, следует больше находится и гулять по свежему воздуху.
На этой стадии острая анемия несет опасность для жизни человека. При 3 степени наблюдается ломкость ногтей и волос, острое снижение защитных сил организма, онемение конечностей, проблемы с сердцем и сосудами. Ребенок начинает часто болеть.
Особенно тяжелыми будут последствия такого симптома у беременных женщин. Это может негативно отразится на плоде, у матери развиться дистрофические изменения матки и плаценты. Анемия 3 степени лечится в стационаре, с переливанием эритроцитарной массы и другими видами медикаментозного лечения.
Основным признаком такого разделения принято считать количество молодых эритроцитов (ретикулоциты) в периферической картине крови. В норме показатель колеблется от 0,5 до 2%.
- Арегенераторную анемию (например, апластическая анемия) — ретикулоциты отсутствуют.
- Гипорегенераторная (витамин B12-дефицитная анемия или железодефицитная анемия) – ретикулоциты ниже 0,5%.
- Регенераторная или норморегенераторная (постгеморрагическая) — ретикулоциты 0,5 — 2%.
- Гиперрегенераторная (гемолитические анемии) — количество ретикулоцитов больше 2%.
Такая классификация основывается на различных механизмах развития анемии, как патологического процесса.
- Ассоциированные с дефицитом Fe — железодефицитные анемии.
- Гемолитические анемии — связанные с повышенным разрушением эритроцитов.
- Гис-гемолитические анемии — при нарушении кровообразования, протекающего в красном костном мозге.
- Постгеморрагические анемии — при острой или хронической кровопотере.
- В12- и фолиеводефицитные анемии.
Мегалобластные анемии: миокардит гемолитический и пернициозная анемия.
Гипохромия — это общее название для разных форм анемии, при которых цветовой показатель крови, вследствие недостатка гемоглобина, меньше 0,8. Не включена в список нозологических единиц. В анализе крови средний показатель для гемоглобина при таком состоянии меньше 30 пикограмм, а средняя концентрация гемоглобина в эритроците составляет менее 330 г на литр. Меняется не только цвет, но и диаметр (макро- или микроцитоз) и форма. Чаще всего при такого рода патологии красной крови кровяные тельца приобретают вид колец с бледно-красной серединой и темно-красными краями (обесцвечиваются).
Патологические формы эритроцитов могут возникать вследствие:
- Железодефицитной анемии при кровопотерях (геморрагическая), нарушении усвоения железа, при невынашивании плода и т.д.
- Хронического отравления свинцом.
- Талассемии – нарушения нормального процесса синтеза полипептидных цепей в структуре гемоглобина.
- Нарушения синтеза и утилизации порфиринов.
- Гиповитаминоза В6.
- При нарушении обмена вещества, хронических воспалительных процессах неинфекционного и инфекционного генезиса.
Дизэритропоэтическая анемия – целая группа достаточно редко встречающихся заболеваний крови, которые возникают из-за нарушения процессов эритропоэза. При этом, большая часть молодых эритроцитов погибает сразу после образования в костном мозге, а количество нормоцитов значительно снижается. Такого рода расстройство предполагает качественный, количественный, кинетический или совмещенный характер нарушения эритропоэза.
Следует упомянуть такую разновидность заболевания — гиперхромная макроцитарная анемия или малокровие. При котором также наблюдают снижение числа эритроцитов и уровня гемоглобина в единичном объеме крови. Как правило, при такого рода нарушениях параллельно дают сбой сердце и сосуды.
По коду МКБ-10 — D62 острая постгеморрагическая анемия. Такой симптом возникает после кровопотери. Подразделяют на острую постгеморрагическую анемию и хроническую постгеморрагическую анемию. Острая анемия развивается после острых и обильных кровотечений, хронические анемии возникают после длительных несильных кровотечений.
Во время быстрой кровопотери значительно снижается объем циркулирующей крови. В ответ на такое событие происходит компенсаторная реакция, которая заключается в возбуждении симпатического отдела нервной системы и рефлекторного спазма сосудов. Пульс ускоряется и ослабевает. Сосуды кожи и мышц максимально сужаются, кровь приливает к сосудам мозга, коронарным сосудам, что поддерживает снабжение кровью жизненно важных органов. При прогрессировании процесса начинает развиваться постгеморрагический шок.
Характерным клиническим симптомом постгеморрагической анемии является острая сосудистая недостаточность из-за гиповолемии (опустошение сосудистого русла). Внешне это проявляется ортостатическим коллапсом, одышкой, учащенным сердцебиением. В первые минуты кровопотери уровень гемоглобина может даже быть высоким, но после поступления тканевой жидкости в русло сосудов данный показатель снижается, даже если кровотечение уже прекратилось. Цветовой показатель остается в норме, одновременно происходит утрата эритроцитов и железа, нормохромная анемия. Ко вторым суткам увеличивается число ретикулоцитов, максимальных показателей достигает на 4-7 день (гиперрегенераторная анемия).
Диагноз ставят на основании клинических признаков и лабораторных показателей, повышения уровня остаточного азота, если кровотечение происходила в верхних отделах ЖКТ. Самое важное при такой нормохромной анемии – это устранить саму кровопотерю, восполнить устраненный объем крови эритроцитарной массой и гепарином (до 60% утраченной крови), кровезаменителями (5% р-р Альбумина, Раствор Рингера, Реополиглюкин).
При постановке диагноза постгеморрагическая анемия необходимо учитывать сведения о произошедшей острой кровопотере при наличии внешнего кровотечения. После массивного внутреннего диагноз основывают на клинических признаках и, в обязательном порядке, лабораторных пробах (Вебера, Грегерсена). Основанием для постановки диагноза также послужит рост уровня остаточного азота при кровотечении из верхнего отдела пищеварительного тракта.
После того, как кризис и острый период миновали, пациенту назначают препараты железа, витамины группы В, Е и С. Такая терапия производится в течение 6 месяцев. При утрате более 50% от объема циркулирующей крови — прогноз неблагоприятный.
Состояние может развиться в результате снижения поступления в организм фолиевой кислоты или нарушения процессов ее всасывания в пищеварительном тракте. Лечение заключается в дополнительном приеме недостающего вещества.
В отличии от патологии, ассоциированной с недостатком В12, фолиеводефицитная анемия диагностируется значительно реже.
Одной из основных причин фолиеводефицитной анемии является недостаточное содержание фолиевой к-ты в рационе. Следует помнить, что нужно включать в свое ежедневное меню больше зелени и печени. Также на здоровье значительно влияет алкогольная интоксикация, беременность, злокачественные новообразования, некоторые дерматиты, гемолиз.
Такого вида заболевания возникает при нарушении всасывания (например, при целиакии), под действием лекарственных средств, Метотрексата, Триамтерена, противосудорожных средств, барбитуратов, Метформина и др. Значительно повышается нужна организма в фолиевой кислоте после гемодиализа и при болезнях печени.
Также на здоровье оказывает влияние дефицит цианокобаламина и его кофермента – метилкобаламина. В таких условиях не происходит трансформации фолиевой кислоты в коферментную форму. В результате нарушается процесс нормального клеточного деления, начинают страдать клетки кроветворной ткани, которые ранее активно размножались. Тормозятся процессы созревания и размножения эритроцитов, сокращается их продолжительность жизни. Изменения касаются и лейкоцитов, возникает лейкопения и тромбоцитопения.
Далее в результате неправильного митоза появляются гигантские клетки эпителия пищевого канала и развиваются воспалительные процессы в слизистой оболочке, стоматиты, гастриты, эзофагиты, энтерит. Еще больше усугубляется первичное нарушения секреции и процесс всасывания внутреннего фактора, усиливается дефицит витаминов. Возникает порочный круг.
Из-за возникшего недостатка цианокобаламина, в организме начинают накапливаться продукты обмена, которые токсичны для нервных клеток. В волокнах тем временам начинают синтезироваться жирные кислоты уже с искаженной структурой. Наблюдается плавное изменение качества клеток спинного мозга и поражаются периферические и черепные нервные сплетения, развивается неврологическая симптоматика.
При таком виде анемии, как правило симптомы у пациента наблюдаются стандартные: высокая утомляемость, учащенное сердцебиение, бледность ногтей и губ, ярко-красный язык. На начальных стадиях отследить признаки поражения НС и ЖКТ практически невозможно. По результатам обследования выявляется гиперхромная макроцитарная анемия, лейкопения, тромбоцитопения. А лечение с помощью витамина В12 не вызывает улучшений лабораторных показателей. Диагноз можно подтвердить с помощью определения уровня сывороточной фолиевой к-ты и в эритроцитах. В норме ее содержание составляет от 100 до 450 нг/л. При фолиеводефицитной анемии концентрация фолиевой кислоты в эритроцитах значительно снижается.
Если проводят анализ периферической картины крови, то отмечают гиперхромную (макроцитарную) анемию при общем снижении уровня гемоглобина и эритроцитов. Непрямой билирубин меняется редко.
В качестве профилактики и для лечения фолиеводефицитной анемии должны назначить фолиевую кислоту в дозе 1 мг/сут, внутрь. Если есть необходимость врач может увеличить дозу. Улучшения должны наступать через в течение 3-4 суток, в том числе проходить должны и неврологические симптомы. В противном случае приходится говорить о недостатке именно витамина В12, а не фолиевой к-ты.
Обязательно проводить профилактику недостатка фолиевой к-ты у беременных женщин и пациентов, принимающих некоторые группы лек. препаратов. Для профилактики назначают 5 мг вещества в сутки.
Относится к виду витаминодефицитных (мегалобластных) анемий, которые возникают при недостаточном поступлении в организм витамина В12 (цианокобаламина). В результате В12-дефицитной анемии поражается кроветворная функция, нервная и пищеварительная система. В отличие от фолиеводефицитной В12-анемии, она развивается в преклонном или старческом возрасте, чаще всего у мужской половины. Проявляется заболевание постепенно.
Человек, страдающий В12-дефицитной анемией, будет испытывать общие симптомы: слабость, пониженная работоспособность, одышка, головокружение, жжение за грудиной, боли в ногах и языке, парестезии, шаткость походки. Такие симптомы будут сочетаться с желтушным цветом кожи, глосситом, незначительным увеличением печени и селезенки, негромким систолическим шумом, глухостью тонов сердца. Нередко поражается и нервная система, развивается комбинированный склероз или фуникулярный миелоз, нарушается чувствительность, полиневрит, атрофия мышц, паралич нижних конечностей.
Развивается анемия из-за недостатка витамина В12, из-за несбалансированности питания, голодания, алкоголизма и отсутствия аппетита. Также синдром может наблюдаться на фоне мальабсорбции, целиакии, изменений в слизистой оболочке кишечника, спру, лимфомы кишечника, болезни Крона, регионарного илеита, из-за длительного приема противосудорожных препаратов.
Вероятность развития В12-дефицитной анемии будет выше при беременности, гемолитической анемии, псориазе, эксфолиативном дерматите. При приеме алкоголя, препаратов–антагонистов фолатов, врождённых нарушениях метаболизма и атрофическом гастрите также может наблюдаться это заболевание.
Как правило, поставить диагноз В12-дефицитная анемия можно без особых проблем. Это может сделать гематолог, невролог, нефролог или гастроэнтеролог по результатам общего и биохимического анализа крови, наличию метилмалоновой кислоты. Также проводят УЗИ брюшной полости и исследование всасывания витамина В12 с помощью радиоизотопов. По показаниям можно провести аспирационную биопсию костного мозга.
Лечение проводят витамином В12 внутримышечно. В течение 1-1,5 месяцев используют поддерживающую дозу. Если уровень гемоглобина упал менее 60 г на л, при нарушении гемодинамики и угрозе анемической комы проводят трансфузии эритроцитов.
В качестве профилактики при заболеваниях, сопровождающихся нарушением всасывания витамина В12, а также после операций нужно под контролем содержания витамина В12 в моче и крови применять профилактические и лечебные курсы витаминотерапии.
Что это такое простыми словами? Это процесс ускоренного разрушения красных кровяных телец, он сопровождается значительным ростом уровня прямого билирубина в крови. Заболевание встречается достаточно редко.
Общим признаком можно считать ускоренное разрушение эритроцитов, сопровождающееся с одной стороны анемией и повышенным образованием продуктов распада эритроцитов, а с другой – реактивно усиленным эритропоэзом.
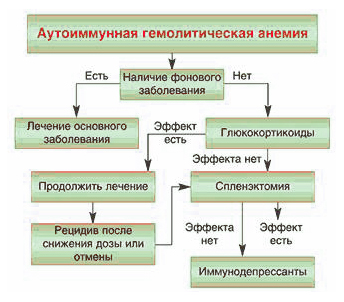
Аутоиммунная гемолитическая анемия, как правило вызвана генетическими дефектами мембран эритроцитов, что вызывает их повышенное разрушение. Аутоиммунное заболевание и гемолиз эритроцитов при приобретенных анемиях наступает под действием внутренних факторов или каких-либо факторов окружающей среды.
На развитие иммунных гемолитических анемий влияют посттрансфузионные реакции, вакцинации, прием некоторых препаратов (сульфаниламидов, анальгетиков, противомалярийных лекарств, производных нитрофуранового ряда). Также такой симптом может проявляться при гемобластозах, аутоиммунных патологиях (НЯК, СКВ), инфекционных болезнях (мононуклеоз, вирусная пневмония, сифилис, токсоплазмоз).
Гемолитические анемии можно поделить на два обширные группы заболеваний: приобретенные и врожденные.
Формы наследственных заболеваний:
- Эритроцитарные мембранопатии, такие как анемия Минковского-Шоффара или болезнь Минковского-Шоффара (микросфероцитоз), акантоцитоз, овалоцитоз, вызванные аномалиями в структуре мембран эритроцитов. Отметим, что сфероцитоз – самый распространенный вид среди патологий (микросфероцитоз).
- Энзимопении, вызванные дефицитом некоторых ферментов (пируваткиназа, глюкозо-6-фосфатдегидрогеназа).
- Гемоглобинопатии, возникшие из-за качественных нарушений структуры гемоглобина или изменения соотношения его нормальных форм.
Приобретенные гемолитические анемии делят на:
- Приобретенные мембранопатии (шпороклеточная анемия, болезнь Маркиафавы-Микели).
- Изо- и аутоиммунные, вызванные действием антител.
- Токсические, возникшие вследствие воздействия ядов, токсинов или других хим. агентов.
- Анемии, ассоциированные с механическими повреждениями в структуре эритроцитов.
Рост концентрации остаточных следов после распада эритроцитов в организме внешне будет проявляться желтухой лимонного оттенка. Также будет наблюдаться повышение концентрации в крови непрямого билирубина и железа. Отмечается уробилинурия и плейохромия кала и желчи. При внутрисосудистом гемолизе дополнительно развивается гипергемоглобинемия, гемоглобинурия, гемосидеринурия. Об усилении эритропоэза говорит ретикулоцитоз и полихроматофилия в составе периферической крови, либо эритронормобластоз костного мозга.
Если у пациента не микросфероцитарная анемия, обусловленная наследственным сфероцитозом или эллиптоцитозом, то необходимо, прежде всего проводить адекватную терапию заболевания, вызвавшего причину гемолитической анемии.
Для лечения обычно применяют:
- медикаменты (например, Десферал);
- спленэктомию;
- трансфузию эритроцитов при кризе;
- ГСК при аутоимунных заболеваниях в средней дозировке.
Апластическая анемия — заболевание, которое относят к категории миелодисплазий. При таком заболевании происходит резкое угнетение или прекращение роста и созревания клеток в костном мозге, еще называемое панмиелофтизом.
Типичными симптомами болезни являются: лейкопения, анемия, лимфопения и тромбоцитопения. Сам термин впервые появился в начале 20 века. Такое заболевание имеет достаточно тяжелое течение и без лечения (в том числе медикаментозного препаратом Атгам) имеет неблагоприятный прогноз.
Очень долго эту болезнь рассматривали в качестве синдрома, объединяющего различные патологические состояния в костном мозгу. В настоящее время термин «апластическая анемия» выделяется в качестве самостоятельной нозологической единицы. Его следует четко разграничивать от синдрома гипоплазии в кроветворной системе.
Апластическая анемия может быть вызвана различными причинами:
- химическими агентами, бензолом, солями тяжелых металлов и так далее;
- ионизирующим излучением;
- приемом некоторых лекарств, цитостатиков, НПВС, Анальгина, Мерказолила, Левомицетина;
- вирусами;
- наличием других аутоиммунных заболеваний.
Также существует форма апластической анемии, передающейся по наследству — анемия Фанкони. Лечение болезни заключается в приеме иммунодепрессантов и проведении пересадки костного мозга.
При серповидно-клеточной анемии человека происходит нарушение строения белка гемоглобина, он приобретает нетипичное кристаллическое строение, в виде серпа. Такую форму называют S-гемоглобином. Заболевание связывают с мутацией НВВ-гена, из-за которой в костном мозге начинает синтезироваться аномальный вид S-гемоглобина, в шестом положении в В-цепи вместо глутаминовой кислоты находится валин. Происходит полимеризация S-гемоглобина, образуются длинные тяжи, эритроциты приобретают форму серпа.
Тип наследования серповидноклеточной анемии – аутосомно-рецессивный при неполном доминировании. У гетерозиготных носителей в эритроцитах находится примерно равное количество гемоглобина А и S. Носители сами не болеют, а выявить серповидные эритроциты можно случайно при проведении лабораторного обследования. Симптомы же могут и вовсе не проявляться. Иногда такие люди начинают ощущать недомогание при гипоксии или тяжелом обезвоживании.
У гомозигот в крови есть только гемоглобин S, заболевание протекает достаточно тяжело. У таких больных высокий уровень степени разрушенных эритроцитов в селезенке, значительно короче срок жизни, часто проявляются признаки хронической недостаточности кислорода.
Такой вид анемии достаточно распространен в регионах, где высокий уровень заболеваемости малярией. У таких больных выше устойчивость к разным штаммам малярийного плазмодия. Поэтому столь вредные аллели часто проявляются у жителей Африки.
Симптомы сильно различаются и их можно наблюдать у детей уже с 3-х месячного возраста. Анемия может приводить к потере сознания, меньшей выносливости, вызвать желтуху. У младенцев наблюдается худоба, слабость, искривление конечностей, удлиненность туловища, изменения в строение черепа и зубов. Также у больных детей повышенная склонность к развитию сепсиса. У подростков наблюдают задержку развития на 2-3 года. Женщины, как правило, способны к зачатию и рождению ребенка.
Мегалобластная анемия (болезнь Аддисона-Бирмера, В12-дефицитная, пернициозная) — заболевание, вызванное недостатком фолиевой кислоты или витамина В12. Происходит это из-за недостатка веществ в пище или при заболеваниях пищеварительного тракта. Также мегалобластическая анемия может возникнуть при врожденных нарушениях процессов синтеза ДНК, приобретенных патологиях и из-за приема некоторых лекарств (антиметаболитов, противосудорожных).
При постоянном недостатке фолиевой кислоты и В12 развивается хроническая анемия, эритроциты изменяют свою форму и размеры. Более легкие стадии иногда протекают бессимптомно, далее начинают уже проявляться внешние признаки. Такое дефицитное состояние часто также называют пернициозной анемией. Заболевание получило статус анемии хронических заболеваний, так как проявляется у пациентов после 60 лет и у перенесших гепатит больных, при энтерите и раке кишечника. Подробнее о такого рода анемиях описано выше.
Развивается вследствие эндогенного В12-авитаминоза, вызванного атрофией желез фундального отдела желудка, которые в норме должны вырабатывать гастромукопротеин. В результате нарушаются процессы всасывания витамина В12 и возникает злокачественная анемия «пернициозного» типа. Чаще всего такой диагноз ставят в возрасте от 50 лет.
Болезнь сопровождается нарушениями нервной, сердечно-сосудистой, кроветворной и пищеварительной системы. Больные обычно жалуются на одышку, общую слабость, отечность ног, боли в сердце, «мурашки» по стопам и кистям, жгучие боли в языке и шаткость походки. По лабораторным показателям наблюдают анемию гиперхромного типа, лейкопению, тромбоцитопению.
Сидеробластная анемия также имеет название сидероахрестическая анемия (САА), железорефрактерная, железонасыщенная или сидеробластическая. Это патологическое состояние нарушений процесса синтеза микроэлементов и кроветворения, чаще всего – железа. Эритроциты содержат малое количество железа, из-за того, что микроэлемент активно расходуется костным мозгом и начинает накапливаться во внутренних органах. Заболевание развивается на фоне недостаточного содержания протопорфирина.
Выделяют две формы болезни:
- пиридоксин-зависимую, возникающую вследствие дефицита пиридоксальфосфата;
- пиридоксин-резистентную, развивающуюся из-за ферментного дефекта (дефицита гемсинтетазы).
Приобретенные формы сидероахрестической анемии чаще наблюдаются в пожилом возрасте, но болезнь не наследуется от родителей. Часто такого рода анемия развивается, как побочный эффект от лечения препаратами от туберкулеза или истощении пиридоксальфосфата при отравлении свинцом, при алкоголизме, миелопролиферативных болезнях крови, кожной порфирии. Встречаются и идиопатические формы САА.
Это редкое, передающееся по наследству заболевание. Анемия Фанкони встречается у 1 из 350000 детей. Наибольшее распространение заболевание получила среди евреев-ашкеназов и жителей Южной Африки.
Возникает из-за наличия дефектов в белковых кластерах, отвечающих за процесс репарации ДНК. Для заболевания характерная высокая ломкость у хромосом, наличие у пациентов старше 40 лет миелоидного лейкоза и апластической анемии.
Для новорожденных с таким недугом характерны врожденные дефекты развития, необычная пигментация, низкорослость, аномалии развития скелета и некоторые неврологические симптомы (косоглазие или недоразвитость одного из глаз, глухота, умственная отсталость), аномалии развития внутренних органов. К сожалению, в среднем такие пациенты живут не более 30 лет.
У диагноза неуточненная анемия код по МКБ-10 D64.9. Это первичный диагноз, который уточняется после проведения обследования у врача, так как он является вторичным признаком какого-либо основного заболеваний. Прежде всего следует исключить возможность кровопотери вследствие травм, хирургических вмешательств, внутренних кровотечений, далее проводится лабораторная диагностика.
По международной классификации МКБ-10 для миелодиспластического синдрома:
- D46.0 Рефрактерная анемия без сидеробластов, так обозначенная;
- D46.1 Рефрактерная анемия с сидеробластами;
- D46.2 Рефрактерная анемия с избытком бластов;
- D46.3 Рефрактерная анемия с избытком бластов с трансформацией;
- D46.4 Рефрактерная анемия неуточненная;
- D46.7 Другие миелодиспластические синдромы;
- D46.9 Миелодиспластический синдром неуточненный.
Приставка «рефрактерная» означает устойчивость заболевания к приему витаминов, препаратов железа, соблюдению диеты. Чаще всего такого вида анемия является наиболее распространенным видом миелодиспластического синдрома. Из-за нарушений процессов созревания бластов в крови значительно понижено содержание гемоглобина, проявляются признаки острого лейкоза. Примерно у 40% пациентов с миелодиспластическим синдромом проявляется рефрактерная анемия. Чаще всего гемоглобинопатия такого рода развивается у пациентов от 50 лет.
Заболевание можно считать промежуточным этапом между рефрактерной анемией и острым лейкозом. Как правило, болезнь проявляется снижением уровня гемоглобина и общей слабостью. Если у больного не нашли других причин для таких изменений картины крови, то основной задачей врачей становится дообследовать пациента и максимально затормозить наступление острого лейкоза.
Что за болезнь талассемия? Это наследуемое по рецессивному типу заболевание, развивающееся из-за снижения синтеза полипептидных цепей в структуре гемоглобина. В зависимости от того, какой мономер перестал нормально синтезироваться различают альфа-, бета-талассемию и дельта-талассемию. Также болезнь классифицируют по степени клинических проявлений, разделяют на тяжелую, легкую и среднюю.
Альфа-талассемия ассоциирована мутациями в генах HBA2 и HBA1. Альфа-цепь кодируется четырьмя локусами и, в зависимости от количества аномальных – различают разные степени тяжести заболевания. Симптомы и течение гемоглобинопатии варьируют от легкой до тяжелой степени гипохромной микроцитарной анемии.
Бета-талассемия существует в двух наиболее распространенных вариантах: малая (minor) и CD8(-AA) – большая (наиболее тяжелая форма заболевания). Анемия развивается из-за мутаций обоих аллелей бета-глобина, когда гемоглобин А начинает вытесняться гемоглобином F. Обычно малая талассемия имеет легкое течение и лечение не требуется.
Согласно Википедии, анемия Даймонда-Блекфена представляет собой наследственную форму красноклеточной аплазии с точно не выявленным типом наследования. Предполагают, что заболевание имеет аутосомно-доминантный тип наследования, который встречается у одной четвертой всех больных. У таких больных обычно проявляются проявления анемии в течение первого года жизни, слабость, бледность, повышенная утомляемость, снижение количества эритроцитов в плазме крови.
Диагноз ставят по общему анализу крови, показателям уровня эритропоэтинов, микроскопии и биопсии костного мозга. Лечению болезнь поддается плохо, назначают ГКС, гемотрансфузии.
Повышение концентрации свободного гемоглобина в плазме крови называют гемоглобинемией. Заболевание возникает вследствие приобретенных и врожденных заболеваний эритроцитов, при повышенном их разрушении. Симптом может проявиться после неправильно проведенного переливания крови, из-за воздействия паразитарных и инфекционных факторов (сепсиса, вирусной инфекции, малярии), после сильного переохлаждения, отравления ядами, бензином, уксусной кислотой, грибами. Проявляется внешне это гиперемией кожных покровов и слизистой, повышением концентрации гемоглобина и билирубина в крови.
Существуют настолько разные причины заболевания, что выявить некоторые из них можно только после проведения лабораторных исследований. Часто бывает, что показатели гемоглобина в норме, а железо низкое. Недуг может наблюдаться при недостатке витаминов группы В, фолиевой к-ты. Малокровие у человека возникает вследствие различных травм и обильных внутренних или внешних кровотечений.
Такой диагнозе женщине могут поставить, если уровень гемоглобина в крови падает ниже 120 г на литр. В целом у женщин, из-за некоторых физиологических особенностей выше склонность к данному недугу. Ежемесячные кровопотери во время менструации, когда в течение недели женщина может потерять до 100 мл крови, беременность, лактация и снижение концентрации ферритина – самые распространенные причины анемии. Часто заболевание развивается из-за психосоматики, когда у женщины депрессивное состояние, она плохо питается, редко выходят на свежий воздух, не занимается спортом или во время климакса, когда происходят глобальные изменения в физиологии женщины.
У мужской половины данный диагноз ставится, если уровень гемоглобина снизился менее 130 г на л. По статистике заболевание возникает реже. Чаще всего из-за каких-то хронических заболеваний, нарушений работы органов и их систем (язвенная болезнь, геморрой, эрозии в кишечнике, доброкачественные и злокачественные новообразования, паразиты, апластическая анемия). Существуют и генетические причины (анемия Фанкони) заболевания, которые не связаны с полом.
Малокровие проявляется по-разному, в зависимости от конкретного вида заболевания. Известно, что при малокровии у человека уменьшается количество эритроцитов, изменяется их строение, содержание железа в крови, падает гемоглобин. Ткани человека испытывают недостаток кислорода и это оказывает влияние на общее состояние и внешний вид человека.
Общие признаки анемии, следующие:
- значительно сниженная работоспособность, общая слабость;
- раздражительность, повышенная утомляемость, сильная сонливость;
- шум в ушах и головные боли, «мушки» перед глазами, головокружения;
- дизурия;
- непреодолимое желание полакомится мелом или известью;
- постоянная одышка;
- тонкие и ломкие волосы, ногти, сухая, неэластичная кожа;
- стенокардия, низкое артериальное давление;
- шум в ушах и частые обмороки;
- изменение цвета стула, желтуха, бледность;
- ломота в теле и суставах, мышечная слабость.
Также существуют специфические симптомы малокровия, характерные для той или ной разновидности:
- Железодефицитная анемия. Для данного диагноза характерная парорексия, у пациента появляется сильное желание жевать мел, землю, бумаги и прочие несъедобные материалы. Можно также выделить койлонихию, трещинки в уголках рта, заеды, воспаленный язык. Иногда может повыситься температура до субфебрильной.
- Основным симптомом В12-дефицитной анемии можно назвать покалывание в конечностях, нестойкость походки, скованность и стесненность в движениях, низкое чувство осязания. У пациента снижаются когнитивные способности, могут возникать галлюцинации. В крайне тяжелых случаях может развиться паранойя или шизофрения.
- Характерным симптомом серповидноклеточной анемии может быть слабость, приступообразные боли в брюшной полости и суставах.
- При отравлении свинцовыми отходами у пострадавшего наблюдаются характерные темно-синие линии на деснах, тошнота и болезненные ощущения в области живота.
- Хроническое разрушение эритроцитов может быть симптомом злокачественной опухоли. В таком состоянии развивается проступающая желтуха, язвы и ссадины на ногах, покраснение мочи. Часто образуются камни в желчном пузыре.
Поставить точный диагноз гемолитическая, мегалобластная или апластическая анемия можно после проведения дифференциальной диагностики. Диф. диагностика проводится по соответствующим таблицам и результатам лабораторных исследований.
источник