Анемии – это группа заболеваний, характеризующихся снижением содержания гемоглобина в единице объема крови с одновременным уменьшением количества эритроцитов.
При исследовании мазков периферической крови пациентов, больных анемией, находят следующие изменения эритроцитов: нарушение формы (пойкилоцитоз, анизоцитоз), размеров диаметра (макроцитоз, микроцитоз), изменение степени насыщения эритроцитов гемоглобином (гиперхромия, гипохромия), появление ядерных остатков в цитоплазме эритроцита (базофильных телец Жоли, базофильных колец Кабо). При некоторых формах анемии в периферической крови появляются незрелые эритроциты, содержащие ядро (эритробласты, нормобласты, мегалобласты) и полихроматофильные эритроциты.
Анемии характеризуются уменьшением числа эритроцитов и количества гемоглобина в единице крови. Но при некоторых заболеваниях число эритроцитов не уменьшается, хотя наблюдается значительное уменьшение гемоглобина. Такая ситуация наблюдается при железодефицитной анемии.
При анемиях изменяется морфология эритроцитов в периферической крови: появляется:
- Пойкилоцитоз – эритроциты разной формы;
- Анизоцитоз – эритроциты различной величины;
- Гиперхромные, гипохромные (в зависимости от интенсивности окраски).
- В эритроцитах могут быть остатки ядер (тельца Жоли – базофильные зерна, и кольца Кабо – базофильные кольца). (Рис. 1, 2)
В крови могут появляться незрелые формы эритроцитов: эритробласты, оксифильные, полихроматофильные, базофильные нормоциты, мегалобласты, мегалоциты и др. В периферической крови изучают гемограмму, включающую количество гемоглобина, клетки крови, в т.ч. эритроциты, тромбоциты, лейкоциты и лейкоцитарную формулу, которая представляет процентное соотношение лейкоцитов. Ретикулоциты периферической крови подсчитывают на 1 тысячу эритроцитов. Норма ретикулоцитов – до 2%.
Так как созревание эритроцитов происходит в красном костном мозге, для уточнения гематологического диагноза производят пункцию грудины с целью получить пунктат красного костного мозга или трепанобиопсию крыла подвздошной кости для получения биоптата. При исследовании пунктата и биоптата оценивают эритропоэз (нормальная регенерация, гипорегенерация, гиперрегенерация) и выявляют тип эритропоэза (эритробластический, мегалобластический, нормобластический). Также рассчитывают соотношение лейкоцитарных и эритроидных клеток костномозгового пунктата (Л:Э). Процентное выражение клеточного состава костного мозга называется миелограммой (Рис.3, 4).
Классификация анемий.
На основании этиологии и патогенеза различают три основные группы анемий: постгеморрагические (вследствие кровопотери), анемии вследствие нарушенного кровообразования, гемолитические (вследствие повышенного кроверазрушения).
Острая постгеморрагическая анемия возникает в результате массивного кровотечения при травмах, ранениях, а также при осложнениях язв желудка, разрывах маточной трубы и других повреждениях сосудов. Чем крупнее поврежденный сосуд, тем более опасным является кровотечение. При повреждении аорты происходит резкое падение артериального давления после потери более одного литра крови, что приводит к смерти. При этом внутренние органы мало изменены. При кровотечении из более мелких сосудов и при потере больше половины общего объема крови смерть наступает от острой сердечной недостаточности, а во внутренних органах отмечается выраженное малокровие.
В патогенезе острой постгеморрагической анемии основную роль играет одновременное уменьшение плазмы крови и эритроцитов, что ведет к острой гипоксии. Это проявляется у пациентов в виде одышки и сердцебиения.
При вскрытии отмечается бледность кожных покровов и внутренних органов. Красный костный мозг плоских костей розовый. Морфология внутренних органов без особенностей.
Хронические постгеморрагические анемии. Основными причинами их возникновения являются осложненные кровотечениями язвы желудка, опухоли, варикозные расширения геморроидальных вен, гемофилии, выраженный геморрагический синдром. В начале хронического кровотечения регенераторная функция костного мозга компенсирует потерю эритроцитов. В результате гипоксии повышается содержание эритропоэтина, который стимулирует пролиферацию клеток красного костного мозга, в периферической крови увеличивается количество ретикулоцитов. Но одновременно с эритроцитами пациент теряет железо, содержащееся в гемоглобине. Поэтому постгеморрагическая анемия переходит в железодефицитную.
В периферической крови наблюдается гипохромная анемия с низким цветовым показателем (до 0,5-0,6 при норме 0,86–1,05), с наличием микроцитоза, пойкилоцитоза, анизоцитоза. Одновременно часто отмечают лейкопению с относительным лимфоцитозом. Количество ретикулоцитов увеличивается (2-4%).
В красном костном мозге, также как при острой кровопотере есть гиперплазия эритроидного ростка с увеличением общего количества нормоцитов до 30-40%, за счет, главным образом, базофильных или полихроматофильных эритроидных клеток.
Макроскопически отмечается бледность кожных покровов, бледность внутренних органов, возникающая гипоксия органов и тканей приводит к жировой дистрофии миокарда печени, почек. Часто выражен геморрагический синдром вследствие потери тромбоцитов при кровотечении, который проявляется в виде кровоизлияний на слизистых и серозных оболочках. Наблюдаются очаговые превращения желтого костного мозга в красный, появляются очаги экстрамедуллярного кроветворения в печени и селезенке.
2. Сидероахрестические (сидеробластные).
3. Анемии, при недостатке В12 и (или) фолиевой кислоты, связанные с нарушением синтеза ДНК и РНК.
4. Гипопластические и апластические.
Железодефицитные анемии (ЖДА) самые частые (700000 человек в мире страдают этим заболеванием). Причинами возникновения ЖДА являются недостаток поступления с пищей железа (алиментарная), что бывает у недоношенных детей, т.к. основной запас железа новорожденные получают от матери в последние дни нормальной беременности. ЖДА возникают также у беременных и кормящих женщин в связи с повышенными запросами организма, у девушек при ювенильном хлорозе (заболевание, связанное с недостатком железа в организме и развившееся на фоне дисфункции половых желез и расстройства менструального цикла). Поздний хлороз появляется во время климакса. ЖДА возникают также из-за недостатка всасывания железа при заболеваниях ЖКТ и после резекции желудка или кишечника.
Картина крови: Гипохромная анемия с низким цветовым показателем (Рис.5). Количество эритроцитов снижено, но может быть и в норме. В костном мозге отмечается увеличение числа эритроидных клеток до 40-50% с преобладанием базофильных и полихроматофильных нормоцитов, отмечается много микроэритробластов. Уровень плазменного железа снижен.
Сидероахрестические (сидеробластные) анемии связаны с нарушением синтеза и утилизации порфиринов, вследствие чего железо плохо используется для синтеза гемоглобина. При этих анемиях также наблюдается низкий уровень гемоглобина. Среди них есть наследственные – сцепленные с Х-хромосомой, и приобретенные, например, при свинцовой интоксикации (сопровождается невритами). Для сидероахрестических анемий характерны:
– гипохромия эритроцитов периферической крови,
– расширенный эритроидный росток красного костного мозга,
– преобладание базофильных эритробластов в пунктате (т.к. они не могут превратиться в полихроматофильные из-за недостатка гемоглобина),
– повышенное количество сидероцитов и сидеробластов в костном мозге, которое обнаруживается при специальной окраске для выявления железа в цитоплазме эритроидных клеток,
– высокое содержание сывороточного железа.
Анемии вследствие недостатка витамина В12 и фолиевой кислоты. Для нормального эритропоэза в красный косный мозг должны поступать витамин В12 и фолиевая кислота, которые участвуют в синтезе ДНК при делении клеток. Всасывание витамина В12 происходит в тонком кишечнике после предварительного связывания с гастромукопротеином желудка. Развитие пернициозной (В12-дефицитной) анемии может быть обусловлено недостатком гастромукопротеина в связи с наследственной неполноценностью добавочных клеток фундальных желез. Но чаще встречается приобретенная В12-дефицитная анемия, развившаяся при участии аутоиммунного механизма.
При этом в организме появляются антитела одного из трех типов:
- Антитела могут блокировать витамин В12, не давая ему возможности соединиться с гастромукопротеином;
- Блокируют гастромукопротеин или комплекс гастромукопротеин – витамин В12;
- Против париетальных клеток.
В результате нарушается пролиферация клеток всех быстро обновляющихся тканей, к которым, в первую очередь, относится кроветворный костный мозг. Основным проявлением нарушения кроветворения становится анемия с уменьшением числа эритроцитов и увеличением их размеров, так как синтез гемоглобина не нарушен, что получило наименование кроветворения по мегалобластическому типу. Неустойчивость мембраны мегалобластов и мегалоцитов ведет к тому, что они частично разрушаются еще в костном мозге, а затем и в периферической крови. Процессы кроверазрушения преобладают над процессами кроветворения. С разрушением элементов крови связан общий гемосидероз, а с нарастающей гипоксией – жировая дистрофия органов. В крови наблюдается гиперхромная анемия с цветовым показателем выше 1 и наличием мегалоцитов, редко мегалобластов. Число ретикулоцитов уменьшено. Отмечается пойкилоцитоз, анизоцитоз, лейкопения, в лейкоцитарной формуле – сдвиг вправо с наличием гигантских нейтрофилов. Количество тромбоцитов снижено с увеличением их размера. СОЭ увеличена.
Патологическая анатомия. Кожа бледная, с желтым оттенком. Подкожный жировой слой развит. Гипостазов нет. Кровь водянистая. Во внутренних органах: селезенке, печени, почках – гемосидероз. Наиболее выражены изменения в ЖКТ, в костном мозге и спинном мозге. В ротовой полости – гунтеровский глоссит – изменения языка. В начале заболевания края и кончик языка ярко-красного цвета, а затем воспалительные явления исчезают, сосочки языка атрофируются, и он становится лакированным. Одновременно с атрофией слизистой языка развивается атрофия слизистой оболочки глотки, пищевода. Наиболее типичным симптомом является атрофия слизистой желудка, а затем и кишечника.
Очень характерны изменения со стороны нервной системы. В спинном мозге, в задних и боковых столбах, выражен распад миелина и осевых цилиндров, что получило название – фуникулярный миелоз. У больных проявляется понижением чувствительности, снижением двигательной функции и т.д. Могут быть очаги ишемии и размягчения головного и спинного мозга.
В периферической крови видны мегалоциты и гиперсегментированные нейтрофилы (Рис.6). Исследование костного мозга дает возможность поставить точный диагноз. Общее количество миелокариоцитов увеличено. Имеется гиперплазия эритроидного ростка, преимущественно за счет появления базофильных форм мегалобластов (их может быть до 30% от общего числа ядерных элементов костного мозга).
В костном мозге виден распад мегалобластов и мегалоцитов и последующий эритрофагоцитоз. Значительная часть гемоглобиновых пигментов (порфирин, гематин) не используются, циркулируют в крови и выводятся из организма преимущественно почками, в которых постепенно развивается гемоглобинурийный нефроз. В селезенке и лимфатических узлах видны очаги экстрамедуллярного кроветворения.
С дефицитом гастромукопротеина связано развитие пернициозно-подобных состояний при раке желудка, лимфогранулематозе желудка, сифилисе желудка, полипозе, коррозивном гастрите (с повреждением половины слизистой желудка и более при отравлениях). При всех этих заболеваниях в желудке возникают дистрофические изменения, приводящие к гибели добавочных и париетальных клеток с развитием недостаточности витамина В12. Такой же генез имеет пострезекционная В12-дефицитная агастрическая анемия.
При нарушении всасывания витамина В12 в кишечнике также возникает В12–фолиево-дефицитная анемия. Это может быть при глистной инвазии (дифиллоботриозная), спру (заболевание, связанное с поражением кишечника, изменениями в нервной и эндокринной системах). Нарушается всасывание витаминов и после удаления тонкой кишки.
В12–фолиево-дефицитная анемия развивается также при использовании некоторых лекарственных препаратов, аналогов фолиевой кислоты (аметоптерин, метотрексат и др.).
В последние годы летальность от пернициозной анемии резко снизилась, в связи с хорошей диагностикой и лечением витаминами В12 и фолиевой кислотой.
Гипо- и апластические анемии. Характеризуются прогрессирующим падением эритропоэза, гранулопоэза, тромбопоэза, вплоть до полного истощения костного мозга. Причины могут быть эндо- и экзогенные. Среди эндогенных причин преобладают наследственные. К ним относятся семейная апластическая анемия Фанкони, при которой аплазия костного мозга сочетается с пороками развития. Впервые выявляется в детском возрасте и гипопластическая анемия Эрлиха, при которой гипоплазия костного мозга сочетается с выраженной кровоточивостью.
Для гипо- и апластических анемий характерно поражение эритроидного и миелоидного ростков кроветворения. В пунктате из грудины нет молодых форм эритроцитов. Красный костный мозг замещается желтым (жировым). В случаях полного опустошения костного мозга говорят о «чахотке» костного мозга – панмиелофтизе. В периферической крови – выраженная анемия с небольшим снижением цветового показателя. Количество гемоглобина может падать до 20 г/л. Число эритроцитов снижается до 1·10 12 /л. Резко падает число лейкоцитов и тромбоцитов.
Причиной возникновения экзогенных апластических анемий могут быть радиактивное облучение, лекарственные препараты (цитостатики, барбитураты, амидопирин, хлорамфеникол) и другие токсические вещества – бензол, фенол и др.
При экзогенных гипопластических анемиях, в отличие от эндогенных, гемопоэз вначале подавляется не полностью. В пунктате из грудины можно найти молодые формы эритро- и миелопоэтических рядов. Однако при длительном воздействии патогенного фактора наступает опустошение красного костного мозга – панмиелофтиз. Для точной диагностики этого состояния применяют трепанобиопсию. Из крыла подвздошной кости берут маленький участок костной ткани, где можно увидеть соотношение красного и желтого костного мозга и выявить процессы склерозирования.
Из-за неустойчивости эритроцитов и поражения тромбоцитарного ростка присоединяются гемолиз, множественные кровотечения, развивается общий гемосидероз, жировая дистрофия паренхиматозных органов, язвенные и некротические процессы.
Гипо и апластические анемии могут возникать при лейкозах, в результате замещения нормального кроветворения опухолевым клоном, и при метастазировании в костный мозг клеток злокачественных опухолей, таких как рак предстательной, молочной, щитовидной желез и желудка (Рис.7).
К этой группе относится также анемия при мраморной болезни (врожденный остеосклероз), при которой наблюдается избыточное костеобразование, ведущее к сужению просвета костей. На месте губчатого вещества появляется плотное вещество, на срезе напоминающее шлифованный мрамор.
К ним относятся заболевания, при которых кроверазрушение преобладает над кровообразованием. Разрушение эритроцитов при гемолизе приводит к общему гемосидерозу и надпочечной желтухе. Иногда развивается гемоглобинурийный нефроз – заболевание почек, при котором продукты распада гемоглобина поражают проксимальные канальцы почек. Появляется гемосидерин в почечном эпителии, вызывая некроз эпителия и разрывы базальных мембран.
В костном мозге наблюдается гиперплазия. Костный мозг разрастается в плоских и трубчатых костях, становится сочным, розово красным, ярко красным. Костномозговое кроветворение происходит усиленно, и незрелые клетки эритроидного ряда ускоренно вымываются в периферическую кровь. В крови значительно растет количество ретикулоцитов. В селезенке, лимфатических узлах, рыхлой соединительной ткани появляются очаги экстрамедуллярного кроветворения.
Гемолитические анемии подразделяют на анемии, обусловленные внутрисосудистым и внесосудистым гемолизом. Гемолитические анемии, обусловленные внутрисосудистым гемолизом по причинам возникновения подразделяют на:
- Токсические (возникают под действием ядов, токсинов).
- Инфекционные (малярия).
- Посттрансфузионные.
- Иммунные гемолитические анемии (гемолитическая болезнь новорожденных).
- Аутоиммунные гемолитические анемии (при аутоиммунных заболеваниях, таких как системная красная волчанка, при хроническом лимфолейкозе, при вирусных инфекциях, при лечении некоторыми лекарственными препаратами и других).
Гемолитические анемии, обусловленные преимущественно внесосудистым (внутриклеточным) гемолизом, часто носят наследственный характер. Для анемий этой группы характерна триада признаков: анемия, спленомегалия и желтуха.
К гемолитическим анемиям этой группы относят мембранопатии, в основе которых лежат дефекты клеточной мембраны эритроцитов, что обуславливает их нестойкость, захват и разрушение макрофагами ретикулоэндотелиальной системы селезенки, костного мозга, лимфоузлов, печени. К основным эритромембранопатиям относят микросфероцитарную гемолитическую анемию и овалоцитарную гемолитическую анемию.
Эритроцитоферментопатии обусловлены отсутствием какого-то фермента в эритроцитах или изменением его активности. Дефицит в эритроцитах глюкозо-6-фосфатдегидрогеназы проявляется у больного (при вирусных инфекциях, приеме некоторых лекарств и т.д.) в виде острых гемолитических кризов, но может дать и хроническую гемолитическую болезнь (Рис.8).
Гемоглобинопатии (гемоглобинозы) связаны с нарушением синтеза глобина и его цепей. Молекула глобина состоит из 4 цепей. В гемоглобине А (α2 β2), который у взрослого человека составляет 97 %, глобин состоит из 2 α-цепей и 2 β-цепей. При гемоглобинопатиях може быть нарушена скорость синтеза одной из цепей (талассемии), либо изменен аминокислотный состав одной или обеих цепей. При некоторых гемоглобинопатиях (серповидноклеточная анемия) человек в повседневной жизни может чувствовать себя достаточно хорошо. Но при повышенной нагрузке, сопровождающейся повышенной потребностью в кислороде (физическая нагрузка, подъем в горы) развивается ацидоз, растворимость гемоглобина нарушается, и он выпадает в осадок, часто с разрывом мембраны эритроцитов, их распадом и развитием гемолитической анемии. Серповидноклеточная анемия и талассемии распространены в средиземноморском регионе. Отмечено, что такие люди легче переносят малярию, которая, видимо, и явилась фактором их выживания (отбора) в условиях частых эпидемий.
источник
Миелограмма — процентное соотношение клеточных элементов в мазках, приготовленных из пунктатов красного костного мозга. Костный мозг содержит две группы клеток: клетки ретикулярной стромы (фибробласты, остеобласты, жировые и эндотелиальные клетки), составляющие абсолютное меньшинство по численности, и клетки кроветворной ткани (паренхимы). Референтные показатели миелограммы приведены в табл..
В настоящее время биопсия красного костного мозга — обязательный метод диагностики в гематологии, так как позволяет оценивать тканевые взаимоотношения в костном мозге.
Исследование красного костного мозга проводят для подтверждения или установления диагноза различных форм гемобластозов и анемий. Миело-грамму необходимо оценивать, сопоставляя её с картиной периферической крови. Диагностическое значение имеет исследование костного мозга при поражении его лимфогранулематозом, туберкулёзом, болезнью Гоше, Нимана-Пика, метастазами опухолей, висцеральным лейшманиозом. Это исследование широко используется в динамике для оценки эффективности проводимой терапии.
Элементы красного костного мозга
Все нейтрофильные элементы
Индекс созревания нейтрофилов
Эозинофилы (всех генераций)
Индекс созревания эритрокариоцитов
Для исследования красного костного мозга производят пункцию грудины или подвздошной кости, из пунктата готовят мазки для цитологического анализа. При аспирации костного мозга всегда происходит попадание крови, тем больше, чем больше получено аспирата. Пунктат обычно оказывается разведённым периферической кровью не более чем в 2,5 раз. Признаки большей степени разведения костного мозга периферической кровью следующие.
■ Бедность пунктата клеточными элементами.
■ Резкое увеличение лейко-/эритробластического соотношения (при соотношении 20:1 и выше исследование пунктата не проводят).
■ Снижение индекса созревания нейтрофилов до 0,4-0,2.
■ Приближение относительного содержания сегментоядерных нейтро-филов и/или лимфоцитов к таковому в периферической крови.
При исследовании красного костного мозга подсчитывают процентное содержание костномозговых элементов, а также определяют абсолютное содержание миелокариоцитов и мегакариоцитов.
■ Миелокариоциты. Уменьшение содержания миелокариоцитов наблюдают при гипопластических процессах различной этиологии, воздействии на организм человека ионизирующего излучения, некоторых химических веществ и ЛС и др. Особенно резко количество ядерных элементов снижается при апластических процессах. При развитии миелофиброза, миелосклероза костномозговой пунктат скуден и количество ядерных элементов в нём также снижено. При наличии между костномозговыми элементами синцитиальной связи (в частности, при миеломной болезни) костномозговой пунктат получают с трудом, поэтому содержание ядерных элементов в пунктате может не соответствовать истинному количеству миелокариоцитов в костном мозге. Высокое содержание миелокариоцитов наблюдают при лейкозах, витамин В12-дефицитных анемиях, гемолитических и постгеморрагических анемиях, то есть при заболеваниях, сопровождающихся гиперплазией костного мозга.
■ Мегакариоциты и мегакариобласты выявляют в небольших количествах, они располагаются по периферии препарата, определение их процентного отношения в миелограмме не отражает истинного положения, поэтому их не подсчитывают. Обычно проводят лишь ориентировочную, субъективную оценку относительного сдвига в направлении более молодых или зрелых форм. Увеличение количества мегакариоцитов и мегакариобластов могут вызывать миелопролиферативные процессы и метастазы злокачественных новообразований в костный мозг (особенно при раке желудка). Содержание мегакариоцитов возрастает также при идиопатической аутоиммунной тромбоцитопении, лучевой болезни в период восстановления, хроническом миелолейкозе. Уменьшение количества мегакариоцитов и мегакариобластов (тромбоцито-пении) могут вызывать гипопластические и апластические процессы, в частности, при лучевой болезни, иммунные и аутоиммунные процессы, метастазы злокачественных новообразований (редко). Содержание мегакариоцитов снижается также при острых лейкозах, В12-дефицит-ных анемиях, миеломной болезни, СКВ.
■ Бластные клетки: увеличение их количества с появлением полиморфных уродливых форм на фоне клеточного или гиперклеточного красного костного мозга характерно для острых и хронических лейкозов.
■ Мегалобласты и мегалоциты разных генераций, крупные нейтрофиль-ные миелоциты, метамиелоциты, гиперсегментированные нейтрофилы характерны для витамин В12-дефицитной и фолиеводефицитной анемий.
■ Миелоидные элементы: увеличение количества их зрелых и незрелых форм (реактивный костный мозг) вызывают интоксикации, острое воспаление, гнойные инфекции, шок, острая кровопотеря, туберкулёз, злокачественные новообразования. Промиелоцитарно-миелоцитарный костный мозг с уменьшением количества зрелых гранулоцитов на фоне клеточной или гиперклеточной реакции может вызвать миелотоксичес-кие и иммунные процессы. Резкое уменьшение содержания гранулоци-тов на фоне снижения миелокариоцитов характерно для агранулоци-тоза.
■ Эозинофилия костного мозга возможна при аллергии, глистных инвазиях, злокачественных новообразованиях, острых и хронических мие-лоидных лейкозах, инфекционных заболеваниях.
■ Моноцитоидные клетки: увеличение их количества выявляют при острых и хронических моноцитарных лейкозах, инфекционном мононук-леозе, хронических инфекциях, злокачественных новообразованиях.
■ Атипичные мононуклеары: увеличение их количества на фоне уменьшения зрелых миелокариоцитов могут вызывать вирусные инфекции (инфекционный мононуклеоз, аденовирус, грипп, вирусный гепатит, краснуха, корь и др.).
■ Лимфоидные элементы: увеличение их количества, появление голоядер-ных форм (тени Гумпрехта) при повышении клеточности красного костного мозга могут вызывать лимфопролиферативные заболевания (хронический лимфолейкоз, макроглобулинемия Вальденстрёма, лим-фосаркомы).
■ Плазматические клетки: увеличение их количества с появлением полиморфизма, двуядерных клеток, изменение окраски цитоплазмы могут вызывать плазмоцитомы (плазмобластомы, а также реактивные состояния).
■ Эритрокариоциты: увеличение их количества без нарушения созревания наблюдают при эритремии. Увеличение содержания эритрокариоцитов и уменьшение лейкоэритросоотношения могут вызывать постгеморрагические анемии и большинство гемолитических анемий. Уменьшение содержания эритрокариоцитов при снижении общего количества ми-елокариоцитов и небольшого (относительного) увеличения бластных клеток, лимфоцитов, плазмоцитов вызывают гипоапластические процессы.
■ Раковые клетки и их комплексы выявляют при метастазах злокачественных опухолей.
Для оценки миелограммы важно не столько определение количества костномозговых элементов и их процентного содержания, сколько их взаимное соотношение. Судить о составе миелограммы следует по специально рассчитанным костномозговым индексам, характеризующим эти соотношения.
■ Индекс созревания эритрокариоцитов характеризует состояние эритро-идного ростка, представляет собой отношение процентного содержания нормобластов, содержащих Hb (то есть полихроматофильных и оксифильных), к общему процентному содержанию всех нормоблас-тов. Уменьшение этого индекса отражает задержку гемоглобинизации, что наблюдают при железодефицитных и иногда при гипопластических анемиях.
■ Индекс созревания нейтрофилов характеризует состояние гранулоцитар-ного ростка. Он равен отношению процентного содержания молодых элементов зернистого ряда (промиелоцитов, миелоцитов и метамиело-цитов) к процентному содержанию зрелых гранулоцитов (палочкоядер-ных и сегментоядерных). Увеличение этого индекса при богатом клетками красном костном мозге свидетельствует о задержке созревания нейтрофилов, при бедном клетками костном мозге — о повышенном выходе зрелых клеток из костного мозга и истощении гранулоцитарно-
го резерва [Соболева Т.Н. и др., 1994]. Увеличение индекса созревания нейтрофилов наблюдают при миелолейкозах, лейкемоидных реакциях миелоидного типа, некоторых формах агранулоцитоза; его уменьшение — при задержке созревания на стадии зрелых гранулоцитов или задержке их вымывания (при гиперспленизме, некоторых инфекционных и гнойных процессах).
■ Лейкоэритробластическое соотношение представляет собой отношение суммы процентного содержания всех элементов гранулоцитарного ростка к сумме процентного содержания всех элементов эритроидного ростка костного мозга. В норме это соотношение составляет 2 : 1-4 : 1, то есть в нормальном костном мозге количество белых клеток в 2-4 раза превышает количество красных. Увеличение индекса при высокой клеточности красного костного мозга (более 150х10 9 /л) свидетельствует о гиперплазии лейкоцитарного ростка (хронический лейкоз); при низкой клеточности (менее 80х10 9 /л) — о редукции красного ростка (апластическая анемия) или большой примеси периферической крови. Уменьшение индекса при высокой клеточности красного костного мозга свидетельствует о гиперплазии красного ростка (гемолитическая анемия), при низкой клеточности — о преимущественной редукции гранулоцитарного ростка (агранулоцитоз). Лейкоэритробластическое соотношение уменьшается при гемолитических, железодефицитных, постгеморрагических, В12-дефицитных анемиях, увеличивается при лейкозах и, иногда, при угнетении эритроидного ростка у больных с гипопластической анемией.
Алгоритмы комплексной диагностики различных видов анемий представлены на Рис. 2-5.
источник
Для исследования красного костного мозга производят пункцию грудины или подвздошной кости, из пунктата готовят мазки для цитологического анализа. При аспирации костного мозга всегда происходит попадание крови, тем больше, чем больше получено аспирата. Пунктат обычно оказывается разведённым периферической кровью не более чем в 2,5 раз. Признаки большей степени разведения костного мозга периферической кровью следующие:
- Бедность пунктата клеточными элементами.
- Отсутствие мегакариоцитов.
- Резкое увеличение лейко-, эритробластического соотношения (при соотношении 20:1 и выше исследование пунктата не проводят).
- Снижение индекса созревания нейтрофилов до 0,4-0,2.
- Приближение относительного содержания сегментоядерных нейтрофилов и/или лимфоцитов к таковому в периферической крови.
При исследовании красного костного мозга подсчитывают процентное содержание костномозговых элементов, а также определяют абсолютное содержание миелокариоцитов и мегакариоцитов.
- Миелокариоциты. Уменьшение содержания миелокариоцитов наблюдают при гипопластических процессах различной этиологии, воздействии на организм человека ионизирующего излучения, некоторых химических веществ и лекарств и др. Особенно резко количество ядерных элементов снижается при апластических процессах. При развитии миелофиброза, миелосклероза костномозговой пунктат скуден и количество ядерных элементов в нём также снижено. При наличии между костномозговыми элементами синцитиальной связи (в частности, при миеломной болезни) костномозговой пунктат получают с трудом, поэтому содержание ядерных элементов в пунктате может не соответствовать истинному количеству миелокариоцитов в костном мозге. Высокое содержание миелокариоцитов наблюдают при лейкозах, витамин В12-дефицитных анемиях, гемолитических и постгеморрагических анемиях, то есть при заболеваниях, сопровождающихся гиперплазией костного мозга.
- Мегакариоциты и мегакариобласты выявляют в небольших количествах, они располагаются по периферии препарата, определение их процентного отношения в миелограмме не отражает истинного положения, поэтому их не подсчитывают. Обычно проводят лишь ориентировочную, cубъективную оценку относительного сдвига в направлении более молодых или зрелых форм. Увеличение количества мегакариоцитов и мегакариобластов могут вызывать миелопролиферативные процессы и метастазы злокачественных новообразований в костный мозг (особенно при раке желудка). Содержание мегакариоцитов возрастает также при идиопатической аутоиммунной тромбоцитопении, лучевой болезни в период восстановления, хроническом миелолейкозе. Уменьшение количества мегакариоцитов и мегакариобластов (тромбоцитопении) могут вызывать гипопластические и апластические процессы, в частности, при лучевой болезни, иммунные и аутоиммунные процессы, метастазы злокачественных новообразований (редко). Содержание мегакариоцитов снижается также при острых лейкозах, В12-дефицитных анемиях, миеломной болезни, системной красной волчанки.
- Бластные клетки: увеличение их количества с появлением полиморфных уродливых форм на фоне клеточного или гиперклеточного красного костного мозга характерно для острых и хронических лейкозов.
- Мегалобласты и мегалоциты разных генераций, крупные нейтрофильные миелоциты, метамиелоциты, гиперсегментированные нейтрофилы характерны для витамин В12-дефицитной и фолиеводефицитной анемий.
- Миелоидные элементы: увеличение количества их зрелых и незрелых форм (реактивный костный мозг) вызывают интоксикации, острое воспаление, гнойные инфекции, шок, острая кровопотеря, туберкулёз, злокачественные новообразования. Промиелоцитарно-миелоцитарный костный мозг с уменьшением количества зрелых гранулоцитов на фоне клеточной или гиперклеточной реакции может вызвать миелотоксические и иммунные процессы. Резкое уменьшение содержания гранулоцитов на фоне снижения миелокариоцитов характерно для агранулоцитоза.
- Эозинофилия костного мозга возможна при аллергии, глистных инвазиях, злокачественных новообразованиях, острых и хронических миелоидных лейкозах, инфекционных заболеваниях.
- Моноцитоидные клетки: увеличение их количества выявляют при острых и хронических моноцитарных лейкозах, инфекционном мононуклеозе, хронических инфекциях, злокачественных новообразованиях.
- Атипичные мононуклеары: увеличение их количества на фоне уменьшения зрелых миелокариоцитов могут вызывать вирусные инфекции (инфекционный мононуклеоз, аденовирус, грипп, вирусный гепатит, краснуха, корь и др.).
- Лимфоидные элементы: увеличение их количества, появление голоядерных форм (тени Гумпрехта) при повышении клеточности красного костного мозга могут вызывать лимфопролиферативные заболевания (хронический лимфолейкоз, макроглобулинемия Вальденстрёма, лимфосаркомы).
- Плазматические клетки: увеличение их количества с появлением полиморфизма, двуядерных клеток, изменение окраски цитоплазмы могут вызывать плазмоцитомы (плазмобластомы, а также реактивные состояния).
- Эритрокариоциты: увеличение их количества без нарушения созревания наблюдают при эритремии. Увеличение содержания эритрокариоцитов и уменьшение лейкоэритросоотношения могут вызывать постгеморрагические анемии и большинство гемолитических анемий. Уменьшение содержания эритрокариоцитов при снижении общего количества миелокариоцитов и небольшого (относительного) увеличения бластных клеток, лимфоцитов, плазмоцитов вызывают гипоапластические процессы.
- Раковые клетки и их комплексы выявляют при метастазах злокачественных опухолей.
Для оценки миелограммы важно не столько определение количества костномозговых элементов и их процентного содержания, сколько их взаимное соотношение. Судить о составе миелограммы следует по специально рассчитанным костномозговым индексам, характеризующим эти соотношения.
- Индекс созревания эритрокариоцитов характеризует состояние эритроидного ростка, представляет собой отношение процентного содержания нормобластов, содержащих гемоглобин (то есть полихроматофильных и оксифильных), к общему процентному содержанию всех нормобластов. Уменьшение этого индекса отражает задержку гемоглобинизации, что наблюдают при железодефицитных и иногда при гипопластических анемиях.
- Индекс созревания нейтрофилов характеризует состояние гранулоцитарного ростка. Он равен отношению процентного содержания молодых элементов зернистого ряда (промиелоцитов, миелоцитов и метамиелоцитов) к процентному содержанию зрелых гранулоцитов (палочкоядерных и сегментоядерных). Увеличение этого индекса при богатом клетками красном костном мозге свидетельствует о задержке созревания нейтрофилов, при бедном клетками костном мозге — о повышенном выходе зрелых клеток из костного мозга и истощении гранулоцитарного резерва. Увеличение индекса созревания нейтрофилов наблюдают при миелолейкозах, лейкемоидных реакциях миелоидного типа, некоторых формах агранулоцитоза; его уменьшение — при задержке созревания на стадии зрелых гранулоцитов или задержке их вымывания (при гиперспленизме, некоторых инфекционных и гнойных процессах).
- Лейкоэритробластическое соотношение представляет собой отношение суммы процентного содержания всех элементов гранулоцитарного ростка к сумме процентного содержания всех элементов эритроидного ростка костного мозга. В норме это соотношение составляет 2 : 1-4 : 1, то есть в нормальном костном мозге количество белых клеток в 2-4 раза превышает количество красных. Увеличение индекса при высокой клеточности красного костного мозга (более 150×10 9 /л) свидетельствует о гиперплазии лейкоцитарного ростка (хронический лейкоз); при низкой клеточности (менее 80×10 9 /л) — о редукции красного ростка (апластическая анемия) или большой примеси периферической крови. Уменьшение индекса при высокой клеточности красного костного мозга свидетельствует о гиперплазии красного ростка (гемолитическая анемия), при низкой клеточности — о преимущественной редукции гранулоцитарного ростка (агранулоцитоз). Лейкоэритробластическое соотношение уменьшается при гемолитических, железодефицитных, постгеморрагических, В12-дефицитных анемиях, увеличивается при лейкозах и, иногда, при угнетении эритроидного ростка у больных с гипопластической анемией.

источник
Апластическая анемия – это состояние, при котором организм перестает вырабатывать достаточное количество новых кровяных телец.
Апластическая анемия вызывает у больных слабость и утомляемость, а также делает их очень подверженными инфекциям и кровотечениям.
Апластическая анемия, редкое и серьезное состояние, может возникнуть в любом возрасте.
Апластическая анемия может развиться внезапно, но может прогрессировать медленно, месяцами ухудшая состояние больного. Современное лечение апластической анемии включает переливания крови, лекарственные препараты и трансплантацию костного мозга.
Апластическая анемия возникает при повреждении костного мозга, которое приводит к замедлению или полному прекращению выработки клеток крови. Костный мозг представляет собой красное губчатое вещество внутри костей, которое постоянно вырабатывает новые клетки крови – эритроциты, лейкоциты, тромбоциты. При апластической анемии больной костный мозг описывают терминами «апластический» или «гипопластический», что означает либо полное отсутствие в нем молодых кровяных телец, либо очень малое их количество.
Факторы, которые временно или необратимо нарушают кроветворную функцию костного мозга, включают:
• Радиоактивное облучение. Человек может стать жертвой радиации как в результате аварий на атомных объектах, так и в результате медицинского облучения – например, при лечении рака.
• Химиотерапия при раке. Воздействие многих химиотерапевтических препаратов плохо сказывается не только на раковых клетках, но и на других интенсивно делящихся клетках организма.
• Токсичные вещества. Воздействие токсинов из окружающей среды, таких как инсектициды, пестициды, лабораторные реактивы, может пагубно повлиять на костный мозг. При этом больному иногда становится лучше, если воздействие химикатов прекратится.
• Некоторые лекарства. Препараты для лечения ревматоидного артрита, некоторые антибиотики могут вызывать апластическую анемию. Данный побочный эффект обязательно должен быть указан в инструкции к препарату.
• Аутоиммунные заболевания. Это большая группа заболеваний, при которых иммунная система организма ошибочно атакует клетки хозяина. Жертвами иммунитета могут стать и клетки костного мозга.
• Вирусная инфекция. Некоторые вирусы играют роль в развитии апластической анемии. Последние исследования позволяют причислить к таким опасным организмам вирус Эпштейна-Барр, цитомегаловирус (ЦМВ), парвовирус В19 и вирус иммунодефицита человека (ВИЧ).
• Беременность. Апластическая анемия, которая возникает при беременности, может быть связана с аутоиммунной проблемой – иммунная система беременной иногда ошибочно атакует костный мозг.
• Неизвестные факторы. Во многих случаях врачи не могут установить точную причину апластической анемии. Тогда говорят о так называемой идиопатической апластической анемии.
Апластическую анемию не стоит путать с миелодиспластическим синдромом.
Это группа заболеваний, при которых костный мозг вырабатывает новые кровяные клетки, но они деформированы или недоразвиты. При миелодиспластическом синдроме костный мозг иногда характеризуют как «гиперпластический» — это означает, что в нем содержится много кровяных телец. Но у некоторых больных с этим синдромом костный мозг почти пуст, поэтому болезнь иногда путают с апластической анемией.
Апластическая анемия связана с некоторыми другими заболеваниями. У части больных с апластической анемией имеется другая редкая болезнь – пароксизмальная ночная гемоглобинурия. Эта болезнь характеризуется слишком быстрым разрушением эритроцитов.
Анемия Фанкони – это редкая, наследственная болезнь, которая приводит к апластической анемии. Дети с болезнью Фанкони могут иметь различные врожденные дефекты, такие как недоразвитие конечностей. Болезнь диагностируется при помощи генетического анализа.
Апластическая анемия встречается редко.
• Лучевая или химиотерапия рака в прошлом.
• Воздействие токсичных веществ на производстве и в быту.
• Использование рецептурных препаратов, таких как хлорамфеникол (Левомицетин) и некоторые средства против ревматоидного артрита.
• Некоторые заболевания кроветворной системы.
• Тяжелые инфекционные заболевания.
• Аутоиммунные процессы.
• Беременность (редко).
Признаки болезни появляются в результате снижения количества тех или иных кровяных телец.
Признаки апластической анемии могут быть следующими:
• Слабость.
• Одышка при напряжении.
• Быстрое или нерегулярное сердцебиение.
• Бледность кожных покровов.
• Частые и тяжелые инфекции.
• Склонность к появлению синяков.
• Кровотечения из десен и носа.
• Длительные кровотечения после порезов.
• Кожная сыпь.
• Головокружение.
• Головные боли.
Апластическая анемия может прогрессировать медленно, неделями и месяцами. Болезнь может быть короткой и проходящей, а может стать хронической. Апластическая анемия требует серьезного отношения, потому что в тяжелых случаях она заканчивается фатально.
Для диагностики этого заболевания врач может назначить следующее:
• Анализы крови. В крови здорового человека уровень эритроцитов, лейкоцитов и тромбоцитов находится в определенных пределах. Эти пределы могут варьировать в зависимости от возраста, пола, расы и других особенностей организма. Но если в анализах обнаружится очень низкий уровень всех трех классов клеток крови, то врач заподозрит апластическую анемию.
• Биопсия костного мозга. Для подтверждения диагноза больному придется пройти болезненную, но необходимую процедуру биопсии. Во время биопсии врач введет специальную иглу в одну из костей и возьмет образец костного мозга. Клетки костного мозга изучат под микроскопом, чтобы увидеть признаки апластической анемии или других заболеваний. При апластической анемии костный мозг будет содержать мало кровяных клеток.
После того, как подтвердится апластическая анемия, врачи назначат дополнительные обследования, чтобы выяснить причину болезни. Это может быть длительный и сложный процесс.
Лечение апластической анемии в легких случаях может состоять в простом наблюдении за пациентом. При более тяжелой форме болезни могут применяться переливания крови, трансплантация костного мозга и специальные препараты, которые стимулируют кроветворение. Тяжелая апластическая анемия угрожает жизни человека и требует обязательной госпитализации.
При низком уровне тромбоцитов или эритроцитов больным переливают донорскую кровь. Это не вылечит апластическую анемию, но поможет контролировать ее симптомы, восполняя кровяные клетки, которые не вырабатывает больной костный мозг. Для переливания могут использовать отдельную массу, состоящую из эритроцитов или тромбоцитов – в зависимости от потребностей больного.
Обычно нет ограничения количества переливаний для одного больного. Но у такой процедуры могут быть осложнения. Переливаемые кровяные тельца содержат железо, которое высвобождается при их разрушении и накапливается в теле. При многократном переливании в организме откладываются большие запасы железа, которые повреждают жизненно важные органы, если не назначить специальные препараты для его выведения.
Другое осложнение заключается в том, что организм может вырабатывать антитела к переливаемым клетках. А это сделает лечение менее эффективным.
Пересадка стволовых клеток, чтобы «перезапустить» костный мозг больного – это иногда единственный способ успешного лечения апластической анемии. Трансплантация стволовых клеток, иногда называемая пересадкой костного мозга, является методом выбора для больных молодого возраста, имеющих подходящего донора. Чаще всего подходящим донором выступает брат или сестра.
Если донор найден, то костный мозг больного сначала истощают высокими дозами радиации или химиотерапией. Далее здоровые стволовые клетки донора фильтруют из его крови, после чего вводят их в кровоток больного. Клетки сами мигрируют в полости костей и начинают там вырабатывать кровяные тельца, как это предусмотрено природой. Но вся процедура очень сложная, дорогостоящая и требует длительного пребывания в больнице. После трансплантации больной должен получать лекарства для профилактики отторжения донорских клеток.
Трансплантация влечет за собой риски. Есть вероятность, что организм начнет отторгать трансплантат. Эта реакция может быть фатальной для реципиента. Кроме того, не каждому больному удается найти донора, который совместим по всем параметрам.
Больные с аутоиммунными заболеваниями, которые повредили костный мозг, нуждаются в лечении иммуносупрессорами – препаратами, подавляющими иммунитет.
Препарат циклоспорин (Генграф, Неорал) и антитимоцитарный глобулин (Тимоглобулин) могут использоваться в качестве примера. Эти лекарства подавляют активность иммунных клеток, которые атакуют костный мозг. Лечение помогает восстановить костный мозг и повысить уровень клеток крови. Два названных выше препарата нередко используют в комбинации.
Кортикостероидные гормоны, такие как метилпреднизолон (Солу-Медрол, Медрол, Метипред), также назначают для подавления иммунитета, иногда наряду с другими лекарствами.
Иммуносупрессоры могут быть очень эффективными при апластической анемии. Обратной стороной медали является то, что подавление иммунитета приводит к риску инфекций. Кроме того, есть возможность, что после отмены лекарств апластическая анемия вернется.
Некоторые препараты помогают усилить кроветворение в костном мозге. Среди них колониестимулирующие факторы, такие как сарграмостин (Лейкин), филграстим (Нейпоген), пегфилграстим (Нейласта) и эпоэтин-альфа (Прокрит, Эпоген). Эти препараты разработаны относительно недавно, их получение является очень дорогим и трудоемким процессом, поэтому стоимость препаратов для среднестатистического больного просто фантастическая. Колониестимулирующие факторы нередко назначают наряду с иммуносупрессорами.
Апластическая анемия сопровождается понижением уровня лейкоцитов и ослаблением иммунной защиты организма. Это делает организм больного очень восприимчивым к различным бактериальным, вирусным и грибковым инфекциям.
При первых признаках инфекций, таких как жар, следует сразу же обращаться к врачу. У человека с ослабленным иммунитетом мало шансов на то, что банальная простуда пройдет «просто так». Безобидная для других людей инфекция может стать опасной для жизни, поэтому врач будет использовать антибиотики, противовирусные и другие препараты для лечения и профилактики.
Апластическая анемия, вызванная радиацией или химиотерапией рака, обычно улучшается после отмены лечения. То же самое касается многих лекарств и токсинов, которые поражают костный мозг.
Беременные женщины с апластической анемией получают переливания крови, потому что другие способы лечения нанесут непоправимый вред ребенку. У многих беременных апластическая анемия проходит сама по себе вскоре после родов. Если этого не произошло, требуется дальнейшее лечение.
Советы для больных апластической анемией:
• Отдыхайте, когда вам это нужно. Анемия может вызвать утомляемость и одышку, даже при незначительной нагрузке. Делайте перерывы в работе, если вы устали, берегите свои силы.
• Избегайте контактных видов спорта. Из-за высокого риска кровотечений, связанных с тромбоцитопенией, контактный спорт может вызвать проблемы. Незначительный порез, синяк, падение – и кровь будет трудно остановить.
• Защитите себя от микробов. Вы можете уменьшить риск инфекций, если будете чаще мыть руки, избегать больных людей и соблюдать правила гигиены. При первых незначительных признаках инфекции немедленно обращайтесь к врачу.
источник
Отмечается эритропения, снижение содержания гемоглобина до 30-40 г/л, анизоцитоз, пойкилоцитоз, гипохромия, снижение ретикулоцитарного индекса, лейкопения за счет снижения количества нейтрофилов.
Патогномоничный признак железодефицита в костном мозге – резкое снижение местных запасов железа (снижается количество сидеробластов – клеток, содержащих гранулы железа). Отмечается умеренная гиперплазия эритроидного ростка. Гемоглобинизация клеток эритрона нарушена: увеличено количество базофильных и полихроматофильных форм, снижено количество оксифильных. По мере истощения запасов железа ферритин и гемосидерин исчезают и из костного мозга, и из других мест хранения.
Особую роль в диагностике играют биохимические показатели:
Уровень ферритина сыворотки снижен – менее 12 нг/мл.
Увеличена общая железосвязывающая способность.
Увеличена ненасыщенная, латентная железосвязывающая способность.
Резко снижено насыщение трансферрина.
Витамин В12 содержится в мясе, яйцах, сыре, молоке, почках, печени. Витамин В12 в продуктах связан с белком, от которого он освобождается в процессе кулинарной обработки и под воздействием протеолитических ферментов ЖКТ, после чего он связывается в желудке с внутренним фактором Кастла. Внутренний фактор – это гликопротеид, который образуется в фундальной части и в области тела желудка париетальными клетками. Комплекс «витамин В12 – фактор Кастла» связывается со специфическими рецепторами клеток подвздошной кишки. Витамин В12 всасывается медленно, за сутки может всосаться не более 6-9 мкг. Незначительная часть витамина В12 может всосаться без фактора Кастла.
Витамин В12 в плазме связывается с транскобаламинами. Известно три транскобаламина – I, II, III. Основное количество витамина переносится транскобаламином II. Этот белок синтезируется в печени.
Содержание витамина В12 в организме здорового человека составляет 2-5 мг, депо находится в печени. Запасы витамина В12 настолько велики, что их хватает на 3-6 лет.
Все клетки организма имеют рецепторы для комплекса «транскобаламин II – витамин В12».
У человека выявлены две метаболически активные формы витамина В12:
1. Метилкобаламин. Эта активная форма обеспечивает нормальное эритробластическое кроветворение и нормально протекающие метотические процессы в других клетках организма. В ходе реакции с метилкобаламином из уридинмонофосфата образуется тимидинмонофосфат, который включается в ДНК. Необходимым условием для течения этой реакции является участие активной коферментной формы фолиевой кислоты – 5, 10 – метилен-тетрагидрофолиевой кислоты.
Метилкобаламин участвует в метилировании гомоцистеина в метионин.
2. 5-дезоксиаденозилкобаламин. Этот метаболит необходим для нормального обмена жирных кислот. Так при распаде некоторых жирных кислот образуется пропионовая кислота. Распад пропионовой кислоты обеспечивается рядом ферментативных реакций, в ходе которых синтезируются производные янтарной кислоты, входящие в цикл Кребса. Одним из промежуточных продуктов является метилмалоновая кислота. Метилмалоновая кислота образуется также при распаде валина и метионина. 5-дезоксиаденозилкобаламин участвует в образовании янтарной кислоты из метилмалоновой. Предполагается участие аденозилкобаламина в биосинтезе миелина. При дефиците витамина В12 накапливается избыток пропионовой и метилмалоновой кислот. Они переходят в жирные кислоты с физиологическим нечетным числом атомов углерода в молекуле. Включаясь в липиды нейронов, они нарушают процессы миелинизации и вызывают жировую дистрофию клеток.
источник
Одним из самых редких, но тяжелых заболеваний системы кровообращения считается апластическая анемия, симптомы, причины, методы лечения этого вида малокровия бывают различны. Все зависит от формы, вида и степени тяжести данной патологии.
Люди, далекие от медицины, зачастую не имеют представления о том, что такое апластическая анемия. Так называется расстройство кроветворной функции костного мозга, ведущее к снижению выработки кровяных клеток. Это приводит к серьезным патологическим изменениям во всех системах человеческого организма. Очень часто заболевание заканчивается летально.
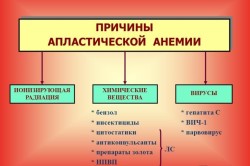
Этиология апластической анемии до сих пор досконально не изучена. Поэтому окончательный список причин данного заболевания все еще полностью не составлен. На данный момент основными причинами апластического малокровия считаются:
- плохая экология в регионе проживания;
- ионизирующая радиация;
- постоянные контакты с опасными химическими веществами в течение долгого времени;
- отдельные инфекционные заболевания: гепатит, цитомегаловирус;
- разрушение костного мозга под воздействием некоторых медикаментозных средств при их длительном приеме в высоких дозах, особенно левомицетина, мышьяка, бензола, химических препаратов, противоопухолевых средств, антибиотиков;
- генетическая предрасположенность;
- беременность;
- патологии костного мозга;
- злоупотребление алкоголем.
Возникновение апластической анемии у детей сразу после рождения может быть спровоцировано такими причинами, как:
- врожденный сифилис;
- токсоплазмоз;
- генерализованный мегалоцитоз.
Часто у детей диагностируется идиопатическая апластическая анемия. В этом случае определить точную причину возникновения патологии не представляется сегодня возможным.
При гипопластической анемии наблюдается еще более серьезное расстройство кроветворной функции костного мозга. В целом гипопластические и апластические анемии вызывают сходные патологии органов и систем организма, имеют похожую симптоматику и лечатся примерно одинаково.
Костный мозг образуется губчатой структурой и располагается в глубине трубчатых костей. Посредством его структуры происходит выработка различных клеток крови: лейкоцитов, тромбоцитов, эритроцитов.
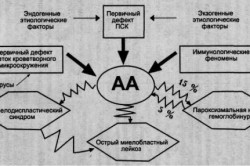
При апластической анемии, прежде всего, нарушается эритрогенез. Стимулировать этот процесс медикаментозными средствами невозможно. В этом случае может помочь только пересадка донорского костного мозга.
Помимо этого, апластичная анемия развивается на фоне уменьшения количества и изменения функций стволовых клеток.
Причиной этого становится нарушение микроокружения, клеточное или гуморальное воздействие иммунного характера, препятствующее нормальному функционированию стволовых клеток.
Апластическая анемия, симптомы которой часто незаметны, является серьезной патологией. В отдельных случаях недуг начинается в острой форме с быстрым нарастанием симптоматических проявлений. Развитие болезни может быстро прогрессировать, приводя к летальному исходу. Возможно также хроническое с периодическими ремиссиями и рецидивами протекание анемии.
Апластическая анемия симптомы имеет следующие: анемический, геморрагический и лейкоцитопенический синдромы. Для каждого из них характерны определенные признаки.
Анемический синдром (снижение уровня гемоглобина) возникает при нарушении формирования эритроцитов и сопровождается такими симптомами, как:
- общая слабость;
- сонливость;
- бессонница;
- раздражительность;
- одышка;
- шум в ушах;
- тахикардия;
- бледность кожных покровов;
- быстрая утомляемость.
Геморрагический синдром (повышение кровоточивости) вызван понижением уровня тромбоцитов в крови. Его сопровождают такие симптомы, как:
- петехии, т. е. точечные кровоизлияния на коже и слизистых оболочках и гематомы;
- плохая свертываемость крови;
- десневые и носовые кровотечения;
- появление крови в моче;
- обильные менструальные выделения у женщин.

Он сопровождается следующими симптомами:
- появление хронических очагов инфекции в различных органах и на поверхности кожи больного;
- учащение инфекционных заболеваний, протекающих длительно и со многими осложнениями;
- стоматит;
- внезапная гипертермия без видимых причин.
По форме апластическая и гипопластическая анемия может быть как врожденной, так и приобретенной.
После проведения анамнестической беседы врач проводит общий осмотр пациента. При этом обязательно применяются такие методы, как:
- выслушивание (аускультация) сердечных шумов;
- простукивание (перкуссия) живота, показывающая увеличение таких органов, как печень и селезенка;
- прощупывание (пальпация) для уточнения результатов перкуссии.
Для получения дополнительных сведений больному назначается:
- общий анализ крови;
- биохимический анализ крови;
- клинический анализ крови — гемограмма;
- забор мазка — биопсия, костного мозга;
- анализ мазка костного мозга, на основании которого составляется миелограмма.
При необходимости больному проводятся специальное тестирование, помогающее уточнить причину заболевания.
На основании всех полученных данных составляется точная клиническая картина заболевания, необходимая для определения курса лечения.
Когда больному диагностируется апластическая анемия, лечение проводится по 3 направлениям: этиологическому, симптоматическому и патогенетическому. Если известна точная причина возникновения заболевания, ее необходимо ликвидировать: прекратить контакт с токсинами, сменить лекарственные препараты, используемые для лечения других заболеваний и т. д.
Восстановлению кроветворного функционирования костного мозга помогают следующие препараты:
- кортикостероиды;
- андрогены;
- цитоксины;
- иммуносупрессоры.
Помимо медикаментозной терапии лечение апластической анемии проводится при помощи таких процедур, как переливание крови и ТКМ. Посредством переливания донорской крови организм больного частично обеспечивается недостающими кровяными клетками.
В особых случаях больным проводится трансплантация костного мозга. Костный мозг донора должен максимально соответствовать костному мозгу реципиента. Поэтому этот метод особенно эффективен, если у больного есть однояйцевый близнец. Процент выживаемости после трансплантации костного мозга выше у реципиентов более молодого возраста.

Основными факторами, влияющими на получение положительных эффектов, являются:
- Степень тяжести заболевания.
- Правильный выбор и хорошая переносимость лечения.
- Возраст больного. Легкая апластическая анемия у детей и молодых людей, не достигших 30-летнего возраста, полностью вылечивается чаще, чем у людей среднего и старшего возраста. При тяжелых формах болезни прогнозы не столь благоприятные.
Основным условием ремиссии и значительного продления жизненного срока является хорошая переносимость патогенетической терапии и успешное проведение трансплантации костного мозга.
Профилактика анемии различного вида может быть первичной или вторичной. Первичная профилактика предполагает исключение возможности развития данной патологии у относительно здорового человека. Этого можно добиться при помощи таких способов, как:
- ведение здорового образа жизни;
- правильное питание;
- постоянное укрепление иммунной системы;
- исключение или сведение к минимуму контакта с ионизирующими излучателями и токсичными веществами, вызывающими патологии костного мозга;
- контролированный прием лекарственных препаратов во время лечения других заболеваний;
- периодические визиты к терапевту и гематологу;
- полный отказ от употребления алкоголя и никотина.
Вторичная профилактика анемии проводится для замедления развития заболевания, избегания его осложнения сопутствующими патологиями. Для этого необходимо:
- аккуратное проведение лечения;
- постоянный контроль специалистов — гематолога и терапевта;
- тщательное контролирование больным своего состояния, немедленное посещение врача при появлении новых симптомов;
- постоянный прием поддерживающих препаратов в течение долгого времени.
Апластическая анемия — опасная патология, которую лечат годами. Только под наблюдением специалиста можно добиться стойкой ремиссии патологии. Самолечение в этом случае неприемлемо и может привести к плачевным последствиям.
источник