На сегодняшний день существует множество различных нарушений в функционировании кровеносной системе человека, которые имеют отличные друг от друга причины возникновения, по-разному проявляются клинически. Различны и прогнозы протекания таких заболеваний. Одним из примеров таких заболеваний является апластическая анемия.
Когда человек впервые сталкивается с диагнозом апластическая анемия, естественно, у него сразу возникает вопрос, что это такое? В основе данного заболевания (другое его название – панмиелофтиз) лежит резкое угнетение процессов кроветворения в красном костном мозге, что клинически проявляется в уменьшении в крови содержания форменных ее клеток – эритроцитов, лейкоцитов и тромбоцитов.
Процент выявления апластической анемии среди населения относительно низок и частота выявленных случаев составляет всего 0,5 на 100 тысяч населения. Этот вид анемии не зависит от пола больного человека, но возможно установить некоторую зависимость от возраста.
Начиная с рождения и до 20 лет частота выявленных случаев среди этой возрастной категории постепенно увеличивается; в категории пациентов возрастом от 20 до 55 лет она сохраняется на одном уровне, а вот после 55 лет резко возрастает.
Согласно последним исследованиям в этой области, у небольшой группы пациентов была установлена генетическая предрасположенность к развитию апластической анемии.
Летальный исход наступает у более, чем половины больных. Некоторые источники отмечают, что этот процент достигает отметки 80.
Согласно МКБ 10-го пересмотра апластическая анемия входит в группу «другие анемии» под кодом D61.
В зависимости от клинической картины проявления заболевания различают:
- Наследственные апластические анемии. Данные патологии приводят к тотальному поражению системы кроветворения. Среди данного вида анемий выделяют два подвида:
- анемии Фанкони – если основное заболевание сопровождается формированием врожденных пороков развития;
- анемии Эстрена – Дамешека – если врожденные пороки отсутствуют;
- анемия Даймонда – Блекфена – форма анемии, при которой отмечается нарушение продукции только эритроцитарных клеток крови, обусловленное генетическими факторами.
- Приобретенные апластические (или гипопластические) анемии. Здесь также различают подвиды:
- формы анемий, которые характеризируются острым, подострым или хроническим процессом угнетения общего кроветворения;
- парциальная (красноклеточная) анемия – угнетается процесс формирования только эритроцитов.
Причины апластической анемией следующие:
- Наличие внешних факторов, которые обладают миелотоксическим эффектом, то есть провоцируют цитостатические нарушения свертываемости крови. Сюда относятся и различные заболевания инфекционной и вирусной природы, и действие ионизирующего излучения, и некоторые лекарственные препараты (анальгин, противотуберкулезные препараты, некоторые виды антибиотиков), а также препараты, применяемые в химиотерапии.
- Эндогенные, то есть внутренние, причины апластической анемии – накопление токсических веществ в результате внутренних нарушений и эндокринных сдвигов, например, в случае развития гипотериоза, уремии.
- Аутоагрессия, когда у больного развивается индивидуальная чувствительность к антигенам и появляются антитела в крови.
- Идиопатические формы апластической анемии. Различают у половины больных, диагностируют в случае, если установить причину развития заболевания не удалось.
На современном этапе специалистам удалось изучить в наибольшей степени только врожденные виды апластических анемий. Так, в случае диагностирования анемии Фанкони причина заключается в изменениях в парных хромосомах I и VII. При анемии Даймонда – Блекфена мутируют гены хромосом I, XVI, XIX, и XIII. Свою роль в этих процессах может сыграть воздействие на организм свободных радикалов.
Современной медицине пока окончательно не известны механизмы и причины, которые приводят к формированию недоразвития костного мозга.
Выделяют несколько процессов развития апластической анемии:
- Развитие в организме процессов, приводящих к поражению стволовых клеток костного мозга.
- Действие защитных механизмов организма (клеточных, под влияние гормонов), в результате которого процессы образования клеток крови подавляются.
- Различные виды нарушений функционирования элементов микроокружения костного мозга (остеогенные, жировые клетки, макрофаги и другие).
- Недостаток в организме факторов, которые активизируют процессы кроветворения.
- Случаи, когда концентрация необходимых для кроветворения веществ сохраняется на должном уровне (в частности, железо в крови, витамин В12, протопорфирин), но они не усваиваются кроветворной тканью.
В случае развития у человека апластической анемии и поражения костного мозга, происходит разрушение клеток крови различной степени зрелости, но, в первую очередь, страдают эритроциты. Нарушается не только средний объем эритроцитов, но также уменьшается и длительность жизнедеятельности зрелых форм.
Заболевание анемии сопровождается нарушениями процессов выведения излишков железа, которое кумулируется в печени и селезенке.
Из-за понижения лейкоцитов в крови происходят сбои в работе иммунной системе организма. Снижением концентрации тромбоцитов в крови объясняется нарушение процессов свертываемости крови.
Повышение лимфоцитов, Отмечается «опустошение» костного мозга (панмиелофтиз).
Поскольку в крови снижается количество зрелых эритроцитов, это приводит к развитию хронической гипоксии в тканях, что влечет за собой дистрофические изменения внутренних органов. В первую очередь очень чувствительны к гипоксии (кислородное голодание) эндокринные железы.
В зависимости от того, насколько выражены нарушения процессов кроветворения, клинические проявления и симптомы апластической анемии очень разнообразны: различают переходные формы апластической анемии от частичного угнетения процессов образования клеток крови до выраженного недоразвития костного мозга.
В течении заболевания выделяют 3 основных синдрома апластических анемий:
- цитопенический;
- септико – некротический;
- геморрагический.
Эти синдромы анемии могут по-разному проявляться в организме человека в зависимости от степени развития заболевания. Различают 3 этапа развития болезни, при этом симптомы апластической анемии на каждом из них разнятся.
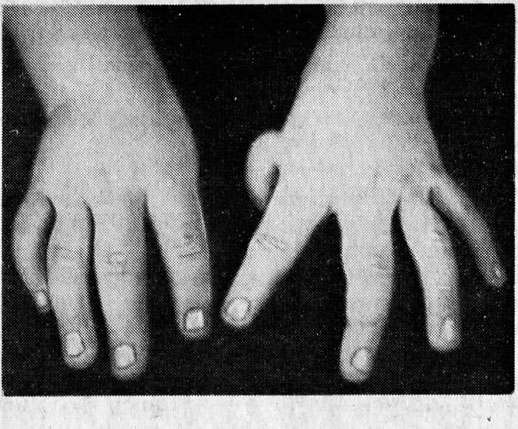
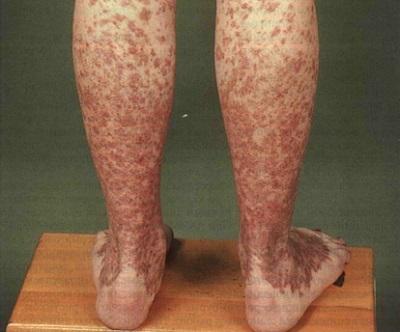
I этап характеризируется проявлением неспецифических симптомов, которые могут быть при любом другом патологическом процессе, — хроническая усталость и общая слабость. Очень часто больные приспосабливаются к существующей у них анемии и обращаются к специалисту только тогда, когда заболевание начнет прогрессировать. Также этот этап характеризуется такими проявлениями геморрагического синдрома, как маточное, носовое кровотечение и повышенная склонность к образованию кровоподтеков (синяки на теле без причины).
На II этапе у больных болеющие апластической анемией отмечается бледность кожи и видимых слизистых оболочек, также иногда могут возникать кровоподтеки. Если заболевание переходит в острую форму, помимо бледности кожных покровов также наблюдают геморрагический шок, некроз слизистых оболочек и высокую температуру. В организме активизируются различные воспалительные процессы (в частности, пневмония).
Обычно печень и селезенка не увеличиваются, но если диагностируют аутоиммунную форму апластической анемии, при которым в организме больного вырабатываются антитела к эритроцитом, может развиться умеренная спленомегалия (увеличение селезенки) и легкая желтушность кожи и склер, вызванных наличием в крови гемолитических компонентов.
Наиболее ярко выраженным является III этап анемии, который характеризируется бурной картиной клинических проявлений. На этой стадии развития апластической анемии анализ крови показывает:
- в клиническом анализе крови определяется ярко выраженная анемия (как правило, нормохромная) – уровень гемоглобина уменьшается до 20 – 30 г/л, концентрация ретикулоцитов снижается (говорит о снижении функциональности костного мозга);
- возникает лейкопения, гранулоцитопения, то есть резко снижается уровень содержания в крови гранулярных лейкоцитов. При этом количество лимфоцитов не изменяется;
- понижение тромбоцитов, вплоть до нуля;
- при гистологическом исследовании ткани костного мозга отмечается катастрофическое исчезновение его клеток, которые замещаются жировой тканью;
- резко повышается СОЭ – до 30 – 50 мм/час;
- в сыворотке крови концентрация железа увеличивается.
Лечение апластической анемии зависит от главного фактора, который предположительно стал причиной развития патологического процесса.
Если заболевание выявлено впервые, больной обязательно подлежит госпитализации в стационар, отделение гематологии. Только в условиях лечебного учреждения можно корректно подобрать необходимый для лечения лекарственный препарат, а также определиться с его дозировкой.
Основными методиками коррекции и лечения апластической анемии у детей и взрослого являются:
- трансфузионные методы (переливание крови);
- трансплантационные методы;
- медикаментозные методы.
Трансфузионный терапевтический метод предполагает переливание больному цельной, эритроцитарной или тромбоцитарной массы, а также гранулоцитов крови. Препараты крови, использующие в трансфузии, готовятся на станциях переливания из донорской крови. Данный метод трансфузии — временный, так как он позволяет только восполнить дефицит клеток крови, но нарушения в костном мозге при этом не ликвидируются. Еще одним минусом трансфузии является то, что при диагностировании аутоиммунных форм апластической анемии применять его нельзя.

Если операции по переливанию крови больному делают довольно часто, это может привести к накоплению в его организме излишков железа, которые откладываются в печени и селезенке. Поэтому такой категории пациентов включают в терапию лекарственные препараты, влияющие на выведение железа из крови.
Наиболее эффективным методом лечения апластической анемии принято считать трансплантационный, при котором происходит пересадка костного мозга человека. Вероятность успеха операции по пересадке костного мозга зависит от возраста больного, процент успешного исхода тем выше, чем моложе пациент. В качестве донора может выступить один из ближайших родственников, имеющий такую же группу крови, что и больной. Для этого необходимо провести исследование на индивидуальную совместимость их групп крови.
Данная методика лечения требует определенной подготовки, чтобы снизить процент вероятности отторжения чужеродных тканей. Перед процедурой переливания крови отменяются, назначается проведение лучевой терапии, закрепленной в последствие курсом химиотерапевтических препаратов. Делается это с целью временного подавления иммунной системы больного, которая может спровоцировать отторжение донорских стволовых клеток. Трансплантация костного мозга при анемии – очень дорогостоящая операция, проводится только в специализированных клиниках.
Медикаментозная терапия при апластической анемии у человека включает применение следующих лекарственных средств:
- иммунодепрессанты – например, циклоспорин, специфические антиглобулины. Применение этих лекарственных форм показано в тех случаях, когда невозможно провести операцию по пересадке костного мозга. Назначаются они комплексно с кортикостероидами, чтобы предупредить развитие анафилактических реакций;
- лекарственные препараты, стимулирующие процессы кроветворения – например, филграстим, лейкомакс. Назначают их только в случае диагностирования лейкопении, поскольку они активируют процессы образования гранулярных лейкоцитов;
- для лечения апластической анемии у мужчин применяют препараты, содержащие андрогены (мужские половые гормоны) – тестостерона пропионат, сустанон;
- при выраженном геморрагическом синдроме показано назначение гемостатиков – дицинон, аминокапроновая кислота;
- одним из примеров препаратов, способствующих выведению железа из крови, является десферал.
Еще один метод лечения апластических анемий — спленэктомия, другими словами операция по удалению селезенки. Частота положительного эффекта составляет 85%. В основе этого метода лечения лежит прекращение аутоиммунных процессов в организме, когда вырабатываются антитела к собственным клеткам. Его можно проводить любым пациентам, у которых отсутствуют инфекционные осложнения.
Запрещено прибегать к использованию рецептов народной медицины при лечении апластической анемии. Лечение патологических нарушений в этом случае предусматривает точную дозировку лекарственных веществ, которую невозможно соблюдать при использовании фитопрепаратов.
Поскольку механизмы развития апластической анемии на данном этапе так и остаются до конца не выясненными, прогноз лечения апластической анемии в большинстве случаев неблагоприятный.
Самый высокий процент смертности отмечается у категории больных с тяжелыми формами заболевания. Из-за прогрессирующего и не поддающего коррекции недоразвития костного мозга возобновить процессы образования клеток крови не удается и это приводит к гибели больного из-за генерализированного сепсиса.
Если же течение заболевания менее тяжелое, у больного отмечается положительная реакция на трансплантацию донорских стволовых клеток, а также применение иммунодепрессантов оказывает эффективное действие – прогнозы перехода заболевания в стадию ремиссии колеблются в пределах 50 – 90%. Одна лишь медикаментозная терапия, без применения оперативных методов лечения, может дать положительный результат только у половины пациентов.
В случае развития наследственных форм апластических анемий клиническая картина зависит от вида заболевания.
При диагностировании апластической анемии Фанкони у ребенка присутствуют такие врожденные пороки развития, как врожденные аномалии развития костной системы (отсутствие I пальца на кисти, искривление либо отсутствие лучевых костей и другие), пороки сердца и почек, аномалии развития глаз (маленькие глазные яблоки).
Симптомы апластической анемии у детей начинают появляться в возрасте 4 года, очень редко – в раннем возрасте. У ребенка наблюдается общая слабость, повышенная утомляемость, частые головные боли. Иммунитет снижается, ребенок становится более восприимчивым к простудным заболеваниям.
Геморрагический синдром проявляется склонностью к частым носовым кровотечениям. Лабораторное обследование дает характерную клиническую картину в анализах крови. Заболевание переходит в хроническую форму, прерываемую периодическими рецидивами.
Летальный исход при этой форме апластической анемии обусловлен присоединением инфекционного процесса или же развитием острой кровопотери из-за усилившегося геморрагического синдрома.
Случаи диагностирования апластической анемии Эстрена – Дамешека довольно редки. Данные виды болезни характеризируются нарушениями только кроветворных процессов.
При анемии Даймонда – Блекфена нарушаются процессы формирования только красных клеток крови. Геморрагический синдром отсутствует. При осмотре специалист отмечает бледность кожи, увеличение печени и спленомегалию. Концентрация тромбоцитов и лейкоцитов в крови может снизиться только в случае сильного поражения селезенки. Заболевание имеет хронически тяжелое течение. Прогноз крайне неблагоприятный. Смерть наступает до достижения 20-летнего возраста.
источник
Апластическая анемия – разнородная группа гематологических заболеваний, морфологическим признаком которых является панцитопения в периферической крови и глубокая гипоплазия или аплазия миелоидной ткани. Развитие апластической анемии обусловлено большим числом эндогенных и экзогенных факторов, вызывающих качественные и количественные изменениями со стороны стволовой клетки и ее микроокружения.
Апластическая анемия — достаточно редкое заболевание: его средняя частота в Европе и США составляет 4-6 случаев на 1 миллион жителей в год. Чаще всего апластическая анемия развивается у лиц до 20 и старше 65 лет, что может быть связано с преобладанием этиологической роли вирусов у лиц молодого возраста и химических веществ — у пожилых людей. Свое подтверждение эта гипотеза находит в исследованиях, проведенных в Китае и Юго-Восточной Азии. Эти регионы, где частота апластической анемии в 3-4 раза выше среднемировой, характеризуются широким распространением вирусных заболеваний (в особенности гепатита) и использованием в сельском хозяйстве ядохимикалиев без адекватной защиты.
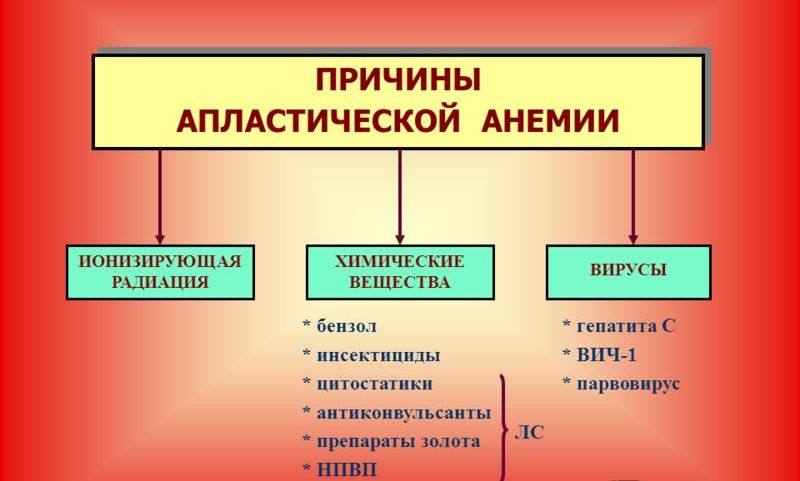
Причину апластической анемии удается выявить менее, чем у 50% больных. В зависимости от этиологических факторов выделяют: врожденные (наследственные) и приобретенные формы заболевания.
К врожденным формам относятся анемия Фанкони, амегакариоцитарная аплазия и апластическая анемия, развивающаяся у больных с негаматологической патологией (синдром Дауна). В группу приобретенных входят первичная (этиологический фактор неизвестен) и вторичная апластическая анемия, которая может возникать при воздействии ионизирующей радиации, химических веществ (бензин, толуол), при вирусных инфекциях (гепатиты В и С, ВИЧ-инфекция, вирус Эпштейна-Барр, парвовирусы), иммунных заболеваниях (системная красная волчанка, эозинофильный фасциит), тимоме и др.
В основе патогенеза апластической анемии лежит внутренний дефект кроветворной стволовой клетки, приводящий к нарушению ее пролиферации и дифференцировки. В реализации факторов, приводящих к изменению в стволовой клетке, имеют значение состояние кроветворного микроокружения (стромы костного мозга), а также иммунопатологические воздействия, обусловленные внешними и/или внутренними факторами.
Течение апластической анемии различно: в одних случаях заболевание возникает внезапно и быстро приводит к летальному исходу, в других протекает более латентно, особенно у лиц пожилого возраста.
Наиболее распространенной является приобретенная первичная апластическая анемия. При этой форме чаще страдают мужчины в возрасте 18-20 лет. Длительность заболевания до первичного обращения за врачебной помощью составляет в среднем от 1 до 3 месяцев. При отсутствии своевременной диагностики апластическая анемия характеризуется неуклонным прогрессированием.
Клинические проявления заболевания тесно связаны с выраженностью изменений в периферической крови (анемия, лейко- и нейтропения, тромбоцитопения) и включают 3 синдрома: анемический, геморрагический и инфекционных осложнений. Как правило, первые симптомы обусловлены анемией. Часто одновременно развивается геморрагический синдром различной степени выраженности (кровоизлияния на коже по петехиально-пятнистому типу, носовые, десневые, в более тяжелых случаях — маточные и желудочно-кишечные кровотечения, кровоизлияния в сетчатку и головной мозг). Иногда геморрагический синдром в начале заболевания настолько выражен, что дает повод к ошибочному диагнозу (это более характерно для редкой формы апластической анемии — амегакариоцитарной аплазии). Синдром инфекционных осложнений в начале заболевания возникает редко (при клинически раритетной форме апластической анемии, характеризующейся преимущественным угнетением нейтропоэза). При прогрессировании заболевания инфекционные осложнения (язвенно-некротическое поражение полости рта, миндалин, пневмония, сепсис и др.) доминируют в клинической картине и, наряду с геморрагическим синдромом, являются одной из основных причин летальных исходов.
В некоторых случаях апластическая анемия проявляется одноростковой цитопенией с соответствующей клинической симптоматикой (чаще — парциальная красноклеточная аплазия, реже — амегакариоцитарная аплазия или угнетение нейтропоэза).
При объективном исследовании больных обращает внимание мраморная бледность кожи и видимых слизистых оболочек. Увеличения селезенки, печени и лимфатических узлов не отмечается; более того, наличие органомегалии и лимфоаденопатии исключает апластическую анемию).
Диагностика апластической анемии основывается на лабораторных показателях (анализ периферической крови) и результатах морфологического исследования костного мозга.
Клинический анализ крови. У 80% больных выявляется трехростковая цитопения: гемоглобин ниже 100 г/л, нейтрофилов менее 1,5х10 9 /л, тромбоцитов менее 100,0х10 9 /л. Анемия, как правило, носит нормо- или гиперхромный характер с выраженным анизоцитозом. Важным является показатель абсолютного количества ретикулоцитов: при апластической анемии у 2/3 больных отмечается ретикулоцитопения.
Исследование миелограммы. Апластическая анемия является абсолютным показанием для стернальной пункции. Чаще всего в аспирате костного мозга выявляется снижение клеточности (уменьшение содержания миелокариоцитов) с угнетением всех ростков гемопоэза, относительный лимфоцитоз, умеренная плазмоцитарная реакция. В связи с тем, что поражение костного мозга развивается неравномерно, зоны аплазии чередуются с участками кроветворного костного мозга. В этой связи для окончательного подтверждения диагноза необходимо проведение трепанобиопсии.
Трепанобиопсия костного мозга — основной метод, позволяющий поставить подтвердить диагноз апластической анемии. При тяжелой АА в трепанобиоптате практически весь объем межбалочных пространств заполнен жировой тканью, среди клеток которой встречаются рассеянные лимфоциты, плазматические клетки, единичные тучные клетки и макрофаги с цитоплазмой, содержащей гемосидерин. При гипоплазии миелоидной ткани, которая может быть начальной фазой заболевания, на фоне жировой ткани сохраняются небольшие скопления клеток эритроидного и гранулоцитарного ростков. Мегакариоциты обычно не обнаруживаются, даже если другие ростки кроветворной ткани более или менее сохранены.
Биохимические исследования. Выполнение этих тестов не связано с диагностикой апластической анемии, но необходимо для проведения дифференциального диагноза с другими анемиями (исследование содержания сывороточного железа, свободного билирубина, свободного гемоглобина плазмы), оценки функции печени (если имеются анамнестические данные о гепатите) и почек (для контроля их функцией на фоне лечения).
Иммунологические исследования. Необходимо определение группы крови и резус-фактора, а также совместимости с донором по системе HLA для подбора компонентов крови и костного мозга (при подготовке к миелотрансплантации).
Вирусологические исследования. Обязательным является определение наличия или отсутствия антител к цитомегаловирусу (CMV). Это связано с тем, что больные, не имеющие антител к CMV, должны получать CMV-отрицательные компоненты крови. Кроме того, необходимо проведение исследований на вирусы гепатита A, B, C и ВИЧ-инфекцию.
Рентгенологические исследования. Рентгенография грудной клетки и придаточных пазух необходимы для определения очагов возможной инфекции, а также для динамического контроля при ее возникновении. У больных молодого возраста необходимо проведение рентгенологических исследований костей предплечий и кистей рук для исключения анемии Фанкони.
Ультразвуковая томография. Ультразвуковое исследование органов брюшной полости в первую очередь показано детям и больным молодого возраста для выявления аномалий развития почек, которые характерны для анемии Фанкони. Выявление при ультразвуковом исследовании увеличения селезенки и печени противоречит диагнозу апластической анемии.
Цитогенетические исследования. Цитогенетические исследования необходимы для исключения анемии Фанкони, миелодиспластического синдрома и острого лейкоза, которые характеризуются цитогенетическими аномалиями.
В соответствии с показателями периферической крови и данными трепанобиопсии выделяют следующие формы апластической анемии.
Тяжелая апластическая анемия.
Периферическая кровь (сочетание не менее двух из трех критериев): а)нейтрофилы 0,5-0,2х10 9 /л; б)тромбоциты 9 /л; в)ретикулоциты 9 /л.
Апластическая анемия средней степени тяжести: те же данные трепанобиопсии при уровне нейтрофилов более 0,5х10 9 /л, тромбоцитов более 20,0х10 9 /л и ретикулоцитов — более 1% (не менее двух из трех критериев).
При наиболее часто встречающейся приобретенной апластической анемии необходимо проводить дифференциальную диагностику с острым лейкозом, миелодиспластическим синдромом, В12–дефицитной анемией и анемией Фанкони.
Острый лейкоз в некоторых случаях проявляется различными вариантами цитопений (моно-, би- или панцитопения) без бластоза периферической крови. Поставить диагноз острого лейкоза помогают клинические данные (частая органомегалия), результаты стернальной пункции, трепанобиопсии, а также наличие цитогенетических аномалий.
Миелодиспластический синдром. Наблюдающееся у некоторых больных апластической анемией сочетание панцитопении, макроцитоза и гиперплазии эритроидного ростка в миелограмме может вызвать подозрение на миелодиспластический синдром. Постановке диагноза миелодиспластического синдрома способствуют данные трепанобиопсии (отсутствие аплазии костного мозга) и результаты цитогенетического исследования (наличие различных хромосомных аномалия).
В12 – дефицитная анемия. Во многих случаях это заболевание сопровождается развитием умеренно выраженной панцитопении в периферической крови, однако клинические (отсутствие геморрагического синдрома и инфекционных осложнений, нередкое поражение желудочно-кишечного тракта и нервной системы) и лабораторно-инструментальные данные (в периферической крови — макро- и мегалоцитоз, гигантские гиперсегментированные нейтрофилы; в миелограмме — мегалобластический тип кроветворения; результаты трепанобиопсии) позволяют верифицировать диагноз В12 – дефицитной анемии.
Анемию Фанкони необходимо исключать у детей в возрасте от 5 до 12 лет. Первый ее тип (классический тип Фанкони) характеризуется наличием грубых пороков развития скелета и внутренних органов (аномалии почек, мочеточников, половых органов, пороки сердца). Второй тип заболевания проявляется малыми аномалиями развития скелета, участками гиперпигментации кожи, задержкой роста больных. Гематологические признаки заболевания проявляются анемией и тромбоцитопенией с развитием геморрагического синдрома. Одновременно с этим развивается повышенная наклонность к инфекциям. В миелограмме количество миелокариоцитов нормальное за счет увеличения содержания клеток эритроидного ряда, выявляется повышенный уровень тучных клеток. Типично значительное увеличение содержания фетального гемоглобина. У половины больных в моче отмечается повышение уровня аминокислот, особенно пролина.
При апластической анемии терапия должна начинаться немедленно после постановки диагноза. Выделяют 4 группы методов: 1)направленные на восстановление костного мозга; 2)заместительная терапия компонентами крови; 3)профилактика и лечение инфекционных осложнений; 4)дополнительные методы лечения.
I Лечение, направленное на восстановление костного мозга включает иммуносупрессивную терапию и миелотрансплантацию.
А. Иммуносупрессивная терапия проводится одним из следующих препаратов.
1.Антилимфоцитарный (АЛГ) или антитимоцитарный глобулин (АТГ) — наиболее распространенный метод лечения больных апластической анемией при невозможности проведения трансплантации костного мозга. Оба препарата относятся к классу иммуносупрессантов. АЛГ назначается в дозе 15 мг/кг/сут в виде 8-12 часовой внутривенной инфузии ежедневно в течение 8 -10 дней; АТГ — в дозе 0,75 мг/кг/сутки, 4-5 часовой внутривенной инфузией, ежедневно в течение 8 -10 дней.
2. Циклоспорин А (сандиммун) относится к иммунодепрессантам. Механизм действия связан со специфическим и обратимым влиянием на геном стволовой клетки и торможением апоптоза. Показан при тяжелой апластической анемии, рефрактерной к терапии АЛГ или АТГ (как самостоятельный метод или в сочетании с АЛГ), а также при повышенной чувствительности к АЛГ. Препарат применяется в дозе 5-10 мг/кг/сутки в два приема. Продолжительность курса должна составлять не менее 3 месяцев (в среднем 6-12 месяцев).
3. Высокие дозы метилпреднизолона — альтернативный метод иммуносупрессивной терапии при тяжелой апластической анемии. Препарат вводится внутривенно болюсом в дозе 0,5- 1,0 г/сутки в течение 5 дней. Результаты терапии сопоставимы с терапией AЛГ/АТГ, однако высокая частота трудно контролируемого тяжелого сахарного диабета, артериальная гипертензия и инфекционные осложнения не всегда дают возможность использовать этот метод лечения.
Б. Трансплантация аллогенного костного мозга — единственный радикальный метод лечения тяжелой и очень тяжелой апластической анемии. При наличии гистосовместимого донора и отсутствии противопоказаний аллогенная миелотрансплантация должна быть проведена как можно раньше, а гемотрансфузии исключены или сведены к минимуму с целью снижения риска передачи цитомегаловирусной инфекции, гепатита В и С, а также аллосенсибилизации.
II. Заместительная терапия компонентами крови.
Показанием для переливания эритроцитов является снижение гемоглобина ниже 80 г/л и гематокрита 30%, а у лиц пожилого возраста и при наличии заболеваний сердечно-сосудистой системы — концентрация гемоглобина менее 90 г/л. С целью уменьшения аллоиммунизации предпочтительнее переливать отмытые эритроциты.
Трансфузии тромбоцитов проводятся при наличии признаков кровотечения (мелена, гематурия, кровохарканье) или кровоизлиянии в жизненно важные органы и сетчатку глаза при их уровне менее 50 х 10 9 /л. При количестве тромбоцитов ниже 20 х 10 9 /л необходимы профилактические трансфузии тромбоконцентрата 2 — 3 раза в неделю.
Несмотря на гранулоцитопению, переливания гранулоцитарной массы при апластической анемии не показаны. Это обусловлено как неэффективностью данной процедуры (после трансфузии гранулоциты находятся в циркуляции не более нескольких часов), так и высокой вероятностью развития тяжелых посттрансфузионных осложнений и аллосенсибилизации.
III. Профилактика и лечение инфекционных осложнений.
У больных апластической анемией имеется повышенный риск развития инфекционных осложнений. Вероятность развития системной или местной инфекции определяется уровнем гранулоцитов, в связи с чем выделяют группы пациентов с высоким (гранулоцитов менее 0,2х10 9 /л), умеренным (гранулоцитов от 0,2х10 9 /л до 0,5х10 9 /л) и низким риском (гранулоцитов более 0,5х10 9 /л). Больные с низким риском возникновения инфекционных осложнений не нуждаются в специальном режиме и терапии. При умеренном и высоком риске инфекции пациенты переводятся в асептические палаты, им проводится обработка кожи и полости рта дезинфицирующими растворами (хлоргексидин) и деконтаминация кишечника (неабсорбируемые антибиотики и противогрибковые препараты per os). Из пищи должны быть исключены продукты, не подвергшиеся термической обработке, а внутримышечные и подкожные инъекции — сведены к минимуму для уменьшения риска подкожных кровоизлияний и местных воспалительных процессов. Такие же мероприятия должны проводиться и у всех пациентов получающих иммуносупрессивную терапию.
Возбудителями инфекционных осложнений у больных без центральных катетеров и дренажей чаще всего является грамположительная флора, а при наличии центрального катетера — грамотрицательная.
При возникновении лихорадки у больного апластической анемией и агранулоцитозом (гранулоцитов менее 0,5х10 9 /л) показано проведение эмпирической антибактериальной терапии препаратами широкого спектра. Стандартной является комбинация аминогликозидов и цефалоспоринов III-IV поколения. Если лихорадка не купируется в течение 48 часов, даже при отсутствие микробиологического подтверждения, назначаются антистафилококковые антибиотики (ванкомицин). После купирования выявленных инфекционных осложнений и нормализации температуры антибиотики отменяются не ранее, чем через 5-7 дней. Если лихорадка возобновляется после отмены антибиотиков, высока вероятность грибковой инфекции (чаще всего вызванная грибами родов Candida и Aspergillus), в связи с чем необходимо назначение противогрибковых препаратов (амфотерицин В). Лечение грибковой инфекции проводится в течение длительного времени, а полное ее купирование даже при адекватной терапии происходит только после восстановления уровня гранулоцитов.
IV. Дополнительные методы лечения.
Андрогенные стероиды используют для стимуляции эритропоэза у пациентов, нуждающихся в постоянных трансфузиях эритроцитарной массы. Обычно применяются анаболические стероиды (оксиметанолон в дозе 200-300 мг/сутки в течение 2-3 месяцев).
Колониестимулирующие факторы (гранулоцитарный, гранулоцитарно-макрофагальный) могут назначаться с целью повышения уровня гранулоцитов у пациентов, имеющих резерв миелоидной ткани (уровень нейтрофилов более 0,5х10 9 /л). Среди других факторов роста перспективно использование интерлейкина-3, который повышает уровень нейтрофилов, а в ряде случаев также число ретикулоцитов и тромбоцитов.
Спленэктомия является дополнительным методом лечения и используется при отсутствии длительного эффекта от гемотрансфузионной терапии, в особенности при сохраняющейся тромбоцитопении.
Оценка эффективности лечения.
Полная ремиссия: гемоглобин выше 100 г/л, нейтрофилы выше 1,0х10 9 /л, тромбоциты выше 100,0х10 9 /л; больные не нуждаются в гемотрансфузиях.
Частичная ремиссия: гемоглобин более 80 г/л, нейтрофилы более 0,5х10 9 /л, тромбоциты более 20,0х10 9 /л; больные не нуждаются в гемотрансфузиях.
Клинико-гематологическое улучшение: улучшение гематологических показателей и уменьшение потребности в заместительной гемотрансфузионной терапии более чем на 2 месяца.
Отсутствие эффекта на терапию: отсутствие улучшения гематологических показателей, сохранение зависимости от гемотрансфузионной терапии.
После трансплантации аллогенного костного мозга полная ремиссия достигается у 50-80%, при иммуносупрессивной терапии — у 40-50% больных с тяжелой апластической анемией. После иммуносупрессивной терапии восстановление функции костного мозга происходит медленно, у ряда пациентов в различные сроки после лечения развивается рецидив заболевания.
Апластическая анемия (АА) – разнородная группа гематологических заболеваний, морфологическим признаком которых является панцитопения в периферической крови и глубокая гипоплазия или аплазия миелоидной ткани.
-анемический синдром(одышка при физических нагрузках, сердцебиения);
-геморрагический синдром – кожные и слизистые геморрагии, носовые, десневые, маточные кровотечения;
-синдром инфекционных осложнений – частые и тяжелые инфекции (язвенное поражение слизистых оболочек полости рта, миндалин, пневмонии, сепсис);
— отсутствуют увеличение лимфатических узлов, печени и селезегки.
-периферическая кровь – панцитопения (анемия, лейкопения, тромбоцитопения) и ретикулоцитопения;
-миелограмма — снижение общего количества миелокариоцитов, сужение всех ростков гемопоэза;
-трепанобиопсия – гипоплазия или аплазия миелоидной ткани;
-цитогенетические исследования –отсутствие цитогенетических аномалий;
Лечение: иммуносупрессивная терапия (антилимфоцитарный/антитимоцитарный глобулин, сандиммун, высокие дозы метилпреднизолона), аллогенная трансплантация костного мозга, поддерживающая терапия компонентами крови (эритроциты, тромбоциты), антибактериальная терапия.
источник
При апластической анемии анализ крови может многое рассказать, как и при любой другой форме этого заболевания. Чаще всего встречается дефицит железа, из-за чего анемия именуется железодефицитной. В целом под ней понимается заболевание, которое провоцирует дефицит железа или неправильный процесс его переработки внутри организма.
Железодефицитной анемии диагностика подтверждает, что первичным заболеванием она считаться не может. Присутствует дополнительное патологическое влияние. Дефицит железа в организме становится причиной неправильного кроветворения. Из-за железодефицита происходит неправильный гемоглобиновый синтез на базе эритроцитов. В результате количество их становится меньше, как и функциональные способности.
Диагностика анемии демонстрирует, что именно железодефицитный вариант является наиболее распространенным в мире. Чаще всего сталкиваются с ЖДА женщины, в том числе из-за беременности и кормления грудью. Кроме этого, они периодически теряют кровь, что снижает количество железа.
Анализ крови при анемии является обязательным исследованием. При этом предлагается три варианта:
- общий кровяной анализ;
- биохимия;
- анализ кала на скрытую кровь.
Рекомендации врачей говорят о том, что лучше пройти все обследования, а не выбирать какое-то одно. Говоря об общем анализе крови, показатели, определяемые при нем, помогают понять, в каком состоянии находятся все кровяные клетки. ОАК демонстрирует соотношение их объемного показателя к жидкой кровяной части. Кроме этого, определяются гемоглобиновые показатели, формула по лейкоцитам.
Биохимия – это лабораторная диагностика, помогающая понять, в каком состоянии находятся системы и внутренние органы. Такое исследование помогает определить и недостаток железа в организме, причем не только выраженный, но и скрытый, за счет определения уровня ферритина и трасферрина. Первый компонент демонстрирует, сколько в организме осталось железистых запасов. Кроме этого, демонстрируются другие показатели, сдвиги которых могут объясняться нехваткой железа.
В рамках сдачи кала на скрытую кровь можно проанализировать присутствует ли в желудке и кишечнике кровотечение. Важно отметить, что такая лабораторная диагностика предполагает особую подготовку. Речь идет об исключении из рациона за три дня до сдачи продуктов с высоким содержанием железа и медикаментов, которые предназначены для восполнения этого недостатка.
Стоит сразу отметить, что большинство анемий поддаются корректировке, особенно, если выявляются на ранней стадии. Чтобы анализы при анемии продемонстрировали правильные цифры, важно подготовиться к ним правильно. Об особенностях подготовки к сдаче калатуже упоминалось выше.
Если говорить про анализ крови при железодефицитной анемии, то здесь все несколько проще. За сутки до сдачи исключается прием любого напитка, содержащего алкоголь. Сдача крови выполняется в утренние часы после предварительного восьмичасового голодания. В этот период запрещено употреблять любую пищу или напитки, кроме негазированной воды. По согласованию с врачом исключаются любые лекарственные препараты, кроме жизненно необходимых. Препараты, в которых содержится железо, должны быть исключены за трое суток до анализа. Курение исключается за полчаса до сдачи. Важно исключить перенапряжение с физической и эмоциональной точки зрения.
Выше уже отмечалось, что анализы на анемию бывают разные, так как существуют разные типы заболевания. В большинстве случаев выполняется постановка диагноза железодефицитная анемия. В организме присутствует дефицит железа. Это может быть результатом недостаточного поступления его вместе с пищей, или результатом неправильной переработки его в организме или длительное кровотечение. Анализу и предстоит определить причину, в соответствии с которой подбирается лечение. Часто такая картина крови наблюдается у беременных или кормящих матерей, в такие моменты железо потребляется организмом в большом количестве, поэтому до анемического состояния дойти не сложно.
Чтобы дифференцировать такое состояние, обратите внимание на гемоглобин, он в таком случае демонстрируется недостаточный, сокращается эритроцитный показатель и уровень железа в сыворотке. Лечение ЖДА, называющейся также малокровием, предполагает прием железа по длительной схеме.
Встречается и гемолитическая анемия. В таком случае болезнь развивается на фоне гемолиза – эритроцитного разрушения в крови. Способствовать этому могут различные факторы. Как пример, отравление ядами, сильные нагрузки стрессового характера, болезни, передающиеся по наследству.
Для такого диагноза выполняется расшифровка анализа мочи, в которой обнаруживается гемоглобин. В крови растет показатель билирубина. Иногда присутствуют эритроциты измененной формы и другие признаки. На основе гемограммы выясняется первопричина, которую и нужно лечить.
В12 дефицитная анемия или по-другому пернициозная анемия встречается в том случае, когда фиксируется недостаток витамина В 12. Без этого витамина невозможен рост и созревание эритроцитов в костном мозге. Кроме этого, без него невозможна правильная работа системы нервной направленности.
Пернициозная анемия часто проявляет себя как покалывание и онемение, присутствующее в пальцах, походка становится шаткой. В анализах пернициозная анемия проявляет себя как повышенное количество эритроцитов с увеличенной формой. Пернициозная анемия часто встречается у пожилых людей. Можно встретить и еще одно ее название – мегалобластная анемия. Недостаточное количество В12 фиксируется при заболеваниях пищеварительного тракта, при присутствии в организме таких паразитов, как ленточные черви. Все это провоцирует диагноз мегалобластная анемия.
Встречается и так называемая злокачественная анемия, именуется которая апластической. Под такими формами анемии понимается особая группа заболеваний крови, в результате чего количество всех клеток крови снижается, а признаки опухолевого процесса отсутствуют. Это не слишком распространенное заболевание, однако поражать оно может представителей всех полов и возрастов, но чаще встречается у старшей возрастной группы. Пробелам апластической анемии заключается в том, что как минимум две трети заболевших не выживают.
Еще одна необычная форма – это серповидноклеточная анемия. Она становится следствием наследственного заболевания кровяной системы. Речь идет о дефекте, работающем на уровне генетики, в результате которого происходит нарушение формирования нормальных гемоглобиновых цепей в рамках эритроцитов. Гемоглобин, который образуется при этом, является аномальным, есть у него отличия и по свойствам электрофизиологического типа, если сравнивать с нормальным здоровым гемоглобином. В результате этого процесса фиксируют изменения самих эритроцитов, которые становятся вытянутыми в длину. Среди наследственных гемоглобинопатий СКА считается наиболее тяжелой формой. Дело в том, что эритроциты с таким изменением подвергаются быстрому разрушению в организме, часто вызывают осложнения тяжелого течения и смерть.
Гипохромная анемия – это общее название для целой группы заболеваний, на фоне которых недостаточность гемоглобина приводит к формированию другого цветового показателя крови. Расшифровка анализа в таком случае демонстрирует цифру менее 0,8, а концентрация гемоглобина в одном эритроците не дотягивает до 330 г/л. Чаще всего гипохромная анемия формируется вслед за ЖДА. Кроме этого, привести к такому диагнозу может отравление свинцом хронического порядка, недостаток витамина В6. Столкнуться с ней можно после некоторых воспалений инфекционной и неинфекционной природы, которые приводят к нарушению железистого обмена.
Если при дифференциальной диагностике железодефицитной анемии был подтвержден диагноз, важно выявить причину патологии. Выше уже отмечалось, что провоцировать ЖДА может как недостаток железа с пищей, так и неправильная его переработка организмом.
Кроме этого, нельзя исключать повышенные в количестве железа потребности организма, врожденный его недостаток, нарушение процессов всасывания или синтеза трансферрина. Влияют негативно массивные кровопотери, алкоголизм, прием ряда медикаментов.
Если говорить о недостатке железа, поступающего с пищей, то чаще всего наблюдается такая проблема при длительном голодании, у вегетарианцев, при однообразных диетах, не предполагающих большое количество животных продуктов.
Повышенная в железе необходимость является нормальным признаком, если речь идет о беременных или кормящих матерях. В такие периоды количество его с пищей должно увеличиваться. При этом если речь идет о многоплодной беременности, то цифры потребления железа должны увеличиваться еще в несколько раз.
Дети, страдающие от врожденного железистого дефицита, рождаются у матерей с тяжелой железодефицитной анемией, при многоплодной беременности или недоношенности. В таком случае с симптомами ЖДА ребенок сталкивается уже на первых неделях жизни.
Когда речь идет о неправильном всасывании железа, подразумевается работа двенадцатиперстной кишки, а именно проблемы со слизистой этого кишечного отдела. Самые разные заболевания ЖКТ становятся причиной поврежденной слизистой, что влияет на скорость, с которой железо всасывается.
Это и ряд наследственных заболеваний, в том числе целиакия, которая подразумевает непереносимость глютена. Это может быть воспаление слизистой, которая покрывает тонкий кишечник, инфекционные проблемы, гастрит атрофического типа, в результате которого сокращаются размеры слизистой, что снижает функционал.
Нельзя исключать и гастрит аутоимунного типа. Заболевание провоцируется нарушением иммунной работы и антительным производством. Атакуют они при этом собственные организменные клетки, в частности, клетки, которые покрывают слизистую желудка, на фоне чего они разрушаются. Такой диагноз может быть поставлен и людям, перенесшим удаление желудка или части тонкого кишечника. Нельзя исключать болезнь Крона, муковисцидоз и раковые проблемы.
Когда речь идет о неправильном синтезе трансферрина, то в большинстве случаев такие проблемы провоцируются разного рода наследственными заболеваниями. Трансферрин отвечает за перенос железа к различным органам, в результате страдает и красный костный мозг, так как синтезироваться эритроциты не могут. За синтез трансферрина отвечают печеночные клетки, поэтому их разнообразные поражения, могут стать причиной сокращенного количества трансферрина, что спровоцирует симптоматику ЖДА.
Повышенная потеря крови тоже может приводить к недостатку железа. При этом чаще всего подразумеваются именно хронические небольшие кровопотери. Дело в том, что одноразовые, даже массированные потери крови, такой проблемы не вызывают, поскольку в организме железо присутствует в виде запасов, которые и предназначены для возмещения таких потерь. Когда же речь идет о хронических кровотечениях внутри, которые незаметны сразу, длятся которые долго, человек может терять по миллиграмму железа каждый день и так на протяжении долгого времени.
Хроническая кровопотеря может формироваться на фоне язвенной болезни желудка или двенадцатиперстной кишки, геморрой, неспецифического язвенного колита, болезни Крона, кишечного полипоза. Влияют таким же образом опухоли ЖКТ, эндометриоз, системная красная волчанка. С таким диагнозом могут столкнуться и слишком активные доноры, которые в год сдают кровь более четырех раз. Важно обнаружить непосредственную причину кровопотери, в противном случае ЖДА для больного неизбежна.
Алкоголизм тоже не лучший друг железа. При длительном и частом употреблении алкогольных напитков повреждается слизистая желудка. Кроме этого, этиловым спиртом угнетаются процессы кроветворения, которые проходят в красном костном мозге, что усиливает анемичные проявления.
Нельзя в качестве причин появления ЖДА исключать и прием определенных медикаментов. Дело в том, что у некоторых лекарственных препаратов, нарушение процессов всасывания и железистой утилизации является побочным эффектом. Чаще всего столкнуться с такой проблемой можно при длительном курсе лечения с большими дозами препарата.
Повлиять на уровень железа могут такие популярные препараты, как противовоспалительные нестероидные средства. Дело в том, что такие препараты как бы разжижают кровь, что чревато образованием хронических внутренних кровотечений. Кроме этого, опасен их бесконтрольный прием язвенной болезнью желудка.
В группу опасных, с этой точки зрения, препаратов входят и антациды, которые сокращают или нейтрализуют скорость выделения желудочного сока. В составе его присутствует соляная кислота, которая требуется для нормального всасывания железа.
Препараты железосвязывающего характера помогают в связке и выводе железа из организма. При этом речь идет не только о свободном железе, но и о запасах организма. Говоря о симптоматике анемии, связанной с дефицитом железа, чаще всего врачами обращается внимание на бледность кожи и губ, слабость, утомляемость. На фоне недостаточности кислорода в крови повышается пульс, который превышает показатель в 90 ударов в минуту. Признаки могут варьироваться, в зависимости от вида анемии, которая вас настигла.
источник
Диагноз выставляется исходя из клинической картины, анализов крови и пункции костного мозга. Лечение в большинстве случаев предполагает пересадку здоровых стволовых клеток. Эффективность лечения зависит от множества факторов, основными из которых являются антигенная совместимость стволовых клеток донора и реципиента, внутренние резервы организма реципиента, качество посттрансплантационного ведения больного и др. Прогноз заболевания скорее отрицательный ввиду сложности нахождения подходящего донора костного мозга, высокого числа осложнений со стороны иммунной системы больного, высокой частоты развития инфекционных осложнений и острой полиорганной недостаточности.
Интересные факты
- В теле взрослого человека содержится в среднем 25 – 30 х 10 12 эритроцитов, что приблизительно равно 2 кг.
- Костный мозг производит в среднем 10 миллиардов эритроцитов в час.
- Благодаря особой форме и структуре эритроцит проходит через сосуды шириной 0,5 – 0,7 мкм.
- Впервые идея о пересадке костного мозга возникла в конце 19 века и успешно осуществилась в 1968 г. в США.
Эритроциты, или красные кровяные тельца, являются наиболее многочисленными клетками крови. Они представляют собой безъядерные клетки в форме двояковогнутого диска. При рассмотрении под микроскопом они выглядят как круги с просветлением посередине. Существуют определенные показатели нормального состояния эритроцита. В первую очередь, форма эритроцита, упомянутая выше. Измененная форма эритроцита часто указывает на определенные виды наследственных анемий. Наличие в крови измененных красных кровяных клеток различной формы называется пойкилоцитозом.
Диаметр эритроцита находится в пределах 7,2 – 7,5 мкм. Увеличение или уменьшение диаметра может свидетельствовать в пользу определенных видов анемий. Присутствие в периферической крови эритроцитов с различным диаметром именуется анизоцитозом.
Средний объем эритроцита равняется 90 мкм 3 . Длительность жизни эритроцита составляет 90 – 120 дней. Физиологическая норма количества эритроцитов и концентрации гемоглобина зависит от пола. У мужчин – 3,9 – 5,2 х 10 12 \л; у женщин – 3,7 – 4,9 х 10 12 \л. Уровень гемоглобина у мужчин колеблется в пределах 130 – 160 г\л, у женщин – 120 – 150 г\л.
Особенности структуры эритроцита
Внутри эритроцита, а точнее, в ячейках цитоскелета (комплекс белков, обеспечивающих поддержание формы клетки) содержится вещество под названием гемоглобин. Подсчитано, что в одном эритроците может находиться от 280 до 400 миллионов молекул данного вещества. Гемоглобин представляет собой белковый комплекс, состоящий из белка глобина и гемма (сложная молекула, в центре которой располагается железо). Основной функцией гемоглобина является перенос молекул кислорода к тканям и удаление из них углекислого газа. Существует несколько разновидностей гемоглобина (Hb). Гемоглобин А (HbA) является наиболее численной фракцией (95 – 98%) и представляет собой обычный гемоглобин, находящийся в кровеносной системе взрослого человека. Гемоглобин А2 (HbA2) является структурной модификацией стандартного гемоглобина и отличается некоторыми особенностями, проявляющимися в неблагоприятных условиях среды. Его количество равно 2 – 3% от общего пула эритроцитов. Гемоглобин F (HbF) – фетальная фракция, у взрослых практически отсутствует (1 – 2%), однако превалирует у новорожденных детей (70 – 90%). К концу первого года жизни эритроциты, содержащие фетальный гемоглобин, разрушаются, а их место занимают эритроциты, заполненные взрослым HbA.
Мембрана эритроцита состоит из двойного слоя липидов, пронизанных белками, выполняющими функцию транспорта ионов и поддержания оптимального электролитного равновесия. На поверхности клеточной мембраны располагается особый слой гликопротеидов, называющийся гликокаликс. Различные молекулы, входящие в его состав, играют роль рецепторов и антигенов гистосовместимости, отличающих эритроцит от других клеток организма. По приблизительным подсчетам на поверхности красных кровяных телец находится как минимум 250 видов различных антигенов, наиболее изученными из которых являются антигены системы АВ0 и резус-фактора. Согласно системе АВ0 эритроциты разделяются на 4 группы, а по резус-фактору различают две группы. Данные группы исключительно важны при переливании крови или эритроцитарной массы от доноров к реципиентам.
По системе АВ0 различают 4 группы крови:
- отсутствие агглютиногенов на поверхности эритроцитов;
- присутствие агглютиногенов А;
- присутствие агглютиногенов В;
- присутствие агглютиногенов А и В.
По резус-фактору различают 2 группы крови:
- резус-положительная (у 85% населения);
- резус-отрицательная (у 15 % населения).
Однако даже при переливании крови пациентам с одинаковой группой крови по обеим группам антигенов случаются анафилактические реакции. Данный феномен объясняется несовместимостью крови донора и реципиента по остальным типам антигенов. Учитывая различные комбинации между ними, вероятность переливания абсолютно идентичной группы крови ничтожно мала. Практически со стопроцентной вероятностью можно утверждать, что, сколько на планете людей, столько и групп крови.
Гликокаликс на поверхности мембраны здорового эритроцита имеет еще одну важную особенность – отрицательный заряд. Благодаря тому, что поверхность всех эритроцитов носит одинаковый заряд, согласно законам физики происходит их взаимное отталкивание. Более того, эндотелиоциты (клетки, выстилающие внутреннюю поверхность кровеносных сосудов) также обладают отрицательным зарядом. Таким образом, предотвращается слипание эритроцитов между собой и их прикрепление к стенкам сосудов, что, в свою очередь, снижает вероятность образования тромбов. Соответственно, при нарушении метаболизма эритроцитов или при повреждении эндотелия сосудов возрастает риск образования тромбов.
Отличительной особенностью эритроцитов является их поразительная способность проникать через сосуды, диаметр которых менее диаметра эритроцита в 2 – 3 раза. С этой целью в процессе созревания эритроцита происходит разрушение его ядра и большинства органелл. Свойство эритроцита изменять свою форму называется деформируемостью и обеспечивается устойчивой работой цитоскелета клетки. Цитоскелет является системой продольных внутриклеточных белков, которые, выстраиваясь определенным образом, придают клетке необходимую форму и способствуют ее активному передвижению. Основными структурами цитоскелета являются микротрубочки и микрофиламенты, а белки, из которых они состоят, называются актин, миозин и тубулин. При необходимости удлинения и сужения эритроцита для прохождения через узкий сосуд происходит активное нагнетание в него ионов кальция, под действием которых происходит перестроение цитоскелета. После прохождения узкой зоны происходит выход кальция из клетки, приводящий к восстановлению его формы.
Однако в определенных случаях пластичность цитоскелета эритроцитов может ухудшаться, приводя к замедленному их прохождению по микроциркуляторному руслу и даже застреванию. При прохождении через селезенку эритроциты с пониженной деформируемостью задерживаются в ее сосудах и уничтожаются клетками макрофагальной системы. Наиболее частыми причинами, ведущими к этому, являются высокие показатели гемоглобина при эритремии, повышенная жирность крови и выход ее температуры за пределы оптимальных величин.
Как и любая живая клетка, эритроцит нуждается в питательных веществах для поддержания работоспособности. Занимательно то, что клетки, переносящие кислород во все уголки тела человека, не нуждаются в нем и соответственно не потребляют его в процессе транспортировки. Образование молекул АТФ (аденозинтрифосфат), являющихся топливом для большинства ферментных систем клетки, происходит анаэробным, то есть безвоздушным путем. Таким образом, эритроциты абсолютно не чувствительны к недостатку кислорода, однако могут страдать от снижения уровня глюкозы в крови.
Помимо функции газообмена эритроциты выполняют еще ряд важных функций:
- поддержание кислотно-щелочного равновесия крови – посредством карбонатной буферной системы, второй по важности в организме.
- определение реологии крови – посредством изменения численности клеточных элементов крови по отношению к жидкой части.
- гемостаз – участие в образовании тромба в месте повреждения сосудистой стенки.
- участие в иммунных процессах – посредством специфических рецепторов к иммуноглобулинам и комплементу на мембране эритроцита.
Созревание и старение эритроцита
Первичной клеткой, из которой происходит рост и дифференцировка эритроцита, является стволовая мультипотентная клетка. Из всех клеток организма она обладает наиболее высоким потенциалом к делению и самым широким спектром возможностей к дифференцировке. Иными словами, она является клеткой предшественницей всех тканей организма, и поэтому уровень ее дифференцированности приравнивается к нулевому. При стимуляции малоизученными наукой медиаторами данная клетка трансформируется в тотипотентные клетки, способность которых к размножению также велика, а уровень дифференцированности выше. Впоследствии при дальнейшей дифференцировке тотипотентной клетки образуется колониеобразующая единица эритроцитарного ряда, иначе именуемая эритроцитарным ростком, являющимся непосредственным и первым предшественником красных кровяных телец.
По мере созревания клетки состав ее органелл значительно изменяется, среда из кислой становится нейтральной, а затем щелочной. Эти изменения соответствуют стадиям проэритробласта и эритробласта. Непосредственным предшественником эритроцита является ретикулоцит. Данная клетка в начале своего развития располагается в костном мозге в течение 24 – 30 часов, после чего выходит в кровеносное русло и дозревает в течение 36 – 44 часов. Отличительной особенностью данных клеток является больший размер по сравнению с эритроцитом, скопления распавшегося ядра в виде небольших включений, незначительная сине-фиолетовая исчерченность. По мере полного созревания ретикулоцита его размер уменьшается за счет удаления из клетки остатков ядра и органелл, связанных с синтезом веществ. Освободившееся место занимается молекулами гемоглобина, располагающимися в ячейках цитоскелета. В сформировавшемся эритроците еще в течение некоторого времени происходит синтез гемоглобина из остаточных цепей матричной РНК. По мере ее распада все синтетические процессы замирают, и эритроцит переходит в режим полноценной работы и параллельного поддержания жизнеспособности.
Регуляция роста и дифференцировки всех клеток эритроидного ряда осуществляется при непосредственном влиянии эритропоэтина. Данное вещество является одним из гормонов, синтезируемых почками. Точкой приложения его действия является проэритробласт. Регуляция осуществляется по механизму обратной связи. Иными словами, при снижении количества эритроцитов или гемоглобина в периферической крови происходит компенсаторный выброс эритропоэтина и наоборот – при высокой концентрации гемоглобина и эритроцитов образование эритропоэтина приостанавливается. Эритропоэтин стимулирует рост, размножение и дифференцировку клеток эритроидного ряда, непосредственно воздействуя на них. Косвенная регуляция скорости эритропоэза (процесс образования эритроцитов в костном мозге) осуществляется посредством фактора стволовых клеток, интерлейкиа-3, витамина В12, микроэлементов (цинк, медь, железо, селен и др.), гормонов (соматостатин, тироксин, кортикостероиды и половые гормоны).
По прошествии 90 – 120 дней ферментные системы эритроцита постепенно изнашиваются, в результате чего размеры эритроцита уменьшаются, а содержание гемоглобина остается без существенных изменений. В результате происходит относительное повышение вязкости цитоплазмы, при котором относительная концентрация гемоглобина составляет 360 – 380 г\л. Возрастает и плотность эритроцита, которая отражается в снижении его деформируемости. При прохождении через узкие сосуды селезенки старые непластичные эритроциты застревают в них, поглощаются и разрушаются макрофагами.
Лейкоциты, или белые кровяные тельца, изначально были выделены в отдельную подгруппу, поскольку содержали ядро и не имели собственной окраски. Данный тип клеток подразделяется на множество видов по форме и выполняемой функции. Их деятельность можно резюмировать в обеспечении активных и пассивных иммунных реакций организма. На поверхности лейкоцитов находятся два комплекса гистосовместимости. Первый хранит информацию о собственных тканях организма, препятствуя их разрушению. Второй содержит информацию об антигенах чужеродных веществ, которые когда-либо попадали в организм, для того чтобы при встрече незамедлительно их атаковать.
Лейкоциты обладают способностью к самостоятельному передвижению в направлении увеличения концентрации определенного вещества. Такое движение называется хемотаксисом. Веществами, притягивающими лейкоциты, являются биологически активные соединения, высвобождающиеся при разрушении любых других лейкоцитов в процессе борьбы с патогенными бактериями, простейшими, грибками и вирусами, попавшими в организм. Физиологическая норма лейкоцитов 4 – 9 х 10 9 \л.
Длительность жизни лейкоцитов разнообразна и зависит преимущественно от функции, которую выполняет клетка. В среднем она колеблется от нескольких десятков дней до нескольких десятков лет. Образование лейкоцитов происходит в красном костном мозге из общего лейкоцитарного ростка. Первичное обучение, в процессе которого лейкоциты приобретают первый комплекс гистосовместимости, осуществляется в тимусе. Вторичное обучение, в процессе которого лейкоциты приобретают второй комплекс гистосовместимости, осуществляется в периферических лимфатических узлах.
Тромбоциты являются третьей и последней разновидностью клеточных элементов крови. Сразу же необходимо заметить, что тромбоциты не являются самостоятельными клетками. Их образование происходит также в красном костном мозге из клеток, называемых мегакариоцитами. Мегакариоцит представляет собой наиболее крупный кроветворный росток по сравнению с эритроцитарным и лейкоцитарным. В диаметре он может достигать 20 – 25 мкм. В центре мегакариоцита располагается крупное ядро. В цитоплазме синтезируется большой спектр биологически активных веществ, которые впоследствии становятся содержимым тромбоцита. Клеточная мембрана образует множество выростов, края которых постоянно отрываются. Мембраны оторвавшихся фрагментов смыкаются, образуя то, что, по сути, и является тромбоцитом.
Тромбоцит выполняет преимущественно функцию гемостаза – сохранения целостности кровеносного русла. Он первый среди остальных клеточных элементов реагирует на повреждение сосудистой стенки и образует первичный тромб, к усилению которого впоследствии привлекаются лейкоциты и эритроциты. Располагаясь непосредственно над сосудистым дефектом, тромбоциты формируют мелкую сеть, в которую попадают эритроциты и лейкоциты. Таким образом образуется сгусток. По мере закрытия сгустком всей поврежденной поверхности тромбоциты выделяют определенные вещества, приводящие к стягиванию сети и ретракции сгустка. При этом из него удаляется большая часть жидкости, а сам тромб становится плотнее.
По данным последних исследований обнаружена еще одна важнейшая функция тромбоцитов, которая заключается в стимуляции процессов роста и регенерации тканей в поврежденной области. Таким образом, тромбоцит играет роль не только в обеспечении гемостаза, но еще и в росте и функциональном восстановлении поврежденных тканей. Физиологическая норма тромбоцитов находится в пределах 180 – 320 х 10 9 \л.
По происхождению апластические анемии делятся на:
- врожденные;
- приобретенные.
В большинстве случаев наблюдается угнетение всех трех ростков кроветворения, однако клинически замечено, что в различные фазы болезни может наблюдаться более выраженное угнетение какого-то одного из ростков. В подтверждение этому был проведен ряд экспериментов, в результате которых было продемонстрировано различное по выраженности эффекта влияние разнообразных неблагоприятных факторов на костный мозг.
По преимущественному поражению костномозговых ростков выделяют:
- угнетение одного кроветворного ростка (эритроцитарного, лейкоцитарного или тромбоцитарного);
- угнетение двух кроветворных ростков;
- угнетение трех кроветворных ростков.

Наиболее распространенным видом врожденной апластической анемией является анемия Фанкони. Непосредственной причиной заболевания является повышенная чувствительность ДНК клеток к повреждающим агентам. Данное заболевание наследуется по аутосомно-рецессивному типу. Это значит, что, для того чтобы оно проявилось, необходимо, чтобы у обоих родителей присутствовал дефект причинного гена. Лишь только в подобном случае вероятность развития клинических признаков заболевания у ребенка составляет приблизительно 25%. Соответственно, предотвратить данное заболевание можно, если заранее знать, что в роду обоих родителей имелись больные данным типом анемии, и предостеречь данную пару от зачатия ребенка.
Различают следующие причины приобретенных апластических анемий:
- ионизирующее излучение;
- лекарственные препараты (декарис, анальгин, левомицетин, тетрациклин, бутадион и др.);
- химические соединения (пестициды, бензол);
- заболевания (вирусные гепатиты А, В и С, вирус Эпштейн-Барр, цитомегаловирус, вирус герпеса, ВИЧ, парвовирус В19 и др.).
- гормональные нарушения со стороны яичников, щитовидной шелезы и вилочковой железы.
Различают следующие теории патогенеза апластической анемии:
- стромальная;
- аутоиммунная;
- преждевременный апоптоз.
Доказано, что рост и созревание клеток костного мозга невозможен без влияния факторов, вырабатываемых стромой. Строма является скоплением соединительнотканных клеток, образующих своего рода «скелет» или «ложе» в котором залегают клетки костного мозга. Строма вырабатывает такие вещества как ИЛ (интерлейкины) 1, 3 и 6 и фактор стволовых клеток. Данные вещества направляют развитие клеток предшественников в то или иное русло на различных стадиях их развития.
В 15 – 20% случаев апластических анемий причинной их развития становится недостаточное формирование и выделение стромальных факторов роста. По этой причине дифференцировка клеток крови останавливается на определенной стадии развития. В костном мозге при специальном исследовании можно обнаружить скопление предшественников клеток крови. В периферической крови отмечается увеличение эритропоэтина, который в норме влияет на строму костного мозга.
Апоптоз является физиологическим процессом, при котором происходит самостоятельное разрушение клеток с определенными мутационными аномалиями или клеток, изживших отведенный им срок. Посредством апоптоза организм защищается от накопления мутаций и вызванных этим осложнений преимущественно опухолевого происхождения. Однако апоптоз может стать и патологическим процессом, когда будет приводить к преждевременному саморазрушению клеток. Причина преждевременного апоптоза заключается в мутации гена, синтезирующего белок Р-450.
Несмотря на существование нескольких успешных теорий развития апластических анемий, в научном мире по-прежнему ведутся многочисленные исследования в данном направлении. Однако для практикующего врача, и тем более для пациента, поиск механизма, по которому происходит развитие заболевания, практически никогда не имеет смысла. Это связано с тем, что на сегодняшний день не существует более или менее эффективных препаратов, помимо стероидных гормонов, способных замедлить прогрессию анемии или хотя бы частично ее компенсировать. К тому же, наиболее эффективным лечением сегодня является трансплантация костного мозга. Поэтому изучение механизма развития апластической анемии имеет исключительно научный интерес.
Редкая врожденная апластическая анемия с тяжелым течением, диагностируемая в возрасте от 4 до 10 лет. Поражает с одинаковой частотой мужской и женский пол. Развивается по причине высокой подверженности ДНК клеток тела, и костного мозга в частности, к различного рода мутациям. Клинически проявляется тремя вышеперечисленными синдромами. Степень выраженности симптомов болезни имеет волнообразный характер с периодами ремиссий и обострений. Отмечается высокий риск развития злокачественных опухолевых процессов.
До 80% больных рождаются со следующими телесными аномалиями:
- Со стороны мышечно-костной системы — добавочные, отсутствующие или сращенные пальцы, недоразвитие или отсутствие лопаток, незаращение твердого неба (волчья пасть, заячья губа), отсутствие ушных раковин, деформация хрящей носа, добавочные позвонки, сколиоз и др.
- Со стороны нервной системы — микроэнцефалия или анэнцефалия, макроцефалия, спинномозговые грыжи, слепота, глухота, миастения, парапарезы и тетрапарезы, умственная отсталость.
- Со стороны мочеполовой системы — недоразвитие или отсутствие почек, добавочные почки, почечный поликистоз, S-образная почка, подковообразная почка (сращение одного из полюсов) эктопия мочеточников, экстрофия (выворот) мочевого пузыря, агенезия (отсутствие развития) матки, двурогая матка, полное заращение девственной плевы, анорхия (отсутствие яичек), агенезия уретры и пениса и др.
- Со стороны сердечно-сосудистой системы — незаращение овального отверстия и межпредсердной перегородки, открытый баталов проток, стенозы аорты на различных уровнях, инверсия магистральных сосудов сердца и др.
- Со стороны пищеварительной системы — стенозы и аневризмы кишечника, дивертикулез, атрезия кишечника (слепо заканчивающийся кишечник), бронхопищеводные свищи на различных уровнях.
Данный тип анемии считается парциально пластическим, поскольку проявляется угнетением исключительно эритроцитарного ростка костного мозга без вовлечения лейкоцитарного и тромбоцитарного ростков. Заболевание носит семейный характер и может проявиться, если хотя бы один родитель болен им. Поскольку заболевание является аутосомно-доминантным, то вероятность проявления колеблется в пределах 50 – 100% в зависимости от комбинации генов родителей.
Непосредственная причина заболевания – низкая чувствительность клеток костного мозга к эритропоэтину. Клинически наблюдается только анемический синдром. Замечена высокая вероятность развития острых лейкозов. В большинстве случаев определяются антитела к эритрокариоцитам, поэтому часто эффективным оказывается иммуносупрессивное лечение. Поддерживающее лечение осуществляется посредством регулярных переливаний эритроцитарной массы.
Наиболее ценными дополнительными исследованиями являются:
- общий анализ крови (ОАК);
- биохимический анализ крови (БАК);
- стернальная пункция;
- трепанобиопсия.
Данные общего анализа крови при апластической анемии свидетельствуют в пользу панцитопении (снижение количества всех трех типов клеток костного мозга). Уменьшение количества лейкоцитов наблюдается преимущественно за счет снижения гранулоцитов (нейтрофилы, эозинофилы и базофилы). Таким образом, относительно увеличивается процент лимфоцитов и моноцитов в лейкоцитарной формуле. На различных стадиях заболевания могут быть выявлены воспалительные признаки в той или иной мере.
Ориентировочными показателями ОАК при апластической анемии являются:
- Гемоглобин (Hb) – менее 110 г\л (норма 120 – 160 г\л). Уменьшение за счет снижения числа эритроцитов.
- Эритроциты – 0,7 – 2,5 х 10 12 \л (норма 3,7 х 10 12 \л). Снижение количества зрелых эритроцитов.
- Ретикулоциты — менее 0,2% (норма 0,3 – 2,0%). Снижение количества молодых форм эритроцитов.
- Цветовой показатель – 0,85 – 1,05 (норма 0,85 – 1,05) свидетельствует о нормохромном характере анемии (содержание гемоглобина в эритроците в пределах нормы).
- Гематокрит (Ht) – менее 30 (норма 35 – 42 у женщин и 40 – 46 у мужчин). Соотношение клеточного состава крови к ее жидкой части. Наблюдается явное уменьшение доли клеток в периферической крови.
- Тромбоциты – менее 35 промилле или 100 х 10 9 \л. Снижение количества тромбоцитов.
- Лейкоциты – 0,5 – 2,5 х 10 9 \л (норма 4 – 9 х 10 9 \л). Выраженная лейкопения за счет снижения числа гранулоцитов (нейтрофилы, эозинофилы и базофилы).
- Палочкоядерные нейтрофилы – 0 – 2% (норма менее 6%). Снижение выработки молодых форм лейкоцитов.
- Сегментоядерные нейтрофилы – 0 – 40% (норма 47 – 72%). Снижение количества зрелых форм нейтрофилов.
- Миелоциты – 0 – 2% (в норме отсутствуют). В условиях гранулоцитопении и наслоения бактериальной инфекции наблюдается более выраженный, чем обычно, сдвиг лейкоцитарной формулы влево с появлением клеток предшественников лейкопоэза.
- Эозинофилы – 0 – 1% (норма 1 – 5%). Снижение количества эозинофилов.
- Базофилы – 0% (норма 0 – 1%). Единичные или полное отсутствие базофилов.
- Лимфоциты – более 40% (норма 19 – 37%). Численное количество лимфоцитов остается в норме. За счет снижения фракции гранулоцитов наблюдается относительный лимфоцитоз (увеличение доли лимфоцитов в крови). Крайне выраженный лимфоцитоз может наблюдаться при наслоении вирусных инфекций.
- Моноциты – более 8% (норма 6 – 8%). Количество моноцитов неизменно и находится в пределах нормы. Моноцитоз (увеличение доли моноцитов в крови) объясняется снижением процентной доли гранулоцитов в лейкоцитарной формуле.
- Скорость оседания эритроцитов – более 15 – 20 мм\час (норма до 10 мм/час у мужчин и до 15 мм/час у женщин). Данный показатель отражает степень выраженности воспалительной реакции в организме.
- Анизоцитоз – наличие в крови эритроцитов различного размера.
- Пойкилоцитоз – наличие в крови эритроцитов различной формы.
Некоторые виды биохимических анализов крови могут акцентировать внимание врача на отклонениях в организме, которые косвенно вписываются в три вышеперечисленных анемических синдрома.
Ориентировочными показателями БАК при апластической анемии являются:
- Сывороточное железо более 30 мкмоль\л (норма 9 – 30 мкмоль/л). Увеличение сывороточного железа на фоне частых переливаний крови. Высокий риск развития гемохроматоза.
- Эритропоэтин более 30 МЕ\л (норма 8 – 30 МЕ/л у женщин и 9 – 28 МЕ\л у мужчин). Увеличение эритропоэтина происходит по двум причинам. Во-первых, не происходит его потребления клетками эритроцитарного ростка. Во-вторых, компенсаторно усиливается его синтез в ответ на анемию.
- НBs-АГ и анти HBcor иммуноглобулины G – положительны (в норме — отрицательны). Данный анализ указывает на наличие вирусного гепатита В. В ряде случаев данный вирус провоцирует развитие аутоиммунной реакции против клеток костного мозга.
- С-реактивный белок – более 10 – 15 мг\л (норма 0 – 5 мг\л). Выявляется при воспалительной реакции на фоне ослабленного иммунитета.
- Тимоловая проба – более 4 (норма 0 — 4). Выявляет признаки воспаления при ослабленном иммунитете.
Данный вид исследования используется с целью визуализации клеток костного мозга и их процентного соотношения. Пункция осуществляется в процедурном кабинете с применением стерильного инструментария и обезболивающих препаратов, преимущественно ингаляторного действия. Обработка места прокола осуществляется попеременно несколькими антисептическими растворами. Пациент находится в положении лежа на спине. Для пункции используются специальные широкие иглы с ограничителем глубины ввода. Шприц и поршень должны обеспечивать достаточный уровень компрессии, поэтому предпочтительнее использовать стеклянные шприцы с железным поршнем. Классически прокол осуществляется в теле грудины на уровне 2 – 3 ребра медленными вращательными движениями до ощущения провала. Резкое прободение повышает риск соскальзывания иглы с грудины и ранение органов грудной полости. После ощущения провала игла фиксируется одной рукой, а второй рукой производится тракция стержня шприца. Забор пунктата осуществляется до отметки 0,3 – 0,5 мм, после чего иглу извлекают, а отверстие заклеивают лейкопластырем. При отсутствии пунктата в месте прокола пункцию выполняют повторно на несколько сантиметров ниже. После пункции пациент должен продолжать находиться в горизонтальном положении под наблюдением медицинского персонала еще в течение 30 минут.
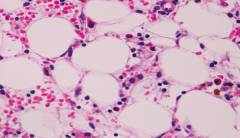
После извлечения шприца выполняется его опорожнение на несколько предметных стекол, из которых впоследствии будут изготовлены 10 – 15 мазков. Мазки фиксируются, окрашиваются и исследуются согласно соответствующим методикам. Результат исследования именуется миелограммой. Миелограмма отражает фактический и относительный клеточный состав костного мозга.
При апластической анемии миелограмма будет скудной, количество клеточных элементов значительно снижено. Камбиальные клетки эритроцитарного и лейкоцитарного ряда единичны или отсутствуют. Мегакариобласты отсутствуют. В редких случаях при пункции случается встретить сгруппированные очаги повышенной пролиферации клеток как компенсаторную реакцию здорового костного мозга на анемию. Такая миелограмма может сбить с толку, поскольку будет свидетельствовать в пользу отсутствия апластической анемии и поэтому будет ложноотрицательной.
Трепанобиопсия является способом изъятия части костного мозга из крыла подвздошной кости пациента. Преимущество данной процедуры над стернальной пункцией заключается в возможности забора большего количества материала с сохранением его структуры. Большее количество материала уменьшает вероятность ложноотрицательного результата апластической анемии, а изучение структуры костного мозга позволяет помимо цитологического исследования (миелограммы) провести еще и гистологическое.
При трепанобиопсии пациент находится в положении лежа на животе. Иглы для проведения данной процедуры схожи с иглами при стернальной пункции, но больше в размерах. Обезболивание и техника забора материала идентична вышеописанной. Результаты трепанобиопсии повторяют результаты стернальной пункции. Вдобавок к этому определяется увеличение процентной доли стромы по отношению к кроветворным клеткам, а также увеличение доли желтого неактивного костного мозга по отношению к красному активному.
При помощи анализа крови и результатов трепанобиопсии возможно определение степени тяжести апластической анемии.
Апластическая анемия средней тяжести определяется следующими показателями:
- гранулоциты менее 2,0 х 109\л;
- тромбоциты менее 100 х 109\л;
- ретикулоциты менее 2 – 3%;
- гипоплазия костного мозга на трепанобиопсии.
Апластическая анемия тяжелой степени определяется следующими показателями:
- гранулоциты менее 0,5 х 109\л;
- тромбоциты менее 20 х 109\л;
- ретикулоциты менее 1%;
- аплазия костного мозга на трепанобиопсии.
Апластическая анемия крайне тяжелой степени определяется следующими показателями:
- гранулоциты менее 0,2 х 109\л;
- тромбоциты единичные или отсутствуют;
- ретикулоциты единичные или отсутствуют;
- аплазия костного мозга на трепанобиопсии.

Медикаменты являются неотъемлемой частью лечения апластической анемии. Наиболее часто используются три группы препаратов — иммунодепрессанты (дексаметазон, метилпреднизолон и др.), цитостатики (циклофосфан, 6-меркаптопурил, циклоспорин А, метотрексат, имуран и др.) и антибиотики (цефалоспорины, макролиды, азалиды, хлорхинолоны и др.). Реже могут использоваться препараты для коррекции артериального давления, нарушений перистальтики микрофлоры кишечника, ферментные препараты и др.
Иммуносупрессоры могут быть использованы в виде монотерапии лишь в начальных стадиях заболевания и в процессе диагностики. Цитостатики при апластической анемии могут применяться в комбинации с иммуносупрессорами. Также важным их предназначением является очистка концентрата стволовых клеток от примесей злокачественных клеток. Антибиотики применяются во всех стадиях заболевания с целью лечения сопутствующих инфекционных осложнений, возникающих на фоне ослабленного или даже отсутствующего иммунитета.
По мере прогрессирования панцитопении возникает необходимость в трансплантации костного мозга – единственного радикального способа излечения апластической анемии. Проблема заключается в том, что для пересадки необходим донор, который предоставит костный мозг совместимый или хотя бы частично совместимый по антигенному составу с костным мозгом реципиента. Нахождение донора может занять длительное время, которым больной в большинстве случаев не располагает. В таких случаях пациенту осуществляются переливания цельной донорской крови или ее компонентов с целью поддержания компенсированного состояния его здоровья.
В данном разделе необходимо указать, что операция, как таковая, производится только донору костного мозга. Реципиент не оперируется. На протяжении десятилетий с момента первой трансплантации костного мозга в 1968 году изучались различные способы введения в организм больного стволовых клеток. Из всех методов наиболее эффективным оказалось внутривенное их введение. Именно по этой причине в дальнейшем операция при апластической анемии будет именоваться трансплантацией стволовых клеток.
Существуют следующие виды трансплантации стволовых клеток:
- аллогенная трансплантация костного мозга;
- аллогенная трансплантация периферических стволовых клеток крови;
- аутологичная трансплантация пуповинной крови;
- аутологичная трансплантация костного мозга;
- аутологичная трансплантация периферических стволовых клеток крови;
- сингенная трансплантация костного мозга.
Данный вид лечения подразумевает извлечение костного мозга донора и трансплантацию его больному реципиенту. Выполнение данной процедуры является технически сложным процессом и подразумевает соблюдение определенных правил.
В первую очередь донор должен быть совместим с организмом реципиента по трем антигенам в двух комплексах гистосовместимости HLA. В итоге ожидается полное сходство донора и реципиента по 6 антигенам. Минимальным порогом, при котором может осуществиться трансплантация является совпадение по 4 из 6 антигенов, однако в этом случае риски различного рода осложнений возрастают в несколько раз. По приблизительным подсчетам только в 30% случаев среди ближайших родственников больного отыскиваются доноры, полностью совместимые по всем 6 антигенам. Не имеет значения ни возраст, ни пол донора. Самым молодым донором в мире являлся четырехмесячный ребенок с весом тела 3,6 кг.
Операция по извлечению костного мозга является модификацией трепанобиопсии с некоторыми изменениями. В первую очередь данное вмешательство значительно более болезненно, поэтому обязательно использование общей или эпидуральной анестезии. Использующиеся иглы обладают большим диаметром. Пункция выполняется от 10 до 20 раз в гребешок каждой подвздошной кости. Количество забираемого материала значительно выше и составляет 10 – 15 мл на килограмм массы тела донора. Таким образом, у донора весом 70 кг будет взято количество костного мозга равное 700 – 1050 мл. Осложнения после подобной процедуры развиваются менее чем в 1% случаев. Подавляющее большинство осложнений связано с анестезией и острой сердечной недостаточностью при массивной кровопотере.
В дальнейшем полученный костный мозг медленно переливается в организм реципиента при помощи внутривенного доступа. Однако подобные случаи достаточно редки, и чаще костный мозг получается из специальных банков-хранилищ биологических материалов. Данные банки пополняются донорами по всему миру. На сегодняшний день насчитывается более 50 национальных банков-хранилищ биологических материалов и более 4 миллионов доноров по всему миру. После выделения костного мозга его необходимо сохранить на длительное время. Для этого он помещается в специальный раствор, не образующий кристаллов льда при замораживании и размораживании. Темпы охлаждения равняются 3 градусам в минуту. При температуре -85 градусов стволовые клетки сохраняются в течение 6 месяцев. При температуре -196 градусов стволовые клетки сохраняются в течение десятков лет. При необходимости использования стволовые клетки размораживаются при температуре 44 – 45 градусов.
Перед введением взвеси стволовых клеток производится их обработка цитостатиками с целью уничтожения примеси злокачественных клеток. Длительный период после трансплантации пациент должен получать интенсивную иммуносупрессивную терапию с целью предотвращения отторжения трансплантата и других нежелательных иммунных реакций.
Несмотря на то, что наиболее распространенным способом добывания стволовых клеток из организма донора является вышеописанная операция, в последние годы активно исследуется метод получения стволовых клеток из периферической крови. Его суть заключается в отделении определенный видов клеток при помощи физического явления, называемого лейкаферезом, с последующей фильтрацией крови в специальных клеточных сепараторах. В данном случае источником стволовых клеток является донорская кровь. После извлечения она обогащается рекомбинантными факторами роста, что приводит к ускорению темпов деления стволовых клеток и увеличению их количества.
Такой метод имеет ряд преимуществ. Во-первых, его побочные эффекты такие же, как при обычном заборе донорской крови. Во-вторых, не страдает костный мозг донора, который при операции должен восстанавливаться в течение как минимум полугода. В-третьих, после трансплантации добытых таким образом стволовых клеток реже развиваются побочные иммунные реакции.
Трансплантация стволовых клеток производится от донора, которым является гомозиготный (однояйцевый) близнец больного. Антигены на поверхности клеток их организмов идентичны, поэтому такой трансплантат не вызовет реакции отторжения и приравнивается к аутологичному.
После проведенной пересадки стволовых клеток пациент должен находиться под бдительным контролем медицинского персонала. Обязательно проведение активной иммуносупрессивной терапии. Низкий иммунитет больного подразумевает его нахождение в специализированных стерильных палатах с замкнутой системой вентиляции, бактериальными фильтрами и т. п. Перед тем как войти в палату медицинский персонал должен быть одет в стерильные костюмы и пройти через санпропускник.
Суть данного осложнения заключается в конфликте иммунных клеток организма хозяина со свежесформированными иммунными клетками донорских стволовых клеток. При этом донорские лимфоциты проявляют выраженную агрессию по отношению к лимфоцитам хозяина. Клинически это проявляется обильной сыпью, кожными буллами, язвами, нарушением функций желудочно-кишечного тракта, сердечно-сосудистой системы и т. д.
Данное осложнение развивается исключительно при пересадке костного мозга или стволовых клеток от аллогенного донора. При пересадке собственных, замороженных ранее стволовых клеток, такое осложнение не развивается. Данное осложнение происходит при полной совместимости костного мозга донора и реципиента по всем 6 антигенам в 30% случаев. При частичной совместимости риск такого осложнения возрастает до 80%. С целью профилактики данной патологической реакции применяются цитостатики. Наиболее часто препаратом выбора является циклоспорин А в паре с одним из следующих препаратов — метотрексат, имуран или глюкокортикоиды (дексаметазон, метилпреднизолон и др.)

Врожденная апластическая анемия Фанкони в большинстве случаев крайне тяжело поддается лечению, поскольку костный мозг никогда не был здоровым и, соответственно, очень сложно восстанавливается. Наличие врожденных аномалий развития сильно ограничивает показания к пересадке костного мозга таким пациентам. В большинстве случаев больные погибают в детском возрасте от аномалий развития или инфекционных осложнений.
Приобретенные апластические анемии имеют более благоприятный прогноз, поскольку в некоторых случаях являются обратимыми после прекращения действия повреждающего фактора на костный мозг.
Применение методов консервации пуповинной крови, стволовых клеток костного мозга и периферической крови повышает шансы на полное выздоровление до 75 – 80%.
источник