На сегодняшний день существует множество различных нарушений в функционировании кровеносной системе человека, которые имеют отличные друг от друга причины возникновения, по-разному проявляются клинически. Различны и прогнозы протекания таких заболеваний. Одним из примеров таких заболеваний является апластическая анемия.
Когда человек впервые сталкивается с диагнозом апластическая анемия, естественно, у него сразу возникает вопрос, что это такое? В основе данного заболевания (другое его название – панмиелофтиз) лежит резкое угнетение процессов кроветворения в красном костном мозге, что клинически проявляется в уменьшении в крови содержания форменных ее клеток – эритроцитов, лейкоцитов и тромбоцитов.
Процент выявления апластической анемии среди населения относительно низок и частота выявленных случаев составляет всего 0,5 на 100 тысяч населения. Этот вид анемии не зависит от пола больного человека, но возможно установить некоторую зависимость от возраста.
Начиная с рождения и до 20 лет частота выявленных случаев среди этой возрастной категории постепенно увеличивается; в категории пациентов возрастом от 20 до 55 лет она сохраняется на одном уровне, а вот после 55 лет резко возрастает.
Согласно последним исследованиям в этой области, у небольшой группы пациентов была установлена генетическая предрасположенность к развитию апластической анемии.
Летальный исход наступает у более, чем половины больных. Некоторые источники отмечают, что этот процент достигает отметки 80.
Согласно МКБ 10-го пересмотра апластическая анемия входит в группу «другие анемии» под кодом D61.
В зависимости от клинической картины проявления заболевания различают:
- Наследственные апластические анемии. Данные патологии приводят к тотальному поражению системы кроветворения. Среди данного вида анемий выделяют два подвида:
- анемии Фанкони – если основное заболевание сопровождается формированием врожденных пороков развития;
- анемии Эстрена – Дамешека – если врожденные пороки отсутствуют;
- анемия Даймонда – Блекфена – форма анемии, при которой отмечается нарушение продукции только эритроцитарных клеток крови, обусловленное генетическими факторами.
- Приобретенные апластические (или гипопластические) анемии. Здесь также различают подвиды:
- формы анемий, которые характеризируются острым, подострым или хроническим процессом угнетения общего кроветворения;
- парциальная (красноклеточная) анемия – угнетается процесс формирования только эритроцитов.
Причины апластической анемией следующие:
- Наличие внешних факторов, которые обладают миелотоксическим эффектом, то есть провоцируют цитостатические нарушения свертываемости крови. Сюда относятся и различные заболевания инфекционной и вирусной природы, и действие ионизирующего излучения, и некоторые лекарственные препараты (анальгин, противотуберкулезные препараты, некоторые виды антибиотиков), а также препараты, применяемые в химиотерапии.
- Эндогенные, то есть внутренние, причины апластической анемии – накопление токсических веществ в результате внутренних нарушений и эндокринных сдвигов, например, в случае развития гипотериоза, уремии.
- Аутоагрессия, когда у больного развивается индивидуальная чувствительность к антигенам и появляются антитела в крови.
- Идиопатические формы апластической анемии. Различают у половины больных, диагностируют в случае, если установить причину развития заболевания не удалось.
На современном этапе специалистам удалось изучить в наибольшей степени только врожденные виды апластических анемий. Так, в случае диагностирования анемии Фанкони причина заключается в изменениях в парных хромосомах I и VII. При анемии Даймонда – Блекфена мутируют гены хромосом I, XVI, XIX, и XIII. Свою роль в этих процессах может сыграть воздействие на организм свободных радикалов.
Современной медицине пока окончательно не известны механизмы и причины, которые приводят к формированию недоразвития костного мозга.
Выделяют несколько процессов развития апластической анемии:
- Развитие в организме процессов, приводящих к поражению стволовых клеток костного мозга.
- Действие защитных механизмов организма (клеточных, под влияние гормонов), в результате которого процессы образования клеток крови подавляются.
- Различные виды нарушений функционирования элементов микроокружения костного мозга (остеогенные, жировые клетки, макрофаги и другие).
- Недостаток в организме факторов, которые активизируют процессы кроветворения.
- Случаи, когда концентрация необходимых для кроветворения веществ сохраняется на должном уровне (в частности, железо в крови, витамин В12, протопорфирин), но они не усваиваются кроветворной тканью.
В случае развития у человека апластической анемии и поражения костного мозга, происходит разрушение клеток крови различной степени зрелости, но, в первую очередь, страдают эритроциты. Нарушается не только средний объем эритроцитов, но также уменьшается и длительность жизнедеятельности зрелых форм.
Заболевание анемии сопровождается нарушениями процессов выведения излишков железа, которое кумулируется в печени и селезенке.
Из-за понижения лейкоцитов в крови происходят сбои в работе иммунной системе организма. Снижением концентрации тромбоцитов в крови объясняется нарушение процессов свертываемости крови.
Повышение лимфоцитов, Отмечается «опустошение» костного мозга (панмиелофтиз).
Поскольку в крови снижается количество зрелых эритроцитов, это приводит к развитию хронической гипоксии в тканях, что влечет за собой дистрофические изменения внутренних органов. В первую очередь очень чувствительны к гипоксии (кислородное голодание) эндокринные железы.
В зависимости от того, насколько выражены нарушения процессов кроветворения, клинические проявления и симптомы апластической анемии очень разнообразны: различают переходные формы апластической анемии от частичного угнетения процессов образования клеток крови до выраженного недоразвития костного мозга.
В течении заболевания выделяют 3 основных синдрома апластических анемий:
- цитопенический;
- септико – некротический;
- геморрагический.
Эти синдромы анемии могут по-разному проявляться в организме человека в зависимости от степени развития заболевания. Различают 3 этапа развития болезни, при этом симптомы апластической анемии на каждом из них разнятся.
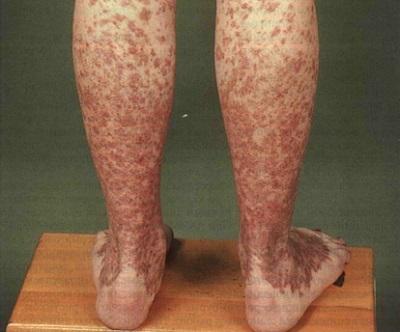
I этап характеризируется проявлением неспецифических симптомов, которые могут быть при любом другом патологическом процессе, — хроническая усталость и общая слабость. Очень часто больные приспосабливаются к существующей у них анемии и обращаются к специалисту только тогда, когда заболевание начнет прогрессировать. Также этот этап характеризуется такими проявлениями геморрагического синдрома, как маточное, носовое кровотечение и повышенная склонность к образованию кровоподтеков (синяки на теле без причины).
На II этапе у больных болеющие апластической анемией отмечается бледность кожи и видимых слизистых оболочек, также иногда могут возникать кровоподтеки. Если заболевание переходит в острую форму, помимо бледности кожных покровов также наблюдают геморрагический шок, некроз слизистых оболочек и высокую температуру. В организме активизируются различные воспалительные процессы (в частности, пневмония).
Обычно печень и селезенка не увеличиваются, но если диагностируют аутоиммунную форму апластической анемии, при которым в организме больного вырабатываются антитела к эритроцитом, может развиться умеренная спленомегалия (увеличение селезенки) и легкая желтушность кожи и склер, вызванных наличием в крови гемолитических компонентов.
Наиболее ярко выраженным является III этап анемии, который характеризируется бурной картиной клинических проявлений. На этой стадии развития апластической анемии анализ крови показывает:
- в клиническом анализе крови определяется ярко выраженная анемия (как правило, нормохромная) – уровень гемоглобина уменьшается до 20 – 30 г/л, концентрация ретикулоцитов снижается (говорит о снижении функциональности костного мозга);
- возникает лейкопения, гранулоцитопения, то есть резко снижается уровень содержания в крови гранулярных лейкоцитов. При этом количество лимфоцитов не изменяется;
- понижение тромбоцитов, вплоть до нуля;
- при гистологическом исследовании ткани костного мозга отмечается катастрофическое исчезновение его клеток, которые замещаются жировой тканью;
- резко повышается СОЭ – до 30 – 50 мм/час;
- в сыворотке крови концентрация железа увеличивается.
Лечение апластической анемии зависит от главного фактора, который предположительно стал причиной развития патологического процесса.
Если заболевание выявлено впервые, больной обязательно подлежит госпитализации в стационар, отделение гематологии. Только в условиях лечебного учреждения можно корректно подобрать необходимый для лечения лекарственный препарат, а также определиться с его дозировкой.
Основными методиками коррекции и лечения апластической анемии у детей и взрослого являются:
- трансфузионные методы (переливание крови);
- трансплантационные методы;
- медикаментозные методы.
Трансфузионный терапевтический метод предполагает переливание больному цельной, эритроцитарной или тромбоцитарной массы, а также гранулоцитов крови. Препараты крови, использующие в трансфузии, готовятся на станциях переливания из донорской крови. Данный метод трансфузии — временный, так как он позволяет только восполнить дефицит клеток крови, но нарушения в костном мозге при этом не ликвидируются. Еще одним минусом трансфузии является то, что при диагностировании аутоиммунных форм апластической анемии применять его нельзя.

Если операции по переливанию крови больному делают довольно часто, это может привести к накоплению в его организме излишков железа, которые откладываются в печени и селезенке. Поэтому такой категории пациентов включают в терапию лекарственные препараты, влияющие на выведение железа из крови.
Наиболее эффективным методом лечения апластической анемии принято считать трансплантационный, при котором происходит пересадка костного мозга человека. Вероятность успеха операции по пересадке костного мозга зависит от возраста больного, процент успешного исхода тем выше, чем моложе пациент. В качестве донора может выступить один из ближайших родственников, имеющий такую же группу крови, что и больной. Для этого необходимо провести исследование на индивидуальную совместимость их групп крови.
Данная методика лечения требует определенной подготовки, чтобы снизить процент вероятности отторжения чужеродных тканей. Перед процедурой переливания крови отменяются, назначается проведение лучевой терапии, закрепленной в последствие курсом химиотерапевтических препаратов. Делается это с целью временного подавления иммунной системы больного, которая может спровоцировать отторжение донорских стволовых клеток. Трансплантация костного мозга при анемии – очень дорогостоящая операция, проводится только в специализированных клиниках.
Медикаментозная терапия при апластической анемии у человека включает применение следующих лекарственных средств:
- иммунодепрессанты – например, циклоспорин, специфические антиглобулины. Применение этих лекарственных форм показано в тех случаях, когда невозможно провести операцию по пересадке костного мозга. Назначаются они комплексно с кортикостероидами, чтобы предупредить развитие анафилактических реакций;
- лекарственные препараты, стимулирующие процессы кроветворения – например, филграстим, лейкомакс. Назначают их только в случае диагностирования лейкопении, поскольку они активируют процессы образования гранулярных лейкоцитов;
- для лечения апластической анемии у мужчин применяют препараты, содержащие андрогены (мужские половые гормоны) – тестостерона пропионат, сустанон;
- при выраженном геморрагическом синдроме показано назначение гемостатиков – дицинон, аминокапроновая кислота;
- одним из примеров препаратов, способствующих выведению железа из крови, является десферал.
Еще один метод лечения апластических анемий — спленэктомия, другими словами операция по удалению селезенки. Частота положительного эффекта составляет 85%. В основе этого метода лечения лежит прекращение аутоиммунных процессов в организме, когда вырабатываются антитела к собственным клеткам. Его можно проводить любым пациентам, у которых отсутствуют инфекционные осложнения.
Запрещено прибегать к использованию рецептов народной медицины при лечении апластической анемии. Лечение патологических нарушений в этом случае предусматривает точную дозировку лекарственных веществ, которую невозможно соблюдать при использовании фитопрепаратов.
Поскольку механизмы развития апластической анемии на данном этапе так и остаются до конца не выясненными, прогноз лечения апластической анемии в большинстве случаев неблагоприятный.
Самый высокий процент смертности отмечается у категории больных с тяжелыми формами заболевания. Из-за прогрессирующего и не поддающего коррекции недоразвития костного мозга возобновить процессы образования клеток крови не удается и это приводит к гибели больного из-за генерализированного сепсиса.
Если же течение заболевания менее тяжелое, у больного отмечается положительная реакция на трансплантацию донорских стволовых клеток, а также применение иммунодепрессантов оказывает эффективное действие – прогнозы перехода заболевания в стадию ремиссии колеблются в пределах 50 – 90%. Одна лишь медикаментозная терапия, без применения оперативных методов лечения, может дать положительный результат только у половины пациентов.
В случае развития наследственных форм апластических анемий клиническая картина зависит от вида заболевания.
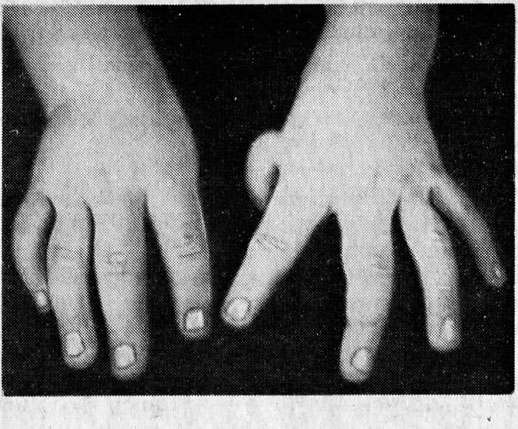
При диагностировании апластической анемии Фанкони у ребенка присутствуют такие врожденные пороки развития, как врожденные аномалии развития костной системы (отсутствие I пальца на кисти, искривление либо отсутствие лучевых костей и другие), пороки сердца и почек, аномалии развития глаз (маленькие глазные яблоки).
Симптомы апластической анемии у детей начинают появляться в возрасте 4 года, очень редко – в раннем возрасте. У ребенка наблюдается общая слабость, повышенная утомляемость, частые головные боли. Иммунитет снижается, ребенок становится более восприимчивым к простудным заболеваниям.
Геморрагический синдром проявляется склонностью к частым носовым кровотечениям. Лабораторное обследование дает характерную клиническую картину в анализах крови. Заболевание переходит в хроническую форму, прерываемую периодическими рецидивами.
Летальный исход при этой форме апластической анемии обусловлен присоединением инфекционного процесса или же развитием острой кровопотери из-за усилившегося геморрагического синдрома.
Случаи диагностирования апластической анемии Эстрена – Дамешека довольно редки. Данные виды болезни характеризируются нарушениями только кроветворных процессов.
При анемии Даймонда – Блекфена нарушаются процессы формирования только красных клеток крови. Геморрагический синдром отсутствует. При осмотре специалист отмечает бледность кожи, увеличение печени и спленомегалию. Концентрация тромбоцитов и лейкоцитов в крови может снизиться только в случае сильного поражения селезенки. Заболевание имеет хронически тяжелое течение. Прогноз крайне неблагоприятный. Смерть наступает до достижения 20-летнего возраста.
источник
Апластическая анемия – разнородная группа гематологических заболеваний, морфологическим признаком которых является панцитопения в периферической крови и глубокая гипоплазия или аплазия миелоидной ткани. Развитие апластической анемии обусловлено большим числом эндогенных и экзогенных факторов, вызывающих качественные и количественные изменениями со стороны стволовой клетки и ее микроокружения.
Апластическая анемия — достаточно редкое заболевание: его средняя частота в Европе и США составляет 4-6 случаев на 1 миллион жителей в год. Чаще всего апластическая анемия развивается у лиц до 20 и старше 65 лет, что может быть связано с преобладанием этиологической роли вирусов у лиц молодого возраста и химических веществ — у пожилых людей. Свое подтверждение эта гипотеза находит в исследованиях, проведенных в Китае и Юго-Восточной Азии. Эти регионы, где частота апластической анемии в 3-4 раза выше среднемировой, характеризуются широким распространением вирусных заболеваний (в особенности гепатита) и использованием в сельском хозяйстве ядохимикалиев без адекватной защиты.
Причину апластической анемии удается выявить менее, чем у 50% больных. В зависимости от этиологических факторов выделяют: врожденные (наследственные) и приобретенные формы заболевания.
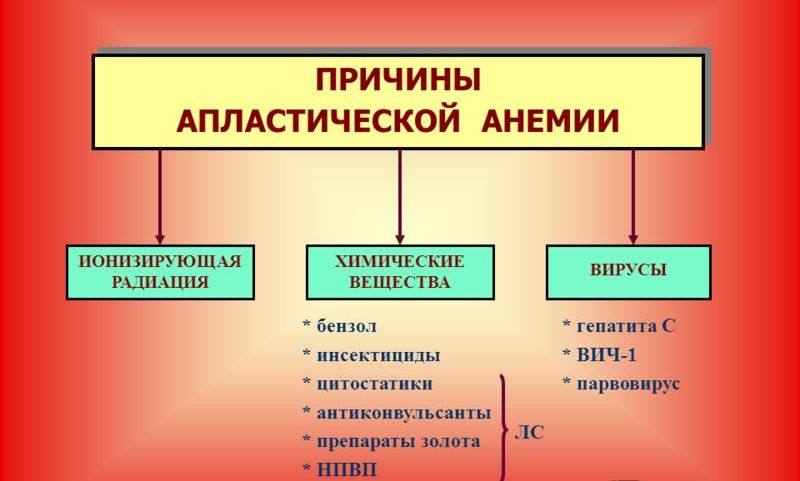
К врожденным формам относятся анемия Фанкони, амегакариоцитарная аплазия и апластическая анемия, развивающаяся у больных с негаматологической патологией (синдром Дауна). В группу приобретенных входят первичная (этиологический фактор неизвестен) и вторичная апластическая анемия, которая может возникать при воздействии ионизирующей радиации, химических веществ (бензин, толуол), при вирусных инфекциях (гепатиты В и С, ВИЧ-инфекция, вирус Эпштейна-Барр, парвовирусы), иммунных заболеваниях (системная красная волчанка, эозинофильный фасциит), тимоме и др.
В основе патогенеза апластической анемии лежит внутренний дефект кроветворной стволовой клетки, приводящий к нарушению ее пролиферации и дифференцировки. В реализации факторов, приводящих к изменению в стволовой клетке, имеют значение состояние кроветворного микроокружения (стромы костного мозга), а также иммунопатологические воздействия, обусловленные внешними и/или внутренними факторами.
Течение апластической анемии различно: в одних случаях заболевание возникает внезапно и быстро приводит к летальному исходу, в других протекает более латентно, особенно у лиц пожилого возраста.
Наиболее распространенной является приобретенная первичная апластическая анемия. При этой форме чаще страдают мужчины в возрасте 18-20 лет. Длительность заболевания до первичного обращения за врачебной помощью составляет в среднем от 1 до 3 месяцев. При отсутствии своевременной диагностики апластическая анемия характеризуется неуклонным прогрессированием.
Клинические проявления заболевания тесно связаны с выраженностью изменений в периферической крови (анемия, лейко- и нейтропения, тромбоцитопения) и включают 3 синдрома: анемический, геморрагический и инфекционных осложнений. Как правило, первые симптомы обусловлены анемией. Часто одновременно развивается геморрагический синдром различной степени выраженности (кровоизлияния на коже по петехиально-пятнистому типу, носовые, десневые, в более тяжелых случаях — маточные и желудочно-кишечные кровотечения, кровоизлияния в сетчатку и головной мозг). Иногда геморрагический синдром в начале заболевания настолько выражен, что дает повод к ошибочному диагнозу (это более характерно для редкой формы апластической анемии — амегакариоцитарной аплазии). Синдром инфекционных осложнений в начале заболевания возникает редко (при клинически раритетной форме апластической анемии, характеризующейся преимущественным угнетением нейтропоэза). При прогрессировании заболевания инфекционные осложнения (язвенно-некротическое поражение полости рта, миндалин, пневмония, сепсис и др.) доминируют в клинической картине и, наряду с геморрагическим синдромом, являются одной из основных причин летальных исходов.
В некоторых случаях апластическая анемия проявляется одноростковой цитопенией с соответствующей клинической симптоматикой (чаще — парциальная красноклеточная аплазия, реже — амегакариоцитарная аплазия или угнетение нейтропоэза).
При объективном исследовании больных обращает внимание мраморная бледность кожи и видимых слизистых оболочек. Увеличения селезенки, печени и лимфатических узлов не отмечается; более того, наличие органомегалии и лимфоаденопатии исключает апластическую анемию).
Диагностика апластической анемии основывается на лабораторных показателях (анализ периферической крови) и результатах морфологического исследования костного мозга.
Клинический анализ крови. У 80% больных выявляется трехростковая цитопения: гемоглобин ниже 100 г/л, нейтрофилов менее 1,5х10 9 /л, тромбоцитов менее 100,0х10 9 /л. Анемия, как правило, носит нормо- или гиперхромный характер с выраженным анизоцитозом. Важным является показатель абсолютного количества ретикулоцитов: при апластической анемии у 2/3 больных отмечается ретикулоцитопения.
Исследование миелограммы. Апластическая анемия является абсолютным показанием для стернальной пункции. Чаще всего в аспирате костного мозга выявляется снижение клеточности (уменьшение содержания миелокариоцитов) с угнетением всех ростков гемопоэза, относительный лимфоцитоз, умеренная плазмоцитарная реакция. В связи с тем, что поражение костного мозга развивается неравномерно, зоны аплазии чередуются с участками кроветворного костного мозга. В этой связи для окончательного подтверждения диагноза необходимо проведение трепанобиопсии.
Трепанобиопсия костного мозга — основной метод, позволяющий поставить подтвердить диагноз апластической анемии. При тяжелой АА в трепанобиоптате практически весь объем межбалочных пространств заполнен жировой тканью, среди клеток которой встречаются рассеянные лимфоциты, плазматические клетки, единичные тучные клетки и макрофаги с цитоплазмой, содержащей гемосидерин. При гипоплазии миелоидной ткани, которая может быть начальной фазой заболевания, на фоне жировой ткани сохраняются небольшие скопления клеток эритроидного и гранулоцитарного ростков. Мегакариоциты обычно не обнаруживаются, даже если другие ростки кроветворной ткани более или менее сохранены.
Биохимические исследования. Выполнение этих тестов не связано с диагностикой апластической анемии, но необходимо для проведения дифференциального диагноза с другими анемиями (исследование содержания сывороточного железа, свободного билирубина, свободного гемоглобина плазмы), оценки функции печени (если имеются анамнестические данные о гепатите) и почек (для контроля их функцией на фоне лечения).
Иммунологические исследования. Необходимо определение группы крови и резус-фактора, а также совместимости с донором по системе HLA для подбора компонентов крови и костного мозга (при подготовке к миелотрансплантации).
Вирусологические исследования. Обязательным является определение наличия или отсутствия антител к цитомегаловирусу (CMV). Это связано с тем, что больные, не имеющие антител к CMV, должны получать CMV-отрицательные компоненты крови. Кроме того, необходимо проведение исследований на вирусы гепатита A, B, C и ВИЧ-инфекцию.
Рентгенологические исследования. Рентгенография грудной клетки и придаточных пазух необходимы для определения очагов возможной инфекции, а также для динамического контроля при ее возникновении. У больных молодого возраста необходимо проведение рентгенологических исследований костей предплечий и кистей рук для исключения анемии Фанкони.
Ультразвуковая томография. Ультразвуковое исследование органов брюшной полости в первую очередь показано детям и больным молодого возраста для выявления аномалий развития почек, которые характерны для анемии Фанкони. Выявление при ультразвуковом исследовании увеличения селезенки и печени противоречит диагнозу апластической анемии.
Цитогенетические исследования. Цитогенетические исследования необходимы для исключения анемии Фанкони, миелодиспластического синдрома и острого лейкоза, которые характеризуются цитогенетическими аномалиями.
В соответствии с показателями периферической крови и данными трепанобиопсии выделяют следующие формы апластической анемии.
Тяжелая апластическая анемия.
Периферическая кровь (сочетание не менее двух из трех критериев): а)нейтрофилы 0,5-0,2х10 9 /л; б)тромбоциты 9 /л; в)ретикулоциты 9 /л.
Апластическая анемия средней степени тяжести: те же данные трепанобиопсии при уровне нейтрофилов более 0,5х10 9 /л, тромбоцитов более 20,0х10 9 /л и ретикулоцитов — более 1% (не менее двух из трех критериев).
При наиболее часто встречающейся приобретенной апластической анемии необходимо проводить дифференциальную диагностику с острым лейкозом, миелодиспластическим синдромом, В12–дефицитной анемией и анемией Фанкони.
Острый лейкоз в некоторых случаях проявляется различными вариантами цитопений (моно-, би- или панцитопения) без бластоза периферической крови. Поставить диагноз острого лейкоза помогают клинические данные (частая органомегалия), результаты стернальной пункции, трепанобиопсии, а также наличие цитогенетических аномалий.
Миелодиспластический синдром. Наблюдающееся у некоторых больных апластической анемией сочетание панцитопении, макроцитоза и гиперплазии эритроидного ростка в миелограмме может вызвать подозрение на миелодиспластический синдром. Постановке диагноза миелодиспластического синдрома способствуют данные трепанобиопсии (отсутствие аплазии костного мозга) и результаты цитогенетического исследования (наличие различных хромосомных аномалия).
В12 – дефицитная анемия. Во многих случаях это заболевание сопровождается развитием умеренно выраженной панцитопении в периферической крови, однако клинические (отсутствие геморрагического синдрома и инфекционных осложнений, нередкое поражение желудочно-кишечного тракта и нервной системы) и лабораторно-инструментальные данные (в периферической крови — макро- и мегалоцитоз, гигантские гиперсегментированные нейтрофилы; в миелограмме — мегалобластический тип кроветворения; результаты трепанобиопсии) позволяют верифицировать диагноз В12 – дефицитной анемии.
Анемию Фанкони необходимо исключать у детей в возрасте от 5 до 12 лет. Первый ее тип (классический тип Фанкони) характеризуется наличием грубых пороков развития скелета и внутренних органов (аномалии почек, мочеточников, половых органов, пороки сердца). Второй тип заболевания проявляется малыми аномалиями развития скелета, участками гиперпигментации кожи, задержкой роста больных. Гематологические признаки заболевания проявляются анемией и тромбоцитопенией с развитием геморрагического синдрома. Одновременно с этим развивается повышенная наклонность к инфекциям. В миелограмме количество миелокариоцитов нормальное за счет увеличения содержания клеток эритроидного ряда, выявляется повышенный уровень тучных клеток. Типично значительное увеличение содержания фетального гемоглобина. У половины больных в моче отмечается повышение уровня аминокислот, особенно пролина.
При апластической анемии терапия должна начинаться немедленно после постановки диагноза. Выделяют 4 группы методов: 1)направленные на восстановление костного мозга; 2)заместительная терапия компонентами крови; 3)профилактика и лечение инфекционных осложнений; 4)дополнительные методы лечения.
I Лечение, направленное на восстановление костного мозга включает иммуносупрессивную терапию и миелотрансплантацию.
А. Иммуносупрессивная терапия проводится одним из следующих препаратов.
1.Антилимфоцитарный (АЛГ) или антитимоцитарный глобулин (АТГ) — наиболее распространенный метод лечения больных апластической анемией при невозможности проведения трансплантации костного мозга. Оба препарата относятся к классу иммуносупрессантов. АЛГ назначается в дозе 15 мг/кг/сут в виде 8-12 часовой внутривенной инфузии ежедневно в течение 8 -10 дней; АТГ — в дозе 0,75 мг/кг/сутки, 4-5 часовой внутривенной инфузией, ежедневно в течение 8 -10 дней.
2. Циклоспорин А (сандиммун) относится к иммунодепрессантам. Механизм действия связан со специфическим и обратимым влиянием на геном стволовой клетки и торможением апоптоза. Показан при тяжелой апластической анемии, рефрактерной к терапии АЛГ или АТГ (как самостоятельный метод или в сочетании с АЛГ), а также при повышенной чувствительности к АЛГ. Препарат применяется в дозе 5-10 мг/кг/сутки в два приема. Продолжительность курса должна составлять не менее 3 месяцев (в среднем 6-12 месяцев).
3. Высокие дозы метилпреднизолона — альтернативный метод иммуносупрессивной терапии при тяжелой апластической анемии. Препарат вводится внутривенно болюсом в дозе 0,5- 1,0 г/сутки в течение 5 дней. Результаты терапии сопоставимы с терапией AЛГ/АТГ, однако высокая частота трудно контролируемого тяжелого сахарного диабета, артериальная гипертензия и инфекционные осложнения не всегда дают возможность использовать этот метод лечения.
Б. Трансплантация аллогенного костного мозга — единственный радикальный метод лечения тяжелой и очень тяжелой апластической анемии. При наличии гистосовместимого донора и отсутствии противопоказаний аллогенная миелотрансплантация должна быть проведена как можно раньше, а гемотрансфузии исключены или сведены к минимуму с целью снижения риска передачи цитомегаловирусной инфекции, гепатита В и С, а также аллосенсибилизации.
II. Заместительная терапия компонентами крови.
Показанием для переливания эритроцитов является снижение гемоглобина ниже 80 г/л и гематокрита 30%, а у лиц пожилого возраста и при наличии заболеваний сердечно-сосудистой системы — концентрация гемоглобина менее 90 г/л. С целью уменьшения аллоиммунизации предпочтительнее переливать отмытые эритроциты.
Трансфузии тромбоцитов проводятся при наличии признаков кровотечения (мелена, гематурия, кровохарканье) или кровоизлиянии в жизненно важные органы и сетчатку глаза при их уровне менее 50 х 10 9 /л. При количестве тромбоцитов ниже 20 х 10 9 /л необходимы профилактические трансфузии тромбоконцентрата 2 — 3 раза в неделю.
Несмотря на гранулоцитопению, переливания гранулоцитарной массы при апластической анемии не показаны. Это обусловлено как неэффективностью данной процедуры (после трансфузии гранулоциты находятся в циркуляции не более нескольких часов), так и высокой вероятностью развития тяжелых посттрансфузионных осложнений и аллосенсибилизации.
III. Профилактика и лечение инфекционных осложнений.
У больных апластической анемией имеется повышенный риск развития инфекционных осложнений. Вероятность развития системной или местной инфекции определяется уровнем гранулоцитов, в связи с чем выделяют группы пациентов с высоким (гранулоцитов менее 0,2х10 9 /л), умеренным (гранулоцитов от 0,2х10 9 /л до 0,5х10 9 /л) и низким риском (гранулоцитов более 0,5х10 9 /л). Больные с низким риском возникновения инфекционных осложнений не нуждаются в специальном режиме и терапии. При умеренном и высоком риске инфекции пациенты переводятся в асептические палаты, им проводится обработка кожи и полости рта дезинфицирующими растворами (хлоргексидин) и деконтаминация кишечника (неабсорбируемые антибиотики и противогрибковые препараты per os). Из пищи должны быть исключены продукты, не подвергшиеся термической обработке, а внутримышечные и подкожные инъекции — сведены к минимуму для уменьшения риска подкожных кровоизлияний и местных воспалительных процессов. Такие же мероприятия должны проводиться и у всех пациентов получающих иммуносупрессивную терапию.
Возбудителями инфекционных осложнений у больных без центральных катетеров и дренажей чаще всего является грамположительная флора, а при наличии центрального катетера — грамотрицательная.
При возникновении лихорадки у больного апластической анемией и агранулоцитозом (гранулоцитов менее 0,5х10 9 /л) показано проведение эмпирической антибактериальной терапии препаратами широкого спектра. Стандартной является комбинация аминогликозидов и цефалоспоринов III-IV поколения. Если лихорадка не купируется в течение 48 часов, даже при отсутствие микробиологического подтверждения, назначаются антистафилококковые антибиотики (ванкомицин). После купирования выявленных инфекционных осложнений и нормализации температуры антибиотики отменяются не ранее, чем через 5-7 дней. Если лихорадка возобновляется после отмены антибиотиков, высока вероятность грибковой инфекции (чаще всего вызванная грибами родов Candida и Aspergillus), в связи с чем необходимо назначение противогрибковых препаратов (амфотерицин В). Лечение грибковой инфекции проводится в течение длительного времени, а полное ее купирование даже при адекватной терапии происходит только после восстановления уровня гранулоцитов.
IV. Дополнительные методы лечения.
Андрогенные стероиды используют для стимуляции эритропоэза у пациентов, нуждающихся в постоянных трансфузиях эритроцитарной массы. Обычно применяются анаболические стероиды (оксиметанолон в дозе 200-300 мг/сутки в течение 2-3 месяцев).
Колониестимулирующие факторы (гранулоцитарный, гранулоцитарно-макрофагальный) могут назначаться с целью повышения уровня гранулоцитов у пациентов, имеющих резерв миелоидной ткани (уровень нейтрофилов более 0,5х10 9 /л). Среди других факторов роста перспективно использование интерлейкина-3, который повышает уровень нейтрофилов, а в ряде случаев также число ретикулоцитов и тромбоцитов.
Спленэктомия является дополнительным методом лечения и используется при отсутствии длительного эффекта от гемотрансфузионной терапии, в особенности при сохраняющейся тромбоцитопении.
Оценка эффективности лечения.
Полная ремиссия: гемоглобин выше 100 г/л, нейтрофилы выше 1,0х10 9 /л, тромбоциты выше 100,0х10 9 /л; больные не нуждаются в гемотрансфузиях.
Частичная ремиссия: гемоглобин более 80 г/л, нейтрофилы более 0,5х10 9 /л, тромбоциты более 20,0х10 9 /л; больные не нуждаются в гемотрансфузиях.
Клинико-гематологическое улучшение: улучшение гематологических показателей и уменьшение потребности в заместительной гемотрансфузионной терапии более чем на 2 месяца.
Отсутствие эффекта на терапию: отсутствие улучшения гематологических показателей, сохранение зависимости от гемотрансфузионной терапии.
После трансплантации аллогенного костного мозга полная ремиссия достигается у 50-80%, при иммуносупрессивной терапии — у 40-50% больных с тяжелой апластической анемией. После иммуносупрессивной терапии восстановление функции костного мозга происходит медленно, у ряда пациентов в различные сроки после лечения развивается рецидив заболевания.
Апластическая анемия (АА) – разнородная группа гематологических заболеваний, морфологическим признаком которых является панцитопения в периферической крови и глубокая гипоплазия или аплазия миелоидной ткани.
-анемический синдром(одышка при физических нагрузках, сердцебиения);
-геморрагический синдром – кожные и слизистые геморрагии, носовые, десневые, маточные кровотечения;
-синдром инфекционных осложнений – частые и тяжелые инфекции (язвенное поражение слизистых оболочек полости рта, миндалин, пневмонии, сепсис);
— отсутствуют увеличение лимфатических узлов, печени и селезегки.
-периферическая кровь – панцитопения (анемия, лейкопения, тромбоцитопения) и ретикулоцитопения;
-миелограмма — снижение общего количества миелокариоцитов, сужение всех ростков гемопоэза;
-трепанобиопсия – гипоплазия или аплазия миелоидной ткани;
-цитогенетические исследования –отсутствие цитогенетических аномалий;
Лечение: иммуносупрессивная терапия (антилимфоцитарный/антитимоцитарный глобулин, сандиммун, высокие дозы метилпреднизолона), аллогенная трансплантация костного мозга, поддерживающая терапия компонентами крови (эритроциты, тромбоциты), антибактериальная терапия.
источник
Апластическая анемия – заболевание системы крови, заключающееся в аплазии (отсутствии формирования) клеток костного мозга, в результате чего развивается дефицит форменных элементов крови – панцитопения. Сходным с этим являются процессы гипоплазии, когда процессы кроветворения происходят в меньшем объёме, чем необходимо и развивается гипопластическая анемия. Обычно эти два понятия объединяют общим понятием апластической анемии.
Когда не известны причины, вызвавшие развитие заболевания, оно носит название идиопатическое. Такое встречается в большинстве случаев. Но иногда всё-таки удаётся установить причину. Ей может быть:
- действие ионизирующего излучения;
- токсины – бензол, инсектициды;
- лекарственные препараты – хлорамфеникол, нестероидные противовоспалительные средства, цитостатики;
- вирусы гепатита, Эбштейна — Барра;
- заболевания иммунной системы;
- генетические нарушения при созревании клеток костного мозга.
Наличие дефекта в стволовых клетках или снижение количества приводит к их низкой пролиферативной активности. Другим механизмом развития апластической анемии является нарушение регуляции иммунокомпетентными клетками процессов созревания ростков крови (гемопоэз). Патология микроокружения – один из возможных путей, приводящих к угнетению синтеза клеток крови или их полному отсутствию.
Возможно сочетание нескольких механизмов в развитии апластической анемии.
Анемия Фанкони – наследственное заболевание с аутосомно-рецессивным типом наследования. В результате мутации образуются белки, нарушающие процессы репарации (восстановление структуры) ДНК. Это приводит к высокой чувствительности и к повреждениям нуклеиновой кислоты, сопровождается прогрессированием нарушений костномозгового кроветворения и повышенной вероятностью развития опухолей.
Все основные симптомы апластической анемии возникают из-за дефицита клеток крови и нарушения их функции. Дефицит тромбоцитов приводит к развитию геморрагического синдрома, лейкоцитов (агранулоцитоз) – пониженному иммунитету, эритроцитов – анемическому синдрому.
Как уже было отмечено ранее, возможны острое и хроническое течение апластической анемии. У 15% больных заболевание протекает остро и сопровождается повышенной температурой тела, множественными кровоизлияниями. При врождённой форме (анемия Фанкони) возможны отставание в росте и развитии, «кофейные» пятна на кожном покрове.
Анемический синдром проявляется головокружением, мельканием «мушек» перед глазами, слабостью.
Лейкоцитопения – низкий уровень лейкоцитов сопровождается присоединением бактериальной инфекции.
Геморрагический синдром – проявляется кровотечениями (носовыми, десневыми, маточными), высыпаниями на коже. При кровоизлиянии в глазное дно это может проявляться снижением остроты зрения. Чаще всего это характерно для лиц молодого возраста с тяжёлой степенью апластической анемии.
Диагноз подтверждается на основании клинических симптомов, лабораторных и инструментальных методов исследования. Характерные симптомы апластической анемии указаны выше.
В первую очередь из лабораторных анализов назначается общий анализ крови, в котором отражается уровень всех форменных элементов. Как уже упоминалось не раз, будет наблюдаться панцитопения – низкие уровни клеток крови.
Обнаруженная анемия характеризуется по цветному показателю. При апластической анемии она нормохромная или возможна незначительная гиперхромность. Ретикулоциты снижены или отсутствуют. Показатели СОЭ (скорость оседания эритроцитов) будут повышены. Низкий уровень лейкоцитов возникает за счёт дефицита гранулоцитов, отмечается относительный лимфоцитоз. Нарушается структура тромбоцитов и их функциональные способности.
Проводят пункцию костного мозга. Характеристика полученного пунктата будет зависеть от того попала ли игла в угнетённый очаг или в остатки нормально функционирующего костного мозга. В первом случае пунктат будет обеднён клеточными элементами, снижено количество молодых форм гранулоцитов, повышено процентное количество лимфоцитов, также нарушены процессы дифференцировки и пролиферации.
Обнаружение бластных клеток в пунктате не имеет отношения к апластической анемии, значит, следует искать другой патологический процесс, сходный с этим по клиническим проявлениям и нарушениям созревания кроветворных клеток.
Отмечается отложение избытка железа в виде пигмента в печени, селезёнке, костном мозге. Для правильной диагностики необходимо выяснить, что могло привести к сниженному уровню лейкоцитов (токсические вещества, лекарственные средства, инфекционные агенты, аутоиммунные поражения, хронические воспалительные процессы, гипотиреоз).
Анемия, похожая на апластическую, может возникать при парциальной красноклеточной аплазии. При таком состоянии изолированно нарушаются процессы синтеза и дифференцировки клеток эритроидного ряда, возможна выработка антител к клеткам костного мозга.
Диагноз апластической анемии ставится при наличии любых 2 критериев из перечисленных ниже:
- уровень гемоглобина менее 100 г/л;
- уровень лейкоцитов менее 3,5 * 109 /л (содержание гранулоцитов менее 1,5 * 109/л);
- гипоклеточный костный мозг и уровень тромбоцитов менее 50 * 109/л.
Характеристика степеней тяжести апластической анемии представлена в таблице 1.
Таблица 1. Критерии степени тяжести апластической анемии.
| Степень тяжести | Критерии |
| Умеренная |
|
| Тяжёлая |
|
| Очень тяжёлая |
|
Основным методом лечения апластической анемии является восстановление количества кроветворных клеток, а также назначение иммуносупрессивной терапии для подавления иммунных реакций. Самым действенным методом считается пересадка стволовых кроветворных клеток.
При трансплантации костного мозга необходимо тщательно проводить оценку на совместимость донора и реципиента во избежание патологии «трансплантат против хозяина».
Отмечается тот факт, что при апластической анемии, вызванной химиотерапией и врождённых формах, терапия иммуносупрессорами не является эффективной.
К иммуносупрессивной терапии относятся:
- антилимфоцитарный иммуноглобулин;
- циклоспорин;
- глюкокортикоиды;
- цитостатики.
Обратите внимание, что самолечением не стоит заниматься, так как у каждого лекарственного средства есть свои показания, противопоказания, побочные эффекты.
Не разрешается употреблять иммуносупрессивные препараты при наличии инфекционно-воспалительного процесса, тяжёлых нарушении сердечно-сосудистой системы, печени, почек, не купируемом геморрагическом синдроме.
При любой терапии необходим контроль за пациентом со стороны медицинского персонала для оценки возможных аллергических реакций, которые могут возникнуть на компоненты лекарственного средства. Может быть отсроченная аллергическая реакция, проявляющаяся спустя 2 – 3 дня.
Использование ростовых факторов обеспечивает поддержание гранулоцитов на уровне 1 – 1,5 * 109/л. В качестве дополнительного метода лечения может быть назначен лимфоцитоплазмаферез. Он оправдан при наличии аллергической реакции или формировании антител к форменным элементам крови. Ещё одним направлением лечения апластической анемии является терапия, проводимая против основных осложнений: инфекционных, геморрагических, аллергических. В некоторых случаях проводится переливание тромбоцитарной и эритроцитарной масс.
Таблица 2. Показания к назначению трансфузии эритроцитарной массы и тромбоконцентрата.
| Комноненты крови для гемотрансфузии | Показания |
| Эритроцитарная масса | Гемоглобин менее 90 г/л Гематокрит менее 30% |
| Тромбоцитарная масса | Кровотечения на фоне низкого уровня тромбоцитов (10 – 20 * 109/л) |
Для оценки терапии используют понятие ремиссии. Улучшение костномозгового кроветворения – неполная (частичная) ремиссия, позволяет пациенту избегать зависимости от переливания крови. Число гранулоцитов в крови составляет более 0,5 * 109/л, что снижает риск тяжёлых инфекционных осложнений. Полная ремиссия сопровождается отсутствием клинических проявлений, уровень гемоглобина приходит в норму, количество тромбоцитов больше 100 * 109/л, гранулоцитарных лейкоцитов – 1 * 109/л.
Исход заболевания зависит от глубины и тяжести поражения костномозгового кроветворения. Прогноз может быть неблагоприятным при неожиданном резком развитии апластической анемии.
Профилактика развития апластической анемии заключается в ограничении влияния на организм неблагоприятных внешних факторов. Необходимо соблюдать правила техники безопасности при работе с ионизирующими излучениями, бензолом, избегать бесконтрольного приёма лекарственных средств, лечить заболевания органов и систем, приводящих к снижению гемопоэза, например, патология почек, цирроз печени.
При подтверждённой апластической анемии необходимо наблюдение за состоянием пациентов, постоянный контроль за уровнями форменных элементов, чтобы не пропустить рецидив и возможные осложнения.
Подводя итог всему вышесказанному, следует обратить внимание на то, что апластическая анемия может развиться неожиданно без какого-либо провоцирующего действия, приводить к геморрагическому, анемическому синдрому, вызывать инфекционно-воспалительные осложнения. Однако своевременно назначенная терапия грамотного специалиста позволит избежать неблагоприятного исхода.
Мы приложили много усилий, чтобы Вы смогли прочитать эту статью, и будем рады Вашему отзыву в виде оценки. Автору будет приятно видеть, что Вам был интересен этот материал. Спасибо!
источник
Апластическая анемия — лечение, симптомы, причины, диагностика и прогноз. Клинические рекомендации, которые помогут остановить тяжелое заболевание
Апластическая анемия ― патология крови, которая связана с угнетением кроветворения (гемопоэза), в результате чего в костном мозге нарушается образованием эритроцитов, тромбоцитов и лейкоцитов.
Заболевание относится к одной из самых тяжелых видов анемии. Встречается преимущественно в молодом (5-25 лет) и пожилом (после 50 лет) возрасте. Радикальным методом терапии является пересадка костного мозга. При невозможности проведения операции, в большинстве случаев, прогноз для жизни неблагоприятный. Впервые описал заболевание иммунолог Пауль Эрлих в конце 19 века.
Существует 3 теории развития апластической анемии, каждая из которых получила научное подтверждение. Воздействие нескольких неблагоприятных факторов утяжеляет течение болезни и затрудняет терапию. По статистике, анемия с угнетением кроветворения встречается редко ― в среднем у 2 человек на миллион населения.
Костный мозг состоит из «скелета» — стромы, в котором находятся предшественники кровяных клеток. Здесь синтезируются факторы роста, которые стимулируют образование молодых клеток крови. Нарушение строения и функций костного мозга и его «скелета» возникает под действием генетических (мутаций хромосом) и приобретенных факторов. В результате развивается угнетение всех ростков гемопоэза: красного (эритроциты, тромбоциты) и белого (лейкоциты).
При некоторых условиях организм воспринимает собственные клетки костного мозга, как чужеродные, и вырабатывает защитные антитела. Это приводит к разрушению предшественников эритроцитов, тромбоцитов, лейкоцитов и, соответственно, уменьшению количества форменных элементов в крови.
Аутоиммунный конфликт возникает вследствие генетических мутаций. Это приводит к нарушению синтеза особых белков, при помощи которых организм распознает свои и чужие клетки. Сбой в работе иммунитета угнетает гемопоэз.
В организме существует защитная система удаления поврежденных, мутированных и опухолеподобных клеток. Этот процесс называется апоптоз. Таким образом поддерживается нормальный клеточный состав тканей и осуществляется защита от онкологических заболеваний.
Под действием генетических факторов нарушается синтез белков, которые являются маркерами дефектных клеток. В результате апоптоз происходит в здоровом костном мозге. Это вызывает преждевременное разрушение молодых эритроцитов, тромбоцитов и лейкоцитов.
В МКБ-10 апластической анемии присвоен код D61. Классификация включает причины (этиологию), вид угнетенного ростка гемопоэза, тяжесть течения заболевания.
По происхождению анемия бывает:
p, blockquote 12,0,0,0,0 —>
- врожденная (конституциональная) ― возникает вследствие генетических мутаций;
- приобретенная ― развивается при воздействии неблагоприятных факторов внешней среды;
- идиопатическая (первичная) ― происходит без видимой причины;
- неуточненная ― если при проведении диагностики этиологию не удалось установить.
По угнетенному ростку кроветворения выделяют анемии:
p, blockquote 13,0,0,0,0 —>
- истинные ― снижается образование всех клеток костного мозга (панцитопения);
- парциальные ― происходит угнетение только одного ростка кроветворения, чаще эритроцитарного.
Анемии по тяжести течения бывают:
p, blockquote 14,0,0,0,0 —>
- тяжелые ― нейтрофилы (вид лейкоцитов) 0,2-0,5х10*9/л, ретикулоциты (молодые формы эритроцитов) менее 1%, тромбоциты не более 20х10*9/л, при трепанобиопсии (пункция костного мозга для анализа) количество клеток составляет 50% от нормы;
- средней тяжести ― нейтрофилы более 0,5х10*9/л, ретикулоциты больше 1%, тромбоциты не менее 20х10*9/л, показатели трепанобиопсии ― 30%;
- сверхтяжелая ― нейтрофилов менее 0,2х10*9, анализ пунктата костного мозга ― менее 30%.
Апластической анемии легкой степени не существует . Заболевание всегда имеет тяжелое течение и сопряжено с риском развития осложнений.
Выделяют 2 основных фактора, которые приводят к возникновению апластической анемии. Это мутации хромосом и негативное влияние внешней среды (приобретенные формы болезни).
Мутации в хромосомах вызывают врожденные анемии, которые обычно имеют тяжелое течение и сопряжены с пороками развития скелета и внутренних органов. Сюда относят анемию Фанкони, Даймонда-Блекфена, изменение крови при синдроме Дауна. Угнетение костного мозга происходит с самого рождения, поэтому заболевание трудно поддается консервативному лечению. Пересадка костного мозга (трансплантация) в большинстве случаев малоэффективна.
Приобретенные анемии развиваются под действием негативного влияния внешней среды. При своевременном выявлении болезни и предотвращения пагубного воздействия патологический процесс можно остановить и нормализовать работу костного мозга. Приобретенные анемии имеют более благоприятный прогноз, хорошо отвечают на проводимую терапию и трансплантацию костного мозга.
Угнетение гемопоэза вызывают токсические продукты. Степень нарушения работы костного мозга зависит от длительности негативного влияния и дозы химического вещества. Высокой токсичностью обладают органические растворители, бензол, соединения мышьяка, пестициды. Отравление чаще происходит во время профессиональной деятельности, которая связана с контактом химических веществ, реже в быту. Влияние радиации (ионизирующего излучения) приводит к быстрому разрушению клеток крови и вызывает тяжелые формы апластической анемии.
Длительный прием медикаментов, токсичных для костного мозга, вызывает угнетение гемопоэза. Препараты оказывают прямое разрушающее влияние на клетки и опосредованное действие ― способствуют сбою в работе иммунной системы и выработке антител против предшественников форменных элементов крови. К токсичным для костного мозга относят некоторые транквилизаторы, антибиотики, противосудорожные, противомалярийные и антитиреоидные (применяют при повышенной функции щитовидной железы) средства, препараты золота, противоопухолевые лекарства.
Вирусные заболевания оказывают опосредованное действие на костный мозг путем развития аутоиммунных реакций против клеток-предшественников. Апластическая анемия в таких случаях развивается в течение полугода после перенесенного заболевания. Опасными для костного мозга являются вирусы гепатита В, С, D, ЦМВ (цитомегаловирус), Эпштейн-Барр, гриппа, папилломы человека.
В 50% случаев причину заболевания выявить не удается, анемию считают идиопатической или неуточненной .
Клинические признаки апластической анемии развиваются остро или могут возникать постепенно. Это зависит от причины заболевания и интенсивности воздействия на организм повреждающих факторов. При наследственных формах характерно медленное развитие патологии, в случае токсического воздействия химических веществ, радиации, медикаментов симптомы нарастают стремительно.
В начале заболевания возникает гипопластическая форма анемии, при которой ростки кроветворения угнетаются частично. Костный мозг сохраняет способность к образованию клеток, но в гораздо меньшем объеме. Апластический процесс подразумевает полное угнетение гемопоэза, что приводит к критическому снижению концентрации эритроцитов, тромбоцитов, лейкоцитов в крови.
Клиническая картина складывается из 3 синдромов: анемического, геморрагического, инфекционного. Синдром ― это совокупность симптомов, которые характерны для заболевания. Анемические и геморрагические проявления возникают первыми, затем присоединяются инфекционные осложнения. Степень тяжести клинических признаков зависит от причины болезни.
Возникает вследствие угнетения красного ростка гемопоэза. Снижается содержание эритроцитов, которые переносят кислород органам и тканям. При этом концентрация гемоглобина в клетках соответствует норме, так как в организме достаточно веществ для его синтеза. Вследствие низкого содержания эритроцитов развивается гипоксия (кислородное голодание тканей). Нормальная работа органов нарушается. Развивается хроническая недостаточность сердца, почек и печени. Страдает функция головного мозга.
Анемический синдром проявляется быстрой утомляемостью, слабостью, сонливостью. Возникает головокружение, частые головные боли, снижение остроты зрения и слуха, мелькание «мушек» перед глазами. Характерны перебои в работе сердца, которые сопровождаются тахикардией, неустойчивостью артериального давления, аритмиями, появлением шумов при выслушивании (аускультации) сердца.
Кожа становится сухая и бледная. Вследствие частых гемотрансфузий (переливаний крови) приобретает желтушный оттенок, что связано с гемолизом (разрушением) эритроцитов. Ухудшение обмена веществ из-за гипоксии приводит к расслоению ногтей, выпадению волос, разрушению зубной эмали. На голенях формируются долго незаживающие язвы.
Появляется вследствие нарушения образования предшественников тромбоцитов в красном ростке гемопоэза. Эти клетки отвечают за формирование сосудистых сгустков для остановки и предупреждения кровотечений. Чаще геморрагический синдром возникает сразу с анемическим или несколько позже. При редком заболевании ― амегакариоцитарной аплазии, угнетение образования тромбоцитов выходит на первый план, что может привести к ошибочному диагнозу.
Синдром характеризуется кровотечениями различной степени тяжести. Появляются мелкие и крупные кровоизлияния в коже ― геморрагическая сыпь. Склонность к возникновению синяков и гематом приводит к присоединению вторичной инфекции и нагноению. Характерны частые кровотечения из носа и десен, обильные менструации, увеличивается время остановки кровотечения. Кожа приобретает пятнистую окраску вследствие многочисленных синяков.
Прогрессирование болезни приводит к массивным кровотечениям из легких, желудка и кишечника. Кровоизлияние в головной мозг вызывает геморрагический инсульт и сопряжено с высоким риском смертельного исхода.
Угнетение белого ростка кроветворения приводит к нарушению образования лейкоцитов. Снижается количество сегментоядерных клеток (при рассмотрении под микроскопом в ядре заметны включения). К ним относят нейтрофилы (см. «Нейтропения»), базофилы (см. «Базопения») и эозинофилы (см. «Эозинопения»). Другие клетки лейкоцитарной формулы (моноциты, лимфоциты) обычно находятся на уровне нормальных показателей, а если рассматривать относительно сегментоядерных лейкоцитов, то их концентрация в крови повышается.
Так как белый росток кроветворения формирует иммунную защиту организма, в результате нарушается способность противостоять бактериальным и вирусным инфекциям, заражению гельминтами, образованию опухолей. Характерно тяжелое течение респираторных заболеваний, воспаление мочеполового тракта, легких. Часто возникают инфекции кожных покровов, долго не заживают царапины и раны. Повреждения кожи склонны к нагноению. Высокий риск развития сепсиса (заражения крови) ухудшает течение болезни.
Наиболее известные врожденные виды заболевания ― анемия Фанкони и Даймонда-Блекфена. Патологию выявляют в детском возрасте, чаще в 5-10 лет. При тяжелом угнетении кроветворения заболевание диагностируют в первые годы жизни.
Наследуется по аутосомно-рецессивному типу. Это означает, что генная мутация должна присутствовать у обоих родителей — только в этом случае патология проявится у детей. Но при этом вероятность рождения больного ребенка составляет 25%. Анемия Фанкони связана с нарушением синтеза белка в составе ДНК. В результате угнетается образование всех клеток крови в костном мозге.
Анемия сочетается с другими врожденными нарушениями. Характерна деформация черепа и скелета: маленький размер головы, укорочение больших пальцев рук, косолапость, низкорослость. Возникают пороки развития внутренних органов: почек (подковообразная форма, удвоение, образование множественных кист), половых органов (недоразвитие, отсутствие одного или обоих яичек), сердца (незаращение боталлова протока, деформация клапанов).
Часто встречается глухота, недоразвитие глаз, опущение века. Страдает умственное развитие. В зрелом возрасте анемия принимает злокачественное течение и трансформируется в рак крови (острый миелоидный лейкоз), который трудно поддается противоопухолевой терапии и сопряжен с высоким риском смерти.
Редкая форма заболевания, при которой происходит угнетение только эритроцитарного ростка гемопоэза. Наследуется по аутосомно-доминантному типу — для развития анемии достаточно мутации генов у одного из родителей. Вероятность появления болезни достигает 50%. Причина развития ― нарушение синтеза рибосомальных белков в хромосомах и нечувствительность костного мозга к эритропоэтину (веществу почек, которое стимулирует гемопоэз).
Анемию Даймонда-Блекфена диагностируют в первые годы жизни. В клинической картине преобладает анемический синдром: бледность кожи, слабость, головокружение, одышка, перебои в области сердца, низкая устойчивость к умеренным физическим нагрузкам.
У новорожденных могут выявлять пороки внутриутробного развития: незаращение верхней губы («заячья» губа), твердого неба («волчья» пасть), недоразвитие черепа и костей скелета, нарушение зрения (катаракта, слепота), пороки развития внутренних органов.
Для выявления апластической анемии назначают лабораторные и инструментальные методы обследования. В постановке диагноза учитывают клинические признаки, наследственность, факт влияния токсических веществ на организм. Стандарт диагностики ― лабораторные исследования крови и костного мозга. Анализы позволяют выявить угнетение гемопоэза и оценить тяжесть течения заболевания.
Таблица ― Лабораторная диагностика апластической анемии
Молодые нейтрофилы (палочкоядерные)
Ниже 2% (обычный показатель 6%)
Увеличение уровня микроэлемента вследствие частых гемотрансфузий
Положительные после перенесенной инфекции
* Антитела к цитомегаловирусу определяют перед проведением гемотрансфузий. Если человек не заражен вирусом, ему переливают CMV-отрицательную кровь.
Стернальная пункция и трепанобиопсия являются обязательными методами обследования при апластической анемии. Только по анализам крови нельзя поставить точный диагноз. Стернальная пункция проводится путем прокола грудины на уровне 2-4 ребра полой иглой для забора небольшого количества костного мозга. Из полученного материала готовят 10-15 мазков на предметных стеклах для микроскопического исследования (изучения под микроскопом). В результате выявляют дефицит клеток в костном мозге.
Трепанобиопсию проводят путем прокола подвздошной кости (одной из костей таза). Методика позволяет взять больший объем костного мозга, провести не только цитологическое (изучение клеток), но и гистологическое исследование (оценку особенностей тканей). Кроме того, этот метод более надежный для диагностики на первых этапах развития болезни, когда остались островки нормального кроветворения. Если при стернальной пункции прокол попал на такой участок, то диагноз может быть ложно опровергнут. Обе процедуры делают под анестезией в условиях операционной.
Дополнительно назначают инструментальные методы обследования:
p, blockquote 49,1,0,0,0 —>
- УЗИ (ультразвуковое исследование) внутренних органов ― выявляет нарушение функции и врожденные пороки развития.
- ЭКГ (электрокардиограмма) ― исследование работы сердца, нарушения ритма и проводимости.
- КТ/МРТ (компьютерная и магнитно-резонансная томография) ― определяет нарушения в строении органов и новообразования.
- Рентгенография рук ― позволяет подтвердить врожденное недоразвитие костей.
- Генетические исследования ― оценивают риск развития анемии Фанкони и Даймонда-Блекфена.
Диагностику проводят в амбулаторных условиях. При тяжелом состоянии пациента и назначении пункции костного мозга дают направление на госпитализацию в гематологию.
В клинической практике чаще встречается приобретенная форма заболевания. Ее необходимо дифференцировать (отличать) от анемии Фанкони, лейкоза, В12-дефицитной анемии, миелодиспластического синдрома.
Таблица ― Дифференциальная диагностика
p, blockquote 52,0,0,0,0 —>
| Заболевание | Отличительные симптомы | Результаты обследования |
| Апластическая анемия приобретенная | Анемический синдром Частые и тяжелые инфекции Печень и селезенка не увеличены | Снижение в крови эритроцитов, лейкоцитов, тромбоцитов (панцитопения) Уменьшение клеток-предшественников в костном мозге |
| Анемия Фанкони | Пороки развития скелета и внутренних органов Пигментация (потемнение) кожи Детский возраст (5-12 лет) | Такие же, как при наследственной форме Фетальный гемоглобин в крови (характерный для внутриутробного развития) |
| Острый лейкоз (рак крови) | Увеличение печени и селезенки | Чаще угнетение одного ростка кроветворения (редко панцитопения) При проведении стернальной пункции ― опухолевые клетки |
| В12-дефицитная анемия | Нет геморрагического и инфекционного синдрома Поражение пищеварительного тракта и нервной системы | Макроцитоз в крови (большие размеры эритроцитов) В результатах стернальной пункции ― мегалобласты |
| Миелодиспластический синдром | Симптомы как при апластической анемии | В костном мозге нет дефицита клеток Генетические исследования выявляют характерные изменения хромосом |
Важный клинический признак заболевания ― отсутствие увеличения печени, селезенки и лимфатических узлов.
В терапии апластической анемии применяют консервативные (медикаментозные) и оперативные методы. Лекарственные средства снижают агрессию иммунной системы против клеток костного мозга, устраняют воспаление, предупреждают развитие инфекций. Переливание крови временно восполняет недостаток клеток и улучшают общее самочувствие.
Единственным радикальным методом терапии, который может остановить развитие анемии, считают операцию по пересадке костного мозга от подходящего донора. Хирургическое лечение сопряжено с риском отторжения трансплантата и другими осложнениями, но дает шанс на выздоровление.
Клинические рекомендации при апластической анемии включают иммуносупрессивные, заместительные и профилактические средства. Терапия направлена на поддержание кроветворения и улучшение общего самочувствия.
Таблица ― Лекарственные препараты при апластической анемии
p, blockquote 57,0,0,0,0 —>
| Цель терапии | Название препаратов | Способ применения |
| Иммунодепрессанты | ||
| Снижение аутоиммунной реакции в организме | Антилимфоцитарный глобулин (АЛГ) | 15 мг/кг в сутки в виде внутривенных инфузий (капельниц) для медленного введения Курс лечения ― 7-10 дней |
| Антитимоцитарный глобулин (АТГ) ― Атгам | 0,75 мг/кг в сутки внутривенно капельно медленно Курс терапии ― 7-10 дней | |
| Торможение апоптоза (преждевременного разрушения клеток) | Циклоспорин А (Сандиммун) | 5-10 мг/кг дважды в сутки Продолжительность лечения ― 3-12 месяцев |
| Глюкокортикоиды | ||
| Угнетение аутоиммунной и воспалительной реакции | Метилпреднизолон | Применяют высокие дозировки: 0,5-1 г в сутки в течение 5 дней |
| Заместительные средства* | ||
| Предупреждение кислородного голодания тканей | Переливание эритроцитарной массы | При уровне гемоглобина крови ниже 80 г/л |
| Профилактика кровотечений | Инфузии тромбоцитарной массы | При содержании клеток менее 50х10*9/л |
| Профилактические средства (антибиотики)** | ||
| Предупреждение инфекций и нагноения | Цефалоспорины (Цефазолин, Цефотаксим, Цефтриаксон) Макролиды (Эритромицин, Азитромицин, Спирамицин) Фторхинолоны (Ципрофлоксацин, Офлоксацин, Пефлоксацин) | Назначают в максимальных дозах в зависимости от тяжести течения инфекции |
| Профилактика грибковых заболеваний | Противогрибковые средства (Амфотерицин В, Бифоназол, Интраконазол, Миконазол) | Дозировки подбирают индивидуально |
| Дополнительные препараты | ||
| Стимуляция образования эритроцитов | Анаболические стероиды (Оксиметолон) | 200-300 мг в сутки в течение 1-3 месяцев |
| Активация белого ростка кроветворения (лейкоцитов) | Колониестимулирующий фактор (гранулоцитарный) | При уровне нейтрофилов не менее 0,5х10*9/л |
* Переливание лейкоцитов не проводят. Белые клетки крови быстро разрушаются и часто вызывают аллергические реакции.
** При высоком риске инфекции (гранулоциты менее 0,5х10*9/л) пациентов переводят в палаты с соблюдение стерильности. Ежедневно кожу обрабатывают антисептическими растворами, в рацион включают только термически обработанную пищу. Минимизируют количество инъекций для предупреждения нагноения кровоподтеков от укола иглой.
Для проведения операции необходимо подобрать подходящего донора, клетки которого способны прижиться в организме пациента. Для этого кровь больного (реципиента) и донора исследуют на совпадение по антигенному составу (особенностям строения белков форменных элементов крови).
Максимально совместимый костный мозг другого человека приживается в 70-80% случаев. Частичное совпадение по антигенам дает эффективность на 40-50%. После операции пациенту назначают длительный прием иммунодепрессантов для предупреждения отторжения пересаженного костного мозга.
Прорывом в гематологии стала возможность использования собственные клетки крови. Забор биологического материала проводят до начала болезни. В таких случаях приживаемость костного мозга составляет 98%, нет опасности отторжения трансплантата и необходимости принимать иммунодепрессанты.
Таблица ― Оценка эффективности терапии
p, blockquote 64,0,0,0,0 —>
| Степень | Показатели крови |
| Полная ремиссия (восстановление функции костного мозга) | Нейтрофилы более 1х10*9/л Тромбоциты более 100х10*9/л |
| Частичная ремиссия | Нейтрофилы 0,5-1,0х10*9/л Тромбоциты 20-100х10*9/л |
| Отсутствие эффекта | Нет значимых изменений в клеточном составе крови Необходимость в регулярных гемотрансфузиях |
В зависимости от особенностей операции выделяют несколько видов трансплантации: аллогенную и аутологичную. В первом случае пересадку биологического материала проводят от донора. Во втором ― применяют собственные ткани пациента.
Донором клеток может стать родственник больного. По статистике, только в 30% случаев удается найти подходящего по всем показателям человека в близком окружении пациента. Пол и возраст не имеют значения. Забор костного мозга можно делать даже у грудного ребенка. Если не удалось найти донора среди родственников, совместимый костный мозг ищут в банке органов. Поиск может занять месяцы и годы.
По сути, операцию проводят только донору, у которого извлекают костный мозг. Для этого под наркозом делают трепанобиопсию. После забора костного мозга (700-1000 мл) клетки переливают реципиенту посредством внутривенных инфузий.
Забор костного мозга при помощи трепанобиопсии можно заменить менее травматичной методикой. Клетки-предшественники (стволовые клетки) получают путем взятия крови у донора. Затем биологический материал обрабатывают в специальных аппаратах и переливают реципиенту.
Получение клеток-предшественников из крови, а не из костного мозга имеет ряд преимуществ. После операции посредством трепанобиопсии восстановление кроветворения донора длится в течение года. Полученные клетки путем обработки крови не вызывают тяжелых иммунных реакций у реципиента, а реабилитация донора сокращается до 3-4 недель.
После рождения ребенка делают забор крови из пуповины (соединительного канала между плацентой и плодом). Биологический материал консервируют и помещают в специальные хранилища. При необходимости пуповинную кровь можно использовать, если человек затем заболевает апластической анемией или онкологическими заболеваниями.
Методика эффективно используется последние десятилетия. Собственные стволовые клетки не отторгаются и не вызывают иммунный конфликт. Единственный недостаток ― высокая стоимость хранения крови в банке донорских органов.
В период стойкой ремиссии и восстановления функции гемопоэза больному проводят трепанобиопсию или получают стволовые клетки из крови. При возникновении обострения биологический материал можно использовать для эффективного и безопасного лечения.
В организме близнецов, которые развивались из одной яйцеклетки, антигены клеток крови максимально похожи. Пересадка костного мозга в таких случаях приравнивается к использованию собственных тканей.
После пересадки костного мозга могут возникать инфекционные, трансплантационные и функциональные нежелательные последствия. Нагноение операционной раны и остеомиелит (гнойное воспаление кости) встречаются редко, так как во время операции соблюдаются стерильные условия.
Гораздо чаще возникает отторжение трансплантата. Иммунная система воспринимает пересаженный костный мозг, как чужеродное вещество, и синтезирует против него антитела. Чем меньше антигенных совпадений между кровью донора и реципиента, тем выше риск развития осложнений.
Операция по пересадке костного мозга становится серьезным испытанием для организма. Если работа функциональных систем уже была нарушена до вмешательства, то риск нарушения их работы повышается в десятки раз. Усугубляет ситуацию прием высоких доз иммунодепрессантов, которые направлены на профилактику отторжения трансплантата. Лекарственные средства обладают токсичностью и ухудшают функцию органов. Развивается почечная и печеночная недостаточность.
Новаторским методом терапии апластической анемии является применение колониестимулирующих средств ― ростовых факторов. Это синтетические препараты, которые способны активировать кроветворение. Ростовые факторы улучшают функцию стромы костного мозга, нормализуя рост и созревание клеток-предшественников крови.
Самым популярным и хорошо изученным считают гранулоцитарный колониестимулирующий фактор. Он активирует белый росток гемопоэза. В результате в крови увеличивается количество лейкоцитов, снижается риск возникновения тяжелых инфекций и гнойных осложнений. Препараты, содержащие гранулоцитарный фактор: Лейкостим, Граноцит, Нейпоген.
Такое лечение помогает пациентам нормализовать состав крови и общее состояние, улучшить качество жизни до пересадки костного мозга. Терапия обладает высокой эффективностью, редко вызывает тяжелые побочные явления. Относительный недостаток препаратов ― высокая цена, если учитывать, что лечение может продлиться долгие месяцы и даже годы.
Предупреждение развития анемии направлено на устранение неблагоприятных факторов внешней среды (профессиональных и бытовых вредностей, радиации), необоснованного назначения токсичных для костного мозга препаратов. Это первичная профилактика болезни. Сюда же входит предупреждение и своевременное лечение инфекций.
Вторичная профилактика проводится при уже возникшем заболевании. Пациенты нуждаются в диспансерном наблюдении гематолога, регулярном обследовании и получении поддерживающего лечения.
Продолжительность и качество жизни зависит от причины анемии, тяжести течения, возникновения осложнений, сроков пересадки костного мозга. После проведения операции прогноз благоприятный в 40-98% случаев. Выздоровление наиболее вероятно после пересадки собственных стволовых клеток.
Неблагоприятный прогноз чаще возникает при наследственных формах, остром течении и быстром прогрессировании болезни. Смертельный исход наступает вследствие массивных кровотечений и тяжелых инфекций, которые плохо поддаются антибактериальной терапии.
Вопрос: Можно ли вылечить апластическую анемию?
Ответ: Единственным радикальным способом терапии является пересадка костного мозга или стволовых клеток. Эффективность операции выше, если биологический материал берут у самого больного. В таких случаях вероятность выздоровления высокая. Если пересаживают донорский костный мозг, то эффективность операции снижается за счет высокого риска отторжения клеток и необходимости длительного приема токсических иммунодепрессивных препаратов.
Вопрос: Апластическая анемия ― это рак крови или нет?
Ответ: Онкологические заболевания возникают вследствие появления в организме атипичных клеток, которые быстро растут и разрушают нормальные ткани. Рак крови вызывает формирование таких клеток в костном мозге. При апластической анемии происходит обеднение кроветворения. В костном мозге находятся нормальные клетки, но в критически малом количестве. Апластическая анемия ― тяжелое заболевание, но это не рак.
Вопрос: Какую диету лучше использовать?
Ответ: В питание включают повышенное содержание белков и углеводов, ограничивают поступление жиров. Рекомендуют диетическое мясо (индюшатина, телятина, курятина), рыбу (пеленгас, карп, хек, минтай), морепродукты. Каши, фрукты и овощи поставляют в организм сложные углеводы, которые медленно всасываются и пополняют энергетические запасы организма. Из рациона исключают маргарин, сало, свинину, баранину, колбасные изделия, копчености, полуфабрикаты, фастфуд. Для улучшения аппетита в пищу добавляют специи.
Вопрос: Можно лечить заболевание народными средствами?
Ответ: Апластическая анемия относится к тяжелой патологии крови, которая трудно поддается терапии лекарственными препаратами. Зачастую помочь больному может только пересадка костного мозга. Народные средства неэффективны в борьбе с болезнью.
Вопрос: Когда используется и какая эффективность препарата Атгам?
Это иммунодепрессивный препарат, который устраняет разрушающее действие иммунитета на собственные клетки костного мозга. Представляет собой антилимфоцитарный глобулин, приготовленный из крови лошади.
Предназначен для внутривенного введения. Назначается одновременно с другими иммунодепрессантами ― глюкокортикоидами и циклоспорином. Атгам эффективен при отсутствии показаний к пересадке костного мозга, нормализует кроветворение, улучшает общее состояние, увеличивает продолжительность жизни.
Апластическая анемия связана с угнетением всех ростков кроветворения, что приводит к критическому снижению содержания эритроцитов, тромбоцитов и лейкоцитов. Это одна из самых серьезных форм малокровия, по тяжести сопоставимая с онкологическими заболеваниями.
p, blockquote 98,0,0,0,0 —>
- Анемия бывает наследственная и приобретенная. Своевременное устранение негативных факторов может остановить развитие патологии. При наследственной форме болезни это сделать невозможно, поэтому врожденные анемии обычно протекают тяжело с неблагоприятным прогнозом.
- Клинические проявления тяжелые, связаны с нарушением функции органов, кровотечениями, затяжными инфекциями. Это приводит к развитию осложнений с высоким риском смертельного исхода.
- Для диагностики недостаточно проведения анализа крови, обязательно назначают пункцию костного мозга. Изучение миелограммы выявляет панцитопению (уменьшение количества клеток всех ростком кроветворения).
- Лечение проводят иммунодепрессивными средствами, что сопряжено с развитием побочных эффектов. Выздоровление обычно наступает после пересадки костного мозга.
- Пациенты должны находиться на диспансерном учете у гематолога. Это предупреждает быстрое прогрессирование болезни.
p, blockquote 99,0,0,0,1 —>
Тяжесть течения заболевания и прогноз зависят от своевременной диагностики и терапии. Чем раньше начато лечение, тем больше шансов остановить опасную для жизни патологию.
источник