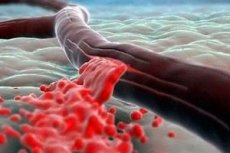
Постгеморрагическая анемия возникает вследствие единственного фактора – кровопотери. За счет этого человеческий организм теряет важные элементы – эритроциты, лейкоциты и другие микроэлементы. Различают острую и хроническую постгеморрагическую анемию. Заболеванию сопутствуют травмы и хронические заболевания, которые сопровождаются хроническими кровопотерями. Лечение этого заболевания заключается в восстановлении необходимых кровяных микроэлементов. При таком диагнозе требуется немедленное обращение в больницу.
Основной причиной для возникновения острой постгеморрагической анемии является потеря значительного объема крови за небольшой период времени. Предпосылками развития этого заболевания являются следующие факторы:
- Перенесенные травмы, вследствие которых повредилась магистральная артерия.
- Хирургическое вмешательство, которое могло привести к повреждению кровеносных сосудов.
- Внематочная беременность, в ходе которой произошел разрыв маточной трубы.
- Значительные внутренние кровотечения, произошедшие по причине серьезных патологий внутренних органов.
Маленькие дети страдают этим серьезным заболеванием зачастую по причине травмирования пуповины, врожденных патологий кровеносной системы, повреждения плаценты, ранней отслойки плаценты или родовой травмы. Значительная потеря крови сопровождается рядом характерных признаков, которые носят ярко выраженный характер.
Человек с острой постгеморрагической анемией будет жаловаться на сильную, резкую боль, головокружение, слабость в теле. Отмечается бледный цвет кожных покровов, синий оттенок губ, холодный пот, обморочное состояние, тошнота, возможна рвота. Также у человека упадет температура тела ниже 36 градусов и понизится артериальное давление. Определить внутреннее кровотечение проблематично, врач делает выводы на основании признаков у пациента. Степени тяжести постгеморрагической анемии измеряются снижением уровня гемоглобина.
Хроническая форма постгеморрагической анемии возникает вследствие незначительных, но частых кровотечений. Хроническое протекание заболевания формируется через несколько месяцев или даже лет. По истечении определенного периода времени формируется так называемое железодефицитное состояние, причиной которого служит значительная потеря железа, которая составляет основу патологического изменения в организме.
Признаки заболевания схожи с теми, которые наблюдаются у людей с недостатком железа в организме: бледность и сухость кожи, отеки лица, изменения восприятия вкуса и запаха, ломкость и тусклость ногтей, головная боль, тошнота, возможно незначительное повышение температуры тела. Такое состояние возникает по нескольким причинам:
- Геморрой, провоцирующий образование микротрещин в прямой кишке, что ведет к примеси крови в стуле человека.
- Язвенная болезнь желудка.
- Маточные кровотечения, обильные менструации, появляющиеся на фоне приема некоторых гормональных средств.
- Хроническая кровопотеря по причине онкологического заболевания.
- Частые обследования и анализы крови.
- Патологии почек, провоцирующие наличие крови в моче.
- Хроническая почечная недостаточность.
По международной классификации болезней МКБ-10 код постгеморрагической анемии фиксируется как D62 и относится к болезням крови, кроветворных органов и отдельных нарушений, вовлекающих иммунный механизм. Хроническая форма течения постгеморрагической анемии определяется кодом D50.0. Из данной классификации исключается врожденная анемия, которая происходит по причине значительной кровопотери у плода – код P61.3.
Сосудистая недостаточность и гиповолемия – это два основных фактора, которые приводят к развитию серьезного заболевания. Гиповолемия сопровождается уменьшением количества плазмы и важных элементов, среди которых эритроциты, которые осуществляют транспортировку кислорода. В результате случается снижение артериального давления, кровенаполнение внутренних органов и тканей, гипоксемия, гипоксия. На степень проявления приспособительных функций организма влияют в первую очередь объем, источник и скорость кроветворения.
Картина крови острой постгеморрагической анемии прогрессирует достаточно стремительно. После остановки кровотечения у пациента наблюдаются следующие проявления: шум в ушах, одышка и сбои ритма сердцебиения. Изменения в результатах анализа крови после прекращения кровотечения происходят по причине механизмов, которые появляются в ответ на потерю значительного количества крови.
Главный и основной метод реабилитации больного с постгеморрагической анемией заключается в установлении причины кровотечения, а затем производится немедленное его устранение: перевязка, ушивание сосудов, резекция внутренних органов. При тяжелой степени постгеморрагической анемии проводится переливание большой дозы крови.
При наружном кровотечении накладывается жгут или давящая повязка, затем пациент доставляется в клинику. В других случаях у человека может наблюдаться внутренняя кровопотеря, о которой говорит сильная сухость во рту. Самостоятельно в домашних условиях помочь человеку с внутренним кровотечением не представляется возможным, поэтому ему необходима срочная госпитализация.
Длительность восстановления нормальной картины крови составляет от шести до восьми недель, однако использование лекарственных медикаментов продолжается практически полгода, что способствует восстановлению нормального кроветворения. Стандартное лечение заключается в применении необходимых препаратов и усиленном питании, которое повышает содержание витаминов и микроэлементов.
источник
Следуя из названия, понятно, что пост — это после, а геморрагическая — это кровотечение, значит постгеморрагическая анемия, эта та анемия которая развивающаяся после кровотечения.
— это анемия вызываемая быстрой и массивной кровопотерей, вследствие травм, ранений, полостных кровотечений и т.д.
Уменьшение общего объема крови
Уменьшение объема циркулирующих эритроцитов и плазмы
Гипоксия, анемия, ишемия органов и тканей
Увел-е продукции эритропоэтина → увел-е количества эритрокариоцитов и ретикулоцитов
Увеличение секреции АДГ, активация РААС,повышение продукции КА
генерализованный спазм сосудов
Мобилизация крови из депо
Индекс Альговера – это отношение частоты пульса к уровню систолического АД.
Легкая степень тяжести кровопотери: дефицит ОЦК 10-20%. Состояние пациента удовлетворительное, общая слабость, головокружение, легкая тошнота. Пульс до 90, АД нормальное. Гемоглобин выше 100, гематокрит более 0,30.
Средняя степень тяжести кровопотери: дефицит ОЦК 20-30%, такая кровопотеря вызывает развитие 1 стадии геморрагического шока, эта стадия хорошо компенсируется организмом за счет активация САС, выбросом КА, периферической вазоконстрикцией. Состояние больного средней степени тяжести, в сознании, спокоен, отмечает выраженную слабость, головокружение, кожные покровы бледные, конечности холодные. Пульс до 100, слабого наполнения. АД умеренно снижено. Олигоурия. Содержание гемоглобина 100-70, гематокрит – 0,30 – 0,35.
Тяжелая степень тяжести кровопотери: дефицит ОЦК 30-40%, такая кровопотеря вызывает развитие 2 стадии геморрагического шока, эта стадия декомпенсированная обратимая. При этом активация САС и периферическая вазоконстрикция не могут компенсировать сниженный сердечный выброс, что ведет к снижению АД. Состояние больного тяжелое, в сознании, беспокойный, резкая слабость, бледность значительно выражена, цианоз. Тахикардия, глухие тоны сердца. АД сист. до 60 мм.рт.ст.. Олигоурия, Гемоглобин 70-50, гематокрит 0,25.
Крайне тяжелая степень тяжести кровопотери: дефицит ОЦК свыше 40%, развивается декомпенсированный, необратимый шок. Состояние крайне тяжелое, без сознания. Холодный, липкий пот, кожа бледная, цианоз, одышка. Пульс нитевидный, более 140. Систолическое АД не определяется. Олигоанурия. Гемоглобин ниже 50, гематокрит 0,25-0,20.
Сосудисто-рефлекторная фаза (1-2 сутки) – показатели без изменений, за счет механизмов компенсации: генерализованный спазм сосудов, увеличение секреции АДГ, активация РААС, повышение продукции КА.
Гидремическая фаза (2-3 день), происходит большое поступление в кровоток тканевой жидкости (аутогемодилюция) и восстановление объема сосудистого русла. Гемоглобин и эритроциты снижены, но ЦП в норме.
Костно- мозговая фаза (через 5-6 дней после кровопотери), происходит повышенная продукция эритропоэтина почками. Гипохромная анемия, лейкоцитоз со свдивом влево, ретикулоцитоз.
Нормализация гемодинамических показателей
Улучшение реологических свойств крови
Во избежание синдрома массивных гемотрансфузий недопустимо вопослнение всей кровопотери только компонентами крови. Общий объём гемотрансфузии не должен превышать 60 % дефицита объёма циркулирующей крови. Остальной объём восполняется кровезаменителями.
Для коррекции ВЭО и КОС : изотонический раствор хлорида натрия, 5% раствор глюкозы, лактасоль, раствор Рингера.
Для восполнения белков плазмы – раствор альбумина, лактопротеин, свежезамороженную плазму.
Развивается вследствие длительно и часто повторяющихся кровотечений, которые приводят к дефициту железа, т.о. данный вид анемии, по сути, является железодефицитной.
Хронические постгеморрагические анемии также требуют поиска и устранения источников хронического кровотечения. Без данной меры все дальнейшие методики лечения не принесут желаемого результата. После тщательного гемостаза уровень гемоглобина в крови корректируется путем назначения пациенту препаратов железа в сочетании с аскорбиновой кислотой, а также соблюдением необходимой диеты.
Препараты, содержащие железо, при хронической постгеморрагической анемии
Железосодержащие препараты при анемии могут использоваться как в виде парентеральных лекарственных форм (инъекции), так и в таблетированной форме. Для их усвоения необходимо сочетать феррумсодержащий препарат с аскорбиновой кислотой, а также с микроэлементами (кобальт, медь, марганец). Последние способствуют более быстрому биосинтезу железа в организме и повышению уровня гемоглобина. Наиболее популярными на сегодняшний день железосодержащими препаратами являются такие вещества, как феррум-лек, ферамид, лактат железа, железа глицерофосфат.
источник
ОПУХОЛИ КРОВЕТВОРНОЙ И ЛИМФАТИЧЕСКОЙ СИСТЕМЫ.
для студентов лечебного и
ОПУХОЛИ КРОВЕТВОРНОЙ И ЛИМФАТИЧЕСКОЙ СИСТЕМЫ.
(общее время занятия – 3 академических часа)
АКТУАЛЬНОСТЬ ТЕМЫ
Овладение материалом темы является необходимой предпосылкой для познания закономерностей морфологических реакций и их клинических проявлений при развитии опухолей системы крови. Это также необходимо в будущей профессиональной деятельности врача для клинической оценки заключений врача-патологоанатома, для клинической диагностики и лечения заболеваний системы крови, а также для анализа источника диагностических ошибок в клинической практике.
ЦЕЛИ ЗАНЯТИЯ
Изучить морфологию лейкозов, провести клинико-анатомические параллели. Подчеркнуть, что лейкозы характеризуются прогрессирующим разрастанием недифференцированных, не подвергающихся созреванию клеток белого ростка кроветворной ткани. разрастание этой ткани в костном мозге и за его пределами нельзя рассматривать как простую гиперплазию, так как лейкозные клетки отличаются морфологическим и биохимическим атипизмом, свойственным клеткам опухолей. В отличие от опухолей при лейкозах имеет место системное поражение кроветворной ткани костного мозга и лишь иногда наблюдается образование изолированных опухолевидных узлов.
Уяснить принцип классификации лейкозов в зависимости от вида разрастающихся клеток кроветворной ткани. При оценке секционных данных обратить внимание на изменения в селезенке, лимфатических узлах, костном мозге, печени, лимфатической ткани желудочно-кишечного тракта. Указать, что в клинике, помимо анализов периферической крови, большое диагностическое значение имеют стернальная пункция и трепанобиопсия.
Разобрать важнейшие осложнения лейкозов. Указать на значение снижения защитных сил организма для развития инфекционных осложнений и изменений сосудов, объясняющих наличие геморрагического синдрома. Изучить морфологию лимфогрануломатоза, как бластоматозного процесса с поражением ретикулярной ткани лимфатических узлов, селезенки, костного мозга. Разобрать динамику морфологических изменений, отметив наличие 3 стадий: 1) диффузной гиперплазии лимфоидной ткани; 2) разрастания атипичных ретикулярных клеток с одновременным наличием элементов грануляционной ткани; 3) развитием некрозов и рубцевания. Указать на выделении различных форм болезни Ходжкина: 1) лимфогистиоцитарную, 2) смешанно-клеточную, 3) форму с преобладанием нодулярного склероза и 4) диффузного фиброза, подчеркнув полиморфизм гистологической картины при этом заболевании.
1. Уметь дать общую характеристику анемий: причины возникновения, механизмы развития, принципы классификации, морфологические проявления при различных Формах.
2. Уметь дать характеристику постгеморрагической анемии, объяснить причины возникновения, механизм развития, назвать формы, представить морфологическую характеристику.
3. Уметь дать характеристику анемий вследствие нарушенного кровообразования, объяснить причину возникновения, механизм развития, назвать формы, представить особенности морфологической картины.
4. Уметь дать характеристику гемолитических анемий, объяснить причины возникновения, патогенез, назвать виды, указать особенности морфологических проявлений.
5. Знать особенности развития и виды аутоиммунных гемолитических анемий.
6. Знать принципы классификации опухолей кроветворной и лимфатической ткани, уметь дать определение лейкозов и злокачественных лимфом.
7. Уметь объяснить патогенез, пути развития лейкозов и злокачественных лимфом.
8. Уметь диагностировать различные виды лейкозов и злокачественных лимфом на основании их микроскопической характеристики.
9. Уметь назвать осложнения и причины смерти больных с опухолями кроветворной и лимфатической ткани.
10. Знать особенности патоморфоза лейкозов и злокачественных лимфом.
ОСНОВНЫЕ УЧЕБНЫЕ ВОПРОСЫ
1. Анемии. Определение. Принципы классификации.
2. Постгеморрагические анемии. Классификация. Причины развития. Патологоанатомические изменения в органах.
3. Анемия вследствие нарушения кровообразования. Классификация. Железодефицитные анемии. Анемия в результате недостатка витамина В12, фолиевой кислоты. Этиопатогенез, морфологические проявления.
4. Пернициозная анемия Аддисона-Бирмера. Этиопатогенез. Морфологические проявления. Гипо- и апластические анемии.
5. Гемолитические анемии. Классификация. Этиопатогенез. Морфологические проявления. Аутоиммунные гемолитические анемии.
6. Клоновая теория кроветворения. Регуляция системы гемопоэза.
7. Лейкозы. Этиопатогенез. Классификация.
8. Острый миелобластный лейкоз. Клинико-морфологические проявления. Осложнения. Причины смерти.
9. Острый лимфобластный лейкоз. Клинико-морфологические проявления. Осложнения.
10. Хронический миелоидный лейкоз. Клинико-морфологические проявления.
11. Хронический лимфолейкоз. Морфологические изменения в органах. Осложнения.
12. Парапротеинемические лейкозы. Миеломная болезнь. Классификация. Морфологические проявления. Осложнения. Причины смерти.
14. Лимфомы. Определение. Классификация. Клинико-морфологические проявления неходжкинских лимфом: лимфосаркомы, болезни Сезари, опухоли Беркитта, грибовидного микоза.
15. Лимфогранулематоз. Этиопатогенез. Клинико-морфологическая классификация. Морфологические особенности различных вариантов. Осложнения. Метастазы. Причины смерти. Тактика лечения.
ВСПОМОГАТЕЛЬНЫЕ МАТЕРИАЛЫ ПО ТЕМЕ
МАКРОПРЕПАРАТЫ: 1. Селезенка при лейкозе.
3. Почка при миеломной болезни.
МИКРОПРЕПАРАТЫ: 1. Почка при остром недифферен-
2. Печень при хроническом лимфолей-
3. Печень при хроническом миелолей-
4. Алейкоцитарная пневмония при
5. Некротическая ангина при лейкозе
6. Лимфоузел при лимфогранулематозе
7. Почка при лимфолейкозе (№ 80)
МАТЕРИАЛЫ ДЛЯ КОНТРОЛЯ ЗА УСВОЕНИЕМ ТЕМЫ
Анемия – состояние, характеризующееся уменьшением содержания гемоглобина в единице объёма крови, чаще при одновременном уменьшении количества эритроцитов, что приводит к развитию кислородного голодания тканей. При анемии в периферической крови нередко появляются эритроциты различной величины (пойкилоцитоз) и формы (анизоцитоз), разной степени окраски (гиперхромия, гипохромия), в эритроцитах иногда обнаруживаются включения (остатки ядерных образований – тельца Хауэлла-Жолли, кольца Кебота, пылинки Вейденрейха).
Принято считать анемией снижение уровня гемоглобина ниже 130 г/л и количества эритроцитов ниже 4х10¹²/л у мужчин и соответственно ниже 120 г/л и 3.5х10¹²/л у женщин.
Классификация.
Наибольший интерес для практического врача представляет этиопатогенетическая классификация анемий:
І. Анемии вследствие кровопотери (постгеморрагические).
1. Острая постгеморрагическая анемия.
2. Хроническая постгеморрагическая анемия.
ІІ. Вследствие нарушенного кровообразования.
1. Железодефицитная анемия.
2. Железоперераспределительная анемия.
3. Железонасыщенная анемия.
4. Мегалобластные анемии (В12- и фолиеводефицитные анемии; мегалобластные анемии, обусловленные наследственным дефицитом ферментов, участвующих в синтезе пуриновых и пиримидиновых оснований; В12-ахрестическая анемия).
5. Гипо- и апластические анемии.
ІІІ. Анемии вследствие усиленного разрушения эритроцитов (гемолитические).
1. Приобретённые гемолитические анемии.
1.3. Вызванные физическими и химическими факторами (в т.ч. лекарственными препаратами).
1.4. Пароксизмальная ночная гемоглобинурия.
1.5. Вызванные синдромом фрагментации эритроцитов.
1.6. Вызванные инфекцией (малярия, клостридиоз).
1.7. Вторичные (при заболеваниях печени и почек).
2. Наследственные гемолитические анемии.
2.1. Анемии, связанные с изменениями мембран эритроцитов (мембранопатии).
2.2. Анемии, связанные с изменениями метаболизма эритроцитов (эритроцитоферментопатии).
2.3. Анемии, связанные с дефектом синтеза гемоглобина (гемоглобинопатии).
Морфологическая классификация анемий
1. Макроцитарная анемия (MCV (mean corpuscular volume – средний объём эритроцита) > 100 мкм³, диаметр эритроцитов > 8 мкм).
2. Микроцитарная анемия (MCV
Дата добавления: 2017-01-21 ; просмотров: 701 | Нарушение авторских прав
источник
Постгеморрагическая анемия – комплекс клинических и гематологических изменений, возникающий вследствие острой или хронической кровопотери. Постгеморрагическая анемия характеризуется бледностью, одышкой, потемнением в глазах, головокружением, гипотермией, артериальной гипотонией; в тяжелых случаях — заторможенностью, нитевидным пульсом, шоком, потерей сознания. Постгеморрагическую анемию диагностируют по данным клинической картины и общего анализа крови; для установления источника кровотечения проводятся инструментальные исследования. При развитии данного состояния необходимо устранение источника кровопотери, проведение трансфузионной и симптоматической терапии.
Постгеморрагическая анемия – гипогемоглобинемия, развивающаяся вследствие геморрагического синдрома и сопровождающаяся ощутимым снижением объема циркулирующей крови (ОЦК). Постгеморрагическая анемия протекает с эритропенией, но часто без уменьшения концентрации гемоглобина (Hb). В норме уровень общего Hb и объем циркулирующих эритроцитов крови составляет соответственно: у мужчин – не ниже 130 г/л и 29-30 мл/кг веса, у женщин – не ниже 120 г/л и 22-23 мл/кг. Постгеморрагическая анемия может осложнять течение самых различных патологический состояний в хирургии, гематологии, гинекологии, гастроэнтерологии, кардиологии и др. Постгеморрагическая анемия может носить острый или хронический характер. Хроническая форма является вариантом железодефицитной анемии, так как механизм развития и симптомы патологии обусловлены усиливающимся дефицитом железа.
Непосредственной причиной постгеморрагической анемии выступает острая или хроническая потеря крови, возникшая вследствие наружного или внутреннего кровотечения. Острая постгеморрагическая анемия возникает при быстрых, массивных кровопотерях, вызванных обычно механическим повреждением стенок крупных кровеносных сосудов или полостей сердца при различных травмах и хирургических операциях, разрывом стенок сердечных камер в зоне инфаркта, разрывом аневризмы аорты и ветвей легочной артерии, разрывом селезенки, разрывом фаллопиевой трубы при внематочной беременности.
Острая постгеморрагическая анемия характерна для обильных маточных кровотечений (менорагий, метрорагий), может сопровождать течение язвы желудка и 12-перстной кишки. У новорожденных постгеморрагическая анемия может быть вызвана плацентарным кровотечением, родовой травмой.
Хроническая постгеморрагическая анемия обусловлена продолжительными, часто возникающими потерями небольших объемов крови при желудочно-кишечных, геморроидальных, почечных, носовых кровотечениях, нарушениях механизмов свертывания крови (ДВС-синдроме, гемофилии). Опухолевые процессы (рак желудка, рак толстой кишки), протекающие с разрушением тканей и органов, проводят к развитию внутреннего кровотечения и постгеморрагической анемии. Гипогемоглобинемия может быть связана с повышением проницаемости стенок капилляров при лейкозах, лучевой болезни, инфекционно-септических процессах, недостаточности витамина C.
Основными факторами развития постгеморрагической анемии выступают явления сосудистой недостаточности, гиповолемия с уменьшением общего объема плазмы и циркулирующих форменных элементов, в частности, эритроцитов, осуществляющих транспорт кислорода. Этот процесс сопровождается снижением артериального давления, кровенаполнения внутренних органов и тканей, гипоксемией, гипоксией и ишемией, развитием шока.
Степень выраженности защитно-приспособительных реакций организма определяется объемом, скоростью и источником кровотечения. В раннюю рефлекторно-сосудистую фазу компенсации кровопотери (первые сутки) благодаря возбуждению симпатико-адреналовой системы наблюдается вазоконстрикция и усиление сопротивления периферических сосудов, стабилизация гемодинамики за счет централизации кровообращения с первоочередным кровоснабжением головного мозга и сердца, уменьшение возврата крови к сердцу и сердечного выброса. Концентрация эритроцитов, Hb и гематокрит пока близки к норме («скрытая» анемия).
Вторая гидремическая фаза компенсации (2-3 сутки) сопровождается аутогемодилюцией — поступлением в кровеносное русло тканевой жидкости и восполнением объема плазмы. Усиление секреции катехоламинов и альдостерона надпочечниками, вазопрессина – гипоталамусом способствует стабильности уровня электролитов в плазме крови. Происходит прогрессирующее снижение показателей эритроцитов и Hb (общего и в единице объема), гематокрита; значение цветового показателя в норме (постгеморрагическая нормохромная анемия).
В третью, костномозговую фазу компенсации (4-5 сутки) из-за недостатка железа анемия становится гипохромной, усиливается образование эритропоэтина почками с активацией ретикулоэндотелиальной системы, эритропоэза костного мозга, очагов экстрамедуллярного кроветворения. В красном костном мозге наблюдается гиперплазия эритроидного ростка и увеличение общего числа нормоцитов, в периферической крови — значительное повышение количества молодых форм эритроцитов (ретикулоцитов) и лейкоцитов. Уровни Hb, эритроцитов и гематокрит понижены. Нормализация уровня эритроцитов и Hb при отсутствии дальнейшей кровопотери происходит через 2-3 недели. При массивной или длительной кровопотере постгеморрагическая анемия приобретает гипорегенеративный характер, при истощении адаптационных систем организма развивается шок.
Клинические признаки постгеморрагической анемии однотипны вне зависимости от причины кровопотери, определяются ее объемом и длительностью.
В первые сутки после острой кровопотери у пациентов отмечается резкая слабость, бледный оттенок кожи и слизистых, одышка, потемнение и мелькание мушек в глазах, головокружение, шум в ушах, пересыхание во рту, снижение температуры тела (особенно, конечностей), холодный пот. Пульс становится частым и слабым, появляется артериальная гипотония. Следствием геморрагического синдрома является малокровие внутренних органов, жировая дистрофия миокарда, печени, ЦНС и других органов. Дети, особенно новорожденные и 1-го года жизни, кровопотерю переносят намного тяжелее, чем взрослые пациенты.
Постгеморрагическая анемия при массивной и быстрой кровопотере сопровождается геморрагическим коллапсом, резким падением артериального давления, нитевидным аритмичным пульсом, адинамией и заторможенностью, учащенным поверхностным дыханием с возможным развитием рвоты, судорог, потерей сознания. Если давление падает до критического уровня, вызывая острое нарушение кровоснабжения и гипоксию органов и систем, смерть наступает от паралича дыхательного центра и остановки сердца.
Медленно развивающаяся постгеморрагическая анемия характеризуется менее выраженными проявлениями, так как успевает частично компенсироваться за счет адаптационных механизмов.
Диагностика постгеморрагической анемии проводится по данным клинической картины, лабораторных и инструментальных исследований (общего и биохимического анализов крови и мочи, ЭКГ, УЗ-диагностики, пункции костного мозга, трепанобиопсии). При осмотре пациента с острой постгеморрагической анемией обращает внимание гипотония, частое дыхание, слабый аритмичный пульс, тахикардия, приглушенность сердечных тонов, небольшой систолический шум на верхушке сердца.
В крови — абсолютное снижение эритроцитарной массы; при продолжающейся кровопотере наблюдается прогрессирующее равномерное падение содержания Hb и эритроцитов. При умеренной кровопотере гематологические признаки постгеморрагической анемии обнаруживается только на 2-4 сутки. Обязателен контроль диуреза, уровня тромбоцитов, электролитов и азотистых продуктов в крови, АД и ОЦК.
При острой постгеморрагической анемии нет необходимости в исследовании костного мозга, его проводят при трудно диагностируемых кровопотерях. В образцах костномозговой пункции признаками анемии являются повышение активности красного костного мозга, в препаратах трепанобиопсии – замещение жировой ткани костного мозга красным кроветворным мозгом.
При диагностике внутренних кровотечений показателен синдром острого малокровия и лабораторные данные. В селезенке, печени, лимфоузлах выявляются очаги экстрамедуллярного кроветворения, указывающие на повышенную нагрузку на гемопоэтическую систему; в крови — транзиторное понижение уровня железа, небольшое увеличение АлТ.
Для выявления и устранения источника кровопотери больные нуждаются в консультациях гематолога, хирурга, гинеколога, гастроэнтеролога и других специалистов; проведении УЗИ органов брюшной полости и малого таза, ФГДС и пр. ЭКГ при постгеморрагической анемии может демонстрировать снижение амплитуды Т-зубца в стандартном и грудном отведении.
Первостепенным в лечении постгеморрагической анемии является установление источника кровотечения и его немедленная ликвидация за счет перевязки и ушивания сосудов, резекции и ушивания поврежденных органов и тканей, повышения свертываемости крови и т. д.
Для восстановления ОЦК и снижения степени гемодинамических нарушений по наблюдением трансфузиолога проводится неотложное переливание консервированной крови, кровезаменителей, плазмы и плазмозаменителей. При незначительном, но продолжительном кровотечении трансфузия цельной крови или плазмы показана в небольших гемостатических дозах. При значительной потере ОЦК трансфузии должны выполняться в дозах, превышающих кровопотерю на 20-30%. Тяжелая постгеморрагическая анемия лечится переливаниями больших доз крови («трансплантация крови»). В период коллапса гемотрансфузии дополняют гипертоническими кровозамещающими растворами.
После восстановления ОЦК проводится коррекция качественного состава крови – восполнение ее компонентов: эритроцитов, лейкоцитов, тромбоцитов. При большой одномоментной кровопотере и остановившемся кровотечении необходимы массивные дозы эритроцитарной массы (> 500 мл). Об эффективности гемотрансфузий судят по повышению АД, гематологическим сдвигам.
Также необходимо введение белковых и электролитных растворов (альбумина, физ. раствора, глюкозы), восстанавливающих водно-солевой баланс. В лечении постгеморрагической анемии используются препараты железа, витамины группы B. Назначается симптоматическая терапия, направленная на нормализацию функциональных нарушений со стороны сердечно-сосудистой и дыхательной систем, печени, почек и др.
Прогноз постгеморрагической анемии зависит от длительности и объема кровотечения. Резкая потеря 1/4 ОЦК приводит к острой анемии и состоянию гиповолемического шока, а потеря 1/2 ОЦК является несовместимой с жизнью. Постгеморрагическая анемия при медленной потере даже значительных объемов крови не столь опасна, поскольку может компенсироваться.
источник
Острая постгеморрагическая анемия
Постгеморрагические анемии
Этиология и патогенез отдельных форм анемий
Развивается вследствие однократной быстрой массивной кровопотери.
Нарушения обусловлены уменьшением объема циркулирующей крови и гипоксией. В ответ на кровопотерю включаются механизмы компенсации, направленные на восстановление утерянного объема крови и на борьбу с анемическим состоянием (гипоксией).
Картина крови. На 1 – 2-е сутки после кровопотери развивается нормохромная анемия. На 4 – 5-е сутки возникает ретикулоцитоз, появляются полихроматофилы, полихроматофильные и оксифильные нормобласты (нормоциты). Вследствие недостаточной гемоглобинизации эритроцитов анемия приобретает гипохромный характер, сопровождается умеренным нейтрофильным лейкоцитозом со сдвигом влево по регенеративному типу.
Развивается вследствие повторных небольших кровопотерь.
По патогенезу является железодефицитной (см. далее).
Дизэритропоэтические анемии (вследствие нарушения эритропоэза)
К данной группе заболеваний относятся:
а) анемии, объединенные общим механизмом возникновения, связанным с нарушением или прекращением эритропоэза в результате дефицита веществ, необходимых для нормального кроветворения – дефицитные анемии (В12 -, В6 -, В2 — фолиево-дефицитные, железо-медь-кобальт-дефицитные, белково-дефицит-ные), а также анемии, возникающие при неспособности костного мозга усваивать гемопоэтические факторы – ахрестические анемии (сидероахрестические, В12 –ахрестические и др.);
б) анемии, вызванные поражением костного мозга токсическими и лекарственными веществами, ионизирующим излучением (гипо- и апластические анемии);
в) анемии при лейкозах, метастазах опухолей в костный мозг (метапластические анемии).
Железодефицитная анемия (ЖДА)
Железо – один из важнейших микроэлементов, входящих в состав организма человека. Взрослому человеку требуется железа 15 мг/сутки. Основные депо железа – печень (гепатоциты и макрофаги), костный мозг, селезёнка, мышцы. Если метаболизм железа нормален, 30-40 % нормобластов костного мозга содержат гранулы ферритина (сидеробласты). Отсутствие сидеробластов характерно для железодефицита. Избыток гранул в сидеробласте служит признаком переполнения организма железом (гемосидероз) или неспособность утилизировать его (сидеробластная анемия, см. далее).
Дефицит железа в организме существует в двух формах, представляющих собой две последовательные стадии одного процесса: латентный (тканевый) дефицит железа (ЛДЖ) и собственно железодефицитная анемия (ЖДА).
ЖДА составляет около 80-90% всех случаев анемий и является одной из самых распространенных ее форм. Женщины страдают чаще, чем мужчины, поскольку запасы железа у последних значительно превышают (на 100-200%) таковые у женщин. Явный и скрытый дефицит железа отмечается почти у 60 % женщин земного шара. Железодефицитные анемии встречаются во всех возрастных группах. Различают «истинные» ЖДА – при абсолютном дефиците железа и «ложные» ЖДА – при нарушении включения железа в гем, в отсутствии первичного абсолютного железодефицита.
Причиной развития ЖДА могут быть: 1) хронические, даже необильные и скрытые кровопотери (маточные, желудочно-кишечные, почечные, легочные, носовые, десневые и пр.); 2) недостаточное поступление железа с пищей; в экономически развитых странах у взрослых встречается редко, гораздо чаще – в развивающихся странах, у детей – при искусственном вскармливании коровьим или козьим молоком; у новорожденных является следствием дефицита железа у матери во время беременности, у недоношенных, при многоплодии; 3) усиленный расход железа в период роста и созревания, в период беременности, лактации; 4) пониженное всасывание железа после резекции желудка, части тонкого кишечника, заболеваниях кишечника; синдроме мальабсорбции; 5) нарушение обмена и утилизации железа при инфекциях, интоксикациях, глистных инвазиях; последние особенно часто встречаются в странах жаркого климата (анкилостомидоз, шистосомоз и пр.); 6) обширные хронические очаги инфекции, быстро растущие опухоли (перераспределительный дефицит железа); при эритремии может развиться значительный тканевой дефицит железа в связи с частыми лечебными кровопусканиями и сосредоточением железа в гемоглобине неопластически увеличенного эритрона. Этот ЛДЖ протекает на фоне высоких показателей Нb и эритроцитов; 7) нарушение транспорта железа (гипо-, атрансферринемия). Нередко действуют комбинации указанных факторов, вызывающих отрицательный баланс железа. Примером ЖДА, развивающейся вследствие комплексного влияния нескольких факторов является хлороз – от греч. «хлорос» – бледно-зеленый или «бледная немочь». Название связано со специфическим цветом лица таких больных. Развивается у девочек-подростков в период полового созревания (ранняя форма – ювенильный хлороз) в связи с повышенным расходом железа (рост, появление менструаций) и угнетающим действием эстрогенов на эритропоэз и у женщин в климактерический период (поздняя форма). При ЖДА уменьшается содержание железа в плазме крови, костном мозге и в тканевых депо.
Болезнь возникает при нарушении процессов синтеза гема и гемоглобинизации эритроцитов вследствие истинного или перераспределительного дефицита железа в организме. При этом снижается содержание сывороточного железа, повышается общая и особенно латентная железосвязывающая способность сыворотки крови с уменьшением процента насыщения переносчика железа – трансферрина (сидерофилина). Снижается также интенсивность транспорта железа в костный мозг, его содержание в митохондриях эритроидных клеток, костного мозга, что тормозит синтез гема, соединение его с глобином, образование гемоглобина. В костном мозге отсутствуют сидеробласты или снижено их содержание (в норме 20-40%).
Картина крови. Основным признаком заболевания служит снижение гематокрита. Содержание Нb колеблется в зависимости от тяжести анемии от 20-30 до 100-110 г/л. Количество эритроцитов может быть снижено (но может быть даже нормальным). Снижение количества эритроцитов объясняют снижением пролиферативной активности эритрона, возрастанием интенсивности неэффективного эритропоэза, некоторым укорочением продолжительности жизни эритроцитов. ЦП резко снижен (0,6 – 0,3), гипохромия, микроцитоз, анизо- и пойкилоцитоз эритроцитов. Нередко наступает нейтропения (в результате уменьшения содержания железосодержащих ферментов в лейкоцитах). СОЭ незначительно увеличена. Содержание железа в сыворотке снижено (сидеропения) – до 2,0-5,0 мкМ/л (норма – 12-32 мкМ/л).
Уровень тромбоцитов может быть незначительно повышен (на фоне кровотечений). Ретикулоцитарный индекс чаще соответствует гипорегенеративному состоянию.
Клиническая картина складывается из двух основных синдромов: общеанемического и сидеропенического.
Общеанемический синдром проявляется симптомами, характерными для всех видов анемии: бледность, общая слабость, быстрая утомляемость, обмороки, одышка, тахикардия, систолический шум.
Сидеропенический синдром характеризуется рядом трофических нарушений. Отмечаются: сухость и трещины кожи, преждевременные морщины, ломкость ногтей, койлонихия (катлонихия) – ложкообразные ногти, ангулярный стоматит, атрофия слизистых оболочек рта, пищевода, желудка, дыхательных путей. Нарушается иммунитет, что приводит к хронизации инфекций, частым ОРЗ; развивается мышечная слабость, слабость физиологических сфинктеров. Может возникнуть извращение вкуса (поедание несъедобных продуктов – мела, бумаги и др.), пристрастие к необычным запахам (ацетон, бензин, краска). Нарушается память, концентрация внимания. При дефиците железа резко усиливается абсорбция свинца, и у детей на этом фоне развивается необратимая задержка интеллектуального развития. Нарушение проницаемости мелких сосудов ведет к отекам лица. Иногда возникает «сидеропенический субфебрилитет».
Железонасыщенная (сидероахрестическая, сидеробластная, железо-ре-фрактерная) анемияобъединяет группу наследственных или приобретенных анемий, при которых нарушается активность ферментов, участвующих в синтезе порфиринов и гема.
Изнаследственные формчаще встречается анемия, передающаяся рецессивным геном, локализующимся в Х-хромосоме; реже – анемия, передающаяся путем рецессивно-аутосомного наследования.
Генетически детерминированное нарушение активности ферментов и коферментов, принимающих участие в синтезе гема, приводит к снижению количества образующихся протопорфиринов и активности процесса связывания железа. Последнее накапливается в организме и откладывается в органах, что обусловливает соответствующую клиническую картину (при отложении железа преимущественно в печени развивается ее цирроз, а в сердечной мышце – недостаточность кровообращения и т.д.).
Развитие анемии, обусловленной геном, локализующимся в Х-хромосоме, связано с дефектом пиридоксальфосфатазы (пиридоксин-зависимая). Это подтверждается благоприятным лечебным эффектом пиридоксальфосфата и витамина В6.
Анемии, возникающие вследствие нарушения других ферментных систем, являются пиридоксин-резистентными.
Приобретенные формыразвиваютсяпри применении противотуберкулезных препаратов, обладающих антагонистическим действием по отношению к пиридоксину; при дефиците витамина В6, хроническом алкоголизме, при свинцовом отравлении (сатурнизме) в результате блокирования свинцом сульфгидрильных групп ферментов, участвующих в синтезе гема, при хронических заболеваниях.
В таких случаях анемия бывает различной степени тяжести. Количество эритроцитов снижается в меньшей степени, чем содержание Нb. ЦП достигает 0,6 – 0,4. Имеет место выраженная гипохромия, базофильная пунктация цитоплазмы (иногда кодоцитоз), анизоцитоз, пойкилоцитоз эритроцитов. Содержание железа в сыворотке крови значительно увеличено (60 – 90 мкмоль/л). Содержание лейкоцитов, тромбоцитов, лейкоцитарная формула остаются нормальными, если не нарушается функция печени. Увеличивается количество сидеробластов в костном мозге.
Клиническая картина при свинцовом отравлении характеризуется поражением нервной системы (энцефалопатии, полиневриты, парезы) и желудочно-кишечного тракта (снижение аппетита, «свинцовые» колики, лиловая кайма на деснах – следствие отложения в клетках свинца).
Дата добавления: 2014-12-27 ; Просмотров: 332 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Постгеморрагическая анемия — это нехватка железосодержащих элементов в плазме крови человека. Малокровие, возникшее вследствие кровопотери, – это одна из наиболее часто встречающихся анемий. Медики различают две формы этого заболевания: хроническую и острую.
Постгеморрагическая анемия хронического характера возникает после небольших, но, в течение некоторого времени, частых кровотечений. Острая же форма данной болезни возникает вследствие внезапно возникшей, обильной кровопотери.
Опасный для человеческой жизни минимальный объем кровопотери взрослого человека – 500 мл.
По Международной классификации болезней 10-го пересмотра постгеморрагическая анемия относится к категории «Болезни крови, кроветворных органов и отдельные нарушения, вовлекающие иммунный механизм». Подраздел: » Анемии, связанные с питанием. Железодефицитная анемия». Классификация болезней с кодами следующая:
- Железодефицитная анемия вторичная вследствие потери крови (хроническая) – код D50.0.
- Острая постгеморрагическая анемия — код D62.
- Врожденная анемия вследствие кровопотери у плода — код P61.3

Этиологией возникновения нехватки крови в организме могут стать:
- Травма, вследствие которой произошло нарушение целостности сосудов и прежде всего крупных артерий.
- Операционное вмешательство. Любое хирургическое вмешательство – это всегда риск. Приступая к даже, казалось-бы обычному обывателю, простейшей операции, хирург не в состоянии предвидеть всех ее нюансов и последствий.
- Язва двенадцатиперстной кишки и желудка. Эти заболевания достаточно часто сопровождаются внутренними кровотечениями. И сложность их своевременного выявления состоит в том, что кровотечение происходит внутри организма и наружно ее можно распознать дилетанту по некоторым признакам и вовремя вызвать скорую. В противном случае промедление может вылиться для больного летальным исходом.
- Нарушение гемостаза. Этот фактор призван поддерживать кровь в жидком состоянии, отвечая за показатель свертываемости крови, что дает возможность поддерживать в пределах нормы объемы циркулирующей крови и нормализуя состав («формулу») крови.
- Внематочная беременность. Эта патология сопровождается у женщин острыми обильными кровотечениями, что и приводит к острой постгеморрагической анемии.
- Легочные болезни. Такое кровотечение проявляется выделениями алого цвета жидкой или сгусткообразной консистенции, возникающими во время кашля.

Патогенез, или последовательность возникающих явлений, составляют явления сосудистой недостаточности, вследствие резкого опорожнения от крови (плазмы) русла сосудов. Эти факторы приводят к недостатку эритроцитов, переносящих кислород, что, в свою очередь, приводит к общему кислородному голоданию организма. Самостоятельно эту потерю, за счет более активной работы сердца, организм восполнить не сможет.

Знания не повредят никому. И для того, чтобы уметь распознать кровотечение (особенно если оно внутреннее), необходимо знать симптомы постгеморрагической анемии и ее проявления, что бы вовремя оказать первую медицинскую помощь или вызвать скорую.
- При обильной кровопотере на первое место выходят сосудистые проявления: одышка, учащенное сердцебиение (тахикардия), падают показатели давления (как артериального, так и венозного).
- Кожа и слизистые больного становятся бледными.
- Больной начинает ощущать потемнение в глазах, шум в ушах и легкое головокружение.
- Может появиться рвотный рефлекс.
- Острым признаком внутреннего кровотечения можно считать резкую сухость во рту. Тяжесть клиники определяется, не только общими объемами потели, но и скоростью, с которой потерпевший теряет кровь.
- Немаловажным фактором является и место травмирования. Так поражения желудочно-кишечного тракта сопровождается резким ростом температуры тела.
- Явные проявления интоксикации.
- Увеличивает свои показатели и уровень остаточного азота в плазме (при этом показатель мочевины остается в норме).
- Даже при небольших объемах внутреннего кровотечения больной ощущает сдавливание органов.
- Индикатором внутреннего повреждения могут стать и каловые выделения. Благодаря выводимой крови, они окрашиваются в черный цвет.
Если человек теряет вследствие травмы (последствием которой есть повреждение крупной артерии), проводимой операции или обострения какой бы то ни было болезни, восьмую часть от общего объема работающей крови – наступает острая форма постгеморрагической анемии.
Медиками различается несколько стадий развития острой формы анемии:
- Рефлекторно-сосудистая стадия. Она выражается резким уменьшением значения артериального давления, побледнением кожи и слизистой, тахикардией. Внезапная нехватка кислорода, поступающего к органам, приводит к спазмам периферических сосудов. Чтобы препятствовать дальнейшему падению давления, организм открывает артериоло-венулярные шунты, приводимые к выводу плазмы из органов. Такая само терапия работает на адекватно компенсационный возврат кровяной жидкости к сердцу.
- Гидремическая стадия. По прошествии трех – пяти часов создается база для гидремической компенсации, обусловленной поступлением жидкости из межтканевой области в кровеносные сосуды. При этом происходит раздражение определенных рецепторов, которые включаются в работу по поддержанию объема циркулирующей по сосудам жидкости. Усиленное синтезирование альдостерона ставит заслон в выведении из организма натрия, который стимулирует задержку воды. Однако это ведет и к разжижению плазмы, и как следствие, снижение содержания эритроцитов и гемоглобина. Эта стадия компенсации может проходить в течение двух – трех дней.
- Костномозговая стадия – эта стадия наступает через четыре-пять суток с момента кровотечения. Прогрессирует гипоксия. Растут показатели эритропоэтина. В периферической крови возрастает количество новообразованных эритроцитов (ретикулоцитов), обладающих сниженным показателем количества гемоглобина. Характеристика данной стадии становится гипохромной. Кроме этого, резкая нехватка крови обуславливает снижение железа в крови.

Данная разновидность анемии, хроническая постгеморрагическая анемия, возникает у больного, если он постепенно, на протяжении некоторого времени, дробно теряет кровь. Такой вид анемии может наблюдаться при ряде заболеваний. Например, таких как: рак кишечника, язвенная болезнь двенадцатиперстной кишки или желудка, гингивит, геморрой, и многие другие. Частые, но незначительные кровотечения приводят к общему истощению организма. Возникает железодефицит. В связи с этим, данную патологию по этиологии относят к постгеморрагической анемии, по патогенезу данное патологическое состояние можно отнести к железодефицитным анемиям.
К данной категории медицина относит и анкилостомную анемию, которая проявляется развивающаяся вследствие инвазии (проникновения) простейших класса нематод в организм больного. Эти паразиты присасываются к стенкам кишечника, травмируя его, что вызывает кровотечение, либо, высасывают кровь из своего хозяина, которая является для них питанием.
Исходя из этого, основной целью терапии при постгеморрагической анемии, в любой ее форме, является восстановление в полном объеме плазмы крови, циркулирующей в сосудах, а так же, как следствие, преодоление железодефицита и нехватки эритропоэза. Но это «скорая помощь» для организма. После экстренной реанимации, необходимо обратить свое внимание на первопричину, побудившую к возникновению кровотечения. А проще – необходимо преступить к лечению основного заболевания.

На сегодняшний день врачи констатируют, что постгеморрагическая железодефицитная анемия начинает принимать достаточно широкое распространение. Если говорить коротко, то железодефицитная анемия – это состояние организма, отличающееся патологической нехваткой ионов железа. Причем массовая концентрация этого элемента снижается повсеместно: и в плазме крови, и в костном мозге, и в так называемом запаснике, куда организм накапливает все необходимое про запас. Как результат, происходит сбой в системе синтеза геммы, образуется недостаток в миоглобине и тканевом ферменте.
Современные статистические исследования озвучивают цифру в 50% — это то количество населения, которое в той или иной форме страдают от малокровия. Соединения, в которых встречаются металлы в природе, плохо усваиваются, либо совсем не усваиваются человеческим организмом. При нарушении баланса в поступлении железа в организм и его использования и получаем железодефицитную анемию.
Чаще всего у взрослого населения дефицит железа бывает связан с остро возникшей или хронической кровопотерей. Это диагноз может возникнуть, хотя и достаточно редко, при носовых кровотечениях, стоматологических аспектах потери крови, а так же при травме… Выявлены и исключительные случаи, когда жезодефицитная анемия развилась у донора, который «зачастил с кровосдачей». Причем, как ни странно это звучит, такие отклонения встречаются у доноров-женщин.
У женщин причинами заболевания может послужить как маточное кровотечение, так и сама беременность, а так же болезненные, патологические сбои в менструальном цикле. Лабораторные исследования показывают, что к постгеморрагической анемии с железодефицитом может привести и фибромиома матки, способствующая вымыванию железа и последующим появлением анемических симптомов.
Второе место по частоте заболеваний занимают кровопотери при острых заболеваниях желудочно-кишечного тракта, которые диагностировать на ранних стадиях достаточно проблематично. Легочные кровотечения являются достаточно редким проявлением дефицита железа, как и кровопотери из мочевыводящих путей и почек.
Новорожденные и грудные детки могут страдать от нехватки железа вследствие неправильного предлежания плаценты, либо при ее повреждении во время хирургического вмешательства (кесарева сечения). А также бывают случаи кишечного кровотечения, как проявления инфекционного заболевания.
Причиной в недостатке железа для деток более старшего возраста может быть и скудность пищевого рациона. Малыш просто не получает достаточное количество элемента вмести с теми продуктами, которыми он питается. Так же причиной анемии может быть и нехватка железа у матери во время ее беременности, а так же у недоношенных либо деток из двойни, тройни… Достаточно редко но, причиной возникновения этого недуга может стать и ошибка акушера, который, не дождавшись прекращения пульсации, слишком рано перерезал пуповину.
Не стоит обходить стороной и ситуацию, когда (например, при больших физических нагрузках, беременности и т. д.) резко возрастает потребность организма в нем. Поэтому и возрастает вероятность возникновения постгеморрагической железодефицитной анемии.
Недостаток этого элемента в организме приносит значительный вред иммунной системе человека. Но, как ни странно это звучит, больные, страдающие железодефицитом, меньше болеют инфекционными заболеваниями. Все просто. Железо – отличная питательная среда для некоторых бактерий. Однако, в свете других проблем, игнорировать недостаток железа в организме человека нельзя. Нередки случаи, когда на нехватку железа в крови указывают изменившиеся пристрастия в питании. Например, появляется, не наблюдавшаяся ранее тяга к перченым или соленым продуктам.
Медики выделяют и психологический аспект железодефицита. Зачастую он возникает у людей, наплевательски относящихся к своему здоровью, а, следовательно, и к себе: диеты, ограниченное питание, гиподинамия, отсутствие свежего воздуха, минимум положительных эмоций. Все это не способствует, а угнетает те обменные процессы, которые идут в организме. Проведя исследование, ученые установили, что за всем этим, как правило, стоит глубокая депрессия, психологическая травма.
На сегодняшний день, медицина снабжена достаточно большим арсеналом в виде препаратов железа: конферон, ферамид, жектофер, сорбифер и достаточно много других. Существуют так же и жидкие формы, например, мальтофер, степень всасывания, которого зависит от уровня в организме железодефецита. Этот препарат разрешен к применению даже для новорожденных (даже недоношенных) детей.
Постгеморрагическая анемия у детей возникает достаточно часто и бывает, как и у взрослых и острой (достаточно часто встречающаяся), и хронической (реже встречающаяся).
Новорожденные достаточно ранимы. У них постгеморрагическая анемия достаточно часто возникает при родовых травмах или может возникнуть даже при чрезмерном заборе крови во время лабораторных исследований. У деток же старшего и среднего возраста, основной причиной анемии, зачастую, являются гельминты, которые, присасываясь к стенке желудочно-кишечного тракта, травмируют организм и провоцируют микрокровотечения.
Первые признаки кровотечения у грудничков можно заметить уже через полчаса после начала. У деток более старшего возраста они проявляются на следующий день или немного позже (это не касается острых спонтанных кровотечений). Хроническое проявление заболевания возникает у деток любого возраста значительно реже. Это, как правило: язвенные болезни желудочно–кишечного тракта, варикоз вен, мочекаменная болезнь, полипы, инвазия паразитов, нефрит, геморрагический диатез, врожденный или приобретенный тромбоз.
Симптомы, на основе которых родители должны поднимать тревогу:
- Таки же, как и у взрослых.
- Но первые проявления – это вялость, снижение аппетита, идет приостановка в росте, и малыш начинает хуже набирать вес.
- Одним из первичных признаков начальной стадии заболевания может являться изменение вкусовых пристрастий крохи, вплоть до того, что дети стремятся кушать землю, мел, глину… Это результат железодефицита и нехватка минеральных составляющих в организме малыша. Иногда эти изменения не столь радикальны.
- Идет изменение и в поведении. Малыши становятся капризным и плаксивым, либо в противовес – апатичным.
- Существует и проявление по внешним признакам: ломкость волос и ноготков, шелушение кожи.
- «Лакированный» гладкий язык.
- У девочек подросткового возраста, перебои в менструальном цикле.
- Достаточно часто на фоне постгеморрагической анемии наблюдаются осложнения инфекционного характера: отит, пневмония…
Первое, что необходимо предпринять в ситуации, когда ребенок находится в состоянии геморрагического шока – это реанимационные мероприятия по остановке кровотечения и противошоковой терапии. Струйно и капельно вводят кровезаменяющие препараты. В этот период устанавливается группа крови малыша и его резус принадлежность. Проводится реанимация свежецитратной кровью. Если таковой не имеется, проводят прямое переливание от донора. Параллельно с этим, поводится поддержка гликозидами сердечно сосудистой системы и приписуется диета, богатая белком и витаминами.
Лечение же постгеморрагической анемии у детей сводится в выявлении и лечении первопричины кровотечения, то есть заболевания, вызвавшего потерю крови.
источник
135. Острая и хроническая постгеморрагическая анемия: этиология, патогенез. Картина крови на различных этапах развития болезни.
Постгеморрагическая анемия — анемия, развивающаяся в результате острой и хронической кровопотери.
Классификация. Различают острую и хроническую постгеморрагическую анемию.
Этиология. Острая постгеморрагическая анемиявозникает после быстрой массивной кровопотери при ранении сосудов или их повреждении патологическим процессом.
Хроническая постгеморрагическая анемияразвивается вследствие повторных кровопотерь, вызванных поражением кровеносных сосудов, при ряде заболеваний (язвенная болезнь желудка, геморрой и др.) и нарушением тромбоцитарно-сосудистого и коагуляционного гемостаза (геморрагический синдром).
Патогенез. Острая постгеморрагическая анемия в первые часы после острой кровопотери проявляется относительно равномерным снижением количества эритроцитов и гемоглобина и сохранением нормального цветового показателя (нормохромная анемия); в мазке крови отсутствуют какие-либо характерные изменения эритроцитов.
Через 2—3 дня после остановки кровотечения количество эритроцитов несколько уменьшается вследствие поступления тканевой жидкости в сосуды (относительная эритропения) и разрушения эритроцитов в клетках системы мононуклеарных фагоцитов (абсолютная эритропения). На 4—5-й день после кровопотери усиливается пролиферация клеток эритроцитарного ростка костного мозга под влиянием возросшей при гипоксии продукции эритропоэтина. В крови увеличивается число полихроматофильных эритроцитов, ретикулоцитов, появляются единичные нормобласты (регенераторная анемия). Цветовой показатель снижается (гипохромная анемия), так как ускоренная регенерация опережает созревание клеток, которые не успевают потерять признаки своей незрелости (ядро, гранулы) и насытиться гемоглобином. Кроме того, массивная острая кровопотеря может привести к дефициту железа и снижению синтеза гемоглобина.
Хроническая постгеморрагическая анемиясопровождается уменьшением запасов железа в организме при повторных кровопотерях и, таким образом, возникновением железодефицитной анемии с гипохромней и микроцитозом эритроцитов. При угнетении кроветворения такая анемия может стать гипо- и арегенераторной с резким уменьшением регенеративных форм эритроцитов в мазке крови.
1 В норме число эритроцитов у мужчин составляет 4,5—5,5•1012/л [4,5—5,5 Т/л; по Международной системе единиц (СИ) Т — Тера=1012], у женщин — 3,5—4,5 Т/л; количество гемоглобина у мужчин — 130—160 г/л (8,1—9,9 ммоль/л), у женщин — 120—140 г/л (7,4—8,7 ммоль/л). назад
2 Эритропоэтин (ЭП) — основной регулятор эритропоэза. Этот гликопротеид вырабатывается в постнатальном периоде в эпителиальных и мезангиальных клетках клубочков почек, у плода и при патологии почек — в печени и селезенке. Стимулятором продукции ЭП служит снижение содержания кислорода в почечной ткани и повышение уровня молочной кислоты. ЭП индуцирует эритроидную дифференцировку эритропоэтинчувствительных клеток костного мозга, взаимодействуя с их мембранными рецепторами и вызывая дерепрессию генов с последующим синтезом РНК и ДНК, железотранспортных систем и гемоглобина. При возрастании уровня ЭП в плазме он ускоряет пролиферацию и созревание эритроцитарных клеток. назад
3 Катехоламины, кортикотропин, тиреоидные гормоны, гликокортикоиды, андрогены усиливают утилизацию кислорода, способствуя тем самым развитию гипоксии и образованию ЭП в почках. Кроме того, эти гормоны повышают чувствительность эритропоэтинчувствительных клеток постного мозга к ЭП и тем самым оказывают активирующее влияние на эритропоэз. назад
4 Эритрон — совокупность незрелых и зрелых, неподвижных и циркулирующих, расположенных интра- и экстравазально клеток эритроцитарного ряда, находящихся на всех стадиях развития — образования (резервный, пролиферирующий, созревающий пул в кроветворной ткани), функционирования (циркулирующий пул в крови) и гибели (в макрофагоцитах органов кроворазрушения).
источник