Различают острую и хроническую постгеморрагическую анемии.
Возникает в результате острой массивной потери крови в объеме от 5 мл/кг массы тела и выше (травма, хирургическое вмешательство, желудочные, маточные, кишечные кровотечения, разрыв фаллопиевых труб, нарушение гемостаза и др.). Сразу после потери крови вследствие уменьшения ее массы появляется общеанемические признаки — тахикардия, одышка, бледность кожных покровов и слизистых оболочек, падение АД. Содержание эритроцитов и гемоглобина снижается равномерно (нормоцитемическая гиповолемия), развивается нормохромная анемия. Изменения периферической крови носят стадийный характер. На 2–3-е сутки после кровотечения в кровь поступает тканевая жидкость, масса ее восстанавливается (гидремическая фаза), а количество эритроцитов и гемоглобина снижается, падает гематокрит, но в связи с выходом эритроцитов из депо цветовой показатель сохраняется в норме (нормохромная анемия), развивается лейкопения (утрата лейкоцитов во время кровотечения, гемодиллюция), тромбоцитопения (утрата тромбоцитов при потере крови, потребление при образовании тромба). Наблюдается умеренный анизоцитоз и пойкилоцитоз эритроцитов. Возникшая гипоксия ведет к повышению уровня эритропоэтина и на 4–5-е сутки после кровотечения активируется функция костного мозга (костномозговая фаза компенсации) появляются регенеративные формы эритроцитов — полихроматофилы, единичные нормобласты (полихроматофильные, оксифильные), ретикулоцитоз. Анемия приобретает гипохромный характер, т. к. ускоренная регенерация опережает созревание эритроцитов из-за возникшего дефицита железа. Развивается нейтрофильный лейкоцитоз со сдвигом влево по регенеративному типу.
Данные нарушения обусловлены уменьшением объема циркулирующей крови и гипоксией. В ответ на кровопотерю включаются механизмы компенсации, направленные на восстановление утерянного объема крови и на борьбу с анемическим состоянием (гипоксией).
Развивается в результате длительно повторяющихся небольших кровотечений. Является вариантом железодефицитных анемий, патогенез и проявления обусловлены нарастающим дефицитом железа.
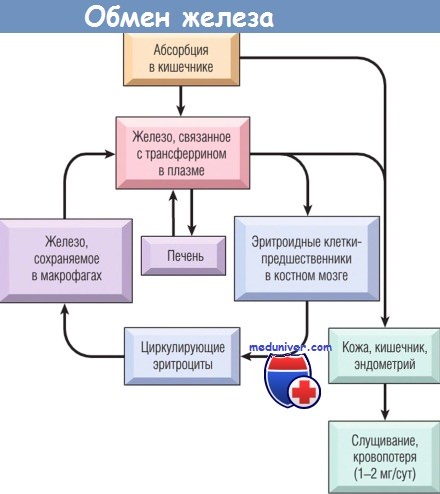
Железо — один из важнейших микроэлементов, входящих в состав организма человека. Взрослому человеку требуется 15–18 мг/сут железа, из которых всасывается 2–2,5 мг. При этом биодоступность содержащегося в пище гемового железа существенно выше, чем негемового. Основные депо железа: печень (гепатоциты и макрофаги), костный мозг, селезёнка, мышцы. Если метаболизм железа нормален, 30–40 % нормобластов костного мозга содержат гранулы ферритина (сидеробласты). Отсутствие сидеробластов характерно для железодефицита. Избыток гранул в сидеробласте служит признаком переполнения организма железом (гемосидероз) или неспособности утилизировать его (сидеробластная анемия). На рис. 2 представлена схема метаболизма железа.
Дефицит железа в организме существует в двух формах, представляющих собой две последовательные стадии одного процесса: латентный (тканевый) дефицит железа (ЛДЖ) и собственно железодефицитная анемия (ЖДА).
ЖДА составляет около 80–90 % всех случаев анемий и является одной из самых распространенных ее форм. Женщины страдают данным заболеванием чаще, чем мужчины, поскольку запасы железа у последних значительно превышают (на 100–200 %) таковые у женщин. Явный и скрытый дефицит железа отмечается почти у 60 % женщин земного шара. Железодефицитные анемии встречаются во всех возрастных группах. Различают «истинные» ЖДА — при абсолютном дефиците железа и «ложные» — при нарушении включения железа в гемм, в отсутствие первичного истинного железодефицита.
Рисунок 2 – Схема метаболизма железа в организме
По патогенетическому принципу с учетом основных этиологических причин железодефицитные анемии делят на пять основных подгрупп (Л.И. Идельсон): 1) связанные с повышенной потерей железа; 2) связанные с недостаточным исходным уровнем железа; 3) связанные с повышенным расходованием железа; 4) связанные с нарушением всасывания железа и недостаточным поступлением его с пищей (алиментарные); 5) связанные с нарушением транспорта железа.
Таблица 3.Причины и механизмы развития железодефицитных состояний
Группы этиологических факторов
Дети недоношенные и новорожденные
Недостаточный исходный уровень железа
Интенсивный рост (пубертатный период)
Повышенное расходование железа
Хроническая кровопотеря: при частых лечебных кровопусканиях, донорстве;
При заболеваниях ССС (гипертоническая болезнь, геморрагическая телеангиэктазия и др.);
При патологии ЖКТ (варикозное расширение вен пищевода, диафрагмальная грыжа, язва желудка и 12-перстной кишки, язвенный колит, дивертикулёз, геморрой и др.);
Из органов мочеполовой системы (алкогольная нефропатия, туберкулёз почек, почечнокаменная болезнь, полипы и рак мочевого пузыря, обильные меноррагии, эндометриоз, миома матки и др.);
Из органов дыхательной системы (рак лёгкого, туберкулёз, бронхоэктазия и др.);
При заболеваниях системы крови (лейкозы, апластическая анемия и др.);
Припатологии системы гемостаза (аутоиммунная тромбоцитопения, гемофилии, ДВС-синдром и др.)
Патологические состояния и болезни
Резекция желудка и кишечника;
Гипосекреция желудочного сока;
Нарушение всасывания железа
Приобретённая гипотрансферринемия (при нарушении белоксинтезирующей функции печени)
Нарушение транспорта железа
Недостаточное поступление железа; нарушение транспорта железа; нарушение всасывания железа; потеря железа
Нарушение всасывания железа
Искусственное вскармливание грудных детей
Недостаточное поступление железа
Избыточные физические нагрузки
Повышенное расходование железа
Нередко действуют комбинации указанных факторов, вызывающих отрицательный баланс железа. Примером ЖДА, развивающейся вследствие комплексного влияния нескольких факторов, является хлороз (от греч. «хлорос» — бледно-зеленый, или «бледная немочь»). Название связано со специфическим цветом лица таких больных. При ЖДА уменьшается содержание железа в плазме крови, костном мозге и в тканевых депо.
Основным звеном патогенеза заболевания является снижение содержания железа в депо, сыворотке крови и костном мозгу. В результате нарушается синтез гемоглобина, возникают гипохромная анемия и трофические расстройства в тканях, признаками которых являются: сухость и вялость кожи, ломкость ногтей, выпадение волос, атрофия слизистой оболочки языка, повышенное разрушение зубов, дисфагия, извращение вкуса, мышечная слабость и др.. В патогенезе клинических проявлений болезни имеет значение: нарушение активности железосодержащих ферментов в тканях организма (цитохром С, цитохромоксидаза, сукцинатдегидрогеназа, пероксидаза, митохондриальная моноаминооксидаза, α-глицерофосфатоксидаза) и недостаточное снабжение тканей кислородом. Признаки гипоксии тканей появляются лишь при значительной выраженности малокровия, когда наступает истощение компенсаторных механизмов, обеспечивающих на ранних этапах развития дефицита железа нормализацию отдачи кислорода из гемоглобина тканям.
Клиническая картина складывается из двух основных синдромов: общеанемического и сидеропенического.
Общеанемический синдром проявляется симптомами, характерными для всех видов анемии: бледность, общая слабость, быстрая утомляемость, обмороки, одышка, тахикардия, систолический шум.
Сидеропенический синдром характеризуется рядом трофических нарушений. Отмечаются: сухость и трещины кожи, преждевременные морщины, ломкость ногтей, койлонихия (катлонихия) — ложкообразные ногти, ангулярный стоматит, атрофия слизистых оболочек рта, пищевода, желудка, дыхательных путей. Нарушается иммунитет, что приводит к хронизации инфекций, частым ОРЗ; развивается мышечная слабость, слабость физиологических сфинктеров. Может возникнуть извращение вкуса (поедание несъедобных продуктов — мела, бумаги и др.), пристрастие к необычным запахам (ацетон, бензин, краска). Нарушается память, концентрация внимания. При дефиците железа резко усиливается абсорбция свинца, и у детей на этом фоне развивается необратимая задержка интеллектуального развития. Нарушение проницаемости мелких сосудов ведет к отекам лица. Иногда возникает «сидеропенический субфебрилитет».
Картина крови. Основным признаком железодефицитной анемии является гипохромия со снижением цветового показателя ниже 0,8 и, соответственно, уменьшением содержания гемоглобина ниже 110 г/л. Количество эритроцитов, как правило, остается на исходном уровне, но в ряде случаев может оказаться сниженным до 2,0-1,5×10 12 /л вследствие нарушения процессов пролиферации клеток эритроидного ряда в костном мозгу и усиления неэффективного эритропоэза (в норме разрушение эритронормобластов в костном мозгу не превышает 10-15%). Ретикулоциты в норме или незначительно увеличены, при прогрессировании ЖДА их количество снижается. Важным морфологическим признаком железодефицитных анемий является анизоцитоз эритроцитов с преобладанием микроцитов.
Нередко развивается нейтропения (в результате уменьшения содержания железосодержащих ферментов в лейкоцитах). СОЭ в норме или незначительно увеличена.
Уровень тромбоцитов может быть незначительно повышен (на фоне кровотечений).
Исследование костного мозга.В КМ определяется нормобластическая гиперплазия с нарушением гемоглобинизации (преобладание базофильных и полихроматофильных нормобластов при снижении оксифильных), снижение индекса созревания нормобластов, снижение количества сидеробластов вплоть до полного их отсутствия. Миелоидный и мегакариоцитарный ростки не изменены.
Биохимический анализ крови – основной диагностический критерий при ЖДА, включающий набор тестов, при помощи которых подтверждается факт дефицита железа в организме:
снижение уровня сывороточного железа,
снижение уровня сывороточного ферритина,
снижение степени насыщения трансферрина железом,
увеличение содержания трансферрина в сыворотке,
повышение общей и латентной железосвязывающей способности сыворотки,
увеличение содержания растворимых рецепторов к трансферритину в сыворотке,
повышение свободного протопорфирина IX в эритроцитах.
Количество железа в сыворотке крови при выраженной ЖДА падает до 5,4–1,8 мкмоль/л при норме 12,5–30,4 мкмоль/л (мужчины; у женщин этот показатель на 10–15% ниже. Под общей железосвязывающей способностью сыворотки понимается количество железа, которое может связаться с трансферрином (в норме 54,0–72,0 мкмоль/л). В норме одна треть трансферрина насыщена железом, а две трети — свободны. Об уровне депонированного железа можно судить по содержанию железа в суточной моче после однократного введения больному 500 мг десферала (продукт метаболизма актиномицетов, избирательно выводящий ион железа из организма). В норме этот показатель соответствует 0,6–1,3 мг железа, а при железодефицитной анемии снижается до 0,2 мг в сутки и менее.
Сывороточный ферритин— очень точный индикатор резервных запасов железа. Он содержит примерно 15-20% общего запаса железа в организме взрослого человека. Определяется почти во всех тканях, особенно высока его концентрация и синтетическая способность в печени, селезенке и костном мозге. Белок в свободном от железа виде называется апоферритином. Ферритин состоит из белковой оболочки, которая окружает ядро трехвалентного железа в виде комплексов окиси и фосфата железа. Каждая молекула апоферритина может сорбировать до 5000 атомов железа, однако большинство молекул ферритина содержат от 1000 до 3000 атомов железа.
Анемии, ассоциированные с заболеваниями внутренних органов, включают анемии при эндокринных заболеваниях, заболеваниях печени и почек.
К числу анемий при эндокринных заболеванияхотносятся анемии при заболеваниях щитовидной и паращитовидных желез, надпочечников, половых желез, гипопитуитаризме и др., в основе патогенеза которых лежит депрессия эритропоэза при дефиците или, напротив, гиперсекреции ряда гормонов. В частности, такие гормоны, как тироксин, кортизол, тестостерон в очень высоких концентрациях вызывают угнетение пролиферативной активности эритроидных прекурсоров. В случае сгущения крови в результате дегидратации (при надпочечниковой недостаточности, гипотиреозе) диагностика анемии может быть затруднена.
К анемиям при заболеваниях печени относятся анемии, возникающие при диффузных поражениях органа (циррозе, хроническом гепатите, гемохроматозе и др.).
Патогенез анемии при заболеваниях печени отличается многообразием патогенетических факторов, что определяется особенностями патогенеза основного заболевания. Выделяют следующие механизмы развития анемии:
угнетение процессов кроветворения в костном мозгу вследствие прямого токсического влияния на клетки-предшественницы гемопоэза алкоголя (при алкогольном поражении печени) и эндогенных токсинов (при нарушениях обезвреживающей и клиренсной функции печени), при нарушениях метаболизма железа и депонирования витамина В12и фолиевой кислоты в пораженной печени;
укорочение продолжительности жизни эритроцитов в результате прямого повреждающего действия токсических продуктов экзогенного (алкоголь) и эндогенного (при эндотоксемии) происхождения, гиперспленизма, при нарушениях внутриклеточного метаболизма эритроцитов (например, в связи с дефицитом в клетках НАДФ + ) и их способности к деформации (вследствие патологии клеточной мембраны при изменениях фракционного состава фосфолипидов, снижении содержания сиаловых кислот);
кровотечения из расширенных вен желудочно-кишечного тракта (при циррозе печени), носовые, геморроидальные и иной локализации (при формирующейся недостаточности синтеза факторов свертывания крови вследствие нарушений белкового обмена).
В подавляющем большинстве случаев при заболеваниях печени регистрируется нормохромная нормоцитарная анемия, при присоединяющемся дефиците железа — микроцитарная нормоили гипохромная, при недостаточности витамина В12и фолиевой кислоты, метастазах рака желудка в печень — макроцитарная анемия нормо- или гиперхромного типа.
Анемии при заболеваниях почекмогут выявляться у больных острым гломерулонефритом, интерстициальным нефритом, хронической почечной недостаточностью. Патогенез анемии при заболеваниях почек определяется снижением продукции эритропоэтина клетками юкстагломерулярного аппарата, депрессией кроветворения в костном мозгу (в результате нарушения пролиферативной активности эритроидных клеток, торможения процессов синтеза гема) и сокращением срока жизни эритроцитов (до 40-50 дней) при действии токсических продуктов азотистого обмена.
Контрольные вопросы по теме:
Охарактеризуйте типовые формы изменений общего объема циркулирующей крови.
Какова этиология олигоцитемических и полицитемических гиповолемий?
Какова этиология олигоцитемических и полицитемических гиперволемий?
Укажите общие механизмы формирования компенсаторно-приспособительных механизмов при кровопотере.
Каков механизм формирования экстренных защитно-приспособительных реакций организма при кровопотерях?
Каков механизм формирования долговременных защитно-приспособительных реакций организма при кровопотерях?
Дайте определение понятию анемия, каковы принципы классификации?
Назовите основные фонды железа в организме?
Перечислите лабораторные показатели, характеризующие состояние красной крови при острой кровопотере?
Перечислите лабораторные показатели, характеризующие состояние красной крови при хронической кровопотере?
Какие Вы знаете анемии, ассоциированные с заболеваниями внутренних органов, какие особенности для них характерны?
Темы реферативных сообщений:
Этиологи и патогенез ювенильного хлороза (у девочек в пубертатный период) при ЖДА
источник
Анемии, развивающиеся при нарушении обмена железа: железодефицитные и железорефрактерные анемии: этиология, патогенез, проявления, особенности картины периферической крови.
Относят: железодефицитные и железорефрактерные анемии.
1) хронические кровопотери (вместе с эритроцитами теряется железо);
2) нарушение всасывания железа (удаление желудка, отсутствие секреции соляной кислоты, заболевания кишечника—энтериты
3) повышенное расходование запасов железа (беременность, лактация, период роста у детей);
4) нарушение включения железа в синтез гема (наследственный дефект ферментов, отравление свинцом).
Железодефицитная анемия может сочетаться с тканевым дефицитом железа в организме, признаками которого являются: ломкость ногтей, выпадение волос, атрофический процесс в слизистой оболочке желудка (атрофический гастрит) и другие симптомы. С развитием атрофического гастрита ухудшается всасывание железа и прогрессирует малокровие.
- Дефицит железа в плазме крови и клетках организма обусловливает снижение его содержания в митохондриях эритроидных клеток костного мозга. 2. Это тормозит синтез гема, соединение его с глобином и, следовательно, образование НЬ.
- Одновременно с этим нарушается синтез и других железосодержащих соединений (как в эритроидных клетках — каталазы, глутатионперок-сидазы, так и в клетках паренхиматозных органов — цитохромов, миоглобина, пероксидазы, каталазы и др.).
- Недостаток указанных ферментов в эритроцитах приводит к снижению резистентности к повреждающему действию перекисных соединений, повышенному их гемолизу и укорочению времени циркуляции в крови.
Сохраняется нормобластический тип кроветворения.
Часто наблюдается умеренная гиперплазия клеток красного ростка гемопоэза. Увеличено число базофильных и полихроматофильных эритробластов при уменьшении количества оксифильных.
Снижено количество эритроцитов и значительно уменьшено содержание НЬ (до 30-40 г/л). Это обусловливает развитие гемической гипоксии. Цветовой показатель снижен до 0,6 и более. Количество ретикулоцитов различно: от нормального до сниженного (при хроническом течении анемии) или повышенного (на начальных этапах анемии). Пойкилоцитоз, анизоцитоз (много микроцитов), наличие «теней» эритроцитов (в связи со сниженным содержанием в них НЬ). Уровень железа (Fe 2+ ) в плазме крови понижен (сидеропения) до 1,8-7,2 мкмоль/л (при норме 12-30 мкмоль/л).
Количество лейкоцитов имеет тенденцию к снижению (за счёт нейтрофилов).
Число тромбоцитов обычно в пределах нормы.
Железорефрактерные (порфиринодефицитные, сидеробластные, сидеро-ахрестические) анемии развиваются в результате нарушения включения в гем железа. В молекуле гема железо связано с одной из разновидностей порфирина — протопорфирином.
Подразделяют на первичные( наследственные) и вторичные (приобретенные):
Первичные анемии – проявления: Костный мозг: повышение числа сидеробластов, увеличение количества базофильных эритробластов, уменьшение числа гемоглобинизированныз эритробластов.
Периферическая кровь: умеренная эритропения, анизоцитоз эритроцитов; гипохромия эритроцитов; пойкилоцитоз эритроцитов, повышение уровня железа в плазме крови.
Приобретенные: Наиболее частые причины: дефицит пиридоксина (витамина В6) и хронические интоксикации (соединениями свинца, алкоголем, антимико-бактериальным средством изониазидом).
Патогенез: При дефиците витамина В6 нарушаются включение железа в молекулу тема и синтез НЬ. В связи с этим увеличивается содержание железа в плазме крови и клетках различных органов. При отравлении свинцом происходит блокада сульфгидрильных групп ферментов синтеза протопорфиринов (в частности, синтетазы 5-аминолевулиновой кислоты, декарбоксилазы уропорфириногена) и как следствие — тема. Нарушение синтеза гема нередко (особенно при отравлении соединениями свинца) сочетается со снижением скорости образования глобина (преимущественно (3-цепи).
В костном мозге увеличено количество эритробластов, а также сидеробластов.
В периферической крови снижено количество эритроцитов (они гипохромные, мишеневидные), увеличено количество ретикулоцитов, повышен уровень железа (до 60-80 мкмоль/л).
Железо обнаруживается также в клетках разных органов и тканей т.е. развивается гемосидероз.
В моче значительно увеличено содержание аминолевулиновой кислоты .
Поражение нервной системы характеризуется развитием энцефалопатии (проявляющейся головной болью, снижением памяти, судорогами). Повреждение ЖКТ проявляется резким снижением аппетита, болями в животе.
Картина крови: незначительное снижение в периферической крови числа эритроцитов, выраженная их гипохромия, анизоцитоз (макроцитоз), пойкилоцитоз, наличие единичных мишеневидных эритроцитов, увеличение содержания железа в сыворотке крови.
источник
В. И. Кривенок, заведующий отделением семейной медицины поликлиники семейного врача (Русановка), г. Киев
Анемией называется клинико-гематологический синдром, характеризующийся уменьшением количества эритроцитов и гемоглобина в крови. Самые разнообразные патологические процессы могут служить основой развития анемических состояний, в связи с чем анемии следует рассматривать как один из симптомов основного заболевания. Распространенность анемий значительно варьирует в диапазоне от 0,7 до 6,9%. Причиной анемии может быть один из трех факторов или их сочетание: кровопотеря, недостаточное образование эритроцитов или усиленное их разрушение (гемолиз).
Среди различных анемических состояний железодефицитные анемии являются самыми распространенными и составляют около 80% всех анемий.
По данным Всемирной организации здравоохранения, каждая 3-я женщина и каждый 6-й мужчина в мире (200 миллионов человек) страдают железодефицитной анемией.
Железо является незаменимым биометаллом, играющим важную роль в функционировании клеток многих систем организма. Биологическое значение железа определяется его способностью обратимо окисляться и восстанавливаться. Это свойство обеспечивает участие железа в процессах тканевого дыхания. Железо составляет лишь 0,0065% массы тела. В организме мужчины с массой тела 70 кг содержится примерно 3,5 г (50 мг/кг массы тела) железа. Содержание железа в организме женщины с массой тела 60 кг составляет примерно 2,1 г (35 мг/кг массы тела). Соединения железа имеют различное строение, обладают характерной только для них функциональной активностью и играют важную биологическую роль. К наиболее важным железосодержащим соединениям относятся: гемопротеины, структурным компонентом которых является гем (гемоглобин, миоглобин, цитохромы, каталаза, пероксидаза), ферменты негеминовой группы (сукцинатдегидрогеназа, ацетил-КоА-дегидрогеназа, ксантиноксидаза), ферритин, гемосидерин, трансферрин. Железо входит в состав комплексных соединений и распределено в организме следующим образом:
- гемжелезо 70%;
- депо железа 18% (внутриклеточное накопление в форме ферритина и гемосидерина);
- функционирующее железо 12% (миоглобин и содержащие железо энзимы);
- транспортируемое железо 0,1% (железо, связанное с трансферрином).
Различают два вида железа: гемовое и негемовое. Гемовое железо входит в состав гемоглобина. Оно содержится лишь в небольшой части пищевого рациона (мясные продукты), хорошо всасывается (на 20-30%), на его всасывание практически не влияют другие компоненты пищи. Негемовое железо находится в свободной ионной форме двухвалентного (Fe II) или трехвалентного железа (Fe III). Большая часть пищевого железа негемовое (содержится преимущественно в овощах). Степень его усвоения ниже, чем гемового, и зависит от целого ряда факторов. Из продуктов питания усваивается только двухвалентное негемовое железо. Чтобы «превратить» трехвалентное железо в двухвалентное, необходим восстановитель, роль которого в большинстве случаев играет аскорбиновая кислота (витамин С). В процессе всасывания в клетках слизистой оболочки кишечника закисное железо Fe 2+ превращается в окисное Fe 3+ и связывается со специальным белком-носителем трансферрином, который осуществляет транспорт железа к гемопоэтическим тканям и местам депонирования железа.
Накопление железа осуществляется белками ферритином и гемосидерином. При необходимости железо может активно освобождаться из ферритина и использоваться для эритропоэза. Гемосидерин является производным ферритина с более высоким содержанием железа. Из гемосидерина железо освобождается медленно. Начинающийся (прелатентный) дефицит железа можно определить по сниженной концентрации ферритина еще до исчерпания запасов железа, при еще сохраняющейся нормальной концентрации железа и трансферрина в сыворотке крови.
Основной этиопатогенетический фактор развития ЖДА дефицит железа. Наиболее частыми причинами возникновения железодефицитных состояний являются:
- потери железа при хронических кровотечениях (наиболее частая причина, достигающая 80%):
- кровотечения из желудочно-кишечного тракта: язвенная болезнь, эрозивный гастрит, варикозное расширение эзофагеальных вен, дивертикулы толстой кишки, инвазии анкилостомы, опухоли, НЯК, геморрой;
- длительные и обильные менструации, эндометриоз, фибромиома;
- макро- и микрогематурия: хронический гломеруло- и пиелонефрит, мочекаменная болезнь, поликистоз почек, опухоли почек и мочевого пузыря;
- носовые, легочные кровотечения;
- потери крови при гемодиализе;
- неконтролируемое донорство;
- недостаточное усваивание железа:
- резекция тонкого кишечника;
- хронический энтерит;
- синдром мальабсорбции;
- амилоидоз кишечника;
- повышенная потребность в железе:
- интенсивный рост;
- беременность;
- период кормления грудью;
- занятия спортом;
- недостаточное поступление железа с пищей:
- новорожденные;
- маленькие дети;
- вегетарианство.
Рекомендуемая ежедневная норма поступления железа с пищей: для мужчин 12 мг, для женщин 15 мг (для беременных 30 мг).
Патогенетически развитие железодефицитного состояния можно условно разделить на несколько стадий:
- прелатентный дефицит железа (недостаточность накопления) отмечается снижение уровня ферритина и снижение содержания железа в костном мозге, повышена абсорбция железа;
- латентный дефицит железа (железодефицитный эритропоэз) дополнительно снижается сывороточное железо, повышается концентрация трансферрина, снижается содержание сидеробластов в костном мозге;
- выраженный дефицит железа = железодефицитная анемия дополнительно снижается концентрация гемоглобина, эритроцитов и гематокрит.
Дигностика ЖДА, основанная на характерной клинической картине и изменении лабораторных показателей (табл. 1).
Таблица 1. Изменение основных лабораторных показателей при железодефицитной анемии
| Лабораторный показатель | Норма | Изменения при ЖДА |
| Гемоглобин | Мужчины — не менее 130 г/л Женщины — не менее 120 г/л | Снижение |
| Морфология эритроцитов | Нормоциты — 68% Микроциты — 15,2% Макроциты — 16,8% | Микроцитоз в сочетании с анизоцитозом и пойкилоцитозом |
| Цветной показатель | 0,86-1,05 | Снижение |
| MCH | 27-31 пг | Снижение |
| MCV | 80-100 фл | Снижение |
| RDV | 11,5-14,5% | Отклонение |
| Ретикулоциты | 2-10‰ | Не изменен |
| Сывороточное железо | Мужчины — 13-30 мкмоль/л Женщины — 12-25 мкмоль/л | Снижение |
| Общая железосвязывающая способность сыворотки | 30-85 мкмоль/л | Повышение |
| Латентная железосвязывающая способность сыворотки | Менее 47 мкмоль/л | Повышение |
| Ферритин | 15-150 мкг/л | Снижение |
| Окрашивание пунктата костного мозга на железо | Наличие сидеробластов | Исчезновение сидеробластов |
В период скрытого дефицита железа появляются многие субъективные жалобы и клинические признаки, характерные для железодефицитных анемий. Пациенты отмечают общую слабость, недомогание, снижение работоспособности. Уже в этот период могут наблюдаться извращение вкуса, сухость и пощипывание языка, нарушение глотания с ощущением инородного тела в горле, сердцебиение, одышка.
При объективном обследовании пациентов обнаруживаются «малые симптомы дефицита железа»: атрофия сосочков языка, хейлит, сухость кожи и волос, ломкость ногтей, жжение и зуд вульвы. Все эти признаки нарушения трофики эпителиальных тканей связаны с тканевой сидеропенией и гипоксией.
Больные железодефицитной анемией отмечают общую слабость, быструю утомляемость, затруднение в сосредоточении внимания, иногда сонливость. Появляются головная боль, головокружение. При тяжелой анемии возможны обмороки. Эти жалобы, как правило, зависят не от степени снижения гемоглобина, а от продолжительности заболевания и возраста больных (табл. 2).
Таблица 2. Распространение симптомов ЖДА в различных возрастных группах
| Симптомы ЖДА | Частота (%) | ||
| Взрослые | Дети | Подростки | |
| Мышечная слабость | ++ | ++ | — |
| Головная боль | + | — | + |
| Снижение памяти | ++ | — | ± |
| Головокружения | + | — | + |
| Кратковременные обмороки | + | — | ± |
| Артериальная гипотония | ++ | ± | — |
| Тахикардия | ++ | — | — |
| Одышка при нагрузке | ++ | + | ++ |
| Боли в области сердца | ++ | — | — |
| Симптомы гастрита | ++ | — | ± |
| Извращение вкуса | + | ++ | — |
| Извращение обоняния | ± | + | — |
++ часто встречается, + встречается редко, — не встречается, ± может встречаться
Железодефицитная анемия характеризуется также изменениями кожи, ногтей и волос. Кожа обычно бледная, иногда с легким зеленоватым оттенком (хлороз) и с легко возникающим румянцем щек, она становится сухой, дряблой, шелушится, легко образуются трещины. Волосы теряют блеск, сереют, истончаются, легко ломаются, редеют и рано седеют. Специфичны изменения ногтей: они становятся тонкими, матовыми, уплощаются, легко расслаиваются и ломаются, появляется исчерченность. При выраженных изменениях ногти приобретают вогнутую, ложкообразную форму (койлонихия). У больных железодефицитной анемией возникает мышечная слабость, которая не наблюдается при других видах анемий. Ее относят к проявлениям тканевой сидеропении. Атрофические изменения возникают в слизистых оболочках пищеварительного канала, органов дыхания, половых органов. Поражение слизистой оболочки пищеварительного канала типичный признак железодефицитных состояний.
Отмечается снижение аппетита. Возникает потребность в кислой, острой, соленой пище. В более тяжелых случаях наблюдаются извращения обоняния, вкуса (pica chlorotica): употребление в пищу мела, известки, сырых круп, погофагия (влечение к употреблению льда). Признаки тканевой сидеропении быстро исчезают после приема препаратов железа.
Во всех случаях железодефицитной анемии необходимо установить непосредственную причину возникновения данного состояния и по возможности ликвидировать ее (чаще всего устранить источник кровопотери или провести терапию основного заболевания, осложнившегося сидеропенией).
Лечение железодефицитной анемии должно быть патогенетически обоснованным, комплексным и нацеленным не только на ликвидацию анемии как симптома, но и на ликвидацию дефицита железа и восполнение его запасов в организме (табл. 3).
Таблица 3. Некоторые препараты железа для перорального применения
| Препарат | Состав | Лекарственная форма и общее содержание железа | Содержание элементарного железа (на прием) | Производитель |
| Монокомпонентные препараты железа ІІ | ||||
| Ферронал | Железа глюконат | Таблетки 300 мг | 12% | CTS |
| Ферронат | Железа фумарат | Суспензия 30 мг/мл | 10 мг/мл | Galena |
| Гемофер пролонгатум | Железа сульфат | Драже 325 мг | 105 мг | Glaxo Wellcome Poznan |
| Ферронал | Железа глюконат | Таблетки 300 мг | 12% | Технолог |
| Хеферол | Железа фумарат | Капсулы 350 мг | 100 мг | Alkaloid |
| Гемофер | Железа хлорид | Капли 157 мг/мл | 45 мг/мл | Terpol |
| Комбинированные препараты | ||||
| Сорбифер дурулес | Железа сульфат, кислота аскорбиновая | Таблетки 320 мг | 100 мг | Egis |
| Тардиферон | Железа сульфат, мукопротеоза, кислота аскорбиновая | Таблетки депо 256,3 мг | 80 мг | Robapharm Pierre Fabre |
| Гино-тардиферон | Железа сульфат, кислота фолиевая мукопротеоза, кислота аскорбиновая | Драже 256,3 мг | 80 мг | Robapharm Pierre Fabre |
| Ферроплект | Железа сульфат, кислота аскорбиновая | Таблетки 50 мг | 10 мг | БХФЗ |
| Ферроплекс | Железа сульфат, кислота аскорбиновая | Таблетки 50 мг | 20% | Biogal |
| Глобирон | Железа фумарат, кислота фолиевая, цианокобаламин, пиридоксин, докузат натрий | 300 мг | 100 мг | Aglowmed |
| Тотема | Железа глюконат, марганца глюконат, меди глюконат | Р-р для внутр. применения Ампулы 5 мг/мл | 50 мг | Innotech International |
| Фенюльс | Железа сульфат, кислота аскорбиновая, никотинамид, витамины группы В | Капсулы 150 мг | 45 мг | Ranbaxy |
| Ранферон-12 | Железа фумарат, кислота фолиевая, цианокобаламин, кислота аскорбиновая, цинка сульфат | Капсулы 305 мг | 100 мг | Ranbaxy |
| Ранферон-12 (эликсир) | Железа аммонийного цитрат, кислота фолиевая, цианокобаламин | Эликсир 200 мг/5мл | 41 мг | Ranbaxy |
| Фенотек | Железа сульфат безводный, кислота аскорбиновая, рибофлавин, тиамина мононитрат, никотинамид, пиридоксина гидрохлорид, кислота пантотеновая | Капсулы 150 мг | Rusan Pharma | |
| Феррамин-Вита | Железа аспарагинат, рибофлавин, цианокобаламин, кислота фолиевая, никотинамид | Таблетки | 60 мг | Галычфарм |
- устранение причины ЖДА;
- лечебное питание;
- ферротерапия;
- профилактика рецидивов.
Больным железодефицитными анемиями рекомендуется разнообразная диета, включающая мясные продукты (телятина, печень) и продукты растительного происхождения (бобы, сою, петрушку, горох, шпинат, сушеные абрикосы, чернослив, гранаты, изюм, рис, гречневую крупу, хлеб). Однако невозможно добиться противоанемического эффекта только диетой. Если даже больной будет питаться высококалорийными продуктами, содержащими животный белок, соли железа, витамины, микроэлементы, можно достичь всасывания железа не более 3-5 мг в сутки. Необходимо применение препаратов железа. В настоящее время в распоряжении врача имеется большой арсенал лекарственных препаратов железа, характеризующихся различным составом и свойствами, количеством содержащегося в них железа, наличием дополнительных компонентов, влияющих на фармакокинетику препарата, различных лекарственных форм.
Согласно рекомендациям, разработанным ВОЗ, при назначении препаратов железа предпочтение отдают препаратам, содержащим двухвалентное железо. Суточная доза должна достигать у взрослых 2 мг/кг элементарного железа. Общая длительность лечения не менее трех месяцев (иногда до 4-6 месяцев). Идеальный железосодержащий препарат должен обладать минимальным количеством побочных эффектов, иметь простую схему применения, наилучшее соотношение эффективность/цена, оптимальное содержание железа, желательно наличие факторов, усиливающих всасывание и стимулирующих гемопоэз.
Показания к парентеральному введению препаратов железа возникают при непереносимости всех пероральных препаратов, нарушении всасывания (неспецифический язвенный колит, энтерит), язвенной болезни желудка и двенадцатиперстной кишки в период обострения, при тяжелой анемии и жизненной необходимости быстрого восполнения дефицита железа. Об эффективности препаратов железа судят по изменениям лабораторных показателей в динамике. К 5-7 дню лечения увеличивается количество ретикулоцитов в 1,5-2 раза по сравнению с исходными данными. Начиная с 10-го дня терапии повышается содержание гемоглобина.
Учитывая прооксидантное и лизосомотропное действие препаратов железа, их парентарельное введение можно сочетать с внутривенным капельным введением реополиглюкина (400 мл один раз в неделю), который позволяет защитить клетку и избежать перегрузки макрофагов железом. Учитывая значительные изменения функционального состояния мембраны эритроцита, активацию перекисного окисления липидов и снижение антиоксидантной защиты эритроцитов при ЖДА, необходимо в схему лечения вводить антиоксиданты, мембраностабилизаторы, цитопротекторы, антигипоксанты, такие как a-токоферол до 100-150 мг в сутки (либо аскорутин, витамин А, витамин С, липостабил, метионин, милдронат и др.), а также сочетать с витаминами В 1 , В 2 , В 6 , В 15 , липоевой кислотой. В некоторых случаях целесообразно применение церулоплазмина.
- Белоус А. М., Конник К. Т. Физиологическая роль железа. К.: Наук. думка, 1991. 104 с.
- Гайдукова С. М., Видиборець С. В., Колесник І. В. Залізодефіцитна анемія. К.: Наук. світ, 2001. 132 с.
- Идельсон Л. И. Гипохромные анемии. М.: Медицина, 1981. 192 с.
- Фармацевтическая опека: Курс лекций для провизоров и семейных врачей / А. А. Зупанец, В. П. Черных, С. Б. Попов и др. ; под ред. В. П. Черныха, И. А. Зупанца, В. А. Усенко. Х.: Мегаполис, 2003. 608 с.
- Коровина Н. А., Заплатников А. Л., Захарова И. Н. Железодефицитные анемии у детей. Руководство для врачей. 2-е изд. Москва, 1999. 56 с.
источник
Железодефицитная анемия — анемия, вызванная недостатком железа в организме в результате нарушения баланса между его поступлением, использованием и потерей. Это самый распространенный вид анемии (80% всей заболеваемости анемиями).
Этиология. Наиболее частой причиной развития железодефицитной анемии (ЖДА) являются повторные и длительные, иногда массивные однократные кровотечения, приводящие к потере железа вместе с эритроцитами. Чаще всего это наблюдается при маточных, реже — желудочно-кишечных, почечных, легочных кровотечениях, при геморрагическом синдроме
ЖДА может возникать при нарушении поступления железа с пищей (при кормлении детей только коровьим или козьим молоком) и повышенном расходе железа в период роста, созревания организма, при беременности, лактации. Кроме того, причиной развития ЖДА служит снижение всасывания железа при заболеваниях пищевого канала (гипоацидный гастрит, хронический энтерит) или резекции его отделов, а также нарушение транспорта железа (гипотрансферринемия при поражении печени, наследственная атрансферринемия 1 ), его утилизации из резервов 2 (при инфекции, интоксикации, глистной инвазии) и депонировании (при гепатитах, циррозе печени).
Патогенез. Экзогенный или эндогенный дефицит железа в организме характеризуется уменьшением и постепенным истощением резервов железа, что проявляется исчезновением гемосидерина в макрофагоцитах печени и селезенки, снижением до 2—5% в костном мозге количества сидеробластов (клетки, содержащие железо в виде гранул ферритина; их число в норме — 20—40%). В крови понижается концентрация сывороточного железа (ги п о си де р е м и я достигает 1,8— 2,7 мкм/л вместо 12,5 — 30,4 мкм/л в норме) и степень насыщения им трансферрина, что приводит к уменьшению транспорта железа в костный мозг. Нарушается включение железа в эритроцитарные клетки, снижается синтез гема в гемоглобине и некоторых железосодержащих и железозависимых ферментов (каталазы, глутатионпероксидазы) в эритроцитах, что повышает их чувствительность к гемолизирующему действию окислителей. Увеличивается неэффективный эритропоэз вследствие возросшего гемолиза эритрокариоцитов в костном мозге и эритроцитов в крови. Продолжительность жизни эритроцитов уменьшается.
В организме при железодефицитной анемии возникают компенсаторные реакции — усиление абсорбции железа в пищевом канале, повышение концентрации трансферрина, гиперплазия эритроцитарного ростка, увеличение интенсивности гликолиза и активности 2,3-дифосфоглицерата в эритроцитах, способствующее лучшей отдаче кислорода тканям. Однако эти реакции оказываются недостаточными, чтобы восполнить дефицит железа в организме и улучшить кислородтранспортную функцию крови при уменьшении общего количества эритроцитов и содержания в них гемоглобина. Возникают морфологические изменения в эритроцитарных клетках костного мозга: гипохромия, связанная с недостаточной гемоглобинизацией, преобладание базофильных нормобластов над ацидофильными в костном мозге, микроцитоз, деструкция ядерных клеток (нарушение митоза, кариорексис, вакуолизация цитоплазмы эритробластов и нормобластов).
Наряду с патологическими изменениями эритропоэза дефицит железа в организме приводит к уменьшению миоглобина и активности железосодержащих ферментов тканевого дыхания. Следствием гемической и тканевой гипоксии при железодефицитной анемии являются атрофические и дистрофические процессы в тканях и органах, особенно выраженные в пищевом канале (глоссит, гингивит, кариес зубов, поражение слизистой оболочки пищевода, атрофический гастрит с ахилией) и сердце (дистрофия миокарда).
Картина крови. Железодефицитная анемия — это анемия с эритробластическим типом кроветворения, гипохромная с низким цветовым показателем (0,6 и меньше). Количество гемоглобина снижается в большей степени, чем число эритроцитов. Для мазка крови характерны гипохромия, «тени» эритроцитов, анулоциты, микроцитоз, пойкилоцитоз. Количество ретикулоцитов зависит от регенераторной способности эритроцитарного ростка (регенераторная или чаще гипорегенераторная анемия).
источник
Дефицит железа — наиболее распространенное во всем мире расстройство, связанное с дефицитом питания. Железодефицитная анемия больше распространена в развивающихся странах, но эта форма анемии часто встречается в США, особенно у детей младшего возраста, молодых девушек и женщин в репродуктивном возрасте. Факторы, лежащие в основе железодефицитной анемии, в разных популяционных группах несколько различаются, и эти факторы лучше рассматривать в контексте нормального метаболизма железа.
а) Метаболизм железа. Среднесуточная диета в западных странах обычно содержит 10-20 мг железа, в основном в виде гема, присутствующего в продуктах животного происхождения (оставшаяся часть представляет собой неорганическое железо в растительной пище). Всасывается 20% железа, входящего в состав гема (гемовое железо), и 1-2% железа, не входящего в состав гема (негемовое железо).
Таким образом, среднего содержания железа в диете западных стран достаточно, чтобы сбалансировать его ежедневную потерю. Общее содержание железа в организме в норме составляет 2 г у женщин и до 6 г у мужчин. Выделяют функциональный и запасной пулы железа. Около 80% функционального железа находятся в гемоглобине, остальные 20% приходятся на долю миоглобина и железосодержащих ферментов, таких как каталаза и цитохромы.
Запасной пул, состоящий из гемосидерина и ферритина, содержит от 15 до 20% общего железа организма. Этот пул у здоровых молодых женщин меньше, чем у мужчин, главным образом из-за потери крови во время менструаций, но дефицит железа у женщин часто наблюдается в результате обильных менструаций или при повышенной потребности в железе во время беременности.
В организме происходит интенсивный обмен (рециклирование) железа между функциональным и запасным пулами. Железо в плазме транспортирует железосвязывающий гликопротеин (трансферрин), синтезируемый в печени. У здоровых людей трансферрин на 35% насыщен железом, и нормальный уровень железа в сыворотке составляет в среднем 120 мкг/дл у мужчин и 100 мкг/дл у женщин. Главная функция трансферрина — доставка железа клеткам, включая эритроидные клетки-предшественники, которым железо необходимо для синтеза гемоглобина. Эритроидные клетки-предшественники имеют высокоаффинные рецепторы трансферрина, опосредующие импорт железа путем эндоцитоза.
Свободное железо высокотоксично, поэтому важно, чтобы железо запасного пула было секвестрировано. Это осуществляется путем прочного связывания железа запасного пула с ферритином или гемосидерином. Ферритин представляет собой распространенный во всех тканях организма комплекс белок-железо, в наибольшем количестве присутствующий в печени, селезенке, костном мозге и скелетных мышцах. В печени большая часть ферритина находится в гепатоцитах. В других тканях, в частности селезенке и костном мозге, ферритин содержится в макрофагах. Гематоциты получают железо из плазмы крови, тогда как железо в макрофагах накапливается в результате разрушения эритроцитов.
В клетках ферритин содержится в цитозоле и лизосомах, в которых частично деградированная белковая оболочка ферритина агрегирует в гранулы гемосидерина. Железо в составе гемосидерина метаболически активно и окрашивается в сине-черный цвет при воздействии ферроцианида калия, составляющего основу красителя берлинская лазурь. В нормальных условиях в организме обнаруживаются лишь следовые количества гемосидерина, в основном в макрофагах костного мозга, селезенки и печени. В перегруженных железом клетках большая часть железа хранится в виде гемосидерина.
Поскольку ферритин поступает в плазму главным образом из запасного пула, уровень железа в плазме хорошо коррелирует с запасами железа в организме. При дефиците железа уровень ферритина в сыворотке всегда ниже 12 мкг/л, тогда как при перегрузке железом этот показатель достигает 5000 мкг/л. Физиологическое значение запасного пула железа состоит в том, что оно может быть быстро мобилизовано в случае возрастания потребности в нем, например после кровопотери.
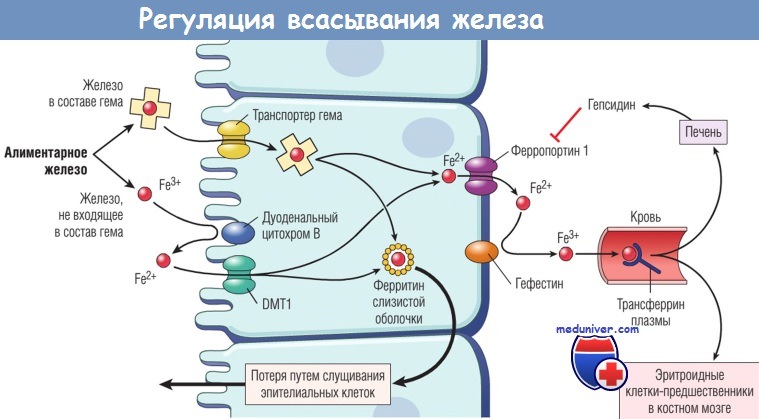
Баланс железа поддерживается в основном за счет регуляции абсорбции алиментарного железа в проксимальном отделе двенадцатиперстной кишки. Железо необходимо для клеточного метаболизма, но высокотоксично в избытке, поэтому общие запасы железа в организме должны тщательно регулироваться. Не существует регулируемого пути экскреции железа, которая ограничена 1-2 мг/сут за счет слущивания эпителиальных клеток слизистой оболочки и кожи. По мере возрастания запасов железа абсорбция падает и наоборот. Пути, ответственные за абсорбцию железа, к настоящему времени изучены достаточно детально и немного различаются у гемового и негемового.
Негемовое железо в просвете кишечника находится главным образом в трехвалентном состоянии (Fe3+) и сначала должно быть восстановлено до двухвалентного (Fe21) посредством ферриредуктаз — цитохрома В и STEAP3. Затем Fe2+ транспортируется через апикальную мембрану двухвалентным металлотранспортером 1. Абсорбция негемового железа вариабельна и часто неэффективна; ее могут подавлять вещества, присутствующие в пище и стабилизирующие Fe3+, и усиливать агенты, стабилизирующие Fe2+. Часто абсорбируются менее 5% негемового железа из пищи.
В отличие от этого количество абсорбируемого гемового железа из гемоглобина, миоглобина и других продуктов животного происхождения достигает 25%. Гемовое железо переходит через апикальную мембрану в цитоплазму с помощью транспортеров, характеристики которых изучены не до конца. Здесь оно метаболизируется с высвобождением Fe2+, которое поступает в общий пул вместе с Fe2+, высвобожденным из негемового железа. Поступившее в дуоденальные клетки железо может транспортироваться в кровь или нет, что зависит от запасов железа в организме. Fe2+, предназначенное для поступления в циркуляцию, транспортируется из цитоплазмы через базолатеральную мембрану энтероцитов ферропортином. Этот процесс сопряжен с окислением Fe2+ до Fe3+, осуществляемым ферриоксидазами гефестином и церулоплазмином.
Вновь абсорбируемое Fe3+ быстро связывается с белком плазмы трансферрином, который доставляет железо клеткам-предшественникам эритроцитов в костном мозге.
Двухвалентный металлотранспортер 1 и ферропортин, широко распространенные в организме, участвуют в транспорте железа в другие ткани. Например, двухвалентный металлотранспортер 1 опосредует поступление функционального железа, высвободившегося из эндоцитированного трансферрина, в цитозоль клеток-предшественников эритроцитов в костном мозге через мембраны лизосом, а ферропортин играет важную роль в высвобождении железа из запасного пула в макрофагах.
Абсорбцию железа регулирует гепсидин — небольшой циркулирующий пептид, синтезируемый в печени и высвобождаемый в ответ на повышение уровня железа в печени. Гепсидин ингибирует перенос железа из энтероцитов в плазму, связывая ферропортин и вызывая его эндоцитоз и деградацию. В результате, как только уровень гепсидина возрастает, железо захватывается дуоденальными клетками в форме ферритина слизистых оболочек и утрачивается при отторжении этих клеток. Таким образом, когда организм переполняется железом, высокий уровень гепсидина ингибирует его абсорбцию в кровь.
И наоборот, при низких запасах железа в организме синтез гепсидина падает, и это облегчает абсорбцию железа. Ингибируя ферропортин, гепсидин не только снижает захват железа из энтероцитов, но и супрессирует высвобождение железа из макрофагов, которые представляют собой важный источник железа, используемого эритроидными клетками-предшественниками для синтеза гемоглобина. Это обстоятельство играет важную роль в патогенезе анемии при хронических заболеваниях.
Изменение уровня гепсидина имеет первостепенное значение при заболеваниях, сопровождающихся нарушениями метаболизма железа. Как будет указано далее, анемию при хронических заболеваниях частично вызывают воспалительные медиаторы, повышающие продукцию гепсидина в печени. Редкую форму микроцитарной анемии вызывают мутации, блокирующие TMPRSS6 — печеночную трансмембранную серинпротеазу, в норме супрессирующую продукцию гепсидина, когда запасы железа снижены.
У пациентов с такой мутацией повышен уровень гепсидина, что приводит к падению абсорбции железа и отсутствию ответа на терапию железосодержащими препаратами. И наоборот, активность гепсидина несоразмерно низка как при первичном, так и при вторичном гемохроматозе — синдроме, возникающем при системной перегрузке железом. Вторичный гемохроматоз может развиться при заболеваниях, ассоциированных с неэффективным гемопоэзом, например при большой b-талассемии и МДС. Посредством еще недостаточно изученных механизмов неэффективный эритропоэз супрессирует образование гепсидина в печени даже при высоком уровне запасов железа. Как указано в главе 18, различные наследственные формы первичного гемохроматоза ассоциируются с мутациями гепсидина или генов, регулирующих его экспрессию.
Железо, абсорбированное из кишечника, связывается с трансферрином плазмы и транспортируется в костный мозг,
где доставляется развивающимся эритроцитам и включается в гемоглобин.
Зрелые эритроциты поступают в кровоток, и через 120 сут их захватывают и разрушают макрофаги,
главным образом в селезенке, печени и костном мозге.
Там железо высвобождается из гемоглобина и включается в новый цикл, связываясь с трансферрином плазмы.
Количество абсорбируемого из кишечника железа сбалансировано его потерей за счет слущивания кератиноцитов,
энтероцитов и клеток эндометрия (у женщин).
б) Этиология. Причинами дефицита железа могут быть:
(1) недостаток железа в пище;
(2) нарушение абсорбции;
(3) повышенная потребность в железе;
(4) хроническая кровопотеря (что наиболее важно).
Чтобы поддерживать нормальный баланс железа, каждые сутки из пищи должно абсорбироваться 1 мг железа. Поскольку из поступающего с пищей железа абсорбируется только 10-15%, то ежедневно в организм взрослого мужчины должно поступать 7-10 мг железа, а взрослой женщины — 7-20 мг. Среднесуточный прием железа с пищей в западных странах составляет 15-20 мг, это количество для большинства мужчин избыточно, а для многих женщин — минимально необходимо. Биодоступность железа в пище — столь же важный фактор, как и его общий уровень.
Железо гема абсорбируется в гораздо большей степени, чем неорганическое железо, на абсорбцию которого влияют другие компоненты пищи. Абсорбцию неорганического железа повышают аскорбиновая кислота, лимонная кислота, аминокислоты и сахара, присутствующие в пище, а ингибируют абсорбцию соли дубильной кислоты (содержатся в чае), карбонаты, оксалаты и фосфаты.
Недостаток железа в пище редко встречается в развитых странах, где 65% алиментарного железа представлено в легко абсорбируемой гемовой форме, обеспечиваемой мясной пищей. Иное наблюдается в развивающихся странах, где источником железа служит в основном растительная пища, в которой оно присутствует в плохо абсорбируемой неорганической форме. Недостаток железа в пище отмечается в особых группах населения:
— грудные дети, составляющие группу высокого риска вследствие очень малого содержания железа в грудном молоке. Грудное молоко человека содержит лишь
0,3 мг/л железа. Количество железа в коровьем молоке в 2 раза выше, однако его биодоступность низкая;
— бедные люди, питание которых недостаточно в любом возрасте вследствие социально-экономических причин;
— пожилые люди, употребляющие мало мяса в силу низких доходов или плохого состояния зубов;
— подростки, употребляющие нездоровую (суррогатную) пищу.
Нарушение абсорбции происходит при спру, стеаторее и хронической диарее. Гастрэктомия ухудшает абсорбцию, уменьшая содержание соляной кислоты и время прохождения пищи через двенадцатиперстную кишку. Как указано ранее, на абсорбцию влияют также специфические компоненты пищи.
Повышенная потребность в железе служит важной причиной его дефицита у детей и подростков, а также у женщин во время беременности и в период предменопаузы. Женщины из бедных слоев общества, много и часто рожающие, имеют крайне высокий риск развития дефицита железа.
Наиболее распространенной причиной дефицита железа в западных странах является хроническая кровопотеря. Наружное кровотечение или геморрагии в желудочно-кишечный, мочевой либо половой тракты истощают запасы железа. При дефиците железа у взрослых мужчин и женщин после менопаузы в западных странах следует прежде всего думать о кровотечении в желудочно-кишечном тракте, если не доказано иное. Сразу же пытаться объяснить дефицит железа у таких лиц другими причинами — значит пропустить скрытый рак органов пищеварения или другое поражение с кровотечением.
При внимательном клиническом исследовании пациента с необъяснимой железодефицитной анемией иногда обнаруживают скрытое кровотечение или опухоль и тем самым спасают жизнь больного.
Показан захват железа эпителиальными клетками двенадцатиперстной кишки.
Если запасов железа в организме достаточно и эритропоэтическая активность в норме, уровень гепсидина в плазме повышается.
Это ведет к снижению уровня ферропортина и захватыванию абсорбированного железа,
которое утрачивается при слущивании эпителиальных клеток двенадцатиперстной кишки.
И наоборот, когда запасы железа в организме уменьшаются или усиливается эритропоэз,
уровень гепсидина падает и активность ферропортина возрастает,
в результате чего большее количество абсорбированного железа переносится на ферритин плазмы.
DMT1 — двухвалентный металлотранспортер 1.
в) Патогенез. Независимо от причин дефицит железа приводит к микроцитарной гипохромной анемии. В начале хронической кровопотери или развития других состояний на фоне отрицательного баланса железа его резервов в форме ферритина и гемосидерина может быть достаточно, чтобы поддержать нормальные уровни гемоглобина, гематокрита, железа в сыворотке и насыщение им трансферрина. В результате прогрессирующего истощения этих резервов сначала снижаются уровни железа в сыворотке и насыщения им трансферрина, не вызывая анемии. На этой ранней стадии возрастает эритроидная активность в костном мозге.
Анемия появляется лишь тогда, когда запасы железа истощены полностью, что сопровождается снижением содержания железа в сыворотке, ферритина и уровня насыщения железом трансферрина.
г) Морфология. В костном мозге повышается (от низкого уровня до умеренного) количество эритроидных клеток-предшественников. Диагностически важным признаком служит отсутствие железа в макрофагах костного мозга, лучше всего определяемое с помощью окрашивания аспиратов костного мозга берлинской лазурью. В мазках периферической крови эритроциты выглядят небольшими (микроцитарными) и бледными (гипохромными). Нормальные эритроциты с достаточным содержанием гемоглобина имеют центральную зону просветления величиной примерно 1/3 диаметра клетки.
При развившейся железодефицитной анемии эта зона увеличена, а гемоглобин виден лишь как узкий ободок. Характерным является также пойкилоцитоз.
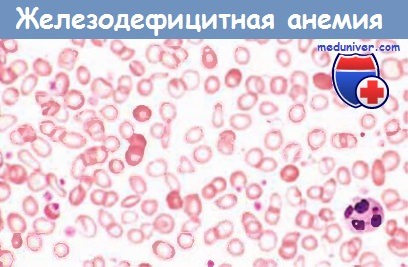
Обратите внимание на мелкие эритроциты с узким ободком из гемоглобина.
Некоторые из них имеют вытянутую форму («клетки-карандаши»).
От этих клеток разительно отличаются немногочисленные, содержащие нормальное количество гемоглобина эритроциты,
присутствующие в крови пациента после недавно проведенной гемотрансфузии.
д) Клинические признаки. Клинические проявления анемии неспецифичны и подробно были описаны ранее. Доминирующие признаки и симптомы часто обусловлены причинами развития анемии, например желудочно-кишечными или гинекологическими заболеваниями, недостаточным питанием, беременностью и мальабсорбцией. При тяжелом и продолжительном дефиците железа истощение железосодержащих ферментов в клетках всего организма проявляется также койлонихией (вогнутые ногти), алопецией, атрофическими изменениями языка и слизистой оболочки желудка и кишечной мальабсорбцией.
Снижение количества железа в центральной нервной системе может привести к извращению аппетита (пикацизму), при котором больные начинают употреблять в пищу несъедобные предметы, например глину, или такие пищевые ингредиенты, как мука. У больных периодически отмечаются движения нижних конечностей во время сна. Дегенерация мышц пищевода, микроцитарная гипохромная анемия и атрофический глоссит — триада главных признаков редкого синдрома Пламмера-Винсона.
Диагноз «железодефицитная анемия» основывают на данных лабораторных исследований. Уровни гемоглобина и гематокрита обычно умеренно снижены. Также наблюдаются микроцитоз, гипохромия и умеренная степень пойкилоцитоза. Содержание железа и ферритина в сыворотке снижено, а общая железосвязывающая способность плазмы, отражающая уровень трансферрина, высока. Низкий уровень железа в сыворотке в совокупности с повышенной железосвязывающей способностью плазмы приводит к падению насыщения трансферрина ниже 15%. Уменьшение запасов железа ингибирует синтез гепсидина, и его уровень в сыворотке снижается.
При неосложненном дефиците железа терапия железосодержащими препаратами per os примерно через 5-7 сут приводит к повышению количества ретикулоцитов, затем наблюдается постепенное увеличение количества эритроцитов и нормализация показателей красной крови.
источник