ФДА — заболевание, обусловленное истощением запасов фолиевой кислоты в организме, следствием чего является нарушение синтеза ДНК в клетках. Основное проявление заболевания — гиперхромная (макроцитарная) анемия.
Эпидемиология.ФДА является редким заболеванием, частота встречаемости которого на несколько порядков ниже, чем В12ДА.
Этиология.Причиной дефицита фолиевой кислоты является увеличение ее потребности во время беременности с одновременным ограничением поступления с пищей. Недостаточное поступление фолиевой кислоты с пищей может быть у лиц, злоупотребляющих алкоголем, наркоманов, малообеспеченных и престарелых людей, которые употребляют в пищу дешевые консервированные продукты.
Всасывание фолиевой кислоты нарушается у лиц, длительно принимающих противосудорожные препараты (дифенин, фенобарбитал), антагонисты фолиевой кислоты (метотрексат).
Патогенез.Дефицит фолиевой кислоты, как и дефицит витамина В12, приводит к развитию мегалобластного кроветворения в костном мозге и развитию гиперхромной (макроцитарной) анемии.
Фолиевая кислота участвует в синтезе дезокситимидинмонофосфата из дезоксиуридинмонофосфата. Данная реакция необходима для обеспечения нормального синтеза ДНК в клетке. Механизм этой реакции был рассмотрен в разделе, посвященном В12ДА. Явления фуникулярного миелоза у больных с ФДА отсутствуют.
Жалобы, связанные с наличием анемии.
При осмотре: бледность кожи и слизистых оболочек. Иногда — легкая иктеричность склер.
Клинически имеются некоторые особенности фолиеводефицитной анемии по сравнению с В12ДА. Реже бывают боли в языке, нет признаков фуникулярного миелоза.
Диагностика.Подозрение на дефицит фолиевой кислоты возникает при выявлении в гемограмме гиперхромной (макроцитарной) анемии с нормальным или низким количеством ретикулоцитов при отсутствии изменений в количестве гранулоцитов и тромбоцитов. Выявление характерной картины мегалобластного кроветворения позволяет с 50% степенью вероятности говорить о дефиците фолиевой кислоты. Решающим методом диагностики является определение фолиевой кислоты в эритроцитах. В норме ее содержание в эритроцитах колеблется от 100 до 450 нг/л. При ФДА содержание фолиевой кислоты в эритроцитах снижается.
При исследовании периферической крови — гиперхромная (макроцитарная) анемия. Снижение содержания гемоглобина и эритроцитов. Других отклонений в гемограмме, как правило, не отмечается. Повышение содержания непрямого билирубина отмечается крайне редко.
Патоморфология костного мозга.Тип гемопоэза — мегалобластное кроветворение. Картина костного мозга при ФДА практически идентична таковой при В12ДА.
Дифференциальная диагностика.В первую очередь, ФДА приходится дифференцировать от В12ДА, затем — от гемолитических анемий, МДС. Для дифференциальной диагностики с В12ДА определяют содержание метилмалоновой кислоты в моче. Ее количество повышено при дефиците витамина В 2 и не изменяется при дефиците фолиевой кислоты. Иногда с диагностической целью прибегают к назначению цианокобаламина и фолиевой кислоты поочередно.
Лечение.Для лечения больных с ФДА используют препараты фолиевой кислоты в дозе 5-10 мг/сут. Длительность курса определяется сроком нормализации содержания гемоглобина в крови.
Прогнозу больных с ФДА благоприятный.
Профилактика. В профилактике дефицита фолиевой кислоты нуждаются беременные женщины, а также пациенты, принимающие препараты, способные нарушать метаболизм фолиевой кислоты. Для профилактики ФДА используют препараты фолиевой кислоты в дозе 5 мг/сут.
источник
Фолиеводефицитная анемия – одна из разновидностей анемии, которая обусловлена дефицитом фолиевой кислоты и её производных (фолатов). Такое нарушение приводит к мегалобластному типу образования кровяных телец.
Такую форму заболевания относят к пернициозному (гибельному) виду. Устаревшее название определяло такое нарушение, как злокачественное малокровие, которое вызывается недостатком витаминов В12 и В9. К дефициту этих веществ особенно чувствительны нервные клетки и костный мозг.
Патогенез анемии основан на нарушении кроветворения. Для нормального образования и развития эритроцитов – клеток, отвечающих за транспортировку кислорода в крови – необходимо достаточное количество витамина В12, железа и фолатов. Ограничение какого-либо компонента ведёт к нарушению развития кровяных клеток, нарушается синтез ДНК. Происходит недоразвитие нормальных эритроцитов, их ядерная структура нарушается. Процесс останавливается на стадии предшественников – мегалобластных клеток (отсюда и классификация анемии как мегалобластная). Такие клетки неспособны сцеплять и переносить кислород.
Особенностью этого вида анемии является:
- синтез гемоглобина не нарушен;
- может провоцировать тромбоцитопению – состояние, при котором снижен уровень тромбоцитов. Оно характерно частыми кровотечениями;
- вызывает лейкопению –понижение в крови уровня лейкоцитов, ведущее к резкому падению иммунитета.
Витамин В и его производные сам организм не синтезирует. Они должны поступать с пищей или с витаминными препаратами. Характерными причинами дефицита фолатов могут стать:
- снижение поступления необходимого элемента с продуктами;
- плохое всасывание, связанное с нарушениями работы ЖКТ или врождёнными заболеваниями;
- болезни печени, которые разрушают «депо» фолиевой кислоты в гепатоцитах;
- избыток отравляющих веществ в крови, поступающих с алкоголем или наркотиками, особенно при хроническом алкоголизме;
- длительный приём некоторых препаратов, обладающих повышенной токсичностью (противотуберкулёзных, противосудорожных, антивирусных);
- повышенный расход витамина В9 во время беременности;
- регулярная процедура гемодиализа.
Одной из причин, провоцирующих развитие анемии, является наследственный дефект. В этиологии ФДА в детском возрасте играют роль такие факторы:
- недоношенность или малый вес новорожденного;
- переход на кормление ребёнка козьим молоком;
- хроническое воспаление тонкой кишки (энтерит);
- инфекционные заболевания.
Даже простой дисбактериоз кишечника может вызвать анемию в лёгкой форме. Наличие глистной инвазии, особенно у детей, это прямая причина для развития тяжёлой фролиеводефицитной анемии.
Фолиеводефицитная анемия имеет типичные признаки и клинические проявления, которые присущи пернициозному виду:
- расстройства пищеварительной системы (частые поносы);
- плохой аппетит;
- приступы тошноты и рвоты;
- неприятные ощущения в коже (покалывания, озноб, жжение);
- расстройства двигательной функции (неустойчивость походки, парезы);
- общая слабость и частая одышка;
- бледность и желтизна кожных покровов, особенно на лице;
- учащённое сердцебиение.
Анемия имеет свои характерные черты. Отличительными признаками дефицита витамина В9 являются:
- ярко-красный цвет слизистой языка, его поверхность становится «лакированной»;
- нервные расстройства (галлюцинации, возбудимость, судороги);
- чувство покалывания или онемения в нижних конечностях.
Также характерными признаками, которые выявляют при помощи обследований и анализов, являются сниженный показатель фолиевой кислоты и наличие в костном мозге аномальных клеток – мегалобластов.
Развитие анемии проходит в два этапа:
- Субклиническая.
- Клиническая.
Первая стадия характерна вялотекущим развитием со слабовыраженными общими симптомами. Явные признаки нехватки витамина отсутствуют. Возможны жалобы на легкие периодические недомогания (быстрая усталость, слабость, головокружения). При проведении анализа показатели содержания витамина В9 будут уже ниже нормы.
Вторая стадия наступает, когда запасы фолиевой кислоты истощаются. На клиническом этапе происходит:
- резкое снижение уровня витамина в крови;
- обострение хронических заболеваний, особенно аритмия и стенокардия;
- появление отёков;
- усиление общих симптомов.
Резкий переход анемии во вторую стадию может спровоцировать психологический стресс или хирургическая операция, сопровождающаяся большой кровопотерей.
При нормальном употреблении фолатов (суточная норма около 50 мкг) запас в организме составляет – 5-10 мг. Чтобы развилась ФДА, фолиевая кислота не должна поступать 4 месяца.
Основными методами диагностики являются лабораторные обследования. Сложности точной диагностики состоят в том, что ФДА часто развивается вместе с дефицитом железа вследствие одной этиологии. В лабораторных характеристиках наблюдают одинаковые сдвиги в показателях при обоих видах анемии. Поэтому при таких смешанных формах анемии анализы становятся малоэффективными. В этом случае решающую роль в постановке диагноза будет играть анамнез и клиника заболевания.
При лабораторной диагностике проводят:
- биохимический анализ крови;
- исследования периферической крови.
Рекомендуемое время для сдачи анализов – утро. Приём пищи не влияет на результат. Главное – не должно быть признаков обезвоживания. Такое осложнение влияет на итоги обследования.
Для фолиеводефицитной анемии характерны показатели:
- уровень ферритина высокий;
- макроцитоз (большой размер эритроцитов);
- снижено количество ретикулоцитов (менее 0,2%);
- содержание сывороточного железа повышено;
- уровень фолиевой кислоты низкий;
- умеренно повышен билирубин;
- содержание В12 в норме;
- снижен цветовой показатель;
- признаки повышенного образования мегалобластов в костном мозге.
Эти данные позволяют установить тип анемии.
Биохимический анализ не считается специфичным для такого вида анемии, но его данные помогут выявить возможные патологии, которые содействуют развитию заболевания.
Часто на практике встречаются комбинация ФДА с В12-дефицитной анемией. У них очень схожие признаки. Наблюдается общая картина крови и костного мозга. В данном случае проводят дифференцированный диагноз.
Норма концентрации основного показателя (фолиевой кислоты) в эритроцитах или сыворотке составляет 100-425 нг/л.
При необходимости проводят специфические обследования:
- анализ крови для определения группы и резуса, если понадобится переливание крови при тяжёлой форме анемии;
- пункция костного мозга;
- рентгенограмма пищеварительной системы;
- анализ мочи;
- анализ на выявление глистной инвазии.
Дополнительные меры обеспечивают более точный диагноз, который помогают выявить сопутствующие заболевания, провоцирующие развитие ФДА.
Есть анализ, определяющий точное содержание фолиевой кислоты в сыворотке (норма от 3 – 16нг/л). Он требует дорогостоящих реактивов и проводится не во всех лабораториях.
До назначения лечения необходимо исключить дефицит В12, иначе терапия фолиевой кислотой не предотвратит развитие неврологических нарушений. Терапия анемии состоит в приёме препаратов с фолиевой кислотой.
Суточная необходимая доза фолатов – 50 мкг. В детском возрасте и во время беременности потребность в витамине В9 возрастает в 2-3 раза.
Рекомендуется совмещать приём витамина В9 с препаратами железа, потому что фолиеводефицитная анемия часто смешана с железодефицитной формой заболевания.
В ходе комплексной терапии используют диету, обогащённую продуктами с высоким содержанием фолиевой кислоты. К ним относятся:
- яйца;
- зелёные салаты (шпинат, кресс-салат, рукола);
- говяжья печень;
- грейпфрут;
- продукты пчеловодства;
- выпечка с использованием живых дрожжей.
Как правило, при средних и тяжёлых формах анемии, диету применяют в сочетании с приёмом лекарственных препаратов витамина В9.
В отдельных случаях, при трудностях постановки диагноза и наличие осложнений, возможна госпитализация.
Как правило, прогноз при фолиеводефицитной анемии благоприятный. При своевременном адекватном лечении образование эритроцитов нормализуется, их уровень повышается. Костный мозг активно восстанавливается.
Первыми мерами по профилактики анемии являются:
- своевременная постановка на учёт всех, кто находится в группе риска;
- питание, обогащённое витаминами и микроэлементами;
- комплексное обследование и анализы при первых подозрениях на анемию;
- прём препаратов фолиевой кислоты с комбинации с железом и витамином В12 (в профилактических дозах);
- своевременное выявление и лечение сопутствующих заболеваний, провоцирующих нехватку В9.
Особое внимание необходимо уделять беременным женщинам, недоношенным малышам и детям с врождёнными патологиями.
В повышенной дозе витамина нуждаются:
- болеющие псориазом или дерматитом;
- пациенты с другими видами анемии;
- принимающие лекарственные препараты, которые препятствуют всасыванию витамина В9.
Средняя доза для профилактики составляет 5 мг в сутки.
Фолиеводефицитная анемия хорошо поддаётся лечению и профилактике. Важно вовремя проходить обследования. При подтверждении диагноза следует соблюдать все рекомендации и назначения врача и не прерывать самостоятельно курс терапии.
Лечение фолиеводефицитной анемии – простое и эффективное. При грамотном назначенном приеме фолиевой кислоты и прохождении полного курса лечения происходит быстрое восстановление работы кроветворной системы и костного мозга. Осложнения возможны только при поздно начатом лечении и ошибочном диагнозе.
источник
Дефицит фолиевой кислоты (а точнее, птероилмоноглутаминовой кислоты) приводит к развитию мегалобластной анемии с теми же характеристиками, что присущи анемии вследствие дефицита витамина В12. Производные FH4 выполняют функцию промежуточного звена в переносе таких моноуглеродных групп, как формиловые и метальные, между различными соединениями. FH4 служит акцептором моноуглеродных фрагментов, получаемых из таких агентов, как серин и формиминоглутаминовая кислота.
Возникающие в результате этих процессов производные FH4, в свою очередь, отдают приобретенные моноуглеродные фрагменты в реакциях синтеза различных метаболитов. Следовательно, FH4 можно рассматривать в качестве биологического посредника в серии обменных процессов с участием моноуглеродных компонентов. К наиболее важным метаболическим процессам, зависимым от такого переноса, относят:
(1) синтез пуринов;
(2) превращение гомоцистеина в метионин (реакция, в которой также необходимо участие витамина B12);
(3) синтез дезокситимидилатмонофосфата.
В первых двух реакциях FH4 высвобождается из своего производного, выполнявшего функцию носителя моноуглеродной группы, и становится вновь доступной для акцепции другого моноуглеродного фрагмента, повторно поступая в донорский пул. В реакции синтеза дезокситимидинмонофосфата образуется дигидрофолат, который должен быть восстановлен дигидрофолатредуктазой для повторного входа в пул FH4. Редуктазный этап имеет существенное значение, т.к. этот фермент чувствителен к ингибирующему действию различных агентов. Среди молекул, синтез которых зависит от фолатов, вероятно, биологически наиболее важной является дезокситимидинмонофосфат, поскольку эта молекула необходима для синтеза ДНК.
Таким образом, подавление синтеза ДНК в результате дефицита как витамина В12, так и фолиевой кислоты служит непосредственной причиной мегалобластоза.
Этиология. Существуют три главные причины дефицита фолиевой кислоты:
(1) сниженное поступление в организм;
(2) повышенная потребность;
(3) нарушения утилизации.
Человек полностью зависит от пищевых источников фолиевой кислоты. Ежедневная потребность в ней составляет 50-200 мкг. В большинстве случаев обычная диета содержит достаточное количество фолиевой кислоты. Наиболее богатым ее источником служит зелень, в частности салат латук, шпинат, спаржа и брокколи. Меньшее количество содержат некоторые фрукты (лимон, банан, дыня) и продукты животного происхождения (например, печень). Фолиевая кислота в этих продуктах присутствует в основном в форме фолилполиглутаматов.
Полиглутаматы чувствительны к термической обработке (кипячение, пропаривание или жарение в течение 5-10 мин), при которой разрушается до 95% фолиевой кислоты. Кишечные конъюгазы расщепляют полиглутаматы на моноглутаматы, которые легко всасываются в проксимальном отделе тощей кишки. Во время абсорбции в кишечнике они превращаются в 5-метилтетрагидрофолаты, нормальную транспортную форму фолатов. Запасы фолатов в организме относительно ограниченны, и при недостаточном поступлении фолиевой кислоты с пищей дефицит может возникнуть уже через несколько недель или месяцев.
Сниженное поступление фолиевой кислоты в организм может происходить или в случае неадекватной диеты, или вследствие нарушений абсорбции в кишечнике. Полноценное питание с избытком обеспечивает фолиевой кислотой организм взрослого человека, т.е. дефицит фолиевой кислоты почти всегда возникает в результате недостаточного питания. Чаще всего это наблюдается у страдающих хроническим алкоголизмом, среди бедных, а также очень старых людей. У алкоголиков с циррозом печени механизм дефицита фолиевой кислоты может быть иным: обусловленным задержкой фолатов в печени, избыточным выведением с мочой и расстройством метаболизма фолиевой кислоты. В этих условиях мегалобластная анемия часто сопровождается общим дефицитом питания и проявлениями других авитаминозов, включая хейлоз, глоссит и дерматит.
Синдромы мальабсорбции, такие как спру, могут привести к нарушению абсорбции фолиевой кислоты, как это происходит при диффузных инфильтративных заболеваниях тонкой кишки (например, при лимфоме). Кроме того, абсорбцию нарушают некоторые лекарственные средства, особенно антиконвульсант фенитоин и оральные контрацептивы.
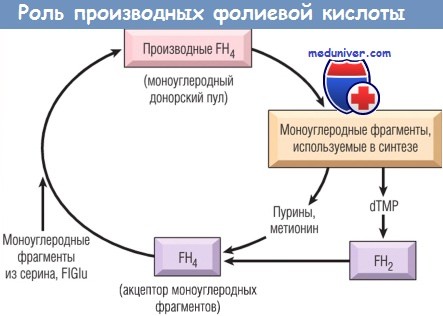
dTMP — дезокситимидинмонофосфат; FH2 — дигидрофолиевая кислота;
FH4 — тетрагидрофолиевая кислота; FIGIu — формиминоглутамат.
В условиях поступления в организм нормального количества фолиевой кислоты, но при повышенной потребности в ней может возникнуть относительный дефицит. Это наблюдается во время беременности, в неонатальном периоде, при гематологических расстройствах, ассоциированных с гиперактивным гемопоэзом (гемолитических анемиях), и диссеминированных злокачественных опухолях. Во всех этих ситуациях потребность в повышенном синтезе ДНК делает недостаточным обычно нормальное поступление фолиевой кислоты с пищей.
Антагонисты фолиевой кислоты, в частности метотрексат, ингибируют активность дигидрофолатредуктазы и приводят к дефициту FH4. При подавлении метаболизма фолиевой кислоты поражаются все быстро пролиферирующие клетки, особенно клетки костного мозга и желудочно-кишечного тракта. Многие химиотерапевтические агенты, используемые для лечения злокачественных опухолей, повреждают ДНК или ингибируют ее синтез посредством других механизмов. Эти вещества также вызывают мегалобласт-ные изменения быстро пролиферирующих клеток.
Мегалобластная анемия, возникающая в случае дефицита фолиевой кислоты, идентична таковой при дефиците витамина В12, поэтому диагноз «дефицит фолиевой кислоты» может быть поставлен лишь после определения сниженного уровня фолатов в сыворотке или эритроцитах. Как и при дефиците витамина В12, уровень гомоцистеина в случае дефицита фолиевой кислоты в сыворотке повышен, но концентрация метилмалоната в норме, благодаря чему неврологические изменения не наблюдаются.
После введения фолиевой кислоты наблюдается быстрый гематологический ответ (о чем свидетельствует ретикулоцитоз), но необходимо иметь в виду, что лечение фолиевой кислотой устраняет также симптомы анемии, вызванной дефицитом витамина В12. Однако прием фолиевой кислоты не предотвращает (и может даже утяжелять) неврологическую симптоматику, типичную для состояния дефицита витамина В12. В связи с этим при мегалобластной анемии до начала лечения фолиевой кислотой необходимо исключить дефицит витамина B12.
источник
Фолиеводефицитная анемия — мегалобластическая анемия, обусловленная нарушением костномозгового кроветворения вследствие дефицита фолиевой кислоты (витамина B9). При фолиеводефицитной анемии развиваются все признаки анемического синдрома (бледность, слабость, тахикардия, снижение АД), незначительная желтуха, увеличение селезенки, анорексия, неустойчивый стул. С целью подтверждения диагноза проводится исследование гемограммы, костного мозга, определение уровня фолиевой кислоты в эритроцитах и сыворотке крови. Лечение B9-дефицитной анемии требует проведения заместительной терапии фолиевой кислотой.
Фолиеводефицитная анемия — комплекс клинико-гематологических проявлений, вызванных недостаточностью фолиевой кислоты вследствие ее ограниченного поступления, снижения абсорбции или повышенного расходования. Фолиеводефицитная анемия встречается реже, чем В12-дефицитная, однако часто сочетается с последней, а также нередко сопутствует железодефицитной анемии. Особую опасность фолиеводефицитная анемия представляет для беременных, поскольку может приводить к формированию пороков развития нервной системы плода, повышать риск отслойки плаценты, преждевременных родов и рождения недоношенного ребенка. Это обусловливает актуальность проблемы не только в рамках гематологии, но также педиатрии, акушерства и гинекологии.
Фолиевая кислота (витамин Вс, В9) поступает в организм в составе соединений — фолатов, присутствующих в овощах (бобовых, брокколи, шпинате, салате, спарже), печени, мясе, шоколаде, дрожжах и др. Запасы фолатов в организме составляют 5-10 мг, а минимальная ежесуточная потребность в них — 50 мкг (в период беременности в 2-3 раза выше). После прекращения поступления фолиевой кислоты извне, истощение ее эндогенных запасов наступает через 3-5 месяцев. Клинические проявления фолиеводефицитной анемии развиваются при снижении уровня витамина В9 в сыворотке крови менее 4 нг/мл.
Этиология фолиеводефицитной анемии может быть связана с недостаточным экзогенным поступлением витамина В9, нарушением его всасывания в кишечнике или повышенным выведением из организма. Чаще всего дефицит фолиевой кислоты носит алиментарный характер; он может быть обусловлен несбалансированным или недостаточным питанием, длительной термической обработкой пищи, вскармливанием детей козьим молоком и т. п.
Повышенную потребность в фолиевой кислоте испытывают беременные и кормящие женщины, недоношенные дети, подростки, онкобольные, пациенты с гемолитической анемией, гемобластозами, эксфолиативным дерматитом, псориазом. Эти категории лиц находятся в группе риска по развитию фолиеводефицитной анемии.
Нарушение абсорбции фолиевой кислоты в ЖКТ наблюдается при хроническом алкоголизме, состоянии после обширной резекции тонкого кишечника, целиакии, лимфоме кишечника, болезни Крона, спру, недостатке витамина В12, приеме антагонистов фолатов (противосудорожных препаратов, барбитуратов, оральных контрацептивов и др.). Чрезмерному выведению фолиевой кислоты из организма могут способствовать цирроз печени, гемодиализ, сердечная недостаточность.
Всасывание фолиевой кислоты происходит в двенадцатиперстной и начальном отделе тощей кишки. После поступления в кровоток она связывается с белками плазмы и транспортируется в печень, где значительная часть фолиевой кислоты откладывается в депо, остальная часть выводится с мочой.
В организме фолиевая кислота присутствует в виде коферментной формы — тетрагидрофолиевой кислоты, активно участвующей в синтезе глутаминовой кислоты, пиримидиновых и пуриновых оснований, а также тимидинмонофосфата – компонента ДНК. При фолиеводефицитной анемии, в первую очередь, нарушается синтез нуклеиновых кислот активно делящихся кроветворных клеток, в результате чего нормобластическое кроветворение сменяется на мегалобластическое. Следствием неэффективного гемопоэза служит развитие анемии, сочетающейся с лейкопенией и тромбоцитопенией.
Фолиеводефицитная анемия чаще развивается у молодых пациентов и беременных женщин. Среди клинических проявлений преобладают признаки анемического синдрома: бледность кожи с оттенком субиктеричности, слабость, тахикардия, артериальная гипотония, головокружения.
В отличие от пернициозной анемии, при дефиците фолиевой кислоты не развиваются неврологические нарушения (фуникулярный миелоз), а расстройства функции желудочно-кишечного тракта выражены незначительно. В числе последних иногда отмечается анорексия, неустойчивость стула, атрофический гастрит, глоссит, незначительная спленомегалия. При углубленном обследовании может выявляться миокардиодистрофия.
У пациентов с эпилепсией, шизофренией, психическими нарушениями фолиеводефицитная анемия усугубляет течение основного заболевания. Дефицит фолиевой кислоты в период беременности является фактором риска формирования дефектов нервной трубки (анэнцефалии, гидроцефалии, менингоцеле), врожденных пороков сердца, расщепления губы и нёба («заячьей губы» и «волчьей пасти»), гипотрофии плода. Кроме этого, у беременной повышается вероятность выкидыша, кровотечения, преждевременного родоразрешения.
После родов женщины с фолиеводефицитной анемией в большей степени подвержены развитию послеродовой депрессии, а дети раннего возраста — задержке психомоторного развития, нарушению работы кишечника, снижению иммунитета.
В общем анализе крови при фолиеводефицитной анемии отмечается гиперхромия, макроцитоз, лейкопения, тромбоцитопения, снижение количества ретикулоцитов. Подтверждению диагноза способствует определение снижения фолиевой кислоты в сыворотке крови (норма 6-20 нг/мл) и эритроцитах (норма – 100-450 нг/л). При исследовании миелограммы выявляется гиперплазия красного ростка, мегалобластный тип кроветворения.
При фолиеводефицитной анемии проба с гистидином, принятым внутрь, оказывается положительной: экскреция формиминглутаминовой кислоты с мочой значительно увеличивается (>18 мг). При миокардиодистрофии, по данным ЭКГ, имеет место нарушение реполяризации миокарда левого желудочка. С помощью УЗИ органов брюшной полости определяется увеличение селезенки. Фолиеводефицитную анемию приходится дифференцировать с В12-дефицитной анемией, острым эритромиелозом, миелодиспластическим синдромом, пароксизмальной ночной гемоглобинурией, гипопластической и аутоиммунной гемолитической анемией.
Лечение фолиеводефицитной анемии требует нормализации питания, устранения провоцирующих факторов, проведения заместительной терапии. Пациентам назначается прием фолиевой кислоты внутрь в дозе 1-5 мг в сутки в течение 4-6 недель под контролем лабораторных показателей крови. При терапии антагонистами витамина В9 назначается его парентеральное введение. Пациенты с нарушением всасывание фолиевой кислоты, должны находиться под наблюдением гематолога и пожизненно получать заместительную терапию.
В профилактическом приеме фолиевой кислоты нуждаются беременные, больные с талассемией, гемолитической анемией. В целях предупреждения патологии плода и акушерских осложнений прием фолиевой кислоты по 0,4 мг/сутки необходимо начинать еще в рамках прегравидарной подготовки (за несколько месяцев до зачатия) и продолжать на протяжении всей беременности и грудного вскармливания. Известно, что профилактический прием фолиевой кислоты, начатый еще до наступления беременности, позволяет снизить частоту рождения детей с врожденными пороками ЦНС в 3,5 раза.
источник
39. В12-дефицитые и фолиево-дефицитные анемии: классификация, этиология, патогенез, клиника, диагностика, терапевтическая тактика (терапия насыщения и поддержания).
Мегалобластные анемии — группа заболеваний, хар-ся появлением в красном костном мозге мегалобластов — клеток красного ядра больших размеров с измененной структурой ядра, которые прослеживаются на всех стадиях дифференцировки эритроидных предшественников. Появление мегалобластов связано с нарушением синтеза ДНК и замедлением созревания клеток.
Витамин B12-дефицитная анемия — группа заболеваний, связанных с дефицитом цианокобаламина (витамин B12) или нарушением его метаболизма.
1) неполноценное питание (исключительно вегетарианское); 2) дефицит внутреннего фактора: гастрит типа А, иммунные антитела к фактору Кастля или к париетальным клеткам желудка, гастроэктомия, врожденный дефицит его без нарушения функции желудка, рак желудка; 3) хронический панкреатит, синдром Золингера-Эллисона, заболевания конечного отдела подвздошной кишки (болезнь Крона, тяжелый энтерит), синдром «приводящей кишки»; 4) дисбактериоз (развитие бактерий в слепых петлях); 5) наличие гельминтов (широкий лентец); 6) хронический алкоголизм; 7) заболевания печени (цирроз, гепатит); 8) прием некоторых лекарственных средств, избыточное применение антиметаболитов при лечении опухолей также может вызвать нарушение синтеза ДНК.
Клиника. Болеют лица в возрасте 45-65 лет, редко клиника встречается у людей до 30 лет, чаще болеют женщины. Обычно манифестация (прогрессия) наступает весной или осенью. Заболевание развивается постепенно, нередко долгое время болезненное состояние проявляется поражением ЖКТ, иногда признаками поражения нервной системы (радикулиты), адаптированной (легкой степени) анемией. Выражены синдромы: поражение кроветворной системы, ЖКТ и нервной системы. Клиника проявляется слабостью, одышкой, тахикардией, периодической диареей, жгучими болями в языке при приеме острой и кислой пищи, парестезиями, снижением чувствительности, а при тяжелых анемиях — спутанностью сознания, депрессией, деменцией. Объективно: покровы бледные с матовым и лимонно-желтым оттенком. Язык гладкий, сглаженный, атрофичный (иногда, гиперпластичный), блестящий, влажный, иногда красный и воспаленный («лакированный» язык, глоссит Хантера). Селезенка часто увеличена, иногда увеличена печень. Парестезии пальцев рук и ног. Атрофия мышц, полиневриты, расстройства координации (неуверенная или шаткая походка, нескоординированные движения).
Диагностика: — очень низкое содержание витамина В12 в плазме (менее 100 пг/л, N 160-950 пг/л), увеличение ферритина, уменьшение гаптоглобина, повышение ЛДГ; — антитела к внутреннему фактору или к париетальным клеткам в сыворотке крови (обнаруживаются в 50% случаев). — гиперхромия, макроцитарная гипо-, норморегенераторная (диспластическая) анемия. Обнаруживаются мегалоциты (11-14 мкм), макроформы и анизоцитоз, включения в эритроцитах (тельца Жолли, кольца Кебота, зернистость Гейнца), полисегментация нейтрофилов. — мегалобластный костный мозг («синий» при окраске по Романовскому); — отрицательный тест Шиллинга (при экскреции мочи после приема радиоактивного витамина В12 внутрь уменьшается выделение кобаламина); — при Ph-метрии желудочного сока гипо- и ахлоргидрия; — при биопсии слизистой желудка — фундальный гастрит, гипертрофия бокаловидных клеток, атрофия париетальных и главных клеток, клеточный атипизм; — увеличение билирубина за счет непрямого (неконъюгированного).
Лечение. Режим амбулаторный или стационарный в зависимости от тяжести анемии. Диета: с повышенным содержанием белков, преимущественно продукты животного происхождения. Лекарственная терапия заключается в назначении цианкобаламина по 1000 мкг в/м 1 раз в день, далее по 500 мкг 3-4 недели, затем по 200 мкг/сут в течение 1-1,5 месяца или по 500 мкг 1 раз в неделю 1 месяц. С целью профилактики рецидивов пожизненно вводят цианкобаламин по 500 мкг 2 раза в месяц. Уже в первые сутки после в/м введения витамина В12 происходит трансформация мегалобластного типа в нормоцитарный, усиливается эритропоэз. Через 48-72 часа после первой инъекции витамина В12 начинает увеличиваться число ретикулоцитов. Ретикулоцитарный криз нарастает к 7-12 дню, что может быть оценено как результат эффективной терапии. В клинических условиях фолиевая кислота не должна использоваться для лечения В12-дефицитной анемии, так как могут развиться серьезные неврологические расстройства даже при ликвидации анемии. Трансфузии эритроцитов проводят при угрозе анемической комы — наиболее грозного и плохо поддающегося лечению осложнения В12-дефицитной анемии. Прогноз при адекватном лечении благоприятный. Хронизация анемии отмечается при алкоголизме и у лиц после тотальной резекции желудка или кишечника. После достижения ремиссии больные подлежат диспансерному наблюдению, проведению ФГС с биопсией слизистой желудка и противорецидивному лечению витамином В12 весной и осенью.
Фолиеводефицитная анемия — анемия, обусловленная дефицитом фолиевой кислоты или нарушения ее утилизации в процессе эритропоэза, что приводит к мегалобластному типу кроветворения.
Патогенез. Фолиевая кислота и ее соединения известны под названием фолатов. Организм получает фолаты при расщеплении содержащихся в пище полиглютаматов в моноглютаматы в тонком кишечнике. В плазме происходит превращение метилтетрафолата в присутствии витамина В12 в тетрагидрофолаты. Последние превращаются в формил-ТГФ (фолиновая кислота), затем в дезокситимидин-монофосфат с последующим синтезирующим действием на ДНК. Таким образом, дефицит витамина В12 ведет к нарушению синтеза фолиновой кислоты и развитию В12-дефицитной анемии. Дефицит фолиевой кислоты ведет к развитию фолиеводефицитной анемии. Суточная потребность фолатов составляет 100 мкг. Запасы, создаваемые в тканях (печень), достаточны для синтезирования ДНК в течение 1-3 мес.
Этиология. 1. Недостаток фолиевой кислоты в пище (в том числе вскармливание новорожденных козьим или порошковым молоком). 2. Нарушения всасывания в тонком кишечнике и нарушения депонирования в печени (в том числе при злоупотреблении алкоголем). 3. Прием антагонистов фолиевой кислоты (метотрексата), аналогов пурина и пиримидина, противосудорожных препаратов — дифенина, фенобарбитала. 4. Повышение потребности в фолиевой кислоте (беременность, новорожденные, миелопролиферативные синдромы, хронический гемолиз). 5. При очень активной пролиферации клеток (гемолиз, лейкозы и другие опухоли, инфекции, псориаз). 6. Угнетение системы дигидрофолат-редуктазы (при приеме ЛС, при алкоголизме).
Клиника сходна с В12-дефицитной анемией. Не характерен атрофический гастрит с ахилией, нет фуникулярного миелоза. Не наблюдается геморрагический диатез. Более выражены функциональные признаки поражения ЦНС. Встречается чаще у детей, молодых женщин, алкоголиков, больных эпилепсией.
Диагностические критерии дефицита фолиевой кислоты: низкий уровень содержания фолатов в сыворотке (натощак) 3-25 нг/мл; низкий уровень содержания фолатов в эритроцитах (N 100-415 нг/мл); макроцитарная диспластическая анемия; мегалобластный костный мозг; нормальный или несколько сниженный уровень витамина В12 в сыворотке крови (менее 100 мг/мл, N 160-930 мг/мл).
Гемограмма и миелограмма сходны с витамин В12-дефицитной анемией.
Дифференциальный диагноз с В12-дефицитной анемией представлен в таблице.
Основные дифференциально-диагностические признаки витамин В12— (2 столбик) и фолиеводефицитной анемий (3 столбик)
Лечение. Фолиевая кислота внутрь 5-15 мг/сут на протяжении 4-6 недель до получения ремиссии. В последующем при неустраненной причине — поддерживающая терапия 1-5 мг/сут.
40. Хронический миелолейкоз: этиология, патогенез, роль хромосомных аббераций в развитии лейкоза, фазы лейкемического процесса, терапия 1-ой линии, терапия резерва. Показания к трансплантации костного мозга, исходы и осложнения ХМЛ.
Хронический миелолейкоз (ХМЛ) – хронически протекающее миелопролиферативное заболевание, при котором наблюдается повышенное образование гранулоцитов, преимущественно нейтрофилов, являющихся субстратом опухоли. Источник опухоли – клетка-предшественник миелопоэза.
Этиология. Причиной патологического роста клеток считается мутация клетки-предшественника миелопоэза (частично детерминированная полипотентная клетка). Это доказывается обнаружением у больных ХМЛ патологической Ph-хромосомы (филадельфийской) в клетках миелоидного, эритроидного, моноцитарного и тромбоцитарного рядов. Ph-хромосома является частым клеточным маркером, подтверждающим происхождение всего патологического клона клеток при ХМЛ от одной материнской. Несмотря на то, что лейкозными являются все три ростка костного мозга, в развернутой стадии ХМЛ наблюдается безграничный рост, только одного ростка – гранулоцитарного. Существенно повышается продукция и мегакариоцитов (тромбоцитов).
Классификация. Заболевание закономерно проходит в своем развитии две стадии – моноклоновую (развернутая доброкачественная) и поликлоновую (терминальную злокачественную). Этому соответствуют три фазы хронического миелолейкоза в клиническом отображении:
— хроническая – гиперплазия гранулоцитарного ростка кроветворения в красном костном мозге, при этом способность клеток к дифференцировке и созреванию сохранена; миелоидная пролиферация костного мозга + небольшие изменения в крови без явлений интоксикации; наблюдается умеренный лейкоцитоз, со сдвигом лейкоцитарной формулы до миелоцитов, увеличением содержания зрелых и созревающих гранулоцитов в красном костном мозге, эритро- тромбоцитопоэз сохранены, селезенка нормальных размеров;
— фаза акселерации – через 3-3,5 года выраженные клинико-гематологические проявления (интоксикация продуктами распада лейкозных клеток, увеличение печени и селезенки, миелоидная пролиферация костного мозга + изменения в крови: появляются бластные клетки, анемия, тромбоцитопения; нарастают симптомы интоксикации — лихорадка, потливость, слабость, снижение массы тела. Важный признак — резистентность к успешно применявшейся ранее химиотерапии);
— бластный криз или терминальная (соответствует развитию поликлоновой опухоли) – рефрактерность к проводимой цитостатической терапии, истощение, значительное увеличение селезенки и печени, дистрофические изменения внутренних органов, выраженные изменения крови (анемия, тромбоцитопения). Появление в периферической крови бластных клеток (до 30–90%), в связи с чем заболевание приобретает черты острого лейкоза. Чаще всего в костном мозге и периферической крови бластный криз хар-ся появлением миелобластов, однако могут встретиться и недифференцируемые бластные клетки. Одновременно происходит значительное угнетение тромбоцитопоэза, развивается геморрагический синдром.
Миелопролиферативный синдром (обусловлен миелоидной пролиферацией костного мозга) включает:
а) общие симптомы, вызванные интоксикацией, разрастаниями лейкозных клеток в костном мозге, селезенке и печени (потливость, слабость, снижение массы тела, тяжесть и боль в области селезенки и печени), оссалгии.
б) увеличение печени и селезенки;
в) лейкемические инфильтраты в коже;
г) характерные изменения в костном мозге и периферической крови.
Синдром, обусловленный осложнениями: а) геморрагический диатез (геморрагии и тромбозы вследствие нарушения прокоагулянтного и тромбоцитарного звеньев гемостаза); б) гнойно-воспалительные (пневмонии, плевриты, бронхиты, гнойные поражения кожи и подкожной клетчатки), обусловленные резким снижением активности иммунитета; в) мочекислый диатез (гиперурикемия вследствие повышенного распада гранулоцитов).
При исследовании периферической крови обнаруживают:
лейкоцитоз (кол-во лейкоцитов колеблется в широких пределах) с появлением в лейкоцитарной формуле пролиферирующих форм (миелобласты и промиелоциты) и созревающих гранулоцитов (миелоциты, метамиелоциты). Функциональные свойства лейкоцитов и содержание в них ферментов изменены: снижена активность щелочной фосфатазы нейтрофилов, нарушена способность к фагоцитозу.
имеется базофильно-эозинофильная ассоциация.
в ранних стадиях болезни возможно обнаружение гипертромбоцитоза, в дальнейшем — тромбоцитопения.
развитие нормоцитарной, нормохромной анемии, связанной в основном с вытеснением лейкозным клоном красного ростка кроветворения, можно наблюдать в развернутой клинико-гематологической стадии. В терминальной стадии анемия становится еще более выраженной.
При исследовании костного мозга: 1) обнаруживают миелоидную пролиферацию костного мозга, нормальный миелопоэз полностью замещен патологическим клоном. 2) В мазке костного мозга преобладают гранулоциты: соотношение лейкоциты/эритроциты достигает 10:1, 20:1 за счет увеличения гранулоцитов. 3) Если в периферической крови высокий тромбоцитоз, в костном мозге отмечается большое количество мегакариоцитов.
При пункции увеличенной селезенки обнаруживается преобладание миелоидных клеток.
Диагностическими критериями заболевания являются:
лейкоцитоз более 20 — 10 3 в 1 мкл крови;
появление в лейкоцитарной формуле пролиферирующих форм (миелобласты и промиелоциты) и созревающих гранулоцитов (миелоциты, метамиелоциты);
миелоидная пролиферация костного мозга (по данным миелограммы и трепанобиопсии);
снижение активности щелочной фосфатазы нейтрофилов (менее 25 ед);
обнаружение Ph-хромосомы в кроветворных клетках;
расширение плацдарма кроветворения (по данным сцинтиграфии костей);
увеличение размеров селезенки и печени.
ХМЛ следует дифференцировать от так называемых лейкемоидных реакций, которые могут возникать при ряде заболеваний (туберкулез, рак, различные инфекции, почечная недостаточность и пр.). По определению А. И. Воробьева (1985), лейкемоидная реакция – это «изменения в крови и органах кроветворения, напоминающие лейкозы и другие опухоли кроветворной системы, но не трансформирующиеся в ту опухоль, на которую они похожи». При лейкемоидной реакции наблюдается высокий лейкоцитоз, в периферической крови появляются незрелые нейтрофилы, однако базофильно-эозинофильная ассоциация не обнаруживается.
Дифференциальный диагноз основывается на выявлении основного заболевания (рак, туберкулез и пр.), на повышении активности щелочной фосфатазы нейтрофилов (вместо ее снижения при ХМЛ). При стернальной пункции для лейкемоидной реакции характерно увеличение содержания миелоцитов, однако Ph-хромосома никогда не определяется.
Лечение. Воздействие на функционирование онкогена препаратом иматиниб мезилат (торговое название — Гливек) — ингибитор ABL-тирозинкиназы. Он соединяется с активными центрами BCR-ABL-тирозинкиназы, что приводит к гибели клеток, содержащих ее, т.е. Ph-положительных клеток. Эффективность превосходит все ранее известные терапевтические средства, применяемые у больных ХМЛ (миелосан, гидроксимочевина, интерферон-α, аллотрансплатация). В настоящее время во всем мире Гливек является препаратом 1-й линии терапии. Назначается по 400 мг в I стадии, по 600 мг во II стадии, до 800 мг в III стадии курсами. Аллотрансплантация гемопоэтических стволовых клеток и препараты новой генерации ингибиторов тирозинкиназ (растительный алкалоид гомогаррингтоин, который проявил высокую эффективность в хронической фазе, в фазе акселерации и даже в бластном кризе ХМЛ. Назначается по 2,5 мг/кг в/в курсом до 14 дней, затем по 7 дней в месяц для поддержания ремиссии) используются в качестве 2-й и последующих линий терапии у больных в хронической фазе ХМЛ с резистентностью к Гливеку или его непереносимостью.
ПОКАЗАНИЯ К ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА:
— Аллогенная трансплантация костного мозга: острые лейкозы; хронический миелолейкоз; тяжелая апластическая анемия; гемоглобинопатии; врожденные иммунодефициты и нарушения метаболизма.
— Аутологичная трансплантация костного мозга: злокачественные лимфомы; некоторые солидные опухоли; аутоиммунные заболевания.
Прогноз. Длительность жизни больных ХМЛ в среднем составляет 3–5 лет, у отдельных больных достигает 10 лет и более. Осложнения ХМЛ. Острая сердечно-сосудистая недостаточность, инфекционные осложнения, ДВС-синдром и др.
Профилактика. Точных мер предупреждения ХМЛ не существует, в связи с чем можно говорить лишь о вторичной профилактике болезни, которая состоит в предупреждении обострений болезни (поддерживающая терапия, исключение инсоляции, простудных заболеваний).
источник
B12-дефицитная и фолиеводефицитная анемия — это анемии связанные с нарушением синтеза нуклеиновых кислот и заменой нормобластического типа кроветворения мегалобластическим из-за недостатка в организме витамина B12 и фолиевой кислоты.
1. Недостаток витамина в пище.
2. Неусвоение витамина B12 в желудке, что может быть связано с нарушением функции фундального отдела желудка, который вырабатывает гастромукопротеин (витамин B12 усваивается в комплексе с гастромукопртеином). Нарушение функции обкладочных клеток вызывается воздействием на них аутоантител (пернициозная анемия или Аддисона-Бирмера или злокачественное малокровие). Кроме того, подобное состояние может возникнуть после резекции желудка.
3. Неусвоение витамина B12 в кишечнике (при резекции тонкой кишки, опухоли, спру, дифиллоботриозе, алкоголизме).
4. Повышенное расходование витаминов при беременности.
5. Нарушение депонирования витаминов в печени при ее диффузном поражении.
Патогенез. Дефицит витамина B12 и фолиевой кислоты, участвующих в образовании тимина, входящего в состав ДНК, снижает скорость ее образования. Замедление репликации ДНК прежде всего заметно в тканях, где в норме деление клеток происходит наиболее часто — в клетках крови и эпителия желудочно-кишечного тракта. Нарушение клеточного деления приводит к формированию крупных клеток крови: мегалоцитов, мегалобластов, гигантских мегакариоцитов. Созревание мегалобластов до мегалоцитов сопровождается нарушением энуклеации (об этом свидетельствуют появление в мегалоцитах телец Жолли (остатки ядра) и колец Кебота (остатки ядерной облочки)). Наличие большого количества мегалобластов и мегалоцитов, насыщенных гемоглобином, обуславливает гиперхромию (ЦП>1.0).
Обычное физиологическое слущивание эпителия ЖКТ из-за нарушения клеточного деления не восстанавливается. Поэтому развиваются атрофически-воспалительные процессы в эпителии всего ЖКТ. При этом всасывание витаминов еще более нарушается.
В результате недостатка витамина B12 в организме накапливается метилмалоновая кислота, которая токсична для нервных клеток. Кроме того, при дефиците витамина B12 в нервных волокнах синтезируются жирные кислоты с измененной структурой, что отражается на образовании миелина и приводит к повреждению аксона. Развивается дегенерация задних и боковых столбов спинного мозга (фуникулярный миелоз), поражаются черепно-мозговые и периферические нервы.
Картина крови. B12-дефицитная и фолиеводефицитная анемия — это анемии мегалобластические, гиперхромные, макроцитарные. В мазке крови появляются мегалоциты — клетки патологической регенерации костного мозга и мегалобласты (крупные клетки с базофильной, полихроматофильной или оксифильной цитоплазмой, для которой характерна раняя гемоглобинизация). В крови встречается много дегенеративно измененных эритроцитов:пойкилоцитоз, анизоцитоз с микроцитозом, гиперхромия, мегалоциты с патологическими включениями. Уменьшается количество клеток физиологической регенерации (ретикулоциты, полихроматофилы), т.к. в костном мозге наблюдается раздражение эритроцитарного ростка с преобладанием мегалобластического типа кроветворения над нормобластическим. Наблюдается тромбо — и лейкоцитопения с атипическими клетками.
Дефицит витамина B12 (цианкоболамина) > :
1. Нарушение перехода: фолиевая кислота > тетрагидрофолиевая кислота > тимин > ДНК. Нарушение клеточного деления, при котором страдают активно размножающиеся клетки:
а) кроветворной ткани (анемия);
б) ЖКТ (воспалительно-атрофические процессы в слизистой).
2. Нарушение перехода метилмалоновой кислоты в янтарную > накопление метилмалоновой кислоты, которая оказывает токсическое действие на нервную систему;
3. Синтез жирных кислот с измененной структурой > нарушение образования миелина.
источник
В-12 и фолиево- дефицитная анемия у детей. Этиология. Патогенез. Клиника, диагностика. Лечение. Профилактика.
это анемия, связанная с нарушением синтеза нуклеиновых кислот и заменой эритробластического типа кроветворения мегалобластическим вследствие недостатка в организме цианокобаламина (витамина В12) и фолиевой кислоты. Обе анемии относятся к дизэритропоэтическому типу.
По этиологии эти анемии могут быть приобретенными и наследственными.
- недостаток этих витаминов в пище (раннее искусственное вскармливание коровьим или козьим молоком, мучной, молочной или молочно-вегетарианской едой, несбалансированная диета, в которой нет достаточного содержания молочных продуктов);
- нарушение всасывания витаминов в тонкой кишке (при резекции тощей кишки или поражении ее опухолью, множественными дивертикулами, при тропическом спру, дифиллоботриозе, алкоголизме);
- повышенное расходование витаминов при беременности (когда эмбриональный тип кроветворения у плода сменяется эритробластическим, увеличивается потребление плодом цианокобаламина и фолиевой кислоты матери); (недоношенные, дети с большой массой тела при рождении, с лимфатическим типом конституции, дети второго полугодия жизни).
- нарушение депонирования витаминов при диффузном поражении печени (гепатит, цирроз). Кроме того, дефицит цианокобаламина возникает в результате нарушения образования внутреннего фактора Касла — мукопротеида (транскоррина) — при наследственном дефекте выработки его клетками желез желудка, при поражении слизистой оболочки желудка опухолью, сифилитической гуммой, большими дозами алкоголя, при резекции желудка, разрушений мукопротеида аутоантителами.
- Недостаточний уровень В12 и фолиевой кислоты в организме (нарушения маточно- плацентарного кровообращения, фетоматеринские и фетоплацентарные кровотечения, синдром фетальной трансфузии при многоплодной беременности, внутриутробная мелена, недоношенесть, многоплодие, глубокий и долговременный дефицит в организме беременной)
Нарушается клеточное деление и прежде всего страдают активно размножающиеся клетки кроветворной ткани. В костном мозге задерживается размножение и созревание эритрокариоцитов., эритробластический тип кроветворения заменяется мегалобластическим, возрастает неэффективный эритропоэз, укорачивается продолжительность жизни эритроцитов. Вследствие нарушения кроветворения и гемолиза эритроцитов развивается анемия, при которой клетки патологической регенерации и эритроциты с признаками дегенерации появляются не только в костном мозге, но и в крови. Изменение лейко- и тромбоцитопоэза проявляется уменьшением числа лейкоцитов и тромбоцитов, выраженной атипией клеток.
Возникновение атипичного митоза и гигантских клеток эпителия пищевого канала приводит к развитию воспалительно-атрофических процессов в слизистой оболочке его отделов (глоссит, стоматит, эзофагит, ахилический гастрит, энтерит). Это усугубляет первичное нарушение секреции и всасывания внутреннего фактора и, следовательно, усиливает дефицит витаминов (порочный круг).
В результате недостатка цианокобаламина (его кофермент дезоксиаденозилкобаламин участвует в образовании янтарной кислоты из метилмалоновой кислоты) в организме накапливается метилмалоновая кислота, токсичная для нервных клеток, а в нервных волокнах синтезируются жирные кислоты с измененной структурой, что отражается на образовании миелина и ведет к повреждению аксона. Развивается дегенерация задних и боковых столбов спинного мозга (фуникулярный миелоз), поражаются черепные и периферические нервы с развитием многообразной неврологической симптоматики.
В12— и фолиеводефицитные анемии — это анемии с мегалобластическим типом кроветворения, гиперхромные, макроцитарные. Содержание эритроцитов и гемоглобина в крови при этих анемиях может резко снижаться, однако цветовой показатель выше 1 (1,4—1,8) в связи с наличием в крови больших по объему мегалобластов и мегалоцитов, насыщенных гемоглобином.
В мазке крови появляются клетки патологической регенерации костного мозга — мегалоциты и единичные мегалобласты
В крови встречается много дегенеративно измененных эритроцитов: пойкилоцитоз, анизоцитоз, гиперхромные мегало- и макроциты, мегалоциты с включениями в виде телец Жолли, колец Кебота, эритроциты с базофильной зернистостью. Уменьшается количество клеток физиологической регенерации (ретикулоциты, полихроматофилы), так как в костном мозге наблюдается раздражение эритроцитарного ростка с преобладанием мегалобластического эритропоэза на фоне угнетения эритробластического кроветворения. Наблюдается лейко- и тромбоцитопения с атипическими клетками (например, гигантские полисегментированные нейтрофильные гранулоциты размером 20—30 мкм, с 8—10 сегментами).
развиваются постепенно: нарастает слабость, недомогание, головокружение, диспепсические расстройства, шум в ушах, склонность к ожирению. Редко заболевание начинается остро, с подъема температуры тела до 38С, выраженной слабости.
- анемический синдром
- гастроэнтероколитический
Синдром желудочной диспепсии(37,% наблюдений) проявляется отрыжкой, тошнотой, потерей вкусовых ощущений, снижением аппетита вплоть до отвращения к пище, тяжестью в эпигастрии, иногда дисфагией, чувством жжения языка, слизистой оболочки рта. На ЭГДС выявляются атрофические изменения в слизистой оболочки пищевода и желудка.
Синдром кишечной диспепсии характеризуется неустойчивым стулом, похуданием.
Глосситпроявляется наличием «ошпаренного» (красного) или «лакированного» с трещинами языка. Боли в языке отмечаются у 30% больных с В12-дефицитной анемией.
Синдром фуникулярного миелоза (сенсорная атаксия – нарушение координации движений)
Синдром межреберной невралгии встречается существенно чаще (до 30% случаев), чем признаки фуникулярного миелоза, проявляется невралгическими болями по ходу межреберий и также обусловлен функциональной недостаточностью нервной ткани проводников.
У части больных отмечается поражение черепномозговых нервов (зрительного, слухового, обонятельного), наличие симптомов спинального паралича (спастический парапарез с повышенными рефлексами и клонусами) Может обнаруживаться центральная скотома (дефект поля зрения) с потерей зрения.
Изменения со стороны центральной нервной системымогут проявлятьсясиндромом психомоторного возбуждения(маниакальное состояние с эйфорией или синдромом депрессиис нарушением памяти и критики — мегалобластное слабоумие).
Дефицит фолиевой кислоты наблюдается обычно в более молодом возрасте, не сопровождается атрофическими изменениями слизистой оболочки желудка и неврологической симптоматикой в отличие от В12ДА.
В12-дефицитной анемии включает парентеральное введение витамина В12 или гидрооксикобаламина (метаболит цианкобаламина) в дозах, обеспечивающих удовлетворение дневной потребности и удвоение запасов депо. Витамин В12вводят по 1000 мкг внутримышечно ежедневно в течение двух недель, затем один раз в неделю до нормализации уровня гемоглобина, после чего переходят на введение 1 раз в месяц в течение всей жизни.
Оксикобаламин в дозе 500–1000 мкг через день или ежедневно. При наличии неврологической симптоматики необходимо введение препарата в дозе 1000 мкг каждые две недели в течение шести месяцев.
При фуникулярном миелозе назначаются массивные дозы цианкобаламина по 1000 мкг ежедневно в течение 7–10 дней, далее два раза в неделю до исчезновения неврологических признаков.
Начало терапии кобаламином быстро улучшает самочувствие больных. Костномозговой эритропоэз превращается из мегалобластного в нормобластный уже через 12 часов после введения витамина В12. Поэтому назначение витамина В12 при коматозном состоянии относится к неотложным мероприятиям. Ретикулоцитоз появляется на 3–5 день, пик его (ретикулоцитарный криз) наиболее выражен на 4–10 день. Концентрация гемоглобина нормализуется через 1–2 месяца. Гиперсегментация нейтрофилов сохраняется до 10–14 дней.
Трансфузии эритроцитарной массыпоказаны для срочной ликвидации симптомов гипоксии.
После терапии кобаламином может развиться тяжелая гипокалиемия. Поэтому в процессе лечения витамином В12необходимо тщательно контролировать содержание калия в крови и при необходимости проводить заместительную терапию.
Лечение кобаламином следует назначать всем больным после тотальной гастрэктомии. Для предупреждения обострения витамин В12вводится один раз в две недели по 100 – 200 мкг.
Больные В12-дефицитной анемией подлежат диспансерному наблюдению, в ходе которого проводится мониторинг состояния периферической крови 1-2 раза в год, а также лечение заболеваний и состояний, приведших к развитию данного вида анемии.
Существуют разные схемы поддерживающей терапии кобаламинами. При назначении цианкобаламинарекомендуются пожизненно ежегодные профилактические трехнедельные курсы по 400-500 мкг через день либо ежемесячное введение 500-1000 мкг препарата.Гидроксикобаламин рекомендуется ежегодными профилактическими курсами по одной инъекции в неделю (1 мг) в течение 2-х месяцев.
источник
ФОЛИЕВОДЕФИЦИТНАЯ АНЕМИЯ
Фолиевая кислота (ФК) является важным фактором нормального процесса кроветворения. При ее дефиците нарушается эритро-, гранулоцито- и тромбоцитопоэз. Анемии, обусловленные дефицитом ФК, независимо от причин сопровождаются появлением в костном мозге мегалобластов, внутрикостномозговым разрушением эритрокариоцитов, панцитопенией, макроцитозом и гиперхромией эритроцитов, иногда психическими расстройствами. Шифр D 52 (МКБ-10).
В организм ребенка фолиевая кислота поступает с пищей (особенно много фолатов содержится в печени, дрожжах, шпинате, мясе) и частично синтезируется в ЖКТ. Суточная потребность для взрослых – 50 мкг, для детей и беременных – в 2-3 раза выше: для детей до 6 месяцев жизни 40 мкг, 7-12 месяцев 60 мкг, 1-3 лет 100 мкг, 4-17 лет 400 мкг, для беременных и кормящих матерей 600 мкг.
Женское молоко содержит в 1 литре около 25 мкг ФК, что достаточно для нормального развития ребенка. Однако содержание ФК уменьшено, если у матери имеется дефицит фолатов. Нагревание молока приводит к уменьшению количества ФК на 40%, а повторная пастеризация – на 80%. Козье молоко содержит ФК в 6 раз меньше, чем коровье.
Содержание фолатов в пищевых продуктах (мг/100 г сырой массы)
| Продукт | Содержание фолатов | Продукт | Содержание фолатов |
| Мясо (бифштекс) | 9,2 | Салат | 21,0 |
| Яйцо (желток) | 12,9 | Брюссельская капуста | 49,0 |
| Яйцо (белок) | 0,6 | Шпинат | 75,0 |
| Хлеб (белый) | 15,0 | Мороженое | 4,0 |
| Корнфлекс | 5,5 | Шоколад | 99,0 |
| Морковь | 8,0 | Сыр | 9,4-13,3 |
Содержание фолатов в молочных продуктах (мкг/л)
| Продукт | Содержание фолатов | |
| Среднее | Диапазон колебаний | |
| Женское молоко | 52 | 31-81 |
| Свежее коровье молоко | 55 | 37-72 |
| Пастеризованное коровье молоко | 51 | 40-65 |
| Козье молоко | 6 | 2-11 |
В отличие от витамина В12, запасы которого могут истощиться при нарушении его поступления в организм лишь за несколько лет, запасы ФК малы и дефицит ее развивается всего лишь за 4 месяца.
Причины дефицита фолиевой кислоты различны.
Нерациональное питание: вскармливание козьим молоком, неправильная термическая обработка пищи, назначение специфических диет при болезни «кленового сиропа» или фенилкетонурии без коррекции ФК. Алиментарная недостаточность ФК часто встречается в Азии, Африке, Южной Америке.
Алиментарная мегалобластическая анемия у доношенных развивается на 2-3 году жизни (редко – во втором полугодии первого года жизни), чаще наблюдается у детей с повторными инфекциями респираторного, желудочно-кишечного или мочевого тракта.
Нарушение абсорбции в результате наследственной или приобретенной патологии ЖКТ (дивертикулы тонкой кишки, резекция тощей кишки, гастрэктомия, целиакия, спру, идиопатическая стеаторея), а также вследствие длительного приема противосудорожных и контрацептивных препаратов и барбитуратов.
Наследственная абсорбция ФК встречается очень редко (предполагается нарушение транспорта ФК на молекулярном уровне). Парентеральное введение ФК приводит к быстрому гематологическому улучшению.
Приобретенные нарушения абсорбции фолатов встречаются часто. При целиакии и диарее уменьшается синтез ФК бактериями вследствие антибиотикотерапии и увеличения скорости пассажа пищевых масс через кишечник. При множественных дивертикулах тонкой кишки дефициту ФК способствует утилизация фолатов большим количеством бактерий, конкурирующих с хозяином за витамин. При обширной резекции тощей кишки дефицит ФК является следствием уменьшения зоны абсорбции.
Повышенная потребность в ФК при сепсисе, распространенных заболеваниях кожи, пневмонии и других инфекциях, диффузном токсическом зобе, злокачественных опухолях, гемолитических анемиях.
Дефицит ФК может возникнуть у беременных («мегалобластическая анемия беременных»), что влияет на внутриутробный рост и постнатальное развитие ребенка. Частота мегалобластической анемии беременных вследствие дефицита ФК колеблется от 0,5% (в странах Запада) до 50% (в Индии).
Помимо «физиологического» дефицита ФК у беременных в последнем триместре, недостатку витамина также способствуют многоплодная беременность, неадекватное питание и инфекции мочевыводящих путей.
Концентрация фолатов в сыворотке крови и эритроцитах новорожденных в 2-3 раза выше, чем у взрослых, однако в течение первых недель жизни она снижается до уровня, свойственного старшим детям и взрослым. Потребность в фолатах у новорожденных в 10 раз больше, чем у взрослых, а потери в первые дни жизни наиболее велики. Поэтому покрыть потребность в ФК за счет диеты, особенно при искусственном вскармливании без коррекции ФК или при кормлении кипяченым молоком не удается.
Особенно легко дефицит ФК возникает у недоношенных в возрасте 6-10 недель, небольшое депо витамина у которых быстро истощается вследствие интенсивного постнатального роста, особенностей питания и частых интеркуррентных инфекций.
Дефицит ФК при гемолитических анемиях связан с повышенной утилизацией фолатов молодыми клетками эритроидного ростка. Особенно низкие уровни ФК (до 3 нг/мл) наблюдаются при серповидно-клеточной анемии, большой талассемии, АГА с тепловыми антителами.
Нарушения метаболизма фолиевой кислоты: наследственные (дефицит ферментов, участвующих в метаболизме ФК) и приобретенные (связаны с пониженной утилизацией ФК при дефиците витамина В12, острых и хронических заболеваниях печени, применении антагонистов ФК – триамтерена, триметоприма, метотрексата, многолетнем применении фенобарбитала).
Увеличение экскреции ФК (при хроническом диализе по поводу ХПН, дефиците витамина В12, заболеваниях печени и сердца).
Патогенез фолиеводефицитной анемии. Коферментные формы фолиевой кислоты участвуют в биосинтезе пуриновых предшественников нуклеиновых кислот, поэтому дефицит ФК приводит к мегалобластной анемии с морфологическими изменениями в периферической крови и костном мозге, аналогичными таковым при дефиците витамина В12.
источник